Помощь студентам в учёбе от Людмилы Фирмаль
Здравствуйте!
Я, Людмила Анатольевна Фирмаль, бывший преподаватель математического факультета Дальневосточного государственного физико-технического института со стажем работы более 17 лет. На данный момент занимаюсь онлайн обучением и помощью по любыми предметам. У меня своя команда грамотных, сильных бывших преподавателей ВУЗов. Мы справимся с любой поставленной перед нами работой технического и гуманитарного плана. И не важно: она по объёму на две формулы или огромная сложно структурированная на 125 страниц! Нам по силам всё, поэтому не стесняйтесь, присылайте.
Срок выполнения разный: возможно онлайн (сразу пишите и сразу помогаю), а если у Вас что-то сложное – то от двух до пяти дней.
Для качественного оформления работы обязательно нужны методические указания и, желательно, лекции. Также я провожу онлайн-занятия и занятия в аудитории для студентов, чтобы дать им более качественные знания.
Моё видео:
youtube.com/embed/4sKc0lcxi7g” frameborder=”0″ allow=”accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture” allowfullscreen=””/>Вам нужно написать сообщение в Telegram . После этого я оценю Ваш заказ и укажу срок выполнения. Если условия Вас устроят, Вы оплатите, и преподаватель, который ответственен за заказ, начнёт выполнение и в согласованный срок или, возможно, раньше срока Вы получите файл заказа в личные сообщения.
Сколько может стоить заказ?Стоимость заказа зависит от задания и требований Вашего учебного заведения. На цену влияют: сложность, количество заданий и срок выполнения. Поэтому для оценки стоимости заказа максимально качественно сфотографируйте или пришлите файл задания, при необходимости загружайте поясняющие фотографии лекций, файлы методичек, указывайте свой вариант.
Какой срок выполнения заказа?Минимальный срок выполнения заказа составляет 2-4 дня, но помните, срочные задания оцениваются дороже.
Сначала пришлите задание, я оценю, после вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Какие гарантии и вы исправляете ошибки?В течение 1 года с момента получения Вами заказа действует гарантия. В течении 1 года я и моя команда исправим любые ошибки в заказе.
Качественно сфотографируйте задание, или если у вас файлы, то прикрепите методички, лекции, примеры решения, и в сообщении напишите дополнительные пояснения, для того, чтобы я сразу поняла, что требуется и не уточняла у вас. Присланное качественное задание моментально изучается и оценивается.
Теперь напишите мне в Telegram или почту и прикрепите задания, методички и лекции с примерами решения, и укажите сроки выполнения. Я и моя команда изучим внимательно задание и сообщим цену.
Если цена Вас устроит, то я вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Мы приступим к выполнению, соблюдая указанные сроки и требования. 80% заказов сдаются раньше срока.
После выполнения отправлю Вам заказ в чат, если у Вас будут вопросы по заказу – подробно объясню. Гарантия 1 год. В течении 1 года я и моя команда исправим любые ошибки в заказе.
youtube.com/embed/g4ioDc7sLwU” frameborder=”0″ allow=”accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture” allowfullscreen=””/>
youtube.com/embed/zW5JhiZ4140″ frameborder=”0″ allow=”accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture” allowfullscreen=””/>
Можете смело обращаться к нам, мы вас не подведем. Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
В заключение хочу сказать: если Вы выберете меня для помощи на учебно-образовательном пути, у вас останутся только приятные впечатления от работы и от полученного результата!
Жду ваших заказов!
С уважением
Пользовательское соглашение
Политика конфиденциальности
ОРБИТАЛЬ | Энциклопедия Кругосвет
Содержание статьи- Гибридизация.
- Участие орбиталей в образовании простых химических связей.
- Участие орбиталей в образовании кратных химических связей.
- Орбитали высоких уровней.
- Перспективы.
ОРБИТАЛЬ – область наиболее вероятного местонахождения электрона в атоме (атомная орбиталь) или в молекуле (молекулярная орбиталь).
Электрон движется в атоме вокруг ядра не по фиксированной линии-орбите, а занимает некоторую область пространства. Например, электрон в атоме водорода может с определенной вероятностью оказаться либо весьма близко к ядру, либо на значительном удалении, однако существует определенная область, где его появление наиболее вероятно. Графически орбиталь изображают в виде поверхности, очерчивающей область, где вероятность появления электрона наибольшая, иначе говоря, электронная плотность максимальна. У атома водорода орбиталь электрона имеет сферическую (шаровую) форму:
Графически орбиталь изображают в виде поверхности, очерчивающей область, где вероятность появления электрона наибольшая, иначе говоря, электронная плотность максимальна. У атома водорода орбиталь электрона имеет сферическую (шаровую) форму:
К настоящему моменту описано пять типов орбиталей: s, p, d, f и g. Названия первых трех сложились исторически, далее был выбран алфавитный принцип. Формы орбиталей вычислены методами квантовой химии.
Орбитали существуют независимо от того, находится на них электрон (занятые орбитали), или отсутствует (вакантные орбитали). Атом каждого элемента, начиная с водорода и заканчивая последним полученным на сегодня элементом, имеет полный набор всех орбиталей на всех электронных уровнях. Их заполнение электронами происходит по мере увеличения порядкового номера, то есть, заряда ядра.
s-Орбитали, как было показано выше, имеют сферическую форму и, следовательно, одинаковую электронную плотность в направлении каждой оси трехмерных координат:
На первом электронном уровне каждого атома находится только одна s-орбиталь.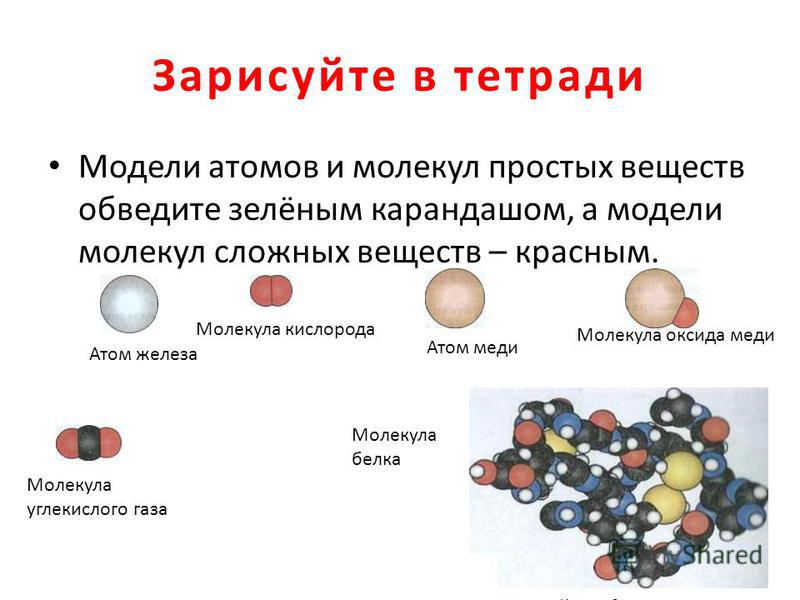 Начиная со второго электронного уровня помимо s-орбитали появляются также три р-орбитали. Они имеют форму объемных восьмерок, именно так выглядит область наиболее вероятного местонахождения р-электрона в районе атомного ядра. Каждая р-орбиталь расположена вдоль одной из трех взаимоперпендикулярных осей, в соответствии с этим в названии р-орбитали указывают с помощью соответствующего индекса ту ось, вдоль которой располагается ее максимальная электронная плотность:
Начиная со второго электронного уровня помимо s-орбитали появляются также три р-орбитали. Они имеют форму объемных восьмерок, именно так выглядит область наиболее вероятного местонахождения р-электрона в районе атомного ядра. Каждая р-орбиталь расположена вдоль одной из трех взаимоперпендикулярных осей, в соответствии с этим в названии р-орбитали указывают с помощью соответствующего индекса ту ось, вдоль которой располагается ее максимальная электронная плотность:
В современной химии орбиталь – определяющее понятие, позволяющее рассматривать процессы образования химических связей и анализировать их свойства, при этом внимание сосредотачивают на орбиталях тех электронов, которые участвуют в образовании химических связей, то есть, валентных электронов, обычно это электроны последнего уровня.
У атома углерода в исходном состоянии на втором (последнем) электронном уровне находится два электрона на s-орбитали (отмечены синим цветом) и по одному электрону на двух р-орбиталях (отмечены красным и желтым цветом), третья орбиталь – рz-вакантная:
Гибридизация.
В том случае, когда атом углерода участвует в образовании насыщенных соединений (не содержащих кратных связей), одна s-орбиталь и три р-орбитали объединяются, образуя новые орбитали, представляющие собой гибриды исходных орбиталей (процесс называют гибридизацией). Количество гибридных орбиталей всегда равно количеству исходных, в данном случае, четыре. Получившиеся орбитали-гибриды одинаковы по форме и внешне напоминают асимметричные объемные восьмерки:
Вся конструкция оказывается как бы вписанной в правильный тетраэдр – призма, собранная из правильных треугольников. При этом орбитали-гибриды располагаются вдоль осей такого тетраэдра, угол между любыми двумя осями – 109°. Четыре валентных электрона углерода располагаются на этих гибридных орбиталях:
Участие орбиталей в образовании простых химических связей.
Свойства электронов, разместившихся на четырех одинаковых орбиталях, эквивалентны, соответственно, будут эквивалентны химические связи, образованные с участием этих электронов при взаимодействии с атомами одного типа.
Взаимодействие атома углерода с четырьмя атомами водорода сопровождается взаимоперекрыванием вытянутых гибридных орбиталей углерода со сферическими орбиталями водородов. На каждой орбитали находится по одному электрону, в результате перекрывания каждая пара электронов начинает перемещаться по объединенной – молекулярной орбитали.
Гибридизация приводит лишь к изменению формы орбиталей внутри одного атома, а перекрывание орбиталей двух атомов (гибридных или обычных) приводит к образованию химической связи между ними. В данном случае (см. рисунок, помещенный ниже) максимальная электронная плотность располагается вдоль линии, связывающей два атома. Такую связь называют s-связью.
В традиционном написании структуры образовавшегося метана вместо перекрывающихся орбиталей используют символ валентной черты. Для объемного изображения структуры валентность, направленную от плоскости чертежа к зрителю показывают в виде сплошной клиновидной линии, а валентность, уходящую за плоскость рисунка – в виде штриховой клиновидной линии:
Таким образом, структура молекулы метана определяется геометрией гибридных орбиталей углерода:
Образование молекулы этана аналогично показанному выше процессу, отличие состоит в том, что при взаимоперекрывании гибридных орбиталей двух атомов углерода происходит образование С-С – связи:
Геометрия молекулы этана напоминает метан, валентные углы 109°, что определяется пространственным расположением гибридных орбиталей углерода:
Участие орбиталей в образовании кратных химических связей.

Молекула этилена образована также с участием орбиталей-гибридов, однако в гибридизации участвуют одна s-орбиталь и только две р-орбитали (рх и ру), третья орбиталь – pz, направленная вдоль оси z, в образовании гибридов не участвует. Из исходных трех орбиталей возникают три гибридных орбитали, которые располагаются в одной плоскости, образуя трехлучевую звезду, углы между осями – 120°:
Два атома углерода присоединяют четыре атома водорода, а также соединяются между собой, образуя s-связь С-С:
Две орбитали pz, не участвовавшие в гибридизации, взаимоперекрываются, их геометрия такова, что перекрывание происходит не по линии связи С-С, а выше и ниже ее. В результате образуются две области с повышенной электронной плотностью, где помещаются два электрона (отмечены синим и красным цветом), участвующие в образовании этой связи. Таким образом, образуется одна молекулярная орбиталь, состоящая из двух областей, разделенных в пространстве. Связь, у которой максимальная электронная плотность расположена вне линии, связывающей два атома, называют p-связью:
Связь, у которой максимальная электронная плотность расположена вне линии, связывающей два атома, называют p-связью:
Вторая валентная черта в обозначении двойной связи, широко используемая для изображения ненасыщенных соединений уже не одно столетие, в современном понимании подразумевает наличие двух областей с повышенной электронной плотностью, расположенных по разные стороны линии связи С-С.
Структура молекулы этилена задана геометрией гибридных орбиталей, валентный угол Н-С-Н – 120°:
При образовании ацетилена в гибридизации участвует одна одна s-орбиталь и одна рx-орбиталь (орбитали pyи pz, в образовании гибридов не участвуют). Две образовавшиеся гибридные орбитали располагаются на одной линии, вдоль оси х:
Взаимоперекрывание орбиталей-гибридов друг с другом и с орбиталями атомов водорода приводит к образованию s-связей С-С и С-Н, изображаемых с помощью простой валентной черты:
Две пары оставшихся орбиталей pyи pz взаимоперекрываются. На рисунке, приведенном ниже, цветными стрелками показано, что из чисто пространственных соображений наиболее вероятно перекрывание орбиталей с одинаковыми индексами х-х и у-у. В результате образуются две p-связи, окружающие простую s-связь С-С:
На рисунке, приведенном ниже, цветными стрелками показано, что из чисто пространственных соображений наиболее вероятно перекрывание орбиталей с одинаковыми индексами х-х и у-у. В результате образуются две p-связи, окружающие простую s-связь С-С:
В итоге молекула ацетилена имеет палочкообразную форму:
У бензола остов молекулы собран из атомов углерода, имеющих гибридные орбитали, составленные из одной s– и двух р-орбиталей, расположенные в форме трехлучевой звезды (как у этилена), р-орбитали, не участвующие в гибридизации, показаны полупрозрачными:
Шесть оставшихся р-орбиталей взаимоперекрываются, образуя молекулярную орбиталь в виде двух кольцевых областей, над и под плоскостью бензольного цикла:
Возникает единая замкнутая электронная система (см. также АРОМАТИЧНОСТЬ).
Молекула бензола плоская, что задано плоской конфигурацией «трехлучевых звезд», из которых она собрана. Молекулярную орбиталь, образованную перекрыванием шести атомных р-орбиталей обозначают в виде кольцевого символа внутри бензольного цикла:
В образовании химических связей могут также участвовать вакантные, то есть, не содержащие электронов орбитали (см. также ТРЕХЦЕНТРОВЫЕ СВЯЗИ).
также ТРЕХЦЕНТРОВЫЕ СВЯЗИ).
Орбитали высоких уровней.
Начиная с четвертого электронного уровня, у атомов появляются пять d-орбиталей, их заполнение электронами происходит у переходных элементов, начиная со скандия. Четыре d-орбитали имеют форму объемных четырехлистников, называемых иногда «клеверным листом», они отличаются лишь ориентацией в пространстве, пятая d-орбиталь представляет собой объемную восьмерку, продетую в кольцо:
d-Орбитали могут образовывать гибриды с s- и p-орбиталями. Параметры d-орбиталей обычно используют при анализе строения и спектральных свойств в комплексах переходных металлов.
Начиная с шестого электронного уровня, у атомов появляются семь f-орбиталей, их заполнение электронами происходит в атомах лантаноидов и актиноидов. f-Орбитали имеют довольно сложную конфигурацию, ниже на рисунке показана форма трех из семи таких орбиталей, имеющих одинаковую форму и ориентированных в пространстве различным образом:
f-Орбитали весьма редко используют при обсуждении свойств различных соединений, поскольку расположенные на них электроны практически не принимают участия в химических превращениях.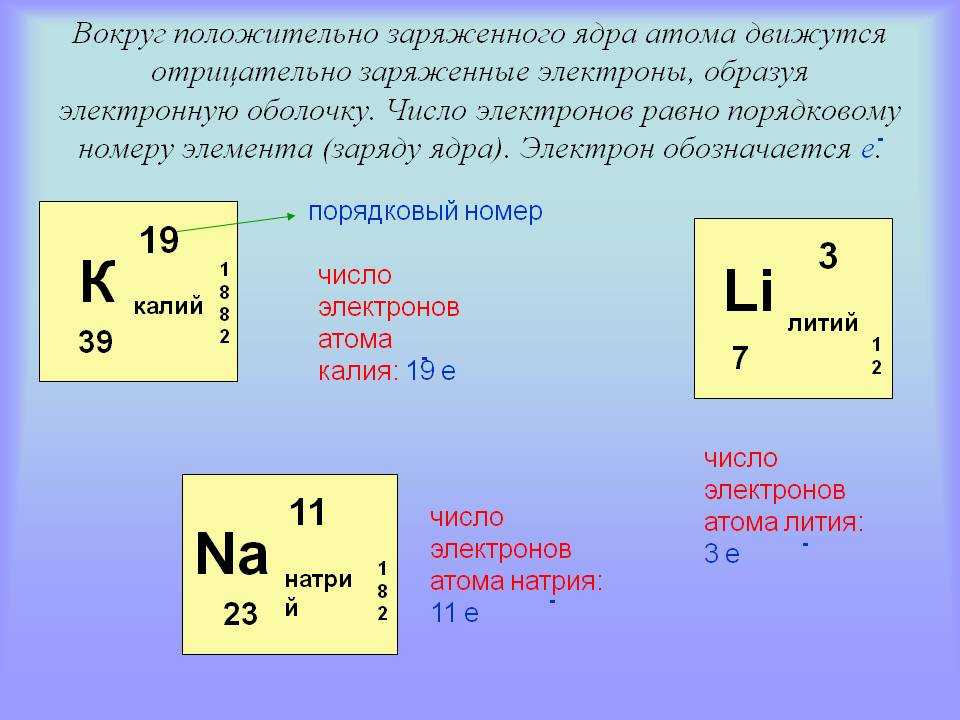 .
.
Перспективы.
На восьмом электронном уровне находится девять g-орбиталей. Элементы, содержащие электроны на этих орбиталях, должны появится в восьмом периоде, пока они недоступны (в ближайшее время ожидается получение элемента № 118, последнего элемента седьмого периода Периодической системы, его синтез проводят в Объединенном институте ядерных исследований в Дубне).
Форма g-орбиталей, вычисленная методами квантовой химии, еще более сложная, чем у f-орбиталей, область наиболее вероятного местонахождения электрона в данном случае выглядит весьма причудливо. Ниже показан внешний вид одной из девяти таких орбиталей:
В современной химии представления об атомных и молекулярных орбиталях широко используют при описании строения и реакционных свойств соединений, также при анализе спектров различных молекул, в некоторых случаях – для прогнозирования возможности протекания реакций.
Михаил Левицкий
Ионизирующее излучение, последствия для здоровья и защитные меры
Ионизирующее излучение, последствия для здоровья и защитные меры- Популярные темы
- Загрязнение воздуха
- Коронавирусная болезнь (COVID-19)
- Гепатит
- Данные и статистика »
- Информационный бюллетень
- Факты наглядно
- Найти страну »
- А
- Б
- В
- Г
- Д
- Е
- Ё
- Ж
- З
- И
- Й
- К
- Л
- М
- Н
- О
- П
- Р
- С
- Т
- У
- Ф
- Х
- Ц
- Ч
- Ш
- Щ
- Ъ
- Ы
- Ь
- Э
- Ю
- Я
- ВОЗ в странах »
- Репортажи
- Регионы »
- Африка
- Америка
- Юго-Восточная Азия
- Европа
- Восточное Средиземноморье
- Западная часть Тихого океана
- Центр СМИ
- Пресс-релизы
- Заявления
- Сообщения для медиа
- Комментарии
- Репортажи
- Онлайновые вопросы и ответы
- События
- Фоторепортажи
- Вопросы и ответы
- Последние сведения
- Чрезвычайные ситуации »
- Новости »
- Новости о вспышках болезней
- Данные ВОЗ »
- Приборные панели »
- Приборная панель мониторинга COVID-19
- Основные моменты »
- Информация о ВОЗ »
- Генеральный директор
- Информация о ВОЗ
- Деятельность ВОЗ
- Где работает ВОЗ
- Руководящие органы »
- Всемирная ассамблея здравоохранения
- Исполнительный комитет
- Главная страница/
- Центр СМИ/
- Информационные бюллетени/
- Подробнее/
- Ионизирующее излучение, последствия для здоровья и защитные меры
\n
\nВыше определенных пороговых значений облучение может нарушить функционирование тканей и/или органов и может вызвать острые реакции, такие как покраснение кожи, выпадение волос, радиационные ожоги или острый лучевой синдром.
\n
\nЕсли доза является низкой и/или воздействует длительный период времени (низкая мощность дозы), обусловленный этим риск существенно снижается, поскольку в этом случае увеличивается вероятность восстановления поврежденных тканей. Тем не менее риск долгосрочных последствий, таких как рак, который может проявиться через годы и даже десятилетия, существует. Воздействия этого типа проявляются не всегда, однако их вероятность пропорциональна дозе облучения. Этот риск выше в случае детей и подростков, так как они намного более чувствительны к воздействию радиации, чем взрослые.
\n
\nЭпидемиологические исследования в группах населения, подвергшихся облучению, например людей, выживших после взрыва атомной бомбы, или пациентов радиотерапии, показали значительное увеличение вероятности рака при дозах выше 100 мЗв. В ряде случаев более поздние эпидемиологические исследования на людях, которые подвергались воздействию в детском возрасте в медицинских целях (КТ в детском возрасте), позволяют сделать вывод о том, что вероятность рака может повышаться даже при более низких дозах (в диапазоне 50-100 мЗв).
В ряде случаев более поздние эпидемиологические исследования на людях, которые подвергались воздействию в детском возрасте в медицинских целях (КТ в детском возрасте), позволяют сделать вывод о том, что вероятность рака может повышаться даже при более низких дозах (в диапазоне 50-100 мЗв).
\n
\nДородовое воздействие ионизирующего излучения может вызвать повреждение мозга плода при сильной дозе, превышающей 100 мЗв между 8 и 15 неделей беременности и 200 мЗв между 16 и 25 неделей беременности. Исследования на людях показали, что до 8 недели или после 25 недели беременности связанный с облучением риск для развития мозга плода отсутствует. Эпидемиологические исследования свидетельствуют о том, что риск развития рака у плода после воздействия облучения аналогичен риску после воздействия облучения в раннем детском возрасте.
\n
Деятельность ВОЗ
\nВОЗ разработала радиационную программу защиты пациентов, работников и общественности от опасности воздействия радиации на здоровье в планируемых, существующих и чрезвычайных случаях воздействия. Эта программа, которая сосредоточена на аспектах общественного здравоохранения, охватывает деятельность, связанную с оценкой риска облучения, его устранением и информированием о нем.
Эта программа, которая сосредоточена на аспектах общественного здравоохранения, охватывает деятельность, связанную с оценкой риска облучения, его устранением и информированием о нем.
\n
\nВ соответствии с основной функцией, касающейся \”установления норм и стандартов, содействия в их соблюдении и соответствующего контроля\” ВОЗ сотрудничает с 7 другими международными организациями в целях пересмотра и обновления международных стандартов базовой безопасности, связанной с радиацией (СББ). ВОЗ приняла новые международные СББ в 2012 году и в настоящее время проводит работу по оказанию поддержки в осуществлении СББ в своих государствах-членах.
\n
“,”datePublished”:”2016-04-29T09:30:00.0000000+00:00″,”image”:”https://cdn.who.int/media/images/default-source/imported/radiation/radiation-africa630x420-jpg.jpg?sfvrsn=e8581c1b_10″,”publisher”:{“@type”:”Organization”,”name”:”World Health Organization: WHO”,”logo”:{“@type”:”ImageObject”,”url”:”https://www. who.int/Images/SchemaOrg/schemaOrgLogo.jpg”,”width”:250,”height”:60}},”dateModified”:”2016-04-29T09:30:00.0000000+00:00″,”mainEntityOfPage”:”https://www.who.int/ru/news-room/fact-sheets/detail/ionizing-radiation-health-effects-and-protective-measures”,”@context”:”http://schema.org”,”@type”:”Article”};
who.int/Images/SchemaOrg/schemaOrgLogo.jpg”,”width”:250,”height”:60}},”dateModified”:”2016-04-29T09:30:00.0000000+00:00″,”mainEntityOfPage”:”https://www.who.int/ru/news-room/fact-sheets/detail/ionizing-radiation-health-effects-and-protective-measures”,”@context”:”http://schema.org”,”@type”:”Article”};
Основные факты
- Ионизирующее излучение — это вид энергии, высвобождаемой атомами в форме электромагнитных волн или частиц.
- Люди подвергаются воздействию природных источников ионизирующего излучения, таких как почва, вода, растения, и воздействию искусственных источников, таких как рентгеновское излучение и медицинские устройства.
- Ионизирующее излучение имеет многочисленные полезные виды применения, в том числе в медицине, промышленности, сельском хозяйстве и в научных исследованиях.
- По мере расширения использования ионизирующего излучения увеличивается и потенциал опасностей для здоровья, если оно используется или ограничивается ненадлежащим образом.

- Острое воздействие на здоровье, такое как ожог кожи или острый лучевой синдром, может возникнуть, когда доза облучения превышает определенные уровни.
- Низкие дозы ионизирующего излучения могут увеличить риск более долгосрочных последствий, таких как рак.
Что такое ионизирующее излучение?
Ионизирующее излучение — это вид энергии, высвобождаемой атомами в форме электромагнитных волн (гамма- или рентгеновское излучение) или частиц (нейтроны, бета или альфа). Спонтанный распад атомов называется радиоактивностью, а избыток возникающей при этом энергии является формой ионизирующего излучения. Нестабильные элементы, образующиеся при распаде и испускающие ионизирующее излучение, называются радионуклидами.
Все радионуклиды уникальным образом идентифицируются по виду испускаемого ими излучения, энергии излучения и периоду полураспада.
Активность, используемая в качестве показателя количества присутствующего радионуклида, выражается в единицах, называемых беккерелями (Бк): один беккерель — это один акт распада в секунду. Период полураспада — это время, необходимое для того, чтобы активность радионуклида в результате распада уменьшилась наполовину от его первоначальной величины. Период полураспада радиоактивного элемента — это время, в течение которого происходит распад половины его атомов. Оно может находиться в диапазоне от долей секунды до миллионов лет (например, период полураспада йода-131 составляет 8 дней, а период полураспада углерода-14 — 5730 лет).
Период полураспада — это время, необходимое для того, чтобы активность радионуклида в результате распада уменьшилась наполовину от его первоначальной величины. Период полураспада радиоактивного элемента — это время, в течение которого происходит распад половины его атомов. Оно может находиться в диапазоне от долей секунды до миллионов лет (например, период полураспада йода-131 составляет 8 дней, а период полураспада углерода-14 — 5730 лет).
Источники излучения
Люди каждый день подвергаются воздействию естественного и искусственного излучения. Естественное излучение происходит из многочисленных источников, включая более 60 естественным образом возникающих радиоактивных веществ в почве, воде и воздухе. Радон, естественным образом возникающий газ, образуется из горных пород, почвы и является главным источником естественного излучения. Ежедневно люди вдыхают и поглощают радионуклиды из воздуха, пищи и воды.
Люди подвергаются также воздействию естественного излучения из космических лучей, особенно на большой высоте. В среднем 80% ежегодной дозы, которую человек получает от фонового излучения, это естественно возникающие наземные и космические источники излучения. Уровни такого излучения варьируются в разных реогрфических зонах, и в некоторых районах уровень может быть в 200 раз выше, чем глобальная средняя величина.
В среднем 80% ежегодной дозы, которую человек получает от фонового излучения, это естественно возникающие наземные и космические источники излучения. Уровни такого излучения варьируются в разных реогрфических зонах, и в некоторых районах уровень может быть в 200 раз выше, чем глобальная средняя величина.
На человека воздействует также излучение из искусственных источников — от производства ядерной энергии до медицинского использования радиационной диагностики или лечения. Сегодня самыми распространенными искусственными источниками ионизирующего излучения являются медицинские аппараты, как рентгеновские аппараты, и другие медицинские устройства.
Воздействие ионизирующего излучения
Воздействие излучения может быть внутренним или внешним и может происходить различными путями.
Внутренне воздействие ионизирующего излучения происходит, когда радионуклиды вдыхаются, поглощаются или иным образом попадают в кровообращение (например, в результате инъекции, ранения). Внутреннее воздействие прекращается, когда радионуклид выводится из организма либо самопроизвольно (с экскрементами), либо в результате лечения.
Внутреннее воздействие прекращается, когда радионуклид выводится из организма либо самопроизвольно (с экскрементами), либо в результате лечения.
Внешнее радиоактивное заражение может возникнуть, когда радиоактивный материал в воздухе (пыль, жидкость, аэрозоли) оседает на кожу или одежду. Такой радиоактивный материал часто можно удалить с тела простым мытьем.
Воздействие ионизирующего излучения может также произойти в результате внешнего излучения из соответствующего внешнего источника (например, такое как воздействие радиации, излучаемой медицинским рентгеновским оборудованием). Внешнее облучение прекращается в том случае, когда источник излучения закрыт, или когда человек выходит за пределы поля излучения.
Люди могут подвергаться воздействию ионизирующего излучения в различных обстоятельствах: дома или в общественных местах (облучение в общественных местах), на своих рабочих местах (облучение на рабочем месте) или в медицинских учреждениях (пациенты, лица, осуществляющие уход, и добровольцы).
Воздействие ионизирующего излучения можно классифицировать по трем случаям воздействия.
Первый случай — это запланированное воздействие, которое обусловлено преднамеренным использованием и работой источников излучения в конкретных целях, например, в случае медицинского использования излучения для диагностики или лечения пациентов, или использование излучения в промышленности или в целях научных исследований.
Второй случай — это существующие источники воздействия, когда воздействие излучения уже существует и в случае которого необходимо принять соответствующие меры контроля, например, воздействие радона в жилых домах или на рабочих местах или воздействие фонового естественного излучения в условиях окружающей среды.
Последний случай — это воздействие в чрезвычайных ситуациях, обусловленных неожиданными событиями, предполагающими принятие оперативных мер, например, в случае ядерных происшествий или злоумышленных действий.
На медицинское использование излучения приходится 98% всей дозы облучения из всех искусственных источников; оно составляет 20% от общего воздействия на население. Ежегодно в мире проводится 3 600 миллионов радиологических обследований в целях диагностики, 37 миллионов процедур с использованием ядерных материалов и 7,5 миллиона процедур радиотерапии в лечебных целях.
Ежегодно в мире проводится 3 600 миллионов радиологических обследований в целях диагностики, 37 миллионов процедур с использованием ядерных материалов и 7,5 миллиона процедур радиотерапии в лечебных целях.
Последствия ионизирующего излучения для здоровья
Радиационное повреждение тканей и/или органов зависит от полученной дозы облучения или поглощенной дозы, которая выражается в грэях (Гр).
Эффективная доза используется для измерения ионизирующего излучения с точки зрения его потенциала причинить вред. Зиверт (Зв) — единица эффективной дозы, в которой учитывается вид излучения и чувствительность ткани и органов. Она дает возможность измерить ионизирующее излучение с точки зрения потенциала нанесения вреда. Зв учитывает вид радиации и чувствительность органов и тканей.
Зв является очень большой единицей, поэтому более практично использовать меньшие единицы, такие как миллизиверт (мЗв) или микрозиверт (мкЗв). В одном мЗв содержится тысяча мкЗв, а тысяча мЗв составляют один Зв. Помимо количества радиации (дозы), часто полезно показать скорость выделения этой дозы, например мкЗв/час или мЗв/год.
Помимо количества радиации (дозы), часто полезно показать скорость выделения этой дозы, например мкЗв/час или мЗв/год.
Выше определенных пороговых значений облучение может нарушить функционирование тканей и/или органов и может вызвать острые реакции, такие как покраснение кожи, выпадение волос, радиационные ожоги или острый лучевой синдром. Эти реакции являются более сильными при более высоких дозах и более высокой мощности дозы. Например, пороговая доза острого лучевого синдрома составляет приблизительно 1 Зв (1000 мЗв).
Если доза является низкой и/или воздействует длительный период времени (низкая мощность дозы), обусловленный этим риск существенно снижается, поскольку в этом случае увеличивается вероятность восстановления поврежденных тканей. Тем не менее риск долгосрочных последствий, таких как рак, который может проявиться через годы и даже десятилетия, существует. Воздействия этого типа проявляются не всегда, однако их вероятность пропорциональна дозе облучения. Этот риск выше в случае детей и подростков, так как они намного более чувствительны к воздействию радиации, чем взрослые.
Эпидемиологические исследования в группах населения, подвергшихся облучению, например людей, выживших после взрыва атомной бомбы, или пациентов радиотерапии, показали значительное увеличение вероятности рака при дозах выше 100 мЗв. В ряде случаев более поздние эпидемиологические исследования на людях, которые подвергались воздействию в детском возрасте в медицинских целях (КТ в детском возрасте), позволяют сделать вывод о том, что вероятность рака может повышаться даже при более низких дозах (в диапазоне 50-100 мЗв).
Дородовое воздействие ионизирующего излучения может вызвать повреждение мозга плода при сильной дозе, превышающей 100 мЗв между 8 и 15 неделей беременности и 200 мЗв между 16 и 25 неделей беременности. Исследования на людях показали, что до 8 недели или после 25 недели беременности связанный с облучением риск для развития мозга плода отсутствует. Эпидемиологические исследования свидетельствуют о том, что риск развития рака у плода после воздействия облучения аналогичен риску после воздействия облучения в раннем детском возрасте.
Деятельность ВОЗ
ВОЗ разработала радиационную программу защиты пациентов, работников и общественности от опасности воздействия радиации на здоровье в планируемых, существующих и чрезвычайных случаях воздействия. Эта программа, которая сосредоточена на аспектах общественного здравоохранения, охватывает деятельность, связанную с оценкой риска облучения, его устранением и информированием о нем.
В соответствии с основной функцией, касающейся “установления норм и стандартов, содействия в их соблюдении и соответствующего контроля” ВОЗ сотрудничает с 7 другими международными организациями в целях пересмотра и обновления международных стандартов базовой безопасности, связанной с радиацией (СББ). ВОЗ приняла новые международные СББ в 2012 году и в настоящее время проводит работу по оказанию поддержки в осуществлении СББ в своих государствах-членах.
- Последствия Чернобыльской аварии для здоровья
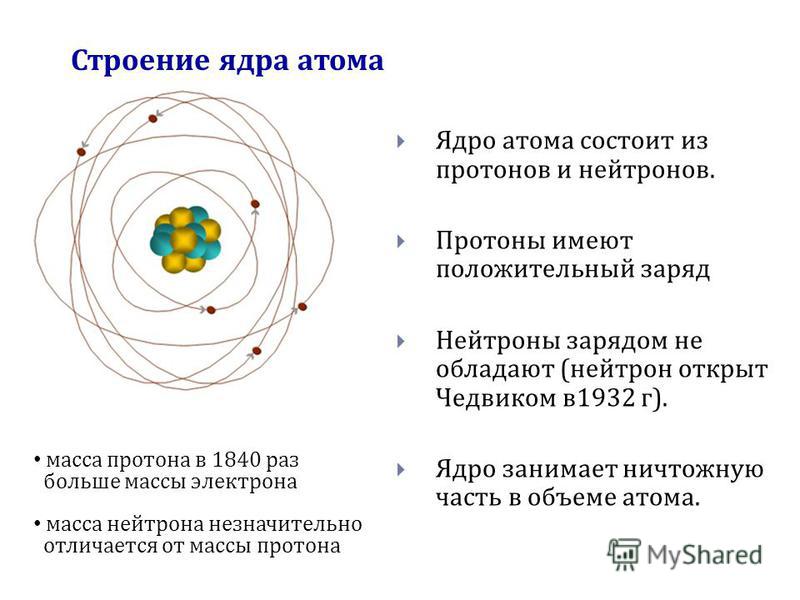
Что такое атом? Факты о строительных блоках материи
Атомы состоят из ядра, состоящего из протонов и нейтронов, вокруг которых вращаются электроны. (Изображение предоставлено: Рост-9Д через Getty Images)
(Изображение предоставлено: Рост-9Д через Getty Images)Атомы являются основными единицами материи. По данным Северо-Западного университета, все во Вселенной, кроме энергии, состоит из материи, поэтому атомы составляют все во Вселенной (открывается в новой вкладке). Термин «атом» происходит от греческого слова «неделимый», потому что когда-то считалось, что атомы — это самые маленькие объекты во Вселенной, и их нельзя разделить. Теперь мы знаем, что атомы состоят из трех частиц, известных как субатомные частицы: протоны, нейтроны и электроны, которые состоят из еще более мелких частиц, таких как кварки.
Атомы образовались после Большого Взрыва 13,7 миллиардов лет назад. Когда горячая и плотная новая Вселенная остыла, условия стали подходящими для образования кварков и электронов. Кварки объединились, чтобы сформировать протоны и нейтроны, и эти частицы объединились в ядра. По данным CERN, все это произошло в течение первых нескольких минут существования Вселенной .
Вселенной потребовалось 380 000 лет, чтобы охладиться настолько, чтобы замедлить электроны, чтобы ядра могли их захватить и образовать первые атомы. По данным лаборатории Джефферсона, самыми ранними атомами были прежде всего водород и гелий, которые до сих пор являются самыми распространенными элементами во Вселенной. Гравитация в конечном итоге заставила облака газа слиться и образовать звезды, а более тяжелые атомы были (и до сих пор) создаются внутри звезд и разлетаются по Вселенной, когда звезда взорвалась (сверхновая).
По данным лаборатории Джефферсона, самыми ранними атомами были прежде всего водород и гелий, которые до сих пор являются самыми распространенными элементами во Вселенной. Гравитация в конечном итоге заставила облака газа слиться и образовать звезды, а более тяжелые атомы были (и до сих пор) создаются внутри звезд и разлетаются по Вселенной, когда звезда взорвалась (сверхновая).
Связанный: Что такое антиматерия, как она производится и опасна ли она?
Атомные частицы
Протоны и нейтроны тяжелее электронов и находятся в ядре в центре атома. Электроны чрезвычайно легкие и существуют в облаке, вращающемся вокруг ядра. По данным Лос-Аламосской национальной лаборатории, электронное облако имеет радиус в 10 000 раз больше, чем ядро .
Протоны и нейтроны имеют примерно одинаковую массу. Однако один протон примерно в 1835 раз массивнее электрона. Атомы всегда имеют одинаковое количество протонов и электронов, и количество протонов и нейтронов обычно также одинаково.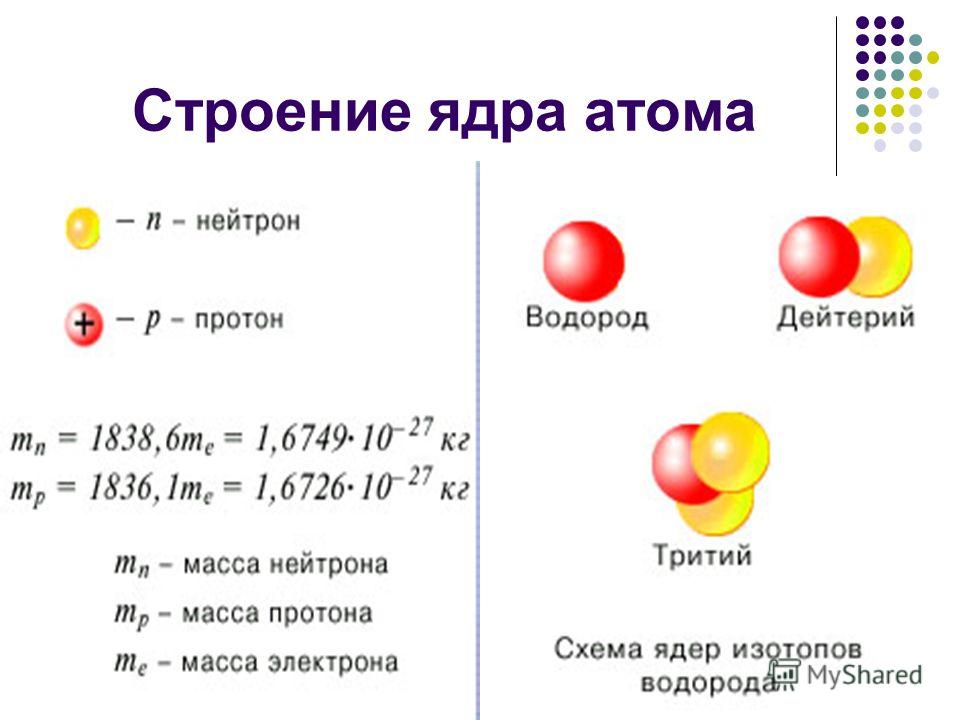 Добавление протона к атому создает новый элемент, а добавление нейтрона создает изотоп или более тяжелую версию этого атома.
Добавление протона к атому создает новый элемент, а добавление нейтрона создает изотоп или более тяжелую версию этого атома.
Ядро
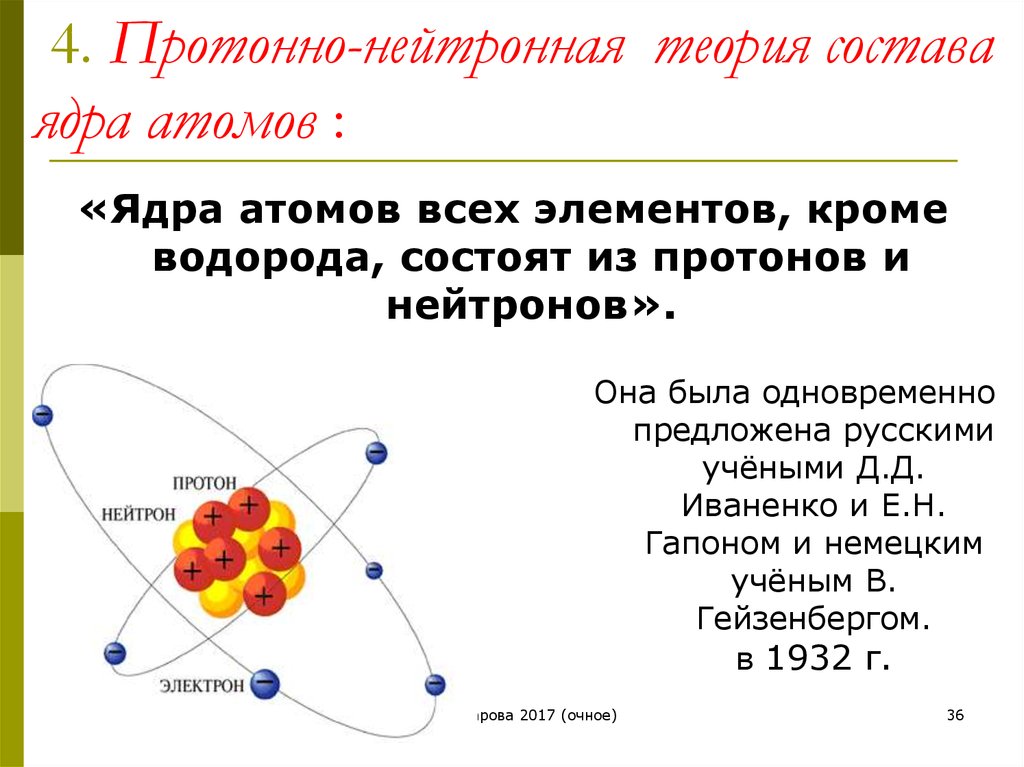
Ядро было открыто в 1911 году Эрнестом Резерфордом, физиком из Новой Зеландии, по данным Американского института физики . В 1920 году Резерфорд предложил название протон для положительно заряженных частиц атома. Он также предположил, что внутри ядра находится нейтральная частица, что Джеймс Чедвик, британский физик и ученик Резерфорда, смог подтвердить в 1932 году. (откроется в новой вкладке). Протоны и нейтроны, из которых состоит ядро, имеют примерно одинаковую массу (протон немного меньше) и имеют одинаковый угловой момент, или спин.
Ядро удерживается вместе сильным взаимодействием, одним из четырех основных сил в природе. Эта сила между протонами и нейтронами преодолевает электрическую силу отталкивания, которая в противном случае раздвинула бы протоны в соответствии с законами электричества. Некоторые атомные ядра нестабильны, потому что сила связи различается для разных атомов в зависимости от размера ядра. Эти атомы затем распадаются на другие элементы, такие как углерод-14, распадающийся на азот-14.
Эти атомы затем распадаются на другие элементы, такие как углерод-14, распадающийся на азот-14.
Протоны
Протоны — это положительно заряженные частицы, находящиеся внутри атомных ядер. Резерфорд обнаружил их в экспериментах с электронно-лучевыми трубками, которые проводились между 1911 и 1919 годами. По данным лаборатории Джефферсона, протоны примерно на 99,86% массивнее нейтронов .
Количество протонов в атоме уникально для каждого элемента. Например, у атомов углерода шесть протонов, у атомов водорода — один, а у атомов кислорода — восемь. Число протонов в атоме называется атомным номером этого элемента. Количество протонов также определяет химическое поведение элемента. Элементы расположены в Периодической таблице элементов в порядке возрастания атомного номера.
Каждый протон состоит из трех кварков — двух «верхних» кварков (каждый с положительным зарядом на две трети) и одного «нижнего» кварка (с отрицательным зарядом на одну треть) — и они удерживаются вместе другими субатомными частицами, называемыми глюоны, которые не имеют массы.
Электроны
Электроны крошечные по сравнению с протонами и нейтронами, более чем в 1800 раз меньше, чем протон или нейтрон. По данным лаборатории Джефферсона, электроны примерно на 0,054% массивнее нейтронов.
Джозеф Джон (Дж.Дж.) Томсон, британский физик, открыл электрон в 189 г.7, по данным Института истории науки . Первоначально известные как «корпускулы», электроны имеют отрицательный заряд и электрически притягиваются к положительно заряженным протонам. Электроны окружают атомное ядро путями, называемыми орбиталями. Эту идею выдвинул австрийский физик Эрвин Шредингер в 1920-х годах. Сегодня эта модель известна как квантовая модель или модель электронного облака. Внутренние орбитали, окружающие атом, имеют сферическую форму, но внешние орбитали намного сложнее.
Электронная конфигурация атома относится к расположению электронов в типичном атоме. Согласно данным Лос-Аламосской национальной лаборатории, используя электронную конфигурацию и принципы физики, химики могут предсказать свойства атома, такие как стабильность, температура кипения и проводимость.
Связанный: Что такое квантовая запутанность?
Нейтроны
Существование нейтрона было теоретизировано Резерфордом в 1920 г. и открыто Чедвиком в 1919 г.32, по данным Американского физического общества . Нейтроны были обнаружены в ходе экспериментов, когда атомы стреляли в тонкий лист бериллия. Высвободились субатомные частицы без заряда — нейтрон.
Нейтроны представляют собой незаряженные частицы, присутствующие во всех атомных ядрах (кроме водорода). Масса нейтрона немного больше массы протона. Как и протоны, нейтроны также состоят из кварков — одного «верхнего» кварка (с положительным зарядом в 2/3) и двух «нижних» кварков (каждый с отрицательным зарядом в одну треть).
История атома
Теория атома восходит как минимум к 440 г. до н.э. Демокриту, греческому ученому и философу. Демокрит, скорее всего, построил свою теорию атомов на работах философов прошлого, по словам Эндрю Дж. Ван Мелсена, автора книги «От атома к атому: история концептуального атома» (издательство Duquesne University Press, 1952).
Демокритовое объяснение атома начинается с камня. Камень, разрезанный пополам, дает две половинки одного и того же камня. Если бы камень нужно было непрерывно резать, в какой-то момент найдется кусок камня, настолько маленький, что его уже нельзя будет разрезать. Термин «атом» происходит от греческого слова «неделимый», которое, по заключению Демокрита, должно быть точкой, в которой существо (любая форма материи) больше не может быть разделено, согласно образовательному веб-сайту Lumen Learning .
Его объяснение включало идеи о том, что атомы существуют отдельно друг от друга, что существует бесконечное количество атомов, что атомы способны двигаться, что они могут объединяться вместе, создавая материю, но не сливаются, чтобы стать новым атомом, и что их нельзя разделить, согласно Universe Today . Однако, поскольку большинство философов того времени — особенно очень влиятельный Аристотель — считали, что вся материя была создана из земли, воздуха, огня и воды, атомная теория Демокрита была отброшена.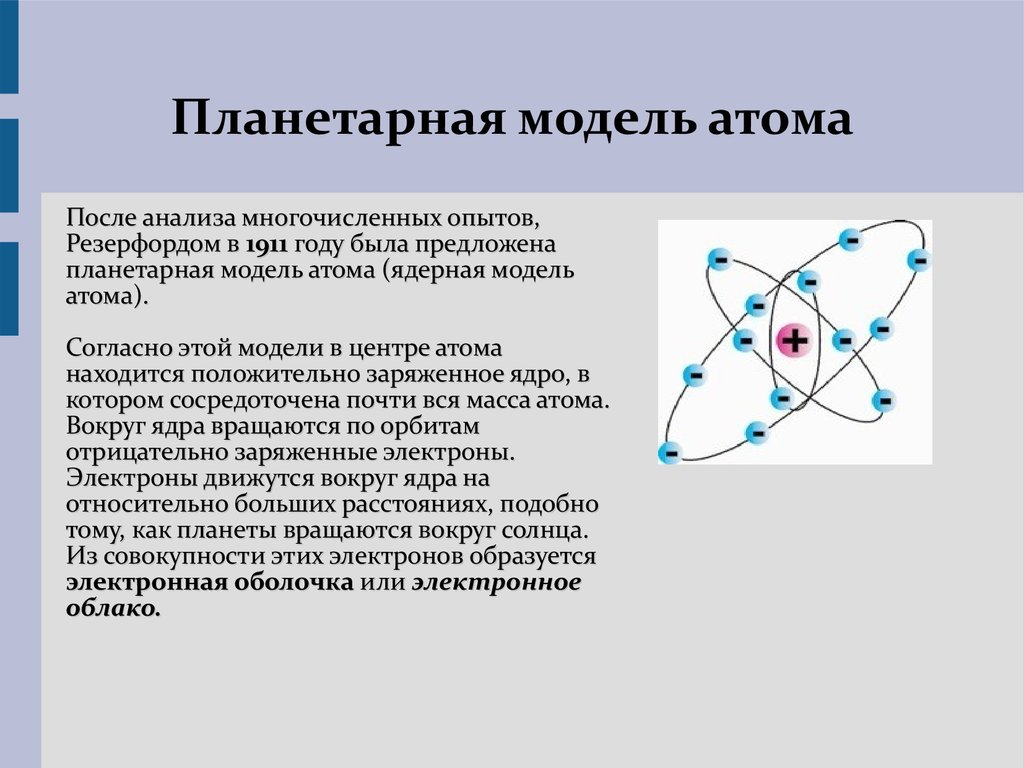
Джон Дальтон, британский химик, опирался на идеи Демокрита в 1803 году, когда он выдвинул свою собственную атомную теорию, по данным химического факультета Университета Пердью . Теория Дальтона включала в себя несколько идей Демокрита, таких как неделимость и неразрушимость атомов, а также то, что различные атомы формируются вместе, чтобы создать всю материю. Дополнения Дальтона к теории включали следующие идеи: что все атомы определенного элемента идентичны, что атомы одного элемента будут иметь различный вес и свойства, чем атомы другого элемента, что атомы не могут быть созданы или уничтожены и что материя образована атомы, объединяющиеся в простые целые числа.
Томсон, британский физик, открывший электрон в 1897 году, доказал, что атомы можно разделить, по данным Фонда химического наследия . Он смог определить существование электронов, изучая свойства электрического разряда в электронно-лучевых трубках. Согласно статье Томсона 1897 года, лучи отклонялись внутри трубки, что доказывало наличие чего-то отрицательно заряженного внутри вакуумной трубки.
В 1899 году Томсон опубликовал описание своей версии атома, широко известной как «модель сливового пудинга». Выдержка из этой статьи находится на сайте Chem Team . Модель атома Томсона включала большое количество электронов, подвешенных в чем-то, что создавало положительный заряд, придавая атому в целом нейтральный заряд. Его модель напоминала сливовый пудинг, популярный британский десерт с изюмом, подвешенным в круглом шаре, похожем на пирог.
Следующим ученым, который еще больше модифицировал и усовершенствовал атомную модель, был Резерфорд, который учился у Томсона, по данным химического факультета Университета Пердью. В 1911 году Резерфорд опубликовал свою версию атома, которая включала положительно заряженное ядро, вращающееся вокруг электронов. Эта модель возникла, когда Резерфорд и его помощники стреляли альфа-частицами по тонким листам золота. Согласно данным Лаборатории Джефферсона, альфа-частица состоит из двух протонов и двух нейтронов, удерживаемых вместе одной и той же сильной ядерной силой, которая связывает ядро.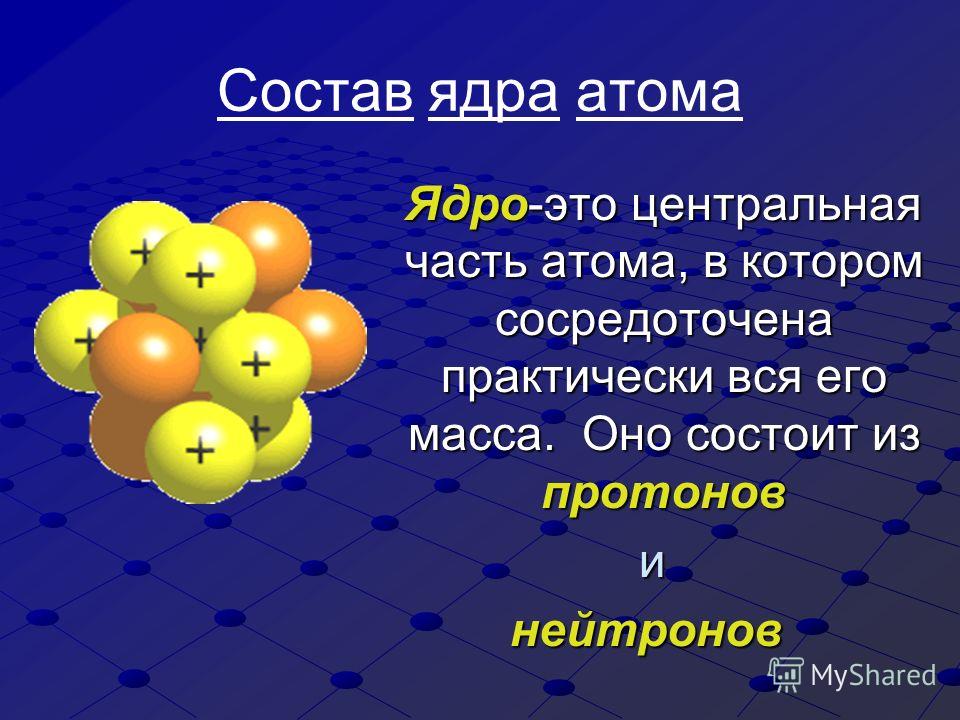
Ученые заметили, что небольшой процент альфа-частиц рассеивался под очень большими углами к первоначальному направлению движения, в то время как большинство проходило насквозь, почти не возмущаясь. Резерфорд смог приблизиться к размеру ядра атома золота, обнаружив, что он по крайней мере в 10 000 раз меньше, чем размер всего атома, при этом большая часть атома представляет собой пустое пространство. Модель атома Резерфорда до сих пор является основной моделью, используемой сегодня.
Несколько других ученых развили модель атома, в том числе Нильс Бор (откроется в новой вкладке) (построен на модели Резерфорда, чтобы включить свойства электронов на основе спектра водорода), Эрвин Шредингер (разработал квантовую модель атома), Вернер Гейзенберг (заявил, что нельзя одновременно знать положение и скорость электрона), и Мюррей Гелл-Манн и Джордж Цвейг (независимо разработали теорию о том, что протоны и нейтроны состоят из кварков).
Дополнительные ресурсы
- Узнайте больше о ранней Вселенной (открывается в новой вкладке) в ЦЕРНе.

- Узнайте больше об истории атомной химии в этом видео от Академии Хана (откроется в новой вкладке).
- Посмотрите это полезное слайд-шоу об атомах (откроется в новой вкладке) из лаборатории Джефферсона.
Дейзи Добриевич присоединилась к Space.com в феврале 2022 года в качестве справочного автора. Ранее она работала штатным автором в нашем сестринском журнале All About Space . Прежде чем присоединиться к нам, Дейзи прошла редакционную стажировку в журнале BBC Sky at Night Magazine и работала в Национальном космическом центре в Лестере, Великобритания, где ей нравилось знакомить общественность с космической наукой. В 2021 году Дейзи защитила докторскую диссертацию по физиологии растений, а также имеет степень магистра наук об окружающей среде. В настоящее время она живет в Ноттингеме, Великобритания.0003
1.8: Субатомные частицы – протоны, нейтроны и электроны
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 25458
Цели обучения
- Знать значение изотопов и атомных масс.

На сегодняшний день открыто около 118 различных элементов; по определению каждый из них химически уникален. Чтобы понять, почему они уникальны, нужно понять строение атома (фундаментальной, отдельной частицы элемента) и характеристики его компонентов. Атомы состоят из электронов, протонов и нейтронов. Хотя это чрезмерное упрощение, игнорирующее другие открытые субатомные частицы, этого достаточно для обсуждения химических принципов. Некоторые свойства этих субатомных частиц приведены в таблице \(\PageIndex{1}\), которая иллюстрирует три важных момента:
- Электроны и протоны имеют электрические заряды, одинаковые по величине, но противоположные по знаку. Относительные заряды -1 и +1 приписаны электрону и протону соответственно.
- Нейтроны имеют примерно ту же массу, что и протоны, но не имеют заряда. Они электрически нейтральны.
- Масса протона или нейтрона примерно в 1836 раз больше массы электрона. Протоны и нейтроны составляют основную массу атомов.

Открытие электрона и протона имело решающее значение для разработки современной модели атома и представляет собой отличный пример применения научного метода. Фактически, выяснение структуры атома — одна из величайших детективных историй в истории науки.
| Частица | Масса (г) | Атомная масса (а.е.м.) 9{-24}\) | 1.008665 | 0 | 0 |
|---|
Почти вся масса атома содержится в маленьком (и поэтому чрезвычайно плотном) ядре , которое несет положительный электрический заряд, и почти весь объем атома состоит из пустого пространства в где находятся электроны (рисунок \(\PageIndex{1}\)). Чрезвычайно малая масса электрона (1/1840 массы ядра водорода) заставляет его вести себя как квантовая частица, а это означает, что его местоположение в любой момент не может быть определено; лучшее, что мы можем сделать, — это описать его поведение в терминах вероятности его проявления в любой точке пространства. Принято (но несколько вводит в заблуждение) описывать объем пространства, в котором электроны атома имеют значительную вероятность быть обнаруженными, как электронное облако . Последний не имеет определенной внешней границы, как и атом. Радиус атома должен быть определен произвольно, например граница, в которой электрон может быть найден с вероятностью 95%. Атомные радиусы обычно составляют 30-300 пм.
Чрезвычайно малая масса электрона (1/1840 массы ядра водорода) заставляет его вести себя как квантовая частица, а это означает, что его местоположение в любой момент не может быть определено; лучшее, что мы можем сделать, — это описать его поведение в терминах вероятности его проявления в любой точке пространства. Принято (но несколько вводит в заблуждение) описывать объем пространства, в котором электроны атома имеют значительную вероятность быть обнаруженными, как электронное облако . Последний не имеет определенной внешней границы, как и атом. Радиус атома должен быть определен произвольно, например граница, в которой электрон может быть найден с вероятностью 95%. Атомные радиусы обычно составляют 30-300 пм.
Количество протонов определяет природу элементов
Количество протонов в ядре атома равно его атомный номер (\(Z\)). Это определяющая черта элемента: его значение определяет идентичность атома. Например, любой атом, содержащий шесть протонов, является элементом углерода и имеет атомный номер 6, независимо от того, сколько в нем нейтронов или электронов. Нейтральный атом должен содержать одинаковое количество положительных и отрицательных зарядов, поэтому количество протонов равно количеству электронов. Следовательно, атомный номер также указывает на количество электронов в атоме. Суммарное количество протонов и нейтронов в атоме называется его массовым числом (\(A\))). Таким образом, число нейтронов равно разнице между массовым числом и атомным номером:
Это определяющая черта элемента: его значение определяет идентичность атома. Например, любой атом, содержащий шесть протонов, является элементом углерода и имеет атомный номер 6, независимо от того, сколько в нем нейтронов или электронов. Нейтральный атом должен содержать одинаковое количество положительных и отрицательных зарядов, поэтому количество протонов равно количеству электронов. Следовательно, атомный номер также указывает на количество электронов в атоме. Суммарное количество протонов и нейтронов в атоме называется его массовым числом (\(A\))). Таким образом, число нейтронов равно разнице между массовым числом и атомным номером:
\[\begin{align*}
\ce{атомный\: число\:(Z)\: &= \:число\: число\: протонов\\
масса\: число\:(A)\: &= \:число\: число\: протонов + число\: число\: нейтронов\\
A-Z\: &= \:число\: число\: нейтронов}
\end{align*}\]
Тождество элемента определяется \(Z\), числом протонов в ядре атома элемента, которое различно для каждого элемента. Известные элементы расположены в порядке возрастания Z в периодической таблице (рисунок \(\PageIndex{2}\)). Обоснование своеобразного формата периодической таблицы объясняется позже. Каждому элементу присваивается уникальный одно-, двух- или трехбуквенный символ. Названия элементов перечислены в периодической таблице вместе с их символами, атомными номерами и атомными массами. Химический состав каждого элемента определяется количеством в нем протонов и электронов.
Известные элементы расположены в порядке возрастания Z в периодической таблице (рисунок \(\PageIndex{2}\)). Обоснование своеобразного формата периодической таблицы объясняется позже. Каждому элементу присваивается уникальный одно-, двух- или трехбуквенный символ. Названия элементов перечислены в периодической таблице вместе с их символами, атомными номерами и атомными массами. Химический состав каждого элемента определяется количеством в нем протонов и электронов.
Символы для нескольких распространенных элементов и их атомов перечислены в таблице \(\PageIndex{2}\). Некоторые символы получены из общего названия элемента; другие аббревиатуры названия на другом языке. Символы состоят из одной или двух букв, например, H для водорода и \(\ce{Cl}\) для хлора. Во избежание путаницы с другими обозначениями только первая буква символа пишется с большой буквы , Например, \(\ce{Co}\) — это символ кобальта, а \(\ce{CO}\) — это обозначение сложного монооксида углерода, который содержит атомы элементов углерода (\( \ce{C}\)) и кислород (\(\ce{O}\)).Все известные элементы и их символы есть в таблице Менделеева.
Во избежание путаницы с другими обозначениями только первая буква символа пишется с большой буквы , Например, \(\ce{Co}\) — это символ кобальта, а \(\ce{CO}\) — это обозначение сложного монооксида углерода, который содержит атомы элементов углерода (\( \ce{C}\)) и кислород (\(\ce{O}\)).Все известные элементы и их символы есть в таблице Менделеева.
Традиционно первооткрыватель (или первооткрыватели) нового элемента дает ему имя. Однако до тех пор, пока название не будет признано Международным союзом теоретической и прикладной химии (IUPAC), рекомендуемое название нового элемента основано на латинском слове (словах) для его атомного номера. Например, элемент 106 назывался уннилгексий (Unh), элемент 107 — уннилсептий (Uns), а элемент 108 — уннилокций (Uno) в течение нескольких лет. Эти элементы теперь названы в честь ученых или мест; например, элемент 106 теперь известен как сиборгий (Sg) в честь Гленна Сиборга, лауреата Нобелевской премии, который принимал активное участие в открытии нескольких тяжелых элементов
Однако до тех пор, пока название не будет признано Международным союзом теоретической и прикладной химии (IUPAC), рекомендуемое название нового элемента основано на латинском слове (словах) для его атомного номера. Например, элемент 106 назывался уннилгексий (Unh), элемент 107 — уннилсептий (Uns), а элемент 108 — уннилокций (Uno) в течение нескольких лет. Эти элементы теперь названы в честь ученых или мест; например, элемент 106 теперь известен как сиборгий (Sg) в честь Гленна Сиборга, лауреата Нобелевской премии, который принимал активное участие в открытии нескольких тяжелых элементов
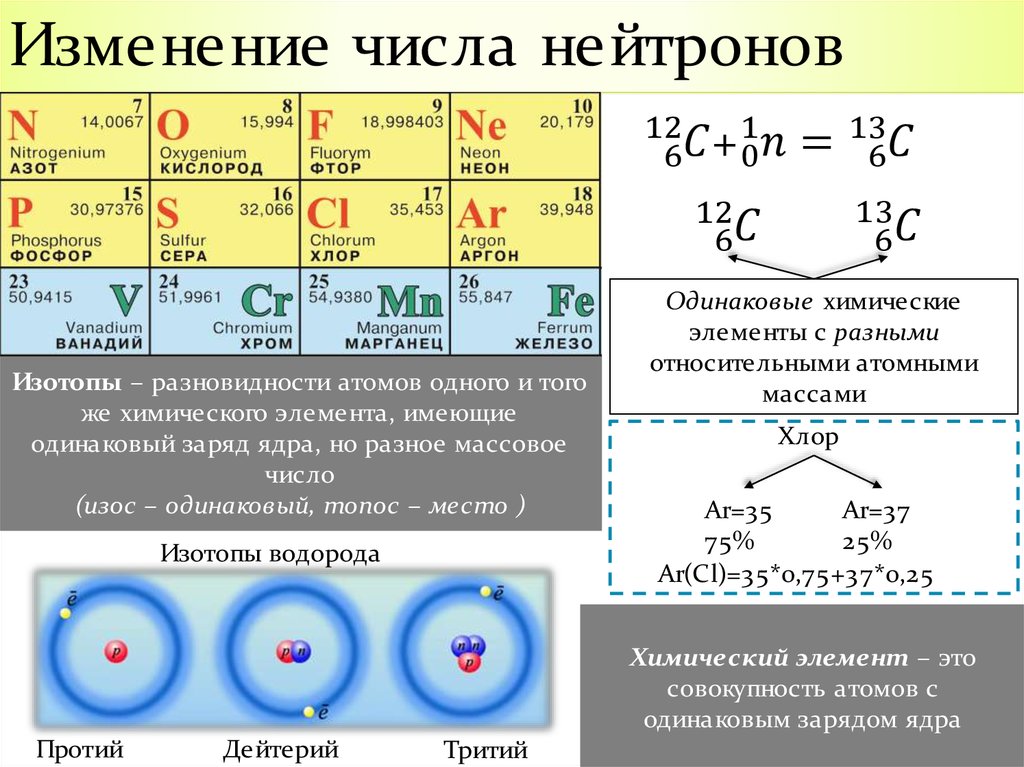
Изотопы: различающиеся числа нейтронов
Напомним, что ядра большинства атомов содержат нейтроны, а также протоны. В отличие от протонов, число нейтронов не является абсолютно фиксированным для большинства элементов. Атомы, имеющие одинаковое количество протонов и, следовательно, одинаковый атомный номер, но разное количество нейтронов, называются изотопами . Все изотопы элемента имеют одинаковое количество протонов и электронов, что означает, что они обладают одинаковым химическим составом. Изотопы элемента отличаются только своей атомной массой, которая определяется массовым числом (\(А\)), суммой чисел протонов и нейтронов. 9{14} С\) ( 14 С), с 8 нейтронами и 6 протонами. Однако ядро 14 C не является стабильным, а подвергается медленному радиоактивному распаду, который является основой метода датирования по углероду-14, используемого в археологии. Многие элементы, кроме углерода, имеют более одного стабильного изотопа; олово, например, имеет 10 изотопов. Информация о встречающихся в природе изотопах элементов с атомными номерами от 1 до 10 приведена в таблице \(\PageIndex{2}\). Обратите внимание, что в дополнение к стандартным названиям и символам изотопы водорода часто упоминаются с использованием общих имен и сопутствующих символов. Водород-2, символизируемый 2 H, также называемый дейтерием и иногда обозначаемый символом D.
Все изотопы элемента имеют одинаковое количество протонов и электронов, что означает, что они обладают одинаковым химическим составом. Изотопы элемента отличаются только своей атомной массой, которая определяется массовым числом (\(А\)), суммой чисел протонов и нейтронов. 9{14} С\) ( 14 С), с 8 нейтронами и 6 протонами. Однако ядро 14 C не является стабильным, а подвергается медленному радиоактивному распаду, который является основой метода датирования по углероду-14, используемого в археологии. Многие элементы, кроме углерода, имеют более одного стабильного изотопа; олово, например, имеет 10 изотопов. Информация о встречающихся в природе изотопах элементов с атомными номерами от 1 до 10 приведена в таблице \(\PageIndex{2}\). Обратите внимание, что в дополнение к стандартным названиям и символам изотопы водорода часто упоминаются с использованием общих имен и сопутствующих символов. Водород-2, символизируемый 2 H, также называемый дейтерием и иногда обозначаемый символом D. Водород-3, обозначаемый символом 3 H, также называемый тритием и иногда обозначаемый символом T.
Водород-3, обозначаемый символом 3 H, также называемый тритием и иногда обозначаемый символом T.
 89. Carbon left superscript 13, left subscript 6 has an atomic number of 6, 6 protons, 7 neutrons, a mass of 13.0033, and a natural abundance percentage of 1.11. Carbon left superscript 14, left subscript 6 has an atomic number of 6, 6 protons, 8 neutrons, and a mass of 14.0032. Its natural abundance percentage is not reported. Nitrogen left superscript 14, left subscript 7 has an atomic number of 7, 7 protons, 7 neutrons, a mass of 14.0031, and a natural abundance percentage of 99.63. Nitrogen left superscript 15, left subscript 7 has an atomic number of 7, 7 protons, 8 neutrons, a mass of 15.0001, and a natural abundance percentage of 0.37. Oxygen left superscript 16, left subscript 8 has an atomic number of 8, 8 protons, 8 neutrons, a mass of 15.9949, and a natural abundance percentage of 99.759. Oxygen left superscript 17, left subscript 8 has an atomic number of 8, 8 protons, 9 neutrons, a mass of 16.9991, and a natural abundance percentage of 0.037. Oxygen left superscript 18, left subscript 8 has an atomic number of 8, 8 protons, 10 neutrons, a mass of 17.
89. Carbon left superscript 13, left subscript 6 has an atomic number of 6, 6 protons, 7 neutrons, a mass of 13.0033, and a natural abundance percentage of 1.11. Carbon left superscript 14, left subscript 6 has an atomic number of 6, 6 protons, 8 neutrons, and a mass of 14.0032. Its natural abundance percentage is not reported. Nitrogen left superscript 14, left subscript 7 has an atomic number of 7, 7 protons, 7 neutrons, a mass of 14.0031, and a natural abundance percentage of 99.63. Nitrogen left superscript 15, left subscript 7 has an atomic number of 7, 7 protons, 8 neutrons, a mass of 15.0001, and a natural abundance percentage of 0.37. Oxygen left superscript 16, left subscript 8 has an atomic number of 8, 8 protons, 8 neutrons, a mass of 15.9949, and a natural abundance percentage of 99.759. Oxygen left superscript 17, left subscript 8 has an atomic number of 8, 8 protons, 9 neutrons, a mass of 16.9991, and a natural abundance percentage of 0.037. Oxygen left superscript 18, left subscript 8 has an atomic number of 8, 8 protons, 10 neutrons, a mass of 17. 9992, and a natural abundance percentage of 0.204. Fluorine left superscript 19, left subscript 9 has an atomic number of 9, 9 protons, 10 neutrons, a mass of 18.9984, and a natural abundance percentage of 100. Neon left superscript 20, left subscript 10 has an atomic number of 10, 10 protons, 10 neutrons, a mass of 19.9924, and a natural abundance percentage of 90.92. Neon left superscript 21, left subscript 10 has an atomic number of 10, 10 protons, 11 neutrons, a mass of 20.994, and a natural abundance percentage of 0.257. Neon left superscript 22, left subscript 10 has an atomic number of 10, 10 protons, 12 neutrons, a mass of 21.9914, and a natural abundance percentage of 8.82.”>
9992, and a natural abundance percentage of 0.204. Fluorine left superscript 19, left subscript 9 has an atomic number of 9, 9 protons, 10 neutrons, a mass of 18.9984, and a natural abundance percentage of 100. Neon left superscript 20, left subscript 10 has an atomic number of 10, 10 protons, 10 neutrons, a mass of 19.9924, and a natural abundance percentage of 90.92. Neon left superscript 21, left subscript 10 has an atomic number of 10, 10 protons, 11 neutrons, a mass of 20.994, and a natural abundance percentage of 0.257. Neon left superscript 22, left subscript 10 has an atomic number of 10, 10 protons, 12 neutrons, a mass of 21.9914, and a natural abundance percentage of 8.82.”> Источники изотопных данных: G. Audi et al., Nuclear Physics A 729 (2003): 337–676; Дж. К. Коц и К. Ф. Перселл, Химия и химическая реактивность, 2-е изд., 1991 г.
Audi et al., Nuclear Physics A 729 (2003): 337–676; Дж. К. Коц и К. Ф. Перселл, Химия и химическая реактивность, 2-е изд., 1991 г.
Пример \(\PageIndex{1}\): Состав атома
Йод является важным микроэлементом в нашем рационе; он необходим для выработки гормона щитовидной железы. Недостаток йода в рационе может привести к развитию зоба, увеличению щитовидной железы. Добавление небольшого количества йода в поваренную соль (йодированную соль) практически устранило эту проблему со здоровьем в Соединенных Штатах, но до 40% населения мира по-прежнему подвержены риску дефицита йода. Атомы йода добавляются в виде анионов, каждый из которых имеет заряд 1- и массовое число 127. Определите количество протонов, нейтронов и электронов в одном из этих анионов йода.
Решение
Атомный номер йода (53) говорит нам о том, что нейтральный атом йода содержит 53 протона в ядре и 53 электрона вне ядра. Поскольку сумма количества протонов и нейтронов равна массовому числу 127, количество нейтронов равно 74 (127 – 53 = 74). Поскольку йод добавляется в виде аниона 1–, число электронов равно 54 [53 – (1–) = 54].
Поскольку йод добавляется в виде аниона 1–, число электронов равно 54 [53 – (1–) = 54].
Упражнение \(\PageIndex{1}\)
Ион платины имеет массовое число 195 и содержит 74 электрона. Сколько протонов и нейтронов он содержит и каков его заряд?
- Ответить
78 протонов; 117 нейтронов; заряд 4+
Пример \(\PageIndex{2}\)
Элемент с тремя стабильными изотопами имеет 82 протона. Отдельные изотопы содержат 124, 125 и 126 нейтронов. Определите элемент и напишите символы для изотопов.
Дано : количество протонов и нейтронов
Запрашиваемый : элемент и символ атома
Стратегия :
- Обратитесь к периодической таблице и используйте количество протонов для идентификации элемента.
- Рассчитайте массовое число каждого изотопа, сложив количество протонов и нейтронов.
- Укажите символ каждого изотопа с массовым числом в верхнем индексе и числом протонов в нижнем индексе, оба написаны слева от символа элемента.
 9{81}Бр}\).
9{81}Бр}\).Ионы: заряженные
Протоны и нейтроны в ядре атома очень сильно удерживаются сильными ядерными силами. Очень трудно либо отделить ядерные частицы, либо добавить дополнительные. Электроны, с другой стороны, удерживаются атомом за счет своего электростатического притяжения к положительно заряженным протонам в ядре. Эта сила сильна, но не настолько сильна, чтобы атом не мог терять или приобретать электроны. Атомы электрически нейтральны, если они содержат одинаковое количество положительно заряженных протонов и отрицательно заряженных электронов. Когда число этих субатомных частиц равно не равен , атом электрически заряжен и называется ионом. Заряд атома определяется как В главе атомы (и молекулы) обычно приобретают заряд, приобретая или теряя электроны. Атом, который получает один или несколько электронов, будет иметь отрицательный заряд и называется анионом. Положительно заряженные атомы под названием {-2}}\]
Заряд вида сильно влияет на его свойства.
 Например, нейтральные атомы натрия нестабильны и бурно реагируют в сочетании с большинством веществ. Однако катионы натрия довольно инертны; на самом деле, мы едим их все время в составе хлорида натрия (поваренной соли). Как мы обсудим позже, катионы и анионы почти всегда встречаются вместе, чтобы обеспечить нейтральность вещества.
Например, нейтральные атомы натрия нестабильны и бурно реагируют в сочетании с большинством веществ. Однако катионы натрия довольно инертны; на самом деле, мы едим их все время в составе хлорида натрия (поваренной соли). Как мы обсудим позже, катионы и анионы почти всегда встречаются вместе, чтобы обеспечить нейтральность вещества.Резюме
Атом состоит из дискретных частиц, которые определяют его химическое и физическое поведение. Каждый атом элемента содержит одинаковое количество протонов, то есть атомный номер ( Z ). Нейтральные атомы имеют одинаковое количество электронов и протонов. Атомы элемента, содержащие разное количество нейтронов, называются изотопами . Каждый изотоп данного элемента имеет одинаковый атомный номер, но другое массовое число ( A ), которое представляет собой сумму чисел протонов и нейтронов. Относительные массы атомов сообщаются с использованием единиц атомной массы ( а.
 е.м. ), которая определяется как одна двенадцатая массы одного атома углерода-12 с 6 протонами, 6 нейтронами и 6 электронами.
е.м. ), которая определяется как одна двенадцатая массы одного атома углерода-12 с 6 протонами, 6 нейтронами и 6 электронами.Авторы и ссылки
Пол Флауэрс (Университет Северной Каролины, Пембрук), Клаус Теопольд (Университет Делавэра) и Ричард Лэнгли (Государственный университет Стивена Ф. Остина) с соавторами. Контент учебника, созданный OpenStax College, находится под лицензией Creative Commons Attribution License 4.0. Загрузите бесплатно по адресу http://cnx.org/contents/85abf193-2bd…[email protected]).
Эд Витц (Университет Куцтауна), Джон В. Мур (UW-Мэдисон), Джастин Шорб (Колледж Хоуп), Ксавьер Прат-Ресина (Университет Миннесоты в Рочестере), Тим Вендорф и Адам Хан.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Показать страницу TOC
- нет на странице
- Теги
- анион
- атомная единица массы (а.
 е.м.)
е.м.) - атомный номер (Z)
- катион
- химический символ
- ион
- изотоп
- Массовый номер (А)
- природное изобилие
- периодическая таблица элементов
Осмий – информация об элементе, свойства и использование
Перейти к основному содержанию
У вас не включен JavaScript. Пожалуйста, включите JavaScript, чтобы получить доступ ко всем функциям сайта.
Перейти к Иридиум >
Группа 8 Температура плавления 3033°С, 5491°F, 3306 К Период 6 Точка кипения 5008°С, 9046°F, 5281 К Блок г Плотность (г см −3 ) 22,5872 Атомный номер 76 Относительная атомная масса 190,23 Состояние при 20°C Твердый Ключевые изотопы 192 Ос Электронная конфигурация [Хе] 4f 1 4 5d 6 6с 2 Номер КАС 7440-04-2 ChemSpider ID 22379 ChemSpider — бесплатная база данных химической структуры. 
Изображение предполагает использование элемента для изготовления высококачественных перьев для ручек.
Блестящий серебристый металл, устойчивый к коррозии. Это самый плотный из всех элементов и в два раза плотнее свинца.
Осмий имеет лишь несколько применений. Он используется для производства очень твердых сплавов для наконечников перьевых ручек, шарниров инструментов, игл и электрических контактов. Он также используется в химической промышленности в качестве катализатора.
Осмий не играет известной биологической роли. Металл не токсичен, но его оксид летуч и очень токсичен, вызывая повреждение легких, кожи и глаз.
Осмий встречается в природе в несвязанном виде, а также в минерале осмиридии (сплав с иридием). Большую часть осмия получают в промышленных масштабах из отходов рафинирования никеля.

История элементов и периодической таблицы
В 1803 году Смитсон Теннант добавил платину в разбавленную царскую водку, представляющую собой смесь азотной и соляной кислот, и заметил, что не весь металл переходит в раствор. Ранее экспериментаторы предполагали, что остаток был графитом, но он подозревал, что это что-то другое, и начал его исследовать. С помощью комбинации обработки кислотой и щелочью он в конечном итоге разделил его на два новых металлических элемента, которые он назвал иридием и осмием, назвав последний из-за сильного запаха, который он испускал. Название происходит от osme греческое слово, обозначающее запах. Хотя он был признан новым металлом, он мало использовался, потому что он был редким и с ним было трудно работать, хотя он был чрезвычайно износостойким и в течение нескольких лет из него делали перья для ручек и иглы для граммофонов.
Атомный радиус, несвязанный (Å) 2.  16
16Ковалентный радиус (Å) 1,36 Сродство к электрону (кДж моль −1 ) 106.1 Электроотрицательность
(шкала Полинга)2.2 Энергии ионизации
(кДж моль −1 )1 ст
814.
 165
165Общие степени окисления 8, 6, 4 , 3, 2, 0, -2 Изотопы Изотоп Атомная масса Естественное изобилие (%) Период полураспада Режим распада 184 Ос 183,952 0,02 – – 186 Ос 185,954 1,59 2 x 10 15 г α 187 Ос 186.  956
9561,96 – – 188 Ос 187,956 13.24 – – 189 Ос 188,958 16.  15
15– – 190 Ос 189,958 26.26 – – 192 Ос 191,961 40,78 – – Относительный риск поставок 7.  6
6Содержание земной коры (ppm) 0,000037 Скорость переработки (%) >30 Взаимозаменяемость Высокая Концентрация продукции (%) 60 Распределение резерва (%) 95 Топ-3 производителя - 1) ЮАР
- 2) Россия
- 3) Зимбабве
Топ-3 держателя резерва - 1) ЮАР
- 2) Россия
- 3) США
Политическая стабильность топ-производителя 44,3 Политическая стабильность держателя верхнего резерва 44,3 Удельная теплоемкость
(Дж кг -1 К -1 )130 Модуль Юнга (ГПа) Неизвестный Модуль сдвига (ГПа) Неизвестный Объемный модуль (ГПа) Неизвестный Давление пара Температура (К) 400 600 800 1000 1200 1400 1600 1800 2000 г. 
2200 2400 Давление (Па) – – – – – – – 1,85
x 10 -103,46
x 10 -82,49
x 10 -68,75
x 10 -5Слушайте подкаст Осмия Стенограмма:
(Промо)
Вы слушаете Химию в ее стихии, представленную вам Chemistry World , журналом Королевского химического общества.

(Конец рекламного ролика)
Крис Смит
Привет, на этой неделе поучительная история о химическом веществе, которое окрестило компанию по производству лампочек и помогает нам находить отпечатки пальцев, но в неправильных руках может вонять до небес. Рассказать историю о самом плотном элементе, который мы знаем, поможет научный телеведущий Квентин Купер.
Квентин Купер
Имея на выбор всю периодическую таблицу, как выбрать конкретный элемент для обсуждения, а не какой-либо другой? У всех есть свои прелести и причуды — ну, кроме, может быть, висмута. У меня никогда не было много времени на висмут, но дело было в том, что я должен был выделить один. А потом до меня дошло. Настоящий миг света. Осмий. Недооцененный, недоиспользованный осмий – если какой-либо элемент нуждается в изменении PR, то это тот самый. Он ломкий, склонный к едкости и, возможно, тупица периодической таблицы. Даже человек, открывший осмий, относился к нему довольно пренебрежительно.
 Возможно, отчасти это связано с тем, что Смитсон Теннант, английский химик, также первым установил, что алмаз является формой углерода. Что также не помогло, так это то, что его открытие осмия примерно в 1803 году было частью работы – он выделил еще один элемент, наряду с ним: тоже металл, он был твердым и желто-белым, а некоторые его соединения имели своего рода радугу. блестели, когда попадали на свет, поэтому он дал ему красивое блестящее название – иридий, как в слове “радужный”. Не повезло с голубовато-серебристым веществом, которое он обнаружил в то же время: оно пахло — по крайней мере, некоторые из его соединений. Теннант описал «резкий и проникающий запах» как один из «самых отличительных признаков» нового элемента . Поэтому он назвал его осмием — osme в переводе с греческого означает «запах». Не очень приятно, но, по крайней мере, уместно: в виде порошка даже при комнатной температуре он выделяет четырехокись осмия, которая настолько едкая, что может повредить глаза, легкие и кожу.
Возможно, отчасти это связано с тем, что Смитсон Теннант, английский химик, также первым установил, что алмаз является формой углерода. Что также не помогло, так это то, что его открытие осмия примерно в 1803 году было частью работы – он выделил еще один элемент, наряду с ним: тоже металл, он был твердым и желто-белым, а некоторые его соединения имели своего рода радугу. блестели, когда попадали на свет, поэтому он дал ему красивое блестящее название – иридий, как в слове “радужный”. Не повезло с голубовато-серебристым веществом, которое он обнаружил в то же время: оно пахло — по крайней мере, некоторые из его соединений. Теннант описал «резкий и проникающий запах» как один из «самых отличительных признаков» нового элемента . Поэтому он назвал его осмием — osme в переводе с греческого означает «запах». Не очень приятно, но, по крайней мере, уместно: в виде порошка даже при комнатной температуре он выделяет четырехокись осмия, которая настолько едкая, что может повредить глаза, легкие и кожу. с особой осторожностью – чтобы помочь обнаружить отпечатки пальцев..
с особой осторожностью – чтобы помочь обнаружить отпечатки пальцев..Итак, осмий – это не просто элемент, это запах, и он намного лучше свинца, золота и платины, поскольку, вероятно, является самым чрезвычайно плотным из всей группы. Я говорю «вероятно», потому что это зависит от того, как вы его измеряете, и, хотя некоторые считают его самым плотным, другие утверждают, что он просто обогащен тем, из чего он был обнаружен, — иридием. На протяжении десятилетий, по мере того как тесты совершенствовались, право носить кепку с плотным стеклом неоднократно переходило между ними двумя… что делает единственным безопасным вариантом объявить их обладателями престижного звания самого плотного элемента в периодической таблице. Учитывая, что у этих двух веществ есть и открытие, и датировка с плотностью, возможно, неудивительно, что они также перетираются в природе и встречаются в виде сплава, остроумно известного как осмиридий — то, что вы найдете в перьях перьевых ручек престижного класса и странных кусочках хирургического оборудования.
 . Сам осмий также играет роль в некоторых катализаторах и используется для окрашивания образцов в микроскопии.
. Сам осмий также играет роль в некоторых катализаторах и используется для окрашивания образцов в микроскопии.Ни один из них не является тем, что вы могли бы назвать массовым применением, что может объяснить, почему, по оценкам, текущее годовое количество осмия, производимого в настоящее время во всем мире, весит меньше, чем большой тигр. Или около 100 килограммов, если вы предпочитаете условные единицы. Однако было время, когда осмий был значительно более востребован. Не из-за его плотности или вонючих соединений, а из-за его высокой температуры плавления. Очень высокая – более 3 тысяч градусов С. После того, как Томас Эдисон изготовил первый коммерческий электрический свет в 1879 г., началась гонка за улучшением его конструкции — для начала была нить накала — кусочек, который светится, излучая свет, но, что особенно важно, не плавится. Должно быть что-то лучше, чем использование Эдисоном бамбука — я имею в виду бамбук, на самом деле. О чем он думал? Было исследовано множество возможностей, но — во многом благодаря работе австрийского химика Карла Ауэра фон Вельсбаха — двумя главными элементами в качестве нитей оказались осмий и вольфрам, у которого еще более высокая температура плавления.
 В наши дни явным фаворитом является вольфрам, но в 1906, когда понадобилось название для новой немецкой компании, производящей эти улучшенные фонари, они просто использовали словесный сплав двух названий. Os от Osmium и ram от Wolfram — немецкое название Tungsten. Отсюда Osram — теперь один из крупнейших производителей осветительных приборов в мире. Отсюда и момент моей яркой лампочки, когда дело дошло до сбора осмия.
В наши дни явным фаворитом является вольфрам, но в 1906, когда понадобилось название для новой немецкой компании, производящей эти улучшенные фонари, они просто использовали словесный сплав двух названий. Os от Osmium и ram от Wolfram — немецкое название Tungsten. Отсюда Osram — теперь один из крупнейших производителей осветительных приборов в мире. Отсюда и момент моей яркой лампочки, когда дело дошло до сбора осмия.Крис Смит
Квентин Купер, который на этой неделе обратил наше внимание на Осмий. Спасибо, Квентин. В следующий раз мы встретимся с металлом, который может решить эту острую проблему.
Андреа Селла
Несколько недель назад со мной в лаборатории произошел глупый случай; Я не буду вдаваться в подробности; Я не очень горжусь тем, что произошло. Но в результате у меня появились поверхностные ожоги на лице и шее. Меня осматривала медсестра-специалист, которая кивнула мне, а затем протянула мне тюбик с мазью. «Это фламмацериум, — сказала она, — наносите его два раза в день».
 «Флама что, — ответил я, — церий», — сказала она. Я был восхищен. «Церий, это не серьезно, это мой любимый элемент».
«Флама что, — ответил я, — церий», — сказала она. Я был восхищен. «Церий, это не серьезно, это мой любимый элемент».Крис Смит
И это Андреа Селла представит химическое вещество, которое буквально проникает прямо под кожу, но в то же время очищает выхлопы автомобилей и полирует зеркала телескопов. Это наука о церии в химии на следующей неделе в его элементе, я надеюсь, что вы можете присоединиться к нам. Я Крис Смит, спасибо, что выслушали, увидимся в следующий раз.
(Promo)
Химия в ее стихии представлена вам Королевским химическим обществом и произведена thenakedscientists.com. Дополнительную информацию и другие эпизоды химии в ее стихии можно найти на нашем веб-сайте chemistryworld.org/elements.
(окончание акции)
Нажмите здесь, чтобы посмотреть видео об осмии
Learn Chemistry: ваш единственный путь к сотням бесплатных учебных ресурсов по химии.

Изображения и видео Visual Elements
© Murray Robertson 1998-2017.
Data
W. M. Haynes, ed., CRC Handbook of Chemistry and Physics , CRC Press/Taylor and Francis, Boca Raton, FL, 95th Edition, Internet Version 2015, по состоянию на декабрь 2014 г.
Таблица 916 & Chemical Constants, Kaye & Laby Online, 16-е издание, 1995 г. Версия 1.0 (2005 г.), по состоянию на декабрь 2014 г.
Дж. С. Курси, Д. Дж. Шваб, Дж. Дж. Цай и Р. А. Драгосет, Атомные веса и изотопные композиции (версия 4.1) , 2015 г., Национальный институт стандартов и технологий, Гейтерсберг, Мэриленд, по состоянию на ноябрь 2016 г.
TL Cottrell, The Strengths of Chemical Bonds , Butterworth, London, 1954.
Использование и свойства
John Emsley, Nature’s Building Blocks: An AZ Guide to the Elements , Oxford University Press, New York, 2nd Издание 2011 г.




 9{81}Бр}\).
9{81}Бр}\). Например, нейтральные атомы натрия нестабильны и бурно реагируют в сочетании с большинством веществ. Однако катионы натрия довольно инертны; на самом деле, мы едим их все время в составе хлорида натрия (поваренной соли). Как мы обсудим позже, катионы и анионы почти всегда встречаются вместе, чтобы обеспечить нейтральность вещества.
Например, нейтральные атомы натрия нестабильны и бурно реагируют в сочетании с большинством веществ. Однако катионы натрия довольно инертны; на самом деле, мы едим их все время в составе хлорида натрия (поваренной соли). Как мы обсудим позже, катионы и анионы почти всегда встречаются вместе, чтобы обеспечить нейтральность вещества. е.м. ), которая определяется как одна двенадцатая массы одного атома углерода-12 с 6 протонами, 6 нейтронами и 6 электронами.
е.м. ), которая определяется как одна двенадцатая массы одного атома углерода-12 с 6 протонами, 6 нейтронами и 6 электронами. е.м.)
е.м.)

 16
16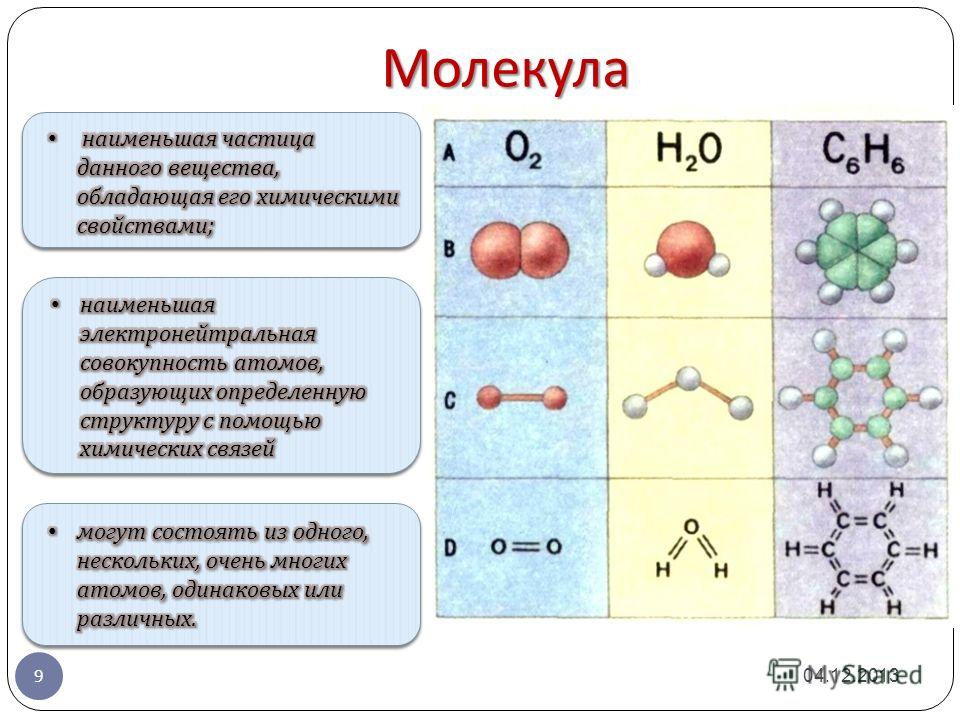 165
165 956
956 15
15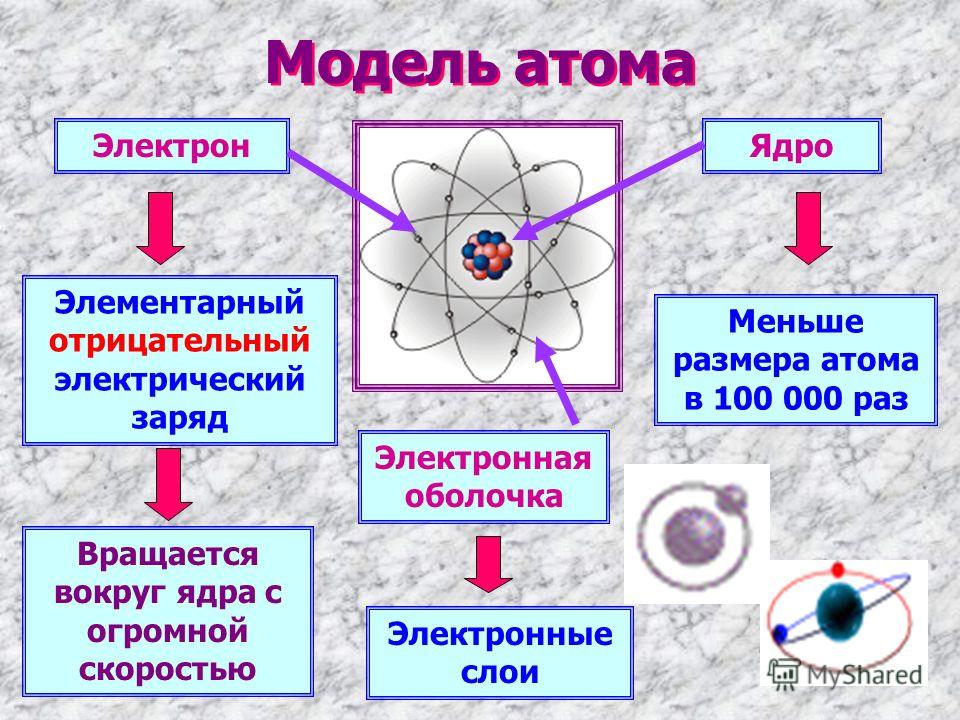 6
6

 Возможно, отчасти это связано с тем, что Смитсон Теннант, английский химик, также первым установил, что алмаз является формой углерода. Что также не помогло, так это то, что его открытие осмия примерно в 1803 году было частью работы – он выделил еще один элемент, наряду с ним: тоже металл, он был твердым и желто-белым, а некоторые его соединения имели своего рода радугу. блестели, когда попадали на свет, поэтому он дал ему красивое блестящее название – иридий, как в слове “радужный”. Не повезло с голубовато-серебристым веществом, которое он обнаружил в то же время: оно пахло — по крайней мере, некоторые из его соединений. Теннант описал «резкий и проникающий запах» как один из «самых отличительных признаков» нового элемента . Поэтому он назвал его осмием — osme в переводе с греческого означает «запах». Не очень приятно, но, по крайней мере, уместно: в виде порошка даже при комнатной температуре он выделяет четырехокись осмия, которая настолько едкая, что может повредить глаза, легкие и кожу.
Возможно, отчасти это связано с тем, что Смитсон Теннант, английский химик, также первым установил, что алмаз является формой углерода. Что также не помогло, так это то, что его открытие осмия примерно в 1803 году было частью работы – он выделил еще один элемент, наряду с ним: тоже металл, он был твердым и желто-белым, а некоторые его соединения имели своего рода радугу. блестели, когда попадали на свет, поэтому он дал ему красивое блестящее название – иридий, как в слове “радужный”. Не повезло с голубовато-серебристым веществом, которое он обнаружил в то же время: оно пахло — по крайней мере, некоторые из его соединений. Теннант описал «резкий и проникающий запах» как один из «самых отличительных признаков» нового элемента . Поэтому он назвал его осмием — osme в переводе с греческого означает «запах». Не очень приятно, но, по крайней мере, уместно: в виде порошка даже при комнатной температуре он выделяет четырехокись осмия, которая настолько едкая, что может повредить глаза, легкие и кожу. с особой осторожностью – чтобы помочь обнаружить отпечатки пальцев..
с особой осторожностью – чтобы помочь обнаружить отпечатки пальцев.. . Сам осмий также играет роль в некоторых катализаторах и используется для окрашивания образцов в микроскопии.
. Сам осмий также играет роль в некоторых катализаторах и используется для окрашивания образцов в микроскопии. В наши дни явным фаворитом является вольфрам, но в 1906, когда понадобилось название для новой немецкой компании, производящей эти улучшенные фонари, они просто использовали словесный сплав двух названий. Os от Osmium и ram от Wolfram — немецкое название Tungsten. Отсюда Osram — теперь один из крупнейших производителей осветительных приборов в мире. Отсюда и момент моей яркой лампочки, когда дело дошло до сбора осмия.
В наши дни явным фаворитом является вольфрам, но в 1906, когда понадобилось название для новой немецкой компании, производящей эти улучшенные фонари, они просто использовали словесный сплав двух названий. Os от Osmium и ram от Wolfram — немецкое название Tungsten. Отсюда Osram — теперь один из крупнейших производителей осветительных приборов в мире. Отсюда и момент моей яркой лампочки, когда дело дошло до сбора осмия. «Флама что, — ответил я, — церий», — сказала она. Я был восхищен. «Церий, это не серьезно, это мой любимый элемент».
«Флама что, — ответил я, — церий», — сказала она. Я был восхищен. «Церий, это не серьезно, это мой любимый элемент».
