Таблица Менделеева online – Переходные металлы
Переходные металлы (переходные элементы) — элементы побочных подгрупп Периодической системы химических элементов Д. И. Менделеева, в атомах которых появляются электроны на d- и f-орбиталях. В общем виде электронное строение переходных элементов можно представить следующим образом: (n – 1)dxnsy. На ns-орбитали содержится один или два электрона, остальные валентные электроны находятся на (n − 1)d-орбитали. Поскольку число валентных электронов заметно меньше числа орбиталей, то простые вещества, образованные переходными элементами, являются металлами.
Таблица переходных металлов
| Группа → Период ↓ |
III | IV | V | VI | VII | VIII | I | II | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 4 | 21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
||||||||||||||||||||
| 5 | 39 Y |
Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
||||||||||||||||||||
| 6 | * | 72 Hf |
73 Ta |
74 W |
75 Re |
Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
||||||||||||||||||||
| 7 | ** | 104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
111 |
112 Cn |
||||||||||||||||||||
| Лантаноиды * | 57 La |
58 Ce |
59 Pr |
60 Nd |
61 Pm |
62 Sm |
63 Eu |
Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
71 Lu |
|||||||||||||||
| Актиноиды ** | 89 Ac |
90 Th |
Pa |
92 U |
93 Np |
94 Pu |
95 Am |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 |
102 No |
103 Lr |
|||||||||||||||
Общая характеристика группы
Все переходные элементы имеют следующие общие свойства:
- Небольшие значения электроотрицательности.

- Переменные степени окисления. Почти для всех d-элементов, в атомах которых на внешнем ns-подуровне находятся 2 валентных электрона, известна степень окисления +2.
- Начиная с d-элементов III группы Периодической системы химических элементов, элементы в низшей степени окисления образуют соединения, которые проявляют основные свойства, в высшей — кислотные, в промежуточной — амфотерные. Например:
| Формула соединения | Характер соединения |
|---|---|
| Mn(OH)2 | Основание средней силы |
| Mn(OH)3 | Слабое основание |
| Mn(OH)4 | Амфотерный гидроксид |
| H2MnO4 | Сильная кислота |
| HMnO4 | Очень сильная кислота |
- Для всех переходных элементов характерно образование комплексных соединений.

ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ | это… Что такое ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ?
ТолкованиеПеревод
- ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ
В соответствии с периодической классификацией элементов существует 44 элемента, образующих подгруппы А. В каждой из этих подгрупп (или семейств) на внешней (валентной) электронной оболочке число электронов равно номеру группы. При переходе от элемента одной подгруппы к элементу соседней подгруппы вдоль периода слева направо число валентных электронов возрастает на 1. Поэтому происходит регулярное изменение свойств от металлических в семействах с низкими номерами до неметаллических в семействах с большими номерами. В то же время имеется более 60 элементов, которые не подчиняются вышеописанным принципам застройки электронной структуры. Все эти элементы являются металлами по своим химическим свойствам (некоторые очень активными), сходными с металлами подгруппы IIA.

Переходные элементы можно разделить на две отдельные группы серий в зависимости от того, расположены последующие электроны на первом (n 1) или втором (n 2) уровне от внешнего слоя. Соответственно элементы относятся в первом случае к коротким (1-му и 2-му) переходным рядам и нормальным сериям (d-сериям) длинных (3-го и 4-го) переходных рядов, а во втором случае к внутренним сериям (f-сериям) длинных переходных рядов (см. табл. 9). Поэтому если определение переходного элемента предусматривает расположение очередного электрона во внутренней оболочке, то металлы подгрупп IB и IIB не являются ни переходными, ни непереходными элементами. Но поскольку они обладают многими свойствами, общими со свойствами переходных элементов, то их в этом разделе относят к переходным элементам.
Поэтому если определение переходного элемента предусматривает расположение очередного электрона во внутренней оболочке, то металлы подгрупп IB и IIB не являются ни переходными, ни непереходными элементами. Но поскольку они обладают многими свойствами, общими со свойствами переходных элементов, то их в этом разделе относят к переходным элементам.
Электронная конфигурация. За некоторым исключением все переходные элементы имеют 2 электрона на внешнем или высшем энергетическом уровне и один или более электронов на низшем (n 1) или (n 2). При переходе от элемента к элементу в пределах одного ряда элементов ядро увеличивается на 1 протон, увеличивая заряд, и соответственно число электронов также увеличивается на 1. Этот дополнительный электрон располагается на (n 1) или (n 2) уровне, т. е. на внутренней оболочке, что приводит к некоторому уменьшению радиуса атома, или сжатию с увеличением атомного номера. На основании этого эффекта можно объяснить многие периодические изменения свойств.
е. на внутренней оболочке, что приводит к некоторому уменьшению радиуса атома, или сжатию с увеличением атомного номера. На основании этого эффекта можно объяснить многие периодические изменения свойств.
Образование связи. Описанное электронное строение позволяет всем этим элементам образовывать химическую связь в соединениях с участием 3 электронов; многие переходные элементы образуют связь с помощью 2 внешних электронов, и все эти элементы могут (хотя и не всегда) предоставлять количество электронов, равное номеру группы, в которой находится данный элемент. Возможность участия в связеобразовании различного числа электронов называется поливалентностью. Например, у марганца, элемента подгруппы VIIВ, степень окисления изменяется от II (MnCl2) до VII (KMnO4). Чем больше электронов участвует в образовании химической связи, тем более ковалентной становится связь.
Окраска ионов. Так как при переходе от одного элемента к другому вдоль ряда переходных элементов в периодической таблице последующие электроны поступают на внутреннюю оболочку и поэтому мало энергетически отличаются друг от друга, то достаточно небольших затрат энергии для перескока электрона в более высокое энергетическое состояние. Атомы и ионы, которые имеют такие подвижные электроны, обычно хорошо окрашены, так как энергии света достаточно для перескока электронов. Поэтому многие ионы переходных элементов окрашены и образуют окрашенные соединения.
Атомы и ионы, которые имеют такие подвижные электроны, обычно хорошо окрашены, так как энергии света достаточно для перескока электронов. Поэтому многие ионы переходных элементов окрашены и образуют окрашенные соединения.
Физические свойства. Малое количество электронов на внешнем уровне объясняет высокую электро- и теплопроводность переходных металлов. Те же электроны могут участвовать и в образовании связей между атомами одного элемента. Природа такого связеобразовании не всегда понятна, но коррелирует с высокими величинами температур плавления и кипения. Строгой тенденции внутри семейства переходных металлов не существует, но атом третьего члена подгруппы В не должен быть больше атома стоящего над ним металла. Например, атомный радиус Zr равен 1,57 , а третий член подгруппы IVB Hf, стоящий под Zr, также имеет r = 1,57 .
Магнитные свойства. Общее правило застройки электронных оболочек атомов состоит в том, что электроны заполняют незанятые орбитали неспаренными электронами, прежде чем начнется заселение орбиталей вторым электроном с образованием пары электронов с одинаковой энергией. Для всех переходных элементов (кроме свободных металлов подгрупп IB и IIB) внутренний уровень (n 1 или n 2) будет иметь такие неспаренные электроны. Благодаря этим электронам атом или ион “втягивается” электромагнитным полем, т.е. обладает парамагнетизмом. Атом или ион, имеющий спаренные электроны, “выталкивается” электромагнитным полем, и такое свойство называется диамагнетизмом. У некоторых переходных металлов, например у Fe из подгруппы VIIIВ, парамагнетизм выражен очень сильно и его принято называть ферромагнетизмом.
Для всех переходных элементов (кроме свободных металлов подгрупп IB и IIB) внутренний уровень (n 1 или n 2) будет иметь такие неспаренные электроны. Благодаря этим электронам атом или ион “втягивается” электромагнитным полем, т.е. обладает парамагнетизмом. Атом или ион, имеющий спаренные электроны, “выталкивается” электромагнитным полем, и такое свойство называется диамагнетизмом. У некоторых переходных металлов, например у Fe из подгруппы VIIIВ, парамагнетизм выражен очень сильно и его принято называть ферромагнетизмом.
Образование комплексных ионов. Малый радиус переходного элемента и наличие вакантных орбиталей для размещения электронов являются благоприятными условиями для взаимодействия этих элементов с большим количеством молекул и ионов, способных быть донорами электронов. Образующиеся по такому механизму соединения или ионы называются координационными или комплексными. Более детальное обсуждение переходных элементов приведено при рассмотрении каждой подгруппы. Порядок их рассмотрения основан на общем правиле классификации элементов, начиная с подгруппы IIIB, а подгруппы IB и IIB рассматриваются в конце как последние члены 1-го, 2-го и 3-го рядов переходных металлов. Последняя, внутренняя серия 4-го ряда переходных металлов актиноиды или трансурановые элементы рассматривается отдельно.
Порядок их рассмотрения основан на общем правиле классификации элементов, начиная с подгруппы IIIB, а подгруппы IB и IIB рассматриваются в конце как последние члены 1-го, 2-го и 3-го рядов переходных металлов. Последняя, внутренняя серия 4-го ряда переходных металлов актиноиды или трансурановые элементы рассматривается отдельно.
Энциклопедия Кольера. — Открытое общество. 2000.
Нужна курсовая?
- ГАЛОГЕНЫ
- РЕДКОЗЕМЕЛЬНЫЕ ЭЛЕМЕНТЫ
Полезное
Переходные металлы – характеристика, свойства и строение
В периодической таблице все элементы подразделяются на 4 категории: основная, переходная, лантаноиды и актиноиды. К основным в группе относятся активные металлы в 2 колонках по крайней левой части таблицы Менделеева и металлы, полуметаллы и неметаллы в 6 столбцах крайней правой. Переходные металлы — это металлические элементы, являющиеся своеобразным мостом между сторонами системы. Все они применяются в качестве катализаторов.
Все они применяются в качестве катализаторов.
Содержание
- Общее понятие
- Место в периодической таблице
- Химические свойства
- Значение переходных элементов
- Характеристики железа
Общее понятие
Переходные металлы образуют соединения, в которых проявляют положительные степени окисления. Наиболее заметно различие свойств в IV-VIII подгруппах, где побочные составляют металлы, а главные — неметаллы. Находящиеся в самой таблице символы обозначаются — d, а буквой f — лантаноиды и актиноиды. Самые выраженные из этой категории: Cr, Mn, Fe, Cu, Zn, и Ag. История открытия указывает на то, что все они в свободном состоянии являются металлами. Внешний номер электронной оболочки совпадает с номером периода.
К самым известным на Земле d-металлам относится железо, следующее сразу после алюминия. Большая часть представлена оксидами или сульфидами. В свободном виде встречается лишь медь. Соединения d-металлов также обнаружены на Луне.
Соединения d-металлов также обнаружены на Луне.
Из всех групп химических элементов переходные достаточно трудно идентифицировать из-за разногласий по поводу того, что именно должно быть в них включено. По одной версии переходными считаются вещества с не полностью заполненной d-электронной подоболочкой.
Место в периодической таблице
Переходные металлы расположены в группах от IB до VIIIB с:
- 21 (скандия) — по (29 медь).
- 39 (иттрия) — по 47 (серебро).
- 57 (лантана) — до 79 (золота).
- 89 (актиния) — до 112 (коперниция).
Последние представлены лантаноидами и актиноидами — f-элементами, входящими в особую группу. Остальные составляют d-элементы.
Химические свойства
В соединениях атомы используются как валентные s- и p, так и d-электроны. Исходя из этого, d-элементы обладают переменной валентностью, что не наблюдается в основных подгруппах. По этой причине они могут образовывать комплексные соединения.
Исходя из этого, d-элементы обладают переменной валентностью, что не наблюдается в основных подгруппах. По этой причине они могут образовывать комплексные соединения.
Все переходные металлы по структуре твердые, имеют высокую температуру плавления и кипения.
При перемещении слева направо в таблице у 5 d-орбиталей обнаруживается большая заполняемость. Из-за слабой связи электронов увеличивается электропроводность и гибкость.
Всем им присуща низкая энергия ионизации, необходимая при удалении электрона от свободного атома. До сих пор ученые спорят относительно классификации элементов на границе между основной группой и переходными металлами, размещенными в правой части таблицы. Ими являются цинк (Zn), кадмий (Cd) и ртуть (Hg). Внешне они напоминают металлы:
- Податливы и пластичны.
- Проводят тепло и электричество.
- Образуют положительные ионы.
Схожесть физических свойств элементов двух этих групп проявляется в том, что лучше всего электричество проводят переходный металл медь и относящийся к основной группе алюминий. Особенность — элементы основной группы легко образуют стабильные соединения с нейтральными молекулами воды или аммиака.
Особенность — элементы основной группы легко образуют стабильные соединения с нейтральными молекулами воды или аммиака.
Значение переходных элементов
В жизнедеятельности человека они выполняют важную функцию. Без них организм не может существовать:
- Железо — главный источник гемоглобина.
- Цинк — вырабатывает инсулин.
- Кобальт — основной компонент витамина В12.
- Медь, марганец и молибден — входят в состав ферментов.
Яркие представители — чугун и сталь, используемые в тяжелой промышленности.
В черной металлургии их получают из железной руды. Вначале выплавляется чугун, а затем из него — сталь. Углерода в чугуне больше 1,7%, а в стали — меньше этого значения.
Благодаря добавкам — хрому, марганцу и никелю — стали обретают другие качества. Так, хром повышает прочность и устойчивость к действию кислот. Наиболее употребительные сплавы на основе меди: бронза, латунь и мельхиор. Особенно широкое применение нашли: сталь, чугун и бронза. Велика значимость железа, неслучайно по его содержанию сплавы подразделяются на черные и цветные.
Особенно широкое применение нашли: сталь, чугун и бронза. Велика значимость железа, неслучайно по его содержанию сплавы подразделяются на черные и цветные.
Характеристики железа
Этот элемент представляет наибольший интерес, поскольку составляет важные соединения, среди которых железная кислота и соли. Чаще всего не используется как чистое вещество, а в виде сплавов с углеродом и другими элементами. Взаимодействует с:
- Неметаллами — при нагревании, преимущественно в виде порошка.
- Кислородом — образование оксидов.
- Водой — при большой температуре. При повышенной влажности вступает в реакцию с водяными парами и кислородом, что служит возникновению ржавчины.
- Кислотами — с выделением водорода.
- Растворами солей — вытесняет менее активные металлы.
Переходные металлы играют огромную роль в жизни людей.
По этой причине их изучение включено в обязательный курс школьной программы. Наиболее подробно о свойствах рассказывается на уроках химии в старших классах при проведении лабораторных работ.
Предыдущая
ХимияГидроксид кремния – формула, свойства и применение соединения
Следующая
ХимияСплавы алюминия – классификация, названия и применение
Переходные металлы | Transition Metal Complexes in Organic Synthesis
Периодическая система всегда под руками
В органической химии элементов немного, и можно не сомневаться, что любой человек, осмелившийся назвать себя химиком, помнит, где находится углерод, кислород, азот и галогены, и уж тем более водород. В химии переходных металлов элементов намного больше, и упомнить их все не всем по силам, и человек, даже отдавший химии всю жизнь, имеет полное право замешкаться, вспоминая, где, например, находится какой-нибудь иридий, и элемент ли это вообще, а может быть цветок какой аленький или синенький.
Но здесь это совершенно необходимо – мы все время будем считать электроны, оценивать положение элементов в группах и рядах, и не попадаться на глупые вопросы, например, про катализ кросс-сочетания фосфиновыми комплексами свинца. Фосфиновые комплексы у свинца вполне могут быть, но металл это непереходный, а следовательно нам в этом курсе малоинтересный. Вторая буква в символе просто предательская – перевернем ее и все встанет на свои места.
Поэтому сразу обзаведемся Периодической таблицей элементов. Для наших целей больше подходит не привычная с детства (раннего или позднего, кому как повезло) уютная и компактная короткопериодная таблица, восходящая еще к Д.И.Менделееву, а так называемая длиннопериодная. Историческая короткопериодная таблица была основана на ранжировании элементов по единственно доступному в глубокой древности параметру, атомным весам. Ни о каких электронах, а тем более атомных орбиталях, валентных оболочках и пр. тогда не было известно совершенно ничего. Короткопериодная форма поэтому мешает в группах элементы различных типов, разделяя их только по неочевидным на близорукий взгляд главным и побочным подгруппам. Но самая неудачная особенность исторической формы – запихивание 15 элементов в одну восьмую группу, что делает непростым понимание того, чем все эти восхитительные элементы различаются, и почему только им, благородным газам и металлам, и тройке более банальных металлов досталась такая свалка. Воздадим поэтому должное восхищение величию исторической Таблицы, и перейдем к более современной форме, которая построена по заполнению валентных уровней электронами, и четко разделяет разные блоки элементов.
Но самая неудачная особенность исторической формы – запихивание 15 элементов в одну восьмую группу, что делает непростым понимание того, чем все эти восхитительные элементы различаются, и почему только им, благородным газам и металлам, и тройке более банальных металлов досталась такая свалка. Воздадим поэтому должное восхищение величию исторической Таблицы, и перейдем к более современной форме, которая построена по заполнению валентных уровней электронами, и четко разделяет разные блоки элементов.
Вот она, в некрасивом, но максимально авторитетном виде, рекомендованным Международным союзом по чистой и прикладной химии (IUPAC), в Номенклатуре неорганических и координационных соединений 2005 года. Многим она как-то интуитивно не нравится, она слишком длинная и плохо вписывается на задние страницы тетрадей и учебников, не умещается целиком в поле зрения, и вообще какая-то странно ступенчатая, на нормальную таблицу никак не похожа. Читать ее приходится, мотая головой слева направо и обратно, почти как болельщику на теннисном матче. Но структура у нее совершенно гениальная – элементы расположены строго по мере заполнения валентных оболочек, поэтому все элементы естественным путем образуют блоки s-, p-, d- и f-элементов (последние приходится вынести наружу, но место их в таблице хорошо понятно. Вместо восьми групп имеем 18, а это очень важное число в счете электронов, соответствующее полностью заполненной валентной spd-оболочке. Да, при этом оказались обижены первые три периода, которым эти 18 электронов могут только присниться, и которые обречены блюсти более скромный 2-х и 8-электронный счет (правило октета Льюиса), но это мелочи.
Но структура у нее совершенно гениальная – элементы расположены строго по мере заполнения валентных оболочек, поэтому все элементы естественным путем образуют блоки s-, p-, d- и f-элементов (последние приходится вынести наружу, но место их в таблице хорошо понятно. Вместо восьми групп имеем 18, а это очень важное число в счете электронов, соответствующее полностью заполненной валентной spd-оболочке. Да, при этом оказались обижены первые три периода, которым эти 18 электронов могут только присниться, и которые обречены блюсти более скромный 2-х и 8-электронный счет (правило октета Льюиса), но это мелочи.
Кто-то может спросить, а какая разница, какой Таблицей пользоваться, все равно все понимают, как они устроены, и что там где. Безусловно это так, но здесь имеются в виду конкретные и простые вещи, в первую очередь система нумерации групп и рядов. Если мы будем, например, упоминать металлы 8-й группы, то это однозначно и только железо-рутений-осмий, а не вообще все 9 или даже 15 элементов, как в исторической таблице. И мы не будем падать в обморок от ссылок на элементы 10-й или 12-й групп. И не будем путать второй ряд переходных металлов с вторым периодом, и не будем возмущенно вопрошать, откуда там взялись переходные металлы, когда каждый знает, что во втором периоде из металлов только литий и бериллий.
И мы не будем падать в обморок от ссылок на элементы 10-й или 12-й групп. И не будем путать второй ряд переходных металлов с вторым периодом, и не будем возмущенно вопрошать, откуда там взялись переходные металлы, когда каждый знает, что во втором периоде из металлов только литий и бериллий.
D-Элементы
В длиннопериодной Таблице элементы расположены строго по мере заполнения валентных уровней, участвующих в образовании химических связей и вообще в любой химической деятельности. Напомню, что заполнение уровней атомов элементов происходит в соответствии с их относительной энергией снизу вверх (это называется принципом Aufbau, в разных формулировках также называется принципом Маделунга-Клечковского), причем эмпирически (спектроскопически) установлен порядок заполнения, удобно представляемый простой диаграммой: выписываем все уровни в порядке появления, и дальше снимаем слоями по диагонали. Получаем сразу и принцип заполнения оболочек, и то, как происходит комплектование периодов в Таблице. Только в первых трех периодах уровни заполняются просто и скучно – по номеру оболочки (точнее, значению главного квантового числа n). В четвертом и пятом d-уровни из предыдущей оболочки выплывают и встают между очередными s и p-уровнями. Это очень важно, так как в значительной степени определяет место интересующих нас элементов, переходных металлов, в Таблице – они нагло влезают между s- и р-элементами, то есть между самыми металлическими металлами (щелочными и щелочноземельными) и неметаллами вместе с примкнувшими к ним металлоидами и горсткой непереходных металлов. Валентные оболочки в этих двух периодах содержат s, p, d уровни, то есть в сумме могут принять 18 электронов. Как увидим скоро, это священное число химии переходных металлов. В шестом периоде происходит следующий сюрприз – влезает “забытый” f-уровень с на две единицы меньшим номером, причем до d-уровня, и его неспешное заполнение дает семейство f-элементов, лантанидов. А уж дальше идут нормальные d-элементы, но сильно отличающиеся от родственников с верхних этажей как раз наличием этого уже заполненного f-уровня.
Только в первых трех периодах уровни заполняются просто и скучно – по номеру оболочки (точнее, значению главного квантового числа n). В четвертом и пятом d-уровни из предыдущей оболочки выплывают и встают между очередными s и p-уровнями. Это очень важно, так как в значительной степени определяет место интересующих нас элементов, переходных металлов, в Таблице – они нагло влезают между s- и р-элементами, то есть между самыми металлическими металлами (щелочными и щелочноземельными) и неметаллами вместе с примкнувшими к ним металлоидами и горсткой непереходных металлов. Валентные оболочки в этих двух периодах содержат s, p, d уровни, то есть в сумме могут принять 18 электронов. Как увидим скоро, это священное число химии переходных металлов. В шестом периоде происходит следующий сюрприз – влезает “забытый” f-уровень с на две единицы меньшим номером, причем до d-уровня, и его неспешное заполнение дает семейство f-элементов, лантанидов. А уж дальше идут нормальные d-элементы, но сильно отличающиеся от родственников с верхних этажей как раз наличием этого уже заполненного f-уровня. Можно было бы ожидать, что в этом ряду произойдет и расширение числа электронов на валентной оболочке на 14 f-электронов, но это не так – заполненный f-уровень становится внутренним, и напрямую в образовании связей не участвует, валентная оболочка по-прежнему остается sdp-типа и вмещает 18 электронов, а на особые свойства этих элементов довесок в виде полного f-уровня влияет косвенно, в основном через эффект сильно потяжелевшего и несущего очень большой дополнительный положительный заряд ядра. Про следующий период говорить ничего не будем, там все радиоактивное и малостабильное, кроме самого начала очередной порции f-элементов, но мы договорились, что f-элементами заниматься не будем вообще. Пока не сбылось древнее пророчество о наличии “островка стабильности” среди трансурановых элементов, пополнения семейства переходных металлов чем-то осязаемым ждать не приходится. В 7 периоде ничего не появилось, хотя он полностью заполнен и даже названия все даны. Подождем восьмого.
Можно было бы ожидать, что в этом ряду произойдет и расширение числа электронов на валентной оболочке на 14 f-электронов, но это не так – заполненный f-уровень становится внутренним, и напрямую в образовании связей не участвует, валентная оболочка по-прежнему остается sdp-типа и вмещает 18 электронов, а на особые свойства этих элементов довесок в виде полного f-уровня влияет косвенно, в основном через эффект сильно потяжелевшего и несущего очень большой дополнительный положительный заряд ядра. Про следующий период говорить ничего не будем, там все радиоактивное и малостабильное, кроме самого начала очередной порции f-элементов, но мы договорились, что f-элементами заниматься не будем вообще. Пока не сбылось древнее пророчество о наличии “островка стабильности” среди трансурановых элементов, пополнения семейства переходных металлов чем-то осязаемым ждать не приходится. В 7 периоде ничего не появилось, хотя он полностью заполнен и даже названия все даны. Подождем восьмого.
Пометим в Периодической таблице тип заполнямых уровней. Слева две группы (1 и 2-я) s-элементов, щелочных и щелочноземельных металлов. Справа 6 групп (от 13-й по 18-ю) p-элементов, там все, что нужно для нормальной органической химии. В середину попадают d-элементы, мы выделили их зелененьким, не знаю, почему-то мне кажется, что переходным металлам идет этот цвет. В этом месте насторожимся и спросим себя (если больше некого), а d-элементы и переходные металлы, это одно и то же? Почти, но не совсем. Чтобы понять, в чем фокус, придется повнимательнее посмотреть на заполнение уровней. Про f-элементы тоже уже все ясно, оставим их в покое. Там есть одна проблема: какой из элементов, занимающих одну клетку под иттрием, является переходным металлом и аналогом иттрия и скандия – первый или последний, лантан или лютеций. У обоих одинаковая валентная оболочка 6s25d1, но у лантана вообще нет f-электронов (но уровень-то пустой есть!), а у лютеция f-оболочка полностью заполнена точно так же как у всех переходных металлов третьего ряда.
Слева две группы (1 и 2-я) s-элементов, щелочных и щелочноземельных металлов. Справа 6 групп (от 13-й по 18-ю) p-элементов, там все, что нужно для нормальной органической химии. В середину попадают d-элементы, мы выделили их зелененьким, не знаю, почему-то мне кажется, что переходным металлам идет этот цвет. В этом месте насторожимся и спросим себя (если больше некого), а d-элементы и переходные металлы, это одно и то же? Почти, но не совсем. Чтобы понять, в чем фокус, придется повнимательнее посмотреть на заполнение уровней. Про f-элементы тоже уже все ясно, оставим их в покое. Там есть одна проблема: какой из элементов, занимающих одну клетку под иттрием, является переходным металлом и аналогом иттрия и скандия – первый или последний, лантан или лютеций. У обоих одинаковая валентная оболочка 6s25d1, но у лантана вообще нет f-электронов (но уровень-то пустой есть!), а у лютеция f-оболочка полностью заполнена точно так же как у всех переходных металлов третьего ряда. Простого ответа на этот очевидный вопрос, увы, нет.
Простого ответа на этот очевидный вопрос, увы, нет.
Электроны на d-уровне
Посмотрим теперь на d-элементы повнимательнее. Есть три полных ряда таких элементов. В каждом последовательно заполняется соответствующий d-уровень. Всего d-орбиталей пять, а d-электронов, соответственно, десять. Поэтому и в каждом ряду есть десять элементов, располагающихся в группах от 3 до 12. Номера групп с 3 по 7 соответствуют исторической Таблице Менделеева, только там используется понятие “побочная подгруппа”, а в длиннопериодной Таблице все группы равноправны (хотя термин main group elements, элементы главных (под)групп, очень широко распространен для обозначения s- и p-элементов и не собирается сдавать позиции). При заполнении оболочек у атома каждого элемента, к сожалению, наблюдаются достаточно серьезные отклонения от простого порядка, когда каждый следующий электрон просто занимал бы следующее свободное место. Электроны вообще очень капризные ребята, их квантовые привычки непросто понять и запомнить. В первом ряду все еще достаточно просто, достаточно усвоить, что при возможности полностью заполнить (в каждой ячейке по два спаренных) или полузаполнить (в каждой ячейке по одному неспаренному) d-уровень, все остальное уходит на второй план, и выбивающуюся из ряда конфигурацию атомов хрома или меди, заимствующих электрон с уже заполненного s-уровня, запомнить несложно. Но во втором или третьем ряду даже эти простые идеи как-то перестают работать однозначно.
В первом ряду все еще достаточно просто, достаточно усвоить, что при возможности полностью заполнить (в каждой ячейке по два спаренных) или полузаполнить (в каждой ячейке по одному неспаренному) d-уровень, все остальное уходит на второй план, и выбивающуюся из ряда конфигурацию атомов хрома или меди, заимствующих электрон с уже заполненного s-уровня, запомнить несложно. Но во втором или третьем ряду даже эти простые идеи как-то перестают работать однозначно.
К счастью, в реальной химии редко имеют дело с одиночными атомами, а когда образуется коодинационное соединение, комплекс, картина просто радикально упрощается. Считается, что так как в образовании связей с лигандами в первую очередь участвуют именно d-орбитали, то в комплексах они стабилизируются и опускаются ниже s-орбиталей.
А если это объяснение кажется несколько натянутым и неубедительным, то можно просто подумать о том, что в комплексах металлов все равно из валентных орбиталей металла и орбиталей лигандов образуются новые орбитали комплекса, металл все равно отдает на это все, что у него есть, и электроны придется переразмещать заново, снизу вверх, уже на орбиталях комплекса, далеко не все из которых сохранят чистый d-характер как в исходном атоме металла. Поэтому то, что называется d-электронной конфигурацией атома металла в комплексе, на самом деле совершенная формальность, а раз так, то нет смысла это усложнять и лучше воспользоваться самым простым вариантом из возможных – берем все, что есть, и для удобства считаем размещенным на d-орбиталях металла.
Поэтому то, что называется d-электронной конфигурацией атома металла в комплексе, на самом деле совершенная формальность, а раз так, то нет смысла это усложнять и лучше воспользоваться самым простым вариантом из возможных – берем все, что есть, и для удобства считаем размещенным на d-орбиталях металла.
Иными словами, для целей координационной химии электроны на атомах металлов в степени окисления 0 (что это означает, скоро обсудим, а пока примем просто за точку отсчета) размещаются на d-орбиталях, пока уровень не будет заполнен полностью. Это невероятно удобно, потому что число d-электронов становится равным номеру группы в длиннопериодной Таблице. Сколько валентных электронов, скажем, у ниобия? – ниобий в 5 группе, значит пять. А у иридия? – в 9-й группе, значит девять.
Так и будет до 10 группы (никель-палладий-платина), когда d-уровень полностью заполнится, и настанет черед s-уровня, того самого, который в изолированном атоме был ниже d-уровня. Теперь он выше и берет первый следующий электрон в 11 группе (медь-серебро-золото), образуя конфигурацию с полностью заполненным d-уровнем, который поэтому сразу становится внутренним, и полузаполненным s-уровнем. О, так значит металлы этой группы не переходные металлы, а s-элементы, и права была историческая таблица Менделеева, когда помещала их в одну группу с щелочными металлами? Права, но не совсем, и в следующем слайде мы увидим, что претензии металлов группы меди на то, чтобы на полных основаниях примыкать к семье переходных металлов, очень основательны. А вот в 12 группе положение, на первый взгляд, похожее, но на самом деле радикально другое – там второй электрон попадает на s-уровень, а d-уровень окончательно становится внутренним.
О, так значит металлы этой группы не переходные металлы, а s-элементы, и права была историческая таблица Менделеева, когда помещала их в одну группу с щелочными металлами? Права, но не совсем, и в следующем слайде мы увидим, что претензии металлов группы меди на то, чтобы на полных основаниях примыкать к семье переходных металлов, очень основательны. А вот в 12 группе положение, на первый взгляд, похожее, но на самом деле радикально другое – там второй электрон попадает на s-уровень, а d-уровень окончательно становится внутренним.
Валентные состояния d-элементов. Переходные металлы.
Легко определить и число электронов на атомах металлов в разных степенях окисления. Для металлов характерны положительные степени окисления (есть и отрицательные, но об этом после). Так как положительная степень окисления – это просто недостаток электронов до числа, положенного каждому элементу, берем нульвалентный элемент и вычитаем. Вот что получается для первого ряда (для остальных будет то же самое). Очевидно, что отнять у атома больше, чем у него есть, невозможно. Поэтому максимальная положительная степень окисления не может быть больше номера группы, но не больше восьми. В этом одна из причин деления переходных металлов на ранние и поздние. Ранние – это те, которых можно достаточно легко ободрать до нитки (до d0), а поздние – те, которые этому успешно сопротивляются. Железо – поздний переходный металл, хотя у него есть степень окисления +8, но достичь ее очень трудно и она очень неустойчива. Во втором и третьем ряду металлы легче расстаются с электронами, и степени окисления +8 для рутения и особенно осмия намного проще достигаются (недавняя история с радиоактивным загрязнением изотопом рутения этим и объясняется), но все равно эти элементы классифицируются как поздние переходные металлы. Вообще, группы 7 и 8 иногда обзывают как ни то, ни се (middle transition metals), но это скверная привычка. Чуть позже уточним эту странную классификацию (ранние-поздние), так как она играет значительную роль в химии переходных металлов.
Очевидно, что отнять у атома больше, чем у него есть, невозможно. Поэтому максимальная положительная степень окисления не может быть больше номера группы, но не больше восьми. В этом одна из причин деления переходных металлов на ранние и поздние. Ранние – это те, которых можно достаточно легко ободрать до нитки (до d0), а поздние – те, которые этому успешно сопротивляются. Железо – поздний переходный металл, хотя у него есть степень окисления +8, но достичь ее очень трудно и она очень неустойчива. Во втором и третьем ряду металлы легче расстаются с электронами, и степени окисления +8 для рутения и особенно осмия намного проще достигаются (недавняя история с радиоактивным загрязнением изотопом рутения этим и объясняется), но все равно эти элементы классифицируются как поздние переходные металлы. Вообще, группы 7 и 8 иногда обзывают как ни то, ни се (middle transition metals), но это скверная привычка. Чуть позже уточним эту странную классификацию (ранние-поздние), так как она играет значительную роль в химии переходных металлов.
Так что же такое “переходный металл” и одно ли это и то же, что d-элемент. Не совсем. D-элементы – это более формальное понятие, так как число каждого из типов элементов в периоде соответствует предельной емкости оболочки: s-элеметов два, p-элементов шесть, d-элементов десять, ну и все – отсчитываем от скандия десять, приезжаем в цинк, вопрос закрыт. А вот термин “переходный металл” имеет более существенное наполнение, хотя оно и менялось с течением времени. Более-менее устоявшийся подход состоит в том, что элемент имеет право так называться, если у него есть валентные состояния, в которых d-оболочка неполна (имеет меньше 10 электронов), в этом случае d-электроны точно участвуют в образовании связей. Если d-оболочка либо всегда пустая, либо всегда полная, участие d-электронов в образовании связей не очевидно и долго являлось предметом споров. Это старая проблема, связанная с так называемыми гипервалентными состояниями p-элементов, которым прописан валентный октет, но которые, начиная с 3 периода, как это следует из общепринятых структурных формул, умеют образовывать больше ковалентных связей, чем этот октет позволяет. Когда структурная химия была еще очень молода, и еще не совсем освоила электронную теорию химической связи, такие состояния (например, сера и другие халькогены в шестивалентном состоянии, или фосфор и его аналоги в пятивалентном состоянии) часто приписывались участию вакантных d-орбиталей, которые таким образом неявно становились валентными. В современной химии так делать не принято, считается анахронизмом, признаком приверженности преданиям далекой старины, а правило октета Льюиса считается в химии непереходных элементов незыблемым, а поэтому такие элементы не имеют право называться d-элементами.
Когда структурная химия была еще очень молода, и еще не совсем освоила электронную теорию химической связи, такие состояния (например, сера и другие халькогены в шестивалентном состоянии, или фосфор и его аналоги в пятивалентном состоянии) часто приписывались участию вакантных d-орбиталей, которые таким образом неявно становились валентными. В современной химии так делать не принято, считается анахронизмом, признаком приверженности преданиям далекой старины, а правило октета Льюиса считается в химии непереходных элементов незыблемым, а поэтому такие элементы не имеют право называться d-элементами.
Следовательно, элементы 12 группы (цинк-кадмий-ртуть) не являются переходными металлами, d-оболочка у них всегда заполнена и спрятана очень глубоко – в комплексах этих металлов граничные орбитали всегда сидят только на лигандах, почти никогда не бывает смещения электронной плотности металл-лиганд и других атрибутов электронной структуры комплексов настоящих переходных металлов. Эти металлы очень похожи на обычные непереходные p-элементы, следующие прямо за ними: цинк-галлий, кадмий-индий и особенно ртуть-таллий-свинец.
Или ничего, или всё: ранние и поздние переходные металлы
Деление переходных металлов на ранние и поздние очень популярно и часто используется, но точного определения не имеет. Это деление связано с одной очень понятной тенденцией в заполнении валентных оболочек и устойчивости валентных состояний разных элементов. Аналогия довольно прозрачная: где в таблице находятся самые металлические (наиболее электроположительные или наименее электроотрицательные) металлы (щелочные и щелочноземельные)? Слева, в начале периодов. А где находятся самые неметаллические (самые электроотрицательные) неметаллы (галогены и кислород)? Справа, в конце периодов. У первых очень мало электронов, проще их отдать, образуя катионы с зарядом, соответствующим номеру группы. У вторых, наоборот, почти полный комплект, и хочется получить недостающее.
Очень похожая картина наблюдается и в рядах переходных металлов. Те, что ближе к началу, предпочитают отдавать электроны. Их любимые степени окисления соответствуют конфигурациям d0 и d2, то есть высокие степени окисления от +3 и выше, соответствующие номеру группы, что роднит их с непереходными металлами. В реакциях они часто проявляют льюисову кислотность и электрофильность, в состоянии d0 имеют много общего с непереходными металлами, в частности высокую степень ионности связей с лигандами. Что все это значит, мы подробно разберем дальше, пока просто отметим эти особенности. К ранним переходным металлам почти всегда относят группы с 3-ей по 6-ю, и довольно часто присоединяют и седьмую.
В реакциях они часто проявляют льюисову кислотность и электрофильность, в состоянии d0 имеют много общего с непереходными металлами, в частности высокую степень ионности связей с лигандами. Что все это значит, мы подробно разберем дальше, пока просто отметим эти особенности. К ранним переходным металлам почти всегда относят группы с 3-ей по 6-ю, и довольно часто присоединяют и седьмую.
С другой стороны, металлы в конце уже имеют много d-электронов, настолько много, что отдать их все всё равно невозможно. Тогда проще или сохранить имеющееся, или даже приобрести недостающие до полного комплекта. Эти металлы не любят высокие степени окисления, которые редко превышают +4, а наиболее распространенными являются +1 и +2. Самые популярные конфигурации d8 и d10. Им свойственны так называемые низковалентные состояния (степени окисления 0 и +1), и даже небольшие отрицательные степени окисления -1 и -2, а в реакциях они часто проявляют нуклеофильность.
Металлы 11-й группы (медь-серебро-золото) – особенные. Так как d-оболочка у них заполнена, а новый электрон поступил на s-уровень, то им естественно его легко отдать. В этом они вроде бы похожи на ранние переходные металлы, а точнее даже на непереходные щелочные металлы, не зря же в исторической Таблице они делили одну первую группу. Но, потеряв этот электрон в валентных состояниях Cu(+1), Ag(+1), Au(+1), они приобретают конфигурацию d10, типичную для поздних переходных металлов, например, для валентных состояний Ni(0), Pd(0), Pt(0), Co(-1), играющих без преувеличения колоссальную роль в той науке, которую мы взялись изучать. Еще у элементов группы меди есть состояния M(+3) (особенно характерно для золота, но и для меди, и, в наименьшей степени, для серебра, эта степень окисления не чужда и играет заметную роль в реакциях), и это d8, также типичная конфигурация для поздних переходных металлов. Поэтому металлы 11 группы имеют право примыкать к поздним переходным металлам, и мы увидим дальше, что медь не заставляет за себя краснеть даже самых благородных представителей этого семейства – это один из самых универсальных металлов, успешно обслуживающий десятки самых разнообразных процессов.
Так как d-оболочка у них заполнена, а новый электрон поступил на s-уровень, то им естественно его легко отдать. В этом они вроде бы похожи на ранние переходные металлы, а точнее даже на непереходные щелочные металлы, не зря же в исторической Таблице они делили одну первую группу. Но, потеряв этот электрон в валентных состояниях Cu(+1), Ag(+1), Au(+1), они приобретают конфигурацию d10, типичную для поздних переходных металлов, например, для валентных состояний Ni(0), Pd(0), Pt(0), Co(-1), играющих без преувеличения колоссальную роль в той науке, которую мы взялись изучать. Еще у элементов группы меди есть состояния M(+3) (особенно характерно для золота, но и для меди, и, в наименьшей степени, для серебра, эта степень окисления не чужда и играет заметную роль в реакциях), и это d8, также типичная конфигурация для поздних переходных металлов. Поэтому металлы 11 группы имеют право примыкать к поздним переходным металлам, и мы увидим дальше, что медь не заставляет за себя краснеть даже самых благородных представителей этого семейства – это один из самых универсальных металлов, успешно обслуживающий десятки самых разнообразных процессов. У остальных металлов группы химия тоже богатая и очень полезная, но более далекая от типичной для семейства. Наиболее сильное отличие металлов группы меди от металлов 8-10 групп состоит в отсутствии так называемых низковалентных состояний (M(0), M(-1), M(-2)), всегда получаемых восстановлением более устойчивых валентных состояний. Cu(+1) имеет множество признаков сходства с низковалентными состояниями металлов 8-10 групп, но и очень важное отличие, – это фактически и есть основное валентное состояние меди в координационных соединениях, особенно металлоорганических. Это очень существенное отличие, и мы к нему еще вернемся.
У остальных металлов группы химия тоже богатая и очень полезная, но более далекая от типичной для семейства. Наиболее сильное отличие металлов группы меди от металлов 8-10 групп состоит в отсутствии так называемых низковалентных состояний (M(0), M(-1), M(-2)), всегда получаемых восстановлением более устойчивых валентных состояний. Cu(+1) имеет множество признаков сходства с низковалентными состояниями металлов 8-10 групп, но и очень важное отличие, – это фактически и есть основное валентное состояние меди в координационных соединениях, особенно металлоорганических. Это очень существенное отличие, и мы к нему еще вернемся.
В заключение подчеркнем, что деление переходных металлов на ранние и поздние – просто удобное упрощение, позволяющее грубо классифицировать элементы и в самых общих чертах понимать, какой химии мы ожидаем от представителей групп. Сказать точно, где кончаются первые и начинаются вторые, и наоборот, точно невозможно и не имеет никакого смысла. Собственно как и в химии непереходных элементов, где совершенно нет четкого представления о том, где кончаются неметаллы и начинаются металлы, из-за чего в той химии даже появляется пограничная группа металлоидов, столь же нечеткая. Тем более не имеет смысла выделение в особую группу каких-то средних переходных металлов, хотя этот термин встретить можно, но крайне трудно понять, что же он может означать, и зачем его вводить. Один средневековый христианский мыслитель, брат Вильям Оккамский, советовал в любой мыслительной деятельности не умножать сущностей сверх необходимого, то есть не вводить избыточных и нечетких понятий там, где уже существуют более осмысленные и определенные понятия. Вот и мы не будем, и обойдемся ранними и поздними переходными металлами. К тому же не стоит забывать, что в действительности каждый – каждый! – металл уникален, ни один не повторяет свойства другого хотя бы на 10%, и каждый имеет свою уникальную роль, свои реакции, свое применение, ни один нельзя заменить на другой, а все вместе они создают фантастическое разнообразие молекул и взаимодействий.
Тем более не имеет смысла выделение в особую группу каких-то средних переходных металлов, хотя этот термин встретить можно, но крайне трудно понять, что же он может означать, и зачем его вводить. Один средневековый христианский мыслитель, брат Вильям Оккамский, советовал в любой мыслительной деятельности не умножать сущностей сверх необходимого, то есть не вводить избыточных и нечетких понятий там, где уже существуют более осмысленные и определенные понятия. Вот и мы не будем, и обойдемся ранними и поздними переходными металлами. К тому же не стоит забывать, что в действительности каждый – каждый! – металл уникален, ни один не повторяет свойства другого хотя бы на 10%, и каждый имеет свою уникальную роль, свои реакции, свое применение, ни один нельзя заменить на другой, а все вместе они создают фантастическое разнообразие молекул и взаимодействий.
Что такое переходные металлы в химии
Главная » Разное » Что такое переходные металлы в химии
Таблица Менделеева online – Переходные металлы
Переходные металлы (переходные элементы) — элементы побочных подгрупп Периодической системы химических элементов Д. И. Менделеева, в атомах которых появляются электроны на d- и f-орбиталях. В общем виде электронное строение переходных элементов можно представить следующим образом: (n – 1)dxnsy. На ns-орбитали содержится один или два электрона, остальные валентные электроны находятся на (n − 1)d-орбитали. Поскольку число валентных электронов заметно меньше числа орбиталей, то простые вещества, образованные переходными элементами, являются металлами.
И. Менделеева, в атомах которых появляются электроны на d- и f-орбиталях. В общем виде электронное строение переходных элементов можно представить следующим образом: (n – 1)dxnsy. На ns-орбитали содержится один или два электрона, остальные валентные электроны находятся на (n − 1)d-орбитали. Поскольку число валентных электронов заметно меньше числа орбиталей, то простые вещества, образованные переходными элементами, являются металлами.
Таблица переходных металлов
Общая характеристика группы
Все переходные элементы имеют следующие общие свойства:
- Небольшие значения электроотрицательности.
- Переменные степени окисления. Почти для всех d-элементов, в атомах которых на внешнем ns-подуровне находятся 2 валентных электрона, известна степень окисления +2.
- Начиная с d-элементов III группы Периодической системы химических элементов, элементы в низшей степени окисления образуют соединения, которые проявляют основные свойства, в высшей — кислотные, в промежуточной — амфотерные.
 Например:
Например:
Введение в переходные металлы II
На этой странице объясняется, что такое переходный металл с точки зрения его электронной структуры, а затем рассматриваются общие особенности химии переходных металлов. К ним относятся переменная степень окисления (степень окисления), образование комплексных ионов, окрашенные ионы и каталитическая активность.
Что такое переходный металл?
Термины переходный металл (или элемент) и элемент d-блока иногда используются, как если бы они означают одно и то же.Они не … есть тонкая разница между этими двумя терминами. Сначала мы рассмотрим элементы блока d:
Вы помните, что когда вы строите Периодическую таблицу и выясняете, куда поместить электроны, используя принцип Ауфбау, после аргона происходит что-то странное. В аргоне уровни 3s и 3p заполнены, но вместо того, чтобы заполнять следующие уровни 3d, вместо этого заполняется уровень 4s, чтобы дать калий, а затем кальций. Только после этого заполняются 3d уровни. Элементы Периодической таблицы, соответствующие заполнению d уровней, называются d блочными элементами.Первый ряд из них показан в сокращенной форме Периодической таблицы ниже.
Элементы Периодической таблицы, соответствующие заполнению d уровней, называются d блочными элементами.Первый ряд из них показан в сокращенной форме Периодической таблицы ниже.
Электронная структура показанных элементов блока d:
| SC | [Ар] 3d 1 4s 2 |
| Ti | [Ар] 3d 2 4s 2 |
| В | [Ар] 3d 3 4s 2 |
| Cr | [Ар] 3d 5 4s 1 |
| Мн | [Ar] 3d 5 4s 2 |
| Fe | [Ар] 3d 6 4s 2 |
| Co | [Ар] 3d 7 4s 2 |
| Ni | [Ар] 3d 8 4s 2 |
| Cu | [Ар] 3d 10 4s 1 |
| Zn | [Ар] 3d 10 4s 2 |
Вы заметите, что узор заливки не совсем аккуратный! Он разрушен как по хрому, так и по меди. Переходные металлы
Переходные металлы
Не все элементы d-блока считаются переходными металлами!
Переходный металл – это металл, который образует один или несколько стабильных ионов, которые имеют не полностью заполненных d-орбиталей. На основании этого определения скандий и цинк не считаются переходными металлами, даже если они входят в d-блок.
- Скандий имеет электронную структуру [Ar] 3d 1 4s 2 . Когда он образует ионы, он всегда теряет 3 внешних электрона и в конечном итоге имеет структуру аргона.Ион Sc 3+ не имеет d-электронов и поэтому не соответствует определению.
- Цинк имеет электронную структуру [Ar] 3d 10 4s 2 . Когда он образует ионы, он всегда теряет два 4s-электрона, чтобы получить ион 2+ с электронной структурой [Ar] 3d 10 . Ион цинка имеет полных уровней d и также не соответствует определению.
В отличие от меди, [Ar] 3d 10 4s 1 , образует два иона. В ионе Cu + электронная структура [Ar] 3d 10 . Однако более распространенный ион Cu 2 + имеет структуру [Ar] 3d 9 . Медь определенно является переходным металлом, потому что ион Cu 2 + имеет неполный d-уровень.
В ионе Cu + электронная структура [Ar] 3d 10 . Однако более распространенный ион Cu 2 + имеет структуру [Ar] 3d 9 . Медь определенно является переходным металлом, потому что ион Cu 2 + имеет неполный d-уровень.
Ионы переходных металлов
Здесь вы столкнулись с одним из самых раздражающих фактов в химии такого уровня! Когда вы разрабатываете электронные структуры первой серии переходов (от скандия к цинку), используя принцип Ауфбау, вы делаете это на основании того, что 3d-орбитали имеют более высокие энергии, чем 4s-орбитали.
Это означает, что вы работаете в предположении, что 3d-электроны добавляются после 4s. Однако во всей химии переходных элементов 4s-орбиталь ведет себя как внешняя орбиталь с самой высокой энергией. Когда эти металлы образуют ионы, первыми всегда теряются 4s-электроны.
4s-электроны теряются первыми при образовании ионов d-блока
Для записи электронной структуры Co
2 + :| Co | [Ар] 3d 7 4s 2 | |
| Co 2 + | [Ар] 3d 7 |
Ион 2+ образуется в результате потери двух 4s-электронов.
Чтобы написать электронную структуру для V
3 + :| В | [Ар] 3d 3 4s 2 | |
| В 3 + | [Ар] 3d 2 |
Сначала теряются 4s-электроны, а затем один из 3d-электронов.
Переменная степень окисления (число)
Одной из ключевых особенностей химии переходных металлов является широкий диапазон степеней окисления (степеней окисления), которые могут проявляться металлами.Однако было бы неправильно создавать впечатление, что только переходные металлы могут иметь переменную степень окисления. Например, такие элементы, как сера, азот или хлор, имеют очень широкий диапазон степеней окисления в своих соединениях – и это, очевидно, не переходные металлы. Однако эта изменчивость менее характерна для металлов, за исключением переходных элементов. Из известных металлов из основных групп Периодической таблицы, только свинец и олово показывают переменную степень окисления в той или иной степени.
Примеры различных степеней окисления переходных металлов
- Железо: Железо имеет две общие степени окисления (+2 и +3), например, в Fe 2 + и Fe 3 + .Он также имеет менее распространенную степень окисления +6 в ионе феррата (VI), FeO 4 2 –.
- Марганец: Марганец имеет очень широкий диапазон степеней окисления в своих соединениях. Например:
| +2 | дюйм Mn 2 + |
| +3 | дюйм Mn 2 O 3 |
| +4 | дюйм MnO 2 |
| +6 | дюйм MnO 4 2 – |
| +7 | дюйм MnO 4 – |
Вы найдете вышеупомянутые и другие примеры, рассмотренные подробно, если вы исследуете химию отдельных металлов из меню переходных металлов. Внизу страницы есть ссылка на это меню.
Внизу страницы есть ссылка на это меню.
Объяснение различных степеней окисления переходных металлов
Мы рассмотрим образование простых ионов, таких как Fe 2 + и Fe 3 + . Когда металл образует ионное соединение, формула производимого соединения зависит от энергетики процесса. В целом образующееся соединение является тем, в котором выделяется больше всего энергии. Чем больше выделяется энергии, тем стабильнее соединение.Есть несколько энергетических терминов, над которыми стоит задуматься, но основные из них:
- Количество энергии, необходимое для ионизации металла (сумма различных энергий ионизации)
- Количество энергии, выделяемой при образовании соединения. Это будет либо энтальпия решетки, если вы думаете о твердых телах, либо энтальпия гидратации ионов, если вы думаете о растворах.
Чем более заряжен ион, тем больше электронов вам нужно удалить и тем больше энергии ионизации вы должны будете обеспечить. Но с учетом этого, чем более заряжен ион, тем больше энергии выделяется в виде энтальпии решетки или энтальпии гидратации иона металла.
Но с учетом этого, чем более заряжен ион, тем больше энергии выделяется в виде энтальпии решетки или энтальпии гидратации иона металла.
Размышляя о типичном непереходном металле (кальции)
Формула хлорида кальция: CaCl 2 . Это почему? Если вы попытались получить CaCl (содержащий ион Ca + ), общий процесс будет немного экзотермическим. Создавая вместо этого ион Ca 2 + , вы должны предоставить больше энергии ионизации, но вы получите намного больше энергии решетки.Между ионами хлорида и ионами Ca 2 + существует гораздо большее притяжение, чем если бы у вас был только ион 1+. Общий процесс очень экзотермический. Поскольку при образовании CaCl 2 выделяется гораздо больше энергии, чем при образовании CaCl, то CaCl 2 более стабилен и поэтому образуется вместо него.
А как насчет CaCl 3 ? На этот раз вам нужно удалить из кальция еще один электрон. Первые два происходят с уровня 4s. Третий идет из 3п.Это гораздо ближе к ядру, поэтому удалить его гораздо сложнее. Между вторым и третьим удаленными электронами наблюдается большой скачок энергии ионизации. Хотя энтальпия решетки будет увеличиваться, этого недостаточно для компенсации дополнительной энергии ионизации, и в целом процесс очень эндотермический. Делать CaCl 3 энергетически нецелесообразно!
Третий идет из 3п.Это гораздо ближе к ядру, поэтому удалить его гораздо сложнее. Между вторым и третьим удаленными электронами наблюдается большой скачок энергии ионизации. Хотя энтальпия решетки будет увеличиваться, этого недостаточно для компенсации дополнительной энергии ионизации, и в целом процесс очень эндотермический. Делать CaCl 3 энергетически нецелесообразно!
Думая о типичном переходном металле (железе)
Вот изменения в электронной структуре железа для образования ионов 2+ или 3+.
| Fe | [Ар] 3d 6 4s 2 | |
| Fe 2 + | [Ар] 3d 6 | |
| Fe 3 + | [Ар] 3d 5 |
Энергия 4s-орбиталей и 3d-орбиталей очень близка.Нет большого скачка количества энергии, необходимой для удаления третьего электрона, по сравнению с первым и вторым. Цифры для первых трех энергий ионизации (в кДж / моль -1 ) для железа по сравнению с таковыми для кальция:
Цифры для первых трех энергий ионизации (в кДж / моль -1 ) для железа по сравнению с таковыми для кальция:
| металл | 1-й IE | 2-й IE | 3-й IE |
|---|---|---|---|
| Ca | 590 | 1150 | 4940 |
| Fe | 762 | 1560 | 2960 |
Энергия ионизации увеличивается по мере того, как вы отбираете у атома больше электронов, потому что такое же количество протонов привлекает меньше электронов.Однако если взять третий электрон из железа, то прирост будет гораздо меньше, чем из кальция.
В случае железа дополнительная энергия ионизации более или менее компенсируется дополнительной энтальпией решетки или энтальпией гидратации, выделяющейся при получении соединения 3+. В результате общее изменение энтальпии не сильно отличается от того, производите ли вы, скажем, FeCl 2 или FeCl 3 . Это означает, что преобразование между двумя соединениями не так уж сложно.
Это означает, что преобразование между двумя соединениями не так уж сложно.
Образование комплексных ионов
Что такое комплексный ион?
Комплексный ион имеет ион металла в центре с рядом других молекул или ионов, окружающих его. Их можно считать прикрепленными к центральному иону координатными (дативными ковалентными) связями (в некоторых случаях связь на самом деле более сложна). Молекулы или ионы, окружающие центральный ион металла, называются лигандами. Простые лиганды включают воду, аммиак и ионы хлора.
Все это объединяет активные неподеленные пары электронов на внешнем энергетическом уровне.Они используются для образования координационных связей с ионом металла.
Некоторые примеры комплексных ионов, образованных переходными металлами
[Fe (H 2 O) 6 ] 2+
[Co (NH 3 ) 6 ] 2+
[Cr (OH) 6 ] 3-
[CuCl 4 ] 2-
Другие металлы также образуют комплексные ионы – это не то, что делают только переходные металлы.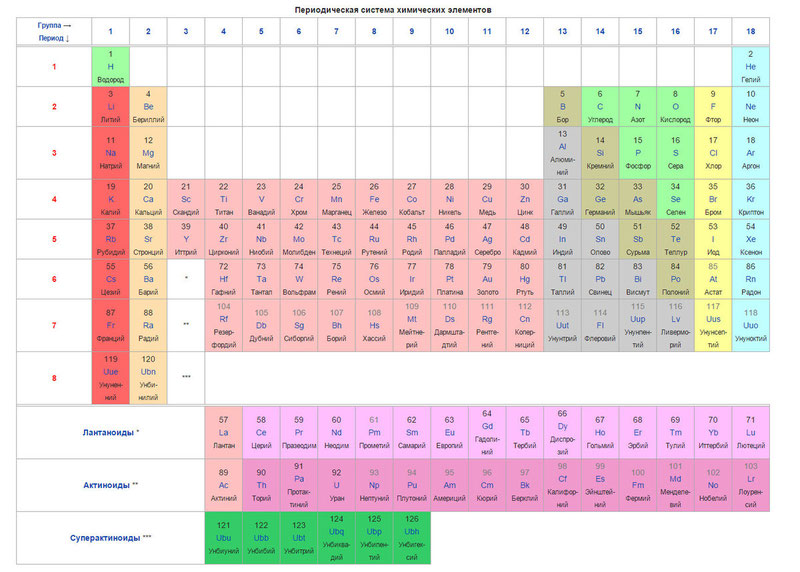 Однако переходные металлы образуют очень широкий спектр комплексных ионов.
Однако переходные металлы образуют очень широкий спектр комплексных ионов.
Образование цветных соединений
На диаграммах показаны приблизительные цвета для некоторых распространенных комплексных ионов переходных металлов.
Вы найдете эти и другие обсуждаемые, если вы перейдете по ссылкам на отдельные металлы в меню переходных металлов (ссылка внизу страницы). Как вариант, вы можете изучить меню сложных ионов (перейдите по ссылке в окне справки, которое только что исчезло в верхней части экрана).
Происхождение цвета в ионах переходных металлов
Когда белый свет проходит через раствор одного из этих ионов или отражается от него, некоторые цвета света поглощаются. Цвет, который вы видите, – это то, как ваш глаз воспринимает то, что осталось. Присоединение лигандов к иону металла влияет на энергии d-орбиталей. Свет поглощается, когда электроны перемещаются между одной d-орбиталью и другой. Это подробно объясняется на другой странице.
Каталитическая активность
Переходные металлы и их соединения часто являются хорошими катализаторами. Некоторые из наиболее очевидных случаев упомянуты ниже, но вы найдете подробное исследование катализа в другом месте на сайте (перейдите по ссылке после примеров). Переходные металлы и их соединения действуют как катализаторы либо из-за их способности изменять степень окисления, либо, в случае металлов, адсорбировать другие вещества на своей поверхности и активировать их в процессе. Все это исследуется в главном разделе катализа.
Некоторые из наиболее очевидных случаев упомянуты ниже, но вы найдете подробное исследование катализа в другом месте на сайте (перейдите по ссылке после примеров). Переходные металлы и их соединения действуют как катализаторы либо из-за их способности изменять степень окисления, либо, в случае металлов, адсорбировать другие вещества на своей поверхности и активировать их в процессе. Все это исследуется в главном разделе катализа.
Железо в процессе Габера
Процесс Габера объединяет водород и азот для получения аммиака с использованием железного катализатора.
Никель при гидрировании связей C = C
Эта реакция лежит в основе производства маргарина из растительных масел. Однако простейшим примером является реакция между этеном и водородом в присутствии никелевого катализатора.
Соединения переходных металлов в качестве катализаторов
Оксид ванадия (V) в контактном процессе
В основе контактного процесса лежит реакция превращения диоксида серы в триоксид серы. Газообразный диоксид серы пропускают вместе с воздухом (в качестве источника кислорода) над твердым катализатором на основе оксида ванадия (V).
Газообразный диоксид серы пропускают вместе с воздухом (в качестве источника кислорода) над твердым катализатором на основе оксида ванадия (V).
Ионы железа в реакции персульфат-ионов с иодид-ионами
Персульфат-ионы (пероксодисульфат-ионы), S 2 O 8 2- , являются очень сильными окислителями. Иодид-ионы очень легко окисляются до йода. И все же реакция между ними в растворе в воде очень медленная. Реакция катализируется присутствием ионов железа (II) или железа (III).{2-} + I_2 \]
Авторы и авторство
.
металлов постпереходного периода | Ученик химии
Постпереходные элементы в периодической таблице – это группа элементов, расположенных между переходными металлами (справа) и металлоидами (слева). Из-за своих свойств их также называют «другими» или «бедными» металлами [1] .
Расположение металлов после перехода в Периодической таблице
Хотя есть некоторые противоречивые теории, обычно постпереходные металлы включают элементы из групп 13-15 [1,2] .
Металлы после перехода в периодической таблице
Элементы 113-116 в периодической таблице Менделеева, то есть нихоний (Nh), флеровий (Fl), московий (Mc) и ливерморий (Lv), считаются, возможно, принадлежащими к семейству пост-переходных металлов, хотя это пока подлежит подтверждению из-за некоторых неизвестных свойств элементов [6] .
Полоний иногда также включается в список постпереходных металлов. То же самое можно сделать для цинка, кадмия и ртути (которые иначе считаются переходными металлами), а также для германия и сурьмы (иначе считающихся металлоидами) [1] .
Свойства и характеристики металлов после перехода
Пример металла после переходного периода Висмут
Физические свойства
- Мягкий или хрупкий, плохая механическая прочность [3]
- Температура плавления ниже, чем у переходных металлов
- Точки кипения также обычно ниже, чем у переходных металлов [3]
- Ковалентная или направленная связь, показанная кристаллическими структурами [4]
- Высокая плотность [5]
Химические свойства
- Склонность к ковалентным связям [3]
- Кислота – основная амфотерия
- Может образовывать полуметаллические соединения [5]
Периодические тенденции металлов после переходного периода
Как правило, атомные радиусы уменьшаются, энергии ионизации увеличиваются, в результате меньше электронов доступно для металлических связей, и поэтому ионы меньше, более поляризуются и имеют тенденцию к образованию ковалентных связей. Следовательно, они имеют меньшую металлическую природу [3] .
Следовательно, они имеют меньшую металлическую природу [3] .
Использование металлов после перехода
Различные элементы этого семейства используются по-разному. Алюминий и олово используются соответственно для изготовления посуды, в электронике, а также для пайки и покрытия стали [5] . Висмут используется для производства пепто-бисмола, лекарства, которое используется для успокоения расстройства желудка [1,5] . Индий используется в электронике, например, для изготовления сенсорных экранов и плоских дисплеев, а галлий находит применение в полупроводниках и топливных элементах [1, 2] .Свинец, помимо прочего, используется в производстве батарей.
Интересные факты
- Алюминий – самый распространенный металл в постпереходный период и третий по распространенности элемент на Земле [1] .
- Висмут из постпереходного металла считался самым тяжелым стабильным элементом до недавнего времени, пока не было обнаружено, что он умеренно радиоактивен.

Артикул:
- https://www.ducksters.com/science/chemistry/post-transition_metals.php
- http://www.miningoilgasjobs.com.au/mining/all-you-need-to-know-about-the-mining—metals-sec/quick-facts-about-post-transition-metals.aspx
- https://ipfs.io/ipfs/QmXoypizjW3WknFiJnKLwHCnL72vedxjQkDDP1mXWo6uco/wiki/Post-transition_metal.html
- https://posttransitionmetals.weebly.com/properties-of-the-post-transition-metals.html
- https://prezi.com/c8vo6gdp78-n/post-transition-metals/
- https://schooledbyscience.com/everyday-uses-of-basic-metals/
.
Переходные металлы и сложная химия ранних актинидных элементов – ScienceDaily
Многим из нас часто говорят, что мы имеем сходство с другим членом нашей семьи – например, что у нас есть нос матери или глаза отца.
Химические элементы в таблице Менделеева также имеют семейное сходство, которое может дать предсказательное представление о том, как элементы взаимодействуют, что приведет ученых к еще невообразимым приложениям.
В случае одного элемента, протактиния, химическое сходство, обусловленное конфигурацией его внешних электронов, связывает два семейства элементов: стабильные и хорошо известные переходные металлы и более экзотические актиниды.
В новом исследовании Аргоннской национальной лаборатории Министерства энергетики США (DOE) и Университета Лилля во Франции химики изучили множественные сходства протактиния, чтобы более полно понять взаимосвязь между переходными металлами и сложной химией ранних актинидных элементов. .
Protactinium Основная ценность протактиниума заключается не в его коммерческом использовании, а в предоставлении нового фундаментального понимания химии элементов. Протактиний – это актинидный элемент, который в периодической таблице находится между торием и ураном.Однако протактиний также очень похож на ниобий и тантал, оба из которых являются переходными металлами, используемыми в ряде химических и металлургических применений. Когда химики поймут их сходство более подробно, они могут обнаружить новые и еще не открытые применения этих и других связанных элементов.
«Протактиний является точкой опоры периодической таблицы», – сказал автор исследования и аргоннский химик Ричард Уилсон. «Вопрос о том, как мы составляем периодическую таблицу, действительно лежит в основе наших размышлений о протактинии.«
Ответ на вопрос, действует ли протактиний больше как актинид или как переходный металл, заключается во внешних электронных оболочках атома протактиния. Ученые обозначают каждую раковину цифрой (от 1 до 7) и буквой (s, p, d или f). В какой оболочке обитают внешние электроны элемента, с точки зрения числа и буквы, определяется его семейство и помогает определить широкий диапазон его химического и физического поведения.
Разница между переходными металлами и актинидами заключается в том, что внешняя оболочка сначала заполняется доступными электронами.Протактиний, отметил Уилсон, особенно важен, потому что он представляет собой границу, на которой энергетически меняются d-орбитали и f-орбитали. Это определяет, как орбитали заполняются и как они взаимодействуют или связываются со своими соседями.
«d-орбитали в переходных металлах непосредственно участвуют в химическом связывании и могут организовываться в довольно предсказуемые структуры», – сказал Уилсон. «Актиниды не так легко образуют такие же виды связей».
По словам Уилсона, химики, изучающие актиниды, которые пытались заставить протактиний действовать как его кузены из переходных металлов, достигли ограниченного успеха.«Можем ли мы заставить протактиний вести себя как ниобий и тантал? Ответ экспериментально -« еще нет »», – сказал Уилсон. «Но работа над теорией этого уникального элемента может дать нам новый взгляд на то, как он может находиться прямо на этом важном химическом и энергетическом перекрестке».
Изменения в электронных орбиталях и поведении связей, которые происходят внутри тяжелых элементов, только усиливаются по мере продолжения периодической таблицы. В самых тяжелых элементах, сказал Уилсон, релятивистские эффекты начинают вытеснять наше классическое понимание того, как определенные элементы «должны» себя вести, даже до такой степени, что предполагаемый элемент может напоминать как инертный благородный газ, так и высокоактивный металл одновременно. .
.
«Мы начинаем понимать, что протактиний – это тот порог, на котором связи в периодической системе начинают меняться», – сказал Уилсон. «Мы углубляемся в то, что действительно движет периодической таблицей».
История Источник:
Материалы предоставлены DOE / Аргоннской национальной лабораторией . Примечание. Содержимое можно редактировать по стилю и длине.
.
Химия для старших классов / переходные элементы – Викиучебники, открытые книги для открытого мира
Из Wikibooks, открытые книги для открытого мира
Перейти к навигации Перейти к поиску
| Ищите Химия для старших классов / переходные элементы в одном из родственных проектов Викиучебника: Викиучебник не имеет страницы с таким точным названием. Другие причины, по которым это сообщение может отображаться:
|
.
Семейства элементов периодической таблицы
Перейти к содержанию
Search for:
Главная » Разное
Автор Тимохин Александр На чтение 6 мин. Просмотров 21 Опубликовано
Просмотров 21 Опубликовано
Элементы можно классифицировать по семействам элементов. Знание того, как идентифицировать семейства, какие элементы входят в состав, и их свойства, помогает предсказать поведение неизвестных элементов и их химические реакции.
01
из 10
Содержание
- Семейства элементов
- 5-элементные семейства
- 9 семейств элементов
- Распознавание семей в Периодической таблице
- Щелочные металлы или семейство 1 группы Элементы
- Щелочноземельные металлы или семейство элементов группы 2
- Семейство элементов переходных металлов
- Группа бора или семейство элементов из земного металла
- Carbon Group или Tetrels Fam набор элементов
- Группа азота или семейство элементов пниктогенов
- Кислородная группа или семейство халькогенов элементов
- Галогенное семейство элементов
- Семейство элементов благородного газа
- Источники
Семейства элементов
Семейство элементов — это набор элементов, имеющих общие свойства. Элементы классифицируются по семействам, потому что три основные категории элементов (металлы, неметаллы и полуметаллы) очень широки. Характеристики элементов этих семейств определяются в первую очередь количеством электронов во внешней энергетической оболочке. С другой стороны, группы элементов — это совокупности элементов, категоризированных по схожим свойствам. Поскольку свойства элементов в значительной степени определяются поведением валентных электронов, семейства и группы могут быть одинаковыми. Однако есть разные способы разбивки элементов на семейства. Во многих учебниках химии и химии выделяются пять основных семейств:
Элементы классифицируются по семействам, потому что три основные категории элементов (металлы, неметаллы и полуметаллы) очень широки. Характеристики элементов этих семейств определяются в первую очередь количеством электронов во внешней энергетической оболочке. С другой стороны, группы элементов — это совокупности элементов, категоризированных по схожим свойствам. Поскольку свойства элементов в значительной степени определяются поведением валентных электронов, семейства и группы могут быть одинаковыми. Однако есть разные способы разбивки элементов на семейства. Во многих учебниках химии и химии выделяются пять основных семейств:
5-элементные семейства
- Щелочные металлы
- Щелочноземельные металлы
- Переходные металлы
- Галогены
- Благородные газы
9 семейств элементов
Другой распространенный метод категоризации распознает девять семейств элементов:
- Щелочные металлы: Группа 1 (IA) — 1 валентный электрон
- Щелочноземельные металлы: Группа 2 (IIA) — 2 валентных электрона
- Переходные металлы: Группы 3-12 — блочные металлы d и f имеют 2 валентных электрона
- Группа бора или земные металлы: Группа 13 (IIIA) — 3 валентных электрона.

- Группа углерода или тетрелы: — Группа 14 (IVA) — 4 валентных электрона
- Группа азота или пниктогены: — Группа 15 (VA) — 5 валентных электронов
- Кислородная группа или халькогены: — Группа 16 (VIA) — 6 валентных электронов
- Галогены: — Группа 17 (VIIA) — 7 валентных электронов
- Благородные газы: — Группа 18 (VIIIA) — 8 валентных электронов s
Распознавание семей в Периодической таблице
Столбцы периодической таблицы обычно отмечают группы или семьи. Для нумерации семейств и групп использовались три системы:
- В более старой системе ИЮПАК использовались римские цифры вместе с буквами, чтобы различать левую (A) и правую (B) стороны периодической таблицы.
- В системе CAS используются буквы для различения элементов основной группы (A) и переходных (B) элементов.
- В современной системе IUPAC используются арабские цифры 1- 18, просто пронумеровав столбцы периодической таблицы слева направо.

Многие периодические таблицы включают как римские, так и арабские числа. Арабская система нумерации сегодня является наиболее широко распространенной..
02
из 10
Щелочные металлы или семейство 1 группы Элементы
Щелочные металлы признаются группой и семейством элементов. Эти элементы — металлы. Натрий и калий являются примерами элементов этого семейства. Водород не считается щелочным металлом, потому что газ не проявляет типичных свойств группы. Однако при правильных условиях температуры и давления водород может быть щелочным металлом.
- Группа 1 или IA
- Щелочные металлы
- 1 валентный электрон
- Мягкие металлические твердые тела
- Блестящие, блестящие
- Высокая теплопроводность и электрическая проводимость
- Низкие плотности, увеличивающиеся с увеличением атомной массы
- Относительно низкие температуры плавления, уменьшающиеся с атомной массой
- Энергичная экзотермическая реакция с водой с образованием газообразного водорода и раствор гидроксида щелочного металла.

- Ионизируйте, чтобы потерять свой электрон, поэтому ион имеет заряд +1
03
из 10
Щелочноземельные металлы или семейство элементов группы 2
Щелочноземельные металлы или просто щелочноземельные металлы признаны важной группой и семейством элементов. . Эти элементы — металлы. Примеры включают кальций и магний.
- Группа 2 или IIA
- Щелочноземельные металлы (щелочные земли)
- 2 валентные электроны
- Металлические твердые тела, тверже щелочных металлов.
- Блестящие, блестящие, легко окисляются
- Высокая теплопроводность и электрическая проводимость
- Более плотная, чем у щелочных металлов.
- Более высокие температуры плавления, чем у щелочных металлов.
- Экзотермическая реакция с водой, возрастающая по мере продвижения вниз по группе; бериллий не реагирует с водой; магний реагирует только с паром.
- Ионизирует, чтобы потерять свои валентные электроны, поэтому ион имеет заряд +2
04
из 10
Семейство элементов переходных металлов
Самое большое семейство элементов состоит из переходных металлов.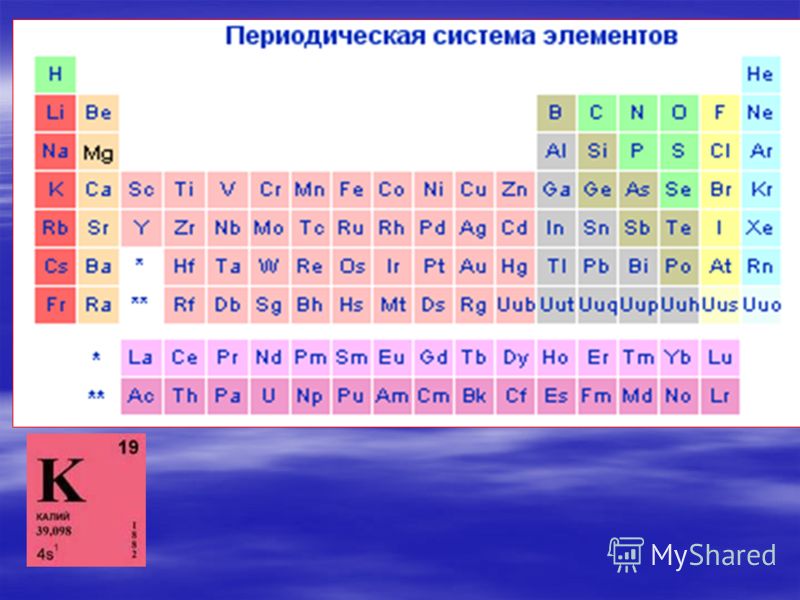 В центре таблицы Менделеева находятся переходные металлы, плюс два ряда под основной частью таблицы (лантаноиды и актиниды) — это особые переходные металлы..
В центре таблицы Менделеева находятся переходные металлы, плюс два ряда под основной частью таблицы (лантаноиды и актиниды) — это особые переходные металлы..
- Группы 3-12
- Переходные металлы или переходные элементы
- Металлы блока d и f имеют 2 валентности электроны
- Твердые металлические твердые тела
- Блестящие, блестящие
- Высокая теплопроводность и электрическая проводимость.
- Плотные
- Высокие температуры плавления
- Большие атомы демонстрируют диапазон степеней окисления
05
из 10
Группа бора или семейство элементов из земного металла
Группа бора или земля Семейство металлов не так хорошо известно, как некоторые другие семейства элементов.
- Группа 13 или IIIA
- Группа бора или Металлы из недр
- 3 валентных электрона
- Разнообразные свойства, промежуточные между свойствами металлов и неметаллов.
- Самый известный член: алюминий
06
из 10
Carbon Group или Tetrels Fam набор элементов
Углеродная группа состоит из элементов, называемых тетрелами, что означает их способность нести заряд 4.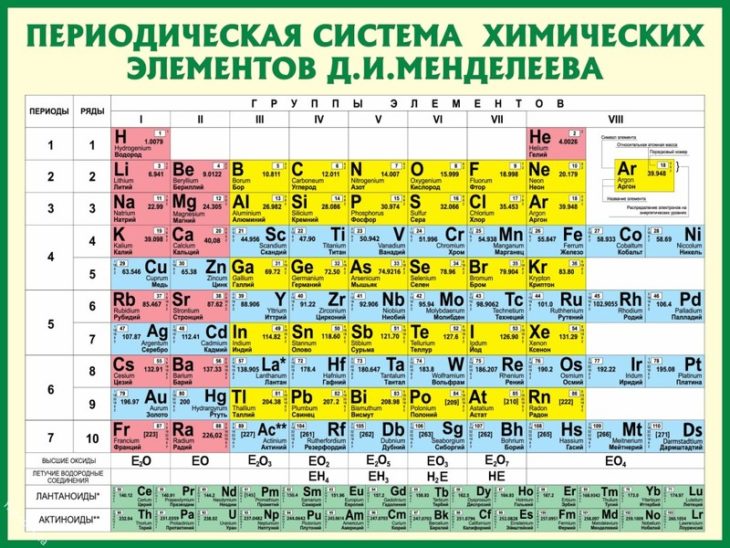
- Группа 14 или IVA
- Группа углерода или тетрелы
- 4 валентных электрона
- Разнообразные свойства, промежуточные между свойствами металлов и неметаллов.
- Самый известный член: углерод, который обычно образует 4 связи
07
из 10
Группа азота или семейство элементов пниктогенов
Пниктогены или азотная группа является важным семейством элементов.
- Группа 15 или VA
- Группа азота или пниктогены
- 5 валентных электронов
- Разнообразные свойства, промежуточные между свойствами металлов и неметаллов.
- Самый известный член: азот
08 v>
из 10
Кислородная группа или семейство халькогенов элементов
Семейство халькогенов также известно как кислородная группа.
- Группа 16 или VIA
- Кислородная группа или халькогены
- 6 валентных электронов
- Различные свойства, меняющиеся от неметаллических становиться металлическим по мере продвижения по семейству
- Самый известный член: кислород
09
из 10
Семейство галогенов — это группа химически активных неметаллов. .
.
- Группа 17 или VIIA
- Галогены
- 7 валентных электронов
- Реактивный неметаллы
- Точки плавления и кипения увеличиваются с увеличением атомного номера.
- Высокое сродство к электрону
- Измените состояние по мере продвижения по семейству, с фтором и хлором, существующими в виде газов при комнатной температуре, в то время как бром является жидкостью, а йод — твердым веществом
10
из 10
Семейство элементов благородного газа
Благородные газы — это семейство инертных неметаллов. Примеры включают гелий и аргон.
- Группа 18 или VIIIA
- Благородные газы или инертные газы
- 8 валентных электронов
- Обычно существуют в виде одноатомных газов, хотя эти элементы (редко) образуют соединения.
- Стабильный электронный октет делает нереактивным (инертным) при обычных обстоятельствах
Источники
- Флюк, Э. «Новые обозначения в Периодической таблице».
 Pure Appl. Chem. ИЮПАК . 60 (3): 431–436. 1988. doi: 10.1351/pac198860030431
Pure Appl. Chem. ИЮПАК . 60 (3): 431–436. 1988. doi: 10.1351/pac198860030431 - Ли, Дж. Дж. Номенклатура неорганической химии: рекомендации . Blackwell Science, 1990, Хобокен, штат Нью-Джерси
- Скерри, Э. Р. Периодическая таблица, ее история и ее значение . Oxford University Press, 2007, Оксфорд.
Переходные металлы – Периодическая таблица
Что такое переходные металлы?
Когда большинство из нас думает о «металлах», мы, вероятно, думаем о переходном металле . Но что такое переходный металл? Существует несколько различных определений. В этой статье мы рассмотрим переходные металлы, они же переходные элементы, к которым относятся элементы таблицы Менделеева с 4 по 11 группы, а также скандий и иттрий. В это определение не включены лантаноиды или элементы актинидного ряда, часто называемые «внутренними переходными металлами», или цинк, кадмий или ртуть, которые мы называем «постпереходными металлами».
Не существует общепринятого определения того, что такое переходный металл. Одним из определений переходного металла является любой металл, который имеет по крайней мере один неспаренный d-электрон в одном из своих стабильных ионов. Неспаренные d-электроны чаще участвуют в химических реакциях. Это определение исключает скандий, поскольку ион Sc+3 не имеет неспаренных d-электронов.
Элементы «D-блока» — это часто используемая фраза, которая описывает элементы в группах с 3 по 12. Они называются элементами d-блока, потому что по мере прохождения рядов d-орбиталь постепенно заполняется электронами. Иногда он используется взаимозаменяемо с термином переходный металл.
Английский химик Чарльз Бери впервые использовал этот термин для описания этой группы элементов.
Свойства переходных металлов
Переходные металлы обычно являются хорошими проводниками тепла и электричества, ковкими и пластичными. Их соединения часто ярко окрашены в растворе и при гидратации и могут проявлять несколько положительных степеней окисления. Это твердые вещества с высокими температурами плавления и кипения. Их соединения часто являются парамагнитными.
Это твердые вещества с высокими температурами плавления и кипения. Их соединения часто являются парамагнитными.
Обычно они довольно плотные и менее реакционноспособны, чем щелочные или щелочноземельные элементы. Они часто являются хорошими катализаторами и легко образуют комплексы с молекулами, называемыми лигандами .
Формирование анионов и потеря электронов
При образовании анионов эти металлы всегда первыми теряют свои s-орбитальные электроны. Ионы переходных металлов обычно имеют неполностью заполненные d-орбитали, за исключением скандия, поэтому скандий иногда исключают из числа переходных металлов.
Примеры переходных металлов
Некоторые из наиболее распространенных примеров включают железо, хром, марганец, ванадий, титан, медь, кобальт, никель, вольфрам, золото и платину.
Химия переходных металлов
Соединения переходных металлов часто сильно окрашены из-за d-электронных переходов. Они часто образуют парамагнитные соединения из-за неспаренных d-электронов. В своей элементарной форме они часто действуют как катализаторы.
В своей элементарной форме они часто действуют как катализаторы.
Почти все металлы имеют несколько степеней окисления, особенно металлы групп 5, 6, 7 и 8. Например, марганец можно легко перевести в 5 различных степеней окисления.
Многие из этих металлов образуют комплексы, называемые координационными соединениями, с лигандами в диапазоне от H 2 0 или галогенидов до органических молекул, таких как ЭДТА. Таким образом, вы получаете интересные соединения, такие как ферроцианид железа Fe 4 [Fe(CN) 6 ] 3 , также известный как берлинская лазурь, или тетрайодомеркурат меди (I), Cu 2 HgI 4 .
Почему они такие разноцветные?
Это из-за их незаполненных d-орбиталей и того, что называется «электронными переходами d-d». Когда переходный металл образует ион, его электроны могут поглощать свет и перемещаться между d-орбиталями. D-орбиталей обычно вырождаются , то есть все они находятся на одном энергетическом уровне. Но когда переходный металл образует комплекс с лигандом, таким как H 2 O или NH 3 , d-орбитали приобретают разные энергетические уровни. Например, Cu +2 бесцветен, а Cu(H 2 0) 6 +2 имеет синий цвет. В зависимости от разницы энергий между этими d-орбиталями будут поглощаться и отражаться световые волны разной длины. Как и ожидалось, ионы без электронов на d-орбитали, такие как Sc +3 или полная d-орбиталь, как Zn +2 , бесцветны.
Но когда переходный металл образует комплекс с лигандом, таким как H 2 O или NH 3 , d-орбитали приобретают разные энергетические уровни. Например, Cu +2 бесцветен, а Cu(H 2 0) 6 +2 имеет синий цвет. В зависимости от разницы энергий между этими d-орбиталями будут поглощаться и отражаться световые волны разной длины. Как и ожидалось, ионы без электронов на d-орбитали, такие как Sc +3 или полная d-орбиталь, как Zn +2 , бесцветны.
Интересные факты о переходных металлах
- Иридий может образовывать соединения со степенью окисления +9 в редких случаях
- Хром и марганец образуют мощные окислители, дихромат- и перманганат-ионы 40C и очень токсичен
- Родий является самым дорогим металлом и стоит более 800 долларов за грамм в 2021 году
- Титан образует на воздухе тонкий оксидный слой, который имеет различный цвет в зависимости от его толщины
- Золото и медь являются двумя из трех металлов, которые окрашиваются (третий — цезий)
- Цвет, который вы видите при переходе раствор металла, как правило, из комплекса, образованного с молекулами воды
- Некоторые соединения, которые они образуют, на самом деле представляют собой ковалентные жидкости, такие как тетрахлорид титана, TiCl 4
Вот некоторая дополнительная информация об истории переходных элементов, начиная с Доктор Эрик Шерри , ведущий специалист по периодической таблице:
«Интересный комментарий о Чарльзе Бери и его первом использовании термина «переходный металл». Более подробное описание этого эпизода см. в Eric Scerri, The Periodic Table, its Story and its Significance, Oxford University Press, 2nd ed., 2020.
Более подробное описание этого эпизода см. в Eric Scerri, The Periodic Table, its Story and its Significance, Oxford University Press, 2nd ed., 2020.
Кроме того, следует отметить, что термин переходный металл или переходный металл элемент существовал задолго до Бери и восходит к первоначальным таблицам Менделеева.
Первоначальная таблица Менделеева содержала периодичность в простом 8-колоночном формате. Другими словами, в отличие от текущей периодической таблицы, которая распознает увеличение длины периодов по мере увеличения атомного номера (2, 8, 18, 32 и т. д.), исходная таблица пыталась втиснуть все элементы в формат из 8 столбцов. Для этого Менделеев и другие пионеры периодической таблицы были вынуждены удалить некоторые элементы из основной части таблицы и создать специальную группу VIII, в которую вошли «переходные элементы», включающие Fe, Co, Ni, Ru, Rh. , Pd, Os, In, Pt.
Так что правильнее будет сказать, что только термин «переходный элемент» в современном понимании произошел от Бери.
Дополнительная литература
Галогены
Щелочные металлы
Щелочноземельные металлы
Благородные газы
Группы периодической таблицы
Периодическая таблица с названиями элементов
Переходные металлы Определение, список и свойства
от Anne Helmenstine (обновлено )Это переходные металлы согласно определению ИЮПАК.
Переходные металлы — самая большая группа элементов в периодической таблице. Они получили свое название, потому что английский химик Чарльз Бери описал переходных серий элементов в 1921 году. Бери исследовал переход от внутреннего слоя с 8 электронами к слою с 18 электронами и от слоя с 18 электронами к слою с 32 электронами. Сегодня большинство людей думают об этих элементах как о переходе с одной стороны таблицы Менделеева на другую. Двигаясь слева направо по периодической таблице, электрон добавляется к d орбиталь каждого атома, переходя из группы 2 в группу 13.
Ниже приведены различные способы определения переходных металлов, список включенных элементов и сводка их общих свойств.
Определение переходного металла
Наиболее распространенное определение переходного металла принято IUPAC. Переходный металл — это элемент с частично заполненной d подоболочкой или способностью образовывать катионы с неполной д подоболочка.
Другие люди считают, что переходные металлы включают любой d -блочный элемент периодической таблицы. В соответствии с этим определением группы с 3 по 12 являются переходными металлами, а серии f -блочных лантанидов и актинидов называются «внутренними переходными металлами».
Список элементов переходных металлов
Согласно определению ИЮПАК существует 40 переходных металлов. Это:
- Атомные номера от 21 (скандий) до 30 (цинк)
- Атомные номера от 39 (иттрий) до 48 (кадмий)
- Атомные номера от 71 (лютеций) до 80 (ртуть)
- Атомные номера от 103 (лоуренсий) до 112 (коперниций)
С технической точки зрения элементы цинк, кадмий и ртуть (группа 12) следует рассматривать как постпереходные, а не переходные металлы, поскольку они имеют полную d 20 9 конфигурацию и обычно производят ионы, сохраняющие эту конфигурацию. Экспериментальные доказательства того, что ртуть ведет себя как переходный металл, были получены в 2007 году. Коперниций, вероятно, следует исключить на том же основании, хотя его окислительные свойства не были подтверждены экспериментально. Однако большинство людей включают эти элементы в список переходных металлов.
Экспериментальные доказательства того, что ртуть ведет себя как переходный металл, были получены в 2007 году. Коперниций, вероятно, следует исключить на том же основании, хотя его окислительные свойства не были подтверждены экспериментально. Однако большинство людей включают эти элементы в список переходных металлов.
Некоторые люди исключают из списка лютеций и лоуренсий. Но лютеций и лоуренсий технически являются элементами группы 3, которые занимают «пространство» в периодической таблице. Есть также ученые и преподаватели, которые включают полный ряд лантанидов и актинидов в качестве переходных металлов.
Свойства переходных металлов
Переходные металлы обладают несколькими характерными свойствами:
Переходные металлы известны своей способностью образовывать цветные водные растворы. (Бенджа-bmm27)- Атомы переходных металлов имеют металлический характер. Другими словами, атомы легко теряют электроны.
- Часто образуют окрашенные соединения.
 Цвета обусловлены электронными переходами d-d .
Цвета обусловлены электронными переходами d-d . - Легко образуют комплексы.
- Имеют несколько положительных степеней окисления. Это связано с малой энергетической щелью между состояниями.
- Они являются хорошими катализаторами.
- Серебряные металлы при комнатной температуре. Исключение составляют медь и золото.
- Они представляют собой твердые вещества при комнатной температуре. Исключение составляет ртуть.
- Они парамагнитны (притягиваются к магнитному полю). Как правило, парамагнетизм возникает из-за неспаренных d -электронов. Три важных элемента в отношении магнетизма — это железо, кобальт и никель. Все три элемента создают магнитное поле.
- Имеют металлический блеск.
- Имеют низкую энергию ионизации.
- Они жесткие.
- Металлы имеют высокие температуры плавления и кипения (кроме ртути).
- Они являются хорошими проводниками электричества и тепла.
- Образуют сплавы.

Ссылки
- Гринвуд, Норман Н.; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн. ISBN 0-08-037941-9.
- ИЮПАК (1997). Сборник химической терминологии , 2-е изд. («Золотая книга»).
- Дженсен, Уильям Б. (2003). «Место цинка, кадмия и ртути в периодической таблице». Журнал химического образования . 80 (8): 952–961. doi:10.1021/ed080p952
Периодическая таблица: репрезентативные элементы и переходные металлы — видео по химии
Ch.2 – Atoms & Elements Worksheetseee Все главы
| Ch.1 – Intro to General Chemistry | 4HRS & 3MINS | 0%. Начало | ||||||
| Глава 2 – Атомы и элементы | 4hrs & 22mins | 0% complete | Worksheet Download the video lesson worksheet Start | |||||
Ch. 3 – Chemical Reactions 3 – Chemical Reactions | 4hrs & 18mins | 0% complete | Рабочий лист Загрузить рабочий лист видеоурока Начало | |||||
| БОНУС: Лабораторные методы и процедуры | 1 час 23 минуты | 0%. Завершите | Рабочий лист Скачать видео -лист урока СТАРЬ | |||||
| Бонус: Математические операции и функции | 47MINS: Математические операции и функции | 47MINS: Математические операции и функции | 47MINS: Mathmatic and Functions | 47mins. Рабочий лист урока Начало | ||||
| Глава 4 – Химические количества и водные реакции | 3 часа и 54 минуты | 0% завершено | Worksheet Download the video lesson worksheet Start | |||||
Ch. 5 – Gases 5 – Gases | 3hrs & 32mins | 0% complete | Worksheet Download the video lesson worksheet Начало | |||||
| Глава 6 – Термохимия | 2 часа и 27 минут | Выполнено 0% | Рабочий лист Скачать рабочий лист видеоурока Start | |||||
| CH.7 – Квантовая механика | 2HRS & 17MINS | 0%. Свойства элементов | 3 часа | Выполнено 0% | Рабочий лист Скачать рабочий лист видеоурока Начало | |||
| CH.9 – Связывание и молекулярная структура | 3HRS & 20MINS | 0%. Завершите | Рабочий лист | 1 час и 55 минут | Выполнено 0% | Рабочий лист Загрузить рабочий лист видеоурока Начало | ||
| CH.11 – Жидкости, твердые тела и межмолекулярные силы | 2HRS & 23MINS | 0%. Заполните | 40004. 2 часа и 53 минуты | Выполнено 0% | Рабочий лист Скачать рабочий лист видеоурока Начало | |||
| Глава 13 – Химическая кинетика | 2hrs & 45mins | 0% complete | Worksheet Download the video lesson worksheet Start | |||||
| Ch.14 – Chemical Equilibrium | 2hrs & 26mins | 0% complete | Рабочий лист Загрузить рабочий лист видеоурока Начало | |||||
| Глава 15 – Кислотное и щелочное равновесие | 4 часа 33 минуты | 0% complete | Worksheet Download the video lesson worksheet Start | |||||
Ch. 16 – Aqueous Equilibrium 16 – Aqueous Equilibrium | 3hrs & 48mins | 0% complete | Worksheet Download рабочий лист видеоурока Старт | |||||
| Гл. 17 – Химическая термодинамика | 1 час и 44 минуты | 0% завершения | Рабочий лист Скачать рабочее лист на видео Start | |||||
| CH.18 – Электрохимия | 2HRS и 12MINS | 0%. | ||||||
| Глава 19 – Ядерная химия | 1 час 26 минут | Выполнено 0% | Рабочий лист Скачать рабочий лист видеоурока Start | |||||
| CH.20 – Органическая химия | 2HRS & 59MINS | 0% Комплект | Worksheet 9000 9000 . Загрузка. неметаллов | 2 часа и 1 минута | 0% завершено | Рабочий лист Скачать рабочий лист видеоурока Начало | ||
Ch. 23 – Transition Metals and Coordination Compounds 23 – Transition Metals and Coordination Compounds | 1hr & 49mins | 0% complete | Worksheet Download the video lesson worksheet Start |
See all sections
| Разделы | |||||||
|---|---|---|---|---|---|---|---|
| Атом | 10 минут | 0 завершено | 17 Обучение040752 | Subatomic Particles | 17 mins | 0 completed | Learn |
| Isotopes | 17 mins | 0 completed | Learn Summary | ||||
| Ions | 28 mins | 0 завершено | Обучение | ||||
| Атомная масса | 23 мин | 0 завершено | 7 | ||||
| Periodic Table: Classifications | 11 mins | 0 completed | Learn | ||||
| Periodic Table: Group Names | 9 mins | 0 completed | Learn | ||||
| Периодическая таблица: характерные элементы и переходные металлы | 7 минут | 0 завершено | Выучить | ||||
| Периодическая таблица: символы элементов | 7 mins | 0 completed | Learn | ||||
| Periodic Table: Elemental Forms | 6 mins | 0 completed | Learn | ||||
| Periodic Table: Phases | 8 mins | 0 завершено | Обучение | ||||
| Периодическая таблица: заряды | 20 минут | 0 завершено | Обучение0316 | ||||
| Calculating Molar Mass | 10 mins | 0 completed | Learn | ||||
| Mole Concept | 38 mins | 0 completed | Learn Summary | ||||
| Law Закон сохранения массы | 6 мин. | 0 завершено | Обучение | ||||
| Закон определенных пропорций | 10 мин. | 0 completed | Learn | ||||
| Atomic Theory | 10 mins | 0 completed | Learn | ||||
| Law of Multiple Proportions | 6 mins | 0 completed | Обучение | ||||
| Эксперимент Millikan Oil Drop Experiment | 9 минут | 0 завершено | Обучение | ||||
| Эксперимент 9 F. Gold Rutherford Gold0316 | 11 mins | 0 completed | Learn |
| Additional Guides |
|---|
| Periodic table Charges (IGNORE) |
| Calculating Molar Mass (IGNORE) |
| Вычисление граммов в моли (IGNORE) |
Узнать
Следующий разделПериодическая таблица: символы элементов
Группы Периодической таблицы можно разбить на Репрезентативные элементы и Переходные металлы
Переходные металлы и репрезентативные элементы
Концепция № 1: Периодическая таблица: репрезентативные элементы и переходные металлы
Переходные металлы можно найти в группах с 3 по 12, остальные группы Репрезентативные элементы
Пример № 1: Какой из следующих металлов является переходным металлом 5-го периода с химическими свойствами, сходными с медью, Cu?
Предыдущий раздел Периодическая таблица: названия групп
Следующий разделПериодическая таблица: символы элементов
Определение, свойства, периодическая таблица | StudySmarter
Определение, свойства, периодическая таблица | StudySmarterВыберите язык
Предлагаемые языки для вас:
Европа
английский (DE) английский (Великобритания)
StudySmarter — универсальное учебное приложение.
4.8 • Рейтинг +11k
Более 3 миллионов загрузок
Бесплатно
Сохранять
Распечатать
Редактировать
Переходные металлы
Содержание :
ОГЛАВЛЕНИЕ
Что для вас значит слово «переход»? Оно происходит от латинского transientum , что означает «переход», и подразумевает переход из одного места в другое.
Вот что такое переходных металлов — группа элементов, которые перекрывают разрыв между двумя сторонами таблицы Менделеева. В этой статье мы окунемся в удивительный мир этих металлов.
В этой статье мы окунемся в удивительный мир этих металлов.
- Эта статья является введением в переходные металлы в неорганической химии.
- Начнем с определения переходных металлов.
- Затем мы посмотрим на их положение в периодической таблице.
- Рассмотрим их общие свойства.
- Наконец, мы рассмотрим некоторые из их применений и применений.
Что такое переходные металлы?
Ученые иногда расходятся во мнениях относительно точной классификации переходных металлов. На самом деле существует несколько различных определений.
Но для сдачи экзаменов вам необходимо знать следующее:
T переходные металлы – это элементы, образующие по крайней мере один стабильный ион с частично заполненной d-подоболочкой электронов .
Вы можете подумать, что это определение охватывает все элементы в d-блоке периодической таблицы, но на самом деле это не так. Это связано с тем, что не все элементы d-блока образуют стабильные ионы с неполными d-подоболочками электронов. Примеры элементов d-блока, которые не являются переходными металлами скандий (Sc) и цинк (Zn). Мы рассмотрим, почему это так, позже.
Это связано с тем, что не все элементы d-блока образуют стабильные ионы с неполными d-подоболочками электронов. Примеры элементов d-блока, которые не являются переходными металлами скандий (Sc) и цинк (Zn). Мы рассмотрим, почему это так, позже.
Вы можете увидеть переходные металлы в таблице Менделеева ниже. Здесь они выделены синим цветом.
Периодическая таблица элементов с выделенными переходными металлами. Olive Odagbu, StudySmarter Original
IUPAC (Международный союз теоретической и прикладной химии) на самом деле имеет немного другое определение переходного металла. Они согласны с тем, что переходный металл — это элемент, который образует по крайней мере один стабильный ион с частично заполненной d-подоболочкой электронов, но говорят также, что переходными металлами могут быть элементы, у которых атомов имеют частично заполненную d-подоболочку. Это определение означает, что скандий и цинк на самом деле являются переходными металлами.
Вы также можете увидеть лантаниды , которые представляют собой элементы с атомными номерами 57–71, и актиниды , имеющие номера 89–103, называемые внутренними переходными металлами . Но в этой статье мы будем придерживаться первого определения, которое мы узнали, — только элементы, выделенные синим цветом выше.
Переходные металлы в периодической таблице
Как мы показали выше, переходные металлы находятся в середине d-блока в периодической таблице.
D-блок — это раздел периодической таблицы. Самая высокая энергетическая подоболочка, обнаруженная в элементах d-блока, всегда является d-подоболочкой. D-блок находится между s- и p-блоками и обеспечивает связь между ними.
В частности, переходные металлы относятся к группам 3–12 и периоды 4-7 , но это не важно — важно только то, что вы можете найти их в таблице Менделеева.
Электронная конфигурация переходных металлов
Мы начнем с их электронной конфигурации как атомов, а затем посмотрим, как она изменяется по мере того, как они образуют ионы. Это также поможет объяснить, почему некоторые члены d-блока не классифицируются как переходные металлы.
Этот раздел, вероятно, не будет иметь особого смысла, если вы не читали Электронные оболочки и Электронная конфигурация . Мы рекомендуем сначала проверить их, чтобы изучить основы электронных оболочек, подоболочек, орбиталей и правил заполнения.
Электронная конфигурация атомов переходных металлов
Как мы упоминали выше, все переходные металлы находятся в d-блоке периодической таблицы. Это означает, что все их валентные электроны находятся в d-подоболочке.
Вы должны помнить, что электроны находятся в оболочках . Они разбиты на подоболочки. Существует четыре различных типа электронных подоболочек: s-, p-, d- и f-подоболочки. Положение элемента в периодической таблице говорит вам о подоболочке с наивысшей энергией, в которой находятся его электроны. Например, подоболочка с наивысшей энергией, обнаруженная в элементах p-блока, является p-подоболочкой.
Положение элемента в периодической таблице говорит вам о подоболочке с наивысшей энергией, в которой находятся его электроны. Например, подоболочка с наивысшей энергией, обнаруженная в элементах p-блока, является p-подоболочкой.
При перемещении по периоду периодической таблицы каждый переходный металл имеет на один электрон больше, чем предыдущий. Эти электроны постепенно заполняют d-подоболочку, но есть несколько скрытых исключений. Рассмотрим подробнее на примере первого ряда переходных металлов (период 4). Мы выделили период ниже.
Периодическая таблица с выделенным периодом 4. Олив Одагбу, StudySmarter Original
Давайте посмотрим на их электронные конфигурации. Как и в периодической таблице, мы выделили переходные металлы.
Электронная конфигурация периода 4. Анна Брюэр, StudySmarter Original
Первые два элемента периода 4, калий (K) и кальций (Ca), находятся в s-блоке. Их валентные электроны находятся в 4s-подоболочке, а их 3d-подоболочки пусты.
Помните, что подоболочки заполняются в определенном порядке, от самой низкой энергии до самой высокой энергии. Обычно это следует схеме от наименьшего числа к наибольшему числу. Например, 2s заполняется до 3s. Однако 3d — это аномалия — у него чуть более высокая энергия, чем у 4s, поэтому он заполняет после 4с. Это всего лишь еще один пример досадного исключения из правил, которое вам нужно выучить!
Следующие 10 элементов являются элементами d-блока. По мере прохождения периода электроны добавляются во внутреннюю 3d-подоболочку один за другим. Например, скандий (Sc) имеет 21 электрон и имеет только один электрон в своей 3d-подоболочке, что дает ему электронную конфигурацию [Ar] 3d 1 4s 2 , тогда как титан имеет 22 электрона и имеет два электрона в своей 3d-подоболочка. Это дает ему электронную конфигурацию [Ar] 3d 2 4с 2 .
Но, как мы упоминали выше, эта схема заполнения грубо прерывается двумя элементами: хромом (Cr) и медью (Cu). Оба имеют частично заполненные 4s-подоболочки. Почему это так?
Оба имеют частично заполненные 4s-подоболочки. Почему это так?
Ну, это потому, что 4s- и 3d-подоболочки имеют очень похожие энергетические уровни. Поскольку электрон в 4s-подоболочке неспаренный, он не испытывает никакого электрон-электронного отталкивания. Это снижает его энергетическое состояние и более чем компенсирует дополнительный электрон в 3d-подоболочке с несколько более высокой энергией. Электронам просто нравится находиться в состоянии с минимально возможной энергией. Также считается, что наличие полузаполненной 3d-подоболочки, как в случае хрома, или полностью заполненной 3d-подоболочки, в случае меди, способствует стабилизации атома.
Ожидаемые и наблюдаемые электронные конфигурации хрома и меди. Анна Брюэр, StudySmarter Original
Электронная конфигурация ионов переходных металлов
Все переходные металлы образуют положительных катионов , теряя электроны.
Возможно, вы помните из Электронная конфигурация , что хотя 3d-подоболочка имеет несколько более высокий энергетический уровень, чем 4s-подоболочка, атомы сначала теряют электроны из 4s-подоболочки. Это означает, что все переходные металлы потеряли свои 4s-электроны до своих 3d-электронов.
Это означает, что все переходные металлы потеряли свои 4s-электроны до своих 3d-электронов.
В качестве примера возьмем железо (Fe). Он обычно образует ионы с зарядами 2+ или 3+. Железо имеет электронную конфигурацию [Ar] 3d 6 4s 2 . При образовании иона 2+ он сначала теряет свои 4s-электроны, придавая ему электронную конфигурацию [Ar] 3d 6 4s 0 . Чтобы образовать ион 3+, ему нужно потерять еще один электрон. Поскольку 4s-подоболочка теперь пуста, этот электрон теряется из 3d-подоболочки, что дает иону электронную конфигурацию [Ar] 3d 5 4с 0 .
Электронная конфигурация железа, железа(II) и железа(III). Анна Брюэр, StudySmarter Original
Почему не все элементы d-блока являются переходными металлами?
Это потому, что не все они образуют стабильные ионы с незавершенными d-подоболочками. Например, скандий (Sc) во всех своих соединениях образует только ионы 3+, что придает ему электронную конфигурацию [Ar] 3d 0 4s 0 . Его 3d-подоболочка полностью пуста, так что это не переходный металл. Точно так же цинк (Zn) образует только ионы 2+ во всех своих соединениях. Эти ионы имеют электронную конфигурацию [Ar] 3d 10 4с 0 . Его трехмерная подоболочка полностью заполнена, поэтому это не переходный металл.
Его 3d-подоболочка полностью пуста, так что это не переходный металл. Точно так же цинк (Zn) образует только ионы 2+ во всех своих соединениях. Эти ионы имеют электронную конфигурацию [Ar] 3d 10 4с 0 . Его трехмерная подоболочка полностью заполнена, поэтому это не переходный металл.
Свойства переходных металлов
Все переходные металлы имеют сходные свойства. Они являются хорошими проводниками тепла и электричества, тверды и прочны, имеют высокие температуры плавления и кипения. По сравнению с металлами 1 и 2 группы они также относительно неактивны. Это делает их чрезвычайно полезными, но мы рассмотрим это в следующем разделе. А пока давайте посмотрим на некоторые другие их характерные свойства. Когда речь заходит о переходных металлах, вам нужно знать о четырех особенностях: 9.0007
- Переходные металлы образуют ионы с множественными степенями окисления . Мы уже рассмотрели, как железо образует ионы 2+ и 3+.

- Образуют комплексных ионов . Комплексные ионы — это ионы, связанные с другими ионами или молекулами, известными как лиганды, с помощью дативных ковалентных связей.
- Образуют окрашенных соединений. Например, медь часто образует растворы синего цвета.
- Это хорошие катализаторы , представляющие собой вещества, которые увеличивают скорость химической реакции, не расходуясь в процессе.
Мы более подробно изучаем эти свойства в разделе Свойства переходных металлов .
Использование переходных металлов
Благодаря своим свойствам переходные металлы находят широкое применение. Вы найдете их в электронике, строительных материалах и многом другом. Вот некоторые из их наиболее распространенных применений:
Алюминий легкий и нетоксичный, поэтому используется не только в производстве деталей автомобилей и самолетов, но также для изготовления банок и фольги для упаковки пищевых продуктов.

Железо используется в строительных материалах, например, в мостах, кораблях и в несущих конструкциях зданий. Это связано с его высокой прочностью и низкой стоимостью. Фактически, железо составляет 90 процентов мирового производства металлов.
Медь используется в электрических проводах из-за ее хорошей электропроводности.
Вы можете найти порошкообразный титан в пиротехнической промышленности, например, в фейерверках, потому что он производит ярко горящие частицы.
Вольфрам используется в нитях накаливания ламп и рентгеновских трубках.
Переходные металлы часто образуют сплавы . Это соединения, состоящие из смесей элементов, из которых хотя бы один является металлом. Сплавы обычно прочнее чистых металлов. Металлы образуют решетки, а в чистых металлах ионы металлов внутри решетки имеют одинаковый размер, поэтому им легко скользить друг по другу.
Сплавы обычно прочнее чистых металлов. Металлы образуют решетки, а в чистых металлах ионы металлов внутри решетки имеют одинаковый размер, поэтому им легко скользить друг по другу.
Однако сплавы содержат ионы металлов разного размера. Они искажают решетку и затрудняют скольжение ионов друг по другу. Полезные сплавы переходных металлов включают латунь (изготовленную из меди и цинка), сталь (изготовленную из железа и углерода, неметалла) и стерлинговое серебро (изготовленную из серебра и другого металла, обычно меди).
Для получения дополнительной информации о металлических решетках см. Металлические Склеивание .
Переходные металлы — основные выводы
Переходные металлы — это элементы, атомы которых имеют частично заполненную d-подоболочку или которые образуют по крайней мере один стабильный ион с частично заполненной d-подоболочкой электронов.
Переходные металлы находятся в d-блоке периодической таблицы.
 Это означает, что их подоболочка с наивысшей энергией всегда является d-подоболочкой. В частности, переходные металлы обнаружены в группы 3 -12 и периоды 4-7.
Это означает, что их подоболочка с наивысшей энергией всегда является d-подоболочкой. В частности, переходные металлы обнаружены в группы 3 -12 и периоды 4-7. Переходные металлы различаются по количеству электронов в их d-подоболочках. Однако у меди и хрома электронные конфигурации немного отличаются от ожидаемых из-за сходства энергетических уровней 4s- и 3d-подоболочек.
При образовании ионов переходные металлы теряют свои 4s-электроны раньше своих 3d-электронов.
Переходные металлы твердые и прочные, имеют высокие температуры плавления и кипения и относительно неактивны.
Переходные металлы также образуют ионы с множественными степенями окисления , образуют комплексных ионов , производят окрашенных соединений и действуют как катализаторов .

Переходные металлы используются в качестве строительных материалов и в электронике. Они также образуют множество различных сплавов .
Часто задаваемые вопросы о переходных металлах
Переходные металлы являются хорошими катализаторами, поскольку они могут изменять свою степень окисления и обладают способностью адсорбировать другие вещества.
Переходные металлы менее реакционноспособны, чем другие группы, из-за высокой энергии ионизации и высокой температуры плавления.
Элементы, находящиеся между группами 3-12 в периодической таблице, являются переходными металлами.
У них нет частично заполненной d-подоболочки в их атомном состоянии или их общей степени окисления (т.е. Zn 2+ , Sc 3+ ), поэтому они не рассматриваются как переходные элементы.
Переходные металлы — это металлы, атомы которых имеют частично заполненную d-подоболочку или которые образуют по крайней мере один стабильный ион с частично заполненной d-подоболочкой электронов. Они находятся между группами 3-12 в периодической таблице.
Они находятся между группами 3-12 в периодической таблице.
Final Transition Metals Quiz
Вопрос
Объясните, почему при проведении анализов с помощью колориметра вам следует использовать контейнеры одинаковых размеров для каждого образца.
Показать ответ
Ответить
Вы должны использовать контейнер тех же размеров, потому что поглощение пропорционально расстоянию, пройденному через раствор.
Показать вопрос
Вопрос
Почему мы используем цветной фильтр в колориметрии?
Показать ответ
Ответить
Мы используем цветной фильтр, соответствующий длине волны, которую раствор поглощает больше всего, таким образом достигается максимальное поглощение.
Показать вопрос
Вопрос
Запишите уравнение, которое показывает связь между постоянной Планка, изменением энергии ∆E и частотой видимого света.
Показать ответ
Ответ
∆E = hv = hc/𝝀
Показать вопрос
Вопрос
Объясните, поглощает ли комплекс переходных ионов, образующий красный раствор, малую или большую частоту.
Показать ответ
Ответ
Красный раствор поглощает большую частоту света синего конца спектра, так как синий является дополнительным цветом к красному.
Показать вопрос
Вопрос
Назовите три свойства переходных металлов, которые могут изменить ∆E
Показать ответ
Ответ
- Степень окисления
- Лиганды
- Координационный номер
Показать вопрос
Вопрос
Как расположение электронов помогает классифицировать переходный элемент?
Показать ответ
Ответ
Переходные элементы образуют стабильные ионы с частично заполненной трехмерной подоболочкой.
Показать вопрос
Вопрос
Джон считает, что неизвестный раствор содержит [Fe(H 2 O) 6 ] 2+ ионов. Для подтверждения он реагирует раствор сначала с водным раствором аммиака, а затем с водным раствором карбоната натрия.
Для подтверждения он реагирует раствор сначала с водным раствором аммиака, а затем с водным раствором карбоната натрия.
Напишите уравнения обеих реакций.
Показать ответ
Ответ
Реакция с аммиаком
FE (H 2 O 6 ) 2+ + 2NH 3 ➔ Fe (H 2 O) 4 ➔ Fe (H 2 O) 4 ➔ Fe (H 2 O) ) 2 + 2NH 4+
Реакция с карбонатом натрия
[FE (H 2 O) 6 ] 2+ + CO 3 2- ⟶ Fe (CO 3 2- ⟶ Fe (CO 3 2- Fe (CO 3 2- Fe (CO 3 2- . 3 ) + 6Н 2 O
Показать вопрос
Вопрос
Какое свойство переходных металлов делает их хорошими катализаторами?
Показать ответ
Ответ
Их разные степени окисления.
Показать вопрос
Вопрос
В реакции между ванадатом аммония и цинком в кислом растворе, что вы можете наблюдать, чтобы показать, что ванадий имеет по крайней мере три степени окисления?
Показать ответ
Ответить
Решение изменится на три разных цвета.
Показать вопрос
Вопрос
Опишите изменения цвета, которые вы наблюдаете, если цинк добавить к раствору ванадата аммония в соляной кислоте.
Показать ответ
Ответить
Цвет меняется с желтого на синий, на зеленый и на фиолетовый.
Показать вопрос
Вопрос
Как вы готовите реактив Толленса и что вы наблюдаете?
Показать ответ
Ответ
- Добавьте немного гидроксида натрия к нитрату серебра, чтобы получить оксид серебра(I), коричневый осадок.
- Добавьте раствор аммиака, чтобы снова растворить оксид серебра(I) в диамминсеребре(I). Раствор бесцветный.
Показать вопрос
Вопрос
Как вы проводите тест «серебряное зеркало» и что происходит, если присутствует альдегид?
Показать ответ
Ответ
Добавьте несколько капель неизвестного органического соединения в реактив Толленса.

Затем осторожно подогрейте на водяной бане.
Если это кетон, вы не увидите изменений в бесцветном растворе
Если это альдегид, вы получите серо-серебряный осадок. Ионы Ag + восстанавливаются до Ag, а альдегид окисляется до карбоновой кислоты.
Показать вопрос
Вопрос
Объясните, как pH и лиганд влияют на окислительно-восстановительный потенциал переходного иона, переходящего из высокой степени окисления в более низкую.
Показать ответ
Ответ
Переходные ионы менее склонны принимать электроны в нейтральном растворе.
Некоторые лиганды, которые более прочно связаны с центральным ионом, затрудняют потерю электронов переходным ионом.
Показать вопрос
Вопрос
Используйте приведенные ниже полууравнения, чтобы составить ионное уравнение для реакции между ванадатом(V) и цинком.
VO 2+ (водн.) + 2H + (водн. ) + e – ⇌ VO 2+ (aq) + H 2 O (L) Eº = +1,00 В
) + e – ⇌ VO 2+ (aq) + H 2 O (L) Eº = +1,00 В
Zn (S) ⇌ Zn 2+ (AQ) + 2E – (AQ) + 2E – (AQ) + 2E – . V
Показать ответ
Ответ
2VO 2+ (AQ) + 4H + (AQ) + ZN (S) ⟶ 2VO 2+ (S) ⟶ 2VO 2 (S) 404040404040404040404040404040404040404040404040404040404040404040404040404040404040404040404040404040404040404. 2 О (л) + Zn 2+ (водный)
Показать вопрос
Вопрос
Почему переходные металлы являются хорошими катализаторами?
Показать ответ
Ответ
Переходные металлы действуют как хорошие катализаторы, поскольку они могут изменять свою степень окисления и обладают способностью адсорбировать другие вещества.
Показать вопрос
Вопрос
Активны ли переходные металлы?
Показать ответ
Ответ
Переходные металлы менее активны, чем другие группы, из-за высокой энергии ионизации и высокой температуры плавления.
Показать вопрос
Вопрос
Какие металлы являются переходными?
Показать ответ
Ответить
Элементы между группами 3-12 в периодической таблице являются переходными металлами.
Показать вопрос
Вопрос
Объясните, почему Sc и Zn не классифицируются как переходные металлы.
Показать ответ
Ответ
У них нет частично заполненной d-подоболочки в их атомном состоянии или их обычных степенях окисления (т.е. Zn 2+ , Sc 3+ ), поэтому они не рассматриваются как переходные элементы.
Показать вопрос
Вопрос
Каковы некоторые общие области применения никеля и титана?
Показать ответ
Ответ
Никель в основном используется в нержавеющей стали, а титан, среди прочего, используется в истребителях.
Показать вопрос
Вопрос
Что такое переходные металлы?
Показать ответ
Ответ
Переходные металлы — это металлы, атомы которых имеют частично заполненную d-подоболочку или которые образуют по крайней мере один стабильный ион с частично заполненной d-подоболочкой электронов.
Показать вопрос
Вопрос
Какое место в периодической таблице занимают переходные металлы?
Показать ответ
Ответить
Переходные металлы находятся между группами 3-12 в периодической таблице.
Показать вопрос
Вопрос
Чем интересна электронная конфигурация переходных металлов?
Показать ответ
Ответ
Интересным наблюдением является тот факт, что 4s-орбитали заполняются раньше, чем 3d-орбитали, поскольку последние имеют несколько более высокий уровень энергии.
Показать вопрос
Вопрос
В каком порядке переходные металлы теряют электроны из s- и d-подоболочек, чтобы образовать ионы переходных металлов?
Показать ответ
Ответить
Сначала они теряют электроны из s-подоболочки, а затем теряют из d-подоболочки.
Показать вопрос
Вопрос
Каковы некоторые характерные свойства переходных металлов?
Показать ответ
Ответить
Они образуют ионы с несколькими степенями окисления.
Образуют сложные ионы.
Образуют окрашенные соединения.
Они являются хорошими катализаторами.
Показать вопрос
Вопрос
Укажите общее использование меди.
Показать ответ
Ответ
Медь используется для изготовления водопроводных труб.
Показать вопрос
Вопрос
Назовите металл d-блока, который находится в жидком состоянии.
Показать ответ
Ответить
Ртуть (Hg)
Показать вопрос
Вопрос
Какое свойство характерно для переходных металлов?
Показать ответ
Ответить
Они образуют ионы разного цвета.
Показать вопрос
Вопрос
Какой из этих элементов является переходным?
Показать ответ
Ответ
Показать вопрос
Вопрос
Каковы некоторые характерные физические свойства переходных металлов?
Показать ответ
Ответить
Они металлические, хорошие проводники тепла и электричества, твердые, блестящие, с высоким MP, высоким BP.
Показать вопрос
Вопрос
Что такое переходный металл?
Показать ответ
Ответ
Переходные металлы — это элементы, образующие по крайней мере один стабильный ион с частично заполненной d-подоболочкой электронов.
Показать вопрос
Вопрос
Какие элементы строки 3 в d-блоке периодической таблицы НЕ ЯВЛЯЮТСЯ переходными металлами? Объясни свой ответ.
Показать ответ
Ответить
Скандий (Sc) и цинк (Zn). Это связано с тем, что ни один из их стабильных ионов не имеет частично заполненной d-подоболочки.
Показать вопрос
Вопрос
Почему некоторые переходные металлы проявляют магнитные свойства?
Показать ответ
Ответить
Они содержат неспаренные электроны в своей d-подоболочке. Это означает, что они обладают общим магнитным моментом.
Показать вопрос
Вопрос
Назовите пять физических свойств переходных металлов.
Показать ответ
Ответить
Например:
- Жесткий и сильный.
- Высокая плотность.
- Хорошая проводимость.
- Высокие температуры плавления и кипения.
- Блестящий и блестящий.
- Нерастворим в воде.
Показать вопрос
Вопрос
Каковы четыре характерных свойства переходных элементов?
Показать ответ
Ответ
1. Комплексообразование ионов
2. Образование окрашенных соединений
3. Переменные степени окисления
4. Каталитическая активность
Показать вопрос
Вопрос
Почему другие переходные элементы обладают свойствами, отличными от свойств других переходных металлов?
Показать ответ
Ответить
Переходные металлы имеют свойства, отличные от других элементов, из-за их частично заполненной d-подоболочки электронов.
Показать вопрос
Вопрос
Почему переходные металлы имеют различные степени окисления?
Показать ответ
Ответить
- Подоболочки d и s близки по энергетическому уровню.
- Для удаления лишних электронов с d-подоболочки не требуется много дополнительной энергии.
- Часто эта дополнительная энергия более чем компенсируется дополнительной энергией, высвобождаемой при образовании новых соединений.
- Таким образом, переходные металлы имеют несколько различных степеней окисления.
Показать вопрос
Вопрос
В чем разница между парамагнетиками и диамагнетиками?
Показать ответ
Ответ
На парамагнитные вещества действует магнитное поле из-за их неспаренных электронов, в то время как на диамагнитные частицы магнитное поле не действует, потому что все их электроны спарены.
Показать вопрос
Вопрос
Что такое комплексные соединения/ионы?
Показать ответ
Ответ
Комплексные соединения содержат центральный ион переходного металла, связанный с рядом ионов или нейтральных молекул дативными ковалентными связями.
Показать вопрос
Вопрос
Приведите пример каталитического использования переходного металла.
Показать ответ
Ответить
- Железо – используется в процессе Габера.
- Никель – используется для гидрирования алкенов.
- Катализаторы Циглера-Натта, содержащие титан или гафний, используемые для полимеризации углеводородов.
Показать вопрос
Вопрос
Почему переходные металлы образуют окрашенные соединения?
Показать ответ
Ответ
- Переходные металлы образуют окрашенные ионы и соединения благодаря частично заполненной d-подоболочке.
- Орбитали в d-подоболочке расщепляются на две группы с разными энергетическими уровнями в зависимости от наличия поблизости лигандов.
- Электроны могут прыгать с орбиталей с более низкой энергией на орбитали с более высокой энергией. При этом они поглощают видимый свет определенной длины волны.
- Результирующий свет, который мы видим, состоит из всех оставшихся длин волн, поэтому он имеет определенный цвет.

Показать вопрос
Вопрос
Переходные металлы имеют ____ температуры плавления и кипения.
Показать ответ
Ответ
Показать вопрос
Вопрос
Переходные металлы являются ____ проводниками тепла и электричества.
Показать ответ
Ответ
Показать вопрос
Вопрос
Переходные металлы ____ в воде.
Показать ответ
Ответ
Растворимый
Показать вопрос
Вопрос
Приведите пример использования переходного металла и объясните, почему его свойства делают его подходящим для данного конкретного применения.
Показать ответ
Ответить
Например:
- Медь используется в кастрюлях, потому что она твердая, прочная и хорошо проводит тепло.
- Золото используется в ювелирных изделиях, потому что оно прочное, блестящее и плохо вступает в реакцию с водой или кислородом.
- Латунь (сплав переходного металла) используется в штырях электрических вилок, потому что она твердая, прочная и хорошо проводит электричество.

- Кобальт используется в красках, потому что он окрашен.
Показать вопрос
Вопрос
Что такое катализатор?
Показать ответ
Ответ
Катализатор – это вещество, которое увеличивает скорость химической реакции без изменения химического состава или количества.
Показать вопрос
Вопрос
Что такое гетерогенный катализатор?
Показать ответ
Ответ
Гетерогенный катализатор находится в другой фазе, чем реагенты. Реакция происходит в активных центрах на поверхности катализатора.
Показать вопрос
Вопрос
Какой катализатор используется в процессе Габера?
Показать ответ
Ответить
Показать вопрос
Вопрос
Процессы Габера и Контакта являются примерами какого типа катализа?
Показать ответ
Ответ
Гетерогенный катализ
Показать вопрос
Вопрос
Каковы этапы теории поверхностной адсорбции?
Показать ответ
Ответить
- Адсорбция: реагенты прилипают к активным участкам поверхности катализатора.

- Реакция: реакция происходит, когда реагенты присоединены к активным центрам.
- Десорбция: продукты отделяются от поверхности катализатора.
Показать вопрос
Вопрос
Что такое гомогенный катализатор?
Показать ответ
Ответ
Гомогенный катализатор находится в той же фазе, что и реагенты.
Показать вопрос
Подробнее о переходных металлах
Откройте для себя подходящий контент для ваших тем
Не нужно обманывать, если у вас есть все необходимое для успеха! Упаковано в одно приложение!
Учебный план
Будьте идеально подготовлены вовремя с индивидуальным планом.
Тесты
Проверьте свои знания с помощью игровых тестов.
Карточки
Создавайте и находите карточки в рекордно короткие сроки.
Заметки
Создавайте красивые заметки быстрее, чем когда-либо прежде.
Учебные наборы
Все учебные материалы в одном месте.
Документы
Загружайте неограниченное количество документов и сохраняйте их в Интернете.
Study Analytics
Определите сильные и слабые стороны вашего исследования.
Еженедельные цели
Ставьте индивидуальные учебные цели и зарабатывайте баллы за их достижение.
Умные напоминания
Хватит откладывать на потом наши напоминания об учебе.
Награды
Зарабатывайте очки, открывайте значки и повышайте уровень во время учебы.
Волшебный маркер
Создавайте карточки в заметках полностью автоматически.
Умное форматирование
Создавайте самые красивые учебные материалы, используя наши шаблоны.
терминология – Сколько существует переходных элементов?
Спросил
Изменено 1 год, 2 месяца назад
Просмотрено 2к раз
$\begingroup$
Я искал в Интернете, и большинство сайтов говорят, что существует 38 переходных металлов. Но в нашем учебнике сказано, что группа 12 или группа цинка не могут считаться переходными металлами, что уже приводит к числу 37.
Более того, Sc, La и Ac также не могут считаться переходными металлами. Таким образом, получается число 34. Y, находящийся в той же группе, что и Sc, также следует исключить из числа переходных металлов, что дает число 33.
Это все мои мысли, не подтвержденные никакими надежными источниками. А также он основан на нашем учебнике. Я хотел бы знать, что не так с этими мыслями.
Примечание : В книге торий рассматривается как блочный элемент. Таким образом, согласно книге число элементов блока d равно 41. $\endgroup$
5
$\begingroup$
Шекспир, по-видимому, сказал: «Что в имени? То, что мы называем розой, любым другим словом пахло бы так же сладко». Правило № 1. Не доверяйте Интернету до тех пор, пока у вас не появится представление о полномочиях веб-сайта (а это приходит с опытом).
Использование термина переходный металл не что иное, как историческое. Вы можете придерживаться определения IUPAC (https://goldbook.iupac.org/terms/view/T06456)
Элемент, атом которого имеет неполную d-подоболочку или который может давать катионы с неполной d-подоболочкой.
При этом цинк не должен быть переходным элементом. Определение не имеет ничего общего со спаренными электронами, как вы написали в комментариях.
Посмотрите на историю слова, это из 18 века из полного OED.
переходной элемент №. Химия [от русского perexodnyj element (см. переходный элемент n. в переходном прил. и n. Соединения)] (первоначально, теперь исторический) любой из девяти металлических элементов, образующих группу VIII периодической таблицы Менделеева; (теперь) любой из большого класса металлических элементов, занимающих центральный блок периодической таблицы (группы IVb–VIII, Ib и IIb, или 4–12, d-блок), которые характеризуются частично заполненными d-орбитали обычно демонстрируют переменную валентность и способность образовывать координационные соединения, а также образовывать множество окрашенных соединений; часто расширяется, чтобы включить также элементы, имеющие частично заполненные f-орбитали (лантаноиды и актиноиды).
$\endgroup$
2
$\begingroup$
Прежде всего, элементы d-блока и переходные элементы являются двумя разными объектами. Эти термины становятся не заменяемыми, когда вы начинаете использовать текущее определение переходного элемента IUPAC (см. Ответ М. Фарука).
Старые учебники включали весь d-блок, включая элементы группы 12, в когорту переходных элементов, потому что исторически название «переход» относилось к общему химические свойства находятся между свойствами элементов из s- и p-блоков, при этом игнорируя лантаноиды и актиноиды.
Эти термины становятся не заменяемыми, когда вы начинаете использовать текущее определение переходного элемента IUPAC (см. Ответ М. Фарука).
Старые учебники включали весь d-блок, включая элементы группы 12, в когорту переходных элементов, потому что исторически название «переход» относилось к общему химические свойства находятся между свойствами элементов из s- и p-блоков, при этом игнорируя лантаноиды и актиноиды.
Я думаю, что нашел довольно строгое, но простое определение, которое также соответствует определению IUPAC и позволяет на самом деле считать переходные элементы [1, с. 1357]:
переходной элемент . (переходный металл). Любой из ряда элементов, у которых заполнение самой внешней оболочки до восьми электронов в течение периода прерывается, чтобы довести предпоследнюю оболочку с 8 до 18 или 32 электронов. Только эти элементы могут использовать предпоследние орбитали оболочки, а также самые внешние орбитали оболочки при связывании.
Все остальные элементы, называемые элементами «большой группы», могут использовать для связи только самые внешние орбитали оболочки. Переходные элементы включают элементы с 21 по 29.(скандий через медь), с 39 по 47 (иттербий через серебро), с 57 по 79 (лантан через золото) и все известные элементы с 89 (актиний) и далее. Все металлы. Многие из них известны тем, что проявляют различные степени окисления и образуют множество сложных ионов, а также обладают чрезвычайно ценными свойствами. в металлическом состоянии.
Следуя этому определению, существует девять переходных элементов в 3d-серии, девять в 4d-серии, 23 в 5d-серии (включая лантаноиды, внутренние переходные элементы) и [в настоящее время] 30 в 6d-серии (при наличии 118 элементов, а оганесон — самый тяжелый из известных элементов), всего 71 переходные элементы (2021):
Адаптировано из Периодической таблицы, не выделено.svg Crossover1370
Строго говоря, мало что известно об электронной конфигурации элементов с $Z > 108,$, поэтому точное количество переходных элементов, вероятно, будет считаться смелым шагом в обозримом будущем.
Ссылка
- Краткий химический словарь Хоули , 16-е изд.; Ларраньяга, М.Д., Льюис, Р.Дж., Льюис, Р.А., Хоули, Г.Г., ред.; John Wiley & Sons, Inc.: Хобокен, Нью-Джерси, 2016 . ISBN 978-1-118-13515-0.
$\endgroup$
3
$\begingroup$
Термин «переход» имеет геометрическое происхождение. Периодическая таблица содержит большие и малые столбцы. Большие столбцы имеют номера $1$, $2, 13, 14$ и т. д. Маленькие столбцы имеют номера от $3$ до $12$, и все они расположены в «переходной» зоне между большие столбцы $2$ и $13$. Поэтому $\ce{Zn}$ и остальные элементы столбца $12$ называются переходными элементами.
$\endgroup$
Твой ответ
Зарегистрируйтесь или войдите в систему
Зарегистрируйтесь с помощью Google
Зарегистрироваться через Facebook
Зарегистрируйтесь, используя адрес электронной почты и пароль
Опубликовать как гость
Электронная почта
Требуется, но не отображается
Опубликовать как гость
Электронная почта
Требуется, но не отображается
Нажимая «Опубликовать свой ответ», вы соглашаетесь с нашими условиями обслуживания, политикой конфиденциальности и политикой использования файлов cookie
.
Переходные металлы – элементы, определение, список, свойства
Что такое переходные металлы?
Переходные металлы или Переходные элементы в периодической таблице представляют собой химические элементы d-блока, лежащие между элементами p- и s-блока. Эти элементы либо в их атомарном состоянии, либо в любой их общей степени окисления или состоянии имеют частично заполненную (n-1)d-орбиталь.
Электронная конфигурация валентной оболочки элементов d-блока или переходных металлов,
(n−1)d от 1 до 10 нс 0, 1, 2
Элементы f-блока (лантаниды или редкоземельные элементы и актиноиды) в периодической таблице называются внутренними переходными металлами. Их называют внутренними переходными металлами, потому что дополнительный электрон входит в (n−2)f-орбитали.
Переходные металлы периодической таблицы
Согласно определению переходных металлов, медь, серебро и золото должны быть исключены из элементов d-блока периодической таблицы. Поскольку эти элементы не имеют частично заполненных d-орбиталей в их атомной или обычной степени окисления.
Поскольку эти элементы не имеют частично заполненных d-орбиталей в их атомной или обычной степени окисления.
Точно так же цинк, кадмий, ртуть и палладий не содержат частично заполненных d-орбиталей в их атомной или обычной степени окисления +2.
Из-за схожих свойств и для обеспечения рациональной классификации эти элементы обычно изучаются с d-блоками или переходными металлами.
Электронная конфигурация переходных элементов
Все переходные элементы или элементы d-блока подразделяются на четыре серии, такие как 3d, 4d, 5d и 6d. Каждая серия 3d, 4d, 5d и 6d состоит из десяти химических элементов.
Электронная конфигурация общей валентной оболочки переходных элементов,
(n-1)d от 1 до 10 ns 0, 1, 2
| Переходной элемент | Символ | Атомный номер | Электронная конфигурация |
| Скандий | Sc | 21 | [Ар] 3d 1 4s 2 |
| Титан | Ти | 22 | [Ar] 3d 2 4s 2 |
| Ванадий | В | 23 | [Ar] 3d 3 4s 2 |
| Хром | Кр | 24 | [Ar] 3d 5 4s 1 |
| Марганец | Мн | 25 | [Ар] 3d 5 4s 2 |
| Железо | Фе | 26 | [Ar] 3d 6 4s 2 |
| Кобальт | Со | 27 | [Ar] 3d 7 4s 2 |
| Никель | Ni | 28 | [Ar] 3d 8 4s 2 |
| Медь | Медь | 29 | [Ар] 3д 10 4 с 1 |
| Цинк | Цинк | 30 | [Ar] 3d 10 4s 2 |
| Переходной элемент | Символ | Атомный номер | Электронная конфигурация |
| Иттрий | Д | 39 | [Кр] 4d 1 5s 2 |
| Зерконий | Зр | 40 | [Кр] 4d 2 5s 2 |
| Ниобий | № | 41 | [Кр] 4d 4 5s 1 |
| Молибден | Пн | 42 | [Кр] 4d 5 5s 1 |
| Технеций | Тк | 43 | [Кр] 4d 5 5s 2 |
| Рутений | Ру | 44 | [Кр] 3d 7 5s 1 |
| Родий | Rh | 45 | [Кр] 3d 7 4s 2 |
| Палладий | Пд | 46 | [Кр] 4d 10 5s 0 |
| Серебро | Аг | 47 | [Кр] 4d 10 5s 1 |
| Кадмий | CD | 48 | [Кр] 4d 10 5s 2 |
| Переходной элемент | Символ | Атомный номер | Электронная конфигурация |
| Лантан | Ла | 57 | [Xe] 4f 0 5d 1 6s 2 |
| Гафний | Хф | 72 | [Xe] 4f 14 5d 2 6s 2 |
| Тантал | Та | 73 | [Xe] 4f 14 5d 3 6s 2 |
| Вольфрам | Вт | 74 | [Xe] 4f 14 5d 4 6s 2 |
| Рений | Ре | 75 | [Xe] 4f 14 5d 5 6s 2 |
| Осмий | ОС | 76 | [Xe] 4f 14 5d 6 6s 2 |
| Иридий | Ир | 77 | [Xe] 4f 14 5d 7 6s 2 |
| Платина | Пт | 78 | [Xe] 4f 14 5d 9 6s 1 |
| Золото | Золото | 79 | [Xe] 4f 14 5d 10 6s 1 |
| Меркурий | рт. ст. ст. | 80 | [Xe] 4f 14 5d 10 6s 2 |
| Переходной элемент | Символ | Атомный номер | Электронная конфигурация |
| Актиний | Ас | 89 | [Rn] 5f 0 6d 1 7s 2 |
| Резерфордий | Рф | 104 | [Rn] 5f 14 6d 2 7s 2 |
| Дубниум | Дб | 105 | [Rn] 5f 14 6d 3 7s 2 |
| Сиборгиум | Сг | 106 | [Rn] 5f 14 6d 4 7s 2 |
| Борий | Бх | 107 | [Rn] 5f 14 6d 5 7s 2 |
| Хассиум | Гс | 108 | [Rn] 5f 14 6d 6 7s 2 |
| Мейтнерий | Мт | 109 | [Rn] 5f 14 6d 7 7s 2 |
| Дармштадтиум | Дс | 110 | [Rn] 5f 14 6d 8 7s 2 |
| Рентгений | Рг | 111 | [Rn] 5f 14 6d 9 7s 2 |
| Коперниций | Сп | 112 | [Rn] 5f 14 6d 10 7s 2 |
Свойства переходных элементов
Свойства переходных элементов данного периода не так сильно отличаются друг от друга. Причина этого факта кроется в электронной конфигурации переходных элементов.
Причина этого факта кроется в электронной конфигурации переходных элементов.
Общая электронная конфигурация переходных металлов отличается друг от друга только числом электронов на d-орбитали. Количество электронов на самой внешней оболочке неизменно равно 0, 1 или 2.
Металлический характер переходных элементов
Все переходные элементы являются металлами из-за небольшого числа электронов в самой внешней квантовой оболочке. Они твердые, податливые и пластичные. Они образовали все четыре типа кристаллических тел, такие как гранецентрированная кубическая, гексагональная закрытая упаковка, объемно-центрированная кубическая и гранецентрированная кубическая кристаллическая решетка.
Металлические и ковалентные связи существуют в атомах переходных металлов. Из-за наличия неполной d-орбитали большинство переходных металлов соединяются с другими элементами ковалентной химической связью. Эти металлы являются хорошими проводниками тепла и электричества.
Тенденции изменения температуры плавления переходных металлов
Переходные элементы имеют очень высокие температуры плавления и кипения по сравнению с элементами s- и p-блока.
Металлы цинк, кадмий и ртуть имеют относительно низкие значения из-за полностью заполненных d-орбиталей. Для ковалентной связи между атомами цинка, кадмия и ртути отсутствуют неспаренные электроны.
Другой переходный металл содержит не полностью заполненную d-орбиталь для ковалентной связи.
Атомные и ионные радиусы переходных элементов
Атомный и ионный радиусы обычно уменьшаются при движении слева направо в периоде. Это связано с тем, что увеличение заряда ядра имеет тенденцию притягивать электронные облака к ядру атома.
Атомные радиусы хрома к меди очень близки друг к другу. За счет одновременного добавления экранирующего электрона к 3d-уровню происходит обратное воздействие на внешние 4s-электроны. Ионные радиусы ионов M +2 и M +3 следуют той же тенденции, что и атомные радиусы.
Энергия ионизации переходных металлов
Первая энергия ионизации переходных металлов лежит между значениями элементов s- и p-блока. Первые значения энергии ионизации лежат в пределах от 5 до 10 электрон-вольт.
Первые значения энергии ионизации лежат в пределах от 5 до 10 электрон-вольт.
В случае переходных металлов добавление дополнительных экранирующих электронов экранирует или уменьшает внутреннее притяжение положительного ядра и ns-электронов. Эффекты увеличения заряда ядра и эффекты экранирования противодействуют друг другу.
За счет этих встречных эффектов потенциалы ионизации медленно возрастают при движении в периоде первой переходной серии.
- Из рисунка выше ясно видно, что первая энергия ионизации Ti, V и Cr немного отличается друг от друга. Точно так же значения Fe, Co, Ni и Cu довольно близки друг к другу.
- Видно, что вторая энергия ионизации более или менее регулярно увеличивается с увеличением атомного номера d-блока или переходных элементов. Значения второй энергии ионизации хрома и меди выше, чем у соседних переходных металлов из-за дополнительной стабильности Cu + и Cr + ион.
Степень окисления переходных металлов
Одним из наиболее важных свойств, отличающих переходные металлы от непереходных элементов, является переменная степень окисления или степень окисления.



 Поэтому если определение переходного элемента предусматривает расположение очередного электрона во внутренней оболочке, то металлы подгрупп IB и IIB не являются ни переходными, ни непереходными элементами. Но поскольку они обладают многими свойствами, общими со свойствами переходных элементов, то их в этом разделе относят к переходным элементам.
Поэтому если определение переходного элемента предусматривает расположение очередного электрона во внутренней оболочке, то металлы подгрупп IB и IIB не являются ни переходными, ни непереходными элементами. Но поскольку они обладают многими свойствами, общими со свойствами переходных элементов, то их в этом разделе относят к переходным элементам. е. на внутренней оболочке, что приводит к некоторому уменьшению радиуса атома, или сжатию с увеличением атомного номера. На основании этого эффекта можно объяснить многие периодические изменения свойств.
е. на внутренней оболочке, что приводит к некоторому уменьшению радиуса атома, или сжатию с увеличением атомного номера. На основании этого эффекта можно объяснить многие периодические изменения свойств. Атомы и ионы, которые имеют такие подвижные электроны, обычно хорошо окрашены, так как энергии света достаточно для перескока электронов. Поэтому многие ионы переходных элементов окрашены и образуют окрашенные соединения.
Атомы и ионы, которые имеют такие подвижные электроны, обычно хорошо окрашены, так как энергии света достаточно для перескока электронов. Поэтому многие ионы переходных элементов окрашены и образуют окрашенные соединения. Для всех переходных элементов (кроме свободных металлов подгрупп IB и IIB) внутренний уровень (n 1 или n 2) будет иметь такие неспаренные электроны. Благодаря этим электронам атом или ион “втягивается” электромагнитным полем, т.е. обладает парамагнетизмом. Атом или ион, имеющий спаренные электроны, “выталкивается” электромагнитным полем, и такое свойство называется диамагнетизмом. У некоторых переходных металлов, например у Fe из подгруппы VIIIВ, парамагнетизм выражен очень сильно и его принято называть ферромагнетизмом.
Для всех переходных элементов (кроме свободных металлов подгрупп IB и IIB) внутренний уровень (n 1 или n 2) будет иметь такие неспаренные электроны. Благодаря этим электронам атом или ион “втягивается” электромагнитным полем, т.е. обладает парамагнетизмом. Атом или ион, имеющий спаренные электроны, “выталкивается” электромагнитным полем, и такое свойство называется диамагнетизмом. У некоторых переходных металлов, например у Fe из подгруппы VIIIВ, парамагнетизм выражен очень сильно и его принято называть ферромагнетизмом. Порядок их рассмотрения основан на общем правиле классификации элементов, начиная с подгруппы IIIB, а подгруппы IB и IIB рассматриваются в конце как последние члены 1-го, 2-го и 3-го рядов переходных металлов. Последняя, внутренняя серия 4-го ряда переходных металлов актиноиды или трансурановые элементы рассматривается отдельно.
Порядок их рассмотрения основан на общем правиле классификации элементов, начиная с подгруппы IIIB, а подгруппы IB и IIB рассматриваются в конце как последние члены 1-го, 2-го и 3-го рядов переходных металлов. Последняя, внутренняя серия 4-го ряда переходных металлов актиноиды или трансурановые элементы рассматривается отдельно.
 Например:
Например:




 Pure Appl. Chem. ИЮПАК . 60 (3): 431–436. 1988. doi: 10.1351/pac198860030431
Pure Appl. Chem. ИЮПАК . 60 (3): 431–436. 1988. doi: 10.1351/pac198860030431