Периодическая система химических элементов … у нас дома
В XIII веке человеку были известны лишь девять химических элементов: семь металлов – золото, серебро, медь, олово, железо, свинец и ртуть, а также два неметаллы – сера и углерод. После этого пятьсот лет длился период алхимии, и за эти годы как побочные продукты интенсивных алхимических поисков были выделены еще пять химических элементов: мышьяк, сурьма, цинк, висмут и фосфор.
В первой половине XVIII века было открыто платину, кобальт и никель. Таким образом, двести пятьдесят лет назад человечеству было известно лишь 17 химических элементов.
1 марта 1869 г. Дмитрий Иванович Менделеев (1834-1907) опубликовал таблицу “Попытка системы элементов, основанной на их атомном весе и химическом сходстве», в которой было чуть больше шести десятков элементов. Через два года, в 1871 году, существенно развив представление о периодах и группах элементов и о месте элемента в системе, ученый назвал эту систему периодической.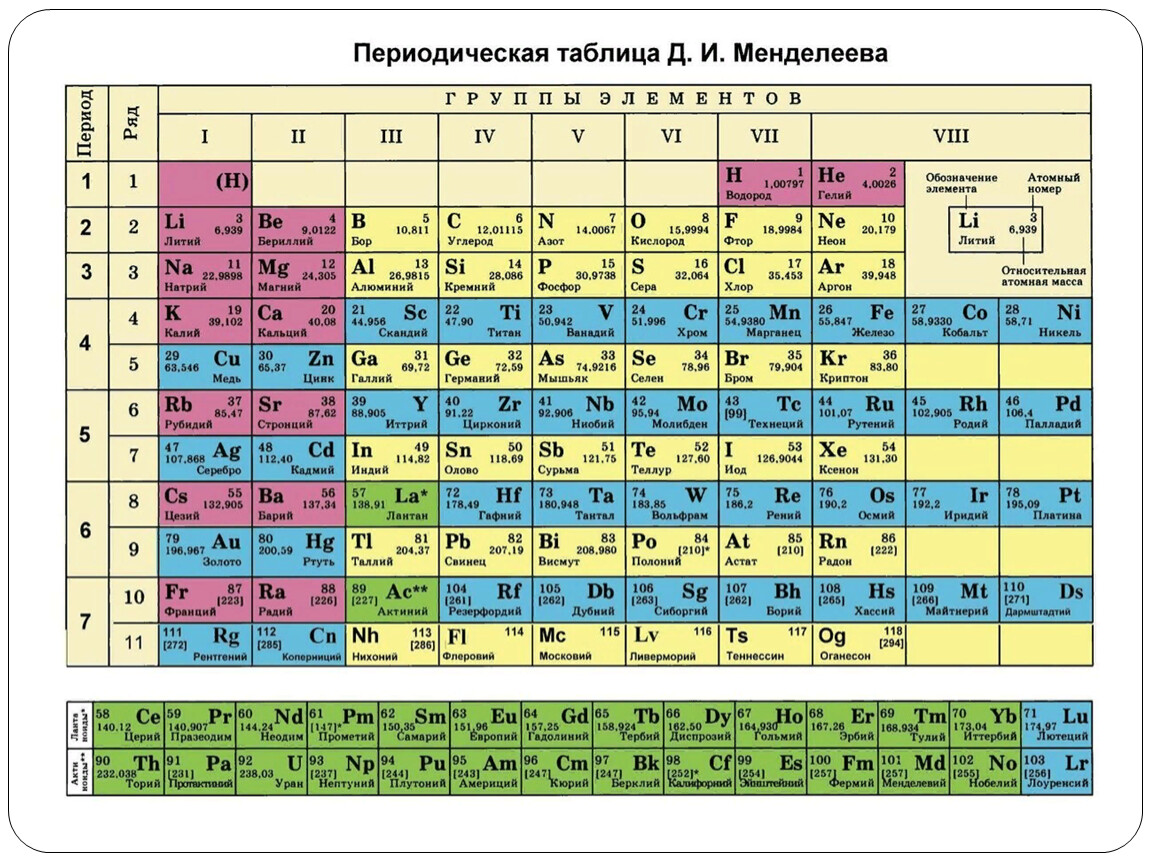
В настоящее время известны 112 (по другим данным 114) химических элементов, которые прочно “закрепили” свое место в периодической системе Д.И.Менделеева, без которой невозможно представить ни один химический класс в школе или химическую лабораторию в институте и университете (при этом элементы, начиная с сто десятого, еще не получили постоянных имен).
Я, наверное, не ошибусь, если скажу, что каждый из нас, впервые войдя в школьный кабинет химии, был потрясен: многочисленные банки, колбы, пробирки на полках, столах и в шкафах, растворы, порошки и кристаллы всех цветов и оттенков, непонятные надписи и формулы, совсем не похожи на математические … Затем мы стали ориентироваться в этом разнообразии и с удивлением узнали, что и мы сами, и все, что нас окружает, состоит всего из девяти десятков химических элементов, огромное количество которых как в чистом виде, так и в химических соединениях и была скрыта в этих стеклянных сосудах химкабинета
Начнем с первого и легкого – водорода.
Второй элемент, который входит в состав воды, роль которого в нашем существовании не меньшая чем водород, а может даже и большая, это кислород. Попробуйте задержать дыхание и несколько десятков секунд обойтись без одной пятой части атмосферного воздуха. Попробовали? То-то! Ни вкуса, ни запаха кислород не имеет, однако ценность его от этого не уменьшается. Кстати, о запахе – когда после грозы мы вдыхаем свежий воздух, то с удовольствием ощущаем своеобразный запах одной из модификаций кислорода – озона.
Вместе с кислородом с воздухом в наши легкие попадает и азот. Правда, в отличие от кислорода, он почти в них не задерживается. Однако огромное количество азота в наш организм попадает с пищей в составе белков. А какую помощь нам иногда может предоставить одна из составляющих нашей медицинской аптечки – нашатырь, состоящий из азота, водорода и кислорода!
Однако огромное количество азота в наш организм попадает с пищей в составе белков. А какую помощь нам иногда может предоставить одна из составляющих нашей медицинской аптечки – нашатырь, состоящий из азота, водорода и кислорода!
Еще два элемента – фтор и хлор – у нас дома только в виде безвредных соединений. Оба они в соединении с углеродом в виде хладона круглосуточно охлаждают продукты и напитки в нашем холодильнике, а также “помогают” косметическим средствам и лакокрасочным материалам под давлением “покидать” аэрозольные баллончики. Немалую роль играет фтор и в нашей ежедневной борьбе с кариесом. Ну а сколько мы поглощаем хлора с поваренной солью!
Если вспомнили о фторе и хлоре, то нельзя не остановиться и на других галогенах – йоде и броме. С йодом (правда в виде спиртового раствора) наши поцарапанные коленки знакомы с детства, ну а бром в очень малом количестве присутствует в упомянутой уже кухонной соли. Кроме того, в составе бромида серебра этот элемент применяют в фотографии, а растворы бромида натрия и калия – как успокаивающие средства.
Среди газов нашей таблицы остались еще так называемые инертные: гелий, неон, аргон, криптон, ксенон и радон. Все они в воздухе, которым мы дышим. Мощный поток света фотовспышки при фотографировании обеспечивает ксенон, а если посмотреть в окно, то можно увидеть цветные буквы рекламных надписей на магазинах и кафе – это “работа” неона (кстати, зеленый цвет этим газоразрядным лампам предоставляют галогениды талию).
В упомянутых лампах-вспышках применяются также рений и гафний. Именно гафниевая фольга формирует направленный поток яркого света.
Остановимся далее подробнее на металлах.
Щелочные металлы – литий, натрий, калий, рубидий и цезий – мгновенно реагируют с кислородом воздуха и поэтому могут присутствовать в нашем доме только в виде соединений. Если в вашей семье есть курильщики или автомобилисты, то с литием нет проблем: соли лития в достаточном количестве содержатся в табаке и в электролите щелочного аккумулятора. Литий входит также в состав стекла телевизионных кинескопов. Натрием (вместе с хлором) в виде поваренной соли мы солим нашу еду, а калий, если вы собственноручно будете заниматься не только фотографированием, но и печатью фотографий, обязательно в виде поташа – карбоната калия – будет в вашем хозяйстве. Кроме того, калий присутствует в составе хрустального стекла, ну а натрий – оконного. Если в вашей “избушке” есть что охранять, то очень вероятно, что в фотоэлементах датчиков движения охранной системы присутствуют рубидий или цезий.
Натрием (вместе с хлором) в виде поваренной соли мы солим нашу еду, а калий, если вы собственноручно будете заниматься не только фотографированием, но и печатью фотографий, обязательно в виде поташа – карбоната калия – будет в вашем хозяйстве. Кроме того, калий присутствует в составе хрустального стекла, ну а натрий – оконного. Если в вашей “избушке” есть что охранять, то очень вероятно, что в фотоэлементах датчиков движения охранной системы присутствуют рубидий или цезий.
Алюминий, этот “крылатый” металл, и медь, может и незаметно для нашего глаза, опутывают нас со всех сторон: стены и потолки, пылесос и электробритва, холодильник и стиральная машина – везде эти металлы присутствуют в виде проводов. Алюминий позволяет нам также видеть себя в зеркале: тончайшая пленка этого металла нанесена на обратной стороне зеркального стекла. Ранее с этой целью применяли серебро (сейчас тоже изготавливают “серебряные” зеркала, но они дороже чем “алюминиевые”). Рассматривая черно-белые фотографии, многие из нас и не догадываются, что в их состав входит металлическое серебро.
Среди ювелирных изделий особое место занимает кольцо, которое обычно изготавливают из сплавов на основе золота. Кроме того, золотом и серебром покрывают наиболее ответственные контакты микросхем, входящие в состав радиоприемников, телевизоров, компьютеров …
Гораздо реже среди ювелирных изделий встречаются платиновые. Но если ваши родные имели особые заслуги перед когда-то великой державой, занимавшей шестую часть суши планеты, то среди их наград случайно могут “отыскаться” ордена, которые содержат этот металл (например, орден Ленина). Также в ювелирном деле ограниченно используется родий (обычно в сплавах с платиной).
Особенно заслуженный металл – железо. К сожалению, “благодаря” его “любви” к кислороду воздуха, железо вокруг нас присутствует только в сплаве с другими элементами. Стальная и чугунная посуда, мебельная фурнитура, слесарный и столярный инструмент … Хотя сегодня и пытаются заменить железо различными пластмассами, с полной уверенностью можно сказать, что этот металл еще не одно десятилетие будет основой нашего “железного” века.
Если заглянуть на кухню, то первое, что бросается в глаза, – это блестящая посуда. Значительная ее часть изготовлена из корозиеустойчивой стали (“нержавейки”), в состав которой обычно входит не только хром и никель, но и такой “космический” металл, как титан. Титан, кроме того, содержится и в распространенных титановых белилах, которым окрашены рамы наших окон. Хром и никель также придают привлекательный вид металлическим деталям велосипеда, что стоит в прихожей или на балконе.
А загляните в инструментальный ящик! На первый взгляд здесь все из обычной стали, однако практически в каждом сверле содержится вольфрам и молибден, гаечных комбинированных ключах – хром и ванадий, а в полотне слесарной ножовки – и хром, и вольфрам, и ванадий.
Если у вас сохранился транзисторный приемник, то в его триодах можно найти индий и селен. Основу же “мозга” современных “умных” помощников – электробытовых приборов – составляют полупроводниковые материалы: кремний и германий, реже галлий. Но несмотря на широкое наступление интегральных схем, даже специалисты сегодня признают, что качественный звук воспроизводит аппаратура не в микросхемах, а почти забытых вакуумных радиолампах, “сетки” которых изготовлены из молибденовой проволоки. В составе деталей таких ламп могут быть также скандий, ниобий, тантал, стронций, вольфрам. Без последнего металла очень трудно представить себе электрическую лампу накаливания.
Но несмотря на широкое наступление интегральных схем, даже специалисты сегодня признают, что качественный звук воспроизводит аппаратура не в микросхемах, а почти забытых вакуумных радиолампах, “сетки” которых изготовлены из молибденовой проволоки. В составе деталей таких ламп могут быть также скандий, ниобий, тантал, стронций, вольфрам. Без последнего металла очень трудно представить себе электрическую лампу накаливания.
Кальция в чистом виде, в отличие от ртути, которая “спряталась” в медицинском термометре, в нашем доме не найдешь вследствие его высокой активности. Но посмотрите на белый потолок (если она у вас не заклеена обоями): побелка – это карбонат кальция.
Много лет назад металлический магний в виде порошка всегда был в арсенале фотографов: это именно он давал ослепительную вспышку, когда с объектива фотоаппарата “вылетала птичка”. А вот соединения магния, в частности сульфат или оксид, и сегодня можно найти в домашней аптечке благодаря их эффективной способности “освобождать” кишечный тракт от лишних веществ.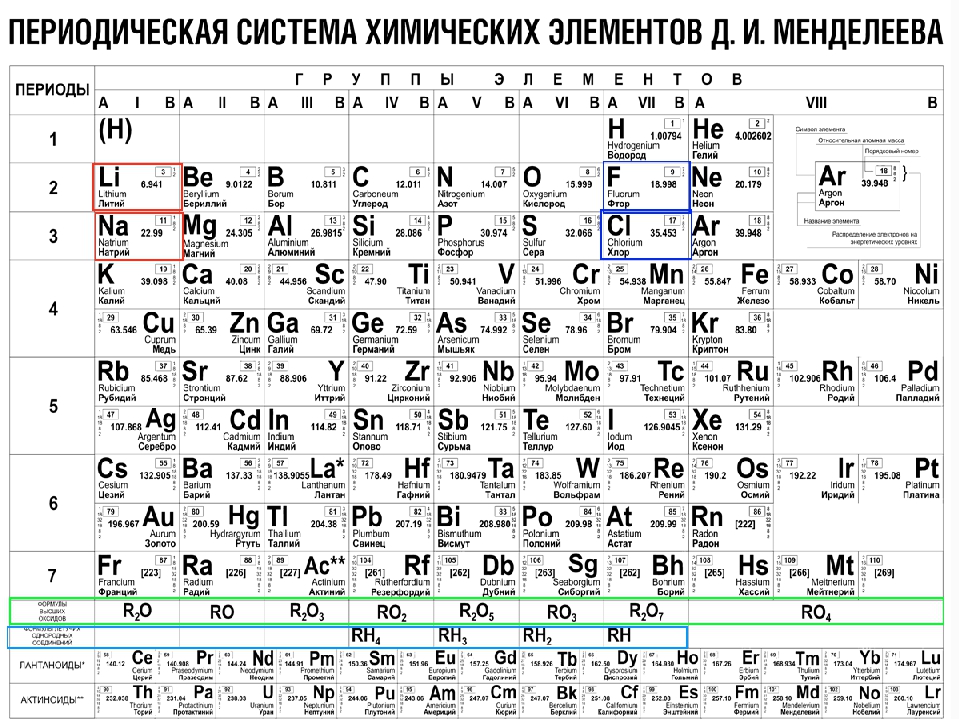
Невозможно дома найти и металлический барий, однако сульфат бария присутствует в фотобумаге, картоне, линолеуме, а возможно и в резине. Кстати, в резине велосипедной шины мы найдем и серу, но чаще всего с ней мы имеем дело, беря в руки спички. А вот фосфор входит в состав смеси, нанесенной на спичечный коробок. Если же вы пользуетесь не спичками, а зажигалкой, то в ее кремне “спрятался” церий.
Для того, чтобы избавиться от некоторых “домашних” животных, применяют различные яды: против тараканов – буру, в состав которой входит бор, а против крыс – мышьяк.
Углерод – основа жизни на нашей планете. Благодаря ему вы в курсе всех новостей: углерод входит в состав типографской краски. Наконец, попробуйте представить себе жизнь без карандаша, основу которого составляет его грифель, изготовленный из графита – аллотропного видоизменения углерода!
Олово вы найдете в белой жести консервной банки или в оловянном припое радиолюбителя, а свинец – в рыболовных грузилах или пластинах автомобильного аккумулятора (в этих пластинах используется и сурьма). Также как компонент припоя применяется висмут, а его оксиды – как антисептические лекарственные средства.
Также как компонент припоя применяется висмут, а его оксиды – как антисептические лекарственные средства.
Слушая свою любимую кассету или диск, мы должны быть благодарны цинку и кадмию, которые входят в состав элементов питания плеера (хотя сегодня ведущие фирмы пытаются изготавливать батарейки без соединений кадмия). Кадмий входит также в состав масляных красок, которые “играют” на картинах замечательным ярко-желтым цветом.
Бериллий входит в состав многих бронз, которые применяются в часовых механизмах, марганец можно найти в обычной “марганцовке” – перманганат калия, а ванадий – в деталях автомобиля и постоянных магнитах, которые можно “найти” в радиоприемнике и мебельных фиксаторах.
Оксид кобальта придает великолепный синий цвета узорам на фарфоровой посуде, а металлический кобальт входит в состав знаменитого сплава “победит”, который позволяет делать отверстия в любом бетоне.
Дождевые плащи и туристические палатки обязаны своей влагонепроницаемостью солям циркония, которые входят в состав эмульсий для пропитки тканей.
Палладий можно найти в виде сплава с платиной в катализаторах дожигания выхлопных газов автомобилей. Если же, не дай бог, вы потеряете один или несколько зубов, то можете воспользоваться довольно эффективным зубным протезом с палладиевого сплава.
А экзотические металлы можно найти в шарике обычной шариковой авторучки: осмий, иридий, рутений!
Активированный европием оксид иттрия – это красный люминофор для цветных экранов телевизоров и мониторов компьютеров. В состав стекла их кинескопов входит стронций, который с другими компонентами дарит нам неповторимые краски (недаром хлорид стронция применяется также и в косметике).
Кстати, еще до недавнего времени в доме можно было встретить обедненный уран (урановый усилитель в фотографии), торий (в виде нитрата тория для магниевых вспышек в фотографии) и даже радий (его соли заставляли светиться циферблаты старых часов).
Ну что, продолжать ?! Как видите, в нашем доме полно “представителей” одной из величайших таблиц человечества – периодической таблицы элементов. Но даже каждый из нас “состоит” из двадцати четырех химических элементов: водорода, кислорода, углерода, азота, калия, кальция, серы, железа, цинка, хлора, фосфора, йода, фтора, меди, кобальта, хрома, магния, молибдена, мышьяка, селена, ванадия, никеля, кремния и олова. Так что давайте не бояться химии или относиться к ней не с предубеждением, а благодарить ее за то разнообразие необходимых и просто приятных вещей, которые нас окружают!
Но даже каждый из нас “состоит” из двадцати четырех химических элементов: водорода, кислорода, углерода, азота, калия, кальция, серы, железа, цинка, хлора, фосфора, йода, фтора, меди, кобальта, хрома, магния, молибдена, мышьяка, селена, ванадия, никеля, кремния и олова. Так что давайте не бояться химии или относиться к ней не с предубеждением, а благодарить ее за то разнообразие необходимых и просто приятных вещей, которые нас окружают!
ХиМиК.ru – ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
ПЕРИОДИЧЕСКАЯ
СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ, упорядоченное множество хим. элементов,
их естеств. классификация, являющаяся табличным выражением периодического
закона Менделеева. Прообразом пе-риодич. системы хим. элементов
послужила таблица “Опыт системы элементов, основанной на их атомном весе и химическом
сходстве”, составленная Д. И. Менделеевым 1 марта 1869 (рис. 1). В послед. годы
ученый совершенствовал таблицу, развил представления о периодах и группах элементов
и о месте элемента в системе. В 1870 Менделеев назвал систему естественной,
а в 1871 периодической. В результате уже тогда периодическая система во многом приобрела совр.
структурные очертания. Опираясь на нее, Менделеев предсказал существование и
св-ва ок. 10 неизвестных элементов; эти прогнозы впоследствии подтвердились.
1). В послед. годы
ученый совершенствовал таблицу, развил представления о периодах и группах элементов
и о месте элемента в системе. В 1870 Менделеев назвал систему естественной,
а в 1871 периодической. В результате уже тогда периодическая система во многом приобрела совр.
структурные очертания. Опираясь на нее, Менделеев предсказал существование и
св-ва ок. 10 неизвестных элементов; эти прогнозы впоследствии подтвердились.
Рис. 1 Таблица “Опыт
системы элементов, основанной на их атомном весе и химическом сходстве”
(Д. И. Менделеев. I мирта 1869).
Однако на протяжении последующих
более 40 лет периодическая система в значит. степени представляла собой лишь эмпирич. обобщение
фактов, поскольку отсутствовало физ. объяснение причин периодич. изменения CB-B
элементов в зависимости от возрастания их атомной массы. Такое объяснение было
невозможно без обоснованных представлений о строении атома (см.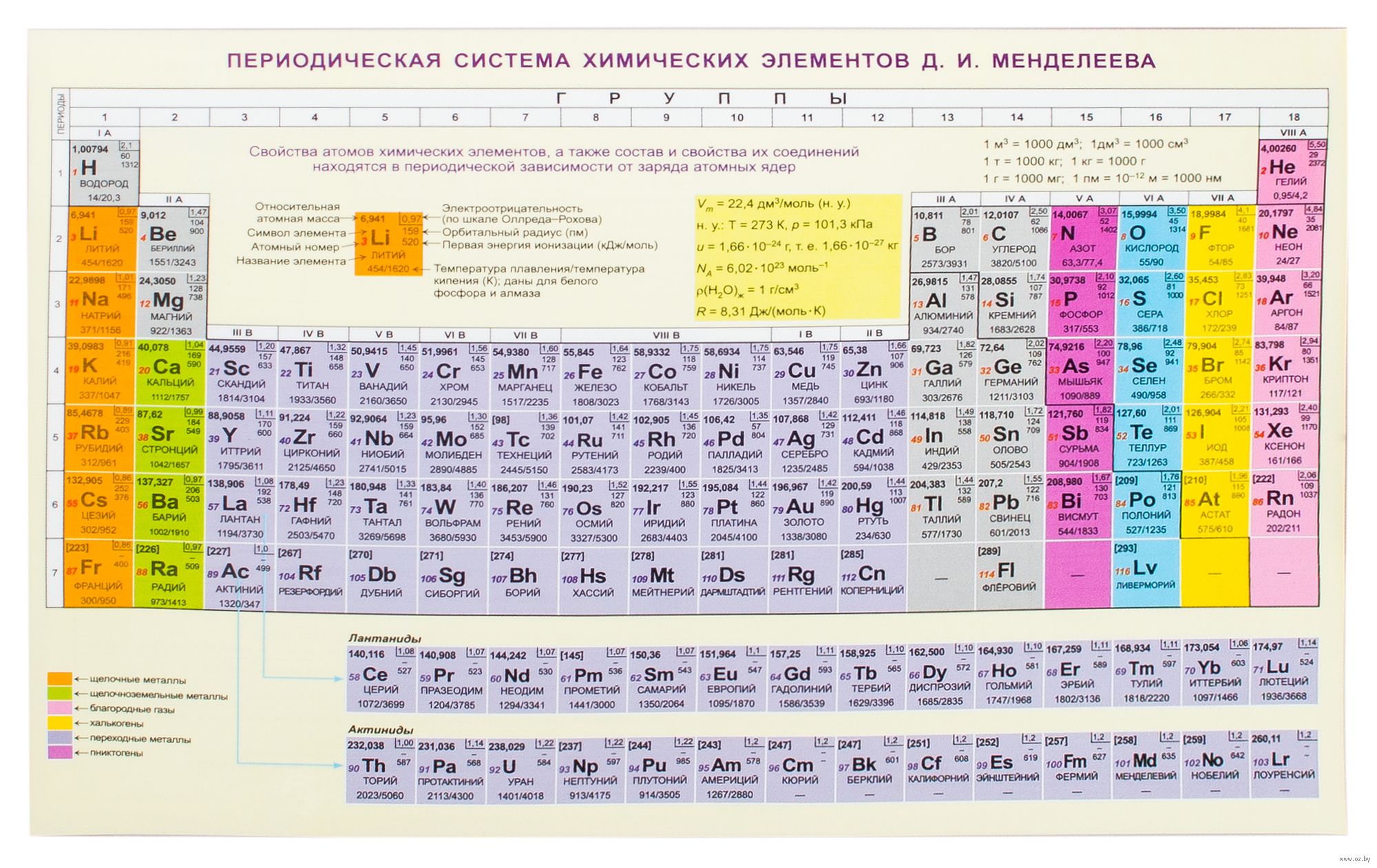 Атом).
Поэтому важнейшей вехой в развитии периодической системы стала планетарная (ядерная) модель
атома, предложенная Э. Резерфордом (1911). В 1913 А. ван ден Брук пришел к выводу,
что порядковый номер элемента в периодической системе численно равен положит. заряду (Z) ядра
его атома. Этот вывод был экспериментально подтвержден Г. Мозли (закон Мозли,
1913-14). В результате периодич. закон получил строгую физ. формулировку, удалось
однозначно определить ниж. границу периодической системы (H как элемент с миним. Z=1), оценить
точное число элементов между H и U и установить, какие элементы
еще не открыты (Z = 43, 61, 72, 75, 85, 87). Теория периодической системы была разработана в
нач. 1920-х гг. (см. ниже).
Атом).
Поэтому важнейшей вехой в развитии периодической системы стала планетарная (ядерная) модель
атома, предложенная Э. Резерфордом (1911). В 1913 А. ван ден Брук пришел к выводу,
что порядковый номер элемента в периодической системе численно равен положит. заряду (Z) ядра
его атома. Этот вывод был экспериментально подтвержден Г. Мозли (закон Мозли,
1913-14). В результате периодич. закон получил строгую физ. формулировку, удалось
однозначно определить ниж. границу периодической системы (H как элемент с миним. Z=1), оценить
точное число элементов между H и U и установить, какие элементы
еще не открыты (Z = 43, 61, 72, 75, 85, 87). Теория периодической системы была разработана в
нач. 1920-х гг. (см. ниже).
Таблице химических элементов могут официально присвоить имя Менделеева – Наука
МОСКВА, 5 февраля. /ТАСС/. Периодической системе химических элементов могут на мировом уровне официально присвоить имя Дмитрия Менделеева, предположительно, это случится 5 декабря в Японии. Об этом сообщил во вторник президент химического факультета МГУ академик Валерий Лунин на Всероссийском съезде учителей и преподавателей химии в Шуваловском корпусе МГУ в Москве.
Об этом сообщил во вторник президент химического факультета МГУ академик Валерий Лунин на Всероссийском съезде учителей и преподавателей химии в Шуваловском корпусе МГУ в Москве.
Несмотря на то, что в России “таблица Менделеева” – устоявшееся название, в мире это не закреплено официально.
2019 год провозглашен Генеральной ассамблеей ООН Международным годом Периодической таблицы химических элементов. Это масштабное событие посвящено 150-летию открытия Периодического закона химических элементов великим русским ученым Д. И. Менделеевым.
“Недавно прошедшая Церемония открытия [Международного года Периодической таблицы химических элементов] в Париже стала триумфом нашей науки, Дмитрия Ивановича Менделеева. 150 лет потребовалось, чтобы это случилось. Но когда я спросил президента американского химического общества [Бонни Чарпентье], а должно ли быть имя Менделеева присвоено таблице, она говорит: пока это тайна, и вы узнаете ответ, когда мы с вами увидимся 5 декабря в Японии. Я надеюсь, что 5 декабря это [присвоение имени] случится”, – сказал Лунин.
Я надеюсь, что 5 декабря это [присвоение имени] случится”, – сказал Лунин.
Всероссийский съезд преподавателей химии, посвященный Международному году таблицы Менделеева, проходит в Московском университете имени Ломоносова 5 февраля. В мероприятии принимают участие более 650 делегатов со всех регионов России. Перед участниками съезда выступают с научно-популярными докладами ведущие специалисты в самых передовых отраслях химии.
МГУ проводит съезд совместно с Ассоциацией учителей и преподавателей химии при поддержке Благотворительного фонда Андрея Мельниченко, Минпросвещения РФ, Минобрнауки, Министерства промышленности и торговли Российской Федерации, Российской академии наук, Российской академии образования, Российского союза химиков, корпорации “Российский учебник”, Российского химического общества имени Д. И. Менделеева.
Академик Александр Сергеев: сомнений в первенстве Менделеева нет
Россия хочет добиться официального присвоения Периодической
таблице элементов имени Дмитрия Ивановича Менделеева. Об этом сообщил
президент Российской Академии наук Александр Сергеев в ходе лекции,
которую он прочитал на молодёжной площадке Восточного экономического
форума.
Об этом сообщил
президент Российской Академии наук Александр Сергеев в ходе лекции,
которую он прочитал на молодёжной площадке Восточного экономического
форума.
В нашей стране все привыкли называть Периодическую систему химических элементов таблицей Менделеева. К сожалению, в остальном мире это не так. В ходе празднования 150-летия этого величайшего изобретения, которое отмечается во всём мире как Международный год Периодической таблицы химических элементов, Россия будет прилагать все усилия, чтобы восстановить справедливость.
Глава РАН рассказал о том, какова в современном мире роль Периодической системы, открытой полтора века назад, какие научные теории существовали до Менделеева, что привело учёного к гениальному открытию и скоро ли появятся в таблице Менделеева новые элементы. Подробности – в материале profiok.com.Открытия не появляются на пустом месте
«Всё, что существует вокруг нас, всё то, что есть в нас и что есть мы, – это химические элементы, – отметил Александр Сергеев. – Поэтому открытие
того, из чего состоит мир, – это величайшее научное открытие в истории
человечества».
– Поэтому открытие
того, из чего состоит мир, – это величайшее научное открытие в истории
человечества».При этом важно понимать, что в науке ничего нельзя изобрести «с чистого листа», не опираясь на уже существующие знания и не взаимодействуя с другими учёными.
«У нас есть поговорка: не успеешь что-то открыть, как тут же набегут предшественники», – поделился с залом глава РАН. Дело в том, что открытия никогда не появляются на пустом месте, и когда учёный что-то изобретает, всегда можно убедиться, что близкие мысли были высказаны до него или практически одновременно.
О том, из чего состоит мир, человечество стало задумываться как минимум со времён античности. Тогда окружающий мир предлагалось разложить на основные компоненты в виде воды, воздуха, огня и земли. В V веке до нашей эры Демокрит предложил «атомистическую» теорию, предположив, что существует некая неделимая единица материи.
Строению
материи были посвящены труды многих учёных. В XVII веке этой проблемой
глубоко занимался Роберт Бойль, в XVIII веке – Антуан Лоран Лавуазье,
разделивший химические элементы на несколько типов.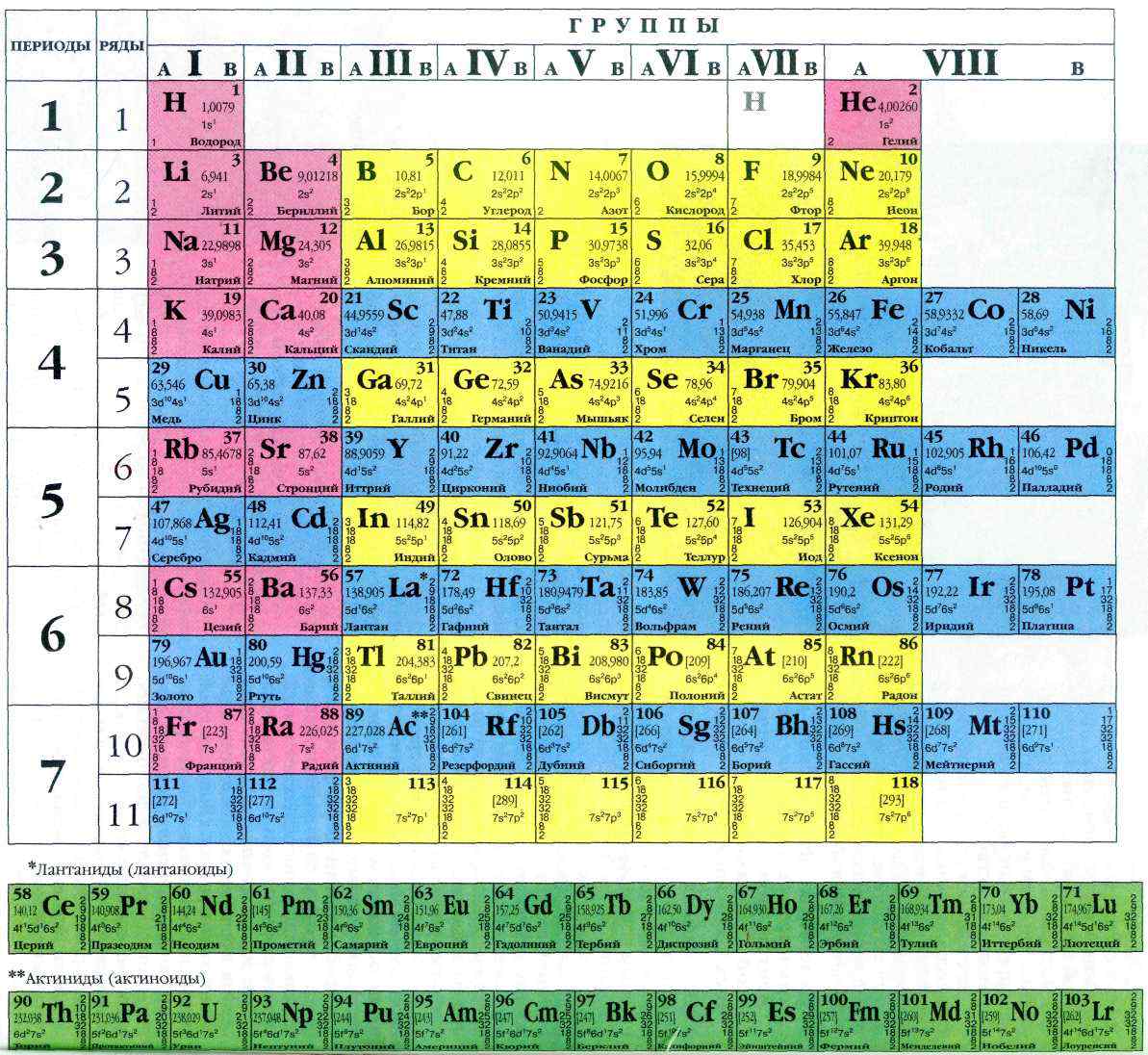 Шведский учёный Йёнс
Якоб Берцелиус ввёл обозначения химических элементов, которые
используются до сих пор (поэтому в Швеции считают, что Периодическая таблица элементов должна носить имя Берцелиуса – прим. profiok.com).
Шведский учёный Йёнс
Якоб Берцелиус ввёл обозначения химических элементов, которые
используются до сих пор (поэтому в Швеции считают, что Периодическая таблица элементов должна носить имя Берцелиуса – прим. profiok.com).
В XIX веке попытки систематизировать обнаруживаемые элементы были многочисленными. Дёберейнер делил элементы на три группы, выстраивая триады. Английский учёный Ньюлендс, увлекавшийся музыкой, пытался создавать из элементов химические «октавы», разделяя их на семёрки. Француз де Шанкуртуа создавал из известных элементов «земную спираль», а немец Юлиус Лотар Мейер в 1864 году, за пять лет до появления таблицы Менделеева, разработал довольно близкую к ней таблицу.
К 1869
году, которым датируется создание таблицы Менделеева, было известно
более половины из известных на сегодня 118 элементов, то есть вопрос
систематизации стоял достаточно остро. Естественно, Дмитрий Иванович
Менделеев знал обо всех работах в этой области и опирался на них,
подчёркивает Александр Сергеев. Его открытие произошло в тот момент,
когда ситуация в научном мире, что называется, «созрела».
Его открытие произошло в тот момент,
когда ситуация в научном мире, что называется, «созрела».
При этом ценность открытия Менделеева состоит не только в том, что он «правильно» систематизировал элементы, которые были известны на тот момент. Важно, что его подход позволил предсказать существование химических элементов, которые были открыты намного позже.
Как вырастить великого учёного?Видимо, под влиянием задачи наращивания кадрового потенциала российской науки, Александр Сергеев подробно проанализировал жизненный путь Менделеева и попытался понять, почему именно ему посчастливилось сформулировать «созревшее» открытие именно в том виде, в каком оно до сих пор признано во всём мире.
Дмитрий
Иванович Менделеев родился в Тобольске и был семнадцатым ребёнком в
семье. Семья была интеллигентной и, в общем, не слишком бедной:
Менделеевых кормил небольшой стекольный завод. Отец будущего химика был
директором гимназии в Тобольске. В той же гимназии преподавал автор
«Конька-горбунка» Пётр Ершов.
Здесь стоит сказать, что Тобольск в тот период был не просто провинциальным городом, а центром притяжения интеллигенции. Туда было разрешено возвращаться из ссылки декабристам, и их постоянно принимали в доме Менделеевых.
По словам Александра Сергеева, после сильнейшего потрясения декабристы, образованнейшие и культурнейшие люди, больше не занимались политической деятельностью, а потому сконцентрировались на науке и образовании. И именно в этой среде воспитывался юный Менделеев.
Закончив гимназию, Менделеев учился в Главном педагогическом институте в Санкт-Петербурге. Будущий учёный снова оказался в особой среде. Во-первых, в институте преподавали университетские профессора. Во-вторых, прекрасное преподавание сочеталось с очень жёсткой дисциплиной. «Ребята много и трудно учились», – описал Александр Сергеев студенческие годы Менделеева.
После
окончания института Менделеев был направлен в Симферополь преподавать в
гимназии. Интересный эпизод: Менделеев, подозревая у себя чахотку,
обратился в больницу, где в то время лечил раненых на Крымской войне
будущий великий хирург Пирогов. Так встретились два гения отечественной
науки. Пирогов никакой чахотки у Менделеева не обнаружил и пообещал
будущему учёному долгую жизнь. И, надо сказать, не обманул: Менделеев
прожил ещё более 50 лет. Этому эпизоду посвящена картина советского
художника Ивана Тихого «Н.И. Пирогов осматривает больного Д.И.
Менделеева».
Так встретились два гения отечественной
науки. Пирогов никакой чахотки у Менделеева не обнаружил и пообещал
будущему учёному долгую жизнь. И, надо сказать, не обманул: Менделеев
прожил ещё более 50 лет. Этому эпизоду посвящена картина советского
художника Ивана Тихого «Н.И. Пирогов осматривает больного Д.И.
Менделеева».
Проработав в Симферополе и Одессе несколько лет, Менделеев получил приглашение вернуться в Петербург для получения стипендии на обучение в Европе. Учился он в Гейдельберге – одном из самых «продвинутых» европейских университетов того времени. Менделеев занимался измерением долей различных компонентов в сложных газах. Преподавали ему величайшие учёные той эпохи, достаточно назвать фамилии, например, Гельмгольца или Кирхгофа. Кроме того, в Гейдельберге тогда училась способная российская молодёжь – Сеченов, Боткин, Мечников, Бутлеров… И в этой среде целыми днями «варился» Менделеев.
«Среда
Менделеевского дома, гимназия, адекватное университетское образование и
обучение за границей сложили Менделеева как учёного, к которому уже в
последний период его жизни в Гейдельберге было привлечено очень
серьёзное внимание учёных всего мира», – заключил Александр Сергеев,
заметив, что в 1860 году Менделеев входил в число организаторов Первого
международного химического конгресса.
Вернувшись в Петербург, Дмитрий Иванович Менделеев, опираясь на уже знакомые ему подходы и идеи, продолжил свои научные изыскания. Эта работа привела его к формулировке закона в следующем виде: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, состоят в периодической зависимости от их атомного веса». Очевидно, что к этой мысли его подвела многолетняя работа с нахождением атомных весов различных веществ.
Конечно, это не теперешняя формулировка закона. Со времён Менделеева было сделано два важнейших открытия. Прежде всего это открытие Резерфордом структуры атома. Второе – открытие структуры ядра (открытие нейтронов и протонов принято связывать с именем немецкого физика Вейнера Гейзенберга, но в этой сфере отличился и советский физик Дмитрий Иваненко, сформулировавший аналогичные положения – прим. profiok.com).
Современные
учёные знают, что на самом деле свойства элементов состоят в
периодической зависимости от величины зарядов ядер их атомов. В таком
виде сформулировать закон Менделеев, конечно, не мог, но он верно
обозначил важнейшее направление для последующего развития науки.
В таком
виде сформулировать закон Менделеев, конечно, не мог, но он верно
обозначил важнейшее направление для последующего развития науки.
Найдётся ли 119-й элемент?
«Любая теория сильна своей предсказательностью, – считает Александр Сергеев. – В случае с теорией Менделеева попадание было точным. После открытия трёх элементов, которые он предсказал, сомнений в том, что открытый им закон имеет предсказательную силу, ни у кого не осталось». Речь идёт о галлии, который Менделеев называл экаалюминием, скандии, который он назвал экагором, и германии, которому он дал название экасилиций.
В
университете Сент-Эндрюсс в Шотландии был найден самый старый из
известных и прижизненный для Менделеева экземпляр таблицы, написанный на
немецком языке и датированный 1885 годом. Этот документ наглядно
показывает, что уже в то время Периодическую таблицу называли таблицей
Менделеева. Кстати, тот самый Мейер, который тоже пытался составить
таблицу из химических элементов, признал первенство Менделеева после
ознакомления с его теорией.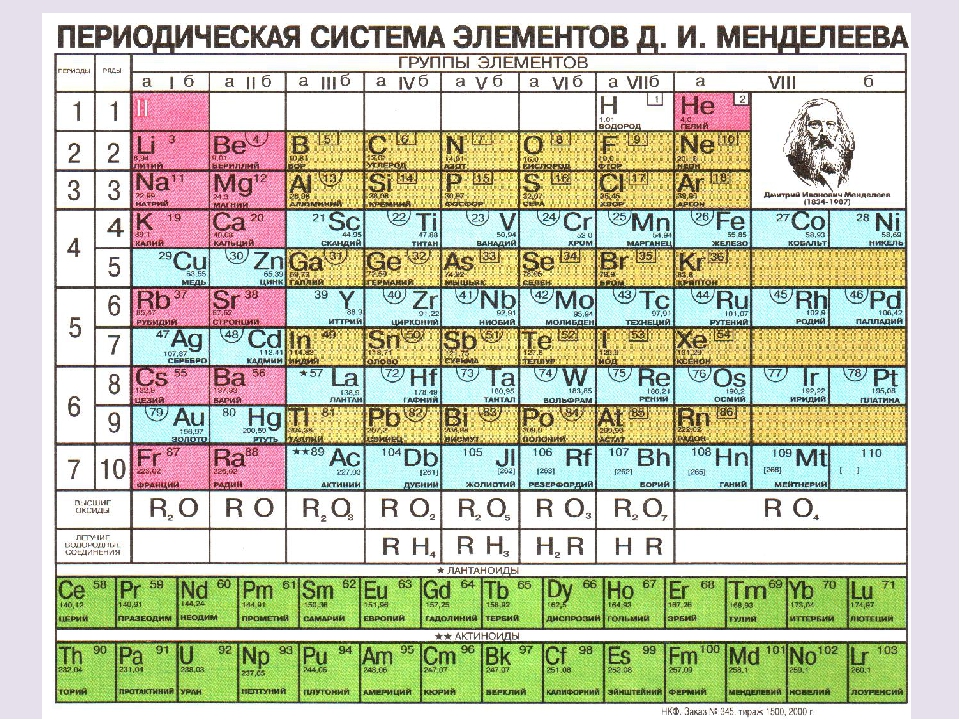
«На сегодняшний день сомнений в первенстве таблицы Менделеева нет, – резюмировал глава РАН. – Это действительно его таблица».
До 1869 года было открыто 63 элемента Периодической системы, сейчас этих элементов 118. Кстати, последний, 118-й элемент носит имя советского и российского учёного Юрия Цолаковича Оганесяна и называет оганесоном. Академик Оганесян, работающий в ОИЯИ в Дубне, – единственный из живущих на Земле учёных, чьим именем назван химический элемент.
Сейчас
среди учёных ведутся серьёзные дискуссии о том, не полна ли таблица
Менделеева и возможно ли открытие каких-то новых элементов. Дело в том,
что теорию Менделеева подхватили физики. Переосмыслением и расширением
Периодической таблицы сегодня занимаются не химики, а физики-ядерщики,
которые сталкивают в искусственных условиях тяжёлые атомы и пытаются
создать новые элементы. Выяснилось, что при движении электронов вокруг
ядер включаются релятивисткие эффекты, и электроны меняют массу. А это
значит, что новые элементы будут обладать уже другими химическими
свойствами, что нарушает ставший привычным для всех концепт
периодичности.
По словам Александра Сергеева, 118-й элемент таблицы Менделеева может стать последним, а дальнейшие эксперименты откроют принципиально новые страницы в истории науки. Впрочем, вопрос пока остаётся открытым. Благодаря новому оборудованию и технологиям современным учёным стала доступной очень интересная область знаний. В этой сфере работают, например, физики в Дубне, где в этом году была запущена фабрика тяжёлых элементов. Будут ли новые элементы соответствовать периодичности, открытой Менделеевым, пока никто не может сказать определённо.
Интересный момент: может получиться так, что Периодическую таблицу открыл российский учёный Менделеев, а точку в её заполнении поставил российский академик Оганесян и его команда из Дубны, отметил глава РАН. Хотя очень хотелось бы, чтобы таблица продолжалась.
У химии великое будущее«Там, где природа кончает производить свои виды, там человек начинает из природных вещей создавать с помощью этой же самой природы бесчисленные виды новых вещей», – привёл Александр Сергеев цитату из Леонардо, пояснив, что эти «бесчисленные виды новых вещей» – это и есть современная химия.
Удивительно, но роль открытия, сделанного полтора века назад, продолжает расти. Всё материальное, что создают современная наука и промышленность, базируется на знаниях об элементах и их свойствах. Кстати, удивительно: молекула ДНК использует всего пять химических элементов из известных 118!
А пока геологи и географы, медики и биологи вовсю пользуются открытием Менделеева, физики пытаются понять, откуда взялись химические элементы, из которых состоит вся наша вселенная. И очень может быть, что современные технологии, позволяющие проводить точнейшие измерения, наконец, позволят найти точные ответы.
«Химия – великая наука, у неё большое будущее, – считает Александр Сергеев. – Будущий мир – это мир новых материалов, которые мы создадим».
Дмитрий Иванович Менделеев не успел получить Нобелевскую премию: он скончался в 1907 году незадолго до присуждения этой награды. «Мы надеемся, что в Международный год периодической таблицы химических элементов к Менделееву, наконец, придёт признание: таблица будет названа его именем, а учёные, которые активно работали над её пополнением, прежде всего академик Оганесян, получат Нобелевскую премию», – заявил Сергеев.
Иллюстрации: слайды А.М. Сергеева к лекции «Периодическая таблица элементов: универсальный язык науки от космоса до новых материалов», картины И.Е. Репина «Портрет Д.И. Менделеева» и И.А Тихого «Н.И. Пирогов осматривает больного Д.И. Менделеева».
Урок познания «Периодическая система химических элементов Д.И. Менделеева» к Единому дню химических знаний
2019 год Генеральной Ассамблеей ООН объявлен Международным годом Периодической таблицы химических элементов. События приурочены к 185-летию со дня рождения русского ученого химика Дмитрия Ивановича Менделеева и 150-летнему юбилею со дня открытия периодической таблицы химических элементов.
8 февраля 2019 года БУ «Национальная библиотека Чувашской Республики» Минкультуры Чувашии проводит Единый день химических знаний «Гений русской науки», посвященный Международному году Периодической таблицы химических элементов и 185-летию со дня рождения Д.И. Менделеева.
С целью повышения научной грамотности, расширения научного кругозора у учащейся молодежи, специалисты Межпоселенческой центральной библиотеки организовали урок познания «Периодическая система химических элементов Д.И. Менделеева» в МБОУ «Моргаушская СОШ». Библиотекари рассказали о жизненном пути Д.И. Менделеева и этапах открытия Периодического закона и периодической системы химических элементов. Рассказ ведущих сопровождался мультимедийной презентацией и был продемонстрирован видеосюжет «Периодический закон и Периодическая система химических элементов Д.И. Менделеева», который вызвал особый интерес у участников мероприятия.
Игра «Химия – загадка» позволила ребятам окунуться в удивительный мир химии, отгадывая различные химические элементы из Периодической системы химических элементов Д.И. Менделеева. Ответив на занимательные задания, ребята подробно изучили химические элементы и узнали о некоторых элементах, которые были названы в честь планет.
Самым интересным моментом стало проведение игры «Пантомима», где участники мероприятия сначала расшифровывали шифрограмму, а затем ее изображали. Интеллектуальная игра «Черный ящик» заинтересовала ребят, и они в ходе игры пришли к выводу, что химические элементы вокруг нас всегда и везде.
С целью закрепления знания по Периодической системе химических элементов Д.И. Менделеева, ведущие провели викторину «Химические элементы», где школьники показали хорошие знания по данной теме. Ребята поблагодарили библиотекарей за познавательный урок и выразили надежду и впредь участвовать на таких мероприятиях.
В истории развития науки известно много крупных открытий, но не все из них можно сравнить с тем, что сделал Дмитрий Иванович Менделеев – ученый-энциклопедист, один из крупнейших мировых химиков. Труды и мысли его до сих пор дают импульс к размышлениям и исследованиям современных деятелей науки.
«Новая система атомных весов, которая делает очевидными аналогии, существующие между телами» []
Philos Trans A Math Phys Eng Sci. 2020 сен 18; 378 (2180): 201.
Питер П. Эдвардс
1 KACST-Оксфордский центр передового опыта в нефтехимии, Лаборатория неорганической химии, Химический факультет, Оксфордский университет, Саут-Паркс-роуд, Оксфорд, Оксфорд, Оксфорд, Великобритания,
2 Лаборатория неорганической химии, Химический факультет, Оксфордский университет, Саут-Паркс-Роуд, Оксфорд, OX1 3QR, Великобритания
Рассел Г.Egdell
2 Лаборатория неорганической химии, Химический факультет, Оксфордский университет, South Parks Road, Oxford OX1 3QR, UK
Dieter Fenske
3 Институт нанотехнологий, Технологический институт Карлсруэ (KIT-), Яйцо Леопольдсхафен, Германия
Бензен Яо
1 KACST-Оксфордский центр передового опыта в области нефтехимии, Лаборатория неорганической химии, Департамент химии, Оксфордский университет, Саут-Паркс-роуд, Оксфорд OX1 3QR, UK
2 Лаборатория неорганической химии , Химический факультет Оксфордского университета, Саут-Паркс-Роуд, Оксфорд, OX1 3QR, UK
1 KACST-Оксфордский центр передового опыта в нефтехимии, Лаборатория неорганической химии, Химический факультет Оксфордского университета, Саус-Паркс-роуд, Оксфорд, Оксфорд, Оксфорд. 3QR, UK
2 Лаборатория неорганической химии, Химический факультет, Оксфордский университет, Саут-Паркс-Роуд, Окс ford OX1 3QR, UK
3 Институт нанотехнологий Технологического института Карлсруэ (KIT), Эггенштайн-Леопольдсхафен, Германия
Опубликовано Королевским обществом.Все права защищены.
Abstract
Исторические корни, открытие и актуальность выдающихся достижений Дмитрия Менделеева стали предметом многочисленных научных работ. Здесь, с кратким обзором, мы надеемся дать ссылку на содержание этого специального выпуска, посвященного великому ученому. Продвижение Менделеева, объявленное в марте 1869 года, как он выразился в 1889 году, перед «… , тогда еще молодым Русским химическим обществом… », впервые изложило саму основу периодического закона химических элементов, естественную связь между свойствами элементов и их атомный вес.Это было и остается центральным элементом исторического пути химии к сегодняшнему положению выдающейся науки.
Данная статья является частью тематического выпуска «Менделеев и таблица Менделеева».
Ключевые слова: Менделеев, таблица Менделеева, периодический закон
1. Введение: Новый свет
Время от времени в науке случаются открытия или достижения, блеск которых таков, что все знания, опыт, концепции, а также интуиция даже следующий день после такого события просто не имеет никакого отношения к тем, что прошел накануне.
Итак, 6 марта 1869 года на заседании Русского химического общества в Санкт-Петербурге доклад Дмитрия Менделеева под названием «Связь свойств с атомным весом элементов» был зачитан аудитории. Николай Меншуткин, соратник Менделеева (). Судя по всему, сам автор был в командировке, чтобы ознакомиться с производством сыра в сельской местности России!
Портрет Дмитрия Менделеева, 27 лет в возрасте от до (Источник: Wikimedia Commons), и его рукописная версия периодического закона химических элементов 1869 года (Источник: Science Photo Library).
Химия – это не просто огромное собрание фактов, но, скорее, точная наука, которая учит нас классифицировать и систематизировать эти факты, и эта классификация должна начинаться с самих химических элементов.
Таким образом, в 1869 году Менделеев, в отличие от многих попыток его предшественников, использовал два набора данных для полной классификации химических элементов, а именно атомные веса элементов и присущие им сходства в химических свойствах [2]. Благодаря этому эпохальному прогрессу родился периодический закон химических элементов.Менделеев не только показал, что в химических свойствах известных в то время элементов существует замечательная естественная периодичность, но и имел смелость и дальновидность заявить, что этот метод классификации представляет собой фундаментальный закон природы, и выявил пробелы в классификации. как неоткрытые тогда элементы ().
Оригинальный вариант периодической системы Менделеева 1870 года. (Источник: Wikimedia Commons).
Получившаяся современная периодическая таблица элементов, несомненно, является одним из самых мощных и легко узнаваемых значков, которые пронизывают всю науку [3] ().
Представление современной периодической таблицы химических элементов, основанное здесь, посредством представления ковалентных радиусов элементов. Примечательно, что даже без обозначения химических элементов это мгновенно распознается как представление таблицы Менделеева. Металлический и неметаллический статус химических элементов (что отражено в закрашивании сфер) взят из G. T. Seaborg, Dalton Trans., 1996, 3899 [4]. Благодарим за это представление Карла Харрисона из Оксфордского университета [5].(Онлайн-версия в цвете.)
Это единственное представление, более чем через полтора столетия после своего первого появления, все еще объединяет и представляет большую часть наших современных знаний об окружающем мире. Помимо обеспечения естественного порядка химических элементов, известных в то время, периодический закон Менделеева, лежащий в основе, позволял предсказывать существование и, что особенно важно, атомный порядок химических элементов, которые тогда еще не были известны, но были обнаружены вскоре после этого.
Даже сегодня не существует ничего похожего на таблицу Менделеева ни в каких других научных дисциплинах.В этом томе Резник подчеркивает параллели – а также существенное различие – между открытием и последующим развитием периодической таблицы Менделеева и открытием эволюции Дарвином и последующим развитием эволюционной биологии [6].
Чтобы подчеркнуть каскадное влияние наступления Менделеева 1869 года, мы воспроизводим здесь просто один комментарий, взятый из стандартного научного текста того времени; это «Атомная теория» Эда Вюрца [1], опубликованная чуть более чем через десять лет после первой публикации этого достижения:
Работа Менделеева недавно пролила новый свет на отношения, существующие между атомным весом элементов и их свойствами.Последние являются функцией атомного веса, который является периодической функцией. Он не ограничивается такой-то группой элементов, но охватывает все элементарные тела химии … таким образом, имея дело с самыми разнообразными и наиболее глубокими вопросами науки … одним словом, взгляните на факты химии с возвышенной и возвышенной точки зрения. комплексная точка зрения.
Менделеев сначала бросил вызов миру, а затем заставил нас столкнуться с тем, насколько наши умы были подготовлены к тому, чтобы признать прогресс явного блеска – подлинное плодотворное достижение, – которое, попросту говоря, изменило наш мир на следующий день после его появления в 1869 году.
Помимо открытия периодического закона химических элементов, Менделеев также внес другой важный вклад в решение химических проблем широкого спектра. Например, возможно, недостаточно хорошо известно, что Менделеев изучал происхождение нефти и выдвинул идею так называемой гипотезы «абиотического происхождения» о том, что углеводороды произошли из карбидов железа под действием водяного пара в глубоких недрах земли. Он писал: « Главный факт, который следует отметить, заключается в том, что нефть зародилась в недрах земли, и только там мы должны искать ее происхождение » [7].Примечательно, что идеи Менделеева, касающиеся многочисленных высокоактивных катализаторов на основе железа, теперь выходят на первый план не только в современных исследованиях использования CO 2 , но и в их эффективном “ отгонке водорода ” из ископаемого топлива с энергоносителем водородом. в настоящее время продвигается как решение надвигающейся климатической чрезвычайной ситуации в мире, как подчеркивается в статье Яо и др. . [8].
2. Простые или естественные элементарные тела (ситуация до 1869 г.)
Дальтон, до сих пор считающийся «бессмертным автором», считал химические комбинации образованными объединением или сложением элементарных атомов, относительными массами который он пытался определить, относя эти веса к одному из элементов – водороду – за единицу.Дальтон возродил и выдвинул гипотезу атомов, чтобы объяснить тот факт, что в химических сочетаниях элементы объединяются в фиксированных пропорциях, а в некоторых случаях – во многих пропорциях [9].
Таким образом, до наступления Менделеева 1869 года все вещества повсеместно относились только к двум классам – простым или элементарным телам или веществам и составным веществам. Список, взятый из учебника [10] всего за год до открытия Менделеева, ярко освещает ситуацию того времени ().Этот замечательный сборник раскрывает совокупность известных тогда элементарных тел в мире вместе с их соответствующими характеристиками. На том этапе, на этих 64 элементарных телах, была основана вся структура и классификация науки – и, по сути, ее применение – химии.
Список элементарных естественных тел 1868 года с их символами, комбинированным весом и удельным весом. Черные буквы обозначают неметаллические вещества; курсив , обычно встречающиеся металлы и обычный тип , более редкие металлы.(Взято из ссылки [10]).
3. «Высокая точка зрения» Менделеева (1869 г. и далее)
Продвижение Менделеева было одновременно простым по принципу и потрясающе продуктивным по своим результатам. В своей лекции Фарадея Лондонского химического общества, представленной в Королевском институте 4 июня 1889 года, Менделеев объявил, что он может даже на этой стадии – заметьте, только двадцатая годовщина своего открытия – сделать вывод, что периодический закон теперь в целом считается доказанным. На этой лекции он представил свои выводы относительно периодического закона химических элементов, отметив: «Это было в марте 1869 года, когда я осмелился изложить тогда еще молодому Русскому химическому обществу идеи по той же теме» [ 11].
Мы воспроизводим здесь только четыре из восьми его замечательных выводов, которые, безусловно, все еще должны удивлять явной мощью и масштабом этого прогресса … Общество) …
‘1. Элементы, расположенные в соответствии с их атомным весом, демонстрируют очевидную периодичность свойств ».
‘5. Величина атомного веса определяет характер элемента точно так же, как величина молекулы определяет характер составного тела ».
‘6. Мы должны ожидать открытия многих еще неизвестных элементов… »
и
‘8. Определенные характерные свойства элементов можно предсказать по их атомному весу ».
Менделеев заключает, «Сегодня, спустя 20 лет после того, как были сформулированы вышеприведенные выводы, они все еще могут рассматриваться как выражающие суть хорошо известного ныне периодического закона» .
4. Вклад Лотара Мейера
Среди характерных свойств, зависящих от атомного веса и предсказываемых им, можно найти, что примечательно, даже характерную плотность элемента.Тот факт, что даже плотность химического элемента подвержена периодическим изменениям с увеличением атомного веса, был впервые блестяще подчеркнут Лотаром Мейером. За такую наглядную и прочную конструкцию мы также должны остаться в долгу перед Мейером, который независимо внес важный вклад в развитие периодического закона химических элементов [12].
Таким образом, если химические элементы расположены вдоль оси абсцисс на расстоянии от нуля и пропорциональном их атомному весу, каждый элемент, таким образом, занимает фиксированную точку вдоль оси.Если затем нарисовать ординату и поместить ее на атомный объем данного элемента, это графическое описание сразу покажет, что изменения атомных объемов (и, следовательно, плотности элемента) являются периодическими [13]. Этим выдающимся достижением Мейер доказал, что положение, занимаемое элементом на этой кривой, зависит от его физического свойства плотности ().
Соотношения между атомными массами элементов и их атомными объемами (по Мейеру).Взято из ссылки [1].
Таким образом, что касается плотностей, из самого принципа построения кривой очевидно, что легкие химические элементы (имеющие значительные атомные объемы) занимают максимумы, а тяжелые металлы (имеющие низкие атомные объемы) – минимумы. Таким образом, щелочные элементы (Li, Na, K, Rb и Cs) составляют пики кривой, в то время как щелочноземельные металлы (Be, Mg, Ca, Sr и Ba) находятся на нисходящем склоне, а галогены (F , Cl, Br и I) на восходящей части кривой.Важность молярного объема элемента (напрямую связанного с его плотностью) в определении того, является ли он металлом или неметаллом, была впервые подчеркнута Д. А. Голдхаммером в 1913 г. и независимо К. Ф. Херцфельдом в 1927 г. [14,15]. Так, например, Херцфельд отметил, что если бы элемент Ag имел большой атомный объем K, то это был бы , а не металл. С другой стороны, если бы благородный газ Xe имел в твердом состоянии низкий молярный объем Cu, он был бы металлом. Вся проблема присутствия металлов и неметаллов в периодической таблице составляет основу статьи Yao et al. [16]. Полезно отметить, что Менделеев написал : «Получение металлического натрия Хамфри Дэви было одним из величайших открытий в химии» , отражая тот факт, что это был первый пример «легкого» (т.е. низкой плотности, большого моляра). объем) металлический элемент. До этого монументального открытия признанными элементарными металлами были тяжелые элементы с высокой плотностью, такие как Au, Hg и Pb. Таким образом, как отмечал Менделеев, ‘… через него (открытие Дэви) понятие элементов стало шире и правильнее» .Поистине, одно из величайших открытий в науке.
Мейер далее отметил, что многие другие физические свойства элементов, такие как пластичность, плавкость и летучесть, аналогичным образом связаны с их атомным весом и подвержены периодическим изменениям с увеличением их атомного веса.
И здесь очевидная периодичность в изменении основных физических свойств была ярким проявлением периодического закона химических элементов Менделеева. Таким образом, не может быть никаких сомнений в том, что Мейер независимо открыл ключевые, центральные принципы периодического закона химических элементов.Это графическое представление атомного объема как функции атомного веса твердых элементов Мейером также явилось значительным достижением.
Что касается масштабов и влияния вклада обоих ученых в формулировку периодического закона, мы отмечаем, что в 1882 году Лондонское королевское общество наградило Менделеев и Мейер своей золотой медалью Дэви, одной из своих высших наград. , «За открытие периодических соотношений атомных весов» [17].
5. Жизнь после Периодического закона 1869 года
После публикации основополагающих работ Менделеева, периодическая таблица Менделеева к концу XIX века все чаще стала частью преподавания химии в университетах по всему миру, и стали доступны настенные диаграммы Менделеева. коммерчески. Об открытии таблицы Менделеева 1885 года в Университете Сент-Эндрюс, Шотландия, считающейся старейшей в мире, говорится в статье Эйткена и его коллег [18].Связь между графическим изображением идей Менделеева в его Таблице и визуальной привлекательностью Древа Чарльза Дарвина исследуется в статье Резника [6].
Что касается теоретических достижений, Менделеев, конечно, не мог знать о существовании субатомных частиц, и поэтому он организовал периодическую таблицу строго по атомному весу, что подразумевало, что что-то, связанное с атомным весом, диктует физические и химические свойства элементы. Прошло много десятилетий, прежде чем стало ясно, что именно количество и природа электронов (и нуклонов) действительно определяют свойства элементов.
Путь к рационализации структуры периодической таблицы с точки зрения электронных конфигураций атомов начался, конечно же, с открытия электрона Дж. Дж. Томсоном в 1897 году [19]. В 1901 году Жан Перрен впервые предложил планетарную модель атома [20] с вращающимися электронами, но сам Томсон предпочел так называемую модель сливового пудинга [21]. Он очень интересовался связью между атомной структурой и химической периодичностью и в 1904 году начал размышлять о том, как расположение слив в пудинге может быть связано с химией элементов [22].Эти идеи так и не превратились во что-то полезное. Химики Гилберт Н. Льюис и Ирвинг Ленгмюр также предложили статические модели с характерным расположением электронов внутри ядра [23].
Наиболее важные шаги, ведущие к нашему нынешнему пониманию химической периодичности, были связаны с манчестерской группой Эрнеста Резерфорда, чей анализ экспериментов по рассеянию α-частиц, проведенных Гейгером и Марсденом, привел к его ядерной модели атома [24]. , что дает более надежную основу для некоторых идей, предложенных Перрином.Работая в качестве демонстратора и научного сотрудника в группе Резерфорда, Генри Мозли показал, что заряд атомного ядра можно приравнять к порядковому номеру элемента в периодической таблице [25,26]. Выводы Мозли были основаны на измерении частот рентгеновских лучей, испускаемых различными элементами при бомбардировке катодными лучами, как это обсуждается в статье Эгделла и Брутона в этом томе [27]. Параллельно с экспериментами Мозли датский физик Нильс Бор, регулярно посещавший Манчестер, работал над своей знаменитой трилогией статей, опубликованной в 1913 г. [28].В первом из них Бор представил идеи концентрических круговых колец, которые могут быть заняты одним электроном в атоме водорода, причем каждое кольцо имеет характерную квантованную энергию и угловой момент, определяемый одним квантовым числом n [29]. В своей второй статье Бор начал бороться с заселенностью различных колец в атомах с более чем одним электроном [30]. Он надеялся, что константы экранирования в формулах Мозли для частот рентгеновских лучей K- и L-типов дадут некоторое представление о занятости кольца [31], но, в конце концов, он предложил конфигурации для элементов до Z = 24 на достаточно специальной основе .Бор продолжал исследовать взаимосвязь между периодичностью и электронной структурой, позже включив второе или вспомогательное квантовое число k (теперь оно будет обозначено как l ), введенное Зоммерфельдом на основе рассмотрения эллиптических орбит с разными эксцентриситетами. В своей Нобелевской лекции 1922 года Бор резюмировал свою работу по периодичности и указал электронные конфигурации для большинства элементов вплоть до Z = 90 (торий) [23]. Следующий важный вклад в электронные конфигурации, основанный на «старой» квантовой теории модели Бора – Зоммерфельда, был внесен Эдмундом Стонером, который представил идею третьего квантового числа j (теперь это будет называться m l ), который может принимать 2 k +1 целых числа в диапазоне от – k до + k [32].
Последние шаги в путешествии последовали за введением Гейзенберга и Шредингера новой квантовой механики; (приближенное) решение уравнения Шредингера для многоэлектронных атомов, которое обеспечило строгую основу для квантовых чисел l и m l и понимание того, почему состояния с одинаковыми n , но разными l имеют разную энергию; и, наконец, описание принципа исключения Паули, который допускал максимальное заполнение двух для каждого состояния, заданного квантовыми числами n, l и m l [33].
Во время нобелевской лекции Бора в 1922 году самым тяжелым известным элементом был уран с Z = 92. Однако в своей таблице электронных конфигураций Бор предложил (без объяснения причин) электронную конфигурацию для элемента 118, понимая, что он должен иметь расположение с восемью электронами во внешней оболочке, аналогичное расположению благородных газов со значениями Z 10 (Ne), 18 (Ar), 36 (Kr) и 54 (Xe). Во включении Бором элемента 118 есть что-то поразительно пророческое.Как обсуждалось в статье Чепмена в этом томе [34], периодическая таблица теперь расширяется до элемента 118 (оганессон) и не более того. Это стало возможным благодаря нескольким десятилетиям лабораторных исследований нуклеосинтеза сверхтяжелых элементов, кульминацией которых стало принятие ИЮПАК в 2015 году элементов 113, 115, 117 и 118. Параллельно с синтезом элементов, помимо урана, продолжалась усилия за последние 50 лет по исследованию влияния теории относительности на электронную структуру тяжелых и сверхтяжелых элементов.В статье Пайпера анализируется влияние релятивистских эффектов на атомные свойства и связи и показано, как периодические тенденции, проявляемые более легкими элементами, начинают изменяться в нижнем ряду периодической таблицы [35]. Это, в свою очередь, ставит новые задачи относительно того, как лучше всего представить таблицу Менделеева, когда включены известные сверхтяжелые элементы и не только, вопрос, который подробно обсуждается в статье Скерри. В этой статье также рассматривается сложный вопрос о том, как лучше всего включить лантаноиды и актиниды в таблицу [36].
Большинство новых элементов, обсуждаемых Чепменом, были получены с помощью тщательно разработанных реакций синтеза. В главе Джонсона, Филдса и Томпсона рассматривается гораздо более широкая тема происхождения природных элементов [37]. Рассмотрено состояние знаний в этой области и дан уровень доверия к каждому из предложенных механизмов. В частности, критически оценивается роль слияний нейтронных звезд в производстве самых тяжелых элементов посредством так называемого r-процесса.
6. Заключительные замечания
«Современная периодическая таблица Менделеева» (предположительно с 1996 г.) приведена в [4]; это из статьи другого «великого человека», химика Гленна Т. Сиборга, который первым начал изучение синтеза новых химических элементов. Сиборг, первый живой человек, удостоенный чести назвать химический элемент в его честь, синтезировал 10 новых элементов тяжелее урана. Сиборг отметил: « Химические элементы являются строительными блоками природы. Все вещества представляют собой комбинации этих элементов ‘.Периодический закон представляет собой, пожалуй, самый решительный прогресс, когда-либо достигнутый в применении теории к предмету химии. Ключевым элементом схемы Менделеева была ее основа в экспериментальных (то есть наблюдаемых) закономерностях и тенденциях в химических свойствах, а не в квантовой механике, как бессознательно (и часто) полагают химики и физики.
Современная (1996) таблица Менделеева (в скобках указаны порядковые номера неоткрытых элементов). Взято из ссылки [4]. (Онлайн-версия в цвете.)
Периодический закон химических элементов Менделеева, без сомнения, является самой фундаментальной естественной системой классификации из когда-либо созданных. Он представляет собой триумф одной из великих организационных тем науки. Мы надеемся, что статьи в этом специальном выпуске – это благородная дань уважения этому триумфу и гениальности славного имени Дмитрия Менделеева, установившего для всего мира периодический закон химических элементов.
Выражение признательности
Мы в долгу перед Элис Пауэр, выпускающим редактором, за ее безграничную поддержку и профессионализм на всех этапах этого начинания, а также Эми Мустилл, производственного редактора, и коллег за их квалифицированную помощь.Мы благодарим Питера Дж. И Клэр Эдвардс и семью за их подарки тома «Атомная теория» 1889 года А. Д. Вюрца и тома «Классная книга современной науки» 1868 года, которые помогли в построении этой точки зрения.
Доступность данных
В этой статье нет дополнительных данных.
Вклад авторов
P.P.E. работал с R.G.E., D.F. и Б.Я. о концепции и дизайне статьи; P.P.E. работали над написанием статьи, и все авторы работали над исправлением статьи на предмет важного интеллектуального содержания.P.P.E. является окончательным лицом, утверждающим публикуемую версию.
Конкурирующие интересы
Мы заявляем, что у нас нет конкурирующих интересов.
Финансирование
Мы благодарны за финансовую поддержку EPSRC (EP / N009924 / 1) и KACST, Саудовская Аравия.
Список литературы
1. Wurtz AD. 1881 г. Атомная теория. Третье издание. Лондон, Великобритания: C. Kegan Paul & Company, Paternoster Square. [Google Scholar] 2. Менделеев Д. 1869 г. О связи свойств элементов с их атомным весом.Zeitschrift für Chemie 12, 405–406. [Google Scholar] 3. Полякофф М., Тан С. 2015 г. Таблица Менделеева: икона и вдохновение. Фил. Пер. R. Soc. А 373, 20140211 (10.1098 / rsta.2014.0211) [PubMed] [CrossRef] [Google Scholar] 4. Seaborg GT. 1996 г. Эволюция современной таблицы Менделеева. J. Chem. Soc., Dalton Trans. 20, 3899–3907. (10.1039 / DT9960003899) [CrossRef] [Google Scholar] 5. Эдвардс П.П., Кребс Б., Райтби П., Лонг Н., Читэм А., Шредер М. 2015 г. Новая химия элементов. Фил. Пер.R. Soc. А 373, 20140190 (10.1098 / rsta.2014.0190). [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 6. Резник Д. 2020. Дерево и таблица: Дарвин, Менделеев и значение «теории». Фил. Пер. R. Soc. А 378, 201 (10.1098 / rsta.2019.0309) [CrossRef] [Google Scholar] 7. Менделеев Д. 1877 г. L’origine du petrole ((Происхождение нефти). Rev. Sci. 13, 409–416. [Google Scholar] 8. Яо Б., Кузнецов В.Л., Сяо Т., Цзе Х, Гонсалес-Кортес С., Дилворт Дж. Р., Аль-Мегрен Х.А., Альшихри С.М., Эдвардс П.П.2020. Топливо, мощность и химическая периодичность. Фил. Пер. R. Soc. А 378, 201(10.1098 / rsta.2019.0308) [CrossRef] [Google Scholar] 9. Viana HE, Порту, Пенсильвания. 2010 г. Развитие атомной теории Дальтона как тематическое исследование в истории науки: размышления для преподавателей химии. Sci. Educ. 19, 75 (10.1007 / s11191-008-9182-2) [CrossRef] [Google Scholar] 10. Авторы учебника. 1868 г. Учебник современной науки Симпкина и Маршалла. Лондон, Великобритания: Джон Хейвуд, Манчестер. [Google Scholar] 11.Менделеев Д.И. 1889 г. Периодический закон химических элементов. J. Chem. Soc., Trans. 55, 634–656. (10.1039 / CT8895500634) [CrossRef] [Google Scholar] 12. Логан Д.Э., Эдвардс П.П. 1985 г. Периодическая система элементов. В металлическом и неметаллическом состояниях материи. Лондон, Великобритания: Тейлор и Фрэнсис. [Google Scholar] 13. Мейер Л. 1870 г. Die Natur der chemischen Elemente als Function ihrer Atomgewichte. Анна. Chem. Pharm. Дополнение 7, 354–364. [Google Scholar] 14. Голдхаммер Д.А. 1913 г. Дисперсия и поглощение по Des Lichtes.В Рухендене isotropen körpern; theorie Und ihre folgerungen. Лейпциг, Германия: Teubner. [Google Scholar] 15. Herzfeld KF. 1927 г. Об атомных свойствах, которые делают элемент металлом. Phys. Ред. 29, 701 (10.1103 / PhysRev.29.701) [CrossRef] [Google Scholar] 16. Яо Б., Кузнецов В.Л., Сяо Т., Слокомб Д.Р., Рао CNR, Хенсель Ф., Эдвардс П.П. 2020. Металлы и неметаллы в периодической таблице. Фил. Пер. R. Soc. А 378, 20200213 (10.1098 / rsta.2020.0213) [CrossRef] [Google Scholar] 17. От редакции. 2019. Оглавление химии.Nat. Chem. 11, 1 (10.1038 / s41557-018-0199-0) [CrossRef] [Google Scholar] 18. Эйткен Р.А., Гил депутат. 2020. Периодическая таблица и другие настенные диаграммы в преподавании химии в Сент-Эндрюсе, 1884–1919. Фил. Пер. R. Soc. А 378, 201
(10.1098 / rsta.2019.0299) [CrossRef] [Google Scholar] 19. Томсон Дж. Дж. 1897 г. Катодные лучи. Философ. Mag. Сер 5 44, 293–316. (10.1080 / 14786449708621070) [CrossRef] [Google Scholar] 20. Перрин Дж. 1901 г. Гипотезы молекул. Revue Scientifique. 15, 449–461. [Google Scholar] 21.Томсон Дж. Дж. 1904 г. О строении атома: исследование устойчивости и периодов колебаний ряда корпускул, расположенных через равные интервалы по окружности; с применением результатов к теории строения атома. Фил. Mag. 6 серия 7, 237–265. (10.1080 / 14786440409463107) [CrossRef] [Google Scholar] 22. Томсон Дж. Дж. 1907 г. Корпускулярная теория материи. Лондон, Великобритания: Констебль и компания. [Google Scholar] 23. Бор Н. 1965 г. Строение атома.В Нобелевских лекциях по физике 1922–1941 гг., Стр. 7–43. Амстердам, Нидерланды: издательство Elsevier Publishing Company. [Google Scholar] 24. Резерфорд Э. 1911 г. Рассеяние альфа- и бета-частиц веществом и структурой атома. Фил. Mag. Сер. 6 21, 669–688. (10.1080 / 14786440508637080) [CrossRef] [Google Scholar] 25. Moseley HGJ. 1913 г. Высокочастотные спектры элементов. Фил. Mag. Сер. 6 26, 1024–1034. (10.1080 / 14786441308635052) [CrossRef] [Google Scholar] 26. Moseley HGJ. 1914 г. Высокочастотные спектры элементов.Часть II. Фил. Mag. Сер. 6 27, 703–713. (10.1080 / 14786440408635141) [CrossRef] [Google Scholar] 27. Эгделл Р.Г., Брутон Э. 2020. Генри Мозли, Рентгеновская спектроскопия и периодическая таблица Менделеева. Фил. Пер. R. Soc. А 378, 201 (10.1098 / rsta.2019.0302) [CrossRef] [Google Scholar] 28. Aaserud F, Heilbron JL. 2013. Любовь, литература и квантовый атом: пересмотр трилогии Нильса Бора 1913 года. Оксфорд, Великобритания: Издательство Оксфордского университета. [Google Scholar] 29. Бор Н. 1913 г. О строении атомов и молекул.Фил. Mag. Сер. 6 26, 1–25. (10.1080 / 14786441308634955) [CrossRef] [Google Scholar] 30. Бор Н. 1913 г. О строении атомов и молекул. Часть II. Системы, содержащие только одно ядро. Фил. Mag. Сер. 6 26, 476–502. (10.1080 / 14786441308634993) [CrossRef] [Google Scholar] 31. Heilbron JL. 2018. Счета Мозли и версии его законов. В «За науку, король и страну: жизнь и наследие Генри Мозли» (редакторы МакЛауд Р., Эгделл Р.Г., Брутон Брутон Э.), стр. 224–243. Лондон, Великобритания: Издательская группа Unicorn.[Google Scholar] 32. Шерри Э. 2016 г. Рассказ о семи ученых и новой философии науки, стр. 117–148. Оксфорд, Великобритания: Издательство Оксфордского университета. [Google Scholar] 33. Шерри Э. 2007 г. Таблица Менделеева: ее история и значение, стр. 227–248. Оксфорд, Великобритания: Издательство Оксфордского университета. [Google Scholar] 34. Чепмен К. 2020. Трансурановые элементы и остров стабильности. Фил. Пер. R. Soc. А 378, 201 (10.1098 / rsta.2019.0535) [CrossRef] [Google Scholar] 35. Pyper NC. 2020. Относительность и таблица Менделеева.Фил. Пер. R. Soc. А 378, 201 (10.1098 / rsta.2019.0305) [CrossRef] [Google Scholar] 36. Шерри Э. 2020. Последние попытки изменить таблицу Менделеева. Фил. Пер. R. Soc. А 378, 201- (10.1098 / rsta.2019.0300) [CrossRef] [Google Scholar] 37. Джонсон Дж. А., Филдс Б. Д., Томпсон Т. А..
2020.
Происхождение элементов: век прогресса. Фил. Пер. R. Soc. А
378, 201
- (10.1098 / rsta.2019.0301) [CrossRef] [Google Scholar]
Сборка современной периодической таблицы
Собираем все вместе
В феврале 1869 года, во время написания второго тома своего учебника химии «Основы химии», Менделеев разработал свою собственную форму периодической таблицы.Популярные источники рассказывают о том, как Менделеев тасовал и переставлял карты, помеченные элементами и их свойствами, как в пасьянсе. Хотя историки не нашли карт в архиве Менделеева, они обнаружили бесчисленное множество групп элементов, покрытых вычеркнутыми идеями и перестановками. Кульминацией этой работы стала таблица Менделеева, в которой он организовал элементы путем увеличения атомной массы и выровнял элементы с аналогичными свойствами в ряды. В 1869 году Менделеев напечатал 200 экземпляров своей таблицы и разослал их коллегам по России и Европе.
Однако Менделеев пошел дальше простого создания таблицы; он утверждал, что организация элементов отражает основной периодический закон. Например, в то время как Мейер поменял местами теллур и йод, Менделеев поменял местами их и утверждал, что атомная масса одного из них должна быть неправильной. (Атомные массы на самом деле не были неправильными, потому что периодичность оказывается основанной на атомном номере, а не на атомной массе.) Менделеев скорректировал массы нескольких элементов на основе своей таблицы, и эти поправки позже были экспериментально подтверждены.
В то время как Мейер оставил пробелы в своей таблице, Менделеев предсказал, что будут обнаружены элементы, которые восполнят эти пробелы. Он зашел так далеко, что предсказал их атомные массы и свойства, и назвал их: эка-бор, эка-алюминий, эка-марганец и эка-кремний («эка» на санскрите означает «единичный» или «один»). Это был смелый шаг; В то время ожидалось, что химики будут репортерами существующих фактов, а не спекулянтами о том, что еще может быть обнаружено. Хотя он не был прав относительно всех их свойств, когда были открыты германий, галлий и скандий, химики смогли увидеть, как они вписываются в пробелы в таблице Менделеева, обеспечивая дальнейшее подтверждение периодического закона Менделеева.
Положение Менделеева как отца таблицы Менделеева укрепилось в 1890-х годах с открытием благородных газов. В то время не только было немыслимо, чтобы элемент мог быть инертным, но для них не было места в периодической таблице. В 1894 году аргон был открыт британским ученым лордом Рэли и шотландским ученым Уильямом Рамзи. Когда единственным предлагаемым благородным газом был аргон, Менделеев и другие химики утверждали, что это не новый элемент, а трехатомный азот (N 3 ).Однако после открытия гелия, криптона, неона и ксенона эти инертные газы не могли быть объяснены. Лишь в 1900 году Рамзи предложил новым элементам дать отдельную группу между галогенами и щелочными металлами. Менделеев ответил так: «Это было чрезвычайно важно для [Рамзи] как подтверждение позиции вновь открытых элементов и для меня как великолепное подтверждение общей применимости периодического закона».
Дорога к нашей современной таблице Менделеева была извилистой, полной тупиков и неправильных поворотов.Это потребовало многочисленных открытий, ученых и экспериментов, а также многочисленных неудач и побед. По сути, это было типично для науки. Хотя нам нравится думать о науке, развивающейся через гениев-одиночек, таких как Менделеев, устремляющих нас к прогрессу, реальность науки такова, что она беспорядочная, требует обширного сотрудничества, основывается на работе других и пересматривает гипотезы, когда появляется новая информация. Менделеев, Мейер и другие были действительно выдающимися учеными не потому, что они все выяснили сами, а потому, что они были полностью вовлечены в выдающееся предприятие, которое мы называем наукой.
Периодическая таблица Менделеева – Периодическая таблица – Edexcel – GCSE Combined Science Revision – Edexcel
Дмитрий Менделеев
Как и многие ученые, работавшие в конце 19 века, русский химик Дмитрий Менделеев (1834-1907) искал способы организовать известные элементы. Менделеев опубликовал свою первую периодическую таблицу элементов в 1869 году.
Характеристики таблиц Менделеева
Менделеев расположил элементы в порядке увеличения относительной атомной массы.Когда он это сделал, он заметил, что химические свойства элементов и их соединений периодически меняются. Затем он расположил элементы, поместив их друг под другом в группы. Чтобы сделать свою классификационную работу, Менделеев внес несколько изменений в свой порядок:
- он оставил пробелы для еще не обнаруженных элементов
- он изменил порядок нескольких элементов, чтобы группы оставались согласованными
Прогнозы с использованием пробелов
Менделеев оставил пробелы в своей таблице, чтобы разместить элементы, которые в то время не были известны.Изучая химические свойства и физические свойства элементов рядом с промежутком, он также мог предсказать свойства этих неоткрытых элементов. Например, Менделеев предсказал существование «эка-кремния», который мог бы уместиться в промежутке рядом с кремнием. Позже был открыт элемент германий. Его свойства оказались похожими на предсказанные и подтвердили периодическую таблицу Менделеева.
Поворот пар
Иод имеет меньшую относительную атомную массу, чем теллур.Так что в таблицах Менделеева йод следует поставить перед теллуром. Однако йод по своим химическим свойствам аналогичен хлору и брому. Чтобы выровнять йод с хлором и бромом в своей таблице, Менделеев поменял местами йод и теллур.
Периодическая таблица Менделеева | Химия для неосновных
Цели обучения
- Опишите структуру Менделеева таблицы Менделеева.
- прогнозов состояния, сделанных возможными с помощью этой таблицы.
Один из полезных способов – использовать флеш-карты. Вы записываете словарные слова, термины на иностранном языке, математические формулы, химические реакции – все, что хотите выучить. Затем вы сортируете эти карточки по категориям, связанным друг с другом темам. Такая организация информации помогает вам увидеть закономерности в материале, чтобы вы могли связать разные идеи воедино и лучше понять их.
Периодическая таблица Менделеева была впервые построена с использованием набора карточек.С помощью этой стратегии Менделеев мог систематизировать и переупорядочивать материал до тех пор, пока не возникнут закономерности.
В 1869 году русский химик и педагог Дмитрий Менделеев (1836–1907) опубликовал периодическую таблицу элементов. В следующем году немецкий химик Лотар Мейер независимо опубликовал очень похожую таблицу. Менделееву обычно уделяют больше внимания, чем Мейеру, потому что его таблица была опубликована первой и из-за нескольких ключевых идей, которые он сделал относительно таблицы.
Рисунок 1. Менделеев
Менделеев писал учебник химии для своих учеников и хотел систематизировать все известные в то время элементы в соответствии с их химическими свойствами.Он классно организовал информацию для каждого элемента на отдельных карточках, которые затем можно было легко переставить по мере необходимости. Он обнаружил, что, когда он расположил их в порядке возрастания атомной массы, определенные сходства в химическом поведении повторялись через равные промежутки времени. Такой тип повторяющегося рисунка называется «периодическим». Маятник, который качается вперед и назад в заданный промежуток времени, является периодическим, как и движение Луны вокруг Земли.
Рисунок 2. Периодическая таблица Менделеева 1869 года.
В , рис. 2 , атомная масса увеличивается сверху вниз вертикальных столбцов, при этом следующие друг за другом столбцы идут слева направо. В результате элементы, находящиеся в одном горизонтальном ряду, представляют собой группы элементов, которые, как известно, обладают схожими химическими свойствами. Одно из открытий Менделеева иллюстрируется элементами теллура (Те) и йода (I). Обратите внимание, что теллур указан перед йодом, хотя его атомная масса выше. Менделеев изменил порядок, потому что он знал, что свойства йода намного больше похожи на свойства фтора (F), хлора (Cl) и брома (Br), чем на кислород (O), серу (S) и селен. (Se).Он просто предположил, что произошла ошибка в определении одной или обеих атомных масс. Как мы вскоре увидим, это оказалось не так, но Менделеев действительно правильно сгруппировал эти два элемента, как он это сделал.
Обратите внимание, что в таблице есть несколько мест, которые не имеют химического символа, а помечены знаком вопроса. Между цинком (Zn) и мышьяком (As) есть два таких недостающих элемента. Менделеев считал, что элементы с атомными массами 68 и 70 в конечном итоге будут открыты и что они будут химически вписываться в каждое из этих пространств.В таблице 1
| Таблица 1 | ||
|---|---|---|
| Eka-Aluminium (Ea) | Галлий (Ga) | |
| Атомная масса | 68 а.е.м. | 69,9 а.е.м. |
| Температура плавления | Низкий | 30.15 ° С |
| Плотность | 5,9 г / см 3 | 5,94 г / см 3 |
| Формула оксида | Ea 2 O 3 | Ga 2 O 3 |
Элемент галлий был обнаружен через четыре года после публикации таблицы Менделеева, и его свойства удивительно хорошо совпадали с экаалюминий, вписываясь в таблицу именно там, где он предсказывал.То же самое было и с элементом, который последовал за галлием, который в конечном итоге получил название германий.
Периодическая таблица Менделеева получила широкое признание в научном сообществе и принесла ему признание как первооткрыватель периодического закона. Элемент номер 101, синтезированный в 1955 году, назван менделевием в честь основателя периодической таблицы Менделеева. Однако пройдет несколько лет после смерти Менделеева, прежде чем можно будет объяснить некоторые расхождения с атомными массами и полностью объяснить причины, лежащие в основе повторения химических свойств.
Сводка
- Менделеев опубликовал свою периодическую таблицу в 1869 году.
- Его организация элементов была основана на атомной массе. Периодическая таблица
- Менделеева позволяла предсказывать свойства элементов, которые еще не были обнаружены.
Практика
- Где родился Менделеев?
- Где он учил?
- Что самое важное в таблице Менделеева?
- Какой еще вклад в химию внес Менделеев?
Обзор
- Когда Менделеев опубликовал свою периодическую таблицу?
- Кто еще разработал периодическую таблицу примерно в то же время?
- Почему таблица Менделеева считалась лучшей?
- Существование какого элемента предсказывал Менделеев?
- Какой элемент был назван в честь Менделеева?
Глоссарий
- Менделевий: Элемент № 101, синтезированный в 1955 году, назван менделевием в честь Дмитрия Менделеева (1836–1907), основателя периодической таблицы.
Периодический закон | Химия для неосновных
Цели обучения
- Укажите периодический закон.
- Опишите организацию таблицы Менделеева.
Как эти предметы связаны друг с другом?
Нам всем понравилась игра «Подсказка». Цель игры – получить информацию об убийстве: кто это сделал, где и что было использовано в качестве орудия убийства. По мере прохождения игры каждый игрок получает улики, и затем они должны объединить эти улики в догадку относительно преступника.Отдельные фрагменты информации приобретают более широкое значение, когда их объединяют с другими частями головоломки.
Периодический закон
Когда Менделеев составил свою периодическую таблицу, никто не знал о существовании ядра. Только в 1911 году Резерфорд провел свой эксперимент с золотой фольгой, который продемонстрировал наличие ядра в атоме. Всего два года спустя, в 1913 году, английский физик Генри Мозли (1887-1915) исследовал рентгеновские спектры ряда химических элементов.Он будет снимать рентгеновские лучи через кристаллы элемента и изучать длины волн обнаруженного им излучения. Мозли обнаружил связь между длиной волны и атомным номером. Его результаты привели к определению атомного номера как количества протонов, содержащихся в ядре каждого атома. Затем он понял, что элементы периодической таблицы должны быть расположены в порядке увеличения атомного номера, а не увеличения атомной массы.
При сортировке по атомному номеру расхождения в таблице Менделеева исчезли.Теллур имеет атомный номер 52, а йод имеет атомный номер 53. Таким образом, хотя теллур действительно имеет большую атомную массу, чем йод, он должным образом помещается перед йодом в периодической таблице. Менделееву и Мозли приписывают наибольшую ответственность за современный периодический закон : когда элементы расположены в порядке возрастания атомного номера, происходит периодическое повторение их химических и физических свойств. В результате появилась таблица Менделеева, которую мы знаем сегодня.Каждая новая горизонтальная строка периодической таблицы соответствует началу нового периода , потому что новый основной энергетический уровень заполняется электронами. Элементы со схожими химическими свойствами появляются через определенные промежутки времени в вертикальных столбцах, называемых группами .
Сводка
- Элементы таблицы Менделеева расположены в порядке возрастания атомного номера.
- Периодический закон гласит: «Когда элементы расположены в порядке возрастания атомного номера, происходит периодическое повторение их химических и физических свойств.”
Практика
Воспользуйтесь ссылкой ниже, чтобы ответить на следующие вопросы:
Henry Moseley
- Где Мозли учился в колледже?
- С кем он проводил исследования после окончания колледжа?
- Что такое закон Мозли?
Обзор
- Знал ли Менделеев о ядре атома?
- Кто открыл связь между длиной волны рентгеновского излучения и атомным номером?
- К чему Мозли пришел к выводу из своего исследования?
- Что такое «периодический закон»?
- Что представляют собой вертикальные столбцы (группы) в периодической таблице?
Глоссарий
- группа: Элементы с аналогичными химическими свойствами появляются через определенные промежутки времени в вертикальных столбцах.
- период: Период – это горизонтальная строка периодической таблицы.
- Периодический закон: Когда элементы расположены в порядке возрастания атомного номера, их химические и физические свойства периодически повторяются.
границ | От редакции: Празднование Международного года Периодической таблицы Менделеева: после Менделеева 150
Периодическая таблица всех химических элементов была впервые разработана и графически отображена как всеобъемлющий закон природы русским ученым Дмитрием Менделеевым в марте 1869 года, за которым сразу же последовал большой скачок в чистой и прикладной химии, физике и других областях. естественные науки и в образовании.Периодическая таблица элементов охватывает большинство предшествующих исследований по той же теме; это было убедительно подтверждено известными количественными графиками различных свойств элементов Юлиуса Лотара Мейера. В течение последних полутора веков Периодическая таблица, несомненно, стала настоящей иконой химии, вдохновив многих ученых различных специальностей, философских мыслителей, бел-эспритов и простых ученых. Тем самым он открыл новые захватывающие горизонты для инновационного устойчивого развития и улучшения достижений человечества.Периодические таблицы стали неотъемлемой частью фундаментальных естественных наук, всех химических классов и даже популярной культуры и искусства по всему миру (Ball, 2019; Chapman, 2019; Düllmann, 2019; Goodilin et al., 2019; Gorbunova et al. ., 2019; Liddle, 2019; Poliakoff et al., 2019; Radford, 2019; Rahm et al., 2019; Rampling, 2019; Scerri, 2019; Shaik et al., 2019).
На этом фоне Генеральная Ассамблея Организации Объединенных Наций провозгласила Международным годом Периодической таблицы химических элементов (IYPT 2019) в ознаменование 150-летия открытия Природной системы химических элементов как одного из наиболее важных и влиятельных достижений в современные науки.Это предоставило беспрецедентную возможность подчеркнуть непрерывный характер научных открытий в мирном и просвещенном мире. Успехи в исследованиях во многих различных контекстах были вызваны открытием Природной системы, что дало хорошие основания для признания важности химии в сотрудничестве с другими базовыми дисциплинами в мире, находящемся под угрозой из-за изменения климата и неограниченного роста населения.
Настоящий сборник тем исследований посвящен естественной системе элементов и ее различным представлениям в форме периодических таблиц, ее научным химическим и физическим основам, ее инновационным приложениям в лабораторных исследованиях, ее передовым открытиям в области химической периодичности и элементарной группы, занимающиеся передовыми химическими исследованиями, физикой, химической инженерией, материаловедением, катализом, экологией, фотовольтаикой и мемристорами.
Cao et al. обсуждают химические элементы в своем обзоре как «ядро», которое сохраняется при изменении веществ. Графические изображения химических свойств элементов в форме периодических таблиц были разработаны с целью либо классификации реальных химических веществ, либо акцентирования внимания на формальных и эстетических концепциях. Первые таблицы обычно включают типичные валентные электронные конфигурации связанных атомов в химических соединениях вместо обычных, но химически нетипичных основных состояний свободных атомов в физическом вакууме; основные химические свойства, такие как числа валентности, размер и энергия валентных оболочек с их совместным изменением по элементам, показывающим основную и вторичную периодичность; своеобразные элементы вверху и внизу Периодической таблицы.Хотя важно, чтобы периодические таблицы отображали важные тенденции в химии элементов, мы можем ожидать необычного химического поведения в окружающей среде, близкой к окружающей среде или необычных условиях. Сочетание экспериментальных данных и теоретических представлений поддерживает более тонкое понимание сложных периодических тенденций и непериодических явлений.
В качестве примера богатого химического состава элементов и его явного влияния на фундаментальные свойства и структурные корреляции современных материалов, Belich et al.сравните несколько революционных материалов на основе кристаллических решеток типа перовскита, включая легендарные семейства высокотемпературных сверхпроводящих купратов, колоссальных магниторезистивных манганитов и гибридных галогенидов свинца для нового поколения солнечных элементов. Авторы показывают, что широко распространенные кристаллические решетки перовскитов представляют собой естественную гибкую платформу для химического дизайна различных современных функциональных материалов с уникальными свойствами. Взаимодействие между химической связью, дефектами и особенностями кристаллохимии делает структуру перовскита «конструктором лего», использующим природные свойства химических элементов.
Несколько авторов представили свои идеи, продвигающие важные классы материалов и наноматериалов из семейства C, Si, Ti, Sn, Pb элементов IV группы классической формы Периодической таблицы. Навроцкая и др. описывает глубоко модифицированные одномерные углеродные наноматериалы, уделяя особое внимание гибридным наноматериалам с уникальными механическими, электрическими, тепловыми и оптическими характеристиками. Среди них особое внимание привлекают гибриды на основе нитевидных форм углерода, таких как углеродные нанотрубки и углеродные нановолокна, в сочетании с неорганическими наночастицами.Из-за структуры и морфологии процессы переноса заряда и энергии приводят к синергетическим эффектам, которые позволяют использовать меньше материалов с более высокой производительностью, включая их экологические применения.
Морозова и др. обсудить важный класс кремниевых наноматериалов – квантовые точки. Авторы отметили, что широко известные кремниевые квантовые точки (SiQD), полупроводниковые наночастицы Si размером от 1 до 10 нм по-прежнему обладают большим прикладным потенциалом для оптоэлектронных устройств и флуоресцентных биомаркировочных агентов.Их гораздо более высокая биосовместимость по сравнению с обычными токсичными квантовыми точками на основе металлов групп II-VI и III-V делает их практическое применение еще более привлекательным для предотвращения загрязнения окружающей среды и повреждения живых организмов.
Оксидные производные кремния составляют особый класс стеклянных материалов. В частности, Шахгильдян и др. разделяют точку зрения о том, что стекло является единственным материалом, который может представлять почти все элементы Периодической таблицы внутри себя, показывая влияние Периодического закона на свойства конечного материала.Авторы впервые воспроизвели Периодическую таблицу в цветах двойного лучепреломления в объеме кварцевого стекла с использованием техники прямой лазерной записи.
Очень важные и технологически релевантные олигосилоксаны обсуждаются Rabanzo-Castillo et al. В частности, использование (C 6 F 5 ) 3 B (OH 2 ) в качестве катализатора для простых и обсуждается экологически безопасный синтез олигосилоксанов непосредственно из гидросиланов. Авторы отмечают, что этот протокол предлагает несколько преимуществ по сравнению с другими методами синтеза силоксанов, таких как мягкие условия реакции, низкая загрузка катализатора и короткое время реакции с высокими выходами и чистотой, хотя такие реакции имеют довольно сложный механизм.С гидросиланом (R 3 SiH) в качестве единственного исходного материала, судьба реакции в значительной степени зависит от образования силанола (R 3 SiOH) из R 3 SiH, поскольку эти два подвергаются дегидросцеплению с образованием дисилоксана. продукт. Получение силанола основано на модифицированной реакции Пирса-Рубинштайна. После того, как силанол произведен, механизм включает серию конкурентных реакций с множеством каталитически релевантных частиц, включая воду, силан и силанол, взаимодействующие с кислотой Льюиса, и предпочтительный цикл реакции зависит от концентрации различных частиц в растворе.
Родионов и др. описывают улучшенный доступ к ожидаемым применениям диоксида титана и его производных для фотокаталитических систем. Авторы представляют новые способы получения, окончательные структурные и функциональные свойства слоистых гибридных производных диоксида титана как эффективного фотокатализатора для получения водорода из водно-спиртового раствора. Гибридный фотокатализатор H 2 Nd 2 Ti 3 O 10 × BuNH 2 был синтезирован твердотельным керамическим методом с последующим протонированием, интеркалированием метиламина и последующим замещением н-бутиламином.В то время как неинтеркалированный Pt-загруженный H 2 Nd 2 Ti 3 O 10 показал максимальную квантовую эффективность всего 2% в диапазоне 220–340 нм, эффективность для гибридных образцов достигала 23–52 %. Этот эффект может быть связан со значительным расширением межслоевого пространства, которое рассматривается как отдельная зона реакции.
Кроме того, Войтович и др. сравнить титанаты и их роль в качестве систем фотокаталитического расщепления с аналогичной серией гибридных ниобатов HCa 2 Nb 3 O 10 × RNH 2 , содержащих интеркалированные н-алкиламины (R = Me, Et, Pr, Bu, Hx, Oc).Особое внимание было обращено на возможное улучшение фотокаталитической активности образцов за счет их модификации наночастицами Pt в качестве сокатализатора. Таким образом, модификация слоистых перовскитоподобных оксидов органическими веществами представляется эффективной стратегией управления их фотокаталитической активностью, которая может быть применена к другим родственным фотокаталитическим материалам.
Илларионов и др. рассмотрим современный мемристический диоксид титана как один из наиболее широко используемых материалов в приложениях резистивной коммутации, включая оперативную память, нейроморфные вычисления, биогибридные интерфейсы и датчики.Функциональные мемристивные свойства тонких пленок диоксида титана сильно зависят от методов их обработки, включая синтез, изготовление и пост-обработку, и поэтому авторы предоставляют обзор основных областей применения мемристивных устройств на основе TiO 2 .
В своем мини-обзоре Петров и Тарасов обобщают существующие данные об уникальных свойствах реакционных полииодидных расплавов (РПМ), используемых для разработки нового типа технологий масштабируемого производства нового поколения солнечных элементов на основе гибридных галлоплюмбатных перовскитов. .Авторы обсуждают потенциал RPM для изготовления гибридных перовскитных пленок и описывают роль полигалогенидов в деградации перовскитных солнечных элементов.
Другой потенциальный кандидат для фотоэлектрических элементов на основе галостаннатов представлен в статье Умедова и др. Структура и свойства неорганического перовскита Cs 2 SnI 6 демонстрируют его потенциал в качестве материала для сбора света или электронно-дырочного транспорта. Авторы сообщают о способе световой настройки абсорбционных и транспортных свойств иодостанната (IV) цезия Cs 2 SnI 6 путем частичного гетеровалентного замещения индия оловом.Поглощение света и ширина оптической запрещенной зоны таких материалов были исследованы методами УФ-видимой спектроскопии поглощения и фотолюминесцентной спектроскопии. Спектроскопия низкотемпературного электронного парамагнитного резонанса использовалась для изучения типа парамагнитных центров в этих материалах.
Еще одна область статей в этом сборнике тесно связана с f-элементами. Довольно оригинальный мини-обзор радиохимиков Романчук и др. раскрыть некоторые важнейшие основные проблемы радиоэкологии.В обзоре кратко, но всесторонне анализируется очень сложный химический состав актинидов, их применение и использование. Среди них уран и плутоний являются наиболее важными, поскольку они используются в ядерном топливном цикле и производстве ядерного оружия, и поэтому обзор сосредоточен на последних экспериментальных, модельных и тематических достижениях в исследовании миграции плутония и урана в окружающая среда, которая включает видообразование этих элементов и химические реакции, контролирующие пути их миграции.
Visentin et al. представили текущее состояние исследований газового переноса однозарядных ионов лантаноидов и актинидов в свете потенциальных приложений для сверхтяжелых ионов. Корреляция ионно-нейтрального потенциала взаимодействия и вариаций подвижности с пространственными параметрами распределения электронов в голых ионах исследуется с помощью концепции ионных радиусов. В то время как качественные тенденции, обнаруженные для потенциалов взаимодействия и подвижностей, делают их привлекательными для исследования сверхтяжелых ионов, отсутствие экспериментальных данных и ограничения используемых скалярных релятивистских ab initio подходов вынуждают прилагать дополнительные усилия для включения измерений переноса в перечень методов, работающих в Режим «один атом за раз».
Наконец, Элькина и Курушкин написали подробный мини-обзор истории, различных синтезов и, возможно, всех известных применений искусственного элемента прометия. Ожидается, что мини-обзор станет окончательной отправной точкой для всех, кто заинтересован в изучении единственного химического элемента в ряду лантанидов, который не имеет стабильных изотопов.
В целом, Сборник суммирует различные новые достижения и тенденции в химии элементов в рамках Периодической системы и, безусловно, полезен для химиков и практических исследователей в области материаловедения, а также устойчивой химии.
Авторские взносы
Все перечисленные авторы внесли существенный, прямой и интеллектуальный вклад в работу и одобрили ее к публикации.
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Мы благодарим всех авторов, принявших участие в этом сборнике статей, а также всех рецензентов за их вклад в тематику исследований.
Список литературы
Чепмен, К. (2019). Сверхтяжелые: создание и нарушение периодической таблицы. Science 365, 974–975.
Google Scholar
Горбунова Ю., Оро Л., Тржечак А., Трифонов А. (2019). К 150-летию Периодической системы химических элементов: 5-я конференция EuChemS по неорганической химии. Eur. J. Inorg. Chem. 2019, 4166–4169. DOI: 10.1002 / ejic.201
4
CrossRef Полный текст | Google Scholar
Рэдфорд, Т.(2019). В его стихии: оглядываясь на Периодическую таблицу Примо Леви. Природа 565, 564–565. DOI: 10.1038 / d41586-019-00288-6
CrossRef Полный текст | Google Scholar
Рам М., Камми Р., Эшкрофт Н. В. и Хоффманн Р. (2019). Сжатие всех элементов периодической таблицы: электронная конфигурация и электроотрицательность атомов при сжатии. J. Am. Chem. Soc. 141, 10253–10271. DOI: 10.1021 / jacs.9b02634
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рэмплинг, Дж.(2019). Более 2000 лет элементов: предыстория периодической таблицы. Природа 565, 563–564. DOI: 10.1038 / d41586-019-00289-5
CrossRef Полный текст | Google Scholar
Шайк, С., Кремадес, Э., и Альварес, С. (2019). Таблица Менделеева – универсальная икона: ее рождение 150 лет назад и ее популяризация через литературное искусство и музыку. Angew. Chem. Int. Эд. 58, 13194–13206. DOI: 10.1002 / anie.201
CrossRef Полный текст | Google Scholar
Проект Периодической таблицы Менделеева практически неузнаваем – но он навсегда изменил науку
Фев.17 декабря 1869 года русский химик Дмитрий Менделеев опубликовал свою первую попытку разделить строительные блоки жизни на упорядоченные группы. Теперь, 150 лет спустя, мы знаем плоды его труда как Периодическую таблицу элементов – квинтэссенцию настенного искусства в классе и незаменимый инструмент исследования для любого, кто хоть раз брал в руки стакан.
Как вы можете сами убедиться в набранном от руки черновике выше, первая таблица Менделеева выглядела совсем иначе, чем та, которую мы знаем сегодня. В 1869 году было известно только 63 элемента (по сравнению со 118 элементами, которые мы идентифицировали сегодня).Будучи студентом Гейдельбергского университета в Германии, а затем профессором Санкт-Петербургского университета, Менделеев понял, что, группируя элементы по их атомному весу, периодически возникают определенные типы элементов. [Элементарно, моя дорогая: 8 малоизвестных элементов]
Менделеев отточил эту «периодическую систему», как он ее называл, записывая имена, массы и свойства каждого известного элемента на набор карточек. По словам историка науки Майка Саттона из Chemistry World, Менделеев затем положил эти карты перед собой – как пасьянс – и начал их перемешивать, пока не нашел порядок, который имел смысл.
В конце концов, момент эврики Менделеева пришел к нему во сне, писал Саттон. Проснувшись, он расположил свои карточки элементов в вертикальные столбцы в порядке увеличения атомного веса, начиная новый столбец, чтобы сгруппировать элементы с аналогичными свойствами в один горизонтальный ряд. Руководствуясь этими руководящими принципами, он в конечном итоге создал первую в мире Периодическую таблицу.
Менделеев был настолько уверен в своей системе, что оставил пробелы для неоткрытых элементов и даже предсказал (правильно) свойства трех из этих элементов.Эти три элемента, известные сейчас как галлий, скандий и германий, были обнаружены в течение следующих трех лет и совпали с предсказаниями Менделеева, что помогло укрепить репутацию его стола, сообщил Саттон.
Таблица не была идеальной (например, Менделеев не смог определить местонахождение водорода с помощью своей системы), но она заложила прочную основу для поколений химиков, на которую они могли опираться в течение следующих 150 лет.
