Аномалии периодической таблицы Менделеева
Изучение большого количества элементов сводится к нескольким группам элементов, если все элементы разделить на несколько групп таким образом, чтобы элементы одной группы имели сходные свойства. Триады Доберейнера, закон октав Ньюленда, периодическая таблица Менделеева — все это помогло классифицировать известные элементы. Но до появления современной периодической таблицы у этих классификаций всегда были некоторые ограничения. Периодическая таблица Менделеева и ее аномалии или ограничения обсуждаются ниже.
Что такое Периодическая таблица Менделеева?
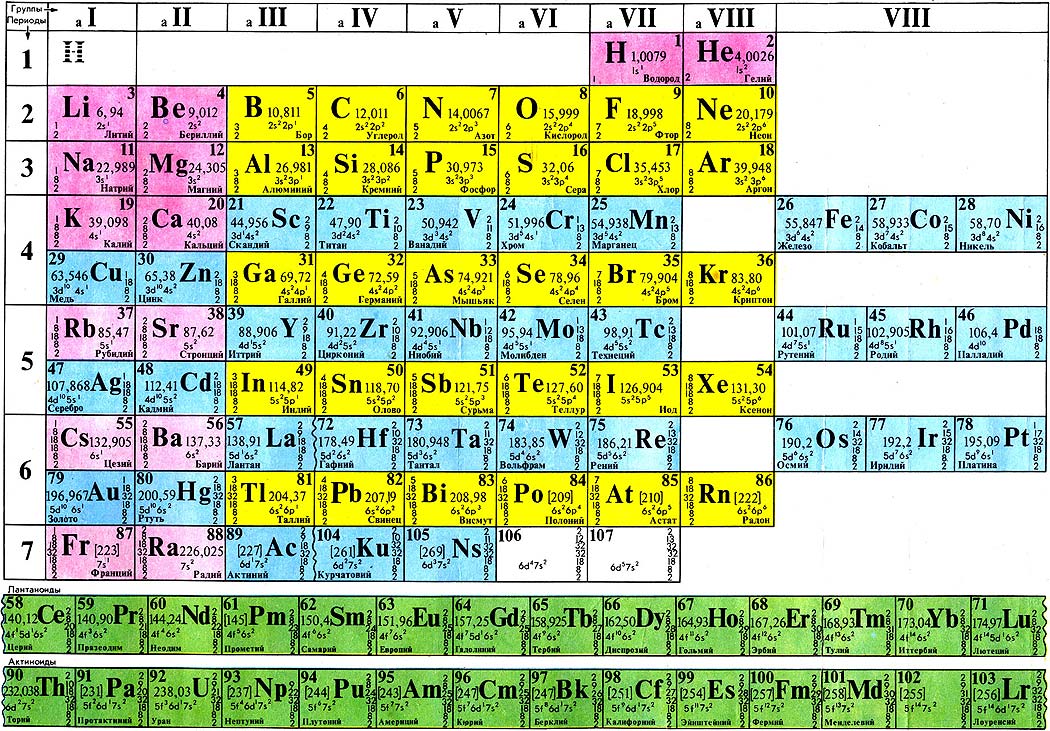
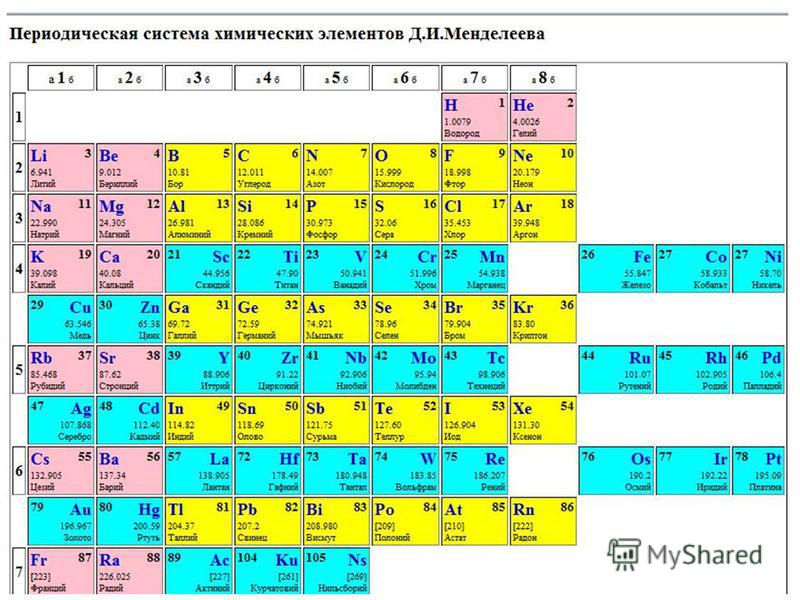
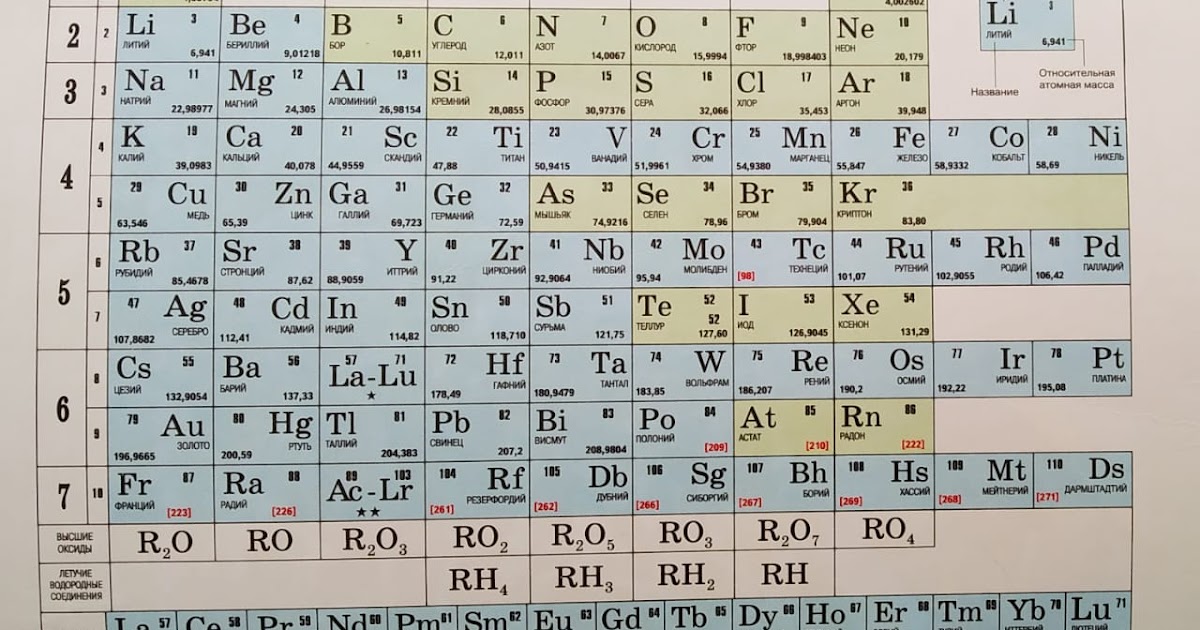
В 1869 году Менделеев предложил периодический закон, который гласит, что если элементы расположены в порядке возрастания атомной массы, их свойства будут повторяться через равные промежутки времени или периоды. Менделеев расположил все 63 известных в то время элемента в периодической таблице в горизонтальные ряды в порядке возрастания атомных масс, но таким образом, чтобы элементы со схожими свойствами располагались вместе в одном вертикальном столбце.
В периодической таблице Менделеева было семь горизонтальных строк, называемых периодами, и восемь вертикальных столбцов, называемых группами. В то время благородные газы не были известны. Итак, в исходной таблице Менделеева не было группы благородных газов. Чтобы элементы, имеющие сходные свойства, попали в один и тот же вертикальный столбец, Менделеев оставил в своей таблице несколько пробелов.
Неоткрытые или неизвестные в то время элементы, для которых в таблице Менделеева остались пробелы, были названы Менделеевым эка-бором, эка-алюминием и эка-кремнием. Когда эти элементы были обнаружены позже, эка-бор был назван скандием, эка-алюминий — галлием, а эка-кремний — германием.
Менделеев также разместил несколько элементов в неправильном порядке их атомных масс, оставив сначала элемент с большей атомной массой, а затем элемент с меньшей атомной массой, чтобы гарантировать, что элементы со схожими свойствами попадут в один и тот же вертикальный столбец. Когда были открыты благородные газы, периодическая таблица Менделеева смогла их включить. Он также может предсказывать свойства нескольких элементов на основе их положения в периодической таблице.
Когда были открыты благородные газы, периодическая таблица Менделеева смогла их включить. Он также может предсказывать свойства нескольких элементов на основе их положения в периодической таблице.
Аномалии менделеевской классификации элементов
Периодическая таблица Менделеева была чрезвычайно полезна при изучении элементов, но у нее были некоторые недостатки, которые нельзя было объяснить с помощью периодического закона Менделеева. Ниже приведены три основных аномалии или ограничения в классификации элементов Менделеева:
- Положение изотопов не может быть объяснено
Атомы одного и того же элемента, имеющие сходные химические свойства, но разные атомные массы, называются изотопами. Поскольку изотопы имеют разные атомные массы, их следует помещать в разные группы периодической таблицы, если элементы расположены в соответствии с атомными массами. В периодической таблице Менделеева изотопы не имели своего столбца. В периодической таблице Менделеева изотопы расположены на одном месте. Например, Cl-35 и Cl-37 представляют собой два изотопа хлора с атомным весом 35 и 37 соответственно. Периодический закон Менделеева не мог объяснить, почему эти два изотопа хлора с разными атомными массами были помещены в одну и ту же группу таблицы Менделеева.
Например, Cl-35 и Cl-37 представляют собой два изотопа хлора с атомным весом 35 и 37 соответственно. Периодический закон Менделеева не мог объяснить, почему эти два изотопа хлора с разными атомными массами были помещены в одну и ту же группу таблицы Менделеева.
- Неверный порядок атомных масс некоторых элементов не может быть объяснен
Элементы расположены в порядке возрастания атомных масс согласно периодическому закону Менделеева. В результате первым должен стоять элемент с меньшей атомной массой, а затем элемент с большей атомной массой. Когда некоторые элементы были сгруппированы, было обнаружено, что первым идет элемент с большей атомной массой, а за ним элемент с меньшей атомной массой. При помещении в правильную группу на основе химических свойств элемент кобальт, который имеет более высокую атомную массу 58,9, идет первым, за ним следует элемент никель, который имеет немного меньшую атомную массу 58,7. Периодический закон Менделеева не мог объяснить эту необычную ситуацию с атомными массами в неправильном порядке.
- Водороду нельзя присвоить правильное место в таблице Менделеева
Водород находится в группе I наряду с щелочными металлами в таблице Менделеева. Это связано с тем, что, подобно щелочным металлам (например, натрию), водород реагирует с галогенами, кислородом и серой с образованием соединений с аналогичными формулами. В таблице ниже показаны аналогичные соединения, образованные натрием и водородом.
| Compounds of hydrogen (H) | Compounds of alkali metal sodium (Na) |
| HCl | NaCl |
| H 2 O | Na 2 O |
| H 2 S | Нет 2 S |
2 Это указывает на то, что водород проявляет некоторые свойства, подобные щелочным металлам.
 Некоторые свойства водорода аналогичны свойствам галогенов (фтор, хлор и бром). Водород, как и галогены (F 2 , Cl 2 , Br 2 ), встречается в виде двухатомных молекул (H 2 ). Кроме того, водород, как и галогены, образует ионные соединения, называемые гидридами, в сочетании с некоторыми металлами и реагирует с неметаллами с образованием ковалентных соединений. Все эти характеристики указывают на принадлежность водорода к VII группе элемента галогена. В результате можно заключить, что водород принадлежит как к группе щелочных металлов , так и к группе галогенов на основе его свойств. Таким образом, периодический закон Менделеева не мог поместить водород в правильное положение в периодической таблице.
Некоторые свойства водорода аналогичны свойствам галогенов (фтор, хлор и бром). Водород, как и галогены (F 2 , Cl 2 , Br 2 ), встречается в виде двухатомных молекул (H 2 ). Кроме того, водород, как и галогены, образует ионные соединения, называемые гидридами, в сочетании с некоторыми металлами и реагирует с неметаллами с образованием ковалентных соединений. Все эти характеристики указывают на принадлежность водорода к VII группе элемента галогена. В результате можно заключить, что водород принадлежит как к группе щелочных металлов , так и к группе галогенов на основе его свойств. Таким образом, периодический закон Менделеева не мог поместить водород в правильное положение в периодической таблице. Неспособность периодического закона Менделеева объяснить положение изотопов, неправильный порядок расположения атомных масс некоторых элементов и положение водорода привели к выводу, что атомная масса не может быть использована для классификации элементов.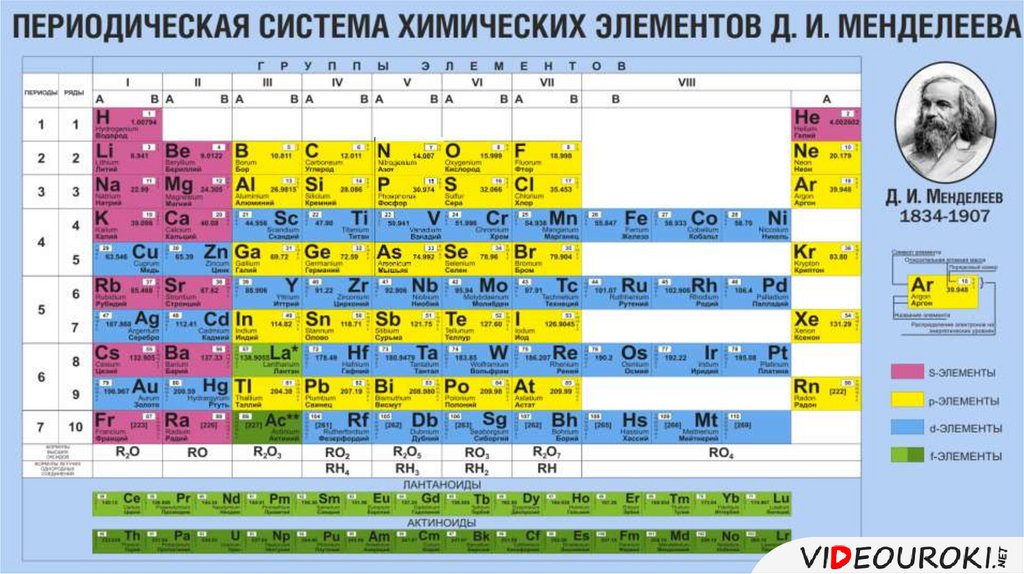 Существовала теория, согласно которой должно существовать более фундаментальное свойство элементов, которое могло бы лучше объяснить периодичность в свойствах элементов. Было обнаружено, что этим свойством является атомный номер элемента. Все аномалии классификации Менделеева исчезли, когда элементы расположили по возрастанию атомных номеров.
Существовала теория, согласно которой должно существовать более фундаментальное свойство элементов, которое могло бы лучше объяснить периодичность в свойствах элементов. Было обнаружено, что этим свойством является атомный номер элемента. Все аномалии классификации Менделеева исчезли, когда элементы расположили по возрастанию атомных номеров.
Решенные вопросы
Вопрос 1: Чем руководствовался Менделеев, оставив пробел в своей периодической таблице?
Ответ:
Менделеев оставил несколько пробелов в своей таблице, чтобы элементы со схожими свойствами были размещены вместе в одном вертикальном столбце или группе.
Вопрос 2: В исходной периодической таблице Менделеева какая группа элементов отсутствовала?
Ответ:
Поскольку инертные газы в то время не были известны, в исходной таблице Менделеева не было группы инертных газов.
Вопрос 3: Назовите некоторые достоинства таблицы Менделеева.
Ответ:
Некоторые достоинства таблицы Менделеева.
- Когда были обнаружены благородные газы, периодическая таблица могла их включить.
- Периодическая таблица Менделеева смогла предвидеть свойства нескольких элементов на основе их положения в периодической таблице.
- Периодическая таблица Менделеева предвидела существование нескольких неизвестных в то время элементов, таких как галлий, скандий и германий.
Вопрос 4: Как определялось положение кобальта и никеля в современной периодической таблице , ?
Ответ:
В периодической таблице Менделеева невозможно объяснить неправильный порядок атомных масс некоторых элементов, таких как кобальт с атомной массой 58,9 и никель с атомной массой 58,7. Чтобы сохранить сходство свойств, медь с более высокой атомной массой должна была быть помещена перед никелем.
Но в современной периодической таблице элементы расположены в порядке возрастания атомного номера. Итак, проблема была решена, поскольку атомный номер кобальта (27) меньше, чем у никеля (28). Поэтому никель с атомным номером 28 ставится после кобальта с атомным номером 27.
Вопрос 5: Сколько в периодической таблице Менделеева групп и периодов?
Ответ:
В исходной таблице Менделеева восемь групп и семь периодов.
Вопрос 6: Почему водород не занял правильное место в периодической таблице Менделеева?
Ответ:
Водород проявляет сходные свойства как со щелочными металлами, так и с галогенами. Таким образом, на основании его свойств был сделан вывод, что водород относится как к группе щелочных металлов, так и к группе галогенов. Следовательно, водород не был помещен в правильное положение в периодической таблице Менделеева.
Достижения периодической таблицы Менделеева
В то время как Доберейнер инициировал изучение периодических отношений, именно Менделеев был ответственен за публикацию периодического закона в первый раз. Менделеев совершил первый прорыв в классификации элементов. Он считался основным участником раннего развития периодической таблицы. В его периодической таблице элементы были расположены на основе их основных свойств, то есть атомной массы.
Периодическая таблица может быть определена как устройство, которое классифицирует все известные элементы на основе их свойств таким образом, что сходные элементы помещаются в один и тот же вертикальный столбец, а разнородные элементы помещаются в разные столбцы.
Когда он начал свою работу по классификации элементов, было известно всего 63 элемента. Он тщательно исследовал связь между атомной массой элемента и их химическими и физическими свойствами. Среди химических свойств он сосредоточился на соединениях, образованных элементами с водородом и кислородом, поскольку они очень реакционноспособны и образуют соединения с большинством элементов.
Менделеев взял 63 карточки, каждая из которых представляла элемент, на которые он записал свойства этого элемента, а также формулы его гидрида и оксида. Затем он разделил и расположил элементы с похожими свойствами и прикрепил карточки к стене одну за другой в вертикальный столбец. Когда он наблюдал за этими карточками после их расстановки, то обнаружил, что большинство элементов автоматически располагались в порядке возрастания их атомных масс. Также было замечено, что элементы со схожими свойствами появляются через определенный интервал времени или, другими словами, наблюдалось повторное появление элементов со схожими физическими и химическими свойствами через определенный интервал времени. На этой основе он сформулировал периодический закон, который гласит, что
«Физические и химические свойства элементов являются периодической функцией их атомных масс».
Периодическая функция означает, что свойства элементов повторяются через определенные регулярные промежутки времени.
. «когда элементы расположены в порядке возрастания их атомных масс, элементы со сходными свойствами повторяются через определенные регулярные интервалы».
Это повторение свойств называется периодичностью свойств.
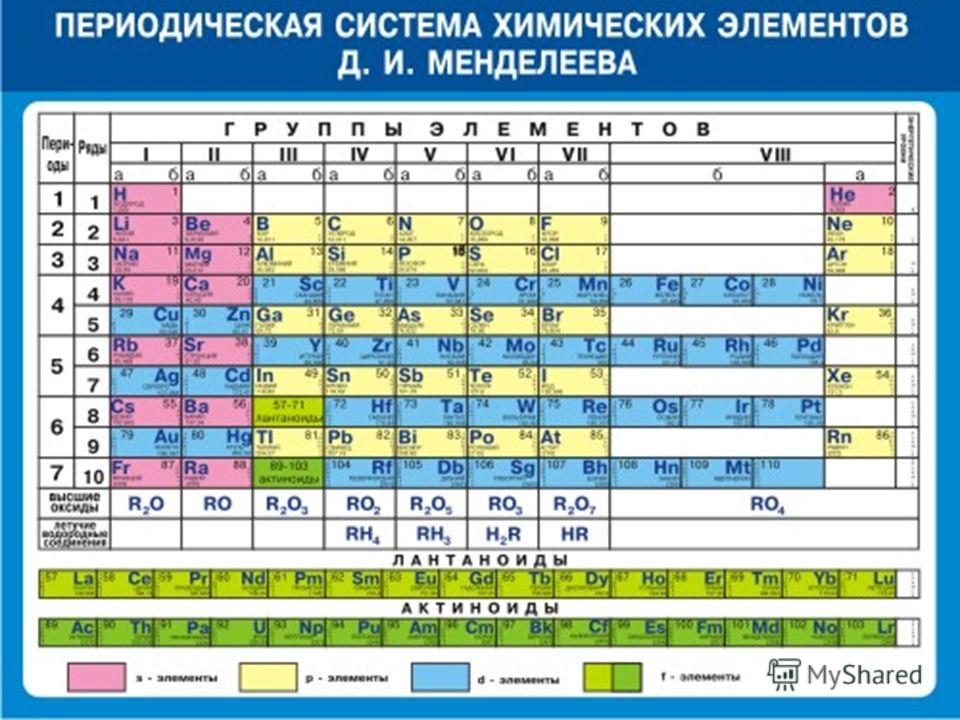
ПЕРИОДИЧЕСКАЯ ТАБЛИЦА МЕНДЕЛЕЕВА
Менделеев расположил известные 63 элемента в порядке возрастания их атомных масс в горизонтальные ряды, называемые периодами, таким образом, что элементы со сходными свойствами попадали в один и тот же вертикальный столбец, называемый группами.
Периодическая таблица Менделеева
Группа
я
II
III
IV
В
ВИ
VII
VIII
Оксид гидрид
Р 2 О
РХ
РО
РН 2
Р 2 О3
РН 3
РО 2
РН 4
Р 2 О 5
РН 3
РО 3
РН 2
Р 2 О 7
РХ
РО 4
Периоды
↓
А Б
А Б
А Б
А Б
А Б
А Б
А Б
Переходная серия
1
Н
1,008
2.
Ли
6.939
Быть
9.012
Б
10.81
С
12.011
№
14.007
О
15,999
Ф
18.998
3.
№
22,99
мг
24.31
АИ
29,98
Си
28.09
Р
30,974
S
32.06
Кл
35.453
4. Первая серия: вторая серия:
К
39.102
Cu
63,54
Ca
40.08
Zn
65.37
СК
44,96
Га
69,72
Ти
47. 90
90
Ge
72,59
В
50,94
Как
74,92
Кр
50.20
Se
78,96
Мн
54,94
руб.79.909
Fe Co Ni
55,85 58,93 58,71
5. Первая серия: вторая серия:
85,47
Аг
107,87
Ср
87,62
CD
112.40
Y
88.91
В
114,82
Zr
91.22
серийный номер
118,69
№
92.91
Сб
121,75
Мо
95,94
Те
127,60
ТК
99
я
126,90
Ру Rh Pd
101,07 102,91 106,4
6. Первая серия: вторая серия:
Первая серия: вторая серия:
CS
132,90
Au
196,97
Ба
137,34
ртутного столба200.59
138,91
Тл
204.37
Хф
178,49
Пб
207.19
Та
180,95
би
208,98
Вт
183,85
Ос Ир Пт
190,2 192,2 195,09
ХАРАКТЕРИСТИКИ ПЕРИОДИЧЕСКОЙ ТАБЛИЦЫ МЕНДЕЛЕЕВА:
Периодическая таблица Менделеева состоит из
Восемь вертикальных столбцов: Группы
Они обозначаются как I, II, III, IV, V, VI, VII и VIII. За исключением группы VIII, каждая группа далее подразделяется на две подгруппы, а именно А и В. Элементы, расположенные в левой части столбца, составляют подгруппу А, а элементы в правой части этого столбца составляют подгруппу.
Элементы подгруппы А известны как нормальные или репрезентативные элементы, в то время как элементы подгруппы В известны как переходные элементы. Это подразделение сделано из-за различия их свойств.
Нормальный/репрезентативный элемент | Переходные элементы |
Я А | ИБ |
II А | II Б |
III А | III Б |
IV А | IV Б |
В А | ВБ |
ВИ А | ВИ Б |
VII А | VII Б |
Группа VIII содержит 9 переходных элементов, объединенных в группу из 3 элементов, которые лежат в 4-м, 5-м и 6-м периодах.
Семь горизонтальных рядов: Периоды
В периодической таблице Менделеева было 7 горизонтальных столбцов, которые мы называем периодами и пронумерованы от 1 до 7.
Нобелевские газы не были известны во времена Менделеева. Так что для этих газов группы не было, а в 1900 г., когда были открыты нобелевские газы, была введена новая группа, называемая нулевой группой.
ДОСТИЖЕНИЯ ПЕРИОДИЧЕСКОЙ ТАБЛИЦЫ МЕНДЕЛЕЕВА:
- Систематическое изучение элементов. Периодическая таблица Менделеева упростила и систематизировала изучение элементов и их соединений, поскольку теперь их свойства можно было изучать как группы или семейства, а не по отдельности. Таким образом, зная свойства одного элемента в группе, можно легко предсказать свойства других элементов в группе.
- Предсказание новых элементов. Менделеев оставил пробелы или пропуски. Эти промежутки представляли собой неизвестные элементы.

- Исправление сомнительных атомных весов. С помощью таблицы Менделеева произведена коррекция сомнительных атомных весов некоторых элементов. Например, бериллию был присвоен атомный вес 13,5 на основе его эквивалентного веса (4,5) и валентности (ошибочно рассчитанной как 3).
Ограничения периодической таблицы Менделеева:
Несмотря на многие достоинства, периодическая таблица Менделеева имеет и определенные недостатки. Некоторые из них приведены ниже.
Вся эта классификация элементов Менделеева решила многие проблемы, такие как предсказание новых элементов, исправление атомных масс и свойства новых элементов, которые будут открыты позже, но не смогла объяснить некоторые проблемы, такие как
- . Положение атома водорода в периодической таблице: Водород помещен в группу IB.
 Однако он напоминает элементы группы IA (щелочные металлы), а также элементы группы VIIA (галогены). Поэтому положение водорода в периодической таблице определено неправильно.
Однако он напоминает элементы группы IA (щелочные металлы), а также элементы группы VIIA (галогены). Поэтому положение водорода в периодической таблице определено неправильно. - Аномальные пары элементов: Аргон (Ar, атомная масса 39,9) ставится перед калием (K, атомная масса 39,0). Точно так же кобальт (co, атомная масса 58,9) помещается перед никелем (Ni, атомная масса 58,7), а теллур (Te, атомная масса 127,6) помещается перед йодом (I, атомная масса 126,9).).
- Положение изотопов : Изотопы водорода с атомными массами 1, 2 и 3 должны быть размещены в трех местах. Однако изотопам не отведены отдельные места в периодической таблице.
Примечание: Изотопы — это атомы одного и того же элемента, имеющие разную атомную массу.
4. Некоторые похожие элементы выделяются, а разнородные элементы группируются.
Медь и ртуть были похожи по своим свойствам, но были отнесены к разным группам.


 Но в современной периодической таблице элементы расположены в порядке возрастания атомного номера. Итак, проблема была решена, поскольку атомный номер кобальта (27) меньше, чем у никеля (28). Поэтому никель с атомным номером 28 ставится после кобальта с атомным номером 27.
Но в современной периодической таблице элементы расположены в порядке возрастания атомного номера. Итак, проблема была решена, поскольку атомный номер кобальта (27) меньше, чем у никеля (28). Поэтому никель с атомным номером 28 ставится после кобальта с атомным номером 27.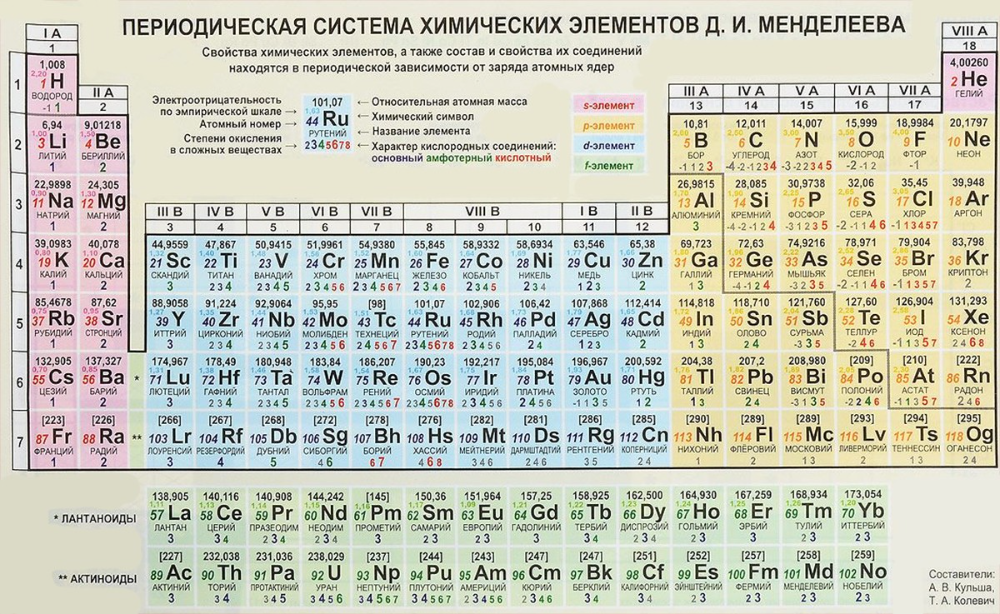
 Однако он напоминает элементы группы IA (щелочные металлы), а также элементы группы VIIA (галогены). Поэтому положение водорода в периодической таблице определено неправильно.
Однако он напоминает элементы группы IA (щелочные металлы), а также элементы группы VIIA (галогены). Поэтому положение водорода в периодической таблице определено неправильно.