Периодическая таблица элементов
Периодическая таблица элементов: нововведение и значок для научного общества
Ответы на некоторые важные вопросы:
Что подразумевается под Периодической таблицей элементов?
Таблица, которая идеально организована с помощью идентифицированных 118 химических элементов сверху вниз по вертикали (столбцы) и слева направо по горизонтали (строки), известна как периодическая таблица элементов. Она также называется «Периодической таблицей элементов». Химические элементы следуют некоторым важным периодическим тенденциям, на основании которых они расположены в Периодической таблице элементов [1].
Рисунок 1: Современная Периодическая таблица элементов
Первый вопрос, который возникает у человека, менее знакомого с химическими терминами, звучит так: «Какие химические элементы расположены в Периодической таблице элементов?». Ответ на этот вопрос прост: элементы состоят только из атомов одного типа и считаются строительными блоками любой материи, обнаруженной на Земле. Они отличаются друг от друга по своим физическим и химическим свойствам. Элементы – это вещества, которые нельзя разложить на более простые вещества [2]. Элементы существуют в трех основных формах материи в природе: твердом, жидком и газообразном. Многие элементы находятся в твердом состоянии при температуре окружающей среды. Некоторые в виде жидкости и несколько элементов в виде газа [3]. Примеры элементов в каждом состоянии вещества показаны ниже [4][5][6].
Они отличаются друг от друга по своим физическим и химическим свойствам. Элементы – это вещества, которые нельзя разложить на более простые вещества [2]. Элементы существуют в трех основных формах материи в природе: твердом, жидком и газообразном. Многие элементы находятся в твердом состоянии при температуре окружающей среды. Некоторые в виде жидкости и несколько элементов в виде газа [3]. Примеры элементов в каждом состоянии вещества показаны ниже [4][5][6].
а) Свободный металл желтоватого цвета, существующий в природе в виде твердого вещества [4].
АЗОТ ГАЗ
б) Элемент без запаха, вкуса и цвета, который существует в виде газа в природе [5].
MERCURY
c) Элемент, который находится в жидком состоянии при комнатной температуре и также известен как быстрорастворимое серебро [6].
Рисунок 1a: Периодическая таблица элементов в виде твердого тела (а. Золото), газа (б. Азот) и жидкости (в. Ртуть) [4][5][6].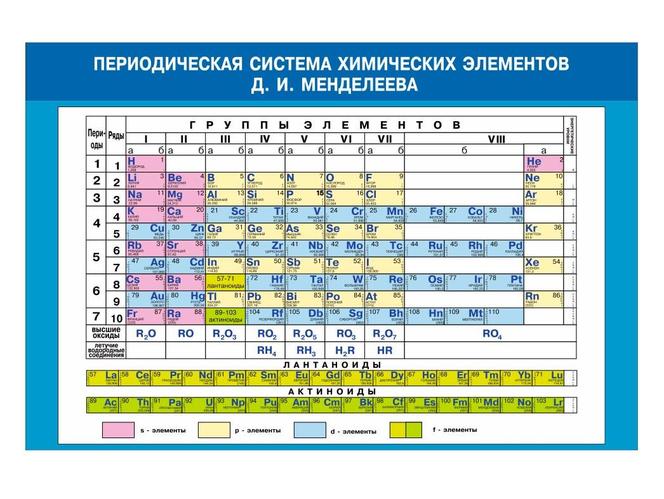
Что такое строки и столбцы в периодической таблице элементов?
Существует два способа расположения химических элементов в Периодической таблице элементов. Один из них — расположение элементов в строках, а второй — расположение химических элементов в столбцах. Периодическая таблица состоит из ряда строк и столбцов, которые обсуждаются ниже.
Группы: Столбцы, которые перемещаются вертикально вниз сверху вниз в периодической таблице элементов, называются «Группами». Химические элементы, относящиеся к одной и той же группе, имеют общее число электронов в своей валентной оболочке. Они могут иметь некоторые общие общие свойства [9]. Элементы расположены в 18 вертикальных столбцах, которые перемещаются сверху вниз в периодической таблице элементов. Визуальное представление приведено ниже.
Рисунок 2: Столбцы, представляющие количество групп в периодической таблице элементов [8].
В таблице ниже представлены группы, присутствующие в периодической таблице элементов, а также общие названия и названия их семейств [9] [11].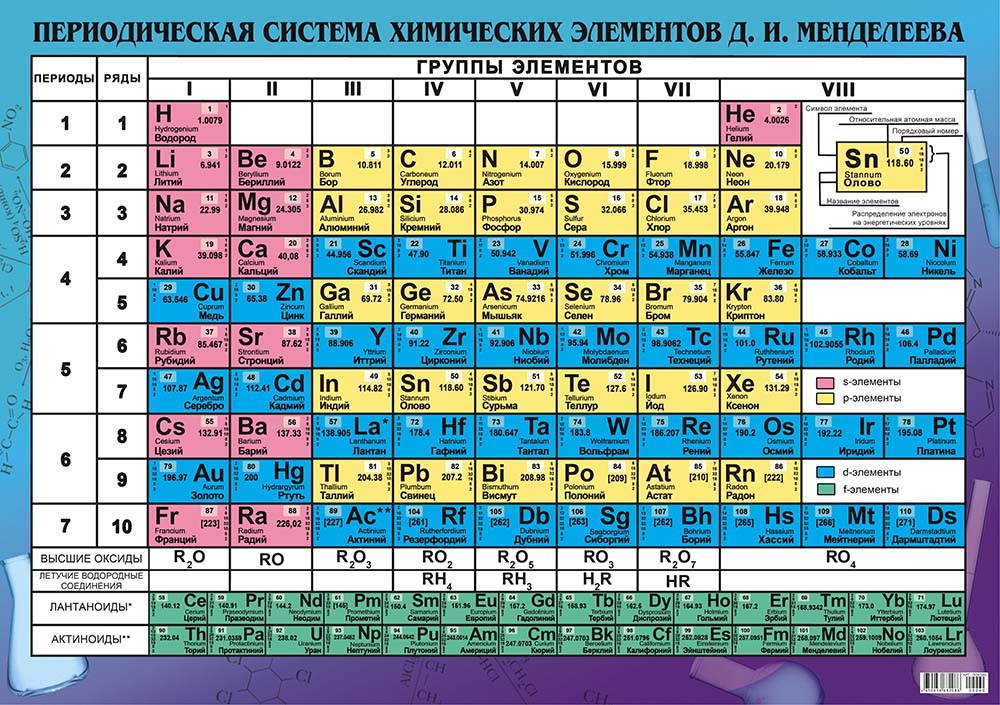
| ГРУППЫ | Обычные названия / Семейства | ||
| Группа 1 (IA) | Alkali Metals / Family Lithium | ||
| Группа 2 (IIA) | ALKALINE METALS / Bery. | ALKALIN (IIIB) | СЕМЕЙ СКАНДИЙ |
| Группа 4 (IVB) | Семейство титана | ||
| Группа 5 (VB) | Семейство ванадиума | 9 9.0062||
| Group 6 (VIB) | Chromium Family | ||
| Group 7 (VIIB) | Manganese Family | ||
| Group 8 (VIIIB) | Iron Family | ||
| Group 9 (viiib) | Семейство кобальтов | ||
| Группа 10 (VIIIB) | Семейство никелей | ||
| Группа 11 (IB) | Монасты/Конечница/Коптель.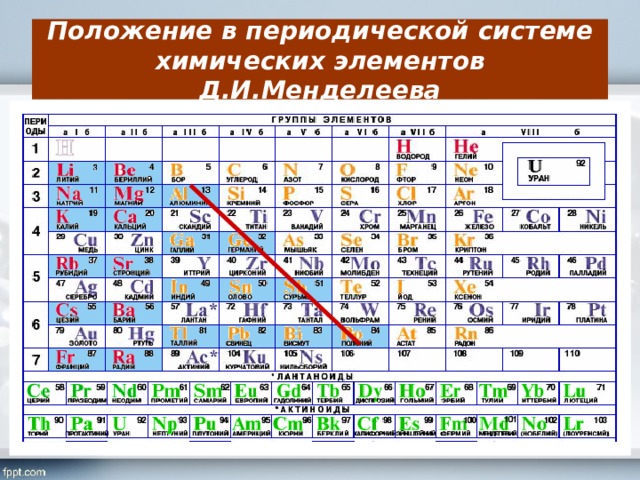 0057 0057 | ||
| ГРУППА 12 (IIB) | Платальные металлы / семейство цинка | ||
| Группа 13 (IIIA) | ICOASAGENS / BORON FAMOU Семейство кристаллогенов / углерода | ||
| Группа 15 (VA) | Пентели или пниктогены / семейство азота | ||
| Группа 16 (VIA) Семейство хлорангидридов / | 70057 | ||
| Group 17 (VIIA) | Halogens / Fluorine Family | ||
| Group 18 (VIIIA) | Aerogens or Noble gases/ Helium Family, Neon Family |
Periods: Строки, которые перемещаются слева направо по горизонтали в периодической таблице элементов, известны как периоды. Элементы организованы в семь периодов, перемещающихся слева направо по горизонтали в периодической таблице. Когда мы переходим от периода 1 к периоду 7 в периодической таблице, мы замечаем значительное увеличение числа орбиталей. Элементы, присутствующие в один и тот же период, имеют одинаковое количество атомных орбиталей [10].
Элементы, присутствующие в один и тот же период, имеют одинаковое количество атомных орбиталей [10].
Рисунок 3: Строки, представляющие количество периодов в Периодической таблице элементов [8].
В таблице ниже представлены горизонтальные периоды, присутствующие в периодической таблице элементов, а также символы названий химических элементов и их одно общее свойство [9] [12].
| НОМЕР ПЕРИОДА | НАИМЕНОВАНИЕ ЭЛЕМЕНТОВ |
| Период 1 | H, и He. → Они оба следуют правилу дублирования. |
| Период 2 | Li, Be, B, C, N, O, F и Ne. → У них есть электроны как на s-, так и на p-орбиталях. |
| Период 3 | Na, Mg, Al, Si, P, S, Cl и Ar. → Все они имеют один стабильный изотоп. |
| Период 4 | K, Ca, Sc, Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Zn, Ga, Ge, As, Se, Br, Kr . → Все они относятся к первому периоду, электроны валентной оболочки которого лежат на характерной орбитали d-блока, поэтому они называются элементами D-блока. |
| Период 5 | Rb, Sr, Y, Zr, Nb, Mo, Tc, Ru, Rh, Pd, Ag, Cd, In, Sn, Sn, Te, I, Xe . → Все они имеют одинаковую общую структуру, и в этот период также включен радиоактивный элемент Tc. |
| Период 6 | Cs, Ba, La, Ce, Pr, Nd, Pm, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu, Hf, Ta, W, Re, Os, Ir, Pt, Au, Hg, Tl, Pb, Bi, Po, At и Rn. → Все они являются элементами f-блока и внутренними переходными элементами. |
| Период 7 | Fr, Ra, Ac, Th, Pa, U, Np, Pu, Am, Cm, Bk, Cf, Es, Fm, Md, No, Lr, Rd, Db, Sg, Bh, Hs, Mt, Ds, Rg, Cn, Uut, Fl, Uup, Lv, Uus и Uuo. → Все они являются природными радиоактивными элементами. |
Что такое История Периодической таблицы элементов?
Периодическая таблица элементов — одно из величайших приложений в дипломатической истории современной химии. Она с благодарностью принята во всем мире научным сообществом. Это был огромный шаг в направлении научного сообщества к познанию окружающего мира [7]. Периодическая таблица элементов претерпела множество изменений, кардинальных изменений, поправок и улучшений за свою 200-летнюю историю, но, тем не менее, основная структура периодической таблицы остается прежней [16]. Краткая история Периодической таблицы элементов обсуждается ниже.
Отец периодической системы: Русский химик Дмитрий Менделеев считается «отцом периодической системы». Он был популярным лектором в Санкт-Петербургском университете в России. Книг по органической и современной химии на русском языке в то время в России не было. Дмитрий Менделеев решил написать книгу самостоятельно и начал работу над «Основами химии». Во время своей работы он признал бессистемность расположения элементов. Он решил организовать 63 химических элемента, которые были известны в то время, в табличной форме [1].
Дмитрий Менделеев решил написать книгу самостоятельно и начал работу над «Основами химии». Во время своей работы он признал бессистемность расположения элементов. Он решил организовать 63 химических элемента, которые были известны в то время, в табличной форме [1].
Как выглядела периодическая таблица элементов Менделеева?
Дмитрий Менделеев записал свойства каждого элемента и начал их систематизировать. Он следовал двум основным инструментам классификации элементов и каким-то образом преуспел в систематическом упорядочении химических элементов по относительному атомному весу (количество протонов и нейтронов вместе с весом электронов), а также по валентным электронам (количество электронов, присутствующих в последней оболочке). /орбита) в конце 19 в.век [1]. Окончательное отображение Периодической таблицы элементов Дмитрия Менделеева показано ниже [7].
Рис. 4. Периодическая таблица элементов Менделеева Впервые опубликована в 1869 г. [7].
Тогда возникает вопрос, почему в периодической таблице элементов Менделеева был видимый разрыв между химическими элементами?
Удовлетворительный ответ на этот конкретный вопрос заключается в том, что перед публикацией своей первой периодической таблицы элементов он мудро решил оставить видимые промежутки между химическими элементами в периодической таблице. Возможной причиной было его предсказание о неисследованных и неопознанных элементах, которые еще предстоит открыть. Он оказался невероятно прав, когда через пятнадцать лет были открыты три новых элемента, которые заполнили пробелы между элементами в Периодической таблице элементов. Периодическая система Менделеева названа «Периодической таблицей элементов» из-за расположения химических элементов в виде горизонтальных рядов и вертикальных столбцов, которые в совокупности образуют таблицу [17].
Возможной причиной было его предсказание о неисследованных и неопознанных элементах, которые еще предстоит открыть. Он оказался невероятно прав, когда через пятнадцать лет были открыты три новых элемента, которые заполнили пробелы между элементами в Периодической таблице элементов. Периодическая система Менделеева названа «Периодической таблицей элементов» из-за расположения химических элементов в виде горизонтальных рядов и вертикальных столбцов, которые в совокупности образуют таблицу [17].
Что обычно подразумевается под «Современной периодической таблицей элементов»? Как выглядела современная периодическая таблица элементов?
Элементы удовлетворительно расположены в современной периодической таблице элементов на основе их периодичности и атомного номера. Многие ученые работали над усовершенствованием периодической системы Менделеева. Так что мы не можем отдать должное Дмитрию Менделееву. Некоторые из них – Антуан Лавуазье (он сгруппировал металлы и неметаллы), Иоганн Вольфанг Доберейнер (он обнаружил сходство в физических и химических свойствах элементов или ввел термин триады), Джон Ньюлендс (ввел закон октав) и Генри Мозли. (Использовал рентгеновские лучи для измерения длин волн каждого элемента и перегруппировал элементы на основе атомных номеров). Фотографии ученых представлены ниже [19].
(Использовал рентгеновские лучи для измерения длин волн каждого элемента и перегруппировал элементы на основе атомных номеров). Фотографии ученых представлены ниже [19].
Рисунок 5: Периодическая таблица элементов, вносящих вклад (а) Антуан Лавуазье, (б) Иоганн Вольфанг, (в) Джон Ньюлендс и (г) Генри Мозли [19].
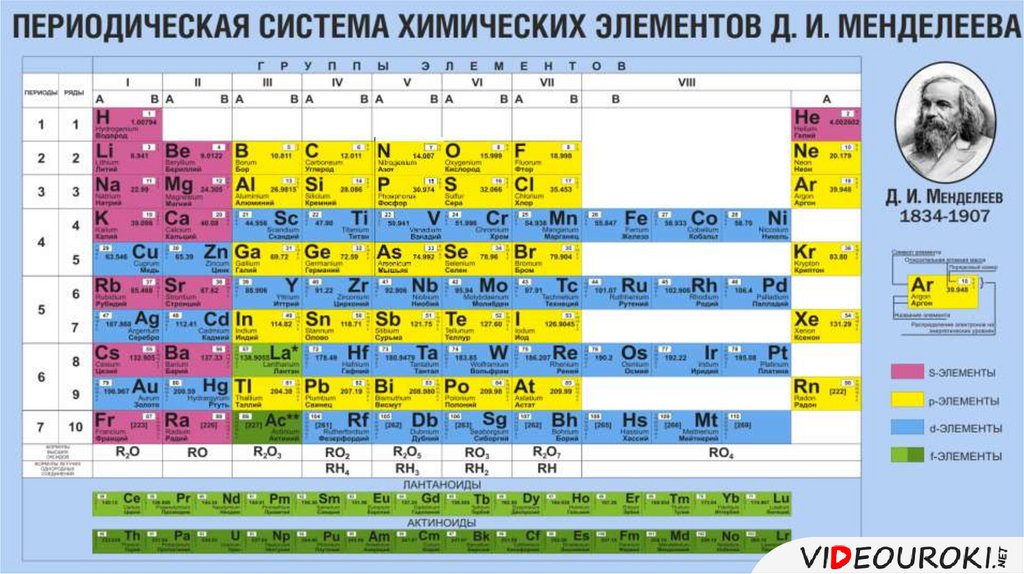
Современная периодическая таблица элементов имеет некоторые уникальные особенности, которых нет в периодической системе Менделеева. Современная периодическая система сохраняет единообразие, потому что элементы расположены в соответствии с возрастающими атомными номерами. С другой стороны, в Периодической системе Менделеева элементы были расположены на основе атомного веса и имели промежутки между ними для неоткрытых элементов. Современная периодическая таблица элементов основана на 118 химических элементах, тогда как периодическая таблица Менделеева содержит 63 элемента. Самым завораживающим усовершенствованием современной таблицы Менделеева является создание отдельных блоков или групп для благородных газов и переходных элементов [18].
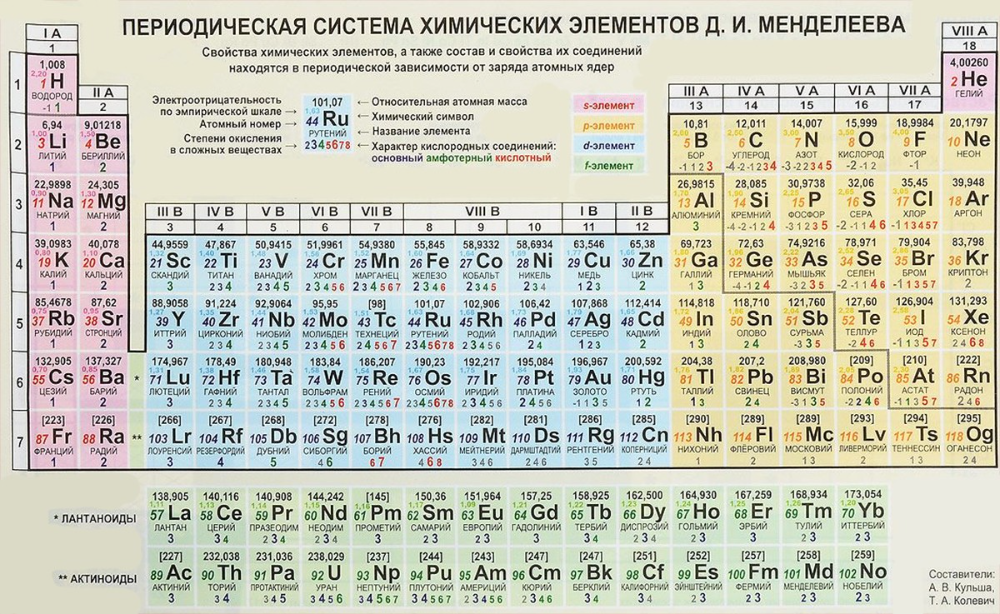
Визуальное представление современной таблицы Менделеева со 118 элементами вместе с отдельными переходными элементами и группами нобелевских газов показано ниже [20].
Рисунок 6: Современная периодическая таблица элементов [20].
Сколько конкретных блоков элементов присутствует в Периодической таблице элементов?
Все химические элементы периодической таблицы элементов расположены в четырех определенных блоках, которые описывают положение самого удаленного электрона элемента на определенной орбитали [12] [8].
- Элементы S-блока:
Элементы S-блока — это элементы, у которых самые внешние электроны находятся на s-орбиталях. Эти элементы имеют низкие температуры плавления, более электроположительны, химически активны и мягки. Пример: щелочные металлы и щелочноземельные металлы. - Элементы P-блока:
Элементы P-блока — это те элементы, у которых самые внешние электроны находятся на p-орбиталях. Эти элементы образуют ковалентные связи за счет взаимного обмена электронами. Пример: углерод, кислород и сера.
Эти элементы образуют ковалентные связи за счет взаимного обмена электронами. Пример: углерод, кислород и сера. - Элементы D-блока:
Элементы D-блока — это элементы, у которых самые удаленные электроны находятся на d-орбиталях. Эти элементы образуют окрашенные соли и имеют высокие температуры плавления или кипения. Пример: переходные элементы. - Элементы F-блока:
Элементы F-блока — это элементы, у которых самые внешние электроны находятся на f-орбиталях. Это металлы с высокой температурой плавления и несколькими степенями окисления. Пример: лантаниды и актиниды [12].
Рисунок 7: Четыре блока современной периодической таблицы элементов [8].
Каким периодическим трендам обычно следуют элементы, представленные в Периодической таблице элементов?
Основные периодические тенденции, которым следуют элементы в периодической таблице элементов, основаны на некоторых свойствах химических элементов, которые обсуждаются ниже [21].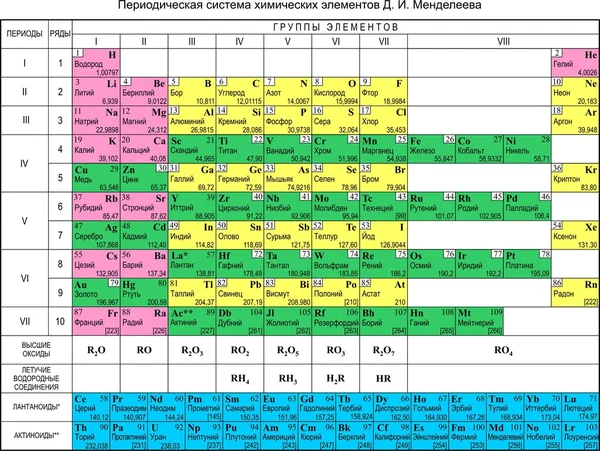
- Атомный радиус
- Сродство к электрону
- Энергия ионизации
- Электроотрицательность
- Металлический характер элементов
- Неметаллический характер элементов
АТОМНЫЙ РАДИУС: Расстояние между центром ядра атома и его валентной оболочкой называется атомным радиусом.
- Тенденция по группе: Атомный радиус увеличивается, когда мы движемся сверху вниз в группе. Причина: Есть две причины увеличения атомного радиуса по группе: увеличение количества оболочек и увеличение заряда ядра.
- Тенденция за период: При движении слева направо в периоде атомный радиус постепенно уменьшается. Причина: Ядерный заряд увеличивается, но количество снарядов остается прежним.
СВЯЗЬ С ЭЛЕКТРОНОМ: Количество энергии, необходимое для присоединения электрона к атому, называется сродством к электрону.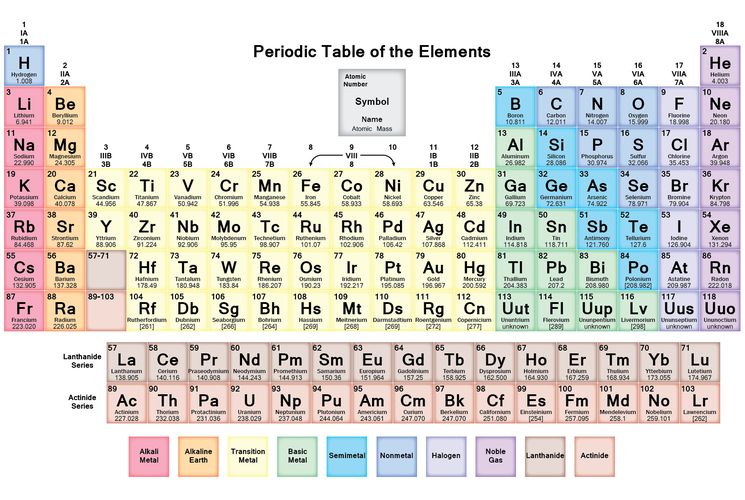
- Тенденция по группе: По мере продвижения в группе сверху вниз сродство к электрону уменьшается.
- Тенденция за период: При движении слева направо в периоде сродство к электрону увеличивается. Причина: Заряд ядра увеличивается, но атомный радиус уменьшается.
Рисунок 8: Периодическая таблица и периодические тренды [22].
ЭНЕРГИЯ ИОНИЗАЦИИ: Количество энергии, необходимое для удаления самого внешнего электрона атома, называется энергией ионизации.
- Тенденция по группе: Энергия ионизации уменьшается по мере продвижения сверху вниз в группе периодической таблицы. Причина: Увеличение атомного радиуса в группе.
- Тренд за период: Энергия ионизации увеличивается, когда мы движемся слева направо по горизонтали. Причина: Увеличение заряда ядра и уменьшение атомного радиуса.

ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ: Способность атома притягивать к себе спаренные электроны для образования химической связи с другим атомом.
- Тенденция по группе: Электроотрицательность уменьшается по мере продвижения сверху вниз в периоде.
- Тенденция за период: Электроотрицательность увеличивается, когда мы движемся слева направо в периоде. Причина: Электронолюбивый характер увеличивается с увеличением заряда ядра.
МЕТАЛЛИЧЕСКИЙ ХАРАКТЕР ЭЛЕМЕНТОВ:
- Тенденция за период: Металлический характер химических элементов уменьшается по мере продвижения слева направо по периоду периодической таблицы.
- Тенденция по группе: Металлический характер химических элементов увеличивается по мере продвижения сверху вниз в группе периодической таблицы.
НЕМЕТАЛЛИЧЕСКИЙ ХАРАКТЕР ЭЛЕМЕНТОВ:
- Тенденции по группе: Неметаллический характер химических элементов уменьшается по мере продвижения сверху вниз в группе периодической таблицы.

- Тенденции за период: Неметаллический характер химических элементов усиливается по мере продвижения слева направо по периоду в периодической таблице.
Почему группы в периодической таблице элементов, естественно, имеют значительное соответствие друг другу?
Элементы, присутствующие в 18 группах периодической таблицы элементов, расположены таким образом, что члены каждой группы демонстрируют значительное соответствие друг другу [13]. Причина: причина этого соответствия заключается в том, что элементы, принадлежащие к одной и той же группе в периодической таблице, имеют почти одинаковые химические и физические свойства из-за одинакового количества электронов в самой внешней оболочке. Другой причиной переписки является обмен однотипными связями. Эта схожая химическая природа в равной степени отделяет членов группы от остальных химических элементов, принадлежащих к другим группам периодической таблицы [13] [14]. Например, членами первой группы являются водород (H), литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr), и все они имеют один электрон. в их внешней оболочке. Все эти элементы обладают общими физическими свойствами, такими как хрупкость, мягкость, пластичность, блеск, ковкость и т. д. [15].
в их внешней оболочке. Все эти элементы обладают общими физическими свойствами, такими как хрупкость, мягкость, пластичность, блеск, ковкость и т. д. [15].
Рис. 10: (а) Представление элементов первой группы в периодической таблице элементов.
(b) Представление валентных электронов на самой внешней оболочке каждого члена группы [14].
Они в равной степени обладают общими химическими свойствами, такими как химическая активность, температуры плавления и кипения [14].
Рисунок 9: Реакционная способность элементов группы 1 [14].
Почему периодическая таблица элементов считается важной для научного сообщества?
Значительное мастерство и практическое мастерство точной Периодической таблицы элементов заключается в том, что она адекватно обеспечивает химика обширными знаниями о химических элементах, обычно существующих в божественной природе. Он дает конкретную информацию о названиях химических элементов, их атомных номерах, их символах и атомных весах открытых элементов.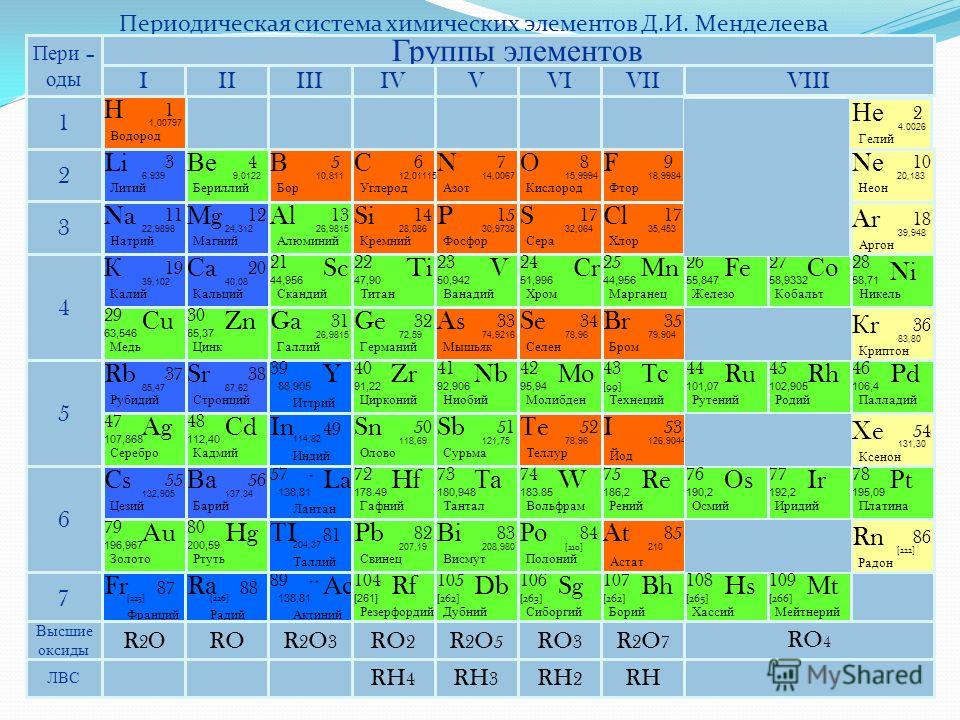 Он служит отличным инструментом для решения задач по химии.
Он служит отличным инструментом для решения задач по химии.
Рисунок 11: Информация об элементе из периодической таблицы элементов [23].
Эта систематизированная Периодическая таблица элементов позволяет химикам мгновенно прогнозировать и распознавать физические и химические свойства элементов. Ученые могут наблюдать химическую активность, возможные химические реакции между различными элементами и периодические тенденции, которые соблюдались при расположении элементов в периодической таблице элементов. Мы можем наблюдать, как она висит на стенах каждой лаборатории, конференц-зала и библиотеки по всему миру, потому что она помогает химикам во всем мире [16].
ССЫЛКИ:
- Как периодическая таблица используется сегодня?
- Химический элемент
- Какие элементы существуют в виде газа, жидкости, твердого тела при комнатной температуре?
- Химические и физические свойства золота
- Химический элемент – ртуть
- Что такое периодическая таблица?
- Как устроена периодическая таблица (по атомной массе или числу?
- Разница между группой элементов и периодом .

- Периоды периодической таблицы .
- Как группа может использоваться для характеристики элемента
- Идентификация блоков элементов в периодической таблице
- Химия – Периодическая таблица
- Что общего у элементов в одной группе?
- Изменение физических свойств внутри группы
- Эволюция периодической таблицы
- Развитие периодической таблицы
- Отличие современной периодической таблицы от периодической таблицы Менделеева
- Краткая история периодической таблицы
- Периодическая таблица элементов
- Тенденции периодических свойств в периодической таблице и причина изменения
- Периоды в периодической таблице
- Химический элемент – олово
Периодическая таблица химических элементов представляет собой табличный метод отображения химических элементов. Хотя предшественники этой таблицы существуют, ее изобретение обычно приписывают русскому химику Дмитрию Менделееву в 1869 году. Периодическая таблица в настоящее время повсеместно используется в академической дисциплине химии, предоставляя чрезвычайно полезную основу для классификации, систематизации и сравнения всех многочисленных форм химического поведения. Таблица также нашла широкое применение в физике, биологии, технике и промышленности. Текущая стандартная таблица содержит 117 подтвержденных элементов по состоянию на 16 октября 2006 г. (в то время как элемент 118 был синтезирован, элемент 117 – нет). Дополнительные рекомендуемые знания
Методы отображения периодической таблицыСтандартная периодическая таблица
Альтернативные версии (Схема/вид таблицы )
Существуют и другие альтернативные периодические таблицы. РасположениеСтруктура таблицы Менделеева демонстрирует повторяющиеся («периодические») химические свойства. Элементы перечислены в порядке возрастания атомного номера (то есть количества протонов в атомном ядре). Ряды располагаются так, чтобы элементы со схожими свойствами попадали в одни и те же вертикальные столбцы ( “группы” ). Согласно квантово-механическим теориям электронной конфигурации внутри атомов, каждая горизонтальная строка ( “период” ) в таблице соответствовала заполнению квантовой оболочки электронами. Дальше по таблице расположены более длинные периоды, в которых элементы группируются в В печатных таблицах каждый элемент обычно указан с его символом элемента и атомным номером; во многих версиях таблицы также указана атомная масса элемента и другая информация, такая как его сокращенная электронная конфигурация, электроотрицательность и наиболее распространенные числа валентности. По состоянию на 2006 год таблица содержит 117 химических элементов, открытие которых подтверждено. Девяносто два найдены естественным образом на Земле, а остальные являются синтетическими элементами, которые были получены искусственно в ускорителях частиц. Элементы 43 (технеций) и 61 (прометий), хотя и имеют более низкий атомный номер, чем встречающийся в природе элемент 92, уран, являются синтетическими; элементы 93 (нептуний) и 94 (плутоний) перечислены вместе с синтетическими элементами, но были обнаружены в следовых количествах на Земле. Периодичность химических свойствОсновная ценность периодической таблицы заключается в возможности предсказать химические свойства элемента на основе его положения в таблице. Следует отметить, что свойства изменяются по-разному при перемещении по вертикали по столбцам таблицы, чем при перемещении по горизонтали по строкам. Группы и периоды
Группы считаются наиболее важным методом классификации элементов. В некоторых группах элементы имеют очень похожие свойства и демонстрируют четкую тенденцию свойств вниз по группе — этим группам обычно дают тривиальные (несистематические) имена, например щелочные металлы, щелочноземельные металлы, галогены и благородные газы. Некоторые другие группы в периодической таблице демонстрируют меньше сходств и/или вертикальных тенденций (например, группы 14 и 15), и у них нет тривиальных названий, и они обозначаются просто номерами групп.
Хотя группы являются наиболее распространенным способом классификации элементов, существуют некоторые области периодической таблицы, где горизонтальные тенденции и сходство свойств более значительны, чем вертикальные групповые тенденции. Это может быть верно для d-блока (или «переходных металлов») и особенно для f-блока, где лантаноиды и актиноиды образуют два существенных горизонтальных ряда элементов. Периодические тренды группСовременные квантово-механические теории строения атома объясняют групповые тенденции, предполагая, что элементы в одной группе имеют одинаковые электронные конфигурации в своей валентной оболочке, что является наиболее важным фактором в объяснении их сходных свойств. Элементы в той же группе также демонстрируют закономерности в их атомном радиусе, энергии ионизации и электроотрицательности. Сверху вниз в группе атомные радиусы элементов увеличиваются. Поскольку заполненных энергетических уровней больше, электроны находятся дальше от ядра. Сверху каждый последующий элемент имеет более низкую энергию ионизации, потому что легче удалить электрон, поскольку атомы менее тесно связаны. Точно так же группа также увидит уменьшение электроотрицательности сверху вниз из-за увеличения расстояния между валентными электронами и ядром. Периодические тренды периодов Элементы того же периода демонстрируют тенденции изменения атомного радиуса, энергии ионизации, сродства к электрону и электроотрицательности. ПримерыБлагородные газы Все элементы группы 18, благородные газы, имеют полновалентные оболочки. Это означает, что им не нужно реагировать с другими элементами, чтобы получить полную оболочку, и поэтому они гораздо менее реакционноспособны, чем другие группы. ГалогеныВ группе 17, известной как галогены, элементам не хватает всего одного электрона для заполнения их оболочек. Поэтому в химических реакциях они склонны приобретать электроны (склонность приобретать электроны называется электроотрицательностью). Наиболее ярко это свойство проявляется у фтора (наиболее электроотрицательного элемента всей таблицы) и уменьшается с увеличением периода. В результате все галогены образуют кислоты с водородом, такие как плавиковая кислота, соляная кислота, бромистоводородная кислота и йодистоводородная кислота, все в форме НХ . Их кислотность увеличивается с увеличением периода, например, в отношении йода и фтора, так как крупный ион I – более устойчив в растворе, чем малый F – , меньше объем, в котором можно диспергировать заряд. Переходные металлыДля переходных металлов (группы с 3 по 12) часто важны горизонтальные тренды по периодам, а также вертикальные тренды вниз по группам; различия между соседними группами обычно не разительны. В реакциях с переходными металлами часто участвуют скоординированные частицы. Лантаниды и актинидыХимические свойства лантаноидов (элементы 57-71) и актинидов (элементы 89-103) даже больше похожи друг на друга, чем у переходных металлов, и разделить их смесь может быть очень сложно. Это важно в химической очистке урана, связанной с атомной энергетикой. Структура периодической таблицы Основным фактором, определяющим химические свойства элемента, является его электронная конфигурация, особенно электроны валентной оболочки. Например, любые атомы с четырьмя валентными электронами, занимающими p-орбитали, будут демонстрировать некоторое сходство. Тип орбитали, на которой находятся самые внешние электроны атома, определяет «блок», к которому он принадлежит. Общее количество электронных оболочек атома определяет период, к которому он принадлежит. Каждая оболочка делится на разные подоболочки, которые по мере увеличения атомного номера заполняются примерно в таком порядке (принцип Ауфбау):
Отсюда и структура таблицы. Продвигаясь по группе от самого легкого элемента к самому тяжелому, электроны внешней оболочки (наиболее легкодоступные для участия в химических реакциях) находятся на одном и том же типе орбиталей, с похожей формой, но со все более высокой энергией и средним расстояние от ядра. Например, все электроны внешней оболочки (или «валентности») первой группы, возглавляемые водородом, имеют один электрон на s-орбитали. В водороде эта s-орбиталь находится в самом низком возможном энергетическом состоянии любого атома, орбитали первой оболочки (и представлена положением водорода в первом периоде таблицы). Во франции, самом тяжелом элементе группы, электрон внешней оболочки находится на орбитали седьмой оболочки, в среднем значительно дальше от ядра, чем электроны, заполняющие все оболочки ниже его по энергии. В качестве другого примера, и углерод, и свинец имеют по четыре электрона на своих орбиталях внешней оболочки. Обратите внимание, что по мере увеличения атомного номера (т. е. заряда атомного ядра) это приводит к большей спин-орбитальной связи между ядром и электронами, что снижает достоверность квантово-механической модели орбитальной аппроксимации, которая рассматривает каждую атомную орбиталь как отдельная сущность. Из-за важности самой внешней оболочки различные области периодической таблицы иногда называют блоками периодической таблицы , названными в соответствии с подоболочкой, в которой находится «последний» электрон, например. s -блок, p -блок, d -блок и т.д. Что касается элементов Ununbium, ununtrium, ununquadium и т. д., то это элементы, которые были открыты, но до сих пор не получили названия. История
В Древней Греции влиятельный греческий философ Аристотель предположил, что существует четыре основных элемента: воздух, огонь, земля и вода. Исходная таблица была создана до открытия субатомных частиц или формулирования современных квантово-механических теорий строения атома. Если упорядочить элементы по атомной массе, а затем сопоставить некоторые другие свойства с атомной массой, можно увидеть волнистость или периодичность к этим свойствам в зависимости от атомной массы. Первым, кто обнаружил эти закономерности, был немецкий химик Иоганн Вольфганг Доберейнер, который в 1829 г. заметил ряд триад сходных элементов:
В 1829 году Доберейнер предложил Закон триад: средний элемент в триаде имел атомный вес, который был средним значением двух других членов. За этим последовал английский химик Джон Ньюлендс, который в 1865 году заметил, что при размещении в порядке возрастания атомного веса элементы со сходными физическими и химическими свойствами повторяются с интервалом в восемь, который он сравнил с октавами музыки, хотя его закон 90 678 октав высмеивался современниками. [2] Однако, несмотря на успех для некоторых элементов, закон октав Ньюлендса потерпел неудачу по двум причинам:
Наконец, в 1869 году русский профессор химии Дмитрий Иванович Менделеев и четыре месяца спустя немец Юлий Лотар Мейер независимо друг от друга разработали первую периодическую таблицу, расположив элементы по массе. Более ранние попытки перечислить элементы, чтобы показать взаимосвязь между ними (например, Ньюлендс), обычно включали их упорядочение по атомной массе. Ключевая идея Менделеева при разработке периодической таблицы заключалась в том, чтобы расположить элементы так, чтобы проиллюстрировать повторяющиеся («периодические») химические свойства (даже если это означало, что некоторые из них не располагались в массовом порядке), и оставить пробелы для «отсутствующих» элементов. Менделеев использовал свою таблицу, чтобы предсказать свойства этих «недостающих элементов», и многие из них действительно были обнаружены и хорошо соответствовали предсказаниям. С развитием теорий строения атома (например, Генри Мозли) стало очевидно, что Менделеев перечислил элементы в порядке возрастания атомного номера (т. е. чистого количества положительного заряда атомного ядра). Эта последовательность почти идентична последовательности возрастания атомной массы. Чтобы проиллюстрировать повторяющиеся свойства, Менделеев начал в своей таблице новые строки так, чтобы элементы со схожими свойствами попадали в одни и те же вертикальные столбцы ( “группы” ). С развитием современных квантово-механических теорий электронной конфигурации внутри атомов стало очевидно, что каждая горизонтальная строка ( «период» ) в таблице соответствует заполнению квантовой оболочки электронами.
В исходной таблице Менделеева каждый период был одинаковой длины. В современных таблицах периоды постепенно увеличиваются, и элементы группируются в s-, p-, d- и 9. Брайсон, Билл (2004). Краткая история почти всего .
Дальнейшее чтение
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Найдите дополнительную информацию о Периодической таблице, выполнив поиск по дочерним проектам Википедии. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|


 Эти элементы образуют ковалентные связи за счет взаимного обмена электронами. Пример: углерод, кислород и сера.
Эти элементы образуют ковалентные связи за счет взаимного обмена электронами. Пример: углерод, кислород и сера.
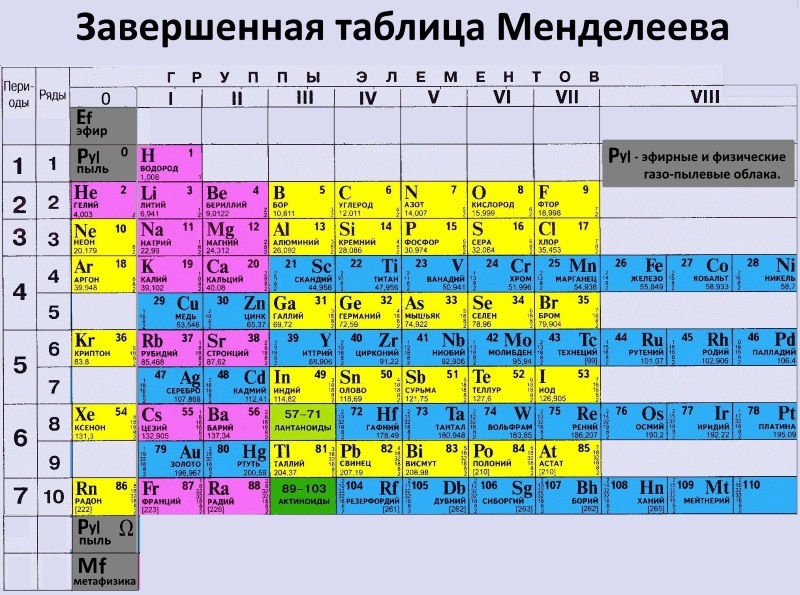
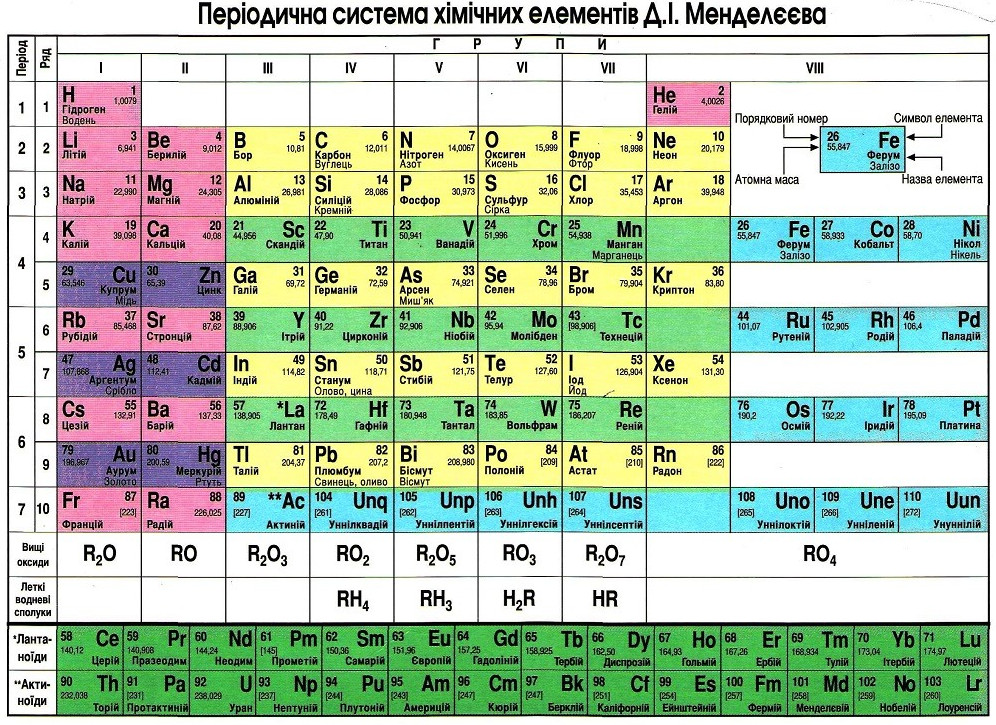
 . Менделеев задумал таблицу для иллюстрации повторяющихся («периодических») тенденций в свойствах элементов. Компоновка таблицы со временем уточнялась и расширялась по мере открытия новых элементов и разработки новых теоретических моделей для объяснения химического поведения. [1]
. Менделеев задумал таблицу для иллюстрации повторяющихся («периодических») тенденций в свойствах элементов. Компоновка таблицы со временем уточнялась и расширялась по мере открытия новых элементов и разработки новых теоретических моделей для объяснения химического поведения. [1]  2 Альтернативные версии (Макет/вид таблицы)
2 Альтернативные версии (Макет/вид таблицы)

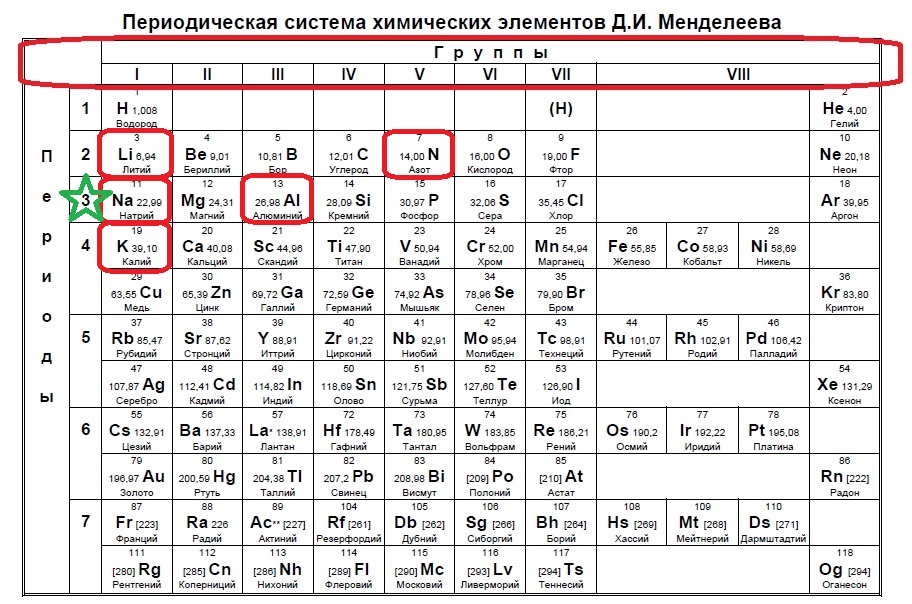
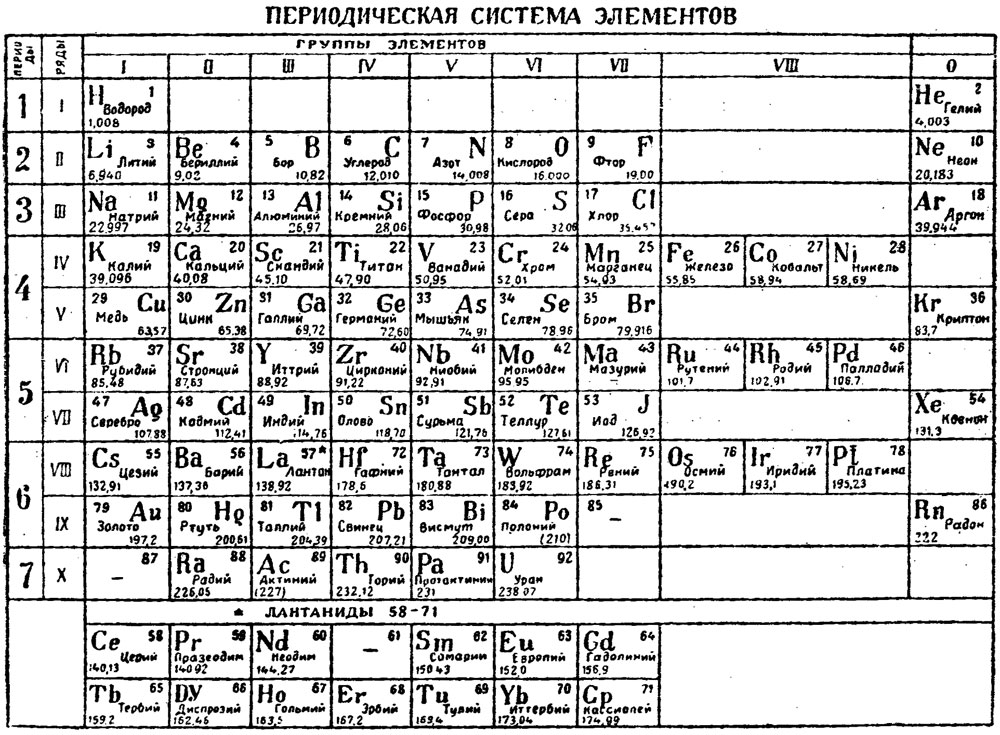
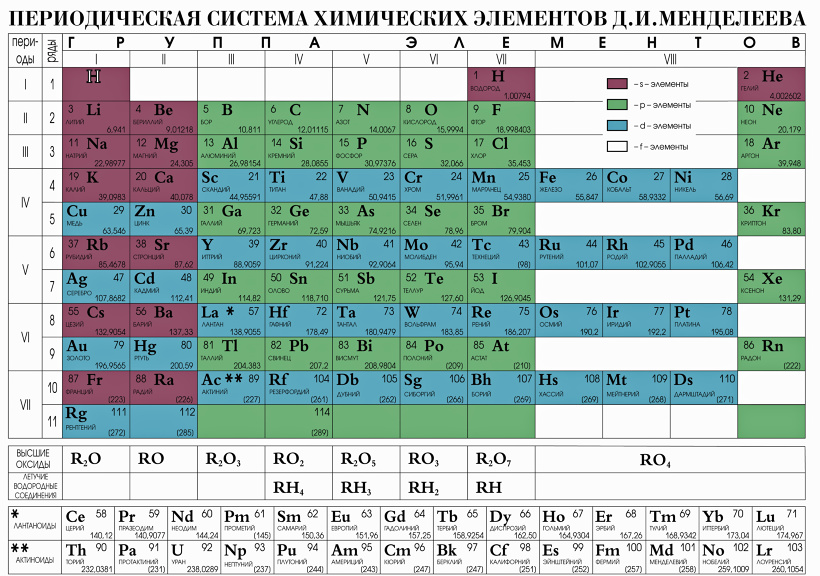
 При движении слева направо по периоду радиус атома обычно уменьшается. Это происходит потому, что каждый последующий элемент имеет добавленный протон и электрон, которые заставляют электрон приближаться к ядру. Это уменьшение атомного радиуса также приводит к увеличению энергии ионизации при движении слева направо по периоду. Чем прочнее связан элемент, тем больше энергии требуется для отрыва электрона. Точно так же электроотрицательность будет увеличиваться так же, как энергия ионизации, из-за силы притяжения, оказываемой ядром на электроны. Сродство к электрону также показывает небольшую тенденцию в течение периода. Металлы (левая часть точки) обычно имеют более низкое сродство к электрону, чем неметаллы (правая часть точки), за исключением инертных газов.
При движении слева направо по периоду радиус атома обычно уменьшается. Это происходит потому, что каждый последующий элемент имеет добавленный протон и электрон, которые заставляют электрон приближаться к ядру. Это уменьшение атомного радиуса также приводит к увеличению энергии ионизации при движении слева направо по периоду. Чем прочнее связан элемент, тем больше энергии требуется для отрыва электрона. Точно так же электроотрицательность будет увеличиваться так же, как энергия ионизации, из-за силы притяжения, оказываемой ядром на электроны. Сродство к электрону также показывает небольшую тенденцию в течение периода. Металлы (левая часть точки) обычно имеют более низкое сродство к электрону, чем неметаллы (правая часть точки), за исключением инертных газов.
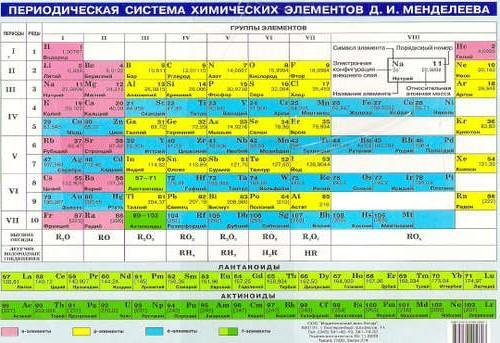
 Число электронов валентной оболочки определяет семейство или группу, к которой принадлежит элемент.
Число электронов валентной оболочки определяет семейство или группу, к которой принадлежит элемент. Поскольку самые внешние электроны определяют химические свойства, те, у которых одинаковое количество валентных электронов, группируются вместе.
Поскольку самые внешние электроны определяют химические свойства, те, у которых одинаковое количество валентных электронов, группируются вместе.
 На все эти элементы можно было бы среагировать, чтобы создать еще один; напр. , земля и огонь объединились в лаву. Однако эта теория была отвергнута, когда начали открывать настоящие химические элементы. Ученым требовалась легкодоступная, хорошо организованная база данных, с помощью которой можно было бы записывать и получать доступ к информации об элементах. Это должно было быть известно как периодическая таблица.
На все эти элементы можно было бы среагировать, чтобы создать еще один; напр. , земля и огонь объединились в лаву. Однако эта теория была отвергнута, когда начали открывать настоящие химические элементы. Ученым требовалась легкодоступная, хорошо организованная база данных, с помощью которой можно было бы записывать и получать доступ к информации об элементах. Это должно было быть известно как периодическая таблица. Плотность некоторых триад следовала аналогичной схеме. Вскоре другие ученые обнаружили, что химические отношения выходят за рамки триад. К группе Cl/Br/I добавляли фтор; сера, кислород, селен и теллур были сгруппированы в семейство; азот, фосфор, мышьяк, сурьма и висмут были отнесены к другой группе.
Плотность некоторых триад следовала аналогичной схеме. Вскоре другие ученые обнаружили, что химические отношения выходят за рамки триад. К группе Cl/Br/I добавляли фтор; сера, кислород, селен и теллур были сгруппированы в семейство; азот, фосфор, мышьяк, сурьма и висмут были отнесены к другой группе. Однако Менделеев нанес несколько элементов вне строгой последовательности масс, чтобы лучше соответствовать свойствам их соседей по таблице, исправил ошибки в значениях нескольких атомных масс и предсказал существование и свойства нескольких новых элементов. в пустых ячейках его таблицы. Позднее Менделеев был подтвержден открытием электронной структуры элементов в конце 19 века.го и начала 20 века.
Однако Менделеев нанес несколько элементов вне строгой последовательности масс, чтобы лучше соответствовать свойствам их соседей по таблице, исправил ошибки в значениях нескольких атомных масс и предсказал существование и свойства нескольких новых элементов. в пустых ячейках его таблицы. Позднее Менделеев был подтвержден открытием электронной структуры элементов в конце 19 века.го и начала 20 века.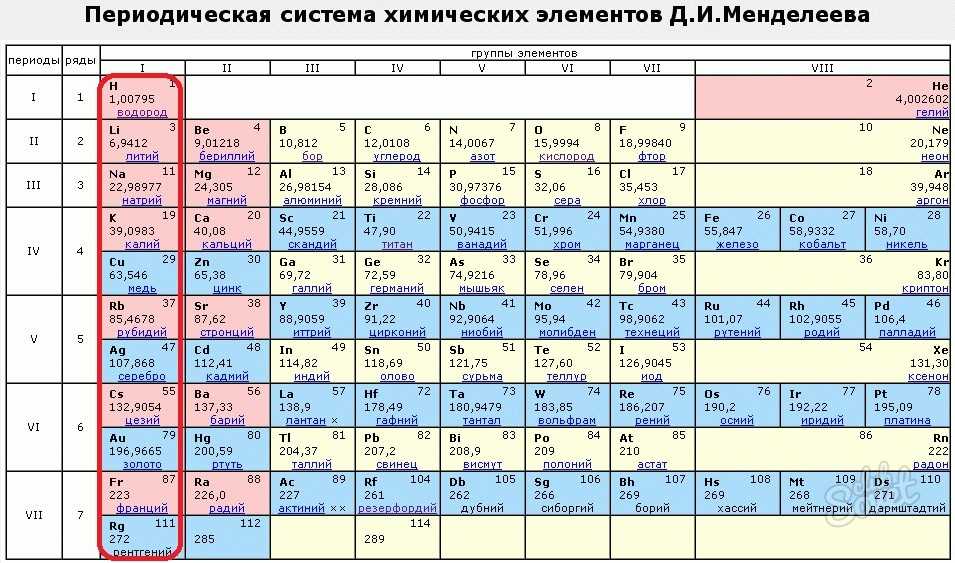
 Лондон: Черный лебедь, 687. ISBN 9780552151740 . стр.141-2
Лондон: Черный лебедь, 687. ISBN 9780552151740 . стр.141-2