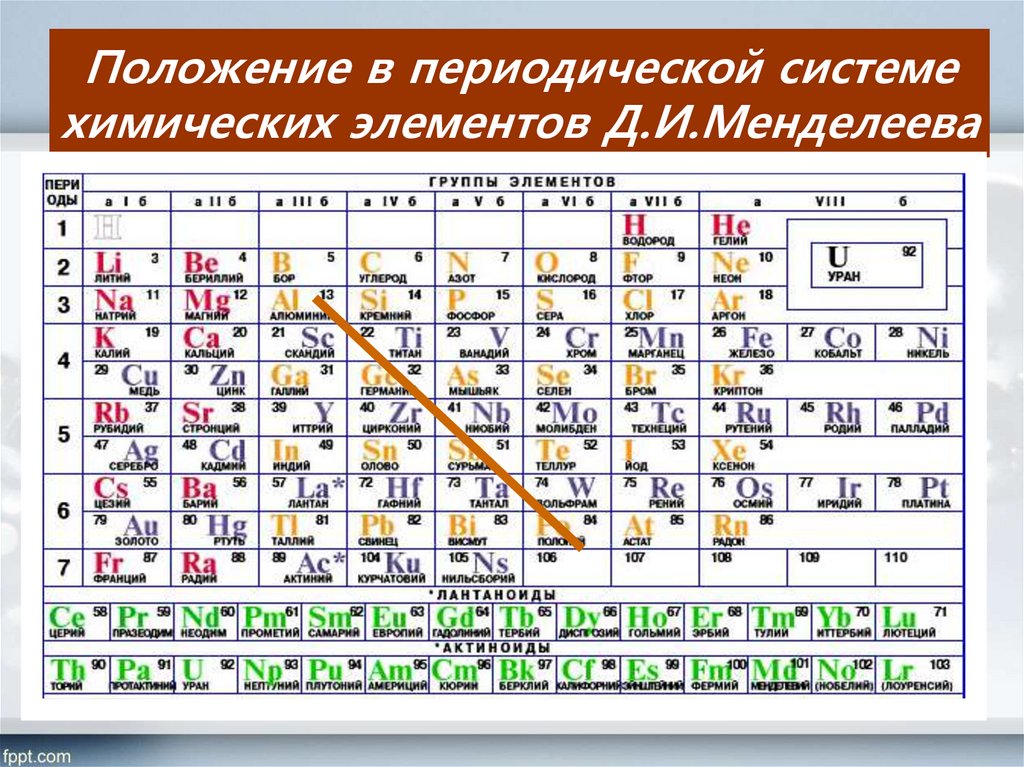
Периодическая система химических элементов Д. И. Менделеева. Знаки химических элементов
Периодическая система химических элементов Д. И. Менделеева. Знаки химических элементов
I. Д. И. Менделеев
Еще алхимики пытались найти закон природы, на основе которого можно было бы систематизировать химические элементы. Но им недоставало надежных и подробных сведений об элементах. К середине XIX в. знаний о химических элементах стало достаточно, а число элементов возросло настолько, что в науке возникла естественная потребность в их классификации. Первые попытки классификации элементов на металлы и неметаллы оказались несостоятельными. Предшественники Д.И.Менделеева (И. В. Деберейнер, Дж. А. Ньюлендс, Л. Ю. Мейер) многое сделали для подготовки открытия периодического закона, но не смогли постичь истину. Дмитрий Иванович установил связь между массой элементов и их свойствами.
Дмитрий Иванович родился в г. Тобольске. Он был семнадцатым ребенком в семье. Закончив в родном городе гимназию, Дмитрий Иванович поступил в Санкт-Петербурге в Главный педагогический институт, после окончания которого с золотой медалью уехал на два года в научную командировку за границу.
Открытию периодического закона предшествовало 15 лет напряженной работы. 1 марта 1869 г. Дмитрий Иванович предполагал выехать из Петербурга в губернии по делам.
Видео-фильм о Д.И. Менделееве
II. Открытие Периодического закона
Периодический закон был открыт на основе характеристики атома – относительной атомной массы
Менделеев расположил химические элементы в порядке возрастания их атомных масс и заметил, что свойства элементов повторяются через определенный промежуток – период, Дмитрий Иванович расположил периоды друг под другом., так, чтобы сходные элементы располагались друг под другом – на одной вертикали, так была построена периодическая система элементов.
1 марта 1869г.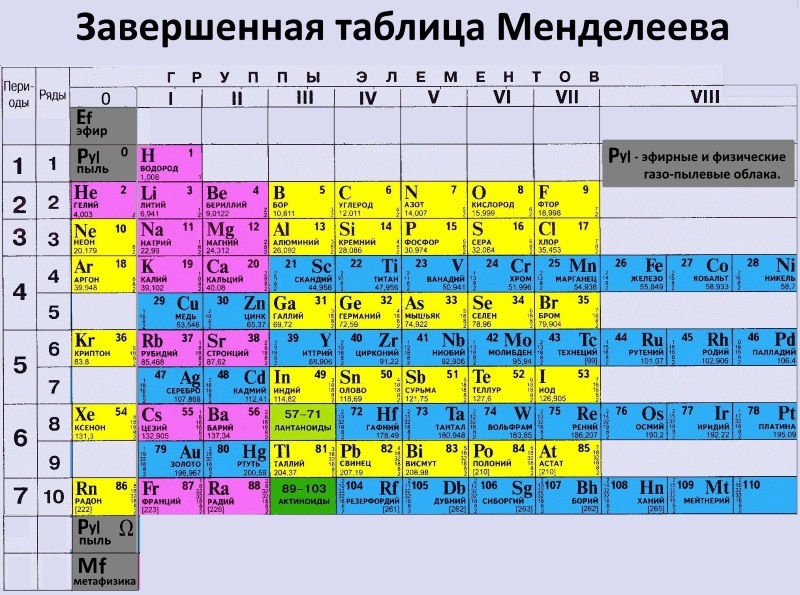 Формулировка периодического закона Д.И. Менделеева.
Формулировка периодического закона Д.И. Менделеева.
Свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов.
К сожалению, сторонников периодического закона сначала было очень мало, даже среди русских ученых. Противников – много, особенно в Германии и Англии.
Открытие периодического закона – это блестящий образец научного предвидения: в 1870 г. Дмитрий Иванович предсказал существование трех еще неизвестных тогда элементов, которые назвал экасилицием, экаалюминием и экабором. Он сумел правильно предсказать и важнейшие свойства новых элементов. И вот через 5 лет, в 1875 г., французский ученый П.Э. Лекок де Буабодран, ничего не знавший о работах Дмитрия Ивановича, открыл новый металл, назвав его галлием. По ряду свойств и способу открытия галлий совпадал с экаалюминием, предсказанным Менделеевым. Но его вес оказался меньше предсказанного. Несмотря на это, Дмитрий Иванович послал во Францию письмо, настаивая на своем предсказании.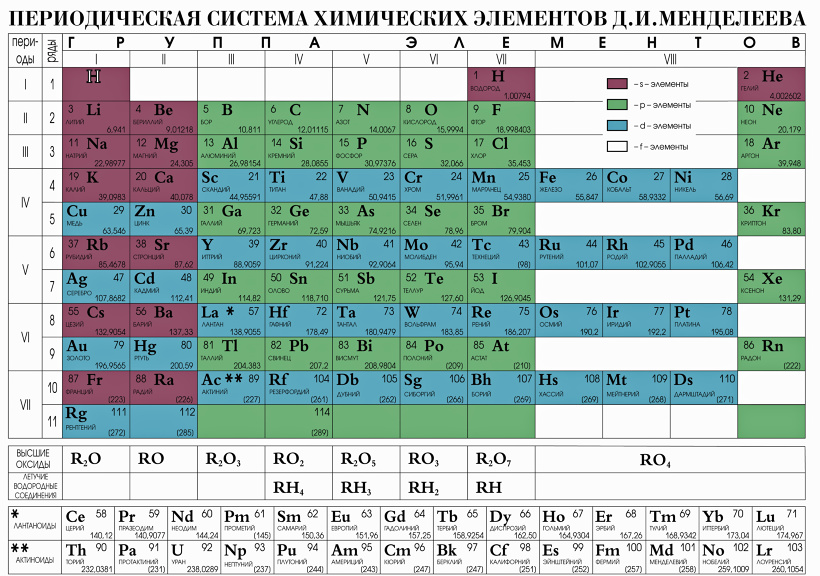
Ученый мир был ошеломлен тем, что предсказание Менделеевым свойств экаалюминияоказалось таким точным. С этого момента периодический закон начинает утверждаться в химии.
В 1879 г. Л. Нильсон в Швеции открыл скандий, в котором воплотился предсказанный Дмитрием Ивановичем экабор.
В 1886 г. К. Винклер в Германии открыл германий, который оказался
Но гениальность Дмитрия Ивановича Менделеева и его открытия — не только эти предсказания!
В четырёх местах периодической системы Д. И. Менделеев расположил элементы не в порядке возрастания атомных масс:
Ar – K, Co – Ni, Te – I, Th – Pa
Ещё в конце 19 века Д.И. Менделеев писал, что, по-видимому, атом состоит из других более мелких частиц. После его смерти в 1907 г. было доказано, что атом состоит из элементарных частиц. Теория строения атома подтвердила правоту Менделеева, перестановки данных элементов не в соответствии с ростом атомных масс полностью оправданы.
Современная формулировка периодического закона.
Свойства химических элементов и их соединений находятся в периодической зависимости от величины заряда ядер их атомов, выражающейся в периодической повторяемости структуры внешней валентной электронной оболочки.
И вот спустя более 130 лет после открытия периодического закона мы можем вернуться к словам Дмитрия Ивановича, взятым в качестве девиза нашего урока: «Периодическому закону будущее не грозит разрушением, а только надстройка и развитие обещаются». Сколько химических элементов открыто на данный момент? И это далеко не предел.
III. Периодическая система химических элементов
Графическим изображением периодического закона является периодическая система химических элементов. Это краткий конспект всей химии элементов и их соединений.
Изменения свойств в периодической системе с ростом величины атомных весов в периоде (слева направо):
1.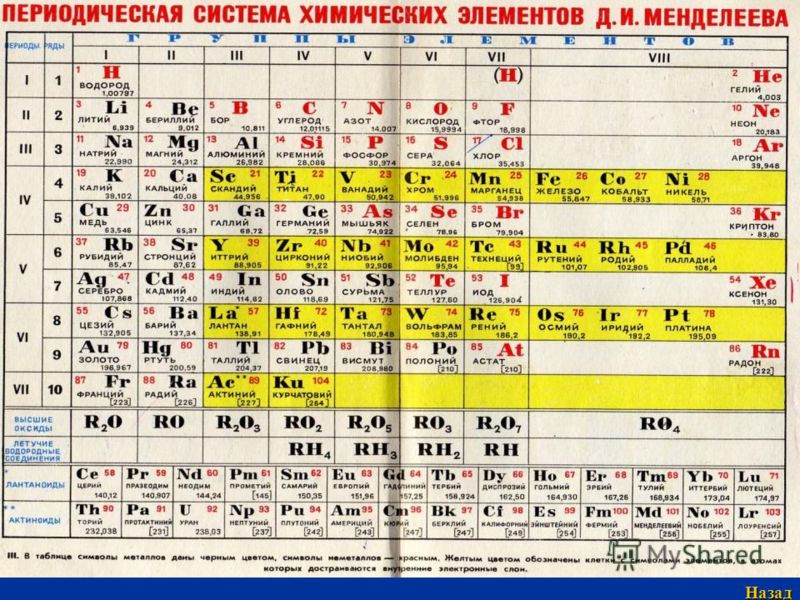 Металлические свойства уменьшаются
Металлические свойства уменьшаются
2. Неметаллические свойства возрастают
3. Валентность элементов в формулах высших оксидов возрастает от I до VII, а в формулах летучих водородных соединений уменьшается от IV до I.
Основные принципы построения периодической системы
Признак сравнения | Д.И.Менделеев |
Как устанавливается последовательность элементов по номерам? (что положено в основу п.с.?) | Элементы расставлены в порядке увеличения их относительных атомных масс. При этом есть исключения. Ar – K, Co – Ni, Te – I, Th – Pa |
Принцип объединения элементов в группы. | Качественный признак. Сходство свойств простых веществ и однотипных сложных. |
Принцип объединения элементов в периоды. | Совокупность элементов по мере роста относительной атомной массы от одного щелочного металла до другого. |
На сегодняшний день открыто 118 химических элементов, каждый из которых занял свою ячейку в Периодической системе. Новые открываемые элементы имеют большую относительную атомную массу, чем уже известные и попадают в конец таблицы. В настоящее время используются длинная и короткая формы периодических таблиц.
В ячейке таблицы записывается символ химического элемента, его название и порядковый номер, значение относительной атомной массы.
Рис. Информация о химическом элементе кислороде
При изучении школьного курса химии, как правило, пользуются короткой формой Периодической таблицы.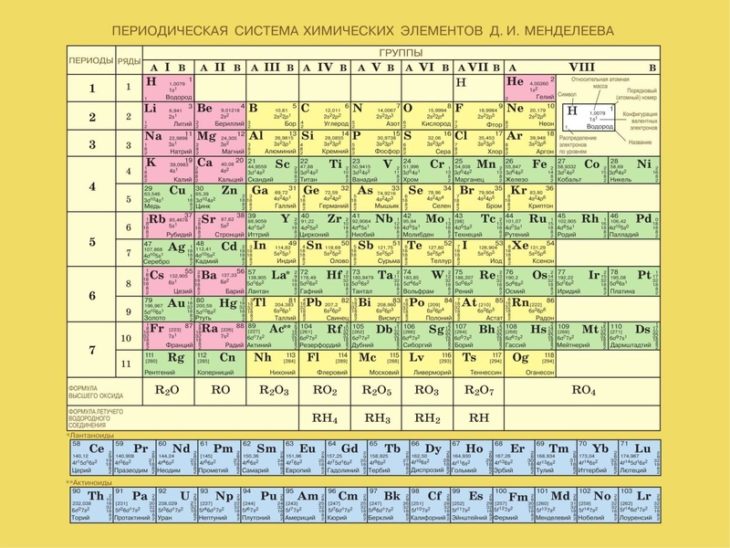
У элементов главных подгрупп высшая валентность, как правило, равна номеру группы. Одними из исключений этого правила являются кислород (его валентность всегда равна II) и фтор (высшая валентность которого – I).
С помощью Периодической таблицы можно определить и низшую валентность элемента. Для этого из 8 (максимального числа групп) надо вычесть номер группы, в которой находится элемент. Например, высшая валентность фосфора равна V (т. к. фосфор находится в V группе), а низшая равна III. Только это правило применимо для элементов главных подгрупп V–VII групп.
Горизонтальные ряды химических элементов в Периодической таблице называются периодами. Пока их 7. Первые три периода называют малыми (первый период содержит всего 2 хим. элемента, а 2 и 3 – по 8 элементов). Периоды 4, 5, 6, 7 называются большими.
элемента, а 2 и 3 – по 8 элементов). Периоды 4, 5, 6, 7 называются большими.
По положению элемента в Периодической системе можно определить его принадлежность к металлам или неметаллам. Для этого в короткой форме таблицы нужно провести диагональ от бериллия к астату. Элементы главных подгрупп, находящиеся выше этой диагонали (плюс водород), относятся к неметаллам. Все остальные элементы – металлы. Инертные газы He, Ne, Ar, Kr, Xe, Rn не относят ни к металлам, ни к неметаллам.
В длинной форме таблицы можно провести диагональ от бора к астату. Все элементы, которые находятся ниже этой диагонали, образуют простые вещества металлы.
Длинная форма периодической системы химических элементов
Рис. Длинная форма периодической системы химических элементов
По положению элемента в периодической системе можно получить информацию о его высшем оксиде и гидроксиде.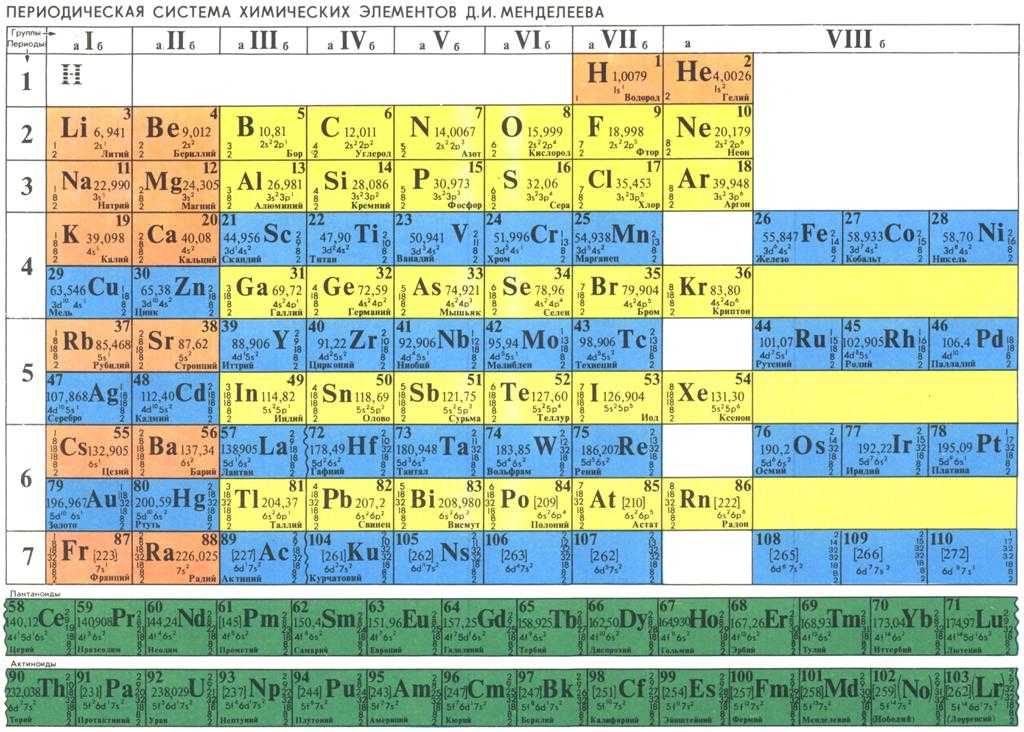 У неметаллов высший оксид и гидроксид имеют кислотный характер, у металлов – основный, у переходных металлов оксид и гидроксид, как правило, амфотерные (см. рис.).
У неметаллов высший оксид и гидроксид имеют кислотный характер, у металлов – основный, у переходных металлов оксид и гидроксид, как правило, амфотерные (см. рис.).
Рис. Связь свойств элементов и образованных ими соединений
IV. Значение Периодического закона
Смотрите фильм: “Периодический закон Менделеева”
V. Язык химии
Посмотрите видео-фильм:
Человечество использует много разных языков. Кроме естественных языков (японского, английского, русского – всего более 2,5 тысяч), существуют еще и искусственные языки, например, эсперанто. Среди искусственных языков выделяются языки различных наук. Так, в химии используется свой, химический язык. Химический язык – система условных обозначений и понятий, предназначенная для краткой, ёмкой и наглядной записи и передачи химической информации. Сообщение, написанное на большинстве естественных языков, делится на предложения, предложения – на слова, а слова – на буквы. Если предложения, слова и буквы мы назовем частями языка, то тогда мы сможем выделить аналогичные части и в химическом языке
Если предложения, слова и буквы мы назовем частями языка, то тогда мы сможем выделить аналогичные части и в химическом языке
Еще в Средневековье, во времена алхимии использовались различные знаки для обозначения веществ, в основном металлов. Ведь основной целью алхимиков было получение из различных металлов золота. Поэтому каждый из них использовал свою систему обозначений.
В 19 в. появилась необходимость использования понятной для всех ученых символики. И одним из первых такую символику предложил Джон Дальтон. Но его обозначениями было неудобно пользоваться.
Химические знаки Дальтона получили некоторое распространение в Великобритании и в Западной Европе, но вскоре были вытеснены чисто буквенными знаками, которые шведский химик Й. Я. Берцелиус предложил в 1814. Он предложил обозначать химические элементы первой буквой их латинского названия. В те времена все научные статьи печатала на латинском языке, он был общепринятым и понятным для всех ученых.Высказанные им принципы составления химических знаков сохранили свою силу до настоящего времени. В России первое печатное сообщение о химических знаках Берцелиуса сделал в 1824 г московский врач И. Я. Зацепин.
В те времена все научные статьи печатала на латинском языке, он был общепринятым и понятным для всех ученых.Высказанные им принципы составления химических знаков сохранили свою силу до настоящего времени. В России первое печатное сообщение о химических знаках Берцелиуса сделал в 1824 г московский врач И. Я. Зацепин.
Химический элемент кислород (по-латински Oxygenium) получил обозначение О.
А химический элемент водород (Hydrogenium) – Н. Если названия нескольких элементов начинались на одну и ту же букву, то в символе элемента указывали вторую или одну из последующих букв названия. Например, ртуть (Hydrargyrum) обозначается Hg.
Обратите внимание, что первая буква знака химического элемента всегда заглавная, если есть вторая буква – то она строчная. Необходимо запоминать не только названия элементов и их символы, но и произношение, т.е. как эти символы читаются.
Определенных правил произношения знаков химических элементов нет.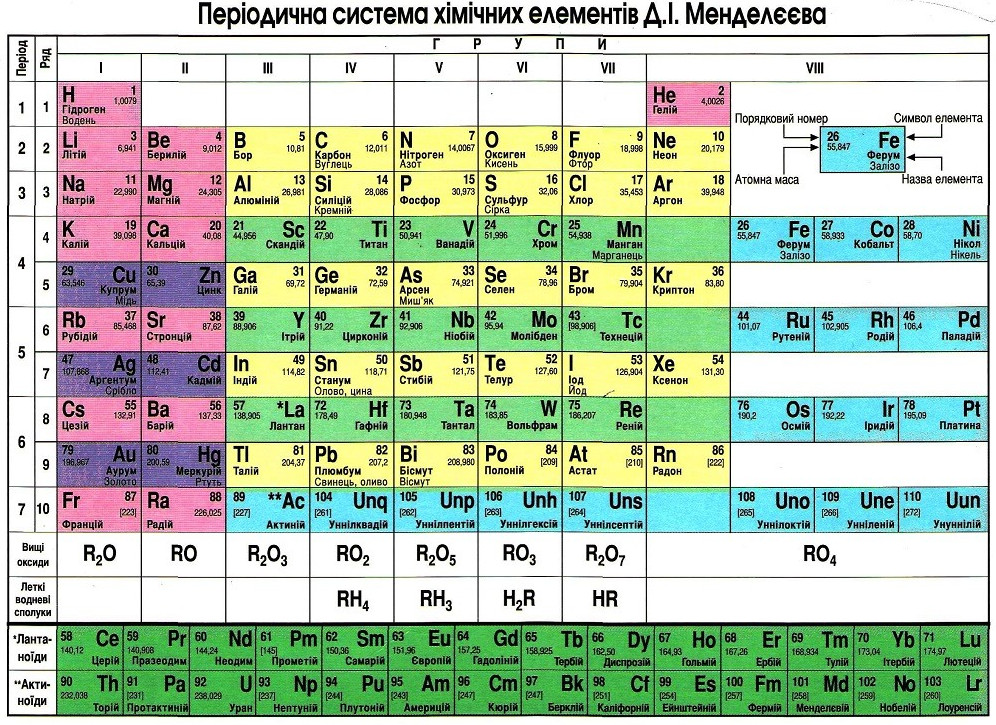 Их надо учить наизусть. Знаки некоторых химических элементов произносятся так же, как и соответствующая буква: кислород – «о», сера – «эс», фосфор – «пэ», азот – «эн», углерод – «цэ».
Их надо учить наизусть. Знаки некоторых химических элементов произносятся так же, как и соответствующая буква: кислород – «о», сера – «эс», фосфор – «пэ», азот – «эн», углерод – «цэ».
Знаки других элементов произносятся так же, как и называются сами элементы: «натрий», «калий», «хлор», «фтор».
Произношение некоторых знаков соответствует их латинскому названию: кремний – «силициум», ртуть – «гидраргирум», медь – «купрум», железо – «феррум».
Ниже приведена таблица химических знаков некоторых элементов, их названия , относительные массы и произношение.
VI. Тренажеры
Тренажёр №1 “Периодический закон и Периодическая система элементов Д. И. Менделеева”
Тренажёр №2. “Закономерности изменения свойств атомов элементов в периодах и группах Периодической системы элементов Д. И. Менделеева”
Презентация к уроку химии “Периодическая система химических элементов Д.
 И. Менделеева. Знаки химических элементов”. 8 класс
И. Менделеева. Знаки химических элементов”. 8 классПрезентация на тему: Периодическая система химических элементов Д.И. Менделеева. Знаки химических элементов.
Презентацию подготовил:
учитель химии Машкова В.С.
МБОУ СОШ №69 г.Воронеж
Периодическую систему можно представить в виде большого дома, я котором «дружно живут» абсолютно все химические элементы, известные человеку. Чтобы уметь пользоваться Периодической системой, необходимо изучить химический алфавит, то есть знаки химических элементов.
«Да- нетка»
А) Атом наименьшая единица элемента?
В) Молекулы меньше, чем атомы?
С) Молекула состоит из одного или нескольких типов атомов?
Д) Молекулы больше атомов?
Е) Из атомов состоит окружающий мир?
(да)
(нет)
(да)
(да)
Принципы названия химических элементов
Первый принцип названия химических элементов – по их характерным свойствам.
Например, актиний – активный
барий – тяжелый
йод – фиолетовый
ксенон – чуждый
неон – новый,
радий и радон – излучающий,
рубидий – темно-красный,
фосфор – светящийся,
хром – цветной.
Второй принцип – по природному источнику.
Кальций и Калий –
от арабского названия золы
Бериллий получил
Свое название от
минерала берилл
Никель – от одноименного
названия минерала
Цирконий –
от минерала циркон.
Вольфрам (на английском языке «тангстен») – от одноименного металла
Литий – от слова lithos, имеющего
греческое происхождение,
и означающего «камень»
Третий принцип – по названиям небесных объектов или по именам героев мифов и древних богов.
К химическим элементам, получившим свое название таким путем, относятся :
гелий
нептуний
плутоний
прометий
селен
титан
торий
уран
Название кобальт произошло от имени злого духа металлургов и рудокопов – Кобольда.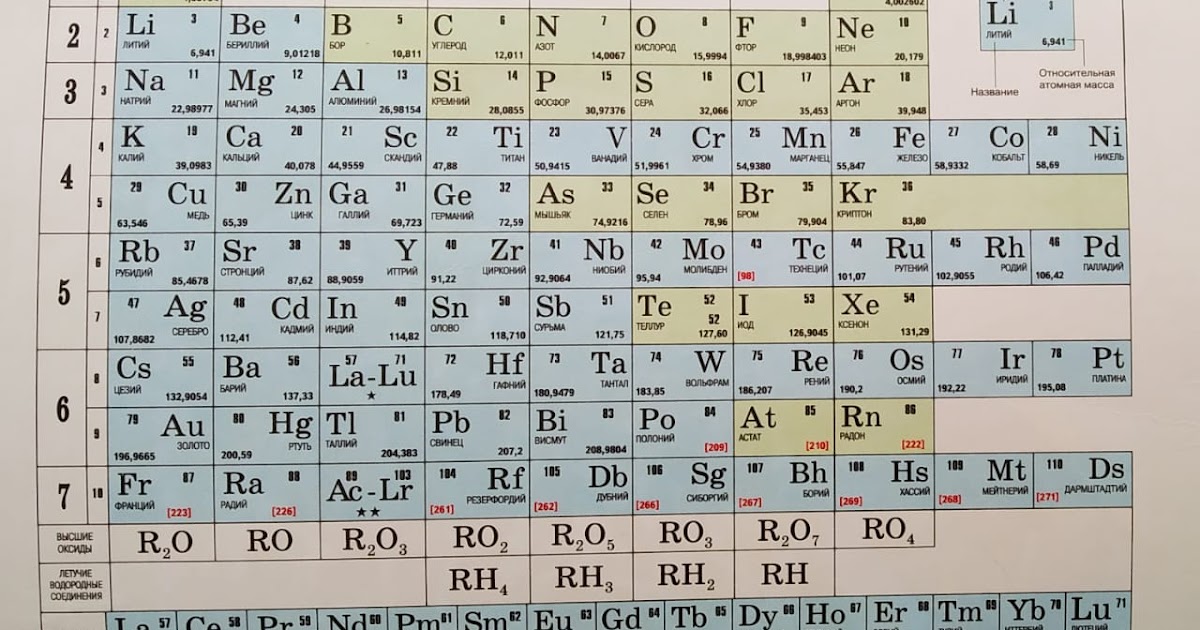
Принцип четвертый – по названию местности, где был открыт элемент.
Этот способ наименования химических элементов обязан своим появлением открытию иттрия в 1794 году. Сюда относятся гольмий, наименование которого произошло от латинского названия Стокгольма, а также скандий, который получил свое название в честь Скандинавии, америций, европий, германий, франций, галлий, калифорний, стронций и другие.
Наибольшее число подобных названий связано со Швецией, ведь именно здесь было открыто 20 химических элементов.
В названиях элементов увековечены имена великих ученых: кюрий, фермий, эйнштейний, менделевий, лоуренсий.
В качестве символов по предложению шведского химика Й. Берцелиуса были приняты в большинстве случаев начальные буквы латинских названий химических элементов.
Водород (латинское название – Hydrogenium) обозначают буквой Н (читается «аш»)
Кислород (латинское название – Oxygenium)
обозначают буквой О (читается «о»)
Углерод (латинское название Carboneum)
обозначают буквой С (читается «цэ»).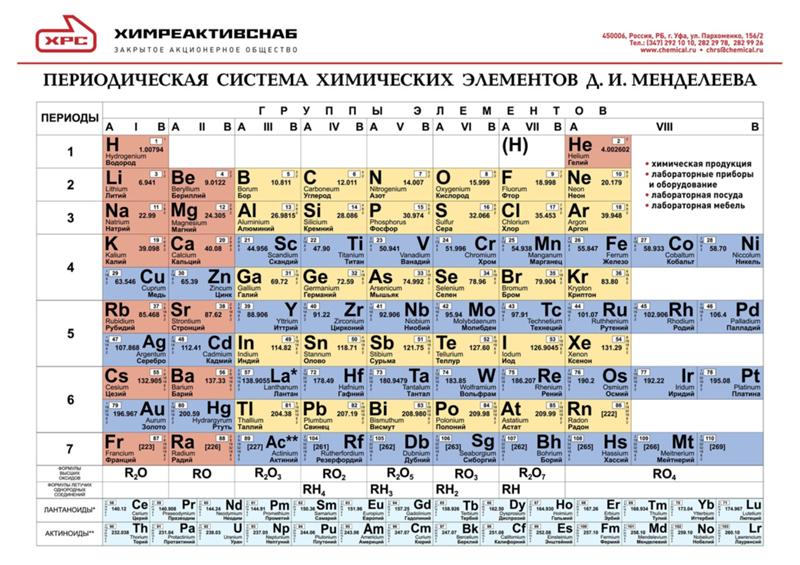
На букву С начинаются латинские названия еще нескольких химических элементов, чтобы их различить Берцелиус предложил к начальной букве латинского названия добавлять еще одну из последующих букв названия. Например,
Кальций записывается символом Са
(читается «кальций»),
Меди — Си (читается «купрум»),
Кобальта — Со (читается кобальт).
Периодическая Система химических элементов Д.И. Менделеева
Периодическая Система состоит из вертикальных столбцов и горизонтальных строк. Горизонтальные строки называются периодами. На сегодняшний день все известные элементы размещаются в семи периодах.
Периоды обозначают арабскими цифрами от 1 до 7. Периоды 1–3 состоят из одного ряда элементов – их называют малыми . Периоды 4–7 состоят из двух рядов элементов, их называют большими.
Периодическая Система химических элементов Д. И. Менделеева
И. Менделеева
Вертикальные столбцы Периодической Системы называют группами элементов . Всего групп восемь, и для их обозначения используют римские цифры от I до VIII. Выделяют главные и побочные подгруппы .
Веселые загадки
(Неон)
- Какой газ утверждает, что он – это не он?
2. В состав каких двух химических элементов входит напиток морских пиратов? 3. Какой химический элемент имеет отношение и к цирку и табуну лошадей? 4. Какой элемент состоит из двух животных?
5. Какой элемент «вращается» вокруг Солнца?
(Хром, бром)
(Цирконий)
(Мышьяк)
(Уран)
6. Какой элемент является настоящим гигантом? 7. Название, какого металла несёт в себе волшебника?
8. От названия какого металла нужно отрезать 1/3, чтобы получить известную кость скелета человека и животных?
9. Какой металл при обычных
условиях является жидким?
(Титан)
(Магний)
(Серебро)
(Ртуть)
Спасибо за внимание
Периодическая таблица Менделеева | Chemistry Nexus
Периодическая таблица Менделеева
В этой таблице показана форма Периодической таблицы химических элементов Менделеева, опубликованная в 1872 году. Заголовок «Reihen» означает «Ряд», а заголовок «Gruppe» означает «Группа». Символы R 2 O и RH 4 и т. Д. Написаны в стиле того времени, в котором для обозначения количества атомов в молекулах используются верхние индексы, а не в текущем стиле, в котором используются нижние индексы. Пробелы, отмеченные дефисом («-»), представляют собой химические элементы, которые Менделеев вывел как существующие, но неизвестные в 1872 году. Он смог с большим успехом предсказать свойства некоторых из отсутствующих химических элементов, таких как германий.
Заголовок «Reihen» означает «Ряд», а заголовок «Gruppe» означает «Группа». Символы R 2 O и RH 4 и т. Д. Написаны в стиле того времени, в котором для обозначения количества атомов в молекулах используются верхние индексы, а не в текущем стиле, в котором используются нижние индексы. Пробелы, отмеченные дефисом («-»), представляют собой химические элементы, которые Менделеев вывел как существующие, но неизвестные в 1872 году. Он смог с большим успехом предсказать свойства некоторых из отсутствующих химических элементов, таких как германий.
| Рейхен | Группа I. – R 2 O | Группа II. – РО | Группа III. – Р 2 О 3 | Группа IV. правая сторона 4 правая сторона 2 | Группа V. RH 3 R 2 O 5 | Группа VI.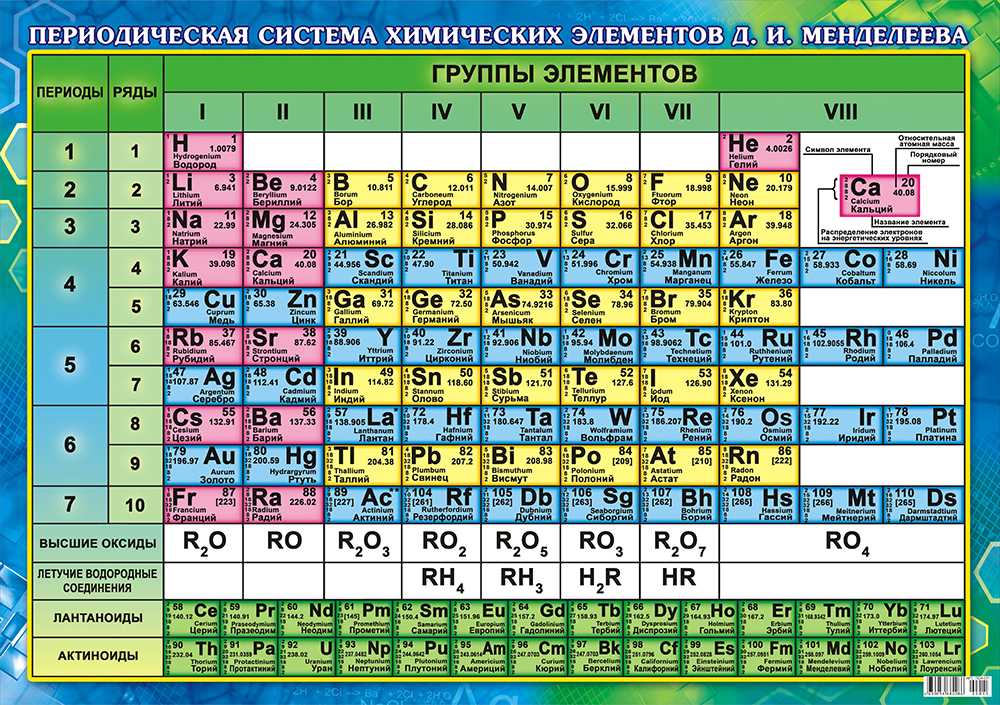 правая сторона 2 правая сторона 3 | Группа VII. RH R 2 O 7 | Группа VIII. – только для чтения 4 |
|---|---|---|---|---|---|---|---|---|
| 1 | Н=1 | |||||||
| 2 | Ли=7 | Be=9,4 | Б=11 | С=12 | N=14 | О=16 | Ж=19 | |
| 3 | Na=23 | Мг=24 | Ал=27,3 | Si=28 | Р=31 | С=32 | Кл=35,5 | |
| 4 | К=39 | Са=40 | -=44 | Ti=48 | В=51 | Кр=52 | Мн=55 | Fe=56, Ce=59, Ni=59, Cu=63.  |
| 5 | (Си=63) | Zn=65 | -=68 | -=72 | Ас=75 | Se=78 | руб=80 | |
| 6 | Руб=85 | Ср=87 | ?Yt=88 | Zr=90 | № = 94 | Мо=96 | -=100 | Ru=104, Rh=104, Pd=106, Ag=108. |
| 7 | (Ag=108) | Cd=112 | В=113 | Sn=118 | Сб=122 | Те=125 | Дж=127 | |
| 8 | Cs=133 | Ба=137 | ?Di=138 | ?Се=140 | – | – | – | – – – – |
| 9 | (-) | – | – | – | – | – | – | |
| 10 | – | – | ?Er=178 | ?La=180 | Та=182 | Ш=184 | – | Os=195, Ir=197, Pt=198, Au=199 |
| 11 | (Ас=199) | рт.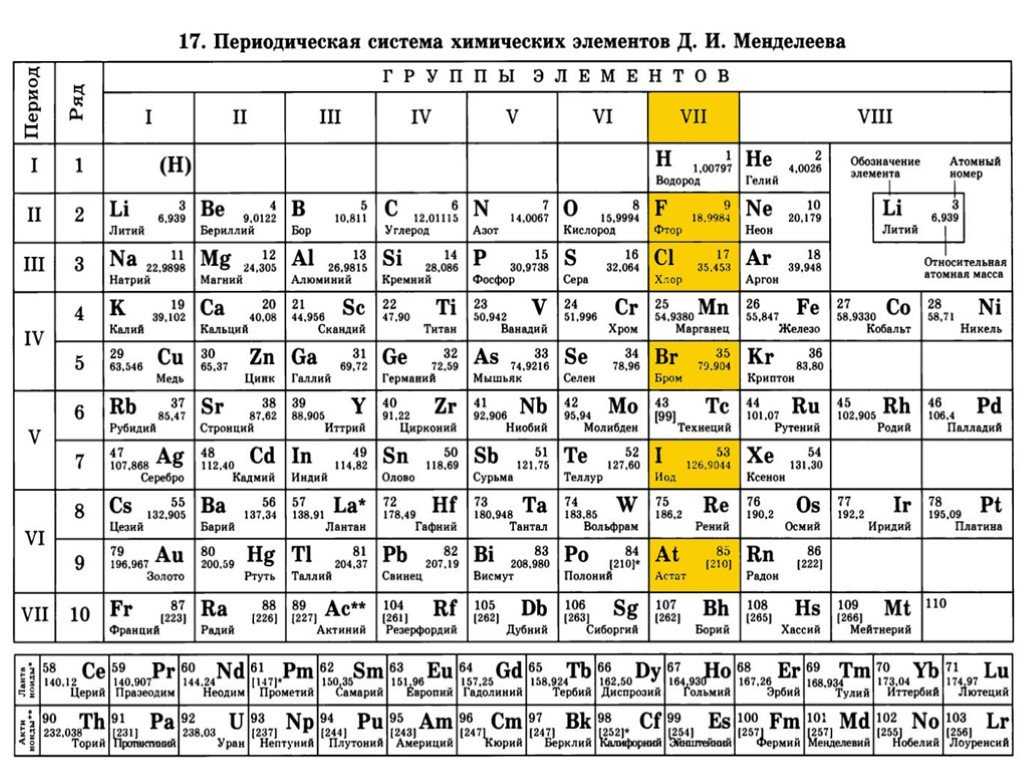 ст.=200 ст.=200 | Тл=204 | Pb=207 | Би=208 | – | – | |
| 12 | – | – | – | Т=231 | – | У=240 | – | – – – – |
В их стихии
News Story
Химики Нью-Йоркского университета делятся своими фаворитами в честь 150-летия периодической таблицы
Читаете это с мобильного телефона? Ваш телефон содержит не менее 30 различных природных элементов, включая литий. Или, может быть, вы пьете сельтерскую воду — соединение двух элементов (углерода и кислорода в виде углекислого газа), растворенное в двух других элементах (водород и кислород в виде воды).
Химические элементы, из которых состоит все вокруг нас, — повод для празднования каждый день, но 2019 год особенный, потому что он отмечает 150-летие периодической таблицы. Разработанный русским ученым Дмитрием Менделеевым в 1869 году (с участием многих других ученых до и после Менделеева), знакомый плакат на стенах кабинета химии начинался как новый способ сортировки и классификации элементов.
Разработанный русским ученым Дмитрием Менделеевым в 1869 году (с участием многих других ученых до и после Менделеева), знакомый плакат на стенах кабинета химии начинался как новый способ сортировки и классификации элементов.
В периодической таблице Менделеева он организовал 63 элемента, известных в 1869 г.по их атомному весу, группируя те, которые имеют схожие свойства. Он также предусмотрительно оставил на столе свободные места, чтобы предвидеть элементы, которые еще не были обнаружены.
Менделеев был на верном пути — за последующие полтора века ученые добавили много новых элементов в пробелы в таблице, доведя сегодня число элементов до 118. Как отметило ранее в этом году Американское химическое общество, «изменения в периодической таблице продолжаются и по сей день и, вероятно, продолжат удивлять нас в будущем. Совсем недавно, в 2016 году, четыре последних пробела в периоде 7 — элементы 113, 115, 117 и 118 — были официально заполнены». Как и многие элементы, два из новейших названы в честь мест, где проводились исследования по созданию элементов: московий и теннессин.
В честь 150-летия периодической таблицы NYU News попросил группу химиков Нью-Йоркского университета назвать свои любимые элементы и рассказать нам, почему они их любят. От лития (№ 3) до галлия (№ 31) — вот их выбор.
Литий
Литий — мой самый любимый элемент в наши дни. Это один из самых легких элементов, и он невероятно преображает. Все наши сотовые телефоны и компьютеры оснащены литий-ионными аккумуляторами, а Нобелевская премия по химии в этом году была присуждена за разработку литий-ионных аккумуляторов.
В моей лаборатории мы хорошо знакомы с этим элементом, поскольку разрабатываем методы, которые позволяют нам заглянуть внутрь батарей, чтобы определить, хорошо ли они работают, и получить подсказки о том, как улучшить батареи, продлить срок их службы и обеспечить их безопасность. .
Углерод
Дирк Траунер, Дженис Катлер, профессор химии
Мне нравится углерод, потому что правила, по которым соединяются атомы углерода, очень просты, но структуры, которые можно создать с их помощью (и несколькими более легкими и тяжелыми второстепенными актерами), такой разнообразный.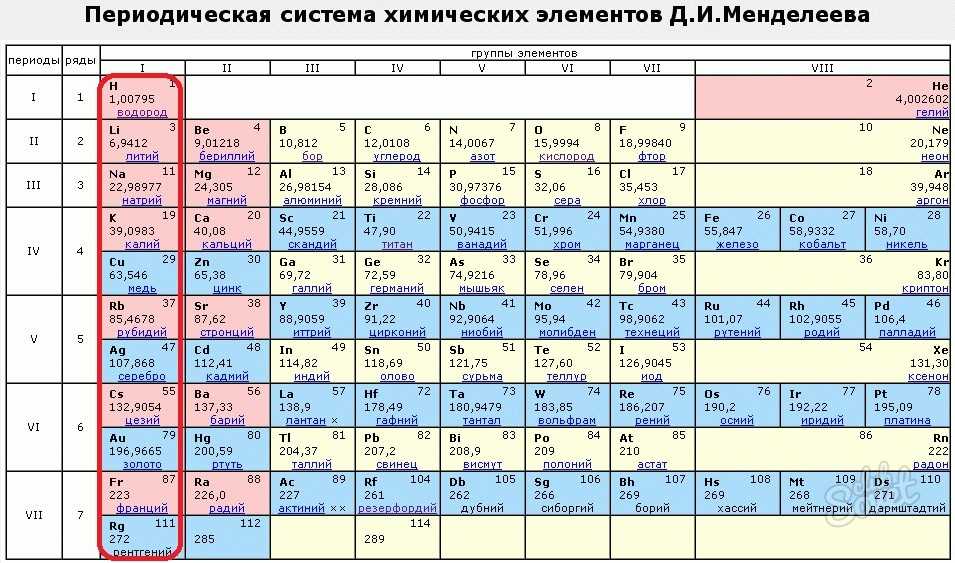 После одной лекции студенты могут предложить молекулы, которые никогда раньше не создавались и о которых даже не думали, но которые, скорее всего, стабильны. Вы можете поставить ферму (и свою карьеру) на углерод!
После одной лекции студенты могут предложить молекулы, которые никогда раньше не создавались и о которых даже не думали, но которые, скорее всего, стабильны. Вы можете поставить ферму (и свою карьеру) на углерод!
Азот
Нед Симан, Маргарет и Герман Сокол, профессор химии
Азот
Азот. Это элемент, который присущ двум семантофоретическим молекулам [которые несут информацию] биологии, нуклеиновым кислотам и белкам. Без азота биология в основном состоит из сахара и жира.
Кремний
Кит Верпель, Маргарет и Герман Сокол Профессор медицинской химии
Кремний
Кремний. Он есть почти во всем: в камнях, песке, компьютерах, в этих маленьких пакетиках, которые вы найдете внутри обуви. Этот элемент больше всего похож на углерод, но он настолько не похож на углерод, что приводит к неожиданному химическому поведению, которое может оказаться действительно полезным. И просто для протокола: нет, я не думаю, что может существовать жизнь в том виде, в каком мы ее знаем, на основе кремния вместо углерода.
Кальций
Марк Уолтерс, доцент кафедры химии
Кальций
Сейчас мой любимый элемент — кальций. Это вещество нашей геосферы в виде компонента известняковых и гипсовых минералов и нашей биосферы в виде костей, зубов, ракушек и даже яичной скорлупы. Это дает нам основу и структуру. Но не только мы… Как компонент портландцемента и облицовочного гипса (гипсокартон), он также служит для изготовления оболочек и жилья для людей.
Это компонент мела, который до появления маркеров сухого стирания служил для улучшения структуры наших идей и выражений, произнесенных или безмолвно набросанных на чистом листе.
Железо
Энди Гамильтон, профессор химии и президент Нью-Йоркского университета
Железо
Большинство химиков-органиков обычно говорят, что их любимым элементом является углерод из-за его роли в качестве основного строительного элемента жизни. Но для меня больше всего интересен элемент железа (Fe). Железо — это элемент, который даже в биологических условиях может иметь доступ к нескольким степеням окисления для выполнения ряда критических функций.
В состоянии Fe 2+ его можно найти (в окружении моей любимой молекулы — порфиринового кольца) в гемоглобине. Эта замечательная комбинация Fe 2+ и порфирина придает крови ярко-красный цвет, а также способность Fe 2+ связываться с кислородом (O 2 ) и транспортировать его по телу. Опасные эффекты угарного газа (СО) связаны с его способностью еще более прочно связываться с Fe 2+ в гемоглобине и препятствовать доступу к живительной молекуле кислорода.
Железо совершает циклы между состояниями Fe 2+ и Fe 3+ в цитохромных белках, одной из важнейших ролей которых в жизни является транспорт электронов по клетке. Смертельный яд цианид (CN –) связывается с Fe 2+ в цитохроме точно так же, как O 2 или CO в гемоглобине, блокируя этот цикл и полностью разрушая пути управления энергией в живых клетках.
Наконец, железо получает доступ к Fe 4+ и Fe 5+ состояний окислительного фермента цитохрома Р450. Этот белок действует в печени как природный отбеливатель, часто очищая все нежелательные беспорядки, которые находятся внутри живых организмов, включая нас!
Этот белок действует в печени как природный отбеливатель, часто очищая все нежелательные беспорядки, которые находятся внутри живых организмов, включая нас!
Медь
Джеймс Кэнэри, профессор и заведующий кафедрой химии
Медь
Я фанат элемента меди. Он не только красив, когда блестит, но и демонстрирует удивительно разнообразную химию. Он был обнаружен 11 000 лет назад и назван в честь Кипра. Медный век (энеолит) на Ближнем Востоке — один из моих любимых периодов в истории. Это необходимый элемент для всего живого на земле. В своей естественной металлической форме он обладает высокой проводимостью и пластичностью, что делает его идеальным материалом для проводов.
В ходе нашего исследования мы обнаружили, что он может заставить молекулу, имеющую рукоятку, подобную резиновой перчатке, выворачиваться наизнанку, что приводит к противоположной рукояти. Точно так же, как когда вы выворачиваете инсайт из резиновой перчатки для левой руки, и он подходит к вашей правой руке, мы можем сделать то же самое с молекулами.
Если элемент теряет один электрон, он приобретает один положительный заряд, образуя медь(I). Бесцветная медь (I) является ключевым игроком в живых организмах для захвата, хранения и транспортировки кислорода в клетке. В крови человека эту роль выполняет железо, но медь(I) очень часто встречается в такой роли у многих организмов. Медь(I) также используется в органической химии для некоторых реакций, которые удивительны с точки зрения того, что они делают, и их эффективности.
Если металлическая медь теряет два электрона, она остается с двумя положительными зарядами на каждый атом меди, медь(II). Соединения меди (II) обычно имеют синий цвет. Он любит растворяться в воде, и реакции, связанные с присоединением/диссоциацией к/от меди (II), могут быть очень быстрыми. Медь (III) также известна, но она очень реакционноспособна и ее нелегко наблюдать.
Меня поразило то, что медь(0), медь(I) и медь(II) настолько отличаются друг от друга, что кажутся разными элементами. Все в них отличается — их внешний вид, их стабильность и их реактивность.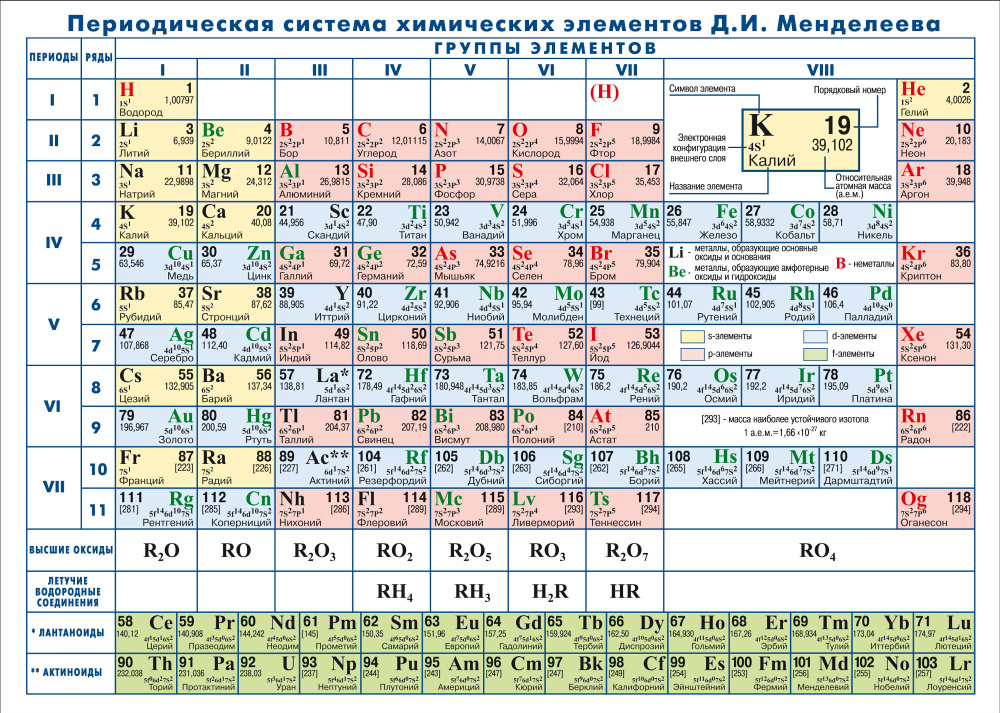
Галлий
Майк Уорд, Джулиус Сильвер, Рослин С. Сильвер и Энид Сильвер Уинслоу, профессор химии
Галлий
Моим любимым элементом должен быть галлий — атомный номер 31, простое число, окруженный алюминием, германием, индием и цинком в периодической таблице, и более редкий, чем золото. Его предсказал в 1871 году не кто иной, как Дмитрий Менделеев, назвавший его «экаалюминием». Затем он был обнаружен в 1875 году Полом Эмилем Лекоком де Буабодраном, который назвал его в честь «галлии», что на латыни означает Галлия, иначе известная как Франция, его родная страна.
Чем так интересен галлий? Он плавится при температуре около 30 ° C (86 ° F), что немного выше комнатной температуры. Это свойство было ключом к дешевому салонному трюку, когда галлий, выкованный в ложки для чайного сервиза, неожиданно плавился при использовании! Отсюда его появление на обложке книги «Исчезающая ложка: и другие правдивые рассказы о безумии, любви и истории мира из Периодической таблицы элементов » Сэма Кина.