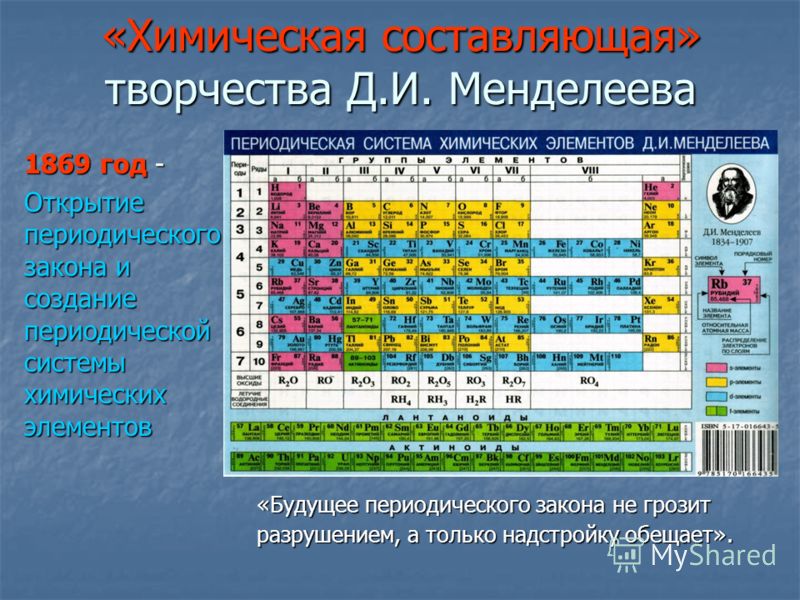
Периоды таблицы
Решением генеральной ассамблеи ЮНЕСКО 2019 год объявлен Международным годом Периодической таблицы химических элементов. 150 лет назад, в феврале 1869-го, Дмитрий Менделеев разослал коллегам черновик, коротко излагающий сущность нового закона, а 6 марта Николай Меншуткин зачитал его доклад перед Русским химическим обществом.
«За отсутствием Д. Менделеева обсуждение этого сообщения отложено до следующего заседания», зафиксировал протокол встречи, однако перемены начались сразу же. Закон, связывающий свойства элементов с их атомной массой, оказался невероятно удобен и универсален, позволив объяснить известные явления и предсказать новые. Его успех назревал давно и стал кульминацией работы многих поколений — а финальные штрихи вносятся в великую таблицу до сих пор.
Древний мир, Средние века, Новое время
Элементы, которые встречаются в чистом виде или легко поддаются выделению и переработке, были известны с незапамятных времен.
Демокрит (460–370 гг. до н. э.). Один из первых философов-материалистов. Сформулировал учение об атомах как неделимых частицах, образующих все существующее в «мировой пустоте».
«Атомы <…> бесконечны по величине и количеству, они вихрем несутся во Вселенной и этим порождают все сложное — огонь, воду, воздух, землю, ибо все они суть соединения каких-то атомов, которые не подвержены воздействиям и неизменны в силу своей твердости».
Диоген Лаэртский, «О жизни, учениях и изречениях знаменитых философов».
Трудов самого Демокрита не сохранилось.
Медь (9000 г. до н. э.)
Медь сравнительно широко встречается в природе в виде чистых самородков, она легко плавится и обрабатывается, поэтому стала одним из первых металлов, который освоило человечество. Древнейшие образцы медных изделий датируются возрастом 11 000 лет, а 5000–6000 лет назад начали распространяться технологии литья из сплава меди и олова — бронзы.
Флогистон (1667–1775 гг.)
Теория, развитая Георгом Шталем, считала металлы сложными веществами, содержащими флогистон, первоэлемент, который высвобождается при горении. Некогда влиятельная идея оказалась права с точностью до наоборот: сегодня мы понимаем, что при горении чистые металлы соединяются с кислородом, образуя оксиды.
Конец XVII — XVIII вв. Эпоха Просвещения
Совершенствование методов и техник химии позволило выделить еще 22 элемента и сформировать базовые представления об их свойствах.
Антуан Лавуазье (1743–1794 гг.). Опроверг теорию флогистона, открыл кислород. Сформулировал представления о простых веществах, выделив 33 элемента, включая некоторые ошибочные.
«Следует называть простыми все тела, которые мы не можем разложить. <…> Несомненно, настанет день, когда эти вещества, являющиеся для нас простыми, будут в свою очередь разложены… Но наше воображение не должно опережать фактов, и нам не следует говорить об этом больше того, что сообщает нам природа».
Фосфор (1669 г.)
В поисках философского камня Хенниг Бранд выделил из мочи белое, светящееся в темноте вещество. Несмотря на все попытки Бранда сохранить рецепт «чудесного носителя света» (phosphorus mirabilis) в секрете, вскоре этому научились и другие естествоиспытатели. Фосфор стал первой новинкой за многие века и считается первым элементом, полученным в ходе настоящих химических экспериментов.
Мурий (1772–1774 гг.)
Желто-зеленый газ, который в 1774 году Джозеф Пристли получил из соляной кислоты, поначалу сочли оксидом неизвестного элемента и назвали по латинскому именованию кислоты (acidum muriaticum). Уже в начале XIX века Гемфри Дэви, пытаясь выделить мурий в чистом виде, обнаружил, что этот газ — простое вещество, и дал ему имя «хлор», что означает «зеленый».
XIX в. Промышленная революция
Золотой век классической химии: 46 новых элементов. Появляется периодическая таблица, которая отражает зависимость свойств элементов от их атомной массы.
Дмитрий Менделеев (1834–1907 гг.). Открыл периодический закон и упорядочил 64 известных тогда элемента в таблицу, предсказал существование нескольких новых.
«Величина атомного веса… обща и свободному простому телу, и всем его соединениям. Атомный вес принадлежит не углю и алмазу, а углероду. <…> Способ распределения элементов по атомному их весу не противоречит естественному сходству между элементами, а, напротив того, прямо на него указывает».
Гелий (1868 г.)
К этому времени ученым уже было известно свойство веществ испускать излучение на строго определенных частотах. Однако Пьер Жансен и Джозеф Локьер заметили в спектре Солнца линии, несвойственные ни одному из известных тогда химических элементов. Существование гелия подтвердилось на Земле в 1880-х, когда его обнаружили в составе минеральных включений и вулканических газов.
Короний (1869–1939 гг.)
После триумфального открытия гелия в спектре солнечной короны нашлись еще несколько линий, которые не удалось связать ни с одним известным элементом. Самым знаменитым из них оказался короний — гипотетический инертный газ, существование которого признавал даже сам Менделеев. Лишь в конце 1930-х было показано, что на частоте «корония» излучают высокоионизированные частицы железа.
Самым знаменитым из них оказался короний — гипотетический инертный газ, существование которого признавал даже сам Менделеев. Лишь в конце 1930-х было показано, что на частоте «корония» излучают высокоионизированные частицы железа.
1898–1947 гг. Атомный век
Открытие радиоактивности позволило изучить внутреннее строение атомов, объяснить периодический закон, освоить атомную энергию и открыть еще 17 элементов.
Мария Склодовская-Кюри (1867–1934 гг.). Одна из первооткрывателей явления радиоактивности, элементов радия и полония, дважды лауреат Нобелевской премии.
«Все соединения радийсодержащего бария светятся самопроизвольно. Этот свет не заметен при дневном освещении, но хорошо виден в полумраке или при газовом освещении. <…> Свет исходит из всей массы тела, тогда как фосфоресцирующее тело светит только той частью поверхности, которая была заранее освещена».
Плутоний (1940 г.)
Об открытии плутония официальная печать сообщила лишь в 1946-м, когда с исследований Гленна Сиборга и его коллег, участвовавших в проекте «Манхэттен», был снят гриф секретности.
Нейтроний (с 1926 г.)
Химик Андреас фон Антропофф назвал так условный «элемент номер ноль», предшествующий водороду и состоящий только из нейтронов, но признания такой взгляд не получил. Позднее термин пытались использовать для описания вырожденной материи внутри нейтронных звезд, однако и здесь нейтроний не прижился. Сегодня он превратился в популярное у фантастов название вымышленных материалов, обычно сверхпрочной брони.
1948–2018 гг. Время синтеза
Новые технологии производства сверхтяжелых ядер позволили синтезировать 21 короткоживущий элемент с атомными номерами от 98 и до 118.
Юрий Оганесян (род. 1933 г.). Теоретик и практик синтеза сверхтяжелых ядер, соавтор открытия нескольких химических элементов, академик РАН.
«Фундаментальным следствием наших знаний о ядерных силах было предсказание существования „Острова стабильности“ сверхтяжелых элементов.
Один из ключевых научных вопросов — где находится граница нашего мира и в этом плане возможное количество химических элементов».
Оганессон (2002 г.)
Еще в ходе Манхэттенского проекта в числе продуктов бомбардировки плутония (атомный номер 94) альфа-частицами был обнаружен кюрий (96). Впоследствии такая же бомбардировка кюрия позволила получить калифорний (98), а ускорители нового поколения, использующие в качестве снарядов куда более тяжелые ядра кальция (20), позволили синтезировать оганессон (118), пока что самый массивный из химических элементов.
Унобтаний (примерно с 1950 г.)
Ироническое — от английского ‘недостижимый’ (unobtainable) — название элемента изобрели пионеры космонавтики, которым постоянно требовались не существовавшие прежде материалы для все новых и новых задач — скажем, для теплоизоляции спускающихся сквозь атмосферу капсул. Сегодня слово может применяться и для реальных материалов, достать или произвести которые особенно сложно.
Источник: Элементы
Период периодической системы | это… Что такое Период периодической системы?
| В этой статье не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. |
Период — строка периодической системы химических элементов, последовательность атомов по возрастанию заряда ядра и заполнению электронами внешней электронной оболочки.
Периодическая система имеет семь периодов. Первый период, содержащий 2 элемента, а также второй и третий, насчитывающие по 8 элементов, называются малыми. Остальные периоды, имеющие 18 и более элементов — большими. Седьмой период не завершён. Номер периода, к которому относится химический элемент, определяется числом его электронных оболочек (энергетических уровней).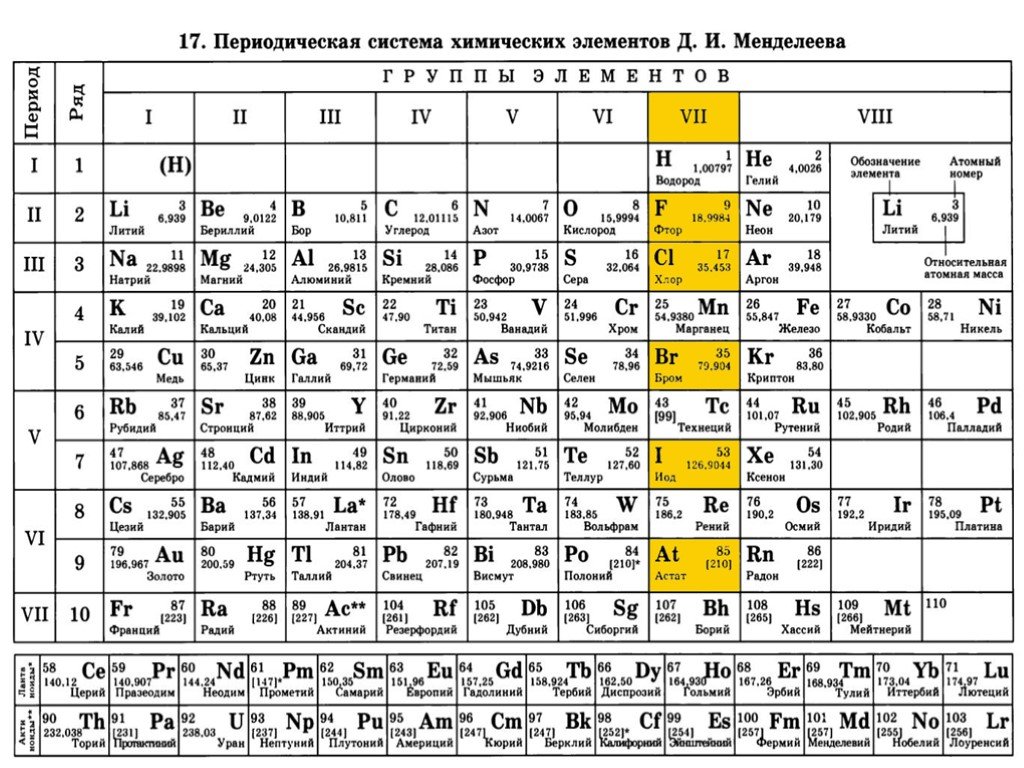
Каждый период (за исключением первого) начинается типичным металлом (Li, Nа, К, Rb, Cs, Fr) и заканчивается благородным газом (Не, Ne, Ar, Kr, Хе, Rn), которому предшествует типичный неметалл.
В первом периоде, кроме гелия, имеется только один элемент — водород, сочетающий свойства, типичные как для металлов, так и (в большей степени) для неметаллов. У этих элементов заполняется электронами 1s-подоболочка.
У элементов второго и третьего периода происходит последовательное заполнение s– и р-подоболочек. Для элементов малых периодов характерно достаточно быстрое увеличение электроотрицательности с увеличением зарядов ядер, ослабление металлических свойств и усиление неметаллических.
Четвёртый и пятый периоды содержат декады переходных d-элементов (от скандия до цинка и от иттрия до кадмия), у которых после заполнения электронами внешней s-подоболочки заполняется, согласно правилу Клечковского, d-подоболочка предыдущего энергетического уровня.
1s
2s 2p
3s 3p
4s 3d 4p
5s 4d 5p
6s 4f 5d 6p
7s 5f 6d 7p
6f 7d 7f
...
В шестом и седьмом периоде происходит насыщение 4f– и 5f-подоболочек, вследствие чего они содержат ещё на 14 элементов больше по сравнению с 4-м и 5-м периодами (лантаноиды в шестом и актиноиды в седьмом периоде).
Вследствие различия периодов по длине и другим признакам существуют разные способы их относительного расположения в периодической системе. В короткопериодном варианте, малые периоды содержат по одному ряду элементов, большие имеют по два ряда. В длиннопериодном варианте все периоды состоят из одного ряда. Ряды лантаноидов и актиноидов обычно записывают отдельно внизу таблицы.
| Количество элементов | 2 или 8 | 18 и более |
| Количество рядов | 1 | 2 |
| Распределение электронов | заполняются только s– и р-подоболочки | заполняются также предвнешние d-подоболочки и предпредвнешние f-подоболочки |
| Изменение свойств элементов | металлические свойства быстро убывают | медленный переход от металлических свойств к неметаллическим |
Элементы одного периода имеют близкие значения атомных масс, но разные физические и химические свойства, в отличие от элементов одной группы.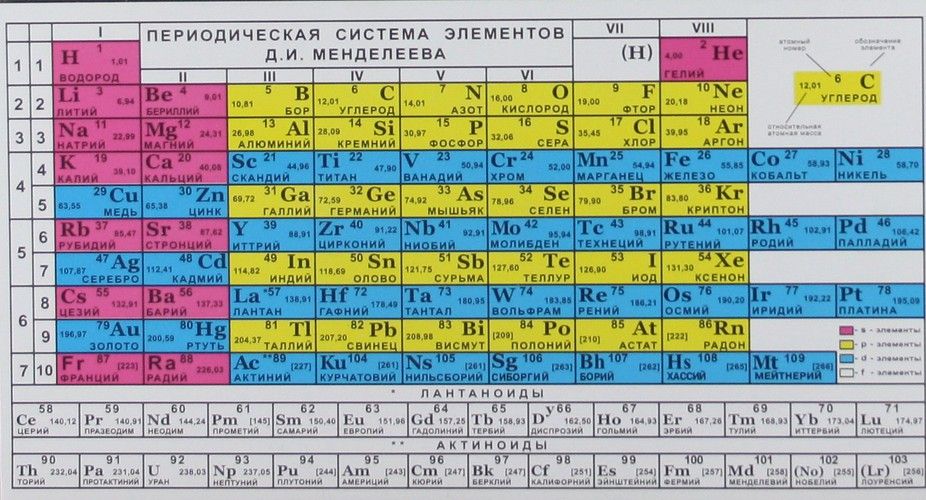 С возрастанием заряда ядра у элементов одного периода уменьшается атомный радиус и увеличивается количество валентных электронов, вследствие чего происходит ослабление металлических и усиление неметаллических свойств элементов, ослабление восстановительных и усиление окислительных свойств образуемых ими веществ.
С возрастанием заряда ядра у элементов одного периода уменьшается атомный радиус и увеличивается количество валентных электронов, вследствие чего происходит ослабление металлических и усиление неметаллических свойств элементов, ослабление восстановительных и усиление окислительных свойств образуемых ими веществ.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo | ||||||||||
| ||||||||||||||||||||||||||||||||||||||||||
Периодическая таблица – Королевское химическое общество
Перейти к основному содержанию
У вас не включен JavaScript. Пожалуйста, включите JavaScript, чтобы получить доступ ко всем функциям сайта.
Пожалуйста, включите JavaScript, чтобы получить доступ ко всем функциям сайта.
Интерактивная периодическая таблица Королевского химического общества включает историю, алхимию, подкасты, видео и тенденции данных по периодической таблице. Нажмите на вкладки вверху, чтобы изучить каждый раздел. Используйте кнопки выше, чтобы изменить свой взгляд на периодическую таблицу и просмотреть потрясающую иллюстрацию визуальных элементов Мюррея Робертсона. Нажмите на каждый элемент, чтобы прочитать подробную информацию.
РФ
104
Дб
105
сержант
106
ч
107
Hs
108
Мт
109
Дс
110
Rg
111
Сп
112
Нч
113
Флорида
114
Мак
115
Ур.
116
Ц
117
Ог
118
FM
100
Мэриленд
101
Нет
102
Лр
103
Загрузите наше бесплатное приложение Периодической таблицы для мобильных телефонов и планшетов.
Почему в периодической таблице всего 7 периодов?
С другой стороны, будет сложно синтезировать элементы тяжелее Оганесона ($\pu{Z = 118}$) из-за отсутствия нейтронов. Когда количество протонов увеличивается в периодической таблице, отношение нейтроны/протоны также увеличивается. В кислороде-$16$ это отношение $\ce{n/p = 8/8 = 1,0}$. В железе-$56$ это соотношение составляет $\ce{30/26 = 1,15}$. В уране-$238$ это $\ce{146/92 = 1,59}$. Для более тяжелых атомов это отношение продолжает увеличиваться.
Когда количество протонов увеличивается в периодической таблице, отношение нейтроны/протоны также увеличивается. В кислороде-$16$ это отношение $\ce{n/p = 8/8 = 1,0}$. В железе-$56$ это соотношение составляет $\ce{30/26 = 1,15}$. В уране-$238$ это $\ce{146/92 = 1,59}$. Для более тяжелых атомов это отношение продолжает увеличиваться.
Одной из проблем, которые необходимо было решить для создания последних элементов (тенессин, оганесон), было найти не слишком тяжелое ядро, содержащее достаточное количество нейтронов, чтобы его можно было использовать в качестве снаряда, направляемого на цель, уже богатую нейтронами. Кальций-$48$ — редкий изотоп кальция, но хороший выбор с протонами $20$ и соотношением нейтрон/протон = $28/20 = 1,4$. Это значение является максимальным возможным значением среди первых элементов $30$. Когда $\ce{Ca-48}$ направляется на такую цель, как уран-$238$ ($92$ протонов), ни одно ядро не может быть образовано с числом протонов больше, чем 92 + 20 = 112$, что является коперницием Cn.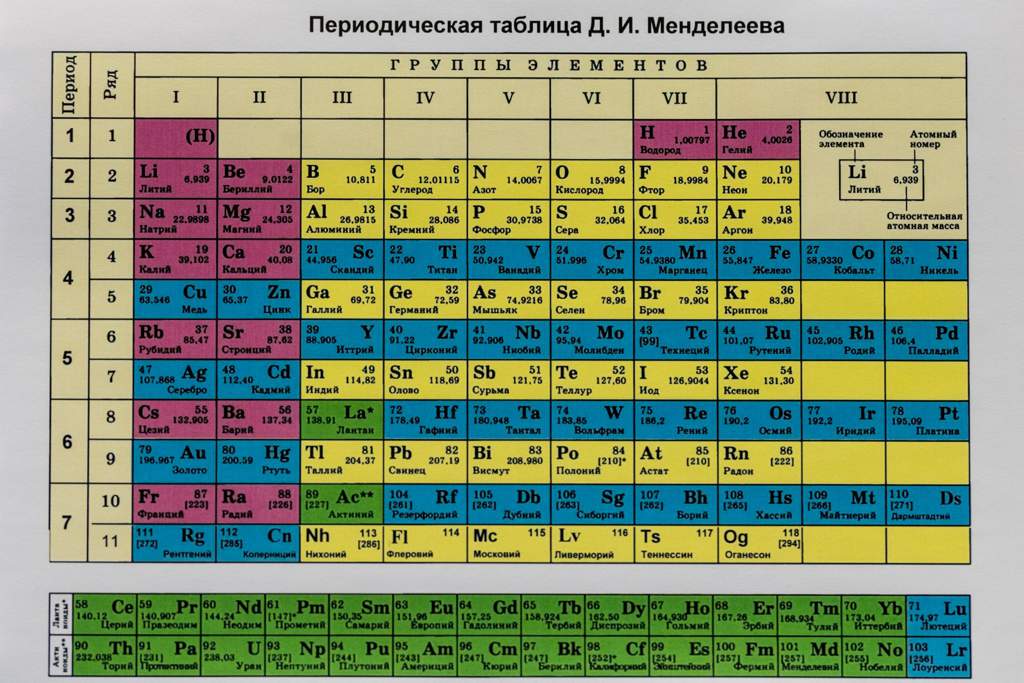 И это столкновение даст ядро с максимумом в $28 + 146 = 174$ нейтронов, что дает изотоп $\ce{Cn-286}$. Это ядро уже достаточно нестабильно, так как его период полураспада меньше $1$ минуты. Если бы в качестве ракеты использовался более легкий изотоп кальция, нейтронов не хватило бы для получения какого-либо изотопа коперниция. Конечно, были обнаружены и более легкие изотопы коперниция.
И это столкновение даст ядро с максимумом в $28 + 146 = 174$ нейтронов, что дает изотоп $\ce{Cn-286}$. Это ядро уже достаточно нестабильно, так как его период полураспада меньше $1$ минуты. Если бы в качестве ракеты использовался более легкий изотоп кальция, нейтронов не хватило бы для получения какого-либо изотопа коперниция. Конечно, были обнаружены и более легкие изотопы коперниция.
Чрезвычайно сложно создать ядро с большим количеством протонов, чем Copernicium-$252$. Для создания более тяжелых атомов необходимо попасть в ядро, имеющее больше протонов, чем у урана. Но эти цели становятся все более и более радиоактивными. Для получения последнего атома оганесона ($\ce{Z = 118}$) необходимо было направить ракеты из ядра $\ce{Ca-48}$ на мишень из калифорния-$252$ ($\ce {98}$ протонов и $154$ нейтронов), период полураспада которых составляет $\pu{2,2 y}$. При использовании в качестве мишени для ядра $\ce{Ca-48}$ может образоваться ядро с максимальным значением $98 + 20 = 118$ протонов и 28 + 154 = 182$ нейтронов, что составляет оганесон-$300$.