Южный федеральный университет | Пресс-центр: Есть ли ещё неоткрытые химические элементы на Земле и во Вселенной, рассказал эксперт ЮФУ
26 декабря 1898 года во Французской академии наук супругами Пьером и Марией Кюри был сделан доклад, в котором они объявили о теоретическом открытии двух новых радиоактивных элементов – радия и полония. Учёные и сегодня продолжают получать новые химические элементы путём ядерного синтеза.
В середине XIX века, когда Дмитрий Менделеев опубликовал свою версию периодической таблицы в журнале Русского химического общества, было открыто всего 63 химических элемента, но под все элементы, открытые позже, в таблице было уготовано место, поскольку Менделеев не столько систематизировал, сколько объяснил закономерности — горизонтальной, вертикальной и диагональной интерполяции свойств элементов. Немецкий учёный, академик Лотар Кольдиц писал, что предсказание ещё неизвестных элементов, их свойств и соединений является исключительно заслугой Дмитрия Ивановича Менделеева.
Сегодня химических элементов в периодической таблице уже 118 — в природе встречаются 92 из них, остальные были получены искусственно — они неустойчивы и имеют короткие периоды существования.
Доцент кафедры аналитической химии Химического факультета ЮФУ Александр Тягливый рассказал, что такие открытия носят в основном фундаментальный интерес — получение новых химических элементов позволяет перепроверить, расширить, усовершенствовать гипотезы и принципы, описывающие физические явления на субатомном уровне.
«Между элементами, располагающимися рядом в таблице Д. И. Менделеева наблюдается схожесть в свойствах веществ, образованных ими, так в периодическом законе рассматриваются закономерности изменения свойств как по периоду, так и по подгруппе. Но если мы говорим о последних открытых элементах, то их характеризуют в основном сугубо на основании теоретических расчетов, так как они не стабильны и их периоды жизни очень короткие»

Последний природный химический элемент периодической таблицы — это уран, атомный номер которого 92. Каждый последующий элемент в таблице Менделеева имеет большую массу, чем предыдущий, и с увеличением числа протонов в ядре ядерным силам сложнее противостоять электростатическому отталкиванию. Поэтому мы и наблюдаем естественный процесс ― радиоактивный распад.
Радиогенные металлы встречаются и в природе, но только как промежуточные продукты распада урана или тория. Например, общее содержание франция в земной коре на всей планете оценивается примерно в 340 граммов — его изотоп существует около получаса и продолжает распад, а залежи урана-235 «рождают» новый франций, то есть его ядерный синтез проводит сама природа.
Последние шесть элементов седьмого периода таблицы Менделеева — 113, 114, 115, 116, 117, 118 — были синтезированы в России: в Объединенном институте ядерных исследований в Дубне (ОИЯИ) на ускорительном комплексе У-400 в лаборатории ядерных реакций имени Георгия Флерова.
Последний из открытых 118-й элемент в 2016 году получил название оганесон (Og) в честь российского ученого Юрия Оганесяна, внесшего вклад в исследования сверхтяжелых элементов. После оганесона, на котором сейчас заканчивается периодическая таблица, должен идти элемент № 119, повторяющий в какой-то степени, в том числе по конфигурации электронов, щелочные металлы. При этом он сам, будучи короткоживущим (речь идет о микросекундах), не будет щелочным металлом. Однако, по словам Александра Тягливого, более устойчивыми могут оказаться элементы следующего периода.
«Существует гипотеза, что есть участки стабильности и нестабильности ядер, которые чередуются в зависимости от массы ядра и его заряда. На текущий момент мы знаем все стабильные изотопы, а тяжелые изотопы открываются всё более нестабильными. Однако, возможно, начиная с определенного соотношения появится следующий интервал стабильности и будут получены устойчивые сверхтяжелые химические элементы. В теории такие существовать могут»
А уже полученные сверхтяжелые металлы, которые на Земле «живут» микросекунды могут оказаться устойчивыми в естественной среде на других планетах других галактик. Также на других планетах могут быть химические элементы, не встречающиеся на Земле — например, частицы, устроенные аналогично атомам, но из более тяжёлых аналогов электронов. Теоретически также возможны частицы противоположные атомам — с отрицательно заряженным ядром и положительно заряженными аналогами электронов, но в объяснении их природы пока есть ряд противоречий.
«В случае протонов в ядре их удерживают ядерные силы, которые компенсируют электростатическое отталкивание, а в случае электронов их быть не должно. С другой стороны, есть аналоги электронов — мюоны, которые тоже отрицательно заряжены. Вселенная огромна и число возможных событий в ней велико, поэтому я не берусь утверждать, что чего-то не может быть, но наше представление о мире пока может описать не все варианты»
Учёные ЮФУ не проводят ядерный синтез и не получают новые элементы, но несколько научных подразделений ЮФУ — Химический факультет, Физический факультет и Международный исследовательский институт интеллектуальных материалов предсказывают и получают новые вещества, соединения и материалы с уникальными и функциональными свойствами.
Структура таблицы «Периодическая система химических элементов Д.И.Менделеева»
Тема: Структура таблицы «Периодическая система химических элементов Д. И. Менделеева» (короткая форма): А- и группы, периоды
Задачи урока:
Образовательные – сформировать знания о периодическом законе и периодической системе Д.И.Менделеева. Научить учащихся работать с периодической системой (уметь определять положение элемента в периодической системе, свойства элемента в зависимости от положения его в периодической системе).
Воспитательные – патриотическое воспитание, формирование естественно – научной картины мира, экологическое воспитание, способствование осознанию роли химических знаний в развитии личности, преодоление трудностей.
Развивающие – развивать наблюдательность, память (при изучении физического смысла периодического закона и графического его отображения). Развивать умение сравнивать. Научить учащихся обобщать и делать выводы, анализировать, составлять, систематизировать.
Содержание материала.
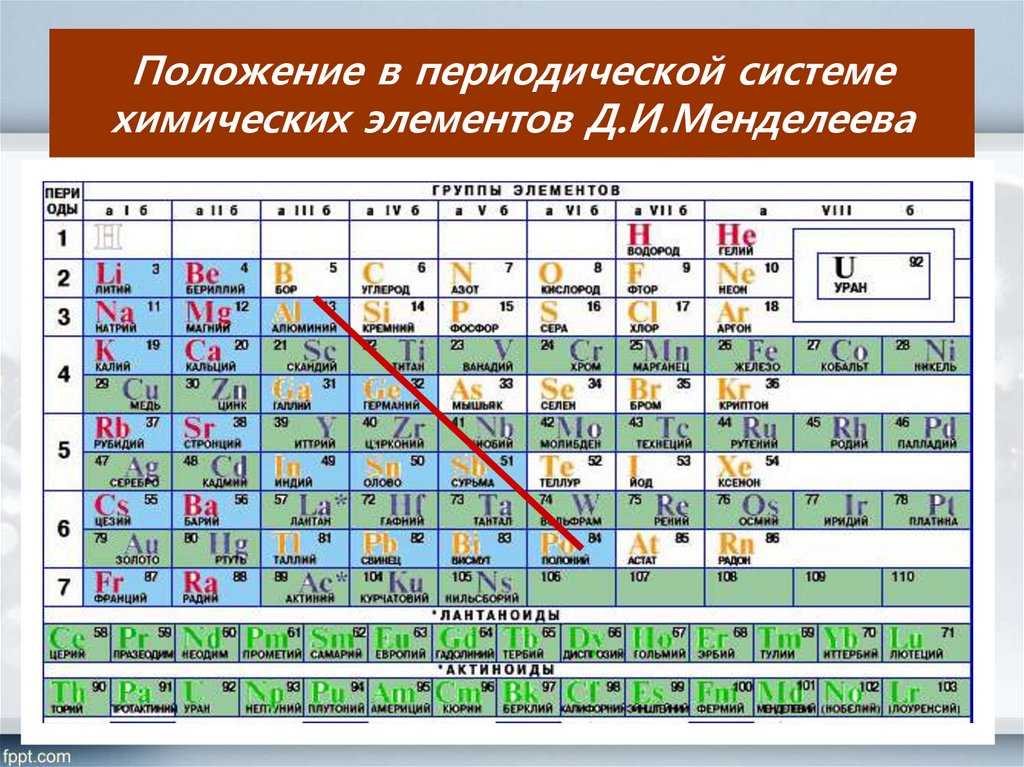
Новая тема. Сегодня мы с Вами продолжаем говорить об атомах хим. элементов, а точнее о расположении определённых видов атомов в ПС и её структуре. Д.И. Менделеев разработал научную классификацию химических элементов – Периодическую систему в форме таблицы. Эту таблицу можно представить в виде дома, где «живут» все химические элементы. Каждому химическому элементу отведена своя «квартира», т.е. клетка с определенным номером.
Лантаноиды актиноиды расположены под основной таблицей элементов, в них по 14 элементов, похожих по своим свойствам. Одни похожи на лантан и называются, поэтому лантаноиды (лантаниды), другие похожи на актиний и называются актиноиды (актиниды). Обе группы включают в себя металлы. Все лантаниды (за исключением прометия) нерадиоактивны; актиниды, напротив, радиоактивны.
Обе группы включают в себя металлы. Все лантаниды (за исключением прометия) нерадиоактивны; актиниды, напротив, радиоактивны.
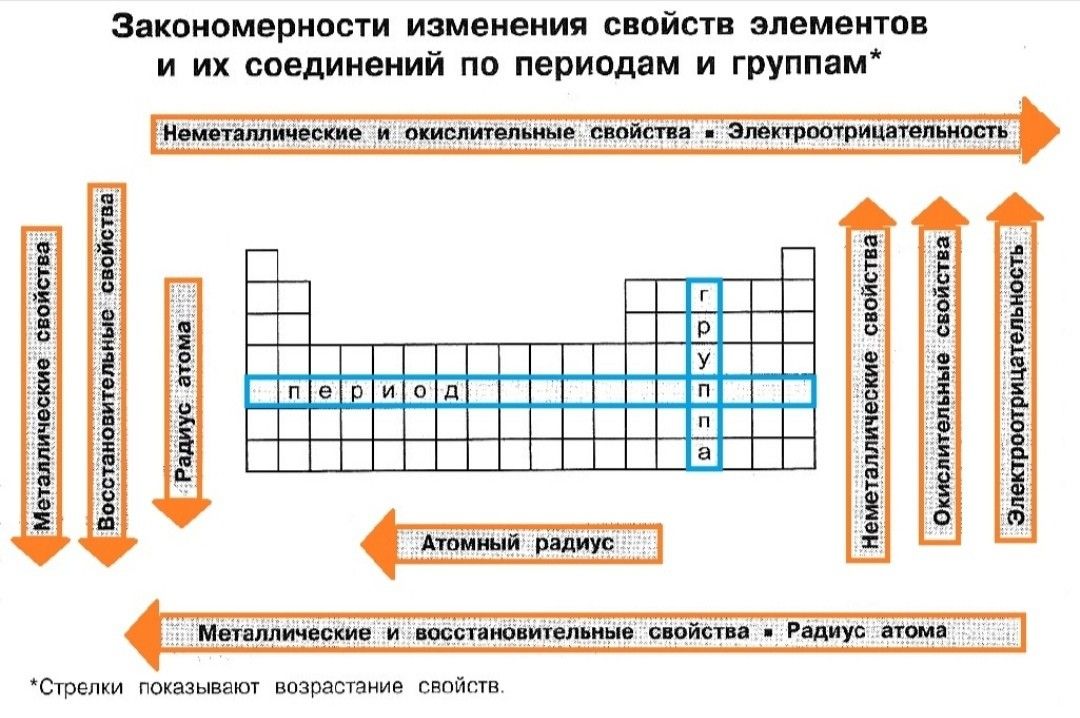
По вертикали химические элементы тоже «живут» друг под другом. Эти вертикальные ряды называются группами. Группами называют вертикальные ряды в периодической системе. В этих вертикальных группах химические элементы имеют сходные свойства. Этих групп всего 8. Каждая группа состоит из двух подгрупп: главной и побочной. Главную подгруппу еще называют группой А, в нее входят элементы малых и больших периодов. Побочную подгруппу называют еще группой В, в нее входят элементы только больших периодов.
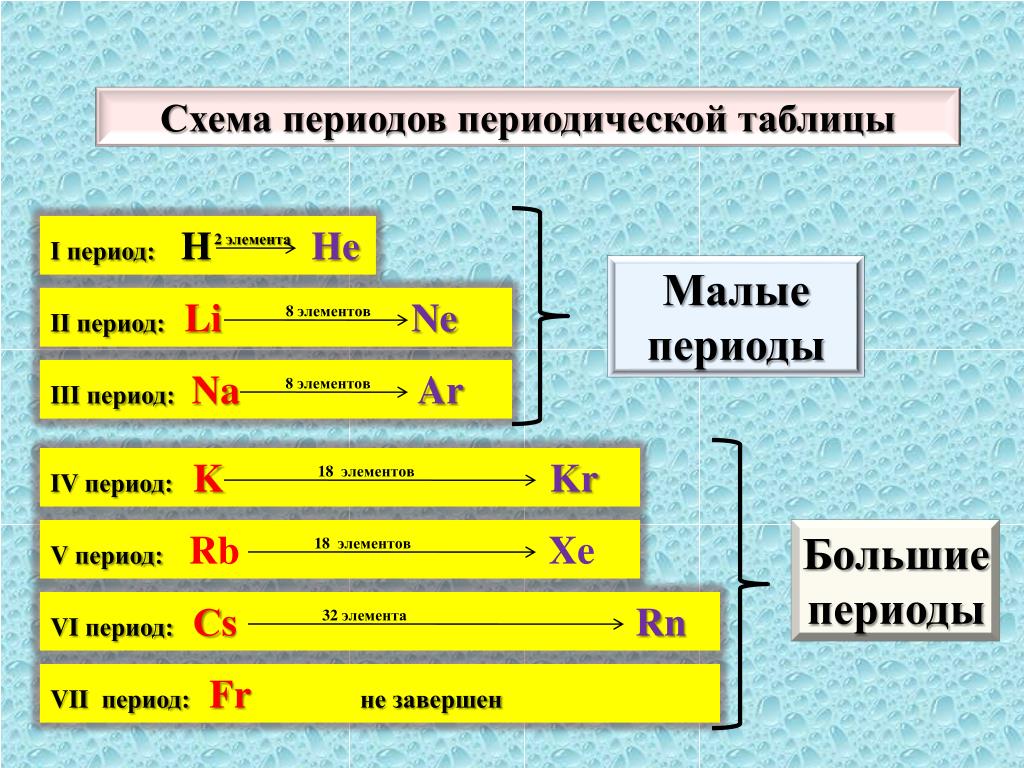
Периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров. В периодической систем семь периодов: первый, второй и третий периоды называют малыми, в них содержится соответственно 2, 8 и 8 элементов; остальные периоды называют большими: в четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент. Эти периоды называют большими, т.к. здесь много химических элементов, расположенных в два ряда. Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом.
Эти периоды называют большими, т.к. здесь много химических элементов, расположенных в два ряда. Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом.
Рассмотрим главную подгруппу I группы, в нее входят Li, Na, K, Rb, Cs, Fr. Это подгруппа лития, ведь литий в ней первый. Побочная подгруппа этой группы образована Cu, Ag, Au, поэтому ее называют подгруппой меди.
Кроме короткопериодной таблицы Д.И. Менделеева, которая у вас в учебнике, есть еще и длиннопериодный вариант (см. рис.)
Всего в таблице 118 химических элементов и подобно тому, как 33 буквы алфавита образует множество слов, так и 118 химических элемента образует множество веществ.
КОРОТКОПЕРИОДНАЯ ТАБЛИЦА
Длиннопериодный вариант таблицы
Физический смысл порядкового номера химического элемента: число протонов в атомном ядре и число электронов, вращающихся вокруг атомного ядра, равны порядковому номеру.
2.Закрепление новой темы (выполнить письменно):
Назовите элементы IVA и VI B групп.
Прямыми линиями выделите ряды, где находятся: элементы одного и того же периода одной линией; элементы одной и той же группы – двумя линиями.
Be, С, N, O, Ne
Be, Mg, Ca, Bа
3.Найдите в каждом ряду один из элементов, который отличается от остальных по положению в периодической системе химических элементов.
а) H, He, Ne, Ar
б) H, Li, Be, B
в) Fe, Co, Ni, Ar
г) F, Cl, Mn, Br
Ответы: а) H; б) H; в) Ar; г) Mn.
4.Выберите группы сходных элементов:
а) Na, Ca, O
б) Ne, Ar, He
в) F, Cl, Br
г) P, В, Li
Ответы: б; в.
3.Задание для самостоятельного изучения (домашнее задание).
Периодическая таблица: семейства и периоды
Обновлено: 15.07.2021
Химия: 1001 практические задачи для чайников (+ бесплатная онлайн-практика)
Исследуйте книгу Купить на Amazon
В периодической таблице элементов есть семь горизонтальных рядов элементов. Каждая из этих строк называетсяПериоды в периодической таблице
В каждом периоде (горизонтальный ряд) атомные номера увеличиваются слева направо. Периоды пронумерованы от 1 до 7 в левой части таблицы. Элементы, находящиеся в одном периоде, имеют не такие уж и похожие химические свойства. Рассмотрим первых двух членов периода 3: натрий (Na) и магний (Mg). В реакциях и те, и другие имеют свойство терять электроны (ведь они металлы), но натрий теряет один электрон, а магний — два. Хлор (Cl), ближе к концу периода, имеет тенденцию приобретать электрон (это неметалл).
Рассмотрим первых двух членов периода 3: натрий (Na) и магний (Mg). В реакциях и те, и другие имеют свойство терять электроны (ведь они металлы), но натрий теряет один электрон, а магний — два. Хлор (Cl), ближе к концу периода, имеет тенденцию приобретать электрон (это неметалл).
Семейства в периодической таблице
Как и человеческие семьи, члены семей (вертикальные столбцы) в периодической таблице имеют сходство или сходные свойства. Семейства помечаются в верхней части столбцов одним из двух способов: Так почему же элементы одного семейства имеют схожие свойства? Вы можете изучить четыре семейства в периодической таблице и посмотреть на электронные конфигурации нескольких элементов в каждом семействе.На рисунке ниже перечислены некоторые важные семейства, которым даны специальные имена:
Семейство IA состоит из щелочных металлов
 Оба эти элемента играют важную роль в химии тела и обычно встречаются в солях.
Оба эти элемента играют важную роль в химии тела и обычно встречаются в солях.Семейство IIA состоит из щелочноземельных металлов . Все эти элементы имеют тенденцию терять два электрона. Кальций (Ca) является важным членом семейства IIA (кальций необходим для здоровых зубов и костей).
Семейство VIIA состоит из галогенов . Все они имеют тенденцию к получению одного электрона в реакциях. Важными членами этого семейства являются хлор (Cl), используемый при производстве поваренной соли и отбеливателя, и йод (I).
Семейство VIIIA состоит из инертных газов . Эти элементы очень неактивны. Долгое время благородные газы называли инертными газами, потому что считалось, что эти элементы вообще не вступают в реакцию.
Ученый по имени Нил Бартлетт показал, что по крайней мере некоторые инертные газы могут вступать в реакцию, но для этого требуются особые условия. После открытия Бартлетта эти газы стали называть благородными.

Валентные электроны и их семейства
Конфигурация электронов показывает количество электронов на каждой орбитали в конкретном атоме. Эти электронные конфигурации показывают, что между каждой группой элементов есть некоторое сходство с точки зрения их валентных электронов.Имейте в виду, что касается количества валентных электронов и номера столбца с римскими цифрами: семейство IA имеет 1 валентный электрон; семейство IIA имеет 2 валентных электрона; семейство VIIA имеет 7 валентных электронов; а семейство VIIIA имеет 8 валентных электронов. Таким образом, для семейств, обозначенных римской цифрой и буквой А, римская цифра указывает количество валентных электронов.
Римская цифра позволяет очень легко определить, что кислород (O) имеет шесть валентных электронов (он относится к семейству VIA), кремний (Si) — четыре и так далее. Вам даже не нужно писать электронную конфигурацию или энергетическую диаграмму, чтобы определить количество валентных электронов.
Об этой статье
Эту статью можно найти в категории:
- Химия,
Разница между периодами и группами
Опубликовано Madhu
Ключевое отличие между периодами и группами заключается в том, что периодов представляют собой горизонтальные строки, тогда как группы представляют собой вертикальные столбцы в периодической таблице химических элементов. В периодической таблице элементов 7 основных периодов и 18 групп.
Периодическая таблица элементов представляет собой большую таблицу, в которой каждый известный химический элемент помещен в определенное место с учетом атомной структуры. Следовательно, как и в любой сетке, в этой периодической таблице также есть строки и столбцы. Кроме того, каждая строка и столбец имеют определенные характеристики, и мы называем строку периодом, а столбец — группой в периодической таблице.
Кроме того, каждая строка и столбец имеют определенные характеристики, и мы называем строку периодом, а столбец — группой в периодической таблице.
СОДЕРЖАНИЕ
1. Обзор и ключевые отличия
2. Что такое периоды в периодической таблице
3. Что такое группы в периодической таблице
4. Сравнение периодов и групп в табличной форме
5. Резюме
Что такое периоды в периодической таблице?
Периоды — это горизонтальные строки периодической таблицы. Все химические элементы в этом ряду имеют одинаковое количество электронных оболочек. При переходе по строке количество протонов в атомном ядре увеличивается на 1 для каждого следующего элемента в периоде. Более того, элементы становятся менее металлическими, когда мы продвигаемся вперед на ряд.
Однако периоды имеют разное количество членов; в одни периоды химических элементов больше, чем в другие периоды. Это связано с тем, что количество элементов определяется количеством электронов, разрешенных в каждой электронной оболочке. В периодической таблице в основном 7 периодов. Таким образом, мы называем их периодом 1, периодом 2, … периодом 7.
В периодической таблице в основном 7 периодов. Таким образом, мы называем их периодом 1, периодом 2, … периодом 7.
Что такое группы в периодической таблице?
Группы — это вертикальные столбцы периодической таблицы. Все химические элементы одной группы содержат одинаковое количество валентных электронов. Например, количество валентных электронов в группе 1 равно 1. В большинстве случаев элементы в одной группе имеют схожие химические и физические свойства. В периодической таблице в основном 18 групп. Однако некоторые группы также имеют общие названия. Например, мы называем элементы группы 1 щелочными металлами, а элементы группы 2 – щелочноземельными металлами.
Рисунок 01: Периоды и группы в периодической таблице
Вот некоторые из этих распространенных названий:
- Группа 1 = щелочные металлы
- Группа 2 = щелочноземельные металлы
- Группа 11 = чеканные металлы
- Группа 12 = летучие металлы
- Группа 17 = галогены
В чем разница между периодами и группами в периодической таблице?
Периоды — это горизонтальные строки в периодической таблице, тогда как группы — это вертикальные столбцы в периодической таблице.

 Оба эти элемента играют важную роль в химии тела и обычно встречаются в солях.
Оба эти элемента играют важную роль в химии тела и обычно встречаются в солях.