Периодический закон и Периодическая система
Гурына Ира
Химия для 9 классаВ начале XX века была создана теория строения атома, на основе которой периодический закон в настоящее время формулируется так: «Свойства химических элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от величины заряда ядра атома.»
- Между положением элемента в периодической системе и его электронным строением существует связь.
- Порядковый номер элемента в периодической системе равен заряду ядра атома (следовательно, порядковый номер показывает число протонов в ядре и число электронов в атоме).
- Каждый период начинается элементом, в атомах которого начинает застраиваться новый электронный слой, причём номер этого слоя равен номеру периода (следовательно, номер периода показывает число электронных слоёв в атомах элементов данного периода).

- Элементы, атомы которых обладают сходными по строению электронными оболочками, попадают в одну подгруппу периодической системы. У всех элементов главных подгрупп электронами заполняется внешний электронный слой, причём число электронов на этом слое равно номеру группы.
У элементов I и II групп электронами заполняется s-подуровень, поэтому они называются s-элементами. У элементов III-VIII групп происходит заполнение р-подуровня, поэтому эти элементы относятся к семейству р-элементов. У элементов побочных подгрупп происходит заполнение электронами d-подуровня предпоследнего слоя, а у лантаноидов и актиноидов f-подуровня предпредпоследнего слоя.
- Свойства элементов определяются их строением. Элементы, имеющие на последнем слое 1 – 2 электрона являются металлическими, 2 – 5 электронов – переходными, 4 – 8 электронов – неметаллическими.
В периоде с возрастанием заряда ядра атомов металлические свойства уменьшаются, а неметаллические усиливаются.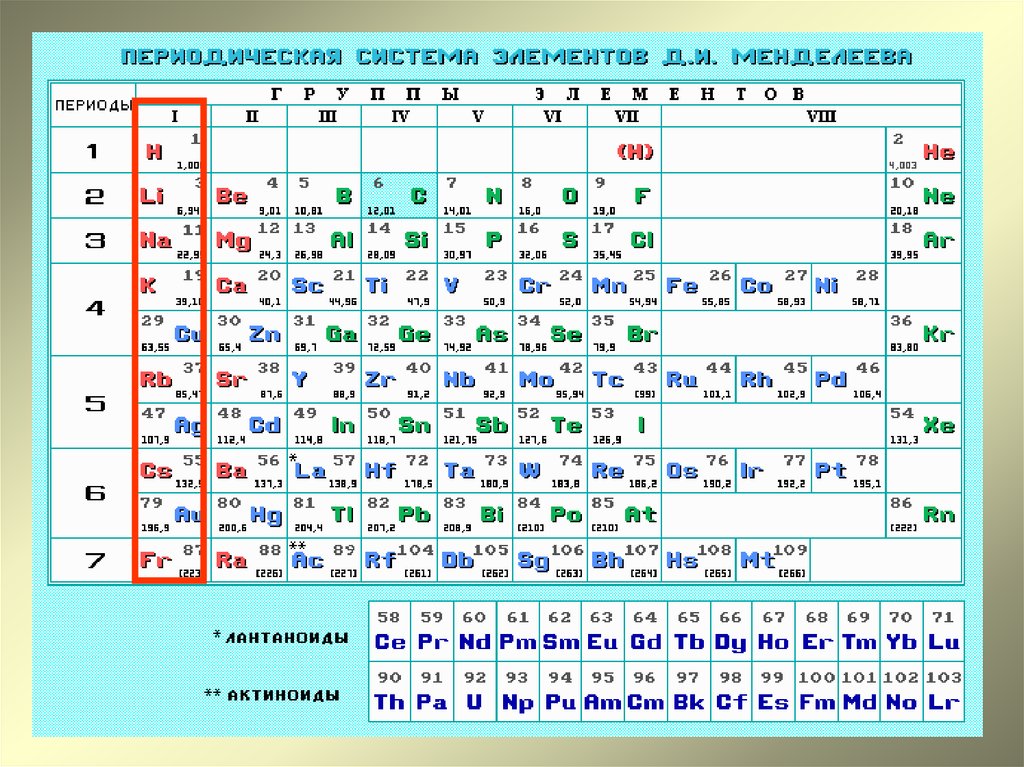 Это связано с увеличением числа электронов на последнем слое.
Это связано с увеличением числа электронов на последнем слое.
В главной подгруппе с возрастанием заряда ядра атомов металлические свойства усиливаются, а неметаллические уменьшаются. Это связано с увеличением числа электронных слоёв, а следовательно с уменьшением сил притяжения электронов последнего слоя к ядру.
Периодическое повторение свойств элементов объясняется периодическим повторением числа электронов на внешнем энергетическом уровне и повторением электронных структур атома.
Химическая активность элементов определяется строением внешнего электронного слоя. Активность галогенов объясняется нехваткой 1 электрона до завершения внешнего слоя. У инертных элементов внешний электронный слой завершён, поэтому они химически неактивны. У атомов щелочных металлов 1 электрон на последнем слое является как бы лишним.
Полезные ссылки
Источник материала
Периодическая система как условная запись периодического закона (видео)
Характеристика элементов по положению в таблице Менделеева (видео)
Изменение свойств элементов и их соединений по периодам и группам (видео)
Периодический закон и Периодическая система химических элементов (видео)
Описание элемента по положению в Периодической системе (видео)
Закономерности изменения электроотрицательности элементов в группе и периоде (видео)
Дополнительные материалы
Периодический закон и периодическая система элементов Менделеева (видео)
Периодическая система элементов (видео)
Поделиться Share Tweet
Периодическая таблица: как использовать, элементы, группы и многое другое!
В звонке периодическая таблица мы можем видеть химические элементы, которые упорядочены по их атомным номерам, а также по их электронной конфигурации, не забывая об их химических свойствах. Все это означает, что перед нами устройство в виде таблицы.
Все это означает, что перед нами устройство в виде таблицы.
Вот почему мы можем определить периодическую таблицу как своего рода схема, позволяющая лучше понять каждый из элементов
Индекс
- 1 Что такое таблица Менделеева и для чего она нужна?
- 2 Разработка атомных элементов, свойств и весов
- 3 Структура таблицы Менделеева и ее элементов
- 3.1 Группы или семьи
- 3.2 Периоды
- 3.3 Блочное деление
- 4 В чем важность таблицы элементов?
- 5 Как пользоваться периодической таблицей
- 6 Новые химические элементы в таблице
Наверняка вы уже знали, что это схема, в которой появляются химические элементы. Но они не случайно, но их размещение и данные, которые дает нам указанная таблица, имеют определенную цель.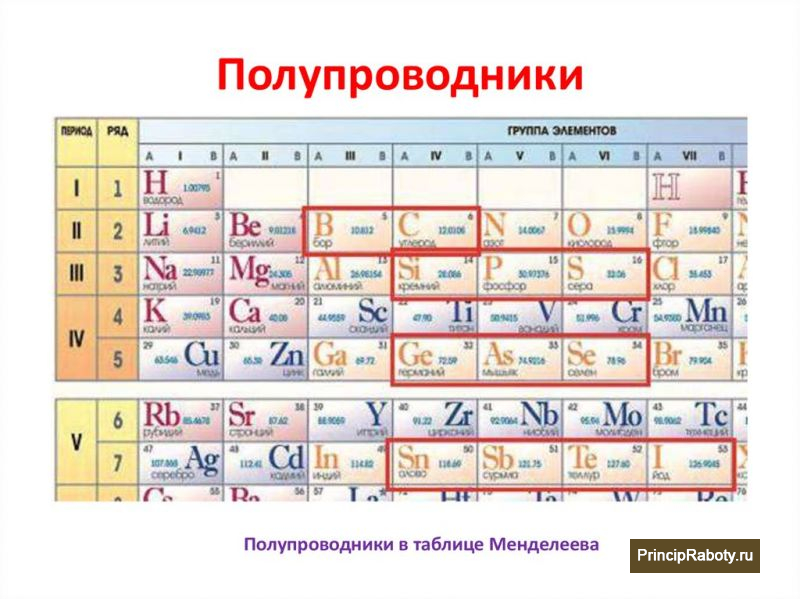
Элементы распределяются как слева направо, так и сверху вниз, но всегда в порядке возрастания их атомные номера, то есть количество протонов. Горизонтальные ряды периодической таблицы элементов называются периодами, а 18 вертикальных столбцов – группами или семействами.
Разработка атомных элементов, свойств и весовНадо сказать, что некоторые элементы были хорошо известны еще в древности. Основными из них были золото, серебро, а также медь или ртуть. Но на самом деле первое открытие химического элемента произошло в XNUMX веке. Именно благодаря Хеннингу Брэнду он открыл фосфор. Уже в XNUMX веке стали известны другие, такие как водород или кислород. Это было так Антуан Лавуазье составил список из 33 пунктов., который сгруппировал их в газы, металлы, неметаллы и землю. В начале XIX века новую идею разработал Джон Далтон. Это была формулировка химического атомизма, таким образом создавая систему относительные атомные массы. Хотя Дальтон предпочитал называть их атомными весами. Позже его идеи также были изменены, поскольку в них были неточности.
В начале XIX века новую идею разработал Джон Далтон. Это была формулировка химического атомизма, таким образом создавая систему относительные атомные массы. Хотя Дальтон предпочитал называть их атомными весами. Позже его идеи также были изменены, поскольку в них были неточности.
После всех исследований и достижений у нас в общей сложности 118 элементов. Мы найдем их разделенными на так называемые группы или семьи и периоды. Вы хотите знать, что символизирует каждый из них?
Группы или семьи
Это вертикальные столбцы, которые мы видим в таблице. В таблице, которую мы все знаем сегодня, их всего 18, и, как мы видим, они пронумерованы должным образом. Элементы в каждой группе имеют очень похожие физические и химические свойства.
- Grupo 1: В нем мы встретим щелочных металлов. Он состоит из элементов: лития (Li), натрия (Na), калия (K), рубидия (Rb), цезия (Cs), франция (Fr).

- Grupo 2: В этой второй группе мы увидим щелочноземельные металлы. Они тверже предыдущих и хорошо проводят электричество. Здесь мы найдем бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (ra).
- Grupo 3: Семья Эскандио. Среди них скандий (Sc) и иттрий (Y). Хотя они несколько противоречивы, мы должны также упомянуть лантан (La) и актиний (Ac).
- Grupo 4: Это семейство титана. В нем мы находим титан (ti), цирконий (Zr), гафний (Hf) и резерфорд (Rf).
- Grupo 5: Внутри семья ванадия, мы собираемся найти ванадий (V), ниобий (Nb), тантал (Ta), дубний (Db).
- Grupo 6: В этой группе мы находим хромовая семья. Там мы увидим хром (Cr), молибден (Mo), вольфрам (W), сиборгий (Sg).
- Grupo 7: марганец (Mn), технеций (Tc) и рений (Re), все они принадлежат к семейству марганцевых.

- Grupo 8: железная семья Он состоит из железа (Fe), рутения (Ru), осмия (Os), калия (Hs).
- Grupo 9: Здесь мы находим кобальт (Co), родий (Rh), иридий (Ir), мейтнерий (Mt).
- Grupo 10: Семейство никеля состоит из никеля (Ni), палладия (Pd), платины (Pt), дармштадция (Ds).
- Grupo 11: Медь (Cu), серебро (Ag) и золото (Au) известны как чеканка металлов
- Grupo 12: Цинк (Zn), кадмий (Cd) и ртуть (Hg).
- Grupo 13: Так называемая группа 13 также соответствует группе бора. Название происходит от земли, потому что именно там их больше всего. Мы находим бор (B), алюминий (Al), галлий (Ga), индий (In), таллий (Ti) и нихоний (nh).
- Grupo 14: В углерод или карбонидная группа, мы находим углерод (C), кремний (Si), германий (Ge), олово (Sn), свинец (Pb), флеровий (FI).

- Grupo 15: В этом случае мы приходим к
- Grupo 16: Он известен как группа амфигенов, хотя они не могут скрыть свой статус кислородной семьи. Итак, мы находим кислород (O), серу (S), селен (Se), теллур (Te), полоний (Po), ливерморио (Lv).
- Grupo 17: галогены находятся в этой группе. Фтор (F), хлор (CI), бром (Br), йод (I), астат (At), тенезе (Ts).
- Grupo 18: Звонки благородные газы Это еще одна группа элементов, имеющих очень похожие свойства. В нормальных условиях это газы без цвета и запаха. Это гелий (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe), радон (Rn) и органезон (Og).
Чтобы понять эту организацию, вы должны знать, что каждый из членов группы имеет очень похожие характеристики как их электронная конфигурация и та же валентность, то есть количество электронов, которые они имеют в последней оболочке. Конечно, если мы посмотрим сверху вниз и на одну и ту же группу, мы увидим, как увеличиваются атомные радиусы каждого из составляющих ее элементов.
Конечно, если мы посмотрим сверху вниз и на одну и ту же группу, мы увидим, как увеличиваются атомные радиусы каждого из составляющих ее элементов.
Периоды
Если теперь сосредоточиться на горизонтальные ряды, которые составляют периодическую таблицу, тогда это заставляет нас говорить о периодах. В зависимости от того, к какому периоду принадлежит каждый элемент, он будет указывать количество энергетических уровней атома. Они организованы по уровням и подуровням, но всегда элементы будут организованы в соответствии с их атомными номерами.
- Период 1: В период один у нас есть только два химических элемента. Водород и гелий.
- Период 2: В этом случае атомный номер немного увеличивается, и мы обнаруживаем в общей сложности восемь элементов, среди которых, среди прочих, литий, бор, углерод или азот, как мы видим на изображении.
- Период 3: В этот период находятся натрий, магний, алюминий, кремний, фосфор или сера.

- Период 4: Четвертая строка таблицы Менделеева уже содержит больше элементов. Всего в нем разместится 18 человек. Мы можем упомянуть как калий и кальций, так и железо и цинк.
- Период 5Что ж, как мы уже знаем, это соответствует пятой строке таблицы элементов. Их также всего 18. Здесь мы найдем стронций или палладий.
- Период 6: Еще 18 элементов находятся в так называемом шестом ряду или периоде 6. Некоторые из них – цезий, вольфрам или ртуть.
- Период 7: Наиболее радиоактивные и нестабильные элементы обнаружены в этот период 7. Актиниды также включены.
Блочное деление
Для выполнения разбивки таблицы элементов блока учитывается орбиталь, на которой находится последний электрон.
- Блок s: Блок s соответствует первым двум группам, то есть щелочным и щелочноземельным группам, не забывая при этом гелий и водород.
- Блок p: Соответствует шести последним группам.
 Содержит все металлоиды.
Содержит все металлоиды. - Блок d: Группы с 3 по 12 будут в этом блоке. Можно сказать, что в нем есть переходные металлы.
- Блок f: Он состоит из лантаноидов и актинидов.
Как мы видели, таблица показывает нам и представляет элементы в простой форме. С одной стороны, мы обнаруживаем, что элементы, собственно говоря, представлены символом. В самой распространенной таблице мы можем видеть, как ее сопровождают всего две цифры. Один из них будет относиться к его массовому числу, то есть сумма протонов и нейтронов. С другой стороны, атомный номер (количество протонов), обычно ставится в нижнем индексе слева от элемента. При всем этом таблица – идеальный инструмент для нашего обучения.
Как пользоваться периодической таблицей
Для многих таблица Менделеева – это больше, чем иероглиф. Вот почему все его деления, числа и даже цвета имеют значение.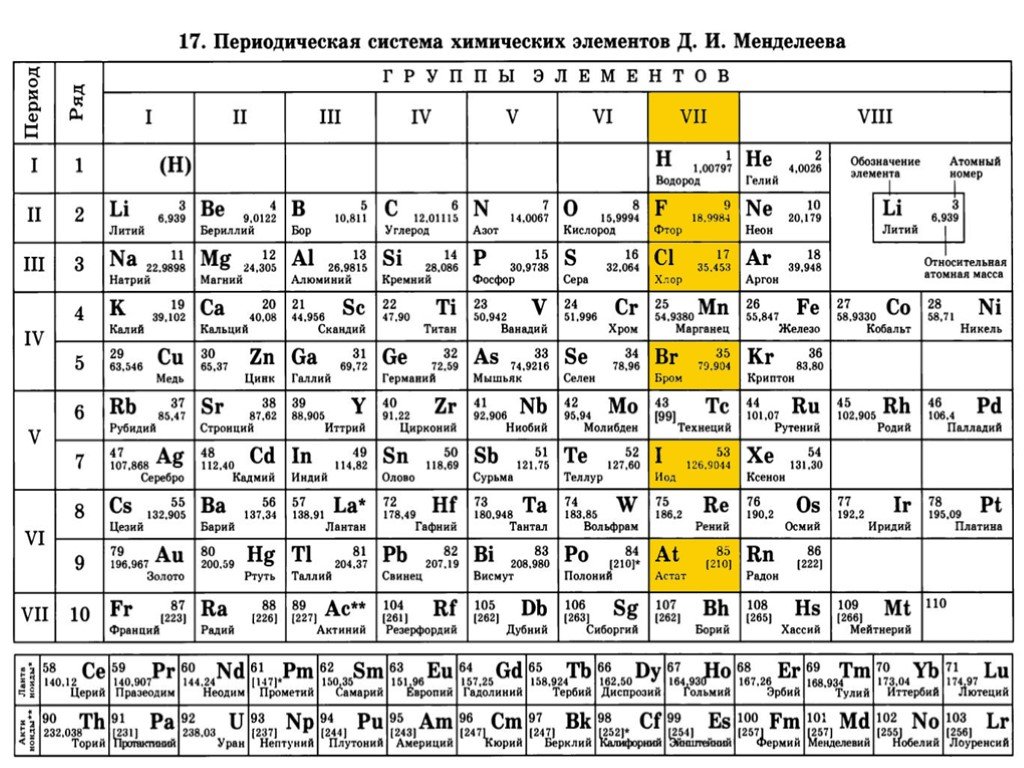 Вы должны знать, что говорит вам каждый из этих разделов:
Вы должны знать, что говорит вам каждый из этих разделов:
- Символы: Символ представление элемента. Он состоит из прописных букв и иногда сопровождается другими строчными буквами, в зависимости от регистра.
- Классификация: Как мы видели ранее, классификация или группы, в которых появляется каждый из элементов, также важны.
- Атомный номер: У каждого атома есть атомный номер. Это равно количество протонов в его ядре. Это число отличает один элемент от другого. Обычно его ставят перед самим элементом. Например, бор (B) имеет номер 5. Это его атомный номер. У него 5 электронов вокруг ядра и 5 протонов в ядре.
- Атомная масса: Это масса атома, выраженная в единицах (а.е.м.).
- Количество протонов: Число протонов любого атома совпадает с его атомным номером.
- Количество нейтронов: Равно атомная масса минус количество протонов.

- Цвет элементов: Указывает на отражение света, когда мы говорим о нормальных условиях.
- Атомный объем: Определяется как объем, занимаемый моль атомов элемента.
Кажется, что когда мы выучили обычную таблицу Менделеева, появляются какие-то новые элементы. В частности, они расположены в седьмом ряду, и вам необходимо знать их четыре. Они названы в честь: Московио, Тенесо, Нихониум и Оганесон. Надо сказать, что элемент Nihonium был открыт некоторыми японскими учеными, а остальные разделены между Россией и США.
Содержание статьи соответствует нашим принципам редакционная этика. Чтобы сообщить об ошибке, нажмите здесь.
Вы можете быть заинтересованы
Периодическая таблица: семейства и периоды
Обновлено: 15.07.2021
Химия: 1001 практические задачи для чайников (+ бесплатная онлайн-практика)
Исследуйте книгу Купить на Amazon
В периодической таблице элементов есть семь горизонтальных рядов элементов.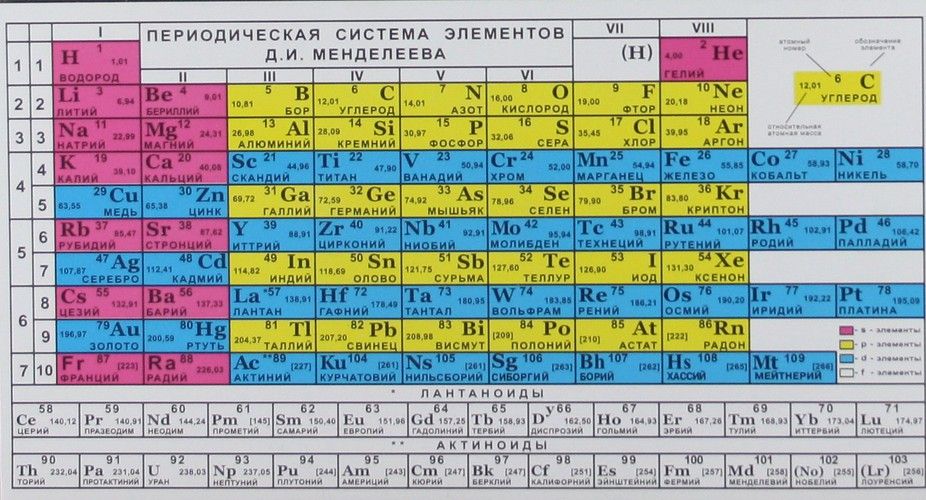 Каждая из этих строк называется периодами . Вертикальные столбцы элементов называются группами или семействами . Наиболее распространенный способ классификации периодической таблицы – металлы, неметаллы и металлоиды.
Каждая из этих строк называется периодами . Вертикальные столбцы элементов называются группами или семействами . Наиболее распространенный способ классификации периодической таблицы – металлы, неметаллы и металлоиды.Периоды в периодической таблице
В каждом периоде (горизонтальный ряд) атомные номера увеличиваются слева направо. Периоды пронумерованы от 1 до 7 в левой части таблицы.Элементы, находящиеся в одном периоде, имеют не такие уж и похожие химические свойства. Рассмотрим первых двух членов периода 3: натрий (Na) и магний (Mg). В реакциях и те, и другие имеют свойство терять электроны (ведь они металлы), но натрий теряет один электрон, а магний — два. Хлор (Cl), ближе к концу периода, имеет тенденцию приобретать электрон (это неметалл).
Семейства в периодической таблице
Как и человеческие семьи, члены семей (вертикальные столбцы) в периодической таблице имеют сходство или сходные свойства. Семейства помечаются в верхней части столбцов одним из двух способов: Так почему же элементы одного семейства имеют схожие свойства? Вы можете изучить четыре семейства в периодической таблице и посмотреть на электронные конфигурации нескольких элементов в каждом семействе.
На рисунке ниже перечислены некоторые важные семейства, которым даны специальные имена:
Семейство IA состоит из щелочных металлов . В реакциях все эти элементы имеют тенденцию терять один электрон. Это семейство содержит некоторые важные элементы, такие как натрий (Na) и калий (K). Оба эти элемента играют важную роль в химии тела и обычно встречаются в солях.
Семейство IIA состоит из щелочноземельных металлов . Все эти элементы имеют тенденцию терять два электрона. Кальций (Ca) является важным членом семейства IIA (кальций необходим для здоровых зубов и костей).
Семейство VIIA состоит из галогенов . Все они имеют тенденцию к получению одного электрона в реакциях. Важными членами этого семейства являются хлор (Cl), используемый при производстве поваренной соли и отбеливателя, и йод (I).
Семейство VIIIA состоит из инертных газов .
 Эти элементы очень неактивны. Долгое время благородные газы называли инертными газами, потому что считалось, что эти элементы вообще не вступают в реакцию.
Эти элементы очень неактивны. Долгое время благородные газы называли инертными газами, потому что считалось, что эти элементы вообще не вступают в реакцию.Ученый по имени Нил Бартлетт показал, что по крайней мере некоторые инертные газы могут вступать в реакцию, но для этого требуются особые условия. После открытия Бартлетта эти газы стали называть благородными.
Валентные электроны и их семейства
Конфигурация электронов показывает количество электронов на каждой орбитали в конкретном атоме. Эти электронные конфигурации показывают, что между каждой группой элементов есть некоторое сходство с точки зрения их валентных электронов. Имейте в виду, что касается количества валентных электронов и номера столбца с римскими цифрами: семейство IA имеет 1 валентный электрон; семейство IIA имеет 2 валентных электрона; семейство VIIA имеет 7 валентных электронов; а семейство VIIIA имеет 8 валентных электронов. Таким образом, для семейств, обозначенных римской цифрой и буквой А, римская цифра указывает количество валентных электронов.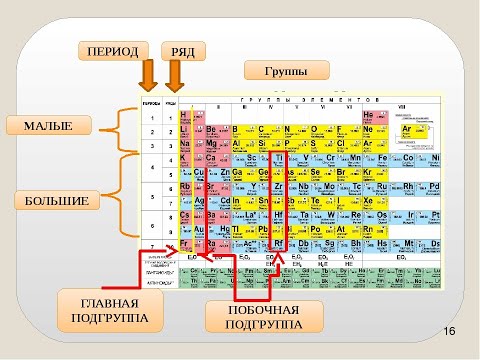
Об этой статье
Эту статью можно найти в категории:
- Химия ,
Современная периодическая таблица: периоды и группы | Химия для неспециалистов |
Цели обучения
- Описать организацию современной таблицы Менделеева.
Как менялся словарь английского языка с течением времени?
Язык меняется со временем. Новые слова входят в язык, а старые слова часто исчезают из-за неиспользования. Словари издаются, чтобы люди могли быть в курсе изменений в языке и знать, как правильно использовать слова.
Эти публикации могут быть в печатном или электронном виде. Словари можно найти в Интернете, а приложения доступны для смартфонов. Словари бесценны для хорошего, надежного общения.
Периодическая таблица претерпела значительные изменения с тех пор, как она была первоначально разработана Менделеевым и Мозли. Было открыто много новых элементов, а другие были искусственно синтезированы. Каждый правильно вписывается в группу элементов со схожими свойствами. Периодическая таблица представляет собой расположение элементов в порядке их атомных номеров, так что элементы со схожими свойствами появляются в одном и том же вертикальном столбце или группе.
На рисунке ниже показана наиболее часто используемая форма таблицы Менделеева. Каждый квадрат показывает химический символ элемента вместе с его названием. Обратите внимание, что некоторые из символов кажутся не связанными с названием элемента: Fe для железа, Pb для свинца и т.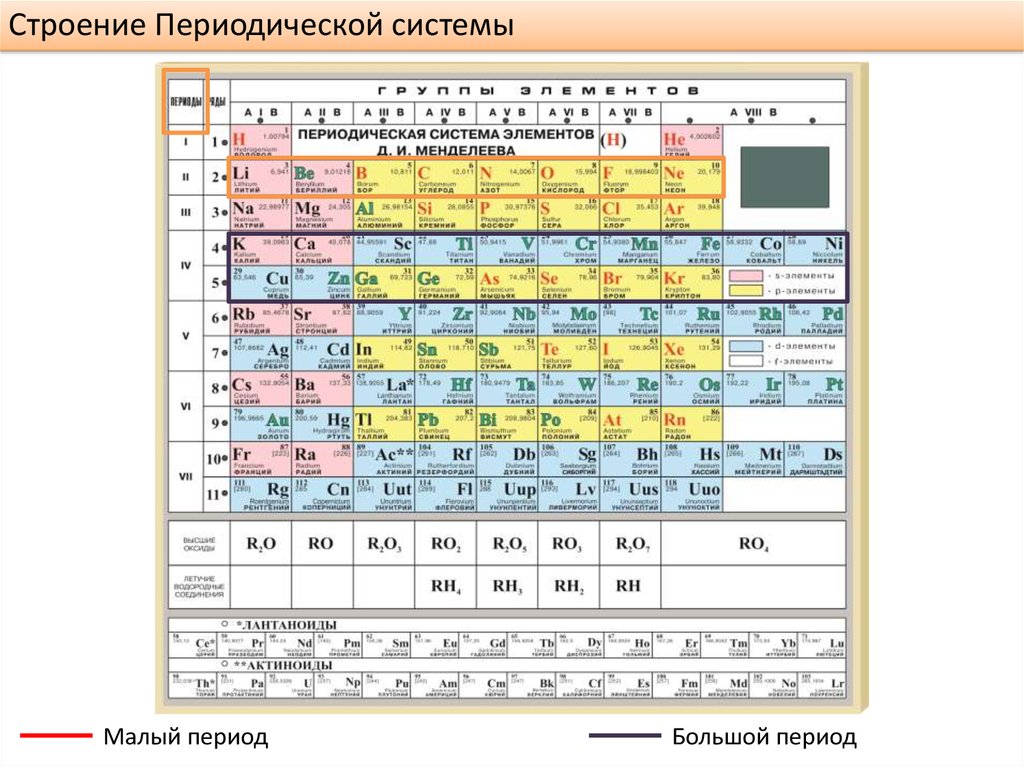 д. Большинство из этих элементов известны с древних времен и имеют символы, основанные на их латинских названиях. Атомный номер каждого элемента написан над символом.
д. Большинство из этих элементов известны с древних времен и имеют символы, основанные на их латинских названиях. Атомный номер каждого элемента написан над символом.
Период — это горизонтальная строка периодической таблицы. В периодической таблице семь периодов, каждый из которых начинается в крайнем левом углу. Новый период начинается, когда новый главный энергетический уровень начинает заполняться электронами. В периоде 1 всего два элемента (водород и гелий), а в периодах 2 и 3 — 8 элементов. Периоды 4 и 5 имеют 18 элементов. Периоды 6 и 7 содержат 32 элемента, поскольку этим периодам принадлежат две нижние строки, отделенные от остальной части таблицы. Они выдвигаются, чтобы сама таблица легче помещалась на одной странице.
Группа — это вертикальный столбец периодической таблицы, основанный на организации электронов внешней оболочки. Всего 18 групп. Существуют две различные системы нумерации, которые обычно используются для обозначения групп, и вы должны быть знакомы с обеими.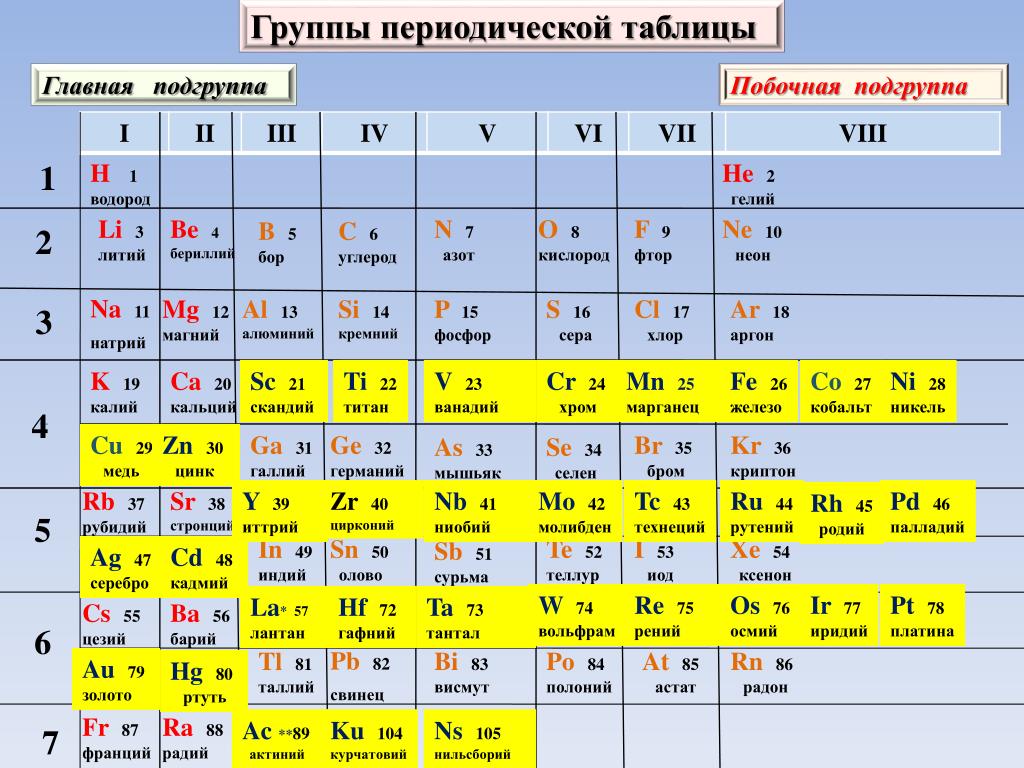 Традиционная система, используемая в Соединенных Штатах, включает использование букв A и B. Первые две группы – это 1A и 2A, а последние шесть – от 3A до 8A. Средние группы используют B в своих названиях. К сожалению, в Европе действовала несколько иная система. Чтобы устранить путаницу, Международный союз теоретической и прикладной химии (IUPAC) решил, что официальная система нумерации групп будет простой от 1 до 18 слева направо. Многие периодические таблицы показывают обе системы одновременно.
Традиционная система, используемая в Соединенных Штатах, включает использование букв A и B. Первые две группы – это 1A и 2A, а последние шесть – от 3A до 8A. Средние группы используют B в своих названиях. К сожалению, в Европе действовала несколько иная система. Чтобы устранить путаницу, Международный союз теоретической и прикладной химии (IUPAC) решил, что официальная система нумерации групп будет простой от 1 до 18 слева направо. Многие периодические таблицы показывают обе системы одновременно.
Резюме
- Периодическая таблица упорядочена по атомному номеру
- Период — это горизонтальная строка периодической таблицы.
- Группа — это вертикальная строка периодической таблицы.
Практика
Воспользуйтесь приведенной ниже ссылкой, чтобы ответить на следующие вопросы:
http://pontotriplo.org/triplepoint/2007/05/the_best_55_online_periodic_tables. html
html
- Выберите периодическую таблицу из столбца «лучших», которая вам больше всего нравится. Почему вы выбрали этот стол?
- Какая таблица Менделеева в разделе «Конкретные» вам нравится больше всего? Почему?
- Какая из «забавных» периодических таблиц вам нравится больше всего? Почему?
Обзор
- Чем современная таблица Менделеева отличается от той, которую опубликовал Менделеев?
- Все ли элементы современной таблицы Менделеева встречаются в природе? Поясните свой ответ.
- Что такое период? Что это означает?
- Что такое «группа»? Что это означает?
- Почему существуют две разные системы нумерации групп?
Глоссарий
- группа: Элементы с похожими химическими свойствами появляются через равные промежутки времени в вертикальных столбцах.
- период: Период — это горизонтальная строка периодической таблицы.
Показать ссылки
ссылки
- Калеб Рёнигк (Flickr:crdotx).







 Содержит все металлоиды.
Содержит все металлоиды.
 Эти элементы очень неактивны. Долгое время благородные газы называли инертными газами, потому что считалось, что эти элементы вообще не вступают в реакцию.
Эти элементы очень неактивны. Долгое время благородные газы называли инертными газами, потому что считалось, что эти элементы вообще не вступают в реакцию.