предшественники, последователи, а также сны и иные мистические события
На состоявшемся недавно торжественном открытии Года Периодической таблицы элементов Президент Российской академии наук Александр Сергеев отметил: «Несмотря на то, что в мире Периодическую таблицу не принято называть по имени российского ученого, в речи генерального секретаря ЮНЕСКО было четко сказано, что это – таблица Менделеева». Для присутствовавшего на торжестве премьер-министра РФ Дмитрия Медведева информация о замалчивании за рубежом имени Менделеева как создателя Периодической таблицы оказалась неожиданной. «Мне и в голову не приходило, что в мире Периодическая система не носит имени Менделеева», – сказал премьер и предложил решить этот вопрос: «У нас не слишком много таких достижений и обязательно нужно постараться это все зафиксировать».
А все-таки, почему на Западе некоторые ученые (а также журналисты и политики, разумеется!) не связывают с именем Менделеева Периодическую таблицу и отчего даже в знаменательный год ее 150-летия то и дело всплывают другие даты открытия основополагающего химического закона?
Первооткрыватели или предшественники?
Во многих странах Европы, в Соединенных Штатах Америки и в Канаде систему Менделеева чаще всего называют просто «Периодическая таблица», а ее автора и вовсе не упоминают.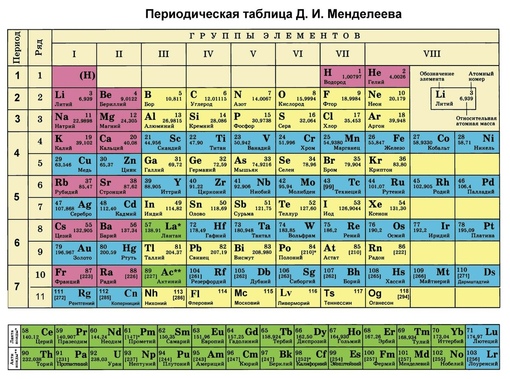 В этих государствах официально не признают тот факт, что данное открытие первым сделал именно русский ученый. Одни уверены в том, что до Менделеева это совершали и другие химики. Вторые утверждают, что русский ученый создал свою систему на основе предыдущих изысканий зарубежных исследователей.
В этих государствах официально не признают тот факт, что данное открытие первым сделал именно русский ученый. Одни уверены в том, что до Менделеева это совершали и другие химики. Вторые утверждают, что русский ученый создал свою систему на основе предыдущих изысканий зарубежных исследователей.
В 1668 г. выдающимся ирландским химиком, физиком и богословом Робертом Бойлем была опубликована книга, в которой было развенчано немало мифов об алхимии и в которой он рассуждал о необходимости поиска неразложимых химических элементов. Ученый также привел их список, состоящий всего из 15 элементов, но допускал мысль о том, что могут быть еще элементы. Это стало отправной точкой не только в поиске новых элементов, но и в их систематизации.
Сто лет спустя французским химиком Антуаном Лавуазье был составлен новый перечень, в который входили уже 35 элементов.
В начале 1864 г. ассистент химика в Королевском сельскохозяйственном обществе Джон Александр Ньюлендс прочел анонимную статью, автор которой утверждал, что атомные веса большинства элементов с большей или меньшей точностью кратны восьми. Мнение анонимного автора было ошибочным, однако Ньюлендс решил продолжить исследования в этой области, составил таблицу, в которой расположил все известные элементы в порядке увеличения их атомных весов. В статье, датированной 20 августа 1864 г., он отметил, что в этом ряду наблюдается периодическое появление химически сходных элементов. Пронумеровав элементы (элементы, имеющие одинаковые веса, имели и один и тот же номер) и сопоставив номера со свойствами элементов, Ньюлендс сделал вывод: «Разность в номерах наименьшего члена группы и следующего за ним равна семи; иначе говоря, восьмой элемент, начиная с данного элемента, является своего рода повторением первого, подобно восьмой ноте октавы в музыке…».
Спустя год, 18 августа 1865 г., Ньюлендс опубликовал новую таблицу элементов, назвав ее «законом октав», который формулировался следующим образом: «Номера аналогичных элементов, как правило, отличаются или на целое число семь, или на кратное семи; другими словами, члены одной и той же группы соотносятся друг с другом в том же отношении, как и крайние точки одной или больше октав в музыке». Публикации Ньюлендса, подобно другим (довольно многочисленным) попыткам нахождения всякого рода закономерностей среди атомных весов элементов, не привлекли особого внимания. 1 марта 1866 г. Ньюлендс сделал доклад «Закон октав и причины химических соотношений среди атомных весов» на заседании Лондонского химического общества, который не вызвал особого интереса. История сохранила лишь ехидное замечание известного химика Джорджа Фостера: не пробовал ли докладчик располагать элементы в порядке начальных букв их названий и не обнаружил ли при этом каких-либо закономерностей? Доклад так и не был напечатан в журнале химического общества.
В 1850–1860-х годах другой английский химик, Уильям Одлинг, предпринял несколько попыток систематизировать химические элементы, основываясь на их атомном весе и атомности (валентности). Он составил несколько таблиц элементов. В таблице, предложенной им в 1864 г. (не сопровождавшейся, однако, никакими комментариями), видны, по словам Д.И. Менделеева, «начатки периодического закона».
«Земная спираль» (vis tellurique) Александра Шанкуртуа
Французы пытаются отдать пальму первенства своему земляку Александру Эмилю Бегуйе де Шанкуртуа. Еще в 1862 г. этот геолог и химик вывел свою систематизацию химических элементов, основанную на закономерном изменении атомных масс – так называемую «земную спираль» (vis tellurique), или «цилиндр Бегуйе». Шанкуртуа нанес на боковую поверхность цилиндра, размеченную на 16 частей, линию под углом 45°, на которой поместил точки, соответствующие атомным массам элементов.
Систематизация Шанкуртуа явилась существенным шагом вперед по сравнению с существовавшими тогда системами, однако его работа поначалу осталась практически незамеченной. Только после открытия Д.И. Менделеевым Периодического закона французы обратили внимание на работы своего земляка.
В 1864 г. ученый из Германии, Юлиус Лотар Мейер, обнародовал таблицу, содержавшую 28 элементов, размещенные в шесть столбцов согласно их валентностям. Мейер намеренно ограничил число элементов в таблице, чтобы подчеркнуть закономерное изменение атомной массы в рядах сходных элементов. В 1870 г. Мейер опубликовал еще одну работу, где были новая таблица и график зависимости атомного объема элемента от атомного веса. Предложенная Мейером в работе «Природа элементов как функция их атомного веса» таблица состояла из девяти вертикальных столбцов, сходные элементы располагались в горизонтальных рядах; некоторые ячейки таблицы Мейер оставил незаполненными.
Интересно, что в 1882 г. и Менделеев, и Мейер получили по Золотой медали «За открытие периодических соотношений атомных весов». Хотя Менделеев утверждал, что немецкий исследователь «не имел в виду периодического закона» и вообще ничего нового в него не привнес.
Таблица, устремленная в будущее
Поиск новых элементов вели ученые по всему миру. К XIX в. наука обогатилась множеством новых знаний о химических элементах, которых к тому времени было открыто больше 60-ти. Именно поэтому и возникла потребность в систематизации этих элементов. Фундаментальный Периодический закон и начальную версию своей периодической системы Менделеев создал еще в 1869 г. Однако ученые умы России, да и всего мира, отнеслись к его открытию с некоторым скепсисом. И кто знает, как все бы обернулось, если бы уже через несколько лет Менделеевские открытия не получили подтверждения.
Гениальность Менделеева заключаестя в том, что он НЕ включил в свою таблицу. Он понимал, что некоторых элементов не хватает, но они будут открыты. Поэтому там, где Далтон, Ньюлендс и другие включили в таблицы то, что было известно, Менделеев оставил место для неизвестного. Еще более удивительно, что он точно предсказал свойства недостающих элементов.
Поэтому там, где Далтон, Ньюлендс и другие включили в таблицы то, что было известно, Менделеев оставил место для неизвестного. Еще более удивительно, что он точно предсказал свойства недостающих элементов.
В первоначальной таблице Менделеева рядом с символом Al (алюминий) есть пустая клетка для неизвестного металла. Менделеев предсказал, что у него будет атомная масса 68, плотность 6 г/см
Легенда о сне Менделеева
Многие слышали историю, что Д.И. Менделееву его таблица приснилась. Эта версия активно распространялась соратником Менделеева А.
 И во сне мне совершенно явственно представилась таблица. Я тут же проснулся и набросал увиденную во сне таблицу на первом же подвернувшемся под руку клочке бумаги».
И во сне мне совершенно явственно представилась таблица. Я тут же проснулся и набросал увиденную во сне таблицу на первом же подвернувшемся под руку клочке бумаги».Однако ни один серьезный исследователь научного творчества Менделеева не утверждал и не доказывал, что ученому во сне привиделась периодическая система химических элементов. Да и Дмитрий Иванович на самом деле никогда этого не утверждал. Более того, сам ученый опровергал историю со сном, говоря: «Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово». Так что легенда о сне может быть и очень привлекательна, но создание таблицы стало возможным только благодаря упорному труду.
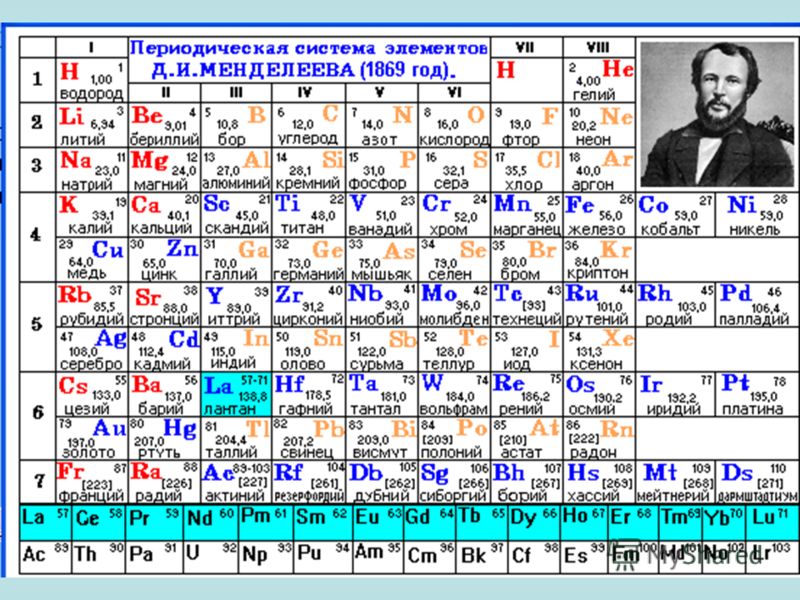
Периодическая система химических элементов (таблица Менделеева)
https://ria.ru/20190129/1550014194.html
Периодическая система химических элементов (таблица Менделеева)
Периодическая система химических элементов (таблица Менделеева)
Периодическая система химических элементов – упорядоченное множество химических элементов и их естественная классификация. РИА Новости, 29.01.2019
РИА Новости, 29.01.2019
2019-01-29T04:51
2019-01-29T04:51
2019-01-29T04:51
справки
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdn23.img.ria.ru/images/99408/72/994087230_0:105:2000:1230_1920x0_80_0_0_b528d261d40438ab5524fc6ad7f580a3.jpg
Периодическая система химических элементов – упорядоченное множество химических элементов и их естественная классификация. Является табличным представлением периодического закона, открытого Дмитрием Менделеевым. Современная формулировка этого закона звучит так: свойства элементов находятся в периодической зависимости от заряда их атомных ядер.Прообразом Периодической системы химических элементов служит таблица “Опыт системы элементов, основанной на их атомном весе и химическом сходств”, составленная Менделеевым в 1869 году. По мере совершенствования этой таблицы он развил представления о периодах и группах элементов и о месте каждого элемента в системе. В 1871 году в книге “Основы химии” Менделеевым была включена “Естественная система элементов Д. Менделеева” – первая классическая короткая форма Периодической системы химических элементов. Современная Периодическая система химических элементов включает 118 элементов. За последние 50 лет таблица Менделеева пополнилась семнадцатью новыми элементами (102-118). Девять из них были впервые получены в российском Объединенном институте ядерных исследований в Дубне. Последнее добавление в таблицу Менделеева было сделано в 2016 году, она пополнилась четырьмя элементами с 113, 115, 117 и 118 атомными номерами, которые соответственно были названы нихоний (Nh), московий (Mc), теннессин (Ts) и оганесон (Og). Сейчас в крупнейших ядерно-физических центрах мира фактически начаты работы по синтезу 119-го, 120-го и 121-го элементов, которые назвали “большой гонкой”.Опубликовано свыше 500 вариантов Периодической системы химических элементов, что связано с попытками поиска решения некоторых частных проблем ее структуры.
В 1871 году в книге “Основы химии” Менделеевым была включена “Естественная система элементов Д. Менделеева” – первая классическая короткая форма Периодической системы химических элементов. Современная Периодическая система химических элементов включает 118 элементов. За последние 50 лет таблица Менделеева пополнилась семнадцатью новыми элементами (102-118). Девять из них были впервые получены в российском Объединенном институте ядерных исследований в Дубне. Последнее добавление в таблицу Менделеева было сделано в 2016 году, она пополнилась четырьмя элементами с 113, 115, 117 и 118 атомными номерами, которые соответственно были названы нихоний (Nh), московий (Mc), теннессин (Ts) и оганесон (Og). Сейчас в крупнейших ядерно-физических центрах мира фактически начаты работы по синтезу 119-го, 120-го и 121-го элементов, которые назвали “большой гонкой”.Опубликовано свыше 500 вариантов Периодической системы химических элементов, что связано с попытками поиска решения некоторых частных проблем ее структуры. Наиболее распространены две табличные формы: короткая и длинная (разрабатывалась Дмитрием Менделеевым, усовершенствована в 1905 году Альфредом Вернером). Современная форма Периодической системы химических элементов (в 1989 году Международным союзом теоретической и прикладной химии рекомендована длинная форма таблицы) состоит из семи периодов (горизонтальных последовательностей элементов, расположенных по возрастанию порядкового номера) и 18 групп (вертикальных последовательностей элементов в соответствии с количеством валентных электронов), а короткая форма таблицы – из восьми групп.Номер группы элементов короткого варианта таблицы Менделеева соответствует числу валентных электронов во внешней электронной оболочке атомов. В длинном варианте таблицы номер группы в большей мере формален. Группы короткого варианта включают главную (а) и побочную (б) подгруппы, в каждой из которых содержатся элементы, сходные по химическим свойствам. Элементы некоторых групп имеют собственные тривиальные названия: щелочные металлы (группа 1 длинной формы таблицы), щелочноземельные металлы (группа 2), халькогены (группа 16), галогены (группа 17), благородные газы (группа 18).
Наиболее распространены две табличные формы: короткая и длинная (разрабатывалась Дмитрием Менделеевым, усовершенствована в 1905 году Альфредом Вернером). Современная форма Периодической системы химических элементов (в 1989 году Международным союзом теоретической и прикладной химии рекомендована длинная форма таблицы) состоит из семи периодов (горизонтальных последовательностей элементов, расположенных по возрастанию порядкового номера) и 18 групп (вертикальных последовательностей элементов в соответствии с количеством валентных электронов), а короткая форма таблицы – из восьми групп.Номер группы элементов короткого варианта таблицы Менделеева соответствует числу валентных электронов во внешней электронной оболочке атомов. В длинном варианте таблицы номер группы в большей мере формален. Группы короткого варианта включают главную (а) и побочную (б) подгруппы, в каждой из которых содержатся элементы, сходные по химическим свойствам. Элементы некоторых групп имеют собственные тривиальные названия: щелочные металлы (группа 1 длинной формы таблицы), щелочноземельные металлы (группа 2), халькогены (группа 16), галогены (группа 17), благородные газы (группа 18). В Периодической системе химических элементов для каждого элемента указывается его символ, название, порядковый номер и значение относительной атомной массы.Первый период содержит два элемента – водород и гелий. Второй и третий периоды (литий – неон; натрий – аргон) содержат по восемь элементов. Четвертый (калий – криптон) и пятый (рубидий – ксенон) периоды содержат по 18 элементов. Шестой период (цезий – радон) содержит 32 элемента и включает особую группу элементов – лантаноиды.Седьмой период (франций – оганесон), подобно шестому, содержит 32 элемента и включает особую группу элементов – актиноиды. Лантаноиды и актиноиды помещены отдельно внизу таблицы.Периодическая система химических элементов сыграла и продолжает играть огромную роль в развитии многих естественнонаучных дисциплин. Она стала важным звеном в эволюции атомно-молекулярного учения, способствовала формулировке современного понятия “химический элемент” и уточнению представлений о простых веществах и соединениях, оказала значительное влияние на разработку теории строения атомов и возникновение понятия изотопии.
В Периодической системе химических элементов для каждого элемента указывается его символ, название, порядковый номер и значение относительной атомной массы.Первый период содержит два элемента – водород и гелий. Второй и третий периоды (литий – неон; натрий – аргон) содержат по восемь элементов. Четвертый (калий – криптон) и пятый (рубидий – ксенон) периоды содержат по 18 элементов. Шестой период (цезий – радон) содержит 32 элемента и включает особую группу элементов – лантаноиды.Седьмой период (франций – оганесон), подобно шестому, содержит 32 элемента и включает особую группу элементов – актиноиды. Лантаноиды и актиноиды помещены отдельно внизу таблицы.Периодическая система химических элементов сыграла и продолжает играть огромную роль в развитии многих естественнонаучных дисциплин. Она стала важным звеном в эволюции атомно-молекулярного учения, способствовала формулировке современного понятия “химический элемент” и уточнению представлений о простых веществах и соединениях, оказала значительное влияние на разработку теории строения атомов и возникновение понятия изотопии. С периодической системой связана строго научная постановка проблемы прогнозирования в химии, что проявилось как в предсказании существования неизвестных элементов и их свойств, так и новых особенностей химического поведения уже открытых элементов. Периодическая система – важнейшая основа неорганической химии; она служит, например, задачам синтеза веществ с заранее заданными свойствами, созданию новых материалов, подбору специфических катализаторов для различных химических процессов. Периодическая система – научная база преподавания общей и неорганической химии, а также некоторых разделов атомной физики.По решению ООН 2019 год провозглашен Международным годом Периодической таблицы химических элементов.Материал подготовлен на основе информации РИА Новости и открытых источников
С периодической системой связана строго научная постановка проблемы прогнозирования в химии, что проявилось как в предсказании существования неизвестных элементов и их свойств, так и новых особенностей химического поведения уже открытых элементов. Периодическая система – важнейшая основа неорганической химии; она служит, например, задачам синтеза веществ с заранее заданными свойствами, созданию новых материалов, подбору специфических катализаторов для различных химических процессов. Периодическая система – научная база преподавания общей и неорганической химии, а также некоторых разделов атомной физики.По решению ООН 2019 год провозглашен Международным годом Периодической таблицы химических элементов.Материал подготовлен на основе информации РИА Новости и открытых источников
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2019
РИА Новости
internet-group@rian. ru
ru
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
https://cdn23.img.ria.ru/images/99408/72/994087230_112:0:1889:1333_1920x0_80_0_0_597a34ca28aa89475eedcbd63e1a68a3.jpgРИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
справки
Периодическая система химических элементов – упорядоченное множество химических элементов и их естественная классификация.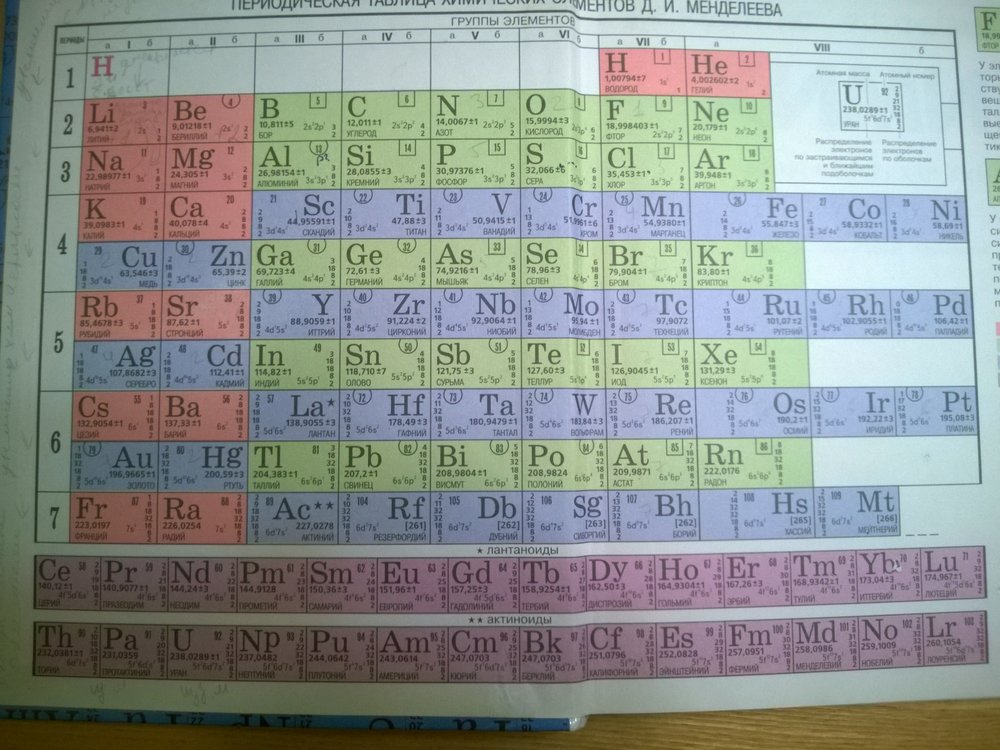
Современная Периодическая система химических элементов включает 118 элементов. За последние 50 лет таблица Менделеева пополнилась семнадцатью новыми элементами (102-118). Девять из них были впервые получены в российском Объединенном институте ядерных исследований в Дубне.
 Последнее добавление в таблицу Менделеева было сделано в 2016 году, она пополнилась четырьмя элементами с 113, 115, 117 и 118 атомными номерами, которые соответственно были названы нихоний (Nh), московий (Mc), теннессин (Ts) и оганесон (Og). Сейчас в крупнейших ядерно-физических центрах мира фактически начаты работы по синтезу 119-го, 120-го и 121-го элементов, которые назвали “большой гонкой”.Опубликовано свыше 500 вариантов Периодической системы химических элементов, что связано с попытками поиска решения некоторых частных проблем ее структуры. Наиболее распространены две табличные формы: короткая и длинная (разрабатывалась Дмитрием Менделеевым, усовершенствована в 1905 году Альфредом Вернером).
Последнее добавление в таблицу Менделеева было сделано в 2016 году, она пополнилась четырьмя элементами с 113, 115, 117 и 118 атомными номерами, которые соответственно были названы нихоний (Nh), московий (Mc), теннессин (Ts) и оганесон (Og). Сейчас в крупнейших ядерно-физических центрах мира фактически начаты работы по синтезу 119-го, 120-го и 121-го элементов, которые назвали “большой гонкой”.Опубликовано свыше 500 вариантов Периодической системы химических элементов, что связано с попытками поиска решения некоторых частных проблем ее структуры. Наиболее распространены две табличные формы: короткая и длинная (разрабатывалась Дмитрием Менделеевым, усовершенствована в 1905 году Альфредом Вернером).Современная форма Периодической системы химических элементов (в 1989 году Международным союзом теоретической и прикладной химии рекомендована длинная форма таблицы) состоит из семи периодов (горизонтальных последовательностей элементов, расположенных по возрастанию порядкового номера) и 18 групп (вертикальных последовательностей элементов в соответствии с количеством валентных электронов), а короткая форма таблицы – из восьми групп.
Номер группы элементов короткого варианта таблицы Менделеева соответствует числу валентных электронов во внешней электронной оболочке атомов. В длинном варианте таблицы номер группы в большей мере формален. Группы короткого варианта включают главную (а) и побочную (б) подгруппы, в каждой из которых содержатся элементы, сходные по химическим свойствам. Элементы некоторых групп имеют собственные тривиальные названия: щелочные металлы (группа 1 длинной формы таблицы), щелочноземельные металлы (группа 2), халькогены (группа 16), галогены (группа 17), благородные газы (группа 18).
В Периодической системе химических элементов для каждого элемента указывается его символ, название, порядковый номер и значение относительной атомной массы.
Первый период содержит два элемента – водород и гелий.
Второй и третий периоды (литий – неон; натрий – аргон) содержат по восемь элементов.
Четвертый (калий – криптон) и пятый (рубидий – ксенон) периоды содержат по 18 элементов.
Шестой период (цезий – радон) содержит 32 элемента и включает особую группу элементов – лантаноиды.
Седьмой период (франций – оганесон), подобно шестому, содержит 32 элемента и включает особую группу элементов – актиноиды.
Лантаноиды и актиноиды помещены отдельно внизу таблицы.
Периодическая система химических элементов сыграла и продолжает играть огромную роль в развитии многих естественнонаучных дисциплин. Она стала важным звеном в эволюции атомно-молекулярного учения, способствовала формулировке современного понятия “химический элемент” и уточнению представлений о простых веществах и соединениях, оказала значительное влияние на разработку теории строения атомов и возникновение понятия изотопии. С периодической системой связана строго научная постановка проблемы прогнозирования в химии, что проявилось как в предсказании существования неизвестных элементов и их свойств, так и новых особенностей химического поведения уже открытых элементов. Периодическая система – важнейшая основа неорганической химии; она служит, например, задачам синтеза веществ с заранее заданными свойствами, созданию новых материалов, подбору специфических катализаторов для различных химических процессов.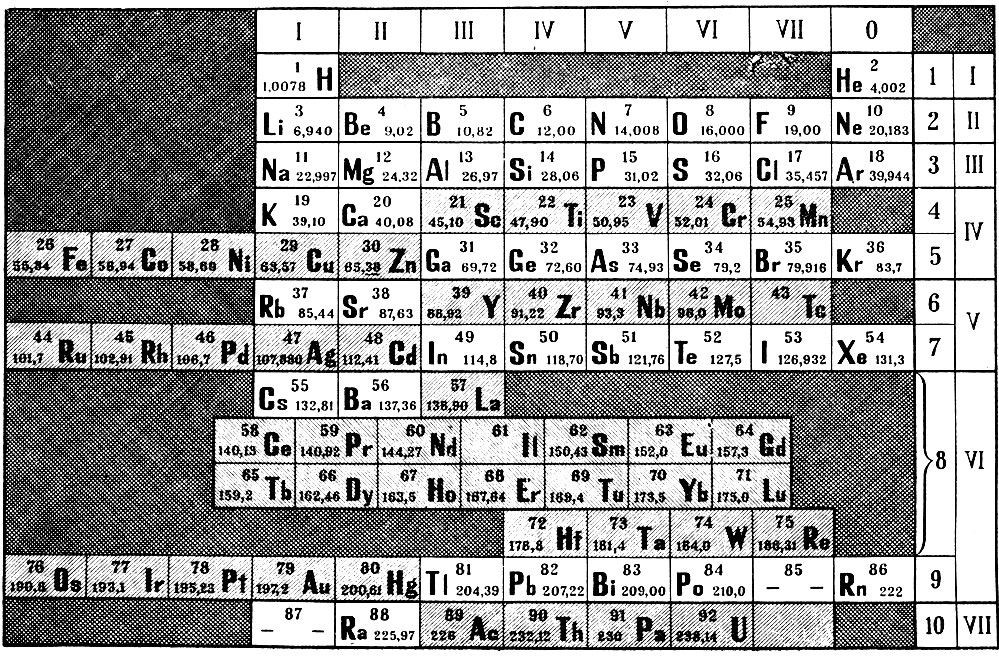 Периодическая система – научная база преподавания общей и неорганической химии, а также некоторых разделов атомной физики.По решению ООН 2019 год провозглашен Международным годом Периодической таблицы химических элементов.
Периодическая система – научная база преподавания общей и неорганической химии, а также некоторых разделов атомной физики.По решению ООН 2019 год провозглашен Международным годом Периодической таблицы химических элементов.Материал подготовлен на основе информации РИА Новости и открытых источников
Как создавалась периодическая таблица элементов Менделеева
У каждой области науки есть свой любимый юбилей. У физиков это «Принципы» Ньютона, книга 1687 года, которая ввела законы движения и гравитации. Биологи празднуют дарвиновское «Происхождение видов» (1859 год) и его день рождения (1809). Астрономы отмечают 1543 год, ведь именно тогда Коперник поместил Солнце в центр Солнечной системы. Что касается химии, ни одна причина для празднования не превзойдет появление периодической таблицы элементов, созданной 150 лет назад в марте русским химиком Дмитрием Ивановичем Менделеевым.
Дмитрий Иванович Менделеев.
Таблица Менделеева стала такой же привычной для студентов-химиков, как калькуляторы для бухгалтеров.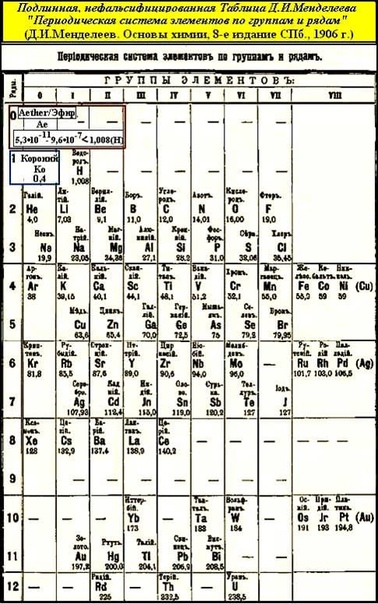 Она содержит всю науку в чуть более сотне квадратов, содержащих символы и цифры. Она перечисляет элементы, которые составляют все земные вещества, сгруппированные таким образом, чтобы можно было выявить закономерности в их свойствах, определить цель химического исследования как в теории, так и на практике.
Она содержит всю науку в чуть более сотне квадратов, содержащих символы и цифры. Она перечисляет элементы, которые составляют все земные вещества, сгруппированные таким образом, чтобы можно было выявить закономерности в их свойствах, определить цель химического исследования как в теории, так и на практике.
Периодическая таблица — это, бесспорно, самая важная концепция в химии.
Таблица Менделеева выглядела как специальная таблица, однако сам он хотел, чтобы она отражала глубокую научную истину, которую он открыл: периодический закон. Его закон выявил глубокие семейные отношения между известными химическими элементами – они проявляют подобные свойства через регулярные промежутки (или периоды), если расположить их в порядке атомного веса – и позволил Менделееву предсказать существование элементов, которые еще не были обнаружены.
«До обнародования этого закона химические элементы были просто фрагментарными, случайными фактами в Природе», заявил Менделеев.
«Закон периодичности впервые позволил нам увидеть неоткрытые элементы на расстоянии, которое раньше было недоступно для химического зрения».
Опыт системы элементов Д. Менделеева.
Таблица Менделеева не только предсказала существование новых элементов. Она подтвердила тогда еще спорную веру в реальность атомов. Она намекнула на существование субатомной структуры и предвидела математический аппарат, лежащий в основе правил, управляющих материей, которые в конечном счете проявили себя в квантовой теории. Его таблица завершила превращение химической науки из средневекового магического мистицизма алхимии в область современной научной строгости. Периодическая таблица символизирует не столько составляющие вещества, сколько логическую стройность и принципиальную рациональность науки в целом.
Как создавалась периодическая таблица
Легенда гласит, что Менделеев задумал и создал свою таблицу в один день: 17 февраля 1869 года по русскому календарю (для большей части мира это 1 марта). Но это, вероятнее всего, преувеличение. Менделеев думал о группировании элементов годами, и другие химики несколько раз рассматривали понятие связей между элементами в предыдущие десятилетия.
Но это, вероятнее всего, преувеличение. Менделеев думал о группировании элементов годами, и другие химики несколько раз рассматривали понятие связей между элементами в предыдущие десятилетия.
Интересные элементы можно найти и в космосе. Астронафты это доказали.
На самом деле, немецкий физик Иоганн Вольфганг Доберейнер заметил особенности группирования элементов еще в 1817 году. В те дни химики еще не полностью поняли природу атомов, описанную атомной теорией Джона Дальтона в 1808 году. В своей «новой системе химической философии» Дальтон объяснил химические реакции, предполагая, что каждое элементарное вещество состоит из атома определенного типа.
Дальтон предположил, что химические реакции производили новые вещества, когда атомы разъединяются или соединяются. Он полагал, что любой элемент состоит исключительно из одного вида атома, который отличается от других по весу. Атомы кислорода весили в восемь раз больше, чем атомы водорода. Дальтон считал, что атомы углерода в шесть раз тяжелее водорода. Когда элементы объединяются для создания новых веществ, количество реагирующих веществ может быть рассчитано с учетом этих атомных весов.
Когда элементы объединяются для создания новых веществ, количество реагирующих веществ может быть рассчитано с учетом этих атомных весов.
Дальтон ошибался насчет некоторых масс – кислород в действительности в 16 раз тяжелее водорода, а углерод в 12 раз тяжелее водорода. Но его теория сделала идею об атомах полезной, вдохновив революцию в химии. Точное измерение атомной массы стало основной проблемой химиков на последующие десятилетия.
Размышляя об этих весах, Доберейнер отметил, что определенные наборы из трех элементов (он назвал их триадами) показывают интересную связь. Бром, например, имел атомную массу где-то между массами хлора и йода, и все эти три элемента демонстрировали сходное химическое поведение. Литий, натрий и калий также были триадой.
Другие химики заметили связи между атомными массами и химическими свойствами, но лишь в 1860-х годах атомные массы стали достаточно хорошо поняты и измерены, чтобы выработалось более глубокое понимание. Английский химик Джон Ньюландс заметил, что расположение известных элементов в порядке увеличения атомной массы приводило к повторению химических свойств каждого восьмого элемента. Эту модель он назвал «законом октав» в статье 1865 года. Но модель Ньюландса не очень хорошо держалась после первых двух октав, что заставило критиков предложить ему расставить элементы в алфавитном порядке. И как вскоре понял Менделеев, отношение свойств элементов и атомных масс были чуть более сложными.
Эту модель он назвал «законом октав» в статье 1865 года. Но модель Ньюландса не очень хорошо держалась после первых двух октав, что заставило критиков предложить ему расставить элементы в алфавитном порядке. И как вскоре понял Менделеев, отношение свойств элементов и атомных масс были чуть более сложными.
Организация химических элементов
Менделеев родился в Тобольске, в Сибири, в 1834 году и был семнадцатым ребенком у своих родителей. Он жил яркой жизнью, преследуя разные интересы и путешествуя по дороге к выдающимся людям. Во время получения высшего образования в педагогическом институте в Санкт-Петербурге он чуть не умер от тяжелой болезни. После окончания он преподавал в средних школах (это нужно было, чтобы получать жалование в институте), попутно изучая математику и естественные науки для получения степени магистра.
Затем он работал преподавателем и лектором (и писал научные работы), пока не получил стипендию для расширенного тура исследований в лучших химических лабораториях Европы.
Вернувшись в Санкт-Петербург, он оказался без работы, поэтому написал превосходное руководство по органической химии в надежде выиграть крупный денежный приз. В 1862 году это принесло ему премию Демидова. Также он работал редактором, переводчиком и консультантом в различных химических сферах. В 1865 году он вернулся к исследованиям, получил доктора наук и стал профессором Петербургского университета.
Вскоре после этого Менделеев начал преподавать неорганическую химию. Готовясь освоить это новое (для него) поле, он остался неудовлетворен доступными учебниками. Поэтому решил написать собственный. Организация текста требовала организации элементов, поэтому вопрос их наилучшего расположения непрестанно был у него на уме.
К началу 1869 года Менделеев добился достаточного прогресса, чтобы понять, что некоторые группы подобных элементов демонстрировали регулярное увеличение атомных масс; другие элементы с примерно одинаковыми атомными массами имели схожие свойства. Оказалось, что упорядочение элементов по их атомному весу было ключом к их классификации.
Периодическая таблица Д. Менелеева.
По собственным словам Менделеева, он структурировал свое мышление, записав каждый из 63 известных тогда элементов на отдельной карточке. Затем, посредством своего рода игры в химический пасьянс, он нашел закономерность, которую искал. Располагая карточки в вертикальных столбцах с атомными массами от низкой к более высокой, он разместил элементы со схожими свойствами в каждом горизонтальном ряд. Периодическая таблица Менделеева родилась. Он набросал черновую версию 1 марта, отправил ее в печать и включил в свой учебник, который скоро должен был быть опубликован. Также он быстро подготовил работу для представления Российскому химическому обществу.
«Элементы, упорядоченные по размерам их атомных масс, показывают четкие периодические свойства», писал Менделеев в своей работе. «Все сравнения, которые я провел, привели меня к выводу, что размер атомной массы определяет природу элементов».
Тем временем, немецкий химик Лотар Мейер также работал над организацией элементов.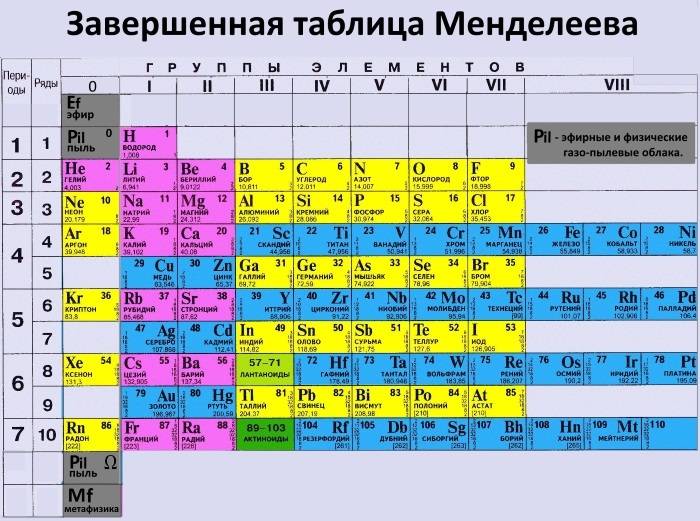 Он подготовил таблицу, похожую на менделеевскую, возможно, даже раньше, чем Менделеев. Но Менделеев издал свою первым.
Он подготовил таблицу, похожую на менделеевскую, возможно, даже раньше, чем Менделеев. Но Менделеев издал свою первым.
Тем не менее, гораздо более важным, чем победа над Мейером, было то, как Менделеев использовал свою таблицу, чтобы сделать смелые прогнозы о неоткрытых элементах. В подготовке свой таблицы Менделеев заметил, что некоторых карточек недоставало. Он должен был оставить пустые места, чтобы известные элементы могли выровняться правильно. Еще при его жизни три пустых места были заполнены ранее неизвестными элементами: галлий, скандий и германий.
Менделеев не только предсказал существование этих элементов, но также правильно описал их свойства в подробностях. Галлий, например, открытый в 1875 году, имел атомную массу 69,9 и плотность в шесть раз превышающую воды. Менделеев предсказал этот элемент (он назвал его экаалюминий), только по этой плотности и атомной массе 68. Его прогнозы для экакремния близко соответствовали германию (открытому в 1886 году) по атомной массе (72 предсказано, 72,3 фактически) и плотности. Он также верно предсказал плотность германиевых соединений с кислородом и хлором.
Он также верно предсказал плотность германиевых соединений с кислородом и хлором.
Таблица Менделеева стала пророческой. Казалось, что в конце этой игры этот пасьян из элементов раскроет тайны Вселенной. При этом сам Менделеев был мастером в использовании своей же таблицы.
Успешные предсказания Менделеева принесли ему легендарный статус мастера химического волшебства. Но сегодня историки спорят о том, закрепило ли открытие предсказанных элементов принятие его периодического закона. Принятие закона могло быть в большей степени связано с его способностью объяснять установленные химические связи. В любом случае, прогностическая точность Менделеева, безусловно, привлекла внимание к достоинствам его таблицы.
К 1890-м годам химики широко признали его закон как веху в химическом познании. В 1900-м году будущий нобелевский лауреат по химии Уильям Рамсей назвал это «величайшим обобщением, которое когда-либо проводилось в химии». И Менделеев сделал это, сам не понимая как.
Математическая карта
Во многих случаях в истории науки великие предсказания, основанные на новых уравнениях, оказывались верными. Каким-то образом математика раскрывает некоторые природные секреты, прежде чем экспериментаторы их обнаружат. Один из примеров — антиматерия, другой — расширение Вселенной. В случае Менделеева, предсказания новых элементов возникли без какой-либо творческой математики. Но на самом деле Менделеев открыл глубокую математическую карту природы, поскольку его таблица отражала значение квантовой механики, математических правил, управляющих атомной архитектурой.
Каким-то образом математика раскрывает некоторые природные секреты, прежде чем экспериментаторы их обнаружат. Один из примеров — антиматерия, другой — расширение Вселенной. В случае Менделеева, предсказания новых элементов возникли без какой-либо творческой математики. Но на самом деле Менделеев открыл глубокую математическую карту природы, поскольку его таблица отражала значение квантовой механики, математических правил, управляющих атомной архитектурой.
В своей книге Менделеев отметил, что «внутренние различия материи, которую составляют атомы», могут быть ответственны за периодически повторяющиеся свойства элементов. Но он не придерживался этой линии мышления. По сути, многие годы он размышлял о том, насколько важна атомная теория для его таблицы.
Но другие смогли прочитать внутреннее послание таблицы. В 1888 году немецкий химик Йоханнес Вислицен объявил, что периодичность свойств элементов, упорядоченных по массе, указывает на то, что атомы состоят из регулярных групп более мелких частиц. Таким образом, в некотором смысле таблица Менделеева действительно предвидела (и предоставила доказательства) сложную внутреннюю структуру атомов, в то время как никто не имел ни малейшего представления о том, как на самом деле выглядел атом или имел ли он какую-нибудь внутреннюю структуру вовсе.
Таким образом, в некотором смысле таблица Менделеева действительно предвидела (и предоставила доказательства) сложную внутреннюю структуру атомов, в то время как никто не имел ни малейшего представления о том, как на самом деле выглядел атом или имел ли он какую-нибудь внутреннюю структуру вовсе.
К моменту смерти Менделеева в 1907 году ученые знали, что атомы делятся на части: электроны, переносящие отрицательный электрический заряд, плюс некоторый положительно заряженный компонент, делающий атомы электрически нейтральными. Ключом к тому, как эти части выстраиваются, стало открытие 1911 года, когда физик Эрнест Резерфорд, работающий в Манчестерском университете в Англии, обнаружил атомное ядро. Вскоре после этого Генри Мозли, работавший с Резерфордом, продемонстрировал, что количество положительного заряда в ядре (число протонов, которое он содержит, или его «атомное число») определяет правильный порядок элементов в периодической таблице.
Генри Мозли.
Атомная масса была тесно связана с атомным числом Мозли — достаточно тесно, чтобы упорядочение элементов по массе только в нескольких местах отличалось от упорядочения по числу. Менделеев настаивал на том, что эти массы были неправильными и нуждались в повторном измерении, и в некоторых случаях оказался прав. Осталось несколько расхождений, но атомное число Мозли прекрасно легло в таблицу.
Менделеев настаивал на том, что эти массы были неправильными и нуждались в повторном измерении, и в некоторых случаях оказался прав. Осталось несколько расхождений, но атомное число Мозли прекрасно легло в таблицу.
Примерно в то же время датский физик Нильс Бор понял, что квантовая теория определяет расположение электронов, окружающих ядро, и что самые дальние электроны определяют химические свойства элемента.
Подобные расположения внешних электронов будут периодически повторяться, объясняя закономерности, которые первоначально выявила таблица Менделеева. Бор создал свою собственную версию таблицы в 1922 году, основываясь на экспериментальных измерениях энергий электронов (наряду с некоторыми подсказками из периодического закона).
Таблица Бора добавила элементы, открытые с 1869 года, но это был тот же периодической порядок, открытый Менделеевым. Не имея ни малейшего представления о квантовой теории, Менделеев создал таблицу, отражающую атомную архитектуру, которую диктовала квантовая физика.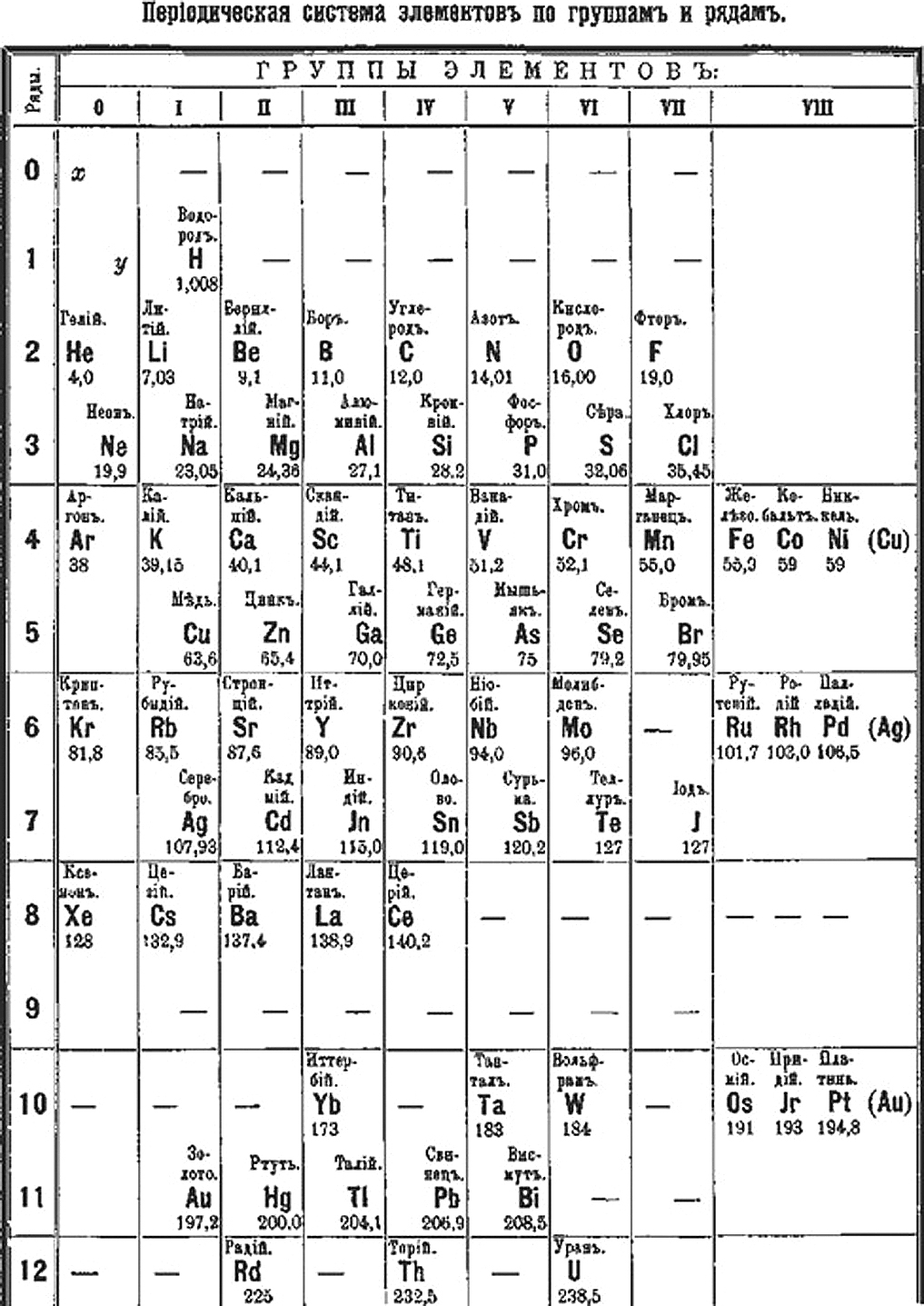
Новая таблица Бора не стала ни первым, ни последним вариантом изначального дизайна Менделеева. Сотни версий периодической таблицы с тех пор были разработаны и опубликованы. Современная форма — в горизонтальном дизайне в отличие от первоначальной вертикальной версии Менделеева — стала широко популярной только после Второй мировой войны, во многом благодаря работе американского химика Гленна Сиборга.
Сиборг и его коллеги создали несколько новых элементов синтетически, с атомными числами после урана, последнего природного элемента в таблице. Сиборг увидел, что эти элементы, трансурановые (плюс три элемента, предшествовавшие урану), требовали новой строки в таблице, которую не предвидел Менделеев. Таблица Сиборга добавила строку для тех элементов под аналогичным рядом редкоземельных элементов, которым тоже не было места в таблице.
Вклад Сиборг в химию принес ему честь назвать собственный элемент — сиборгий с номером 106. Это один из нескольких элементов, названных в честь известных ученых. И в этом списке, конечно, есть элемент 101, открытый Сиборгом и его коллегами в 1955 году и названный менделевием — в честь химика, который прежде всех остальных заслужил место в периодической таблице.
И в этом списке, конечно, есть элемент 101, открытый Сиборгом и его коллегами в 1955 году и названный менделевием — в честь химика, который прежде всех остальных заслужил место в периодической таблице.
Заходите на наш канал с новостями, если хотите больше подобных историй.
Элементы под рукой
В этом году мир отмечает 150-летний юбилей со дня открытия периодической системы элементов. Недавно в честь него мы предлагали пройти тест на знание названий химических элементов, которые по тем или иным причинам в таблицу Менделеева не попали. Однако споры вокруг названий элементов — далеко не единственные разногласия, которые были связаны с периодической системой за полтора века ее истории. На этот раз мы расскажем об альтернативных вариантах формы таблицы элементов, которые в большом количестве предлагались за это время, но в итоге так и не стали широко использоваться.
Наверняка многие из вас видели «таблицы Менделеева», составленные для сортов шоколада, героев мультсериалов, алкогольных напитков или, например, профессиональных велосипедистов. Более научные, но тоже не самые оригинальные варианты периодических систем можно получить, если в ячейках обычной таблицы химических элементов вместо их атомных масс указывать какие-то другие параметры: дату открытия элемента, его фотографию в форме простого вещества, период полураспада, элеткроотрицательность или изображения электронных орбиталей. Например, в нашем материале «Европейский след» мы писали о том, как те или иные элементы зарождаются в недрах звезд, и для наглядности использовали таблицу Менделеева с указанием процессов, которые приводят к появлению каждого из них.
Многие из этих таблиц по-своему интересны, информативны, красивы или смешны, но речь сейчас пойдет не о них. Мы предлагаем вам познакомиться с теми формами периодической системы элементов, которые принципиально отличаются от ее традиционного представления. Эти системы включают те же самые элементы, но для наглядности физических принципов, на которых основана периодичность их свойств, или просто для удобства использования ученые в разное время пытались представить их не в виде привычной нам таблицы из восемнадцати столбцов и семи строчек, а как-то иначе. Для этого они меняли направление периодов и групп, наматывали последовательность элементов на цилиндр и представляли их в виде ветвящихся деревьев.
Периодичность свойств
Чтобы разобраться, почему для периодической таблицы химических элементов предлагали так много разных способов графического представления, сначала кратко напомним о физических основах периодического закона.
В любой версии таблицы элементы расположены по увеличению заряда ядра: у первого элемента — водорода — он самый маленький и равен (по модулю) заряду одного электрона, а у самого тяжелого из известных на данный момент оганесона, расположенного в нижнем правом углу таблицы, он равен (тоже по модулю) заряду сразу 118 электронов.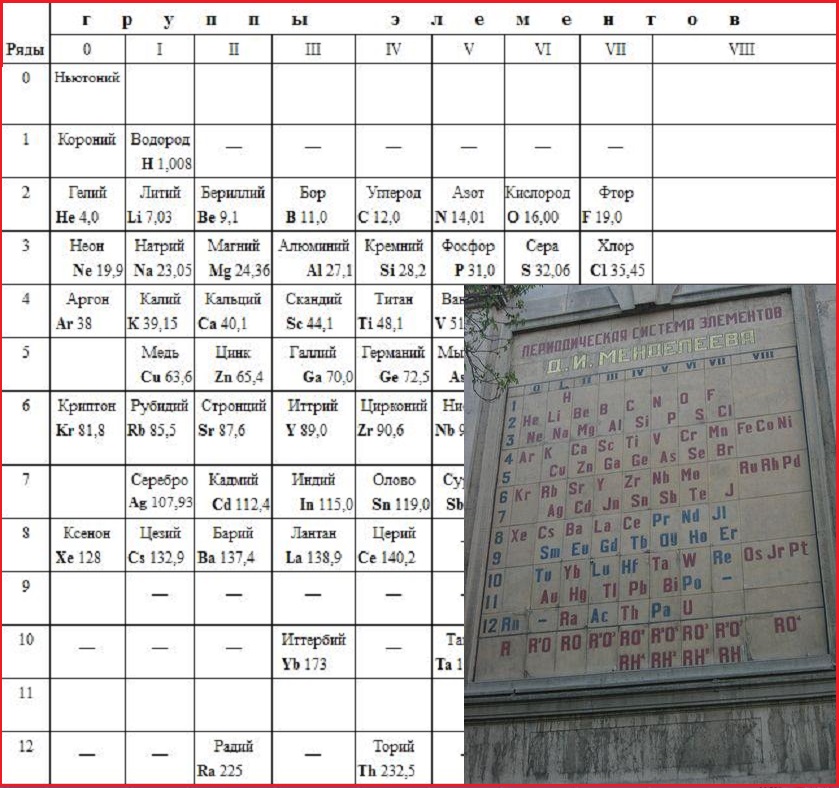 Поскольку заряд ядра определяется количеством в нем протонов, то вместе с зарядом растет и его масса (редкие исключения возможны из-за непостоянного соотношения между числом протонов и нейтронов в ядре), а периодичность свойств связана со структурой электронных оболочек атомов.
Поскольку заряд ядра определяется количеством в нем протонов, то вместе с зарядом растет и его масса (редкие исключения возможны из-за непостоянного соотношения между числом протонов и нейтронов в ядре), а периодичность свойств связана со структурой электронных оболочек атомов.
Грубо говоря, орбитали, на которых могут находиться электроны вокруг ядра атома, расположены «слоями». Эти слои отличаются между собой по размеру, энергии и форме. Первыми из них заполняются электронами те, которые расположены ближе всего к ядру, а если на них все места уже заняты, то электроны выбирают оболочки подальше от ядра и, соответсвенно, побольше. При этом вместе с увеличением радиуса растет и их энергия, и разнообразие форм: так, у самого близкого к ядру электронного слоя есть только одна сферическая s-орбиталь, а следующий слой состоит уже из четырех орбиталей: к одной сферической присоединяются еще три гантелевидные p-орбитали.
На следующих периодах появляются еще пять крестообразных d-орбиталей, а затем еще и 7 f-орбиталей. Подробнее о физических принципах, на которых основана периодичность химических свойств, вы можете прочитать в нашем материале «Элемент неожиданности».
Подробнее о физических принципах, на которых основана периодичность химических свойств, вы можете прочитать в нашем материале «Элемент неожиданности».
От того, на каком слое находится «самый дальний» от ядра электрон, и зависит, в каком периоде окажется элемент, а каждый переход к новому слою (когда все более маленькие оказываются занятыми) означает переход к новому периоду в таблице. При этом последовательность заполнения электронных оболочек важна для формирования структуры таблицы и определяется значениями главного и орбитального квантового чисел электронов и формулируется как правило Клечковского (оно же правило Маделунга): сначала заполняется уровень с наименьшим значением суммы этих двух чисел, а при равенстве этих сумм приоритет оказывается у оболочки с меньшим значением главного числа.
Схема заполнения электронами энергетических уровней согласно правилу Клечковского
Wikimedia commons
Логичный вопрос — как всю эту сложную периодическую систему с большим разнообразием электронных орбиталей, увеличением их числа и типов на каждом новом уровне представить графически: куда стоит помещать те или иные элементы, в каком направлении должно происходить увеличение массы атома, как лучше всего продемонстрировать периодичность и сходство свойств, как связать положение элементов с их электронной структурой.
Самый простой пример возникающих сложностей можно найти в самом начале таблицы Менделеева — это водород. С одной стороны, у него на внешнем уровне всего один электрон, что сразу делает его похожим на щелочные металлы: литий, натрий или калий, — а с другой стороны, того же одного электрона водороду не хватает до конфигурации инертного газа, из-за чего для него характерны и некоторые свойства галогенов — фтора или хлора.
В результате в течение долгого времени водород метался между первой группой и седьмой, а в некоторых вариантах таблицы занимал одновременно две позиции в первом периоде таблицы. Подобных коллизий — как фундаментального, так и эстетического характера — за историю периодической таблицы возникало немало.
Вертикально или горизонтально
Например, один из первых вопросов, который задаст учитель химии школьнику, только что познакомившемуся с таблицей элементов, — где в ней находятся периоды, а где группы, кто из них располагается по вертикали, а кто по горизонтали? Прилежному восьмикласснику ответить на этот вопрос никакого труда не составит: конечно, периоды расположены в строках таблицы, а группы — в столбцах.
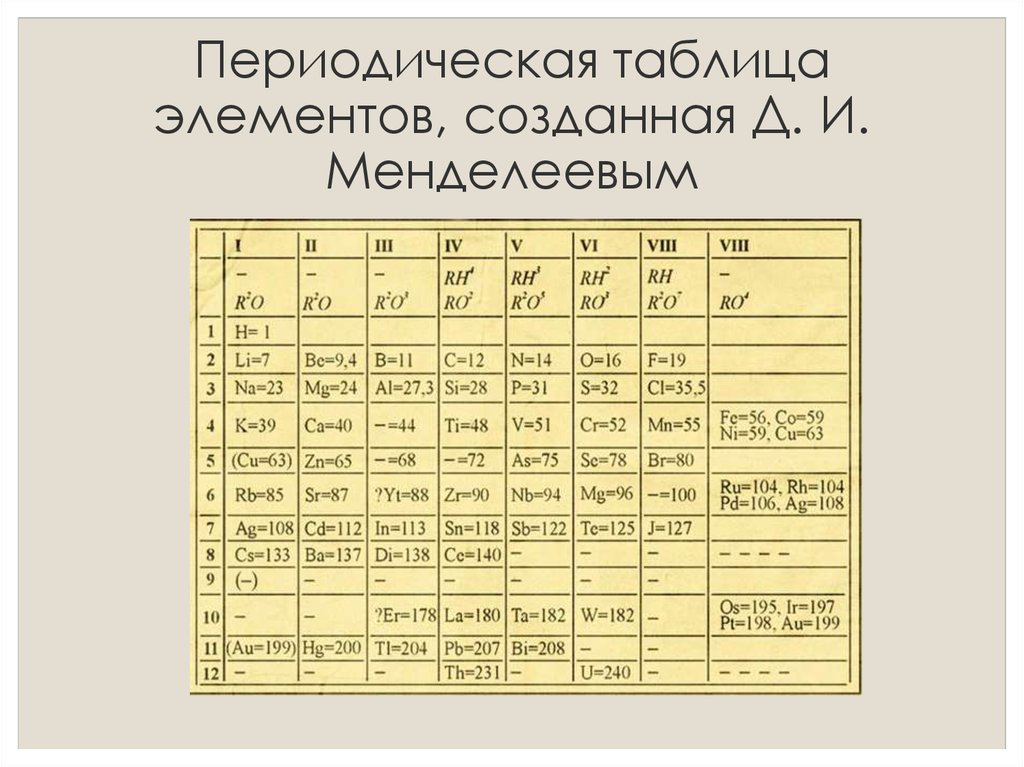
А вот сам Менделеев уверен в этом не был и в какой-то момент мог ответить на этот вопрос иначе. Самая первая версия таблицы, которую он в 1869 году сначала нарисовал у себя в дневнике, а затем опубликовал в журнале Русского химического общества, была вертикальной: каждый новый период располагался в новом столбце, а похожие по химическим свойствам элементы из одной и той же группы располагались по горизонтальным рядам. В результате 63 известных на тот момент элемента занимали 6 столбцов и 19 строчек.
Рукопись Д. И. Менделеева 1869 года, на которой приведена одна из первых версий периодической таблицы элементов в вертикальной форме
Музей-архив Д. И. Менделеева при СПбГУ
Французский экземпляр «Опыта системы элементов» с вертикальной версией таблицы, разосланный Менделеевым иностранным ученым в 1869 году
Музей-архив Д. И. Менделеева при СПбГУ
И. Менделеева при СПбГУ
Уже в следующем году Менделеев предложил горизонтальную версию таблицы (такую форму имеет и найденная недавно в Сент-Эндрюсском университете одна из старейших сохранившихся копий настенных периодических таблиц, напечатанная в 1885 году, и таблица в аудитории СПбГУ, изготовленная по указанию самого ученого в 1876 году). Тем не менее, вплоть до конца XIX века вертикальные таблицы и их модифицированные версии продолжали использоваться наряду с горизонтальными.
Вопрос о старейшем экземпляре таблицы Менделеева для N + 1 прокомментировал заведующий Музеем-архивом Д. И. Менделеева при СПбГУ Игорь Дмитриев:«Насколько можно судить по сохранившимся документам, Менделеев размышлял о систематике химических элементов по крайне мере с 1867 года, а в активную фазу работа по систематике элементов вошла в начале 1869 года. Провыв наступил 17 февраля (1 марта по новому стилю) 1869 года — именно этим числом датирован и один из сохранившихся набросков. На нем сверху рукою Менделеева написано: “Опыт системы элементов, основанной на их атомном весе и химическом сходстве, Д. Менделеева”. Этот вариант систематики элементов вскоре был отпечатан в виде отдельного листка тиражом 200 экземпляров и разослан русским и иностранным химикам».
На нем сверху рукою Менделеева написано: “Опыт системы элементов, основанной на их атомном весе и химическом сходстве, Д. Менделеева”. Этот вариант систематики элементов вскоре был отпечатан в виде отдельного листка тиражом 200 экземпляров и разослан русским и иностранным химикам».
Подробнее о самых старых копиях таблицы Менделеева читайте в нашем блоге «Дело не в таблице».
Компактно или наглядно
Количество периодов в периодической таблице за 150 лет увеличилось с шести до семи (и этот факт вопросов не вызывает), а вот насчет «правильного» количества столбцов в таблице до сих пор спорят. Большинство читателей в ответ на вопрос о возможных вариантах таблицы Менделеева наверняка сразу вспомнят про короткопериодную и длиннопериодную версии.
В первом случае d-элементы, у которых появляются электроны на d-орбиталях и которые присутствуют в таблице начиная с 4 периода, записываются в две строчки. Такая запись возможна благодаря сходству степеней окисления у элементов главной группы (то есть p-элементов) и расположенных над ними переходных металлов из d-блока таблицы.
Горизонтальная короткопериодная таблица Менделеева, опубликованная в 1871 году
Wikimedia commons
Короткая запись таблицы получается весьма компактной, но, например, некоторые из металлов в такой системе целыми тройками оказываются как будто бы в той же группе, что и инертные газы, хотя по своим химическим свойствам совершенно на них не похожи. В результате в 1989 году ИЮПАК официально отменил короткий вариант таблицы и сейчас она используется редко, а основной версией таблица стала «длиннопериодная».
В ней все элементы из одного периода записываются одной строкой. С одной стороны, это позволяет избежать некоторой путаницы, но с другой — таблица при этом становится значительно менее компактной и резко увеличивается по ширине. Поэтому чтобы избежать дальнейшего разрастания таблицы элементов в горизонтальном направлении, все f-элементы — лантаноиды и актиноиды — в обоих вариантах таблицы выносятся в отдельные секции в нижней части таблицы.
Поэтому чтобы избежать дальнейшего разрастания таблицы элементов в горизонтальном направлении, все f-элементы — лантаноиды и актиноиды — в обоих вариантах таблицы выносятся в отдельные секции в нижней части таблицы.
Несмотря на избыточную ширину даже такого варианта таблицы, физик Гленн Сиборг решил, однако, на нем не останавливаться и в 1969 году предложил свою версию сверхрасширенной таблицы. В этой версии таблицы без переносов строки включаются не только d-элементы, но и f-элементы, то есть лантаноиды и актиноиды (которые сейчас всегда выносятся в отдельную секцию), а также g-элементы, ни один из которых на данный момент не получен. Всего в таблице оказалось 218 элементов — даже сейчас таблица ровно на сто элементов короче, а в тот момент их было синтезировано еще меньше.
Стоит отметить, что насчет научной ценности такой таблицы у ученых возникают сомнения. Во-первых, это просто неудобно — полная версия таблицы будет занимать несколько разворотов книги (да и на экран монитора не уместится). Во-вторых, у большинства химиков вопросы вызывает сохранение периодических закономерностей для химических свойств у настолько тяжелых элементов — при такой массе их свойства сильнее зависят от состава ядра, чем от заполненности электронных оболочек. Эта проблема становится актуальной уже для актиноиодов, а недавно было показано, что и оганесон — последний элемент седьмого периода — не так уж сильно похож на инертный газ.
Во-вторых, у большинства химиков вопросы вызывает сохранение периодических закономерностей для химических свойств у настолько тяжелых элементов — при такой массе их свойства сильнее зависят от состава ядра, чем от заполненности электронных оболочек. Эта проблема становится актуальной уже для актиноиодов, а недавно было показано, что и оганесон — последний элемент седьмого периода — не так уж сильно похож на инертный газ.
«Левосторонняя» таблица элементов Шарля Жане 1928 года
Charles Janet / Imprimerie De ́partementale de l’Oise, Beauvais, 1928
Справа или слева
Попытка уместить каждый период в единственную строчку, вплоть до абсурдных вариантов с 50 столбцами, — на самом деле самый простой и безобидный способ изменить внешний вид таблицы, чтобы сделать ее нагляднее. Эти таблицы почти не отличаются от традиционных, и перестроиться на них труда не составит. Значительно сложнее это сделать при работе со некоторыми другими периодическими системаи.
Эти таблицы почти не отличаются от традиционных, и перестроиться на них труда не составит. Значительно сложнее это сделать при работе со некоторыми другими периодическими системаи.
Например, одна из наиболее известных версия альтернативного способа заполнения — это так называемая «левосторонняя» таблица Шарля Жане, которую он предложил в 1928 году. Жане опубликовал за один год две работы, в которых предложил сразу три модификации такой таблицы, остановившись на наиболее наглядной версии.
В отличие от традиционной таблицы, блоки s- и p-элементов в ней расположены в обратном порядке: s-блок (щелочные и щелочноземельные металлы) справа, а p-блок — слева от него. При этом заполняется эта таблица, как и традиционная, слева направо, поэтому переход от одного периода к другому происходит между 2-й и 13-й (или 3-й в короткопериодном варианте) группами. Таким образом, s-элементы в таблице оказываются расположены около правого края, слева от них — инертные газы и весь p-блок, еще левее — d-элементы.
Основное преимущество подобного расположения элементов состоит в том, что с помощью него в «длиннопериодном» варианте таблицы удается избежать разрывов между s- и p-элементами, благодаря чему можно с ходу, практически не задумываясь, определить электронную конфигурацию атома того или иного элемента в незаряженном состоянии, просто отсчитывая нужные блоки с правой стороны.
Другая необычная версия таблицы — это «древовидная» таблица, которую предложил Эдвард Мазурс в 1967 году. В ней не только новый период, а каждый новый блок элементов (s-, p-, d- и f-блоки), начинается на новой строчке. Каждый из них выравнивается по центру, в результате чего образуется структура, напоминающая рисунок елки, треугольные уровни у которой перевернуты вверх ногами. «Ствол» это дерева состоит из s-элементов, над ними находятся p-элементы, затем d- и f-металлы (если они в периоде есть).
Эта таблица также позволяет быстро определить электронную структуру элементов, а для облегчения восприятия, как и в традиционных вариантах, ее ячейки подкрашивают тем или иным цветом.
Древовидная периодическая таблица Эдварда Мазурса, опубликованная на форзаце его книги 1974 года
E. G. Mazurs, Graphic Representation of the Periodic System during One Hundred Years, 1974
Таблица или дерево
При этом далеко не все варианты альтернативных периодических систем, предложенных за 150 лет их истории, представляли собой таблицы. Например, в конце XIX века и начале XX века на основе первоначального вертикального варианта Менделеева ученые пытались построить всевозможные ветвящиеся структуры, которые должны были, по мысли авторов, лучше описывать периодичность свойств, чем таблица из столбцов и строчек.
Как и значительно более поздний вариант Мазурса, эти таблицы тоже напоминают разрастающиеся деревья, но состоят не из отдельных ячеек, а представляют собой элементы, связанные между собой веточками, определяющими родство свойств.
Разветвленная система элементов Бэйли 1882 года
G. N. Quam and Mary Bettell Quam / Journal of Chemical Education, 1934
Во всех этих вариантах ученые использовали идею увеличения длины периода с ростом массы элемента — на каждом следующем шаге между щелочными металлами и галогенами (инертные газы на момент публикации большинства этих вариантов еще не были известны) встраивается все большее число новых элементов.
Ветвистые структуры из элементов, соединенных палочками, иногда принимали довольно необычные формы. Например, в периодической системе Старека 1932 года элементы сгруппированы по сходству физических свойств и образуют зигзагообразную систему с диагональным выравниванием элементов, напоминающую проекцию какой-то сложной трехмерной структуры.
Периодическая система, предолженная Стареком в 1932 году
G. N. Quam and Mary Bettell Quam / Journal of Chemical Education, 1934
Строчки или витки
Пожалуй, самой популярной альтернативой табличному представлению за всю историю периодической системы элементов оказались всевозможные модификации спиральных структур. Основная проблема формы таблицы — прерывистость ее структуры. Чтобы перейти в ней от одного периода к другому, так или иначе нужно перескакивать с конца предыдущей строки к началу новой. Такой скачок, однако, противоречит постепенному росту заряда ядра — при переходе от инертного газа к щелочному металлу следующего периода нужно увеличить заряд ядра на заряд всего одного протона — так же, как и при переходе к следующему элементу в середине периода.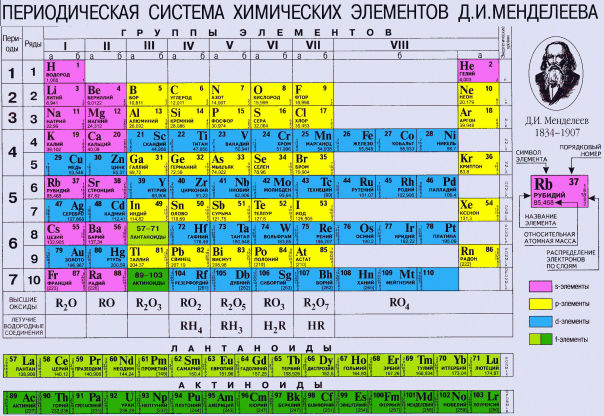
Спиральная периодическая система Гуго Эрдманна 1902 года
G. N. Quam and Mary Bettell Quam / Journal of Chemical Education, 1934
В начале XX века было предложено еще несколько «спиралей Менделеева», а значительный шаг в их улучшении сделал тот же Шарль Жане. После публикации своей «левосторонней» версии таблицы он в том же 1928 году начал работать над спиральными версиями структуры. Жане разработал несколько версий объемных и плоских спиралей, что, помимо прочего, помогло ему фактически прийти к верному правилу последовательности заполнения электронных орбиталей на шесть лет раньше Маделунга и на 21 год раньше Клечковского.
После публикации своей «левосторонней» версии таблицы он в том же 1928 году начал работать над спиральными версиями структуры. Жане разработал несколько версий объемных и плоских спиралей, что, помимо прочего, помогло ему фактически прийти к верному правилу последовательности заполнения электронных орбиталей на шесть лет раньше Маделунга и на 21 год раньше Клечковского.
Повторные обороты на длинных периодах Жане заменил петлями — покороче для d-элементов и подлиннее — для f-элементов, так что структура в зависимости от формы записи стала напоминать голову кролика или кактус.
Вторая версия спиральной периодической системы Шарля Жане 1928 года
Charles Janet, La classification hélicoïdale des elements chimiques, 1928
Спиральная система Шарля Жане в форме лемнискаты
E.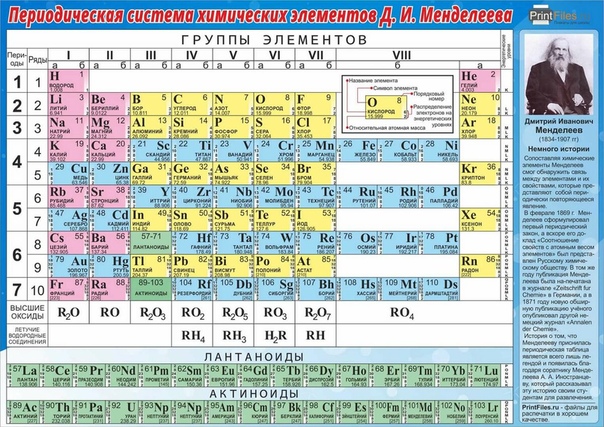 G. Mazurs / Graphic Representation of the Periodic System during One Hundred Years, 1974
G. Mazurs / Graphic Representation of the Periodic System during One Hundred Years, 1974
Спиральная периодическая система Гордона Ирвина 1939 года
K. Gordon Irwin / Journal of Chemical Education, 1939
Спиральная периодическая система Теодора Бенфея, опубликованная в 1964 году
Wikimedia commons
Подобные плоские спирали продолжали дорабатываться и дополняться в течение еще нескольких десятков лет, но стать полноценной заменой таблицам так и не смогли.
Плоская или объемная
Интересно, что не так мало альтернативных версий периодической системы элементов были не плоскими, а объемными. И в основе большинства из них тоже оказывались спиральные структуры. Обычно цепочки последовательностей элементов предлагали «наматывать» на цилиндр или конус (в последнем случае таблица становится похожа на гирлянду на новогодней елке).
И в основе большинства из них тоже оказывались спиральные структуры. Обычно цепочки последовательностей элементов предлагали «наматывать» на цилиндр или конус (в последнем случае таблица становится похожа на гирлянду на новогодней елке).
Однако из-за невозможности нормально работать с изображениями этих спиралей на бумаге и небольшой наглядности все эти варианты остались лишь экспериментами.
Модель спиральной периодической системы в форме восьмерки, предложенная Круксом в 1898 году
G. N. Quam and Mary Bettell Quam / Journal of Chemical Education, 1934
При этом, кроме научно значимых попыток создания объемных структур, ученые и художники наносили периодическую таблицу и на другие объемные фигуры. Например, в начале XX века появилась сферическая версия таблицы элементов, которая заполнялась сверху вниз, при этом на нижнюю половину сферы должны были попадать все неустойчивые элементы. Или совсем экстравагантные варианты, такие как таблица Менделеева на ленте Мёбиуса, которая имеет, правда, лишь эстетическую ценность.
Или совсем экстравагантные варианты, такие как таблица Менделеева на ленте Мёбиуса, которая имеет, правда, лишь эстетическую ценность.
Из-за того, что многочисленные версии таблиц элементов стали возникать сразу же после формулировки периодического закона, уже с конца XIX века появились и первые обзорные статьи, которые сравнивали эти варианты между собой, определяя наиболее удобные, наглядные и подходящие для дальнейшего использования версии. Сейчас новые подобные публикации в форме отдельных статей и целых монографий все еще продолжают появляться, хотя носят уже скорее исторический интерес.
Александр Дубов
Литература
1. G. N. Quam and Mary Battel Quam, Types of Graphic Classifications of the Elements, Journal of Chemical Education, 1934.2. Edward G. Mazurs, Graphic Representations of the Periodic System During One Hundred Years, University of Alabama Press, 1974.
3. Eric Scerri, The Periodic Table: Its Story and Its Significance, Oxford University Press, 2006.
Периодическая система таблица Менделеева – Справочник химика 21
При построении периодической системы Менделеев руководствовался принципом расположения элементов по возрастающим атомным массам. Однако, как видно нз таблицы, в трех случаях этот принцип оказался нарушенным. Так, аргон (атомная масса 39,948 а. е. м.) стоит до калия (39,098 а. е. м.), кобальт (58,9332 а. е. м.) находится до никеля (58,70 а. е. м.) и теллур (127,60 а. е. м.) до иода (126,9045 а. е. м.). Здесь Менделеев отступил от принятого им порядка, исходя из свойств этих элементов, требовавших именно такой последовательности их расположения. Таким образом, он не придавал исключительного значения атомной массе и, устанавливая место элемента в таблице, руководствовался всей совокупностью его свойств. Позднейшие исследования показали, что произведенное Менделеевым размещение элементов в пе- [c.52]
Позднейшие исследования показали, что произведенное Менделеевым размещение элементов в пе- [c.52] Обоснуйте, почему аргон с относительной атомной массой 39,9 располагается в периодической системе перед калием, атомная масса которого меньше (К) = 39,1 (элементы расположил в таблице правильно еще Д. И. Менделеев ). [c.26]
ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ Д. И. МЕНДЕЛЕЕВА — естественная система химических элементов, созданная гениальным русским химиком Д. И. Менделеевым. Расположив элементы в последовательности возрастания атомных масс и сгруппировав элементы с аналогичными свойствами, Д. И. Менделеев составил таблицу элементов, закономерности которой теоретически вытекают из сформулированного им периодического закона Физические и химические свойства элементов, проявляющиеся в свойствах простых и сложных тел, ими образуемых, находятся в периодической зависимости от их атомного веса (1869—1871 гг. ). Периодический закон и периодическая система элементов Д. И. Менделеева позволяют установить свя ь между всеми химическими элементами, предсказать существование ранее неизвестных элементов и описать их свойства. Как впоследствии стало известно, периодичность в изменении свойств элементов обусловлена числом электронов в атоме, электронной структурой атома, периодически изменяющейся по мере возрастания числа электронов. Число электронов равно положительному заряду атомного ядра это число равно порядковому (атомному) номеру элемента в периодической системе элементов Д. И. Менделеева. Отсюда современная формулировка периодического закона Свойства элементов, а также свойства образованных ими простых и сложных соединений находятся в периодической зависимости от величины зарядов их атомных ядер (2) . Поскольку атомные массы элементов, как правило, возрастают в той же последовательности, что и заряды атомных ядер, современная форма таблицы периодической системы элементов полностью совпадает с менделеевской, где аргон, кобальт, теллур расположены не в порядке возрастания атомной массы, а на основе их химических свойств.
). Периодический закон и периодическая система элементов Д. И. Менделеева позволяют установить свя ь между всеми химическими элементами, предсказать существование ранее неизвестных элементов и описать их свойства. Как впоследствии стало известно, периодичность в изменении свойств элементов обусловлена числом электронов в атоме, электронной структурой атома, периодически изменяющейся по мере возрастания числа электронов. Число электронов равно положительному заряду атомного ядра это число равно порядковому (атомному) номеру элемента в периодической системе элементов Д. И. Менделеева. Отсюда современная формулировка периодического закона Свойства элементов, а также свойства образованных ими простых и сложных соединений находятся в периодической зависимости от величины зарядов их атомных ядер (2) . Поскольку атомные массы элементов, как правило, возрастают в той же последовательности, что и заряды атомных ядер, современная форма таблицы периодической системы элементов полностью совпадает с менделеевской, где аргон, кобальт, теллур расположены не в порядке возрастания атомной массы, а на основе их химических свойств. Это несоответствие рассматривалось противниками Д. И. Менделеева как недостаток его системы, но, как позже было доказано, закономерность нарушается в связи с изотопным составом элементов, что также предвидел Д. И. Менделеев. Периодический закон и периодическая система элементов [c.188]
Это несоответствие рассматривалось противниками Д. И. Менделеева как недостаток его системы, но, как позже было доказано, закономерность нарушается в связи с изотопным составом элементов, что также предвидел Д. И. Менделеев. Периодический закон и периодическая система элементов [c.188]
Вот как выглядела эта история. Иногда говорят, что Ньюлендсу задавали вопросы об аккордах и арпеджио , но на самом деле его спрашивали только об алфавитном порядке. Однако недоверие было совершенно очевидным, а незадачливая музыкальная аналогия сделала идеи Ньюлендса больше похожими на магию, чем на науку. Отсутствие места для новых элементов и помещение по два элемента в некоторые места таблицы были серьезными недостатками. По-видимому, главным достоинством схемы, предложенной Менделеевым, было введение больших периодов после двух первых, содержащих по восемь элементов. Менделеев подкреплял свою таблицу очень большим числом химических доказательств, а также прославившими его предсказаниями новых элементов и их химических свойств.
 Он несомненно заслужил репутацию создателя периодической системы элементов. [c.327]
Он несомненно заслужил репутацию создателя периодической системы элементов. [c.327]Разделив все элементы иа периоды и располагая одн,н период под другим так, чтобы сходные ио свойствам и типу образуемых соединений элементы приходились друг под другом, Менделеев составил таблицу, названную им периодической системой элементов по группам и рядам. Эта таблица в современном виде, дополненная открытыми уже после Менделеева элементами, приведена в начале книги. Она состоит из десяти горизонтальных рядов и восьми вертикальных столбцов, или групп, [c.49]
Открытый закон периодичности Д. И. Менделеев использовал для создания периодической системы элементов. Днем рождения системы Д. И. Менделеева обычно считают 18 февраля 1869 г., когда был составлен первый вариант таблицы. В этой таблице 63 известных Д. И. Менделееву элемента были расположены в порядке возрастания атомных масс. Это расположение отражало также периодичность изменения свойств элементов.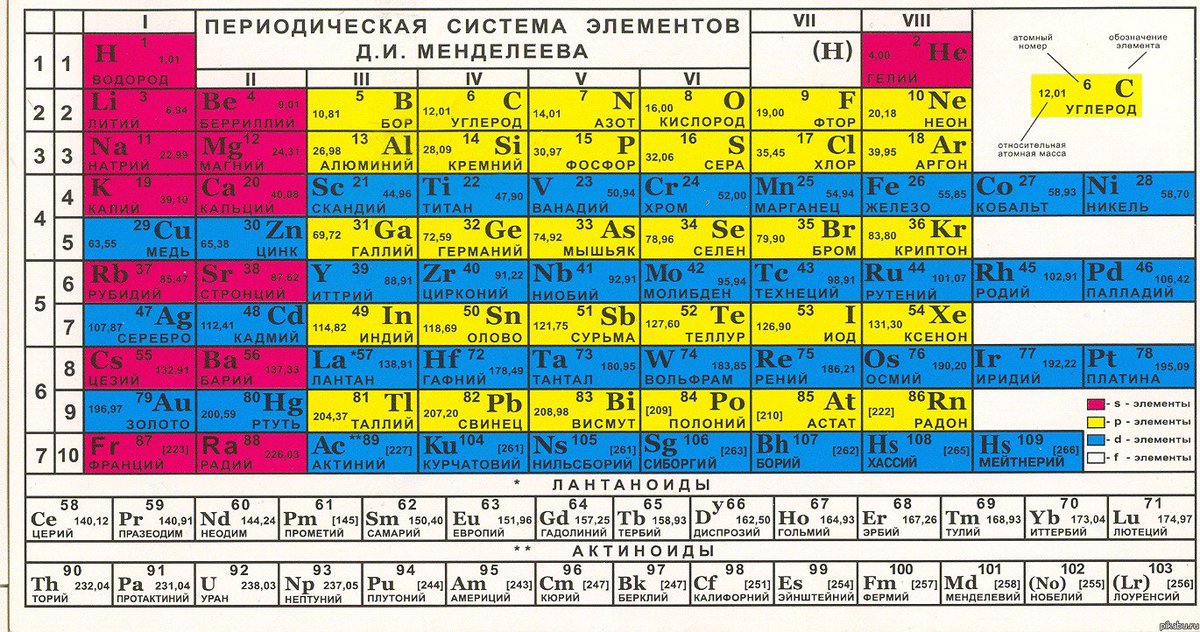 В таблице были оставлены пустые места для четырех еще не открытых элементов с атомными массами 45, 68, 70 и 180. Существование их было предсказано Д. И. Менделеевым. [c.20]
В таблице были оставлены пустые места для четырех еще не открытых элементов с атомными массами 45, 68, 70 и 180. Существование их было предсказано Д. И. Менделеевым. [c.20]
Свою таблицу Менделеев опубликовал в 1869 г., т. е. раньше, чем была издана основная работа Мейера (рис. 16). Однако честь открытия Периодической системы элементов принадлежит Менделееву не из-за приоритета публикации, действительная причина состоит в том, как Менделеев построил свою таблицу. [c.99]
Точно так же периодическая система дала толчок к исправлению атомных масс некоторых элементов. Например, цезию раньше приписывали атомную массу 123,4. Менделеев же, располагая элементы в таблицу, нашел, что по своим свойствам цезий должен стоять в главной подгруппе первой группы под рубидием и потому будет иметь атомную массу около 130. Современные определения показывают, что атомная масса цезия равна 132,9054. [c.77]
Несмотря на большое значение ранних работ различных ученых, главная заслуга в развитии периодической системы принадлежит русскому ученому Дмитрию Ивановичу Менделееву и немецкому ученому Юлиусу Лотару Мейеру. Независимо один от другого они открыли, что свойства элементов могут быть выражены как периодическая функция от. чх атомных весов, и сделали возможной периодическую классификацию, которая мало изменилась в течение последующих лет. Менделеев опубликовал свое первое сообщение о периодической системе в 1869 г., на несколько месяцев раньше появления в печати таблицы Мейера. Однако нет сомнения, что оба ученых достойны славы за открытие периодического закона, независимо от даты опубликования. Это было признано Королевским Обществом, присудившим в 1882 г, и Д. И. Менделееву, и Мейеру медаль Дэви. [c.84]
Независимо один от другого они открыли, что свойства элементов могут быть выражены как периодическая функция от. чх атомных весов, и сделали возможной периодическую классификацию, которая мало изменилась в течение последующих лет. Менделеев опубликовал свое первое сообщение о периодической системе в 1869 г., на несколько месяцев раньше появления в печати таблицы Мейера. Однако нет сомнения, что оба ученых достойны славы за открытие периодического закона, независимо от даты опубликования. Это было признано Королевским Обществом, присудившим в 1882 г, и Д. И. Менделееву, и Мейеру медаль Дэви. [c.84]
Период полураспада (Т. д)- время, за которое количество нестабильных частиц уменьшается наполовину. П. п.— одна из основных характеристик радиоактивных изотопов, неустойчивых элементарных (фундаментальных) частиц. Периодическая система элементов Д. И. Менделеева — естественная система химических элементов. Расположив элементы в порядке возрастания атомных масс (весов) и сгруппировав элементы с аналогичными свойствами, Д.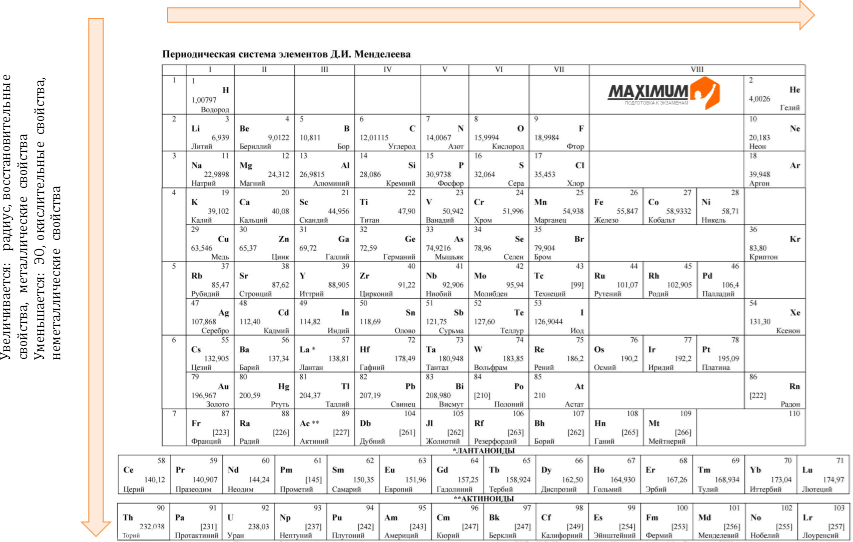 И. Менделеев составил таблицу элементов, выражающую открытый им периодический закон Физические и химические свойства элементов, проявляющиеся в свойствах простых и сложных тел, ими образуемых, стоят в периодической зависимости от их атомного веса (1869—1871 гг.). Периодический закон и периодическая таблица элементов Д. И. Менделеева позволяют установить взаимную связь между всеми известными химическими элементами, предсказать существование ранее неизвестных элементов и описать их свойства. На основе закона и периодической системы Д. И. Менделеева найдены закономерности в свойствах химических соединений различных элементов, открыты новые элементы, получено много новых веществ. Периодичность в изменении свойств элементов обусловлена строением электронной оболочки атома, периодически изменяющейся по мере возрастания числа электронов, равного положительному заряду атомного ядра Z. Отсюда современная формулировка периодического закона свойства элементов, а также образованных ими простых и сложных соединений находятся в периодической зависимости от величин зарядов их атомных ядер (Z).
И. Менделеев составил таблицу элементов, выражающую открытый им периодический закон Физические и химические свойства элементов, проявляющиеся в свойствах простых и сложных тел, ими образуемых, стоят в периодической зависимости от их атомного веса (1869—1871 гг.). Периодический закон и периодическая таблица элементов Д. И. Менделеева позволяют установить взаимную связь между всеми известными химическими элементами, предсказать существование ранее неизвестных элементов и описать их свойства. На основе закона и периодической системы Д. И. Менделеева найдены закономерности в свойствах химических соединений различных элементов, открыты новые элементы, получено много новых веществ. Периодичность в изменении свойств элементов обусловлена строением электронной оболочки атома, периодически изменяющейся по мере возрастания числа электронов, равного положительному заряду атомного ядра Z. Отсюда современная формулировка периодического закона свойства элементов, а также образованных ими простых и сложных соединений находятся в периодической зависимости от величин зарядов их атомных ядер (Z). Поэтому химические элементы в П. с. э. располагаются в порядке возрастания Z, что соответствует в целом их расположению по атомным массам, за исключением Аг—К, Со—N1, Те—I, Th—Ра, для которых эта закономерность нарушается, что связано с нх изотопным составом. В периодической системе все химические элементы подразделяются на группы и периоды. Каждая группа в свою очередь подразделяется на главную и побочную подгруппы. В каждой подгруппе содержатся элементы, обладающие сходными химическими свойствами. Элементы главной и побочной подгрупп в каждой группе, как правило, обнаруживают между собой определенное химическое сходство главным образом в высших степенях окисления, которое, как правило, соответствует номеру группы. Периодом называют совокупность элементов, начинающуюся щелочным металлом и заканчивающуюся инертным газом (особый случай — первый период) каждый период содержит строго определенное число элементов. П. с. э. имеет 8 групп и 7 периодов (седьмой пока не завершен). [c.98]
Поэтому химические элементы в П. с. э. располагаются в порядке возрастания Z, что соответствует в целом их расположению по атомным массам, за исключением Аг—К, Со—N1, Те—I, Th—Ра, для которых эта закономерность нарушается, что связано с нх изотопным составом. В периодической системе все химические элементы подразделяются на группы и периоды. Каждая группа в свою очередь подразделяется на главную и побочную подгруппы. В каждой подгруппе содержатся элементы, обладающие сходными химическими свойствами. Элементы главной и побочной подгрупп в каждой группе, как правило, обнаруживают между собой определенное химическое сходство главным образом в высших степенях окисления, которое, как правило, соответствует номеру группы. Периодом называют совокупность элементов, начинающуюся щелочным металлом и заканчивающуюся инертным газом (особый случай — первый период) каждый период содержит строго определенное число элементов. П. с. э. имеет 8 групп и 7 периодов (седьмой пока не завершен). [c.98]
Во втором варианте таблицы Менделеев поместил только один элемент из лантаноидов — Се. Для остальных забронировал места. Впоследствии, когда их было известно уже 11 (1902 1903), он включает в таблицу только два — Се и УЬ, так как не мог окончательно определиться, куда их поместить. В 1903 г. он писал Тут мое мнение ни на чем не остановилось, и здесь я вижу одну из труднейших задач, представляемых периодической закономерностью . Возникает вопрос а в чем собственно заключается трудность задачи Ведь есть (как считает автор) естественная система химических элементов, сформулирован главный закон, лежащий в ее основе, — бери, пользуйся Но почему же они не срабатывают А дело в том, что в основе системы лежит не только периодическая законность (дифференциация), но и непрерывная законность (интеграция). Трудность размещения в Периодической [c.71]
Для остальных забронировал места. Впоследствии, когда их было известно уже 11 (1902 1903), он включает в таблицу только два — Се и УЬ, так как не мог окончательно определиться, куда их поместить. В 1903 г. он писал Тут мое мнение ни на чем не остановилось, и здесь я вижу одну из труднейших задач, представляемых периодической закономерностью . Возникает вопрос а в чем собственно заключается трудность задачи Ведь есть (как считает автор) естественная система химических элементов, сформулирован главный закон, лежащий в ее основе, — бери, пользуйся Но почему же они не срабатывают А дело в том, что в основе системы лежит не только периодическая законность (дифференциация), но и непрерывная законность (интеграция). Трудность размещения в Периодической [c.71]
На протяжении почти четырех десятилетий Д. И. Менделеев работал над усовершенствованием периодической системы элементов, разрабатываемой им в различных вариантах. Последний вариант короткой формы таблицы был опубликован им в 8-м издании Основ химии . [c.75]
[c.75]
В поисках периодической системы элемеитов Менделеев шел от представления об отдельных, разрозненных, не связанных между собой элементов и их групп к раскрытию их взаимной связи между собой. Общая связь, охватывающая все элементы, раскрывалась не сразу, не в виде пришедшего как бы по наитию решения, а последовательно, шаг за шагом. Когда речь шла о членах одного и того же семейства (например, семейства железа, платины или церитовых металлов), элементы оказывались близкими и по химическим свойствам, и по атомным весам. Поэтому связи элементов внутри таких семейств обнаруживались с особой ясностью, даже если в начале составления таблицы они не были еще выяснены в полном объеме. [c.45]
Решающий шаг в развитии периодической системы сделал Менделеев. Оп систематически изучал взаимосвязь между атомным весом и физическими и химическими свойствами элементов, обращая особое внимание на валентность. В 1869 г. Менделеев предложил таблицу элементов, содержащую семнадцать столбцов и в общем более похожую на новую форму периодической системы (см. стр, 56—57). В 1871 г. Менделеев видоизменил свою таблицу— сократил число столбцов до восьми, перегруппировал элементы длинных периодов в два ряда по семи элементов и ввел восьмой столбец, содержащий по три элемента в ряду (см. табл. 6, стр. 55). Аналогичная таблица была предложена в том же году [c.53]
стр, 56—57). В 1871 г. Менделеев видоизменил свою таблицу— сократил число столбцов до восьми, перегруппировал элементы длинных периодов в два ряда по семи элементов и ввел восьмой столбец, содержащий по три элемента в ряду (см. табл. 6, стр. 55). Аналогичная таблица была предложена в том же году [c.53]
За основу классификации элементов Менделеев, как и Мейер, принял массу, но при этом Менделеев не рассматривал массу как единственную характеристику элемента. В современной формулировке Периодического закона отражается зависимость свойств элементов от порядкового номера элемента 2, т. е. от заряда ядра атомов, поскольку именно величина 2 однозначно характеризует химический элемент (см. 1.6). Не менее важным был учет Менделеевым химических свойств элементов именно эти свойства для некоторых элементов оказались решающими при выборе места данного элемента в таблице. В наши дни открытие Менделеева блестяще подтвердилось все новые элементы, как обнаруженные в природе, так и синтезированные искусственно, занимают свое естественное место в Периодической системе. [c.100]
[c.100]
В то время целый ряд ученых, работая независимо, пытались создать классификацию элементов, в которой бы рядом располагались элементы с близкими свойствами. Такой тип расположения называется периодической системой. В 1869 году русский химик Дмитрий Иванович Менделеев опубликовал периодическую систему, очень похожую на ту, что используется в настоящее время. Это таблица, напоминающая табличный календарь, в котором все воскресения расположены в одной колонке, нее понедельники — в другой и т.д., а все дни одной недели располагаются в одном горизонтальном ряду. [c.124]
Эта убедительная логичность развития мысли о непрерывном ряде и рождает легенды. Рассудок бунтует против того иррационального пути, которым шел Д. И. Менделеев в создании Периодической системы. Его первая таблица содержала объективной информации не более чем таблица Д. Ньюлендса. И увидел он в ней то же, что и Ньюлендс — повторяемость. Однако Менделеев превзошел соперника в логичности и широте мышления. Чтобы найти, — писал он, — надо не только глядеть и глядеть внимательно, но и знать, и знать многое, чтобы знать, куда глядеть . Он даже в этой несовершенной системе увидел то, что скрыто от глаз рядового ученого, и решился на теоретические обобщения и прогнозы. Приведу их полностью [c.54]
Чтобы найти, — писал он, — надо не только глядеть и глядеть внимательно, но и знать, и знать многое, чтобы знать, куда глядеть . Он даже в этой несовершенной системе увидел то, что скрыто от глаз рядового ученого, и решился на теоретические обобщения и прогнозы. Приведу их полностью [c.54]
Ученые, которые с недоверием относились к системе Д. И. Менделеева, пытались истолковать открытие инертных газов как удар по Периодической системе. В действительности же, эти элементы не только нашли свое место в системе, но и логически дополнили ее, заняв место между типическими металлами и типическими неметаллами (галогенами). Для них Менделеев вводит отдельную нулевую группу, которую помещает в левой части таблицы перед первой. Позже она была совмещена с 8-й группой и велся длительный спор об их альтернативности. (Как будет показано позже, спор этот был безосновательным). Компромиссно остановились на 8-й группе. В современных таблицах нулевая группа отсутствует. Считается, что проблема решена окончательно. Но это мнение ошибочно, и мы еще вернемся к данному вопросу. [c.71]
Но это мнение ошибочно, и мы еще вернемся к данному вопросу. [c.71]
Периодический закон был создан на основе анализа макроскопических свойств элементов и их соединений. Менделеев полагал, что периодический закон является отражением глубоких закономерностей строения веш,ества. Выражением периодического закона служит таблица, наглядно отражающая эти закономерности и получившая название периодической системы элементов Д. И. Менделеева. [c.22]
Развитие химии в период творческой деятельности Д. И. Менделеева привело ученого к выводу, что свойства химических элементов определяются их атомной массой, т. е. величиной, характеризующей относительную массу атома. Поэтому в основу систематики элементов он положил именно атомный вес, как фактор, от которого зависят физические и химические свойства элементов. Д. И. Менделеев сформулировал периодический закон так свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов . Вслед за открытием закона Д. И. Менделеев опубликовал периодическую систему элементов, в которой вертикальные ряды сходных элементов назвал группами, а горизонтальные ряды, в пределах которых закономерно изменяются свойства элементов от типичного металла до типичного неметалла,— периодами. Современная периодическая система химических элементов Д. И. Менделеева состоит из семи периодов и восьми групп и содержит 105 элементов. Порядковый номер элемента в периодической системе не только определяет его положение в таблице, но и отражает важнейшее свойство атомов — величину заряда их ядер. Поэтому периодический закон Д. И. Менделеева в настоящее время формулируется так свойства элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от заряда ядер атомов элементов. [c.43]
Вслед за открытием закона Д. И. Менделеев опубликовал периодическую систему элементов, в которой вертикальные ряды сходных элементов назвал группами, а горизонтальные ряды, в пределах которых закономерно изменяются свойства элементов от типичного металла до типичного неметалла,— периодами. Современная периодическая система химических элементов Д. И. Менделеева состоит из семи периодов и восьми групп и содержит 105 элементов. Порядковый номер элемента в периодической системе не только определяет его положение в таблице, но и отражает важнейшее свойство атомов — величину заряда их ядер. Поэтому периодический закон Д. И. Менделеева в настоящее время формулируется так свойства элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от заряда ядер атомов элементов. [c.43]
Для иллюстрации в табл. 1.8 сопоставлены современные данные и величины атомных весов, которые фигурировали в знаменитом менделеевском Опыте системы элементов, основанной на их атомном весе и химическом сродстве (отдельное издание от 1 марта 1869 г. [18, с. 9]. В таблицу включены все РЗЭ, которые Менделеев принимал во внимание при составлении первых вариантов периодической системы. [c.83]
[18, с. 9]. В таблицу включены все РЗЭ, которые Менделеев принимал во внимание при составлении первых вариантов периодической системы. [c.83]
В свое время периодическая система элементов сыграла выдающуюся роль в предсказании еще не открытых элементов и их свойств. Например, сам Менделеев предсказал существование германия за 19 лет до открытия этого элемента, и его свойства действительно оказались в замечательном согласии с предсказанными. На сегодняшний день все пробелы в периодической таблице заполнены, так что порядковые номера элементов образуют непрерывный ряд, но она позволяет предсказывать свойства еще не- [c.105]
Д. И. Менделеев предвидел будущее открытие элемента с порядковым номером 72. Но описать его свойства с той же обстоятельностью, как свойства тоже еще не открытых скандия, германия и галлия, Менделеев не мог. Стройность периодической системы необъяснимо нарушали лантан и следующие за ним элементы. Позже Богуслав Браунер, выдающийся чешский химик, друг и сподвижник Менделеева, предложил выделить 14 лантаноидов в самостоятельный ряд, а в основном тексте таблицы поместить их все в клетку лантана.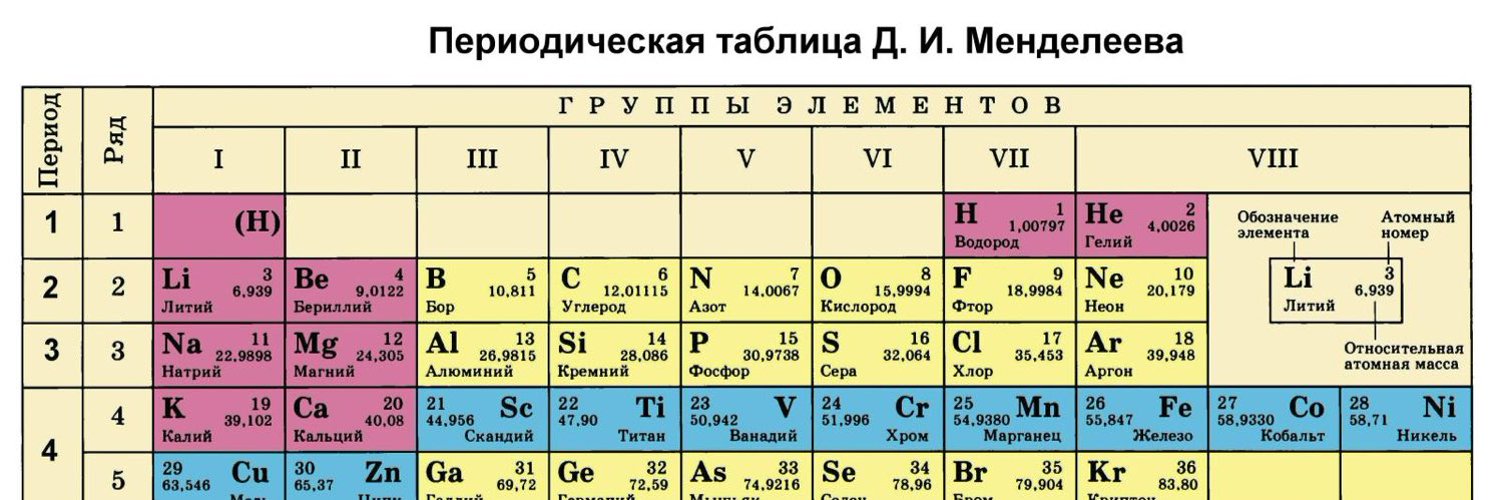 В 1907 г. был открыт самый тяжелый лантаноид — лютеций. Впрочем, уверенности в том, что [c.161]
В 1907 г. был открыт самый тяжелый лантаноид — лютеций. Впрочем, уверенности в том, что [c.161]
В 1869 г. русский ученый Д. И. Менделеев составил таблицу, включающую большинство известных элементов, в которой элементы были сгруппированы в нескольких горизонтальных рядах так, что вертикальные столбцы включали элементы, сходные по химическим свойствам. Эта таблица, которую Менделеев назвал системой элементов, сегодня называется Периодической системой химических злементов (ее современный вид приведен на переднем форзаце). Кроме того, им был открыт и сформулирован фундаментальный закон природы — закон периодичности . Это основной химический закон, который называется Периодическим законом. [c.100]
В пятом ряду таблицы после лантана следуют 14 элементов, называемых лантаноидами. Они сходны по свойствам с лантаном и редко встречаются в природе. Менделеев дал им название редкоземельных. В современной периодической системе эти элементы помещают внизу таблицы, отмечая звездочкой их положение в клетке лантана.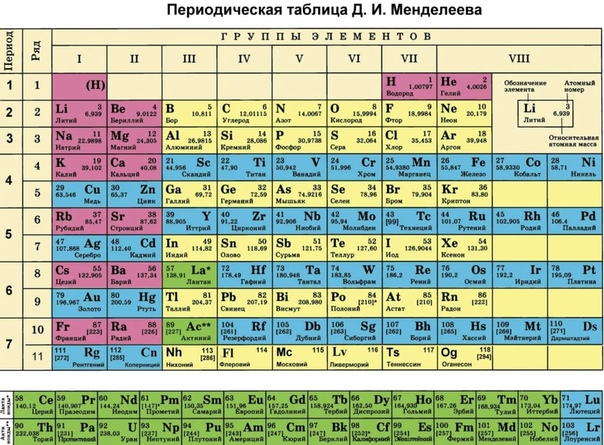 [c.43]
[c.43]
При создании периодической таблицы Менделеев поставил теллур и соседний с ним йод (так же, как впоследствии аргон и калий) в VI и VII группы не в соответствии, а вопреки их атомным весам. Действительно, атомный вес теллура — 127,61, а йода — 126,91. Значит, йод должен был бы стоять не за теллуром, а впереди него. Менделеев, однако, не сомневался в правильности своих рассуждений, так как считал, что атомные веса этих элементов определены недостаточно точно. Близкий друг Менделеева чешский химик Богуслав Браунер тщательно проверил атомные веса теллура и йода, но его данные совпали с прежними. Правомерность исключений, подтверждающих правило, была установлена лишь тогда, когда в основу периодической системы легли не атомные веса, а заряды ядер, когда стал известен изотопный состав обоих элементов. У теллура, в отличие от йода, преобладают тяжелые изотопы. [c.23]
Степень сходства между элементами имеет несколько градаций, которыми обусловлена специфичность каждого места в системе. Задача состоит в том, чтобы графически изобразить по возможности главные черты п оттенки в соотношении и переходах между элементами. С этой точки зрения первоначальная таблица оказалась слишком неопределённой и вместе с тем негибкой, одеревенелой, а потому огрубляющей реальные связи между элементахмп. Расположение элемеитов ка кдого периода в один ряд не соответствовало реальному содержанию понятия место элемента в системе . В целом лестничная форма таблицы недостаточно полно и наглядно выража.ла многие существенные стороны периодической системы. Поэтому Менделеев, хотя и удерживал её, но придавал ей явно второстепенное значение. Главное же внимание у ке с первого издания Основ хилгаи он перенёс на короткую таблицу. Её можно назвать также восъмиклеточной, так как каждый ряд в ней разбпт на 8 клеток. [c.172]
Задача состоит в том, чтобы графически изобразить по возможности главные черты п оттенки в соотношении и переходах между элементами. С этой точки зрения первоначальная таблица оказалась слишком неопределённой и вместе с тем негибкой, одеревенелой, а потому огрубляющей реальные связи между элементахмп. Расположение элемеитов ка кдого периода в один ряд не соответствовало реальному содержанию понятия место элемента в системе . В целом лестничная форма таблицы недостаточно полно и наглядно выража.ла многие существенные стороны периодической системы. Поэтому Менделеев, хотя и удерживал её, но придавал ей явно второстепенное значение. Главное же внимание у ке с первого издания Основ хилгаи он перенёс на короткую таблицу. Её можно назвать также восъмиклеточной, так как каждый ряд в ней разбпт на 8 клеток. [c.172]
Таблицы периодической системы. На основании открытого им периодического закона Менделеев составил периодическую систему элементов. Он разбил весь ряд элементов на отдельные отрезки, внутри которых начинается и заканчивается периодическое изменение свойств, и расположил эти отрезки один под другим.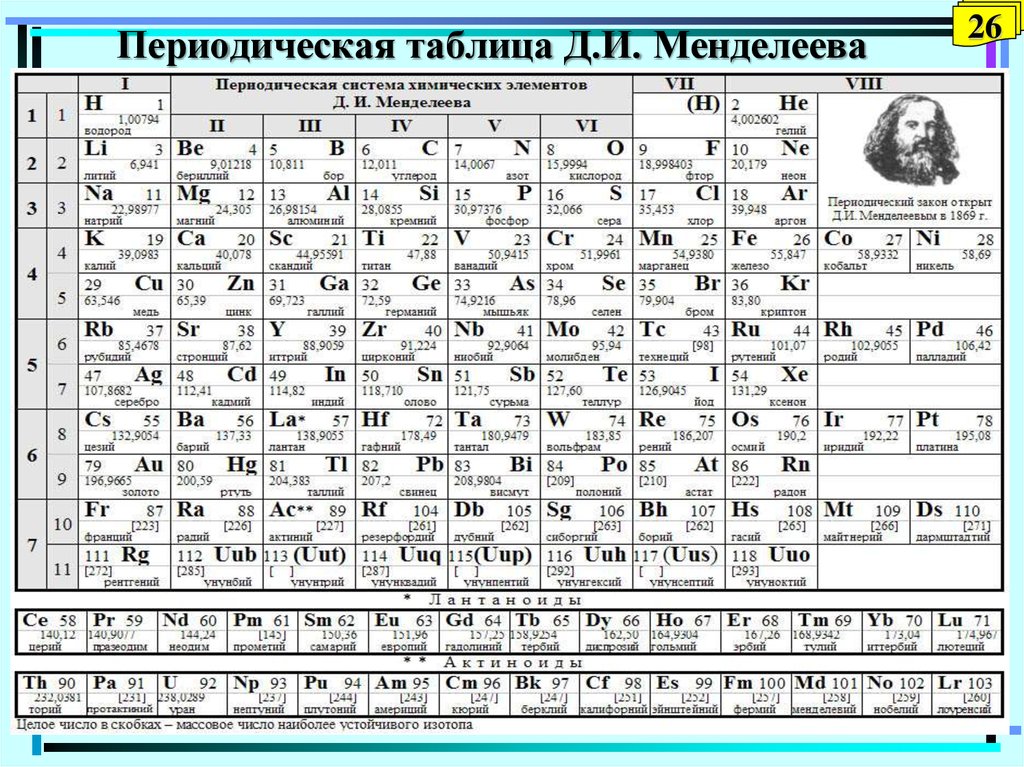 Как известно, таблица Менделеева в ее так называемой коротко-пернодной форме (табл. 2 на первом форзаце книги) подразделяется на семь горизонтальных периодов и восемь вертикальных групи. [c.36]
Как известно, таблица Менделеева в ее так называемой коротко-пернодной форме (табл. 2 на первом форзаце книги) подразделяется на семь горизонтальных периодов и восемь вертикальных групи. [c.36]
В этом первоначальном варианте таблицы многое было неясно, требовало уточнений и изменений. На протяжении 37 лет.Менделеев продолжает дальнейшую творческую разработку периодической системы элементов. В V111 издании Основ химии был помещен следующий вариант системы, который следует рассматривать как итог работы Менделеева в развитии периодического закона (табл. 25). [c.79]
В то время, когда Менделеев на основе открытого им периодического закона составлял свою таблицу, многие элементы были еще неизвестны. Так, был неизвестен элемент четвертого периода скандий. По атомной массе вслед за кальцием шел титан, но титан нельзя было поставить сразу после кальция, так как он попал бы в третью группу, тогда как титан образует высший оксид Т10г, да и по другим свойствам должен быть отнесен к четвертой группе. Поэтому Менделеев пропустил одну клетку, т. е. оставил свободное место между кальцием и титаном. На том же основании в четвертом периоде между цинком и мышьяком были оставлены две свободные клетки, занятые теперь элементами галлием и германием. Свободные места остались и в других рядах. Менделеев был не только убежден, что должны существовать неизвестные еще элементы, которые заполнят эти места, но и заранее предсказал свойства таких элементов, основываясь на их положении среди других элементов периодической системы. Одному из них, которому в будущем предстояло занять место между кальцием и титаном, он дал название экабор (так как свойства его должны были напоминать бор) два других, для которых в таблице остались свободные места между цинком и мышьяком, были названы экаалюминием и экасилицием. [c.76]
Поэтому Менделеев пропустил одну клетку, т. е. оставил свободное место между кальцием и титаном. На том же основании в четвертом периоде между цинком и мышьяком были оставлены две свободные клетки, занятые теперь элементами галлием и германием. Свободные места остались и в других рядах. Менделеев был не только убежден, что должны существовать неизвестные еще элементы, которые заполнят эти места, но и заранее предсказал свойства таких элементов, основываясь на их положении среди других элементов периодической системы. Одному из них, которому в будущем предстояло занять место между кальцием и титаном, он дал название экабор (так как свойства его должны были напоминать бор) два других, для которых в таблице остались свободные места между цинком и мышьяком, были названы экаалюминием и экасилицием. [c.76]
Первоначальный вариант периодической системы Д. И. Менделеева имел длинную форму. (На втором форзаце книги этот вариант приведен в современном оформлении.) В декабре 1870 г. Д. И. Менделеев опубликовал короткую форму периодической системы. (На первом форзаце книги приведен вариант короткой формы таблицы.) Д. И. Менделеев отдавал преимущество короткому варианту. До настоящего времени продолжают поступать предложения о новых вариантах таблицы периодической системы элементов. Их известно уже несколько сотен. Но наилучшими из них, четко и глубоко передающими периодический закон, остаются вариагньг Д. И. Менделеева. [c.75]
Наиболее иоздиее по времени указание Менделеева по проблеме РЗЭ мы находим в примечании к периодической таблице в восьмом (последнем прижизненном) издании Основ химии , тщательно отредактированном самим автором. Менделеев дает следующую итоговую оценку проблемы РЗЭ Между Ge=140 и Та=183 недостает целого большого периода, ио ряд редких элементов (изучение их не полно) например, Рг=141, Nd=144, Sm=150, Eu = 152, Gd = 160, Но=165 Ег=166, Tu=I71 и Yb=173 представляет, по современным сведениям вес атома, как раз восполняющий этот промежуток, потому в указан ном месте периодическая система элементов представляет собой сво го рода разрыв, требующий новых изысканий [18, с. 367]. [c.90]
Одним из основных принципов, которым руководствавался Д. И. Менделеев при построении периодической системы, было предоставление каждому химическому элементу собственной клетки в таблице. Однако при размещении в периодической системе элементов середин больших приодов он отступил от этого правила и поместил в каждой клетке по три элемента. Основанием для такого объединения было большое сходство авойств элементов, имеющих близкие атомные массы. Возникло три триады — железа, палладия, платины. Расположение в одной клетке периодической системы нескольких элементов, сходных по свойствам, в дальнейшем нашло развитие ученик и последователь Менделеева Богуслав Браунер (долгое время был профессором Пражского университета) разместил все спутники церия (по Менделееву) в одной клетке периодической системы вместе с церием, подчеркнув тем самым близость химических свойств этих элементов [1]. Впоследствии все РЗЭ, следующие за церие.м (и сам церий) стали помещать в одной клетке периодической системы вместе с лантаном (лантаниды) то же относится и к актинидам (см. с. 86—230). [c.110]
Оболочечная структура электронных состояний атомов, следуюшая из законов движения электронов, объясненных квантовой механикой, была в некоторой степени предугадана замечательным русским химиком Менделеевым в 1868 г., т. е. задолго до появления квантовой механики, Менделеев открыл периодический закон химических элементов, который он выразил в виде таблицы апериодической системы элементов по группам и рядам . Периодическая система элементов Менделеева состоит из десяти горизонтальных рядов, которые составляют семь периодов, и девяти групп (вертикальных столбцов), в которых один под другим расположены сходные между собой элементы. Первоначальная таблица Менделеева содержала только восемь групп, так как инертные газы в то время не были еше известны. Произведенное Менделеевым размещение элементов в периодической системе оказалось полностью отражающим строение атомов, найденное современной квантовой механикой. Каждому периоду системы элементов Менделеева соответствует одна электронная оболочка в атоме. [c.361]
Когда Менделеев составлял свою таблицу на основании открытого им периодического закона, многие элементы не были известны. Руководствуясь рядом соображенТ1Й, Менделеев пришел к выводу, что в природе должны существовать еще неизвестные элементы, и оставил для них в периодической системе пустые места. Он предсказал свойства трех таких элементов на основании их положения среди других элементов в таблице. Одному из них Менделеев дал название экабор, так как этот элемент, по мнению Менделеева, должен был походить по свойствам на бор. Два другие были названы экаалюминием и экасилицием. Еще при жизни Менделеева эти три элемента были открыты. Первым был открыт галлий его свойства оказались такими, какие были предсказаны для экаалюминия. Затем был открыт скандий, обладающий свойствами экабора, и, наконец, германий, имеющий свойства, предсказанные для экаси-лиция. [c.46]
Приведенньщув табл. 2 приложения способ представления периодической системы, при котором элементы больших периодов подразделяются на два ряда и, следовательно, горизонтальное протяжение таблицы определяется длиной малых (коротких) периодов, называется короткопериодной формой в противоположность длиннопериодной форме, когда элементы больших (длинных) периодов располагаются в один непрерывный ряд. В этом случае приходится соответственно раздвигать малые периоды. Уже Менделеев наряду с короткопериодной применял также и длиннопериодную форму. В табл. 1 периодической системе придан тот вид (с добавлением открытых с тех пор элементов), который близок применявшемуся Менделеевым. [c.23]
Периодическая система элементов Менделеева. Д. И. Менделеев, основываясь на законе периодичности, расположил известные в то время элементы в таблицу по группам и рядам. Эта таблица получила название аериодической системы элементов Менделеева. Пополненная современными данными, таблица приведена на стр. 194—195. [c.193]
1.3. Таблица Менделеева – Азбука химии
[МУЗЫКА] [МУЗЫКА] [МУЗЫКА] Я думаю, что если у десяти случайных прохожих спросить, с чем у них ассоциируется химия, то девять однозначно ответят: с периодической системой Дмитрия Ивановича Менделеева. Давайте познакомимся с этой таблицей подробнее. Итак, сейчас известно 118 элементов, и все они имеют свои названия. Последние элементы получили названия в конце 2016 года. Все элементы расположены в периодической системе в порядке возрастания заряда ядра. Однако Менделеев изначально располагал элементы в порядке возрастания атомных масс элементов. Однако уже при жизни Менделеева были открыты инертные газы, которые не имели в первоначальном варианте таблицы своего положения. Эту проблему очень легко разрешил Дмитрий Иванович: он сказал, что необходимо добавить еще одну группу и пошел на нарушение своего собственного принципа — он расположил аргон, имеющего атомную массу 40, перед калием, у которого атомная масса 39. Дело в том, что Менделеев ориентировался не только на атомный вес, но также еще и на сходство химических свойств. Как же устроена периодическая система? Мы ее называем периодической, поскольку в ней есть периоды. Период — это последовательность химических элементов по возрастанию заряда ядра их атома, в которых происходит заполнение внешних электронных оболочек. Существуют два варианта периодической системы в зависимости от того, как изображены периоды. Длинный периодный вариант, рекомендованный IUPAC, в нем все элементы одного периода располагаются в одну строчку. Или короткопериодный вариант — этот вариант особенно популярен на территории России. В этом варианте один период может записываться в две строки. Такая табличка получается более компактной и в чем-то даже более удобной для использования. Кроме того, в периодической системе есть еще и группы. Группы — это тоже последовательность атомов по возрастанию заряда ядра, однако эти атомы обладают однотипным электронным строением. То есть в них происходит заполнение однотипных атомных орбиталей. В короткопериодном варианте периодической системы группы дополнительно разделяются на главную и побочную подгруппу. Дело в том, что в главной подгруппе заполняются только s- или p-электроны, а в побочных подгруппах также d-электроны. Некоторые группы элементов имеют собственные групповые названия. Так, первая A группа, то есть главная подгруппа первой группы периодической системы, или просто первая в длиннопериодном варианте периодической таблицы, имеет название «Щелочные металлы». Там расположены элементы металлы, которые могут образовывать сильные основания — щелочи. Вторая A группа, то есть главная подгруппа второй группы, — это щелочно-земельные элементы. Пятая A группа, или 15-я группа в длиннопериодном варианте, — это элементы пниктогены. Однако такое название редко используется. Шестая A группа, или 16-я группа в длиннопериодном варианте — это элементы халькогены, то есть рождающие руду. Седьмая A группа — галогены, то есть рождающие соли. И наконец восьмая A группа — это инертные, или благородные, газы. Помимо разделения элементов на группы и периоды, можно выделять еще и отдельные семейства элементов. Самым естественным разделением элементов на семейства является разделение их по электронному строению. Так, можно выделить электронное семейство s-элементов, p-элементов, d-элементов и f-элементов. Особенно ярко они появляются в длиннопериодном варианте таблицы, потому что здесь эти элементы занимают отдельные прямоугольные блоки. В короткопериодном варианте эти элементы начинают пересекаться, однако при определенной сноровке и тренировке вы сможете легко отличить s- и p-элементы от d-элементов в периодической системе в короткопериодной ее форме. По общности химических свойств часто объединяют некоторые и другие элементы. Например, выделяют триаду железа, которая содержит железо, кобальт и никель. И платиновые металлы: рутений, родий, палладий, осмий, иридий и платина. Если к ним добавить серебро и золото, то такое семейство можно назвать благородные металлы. Переходными металлами называют d-элементы за исключением последних d-элементов. Всего можно выделить несколько переходных рядов. Первый переходный ряд — это элементы от скандия до меди, а второй — от иттрия до серебра, третий — от лантана до золота. Это обусловлено тем, что у них некоторые особые свойства, которые отличают их от свойств непереходных элементов. С этими свойствами мы будем знакомиться в нашем курсе. Наконец можно выделить трансурановые элементы. Общим для них является то, что это искусственные элементы. Они все сильно радиоактивны и крайне неустойчивы. Как же связано строение атома в его положением в периодической системе? Химические элементы расположены в таблице не хаотично, а в строгом соответствии со строением их атомов. Так, количество электронных уровней определяет номер периода, а количество электронов на валентных подуровнях определяет номер группы. Последний по правилам заполнения электрон определяет принадлежность элемента к определенному электронному семейству. Давайте проиллюстрируем эти правила на нескольких примерах. Возьмем, например, натрий: это 11-й по счету элемент. Всего в электронной оболочке атомов натрия три электронных уровня, поэтому натрий расположен в третьем периоде. Его электронная конфигурация 1s2 2s2 2p6 3s1. На внешнем электронном слое один электрон, 3s1 — внешний электронный слой. Поэтому натрий расположен в первой группе. Этот электрон относится к s-электронам, поэтому натрий относится к s-электронному семейству элементов. Это щелочной металл. Кислород — это восьмой по счету элемент. Его электронная конфигурация — 1s2 2s2 2p4. Всего два электронных уровня, поэтому кислород располагается во втором периоде. На внешнем слое у кислорода шесть электронов 2s2 2p4, поэтому кислород принадлежит к шестой группе элементов. И последний по правилам заполнения электрон — это p-электрон, поэтому кислород относится к p-электронному семейству элементов. Железо. Железо расположено в четвертом периоде. Его электронная конфигурация (я назову ее в краткой форме): это [Ar] 4s2 3d6. Всего у железа четыре электронных уровня, на которых есть электроны, поэтому железо находится в четвертом периоде. На внешнем электронном слое восемь электронов 4s2 3d6, поэтому железо находится в восьмой группе. Ну и последний по правилам заполнения электрон — это d-электрон, поэтому и железо тоже — d-элемент. Дмитрий Иванович Менделеев сформулировал свой закон следующим образом: «Свойства простых тел, а также формы и свойства соединения элементов, а потому и свойства образуемых или простых и сложных тел стоят в периодической зависимости от их атомного веса». Пользуясь этим законом, Дмитрий Иванович Менделеев предсказал свойства неизвестных на тот момент элементов. Эти элементы — некоторые из них — были открыты уже при жизни самого Дмитрия Ивановича Менделеева, которые подтвердили верность его закона. Именно это отличает открытие Дмитрия Ивановича Менделеева от попыток других многочисленных ученых систематизировать химические элементы. Однако, конечно, в XX веке ученым удалось раскрыть строение атома, и в этот периодический закон пришлось внести одну, но очень важную, существенную корректировку. Все-таки свойства простых тел, а также формы и свойства соединения элементов находятся в периодической зависимости не от атомного веса, а от заряда ядер атомов химических элементов. Какие же свойства находятся в такой периодической зависимости? Давайте разберем некоторые из них. Одно из главнейших свойств — это радиус атомов элементов. Радиус атомов увеличивается в группах и уменьшается в периодах. Уменьшение радиуса атомов в периодах связано с тем, что количество энергетических уровней не изменяется, тогда как заряд ядра возрастает. Это означает, что внешние электроны начинают с большей силой притягиваться к ядру, и поэтому радиус атома уменьшается, а в группах происходит нарастание количества энергетических уровней. Мы помним, что номер энергетического уровня, то есть главное квантовое число, связано с размером атомной орбитали: чем больше номер, тем больше размер. Поэтому в группах радиус атомов увеличивается. Очень важное свойство химических элементов — это электроотрицательность, то есть способность атомов химических элементов притягивать к себе свои собственные электроны, а также электроны химических связей. Наибольшей электроотрицательностью обладает атом фтора, а наименьшей — цезий и рубидий. Электроотрицательность увеличивается в периодах и уменьшается в группах. Способность атомов притягивать к себе электроны обуславливает их многие химические свойства. Так, элементы-галогенам, которым недостает до заполнения своей электронной конфигурации всего лишь одного электрона, то есть до получения ими электронной конфигурации инертного газа, обладают высокой электроотрицательностью, высокой способностью притянуть к себе еще один хотя бы электрончик. А вот щелочным металлам гораздо проще избавиться от своего единственного электрона, чтобы принять очень устойчивую электронную конфигурацию инертного газа. Поэтому у щелочных газов наименьшая электроотрицательность. Другие важные свойства — это металлические и неметаллические свойства. Металлические, или восстановительные, свойства возрастают в группах и уменьшаются в периодах. Это означает, что наиболее выраженными металлическими свойствами обладают элементы, расположенные в левом нижнем углу периодической системы. А вот, напротив, неметаллические, или окислительные, свойства возрастают в периодах и уменьшаются в группах. Это означает, что наиболее характерные элементы-неметаллы расположены в правой верхней части периодической системы. Можно провести условную диагональ металличности/неметалличности в периодической системе. Тогда выше этой диагонали будут расположены элементы-неметаллы, а ниже — элементы-металлы. Вдоль такой диагонали будут расположены амфотерные элементы. Поэтому такую диагональ часто называют диагональ амфотерности. Итак, как же реагируют элементы друг с другом? Они вступают во взаимодействие, которое непременно приводит к тому, что электроны, принадлежащие атомам, становятся общими электронами. В этом заключается основной принцип образования химических связей. Давайте рассмотрим это в следующей лекции.
Международный год периодической таблицы: 150-летие гениального творения Дмитрия Менделеева (Newsweek, США) | Общество | ИноСМИ
Почти в каждой химической лаборатории на нас со стен смотрит периодическая таблица химических элементов. Ее создание, как правило, ставят в заслугу русскому химику Дмитрию Менделееву, который в 1869 году выписал известные элементы (которых в то время было 63) на карточки, а затем расположил их по столбцам и строкам в соответствии с их химическими и физическими свойствами. В ознаменование 150-летия этого поворотного момента в науке ООН провозгласила 2019 год Международным годом периодической таблицы химических элементов.
Но на самом деле периодическая таблица началась не с Менделеева. Расположить химические элементы в определенном порядке пытались многие. За несколько десятков лет до этого химик Джон Далтон (John Dalton) попытался упорядочить элементы в таблицу, а также придумать для них некоторые довольно интересные символы (они не «прижились»). И всего за несколько лет до того, как Менделеев взялся за дело со своей колодой самодельных карточек, Джон Ньюлендс (John Newlands) также создал таблицу, распределив элементы в соответствии с их свойствами.
Vesti.lvMainichi ShimbunGazeta WyborczaГениальность Менделеева заключалась в том, что кое-какие элементы он просто не включил в свою таблицу. Он понимал, что некоторых элементов не хватает, но они будут открыты. Поэтому там, где Далтон, Ньюлендс и другие включили в таблицы то, что было известно, Менделеев оставил место для неизвестного. Еще более удивительно, что он точно предсказал свойства недостающих элементов.Вы обратили внимание на вопросительные знаки в первоначальной таблице Менделеева? Например, рядом с символом Al (алюминий) есть пустая клетка для неизвестного металла. Менделеев предсказал, что у него будет атомная масса 68, плотность шесть граммов на кубический сантиметр и очень низкая температура плавления. Шесть лет спустя Поль Эмиль Лекок де Буабодран (Paul Émile Lecoq de Boisbaudran) открыл галлий и, конечно же, вписал его в таблицу прямо в свободную клетку с атомной массой 69,7, плотностью 5,9 г/см3 и температурой плавления настолько низкой, что он становится жидким в руке. Такие же пустые клетки в таблице Менделеев оставил для скандия, германия и технеция (который был открыт лишь в 1937 году, через 30 лет после его смерти).
На первый взгляд таблица Менделеева не очень похожа на ту, с которой мы знакомы. Во-первых, в современной таблице есть множество элементов, которые Менделеев упустил из виду (и не смог оставить для них пустые клетки) — прежде всего речь идет о благородных, инертных, газах (таких как гелий, неон, аргон). Кроме того, таблица устроена не так, как наш современный вариант этой системы, элементы в которой мы теперь располагаем в виде двухмерной таблицы — столбцов и строк.
Но как только вы развернете таблицу Менделеева на 90 градусов, становится очевидным ее сходство с современным вариантом. Например, галогены — фтор (F), хлор (Cl), бром (Br) и йод (I) (в таблице Менделеева обозначено символом J) — все оказываются рядом друг с другом. Сегодня они расположены в 17-м столбце таблицы (или 17-й группе, как предпочитают называть его химики). Переход от этого варианта к знакомой схеме может показаться незначительным, но спустя годы после публикаций Менделеева было много экспериментов с альтернативными вариантами расположения элементов. Еще до того, как таблица приобрела свой постоянный вид с разворотом под прямым углом, люди предлагали целый ряд странных и замечательных конфигураций.
Одним особенно ярким примером является опубликованная в 1870 году спиральная система элементов Генриха Баумгауера (Heinrich Baumhauer), в центре которой расположен водород, а элементы в порядке увеличения их атомной массы расположены от центра по спирали. Элементы, попадающие на каждый из радиусов спирали, имеют общие свойства, как и элементы столбца (группы) в современной таблице. Была и довольно странная «гантелеобразная» конфигурация периодической системы, предложенная в 1892 году Генри Бассетом (Henry Basset).
И все же к началу XX века таблица приняла знакомую нам горизонтальную форму, и ее вариант, предложенный в 1905 году Генрихом Вернером (Heinrich Werner), выглядел на удивление современно. Впервые инертные газы оказались в своем (знакомом сегодня) положении на правом краю таблицы. Вернер также попытался последовать примеру Менделеева, оставив пробелы, хотя он довольно переусердствовал с предположениями об элементах легче водорода и еще одном элементе, который должен был занять место между водородом и гелием (ни одного из них не существует). Несмотря на этот довольно современный вид таблицы, предпринимались дальнейшие попытки изменить ее конфигурацию.
Особенно авторитетным был вариант, предложенный Шарлем Жанетом (Charles Janet). К составлению таблицы он подошел с точки зрения физики и, используя недавно открытую квантовую теорию, создал вариант расположения элементов, основанный на электронных конфигурациях. Многие физики по-прежнему предпочитают созданную им «левостороннюю» таблицу. Интересно, что Жанет тоже оставил свободные клетки для элементов — вплоть до 120, несмотря на то, что в то время было известно только 92 элемента (сегодня нам известно лишь 118).
Современная таблица фактически представляет собой непосредственную доработку варианта, предложенного Жанетом. Щелочные металлы (группа, на первом месте в которой находится литий) и щелочноземельные металлы (группа, начинающаяся с бериллия) были перенесены с крайней правой стороны на левый край таблицы, в результате чего получилась периодическая таблица очень широкая по виду (длиннопериодная форма). Проблема с таблицей такой конфигурации заключается в том, что она не помещается на странице или плакате, поэтому — в основном по эстетическим причинам — элементы f-блока обычно выносятся за пределы основной таблицы и помещаются под ней. Именно так и появился вариант признаваемой сегодня периодической таблицы. Это не значит, что люди не пытаются создать другие конфигурации таблицы, зачастую пытаясь продемонстрировать взаимосвязи между элементами, которые не являются очевидными в обычной таблице. Существуют буквально сотни вариантов таблицы (посмотрите базу данных Марка Лича), среди которых особенно популярны спиральные и трехмерные конфигурации, не говоря уже о более шутливых вариантах.
А как насчет приведенного ниже моего собственного варианта, в котором объединены два традиционных изображения — таблица Менделеева и схема лондонского метро Генри Бека (Henry Beck)? Или головокружительный набор имитаций, цель которых — придать ощущение научности при классификации чего бы то ни было — от пива до диснеевских персонажей, а также моей любимой «иррациональной чепухи». Все это показывает, как периодическая таблица элементов стала традиционным, культовым символом науки.
Материалы ИноСМИ содержат оценки исключительно зарубежных СМИ и не отражают позицию редакции ИноСМИ.
предшественники, последователи, а также другие мистические события
На состоявшемся недавно торжественном открытии Года Периодическая таблица элементов Президент Российской академии наук Александр Сергеев отметил: «Несмотря на то, что в мире Периодическую таблицу не принято называть по имени российского ученого, в речи генерального секретаря ЮНЕСКО было четко сказано, что это – таблица Менделеева ». Для присутствовавшего на торжестве премьер-министра РФ Дмитрия Медведева информация о замалчивании за рубежом имени Менделеева как создателя Периодической таблицы неожиданной.«Мне и в голову не приходило, что в мире», – сказал, чтобы решить этот вопрос: «У нас не слишком много таких достижений и нужно постараться это все зафиксировать».
А все-таки, почему на Западе некоторые ученые (а также журналисты и политика, очевидно!) Не связывают с именем Менделеева Периодическую таблицу и отчего даже в знаменательный год ее 150-летия то и дело всплывают другие даты открытия основополагающего химического закона?
Первооткрыватели или предшественники?
Во многих странах Европы, в Штатах Америки и в Канаде системы Менделеева чаще всего называют просто «Периодическая таблица», а ее вовсе не упоминают.В этих государствах официально не признают тот факт, что данное открытие первым сделал именно русский ученый. Одни уверены в том, что до Менделеева это совершали и другие химики. Вторые утверждают, что русский ученый создал свою систему на предыдущих исследованиях зарубежных исследователей.
ведь и Дмитрий Иванович всегда утверждал, что его Периодическая система – плод 20-летних раздумий и изысканий с опорой на многочисленные труды исследователей многих стран!
В 1668 г.выдающим ирландским химиком, физиком и богословом Робертом Бойлем была опубликована книга, в которой было развенчано немало мифов об алхимии и в которой он рассуждал о необходимости поиска неразложимых химических элементов. Ученый привел их список, состоящий всего из 15 элементов, но допускал мысль о том, что могут быть еще элементы. Это стало отправной точкой не только в поиске новых элементов, но и в их систематизации.
Сто лет спустя французским химиком Антуаном Лавуазье был составлен новый перечень, в который входили уже 35 элементов.23 из них позже были признаны неразложимыми.
В начале 1864 г. Ассистент химика в Королевском сельскохозяйственном обществе Джон Ньюлендс прочел анонимную статью, автор утверждал, что атомные веса элементов с большей или меньшей точностью кратны восьми. Мнение анонимного автора было ошибочным, однако Ньюлендс решил продолжить исследования в области, составив таблицу, в этой расположил все известные элементы в порядке увеличения их атомных весов.В статье, датированной 20 августа 1864 г., он сход, что в этом ряду наблюдается периодическое появление химически элементов. Пронумеровав элементы (элементы, имеющие одинаковый вес, имели и один и тот же номер) и сопоставив номера со свойствами элементов, Ньюлендс сделал вывод: «Разность в номерах наименьшего члена группы и следующего за ним равна семи; говоря, восьмой элемент, начиная с данного элемента, является своего рода повторением первого, аналогичной ноте октавы в музыке… ».Тем самым им впервые была высказана идея периода о типичности изменений свойств элементов.
Спустя год, 18 августа 1865 г., Ньюлендс опубликовал новую таблицу, назвав ее «законом октав», который формулировался следующим образом: «Аналогичные элементы, как правило, отличаются или на целое число семь, или на кратное семь; Другими словами, члены одной и той же группы соотносятся друг с другом в том же отношении, как и крайние точки одной или больше октав в музыке ». Попытки нахождения всякого рода закономерностей среди атомных элементов, не привлекли особого внимания.1 марта 1866 г. Ньюлендс сделал доклад «Закон октав и причины химических веществ среди атомных весов» на Лондонского химического общества, который не вызвал особого интереса. История сохранилась ехидное замечание известного химика Джорджа Фостера: не пробовал ли докладчик располагать элементы в этом-либо порядке их названий и не обнаружил ли при этом каких-либо закономерностей? Доклад так и не был напечатан в журнале химического общества. После этой неудачи Ньюлендс не предпринимал попытку дальнейшей разработки своей систематики.
В 1850–1860-х годах другой английский химик, Уильям Одлинг, предпринял несколько попыток систематизировать химические элементы, методы на их атомном весе и атомности (валентности). Он составил несколько таблиц элементов. В таблице, предложенной им в 1864 г. (не сопровождавшейся, однако, никакими комментариями), видны, по словам Д.И. Менделеева, «начатки периодического закона».
«Земная спираль» (vis tellurique) Александра Шанкуртуа
Французы пытаются отдать пальму первенства своему земляку Александру Эмилю Бегуйе де Шанкуртуа.Еще в 1862 г. этот геолог и химик вывел свою систематизацию химических элементов, основанную на закономерном изменении атомных масс – так называемую «земную спираль» (vis Tellurique), или «цилиндр Бегуйе». Шанкуртуа нанесла на боковую поверхность цилиндра, размеченную на 16 частей, линию под углом 45 °, на которой поместил точки, соответствующие атомным массам элементов. Таким образом, элементы, представленные на одной вертикальной линии, располагались на одной вертикальной линии.При этом точки, отвечающие сходным по свойствам элементам, часто оказываются на одной вертикальной линии.
Систематизация Шанкуртуа явилась существенным шагом вперед по сравнению с существовавшими тогда системами, однако его работа поначалу осталась практически незамеченной. Только после открытия Д.И. Менделеевым Периодического закона французы обратили внимание на работы своего земляка.
В 1864 г. ученый из Германии, Юлиус Лотар Мейер, обнародовал таблицу, содержавшую 28 элементов, размещенные в шесть столбцов согласно их валентностям.Мейер намеренно ограничил число элементов в таблице, чтобы подчеркнуть закономерное изменение атомной массы в ряде сходных элементов. В 1870 г. Мейер опубликовал еще одну работу, где были новые таблицы и график зависимости атомного элемента от атомного веса. Предложенная Мейером в работе «Природа элементов как функция их атомного веса» таблица состояла из девяти вертикальных столбцов, сходные элементы располагались в горизонтальных рядах; некоторые ячейки таблицы Мейер оставил незаполненными.
Интересно, что в 1882 г. и Менделеев, и Мейер получили по Золотым медали «За открытие периодических ресурсов атомных весов». Хотя Менделеев утверждал, что немецкий исследователь «не имел в виду периодического закона» и вообще ничего нового в него не привнес.
Таблица, устремленная в будущее
Поиск новых элементов великих ученых по всему миру. К XIX в. наука обогатилась множеством новых знаний о химических элементах, которых к времени было открыто больше 60-ти.Именно поэтому и возникла потребность в систематизации этих элементов. Фундаментальный Периодический закон и начальную версию своей периодической системы Менделеев создал еще в 1869 г. Однако ученые умы России, да и всего мира, отнеслись к его открытию с некоторым скепсисом. И кто знает, как все бы обернулось, если бы уже через несколько лет Менделеевские открытия не получили подтверждения.
Гениальность Менделеева заключаестя в том, что он НЕ включил в свою таблицу. Он понимал, что некоторых элементов не хватает, но они будут открыты.Поэтому там, где Далтон, Ньюлендс и другие включили в таблицы то, что было известно, Менделеев оставил место для неизвестного. Еще более удивительно, что он точно предсказал свойства недостающих элементов.
В специальной таблице Менделеева рядом с символом Al (алюминий) есть пустая клетка для неизвестного металла. Менделеев предсказал, что у него будет атомная масса 68, плотность 6 г / см 3 и очень низкая температура плавления. Шесть лет спустя Поль Эмиль Лекок де Буабодран открыл галлий и, конечно же, вписал его в таблицу прямо в свободную клетку с атомной массой 69,7, плотностью 5,9 г / см 3 и температурой плавления настолько низкой, что он становится жидким в руке.Такие же пустые клетки в таблице Менделеев оставил для скандия, германия и технеция (который был открыт лишь в 1937 г., через 30 лет после его смерти).
Легенда о сне Менделеева
Многие слышали историю, что Д.И. Менделееву его таблица приснилась. Эта версия активно распространялась соратником Менделеева А.А. Иностранцевым в забавной истории, которой он развлекал своих студентов. Он, что Дмитрий Иванович, лег и во сне отчетливо видел свою таблицу, в которой все химические элементы были расставлены в нужном порядке.После этого студенты даже шутили, таким способом была открыта 40 ° -ная водка. Но реальные предпосылки для истории со сном все же были: как уже упоминалось, Менделеев работал над таблицами без сна и Иностранцев, однажды застал его уставшим и вымотанным. Днем Менделеев решил немного передохнуть, а некоторое время спустя, резко проснулся, сразу же взял листок бумаги и изобразил на нем уже готовую таблицу. Вперед Д.И. Менделеев, якобы, рассказывал своему соратнику: «В течение нескольких недель я спал урывками, пытаясь найти тот магический принцип, который сразу привел бы в порядок всю груду накопленного материала.И вот в одно прекрасное утро, проведя бессонную ночь и отчаявшись найти решение, я, не раздеваясь, прилег на диван в кабинете и заснул. И во сне мне явственно представилась таблица. Я тут же проснулся и набросал увиденную во сне таблицу на первом же подвернувшемся под руку клочке бумаги ».
Однако ни один серьезный исследователь научного творчества Менделеева не утверждал, что ученому во сне привиделась периодическая система химических элементов. Да и Дмитрий Иванович на самом деле никогда этого не утверждал.Более того, сам ученый опровергал историю со сном, говоря: «Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово». Так что легенда о сне может быть и очень привлекательна, но создание таблицы стало возможным только благодаря упорному труду.
Периодическая система химических элементов (таблица Менделеева)
https://ria.ru/201
/1550014194.htmlПериодическая система химических элементов (таблица Менделеева)
Периодическая система химических элементов (таблица Менделеева)
Периодическая система химических элементов элементов – упорядоченное множество химических элементов и их естественная классификация.РИА Новости, 29.01.2019
2019-01-29T04: 51
2019-01-29T04: 51
2019-01-29T04: 51
справки
/ html / head / meta [@ name = ‘og : title ‘] / @ content
/ html / head / meta [@ name =’ og: description ‘] / @ content
https://cdn23.img.ria.ru/images/99408/72/994087230_0: 105: 2000: 1230_1920x0_80_0_0_b528d261d40438ab5524fc6ad7f580a3.jpg
Периодическая система химических элементов – упорядоченное множество химических элементов и их естественная классификация.Является табличным представлением периодического закона, открытого Дмитрием Менделеевым. Современная формулировка этого закона звучит так: свойства элементов находятся в периодической зависимости от заряда их атомных ядер.Прообразом периодической системы химических элементов служит таблица “Опыт системы элементов, основанной на их атомном весе и химическом сходств”, составленная Менделеевым в 1869 году. По мере совершенствования периода этой таблицы развил представления о группах элементов и о месте каждого элемента в системе.В 1871 году в книге “Основы химии” Менделеевым была включена “Естественная система элементов Д. Менделеева” – первая классическая короткая форма Периодической системы химических элементов. Современная Периодическая система химических элементов включает 118 элементов. За последние 50 лет таблицы Менделеева пополнилась семнадцатью новыми элементами (102-118). Девять из них были впервые получены в российском Объединенном ядерных исследованиях в Дубне. Последнее добавление в таблицу Менделеева было сделано в 2016 году, она пополнилась четырьмя элементами 113, 115, 117 и 118 атомными номерами, которые соответственно были названы нихоний (Nh), московий (Mc), теннессин (Ts) и оганесон (Og).Сейчас в системе ядерно-физических элементов, которые назвали “большой гонкой”, что связано с попытками поиска решений некоторых частных проблем ее структуры. Наиболее распространены две табличные формы: короткая и длинная (разработана Дмитрием Менделеевым, усовершенствована в 1905 году Альфредом Вернером). Современная форма Периодической системы химических элементов (в 1989 году Международным порядком теоретической и прикладной химии рекомендована длинная форма таблицы) из семи периодов (горизонтальных последовательностей элементов, установленных по возрастаниюкового номера) и 18 групп (вертикальных последовательностей элементов в соответствии с системой валентных электронов) , а короткая форма таблицы – из восьми групп.Номер группы элементов короткого варианта таблицы Менделеева в системе валентных электронов во внешней электронной оболочке элементов. В длинном варианте таблицы номер группы в большей мере формален. Группы короткого варианта включают основные (а) и побочные (б) подгруппы, в каждой из элементов, входящих в состав, сходные по химическим свойствам. Элементы некоторых групп имеют собственные тривиальные названия: щелочные металлы (группа 1 длинной формы таблицы), щелочноземельные металлы (группа 2), халькогены (группа 16), галогены (группа 17), благородные газы (группа 18).В Периодической системе химических элементов для каждого элемента указывается его символ, название, порядковый номер и значение относительной массы.Первый период содержит два элемента – водород и гелий. Второй и третий периоды (литий – неон; натрий – аргон) содержат по восемь элементов. Четвертый (калий – криптон) и пятый (рубидий – ксенон) периоды содержат по 18 элементов. Шестой период (цезий – радон) содержит 32 элемента и включает особую группу элементов – лантаноиды.Седьмой период (франций – оганесон), элементов шестому, содержит 32 элемента и включает особую группу элементов – актиноиды.Лантаноиды и актиноиды помещены отдельно в нижнюю часть. Периодическая система химических элементов играет и продолжает играть роль в развитии многих естественнонаучных дисциплин. Она стала важным звеном в эволюции атомно-молекулярного учения, способствовала формулировке современного понятия “химический элемент” и уточнению представлений простых веществ и соединений, оказав существенное влияние на разработку теории строения элементов и возникновение понятия изотопии. С периодической системой связана строго научная постановка проблемы прогнозирования в химии, что проявилось как в способах существования неизвестных элементов и их свойств, так и новых возможностей химического поведения уже открытых элементов.Периодическая система – важнейшая основа неорганической химии; она служит, например, задачам использования материалов с заранее заданными свойствами, создание новых материалов, подбору специфических катализаторов для различных химических процессов. Периодическая система – научная база преподавания общей и неорганической химии, а также некоторые разделы системной системы Организации Объединенных Наций. @rian.ru
7 495 645-6601
ФГУП МИА «Россия сегодня»
https: //xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2019
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https: //xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru /docs/about/copyright.html
https: // xn – c1acbl2abdlkab1og.xn – p1ai /
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https: //xn--c1acbl2abdlkab1og.xn--p1ai/awards /
https://cdn23.img.ria.ru/images/99408/72/994087230_112:0:1889:1333_1920x0_80_0_0_597a34ca28aa89475eedcbd63e1a68a3.jpgРИА2000 64
70003 9-group@[email protected] ФГУП МИА «Россия сегодня»
https: // xn – c1acbl2abdlkab1og.xn – p1ai / awards /
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https: //xn--c1acbl2abdlkab1og.xn--p1ai / awards /
справки
Периодическая система химических элементов – упорядоченное множество химических элементов и их естественная классификация.
Является табличным представлением периода закона, открытого Дмитрием Менделеевым. Современная формулировка этого закона звучит так: свойства элементов находятся в периодической зависимости от заряда их атомных ядер.Прообразом Периодической системы химических элементов служит таблица “Опыт системы элементов, основанной на их атомном весе и химическом сходств”, составленная Менделеевым в 1869 году. По мере совершенствования периода этой таблицы развил представления о группах элементов и о месте каждого элемента в системе. В 1871 году в книге “Основы химии” Менделеевым была включена “Естественная система элементов Д. Менделеева” – первая классическая короткая форма Периодической системы химических элементов.Современная Периодическая система химических элементов включает 118 элементов. За последние 50 лет таблицы Менделеева пополнилась семнадцатью новыми элементами (102-118). Девять из них были впервые получены в российском Объединенном ядерных исследованиях в Дубне. Последнее добавление в таблицу Менделеева было сделано в 2016 году, она пополнилась четырьмя элементами 113, 115, 117 и 118 атомными номерами, которые соответственно были названы нихоний (Nh), московий (Mc), теннессин (Ts) и оганесон (Og).Сейчас в системе ядерно-физических элементов, которые назвали “большой гонкой”, что связано с попытками поиска решений некоторых частных проблем ее структуры. Наиболее распространены две табличные формы: короткая и длинная (разработана Дмитрием Менделеевым, усовершенствована в 1905 году Альфредом Вернером).
Современная форма Периодической системы химических элементов (в 1989 году Международным союзом последовательной и прикладной химии рекомендована длинная форма таблицы) из семи периодов (горизонтальных последовательностей элементов, расположенных по возрастанию порядкового номера) и 18 групп (вертикальных последовательностей элементов в соответствии с теорией валентных электронов) ), а короткая форма таблицы – из восьми групп.
Номер группы элементов короткого варианта таблицы Менделеева соответствует системе валентных электронов во внешней электронной оболочке элементов. В длинном варианте таблицы номер группы в большей мере формален. Группы короткого варианта включают основные (а) и побочные (б) подгруппы, в каждой из элементов, входящих в состав, сходные по химическим свойствам. Элементы некоторых групп имеют собственные тривиальные названия: щелочные металлы (группа 1 длинной формы таблицы), щелочноземельные металлы (группа 2), халькогены (группа 16), галогены (группа 17), благородные газы (группа 18).
Периодическая система химических элементов для каждого элемента указывается его символ, название, порядковый номер и значение относительной атомной массы.
Первый период содержит два элемента – водород и гелий.
Второй и третий периоды (литий – неон; натрий – аргон) содержат по восемь элементов.
Четвертый (калий – криптон) и пятый (рубидий – ксенон) периоды содержат по 18 элементов.
Шестой период (цезий – радон) содержит 32 элемента и включает особую группу элементов – лантаноиды.
Седьмой период (франций – оганесон), подобно шестому, содержит 32 элемента и включает особую группу элементов – актиноиды.
Лантаноиды и актиноиды помещены отдельно внизу таблицы.
Периодическая система химических элементов сыграла и продолжает играть огромную роль в развитии многих естественнонаучных дисциплин. Она стала важным звеном в эволюции атомно-молекулярного учения, способствовала формулировке современного понятия “химический элемент” и уточнению представлений простых веществ и соединений, оказав существенное влияние на разработку теории строения элементов и возникновение понятия изотопии.С периодической системой связана строго научная постановка проблемы прогнозирования в химии, что проявилось как в способах существования неизвестных элементов и их свойств, так и новых возможностей химического поведения уже открытых элементов. Периодическая система – важнейшая основа неорганической химии; она служит, например, задачам использования материалов с заранее заданными свойствами, создание новых материалов, подбору специфических катализаторов для различных химических процессов. Периодическая система – научная база преподавания общей и неорганической химии, а также некоторых разделов атомной физики.По решению ООН 2019 год провозглашен Международным годом Периодической таблицы химических элементов.Материал подготовлен на основе информации РИА Новости и открытых источников
Международный год периодической таблицы: 150-летие гениального творения Дмитрия Менделеева (Newsweek, США) | Общество | ИноСМИ
Почти в каждой химической лаборатории на нас со стенами смотрит периодическая таблица химических элементов. Ее создание, как правило, ставит в заслугу русскому химику Дмитрию Менделееву, который в 1869 году выписал известные элементы (в то время было 63) на, а расположил их по столбцам и строкам в соответствии с их химическими и физическими свойствами.В ознаменование 150-летия ООН этого поворотного момента в науке провозгласила 2019 год Международным годом периодической таблицы химических элементов.
Но на самом деле периодическая таблица началась не с Менделеева. Расположить химические элементы в определенном порядке многие пытались. За несколько десятков лет до этого химик Джон Далтон (Джон Далтон) попытался упорядочить элементы в таблице, а также придумать для них некоторые довольно интересные символы (они не «прижились»). И всего за несколько лет до того, как Менделеев взялся за дело со своей колодой самодельных карточек, Джон Ньюлендс (Джон Ньюлендс) также создал таблицу, распределив элементы в соответствии с их свойствами.
Vesti.lv Mainichi Shimbun Gazeta Wyborcza Гениальность Менделеева заключилась в том, что кое-какие элементы он просто не включил в свою таблицу. Он понимал, что некоторых элементов не хватает, но они будут открыты. Поэтому там, где Далтон, Ньюлендс и другие включили в таблицы то, что было известно, Менделеев оставил место для неизвестного. Еще более удивительно, что он точно предсказал свойства недостающих элементов.
Вы обратили внимание на вопросительные знаки в первоначальной таблице Менделеева? Например, рядом с символом Al (алюминий) есть пустая клетка для неизвестного металла. Менделеев предсказал, что у него будет атомная масса 68, плотность шесть граммов на кубический сантиметр и очень низкая температура плавления. Шесть лет спустя Поль Эмиль Лекок де Буабодран (Поль Эмиль Лекок де Буабодран) открыл галлий и, конечно же, вписал его в таблицу прямо в свободную клетку с атомной массой 69,7, плотностью 5,9 г / см3 и температурой плавления настолько низкой, что он становится жидким в руке.Такие же пустые клетки в таблице Менделеев оставил для скандия, германия и технеция (который был открыт лишь в 1937 году, через 30 лет после его смерти).
На первый взгляд таблица Менделеева не очень похожа на ту, с которой мы знакомы. Во-первых, в современной таблице есть элементы, которые можно оставить в форме (и не смог оставить пустые клетки) – прежде всего речь идет о благородных, инертных, газах (таких гелий, неон, аргон). Кроме того, таблица устроена не так, как наш современный вариант этой системы, элементы в которой мы теперь располагаем в виде двухмерной таблицы – столбцов и строк.
Таблица Менделева на 90 градусов, становится очевидным ее сходство с существом. Например, галогены – фтор (F), хлор (Cl), бром (Br) и йод (I) (в таблице Менделеева обозначено символом J) – все оказываются рядом друг с другом. Сегодня они расположены в 17-м столбце таблицы (или 17-й, как выбирают его химики). Переход от этого варианта к знакомой схеме может показаться незначительным, но спустя годы после публикаций Менделеева было много экспериментов с альтернативными вариантами расположения элементов.Еще до того, как таблица приобрела свой постоянный вид с разворотом под прямым углом, люди предлагали целый ряд странных и замечательных конфигураций.
Одним особенно ярким примером является опубликованная в 1870 году спиральная система элементов Генриха Баумгауера (Генриха Баумгауера), в центре которого расположен водород, а элементы в порядке увеличения их атомной массы расположены от центра по спирали. Элементы, попадающие на каждый из радиусов спирали, имеют общие свойства, как и элементы столбца (группы) в современной таблице.Была и довольно странная «гантелеобразная» конфигурация периодической системы, предложенная в 1892 году Генри Бассетом (Генри Бассет).
И все же к началу XX века таблица знакомую нам горизонтальную форму, и ее вариант, предложенный в 1905 году Генрихом Вернером (Генрих Вернер), выглядел на удивление современно. Впервые инертные газы оказались в своем (знакомом сегодня) положении на правом краю таблицы. Вернер также попытался последовать примеру Менделеева, предположить, что он довольно переусерден с предположением о том, что одним из веществ, содержащихся в организме, является тот, который должен был занять место между водородом и гелием (ни одного из них не существует).Несмотря на этот довольно современный вид таблицы, предпринимались попытки изменить ее конфигурацию.
Особенно авторитетным был вариант, предложенный Шарлем Жанетом (Чарльз Джанет). К составлению таблицы он подошел с точки зрения физики и используя недавно открытую квантовую теорию, создал вариант расположения элементов, основанный на электронных конфигурациях. Многие физики по-прежнему предпочитают создавать им «левостороннюю» таблицу. Интересно, что Жанет тоже оставил свободные клетки для элементов – до 120, несмотря на то, что в то время известно только 92 элемента (сегодня нам известно лишь 118).
Современная таблица представляет собой непосредственную доработку варианта, предложенного Жанетом. Щелочные металлы (группа, на первом месте в которой находится литий) и щелочноземельные металлы (группа, начинающаяся с бериллия) были перенесены с крайней правой стороны на левый край таблицы, в результате чего получилась периодическая таблица очень широкая по виду (длиннопериодная форма). Проблема с таблицами такой конфигурации заключается в том, что она не помещается на странице или плакате, поэтому в основном по эстетическим причинам – элементы f-блока обычно выносятся за пределы таблицы и помещаются под ней.Именно так и появился вариант признаваемой сегодня периодической таблицы. Это не значит, что люди не используют другие конфигурации таблиц. Существуют современные варианты модели (посмотрите, как используются популярные варианты спиральные и трехмерные конфигурации, не говоря уже о более шутливых вариантах.
А как насчет приведенного ниже моего собственного варианта, в котором объединены два изображения – таблица Менделеева и схема лондонского метро Генри Бека (Генри Бек)? Или головокружительный набор имитаций, цель которых – придать ощущение научности при классификации чего бы то ни было – от пива до диснеевских персонажей, а также моей любимой «иррациональной чепухи».Все это показывает, как периодическая таблица элементов стала традиционным, культовым символом науки.
Материалы ИноСМИ содержат оценки исключительно зарубежных СМИ и не отражают позицию редакции ИноСМИ.
Элементы под рукой
В этом году мир отмечает 150-летний юбилей со дня открытия периодической системы элементов. Недавно в честь него мы предоставили тест на знание названий химических элементов, которые по тем или иным причинам в таблице Менделеева не попали.Однако споры вокруг названий элементов – не единственные разногласия, которые были связаны с периодической системой за полтора века ее истории. На этот раз мы расскажем об альтернативных вариантах формы элементов, которые в большом количестве предлагались за это время, но в итоге так и не стали широко распространяться.
Наверняка многие из вас видели «таблицы Менделеева», составленные для сортов шоколада, героев мультсериалов, алкогольных напитков или, например, профессиональных велосипедистов.Обычные химические элементы вместо их атомных масс указывать какие-то другие параметры: дату открытия элемента, в форме простого вещества, период полураспада, элеткроотрицательность или изображения электронных орбиталей. Например, в нашем материале «Европейский след» мы писали о том, как другие элементы зарождаются в недрах звезд, и для наглядности использовали таблицу Менделеева с указанием процессов, которые приводят к появлению каждого из них.
Многие из этих таблиц по-своему интересны, информативны, красивы или смешны, но речь сейчас пойдет не о них. Мы предлагаем вам познакомиться с теми формами периодической системы элементов, которые отличаются от ее традиционного представления. Эти системы включают в себя те же самые элементы, которые используются в качестве основы для использования различных таблиц из восемнадцати столбцов и семи строчек, а как-то. иначе.Для этого они меняли направление периодов и групп, наматывающих элементы на цилиндр и представляющие их в виде ветвящихся деревьев.
Периодичность Свойства
, чтобы разобраться, почему для периодической классификации химических элементов предлагали так много способов графического представления, сначала кратко напомним о физических основах периодического закона.
В любой версии системы элементов размещения по увеличению одного ядра: он самый маленький и равен (по модулю) заряду электрона, а у самого тяжелого из известных на данный момент оганесона, расположенного в нижнем углу таблицы, он равенство (тоже по модулю) заряду сразу 118 электронов.Генератор электрических движений приводит к возникновению неисправностей в ядре.
Грубо говоря, орбитали, на которые могут быть электроны вокруг ядра, расположены «слоями». Эти слои отличаются между собой по размеру, энергии и форме. Первыми из них заполняются электронами, которые расположены ближе всего к ядру, а если на них все места уже заняты, то электроны выбирают оболочку подальше от ядра и, соответсвенно, побольше.При этом вместе с этим вместе с радиуса растет и их энергия, и разнообразие форм: так, у самого близкого к ядру электронного слоя есть только одна сферическая s-орбиталь, следующий слой состоит уже из четырех орбиталей: к одной сферической присоединяются еще три гантелевидные p- орбитали.
На следующем периоде появляются еще пять крестообразных d-орбиталей, а затем еще и 7 f-орбиталей. Подробнее о физических принципах, на которых основывается периодичность наших химических свойств, вы можете прочитать в материале «Элемент неожиданности».
От того, на каком слое находится «самый дальний» от ядра электрона, и зависит от того, в каком периоде всплывшего элемента, а каждый переход к новому слою (когда все более маленькие оказываются занятыми) означает переход к новому периоду в таблице. При этом значения последовательности заполнения электронных оболочек важны для формирования структуры структуры и задаются основные числа электронного и квантового чисел. у оболочки с меньшим значением главного числа.
Схема заполнения электронами энергетических уровней согласно правилу Клечковского
Викискладе
. В каком направлении происходит увеличение массы атома, как лучше всего. и сходство свойств, как связать положение элементов с их электронной структурой.
Самый простой пример самых сложных сложностей можно найти в начале таблицы Менделеева – это водород. С одной стороны, у него на внешнем уровне всего один электрон, что сразу делает его похожим на щелочные металлы: литий, натрий или калий, – а с другой стороны, того же одного электрона водороду не хватает до конфигурации инертного газа, из-за чего для него характерны и некоторые свойства галогенов – фтора или хлора.
В результате в течение долгого времени водород метался между первой группой и седьмой, а в некоторых вариантах таблицы занимал одновременно две позиции в первом периоде таблицы.Подобных коллизий – как фундаментального, так и эстетического характера – за историю периодической таблицыло немало.
Вертикально или горизонтально
Например, один из первых вопросов, который задает учитель химии школьнику, только что познакомившемуся с таблицами элементов, – где в ней находятся периоды, а где группы, кто из них зависит по вертикали, а кто по горизонтали? Прилежному восьмикласснику ответить на этот вопрос никакого труда не составит: конечно, периоды расположены в строках таблицы, а группы – в столбцах.
А вот сам Менделеев уверен в этом не был и в какой-то момент мог ответить на этот вопрос иначе. Самая первая версия таблицы, которую он в 1869 году сначала нарисовал у себя в дневнике, а затем опубликовал в журнале Русского химического общества, была вертикальной: каждый новый период располагался в новом столбце, а похожие по химическим свойствам элементы из одной и той же группы располагались по горизонтальным рядам. В результате 63 известных на тот момент элемента занимали 6 столбцов и 19 строчек.
Рукопись Д. И. Менделеева 1869 года, на которой приведена одна из первых версий периодической таблицы элементов в вертикальной форме
Музей-архив Д. И. Менделеева при СПбГУ
Французский экземпляр «Опыта системы элементов» с вертикальной версией таблицы, разосланный Менделеевым иностранным ученым в 1869 году
Музей-архив Д.И. Менделеева при СПбГУ
Одна из старейших сохранившихся копий настенных периодических таблиц, напечатанная в 1885 году, и таблица в аудитории СПбГУ, полученная по указанию самого самого ученого в 1876 году. ). Тем не менее, вплоть до конца XIX века вертикальные положения и их модифицированные версии продолжали штат Америки с горизонт. Вопрос о старейшем экземпляре таблицы Менделеева для N + 1 пишет заведующий Музеем-архивом Д. И. Менделеева при СПбГУ Игорь Дмитриев:«Насколько можно судить по сохранившимся документам, Менделеев размышлял о систематике химических элементов по крайне мере с 1867 года, активная фазу работа по систематике элементов вошла в начале 1869 года. Провыв наступил 17 февраля (1 марта по новому стилю) 1869 года – именно этим числом датирован и один из сохранившихся набросков.На нем сверху рукою Менделеева написано: “Опыт системы элементов, основанной на их атомном весе и химическом сходстве, Д. Менделеева”. Этот вариант систематики элементов вскоре был подписан в виде отдельного листка тиражом 200 экземпляров русским и иностранным химикам ».
Подробнее о самых старых копиях таблицы Менделеева читайте в нашем блоге «Дело не в таблице».
Компактно или наглядно
Количество периодов в периодической таблице за 150 лет увеличилось с фактом до семи (и этот вопрос не вызывает), а вот насчет «правильного» количества столбцов в таблице до пор спорят.Большинство читателей в ответ на вопрос о вероятных вариантах таблицы Менделеева наверняка сразу вспомнят про короткопериодную и длиннопериодную версию.
В первом случае d-элементы, у которых появляются электроны на d-орбиталях и которые присутствуют в таблице начиная с 4 периода, записываются в две строчки. Такая запись возможна благодаря сходству степеней окисления элементов главной группы (то есть p-элементов) и расположенных над ними переходных металлов из d-блока таблицы.
Горизонтальная короткопериодная таблица Менделеева, опубликованная в 1871 году
Викискладе
Короткая запись таблицы получается весьма компактной, но, например, некоторые из металлов в такой системе целыми тройками оказываются как будто бы в той же группе, что и инертные газы, хотя по своим химическим свойствам совершенно на них не похожи.В результате в 1989 году ИЮПАК официально отменил короткий вариант таблицы и сейчас она используется редко, а основной версией таблица стала «длиннопериодная».
В ней все элементы из одного периода записываются одной строкой. С одной стороны, это позволяет избежать некоторого увеличения ширины. Поэтому чтобы избежать дальнейшего разрастания таблицы элементов в горизонтальном направлении, все f-элементы – лантаноиды и актиноиды – в обоих вариантах таблицы выносятся в отдельные секции в нижней части таблицы.
Несмотря на избыточную ширину даже такого варианта таблицы, физик Гленн Сиборг решил, однако, на нем не останавливаться и в 1969 году использовать свою версию сверхрасширенной таблицы. В этой версии таблицы без переносов строки включаются не только d-элементы, но и f-элементы, есть лантаноиды и актиноиды (которые сейчас всегда выносятся в отдельную секцию), а также g-элементы, ни один из которых на данный момент не получен . Всего в таблице оказалось 218 элементов – даже сейчас таблица ровно на сто элементов короче, а в тот момент их было синтезировано еще меньше.
Стоит отметить, что насчет научных ценностей такой древесины у ученых продолжает. Во-первых, это просто неудобно – полная версия таблицы будет занимать несколько разворотов книги (да и на экран монитора не уместится). Сохранение свойств химических элементов в таких условиях. Эта проблема становится актуальной уже для актиноиодов, недавно было показано, что и оганесон – последний элемент седьмого периода – не так уж сильно похож на инертный газ.
«Левосторонняя» таблица элементов Шарля Жане 1928 года
Charles Janet / Imprimerie De ́partementale de l’Oise, Бове, 1928 г.
Справа или слева
Попытка уместить каждый период в единственную строчку, вплоть до абсурдных вариантов с 50 столбцами, – на самом деле простой и безобидный способ изменить внешний вид таблицы, чтобы сделать ее нагляднее.Эти таблицы почти не отличаются от людей, и перестроиться на них труда не составляет. Значительнонее это сделать при работе со сложными другими периодическими системами.
Например, одна из наиболее известных версий альтернативного способа заполнения – это так называемая «левосторонняя» таблица Шарля Жане, которую он использует в 1928 году. Жане опубликовал за один год две работы, в режиме сразу три варианта такой таблицы, ускоряясь на наиболее наглядной версии.
В отличие от стандартной таблицы, блоки s- и p-элементов в ней расположены в обратном порядке: s-блок (щелочные и щелочноземельные металлы) справа, а p-блок – слева от него. При этом заполняется эта таблица, как и традиционная, слева направо, поэтому переход от одного периода к другому происходит между 2-й и 13-й группой (или 3-й в короткопериодном варианте) группой. Таким образом, s-элементы в таблице оказываются защищены около правого края, слева от них – инертные газы и весь p-блок, еще левее – d-элементы.
Основное преимущество подобного расположения элементов состоит в том, что с помощью него в «длиннопериодном» варианте таблицы удается избежать разрывов между s- и p-элементами, благодаря чему можно с ходу, практически не задумываясь, определить электронную конфигурацию атома того или иного элемента в незаряженном состоянии, просто отсчитывая нужные блоки с правой стороны.
Другая необычная версия таблицы – это «древовидная» таблица, которую использует Эдвард Мазурс в 1967 году.В ней не только новый период, а каждый новый блок элементов (s-, p-, d- и f-блоки), начинается на новой строчке. Каждый из них выравнивается по центру, в результате чего образует структуру, напоминающую рисунок елки, треугольные уровни, которые перевернуты вверх ногами. «Ствол» это дерево состоит из s-элементов, над ними находятся p-элементы, затем d- и f-металлы (если они в периоде есть).
Эта таблица также позволяет быстро определить электронные восприятия, а для облегчения восприятия, как и в вариантах, ее варианты подкрашивают тем или иным цветом.
Древовидная периодическая таблица Эдварда Мазурса, опубликованная на форзаце его книги 1974 года
Мазурс Э.Г. Графическое изображение периодической системы за сто лет, 1974 г.
Таблица или дерево
При этом далеко не все варианты альтернативных периодических систем, предложенных за 150 лет их истории, представляли собой таблицу.Например, в конце XIX века и начале XX века на основе первоначального вертикального варианта Менделеева ученых пытались построить всевозможные ветвящиеся структуры, которые должны были быть, по мысли авторов, лучше описывать периодичность, чем таблица из столбцов и строчек.
Как и значительно более поздний Мазурса, эти варианты также напоминают разрастающиеся деревья, но состоят не из отдельных ячеек, а представляют собой элементы, связанные между собой веточками определяющими родственными свойствами.
Разветвленная система элементов Бэйли 1882 года
Г. Н. Квэм и Мэри Беттелл Квэм / Журнал химического образования, 1934 г.
Во всех этих вариантах ученые использовали идею увеличения периода роста массы элемента – в следующем шаге между щелочными металлами и галогенами (инертные газы на момент публикации этих вариантов еще не были известны) встраивается все большее число новых элементов.
Ветвистые структуры из элементов, соединенных палочками, иногда принимали довольно необычные формы. Например, в периодической системе Старека 1932 года элементы сгруппированы по сходству физических структур и образуют зигзагообразную систему с диагональным выравниванием элементов, напоминающую проекцию какой-то сложной трехмерной структуры.
Периодическая система, предолженная Стареком в 1932 году
г.Н. Квэм и Мэри Беттелл Квэм / Журнал химического образования, 1934 г.
Строчки или витки
Пожалуй, самой альтернативной табличной представлению за всю историю периодической системы элементов всевозможные модификации спиральных структур. Основная проблема формы таблицы – прерывистость ее структуры. Чтобы перейти в ней от одного периода к другому, так или иначе нужно перескакивать с конца предыдущей строки к новой.Такой же, как и переход при этом, происходит ускорение заряда ядра – переход при ускорении от инертного газа к щелочному металлу следующего периода нужно увеличить заряд ядра на заряд всего одного протона – так же, как и переходе к следующему в середине периода.
Наиболее очевидной геометрической структурой, которая позволяет показать одновременно и периодичность системы, оказалась спираль. Спиральные формы для систем элементов начали предлагать еще в конце XIX века, одну из первых значимых с точки зрения точки зрения спиралей элементов в 1902 году Гуго Эрдманн.В предложенной системе цепочка с последовательностью элементов наматывается на архимедову спираль, при этом короткие периоды (без переходных металлов) проходят один оборот, а длинные – два.Спиральная периодическая система Гуго Эрдманна 1902 года
Г. Н. Квэм и Мэри Беттелл Квэм / Журнал химического образования, 1934 г.
В начале XX века было предложено еще несколько «спиралей Менделеева», а значительный шаг в их улучшении сделал тот же Шарль Жане.После публикации своей «левосторонней» версии таблицы он в том же 1928 году начал работать над спиральными версиями структуры. Жане разработали несколько версий объемных и плоских спиралей, которые, помимо прочего, помогли ему завершить выполнение к верному правилу заполнения электронных орбиталей на шесть лет раньше Маделунга на 21 год Клечковского.
обороты на длинных периодах Жане заменили петли – покороче для d-элементов и подлиннее – для f-элементов, так что структура в зависимости от формы записи стала напоминать голову кролика или кактус.
Вторая версия спиральной периодической системы Шарля Жане 1928 года
Шарль Жане, La классификация hélicoïdale des elements chimiques, 1928
Спиральная система Шарля Жане в форме лемнискаты
E.Г. Мазур / Графическое изображение периодической системы за сто лет, 1974 г.
Спиральная периодическая система Гордона Ирвина 1939 года
К. Гордон Ирвин / Журнал химического образования, 1939 г.
Спиральная периодическая система Теодора Бенфея, опубликованная в 1964 году
Викискладе
Похожие плоские спирали продолжали дорабатываться и дополняться в течение еще нескольких десятков лет, но стать полноценной заменой таблицам так и не смогли.
Плоская или объемная
Интересно, что не так мало альтернативных версий периодической системы элементов были не плоскими, а объемными. И в основы из них тоже оказывались спиральные структуры. Обычно цепочки последовательности элементов предлагали «наматывать» на цилиндр или конус (в последнем случае таблица становится похожа на гирлянду на новогодней елке).
Из-за невозможности нормально работать с изображениями спиралей на бумаге и небольшой наглядности все эти варианты остались лишь экспериментами.
Модель спиральной периодической системы в форме восьмерки, предложенная Круксом в 1898 году
Г. Н. Квэм и Мэри Беттелл Квэм / Журнал химического образования, 1934 г.
При этом, кроме научно значимых попыток создания объемных структур, ученые и художники наносили периодическую таблицу и другие объемные фигуры.Например, в начале XX века появилась сферическая версия таблицы элементов, которая заполняется сверху вниз, при этой нижней половину сферы должны быть попадать все неустойчивые элементы. Или совсем экстравагантные варианты, такие как таблица Менделеева на ленте Мёбиуса, которая имеет, правда, лишь эстетическую ценность.
Из-за того, что различные версии таблиц элементов стали возникать сразу же после формулировки периодического закона, уже с конца XIX века появились первые статьи, которые сравнивали эти варианты между собой, определяющие наиболее удобные, наглядные и подходящие для использования версии.Новые данные публикации в отдельных статьях и целых монографий все еще появляются, хотя носят уже скорее исторический интерес.
Александр Дубов
Литература
1. Г. Н. Квэм и Мэри Баттель Квэм, Типы графических классификаций элементов, Журнал химического образования, 1934 г.2. Эдвард Г. Мазурс, Графические представления периодической системы в течение ста лет, Университет Алабамы Press, 1974.
3. Эрик Скерри, Периодическая таблица: ее история и ее значение, Oxford University Press, 2006.
Менделеева первоначальная – Справочник химика 21
Теория электролитической диссоциации Аркениуса в своем первичном виде ярко выраженную механистическую окраску.Положения теории правильности ее основы. К тому же, появление теории Аррениуса относится к периоду, когда в химии еще господствовало эмпирическое направление исследований (особенно в области органической химии), а также связи химии с физикой только-только еще устанавливались. Сам Аррениус, считавший себя физиком, противопоставлял теорию электролитической диссоциации химическим теориям и прежде всего гидратной химической теории растворов Д.И. Менделеева. Менделеев же, вместе с многочисленными сторонниками своих воззрений полагается, что существование его гидратной теории исключает необходимость в создании особой теории электролитической диссоциации. [ок. 425]В первоначальной таблице Менделеева было помещено 63 химических элемента. Сейчас известно 105. Из 42 элементов, их открытых после 1869 г., Менделеев предсказал существование по крайней мере 20. В частности, Менделеев предоставел места, где сейчас расположены франций, скандий, галлий, германий, гафний, полоний, астат, технеций, рений , радий, актиний, протактиний и некоторые редкоземельные элементы.Он также разместил сам инертные газы, которые вначале не предполагал. Свойства некоторых элементов предсказал с удивительной точностью Менделеев. Это предсказание было основано на правиле атом-аналогии, установленном Самим Менделеевым. Сущность этого правила заключается в том, что физические константы (включая и атомные массы) определяют как среднеарифметические значения из констант его ближайших четырех соседей. На основе того же принципа Менделеев предсказывает наиболее значительные химические свойства.Для названий не открытых еще элементов Менделеев приставки, заимствованные из санскритского языка. Например, экабор, экакремний, экацезий, экаиод, экамарганец, двимарганец и т. д. [c.38]
КЬ = 104,4, РЬ = 197,4 (см. Ст. 1 и 2, стр. 9 и 23 в основном томе). В ст. 3 и 4 этого уже не делается, равно как и в ст. 5 и 6. Но в примечании к ст. 7 (стр. 167 в основном томе) вновь указывается, что возможными аналогами Мпозитные ключи и Оз, которые займут соответственные места в гр.VII системы элементов. На ф. 23 видно, что Менделеев использовал записал КЬ в одну подгруппу о Мп, но затем вычеркнул его и перенес ниже, поставив между N1 и Ое. В оригинале таблицы ф. 22) имеются дефекты и повреждение, изготовились цифры атомного веса экасилиция (68) получились не полностью, а цифры атомного веса экасилиция (72) не вовсе. [c.616]
Первоначально Д. И. Менделеев назвал железо, кобальт и никель переходными элементами. Как изменилось понятие переходные элементы в наше время, какие основные признаки характеризуют это понятие Дайте современное определение переходных элементов. [c.157]
Успешное решение структурно-молекулярных вопросов во многом зависело от разработки эффективных методов разделения и асфальтенов – этих сложных гетерогенных смесей, на более простые группы близких по составу и строению веществ. Еще Д. И. Менделеев настойчиво пропагандировал и сам применял в своих опытах физические методы и методы разделения исследования нефтей. В статье по нефтяным делам, опубликованной в 1885 г., он писал, что … химическая нефть не может быть иначе определен, как при помощи физического разделения составных начал нефти на основании их летучести и различий в температуре кипения, растворимости и тому. подобных свойств [1, с.426], и далее … мощный лабораторный анализ нефти [1, с. 428]. [около 90]
В то же время Д. И. Менделеев предполагал, что образование нефти происходит в земной коре в результате действия воды на карбиды металлов. Углерод карбидов и водород, входящий в состав воды при этих реакциях, превращаются в углеводороды, которые в газообразном виде поднимаются по трещинам в земной коре в верхние более холодные слои.Пары жидких углеводородов здесь конденсируются, образуется в пористых пластах залежи нефти. В. Д. Соколовым была выдвинута космическая гипотеза происхождения нефти, согласно которой углеводороды находились в первоначальном земном газовом облаке и были поглощены при образовании земной коры. [c.67]
Разложение углеводородов при высокой температуре без доступа воздуха было известно еще в прошлом столетии. В 1875 г. ассистент Петербургского технологического института А. А. Летний, изучая движение высокой температуры на тяжелые нефти, установил, что при этом образуются летучие продукты (бензин).Д. И. Менделеев неоднократно указывал на необходимость изучения высоких температур на тяжелые нефтяные масла, отмеченная, что они претерпевают при этом изменении, и среди образующихся продуктов найдутся технически важные и полезные. В 1885 г. в Баку была построена установка для получения керосина путем системы нефтяных остатков. Промышленные крекинг-установки для получения бензина из нефтяных фракций стали строить в США, начиная с 1913 г. Первоначальные способы термической переработки нефти и применявшаяся для этого аппаратура подверглись различным усовершенствованиям.В Советском Союзе первые крекинг-установки системы Виккерса были построены в Баку в 1927—1928 гг. [c.269]
В некоторых случаях Д. И. Менделеев расположил элементы в соответствии с закономерным изменением свойств, предполагаемая возможная неточность значений их атомных масс (Оз, 1г, Р1, Аи, Те, I, N1, Со). Этим была поставлена задача уточнения указанных указанных элементов, и для некоторых из них атомные массы были исправлены. Первоначально казалось, что открытие благородных газов нарушило периодичность изменения элементов, однако затем открылись другие благородные газы, которые хорошо вписались в периодическую систему. [c.29]
Количественные характеристики элементов в земной коре Менделеев в то время не мог но современная наука использует цифрами, характеризующие количество элементов в земной коре в процентах по весу. Эти весовые количества элементов принимаются называть весовыми кларками. Первоначально установленные кларки постоянно пополняются рядом ученых. И. Вернадского, А. Е. Ферсмана, А. П. “Виноградова, В.Г. Хлопина и др., А из зарубежных ученых – Кларка, Гольдшмидта, Вашингтона, Хевеши. [c.7]
Такое предположение, что все же не является единственно возможным наличием в нефти материалов растительного и животного происхождения, можно также объяснить тем, что нефть, образовавшаяся вначале неорганическим путем, например из карбидов металлов и (Д И Менделеев), могла в расширять органические вещества, не имеющее отношения к ее первоначальному происхождению. [c.31]
В 1871 г. Менделеев формулирует периодический закон свойства элементов, а потому и свойства образуемых ими простых и сложных тел стоят в периодической зависимости от их атомного веса. Он создает новый, клеточный вариант таблицы, которую называет естественной системой элементов. В этом варианте, в отличие от первоначального, Менделеев все элементы разделяет на восемь групп номер [c.74]
Наглядным процессом перехода гипотезы в закон, от одного уровня знаний к другому, более высокому, открытие и утверждение периодического закона.Первоначально положение о периодической зависимости свойств элементов от их атомного веса Менделеев сам рассматривал как гипотезу. Он прекрасно понимает, что выдвинутое им положение, хотя и в высшей степени вероятное, не будет считаться гипотезой до тех пор, пока его не проверили. Каков же путь проверки Утверждение режима возможно только при выводе из него следствий, без невозможных и не ожидаемых, и оправдания тех следствий в пути. Поэтому-то, увидев периодический закон, я со своей стороны (1869–1871) вывел его такие логические следствия, которые могли показать – верен он или нет. [c.296]
Чтобы придать наглядность тому или иномуу, мы выражаем его в виде (двухмерного) графика нередко график даже предшествовал открытию закона. 1) более сложный закон, тем труднее поддается он графическому изображению, и на известном этапе сложной сложности закона (например, при функциональной связи четырех величин) услуги геометрии как вспомогательного аппарата химии и физики оказываются исчерпанными 2) одному и тому же закону можно придать различные графические выражения (например, меняя прямоугольную систему координат на косоугольную, угловую и т.д.). Этим объясняется появление сотен периодических таблиц, предлагающих разных авторов, однако наиболее многосторонний период изображается прямоугольной таблицей, представляющей – с малыми изменениями – первоначальную таблицу Менделеева (см. Стр. 66). Впрочем, уже сам Менделеев наряду с так называемой короткой схемой таблицы приводил и длинную ее. [c.65]
В индивидуальном варианте таблицы Менделеева групп было восемь. Номер группы (I, П, И1 ,…, VHI) соответствовал высшей валентности элементов в кислородных соединений. После открытия инертных газов (в 90-х годах прошлого века) Д. И. Менделеев прибавил в систему элементов девятую группу – нулевую – в соответствии с валентностью этих элементов, равной 0. [c.106]
Теоретические представления Менделеева о растворах обычно называются гидратной теорией растворов. Менделеев придерживался при объяснении растворов химических трактовки растворения и сольватации растворенных веществ.Он был противником первоначальной теории электролитической диссоциации С. Аррениуса и В. Оствальда. Гидратная теория Менделеева представляет собой крупное научное обобщение. Она получила особенно большое значение при разработке новейших теорий растворов. [c.374]
Только подготовка полноценных технических кадров, он может решить задачу подъема промышленности страны, распространения теоретических обобщений технологии, что в свою очередь даст возможность дополнить эмпирический подход рационализмом и избежать ползучего эмпиризма.Менделеев, но многолетний жизненный опыт показывает, что практические дела можно наиболее успешно решать, только при знакомстве с абстрактами, только при знакомстве с абстрактами, лечить и даже строить мосты, лечить и совершать другие практические дела. Используя те же интегралами, которые используются не улавливают. Только абстрактный, соединенный с проверенными опытами и наблюдениями, дает уверенность в предстоящем невидимом результате, в ожидаемом, как в настоящем.. насколько то доступно людям, предвидеть предстоящее на основании существующего и прошлого [c.79]
Законы сохранения вещества и энергии или вечности сил, движения, Менделеев считал науки о веществе.На этой основе, говорил он, могут рождаться гипо-тические представления о природе вещества, которые, по крайней мере, удовлетворять известнымам. Так, атомистическая гипотеза даже в своем первоначальном виде, даже у Демокрита, пояс Менделеев, полностью соответствует закону вечности вещества, однако не гипотеза вызвала закон вечности вещества, хотя она появилась за много столетий до того, как был найден этот закон вечности. Наоборот, – пишет великий химик, – лишь после утверждения закона вечности вещества… атомистическое учение стало укрепляться в сознании и прилагаться в научных исследованиях о веществе °. [c.124]
Первоначальное понятие о силе, говорил Менделеев, получается из личного опыта и из знакомства с силами животных, и только является отвлеченное понятие о силах вообще или об энергии. Менделеев замечает также, что при формировании понятия сила, вначале познается видимая, т. е. механическая сила, а затем и силы скрытые или молекулярные, т. е. прямо не видимые и непосредственно не ощущаемые.То же самое и в приложении. Сперва все делается работою людей и лошадей, потом силою ветра и воды, далее силою тепла в паровых и других термических машинах, а под конец силою электрическою и химическою [c.160]
Не соглашаясь с теми, кто искусственно противопоставляет виды промышленности друг другу, Менделеев доказал, что в союзе с промышленностью и наукойское хозяйство постепенно, после долгих эволюций (т. е. последовательных форм развития), изменит свою первоначальную форму и приблизится к индустриальной форме. [c.172]
Менделеев пони.мал, что путь от первоначальной гипотезы к истине лежит через эксперимент, через проверку ее в опыте. Так, характеризуя свое открытие производной с15 / с1р в растворах, он писал, что любое возможное объяснение будет сперва гипотезой, могущей превратиться в истину только после проверки. Надобно ясно отличать правду действительности от истины умозаключения, – показать он.— Разрыв сплошности производной ёз / с1р есть правда, в которой легко убедиться, объяснение же его причины есть гипотеза, могущая стать истиною лишь после долгих новых проверок [c.202]
В самом деле, стоит только посмотреть на таблицу, приведенную в статье, чтобы заметить, что он объединил в каждом ряду резко несходные элементы. И это сделано им неслучайно. Не могу не обратить внимание также на то, – пишет Менделеев, – что в низших членах рядов, сравнительно с высшими, заметна большая резкость и ясность свойств и факторов. Это подобно тому, что мы замечаем в ряду гомологов в высших членах гомологических рядов сглаживаются некоторые особенности, принадлежащие ряду так, напр., парафин, который относили к ряду этилена, можно с такою же (и, конечно, большею) справедливостью относить и к ряду болотного газа, потому что в столь высоких гомологах никаких резких улучшений ни в том, ни в другом ряду нельзя подозревать. Точно так же сглаживаются особенности простых тел, резко выставляющихся в первых столбцах, в последнем столбце, образованных самыми тяжелыми элементами. Свинец, таллий, висмут, золото, ртуть, платина, иридий, осмий и вольфрам не только суть мало энергические элементы, но в то же время все суть элементы тяжелые, из можно даже во многих отношениях составить одну группу, не нарушая притом первых требований аналогии.Таллий и висмут в этом отношении стоят, однако, между собою дальше, чем свинец к таллию или висмут коту зол, ртути и платине. Притом элементы, стоящие ниже галоидного [c.298]
Соединяясь друг с другом, галоиды, как и щелочные металлы, образуют в химическом непрочные соединения. Следовательно, говорит Менделеев, те и другие, соединяясь с себе подобными, образуют мало характерные соединения, обладающие свойствами составных частей, в них входящие. Соединяясь же со щелочными металлами (как единство противоположностей), галоиды образуют прочные во всех отношениях тела, которые имеют свойства галоидов и щелочных металлов совершенно исчезают.Образование таких соединений сопровождается выделением тепла и глубоким изменением физическими и химическими свойствамих. [c.313]
Менделеев видел, что скачки имеют самые различные формы, что совершаются они самыми разнообразными способами. Это можно установить хотя бы из описания изменений, происходящих в свойствах в связи с изменением массы. По мере возрастания массы, – писал ученый, – сперва свойства последовательно и правильно изменяются, а затем начинается новое, прежнее, период изменения свойств.Тем не менее здесь, как и в других явлениях, есть случай, когда малое изменение массы атома влечет малое изменение свойств, определяет изменение второго порядка это видно, напр., В УП1 группе … так, атомные веса Ре, Со и N1, Ни, НЬ и Рс1, Оз, 1г и очень близки между собою, но и их свойства их очень близки, различия иногда два уловимы [c.336]
Ве = 14 между литием Ы = 7 и бором В = 11 было неестественным , как и положение алюминия А1 = 27,4 между натрием Ка = 23 и магнием Мд = 24.Поэтому Менделеев ему снял с установленного отведенного места алюминий и его перенес на пустовавшее до тех пор место между кремнием 81 = 28 и магнием. Для бериллия же открывалось свободное место между В = 11 иЫ = 7 —в ряду с магнием, но при условии, что его атомный вес будет изменен на такое значение, устойчивое промежуточным между значениями 7 (для лития) и 11 (для бора). Но так как при переносе сюда бериллия оказался бы аналогом не алюминия, а магния, то для его окиси следовало бы в таком случае принять не глиноземную, магнезиальную формулу – ВеО. [c.11]
В этом индивидуальном варианте таблицы многое было неясно, требовало уточнений и изменений. На 37 лет.Менделеев продолжает дальнейшую творческую периодическую систему элементов. В V111 издании Основным методом рассмотрения как итог работы Менделеева в развитии периодического закона (табл. 25) является химии был помещен вариант системы. [c.79]
Мы начнем с урана, а не с индия, хотя сам Менделеев ставил впереди, как мы уже видели, индий, а не уран, вероятно, потому что индийский был первым, исправленный атомный вес которого получил опытное подтверждение.Однако, как увидим далее, индийское занятие в периодической системе (между кадмием и оловом), используемое Менделеев отвел урану [c.43]
Сущность периодического закона. Исследуя изменения значения химических элементов, сравниваются в рядо возрастаюн1имм их атомной массы, Менделеев установил, что сходные в химическом отношении элементы встречаются через правильные промежутки (числа элементов) и, таким образом, одни и те же свойства периодически повторяются в этом ряду.На этом основании Менделеев н вывел периодический закон, или как он его назвал, закон периодичности, установленный следующим образом [c.35]
Изучение распространенности химических элементов в природе началось в первой половине XIX столетия. Большое внимание этому уделяли классики геохимии Ф. Кларк, В. М. Гольдшмидт, В. И. Вернадский, А. Е. Ферсман. Уже первые анализы горных породили установить ряд эмпирических закономерностей химических элементов.Д. И. Менделеев представил, что в природе более распространены элементы начала построенной им таблицы, а более редкие находятся в ее конце. Позже было установлено, что преобладают четные элементы таблицы по сравнению с нечетными. Эта закономерность, как известно, получила название правила Оддо— Гаркннса. Изучение химического состава метеоритов, а также показ и состав звездных показателей с помощью спектрального анализа элементов, вернее, основные черты первоначальной распространенности в Солнечной системе в степени общими для космических тел Галактики и Земли.В настоящее время не вызывает сомнения то обстоятельство, что главные особенности распространения элементов чувствительными свойствами их элементов. Поэтому для выяснения более детальных данных распределения элементов важно знать распространенность не только их, но и отдельных ядерных, видов – изотопов. Этот вопрос рассмотрен в главе, посвященной геохимии изотопов. [c.71]
Первоначальный вариант периодической системы Д. И. Менделеева имеет длинную форму.(На втором форзаце книги этот вариант приведен в современном оформлении.) В декабре 1870 г. Д. И. Менделеев опубликовал короткую форму периодической системы. (На первом форзаце книги приведен вариант короткой формы таблицы.) Д. И. Менделеев отдавал преимущество короткому варианту. До настоящего времени продолжается поступать предложения о новых вариантах таблицы периодической системы элементов. Их известно уже несколько сотен. Но наилучшими из них, четко и глубоко передающими периодический закон, продолжаютагньг Д.И. Менделеева. [c.75]
Понятие о химическом элементе. Необходимость четко различать понятие элемент и простое вещество впервые отмечен Д. И. Менделеев. Полезно ясное различие между понятием о простом теле как об отдельном нем однородном веществе ио же как о вещественной части или элементе сделать сложные вещестЕ. Можно дать начальное определение понятия элемента химический элемент есть вид атомов, входящий в состав простых и сложных элементов, характеризующийся совокупностью свойств. [c.6]
Элементы расположенные в порядке возрастания атомных весов, проявляют закономерное изменение химического свохктв. Если изять первые два и последующие восемь элементов, то этп изменения сводятся к периодическому убыванию и возрастанию соответствующих свойств элементов [1]. Такая картина повторяется в дальнейшем аналогичным образом. Элементы распределяются по девяти группам и семи периодам, последним из которых, незакончен (табл. 1). Из рассмотренпя химических свойств следует, что расположение в порядке возрастания атомных весовается в случае аргона и калия, кобальта и нпкеля, теллура и пода, тория и протактиния.Менделеев первый составил современную таблицу элементов, после чего она указывала на отсутствие значительного числа элементов настоящего триумфом периодического закона было иредсказание Менделеевым недостающих элементов, которые были вскоре открыты. Более того, целая группа элементов, открытая Рамзаем (пулевая группа), уложилась в первоначальную систему. Необходимо отметить, что число элементов в законченных периодх равно 2, 8, 8, 18, 18 и 32 или 2Хп, где п принимает значения 1, 2, 3 и 4.Из табл. 1 и 2 видно, что лишь немногие элементы имеют целочисленные атомные веса по отношению к кислороду, атомный вес которого принят за 16,0000, хотя для легких элементов отклонения от целочисленных значений часто очень невелики. Не только сами атомные веса, но и их отклонения от целочисленных величин имеют большое теоретическое значение. [c.187]
Оболочечная структура электронных состояний атомов, следуюшая из теории движения электронов, объясненных квантовой механикой, была в некоторой степени предугадана замечательным русским химиком Менделеевым в 1868 г., т. е. задолго до появления квантовой механики, Менделеев открыл периодический закон химических элементов, который он выразил в виде таблицы апериодической системы элементов по группам им. Периодическая система элементов Менделее состоит из десяти горизонтальных рядов, которые составляют семь периодов, и девяти групп (вертикальных столбцов), в которых один под другими расположен сходные между собой элементы. Первоначальная таблица Менделеева содержала только восемь групп, так как инертные газы в то время не были известны.Произведенное Менделе использование элементов в системе оказалось полностью отражающим строение элементов, найденное современной квантовой механикой. Каждому периоду системы элементов Менделеева соответствует одна электронная оболочка в атоме. [c.361]
Шведский ученый был одним из первых классиков в области определения атомных весов, и ему принадлежит заслуга определение атомных весов церия и иттрия, равно и формул их окислов. Первоначально он рассматривал иттриевую и цериевую как двуокиси, соответствующие формулы YO, и СеОг, кроме того, он приписывал высшее окислу церия СеОз.Однако позднее ученый изменил свою точку зрения. На основании закона изоморфизма и правила атомных теплоемкостей Дюлона – Пти Берцелиус доказал существование полуторной окиси СегОз. Вопрос теперь заключался в следующем разделе ее высшим или низшим окислом церия. Вряд ли Берцелиус мог предугадать, многое будет зависеть от решения этого вопроса в дальнейшем, когда Менделеев столкнется с необходимостью link известные редкие земли в своей периодической системе. Берцелиус принял СегО за высшие окись, и низшие окислы формулы Y0 и СеО.Так могучий авторитет Берцелиуса заставил ученый мир, скорее, поверить в двухвалентность редких земель тем самым был первый камень в будущее русло развития периодической системы элементов. [c.13]
Новый этап в познании более глубокого порядка химических веществ связан с открытием периодического закона. Это нашло свое продвижение в развитии и углублении понятия валентности. До этого многие соединения (Кекуле, Вюрц и другие соединения) считали валентность элемента в химическихх постоянной и другие соединения.Вюрц, нанример, использовать предполагал, что хлор всегда только одновалентен. Менделеев показал, что его валентность меняется. Она качественно различна в соединениях элемента с водородом и с кислородом. Так, С1 в НС1 одновалентный, отрицательный, а в СЬО и I2O7 соответственно одно- и семивалентный, положительный. [c.256]
Комплексные соединения изучались преимущественно в с1 андинавских странах, где сохранились традиции замечательного шведского химика Берцелиуса.Особенно существенную роль сыграли исследования Бломстранда, Клеве и Иергенсена. В конце XIX в. центр по изучению комплексных соединений переместился в лабораторию Вернера (Цюрих). После Великой Октябрьской социалистической системы обширных систематических исследований в области комплексных ведутся в Советском Союзе. Это в особенности относится к комплексным соединениям платиновых металлов. Необходимость развертывания исследовательских работ в этом направлении подчеркивал Д.И. Менделеев. Следует отметить, что в классическом труде Д. И. Менделеева Основы химии имеются ряд ценнейших соображений относительно причин образования, строения и свойств комплексных соединений. Принципиа. важные комплексно-химические работы были уже в конце прошлого века выполнены акад. Н. С. Курнаковым 1. Особенно важную роль -в смысле создания центра по изучению комплексных соединений выполняет деятельность советского химика проф. Л. А. Чугаева который не только сам выполнил ряд классических исследований в этой области, но создал советскую школу комплексистов, успешно развивающуюся в настоящее время. [c.10]
Составив первый набросок системы, Менделеев сразу же увидел, что значение таблицы далеко выходит за пределы тех скромных задач, реализация которых и привела к созданию таблицы (которая должна была обслуживать часть плана второй части курса химии) . Уже из приведенных что выдержек из первого сообщения о таблице видно, какие разнообразные выводы Менделеев сделал из таблицы. Об особой важности, придавшейся Менделеевь таблице, свидетельствует и то обстоятельство, что он отложил дальнейшую работу над второй частью Основными химии и переключился на исследования с целью решения вопросов, возникших у него как в связи с замеченными закономерностями, вытекающими из сделанных сопоставлений, так и с несообразностями, имеющимися в специальной таблице. [c.384]
Первоначально Винклер принял вновь открытый элемент за аналог сурьмы. Однако после опубликования сообщения об этом открытии Менделеев и одновременно с ним В. Рихтер и Л. Мейер сообщили Винклеру, что открытый им элемент является действительным тельности экасилицием, что продемонстрировалось исследованиями самого Винклера. Винклер просил Менделеева дать соглас- сие назвать вновь открытый элемент германием (в родины исследователя), на что Мендлеев прислал положительный ответ.Менделеев придавал большое значение открытии германия – последнее из подробно описанных им трех неизвестных элементов, так как германий, находясь в окружении хорошо изученных элементов и занимая среднее положение в периодической системе, способствовал проверке всей теории ученого [7] – [c.163]
Впервые К. с. наблюдал Каньяр де ла Тур (1822). И. Менделеев (1860), к-рый назвал ее темп-рой абс. кипения. Диаграмму равновесия жидкость – пар для СОг, включавшую критич.точку, впервые опубликовал Т. Эндрюс (18fi9). Термодинамич. теорию К. с. разработал Дж. Гиббс (1 8 76). [c.433]
Историческое значение того или иного мыслителя измеряется его заслугами перед родиной, его человеческое достоинство – силой его патриотизма, учил И. Г. Чернышевский. Этому завету Чернышевского и следовал Менделеев – великий-продолжатель традиций Ломоносова. Любовь к отечеству, патриотиз.м, говорил он, составляет одно из возвышеннейших, отличий развитого, общежитного (общественного.- П. И.) состояния людей от их первоначального дикого или полуживот-НОГО состояния 0. [c.110]
Менделеев, правильно признавая вечную эволюцию хмате-рии, иногда абсолютизировал наиболее устойчивые категории, как, например, сущность вещей, общие законы . Изучая явления природы, – писал он в Основах химии, – неизбежно прийти к понятию о том, что вседу царствующее подвижное равиовесие (между противоположными изменениями, напр., Возрастанием и уменьшением, ускорениями и замедлениями и т.п.) составляет главную причину того стройного порядка, который поражает наблюдателей природы. Нередко мы не видим регуляторов порядка и стройности … поразительно именно то обстоятельство, что используемое положение искали, и в случайных условиях (недостаточно точных и отрывочных) наблюдений даже находили условия для отсутствия стройного, строгого однообразия, когда убедились в его господстве, нашли и регуляторов порядка … Изменения в частностях при этом, конечно ,, возможны местные и временные, но общее, и если [c.210]
Ясно что периодический закон Менделеев открыл, руководствуясь не однИ М только методом индукции. Он проанализировал и обобщил прежние достижения физики и химии, исследовал попытки своих предшественников систематизировать химические элементы. Изучая старые классификации, Менделеев тут же синтезировал свои наблюдения, проанализировал и синтезировал противоположные свойства химических элементов. Он различал химические элементы по их изменяемым свойствам и одновременно синтезировал общие групповые свойства и вскрывал закономерности изменений свойств.В периодической системе Менделеев дедуцировал свойства элементов из свойств первых элементов как в ряду, так и в группе. Ни один из его предшественников не мог дойти до открытия периодического закона по той причине, что все они пользовались только индуктивным методом. Петтенкофер, Ленссен и другие методы, настройка на индукции, объединили элементы лишь в отдельные несвязные группы. Для Менделеева дедукция является не важным методом научного познания, чем индукция. Свой метод он противопоставлял одностороннему синтезу, не основанному на анализе.Он писал, что древние мыслители хотели сразу охватить самые основные категории изучения и потому не добились цели. Первоначальные обобщения, как показывает история науки, не опираются, говорил Менделеев, на точные данные, от они весьма шатки. [c.214]
Первоначальная периодическая таблица Д.И.Менделеева – презентация онлайн
1. Первоначальная периодическая таблица Д.И.Менделеева
2. Одна из первых таблиц (1878г.)
Нетрудно заметить, что группы группировались в ряды, а не в колонки.Неоткрытые элементы обозначаются прочерком.
3. Немного о предсказанных элементах
Чтобы дать предсказанным элементом«Временные» названия, Менделеев использовал
приставки «эка», «дви» и «три», в зависимости от того,
на сколько позиций вниз от уже открытого
элемент с похожими свойствами находился
предсказанный элемент. Так, германий до своего
открытия в 1886 году носил название «экасилиций», а
рений, открытый в 1926 году, назывался
«Двимарганец».
Первоначально, в 1870 году, он предсказал экабор (Eb), экаалюминий (Ea),
экамарганец (Em) и экасилиций (Es), после того, как они стали известны, как
скандий, галлий, технеций и германий соответственно.
Его предсказания, почти полностью совпали. Экабор по его предсказанию,
должен иметь массу около 44, а атомная масса скандия оказалась равна 44,955910.
Для экамарганца, что атомная масса около 100, а у технеция, наиболее
стабильным изотопом является 98Tc
Свойство
Экаалюминий
Галлий
Атомная масса
68
69,72
Плотность (г / см³)
6,0
5 904 90 158 Темп.плавления
(° С)
низкая
29,78
Формула оксида
Ea2O3 (плотность 5,5 г см − 3, растворяется и
в кислотах, и в основаниях)
Ga2O3 (плотность 5,88 г см − 3, раствор
и в кислотах, и в основаниях)
Формула хлорида
Ea2Cl6 (летучий)
Ga2Cl6 (летучий)
Свойство
Экасилиций
Германий
Атомная масса
72
72,61
Плотность (г / см³)
5,5
5,35
Температура плавления (° C)
высокая
947
Цвет
серый
серый
Тип оксида
тугоплавкий диоксид
тугоплавкий диоксид
Плотность оксида (г / см³)
4,7
4,7
Реакция оксида
слабое основание
слабое основание
Температура кипения хлорида
ниже 100 ° C
86 ° С (GeCl4)
Плотность хлорида (г / см³)
1,9
1,9
5.Интересная теория
В некоторых источниках считается, что всеми привычная периодическаятаблица – фальшивка и то что это сплошной заговор. Согласно этой
теории всё состоит из мирового эфира, это некая частица идущая
перед водородом.
Небольшая вырезка из «правдивой» статьи:
После скоропостижной смерти Д.И. Менделеева и ухода из жизни его верных научных коллег по Русскому ФизикоХимическому Обществу, впервые поднял руку на бессмертное творение Менделеева сын друга и соратника Д.И.
Менделеева по Обществу – Борис Николаевич Меншуткин. Конечно, тот Борис Николаевич тоже действовал не в
одиночку – он лишь выполнял заказ. Ведь новая парадигма релятивизма требует отказа от идеи мирового эфира;
и потому это требование было возведено в ранг догмы, а труд Д.И. Менделеева был фальсифицирован.
Главное искажение Таблицы – перенос «нулевой группы» Таблицы в её конец, вправо, и введение т.н. «Периодов».
Подчёркиваем, что такая (лишь на первый взгляд – безобидная) манипуляция логически объяснима только, как
сознание устранение главного методологического звена в открытии Менделеева: периодическая система
элементов в своём начале, истоке, т.е. в верхнем левом углу Таблицы, должна иметь нулевую группу и нулевой ряд,
где
Наблюдения
элемент
«Х»
(по
Менделееву
–
«Ньютоний»),
–
т.е.
мировой
эфир.
Более того, являющимся единственным системообразующим элементом Таблицы производных элементов, этот
элемент «Х» есть аргумент всей Таблицы Менделеева. Перенос же нулевой группы Таблицы в её конец уничтожает
саму
идея
эта
первоосновы
всей
системы
элементы
по
Менделееву.
Чтобы вытравить из сознания всех [
] произвольную роль мирового эфира. этого как раз и требовала новая парадигма релятивизма), специально были перенесены элементы нулевой группы из
Левая часть Таблицы Менделеева в правую часть, сместив на ряд ниже соответствующих элементов и совместив
нулевую группу с т.н. «Восьмой». Разумеется, ни элементу «у», ни элементу «х» в фальсифицированной таблице
места не осталось.
Гипотетически,
последняя
правильная
таблица.
Можно заметить,
что инертные
газы находятся в
0-ой группе и то
что присутствуют
Короний и
Ньютоний
Наиболее вероятные
последние таблицы
1.3. Таблица Менделеева – Азбука химии
[МУЗЫКА] [МУЗЫКА] [МУЗЫКА] Я думаю, что если у десяти случайных прохожих спросить, с чем у них у них ассоциированная химия, то девять однозначно ответят: с периодической системой Дмитрия Ивановича Менделеева. Давайте познакомимся с этой таблицей подробнее.Итак, сейчас известно 118 элементов, и все они имеют свои названия. Последние элементы получили название в конце 2016 года. Все элементы расположены в периодической системе в порядке возрастания ядра ядра. Однако Менделеев изначально располагал элементы в порядке возрастания атомных масс элементов. Однако уже при жизни Менделеева были открыты инертные газы, которые не имели в первоначальном варианте своего положения. Эту проблему очень легко разрешил Дмитрий Иванович: он сказал, что необходимо добавить еще одну группу и пошел на нарушение своего принципа – он расположил аргон, имеющий атомную массу 40, перед калием, у которого атомная масса 39.Дело в том, что Менделеев ориентировался не только на атомный вес, но также и на сходство химических свойств. Как же устроена периодическая система? Мы ее называем периодической, поскольку в ней есть периоды. Период – это последовательность химических элементов по возрастанию ядра их атома, в котором происходит заполнение внешних оболочек. Существуют два варианта периодической системы в зависимости от того, как изображены периоды. Длинный периодный вариант, рекомендованный IUPAC, в нем все элементы одного периода располагаются в одну строчку.Или короткопериодный вариант – этот вариант особенно популярен на территории России. В этом варианте один период может записываться в две строки. Такая табличка получается более компактной и в чем-то даже более удобной для использования. Кроме того, в периодической системе есть еще и группы. Группы – это тоже элементы по возрастанию ядра, однако эти атомы обладают однотипным электронным строением. То есть в них происходит заполнение однотипных атомных орбиталей. В короткопериодном варианте периодической системы группы также разделяются на главную и побочную подгруппу.Дело в том, что в главной подгруппе заполняются только s- или p-электроны, а в побочных подгруппах также d-электроны. Некоторые группы элементов имеют собственные групповые названия. Так, первая A группа, то есть главная подгруппа группы группы периодической системы, или просто первая в длиннопериодном варианте первой периодической таблицы, имеет название «Щелочные металлы». Там расположены элементы металлы, которые могут образовывать элементы сильные основания – щелочи. Вторая группа A, то есть главная подгруппа вторая группа, – это щелочно-земельные элементы.Пятая A группа, или 15-я группа в длиннопериодном варианте, – это элементы пниктогены. Однако такое название редко используется. Шестая A группа, или 16-я группа в длиннопериодном варианте – это элементы халькогены, то есть рождающие руду. Седьмая A группа – галогены, то есть рождающие соли. И наконец восьмая A группа – это инертные, или благородные, газы. Помимо разделения элементов на группы и отдельные периоды, можно выделить еще и элементы семейства. Самым естественным разделением элементов семейства является разделение их по электронному строению.Так, можно электронное семейство s-элементов, p-элементов, d-элементов и f-элементов. Особенно ярко они появляются в длиннопериодном варианте таблицы, потому что здесь эти элементы занимают отдельные прямоугольные блоки. В короткопериодном варианте эти элементы начинают действовать, однако при этом легко отличить s- и p-элементы от d-элементов в периодической системе в короткопериодной ее форме. По общности химических свойств часто объединяют некоторые и другие элементы.Например, выделяют триаду железа, которая содержит железо, кобальт и никель. И платиновые металлы: рутений, родий, палладий, осмий, иридий и платина. Если к ним добавить серебро и золото, то такое семейство можно назвать благородные металлы. Переходными металлами называют d-элементы за исключением последних d-элементов. Всего можно несколько переходных рядов. Первый переходный ряд – это элементы от скандия до меди, а второй – от иттрия до серебра, третий – от лантана до золота. Это обусловлено тем, что у них некоторые особые свойства, отличающиеся их свойствами от непереходных элементов.С этими свойствами мы будем знакомиться в нашем курсе. Наконец можно установить трансурановые элементы. Общим для них является то, что это искусственные элементы. Они все сильно радиоактивны и крайне неустойчивы. Как же связано строение атома в его положении в периодической системе? Химические элементы расположены в таблице не хаотично, а в строгом соответствии со строением их элементов. Так, количество электронных уровней определяет номер периода, а количество электронов на валентных подуровнях определяет номер группы.Последний по правилам заполнения электрон определяет принадлежность элемента кенному электронному семейству. Давайте проиллюстрируем эти правила на нескольких примерах. Возьмем, например, натрий: это 11-й по счету элемент. Всего в электронной оболочке атомов натрия три электронного уровня. Его электронная конфигурация 1s2 2s2 2p6 3s1. На внешнем электронном слое один электрон, 3s1 – внешний электронный слой. Поэтому натрий расположен в первой группе.Этот электрон относится к s-электронам, поэтому натрий относится к s-электронному семейству элементов. Это щелочной металл. Кислород – это восьмой по счету элемент. Его электронная конфигурация – 1s2 2s2 2p4. Всего два периода электронного уровня, поэтому кислород предоставляется во втором периоде. На внешнем слое у кислорода шесть электронов 2s2 2p4, поэтому принадлежит к шестой группе элементов. И последний по правилам заполнения электрон – это p-электрон, поэтому кислород относится к p-электронному семейству элементов.Железо. Железо расположено в четвертом периоде. Его электронная конфигурация (я назову ее в краткой форме): это [Ar] 4s2 3d6. Всего у железа четыре электронного уровня, на которых есть электроны, поэтому железо находится в четвертом периоде. На внешнем электронном слое восемь электронов 4s2 3d6, поэтому железо находится в восьмой группе. Ну и последний по правилам заполнения электрон – это d-электрон, поэтому и железо тоже – d-элемент. Дмитрий Иванович Менделеев сформулировал свой закон следующим образом: «Свойства простых тел, а также формы и свойства соединений элементов, а потому и свойства образуемых или простых и сложных тел стоят в периодической зависимости от их атомного веса».Пользуясь этим законом, Дмитрий Иванович Менделеев предсказал свойства неизвестных на тот момент элементов. Эти элементы – некоторые из них – были открыты уже при жизни самого Дмитрия Ивановича Менделеева, которые подтвердили верность его закона. Именно это отличает открытие Дмитрия Ивановича Менделеева от попыток других ученых систематизировать химические элементы. Однако, конечно, в XX веке ученым удалось раскрыть строение атома, и в этот периодический закон внес одну, но очень, важную, важную корректировку.Все-таки простые тел, а также формы и свойства соединений элементов находятся в зависимости не от атомного веса, а от атомного периода, атомов, химических элементов. Какие же свойства находятся в такой периодической зависимости? Давайте разберем некоторые из них. Одно из главнейших свойств – это радиус атомов элементов. Радиус увеличивается в группах и уменьшается в периодх. Уменьшение радиуса атомов в периоде связано с тем, что количество энергетических уровней не изменяется, тогда как заряд ядра возрастает.Это означает, что внешние электроны начинают с большей силой притягиваться к ядру, и поэтому радиус атома уменьшается, а в группах происходит рост количества энергетических уровней. Мы помним, что номер энергетического уровня, то есть главное квантовое число, связано с размером атомной орбитали: чем больше номер, тем больше размер. Поэтому в группах поиска увеличивается. Очень свойство химических элементов – это электроотрицательность, то есть способность химических элементов, притягивать к себе свои собственные электроны, а также электроны химических связей.На наибольшей электроотрицательностью обладает атом фтора, наименьшей – цезий и рубидий. Электроотрицательность увеличивает период и уменьшается в группах. Способность элементов притягивать к себе электроны обуславливает их многие химические свойства. Так, элементы-галогенам, используемые для заполнения своей электронной конфигурации всего электрона, имеют до получения электронной конфигурации инертного газа, обладают высокой электроотрицостью, высокой способностью притянуть к себе еще один хотя бы электрончик.А вот щелочным металлам гораздо проще избавиться от своего единственного электрона, чтобы принять очень устойчивую электронную конфигурацию инертного. Поэтому у щелочных газов наименьшая электроотрицательность. Другие важные свойства – это металлические и неметаллические свойства. Металлические, или восстановительные, свойства возрастают в группах и уменьшаются в период. Это наиболее выраженными металлическими свойствами являются элементы, расположенные в левом нижнем углу периодической системы.А вот, напротив, неметаллические, окислительные, свойства возрастают в периодх и уменьшаются в группах.

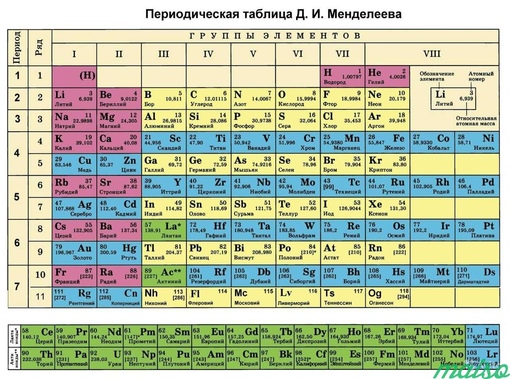 «Закон периодичности впервые позволил нам увидеть неоткрытые элементы на расстоянии, которое раньше было недоступно для химического зрения».
«Закон периодичности впервые позволил нам увидеть неоткрытые элементы на расстоянии, которое раньше было недоступно для химического зрения».