В России стартует международный год периодической таблицы химических элементов
В России сегодня стартует международный год периодической таблицы химических элементов. Дмитрий Менделеев 150 лет назад придумал стройную систему, которая позволила систематизировать не только известные на тот момент вещества, но и предсказать существование новых. Пустые клеточки в таблице Менделеева ученые заполняют до сих пор.
Это то, из чего состоим мы, все, что нас окружает, и из чего состоит сама вселенная – десятки химических элементов. 150 лет назад один человек обнаружил в этом кажущимся хаосе — фундаментальный закон природы. Таблица Менделеева и периодический закон – одно из величайший открытий человечества может поместиться на одной странице, но в ней все на своих местах.
Теодор Грэй — коллекционер химических элементов, в своей деревянной таблице или «столе Менделеева» положил за каждой ячейкой по образцу химического элемента. Красота и стройность периодического закона, открытого русским ученым, заразила Грея страстью к науке на всю жизнь.
Упорядочить химические элементы пытались многие ученые до Менделеева, в столбики и спирали, в группы по три или по семь, как музыкальные ноты, самые невероятные формы. Но головоломка не решилась — ученые пытались построить систему вокруг известных на тот момент элементов, а таких было всего чуть больше шестидесяти. Но таблица Менделеева изменила все.
« Она фактически предсказывала существование тех элементов, которых на тот момент еще не было, и у Менделеева оставались пустые клеточки, которые затем были заполнены элементами. То есть это предсказательный характер, основанный на периодичности свойств и на том, что свойства того или много элемента, они являются промежуточными между свойствами элементов, находящимися справа и слева», – объяснил профессор химического факультета МГУ Степан Колмаков.
Конечно, то, что таблица якобы приснилась Менделееву — всего лишь миф. Ученый рассказывал, что трудился над открытием годами. А последующие полтора века усердно работали уже другие, чтобы найти предсказанные элементы.
Кузница химических элементов — подмосковная Дубна. Там, в Объединенном институте ядерных исследований их открыли 10. Последние 20 лет, по сути ,только Дубнинские ученые и смогли продолжить заполнять таблицу Менделеева. Например, 118-й назвали оганесон в честь Юрия Оганесяна, который стоял во главе этих исследований. Новые элементы синтезируются с помощью огромных ускорителей.
«Двенадцать триллионов частиц в секунду проходят через мишень, и так эксперимент длится неделями, месяцами, для того, чтобы синтезировать несколько новых ядер. Вероятность образования этих новых ядер — очень мала. Но сегодня мы дошли до 118 — мы закрыли седьмой период периодической таблицы», – поделился директор лаборатории ядерных реакций им Флерова Объединенного института ядерных исследований Сергей Дмитриев.
Самый мощный в мире ускоритель, который называют фабрикой тяжелых элементов, будет запущен уже в этом году, и начнутся поиски 119 и 120. Место для которых в таблице уже, конечно, есть. За 150 лет периодический закон не дал сбоя.
Первый период периодической системы – это… Что такое Первый период периодической системы?
К пе́рвому пери́оду периоди́ческой систе́мы относятся элементы первой строки (или первого периода) периодической системы химических элементов. Строение периодической таблицы основано на строках для иллюстрации повторяющихся (периодических) трендов в химических свойствах элементов при увеличении атомного числа: новая строка начинается тогда, когда химические свойства повторяются, что означает попадание элементов с аналогичными свойствами в тот же вертикальный столбец. Первый период содержит меньше всего элементов (их всего два: водород и гелий) по сравнению с другими строками таблицы. Данное положение объясняется современной теорией строения атома.
Элементы
Водород
Водородная спектральная разрядная трубка Дейтериевая спектральная разрядная трубкаВодород (Н) является химическим элементом с атомным номером 1. При нормальной температуре и давлении водород представляет собой легковоспламеняющийся двухатомный газ без цвета, запаха и вкуса, неметалл, с молекулярной формулой H Водород является самым лёгким элементом с атомной массой 1,00794 а.е.м.[1]
Водород является самым лёгким элементом с атомной массой 1,00794 а.е.м.[1]
Водород является самым распространённым химическим элементом, составляя примерно 75% от массы всех элементов во Вселенной.[2] Звёзды в главной последовательности в основном состоят из водорода в состояние плазмы. В элементарном состоянии водород является относительно редким элементом на Земле, поэтому в промышленных масштабах он производится из таких углеводородов, как метан. Большинство элементарного водорода используется «немедленно» (имеется в виду локально на производственной площадке), крупнейшими почти равными рынками являются переработка ископаемого топлива, например, гидрокрекинг, и производство аммиака, в основном для рынка удобрений. Водород можно получить также из воды с помощью процесса электролиза, но при этом производство водорода получается коммерчески значительно дороже, чем из природного газа.
Наиболее распространенный изотоп водорода природного происхождения, известный как протий, имеет один протон и не имеет ни одного нейтрона. [4] В ионных соединениях он может либо получить положительный заряд, став катионом, состоящим из одного протона, либо приобрести отрицательный заряд, став анионом, известным как гидрид. Водород может вступать в соединения с большинством элементов, он присутствует в воде и в большинстве органических веществ.
[4] В ионных соединениях он может либо получить положительный заряд, став катионом, состоящим из одного протона, либо приобрести отрицательный заряд, став анионом, известным как гидрид. Водород может вступать в соединения с большинством элементов, он присутствует в воде и в большинстве органических веществ.
Взаимодействие водорода с различными металлами являются очень важным в металлургии, так как многие металлы испытывают водородное растрескивание, Растворимость водорода меняется при наличии локальных повреждений кристаллической решетки металла или при наличии примесей.[11]
Растворимость водорода меняется при наличии локальных повреждений кристаллической решетки металла или при наличии примесей.[11]
Гелий
Гелиевая спектральная разрядная трубкаГелий (He) является одноатомным инертным химическим элементом с атомным номером 2, без цвета, вкуса и запаха, нетоксичным, стоящим в начале группы благородных газов в периодической таблице.
Гелий был открыт в 1868 году французский астроном Пьером Жансеном, который первым обнаружил этот элемент по наличию неизвестной ранее жёлтой спектральной линии солнечного света во время солнечного затмения.[14] В 1903 году большие запасы гелия были найдены на месторождении природного газа в США, на сегодняшний день эта страна является крупнейшим поставщиком этого газа.[15] Гелий используется в криогенной технике,![]() [21] Вдыхая небольшой объём газа, можно на время изменить тембр и качество человеческого голоса.[22] Поведение жидкого гелия-4 в двух жидких фазах гелий I и гелий II имеет важное значение для исследователей, изучающих квантовую механику и явления сверхтекучести в частности,
[21] Вдыхая небольшой объём газа, можно на время изменить тембр и качество человеческого голоса.[22] Поведение жидкого гелия-4 в двух жидких фазах гелий I и гелий II имеет важное значение для исследователей, изучающих квантовую механику и явления сверхтекучести в частности,
Гелий является вторым по лёгкости элементом и вторым по распространённости в наблюдаемой Вселенной.[25] Большинство гелия образовалось во время Большого взрыва, но и новый гелий постоянно создаётся в результате слияния ядер водорода в звездах.[26] На Земле гелий относительно редок, он образуется в результате естественного распада некоторых радиоактивных элементов,[27] потому что альфа-частицы, которые при этом испускаются, состоят из ядер гелия. Этот радиогенный гелий улавливается в составе природного газа в концентрациях до семи процентов от объема, [29]
[29]
В традиционном изображении периодической таблицы гелий находится над неоном, что отражает его статус благородного газа, однако иногда, как, например, в таблице Менделеева Джанета, он находится над бериллием, что отражает строение его электронной конфигурации.
Примечания
- ↑ Hydrogen – Energy. Energy Information Administration.
- ↑ Palmer, David
- ↑ Staff Hydrogen Basics — Production. Florida Solar Energy Center (2007).
- ↑ Sullivan, Walter. Fusion Power Is Still Facing Formidable Difficulties, The New York Times (11 марта 1971).
- ↑ “hydrogen”, Encyclopædia Britannica, 2008
- ↑ Eustis, S. N. (2008-02-15). «Electron-Driven Acid-Base Chemistry: Proton Transfer from Hydrogen Chloride to Ammonia». Science 319 (5865): 936–939. DOI:10.1126/science.1151614.
 PMID 18276886.
PMID 18276886. - ↑
- ↑ Rogers, H. C. (1999). «Hydrogen Embrittlement of Metals». Science 159 (3819): 1057–1064. DOI:10.1126/science.159.3819.1057. PMID 17775040.
- ↑ Christensen, C. H., Nørskov, J. K.; Johannessen, T.. Making society independent of fossil fuels — Danish researchers reveal new technology, Technical University of Denmark (July 9, 2005).
- ↑ Takeshita, T.; Wallace, W.E.; Craig, R.S. (1974). «Hydrogen solubility in 1:5 compounds between yttrium or thorium and nickel or cobalt». Inorganic Chemistry 13 (9): 2282–2283. DOI:10.1021/ic50139a050.
- ↑ Kirchheim, R. (1988). «Hydrogen solubility and diffusivity in defective and amorphous metals». Progress in Materials Science 32 (4): 262–325. DOI:10.1016/0079-6425(88)90010-2.
- ↑ Helium: the essentials.
 WebElements.
WebElements. - ↑ Helium: physical properties. WebElements.
- ↑ Pierre Janssen. MSN Encarta.
- ↑ Theiss, Leslie Where Has All the Helium Gone?. Bureau of Land Management (18 января 2007).
- ↑ Timmerhaus, Klaus D. Cryogenic Engineering: Fifty Years of Progress. — Springer. — ISBN 0-387-33324-X
- ↑
- ↑ “helium dating”, Encyclopædia Britannica, 2008
- ↑ Brain, Marshall How Helium Balloons Work. How Stuff Works.
- ↑ Jiwatram, Jaya The Return of the Blimp. Popular Science (10 июля 2008).
- ↑ (2005-02-01) «When good GTAW arcs drift; drafty conditions are bad for welders and their GTAW arcs.». Welding Design & Fabrication.
- ↑ Montgomery, Craig Why does inhaling helium make one’s voice sound strange?.

- ↑ Probable Discovery Of A New, Supersolid, Phase Of Matter. Science Daily (3 сентября 2004).
- ↑ Browne, Malcolm W.. Scientists See Peril In Wasting Helium; Scientists See Peril in Waste of Helium, The New York Times (21 августа 1979).
- ↑ Helium: geological information. WebElements.
- ↑ Cox, Tony Origin of the chemical elements. New Scientist (3 февраля 1990).
- ↑ Helium supply deflated: production shortages mean some industries and partygoers must squeak by., Houston Chronicle (5 ноября 2006).
- ↑ Brown, David Helium a New Target in New Mexico. American Association of Petroleum Geologists (2 февраля 2008).
- ↑ Voth, Greg. Where Do We Get the Helium We Use?, The Science Teacher (1 декабря 2006).
Ссылки
Учёные из Дубны дополнили таблицу Менделеева
Ученым из подмосковной Дубны удалось устранить еще один пробел в таблице Менделеева. В пустующей 117-й ячейке появился новый сверхтяжелый элемент. Официального имени ему пока не присвоили. Ученые называют его скромно – унунсептий.
В пустующей 117-й ячейке появился новый сверхтяжелый элемент. Официального имени ему пока не присвоили. Ученые называют его скромно – унунсептий.
Эксперимент, продолжавшийся пять месяцев в циклотроне Объединённого института ядерных исследований, принёс учёным долгожданную награду – шесть ядер 117-го элемента Периодической таблицы. Подробнее об этом – Юрий Оганесян – научный руководитель лаборатории ядерных реакций имени Флёрова, академик РАН, доктор физико-математических наук: “Эксперимент шел 140 дней непрерывно, и в результате этого облучения мы увидели 6 атомов, которые указывали на образование и распад 117-го элемента. Среди шести атомов – сразу два изотопа соседних. Один из них распадается за 25 секунд, а другой распадается за 22 часа”.
Для ученых это большая победа. История открытия началась в июне прошлого года. Американские специалисты из Окриджской национальной лаборатории синтезировали 20 миллиграммов сверхчистого 97-го элемента – берклия – и отправили его в подмосковную Дубну. Российские учёные – признанные лидеры в синтезе сверхтяжёлых элементов.
Российские учёные – признанные лидеры в синтезе сверхтяжёлых элементов.
В институте ядерных исследований были получены элементы с атомными номерами до 116-го и самый тяжёлый – 118-й. Между ними существовала пустота. Чтобы её заполнить, атомы берклия в циклотроне подвергали обстрелу ионами кальция. Учёные торопились. Время эксперимента было строго ограничено.
Сверхтяжёлых элементов в природе не существует. Искусственно созданные они быстро распадаются. Например, время полураспада берклия – 320 дней. “Для того чтобы его накопить в достаточном количестве, нужен очень мощный реактор, – поясняет Юрий Оганесян. – Использование самого мощного реактора позволило получить 22 грамма этого уникального вещества”.
Пока у открытого элемента нет имени. Неофициально его обозначают унунсептий. Атомный номер – 117. Давать официальное название до подтверждения результатов опытов учёные не спешат. Это считается своего рода “плохой кармой”.
“Западные ученые тоже пытаются синтезировать эти элементы, но у них не получается”, – отмечает заместитель директора по научной работе НИИ ядерной физики имени Скобелицына, профессор Виктор Саврин.
Пока открытие проверяется, учёные уже рассуждают о его важности. Элементы, стоящие в таблице за ураном, – искусственного происхождения. Чем выше их атомный номер, тем быстрее они распадаются. Но жизнь последних, полученных в Дубне, элементов стала, напротив, увеличиваться.
Специалисты высказали гипотезу о том, что существует своего рода “островок стабильности” в районе элементов с атомным номером 126 или даже 120. К работам над его синтезом российские специалисты из Объединённого института ядерных исследований намерены приступить через год. Тогда, возможно, учёные смогут ответить на вопрос, имеет ли периодическая таблица границу, и, если да, то где она.
Первый элемент периодической системы элементов 7 букв
Ad
Ответы на сканворды и кроссворды
Водород
Первый элемент периодической системы элементов 7 букв
НАЙТИ
Похожие вопросы в сканвордах
-
Первый элемент периодической системы элементов.
 Широко распространён в природе. Катион самого распространённого изотопа водорода 1H 7 букв
Широко распространён в природе. Катион самого распространённого изотопа водорода 1H 7 букв
- Второй порядковый элемент периодической системы химических элементов Д. И. Менделеева, с атомным номером 2. Расположен в главной подгруппе восьмой группы, первом периоде периодической системы. Возглавляет группу инертных газов в периодической таблице. Обозначается символом He. Простое вещество гелий 5 букв
- Элемент главной подгруппы восьмой группы, третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 18. Обозначается символом Ar. Третий по распространённости элемент в земной атмосфере 5 букв
Похожие ответы в сканвордах
- Водород – Химический элемент, самый легкий газ, в соединении с кислородом образующий воду 7 букв
- Водород – Химический элемент 7 букв
- Водород – Компонент аммиака 7 букв
- Водород – Химический элемент, легкий газ 7 букв
-
Водород – Английский химик уильям праут, живший в первой половине 19 века, считал это “первичной материей”, посредством конденсации которой образовались все элементы.
 назовите это 7 букв
назовите это 7 букв
- Водород – Всего их 108, названия имеют 105, из них 2 необщепринятых. Как называется первый 7 букв
- Водород – Германия находится на 32 месте, Россия- на 44, Польша- на 84, Франция- на 87, а Америка- только на 95. А на первом 7 букв
- Водород – Какой химический элемент (атомный номер 1) обозначается символом H 7 букв
- Водород – Какому элементу принадлежит латинское название Hydrogenium 7 букв
- Водород – Легкий, горючий и крайне взрывоопасный в смеси с воздухом газ 7 букв
- Водород – Самый легкий газ 7 букв
- Водород – Самый легкий химический элемент 7 букв
-
Водород – Самый легкий хим.
 элемент 7 букв
элемент 7 букв
- Водород – Химический элемент с атомной массой 1, 2 и 3 7 букв
- Водород – Химический элемент, легкий горючий газ без цвета, запаха и вкуса, в соединении с кислородом образующий воду 7 букв
- Водород – Химический элемент, стоящий под номером 1 в таблице Менделеева 7 букв
- Водород – Что надо сжечь, чтобы получилась вода 7 букв
- Водород – Самый распространенный хим. элемент космоса 7 букв
- Водород – Хим. элемент, легкий газ 7 букв
- Водород – НВОДОРОД 7 букв
-
Водород – Первый элемент периодической системы элементов. Широко распространён в природе.
 Катион самого распространённого изотопа водорода 1H 7 букв
Катион самого распространённого изотопа водорода 1H 7 букв
- Водород – Самый распространенный химический элемент во Вселенной 7 букв
- Водород – Очень лёгкий газ 7 букв
- Водород – Взрывоопасный газ 7 букв
- Водород – H (хим.) 7 букв
- Водород – №1 в таблице Менделеева 7 букв
- Водород – Самый лёгкий элемент 7 букв
- Водород – Дейтерий 7 букв
- Водород – Лёгкий бесцветный газ 7 букв
- Водород – Газ без цвета, запаха и вкуса 7 букв
- Водород – Легкий, горючий и крайне взрывоопасный в смеси с воздухом газ 7 букв
- Водород – Газ в составе воды 7 букв
- Водород – «Н» втаблице Менделеева 7 букв
- Водород – Газ из которого в основном состоит юпитер 7 букв
Таблицу Менделеева хотят расширить до 173 элементов // Смотрим
Последний химический элемент таблицы Менделеева сегодня имеет номер 118. Речь об элементе под названием оганесон. Но расчёты физиков и химиков указывают на то, что мы вполне можем получить 173 элемента. Как это реализовать, ученые обсуждают в Дубне на международном совещании “Сверхтяжелые элементы”. В дискуссии участвуют президент РАН Александр Сергеев и члены Совета РАН по физике тяжелых ионов.
Речь об элементе под названием оганесон. Но расчёты физиков и химиков указывают на то, что мы вполне можем получить 173 элемента. Как это реализовать, ученые обсуждают в Дубне на международном совещании “Сверхтяжелые элементы”. В дискуссии участвуют президент РАН Александр Сергеев и члены Совета РАН по физике тяжелых ионов.
Совещание проходит в Дубне, так как именно здесь, в Лаборатории ядерных реакций Объединенного института ядерных исследований, впервые в мире был синтезирован тот самый “конечный” 118-й элемент, а также пятерка других – со 113-го по 117-й.
Кстати, элемент под номером 118 назван оганесоном в честь академика Юрия Оганесяна, научного руководителя Лаборатории ядерных реакций. Его команда создала все шесть сверхтяжелых химических элементов от номера 113 до номера 118.
Известный на весь мир советский и российский учёный Юрий Цолакович Оганесян. Сейчас академику 88 лет.
Как дополнить Природу своими рукамиЧеловечество в лице великих ученых еще в начале ХХ века пришло к выводу, что химические элементы можно не только находить в природе, но и создавать искусственно.
Первым “искусственным” элементом стал технеций, стоящий в таблице Менделеева под номером 43. Его синтезировали в 1937 году, а впоследствии обнаружили в ничтожных количествах в природе.
Сверхтяжелых элементов с номерами от 95-го до 118-го в природе не существует. Да и в стенах лаборатории сверхтяжелые элементы живут доли секунды.
Жизнь таких элементов столь коротка из-за их супертяжелых ядер, в которых в невероятной тесноте обитают почти три сотни протонов и нейтронов.
Напомним, что из протонов и нейтронов состоят ядра всех химических элементов. Но, чем больше в ядре протонов и нейтронов, тем сильнее взаимодействия между ними – как в толпе вагона метро.
Подобно выскакивающим из набитого вагона пассажирам, из переполненного ядра всякого сверхтяжелого элемента с облегчением вылетает на волю компания из двух протонов и двух нейтронов – альфа-частица. Так сверхтяжелый элемент превращается в более легкий и “жизнеспособный”. Этот процесс физики называют альфа-распадом.
Таким образом, все сверхтяжелые элементы радиоактивны. И это объясняет, почему сверхтяжелых элементов нет в природе. Даже если они и образуются где-то в естественных условиях, человечество их попросту не может “поймать”.
Так что синтез сверхтяжелых элементов сравним с актом творения Природы. Это сверхзадача, которая удивительным образом оказалась под силу человеку – его мысли и его технологиям.
Временная шкала показывает, когда открывались те или иные элементы. Перевод Вести.Ru.
Есть ли пределы у Природы?Создатели сверхтяжелых элементов, конечно, думали над вопросом, какое максимальное число протонов и нейтронов можно объединить в ядро и окружить облаком из электронов, чтобы такую конструкцию можно было назвать химическим элементом.
Четыре года назад группа новозеландских и американских физиков заявила: на оганесоне таблица Менделеева закончилась, и химическим элементам с номерами 119 и 120 уже не бывать.
Однако более поздние расчеты французских, шведских, польских, финских специалистов показали, что на оганесоне таблица Менделеева не закончится. Номер последнего элемента таблицы Менделеева – 173!
До него, конечно, еще нужно добраться, но дубненским физикам технология их создания уже понятна.
Для синтеза элементов выше 118-го в Объединенном институте ядерных исследований недавно построили “Фабрику сверхтяжелых элементов”. Там собираются начать синтез химических элементов под номерами 119 и 120 осенью 2021 года.
Куда применить сверхтяжелые элементы?Сверхтяжелые элементы могут стать волшебным инструментом получения частиц из пустоты, то есть из вакуума. Осуществить эту известную идею в Дубне на коллайдере NICA предложил 30 июня академик Юрий Оганесян. Коллайдер сейчас строится в Дубне и должен войти в строй через два года.
Согласно физической теории, сильное электрическое поле может рождать в вакууме пару двух частиц – электрон и позитрон. Позитрон – это античастица для электрона. Он всем похож на электрон, только заряжен положительно.
Позитрон – это античастица для электрона. Он всем похож на электрон, только заряжен положительно.
Еще никому в мире не удалось получить электрон-позитронную пару из вакуума с помощью электрического поля.
Но коллайдер NICA будет способен ускорять тяжелые ядра урана. В ядре урана 92 протона. При сближении двух тяжелых ядер урана возникает очень сильное электрическое поле. Его создают заряды обоих ядер. Это сильное поле должно рождать в вакууме пару двух элементарных частиц – электрон и позитрон.
Что при этом будет происходить? Один протон из ядра урана будет забирать рожденный из вакуума электрон и превращаться вместе с ним в нейтрон. После этого в ядре урана останется 91 протон, а нейтронов станет на один больше.
Позитрон же улетит восвояси. Его “увидит” детектор, после чего физики сообщат миру о фундаментальном событии – рождении электрон-позитронной пары из вакуума с помощью электрического поля. Такое вот волшебство.
Второй вариант вынашивания и рождения электрон-позитронной пары из вакуума: создание сильного электрического поля с помощью мощного лазера.
Период полураспада сверхтяжелых элементов исчисляется долями секунд. Перевод Вести.Ru.
Президент РАН Александр Сергеев в ходе своего доклада перед участниками совещания дополнил перечень новых физических явлений, которые можно будет получить на российских установках с помощью такого лазера. Также академик озвучил необходимые параметры такого инструмента.
К примеру, для рождения электрон-позитронной пары понадобится петаваттный лазер, то есть лазер мощностью 10-100 петаватт. Один петаватт равен 1015 Вт.
Лазерный центр такой выдающейся мощности для ядерно-физических исследований академик Сергеев предложил построить в Дубне. Его созданием инженеры займутся после завершения строительства коллайдера NICA.
Ранее мы сообщали о создании физиками новой периодической системы химических элементов, отражающей законы ядерной физики, а не химии.
Больше новостей из мира науки вы найдёте в разделе “Наука” на медиаплатформе “Смотрим”.
Церемония открытия Международного года Периодической таблицы химических элементов в штаб-квартире ЮНЕСКО
1 марта 2019 году исполняется 150 лет со дня открытия Периодического закона Д.И. Менделеева, который впоследствии воплотился в виде Периодической таблицы химических элементов. Это событие оказало огромное влияние на фундаментальную науку и способствовало становлению и развитию ядерной медицины, молекулярной биологии, нанотехнологий и многих других социально значимых направлений прикладных исследований. В связи с этим, Генеральная ассамблея ООН провозгласила 2019 год Международным годом Периодической таблицы химических элементов.
29 января 2019 года в штаб-квартире ЮНЕСКО в Париже (Франция) состоялась торжественная Церемония открытия Международного года Периодической таблицы химических элементов. На протяжении целого дня проходили круглые столы с участием представителей со всего мира. С докладами выступали такие звезды мировой науки, как лауреат Нобелевской премии 2017 года Бен Феринга (создатель «наноавтомобиля») и академик РАН Юрий Цолакович Оганесян (в честь которого назван 118-ый элемент Периодической таблицы Менделеева). Обсуждались значения фундаментальных исследований для устойчивого развития прикладной науки и профессионального образования. Сеченовский университет в составе официальной российской делегации на Церемонии представлял аспирант кафедры химии Института фармации Терехов Роман Петрович.
С докладами выступали такие звезды мировой науки, как лауреат Нобелевской премии 2017 года Бен Феринга (создатель «наноавтомобиля») и академик РАН Юрий Цолакович Оганесян (в честь которого назван 118-ый элемент Периодической таблицы Менделеева). Обсуждались значения фундаментальных исследований для устойчивого развития прикладной науки и профессионального образования. Сеченовский университет в составе официальной российской делегации на Церемонии представлял аспирант кафедры химии Института фармации Терехов Роман Петрович.
Сеченовский университет наук о жизни традиционно отводит важное место в образовательных программах для фундаментальных наук, знание которых выступает в качестве базиса для создания профессиональных компетенций у будущих врачей и провизоров. Понимание основополагающих законов природы необходимо для правильного формирования клинического мышления. Умение ориентироваться в биологических, физических и химических данных позволяет адаптироваться к быстро изменяющимся условиям, в которых существует современные медицина и фармация. Осознавая важность фундаментальных исследований для развития науки, в 2018 году Сеченовский университет начал осуществлять подготовку специалистов по направлениям бакалавриата «Механика и математическое моделирование», «Информационные системы и технологии», «Материаловедение и технологии материалов» и «Наноматериалы», которые пользуются заслуженным вниманием у абитуриентов.
Осознавая важность фундаментальных исследований для развития науки, в 2018 году Сеченовский университет начал осуществлять подготовку специалистов по направлениям бакалавриата «Механика и математическое моделирование», «Информационные системы и технологии», «Материаловедение и технологии материалов» и «Наноматериалы», которые пользуются заслуженным вниманием у абитуриентов.
Церемония открытия Международного года Периодической таблицы химических элементов послужила уникальным форумом для ведущих исследователей с мировым именем и талантливых молодых ученых со всего света для обсуждения актуальных проблем высшего образования и науки.
, который является первым элементом химии класса 11 периодической таблицы CBSE
Подсказка: Периодическая таблица представляет собой табличное отображение химических элементов, встречающихся в природе или созданных руками человека. Элементы упорядочиваются периодически на основе атомного номера, электронной конфигурации и химических свойств. Современная периодическая таблица Менделеева, которую мы используем сегодня, была предложена Дмитрием Менделеевым и поэтому известна как периодическая таблица Менделеева.
Современная периодическая таблица Менделеева, которую мы используем сегодня, была предложена Дмитрием Менделеевым и поэтому известна как периодическая таблица Менделеева. Полный шаг за шагом Ответ:
Современная таблица Менделеева состоит из элементов стоимостью 118 $, из которых 94 $ являются естественными, остальные созданы руками человека.1} $ конфигурации, он напоминает щелочные металлы. Но энергия ионизации очень высока и сравнима с галогенами. Подобно галогенам, он неметалл и принимает электрон для завершения своей валентной оболочки. С учетом многих других факторов, таких как температура плавления и кипения, реакционная способность по отношению к металлам и неметаллам, водород помещен в группу $ 1 $ и период $ 1 $ периодической таблицы.
Примечание:
Водородная связь – это электростатическое притяжение между атомом водорода и любыми электроотрицательными элементами, такими как N, F, O.Хотя они слабее, чем полностью ковалентные или ионные связи, они неизбежны при формировании структуры ДНК и белков. Кроме того, водородные связи определяют стабильность, структуру и физические или химические свойства (например, высокие температуры кипения) многих органических и неорганических соединений.
Кроме того, водородные связи определяют стабильность, структуру и физические или химические свойства (например, высокие температуры кипения) многих органических и неорганических соединений.
Какой химический элемент был обнаружен впервые?
Поскольку 2019 год объявлен Генеральной Ассамблеей Организации Объединенных Наций Международным годом Периодической таблицы химических элементов, мы отмечаем все элементарные элементы.В этой статье мы рассмотрим, какой химический элемент был открыт первым.
Древние химические элементы
На самом деле есть два ответа на вопрос «какой химический элемент был открыт первым?», Потому что существует ряд элементов, о которых мы знали с древних времен. Конечно, они не были признаны элементами в том виде, в каком мы их знаем сегодня, но сера (S), серебро (Ag), олово (Sn), сурьма (Sb), золото (Au), углерод (C), ртуть (Hg) , и свинец (Pb) были известными материалами на протяжении тысячелетий.
Например, у нас есть свидетельства использования меди еще с 9000 г. до н.э., когда она использовалась для изготовления бус и украшений, а золотые артефакты и украшения были датированы до 6000 г. до н.э.
до н.э., когда она использовалась для изготовления бус и украшений, а золотые артефакты и украшения были датированы до 6000 г. до н.э.
«Первый» химический элемент
Фосфор (P) был первым химическим элементом, который был открыт после древних времен немецким алхимиком Хеннигом Брандом в 1669 году. В то время Бранд пытался создать философский камень, легендарное алхимическое вещество, которое, как считалось, превращало металл в золото. .Для этого он экспериментировал с мочой, выпаривая ее с образованием солей. Довольно отвратительно, но Бранд оставил мочу гнить, а затем превратил ее в пасту, нагрел ее и пропустил пары тепла через воду. Он считал, что эти пары затем конденсируются в золото. Они этого не сделали.
Однако побочным продуктом этого мрачного эксперимента было белое вещество, которое светилось в темноте и горело ярким светом. Бренд назвал его phosphorus mirabilis , что означает «чудесный носитель света».
О фосфоре
Существует две основные формы элементарного фосфора: белый фосфор и красный фосфор. Оба они настолько реакционны, что никогда не встречаются в виде свободных элементов, но фосфор действительно встречается в минералах в виде фосфата, который можно найти в земной коре.
Оба они настолько реакционны, что никогда не встречаются в виде свободных элементов, но фосфор действительно встречается в минералах в виде фосфата, который можно найти в земной коре.
Фосфор также содержится в организме человека и составляет 1% от веса нашего тела – фосфаты являются компонентом ДНК. В настоящее время фосфор в основном используется в промышленности в качестве удобрения, а также в качестве пестицида, добавки и нервно-паралитического агента.
Заявление об ограничении ответственности
Весь контент, опубликованный в блоге ReAgent.co.uk, предназначен только для информации. Блог, его авторы и аффилированные лица не несут ответственности за несчастные случаи, травмы или ущерб, причиненные частично или непосредственно в результате использования предоставленной информации. Кроме того, мы не рекомендуем использовать какие-либо химические вещества без ознакомления с Паспортом безопасности материала (MSDS), который можно получить у производителя. Вы также должны следовать всем советам по безопасности и мерам предосторожности, указанным на этикетке продукта.Если у вас есть вопросы, связанные со здоровьем и безопасностью, посетите HSE.gov.uk.
Вы также должны следовать всем советам по безопасности и мерам предосторожности, указанным на этикетке продукта.Если у вас есть вопросы, связанные со здоровьем и безопасностью, посетите HSE.gov.uk.
Japan дает своему первому элементу имя, и это nihonium
Может быть сюрпризом, сколько времени и размышлений уходит на присвоение имен элементам – пройдет еще пять месяцев, прежде чем последние имена будут высечены в камне. Для любителей химии по всему миру эти имена – больше, чем просто ярлык.
Четыре новых элемента периодической таблицы, предварительно названные московий, теннессин, оганессон и нихоний, завершат седьмую строку периодической таблицы.Для многих ученых добавление этих имен вызывает праздник.
Это волнение особенно распространено в Японии, поскольку нихоний – первый элемент, обнаруженный в азиатской стране. Эрик Шерри, профессор химии Калифорнийского университета в Лос-Анджелесе и эксперт по периодической таблице Менделеева, считает, что у японцев есть все основания для гордости.
«Я думаю, это очень важное дело. На самом деле мне пришло в голову, что это было почти научным эквивалентом того, что Хиллари Клинтон стала первой женщиной, номинированной на премию U.С. президентские выборы », – говорит Шерри. “Это первый”.
Благодаря исследованиям, проведенным Косуке Морита из RIKEN Nishina Center for Accelerator-Based Science, Азия может быть официальным участником периодической таблицы. На данный момент элементы еще не поступили из лабораторий в Океании или Африке.
«Наука была в значительной степени исключительно западным делом, по крайней мере, в том, что касалось наименования элементов», – говорит Шерри.
Национальную гордость можно ощутить в самом слове, так как нихоний назван в честь «Нихон», японского слова, обозначающего Японию.Процесс присвоения имен элементам длинный и подробный, так как предлагаемые имена должны соответствовать определенному набору руководящих принципов, контролируемых Международным союзом теоретической и прикладной химии (IUPAC). Элементы могут быть названы в честь минералов, мест, свойств элементов, ученых и даже мифологических персонажей.
Элементы могут быть названы в честь минералов, мест, свойств элементов, ученых и даже мифологических персонажей.
Шерри относится к элементу торий, который был назван в честь норвежского бога Тора. Это лишь один из примеров того, как именование элементов вышло за рамки науки.
В течение следующих пяти месяцев статус этих имен будет открыт для комментариев широкой общественности.Учитывая, что таблица Менделеева существует как универсальный инструмент, у земного шара будет шанс взвесить новые дополнения.
«Это очень символично из-за статуса таблицы Менделеева, это своего рода священная таблица для химиков и физиков, и фактически для всех ученых», – говорит Шерри. «На самом деле очень важно быть помещенным на этом столе».
С тех пор, как нихоний скоро займет место в таблице Менделеева, Япония купается в свете научной славы.
Элементы и когда они были впервые обнаружены | Сильвия Пауэлл
Задумывались ли вы когда-нибудь о том, как давно был обнаружен первый элемент Периодической таблицы элементов? И сколько элементов было найдено до создания Периодической таблицы? И кто именно нашел все эти элементы? Что ж, у меня есть ответы на эти животрепещущие вопросы. Хотя ответы заставят вас глубже погрузиться в очень долгую историю открытия элементов. Я говорю о 9000 году до н. Э. Итак, первый элемент был обнаружен 11 000 лет назад!
Хотя ответы заставят вас глубже погрузиться в очень долгую историю открытия элементов. Я говорю о 9000 году до н. Э. Итак, первый элемент был обнаружен 11 000 лет назад!
Начнем с самых ранних элементов. Медь была самым первым элементом, обнаруженным еще в 9000 году до н. Э., Что кажется почти невероятным, если у ученых тогда были способности и интеллект, чтобы открыть новый элемент, когда они с ним столкнулись. Это действительно заставляет задуматься, какие времена мы любили тогда, и осознавали ли они, насколько масштабным на самом деле было открытие первого элемента !? В течение следующих 4000 лет были обнаружены более популярные металлические элементы: свинец, железо, серебро и золото.Металл обычно использовался для изготовления простых инструментов, структур и украшений, конечно, поэтому он соответствует тому, что они были одними из первых найденных элементов.
В 1800-х годах наблюдался рост открытия таких элементов, как щелочные металлы, металлы пост-переходного периода и лантаноиды.
В течение следующих 6700 лет горстка других элементов была обнаружена в регионах Ближнего Востока, таких как Египет и Римская империя. Но только в 1700-х годах Периодическая таблица действительно начала наполняться множеством открытий новых элементов благодаря огромным достижениям науки за это время.Ученые учились разбивать атомы и другие соединения и находить крошечные кусочки, из которых они состоят, элементы. Между 1766 и 1772 годами были открыты некоторые из наиболее важных элементов, которые составляют большую часть нашей Земли и атмосферы: водород, кислород и азот.
Чтобы лучше взглянуть на все элементы, которые были открыты в 1700-х годах:
В 1800-х годах наблюдался рост открытий элементов, которые были более щелочными металлами, постпереходными металлами и лантанидами.
И хотя все это продолжалось более 100 лет, Периодическая таблица еще не была создана! Наконец, он был создан Дмитрием Менделеевым в 1869 году, и он даже предусмотрительно оставил в таблице множество открытых пространств для любых будущих элементов, которые еще не были обнаружены.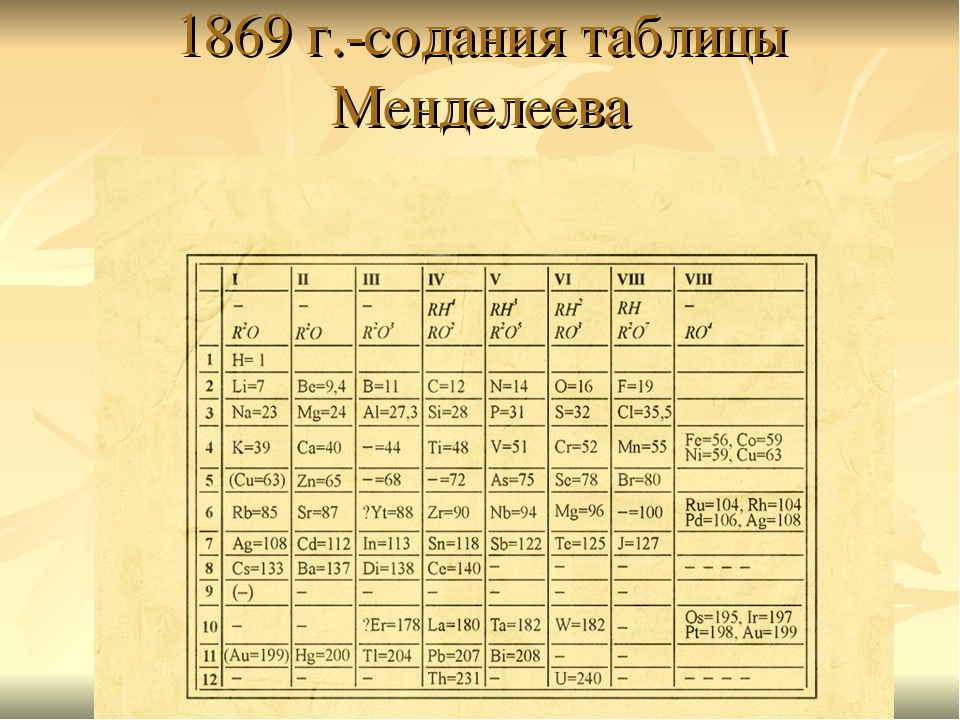
Но на этом открытия не закончились. Хотя в начале 1900-х они немного замедлились, к 1930-м годам ученые начали работать над исследованиями ядерного оружия и поэтому начали работать с атомами гораздо большего размера, чем раньше.И в этих больших атомах было много неизвестных материалов, которые они могли обнаружить и идентифицировать. В период с 1940 по 1966 год благодаря этим ядерным исследованиям ученые открыли более 10 актинидных элементов.
С тех пор постоянно открываются новые элементы, самые свежие из которых даже были обнаружены в 2009 году! Элементом был Tennessine, найденный в России, кому интересно. Ознакомьтесь с полной шкалой времени, когда элементы были обнаружены здесь. И взгляните на периодическую таблицу первооткрывателей ниже (которую также можно найти по ссылке выше).
Как во Вселенной появился первый химический элемент?
В: Как во Вселенной появился первый химический элемент?
Candy Ye
Мельбурн, Австралия
A : Сразу (намного меньше, чем через секунду) после Большого взрыва Вселенная была слишком горячей и слишком плотной для формирования элементов. Водород не появлялся до тех пор, пока Вселенная не распространилась – и впоследствии не остыла – настолько, чтобы образовались первые протоны и нейтроны, а затем и простые атомы.
Водород не появлялся до тех пор, пока Вселенная не распространилась – и впоследствии не остыла – настолько, чтобы образовались первые протоны и нейтроны, а затем и простые атомы.
Примерно через 10–12–10–6 секунд после Большого взрыва образовались нейтрино, кварки и электроны. Протоны и нейтроны начали формироваться вскоре после Большого взрыва, примерно через 10-6–1 секунду. Примерно через 3 минуты после Большого взрыва условия достаточно остыли, чтобы эти протоны и нейтроны образовали ядра водорода. Это называется эпохой нуклеосинтеза. Некоторые из этих ядер вместе образовали гелий, хотя и в гораздо меньших количествах (всего несколько процентов). Но примерно через 20 минут нуклеосинтез закончился, и новые ядра не могли образоваться.
Проблема на этом этапе заключалась в том, что электроны не могли оставаться на орбите вокруг какого-либо атомного ядра из-за огромного тепла и излучения, все еще заполняющего Вселенную. Вскоре после образования любых нейтральных атомов (нейтральные атомы просто содержат такое же количество протонов и электронов и, следовательно, не несут общего заряда), они снова были разбиты энергетическим излучением.
Наконец, примерно через 380000 лет или около того, Вселенная снова расширилась и остыла достаточно, чтобы создать условия, благоприятствующие тому, чтобы электроны оставались на орбите вокруг атомных ядер.Именно тогда произошла рекомбинация – наконец, появился нейтральный водород (и гелий), потому что они могли «рекомбинировать» (удерживаться) электронами, не теряя их из-за паразитного излучения. Если это число звучит знакомо, это должно быть так – 380000 лет после Большого взрыва – это также время, когда возник космический микроволновый фон, потому что сформированные атомы быстро вошли в свое самое низкое энергетическое состояние, высвобождая избыточную энергию в виде фотонов, которые могли наконец-то свободно путешествовать по вселенной, не натыкаясь ни на что по пути.Это свет, составляющий космический микроволновый фон.
Элисон Клесман
Заместитель редактора
Сначала был водород | Химия природы
Войцех Грохала описывает, как самый старый, легкий и самый распространенный элемент во Вселенной продолжает играть важную роль на сегодняшней Земле.
История водорода – элемента, наполняющего мир в том виде, в каком мы его знаем, – состоит из самых драматических событий.Атомы водорода и гелия появились через 379000 лет после Большого взрыва. Когда горячая, плотная плазма протонов, электронов и фотонов, которая была Вселенной, начала охлаждаться и расширяться, электроны и протоны собрались, чтобы сформировать атомы. Четыреста миллионов лет спустя звезды, такие как наше собственное Солнце, эволюционировали из коллапсированных под действием гравитации облаков газообразного водорода, обеспечивая тепло, необходимое для поддержания жизни в гигантской ледяной космической бездне с температурой 2,7 кельвина. Третий колоссальный прорыв в истории водорода произошел около 4 лет.4 миллиарда лет назад, когда температура на Земле упала ниже 100 ° C и оксид дигидрогена начал конденсироваться на ее поверхности, что привело к появлению жизни в новой водной среде.
По оценкам, сегодня водород составляет 90% всех атомов во Вселенной, и он необходим для материального мира. В том числе и мы сами: около двух третей атомов в наших телах – это водород. Ни в коем случае не являясь непродуктивной массой, первый элемент таблицы Менделеева является отличным химическим топливом, которое привлекает все большее внимание.Атмосфера ранней Земли была богата водородом, и бактериальные ферменты, называемые гидрогеназами, эволюционировали для выработки энергии из молекулярного H 2 или H 2 O (ссылка 1). Микроорганизмы размножались в восстановительных условиях, и многие из них выживают на водородном топливе по сей день.
Предоставлено: БИБЛИОТЕКА КОНГРЕССА / НАУЧНАЯ ФОТОБИБЛИОТЕКА
Ван Гельмонт первым обнаружил, что, хотя водород горюч на воздухе, сам по себе он не может поддерживать горение.В 1671 году Роберт Бойль описал образование пузырьков газа в результате реакции железных опилок с кислотой, но именно Кавендиш распознал H 2 (который он называл “ легковоспламеняющимся воздухом ”) как вещество, отличное от других газов, которые: когда он был сожжен в «дефлогистированном воздухе» (кислороде), образовалась вода. Это открытие вдохновило Лавуазье назвать вещество «водородом», что означает водообразователь, в 1783 году. И наоборот, в 1800 году Николсон и Карлайл (вскоре за ними последовал Риттер) сумели разложить воду на элементарные составляющие с помощью электролиза.Именно этого процесса мы пытаемся достичь сегодня, хотя и с гораздо меньшими счетами за электроэнергию, с помощью фотохимического процесса 2 . Образовавшийся газ H 2 является прекрасным сверхлегким энергоносителем и очень многообещающим топливом – в большом количестве и экологически безопасен, поскольку его окисление приводит к образованию воды. Молекулярный H 2 заполнил один из первых воздушных шаров, использовавшихся для перевозки людей в 1783 году (на фото), и топливные баки ракет двумя веками позже, позволяя любознательным исследовать все дальше и дальше.
Это открытие вдохновило Лавуазье назвать вещество «водородом», что означает водообразователь, в 1783 году. И наоборот, в 1800 году Николсон и Карлайл (вскоре за ними последовал Риттер) сумели разложить воду на элементарные составляющие с помощью электролиза.Именно этого процесса мы пытаемся достичь сегодня, хотя и с гораздо меньшими счетами за электроэнергию, с помощью фотохимического процесса 2 . Образовавшийся газ H 2 является прекрасным сверхлегким энергоносителем и очень многообещающим топливом – в большом количестве и экологически безопасен, поскольку его окисление приводит к образованию воды. Молекулярный H 2 заполнил один из первых воздушных шаров, использовавшихся для перевозки людей в 1783 году (на фото), и топливные баки ракет двумя веками позже, позволяя любознательным исследовать все дальше и дальше.
Однако для практического применения он должен храниться в сжатом, сжиженном или твердом состоянии. 3 . В 1970 году в исследовательских лабораториях Philips было случайно обнаружено, что водород может обратимо поглощаться интерметаллическими соединениями в виде гидрида 4 . Это привело к впечатляющему успеху в области электрохимического хранения водорода, и первые серийные автомобили с приводом от никель-металл-гидридных батарей появились на дорогах Японии в 1997 году. Вместе с энергичным развитием водородно-кислородных топливных элементов и твердых протонных проводников 5 эти достижения приближают нас к осуществлению мечты Жюля Верна о том, что «водород и кислород… будет неисчерпаемым источником тепла и света », упомянутого в Таинственный остров еще в 1874 году.
Это привело к впечатляющему успеху в области электрохимического хранения водорода, и первые серийные автомобили с приводом от никель-металл-гидридных батарей появились на дорогах Японии в 1997 году. Вместе с энергичным развитием водородно-кислородных топливных элементов и твердых протонных проводников 5 эти достижения приближают нас к осуществлению мечты Жюля Верна о том, что «водород и кислород… будет неисчерпаемым источником тепла и света », упомянутого в Таинственный остров еще в 1874 году.
Поскольку H и H 2 составляют прототипные атом и молекулу, соответственно, они широко использовались теоретиками более века – с момента зарождения квантовой механики. Эти два вида служили испытательными площадками для строгих критических оценок различных квантово-механических моделей и приближений 6 . Степени окисления водорода варьируются от -1 (гидрид) до 0 (элементарный) и +1 (протон), с очень разными физико-химическими свойствами для каждого вида. Молекула H 2 , изоэлектронная атому He с замкнутой оболочкой в единой модели атома, довольно инертна. Только в 1984 году Кубас описал координацию молекулярного H 2 с переходными металлами 7 . Напротив, анион H – – очень сильное основание и сильный восстановитель, тогда как H + – прожорливая кислота и мощный окислитель; не (или очень слабо) гидратированные протоны, присутствующие в сверхкислотной среде, легко превращают алканы в карбокатионы 8 .Действительно, водород был ключевым элементом в создании вполне разумных теорий кислотности и основности, которые стали рассматриваться как реакции переноса протона в теории Бронстеда-Лоури.
Молекула H 2 , изоэлектронная атому He с замкнутой оболочкой в единой модели атома, довольно инертна. Только в 1984 году Кубас описал координацию молекулярного H 2 с переходными металлами 7 . Напротив, анион H – – очень сильное основание и сильный восстановитель, тогда как H + – прожорливая кислота и мощный окислитель; не (или очень слабо) гидратированные протоны, присутствующие в сверхкислотной среде, легко превращают алканы в карбокатионы 8 .Действительно, водород был ключевым элементом в создании вполне разумных теорий кислотности и основности, которые стали рассматриваться как реакции переноса протона в теории Бронстеда-Лоури.
Первый элемент никогда не переставал иметь первостепенное значение для многих аспектов нашего мира, и он готов и дальше играть свою важную роль в стратегиях устойчивой энергетики.
История изменений
18 марта 2015
В статье In Your Element «Сначала был водород» ( Nature Chem .
 7 , 264; 2015) изображение было неверным и не изображало водородный баллон. Предложение, относящееся к изображению, должно было читаться следующим образом: «Молекулярный H 2 » заполнил один из первых воздушных шаров, использовавшихся для перевозки людей в 1783 году (на фото), и топливные баки ракет двумя веками позже, позволяя любознательным исследовать все дальше и дальше. ‘ Эти ошибки были исправлены в онлайн-версиях после печати: 18 марта 2015 г.
7 , 264; 2015) изображение было неверным и не изображало водородный баллон. Предложение, относящееся к изображению, должно было читаться следующим образом: «Молекулярный H 2 » заполнил один из первых воздушных шаров, использовавшихся для перевозки людей в 1783 году (на фото), и топливные баки ракет двумя веками позже, позволяя любознательным исследовать все дальше и дальше. ‘ Эти ошибки были исправлены в онлайн-версиях после печати: 18 марта 2015 г.
Ссылки
- 1
Vignais, P.M. & Billoud, B. Chem. Ред. 107 , 4206–4272 (2007).
CAS Статья Google ученый
- 2
Walter, M. G. et al. Chem. Ред. 110 , 6446–6473 (2010).
CAS Статья Google ученый
- 3
Schlapbach, L. & Züttel, A. Nature 414 , 353–358 (2001).
CAS Статья Google ученый
- 4
Vanvucht, J.
 H. et al. Philips Res. Реп. 25 , 133–140 (1970).
H. et al. Philips Res. Реп. 25 , 133–140 (1970).CAS Google ученый
- 5
Haile, S. M. et al. Nature 410 , 910–913 (2001).
CAS Статья Google ученый
- 6
Kołos, W. & Wolniewicz, L. J. Chem. Phys. 43 , 2429–2441 (1965).
Артикул Google ученый
- 7
Кубас, Г.J. et al. J. Am. Chem. Soc. 106 , 451–452 (1984).
CAS Статья Google ученый
- 8
Olah, G.A. et al. J. Am. Chem. Soc. 93 , 1251–1256 (1971).
CAS Статья Google ученый
Скачать ссылки
Информация об авторе
Принадлежность
Войцех Грохала находится в Центре новых технологий Варшавского университета, wirki i Wigury 93, 02089 Варшава, Польша
Wojciech Grochala
Corresponding authorНанокластеры палладия в виде цветов, украшенные графеновыми электродами для сверхчувствительного и гибкого измерения газообразного водорода
- Дон Хун Шин
- Джун Сеоп Ли
- Jyongsik Jang
Научные отчеты (2015)
Исправление
Природа Химия (2015)
Для корреспонденции
Войцех Грохала.
Об этой статье
Цитируйте эту статью
Grochala, W. Сначала был водород. Nature Chem 7, 264 (2015). https://doi.org/10.1038/nchem.2186
Скачать цитату
Поделиться этой статьей
Все, с кем вы поделитесь следующей ссылкой, смогут прочитать это содержание:
Получить ссылку для совместного использованияИзвините, ссылка для совместного использования в настоящее время недоступно для этой статьи.
Предоставлено инициативой по обмену контентом Springer Nature SharedIt
Дополнительная литература
Во-первых, элемент будет называться исследователями в Японии
Начиная с XIX века европейские и американские открытия монополизировали присвоение имен элементам в периодической таблице. Это очевидно в таких записях, как франций, германий, скандий, полоний, европий, калифорний, берклий и америций.
Это очевидно в таких записях, как франций, германий, скандий, полоний, европий, калифорний, берклий и америций.
Но теперь впервые исследователи из Азии сделают дополнение к самому фундаментальному каталогу химии.
Ученые из института Рикен в Японии дадут официальное название элементу 113, известному в настоящее время под названием-заполнителем ununtrium, объявил на прошлой неделе Международный союз чистой и прикладной химии.
Организация заявила, что исследования, опубликованные японскими учеными с 2004 по 2012 год, дают группе убедительные доказательства открытия этого элемента.Заявление было сделано более чем через 12 лет после того, как японская команда впервые попыталась синтезировать сверхтяжелый элемент, запустив луч цинка в тонкую пленку висмута.
Под руководством Косуке Морита группа начала бомбардировать атомы висмута в ускорителе частиц со скоростью 10 процентов от скорости света в 2003 году. Год спустя они успешно слили два атомных ядра из этих элементов, создав свое первое ядро Элемента 113. но он распался менее чем за тысячную долю секунды. В 2005 году команда произвела Element 113 во втором мероприятии, но химический союз не посчитал демонстрацию достаточно убедительной, чтобы обозначить открытие.
но он распался менее чем за тысячную долю секунды. В 2005 году команда произвела Element 113 во втором мероприятии, но химический союз не посчитал демонстрацию достаточно убедительной, чтобы обозначить открытие.
«Более семи лет мы продолжали искать данные, окончательно идентифицирующие Элемент 113, но мы никогда не видели другого события», – говорится в заявлении доктора Морита. «Однако я не был готов сдаваться, так как считал, что однажды, если мы будем настойчивыми, удача снова обрушится на нас».
В 2012 году команда наконец представила убедительные доказательства того, что они синтезировали Элемент 113. В течение этих девяти лет луч был активен в течение 553 дней и запустил более 130 квинтиллионов атомов цинка, согласно данным Nature.
Химический союз вместе с Международным союзом чистой и прикладной физики предоставил исследователям Райкена права на наименование элемента 113 над совместной российско-американской командой, которая также утверждала, что открыла этот элемент.

 PMID 18276886.
PMID 18276886. WebElements.
WebElements.
 Широко распространён в природе. Катион самого распространённого изотопа водорода 1H 7 букв
Широко распространён в природе. Катион самого распространённого изотопа водорода 1H 7 букв
 назовите это 7 букв
назовите это 7 букв
 элемент 7 букв
элемент 7 букв
 Катион самого распространённого изотопа водорода 1H 7 букв
Катион самого распространённого изотопа водорода 1H 7 букв
 7 , 264; 2015) изображение было неверным и не изображало водородный баллон. Предложение, относящееся к изображению, должно было читаться следующим образом: «Молекулярный H 2 » заполнил один из первых воздушных шаров, использовавшихся для перевозки людей в 1783 году (на фото), и топливные баки ракет двумя веками позже, позволяя любознательным исследовать все дальше и дальше. ‘ Эти ошибки были исправлены в онлайн-версиях после печати: 18 марта 2015 г.
7 , 264; 2015) изображение было неверным и не изображало водородный баллон. Предложение, относящееся к изображению, должно было читаться следующим образом: «Молекулярный H 2 » заполнил один из первых воздушных шаров, использовавшихся для перевозки людей в 1783 году (на фото), и топливные баки ракет двумя веками позже, позволяя любознательным исследовать все дальше и дальше. ‘ Эти ошибки были исправлены в онлайн-версиях после печати: 18 марта 2015 г. H. et al. Philips Res. Реп. 25 , 133–140 (1970).
H. et al. Philips Res. Реп. 25 , 133–140 (1970).