Первая в Азии запись в периодической таблице, названная в честь Японии
Косуке Морита улыбается, указывая на доску с новым атомным элементом 113 во время пресс-конференции в Вако, префектура Сайтама, 31 декабря 2015 года. элемент, был официально утвержден в среду.
Кадзухиро Ноги/АФП/АФП/Getty ImagesОсновные моменты истории
«Нихониум» — первый элемент из Азии, добавленный в периодическую таблицу
Исследователь элементов Косуке Морита усердно работает над этим открытием с 2003 года
Си-Эн-Эн —
Имена остаются на всю жизнь. Поймите их неправильно, и ваши дети, скорее всего, будут испытывать трудности на протяжении всей жизни.

«Нихоний (Nh),» московий (Mc), оганесон (Og) и теннессин (Ts) — четыре элемента, которые были официально утверждены и присоединились к 118 другим элементам в периодической таблице в среду. Благодаря последним дополнениям периодическая таблица заполнена до седьмой строки.
Профессор Университета Кюсю Косуке Морита (в центре) указывает на «нихониум» в периодической таблице во время пресс-конференции в городе Фукуока на юго-западе Японии 1 декабря 2016 г.
«Все элементы раньше были обнаружены на Западе, и замечательно, что теперь у нас есть элемент, открытый в Азии», — говорится в заявлении Мориты.
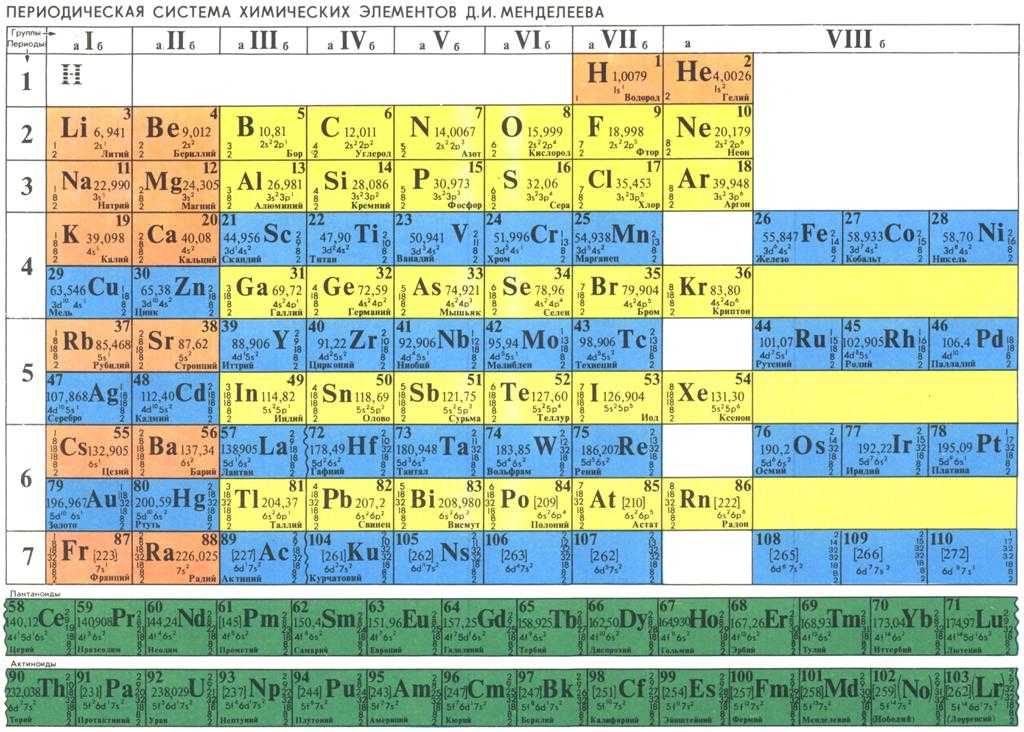
Группа впервые синтезировала элемент 113 в июле 2004 года, повторив этот подвиг в апреле 2005 года и августе 2012 года. Они использовали линейный ускоритель тяжелых ионов Национального исследовательского института RIKEN — ускоритель частиц, который увеличивает кинетическую энергию заряженных ионов для проведения реакций.
В декабре 2015 года Косуке Морита представил предложенное его командой название элемента 113 в Международный союз теоретической и прикладной химии. Он был официально одобрен после публичного рассмотрения в период с июня по ноябрь 2016 года.
Затем Морита хочет сосредоточиться на обнаружении еще более тяжелых элементов, которые могут попасть в периодическую таблицу.
Первые элементы в периодической таблице CBSE Class 12th Science Notes
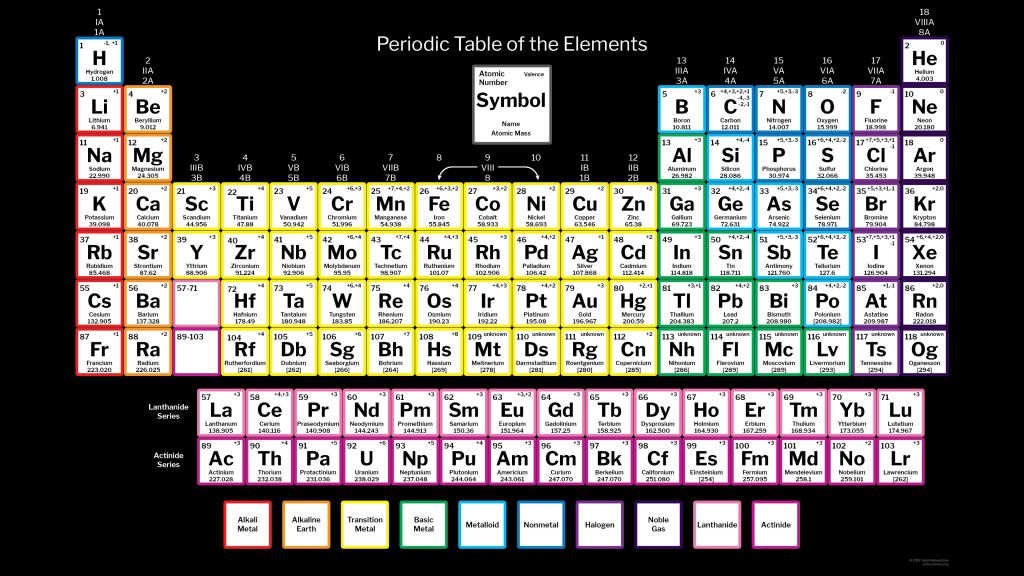
Элементы расположены в периодической таблице таким образом, что каждый элемент с похожими химическими и физическими свойствами будет помещен вместе в столбцы, известные как группы. На основе этого можно определить несколько свойств, таких как атомный радиус, энтальпия ионизации, стабильность, энтальпия электронного усиления и так далее. Несмотря на то, что свойства следуют правильному порядку увеличения или уменьшения по мере продвижения вниз по группе, некоторые элементы, которые находятся на первом месте, демонстрируют аномальные свойства.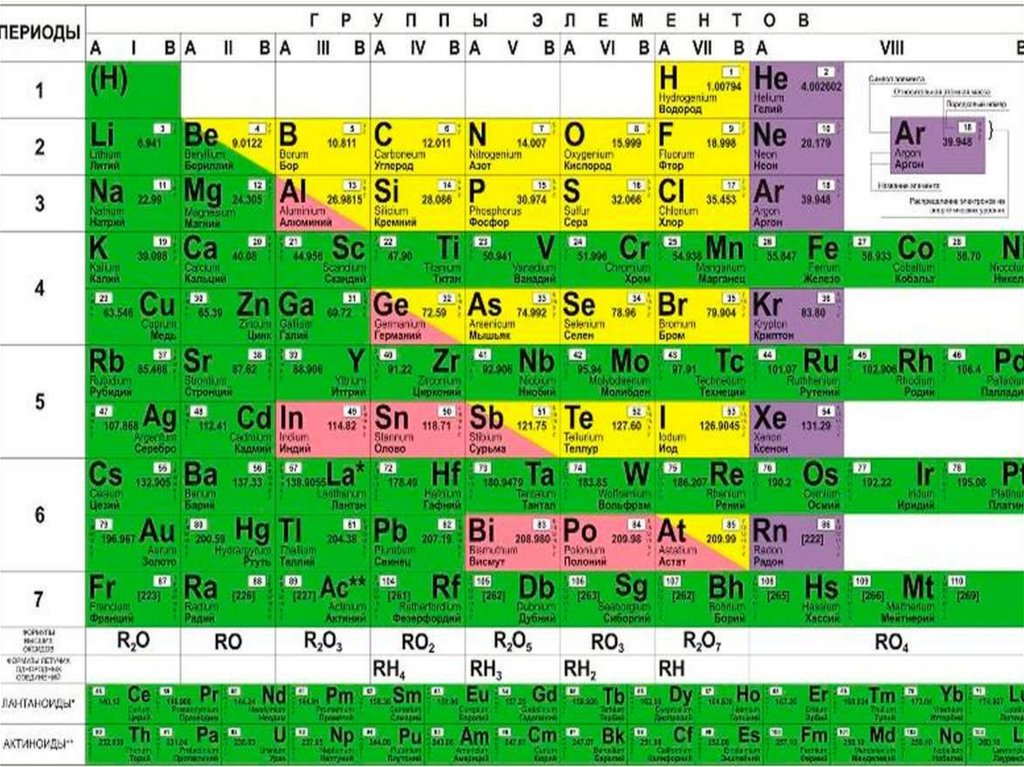 Их поведение не соответствует остальным элементам, присутствующим в группе, поэтому их изучение так важно в химии.
Их поведение не соответствует остальным элементам, присутствующим в группе, поэтому их изучение так важно в химии.
Что за аномальное поведение элементов?
Аномальные свойства любого элемента в основном связаны с электронной конфигурацией, уникальным расположением электронов в оболочках и физической структурой.
Из-за аномального поведения в периодической таблице современное представление не считается идеальным. Это недостаток, который еще предстоит исправить, чтобы объяснить, почему эти элементы с разными физическими и химическими свойствами были сгруппированы с другими элементами.
Почему первые элементы в группах Периодической таблицы показывают аномалии в своем поведении?
Несколько причин в целом могут объяснить, почему первые элементы периодической таблицы демонстрируют аномальные свойства. В этом разделе ниже некоторые из этих причин объясняются должным образом, чтобы дать краткое представление о таких аномалиях.
- Первые элементы всегда меньше по размеру, чем остальные элементы, расположенные ниже по группе.
 Из-за меньших радиусов электростатическая сила притяжения между протонами и электронами последней оболочки максимальна.
Из-за меньших радиусов электростатическая сила притяжения между протонами и электронами последней оболочки максимальна. - Кроме того, первый элемент в группах s-блока имеет меньшую энтальпию ионизации, поэтому они не могут легко образовывать ионные соединения, как другие элементы в той же группе.
- Точно так же энтальпия электрона также довольно высока, поэтому электрону потребуется много энергии, чтобы войти в последнюю незаполненную подоболочку и завершить структуру.
- Поскольку блочные элементы s и p не имеют d-орбиталей, в элементе не будет валентной оболочки. Следовательно, электроны не могут перейти на высокоэнергетические орбитали, когда тепло или любая другая энергия поступает извне.
Какие первые элементы групп периодической таблицы показывают аномалии?
Только первые элементы блоков s и p демонстрируют аномальные свойства, потому что эти блоки следуют строгим принципам электронного устройства. Они могут образовывать ионные связи, а их последние орбитали крайне нестабильны. Следовательно, их также называют электроположительными и электроотрицательными группами соответственно.
Следовательно, их также называют электроположительными и электроотрицательными группами соответственно.
Следующие первые элементы периодической таблицы демонстрируют аномальные свойства:
- Литий из группы 1 или IA
- Бериллий из группы 2 или IIA
- Углерод из группы 14 или IVA
- Фтор из группы 17 и VIIA
Кроме этих элементов азот, кислород и бор также проявляют аномальное поведение . Однако степень аномалии невелика, поэтому большую часть времени учитываются только четыре упомянутых выше элемента.
Объяснение аномального поведения лития
Причина
Литий является первым элементом группы 1 или IA. В результате он имеет чрезвычайно малый размер и атомный радиус. Последняя s-орбиталь имеет один электрон, который испытывает сильное электростатическое притяжение от трех протонов, присутствующих в ядре. Благодаря этому поляризационная способность ионов лития также довольно высока. Эти две причины могут хорошо объяснить аномальное поведение лития.
Аномальное поведение
- Во-первых, литий имеет один электрон на s-оболочке, поэтому он должен вести себя как все другие щелочные металлы. Однако этот элемент образует ковалентную связь из-за высокой поляризационной способности и, следовательно, это одно из аномальных свойств первого элемента.
- Также литий довольно твердый по сравнению с натрием и калием той же группы, которые невероятно мягкие и их можно срезать ножом.
- Хлорид лития может кристаллизоваться в присутствии влаги, что является одним из аномальных свойств первого элемента группы 1, поскольку никакой другой щелочной металл не может образовывать гидраты.
Объяснение аномального поведения фтора
Причина
Фтор принадлежит к семейству галогенов или группе 17. Будучи первым элементом с плотными электронными облаками на последней орбитали, он демонстрирует большую аномалию в своем поведении по сравнению с другими сериями галогенов. элементы. Основными причинами такого поведения являются отсутствие d-орбиталей в валентной оболочке, малая структура, плотное электронное облако, меньшее сродство к электронам и низкая энтальпия диссоциации связи.
Аномальное поведение
- Фтор может проявлять уникальное аномальное поведение в периодической таблице, образуя водородные связи и образуя соединения, подобные HF.
- Фтор не может легко образовывать ионные соединения, в отличие от других элементов той же группы, потому что он имеет низкое сродство к поступающим электронам.
Объяснение аномального поведения бериллия
Причина
Бериллий является первым элементом группы 2 или IIA, и он также проявляет аномальные свойства. Основной причиной такого поведения является малый размер по сравнению с другими элементами группы 2, высокая энтальпия ионизации, поляризационное свойство и повышенная электростатическая сила притяжения между ядром и 2s-орбитальными электронами.
Аномальное поведение
- Одним из существенных аномальных свойств бериллия является его координатное число 4, но все другие щелочные металлы группы 2 имеют координатное число 6.
- Бериллий имеет высокие температуры плавления и кипения по сравнению с другими щелочными металлами .
 Поэтому он считается одним из самых твердых металлов s-блока в периодической таблице.
Поэтому он считается одним из самых твердых металлов s-блока в периодической таблице. - Кроме того, бериллий имеет высокую энтальпию ионизации, поэтому он не может образовывать ионные соединения, теряя два электрона в s-оболочке. Вместо этого он разделяет электронное облако для образования ковалентных связей.
Резюме:
Поскольку эти элементы демонстрируют широкий спектр аномальных свойств, очень важно понимать различия между их физическими свойствами и химическим поведением по отношению к другим элементам, принадлежащим к рассматриваемой группе. Кроме того, эти элементы обычно изучаются по-разному из-за их свойств, поскольку их нельзя сопоставить с обычными элементами той же группы. Кроме того, их исследования также определяют условия, необходимые для придания им химической активности и искусственного образования их соединений. Помимо элементов s- и p-блоков, некоторые элементы d-блока также обладают аномальными свойствами, но они не рассматриваются, потому что элементы d-блока на самом деле не следуют групповым правилам.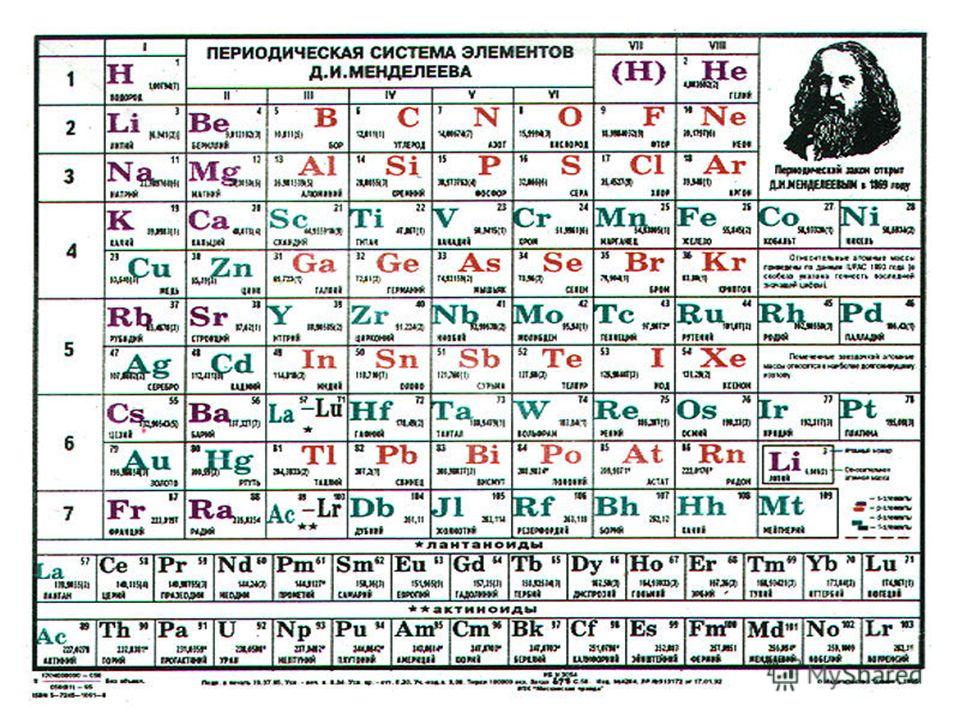

 Из-за меньших радиусов электростатическая сила притяжения между протонами и электронами последней оболочки максимальна.
Из-за меньших радиусов электростатическая сила притяжения между протонами и электронами последней оболочки максимальна. Поэтому он считается одним из самых твердых металлов s-блока в периодической таблице.
Поэтому он считается одним из самых твердых металлов s-блока в периодической таблице.