Водород – самый распространённый элемент Вселенной
Несмотря на то, что водород является самым распространённым химическим элементом в природе, открыт он был только в 18 веке. В1766 году английский ученый Генри Кавендиш провёл ряд опытов с различными металлами, помещая их в растворы серной и соляной кислот. В результате каждого эксперимента он получал одно и то же легкое газообразное вещество, которое назвал «горючим воздухом». При сжигании «горючий воздух» давал воду. Полученную таким способом воду в 1783 году детально изучил французский химик Антуан Лавуазье, осуществив её анализ, разлагая водяной пар раскалённым железом. Так он установил, что «горючий воздух» входит в состав воды и может быть из неё выделен.
Лавуазье дал полученному газу название hydrogène (др. греч. — рождающий воду). Русский термин «водород» предложил химик Михаил Соловьёв в 1824 году — по аналогии с «кислородом» Ломоносова.
Водород – самый легкий, самый простой и самый распространенный химический элемент во Вселенной, обозначается символом H, занимает клетку № 1 в Таблице Менделеева и имеет относительную атомную массу равную 1.
Во Вселенной на долю водорода приходится около 88% всех атомов (примерно 11 % составляют атомы гелия, доля всех остальных вместе взятых элементов — меньше 1 %).
Таким образом, водород — основная составная часть звёзд и межзвёздного газа. Он играет ключевую роль в реакциях первичного и звёздного нуклеосинтеза, который, в свою очередь, является причиной наблюдаемой распространённости химических элементов.
Особое положение, которое занял водород с момента открытия, привлекало внимание ученых различных направлений. Так, в 1815 году английский химик, врач и религиозный философ Уильям Праут анонимно опубликовал статью, в которой впервые предположил, что все атомы построены из простейшего водорода. Если масса водорода равна 1, то атомные массы всех других элементов должны выражаться целыми числами. Противники гипотезы, в частности Якоб Берцелиус, утверждали, что атомные массы элементов не находятся в целочисленных отношениях по отношению к водороду. Уровень развития техники измерения масс атомов в то время был достаточно высок, поэтому изначально ряду учёных удалось опровергнуть его теорию, так как полученный атомный вес (как тогда говорили) например хлора, был равен 35,5. С открытием изотопов в начале 20 века доказательства некорректности гипотезы Праута, основанные на измерениях атомных масс, оказались также ошибочными — дробный атомный вес хлора был следствием того, что природный хлор является смесью разных изотопов, о существовании которых во времена Праута не знали. И сейчас у этой теории есть сторонники и противники, а в историю науки это научное предположение вошло как «Гипотеза Праута».
Если масса водорода равна 1, то атомные массы всех других элементов должны выражаться целыми числами. Противники гипотезы, в частности Якоб Берцелиус, утверждали, что атомные массы элементов не находятся в целочисленных отношениях по отношению к водороду. Уровень развития техники измерения масс атомов в то время был достаточно высок, поэтому изначально ряду учёных удалось опровергнуть его теорию, так как полученный атомный вес (как тогда говорили) например хлора, был равен 35,5. С открытием изотопов в начале 20 века доказательства некорректности гипотезы Праута, основанные на измерениях атомных масс, оказались также ошибочными — дробный атомный вес хлора был следствием того, что природный хлор является смесью разных изотопов, о существовании которых во времена Праута не знали. И сейчас у этой теории есть сторонники и противники, а в историю науки это научное предположение вошло как «Гипотеза Праута».
По распространённости в земной коре водород стоит на 9 месте со средним содержанием около 1% по массе, находясь там, в основном, в виде соединений.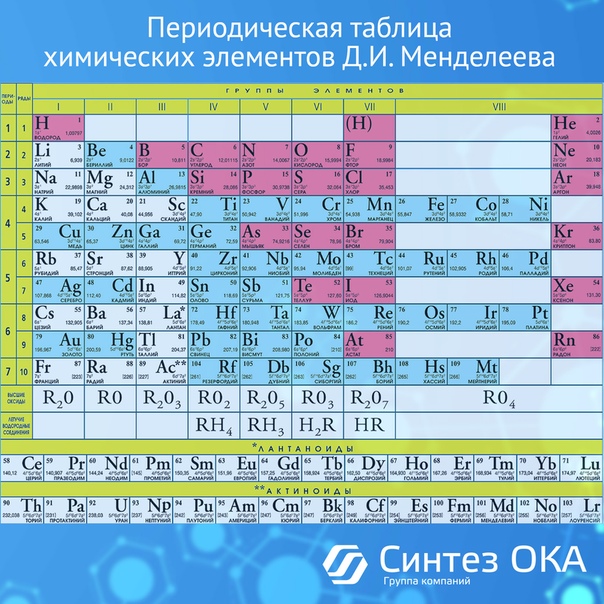 Свободный водород h3 относительно редко встречается в земной коре, но в составе воды он принимает активное участие в геохимических процессах. Основной потребитель водорода – химическая промышленность. Более 50 % мирового выпуска водорода идёт на производство аммиака (Nh4), ещё 10 % используется для производства метанола (Ch4OH). Из этих веществ производят пластмассы, удобрения, взрывчатые вещества и многое другое.
Свободный водород h3 относительно редко встречается в земной коре, но в составе воды он принимает активное участие в геохимических процессах. Основной потребитель водорода – химическая промышленность. Более 50 % мирового выпуска водорода идёт на производство аммиака (Nh4), ещё 10 % используется для производства метанола (Ch4OH). Из этих веществ производят пластмассы, удобрения, взрывчатые вещества и многое другое.
Основные элементы периодической таблицы.
Как пользоваться таблицей Менделеева? Для непосвященного человека читать таблицу Менделеева – всё равно, что для гнома смотреть на древние руны эльфов. А таблица Менделеева может рассказать о мире очень многое.
Помимо того, что сослужит вам службу на экзамене, она еще и просто незаменима при решении огромного количества химических и физических задач. Но как ее читать? К счастью, сегодня этому искусству может научиться каждый. В этой статье расскажем, как понять таблицу Менделеева.
Периодическая система химических элементов (таблица Менделеева) – это классификация химических элементов, которая устанавливает зависимость различных свойств элементов от заряда атомного ядра.
История создания Таблицы
Дмитрий Иванович Менделеев был не простым химиком, если кто-то так думает. Это был химик, физик, геолог, метролог, эколог, экономист, нефтяник, воздухоплаватель, приборостроитель и педагог. За свою жизнь ученый успел провести фундаментально много исследований в самых разных областях знаний. Например, широко распространено мнение, что именно Менделеев вычислил идеальную крепость водки – 40 градусов.
Не знаем, как Менделеев относился к водке, но точно известно, что его диссертация на тему «Рассуждение о соединении спирта с водой» не имела к водке никакого отношения и рассматривала концентрации спирта от 70 градусов. При всех заслугах ученого, открытие периодического закона химических элементов – одного их фундаментальных законов природы, принесло ему самую широкую известность.
Существует легенда, согласно которой периодическая система приснилась ученому, после чего ему осталось лишь доработать явившуюся идею. Но, если бы все было так просто.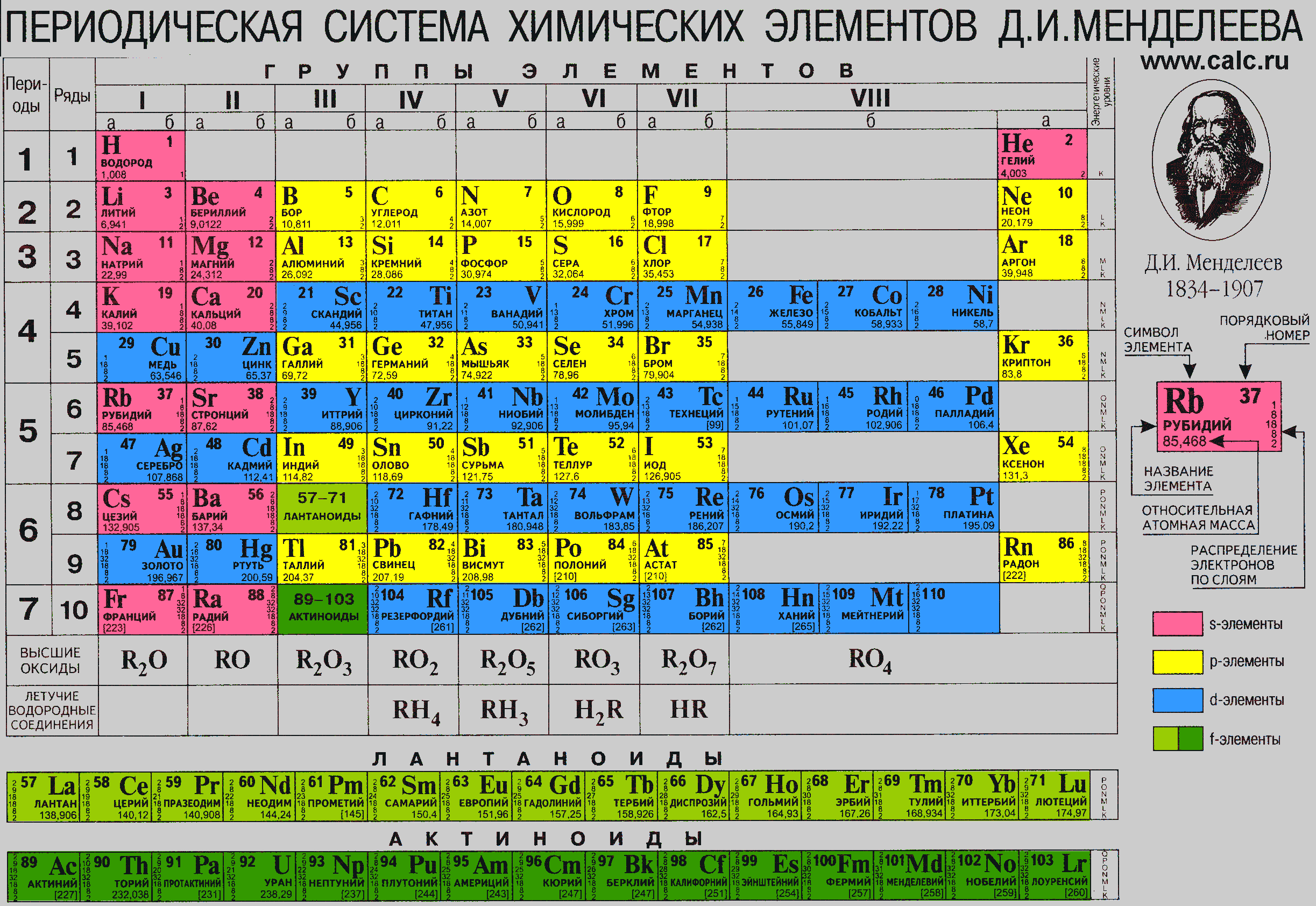 . Данная версия о создании таблицы Менделеева, по-видимому, не более чем легенда. На вопрос о том, как была открыта таблица, сам Дмитрий Иванович отвечал: «
. Данная версия о создании таблицы Менделеева, по-видимому, не более чем легенда. На вопрос о том, как была открыта таблица, сам Дмитрий Иванович отвечал: «
В середине девятнадцатого века попытки упорядочить известные химические элементы (известно было 63 элемента) параллельно предпринимались несколькими учеными. Например, в 1862 году Александр Эмиль Шанкуртуа разместил элементы вдоль винтовой линии и отметил циклическое повторение химических свойств.
Химик и музыкант Джон Александр Ньюлендс предложил свой вариант периодической таблицы в 1866 году. Интересен тот факт, что в расположении элементов ученый пытался обнаружить некую мистическую музыкальную гармонию. В числе прочих попыток была и попытка Менделеева, которая увенчалась успехом.
В 1869 году была опубликована первая схема таблицы, а день 1 марта 1869 года считается днем открытия периодического закона. Суть открытия Менделеева состояла в том, что свойства элементов с ростом атомной массы изменяются не монотонно, а периодически.
Первый вариант таблицы содержал всего 63 элемента, но Менделеев предпринял ряд очень нестандартных решений. Так, он догадался оставлять в таблице место для еще неоткрытых элементов, а также изменил атомные массы некоторых элементов. Принципиальная правильность закона, выведенного Менделеевым, подтвердилась очень скоро, после открытия галлия, скандия и германия, существование которых было предсказано ученым.
Современный вид таблицы Менделеева
Ниже приведем саму таблицу
Сегодня для упорядочения элементов вместо атомного веса (атомной массы) используется понятие атомного числа (числа протонов в ядре). В таблице содержится 120 элементов, которые расположены слева направо в порядке возрастания атомного числа (числа протонов)
Столбцы таблицы представляют собой так называемые группы, а строки – периоды. В таблице 18 групп и 8 периодов.
- Металлические свойства элементов при движении вдоль периода слева направо уменьшаются, а в обратном направлении – увеличиваются.

- При движении сверху вниз по группе увеличиваются восстановительные металлические свойства.
- Окислительные и неметаллические свойства при движении вдоль периода слева направо увеличиваются.
Что мы узнаем об элементе по таблице? Для примера, возьмем третий элемент в таблице – литий, и рассмотрим его подробно.
Первым делом мы видим сам символ элемента и его название под ним. В верхнем левом углу находится атомный номер элемента, в порядке которого элемент расположен в таблице. Атомный номер, как уже было сказано, равен числу протонов в ядре. Число положительных протонов, как правило, равно числу отрицательных электронов в атоме (за исключением изотопов).
Атомная масса указана под атомным числом (в данном варианте таблицы). Если округлить атомную массу до ближайшего целого, мы получим так называемое массовое число. Разность массового числа и атомного числа дает количество нейтронов в ядре. Так, число нейтронов в ядре гелия равно двум, а у лития – четырем.
Так, число нейтронов в ядре гелия равно двум, а у лития – четырем.
Вот и закончился наш курс “Таблица Менделеева для чайников”. В завершение, предлагаем вам посмотреть тематическое видео, и надеемся, что вопрос о том, как пользоваться периодической таблицей Менделеева, стал вам более понятен. Напоминаем, что изучать новый предмет всегда эффективнее не одному, а при помощи опытного наставника. Именно поэтому, никогда не стоит забывать о студенческом сервисе , который с радостью поделится с вами своими знаниями и опытом.
ПЕРИОДИЧЕСКАЯ ТАБЛИЦА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
Графическим изображением периодического закона является периодическая таблица. Она содержит 7 периодов и 8 групп.
Короткая форма таблицы Д.И. Менделеева.
Полудлинный вариант таблицы Д.И. Менделеева.
Существует ещё и длинный вариант таблицы, он похож на полудлинный, но только лантаноиды и актиноиды не вынесены за пределы таблицы.
Оригинал таблицы Д. И. Менделеева
1. Период –химические элементы,
расположенные в строчку (1 – 7)
Период –химические элементы,
расположенные в строчку (1 – 7)
Малые (1, 2, 3) – состоят из одного ряда элементов
Большие (4, 5, 6, 7) – состоят из двух рядов – чётного и нечётного
Периоды могут состоять из 2 (первый), 8 (второй и третий), 18 (четвертый и пятый) или 32 (шестой) элементов. Последний, седьмой период незавершен.
Все периоды (кроме первого) начинаются щелочным металлом, а заканчиваются благородным газом.
Во всех периодах с увеличением относительных атомных
масс элементов наблюдается усиление неметаллических и ослабление металлических
свойств. В больших периодах переход свойств от активного металла к благородному
газу происходит более медленно (через 18 и 32 элемента), чем в малых периодах
(через 8 элементов). Кроме того, в малых периодах слева направо
валентность в соединениях с кислородом возрастает от 1 до 7 (например, от
Na
до
Cl
). В больших периодах вначале
валентность возрастает от 1 до 8 (например, в пятом периоде от рубидия к
рутению), затем происходит резкий скачок, и валентность уменьшается до 1 у
серебра, потом снова возрастает.
2. Группы – вертикальные столбцы элементов с одинаковым числом валентных электронов, равным номеру группы. Различают главные (А) и побочные подгруппы (Б).
Главные подгруппы состоят из элементов малых и больших периодов.
Побочные подгруппы состоят из элементов только больших периодов.
В главных подгруппах сверху вниз металлические свойства усиливаются, а неметаллические ослабевают. Элементы главных и побочных групп сильно отличаются по свойствам.
Номер группы показывает высшую валентность элемента (кроме N, O , F ).
Общими для элементов главных и побочных подгрупп являются формулы высших оксидов (и их гидратов). У высших оксидов и их гидратов элементов I – III групп (кроме бора) преобладают основные свойства, с IV по VIII – кислотные.
Группа | III | VII | VIII (кроме инертных газов) | |||||
Высший оксид | Э 2 О | ЭО | Э 2 О 3 | ЭО 2 | Э 2 О 5 | ЭО 3 | Э 2 О 7 | ЭО 4 |
Гидрат высшего оксида | ЭОН | Э(ОН) 2 | Э(ОН) 3 | Н 2 ЭО 3 | Н 3 ЭО 4 | Н 2 ЭО 4 | НЭО 4 | Н 4 ЭО 4 |
Для элементов главных подгрупп общими
являются формулы водородных соединений. Элементы главных подгрупп
I
–
III
групп образуют твердые вещества –
гидриды (водород в степени окисления – 1), а
IV
–
VII
групп – газообразные. Водородные
соединения элементов главных подгрупп
IV
группы (ЭН 4) – нейтральны,
V
группы (ЭН 3) –
основания,
VI и
VII групп (Н 2 Э и НЭ) – кислоты.
Элементы главных подгрупп
I
–
III
групп образуют твердые вещества –
гидриды (водород в степени окисления – 1), а
IV
–
VII
групп – газообразные. Водородные
соединения элементов главных подгрупп
IV
группы (ЭН 4) – нейтральны,
V
группы (ЭН 3) –
основания,
VI и
VII групп (Н 2 Э и НЭ) – кислоты.
1 марта 1869 года Менделеев закончил свою работу “Опыт системы элементов, основанной на их атомном весе и химическом сходстве”. Этот день считается днём открытия периодического закона элементов Д.М. Менделеева. “Открытие Д.И. Менделеева относится к фундаментальным законам мироздания, таким как закон всемирного тяготения Ньютона или теория относительности Эйнштейна, а Д.М. Менделеев стоит в одном ряду с именами этих великих физиков”. Академик А.И. Русанов.
“Периодическая система как была, так и осталась в самых новейших решениях проблемы о веществе главной путеводной звездой”. Проф. А. Н. Реформатский.
“Когда подходишь к оценке личностей, подобных Д. И. Менделееву, к анализу их научного творчества, невольно является желание отыскать в этом творчестве элементы, всего более отмеченные печатью гения..jpg) Из всех признаков, отличающих гениальность и ее проявление, два, кажется, являются наиболее показательными: это, во-первых, способность охватывать и объединять широкие области знания и, во-вторых, способность к резким скачкам мысли, к неожиданному сближению фактов и понятий, которые для обыкновенного смертного кажутся далеко стоящими друг от друга и ничем не связанными, по крайнем мере до того момента, когда такая связь будет обнаружена и доказана”. Л. А. Чугаев, профессор химии.
Из всех признаков, отличающих гениальность и ее проявление, два, кажется, являются наиболее показательными: это, во-первых, способность охватывать и объединять широкие области знания и, во-вторых, способность к резким скачкам мысли, к неожиданному сближению фактов и понятий, которые для обыкновенного смертного кажутся далеко стоящими друг от друга и ничем не связанными, по крайнем мере до того момента, когда такая связь будет обнаружена и доказана”. Л. А. Чугаев, профессор химии.
Да и сам Менделеев понимал огромное значение открытого им закона для науки. И верил в его дальнейшее развитие. “По видимому, периодическому закону будущее не грозит разрушением, а только надстройки и развитие обещает”. Д.И. Менделеев.
Первоначальный вид таблицы, написанный рукой Д.И. Менделеева.
Если бы все научные знания мира пропали бы, из-за какого либо катаклизма, то для возрождения цивилизации одним из главных законов стал бы периодический закон Д.И. Менделеева. Успехи атомной физики, включая ядерную энергетику и синтез искусственных элементов, стали возможными лишь благодаря Периодическому закону.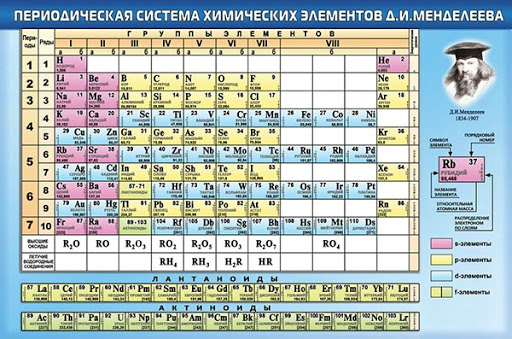 В свою очередь, они расширили и углубили сущность закона Менделеева.
В свою очередь, они расширили и углубили сущность закона Менделеева.
Периодический закон сыграл огромную роль в развитии химии и других естественных наук. Была открыта взаимная связь между всеми элементами, их физическими и химическими свойствами. Это поставило перед естествознанием научно-философскую проблемы огромной важности: эта взаимная связь должно получить объяснение.
Открытию периодического закона предшествовало 15 лет напряженной работы. Ко времени открытия периодического закона было известно 63 химических элемента, существовало около 50 различных классификаций. Большинство ученых сравнивали между собой только сходные по свойствам элементы, поэтому не смогли открыть закон. Менделеев же сравнивал между собой все, в том числе и несходные элементы. Менделеев выписал на карточки все известные сведения об открытых и изученных в то время химических элементах и их соединениях, расположил их в порядке возрастания их относительных атомных масс и всесторонне проанализировал всю эту совокупность, пытаясь найти в ней определенные закономерности. В результате напряженного творческого труда он обнаружил в этой цепочке отрезки, в которых свойства химических элементов и образованных ими веществ изменялись сходным образом – периодически – периоды. С развитием учения о строении электронной оболочки атомов стало ясно, почему свойства атомов показывают периодичность с возрастанием атомной массы. Атомы с одинаковой внешней сферой составляют одну группу. Атомы с одинаковым числом внешних сфер – составляют один ряд. Атомы с ядрами, имеющими одинаковые заряды, но разные массы, обладают одинаковыми химическими свойствами, но разными атомными весами и представляют собой изотопы одного и того же химического элемента. По существу свойства атомов отражают свойства внешних электронных оболочек, которые тесно связанны с законами квантовой физики.
В результате напряженного творческого труда он обнаружил в этой цепочке отрезки, в которых свойства химических элементов и образованных ими веществ изменялись сходным образом – периодически – периоды. С развитием учения о строении электронной оболочки атомов стало ясно, почему свойства атомов показывают периодичность с возрастанием атомной массы. Атомы с одинаковой внешней сферой составляют одну группу. Атомы с одинаковым числом внешних сфер – составляют один ряд. Атомы с ядрами, имеющими одинаковые заряды, но разные массы, обладают одинаковыми химическими свойствами, но разными атомными весами и представляют собой изотопы одного и того же химического элемента. По существу свойства атомов отражают свойства внешних электронных оболочек, которые тесно связанны с законами квантовой физики.
Сама таблица Менделеева много раз трансформировалась, отображая разную информацию о свойствах атомов. Встречаются и курьёзные таблицы.
Так называемая короткопериодная или короткая форма ТМ
Длиннопериодная или длинная форма ТМ
Сверхдлинная.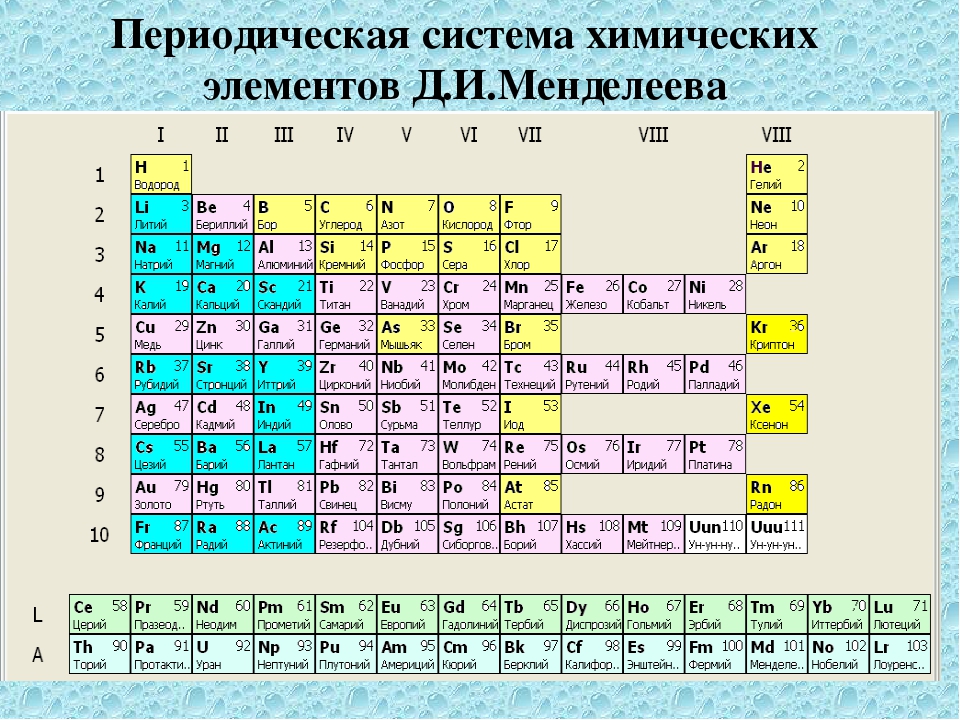
Флаги государств, обозначающие страну, где впервые открыли данный элемент.
Названия элементов, которые были отменены или оказались ошибочными, как например, история с дидимом Di – оказался в дальнейшем смесью двух вновь открытых элементов празеодима и неодима.
Здесь синим цветом обозначены элементы, образованные во время Большого Взрыва, голубым – синтезированные во время первичного нуклеосинтеза, жёлтые и зелёные цвета обозначают элементы, синтезированные соответственно в недрах “малых” и “больших” звёзд. Розовым цветом – вещества (ядра), синтезируемые во время вспышек сверхновых звёзд. Кстати, золото (Au) ещё синтезируется во время столкновений нейтронных звёзд. Фиолетовые – созданные в лабораториях искусственно. Но это ещё не вся история…
Здесь разными цветами обозначены органические, неорганические и незаменимые элементы, необходимые для построения тел живых существ, в том числе и нас.
Таблица-башня
Предложена в 2006-ом Виталием Циммерманом на основе идей Чарльза Джанета. Он изучал орбитальное заполнение атомов – то, как располагаются электроны относительно ядра. И на основе этого разделил все элементы в четыре группы, рассортировав их по конфигурациям положения электронов. Таблица предельно проста и функциональна.
Он изучал орбитальное заполнение атомов – то, как располагаются электроны относительно ядра. И на основе этого разделил все элементы в четыре группы, рассортировав их по конфигурациям положения электронов. Таблица предельно проста и функциональна.
Таблица – спираль.
В 1964-ом Теодор Бенфей предложил поставить в центр таблицы водород (H), а прочие элементы разместить вокруг него по спирали, которая раскручивается по часовой стрелке. Уже на втором витке спираль вытягивается в петли, который соответствуют переходным металлам и лантаноидам с актиноидами, предусмотрено место для неизвестных пока суперактинидов. Это придает таблице вид экстравагантного дизайнерского решения.
Таблица – радужная спираль.
Изобретена в 1975 химиком Джеймсом Хайдом. Он увлекался кремнийорганическими соединениями, поэтому в основание таблицы попал именно кремень, так как у него большое число связей с другими элементами. Различные категории элементов так же объединены по секторам и отмечены нужным цветом. Таблица красивее аналогов, но из-за криволинейной формы пользоваться ею непросто.
Таблица красивее аналогов, но из-за криволинейной формы пользоваться ею непросто.
Эти таблицы отображают последовательность заполнения электронных оболочек. Во всяком случае некоторые из них. Все эти таблицы выглядят весьма экзотично.
Таблица изотопов. Здесь отображено время “жизни” различных изотопов, их стабильность в зависимости от массы ядра. Впрочем, это уже не таблица Менделеева, это совсем другая (ядерная физика) история…
Нестандартное домашнее задание по химии. Составляем Таблицу Менделеева из нарисованных карточек.
Тема домашнего задания: нарисовать карточку отдельного химического элемента, присутствующего в живых организмах (биоген) с иллюстрацией его действия на живые организмы.
Класс – 8– 10 класс; сложность – высокая, межпредметная; время выполнения – 30-40 минут.
Тип задания – индивидуальное, а затем – в группе; способ проверки – сбор иллюстраций отдельных химических элементов формата А4, и составление из них общей таблицы Менделеева.
Учебники:
1) учебник химии 10 класс — О.С. Габриелян, И.Г. Остроумов, С.Ю. Пономарев, углубленный уровень (ГЛАВА 7. Биологически активные соединения, стр.300).
2) учебник химии 8 класс – О.С. Габриелян, (§ 5. Периодическая система химических элементов Д. И. Менделеева. Знаки химических элементов, стр. 29).
3) учебник экологии 10 (11) класс – Е. А. Криксунов, В.В.Пасечник, (Глава 6. Окружающая среда и здоровье человека, 6.1. Химические загрязнения среды и здоровье человека, стр. 217).
4) учебник биологии 10-11 класс – Общая биология. Базовый уровень. Под ред. Беляева Д.К., Дымшица Г.М. (Глава 1. Химический состав клетки. § 1. Неорганические соединения, § 2. Биополимеры.).
Цели: освоениезнаний о биохимических процессах в живой клетке, геохимических процессах в природе, полученные школьниками самостоятельно и осмысленно, закреплённые рисунком, творческое рисование. Создание уникальных наглядных пособий для других учеников. Составление авторской уникальной «Таблицы Менделеева».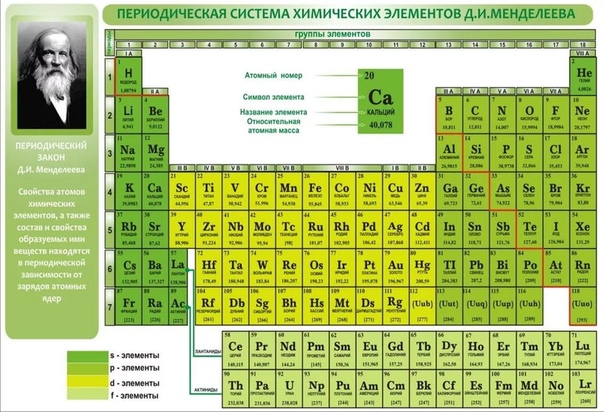
Пояснительная записка.
Суть домашнего задания в том, что ученики рисуют участие каждого химического элемента в геохимических процессах. А затем все рисунки объединяются в сводную “Таблицу Менделеева”, которую можно вывесить на стене в классе. Образуется некий наглядный продукт совместного творчества: “Экология в картинках”. В разных классах получаются разные “Таблицы Менделеева”, главное сохранить табличную форму и проследить, чтобы все рисунки были на листе формата А4. А также, чтобы в углу листа был проставлен химический знак того элемента, о котором нарисован сюжет. Вначале каждый ученик выбирает конкретный химический элемент для изучения. Затем самостоятельно, или с помощью учителя ищет информацию, выбирает нужную, придумывает сюжет рисунка, рисует и размещает свой рисунок на стене в ячейку умозрительной таблицы Менделеева для соответствующего химического элемента. Можно упростить/усложнить задачу, из всех химических элементов выбрав только наиболее распространенные на земле, или, наоборот – наименее распространенные.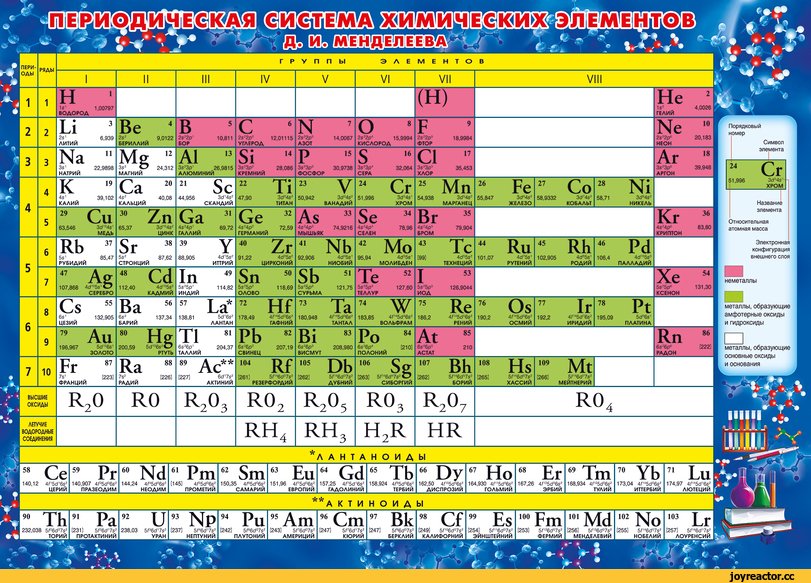 Можно выбрать только биогены (химические элементы, входящие в состав живых организмов) и рисовать
учебные карточки с сюжетами о них. Можно выбрать макроэлементы живых клеток, а можно – только микроэлементы и т.д. В экологических справочниках сейчас можно найти много различной информации на эту тему.
Можно выбрать только биогены (химические элементы, входящие в состав живых организмов) и рисовать
учебные карточки с сюжетами о них. Можно выбрать макроэлементы живых клеток, а можно – только микроэлементы и т.д. В экологических справочниках сейчас можно найти много различной информации на эту тему.
Справочный материал: Биогенными называют химические элементы, постоянно присутствующие в живых организмах и играющие какую-либо биологическую роль: O, C, H, Ca, N, K, P, Mg, S, Cl, Na, Fe, I , Cu .
Виртуальная «Таблица Менделеева». Вместо бумажной таблицы на стене в классе, можно организовать виртуальную таблицу и общую работу в ней учеников. Для этого учитель готовит макет таблицы в Google -документах и открывает доступ ученикам. Рисовать ученики могут с помощью компьютерных программ, а могут загружать рисунки, выполненные карандашами и красками. Вот первоначальный макет такой таблицы, частично заполненный учениками.
Отдельные учебные карточки , с ученическими скетчами на тему воздействия конкретных химических элементов на живые организмы (формат А4 каждой карточки).
ПРИЛОЖЕНИЕ. Таблица химических элементов-биогенов, как справочный материал для рисования сюжетов учебных карточек.
Пороговые концентрации химических элементов в почвах (мг/кг) и возможные реакции организмов (по Ковальскому) | |||
Химический элемент | Недостаток – нижняя пороговая концентрация | Норма | Избыток – верхняя пороговая концентрация |
Кобальт | Меньше 2-7. Анемия, гипо- и авитоминоз В, эндемический зоб. | 7-30 | Более 30. Угнетение синтеза витамина В. |
Медь | Меньше 6-13. Анемия, заболевания костной системы. Невызревание злаков, суховершинность плодовых деревьев. | 13-60 | Более 60. |
Марганец | До 400. Заболевание костей, увеличение зоба. | 400-3000 | Более 3000. Заболевания костной системы. |
Цинк | До 30. Карликовый рост растений и животных. | 30-70 | Более 70. Угнетение окислительных процессов, анемия |
Молибден | До 1,5. Заболевания растений. | 1,5-4 | Более 4. Подагра у человека, молибденовый токсикоз у животных. |
Бор | Меньше 3-6. Отмирание точек роста стеблей и корней растений. | 6-30 | Более 30. Боровые поносы (энтериты) у животных. |
Стронций | Более 600. Уровская болезнь, рахит, ломкость костей. | ||
Йод | Менее 2-5. Эндемический зоб у людей | 5-40 | Более 40. Ослабление синтеза йодистых соединений щитовидной железы. |
Таблица Менделеева является одним из величайших открытий человечества, позволившим упорядочить знания об окружающем мире и открыть новые химические элементы . Она является необходимой для школьников, а так же для всех, кто интересуется химией. Кроме того, данная схема является незаменимой и в других областях науки.
Данная схема содержит все известные человеку элементы, причем они группируются в зависимости от атомной массы и порядкового номера . Эти характеристики влияют на свойства элементов. Всего в коротком варианте таблицы имеется 8 групп, элементы, входящие в одну группу, обладают весьма сходными свойствами. Первая группа содержит водород, литий, калий, медь, латинское произношение на русском которой купрум. А так же аргентум — серебро, цезий, золото — аурум и франций. Во второй группе расположены бериллий, магний, кальций, цинк, за ними идут стронций, кадмий, барий, заканчивается группа ртутью и радием.
Во второй группе расположены бериллий, магний, кальций, цинк, за ними идут стронций, кадмий, барий, заканчивается группа ртутью и радием.
В состав третьей группы вошли бор, алюминий, скандий, галлий, потом следуют иттрий, индий, лантан, завершается группа таллием и актинием. Четвертая группа начинается с углерода, кремния, титана, продолжается германием, цирконием, оловом и завершается гафнием, свинцом и резерфордием. В пятой группе имеются такие элементы, как азот, фосфор, ванадий, ниже расположены мышьяк, ниобий, сурьма, потом идут тантал висмут и завершает группу дубний. Шестая начинается с кислорода, за которым лежат сера, хром, селен, потом следуют молибден, теллур, далее вольфрам, полоний и сиборгий.
В седьмой группе первый элемент – фтор, потом следует хлор, марганец, бром, технеций, за ним находится йод, потом рений, астат и борий. Последняя группа является самой многочисленной . В нее входят такие газы, как гелий, неон, аргон, криптон, ксенон и радон. Так же к данной группе относятся металлы железо, кобальт, никель, родий, палладий, рутений, осмий, иридий, платина. Далее идут ханний и мейтнерий. Отдельно расположены элементы, которые образуют ряд актиноидов и ряд лантаноидов . Они обладают сходными свойствами с лантаном и актинием.
Далее идут ханний и мейтнерий. Отдельно расположены элементы, которые образуют ряд актиноидов и ряд лантаноидов . Они обладают сходными свойствами с лантаном и актинием.
Данная схема включает в себя все виды элементов, которые делятся на 2 большие группы – металлы и неметаллы , обладающие разными свойствами. Как определить принадлежность элемента к той или иной группе, поможет условная линия, которую необходимо провести от бора к астату. Следует помнить, что такую линию можно провести только в полной версии таблицы. Все элементы, которые находятся выше этой линии, и располагаются в главных подгруппах считаются неметаллами. А которые ниже, в главных подгруппах – металлами. Так же металлами являются вещества, находящиеся в побочных подгруппах . Существуют специальные картинки и фото, на которых можно детально ознакомиться с положением этих элементов. Стоит отметить, что те элементы, которые находятся на этой линии, проявляют одинаково свойства и металлов и неметаллов.
Отдельный список составляют и амфотерные элементы, которые обладают двойственными свойствами и могут образовывать в результате реакций 2 вида соединений. При этом у них проявляются одинаково как основные, так и кислотные свойства . Преобладание тех или иных свойств зависит от условий реакции и веществ, с которыми амфотерный элемент реагирует.
Стоит отметить, что данная схема в традиционном исполнении хорошего качества является цветной. При этом разными цветами для удобства ориентирования обозначаются главные и побочные подгруппы . А так же элементы группируются в зависимости от схожести их свойств.
Однако в настоящее время наряду с цветной схемой очень распространенной является периодическая таблица Менделеева черно белая. Такой ее вид используется для черно-белой печати. Несмотря на кажущуюся сложность, работать с ней так же удобно, если учесть некоторые нюансы. Так, отличить главную подгруппу от побочной в таком случае можно по отличиям в оттенках, которые хорошо заметны.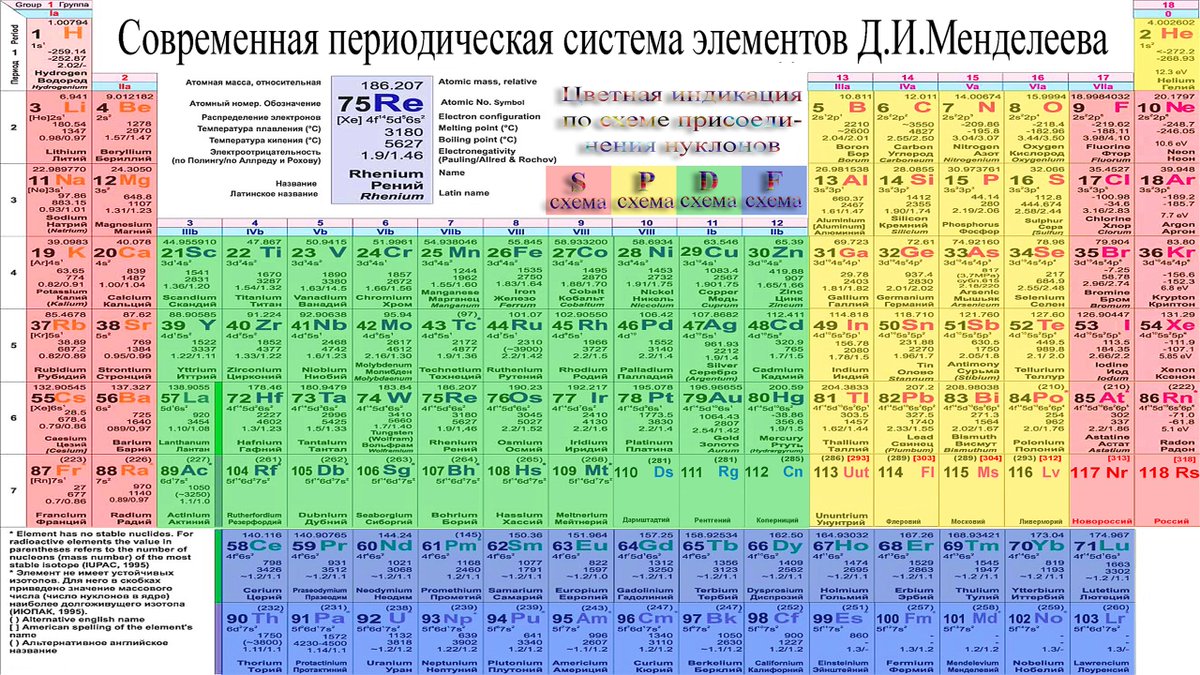 К тому же в цветном варианте элементы с наличием электронов на разных слоях обозначаются разными цветами .
К тому же в цветном варианте элементы с наличием электронов на разных слоях обозначаются разными цветами .
Стоит отметить, что в одноцветном исполнении ориентироваться по схеме не очень трудно. Для этого будет достаточно информации, указанной в каждой отдельной клеточке элемента.
Егэ сегодня является основным видом испытания по окончанию школы, а значит, подготовке к нему необходимо уделять особое внимание. Поэтому при выборе итогового экзамена по химии , необходимо обратить внимание на материалы, которые могут помочь в его сдаче. Как правило, школьникам на экзамене разрешено пользоваться некоторыми таблицами, в частности, таблицей Менделеева в хорошем качестве. Поэтому, чтобы она принесла на испытаниях только пользу, следует заблаговременно уделить внимание ее строению и изучению свойств элементов, а так же их последовательности. Необходимо научиться, так же пользоваться и черно-белой версией таблицы , чтобы на экзамене не столкнуться с некоторыми трудностями.
Помимо основной таблицы, характеризующей свойства элементов и их зависимость от атомной массы, существуют и другие схемы, которые могут оказать помощь при изучении химии. Например, существуют таблицы растворимости и электроотрицательности веществ . По первой можно определить, насколько растворимо то или иное соединение в воде при обычной температуре. При этом по горизонтали располагаются анионы – отрицательно заряженные ионы, а по вертикали – катионы, то есть положительно заряженные ионы. Чтобы узнать степень растворимости того, или иного соединения, необходимо по таблице найти его составляющие. И на месте их пересечения будет нужное обозначение.
Если это буква «р», то вещество полностью растворимо в воде в нормальных условиях. При наличии буквы «м» — вещество малорастворимое, а при наличии буквы «н» — оно почти не растворяется. Если стоит знак «+», — соединение не образует осадок и без остатка реагирует с растворителем. Если присутствует знак «-», это означает, что такого вещества не существует. Иногда так же в таблице можно увидеть знак «?», тогда это обозначает, что степень растворимости этого соединения доподлинно не известна. Электроотрицательность элементов может варьироваться от 1 до 8, для определения этого параметра так же существует специальная таблица.
Иногда так же в таблице можно увидеть знак «?», тогда это обозначает, что степень растворимости этого соединения доподлинно не известна. Электроотрицательность элементов может варьироваться от 1 до 8, для определения этого параметра так же существует специальная таблица.
Еще одна полезная таблица – ряд активности металлов. В нем располагаются все металлы по увеличении степени электрохимического потенциала. Начинается ряд напряжения металлов с лития, заканчивается золотом. Считается, что чем левее занимает место в данном ряду металл, тем он более активен в химических реакциях. Таким образом, самым активным металлом считается металл щелочного типа литий. В списке элементов ближе к концу так же присутствует водород. Считается, что металлы, которые расположены после него, являются практически неактивными. Среди них такие элементы, как медь, ртуть, серебро, платина и золото.
Таблица Менделеева картинки в хорошем качестве
Данная схема является одним из крупнейших достижений в области химии. При этом существует немало видов этой таблицы – короткий вариант, длинный, а так же сверхдлинный. Самой распространенной является короткая таблица, так же часто встречается и длинная версия схемы. Стоит отметить, что короткая версия схемы в настоящее время не рекомендуется ИЮПАК для использования.
При этом существует немало видов этой таблицы – короткий вариант, длинный, а так же сверхдлинный. Самой распространенной является короткая таблица, так же часто встречается и длинная версия схемы. Стоит отметить, что короткая версия схемы в настоящее время не рекомендуется ИЮПАК для использования.
Всего было разработано больше сотни видов таблицы , отличающихся представлением, формой и графическим представлением. Они используются в разных областях науки, либо совсем не применяются. В настоящее время новые конфигурации схемы продолжают разрабатываться исследователями. В качестве основного варианта используется либо короткая, либо длинная схема в отличном качестве.
Изначальная таблица Менделеева включала эфир. Зачем же его исключили? : matveychev_oleg — LiveJournal
Мировой эфир есть субстанция ВСЯКОГО химического элемента и значит – ВСЯКОГО вещества, есть Абсолютная истинная материя как Всемирная элементообразующая Сущность.Мировой эфир – это исток и венец всей подлинной Таблицы Менделеева, её начало и конец, – альфа и омега Периодической системы элементов Дмитрия Ивановича Менделеева.
В античной философии эфир (aithér-греч) наряду с землей, водой, воздухом и огнем – один из пяти элементов бытия (по Аристотелю) – пятая сущность (quinta essentia -лат.), понимаемая как тончайшая всепроникающая материя. В конце XIX века в ученых кругах получила широкое хождение гипотеза о мировом эфире (МЭ), заполняющем все мировое пространство. Он понимался как невесомая и упругая жидкость, которая пронизывает все тела. Существованием эфира пытались объяснить многие физические явления и свойства.
Предисловие.У Менделеева было два фундаментальных научных открытия:
1 – Открытие Периодического закона в субстанции химии,
2 – Открытие взаимосвязи субстанции химии и субстанции Эфира, а именно: частицы Эфира формирует молекулы, ядра, электроны и т.д., но в химических реакциях не участвуют.
Эфир – частицы вещества размером ~ 10–100 метра (фактически – «первокирпичики» материи).
Факты. В подлинной таблице Менделеева был Эфир. Ячейка для Эфира располагалась в нулевой группе с инертными газами и в нулевом ряду как главный системообразующий фактор для построения Системы химических элементов. После смерти Менделеева таблицу исказили, убрав из неё Эфир и отменив нулевую группу, тем самым, скрыв фундаментальное открытие концептуального значения.
После смерти Менделеева таблицу исказили, убрав из неё Эфир и отменив нулевую группу, тем самым, скрыв фундаментальное открытие концептуального значения.
В современных таблицах Эфира: 1 – не видно, 2 – и не угадывается (из-за отсутствия нулевой группы).
Такой целенаправленный подлог сдерживает развитие прогресса цивилизации.
Техногенные катастрофы (напр. Чернобыль и Фукусима) были бы исключены, если бы в развитие подлинной таблицы Менделеева своевременно были вложены адекватные ресурсы. Сокрытие концептуальных знаний идёт на глобальном уровне для «опускания» цивилизации.
Результат. В школах и ВУЗах преподают обрезанную таблицу Менделеева.
Оценка ситуации. Таблица Менделеева без Эфира – то же самое, что человечество без детей – прожить можно, но развития и будущего не будет.
Резюме. Если враги человечества знания скрывают, то наша задача – эти знания раскрывать.
Вывод. В старой таблице Менделеева элементов меньше, а форсайта больше, чем в современной.
Заключение. Новый уровень возможен только при изменении информационного состояния общества.
Новый уровень возможен только при изменении информационного состояния общества.
Итог. Возврат к истинной таблице Менделеева – это уже вопрос не научный, а вопрос политический.
В чем же был основной политический смысл эйнштейновского учения? Он состоял в том, чтобы любыми путями перекрыть человечеству доступ к неисчерпаемым естественным источникам энергии, которые открывало изучение свойств мирового эфира. В случае успеха на этом пути, мировая финансовая олигархия теряла власть в этом мире, особенно в свете ретроспективы тех лет: Рокфеллеры сделали немыслимое состояние, превосходящее бюджет Соединенных Штатов, на нефтяных спекуляциях, и утрата той роли нефти, которую заняло «черное золото» в этом мире – роль крови мировой экономики – их не вдохновляла.
Не вдохновляло это и прочих олигархов – угольных и стальных королей. Так финансовый магнат Морган моментально прекратил финансирование экспериментов Николы Теслы, когда тот вплотную подошел к беспроводной передаче энергии и извлечению энергии «из ниоткуда» – из мирового эфира. После этого обладателю огромного количества воплощенных в практику технических решений не оказывал финансовой помощи никто – солидарность у финансовых воротил как у воров в законе и феноменальный нюх на то, откуда исходит опасность. Вот поэтому против человечества и была произведена диверсия под названием «Специальная Теория Относительности».
После этого обладателю огромного количества воплощенных в практику технических решений не оказывал финансовой помощи никто – солидарность у финансовых воротил как у воров в законе и феноменальный нюх на то, откуда исходит опасность. Вот поэтому против человечества и была произведена диверсия под названием «Специальная Теория Относительности».
Один из первых ударов пришелся на таблицу Дмитрия Менделеева, в которой эфир стоял первым номером, именно размышления об эфире породили гениальное прозрение Менделеева – его периодическую таблицу элементов.
Глава из статьи: В.Г. Родионов. Место и роль мирового эфира в истинной таблице Д.И. Менделеева
6. Argumentum ad rem
То, что сейчас преподносят в школах и университетах под названием «Периодическая система химических элементов Д.И. Менделеева»,- откровенная ф а л ь ш и в к а .
Последний раз в неискажённом виде настоящая Таблица Менделеева увидела свет в 1906 году в Санкт-Петербурге (учебник «Основы химии», VIII издание). И только спустя 96 лет забвения подлинная Таблица Менделеева впервые восстаёт из пепла благодаря публикации диссертации в журнале ЖРФМ Русского Физического Общества.
И только спустя 96 лет забвения подлинная Таблица Менделеева впервые восстаёт из пепла благодаря публикации диссертации в журнале ЖРФМ Русского Физического Общества.
После скоропостижной смерти Д. И. Менделеева и ухода из жизни его верных научных коллег по Русскому Физико-Химическому Обществу, впервые поднял руку на бессмертное творение Менделеева — сын друга и соратника Д. И. Менделеева по Обществу — Борис Николаевич Меншуткин. Конечно, Меншуткин действовал не в одиночку, — он лишь выполнял заказ. Ведь, новая парадигма релятивизма требовала отказа от идеи мирового эфира; и потому это требование было возведено в ранг догмы, а труд Д. И. Менделеева был фальсифицирован.
Главное искажение Таблицы — перенос «нулевой группы» Таблицы в её конец, вправо, и введение т.н. «периодов». Подчёркиваем, что такая (лишь на первый взгляд — безобидная) манипуляция логически объяснима только как сознательное устранение главного методологического звена в открытии Менделеева: периодическая система элементов в своём начале, истоке, т. е. в верхнем левом углу Таблицы, должна иметь нулевую группу и нулевой ряд, где располагается элемент «Х» (по Менделееву — «Ньютоний»),- т.е. мировой эфир.
е. в верхнем левом углу Таблицы, должна иметь нулевую группу и нулевой ряд, где располагается элемент «Х» (по Менделееву — «Ньютоний»),- т.е. мировой эфир.
Более того, являясь единственным системообразующим элементом всей Таблицы производных элементов, этот элемент «Х» есть аргумент всей Таблицы Менделеева. Перенос же нулевой группы Таблицы в её конец уничтожает саму идею этой первоосновы всей системы элементов по Менделееву.
Для подтверждения вышесказанного, предоставим слово самому Д. И. Менделееву.
«… Если же аналоги аргона вовсе не дают соединений, то очевидно, что нельзя включать ни одну из групп ранее известных элементов, и для них должно открыть особую группу нулевую … Это положение аргоновых аналогов в нулевой группе составляет строго логическое следствие понимания периодического закона, а потому (помещение в группе VIII явно не верно) принято не только мною, но и Браизнером, Пиччини и другими … Теперь же, когда стало не подлежать ни малейшему сомнению, что перед той I группой, в которой должно помещать водород, существует нулевая группа, представители которой имеют веса атомов меньше, чем у элементов I группы, мне кажется невозможным отрицать существование элементов более лёгких, чем водород.
Из них обратим внимание сперва на элемент первого ряда 1-й группы. Его означим через «y». Ему, очевидно, будут принадлежать коренные свойства аргоновых газов … «Короний», плотностью порядка 0,2 по отношению к водороду; и он не может быть ни коим образом мировым эфиром.
Этот элемент «у», однако, необходим для того, чтобы умственно подобраться к тому наиглавнейшему, а потому и наиболее быстро движущемуся элементу «х», который, по моему разумению, можно считать эфиром. Мне бы хотелось предварительно назвать его «Ньютонием» — в честь бессмертного Ньютона … Задачу тяготения и задачи всей энергетики (!!! — В.Родионов) нельзя представить реально решёнными без реального понимания эфира, как мировой среды, передающей энергию на расстояния. Реального же понимания эфира нельзя достичь, игнорируя его химизм и не считая его элементарным веществом; элементарные же вещества ныне немыслимы без подчинения их периодической законности» («Попытка химического понимания мирового эфира». 1905 г. , стр. 27).
, стр. 27).
«Эти элементы, по величине их атомных весов, заняли точное место между галлоидами и щелочными металлами, как показал Рамзай в 1900 году. Из этих элементов необходимо образовать особую нулевую группу, которую прежде всех в 1900 году признал Еррере в Бельгии. Считаю здесь полезным присовокупить, что прямо судя по неспособности к соединениям элементов нулевой группы, аналогов аргона должно поставить раньше элементов 1 группы и по духу периодической системы ждать для них меньшего атомного веса, чем для щелочных металлов.
Это так и оказалось. А если так, то это обстоятельство, с одной стороны, служит подтверждением правильности периодических начал, а с другой стороны, ясно показывает отношение аналогов аргона к другим, ранее известным, элементам. Вследствие этого можно разбираемые начала прилагать ещё шире, чем ранее, и ждать элементов нулевого ряда с атомными весами гораздо меньшими, чем у водорода.
Таким образом, можно показать, что в первом ряду первым перед водородом существует элемент нулевой группы с атомным весом 0,4 (быть может, это короний Ионга), а в ряду нулевом, в нулевой группе — предельный элемент с ничтожно малым атомным весом, не способным к химическим взаимодействиям и обладающий вследствие того чрезвычайно быстрым собственным частичным (газовым) движением.
Эти свойства, быть может, должно приписать атомам всепроникающего (!!! — В.Родионов) мирового эфира. Мысль об этом указана мною в предисловии к этому изданию и в русской журнальной статье 1902 года …» («Основы химии». VIII изд., 1906 г., стр. 613 и след.)
Скачать статью В.Г. Родионова
Настоящая таблица Менделеева. Рыбников Юрий Степанович.
Запретная Физика. Теория Эфира
Полное видео лекции тут: Фальсификация таблицы Менделеева
Источники: 1, 2, 3, 4
Из комментариев:
Для химии современной периодической таблицы элементов достаточно.
Роль эфира может быть полезна в ядерных реакциях, но и это слишком не значительно.
Учёт влияния эфира наиболее близко в явлениях распада изотопов. Однако учёт этот чрезвычайно сложен и наличие закономерностей принимаются не всеми учёными.
Самое простое доказательство наличия эфира: Явление аннигиляции позитрон-электронной пары и возникновение этой пары из вакуума, а также невозможность поймать электрон в состоянии покоя. Так же электромагнитное поле и полная аналогия между фотонами в вакууме и звуковыми волнами – фононами в кристаллах.
Так же электромагнитное поле и полная аналогия между фотонами в вакууме и звуковыми волнами – фононами в кристаллах.
Оригинал у digitall_angell
О происхождении химических элементов
Мы считаем само собой разумеющимся, что существует периодическая таблица с многочисленными элементами (по последним подсчетам, 118), из которых мы можем построить мир вокруг нас. Но когда Вселенная началась с большого взрыва, в ней вообще не было элементов. Многие элементы, из которых состоит Земля и люди на ней, должны были быть созданы в ядерных печах внутри звезд и высвободились только после того, как звезда достигла конца своей жизни. Фактически, только легкие элементы, такие как водород и гелий, были созданы в начале Вселенной.Мы можем использовать наши знания о том, как реагируют частицы, чтобы выяснить, как эти элементы образовались всего через несколько минут после Большого взрыва.
Альфер, Бете, Гамов…
«Казалось несправедливым по отношению к греческому алфавиту, чтобы статья была подписана только Альфером и Гамовым, и поэтому имя доктора Ганса А.Бете ( заочно ) был вставлен при подготовке рукописи к печати»
— Георгий Гамов, Сотворение Вселенной (1952)
Когда Ральф Альфер защищал докторскую диссертацию в 1948 году, посмотреть пришло более 300 человек.Защита диссертации обычно не вызывает такого большого волнения, по крайней мере, не за пределами ближайших родственников защитника, но эта была другой.
Прежде чем закончить свою докторскую диссертацию, Альфер вместе со своим научным руководителем Джорджем Гамовым написали и опубликовали статью, в которой утверждалось, что Большой взрыв создал водород, гелий и другие элементы в определенных количествах. Гамов, всегда юморист, считал неуместным публиковать статью с именами авторов, столь похожими на «альфа» и «гамма», не включая «бета» — к счастью, друг Гамова Ганс Бете был счастлив угодить, и его имя было добавлено. к бумаге.Бете действительно просмотрел рукопись и позже работал над теориями, компенсирующими недостатки первоначальной статьи.
Статья была опубликована в Physical Review 1 апреля 1948 года. Она называлась «Происхождение химических элементов» и описывала процесс, благодаря которому все известные элементы во Вселенной могли появиться вскоре после Большого взрыва. Он основывался на предыдущей работе Гамова, в которой предполагалось, что элементы возникли «в результате непрерывного процесса наращивания, остановленного быстрым расширением и охлаждением первичной материи» — другими словами, различные атомы были созданы путем добавления одного нуклона в время до ядра, прежде чем процесс был остановлен, когда Вселенная стала слишком холодной.
Альфер и Гамов (с небольшой помощью Бете) изложили свое видение ранней Вселенной, в которой вся материя представляла собой сильно сжатый «суп» нейтронов, некоторые из которых могли улетучиваться и распадаться на протоны и электроны по мере того, как Вселенная расширилась и стала менее плотной. Они считали, что эти новые протоны могут затем захватывать нейтроны, вместе создавая ядра дейтерия — изотопа водорода, который имеет один протон и один нейтрон. Затем они экстраполировали эту идею и сказали, что все, что нужно было сделать для создания более тяжелых ядер, — это захватить еще один нуклон.
Затем они экстраполировали эту идею и сказали, что все, что нужно было сделать для создания более тяжелых ядер, — это захватить еще один нуклон.
Но все немного сложнее. Их идея работает для элементов вплоть до гелия — и действительно производит водород и гелий, которые вместе составляют 99% материи во Вселенной, в правильных пропорциях, объясняющих их распространенность, — но она терпит неудачу, когда вы пытаетесь сложить вместе пять нуклонов. Не существует стабильного изотопа любого элемента, имеющего пять нуклонов. Теория Альфера и Гамова основывалась на использовании каждого элемента в качестве ступени для перехода к следующему, поэтому эта информация остановила ее на своем пути.
Тем не менее, это был важный шаг в правильном направлении, и он описывал большую часть Вселенной в силу того факта, что водород и гелий составляют такую большую ее часть. Теория была признана значимой и в то время. Среди 300 человек, присутствовавших в комнате на защите диссертации Альфера, по-видимому, была газета Washington Post. После его выступления они опубликовали статью под заголовком «Мир начался за 5 минут, новая теория».
После его выступления они опубликовали статью под заголовком «Мир начался за 5 минут, новая теория».
Нуклеосинтез Большого Взрыва
С тех пор, как Альфер, Бете и Гамов опубликовали свою статью, космологи проделали гораздо больше работы по изучению образования легких элементов в ранней Вселенной.Теперь у этого процесса есть название: нуклеосинтез большого взрыва.
В первые несколько секунд после Большого взрыва Вселенная была очень горячей и плотной, что делало ее полностью ионизированной — все протоны, нейтроны и электроны свободно перемещались и не собирались вместе, чтобы образовать атомы. Только через три минуты, когда Вселенная остыла с 10 32 до 10 9 °C, могло начаться образование легких элементов.
В этот момент электроны все еще свободно перемещались, и могли образовываться только атомные ядра.Технически протоны были первыми ядрами (в соединении с электроном они образуют атом водорода), а дейтроны — вторыми. Дейтроны являются ядрами дейтерия и образуются, когда протоны и нейтроны сливаются и испускают фотоны.
Дейтроны являются ядрами дейтерия и образуются, когда протоны и нейтроны сливаются и испускают фотоны.
Дейтроны и нейтроны могут сливаться, образуя ядро трития с одним протоном и двумя нейтронами. Когда ядро трития сталкивается с протоном, они могут объединиться в ядро гелия с двумя протонами и двумя нейтронами, известное как He-4. Другой путь, ведущий к гелию, — это соединение дейтрона и протона в ядро гелия с двумя протонами, но только с одним нейтроном, Не-3.Когда Не-3 сталкивается с нейтроном, они могут сливаться, образуя полное ядро гелия, Не-4. На каждом этапе этих реакций также испускается фотон.
Излучение фотонов может быть медленным процессом, и существует ряд реакций, которые поглощают дейтроны и создают ядра гелия быстрее, потому что они обходят испускание фотонов. Они начинают с слияния двух дейтронов, а конечным результатом является ядро He-4 и либо протон, либо нейтрон, в зависимости от конкретного пути.
Литий и бериллий также производились в очень небольших количествах.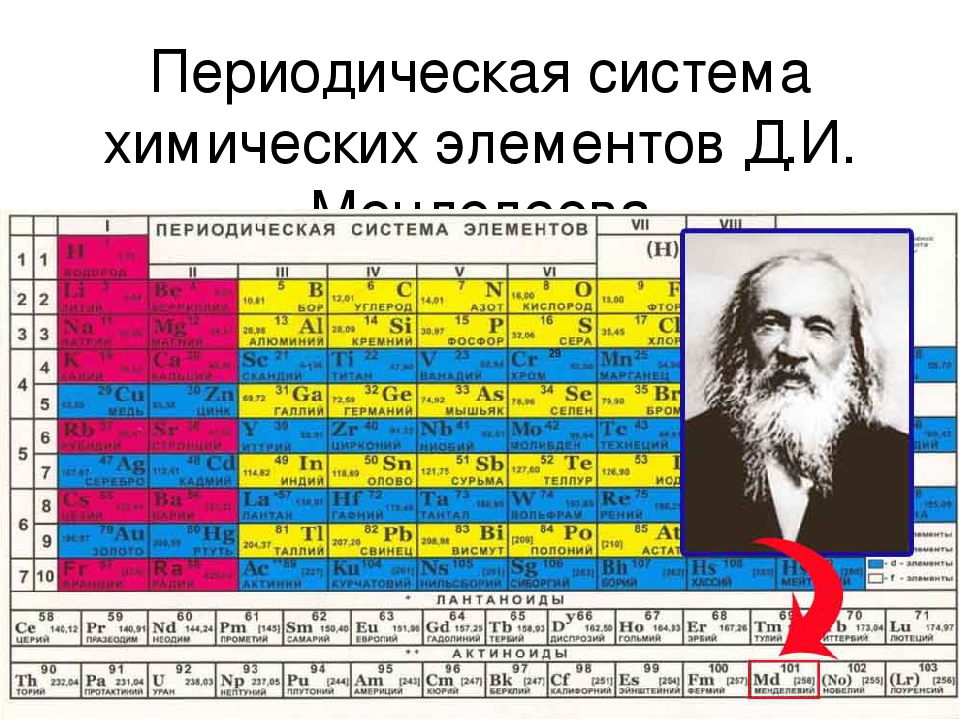 Весь этот процесс происходил более чем через 20 минут после Большого взрыва, когда Вселенная стала слишком холодной и разреженной для образования ядер.
Весь этот процесс происходил более чем через 20 минут после Большого взрыва, когда Вселенная стала слишком холодной и разреженной для образования ядер.
Обилие легких элементов можно предсказать, используя всего одну величину — плотность барионов во время нуклеосинтеза. Барионы — это частицы, состоящие из трех кварков, таких как протоны и нейтроны. Используя плотность барионов, предсказанную нуклеосинтезом Большого взрыва, общая масса Вселенной составила бы 25% гелия, 0,01% дейтерия и даже меньше, чем лития.Эти первобытные изобилия можно проверить и, конечно же, испытали. Нигде во Вселенной не наблюдается содержание гелия менее 23%. Это главное доказательство большого взрыва.
Ядрам, образовавшимся в ходе нуклеосинтеза Большого взрыва, пришлось долго ждать, прежде чем они смогли объединиться с электронами и образовать нейтральные атомы. Когда через 380 000 лет после Большого взрыва наконец был получен нейтральный водород, было испущено космическое микроволновое фоновое излучение (CMB).
Альфер и его коллега Роберт Херман предсказали существование реликтового излучения в конце 1940-х годов, когда поняли, что реликтовое излучение будет побочным эффектом рекомбинации электронов с атомными ядрами.Теперь реликтовое излучение дает нам возможность перепроверить нашу работу с помощью независимых измерений барионной плотности. Глядя на флуктуации реликтового излучения, мы находим барионную плотность, которая дает правильное содержание легких элементов — кажется, мы действительно понимаем, что произошло всего через несколько минут после образования Вселенной.
Ссылка
Альфер Р., Бете Х. и Гамов Г. (1948). The Origin of Chemical Elements Physical Review, 73 (7), 803-804 DOI: 10.1103/PhysRev.73.803
ISOLDE раскрывает фундаментальное свойство самого редкого элемента на Земле
Это открытие важно как для фундаментальных, так и для медицинских исследований, поскольку этот элемент является многообещающим кандидатом для лечения рака с помощью таргетной альфа-терапии.
Группа исследователей, использующих ядерно-физический комплекс ISOLDE в ЦЕРНе, впервые измерила так называемое сродство к электрону химического элемента астата, самого редко встречающегося в природе элемента на Земле.Результат, описанный в статье, только что опубликованной в Nature Communications , важен как для фундаментальных, так и для прикладных исследований. Это открытие не только дает доступ к неизвестным до сих пор свойствам этого элемента и позволяет тестировать теоретические модели, но и представляет практический интерес, поскольку астат является многообещающим кандидатом для создания химических соединений для лечения рака с помощью таргетной альфа-терапии.
Сродство к электрону — это энергия, высвобождаемая при присоединении электрона к нейтральному атому в газовой фазе с образованием отрицательного иона.Это одно из самых фундаментальных свойств химического элемента. Вместе с энергией ионизации, энергией, необходимой для отрыва электрона от атома, она определяет несколько других характеристик элемента, таких как его электроотрицательность — способность элемента притягивать общие электроны в химических связях между атомами.
Хотя астат был открыт в 1940-х годах, знания о его свойствах в основном основывались на теоретических расчетах или на экстраполяции свойств его родственников в периодической таблице; астат относится к семейству галогенов, в которое входят хлор и йод.Это связано с тем, что на Земле мало астата, а крошечные количества этого элемента, которые можно получить в лаборатории, не позволяют использовать традиционные методы измерения его свойств. Одним заметным исключением было предыдущее измерение в ISOLDE энергии ионизации элемента.
В новом исследовании ISOLDE атомы астата были впервые получены вместе с другими атомами путем запуска высокоэнергетического пучка протонов из протонного синхротронного ускорителя по ториевой мишени. Затем атомы астата были подвергнуты отрицательной ионизации, а ионы изотопа 211 At были извлечены и отправлены в специальное измерительное устройство, в котором на ионы направлялся лазерный свет с регулируемой энергией для измерения энергии, необходимой для извлечения дополнительного электрона из атома. 211 На ион и превратить ион в нейтральный атом.
211 На ион и превратить ион в нейтральный атом.
Из этого измерения исследователи ISOLDE получили значение 2,41578 эВ для электронного сродства астата. Это значение, которое согласуется со значением, полученным авторами с использованием современных теоретических расчетов, указывает на то, что сродство к электрону астата является самым низким из всех галогенов, но, тем не менее, выше, чем у любых других элементов вне семейства галогенов. которые были измерены до сих пор.
Если этого было недостаточно, исследователи продолжили использовать полученное сродство к электрону и предыдущее измерение энергии ионизации, чтобы определить несколько других свойств астата, таких как его электроотрицательность.
Эти свойства имеют отношение к исследованиям, изучающим возможное использование соединений 211 At в таргетной альфа-терапии, лечении, которое доставляет альфа-излучение к раковым клеткам. Астатин 211 At является идеальным источником альфа-излучения, но большинство исследуемых соединений 211 At подвержены быстрому высвобождению отрицательных ионов 211 At, которые могут повредить здоровые клетки до того, как соединения достигнут раковых клеток.
«Наши результаты могут быть использованы для улучшения наших знаний об этой реакции высвобождения и стабильности соединений 211 At, рассматриваемых для таргетной альфа-терапии», — говорит ведущий автор исследования Дэвид Леймбах.«Кроме того, наши результаты открывают путь к измерениям сродства к электрону элементов тяжелее астата, потенциально сверхтяжелых элементов, которые производятся по одному атому за раз».
«Настоящим результатом мы завершаем 10-летнюю исследовательскую работу в ISOLDE по определению фундаментальных свойств астата, энергии ионизации и сродства к электрону, которые в совокупности позволили нам определить электроотрицательность астата», — добавляет Себастьян Роте, ведущий автор более раннего исследования ISOLDE.
Происхождение элементов
Происхождение элементов
Приблизительно 73% массы видимой Вселенной находится в форме водорода. Гелий составляет около 25% массы, а все остальное составляет всего 2%. Хотя содержание этих более массивных («тяжелых», A > 4) элементов кажется довольно низким, важно помнить, что большинство атомов в наших телах и на Земле являются частью этой небольшой части материи Земли. вселенная.Элементы с малой массой, водород и гелий, были произведены в горячих и плотных условиях рождения самой Вселенной. Рождение, жизнь и смерть звезды описываются в терминах ядерных реакций. Химические элементы, составляющие материю, которую мы наблюдаем во Вселенной, были созданы в результате этих реакций.
Хотя содержание этих более массивных («тяжелых», A > 4) элементов кажется довольно низким, важно помнить, что большинство атомов в наших телах и на Земле являются частью этой небольшой части материи Земли. вселенная.Элементы с малой массой, водород и гелий, были произведены в горячих и плотных условиях рождения самой Вселенной. Рождение, жизнь и смерть звезды описываются в терминах ядерных реакций. Химические элементы, составляющие материю, которую мы наблюдаем во Вселенной, были созданы в результате этих реакций.
Приблизительно 15 миллиардов лет назад Вселенная началась как чрезвычайно горячая и плотная область лучистой энергии, Большой Взрыв. Сразу после образования он начал расширяться и охлаждаться.Лучистая энергия произвела кварк-антикварки и электрон-позитроны, а также другие пары частица-античастица. Однако когда частицы и античастицы столкнутся в высокоэнергетическом газе, они аннигилируют обратно в электромагнитную энергию. По мере расширения Вселенной средняя энергия излучения становилась меньше. Рождение и аннигиляция частиц продолжались до тех пор, пока температура не снизилась настолько, что создание пар стало энергетически невозможным.
Рождение и аннигиляция частиц продолжались до тех пор, пока температура не снизилась настолько, что создание пар стало энергетически невозможным.
Одним из признаков Большого Взрыва, сохранившихся до наших дней, является длинноволновое излучение, заполняющее Вселенную.Это радиация, оставшаяся от первоначального взрыва. Текущая температура этого «фонового» излучения составляет 2,7 К. (Температура Т газа или плазмы и средняя кинетическая энергия частиц Е связаны постоянной Больцмана к = 1,38 х 10 -23 Дж/К, в уравнении E = kT .) На рис. 10.1 показаны температуры на различных этапах временной эволюции Вселенной от кварк-глюонной плазмы до настоящего времени.
Сначала кварки и электроны существовали в виде плазмы лишь мимолетно, потому что аннигиляция удаляла их так же быстро, как и создавала. Когда Вселенная остыла, кварки сконденсировались в нуклоны. Этот процесс был похож на то, как пар конденсируется в капли жидкости при охлаждении водяного пара. Дальнейшее расширение и охлаждение позволило нейтронам и некоторым протонам слиться с ядрами гелия. Содержание водорода 73% и гелия 25%, существующее сегодня во Вселенной, обусловлено периодом конденсации в течение первых трех минут.2% ядер, более массивных, чем гелий, присутствующих во Вселенной сегодня, были созданы позже в звездах.
Дальнейшее расширение и охлаждение позволило нейтронам и некоторым протонам слиться с ядрами гелия. Содержание водорода 73% и гелия 25%, существующее сегодня во Вселенной, обусловлено периодом конденсации в течение первых трех минут.2% ядер, более массивных, чем гелий, присутствующих во Вселенной сегодня, были созданы позже в звездах.
Ядерные реакции, которые образовали 4 He из нейтронов и протонов, были реакциями радиационного захвата. Свободные нейтроны и протоны, слитые с дейтерием (d или 2 H) с избыточной энергией, испускаемой в виде гамма-излучения с энергией 2,2 МэВ,
n + p Æ d + g.
Эти дейтроны могли затем захватить другой нейтрон или свободный протон с образованием трития ( 3 H) или 3 He,
d + n Æ 3 H + g и d + p Æ 3 He + g.
Наконец, 4 Он был получен в результате реакций:
d+ d Æ 4 He + g, 3 He + n Æ 4 He + g и 3 H + p Æ 4 He + g.
Значительное количество ядер более массивных, чем 4 Он не образовался в результате Большого Взрыва, потому что плотности и энергии частиц не были достаточно велики, чтобы инициировать дальнейшие ядерные реакции.
Потребовались сотни тысяч лет дальнейшего охлаждения, пока средние энергии ядер и электронов не стали достаточно низкими для образования стабильных атомов водорода и гелия. Примерно через миллиард лет облака холодного атомарного водорода и газообразного гелия начали стягиваться под действием их взаимных гравитационных сил. Облака нагревались по мере того, как они сжимались до более высокой плотности. Когда температура газообразного водорода достигла нескольких миллионов кельвинов, в ядрах этих протозвезд начались ядерные реакции.Теперь в ядрах очень массивных звезд стали образовываться более массивные элементы.
Содержание главы
Эйнштейний: Ученые создали и зафиксировали 99-й химический элемент
Эйнштейний, неуловимый 99-й элемент в периодической таблице, был создан и захвачен, что позволило впервые охарактеризовать некоторые его свойства.
Так называемый «синтетический элемент», не встречающийся в природе на Земле, был обнаружен среди обломков первой водородной бомбы в 1952 году.
С тех пор было проведено очень мало экспериментов с эйнштейнием, потому что он исключительно радиоактивный и его чрезвычайно трудно получить.
Исследователи из США, однако, использовали передовые технологии для создания 250 нанограммов элемента.
Это основное свойство определяет, как эйнштейний будет связываться с другими атомами и молекулами, и является ключом к пониманию возможных химических взаимодействий.
Эйнштейний — неуловимый 99-й элемент периодической таблицы — был создан и зафиксирован, что позволило впервые охарактеризовать некоторые его свойства
Не встречающийся в природе на Земле так называемый «синтетический элемент» был обнаружен среди обломки первой водородной бомбы (на фото) под кодовым названием «Айви Майк», 1952 год.
‘Это замечательное достижение, что мы смогли работать с таким небольшим количеством материала и заниматься неорганической химией.
«Это важно, потому что чем больше мы понимаем химическое поведение [эйнштейния], тем больше мы можем применить это понимание для разработки новых материалов или новых технологий».
Это, объяснила она, может помочь не только в поиске приложений непосредственно для эйнштейния, но и для остальных актинидов — блока из 15 металлических и радиоактивных элементов с атомными номерами от 89 до 103.
В то же время новые результаты могут помочь химикам определить новые тенденции в отношении элементов, составляющих периодическую таблицу.
В своем исследовании профессор Абергель и его коллеги произвели образец эйнштейния в так называемом реакторе с высоким потоком изотопов в Окриджской национальной лаборатории в Теннесси, одном из немногих объектов в мире, способных производить этот элемент.
Этот материал был получен путем бомбардировки кюрия — другого радиоактивного элемента из ряда актинидов — нейтронами, чтобы вызвать длинную цепочку ядерных реакций, в результате которых образуется желаемый эйнштейний.
Получение значительного количества чистого эйнштейния, однако, чрезвычайно сложно, и образец группы оказался зараженным калифорнием.
Это помешало им использовать рентгеновскую кристаллографию — золотой стандарт для получения структурной информации о высокорадиоактивных молекулах — на их образце, что вынудило их разработать новые подходы и инструменты для изучения их эйнштейния.
Вторая проблема возникла в результате COVID-19: пандемия вынудила команду закрыть свою лабораторию, прежде чем они смогли завершить многие запланированные дополнительные эксперименты с образцом.
Несмотря на то, что они произвели один из наиболее стабильных изотопов эйнштейния, его «период полураспада» — время, необходимое для распада половины вещества во что-то другое, — составил всего 276 дней, а это означает, что большая часть их образца ушла время они вернулись.
ЭЙНСТЕЙНИЙ: ОСНОВЫ
На фото образец эйнштейния массой 300 микрограмм, помещенный в кварцевую пробирку. содержит 99 протонов).
содержит 99 протонов).
Как и все другие элементы так называемого «актинидного ряда», он чрезвычайно радиоактивен.
В темноте (как на фото слева) видно, что образцы эйнштейния светятся синим цветом.
Впервые он был обнаружен после создания первой в мире водородной бомбы в 1952 году.
Как так называемый «синтетический элемент», эйнштейний в природе не встречается на Земле. В настоящее время он не нашел применения вне фундаментальных научных исследований.
Назван в честь физика Альберта Эйнштейна.
С тех пор было проведено очень мало экспериментов с эйнштейнием, потому что он исключительно радиоактивный и его чрезвычайно трудно получить. Однако исследователи из США (на фото) использовали передовые технологии для создания 250 нанограммов элемента
. расстояние связи и некоторые другие свойства элемента.
«Определение расстояния связи может показаться неинтересным, но это первое, что вы хотели бы знать о том, как металл связывается с другими молекулами, — объяснил профессор Абергель.
Понимание того, как могут быть расположены атомы в молекуле, содержащей эйнштейний, может дать ученым представление о химических свойствах таких молекул и улучшить понимание химических тенденций в периодической таблице.
«Получив этот фрагмент данных, мы получим лучшее и более широкое понимание того, как ведет себя весь ряд актинидов», — сказал профессор Абергель.
«И в этой серии у нас есть элементы или изотопы, которые можно использовать для производства ядерной энергии или радиофармацевтических препаратов».
Полученные данные, как объяснил профессор Абергель, могут помочь не только в поиске приложений непосредственно для эйнштейния, но и для остальных актинидов — блока из 15 металлических и радиоактивных элементов с атомными номерами от 89 до 103 (здесь они показаны зеленым цветом).
Работа с эйнштейнием также намекает на возможность изучения химии, лежащей за пределами нынешней таблицы Менделеева, и, возможно, даже на открытие совершенно нового элемента.
«Мы действительно начинаем немного лучше понимать, что происходит ближе к концу таблицы Менделеева, и теперь вы можете представить себе мишень из эйнштейния для открытия новых элементов», — объяснил профессор Абергель.
‘Подобно последним элементам, открытым за последние 10 лет, таким как теннессин, в котором использовалась мишень из берклия, если бы вы могли выделить достаточно чистого эйнштейния для создания мишени, вы могли бы начать искать другие элементы.
Это, добавила она, может приблизить нас к теоретическому «острову стабильности», где физики-ядерщики предсказывают, что период полураспада изотопов может составлять минуты или дни — в отличие от периода полураспада в микросекунды или менее, обычно встречающегося среди сверхтяжелых элементов.
Полные результаты исследования были опубликованы в журнале Nature.
КАК БЫЛА СОЗДАНА ПЕРИОДИЧЕСКАЯ ТАБЛИЦА?
Химики всегда искали способы расположения элементов, чтобы отразить сходство их свойств.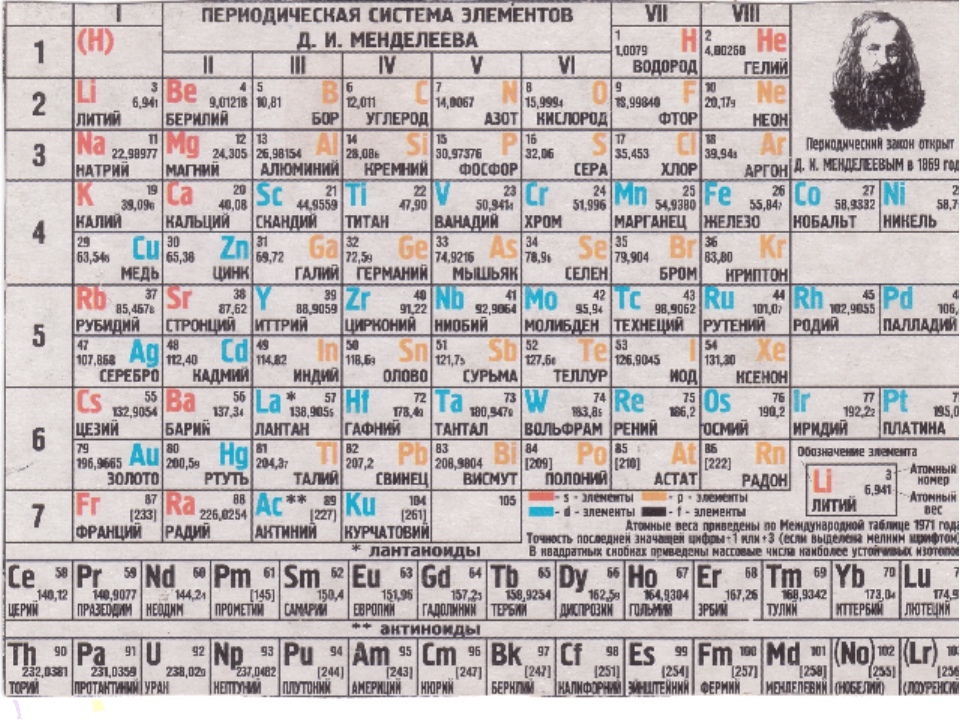
В современной периодической таблице элементы перечислены в порядке возрастания атомного номера — числа протонов в ядре атома.
Исторически, однако, относительные атомные массы использовались учеными, пытающимися упорядочить элементы.
Это произошло главным образом потому, что идея о том, что атомы состоят из более мелких субатомных частиц — протонов, нейтронов и электронов — не была развита.
Тем не менее, основа современной периодической таблицы была хорошо установлена и даже использовалась для предсказания свойств неоткрытых элементов задолго до того, как была разработана концепция атомного номера.
Спросите большинство химиков, открывших периодическую таблицу, и вы почти наверняка получите ответ Дмитрия Менделеева.
Русский ученый первым опубликовал версию таблицы, которую мы узнали бы сегодня, в 1869 году, но заслуживает ли он всей похвалы?
Ряд других химиков до Менделеева исследовали закономерности в свойствах известных в то время элементов.
Самая ранняя попытка классифицировать элементы была предпринята в 1789 году, когда Антуан Лавуазье сгруппировал элементы на основе их свойств в газы, неметаллы, металлы и земли.
В последующие десятилетия было предпринято несколько других попыток сгруппировать элементы вместе.
В 1829 году Иоганн Доберейнер определил триады элементов с химически схожими свойствами, такие как литий, натрий и калий, и показал, что свойства среднего элемента можно предсказать по свойствам двух других.
Только когда на конференции в Карлсруэ, Германия, в 1860 году стал доступен более точный список атомных масс элементов, реальный прогресс в открытии современной периодической таблицы был достигнут.
Этот раздел веб-сайта посвящен работе многих известных ученых, чье стремление узнать больше о мире, в котором мы живем, и об атомах, из которых состоят окружающие нас вещи, привело к созданию периодической таблицы в том виде, в каком мы ее знаем сегодня.
Источник: Королевское химическое общество
Химический элемент — история элементов — вода, определение, обнаружение и список
Многие вещества, ныне известные как элементы, известны с древних времен. Золото (Au) было найдено и использовано в украшениях в позднем каменном веке, около 10 000 лет назад.Более 5000 лет назад в Египте для различных целей также использовались металлы железо (Fe), медь (Cu), серебро (Ag), олово (Sn) и свинец (Pb). Мышьяк (As) был открыт около г. до н.э. г. Д . 1250 г., а фосфор (P) был открыт около 1674 г. К 1700 г. было известно около 12 элементов, но они еще не были признаны такими, как сегодня.
Золото (Au) было найдено и использовано в украшениях в позднем каменном веке, около 10 000 лет назад.Более 5000 лет назад в Египте для различных целей также использовались металлы железо (Fe), медь (Cu), серебро (Ag), олово (Sn) и свинец (Pb). Мышьяк (As) был открыт около г. до н.э. г. Д . 1250 г., а фосфор (P) был открыт около 1674 г. К 1700 г. было известно около 12 элементов, но они еще не были признаны такими, как сегодня.
Представление об элементах, т. е. теория о том, что существует ограниченное число основных чистых субстанций, из которых состоят все остальные субстанции, восходит к древним грекам.Эмпедокл (ок. 495–435 B . C .) предположил, что существует четыре основных «корня» всех материалов: земля, воздух, огонь и вода . Платон (ок. 427–347 B . C ) называл эти четыре «корня» 90 104 stoicheia 90 105 элементами. Аристотель (384–322 B . C .), ученик Платона, предположил, что элемент есть «одно из тех простых тел, на которые могут быть разложены другие тела и которое само не способно разделяться на другие.«За исключением ядерного деления и других ядерных реакций, открытых более 2000 лет спустя, посредством которых атомы элемента могут быть разложены на более мелкие части, это определение остается точным.
C .), ученик Платона, предположил, что элемент есть «одно из тех простых тел, на которые могут быть разложены другие тела и которое само не способно разделяться на другие.«За исключением ядерного деления и других ядерных реакций, открытых более 2000 лет спустя, посредством которых атомы элемента могут быть разложены на более мелкие части, это определение остается точным.
На протяжении многих лет возникло несколько других теорий, большинство из которых было опровергнуто. Например, швейцарский врач и алхимик Теофраст Бомбаст фон Гогенгейм (ок. 1493–1541), также известный как Парацельс, предположил, что все состоит из трех «принципов»: соли , ртути и серы.Алхимик по имени ван Гельмонт (ок. 1577–1644) пытался объяснить все с точки зрения всего двух элементов: воздуха и воды.
В конце концов, английский химик Роберт Бойль (1627–1691) возродил определение Аристотеля и усовершенствовал его. В 1789 году французский химик Антуан Лавуазье (1743–1794) смог опубликовать список химических элементов, соответствующих определению Бойля. Хотя некоторые из «элементов» Лавуазье впоследствии оказались соединениями (комбинациями реальных элементов), его список подготовил почву для принятия стандартных названий и символов для различных элементов.
Хотя некоторые из «элементов» Лавуазье впоследствии оказались соединениями (комбинациями реальных элементов), его список подготовил почву для принятия стандартных названий и символов для различных элементов.
Шведский химик Я. Й. Берцелиус (1779–1848) первым применил современный метод классификации: одно- или двухбуквенный символ для каждого элемента. Эти символы можно легко сложить вместе, чтобы показать, как элементы объединяются в соединения. Например, запись двух Hs и одного O вместе как H 2 O будет означать, что частицы (молекулы) воды состоят из двух атомов водорода и одного атома кислорода, связанных вместе. Берцелиус опубликовал таблицу из 24 элементов, включая их атомные веса, большинство из которых близки к современным значениям.
К 1800 году было известно только около 25 истинных элементов, но прогресс был относительно быстрым на протяжении всего девятнадцатого века. К тому времени, когда русский ученый Дмитрий Иванович Менделеев (1834–1907) в 1869 году составил свою периодическую таблицу , ему приходилось считаться с примерно 60 элементами. К 1900 году их было более 80. Список быстро расширился до 92, заканчиваясь ураном (атомный номер 92). Там он оставался до 1940 года, когда начался синтез трансурановых элементов.
К 1900 году их было более 80. Список быстро расширился до 92, заканчиваясь ураном (атомный номер 92). Там он оставался до 1940 года, когда начался синтез трансурановых элементов.
Именование элементов | Каролина.ком
Кристалл Джетер
Разработчик продукта
В таблице Менделеева перечислены более 100 именованных элементов. Некоторые из этих элементов широко распространены и хорошо знакомы, а другие настолько редки, что существуют всего доли секунды, прежде чем распасться. Вы когда-нибудь задумывались, как эти элементы получили свои названия?
Некоторые известные нам сегодня названия элементов происходят от латинского слова, обозначающего элемент, и не имеют никакого другого названия.Эти элементы были найдены естественным образом, и в древние времена людям было довольно легко извлекать и использовать их; они включают такие элементы, как свинец (plubium, Pb), железо (ferrum, Fe), медь (cuprum, Cu), олово (stannum, Sn), серебро (argentum, Ag) и золото (aurum, Au). Эти элементы, возможно, были названы в языках, предшествовавших Римской империи , , но имена были задокументированы во времена Римской империи, и поэтому они используются сегодня.
Эти элементы, возможно, были названы в языках, предшествовавших Римской империи , , но имена были задокументированы во времена Римской империи, и поэтому они используются сегодня.
Множество соглашений об именах
Поскольку обнаружение элемента может быть сложной задачей, отдельные лица или группы, обнаружившие элемент, обычно получают привилегию дать ему имя.Элементы были названы в честь ряда вещей, включая их атрибуты, состав или руду, из которой они были выделены, как они были обнаружены или получены, мифологические персонажи, места и известные люди.
Некоторые элементы имеют описательные имена, основанные на атрибуте элемента. Например, некоторые виды фосфора горят на воздухе. Греческое фосфорос , от которого происходит название фосфорный, означает «приносящий молнию», представляя его реактивность.Йод назван от греческого слова iodes , что означает «фиолетовый», из-за пурпурного цвета газообразной формы йода.
Другие элементы были названы в честь соединения или руды, из которой они были выделены. Например, алюминий содержится в квасцах (соединение алюминия, калия и сульфата) и был назван в честь этого соединения. Никель был назван в честь немецкого слова kupfernickel (или kopparnickel ), означающего «медный цвет», что описывает руду, никколит (или никелин), из которой получают никель.
Например, алюминий содержится в квасцах (соединение алюминия, калия и сульфата) и был назван в честь этого соединения. Никель был назван в честь немецкого слова kupfernickel (или kopparnickel ), означающего «медный цвет», что описывает руду, никколит (или никелин), из которой получают никель.
Подобно гелию и технецию, некоторые элементы были названы в зависимости от того, как они были открыты или получены. Ученые открыли гелий, когда изучали солнечное затмение и увидели неожиданную линию в спектре излучения; поэтому гелий был назван в честь греческого слова, обозначающего солнце, helios . Технеций назван от греческого слова technêtos , что означает «искусственный» и применяется потому, что у технеция нет стабильных изотопов, и ученые произвели его искусственно в лаборатории.
Ученые назвали элементы уран, нептуний и плутоний в честь планет. В 1789 году они назвали элемент 92 ураном в честь Урана, открытого в 1781 году. Когда в 1940-х годах были открыты элементы 93 и 94, ученые назвали их нептунием и плутонием в честь планет, которые следовали за Ураном в Солнечной системе. Ученые также назвали элементы 46 (палладий) и 58 (церий) в честь небесных тел, но в этих случаях в честь астероидов Паллада и Церера соответственно.
Ученые также назвали элементы 46 (палладий) и 58 (церий) в честь небесных тел, но в этих случаях в честь астероидов Паллада и Церера соответственно.
Другие элементы были названы в честь мифологических персонажей.Торий получил свое название от Тора, скандинавского бога грома. Элемент 73, тантал, получил свое название от Тантала, греческого бога и сына Зевса. Тантал наиболее известен своим вечным наказанием, которое заключалось в том, чтобы терпеть неутолимую жажду. Вынужденный стоять в бассейне с водой, когда Тантал наклонялся, чтобы напиться, вода исчезала. Ученые выбрали это название для тантала, потому что его оксид не вступает в реакцию с кислотой, что является метафорической параллелью судьбе Тантала. Позже, когда ученые обнаружили, что один из первых образцов, содержащих тантал, также содержал еще один новый элемент, он был назван ниобием в честь Ниобы, дочери Тантала.
Недавно открытые элементы имеют названия, обозначающие места. Ученые назвали элементы иттрием (Y), иттербием (Yb), тербием (Tb) и эрбием (Er) в честь Иттербю, Швеция, поскольку все они были найдены там в шахте. Ученые назвали берклий (Bk) в честь города Беркли, штат Калифорния, где этот элемент был открыт. Точно так же ученые назвали другие элементы, такие как галлий и рутений, в честь древней Галлии (современная Франция) и Рутении (часть современной России), мест, в которых они были обнаружены.
Ученые назвали берклий (Bk) в честь города Беркли, штат Калифорния, где этот элемент был открыт. Точно так же ученые назвали другие элементы, такие как галлий и рутений, в честь древней Галлии (современная Франция) и Рутении (часть современной России), мест, в которых они были обнаружены.
Многие элементы названы в честь известных ученых. Некоторые из самых известных элементов включают эйнштейний (Альберт Эйнштейн), кюрий (Мария и Пьер Кюри), резерфордий (Эрнест Резерфорд), нобелий (Альфред Нобель) и менделевий (Дмитрий Менделеев).
Трансфермиевые войны
Сегодня элементы по-прежнему называют группами или отдельными лицами, которые первыми открыли элементы; однако определение того, кто сделал первое открытие, привело к некоторым интересным спорам об именах.Ученые создают новые элементы искусственно, и элементы обычно существуют очень короткие периоды времени, что затрудняет доказательство того, что элемент был создан. Так было в случае так называемых трансфермиевых войн, когда две лаборатории (одна из США и одна из России) заявили об открытии элементов 104 и 105.
Каждая из двух лабораторий заявила об открытии этих элементов, предложила названия и отказалась признать названия другой группы.IUPAC (Международный союз теоретической и прикладной химии), который официально подтверждает названия элементов и является последней инстанцией, предложил компромисс. Компромисс предлагал использовать название, выбранное американской лабораторией для элемента 105, ганий, вместо элемента 108, открытого другой лабораторией в Германии. Однако немецкая группа не согласилась с предложенным компромиссом, заявив, что ее лаборатория бесспорно открыла элемент 108 и что, основываясь на традиционных соглашениях об именах, она должна выбрать имя.Споры закончились в 1997 году, когда американская и российская группы согласились совместно назвать элементы 104 и 105. Немецкая группа смогла назвать открытые ею элементы в соответствии с традицией.
IUPAC и стандартизированное обозначение
В настоящее время процесс именования стал гораздо более стандартизированным, и для присвоения имени новому элементу необходимо выполнить определенные шаги. Когда лаборатория сообщает об открытии нового элемента, группа из IUPAC и IUPAP (Международный союз теоретической и прикладной физики) проверяет открытие.После того, как команда подтвердит событие, первооткрыватели имеют право предложить имя. Оттуда предложенное имя проходит несколько этапов проверки и комментариев, прежде чем оно будет утверждено. Если IUPAC отклоняет первоначальное название, то это дает группе исследователей еще одну возможность предложить другое название. Как только IUPAC утверждает название, оно становится официальным.
Когда лаборатория сообщает об открытии нового элемента, группа из IUPAC и IUPAP (Международный союз теоретической и прикладной физики) проверяет открытие.После того, как команда подтвердит событие, первооткрыватели имеют право предложить имя. Оттуда предложенное имя проходит несколько этапов проверки и комментариев, прежде чем оно будет утверждено. Если IUPAC отклоняет первоначальное название, то это дает группе исследователей еще одну возможность предложить другое название. Как только IUPAC утверждает название, оно становится официальным.
В рекомендациях IUPAC для нового имени указано, что оно может быть основано на:
- Мифологическое понятие или персонаж (включая астрономический объект)
- Минеральное или подобное вещество
- Место или географический регион
- Свойство элемента
- Ученый
Кроме того, все имена новых элементов должны заканчиваться суффиксом «-ium.«Как только название элемента было неофициально использовано, как, например, когда американская лаборатория предложила ганний для элемента 105, это имя нельзя использовать для другого нового элемента.
Элемент неожиданности | Аргоннская национальная лаборатория
Химические элементы в периодической таблице также имеют семейное сходство, которое может дать прогнозную информацию о том, как взаимодействуют элементы, что приведет ученых к еще не воображаемым приложениям.
В случае одного элемента, протактиния, химическое сходство, обусловленное конфигурацией его крайних электронов, связывает два семейства элементов: стабильные и хорошо известные переходные металлы и более экзотические актиноиды.
В новом исследовании, проведенном Аргоннской национальной лабораторией Министерства энергетики США (DOE) и Университетом Лилля во Франции, химики изучили многочисленные сходства протактиния, чтобы более полно понять взаимосвязь между переходными металлами и сложной химией ранних актинидных элементов. .
«Вопрос о том, как мы составили периодическую таблицу, действительно лежит в основе наших размышлений о протактинии». — Ричард Уилсон, химик из Аргонны
Основная ценность протактиния заключается не в его коммерческом использовании, а в предоставлении новых фундаментальных знаний о химии элементов. Протактиний является актинидным элементом и находится между торием и ураном в периодической таблице. Однако протактиний также очень похож на ниобий и тантал, оба из которых являются переходными металлами, используемыми в ряде химических и металлургических применений. Когда химики поймут их сходство более подробно, они могут открыть новые и еще не открытые области применения этих и других родственных элементов.
Протактиний является актинидным элементом и находится между торием и ураном в периодической таблице. Однако протактиний также очень похож на ниобий и тантал, оба из которых являются переходными металлами, используемыми в ряде химических и металлургических применений. Когда химики поймут их сходство более подробно, они могут открыть новые и еще не открытые области применения этих и других родственных элементов.
«Протактиний находится в точке опоры в периодической таблице», — сказал автор исследования и химик из Аргонны Ричард Уилсон.«Вопрос о том, как мы составили периодическую таблицу, действительно лежит в основе наших размышлений о протактинии».
Ответ на вопрос, действует ли протактиний больше как актинид или как переходный металл, лежит во внешних электронных оболочках атома протактиния. Ученые обозначают каждую раковину цифрой (от 1 до 7) и буквой (s, p, d или f). То, какую оболочку занимают внешние электроны элемента, с точки зрения числа и буквы, определяет его семейство и помогает определить широкий спектр его химического и физического поведения.
Разница между переходными металлами и актинидами заключается в том, какая внешняя оболочка сначала заполняется доступными электронами. Протактиний, отметил Уилсон, особенно важен, потому что он представляет собой границу, на которой d-орбиталь и f-орбиталь энергетически меняются местами. Это определяет, как заполняются орбитали и как они взаимодействуют или связываются со своими соседями.
«D-орбитали в переходных металлах очень непосредственно участвуют в химических связях, и они могут организовываться в довольно предсказуемые структуры», — сказал Уилсон.«Актиниды не так легко образуют такие же связи».
Согласно Уилсону, химики, изучающие актиноиды, которые пытались уговорить протактиний действовать как его родственники из переходных металлов, добились ограниченного успеха. «Можем ли мы заставить протактиний вести себя как ниобий и тантал? Экспериментальный ответ — «еще нет», — сказал Уилсон. «Но работа над теорией этого уникального элемента может дать нам новый взгляд на то, как он может находиться прямо на этом важном химическом и энергетическом пересечении.
Изменения электронных орбиталей и поведения связей, происходящие в тяжелых элементах, только усиливаются по мере развития периодической таблицы. В самых тяжелых элементах, сказал Уилсон, релятивистские эффекты начинают вытеснять наше классическое понимание того, как определенные элементы «должны» вести себя, вплоть до того момента, когда гипотетический элемент может напоминать одновременно инертный благородный газ и высокоактивный металл. время.
«Мы начинаем понимать, что протактиний — это порог, на котором связи в периодической системе начинают меняться», — сказал Уилсон.«Мы углубляемся в то, что действительно заставляет периодическую таблицу работать».
Исследование «Протактиний и пересечение химии актинидов и переходных металлов» появилось в онлайн-выпуске Nature Communications от 12 февраля.
Исследователи использовали Центр лабораторных вычислительных ресурсов Аргонны, а работа финансировалась Управлением науки Министерства энергетики США.
Аргоннская национальная лаборатория занимается поиском решений насущных национальных проблем в области науки и техники.Первая в стране национальная лаборатория, Аргонн, проводит передовые фундаментальные и прикладные научные исследования практически во всех научных дисциплинах. Исследователи Аргонны тесно сотрудничают с исследователями из сотен компаний, университетов, а также федеральных, государственных и муниципальных учреждений, чтобы помочь им решить их конкретные проблемы, укрепить научное лидерство Америки и подготовить нацию к лучшему будущему. Компания Argonne, в которой работают сотрудники из более чем 60 стран, находится под управлением UChicago Argonne, LLC для U.S. Отдел науки Министерства энергетики .
Управление науки Министерства энергетики США является крупнейшим сторонником фундаментальных исследований в области физических наук в Соединенных Штатах и работает над решением некоторых из самых насущных проблем нашего времени.



 Поражение печени, анемия, желтуха.
Поражение печени, анемия, желтуха.
 Бете ( заочно ) был вставлен при подготовке рукописи к печати»
Бете ( заочно ) был вставлен при подготовке рукописи к печати»