просто и понятно о его применении в физике
8 комментариев
Содержание:
Определение
Простая формулировка первого закона термодинамики может звучать примерно так: изменение внутренней энергии той или иной системы возможно исключительно при внешнем воздействии. То есть другими словами, чтобы в системе произошли какие-то изменения необходимо приложить определенные усилия извне. В народной мудрости своеобразным выражением первого закона термодинамики могут служить пословицы – «под лежачий камень вода не течет», «без труда не вытащишь рыбку из пруда» и прочая. То есть на примере пословицы про рыбку и труд, можно представить, что рыбка и есть наша условно закрытая система, в ней не произойдет никаких изменений (рыбка сама себя не вытащит из пруда) без нашего внешнего воздействия и участия (труда).
Интересный факт: именно первый закон термодинамики устанавливает, почему потерпели неудачу все многочисленные попытки ученых, исследователей, изобретателей изобрести «вечный двигатель», ведь его существование является абсолютно невозможным согласно этому самому закону, почему, смотрите абзац выше.
В начале нашей статьи было максимального простое определение первого закона термодинамики, в действительности в академической науке существует целых четыре формулировки сути данного закона:
- Энергия ни откуда не появляется и ни куда не пропадает, она лишь переходит из одного вида в другой (закон сохранения энергии).
- Количество теплоты, полученной системой, идет на совершение ее работы против внешних сил и изменение внутренней энергии.
- Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданной системе, и не зависит от способа, которым осуществляется этот переход.

- Изменение внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты, переданной системе, и работой, совершенной системой над внешними силами.
Формула
Формулу первого закона термодинамики можно записать таким образом:
Q = ΔU + A
Количество теплоты Q, передаваемое системе равно суме изменения ее внутренней энергии ΔU и работы A.
Процессы
Также первый закон термодинамики имеет свои нюансы в зависимости от проходящих термодинамических процессов, которые могут быть изохронными и изобарными, и ниже мы детально опишем о каждом из них.
Закон для для изохорного процесса
Изохорным процессом в термодинамике называют процесс, происходящий при постоянном объеме. То есть, если будь-то в газе или жидкости нагреть вещество в сосуде, произойдет изохорный процесс, так как объем вещества останется неизменным. Это условие имеет влияние и на первый закон термодинамики, проходящий при изохорном процессе.
В изохорном процессе объем V является константой, следовательно, газ работы не совершает A = 0
Из этого выходит следующая формула:
Q = ΔU = U (T2) – U (T1).
Здесь U (T1) и U (T2) – внутренние энергии газа в начальном и конечном состояниях. Внутренняя энергия идеального газа зависит только от температуры (закон Джоуля). При изохорном нагревании тепло поглощается газом (Q > 0), и его внутренняя энергия увеличивается. При охлаждении тепло отдается внешним телам (Q < 0).
Закон для для изобарного процесса
Аналогично изобарным процессом называется термодинамический процесс, происходящий в системе при постоянном давлении и массе газа. Следовательно, в изобарном процессе (p = const) работа, совершаемая газом, выражается следующим уравнением первого закона термодинамики:
A = p (V2 – V1) = p ΔV.
Изобарный первый закон термодинамики дает:
Q = U (T2) – U (T1) + p (V2 – V1) = ΔU + p ΔV. При изобарном расширении Q > 0 – тепло поглощается газом, и газ совершает положительную работу. При изобарном сжатии Q < 0 – тепло отдается внешним телам. В этом случае A < 0. Температура газа при изобарном сжатии уменьшается, T2 < T1; внутренняя энергия убывает, ΔU < 0.
При изобарном сжатии Q < 0 – тепло отдается внешним телам. В этом случае A < 0. Температура газа при изобарном сжатии уменьшается, T2 < T1; внутренняя энергия убывает, ΔU < 0.
Практическое применение
Видео
И в завершение нашей статьи вашему вниманию образовательное видео о первом законе термодинамике и внутренней энергии.
Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту [email protected] или в Фейсбук, с уважением автор.
Страница про автора
Эта статья доступна на английском – First Law of Thermodynamics.
| ГОСТы, СНиПы Карта сайта TehTab.ru Поиск по сайту TehTab.ru | Навигация по справочнику TehTab.ru: главная страница / / Техническая информация/ / Физический справочник/ / Тепловые величины, включая температуры кипения, плавления, пламени и т.
| |||||
Нашли ошибку? Есть дополнения? Напишите нам об этом, указав ссылку на страницу. | ||||||
TehTab.ru Реклама, сотрудничество: [email protected] | Обращаем ваше внимание на то, что данный интернет-сайт носит исключительно информационный характер. Информация, представленная на сайте, не является официальной и предоставлена только в целях ознакомления. Все риски за использование информаци с сайта посетители берут на себя. Проект TehTab.ru является некоммерческим, не поддерживается никакими политическими партиями и иностранными организациями. | |||||
Первый закон термодинамики – формула, формулировка и применение
Законы термодинамики, как правило, довольно просто сформулировать и понять, поэтому легко можно недооценить действие, оказываемое ими. Они влияют на многие процессы, в том числе на то, как энергия может быть использована во Вселенной. Последствия первого закона термодинамики затрагивают почти все аспекты научных исследований.
Они влияют на многие процессы, в том числе на то, как энергия может быть использована во Вселенной. Последствия первого закона термодинамики затрагивают почти все аспекты научных исследований.
Содержание
- Определение и понятие
- Математическое представление
- История открытия
- Термодинамические системы
- Применение на практике
- Основные изопроцессы
Определение и понятие
Термодинамика — это раздел физики, который занимается взаимоотношениями между теплом и другими формами энергии. В частности, он описывает, как тепловая энергия преобразуется в другие виды и влияет на материю. Основные принципы термодинамики содержат три закона:
 Изменение энергии неизолированной термодинамической системы равно разности между количеством теплоты, переданной системе, и работой, совершенной системой над внешними силами.
Изменение энергии неизолированной термодинамической системы равно разности между количеством теплоты, переданной системе, и работой, совершенной системой над внешними силами. Предельно изолированная система обычно равна нулю и во всех случаях определяется только количеством различных основных состояний, которые она имеет. В частности, энтропия чистого кристаллического вещества (идеальный порядок) при абсолютной нулевой температуре равна нулю. Это выражение верно, если идеальный кристалл имеет только одно состояние с минимальной энергией.
Предельно изолированная система обычно равна нулю и во всех случаях определяется только количеством различных основных состояний, которые она имеет. В частности, энтропия чистого кристаллического вещества (идеальный порядок) при абсолютной нулевой температуре равна нулю. Это выражение верно, если идеальный кристалл имеет только одно состояние с минимальной энергией.Эти законы не имеют особого отношения к тому, как и почему происходит теплообмен, что имеет смысл для открытий, которые были сформулированы до того, как атомная теория была полностью принята. Они имеют дело с общей суммой энергетических и тепловых переходов внутри системы и не учитывают специфическую природу теплопередачи на атомном или молекулярном уровне.
Математическое представление
Физики обычно используют единообразные условные обозначения для представления величин в I законе термодинамики. Они выглядят так:

Формула первого закона термодинамики выглядит следующим образом: ∆U=Q+A. Это даёт математическое представление первого закона, который оказывается очень полезным и может быть переписан несколькими способами:
Анализ термодинамического процесса в классе физики обычно включает анализ ситуации, когда одна из этих величин либо равна 0, либо контролируется разумным образом. Например, в адиабатном процессе теплообмен (Q) равен 0, в изохорном работа (W) тоже имеет значение 0.
История открытия
История термодинамики начинается с Отто фон Герике, который в 1650 году построил первый в мире вакуумный насос и продемонстрировал его действие, используя свои магдебургские полушария. Ученый был вынужден произвести такой эксперимент, чтобы опровергнуть давнее предположение Аристотеля о том, что «природа не терпит вакуума».
Ученый был вынужден произвести такой эксперимент, чтобы опровергнуть давнее предположение Аристотеля о том, что «природа не терпит вакуума».
Вскоре после этого в 1656 году английский физик и химик Роберт Бойль узнал о конструкции Герике и по согласованию с учёным Робертом Гуком построил воздушный насос. Используя его, они заметили корреляцию между давлением, температурой и объёмом. Со временем был сформулирован закон Бойля, согласно которому давление и объём обратно пропорциональны.
Изучение тепла как отдельной формы энергии началось примерно в 1798 году, когда сэр Бенджамин Томпсон (также известный как граф Румфорд), британский военный инженер, заметил, что тепло может генерироваться пропорционально количеству проделанной работы. Эта фундаментальная концепция в итоге стала следствием I закона термодинамики.
Французский физик Сади Карно впервые сформулировал базовый принцип термодинамики в 1824 году. Его учёный использовал для определения своего теплового двигателя цикла Карно. В итоге этот принцип перешел во второй закон термодинамики немецкого физика Рудольфа Клаузиуса. Ему нередко приписывают и формулировку первого закона.
В итоге этот принцип перешел во второй закон термодинамики немецкого физика Рудольфа Клаузиуса. Ему нередко приписывают и формулировку первого закона.
Одной из причин быстрого развития термодинамики в XIX веке была необходимость разработки эффективных паровых двигателей во время промышленной революции.
Термодинамические системы
По словам профессора физики университета штата Миссури Макки, энергию можно разделить на две части. К одной из них принадлежит поршень, движущийся и толкающий газ.
Макки объясняет: «Когда я приставляю два образца металла друг к другу, два атома сталкиваются, одна из частиц отрывается быстрее другой, я не могу удержаться от наблюдения за этим процессом. Это происходит в очень маленьком масштабе времени, на небольшом расстоянии и много раз в секунду. Итак, мы просто делим всю передачу энергии на две группы: то, что мы будем отслеживать, и то, что не будем. Последний из них называется теплом». Термодинамические системы обычно рассматриваются как открытые, закрытые или изолированные:
 Например, кастрюля с кипящим супом получает энергию из печи, излучает тепло из емкости и выделяет вещество в виде пара. Это открытая система.
Например, кастрюля с кипящим супом получает энергию из печи, излучает тепло из емкости и выделяет вещество в виде пара. Это открытая система.Однако на практике совершенно изолированные системы не могут существовать. Все системы передают энергию в окружающую среду посредством излучения независимо от того, насколько они изолированы. Суп в термосе останется горячим только в течение нескольких часов и достигнет комнатной температуры на следующий день.
В другом примере звёзды белых карликов, которые больше не производят энергию, могут быть изолированы световыми годами почти до идеального вакуума в межзвёздном пространстве, но в итоге они будут охлаждаться с нескольких десятков тысяч градусов почти до абсолютного нуля в связи с потерей энергии из-за излучения. Хотя этот процесс занимает больше времени, чем нынешний век Вселенной, его не остановить.
Хотя этот процесс занимает больше времени, чем нынешний век Вселенной, его не остановить.
Применение на практике
Наиболее распространённым практическим применением I закона является тепловой двигатель. Он преобразует тепловую энергию в механическую и наоборот. Большинство таких двигателей попадает в категорию открытых систем. Их основной принцип использует взаимосвязь между теплом, объёмом и давлением рабочей жидкости, которая обычно является газом. В некоторых случаях она может подвергаться фазовым переходам от газа к жидкости и обратно во время цикла.
Если газ подвергается нагреванию, он расширяется, но когда он ограничен, давление увеличивается. Если нижняя стенка удерживающей камеры является верхом подвижного поршня, то давление оказывает силу на поверхность, заставляя его двигаться вниз. Это движение затем можно использовать для выполнения работы, равной суммарному усилию, приложенному к верхней части поршня, умноженному на расстояние, на которое он перемещается.
Существуют многочисленные вариации основного теплового двигателя. Например, паровые двигатели полагаются на внешнее сгорание, чтобы нагреть бак котла, содержащий рабочую жидкость, обычно воду. Она превращается в пар, а затем давление используется для привода поршня, который преобразует тепловую энергию в механическую. Однако в автомобильных двигателях используется внутреннее сгорание, когда жидкое топливо испаряется, смешивается с воздухом и воспламеняется внутри цилиндра над подвижным поршнем, приводящим его в движение вниз.
Холодильники и тепловые насосы — это двигатели, которые преобразуют механическую энергию в тепло. Большинство из них попадает в категорию закрытых систем. Когда газ сжимается, его температура увеличивается. Он может затем передавать тепло в окружающую среду. Затем, когда сжатому газу позволяют расширяться, его температура становится ниже, чем была до сжатия, потому что часть его тепловой энергии оказалась удалена во время горячего цикла. Холодный газ может затем поглощать тепловую энергию из окружающей среды. Это принцип работы кондиционера.
Это принцип работы кондиционера.
Кондиционеры на самом деле не производят холод, они удаляют тепло. Рабочая жидкость переносится наружу механическим насосом, где нагревается компрессией. После этого он передаёт это тепло наружной среде через теплообменник с воздушным охлаждением. Затем он возвращается в помещение, где ему разрешается расширяться и охлаждаться, чтобы он мог поглощать тепло из воздуха через другой теплообменник.
Тепловой насос — это просто кондиционер, работающий в обратном направлении. Тепло от сжатой рабочей жидкости используется для обогрева здания. После этого он переносится наружу, где расширяется и становится холодным, что позволяет ему поглощать тепло из наружного воздуха, который даже зимой обычно теплее, чем холодная рабочая жидкость.
В геотермальных или наземных системах кондиционирования воздуха и тепловых насосах используются длинные U-образные трубки в глубоких скважинах или набор горизонтальных труб, погруженных в большую площадь, по которой циркулирует рабочая жидкость, а тепло передаётся на землю или из нее. Другие системы используют реки или океаническую воду для нагрева или охлаждения рабочей жидкости.
Другие системы используют реки или океаническую воду для нагрева или охлаждения рабочей жидкости.
Основные изопроцессы
Поскольку тепловые двигатели могут пройти сложную последовательность шагов, упрощённая модель часто используется для иллюстрации принципов термодинамики. В частности, можно рассмотреть газ, который расширяется и сжимается в цилиндре с подвижным поршнем при заданном наборе условий. Применение первого закона термодинамики к изопроцессам содержит два таких набора:
 Однако этот процесс не нарушает фундаментальных ограничений по эффективности, поскольку само по себе расширение не является циклическим процессом.
Однако этот процесс не нарушает фундаментальных ограничений по эффективности, поскольку само по себе расширение не является циклическим процессом. Многие природные явления адиабатны, потому что времени для значительного теплового потока недостаточно. Например, когда тёплый воздух поднимается в атмосферу, он расширяется и охлаждается по мере того, как давление падает при наборе высоты. Но он является хорошим теплоизолятором, поэтому нет значительного теплового потока от него. В этом случае окружающий воздух играет роль стенок изолированного цилиндра и подвижного поршня.
Например, когда тёплый воздух поднимается в атмосферу, он расширяется и охлаждается по мере того, как давление падает при наборе высоты. Но он является хорошим теплоизолятором, поэтому нет значительного теплового потока от него. В этом случае окружающий воздух играет роль стенок изолированного цилиндра и подвижного поршня.
Тёплый воздух работает против давления, создаваемого окружающим воздухом при его расширении, поэтому его температура должна падать. Более подробный анализ этого адиабатического расширения объясняет бо́льшую часть понижения температуры с высотой, учитывая известный факт, что на вершине горы холоднее, чем у её основания.
Тепло, подаваемое при постоянном давлении, также известно как изобарный процесс. При нем не происходит изменения давления во время подачи тепла в систему.
Первое начало термодинамики рассматривается многими как основа концепции сохранения энергии. В основном это говорит о том, что энергия, которая поступает в систему, не может быть потеряна по пути, но должна быть использована для того, чтобы изменить внутреннюю энергию, либо выполнить работу. С этой точки зрения он является одним из самых обширных научных понятий, когда-либо обнаруженных.
С этой точки зрения он является одним из самых обширных научных понятий, когда-либо обнаруженных.
Предыдущая
ФизикаЗакон Кулона – взаимодействие электрических зарядов, формула и задачи
Следующая
ФизикаПостроение изображений в линзах – виды, правила и формулы
Первое начало термодинамики формулы. Первый закон термодинамики и его применение в физике
Внутренняя энергия может изменяться за счет в основном двух различных процессов: совершения над телом работы А и сообщения ему количества тепла Q. Совершение работы сопровождается перемещением внешних тел, воздействующих на систему. Так, например, при вдвигании поршня, закрывающего сосуд с газом, поршень, перемещаясь, совершает над газом работу Л. По третьему закону. Ньютона газ при этом совершает над поршнем работу
Сообщение газу тепла не связано с перемещением внешних тел и, следовательно, не связано с совершением над газом макроскопической (т. е. относящейся ко всей совокупности молекул, из которых состоит тело) работы. В этом случае изменение внутренней энергии обусловлено тем, что отдельные молекулы более нагретого тела совершают работу над отдельными молекулами тела, нагретого меньше. Передача энергии происходит при этом также через излучение. Совокупность микроскопических (т. е. захватывающих не все тело, а отдельные его молекулы) процессов, приводящих к передаче энергии от тела к телу, носит название теплопередачи.
е. относящейся ко всей совокупности молекул, из которых состоит тело) работы. В этом случае изменение внутренней энергии обусловлено тем, что отдельные молекулы более нагретого тела совершают работу над отдельными молекулами тела, нагретого меньше. Передача энергии происходит при этом также через излучение. Совокупность микроскопических (т. е. захватывающих не все тело, а отдельные его молекулы) процессов, приводящих к передаче энергии от тела к телу, носит название теплопередачи.
Подобно тому как количество энергии, переданное одним телом другому, определяется работой А, совершаемой друг над другом телами, количество энергии, переданное от тела к телу путем теплопередачи, определяется количеством тепла Q, отданного одним телом другому. Таким образом, приращение внутренней энергии системы должно быть равно сумме совершенной над системой работы А и количества сообщенного системе тепла
Здесь – начальное и конечное значения внутренней энергии системы. Обычно вместо работы А, совершаемой внешними телами над системой, рассматривают работу А (равную -А), совершаемую системой над внешними телами. Подставив -А вместо А и разрешив уравнение (83.1) относительно Q, получим:
Подставив -А вместо А и разрешив уравнение (83.1) относительно Q, получим:
Уравнение (83.2) выражает закон сохранения энергии и представляет собой содержание первого закона (начала) термодинамики. Словами его можно выразить следующим образом: количество тепла, сообщенное системе, идет на приращение внутренней энергии системы и на совершение системой работы над внешними телами.
Сказанное отнюдь не означает, что всегда при сообщении тепла внутренняя энергия системы возрастает. Может случиться, что, несмотря на сообщение системе тепла, ее энергия не растет, а убывает . В этом случае согласно (83.2) , т. е. система совершает работу как за счет получаемого тепла Q, так и за счет запаса внутренней энергии, убыль которой равна . Нужно также иметь в виду, что величины Q и А в (83.2) являются алгебраическими означает, что система в действительности не получает тепло, а отдает).
Из (83.2) следует, что количество тепла Q можно измерять в тех же единицах, что и работу или энергию. В СИ единицей количества тепла служит джоуль.
В СИ единицей количества тепла служит джоуль.
Для измерения количества тепла применяется также особая единица, называемая калорией. Одна калория равна количеству тепла, необходимому для нагревания 1 г воды от 19,5 до 20,5 °С. Тысяча калорий называется большой калорией или килокалорией.
Опытным путем установлено, что одна калория эквивалентна 4,18 Дж. Следовательно, один джоуль эквивалентен 0,24 кал. Величина называется механическим эквивалентом тепла.
Если величины, входящие в (83.2), выражены в разных единицах, то некоторые из этих величии нужно умножить на соответствующий эквивалент. Так, например, выражая Q в калориях, a U и А в джоулях, соотношение (83.2) нужно записать в виде
В дальнейшем мы будем всегда предполагать, что Q, А и U выражены в одинаковых единицах, и писать уравнение первого начала термодинамики в виде (83.2).
При вычислении совершенной системой работы или полученного системой тепла обычно приходится разбивать рассматриваемый процесс на ряд элементарных процессов, каждый из которых соответствует весьма малому (в пределе – бесконечно малому) изменению параметров системы. Уравнение (83.2) для элементарного процесса имеет вид
Уравнение (83.2) для элементарного процесса имеет вид
где – элементарное количество тепла, – элементарная работа и – приращение внутренней энергии системы в ходе данного элементарного процесса.
Весьма важно иметь в виду, что и нельзя рассматривать как приращения величин Q и А.
Соответствующее элементарному процессу А какой-либо величины можно рассматривать как приращение этой величины только в том случае, если соответствующая переходу из одного состояния в другое, не зависит от пути, по которому совершается переход, т. е. если величина f является функцией состояния. В отношении функции состояния можно говорить о ее «запасе» в каждом из состояний. Например, можно говорить о запасе внутренней энергии, которым обладает система в различных состояниях.
Как мы увидим в дальнейшем, величина совершенной системой работы и количество полученного системой тепла зависят от пути перехода системы из одного состояния в другое. Следовательно, ни Q, ни А не являются функциями состояния, в силу чего нельзя говорить о запасе тепла или работы, которым обладает система в различных состояниях.
Внутренняя энергия U термодинамической системы может быть изменена двумя способами: при совершении механической работы и при помощи теплообмена. Если оба способа задействованы одновременно, то можно записать
\(~\Delta U = Q – A \) или \(~Q = \Delta U + A .\)
Эта формула выражает первое начало термодинамики .
- Количество теплоты, сообщенное термодинамической системе, расходуется на изменение ее внутренней энергии и на совершение работы системой против внешних сил.
Если вместо работы A системы над внешними телами ввести работу внешних сил A ” (А = –A “), то первое начало термодинамики можно переписать так:
\(~\Delta U = Q + A” .\)
- Изменение внутренней энергии термодинамической системы равно сумме работы, произведенной над системой внешними силами, и количеству теплоты, переданному системе в процессе теплообмена.
Первое начало термодинамики является обобщением закона сохранения энергии для механических и тепловых процессов. Например, рассмотрим процесс торможения бруска на горизонтальной поверхности под действием силы трения. Скорость бруска уменьшается, механическая энергия «исчезает». Но при этом трущиеся поверхности (брусок и горизонтальная поверхность) нагреваются, т.е. механическая энергия превращается во внутреннюю.
Например, рассмотрим процесс торможения бруска на горизонтальной поверхности под действием силы трения. Скорость бруска уменьшается, механическая энергия «исчезает». Но при этом трущиеся поверхности (брусок и горизонтальная поверхность) нагреваются, т.е. механическая энергия превращается во внутреннюю.
Применение первого начала к различным тепловым процессам
Изохорный процесс
Объем не изменяется: V = const. Следовательно, ΔV = 0 и А = –A ” = 0, т.е. никакой механической работа не совершается. Первое начало термодинамики будет иметь вид:
\(~Q = \Delta U.\)
- При изохорном процессе вся энергия, сообщаемая газу путем теплообмена, расходуется целиком на увеличение его внутренней энергии.
Изотермический процесс
Температура газа не изменяется: Τ = const. Следовательно, ΔT = 0 и ΔU = 0. Первое начало термодинамики будет имеет вид:
\(~Q = A.\)
- При изотермическом процессе вся энергия, сообщаемая газу путем теплообмена, идет на совершение газом работы.

Изобарный процесс
Давление не изменяется: p = const. При расширении газ совершает работу Α = p ⋅ΔV и нагревается, т.е. изменяется его внутренняя энергия.
Первое начало термодинамики будет имеет вид:
\(~Q = A + \Delta U .\)
- При изобарном процессе количество теплоты, сообщенное термодинамической системе, расходуется на изменение ее внутренней энергии и на совершение работы системой против внешних сил.
Адиабатный процесс
Адиабатный процесс – это процесс, происходящий без теплообмена системы с окружающей средой, т.е. Q = 0.
Такие процессы происходят при хорошей теплоизоляции системы либо при быстрых процессах, когда теплообмен практически не успевает произойти. Первое начало термодинамики будет имеет вид:
\(~\Delta U + A = 0\) или \(A = -\Delta U .\)
Если А > 0 (ΔV > 0 газ расширяется), то ΔU
- при адиабатном расширении газ совершает работу и сам охлаждается.

Охлаждение воздуха при адиабатном расширении вызывает, например, образование облаков.
Если А V U > 0 (газ нагревается), т.е.
- при адиабатном сжатии над газом совершается работа и газ нагревается.
Это используется, например, в дизельных двигателях, где при резком сжатии воздуха температура повышается настолько, что воспламеняются пары топлива в двигателе.
Адиабатное изменение состояния газа можно выразить графически. График этого процесса называют адиабатой . При одних и тех же начальных условиях (p 0 , V 0) при адиабатном расширении давление газа уменьшается быстрее, чем при изотермическом (рис. 1), так как падение давления вызвано не только увеличением объема (как при изотермическом расширении), но и понижением температуры. Поэтому адиабата идет ниже изотермы и газ при адиабатном расширении совершает меньшую работу, чем при изотермическом расширении.
Из первого начала термодинамики вытекает невозможность создания вечного двигателя первого рода , т. е. такого двигателя, который совершал бы работу без затраты энергии извне.
е. такого двигателя, который совершал бы работу без затраты энергии извне.
Действительно, если к системе не подводится энергия (Q = 0), то A = –ΔU и работа может быть совершена только за счет убыли внутренней энергии системы. После того как запас энергии окажется исчерпанным, двигатель перестанет работать.
См. также
- А так ли хорошо знаком вам вечный двигатель? // Квант. – 2003. – № 3. – C. 32-33
- Могилевский М. Леонардо да Винчи и принцип невозможности вечного двигателя //Квант. – 1999. – № 5. – С. 14-18
Уравнение теплового баланса
Если система замкнута (работа внешних сил A ” = 0) и теплоизолирована (Q = 0), то первое начало термодинамики будет иметь вид:
\(~\Delta U = 0 .\)
Если в такой системе имеются тела с различной температурой, то между ними будет происходить теплообмен: тела, у которых температура выше, будут отдавать энергию и охлаждаться, а тела с меньшей температурой будут получать энергию и нагреваться. Это будет происходить до тех пор, пока температуры у всех тел не станут одинаковыми, т.е. наступит состояние термодинамического равновесия. При этом
Это будет происходить до тех пор, пока температуры у всех тел не станут одинаковыми, т.е. наступит состояние термодинамического равновесия. При этом
\(~Q_1 + Q_2 + \ldots + Q_n = 0 .\)
Первый закон термодинамики для замкнутой и адиабатически изолированной системы называют уравнением теплового баланс а:
- в замкнутой системе тел алгебраическая сумма количеств теплоты, отданных и полученных всеми телами, участвующими в теплообмене, равна нулю.
При этом применяют следующее правило знаков :
- количество теплоты, полученное телом, считают положительным, отданное – отрицательным.
*Теплоемкость газов
Литература
- Аксенович Л. А. Физика в средней школе: Теория. Задания. Тесты: Учеб. пособие для учреждений, обеспечивающих получение общ. сред, образования / Л. А. Аксенович, Н.Н.Ракина, К. С. Фарино; Под ред. К. С. Фарино. – Мн.: Адукацыя i выхаванне, 2004. – C. 129-133, 152-161.
- Жилко В.В. Физика: Учеб.
 пособие для 11-го кл. общеобразоват. шк. с рус. яз. обучения / В.В. Жилко, А.В.Лавриненко, Л.Г. Маркович. – Мн.: Нар. асвета, 2002. – С. 125, 128-132.
пособие для 11-го кл. общеобразоват. шк. с рус. яз. обучения / В.В. Жилко, А.В.Лавриненко, Л.Г. Маркович. – Мн.: Нар. асвета, 2002. – С. 125, 128-132.
Представляет собой закон сохранения энергии, один из всеобщих законов природы (наряду с законами сохранения импульса, заряда и симметрии):
Энергия неуничтожаема и несотворяема ; она может только переходить из одной формы в другую в эквивалентных соотношениях.
Первое начало термодинамики представляет собой постулат – оно не может быть доказано логическим путем или выведено из каких-либо более общих положений. Истинность этого постулата подтверждается тем, что ни одно из его следствий не находится в противоречии с опытом.
Приведем еще некоторые формулировки первого начала термодинамики:
– Полная энергия изолированной системы постоянна;
– Невозможен вечный двигатель первого рода (двигатель, совершающий работу без затраты энергии).
Первое начало термодинамики устанавливает соотношение между теплотой Q, работой А и изменением внутренней энергии системы?U:
Изменение внутренней энергии системы равно количеству сообщенной системе теплоты минус количество работы, совершенной системой против внешних сил.
dU = δQ-δA (1.2)
Уравнение (1.1) является математической записью 1-го начала термодинамики для конечного, уравнение (1.2) – для бесконечно малого изменения состояния системы.
Внутренняя энергия является функцией состояния ; это означает, что изменение внутренней энергии?U не зависит от пути перехода системы из состояния 1 в состояние 2 и равно разности величин внутренней энергии U 2 и U 1 в этих состояниях:
U = U 2 -U 1 (1.3)
Следует отметить, что определить абсолютное значение внутренней энергии системы невозможно; термодинамику интересует лишь изменение внутренней энергии в ходе какого-либо процесса.
Рассмотрим приложение первого начала термодинамики для определения работы, совершаемой системой при различных термодинамических процессах (мы будем рассматривать простейший случай – работу расширения идеального газа).
Изохорный процесс (V = const; ?V = 0).
Поскольку работа расширения равна произведению давления и изменения объема, для изохорного процесса получаем:
Изотермический процесс (Т = const).
Из уравнения состояния одного моля идеального газа получаем:
δА = PdV = RT(I.7)
Проинтегрировав выражение (I.6) от V 1 до V 2 , получим
A=RT= RTln= RTln(1.8)
Изобарный процесс (Р = const).
Q p = ?U + P?V (1.12)
В уравнении (1.12) сгруппируем переменные с одинаковыми индексами. Получаем:
Q p = U 2 -U 1 +P(V 2 -V 1) = (U 2 + PV 2)-(U 1 +PV 1) (1.13)
Введем новую функцию состояния системы – энтальпию Н , тождественно равную сумме внутренней энергии и произведения давления на объем: Н = U + PV. Тогда выражение (1.13) преобразуется к следующему виду:
Q p = H 2 -H 1 = ?H (1.14)
Т.о., тепловой эффект изобарного процесса равен изменению энтальпии системы.
Адиабатический процесс (Q = 0, δQ = 0).
При адиабатическом процессе работа расширения совершается за счёт уменьшения внутренней энергии газа:
A = -dU=C v dT (1.15)
В случае если Сv не зависит от температуры (что справедливо для многих реальных газов), работа, произведённая газом при его адиабатическом расширении, прямо пропорциональна разности температур:
A = -C V ?T (1. 16)
16)
Задача №1. Найти изменение внутренней энергии при испарении 20 г этанола при температуре его кипения. Удельная теплота парообразования этилового спирта при этой температуре составляет 858,95 Дж/г, удельный объем пара – 607 см 3 /г (объемом жидкости пренебречь).
Решение :
1 . Вычислим теплоту испарения 20 г этанола: Q=q уд ·m=858,95Дж/г·20г = 17179Дж.
2 . Вычислим работу по изменению объема 20 г спирта при переходе его из жидкого состояния в парообразное: A= P?V,
где Р – давление паров спирта, равно атмосферному, 101325 Па (т.к. всякая жидкость кипит, когда давление ее паров равно атмосферному).
V=V 2 -V 1 =V ж -V п, т.к. V ж
3. Вычислим изменение внутренней энергии:
U=17179Дж – 1230 Дж = 15949 Дж.
Поскольку?U>0, то следовательно при испарении этанола происходит увеличение внутренней энергии спирта.
Применение первого начала термодинамики к изопроцессам идеального газа. Зависимость теплоёмкости идеального газа от вида процесса. Формула Майера.
Работа, совершаемая газом при изопроцессах.
Адиабатический процесс. Политропические процессы.
Основные термодинамические понятия: внутренняя энергия, работа, теплота.
 Уравнение первого начала термодинамики.
Уравнение первого начала термодинамики.
Основные термодинамические понятия
в отличие от молекулярно-кинетической теории не вдаётся в рассмотрение микроскопической картины явлений (оперирует с макропараметрами). Термодинамика рассматривает явления, опираясь
на основные законы (начала), которые являются обобщением огромного количества опытных данных.
Внутренняя энергия – энергия физической системы, зависящая от её внутреннего состояния . Внутренняя энергия включает энергию хаотического (теплового) движения всех микрочастиц системы (молекул, атомов, ионов и т. д.) и энергию взаимодействия этих частиц . Кинетическая энергия движения системы как целого и её потенциальная энергия во внешних силовых полях во внутреннюю энергию не входит. В термодинамике и её приложениях представляет интерес не само значение внутренней энергии, а её изменение при изменении состояния системы. Внутренняя энергия – функция состояния системы.
д.) и энергию взаимодействия этих частиц . Кинетическая энергия движения системы как целого и её потенциальная энергия во внешних силовых полях во внутреннюю энергию не входит. В термодинамике и её приложениях представляет интерес не само значение внутренней энергии, а её изменение при изменении состояния системы. Внутренняя энергия – функция состояния системы.
Работа термодинамической системы над внешними телами заключается в изменении состояния этих тел и определяется количеством энергии, передаваемой системой внешним телам при изменении объема.
Сила, создаваемая давлением газа на поршень площади равна
. Работа, совершаемая при перемещении поршня
, равна
, где
изменение объёма газа (рис. 14.1), то есть
Теплота
(количество теплоты) –
количество энергии, получаемой или отдаваемой системой при теплообмене. Элементарное количество теплоты
Элементарное количество теплоты
какой-либо функции параметров состояния. Передаваемое системе количество теплоты, как и работа, зависит от того,
каким способом система переходит из начального состояния в конечное. (В отличие от внутренней энергии, для которой
, но
, нельзя сказать, сколько работы содержит тело, “это функция” процесса – динамическая характеристика).
1-ый закон (начало) термодинамики: количество теплоты, сообщённое системе, идёт на приращение внутренней энергии системы и на совершение системой работы над внешними телами .
где
количество сообщённой телу теплоты;
и
начальное и конечное значения внутренней энергии;
работа, совершённая системой над внешними телами.
В дифференциальной форме 1-ое начало:
сообщённое телу элементарное количество теплоты;
изменение внутренней энергии;
совершённая телом работа (например, работа, совершённая при расширении газа).
Применение 1-го начала термодинамики к изопроцессам идеального газа
(Изопроцессы от
(греч.) – равный). Процессы, происходящие при каком-то постоянном параметре (
изотермический;
изобарический;
изохорический).
Теплоёмкостью тела называется величина, равная отношению сообщённого телу количества теплоты
к соответствующему приращению температуры
.
Размерность теплоёмкости тела
.
Аналогичные определения вводятся для 1 моля (молярная теплоёмкость
), и для единицы массы вещества
.
Рассмотрим нагревание газа при постоянном объёме. По первому закону термодинамики:
, т.к.
, то
.
по определению, а для процесса с :
, где
теплоёмкость газа при постоянном объёме.
Тогда
и
Теплоёмкость газа при постоянном давлении :
.
Для идеального газа для 1 моля (из уравнения Менделеева-Клапейрона).
.
Продифференцируем это выражения по температуре Т, получим:
, получим для 1 моля
Но выражение называется
уравнением Майера. Оно показывает, что
всегда больше
на величину молярной газовой постоянной. Это объясняется тем, что
Это объясняется тем, что
по сравнению с процессом при постоянном объёме,
требуется ещё дополнительное количество теплоты на совершение работы расширения газа,т.к. постоянство давления обеспечивается увеличением объёма газа.
При адиабатическом процессе (процесс протекающий без теплообмена с внешней средой).
,
, т.е. теплоёмкость в адиабатическом процессе равна нулю.
Существуют процессы, при которых газ, расширяясь, совершает работу большую, чем полученная теплота, тогда его температура понижается , несмотря на приток теплоты. Теплоёмкость в этом случае отрицательна . В общем случае
.
3. Работа, совершаемая газом при изопроцессах
Изобарный
.
| Диаграмма этого процесса (изобары) в координатах изображается прямой, параллельной оси (рис.  14.2). При изобарном процессе работа газа при расширении объёма от до равна: 14.2). При изобарном процессе работа газа при расширении объёма от до равна: | ||
| Рис. 14.2 |
И определяется площадью заштрихованного прямоугольника на рис. 14.2.
Изохорный процесс (). Диаграмма этого процесса
| | (изохора ) в координатах изображается прямой, параллельной оси ординат (рис. 14.3). поскольку , то . Изотермический процесс (). (рис. 14.4). Воспользовавшись уравнением состояния идеального газа Менделеева- Клайперона для работы в изотермическом процессе получаем: | ||
| Рис. 14.3 | |||
Изотермический процесс является
идеальным процессом, т. к. расширение газа при постоянной температуре может происходить только
к. расширение газа при постоянной температуре может происходить только
. При конечной скорости расширения возникнут градиенты температуры.
4. Адиабатический (адиабатный) процесс
Это процесс, происходящий без теплообмена с окружающими телами . Рассмотрим, при каких условиях можно реально осуществить адиабатический процесс, или приблизиться к нему.
1. Необходима адиабатическая оболочка , теплопроводность которой равна нулю. Приближением к такой оболочке может служить сосуд Дьюара .
2. 2-ой случай – процессы, протекающие очень быстро . Теплота не успевает распространиться и в течение некоторого времени можно полагать .
3. Процессы, протекающие в очень больших объёмах газа , например, в атмосфере (области циклонов, антициклонов). Для выравнивания температуры передача теплоты должна происходить из соседних, более нагретых слоёв воздуха, на это часто требуется значительное время.
Для адиабатического процесса первый закон термодинамики :
или
.
В случае расширения газа
,
, (температура понизится). Если произошло сжатие газа
, то
(температура повышается). Выведем уравнение, связывающее параметры газа при адиабатическом процессе. Учтём, что для идеального газа
, тогда
Разделим обе части уравнения на
:
.
Из уравнения Майера
, тогда
.
Обозначим
.
.
Проинтегрируем это уравнение:
Отсюда
Получили уравнение Пуассона (для адиабаты) (1 – ая форма). Заменим
:
,
2 – ая форма уравнения Пуассона . На рис. 14.5 представлены сравнительные графики изотермы и адиабаты.
Рис. 14.5
Так как
, то график адиабаты более крутой по сравнению с изотермой. Вычислим
Вычислим
:
т.е
Политропические процессы .
Так называют процессы, уравнение которых в переменных
имеет вид
где n-произвольное число, как положительное, так и отрицательное, а также равное нулю. Соответствующую кривую называют политропой. Политропическими являются, в частности, процессы адиабатический, изотермический, изобарический, изохорический.
Вопросы для самоконтроля
Лекция №15
Второе начало термодинамики
План
Обратимые и необратимые процессы. Круговой процесс (цикл). Равновесные состояния и процессы.
. Максимальный КПД теплового движения.
Тепловые двигатели и холодильные машины.
Энтропия. Закон возрастания энтропии.
Статистический вес (термодинамическая вероятность). Второе начало термодинамики и его статистическое толкование.
1. Обратимые и необратимые процессы
Пусть в результате некоторого процесса в изолированной системе тело переходит из состояния А в состояние В и затем возвращается в начальное состояние А . Процесс называется обратимым , если возможно осуществить обратный переход из В в А через те же промежуточные состояния, что и в прямом процессе , чтобы не осталось никаких изменений и в самом теле и в окружающих телах. Если же обратный процесс невозможен , или по окончании процесса в окружающих телах и в самом теле остались какие-либо изменения, то процесс является необратимым .
Примеры необратимых процессов . Любой процесс сопровождаемый трением является необратимым (теплота, выделяющаяся при трении не может без затраты работы другого тела собраться и вновь превратиться в работу). Все процессы, сопровождаемые теплопередачей от нагретого тела к менее нагретому, является необратимыми (например, теплопроводность). К необратимым процессам также относятся диффузия, вязкое течение. Все необратимые процессы являются неравновесными .
К необратимым процессам также относятся диффузия, вязкое течение. Все необратимые процессы являются неравновесными .
Равновесные – это такие процессы, которые представляют из себя последовательность равновесных состояний . Равновесное состояние – это такое состояние, в котором без внешних воздействий тело может находиться сколь угодно долго. (Строго говоря, равновесный процесс может быть только бесконечно медленным . Любые реальные процессы в природе протекают с конечной скоростью и сопровождаются рассеянием энергии. Обратимые процессы – идеализация , когда необратимыми процессами можно пренебречь).
Круговой процесс (цикл). Если тело из состояния А в состояние В переходит через одни промежуточные состояния, а возвращается в начальное состояние А через другие промежуточные состояния, то совершается круговой процесс , или цикл .
Круговой процесс является обратимым , если все его части обратимы . Если какая-либо часть цикла необратима, то и весь процесс необратим.
Если какая-либо часть цикла необратима, то и весь процесс необратим.
2. Цикл Карно и его КПД для идеального газа
(Сади Карно (1796 – 1832) – французский физик).
| Цикл Карно заключается в следующем . Сначала система, имея температуру , приводится в тепловой контакт с нагревателем . Затем, бесконечно медленно уменьшая внешнее давление, её заставляют расширяться по изотерме 1-2 . При этом она получает тепло от нагревателя и производит работу против внешнего давления . |
Рабочий цикл состоит из двух равновесных изотерм и двух равновесных адиабат (рис. 15.2). В машине, как допускают, отсутствуют потери на трение, теплопроводность и т.д. С машиной связаны два резервуара теплоты. Один, имеющий температуру , называется
нагревателем, другой имеющий более низкую температуру –
холодильником(или
теплоприёмником). Резервуары настолько велики, что отдача или получение теплоты не изменяет их температуру.
Резервуары настолько велики, что отдача или получение теплоты не изменяет их температуру.
После этого систему адиабатически изолируют и заставляют расширяться по адиабате 2 – 3 , пока её температура не достигает температуры холодильника . При адиабатическом расширении система также совершает некоторую работу против внешнего давления. В состоянии 3 систему приводят в тепловой контакт с холодильником и непрерывным увеличением давления изотермически сжимают её до некоторого состояния 4. При этом над системой производится работа (т.е. сама система совершает отрицательную работу
), и она отдаёт холодильнику некоторое количество тепла
. Состояние 4 выбирается так, чтобы можно было сжатием по адиабате 4 – 1 вернуть систему в исходное состояние. Для этого над системой надо совершить работу
(система должна произвести отрицательную работу
). В результате кругового процесса Карно внутренняя энергия системы не изменяется , поэтому произведённая работа
Рассчитаем коэффициент полезного действия идеальной тепловой машины , работающей по циклу Карно. Эта величина равна отношению количества теплоты, превращённого в работу , к количеству теплоты, полученному от нагревателя .
Эта величина равна отношению количества теплоты, превращённого в работу , к количеству теплоты, полученному от нагревателя .
Полезная работа за цикл равна сумме всех работ отдельных частей цикла:
Работа изотермического расширения:
,
адиабатического расширения:
,
изотермического сжатия:
,
адиабатического сжатия:
Адиабатические участки цикла не влияют на общий результат , т.к. работы на них равны и противоположны по знаку, следовательно
.
. (1)
Так как состояния газа, описываемые точками 2 и 3 лежат на одной адиабате, то параметры газа связаны уравнением Пуассона:
.
Аналогично для точек 4 и 1:
Разделив почленно эти уравнения, получим:
, тогда из (1) получается
То есть КПД цикла Карно определяется только температурами нагревателя и холодильника
.
Теорема Карно (без доказательства): КПД всех обратимых машин, работающих при одних и тех же температурах нагревателя и холодильника одинаков и определяется только температурами нагревателя и холодильника .
Замечание: КПД реальной тепловой машины всегда ниже , чем КПД идеальной тепловой машины (в реальной машине существуют потери тепла , которые не учитываются при рассмотрении идеальной машины).
3. Принцип действия теплового двигателя и холодильной машины
Любой тепловой двигатель состоит из 3-х основных частей : рабочего тела, нагревателя и холодильника .
Рабочее тело получает некоторое количество теплоты , от нагревателя. При сжатии газ передаёт некоторое количество теплоты холодильнику. Полученная работа , совершаемая двигателем за цикл:
(Замечание: реальные тепловые двигатели обычно работают по так называемому
разомкнутому циклу, когда газ после расширения
выбрасывается, и
сжимается новая порция. Однако это существенно не влияет на термодинамику процесса. В
Однако это существенно не влияет на термодинамику процесса. В
цикле расширяется и сжимается
одна и та же порция.).
Холодильная машина . Цикл Карно обратим, следовательно, его можно провести в обратном направлении . (4-3-2-1-4 (рис.15.3)) От холодильной камеры поглощается тепло .
| Нагревателю рабочее тело передаёт некоторое количество теплоты . Внешние силы совершают работу , тогда В результате цикла некоторое количество теплоты переходит от холодного тела к телу с более высокой температурой . Реально рабочим телом в холодильной установке обычно служат пары легкокипящих жидкостей – аммиак, фреон и т. п. К машине подводится энергия от | |
| Рис. 15.3 |
электрической сети. За счёт этой энергии и совершается процесс “
За счёт этой энергии и совершается процесс “
” от холодильной камеры к более нагретым телам (к окружающей среде).
Эффективность холодильной установки оценивается по холодильному коэффициенту:
Тепловой насос. Это непрерывно действующая машина, которая за счёт затрат работы (электроэнергии) отбирает тепло от источника с низкой температурой (чаще всего близкой к температуре окружающей среды ) и передаёт источнику тепла с более высокой температурой количество теплоты , равна сумме тепла, отобранного от низкотемпературного источника и затраченной работы:
.
всегда больше единицы (максимально возможный
).
Для сравнения : если отапливать помещение с помощью обычных электронагревателей , то количество теплоты , выделенное в нагревательных элементах, в точности равно расходу электроэнергии .
4 . Энтропия. Закон возрастания энтропии
В термодинамике понятие “энтропия” было введено немецким физиком Р. Клаузиусом (1865 г.).
Из статической физики: отношение количества теплоты
, сообщаемого системе, к температуре (системы) есть приращение некоторой функции состояния (энтропий).
Каждое состояние тела характеризуется определённым значением энтропии . Если обозначить энтропию в состояниях 1 и 2 как и , то по определению для обратимых процессов:
Значение произвольной постоянной, с которой определена энтропия, не играет роли.
Физический смысл имеет не сама энтропия, а разность энтропий.
Закон возрастания энтропии .
Допустим, что изолированная система переходит из равновесного
(для обратного процесса знак “=” , для необратимого “Для нашего перехода 1 – 2 – 1:
.
Так как процесс 2 – 1 обратимый, то будет равенство. (Закон возрастания энтропии ).
5. Статистический вес (термодинамическая вероятность).
Под термодинамической вероятностью понимается число микросостояний (микрораспределений, например, распределений молекул по пространству или энергии) которыми может определяться рассматриваемое макрораспределение .
3-я и 4-я – в первой и т.д. (рис. 15.5).
(энтропия определяется с точностью до константы
const),
где
константа Больцмана,
термодинамическая вероятность.
Второе начало термодинамики и его статистическое толкование
Формулировка Больцмана:
.
Формулировка Клаузиуса:
. можно оценить используя соотношение:
можно оценить используя соотношение:
.
, тогда
Это означает, что на каждый
случаев переходов
от тела с температурой 301 К к телу с температурой 300 К может произойти один случай перехода того же количества теплоты от тела с температурой 300 К к телу с температурой 301 К. (Заметим, что для совсем малого количества теплоты
вероятности становится сравнимыми и для таких случаев второе начало применить уже нельзя.).
Вообще же, говоря если в системе имеется многовариантность путей, процессов, то, рассчитав энтропию конечных состояний, можно теоретически определить вероятность того или иного пути, процесса , не производя их реально и в этом важное практическое применение формулы, связывающей термодинамическую вероятность с энтропией.
Вопросы для самоконтроля
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1.Иродов И.Е . Физика макросистем. – М. – С. – Пб.: Физматлит,
2. Савельев И. В . Курс общей физики: В 3 т. – М.: Наука, 1977. Т.1. – 432с.
В . Курс общей физики: В 3 т. – М.: Наука, 1977. Т.1. – 432с.
3.Матвеев А.Н. Молекулярная физика. – М.: Высш. Шк., 1987.
4.Сивухин Д.В. Общий курс физики: В 5т. – М.: Наука, 1975. т.2.
5.Телеснин Р.В . Молекулярная физика. – М.: Высш. шк., 1973. –
6.Зисман Г.А., Тодес О.М. Курс общей физики: В 3т. – М.:
Наука., 1969. Т 1. – 340с.
7.Трофимова Т.И . Курс физики. – М.: Высш. шк., 1990. – 478с.
8. Кунин В.Н . Конспект лекций по трудным разделам физики
Владим. политехн. ин-т. – Владимир, 1982/ – 52с.
9.Физика. Программа, методические указания и задачи для
студентов – заочников (с примерами решения) / Сост.: А.Ф. Гал-
кин, А.А. Кулиш, В.Н. Кунин и др.; Под ред. А.А. Кулиша; Вла-
дим. гос. ун-т. – Владимир, 2002. – 128с.
10.Методические указания для самостоятельной работы по фи
зике / Сост.: Е.В. Орлик, Э.Д. Корж, В.Г. Прокошев; Владим.
гос. ун-т. – Владимир, 1988. – 48с.
Лекция № 7. молекулярно-кинетическая теория
идеального газа………………………………………………….4
Л екция № 8. элементы классической статистики
(статистической физике)……………………………………12
Лекция № 9. реальные газы……………………………………………………..25
Лекция № 10. свойства жидкостей………………………………………….32
Лекция № 11. свойства твердых тел………………………………………….40
Лекция № 12. фазовые равновесия и фазовые переходы………….47
Основные законы, которые являются основой термодинамики, называют началами. В основании термодинамики лежат три начала. Первое начало термодинамики является законом сохранения энергии для термодинамических процессов. В интегральном виде формула первого начала термодинамики выглядит как:
что означает: количество теплоты, подводимое к термодинамической системе, идет на совершение данной системой работы и изменение ее внутренней энергии. Условлено считать, что если теплота к системе подводится, то она больше нуля ( title=”Rendered by QuickLaTeX. com”>) и если работу выполняет сама термодинамическая система, то она положительна ( title=”Rendered by QuickLaTeX.com”>).
com”>) и если работу выполняет сама термодинамическая система, то она положительна ( title=”Rendered by QuickLaTeX.com”>).
Первое начало термодинамики можно представить в дифференциальном виде, тогда формула для него будет:
где – бесконечно малое количество теплоты, подводимое к системе; – элементарная работа системы; – малое изменение внутренней энергии системы.
Если исследуемой термодинамической системой является идеальный газ, то работа выполняемая им связана с изменением объема (), в таком случае формулой первого начала термодинамики (в дифференциальном виде) можно считать выражение:
Следует напомнить, что первое начало термодинамики не указывает направление, в котором происходит термодинамический процесс. Формула первого начала отображает только изменение параметров системы, если процесс происходит. В термодинамике за указание на направление процесса отвечает второе начало.
Формулы первого начала термодинамики для процессов
Для процесса, происходящего в некоторой массе газа при постоянной температуре (изотермический процесс), формула первого начала термодинамики преобразуется к виду:
Из выражения (4) следует, что вся теплота, которую получает термодинамическая система, расходуется на совершение этой системой работы.
Формулой первого начала термодинамики для изохорного процесса служит выражение:
При изохорном процессе, все тепло, полученное системой, идет на увеличение ее внутренней энергии.
В изобарном процессе формула первого закона термодинамики остается без изменения (3).
Адиабатный процесс отличается тем, что он происходит без обмена теплотой с окружающей средой. В формуле для первого начала термодинамики это отражается так:
В адиабатическом процессе газ совершает работу за счет своей внутренней энергии.
Примеры решения задач по теме «Первый закон термодинамики»
ПРИМЕР 1
| Задание | На рис.1 изображены изотермы AB и CD. Найдите отношение количества теплоты (), которое получает одна и та же масса газа в процессах I и II. Считайте массу газа в процессах неизменной. |
| Решение | Процесс I является изохорным. Для изохорного процесса первое начало термодинамики запишем как: Процесс II – является изобарным, для него первое начало термодинамики принимает вид: где использовано уравнение состояния идеального газа для изобарного процесса и рассмотрены начальное и конечное состояния газа: Найдем искомое отношение: |
| Ответ | = |
ПРИМЕР 2
| Задание | Какое количество теплоты сообщили одноатомному идеальному газу в количестве моль, если провели с ним изобарное нагревание? Температура изменилась на K. |
| Решение | Основой для решения задачи является первое начало термодинамики, которое для изобарного процесса запишем как: Для изобарного процесса работа газа равна: |
Применение 1-ого закона термодинамики к изопроцессам.
Основные ссылки
CSS adjustments for Marinelli theme
Объединение учителей Санкт-Петербурга
Форма поиска
Поиск
Вы здесь
Главная » Применение 1-ого закона термодинамики к…
ПРИМЕНЕНИЕ 1 ЗАКОНА ТЕРМОДИНАМИКИ К ИЗОПРОЦЕССАМ. | |||||
Процесс | Постоянные | График | Изменение внутренней энергии | Запись 1-го закона термодинамики |
Физический смысл |
Изотермическое расширение | m=const M=const T=const pV=const | U=const ΔU=0 | Q=A’ | Изотермический процесс не может происходить без теплопередачи. | |
Изотермическое сжатие | m=const M=const T=const pV=const | U=const ΔU=0 | A=-Q | Изотермический процесс не может происходить без теплопередачи. Вся работа внешних сил выделяется в виде тепла. | |
Изохорное нагревание | m=const M=const V=const |
| p↑ T↑ U↑ ΔU>0 | A=0 Q= ΔU | Все количество теплоты, переданное системе, расходуется на увеличение ее внутренней энергии. |
Изохорное охлаждение | m=const M=const V=const |
| p↓ T↓ U↓ ΔU<0 | A=0 Q= ΔU<0 | Система уменьшает свою внутреннюю энергию, отдаваятепло окружающим телам. |
Изобарное расширение (нагревание) | m=const M=const p=const |
| V↑ T↑ U↑ ΔU>0 | Q=ΔU+A’ ΔU=Q-А’>0 | Количество теплоты, переданное системе, превышает совершенную еюмеханическую работу. |
Изобарное сжатие (охлаждение) | m=const M=const p=const | V↓ T↓ U↓ ΔU<0 | ΔU=Q+A<0 Q<0 | Количество теплоты, отдаваемое системой, превышает работу внешних сил. Часть тепла система отдает за счет уменьшениявнутр. энергии. | |
Адиабатное Расширение | m=const M=const =const | ΔU<0 U↓ T↓ | Q=0 A’ > 0 ΔU=-A’ < 0 A’=-ΔU | Система совершает механическую работу только за счет уменьшения своей внутренней энергии. | |
Адиабатное сжатие | m=const M=const =const | ΔU>0 U↑ T↑ | Q=0 A>0 ΔU=A | Внутренняя энергия системы увеличивается за счет работы внешних сил. | |
Теги:
конспект
Закон термодинамики для изопроцессов
Определение 1
Первый закон термодинамики – теория сохранения и удержания энергии: при любых физических взаимосвязях этот показатель не может самостоятельно возникать или исчезать, а только передается от одних материальных тел к другим, превращаясь в совершенно иную форму.
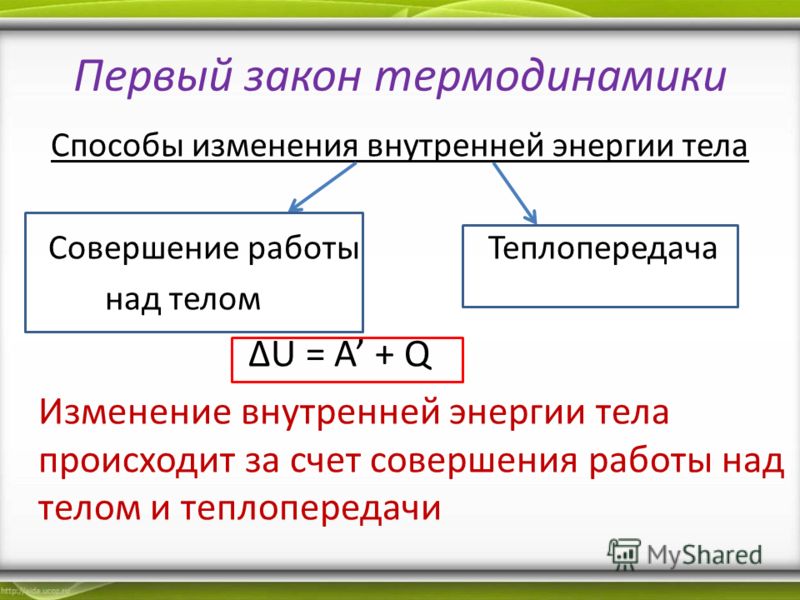
Рисунок 1. Первый закон термодинамики для изопроцессов. Автор24 — интернет-биржа студенческих работ
Общая форма закона сохранения имеет вид. Здесь $∆E$ –постепенное изменение механической энергии системы, $∆U$ – изменение энергии физических тел, $А$ – работа внешних сил, $Q$ – количество полученной системой теплоты.
Здесь $∆E$ –постепенное изменение механической энергии системы, $∆U$ – изменение энергии физических тел, $А$ – работа внешних сил, $Q$ – количество полученной системой теплоты.
Но изучая данный закон для изопроцессов, необходимо рассматривать формулу: $∆U = A + Q$.
Согласно первому термодинамическому постулату, изменение внутреннего энергетического потенциала будет равняться сумме выполненной внешними силами работы. Однако это возможно только при переходе системы из одного состояние в другое.
Определение 2
Изопроцессы – это термодинамические процессы, протекающие при неизменном значении одного из макроскопических показателей $(р, V, T)$.
Процесс изменения общего состояния системы в термодинамике при постоянном давлении называется изобарным. Этот закон был впервые установлен экспериментально в 1802 году французским ученым Ж. Гей-Люссаком. Изохорный процесс изучает изменение взаимодействий вещество в определенной среде при постоянном объеме.
При изотермическом процессе температура физического вещества не изменяется, значит не постоянной остается и внутренняя энергия системы. Первый закон термодинамики для изопроцессов принимает следующий вид: $Q = A’$. Все количество теплоты, получаемое газом, расходуется на выполнение им работы против действия внешних сил. Или, если газ в итоге сжимается, при этом температура фиксируется на прежнем уровне, работу выполняют окружающие систему факторы, а газ отдает только некоторое количество теплоты. При изохорном процессе объем концепции не изменяется, значит работа нулевая: $A = -p∆V$.
Первый закон термодинамики для изопроцессов принимает следующий вид: $Q = A’$. Все количество теплоты, получаемое газом, расходуется на выполнение им работы против действия внешних сил. Или, если газ в итоге сжимается, при этом температура фиксируется на прежнем уровне, работу выполняют окружающие систему факторы, а газ отдает только некоторое количество теплоты. При изохорном процессе объем концепции не изменяется, значит работа нулевая: $A = -p∆V$.
Изопроцессы в термодинамике
Рисунок 2. Изопроцессы. Автор24 — интернет-биржа студенческих работ
В отсутствие внешних полей в термодинамике идеальный газ равномерно распределяется по всему предоставленному ему объему. Вследствие хаотического движения молекул изотермические процессы начинают демонстрировать силовое воздействие, характеризуемое давлением.
Замечание 1
Если над веществом в закрытой среде не совершать работы и не передавать ему определенное количество энергии в ходе теплопередачи, в системе появится состояние термодинамического равновесия, характеризуемое одинаковыми давлением газа и температурой.
При термодинамическом равновесии состояние элементов фиксированной массы $m$ описывается тремя параметрами:
- объемом $V$, который занимает рабочее тело;
- давлением $p$, создаваемым веществом;
- его температурой $T$.
С течением времени состояние исследуемой системы при влиянии изопроцессов не может изменяться. Такое явление называют равновесным, если в каждый временной период взаимосвязанные элементы находились в состоянии термодинамической стабильности.
При реализации любого процесса в результате теплопередачи концепция может отдавать или получать некоторое количество теплоты, которое в соответствии с первым термодинамическим началом идет на проведение системой важной работы на изменение её внутренней энергии.
Изопроцессы в газах
Рисунок 3. Изопроцессы в газах. Автор24 — интернет-биржа студенческих работ
Для того, чтобы более детально изучить действие изопроцессов в идеальных газов, необходимо определить состояния данной массы вещества, которое характеризуется тремя макроскопическими параметрами:
- давлением;
- объемом;
- температурой.

Уравнение состояния идеального газа – это такой утверждение, которое связывает три вышеуказанных показателей в одно целое.
Единственная величина в формуле изопроцессов, которая непосредственно зависит от рода газа, это его молярная масса. Из уравнения общего состояния вытекает связь между объемом, давлением и температурой идеального газа, который может находиться одновременно в двух любых состояниях. таким образом, для данной массы исследуемого элемента, все действующие процессы вне зависимости от основных параметров осуществляют определенное давление на объем, деленное на абсолютную температуру. Это возможно получить в случае, если есть постоянная величина
Применение изопроцессов в тепловом двигателе
В начале XIX столетия французский изобретатель Сади Карно тщательно изучил пути повышения эффективности работы тепловых двигателей. Инженер придумал универсальный цикл, который должен производить идеальный газ с помощью изопроцессов в некоторой тепловой машине. В результате получилось определить максимально возможный энергетический потенциал. Цикл Карно состоит из двух адиабат и изотерм.
В результате получилось определить максимально возможный энергетический потенциал. Цикл Карно состоит из двух адиабат и изотерм.
Замечание 2
Идеальный газ приводят в контакт с определенным нагревателем и предоставляют ему шанс расширяться изотермически, то есть при температуре самого нагревателя.
Когда расширившийся элемент перейдет в следующее состояние, его тепло полностью изолируют от устройства и предоставят возможность самостоятельно расширяться адиабатически, то есть газ совершает некоторый функционал за счет убыли его внутренней энергии.
Расширяясь изотермически газ постепенно охлаждается до тех пор, пока его изначальная температура не будет равна температуре работающего холодильника. Теперь вещество взаимодействует с холодильником, где все процессы сжимаются изобарно. Затем идеальный газ необходимо изолировать от тепла, при этом температура самого объекта увеличивается и постепенно достигает температуры нагревателя. Процесс повторяется неоднократно.
Некоторые известные виды тепловых двигателей:
- паровая турбина;
- паровая машина;
- двигатель внутреннего сгорания;
- реактивный мотор.

Физическая база работы всех тепловых двигателей абсолютно однообразна и равномерна. Данный агрегат состоит из трех главных частей: рабочего тела, нагревателя и холодильника.
Карно доказал, что рентабельность любой другой тепловой машины будет значительно меньше, чем эффективность работы указанного цикла. На практике не применяют оборудования, работающие по закону Карно, но формула позволяет определить максимально подходящий параметр при изначально заданных температурах основных частей.
Очевидно, что для увеличения действия изопроцессов в термодинамике необходимо понижать температуру холодильника и увеличивать температуру нагревателя. Стоит отметить, что осуществлять данные процессы искусственно – совершенно невыгодно, так как это требует дополнительных затрат энергии. Однако формула Карно показала, что на сегодняшний день существуют неиспользованные и мощные резервы повышения работы паровых машин, так как практический метод очень сильно отличается от цикла Карно.
15.1: Первый закон термодинамики
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 1594
- OpenStax
- OpenStax
Цели обучения
К концу этого раздела вы сможете:
- Дать определение первому закону термодинамики.
- Опишите, как сохранение энергии связано с первым законом термодинамики.
- Определить случаи применения первого закона термодинамики в повседневных ситуациях, включая биологический метаболизм.
- Рассчитать изменения внутренней энергии системы после учета теплопередачи и выполненной работы.
Если нас интересует, как теплопередача преобразуется в работу, то важен принцип сохранения энергии. первый закон термодинамики применяет принцип сохранения энергии к системам, в которых передача тепла и выполнение работы являются методами передачи энергии в систему и из нее.
первый закон термодинамики применяет принцип сохранения энергии к системам, в которых передача тепла и выполнение работы являются методами передачи энергии в систему и из нее.
Первый закон термодинамики гласит, что изменение внутренней энергии системы равно чистому переносу тепла в систему за вычетом чистой работы, выполненной системой. В форме уравнения первый закон термодинамики равен
.\[\Delta U = Q – W. \label{first}\]
Здесь \(\Delta U\) есть изменение внутренней энергии \(U\) системы. \(Q\) – чистого тепла, переданного в систему — то есть \(Q\) представляет собой сумму всего теплопереноса в систему и из нее. \(W\) — это чистая работа, проделанная системой , то есть \(W\) — это сумма всей работы, проделанной системой или над ней. Мы используем следующие соглашения о знаках: если \(Q\) положительна, то в систему имеет место чистый теплообмен; если \(W\) положительно, то система совершает чистую работу. Таким образом, положительный \(Q\) добавляет энергию системе, а положительный \(W\) забирает энергию у системы. Таким образом, \(\Delta U = Q – W\). Обратите также внимание, что если в систему передается больше тепла, чем совершается работа, разница сохраняется в виде внутренней энергии. Хорошим примером этого являются тепловые двигатели — в них происходит передача тепла, чтобы они могли совершать работу (рис. \(\PageIndex{2}\)). Теперь мы рассмотрим \(Q, \, W\) и \(\Delta U\) дальше.
\(W\) — это чистая работа, проделанная системой , то есть \(W\) — это сумма всей работы, проделанной системой или над ней. Мы используем следующие соглашения о знаках: если \(Q\) положительна, то в систему имеет место чистый теплообмен; если \(W\) положительно, то система совершает чистую работу. Таким образом, положительный \(Q\) добавляет энергию системе, а положительный \(W\) забирает энергию у системы. Таким образом, \(\Delta U = Q – W\). Обратите также внимание, что если в систему передается больше тепла, чем совершается работа, разница сохраняется в виде внутренней энергии. Хорошим примером этого являются тепловые двигатели — в них происходит передача тепла, чтобы они могли совершать работу (рис. \(\PageIndex{2}\)). Теперь мы рассмотрим \(Q, \, W\) и \(\Delta U\) дальше.
 \(Q\) представляет собой чистую теплопередачу – это сумма всех теплопередач в систему и из нее. \(Q\) положителен для чистой передачи тепла в систему. \(W\) – это полная работа, выполненная системой. \(W\) положительна, когда система совершает больше работы, чем над ней. Изменение внутренней энергии системы \(\Delta U\) связано с выделением тепла и работой согласно первому закону термодинамики (уравнение \ref{first}).
\(Q\) представляет собой чистую теплопередачу – это сумма всех теплопередач в систему и из нее. \(Q\) положителен для чистой передачи тепла в систему. \(W\) – это полная работа, выполненная системой. \(W\) положительна, когда система совершает больше работы, чем над ней. Изменение внутренней энергии системы \(\Delta U\) связано с выделением тепла и работой согласно первому закону термодинамики (уравнение \ref{first}).ЗАКОН ТЕРМОДИНАМИКИ И ЗАКОН СОХРАНЕНИЯ ЭНЕРГИИ
Первый закон термодинамики на самом деле является законом сохранения энергии, сформулированным в форме, наиболее полезной в термодинамике. Первый закон устанавливает связь между теплопередачей, выполненной работой и изменением внутренней энергии системы.
Теплота
Q и Работа Вт Теплопередача \(Q\) и выполнение работы \(Вт\) – это два повседневных способа подачи энергии в систему или получения энергии из нее. Процессы совсем другие. Теплопередача, менее организованный процесс, обусловлена разницей температур. Работа, вполне организованный процесс, включает в себя действие макроскопической силы на расстоянии. Тем не менее, теплота и работа могут давать одинаковые результаты. Например, и то, и другое может вызвать повышение температуры. Передача тепла в систему, например, когда солнце нагревает воздух в велосипедной шине, может повысить его температуру, и, таким образом, над системой может совершаться работа, например, когда велосипедист накачивает воздух в шину. После того, как произошло повышение температуры, невозможно сказать, было ли оно вызвано теплопередачей или совершением работы. Эта неопределенность является важным моментом. Теплопередача и работа — это энергия в пути — ни одна из них не хранится как таковая в системе. Однако и то, и другое может изменить внутреннюю энергию \(U\) системы. Внутренняя энергия — это форма энергии, совершенно отличная от теплоты или работы.
Работа, вполне организованный процесс, включает в себя действие макроскопической силы на расстоянии. Тем не менее, теплота и работа могут давать одинаковые результаты. Например, и то, и другое может вызвать повышение температуры. Передача тепла в систему, например, когда солнце нагревает воздух в велосипедной шине, может повысить его температуру, и, таким образом, над системой может совершаться работа, например, когда велосипедист накачивает воздух в шину. После того, как произошло повышение температуры, невозможно сказать, было ли оно вызвано теплопередачей или совершением работы. Эта неопределенность является важным моментом. Теплопередача и работа — это энергия в пути — ни одна из них не хранится как таковая в системе. Однако и то, и другое может изменить внутреннюю энергию \(U\) системы. Внутренняя энергия — это форма энергии, совершенно отличная от теплоты или работы.
Внутренняя энергия
U Мы можем думать о внутренней энергии системы двумя разными, но непротиворечивыми способами.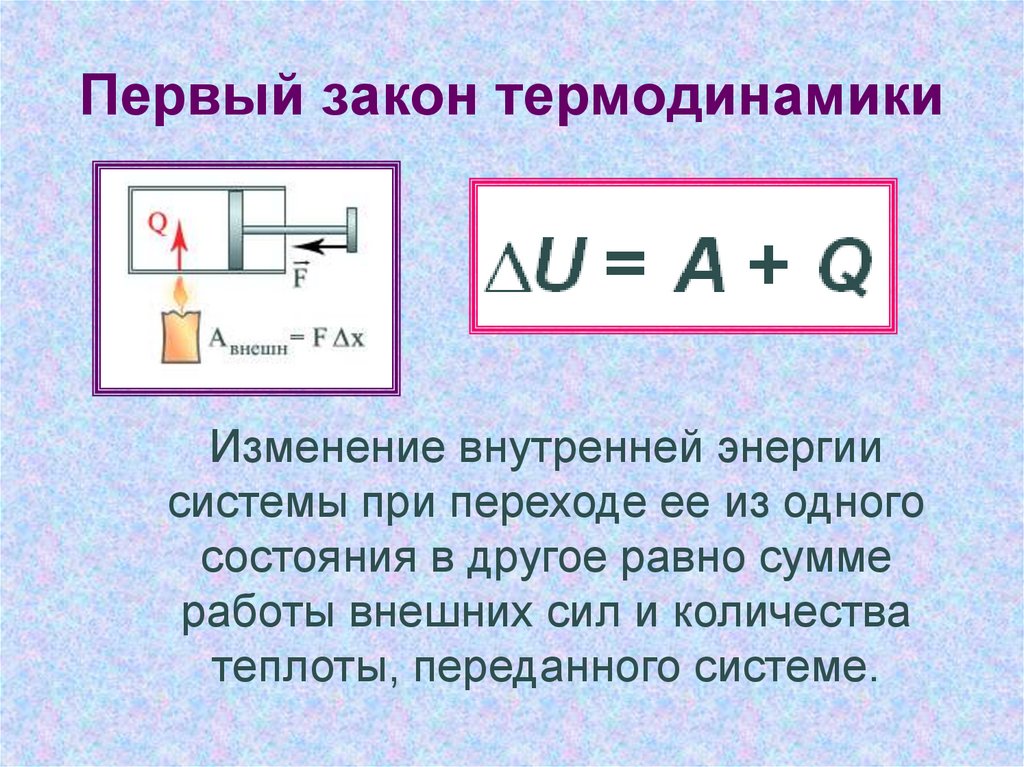 Первый — это атомно-молекулярный взгляд, который исследует систему в атомном и молекулярном масштабе. внутренняя энергия \(U\) системы есть сумма кинетической и потенциальной энергий ее атомов и молекул. Напомним, что кинетическая плюс потенциальная энергия называется механической энергией. Таким образом, внутренняя энергия представляет собой сумму атомной и молекулярной механической энергии. Поскольку невозможно уследить за всеми отдельными атомами и молекулами, мы должны иметь дело со средними значениями и распределениями. Второй способ представления внутренней энергии системы — ее макроскопические характеристики, которые очень похожи на средние атомные и молекулярные значения.
Первый — это атомно-молекулярный взгляд, который исследует систему в атомном и молекулярном масштабе. внутренняя энергия \(U\) системы есть сумма кинетической и потенциальной энергий ее атомов и молекул. Напомним, что кинетическая плюс потенциальная энергия называется механической энергией. Таким образом, внутренняя энергия представляет собой сумму атомной и молекулярной механической энергии. Поскольку невозможно уследить за всеми отдельными атомами и молекулами, мы должны иметь дело со средними значениями и распределениями. Второй способ представления внутренней энергии системы — ее макроскопические характеристики, которые очень похожи на средние атомные и молекулярные значения.
Макроскопически мы определяем изменение внутренней энергии \(\Delta U\) как соответствующее первому закону термодинамики (уравнение \ref{first}): \[\Delta U = Q – W \nonumber\]
Многие детальные эксперименты подтвердили, что \(\Delta U = Q – W\), где \(\Delta U\) — изменение полной кинетической и потенциальной энергии всех атомов и молекул в системе. Экспериментально установлено также, что внутренняя энергия \(U\) системы зависит только от состояния системы и не как дошло до такого состояния . В частности, установлено, что \(U\) является функцией нескольких макроскопических величин (например, давления, объема и температуры), не зависящих от прошлой истории, например, от того, происходил ли теплообмен или совершалась работа. Эта независимость означает, что если мы знаем состояние системы, мы можем вычислить изменения ее внутренней энергии \(U\) по нескольким макроскопическим переменным.
Экспериментально установлено также, что внутренняя энергия \(U\) системы зависит только от состояния системы и не как дошло до такого состояния . В частности, установлено, что \(U\) является функцией нескольких макроскопических величин (например, давления, объема и температуры), не зависящих от прошлой истории, например, от того, происходил ли теплообмен или совершалась работа. Эта независимость означает, что если мы знаем состояние системы, мы можем вычислить изменения ее внутренней энергии \(U\) по нескольким макроскопическим переменным.
МАКРОСКОПИЧЕСКОЕ и МИКРОСКОПИЧЕСКОЕ
В термодинамике мы часто используем макроскопическую картину при расчетах поведения системы, в то время как атомарная и молекулярная картина дает основные объяснения в терминах средних значений и распределений. Мы еще увидим это в следующих разделах этой главы. Например, в теме энтропии расчеты будут производиться с использованием атомарно-молекулярного представления.
Чтобы получить лучшее представление о внутренней энергии системы, давайте рассмотрим систему, переходящую из состояния 1 в состояние 2. Система имеет внутреннюю энергию \(U_1\) в состоянии 1, и у нее есть внутренняя энергия энергия \(U_2\) в состоянии 2, независимо от того, как она попала в любое состояние. Таким образом, изменение внутренней энергии
Система имеет внутреннюю энергию \(U_1\) в состоянии 1, и у нее есть внутренняя энергия энергия \(U_2\) в состоянии 2, независимо от того, как она попала в любое состояние. Таким образом, изменение внутренней энергии
\[\Delta U = U_2 – U_1\]
не зависит от того, что вызвало это изменение. Другими словами, \(\delta U\) не зависит от пути . Под путем мы подразумеваем способ добраться из начальной точки в конечную. Почему важна эта независимость? И \(Q\), и \(W\) зависит от пути , но \(\Delta U\) не зависит (уравнение \ref{first}). Эта независимость от пути означает, что внутреннюю энергию \(U\) легче учитывать, чем теплопередачу или выполненную работу.
Пример \(\PageIndex{1}\): расчет изменения внутренней энергии – одно и то же изменение \(U\) вызывается двумя различными процессами система совершает работу 10,00 Дж. Затем из системы передается 25,00 Дж тепла, а над системой совершается работа 4,00 Дж. Каково чистое изменение внутренней энергии системы?
 а) Всего в систему передается 15,00 Дж теплоты, а работа совершает всего 6,00 Дж. Изменение внутренней энергии равно \(\дельта U = Q – W = 9,00 \, Дж\). (b) Теплопередача удаляет из системы 150,00 Дж, а работа прибавляет 159 Дж.0,00 Дж в него, производя увеличение внутренней энергии на 9,00 Дж. Если система начинается в одном и том же состоянии в (а) и (б), она в конечном итоге окажется в одном и том же конечном состоянии в любом случае — ее конечное состояние связано с внутренней энергией, а не с тем, как эта энергия была приобретена.
а) Всего в систему передается 15,00 Дж теплоты, а работа совершает всего 6,00 Дж. Изменение внутренней энергии равно \(\дельта U = Q – W = 9,00 \, Дж\). (b) Теплопередача удаляет из системы 150,00 Дж, а работа прибавляет 159 Дж.0,00 Дж в него, производя увеличение внутренней энергии на 9,00 Дж. Если система начинается в одном и том же состоянии в (а) и (б), она в конечном итоге окажется в одном и том же конечном состоянии в любом случае — ее конечное состояние связано с внутренней энергией, а не с тем, как эта энергия была приобретена.Стратегия
В части (a) мы должны сначала найти чистую теплопередачу и чистую работу, выполненную на основе данной информации. Затем первый закон термодинамики (уравнение \ref{first}).
можно использовать для определения изменения внутренней энергии. В части (b) даны чистая теплопередача и проделанная работа, поэтому уравнение можно использовать напрямую.
Решение для (a)
Чистая теплопередача – это теплопередача в систему за вычетом теплопередачи из системы, или
\[ \begin{align*} Q &= 40. 00 \, J – 25.00 \, J \\[5pt] &= 15.00 \, J \end{align*}\]
00 \, J – 25.00 \, J \\[5pt] &= 15.00 \, J \end{align*}\]
Аналогично, общая работа равна работе, выполненной системой, за вычетом работы, выполненной системой, или
\[ \begin{align*} W &= 10.00 \, J – 4.00 \, J \\[5pt] &= 6.00 \, J. \end{align*}\]
Обсуждение (а)
Независимо от того, смотрите ли вы на общий процесс или разбиваете его на этапы, изменение внутренней энергии одинаково.
Решение для (b)
Здесь чистая теплопередача и полная работа непосредственно равны \(Q = -150,00 \, Дж\) и \(W = -159,00 \, Дж\), так что
\[ \begin{align*} \Delta U &= Q – W = -150.00 – (-159.00) \\[5pt] &= 9.00 \, J. \end{align*}\]
Обсуждение на (b)
Совершенно другой процесс в части (b) дает те же 9Изменение внутренней энергии на 0,00 Дж, как в части (а). Обратите внимание, что изменение в системе в обеих частях связано с \(\Дельта U\), а не с отдельными задействованными \(Q\) или \(W\). Система оказывается в том же состоянии как в (a), так и в (b). Части (а) и (б) представляют два разных пути, по которым система должна следовать между одними и теми же начальной и конечной точками, и изменение внутренней энергии для каждого одинаково — оно не зависит от пути.
Система оказывается в том же состоянии как в (a), так и в (b). Части (а) и (б) представляют два разных пути, по которым система должна следовать между одними и теми же начальной и конечной точками, и изменение внутренней энергии для каждого одинаково — оно не зависит от пути.
Метаболизм человека и первый закон термодинамики
Метаболизм человека – это преобразование пищи в теплопередачу, работу и накопление жира. Метаболизм — интересный пример действия первого закона термодинамики. Теперь мы еще раз взглянем на эти темы через первый закон термодинамики. Рассматривая тело как интересующую нас систему, мы можем использовать первый закон для изучения теплопередачи, выполнения работы и внутренней энергии в различных видах деятельности, от сна до тяжелых упражнений. Каковы некоторые из основных характеристик теплообмена, совершения работы и энергии в организме? Во-первых, температура тела обычно поддерживается постоянной за счет передачи тепла в окружающую среду. Это означает, что \(Q\) отрицательно. Другой факт заключается в том, что тело обычно воздействует на внешний мир. Это означает, что \(W\) положительно. В таких ситуациях тело теряет внутреннюю энергию, так как \(\Delta U = Q – W\) отрицательна.
Это означает, что \(Q\) отрицательно. Другой факт заключается в том, что тело обычно воздействует на внешний мир. Это означает, что \(W\) положительно. В таких ситуациях тело теряет внутреннюю энергию, так как \(\Delta U = Q – W\) отрицательна.
Теперь рассмотрим последствия еды. Прием пищи увеличивает внутреннюю энергию тела за счет добавления химической потенциальной энергии (это неромантичный взгляд на хороший стейк). Тело усваивает всю пищу, которую мы потребляем. По сути, обмен веществ представляет собой процесс окисления, при котором высвобождается химическая потенциальная энергия пищи. Это означает, что потребление пищи осуществляется в форме работы. Энергия пищи сообщается в специальной единице, известной как калория. Эта энергия измеряется путем сжигания пищи в калориметре, так определяются единицы измерения.
В химии и биохимии одна калория (обозначается строчными буквами как с) определяется как энергия (или теплопередача), необходимая для повышения температуры одного грамма чистой воды на один градус Цельсия. Диетологи и люди, следящие за весом, обычно используют диетических калорий, которые часто называют калориями ( пишется с большой буквы C). Одна пищевая калория — это энергия, необходимая для повышения температуры одного килограммов воды на один градус Цельсия. Это означает, что для химика одна диетическая калория равна одной килокалории, и нужно быть осторожным, чтобы не путать их.
Диетологи и люди, следящие за весом, обычно используют диетических калорий, которые часто называют калориями ( пишется с большой буквы C). Одна пищевая калория — это энергия, необходимая для повышения температуры одного килограммов воды на один градус Цельсия. Это означает, что для химика одна диетическая калория равна одной килокалории, и нужно быть осторожным, чтобы не путать их.
Опять же, рассмотрим внутреннюю энергию, потерянную телом. Эта внутренняя энергия может быть использована в трех направлениях: для теплопередачи, для выполнения работы и для накопления жира (крошечная часть также идет на восстановление и рост клеток). Теплообмен и совершение работы забирают внутреннюю энергию из организма, а пища возвращает ее. Если вы едите только нужное количество пищи, то ваша средняя внутренняя энергия остается постоянной. Все, что вы теряете при теплопередаче и выполнении работы, заменяется пищей, так что в долгосрочной перспективе \(\Delta U = 0\). Если вы постоянно переедаете, то \(\Дельта U\) всегда положительна, и ваше тело откладывает эту дополнительную внутреннюю энергию в виде жира. Обратное верно, если вы едите слишком мало. Если значение \(\Delta U\) отрицательное в течение нескольких дней, то организм метаболизирует собственный жир для поддержания температуры тела и выполнения работы, требующей энергии от тела. Этот процесс заключается в том, как диета приводит к потере веса.
Если вы постоянно переедаете, то \(\Дельта U\) всегда положительна, и ваше тело откладывает эту дополнительную внутреннюю энергию в виде жира. Обратное верно, если вы едите слишком мало. Если значение \(\Delta U\) отрицательное в течение нескольких дней, то организм метаболизирует собственный жир для поддержания температуры тела и выполнения работы, требующей энергии от тела. Этот процесс заключается в том, как диета приводит к потере веса.
Жизнь не всегда так проста, как знает каждый, кто сидит на диете. Организм накапливает жир или усваивает его, только если потребление энергии изменяется в течение нескольких дней. После того, как вы сели на основную диету, следующая будет менее успешной, потому что ваше тело меняет реакцию на низкое потребление энергии. Ваш основной уровень метаболизма (BMR) — это скорость, с которой пища преобразуется в теплопередачу и совершается работа, когда тело находится в полном покое. Организм регулирует скорость основного обмена, чтобы частично компенсировать переедание или недоедание. Тело снизит скорость метаболизма, а не устранит собственный жир, чтобы заменить потерянное потребление пищи. Вы будете легче остывать и чувствовать себя менее энергичным в результате более низкой скорости обмена веществ, и вы не будете терять вес так быстро, как раньше. Упражнения помогают похудеть, потому что они производят как теплопередачу от вашего тела, так и работу, а также повышают скорость метаболизма, даже когда вы находитесь в состоянии покоя. Снижению веса способствует также довольно низкая эффективность преобразования внутренней энергии тела в работу, так что потери внутренней энергии в результате выполнения работы намного больше, чем выполненная работа. Следует, однако, отметить, что живые системы не в тепловом равновесии.
Тело снизит скорость метаболизма, а не устранит собственный жир, чтобы заменить потерянное потребление пищи. Вы будете легче остывать и чувствовать себя менее энергичным в результате более низкой скорости обмена веществ, и вы не будете терять вес так быстро, как раньше. Упражнения помогают похудеть, потому что они производят как теплопередачу от вашего тела, так и работу, а также повышают скорость метаболизма, даже когда вы находитесь в состоянии покоя. Снижению веса способствует также довольно низкая эффективность преобразования внутренней энергии тела в работу, так что потери внутренней энергии в результате выполнения работы намного больше, чем выполненная работа. Следует, однако, отметить, что живые системы не в тепловом равновесии.
Тело дает нам отличный показатель того, что многие термодинамические процессы являются необратимыми . Необратимый процесс может идти в одном направлении, но не в обратном, при заданном наборе условий. Например, хотя жировые отложения могут быть преобразованы для выполнения работы и передачи тепла, работа, совершаемая над телом, и перенос тепла в него не могут быть преобразованы в жировые отложения. В противном случае мы могли бы пропустить обед, загорая или спускаясь по лестнице. Другим примером необратимого термодинамического процесса является фотосинтез. Этот процесс представляет собой поглощение растениями одной формы энергии — света — и преобразование ее в химическую потенциальную энергию. Оба применения первого закона термодинамики проиллюстрированы на рисунке \(\PageIndex{4}\). Одним из больших преимуществ законов сохранения, таких как первый закон термодинамики, является то, что они точно описывают начальную и конечную точки сложных процессов, таких как метаболизм и фотосинтез, без учета промежуточных осложнений.
В противном случае мы могли бы пропустить обед, загорая или спускаясь по лестнице. Другим примером необратимого термодинамического процесса является фотосинтез. Этот процесс представляет собой поглощение растениями одной формы энергии — света — и преобразование ее в химическую потенциальную энергию. Оба применения первого закона термодинамики проиллюстрированы на рисунке \(\PageIndex{4}\). Одним из больших преимуществ законов сохранения, таких как первый закон термодинамики, является то, что они точно описывают начальную и конечную точки сложных процессов, таких как метаболизм и фотосинтез, без учета промежуточных осложнений.
 Этот процесс называется фотосинтезом.
Этот процесс называется фотосинтезом.Резюме
В таблице представлена сводка терминов, относящихся к первому закону термодинамики.
| Срок | Определение |
|---|---|
| \(У\) | Внутренняя энергия — сумма кинетической и потенциальной энергий атомов и молекул системы. Можно разделить на множество подкатегорий, таких как тепловая и химическая энергия. Зависит только от состояния системы (например, от ее \(P\), \(V\) и \(T\), а не от того, как энергия поступила в систему. Изменение внутренней энергии не зависит от пути9.0221 |
| \(Q\) | Тепло — энергия, передаваемая из-за разницы температур. Характеризуется беспорядочным движением молекул. Сильно зависит от пути. Вход \(Q\) в систему положителен. |
| \(Вт\) | Работа — энергия, переданная силой, движущейся на расстояние. Организованный, упорядоченный процесс. Зависит от пути. \(W\), совершаемая системой (либо против внешней силы, либо для увеличения объема системы), положительна. |
- Первый закон термодинамики записывается как \(\Delta U = Q – W\), где \(\Delta U\) – изменение внутренней энергии системы, \(Q\) – чистая теплопередача (сумма всей теплопередачи в систему и из системы), а \(W\) – чистая выполненная работа (сумма всей работы, выполненной системой или системой).
- И \(Q\), и \(W\) представляют собой транзитную энергию; только \(\Delta U\) представляет собой независимую величину, которую можно сохранить.
- Внутренняя энергия \(U\) системы зависит только от состояния системы, а не от того, как она достигла этого состояния.
- Обмен веществ живых организмов и фотосинтез растений являются специализированными видами теплообмена, совершения работы и внутренней энергии систем.

Глоссарий
- первый закон термодинамики
- утверждает, что изменение внутренней энергии системы равно чистому переносу тепла в система минус чистая работа, выполненная система
- внутренняя энергия
- сумма кинетической и потенциальной энергий атомов и молекул системы
- метаболизм человека
- преобразование пищи в теплопередачу, работу и накопленный жир
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- ОпенСтакс
- Лицензия
- СС BY
- Версия лицензии
- 4,0
- Программа OER или Publisher
- ОпенСтакс
- Показать оглавление
- нет
- Теги
- первый закон термодинамики
- метаболизм человека
- внутренняя энергия
Первый закон термодинамики | Физика |
Цели обучения
К концу этого раздела вы сможете:
- Дать определение первому закону термодинамики.

- Опишите, как сохранение энергии связано с первым законом термодинамики.
- Определить случаи применения первого закона термодинамики в повседневных ситуациях, включая биологический метаболизм.
- Рассчитать изменения внутренней энергии системы после учета теплопередачи и выполненной работы.
Рис. 1. Этот кипящий чайник представляет энергию в движении. Вода в чайнике превращается в водяной пар, потому что тепло передается от плиты к чайнику. По мере того, как вся система нагревается, совершается работа — от испарения воды до свиста чайника. (кредит: Джина Гамильтон)
Если нас интересует, как теплопередача преобразуется в работу, то важен принцип сохранения энергии. Первый закон термодинамики применяет принцип сохранения энергии к системам, в которых передача тепла и совершение работы являются методами передачи энергии в систему и из нее. первый закон термодинамики гласит, что изменение внутренней энергии системы равно чистому переносу тепла в систему за вычетом чистой выполненной работы по система. В форме уравнения первый закон термодинамики выглядит так: Δ U = Q − Вт .
В форме уравнения первый закон термодинамики выглядит так: Δ U = Q − Вт .
Здесь Δ U — изменение внутренней энергии U системы. Q представляет собой чистое тепло, переданное в систему , то есть Q представляет собой сумму всего теплопередачи в систему и из нее. W это чистая работа, выполненная системой — то есть Вт — это сумма всей работы, выполненной системой или над ней. Мы используем следующие соглашения о знаках: если Q положительное, то в систему идет чистый перенос тепла; если Вт положительно, то система совершает чистую работу. Таким образом, положительный Q добавляет энергию в систему, а положительный W забирает энергию из системы. Таким образом, Δ U = Q − Вт . Обратите также внимание, что если в систему передается больше тепла, чем совершается работа, разница сохраняется в виде внутренней энергии. Хорошим примером этого являются тепловые двигатели — в них происходит передача тепла, чтобы они могли совершать работу. (См. рис. 2.) Теперь мы рассмотрим Q , W и Δ U далее.
Хорошим примером этого являются тепловые двигатели — в них происходит передача тепла, чтобы они могли совершать работу. (См. рис. 2.) Теперь мы рассмотрим Q , W и Δ U далее.
Рис. 2. Первый закон термодинамики — это принцип сохранения энергии, установленный для системы, в которой теплота и работа являются методами передачи энергии для системы, находящейся в тепловом равновесии. Q представляет чистую теплопередачу — это сумма всех теплопередач в систему и из нее. Q положителен для чистого теплопереноса в систему. Вт — это общая работа, выполненная системой. W является положительным, когда система выполняет больше работы, чем на ней. Изменение внутренней энергии системы, Δ U , связано с теплом и работой по первому закону термодинамики, Δ U = Q – Вт .
Создание связей: закон термодинамики и закон сохранения энергии
Первый закон термодинамики на самом деле является законом сохранения энергии, сформулированным в форме, наиболее полезной в термодинамике. Первый закон устанавливает связь между теплопередачей, выполненной работой и изменением внутренней энергии системы.
Первый закон устанавливает связь между теплопередачей, выполненной работой и изменением внутренней энергии системы.
Нагрев
Q и Работа Вт Теплопередача ( Q ) и выполнение работы ( W ) являются двумя повседневными способами подачи энергии в систему или ее вывода из системы. Процессы совсем другие. Теплопередача, менее организованный процесс, обусловлена разницей температур. Работа, вполне организованный процесс, включает в себя действие макроскопической силы на расстоянии. Тем не менее, теплота и работа могут давать одинаковые результаты. Например, и то, и другое может вызвать повышение температуры. Передача тепла в систему, например, когда солнце нагревает воздух в велосипедной шине, может повысить его температуру, и, таким образом, над системой может совершаться работа, например, когда велосипедист накачивает воздух в шину. После того, как произошло повышение температуры, невозможно сказать, было ли оно вызвано теплопередачей или совершением работы. Эта неопределенность является важным моментом. Теплопередача и работа — это энергия в пути — ни одна из них не хранится как таковая в системе. Однако оба могут изменить внутреннюю энергию У системы. Внутренняя энергия — это форма энергии, совершенно отличная от теплоты или работы.
Эта неопределенность является важным моментом. Теплопередача и работа — это энергия в пути — ни одна из них не хранится как таковая в системе. Однако оба могут изменить внутреннюю энергию У системы. Внутренняя энергия — это форма энергии, совершенно отличная от теплоты или работы.
Внутренняя энергия
U Мы можем думать о внутренней энергии системы двумя разными, но непротиворечивыми способами. Первый — это атомно-молекулярный взгляд, который исследует систему в атомном и молекулярном масштабе. внутренняя энергия U системы представляет собой сумму кинетической и потенциальной энергий ее атомов и молекул. Напомним, что кинетическая плюс потенциальная энергия называется механической энергией. Таким образом, внутренняя энергия представляет собой сумму атомной и молекулярной механической энергии. Поскольку невозможно уследить за всеми отдельными атомами и молекулами, мы должны иметь дело со средними значениями и распределениями. Второй способ представления внутренней энергии системы — ее макроскопические характеристики, которые очень похожи на средние атомные и молекулярные значения.
Второй способ представления внутренней энергии системы — ее макроскопические характеристики, которые очень похожи на средние атомные и молекулярные значения.
Макроскопически мы определяем изменение внутренней энергии Δ U как соответствующее первому закону термодинамики: Δ U = Q − Вт .
Многие детальные эксперименты подтвердили, что Δ U = Q − Вт , где Δ U — изменение полной кинетической и потенциальной энергии всех атомов и молекул в системе. Экспериментально установлено также, что внутренняя энергия U системы зависит только от состояния системы и не как дошло до такого состояния . Более конкретно, U оказывается функцией нескольких макроскопических величин (например, давления, объема и температуры), не зависящих от прошлой истории, например, от того, происходил ли теплообмен или совершалась работа. Эта независимость означает, что если мы знаем состояние системы, мы можем рассчитать изменения ее внутренней энергии U по нескольким макроскопическим переменным.
Установление соединений: макроскопическое и микроскопическое
В термодинамике мы часто используем макроскопическую картину при расчетах поведения системы, в то время как атомарная и молекулярная картина дает основные объяснения в терминах средних значений и распределений. Мы еще увидим это в следующих разделах этой главы. Например, в теме энтропии расчеты будут производиться с использованием атомарно-молекулярного представления.
Чтобы получить лучшее представление о внутренней энергии системы, давайте рассмотрим систему, переходящую из состояния 1 в состояние 2. Внутренняя энергия системы равна 9.0050 U 1 в Состоянии 1, и имеет внутреннюю энергию U 2 в Состоянии 2, независимо от того, как он попал в любое состояние. Таким образом, изменение внутренней энергии Δ U = U 2 − U 1 не зависит от того, что вызвало изменение. Другими словами, Δ U не зависит от пути . Под путем мы подразумеваем способ добраться из начальной точки в конечную. Почему важна эта независимость? Обратите внимание, что Δ U = Q − Вт . И Q , и W зависят от пути , а Δ U — нет. Эта независимость от пути означает, что внутреннюю энергию U легче учитывать, чем теплопередачу или выполненную работу.
Другими словами, Δ U не зависит от пути . Под путем мы подразумеваем способ добраться из начальной точки в конечную. Почему важна эта независимость? Обратите внимание, что Δ U = Q − Вт . И Q , и W зависят от пути , а Δ U — нет. Эта независимость от пути означает, что внутреннюю энергию U легче учитывать, чем теплопередачу или выполненную работу.
Пример 1. Расчет изменения внутренней энергии: одно и то же изменение
U производится двумя различными процессами- Предположим, что системе передается теплота 40,00 Дж, в то время как система совершает работу 10,00 Дж. Затем из системы передается 25,00 Дж тепла, а над системой совершается работа 4,00 Дж. Каково чистое изменение внутренней энергии системы?
- Как изменится внутренняя энергия системы, если из системы будет передано 150,00 Дж теплоты, а над системой будет совершено 159,00 Дж работы? (См.
 рис. 3).
рис. 3).
Рис. 3. Два разных процесса вызывают одно и то же изменение в системе. (a) Всего в систему поступает 15,00 Дж теплоты, а работа отнимает всего 6,00 Дж. Изменение внутренней энергии равно ΔU=Q−W=9,00 Дж. (b) Теплопередачей отводится 150,00 Дж из система во время работы ставит 1590,00 Дж в него, производя увеличение внутренней энергии на 9,00 Дж. Если система начинается в одном и том же состоянии в (а) и (б), она в конечном итоге окажется в одном и том же конечном состоянии в любом случае — ее конечное состояние связано с внутренней энергией, а не с тем, как эта энергия была приобретена.
Стратегия
В части 1 мы должны сначала найти чистую теплопередачу и чистую работу, выполненную на основе данной информации. Затем можно использовать первый закон термодинамики (Δ U = Q − Вт ), чтобы найти изменение внутренней энергии. В части (b) даны чистая теплопередача и проделанная работа, поэтому уравнение можно использовать напрямую.
Решение для части 1
Чистая теплопередача представляет собой теплопередачу в систему за вычетом теплопередачи из системы, или
Q = 40,00 Дж − 25,00 Дж = 15,00 Дж.
Точно так же общая работа представляет собой работу, выполненную системой, за вычетом работы, выполненной системой, или
Вт = 10,00 Дж – 4,00 Дж = 6,00 Дж.
Таким образом, изменение внутренней энергии определяется первым законом термодинамики:
Δ U = Ом − Вт = 15,00 Дж − 6,00 Дж = 9,00 Дж.
Мы также можем найти изменение внутренней энергии для каждого из двух шагов. Во -первых, рассмотрим 40,00 j теплопередачи в и 10,00 j тренировки, или Δ U 1 = Q 1 – W 1 = 40,00 J – 10,00 J = 30,00 J.
9 = 40,00 J – 10,00 J = 30,00 J.
9 = 40,00 J – 10,00 J = 30,00 J.
9 = 40,00 J – 10,00 J = 30,00.00. Теперь рассмотрим 25,00 Дж теплопередачи наружу и 4,00 Дж работы внутрь, или
∆ U 2 = Q 2 − Вт 2 = –25,00 Дж −(−4,00 Дж) = –21,00 Дж.
Общее изменение представляет собой сумму этих двух шагов, или Δ U = Δ U 1 + Δ U 2 = 30,00 Дж + (-21,00 Дж) = 9,00 Дж
2
1
Независимо от того, смотрите ли вы на общий процесс или разбиваете его на этапы, изменение внутренней энергии одинаково.
Решение для части 2
Здесь чистая теплопередача и полная работа непосредственно равны Q = –150,00 J и W = –159,00 J, так что
Δ U = Q – W = –150,00 J – ( – 159,00 J) = 9,00 J.
Dursing On Dursing On On Dursing On On Dressing On On On Dursing On On On Dressing ON ON ON DRESSIC ON ON ON DRESSIC Часть 2
Совсем другой процесс в части 2 вызывает то же изменение внутренней энергии на 9,00 Дж, что и в части 1. Обратите внимание, что изменение в системе в обеих частях связано с Δ U , а не с отдельными Q с или W задействован. Система заканчивается на же состояние в обеих частях. Части 1 и 2 представляют два разных пути, по которым система должна следовать между одними и теми же начальной и конечной точками, и изменение внутренней энергии для каждого одинаково – оно не зависит от пути.
Обратите внимание, что изменение в системе в обеих частях связано с Δ U , а не с отдельными Q с или W задействован. Система заканчивается на же состояние в обеих частях. Части 1 и 2 представляют два разных пути, по которым система должна следовать между одними и теми же начальной и конечной точками, и изменение внутренней энергии для каждого одинаково – оно не зависит от пути.
Метаболизм человека и первый закон термодинамики
Метаболизм человека — это преобразование пищи в теплопередачу, работу и накопление жира. Метаболизм — интересный пример действия первого закона термодинамики. Теперь мы еще раз взглянем на эти темы через первый закон термодинамики. Рассматривая тело как интересующую нас систему, мы можем использовать первый закон для изучения теплопередачи, выполнения работы и внутренней энергии в различных видах деятельности, от сна до тяжелых упражнений. Каковы некоторые из основных характеристик теплообмена, совершения работы и энергии в организме? Во-первых, температура тела обычно поддерживается постоянной за счет передачи тепла в окружающую среду. Это означает Q отрицательный. Другой факт заключается в том, что тело обычно воздействует на внешний мир. Это означает, что Вт является положительным. В таких ситуациях тело теряет внутреннюю энергию, поскольку Δ U = Q − Вт отрицательно.
Это означает Q отрицательный. Другой факт заключается в том, что тело обычно воздействует на внешний мир. Это означает, что Вт является положительным. В таких ситуациях тело теряет внутреннюю энергию, поскольку Δ U = Q − Вт отрицательно.
Теперь рассмотрим последствия еды. Прием пищи увеличивает внутреннюю энергию тела за счет добавления химической потенциальной энергии (это неромантичный взгляд на хороший стейк). Тело усваивает всю пищу, которую мы потребляем. По сути, обмен веществ представляет собой процесс окисления, при котором высвобождается химическая потенциальная энергия пищи. Это означает, что потребление пищи осуществляется в форме работы. Энергия пищи сообщается в специальной единице, известной как калория. Эта энергия измеряется путем сжигания пищи в калориметре, так определяются единицы измерения.
В химии и биохимии одна калория (обозначается строчными буквами как с) определяется как энергия (или теплопередача), необходимая для повышения температуры одного грамма чистой воды на один градус Цельсия. Диетологи и люди, следящие за весом, обычно используют диетических калорий, которые часто называют калориями ( пишется с большой буквы C). Одна пищевая калория — это энергия, необходимая для повышения температуры одного килограммов воды на один градус Цельсия. Это означает, что для химика одна диетическая калория равна одной килокалории, и нужно быть осторожным, чтобы не путать их.
Диетологи и люди, следящие за весом, обычно используют диетических калорий, которые часто называют калориями ( пишется с большой буквы C). Одна пищевая калория — это энергия, необходимая для повышения температуры одного килограммов воды на один градус Цельсия. Это означает, что для химика одна диетическая калория равна одной килокалории, и нужно быть осторожным, чтобы не путать их.
Опять же, рассмотрим внутреннюю энергию, потерянную телом. Эта внутренняя энергия может быть использована в трех направлениях: для теплопередачи, для выполнения работы и для накопления жира (крошечная часть также идет на восстановление и рост клеток). Теплообмен и совершение работы забирают внутреннюю энергию из организма, а пища возвращает ее. Если вы едите только нужное количество пищи, то ваша средняя внутренняя энергия остается постоянной. Все, что вы теряете при теплопередаче и выполнении работы, заменяется пищей, так что в долгосрочной перспективе Δ U =0. Если вы постоянно переедаете, то Δ U всегда положительна, и ваше тело откладывает эту дополнительную внутреннюю энергию в виде жира. Обратное верно, если вы едите слишком мало. Если Δ U отрицателен в течение нескольких дней, то организм метаболизирует собственный жир для поддержания температуры тела и выполнения работы, забирающей энергию у организма. Этот процесс заключается в том, как диета приводит к потере веса.
Если вы постоянно переедаете, то Δ U всегда положительна, и ваше тело откладывает эту дополнительную внутреннюю энергию в виде жира. Обратное верно, если вы едите слишком мало. Если Δ U отрицателен в течение нескольких дней, то организм метаболизирует собственный жир для поддержания температуры тела и выполнения работы, забирающей энергию у организма. Этот процесс заключается в том, как диета приводит к потере веса.
Жизнь не всегда так проста, как знает любой человек, сидящий на диете. Организм накапливает жир или усваивает его, только если потребление энергии изменяется в течение нескольких дней. После того, как вы сели на основную диету, следующая будет менее успешной, потому что ваше тело меняет реакцию на низкое потребление энергии. Ваш основной уровень метаболизма (BMR) — это скорость, с которой пища преобразуется в теплопередачу и совершается работа, когда тело находится в полном покое. Организм регулирует скорость основного обмена, чтобы частично компенсировать переедание или недоедание. Тело снизит скорость метаболизма, а не устранит собственный жир, чтобы заменить потерянное потребление пищи. Вы будете легче остывать и чувствовать себя менее энергичным в результате более низкой скорости обмена веществ, и вы не будете терять вес так быстро, как раньше. Упражнения помогают похудеть, потому что они производят как теплопередачу от вашего тела, так и работу, а также повышают скорость метаболизма, даже когда вы находитесь в состоянии покоя. Снижению веса способствует также довольно низкая эффективность преобразования внутренней энергии тела в работу, так что потери внутренней энергии в результате выполнения работы намного больше, чем выполненная работа. Следует, однако, отметить, что живые системы не в тепловом равновесии.
Тело снизит скорость метаболизма, а не устранит собственный жир, чтобы заменить потерянное потребление пищи. Вы будете легче остывать и чувствовать себя менее энергичным в результате более низкой скорости обмена веществ, и вы не будете терять вес так быстро, как раньше. Упражнения помогают похудеть, потому что они производят как теплопередачу от вашего тела, так и работу, а также повышают скорость метаболизма, даже когда вы находитесь в состоянии покоя. Снижению веса способствует также довольно низкая эффективность преобразования внутренней энергии тела в работу, так что потери внутренней энергии в результате выполнения работы намного больше, чем выполненная работа. Следует, однако, отметить, что живые системы не в тепловом равновесии.
Тело дает нам отличный показатель того, что многие термодинамические процессы являются необратимыми . Необратимый процесс может идти в одном направлении, но не в обратном, при заданном наборе условий. Например, хотя жировые отложения могут быть преобразованы для выполнения работы и передачи тепла, работа, совершаемая над телом, и перенос тепла в него не могут быть преобразованы в жировые отложения.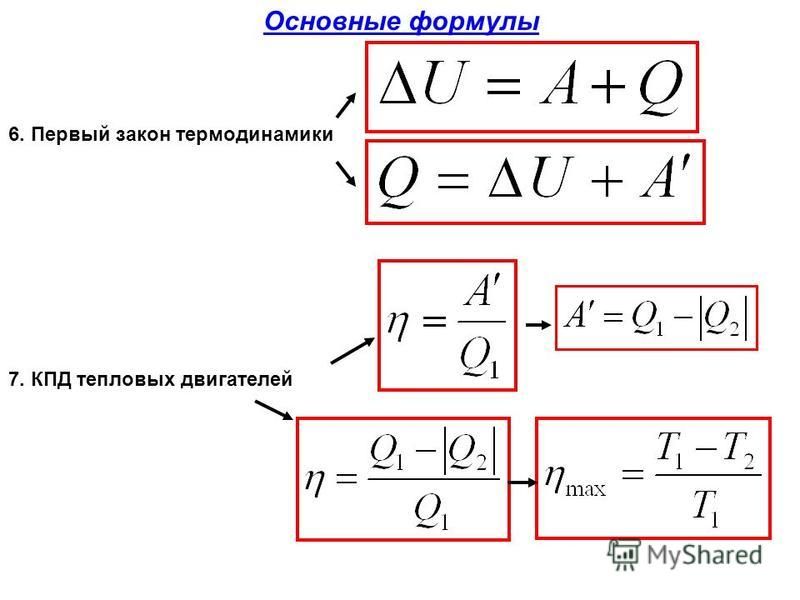 В противном случае мы могли бы пропустить обед, загорая или спускаясь по лестнице. Другим примером необратимого термодинамического процесса является фотосинтез. Этот процесс представляет собой поглощение растениями одной формы энергии — света — и преобразование ее в химическую потенциальную энергию. Оба применения первого закона термодинамики проиллюстрированы на рис. 4. Большое преимущество законов сохранения, таких как первый закон термодинамики, заключается в том, что они точно описывают начало и конец сложных процессов, таких как метаболизм и фотосинтез, без учета осложнения между ними. В Таблице 1 представлена сводка терминов, относящихся к первому закону термодинамики.
В противном случае мы могли бы пропустить обед, загорая или спускаясь по лестнице. Другим примером необратимого термодинамического процесса является фотосинтез. Этот процесс представляет собой поглощение растениями одной формы энергии — света — и преобразование ее в химическую потенциальную энергию. Оба применения первого закона термодинамики проиллюстрированы на рис. 4. Большое преимущество законов сохранения, таких как первый закон термодинамики, заключается в том, что они точно описывают начало и конец сложных процессов, таких как метаболизм и фотосинтез, без учета осложнения между ними. В Таблице 1 представлена сводка терминов, относящихся к первому закону термодинамики.
Рис. 4. (a) Применение первого закона термодинамики к обмену веществ. Выводимая из тела теплота (Q) и работа, совершаемая телом (W), забирают внутреннюю энергию, а прием пищи замещает ее. (Прием пищи можно рассматривать как работу, совершаемую телом.) (b) Растения преобразуют часть лучистой теплопередачи при солнечном свете в накопленную химическую энергию. Этот процесс называется фотосинтезом.
Этот процесс называется фотосинтезом.
| Таблица 1. Сводка терминов для первого закона термодинамики, ΔU = Q − W | |
|---|---|
| Срок | Определение |
| У | Внутренняя энергия — сумма кинетической и потенциальной энергий атомов и молекул системы. Можно разделить на множество подкатегорий, таких как тепловая и химическая энергия. Зависит только от состояния системы (например, ее P , V и T ), а не от того, как энергия попала в систему. Изменение внутренней энергии не зависит от пути. |
| К | Тепло — энергия, передаваемая из-за разницы температур. Характеризуется беспорядочным движением молекул. Сильно зависит от пути. Q вход в систему положительный. |
| Ш | Работа — энергия, переданная силой, движущейся на расстояние. Организованный, упорядоченный процесс. Зависит от пути. Вт , совершаемое системой (либо против внешней силы, либо для увеличения объема системы), положительна. |
РЕЗЮМИ РЕЗЮМЕ
- Первый закон термодинамики приведен в виде Δ U = Q – W , где Δ U – это изменение во внутренней энергии системы, Q IS IS the y. the Δ the is is is is is is the y. the y . чистая теплопередача (сумма всей теплопередачи в систему и из нее), а Вт является чистой выполненной работой (сумма всей работы, выполненной системой или системой).
- Оба Q и W являются энергией в пути; только Δ U представляет собой независимую величину, которую можно хранить.
- Внутренняя энергия U системы зависит только от состояния системы, а не от того, как она достигла этого состояния.

- Обмен веществ живых организмов и фотосинтез растений являются специализированными видами теплообмена, совершения работы и внутренней энергии систем.
Концептуальные вопросы
- Опишите фотографию чайника в начале этого раздела с точки зрения передачи тепла, выполненной работы и внутренней энергии. Как передается тепло? Какая работа сделана и что она делает? Как чайник сохраняет свою внутреннюю энергию?
- Первый закон термодинамики и закон сохранения энергии, как обсуждалось в книге «Сохранение энергии», явно связаны между собой. Чем они различаются по рассматриваемым видам энергии?
- Теплопередача Q и выполненная работа Вт всегда представляют собой энергию в пути, тогда как внутренняя энергия U является энергией, хранящейся в системе. Приведите пример каждого типа энергии и конкретно укажите, как она либо находится в пути, либо находится в системе.
- Чем отличаются теплопередача и внутренняя энергия? В частности, что можно хранить как таковое в системе, а что нельзя?
- Если вы сбежите по лестнице и остановитесь, что произойдет с вашей кинетической энергией и вашей начальной гравитационной потенциальной энергией?
- Объясните, как энергию пищи (калории) можно рассматривать как молекулярную потенциальную энергию (в соответствии с атомарным и молекулярным определением внутренней энергии).

- Определите тип энергии, передаваемой вашему телу в каждом из следующих случаев: внутренняя энергия, теплопередача или выполнение работы: (а) купание в солнечных лучах; б) прием пищи; в) подняться на лифте на верхний этаж.
Задачи и упражнения
- Как изменится внутренняя энергия автомобиля, если в его бак залить 12,0 галлонов бензина? Энергоемкость бензина составляет 1,3 × 10 8 Дж/галлон. Все остальные факторы, например температура автомобиля, постоянны.
- Какой объем теплоты происходит от системы, если ее внутренняя энергия уменьшилась на 150 Дж при совершении работы 30,0 Дж?
- Система совершает 1,80 × 10 8 Дж работы при 7,50 × 10 8 Дж происходит передача тепла в окружающую среду. Каково изменение внутренней энергии системы при отсутствии других изменений (например, температуры или добавления топлива)?
- Как изменится внутренняя энергия системы, которая совершает работу 4,50×10 5 Дж, при этом теплопередача в систему составляет 3,00×10 6 Дж, а теплопередача 8,00×10 6 Дж.
 к окружающей среде?
к окружающей среде? - Предположим, что женщина выполняет работу 500 Дж и 9При этом в окружающую среду происходит передача 500 Дж тепла. а) Каково уменьшение ее внутренней энергии при условии отсутствия изменения температуры или потребления пищи? (То есть другого переноса энергии нет.) (б) Каков ее КПД?
- (а) Сколько энергии пищи усвоит человек в процессе выполнения работы в 35,0 кДж с КПД 5,00%? б) Какой объем теплоты передается окружающей среде, чтобы поддерживать ее температуру постоянной?
- (a) Какова средняя скорость метаболизма в ваттах у человека, который усваивает 10 500 кДж пищевой энергии за один день? б) Какую максимальную работу в джоулях он может совершить без расщепления жира при максимальном КПД 20,0 %? (c) Сравните производительность его работы с дневной мощностью двигателя мощностью 187 Вт (0,250 л.с.).
- (a) Как долго хватит энергии чашки йогурта 1470 кДж (350 ккал) на женщину, выполняющую работу мощностью 150 Вт с эффективностью 20,0% (например, при неторопливом подъеме по лестнице)? (б) Означает ли время, указанное в части (а), что легко потреблять больше энергии пищи, чем вы можете обоснованно ожидать от работы с помощью физических упражнений?
- (a) Женщина, взбирающаяся на монумент Вашингтона, усваивает 6,00 × 10 2 кДж пищевой энергии.
 Если ее КПД составляет 18,0%, сколько тепла передается окружающей среде, чтобы поддерживать ее температуру постоянной? (b) Обсудите величину теплопередачи, найденную в (a). Соответствует ли это тому, что вы быстро разогреваетесь во время тренировки?
Если ее КПД составляет 18,0%, сколько тепла передается окружающей среде, чтобы поддерживать ее температуру постоянной? (b) Обсудите величину теплопередачи, найденную в (a). Соответствует ли это тому, что вы быстро разогреваетесь во время тренировки?
Глоссарий
первый закон термодинамики: указывает, что изменение внутренней энергии системы равно чистой передаче тепла системе за вычетом чистой работы, выполненной системой
внутренняя энергия: сумма кинетической и потенциальные энергии атомов и молекул системы
метаболизм человека: преобразование пищи в теплопередачу, работу и накопление жира
Избранные решения задач и упражнений
1. 1,6 × 10 9 Дж
3. –9,30 × 10 8 Дж
5. (а) –1,0 × 10 4 Дж, или –2,39 ккал; (б) 5,00%
7. (а) 122 Вт; (б) 2.10 × 10 6 Дж; в) работа, совершаемая двигателем, равна 1,61 × 10 7 Дж; таким образом, двигатель производит работу, в 7,67 раз превышающую работу человека
9. (a) 492 кДж; (б) Это количество тепла соответствует тому факту, что вы быстро согреваетесь во время тренировки. Поскольку тело неэффективно, избыточное тепло должно рассеиваться через потоотделение, дыхание и т. д.
(a) 492 кДж; (б) Это количество тепла соответствует тому факту, что вы быстро согреваетесь во время тренировки. Поскольку тело неэффективно, избыточное тепло должно рассеиваться через потоотделение, дыхание и т. д.
Лицензии и атрибуции
Контент по лицензии CC, совместно используемый ранее
- College Physics. Автор: : Колледж OpenStax. Расположен по адресу : https://openstax.org/books/college-physics/pages/1-introduction-to-science-and-the-realm-of-physics-physical-quantities-and-units. Лицензия : CC BY: Attribution . Условия лицензии : Находится в лицензии
Первый закон термодинамики: формула, пример и уравнение
Первый закон термодинамики — один из трех фундаментальных законов термодинамики. Он выводится из закона сохранения энергии, но формулируется другим и более полезным образом для термодинамики, чтобы включить системы, в которых основным методом передачи энергии является передача тепла и работа.
Первый закон термодинамики: уравнение
Первый закон термодинамики был выведен в 19 веке Рудольфом Клаузиусом и Уильямом Томсоном. Он утверждает, что полное изменение внутренней энергии ΔU замкнутой системы равно полному теплообмену, переданному в систему Q, за вычетом полной работы, выполненной системой W.
Рисунок 1. Первый закон термодинамики. Источник: Огулкан Тезкан, StudySmarter.
Первый закон термодинамики: внутренняя энергия (U)
Внутреннюю энергию системы в меньшем масштабе можно рассматривать как накопленную сумму кинетической и потенциальной энергии ее атомов и молекул. Однако более полезно определять внутреннюю энергию в более широком масштабе, используя макроскопические величины системы, включая давление, температуру и объем, для изучения поведения системы.
Первый закон термодинамики: Теплота (Q)
Теплота (Q), измеряемая в джоулях, представляет собой энергию, которая передается молекулярным движением и столкновениями из-за разницы температур. Когда система принимается за эталон, теплота, поступающая в систему, может считаться положительной, а теплота, выходящая из системы, – отрицательной.
Когда система принимается за эталон, теплота, поступающая в систему, может считаться положительной, а теплота, выходящая из системы, – отрицательной.
Первый закон термодинамики: работа (Вт)
Работа (Вт) системы, измеряемая в джоулях, представляет собой энергию, которая передается от одной системы к другой или к ее окружению. Это общий вид механической работы.
- Когда работа выполняется системой отсчета, работа определяется как отрицательная, поскольку энергия теряется из системы отсчета и потребляется внешней системой или окружающей средой.
- Когда работа выполняется в системе отсчета, работа определяется как положительная, поскольку энергия добавляется к системе отсчета и теряется из внешней системы или окружающей среды.
Некоторые примеры положительной и отрицательной работы в зависимости от выбранной системы отсчета приведены в таблице ниже.
Примеры | Работа, совершаемая системой, положительна | Работа, совершаемая системой, отрицательна | Окружение является системой отсчета (энергия добавляется в окружение от двигателя). | Двигатель – это система отсчета (энергия двигателя передается в окружающую среду). |
Холодильники потребляют работу. | Холодильники – система отсчета (в холодильники добавляется энергия из окружающей среды). | Окружающая среда является системой отсчета (энергия теряется из окружающей среды). |
Первый закон термодинамики в дифференциальной форме
Дифференциальную форму первого закона термодинамики можно увидеть ниже. Дифференциальная форма уравнения используется для более подробного описания скорости изменения теплоты и работы и, как расширение, скорости изменения внутренней энергии системы.
∂U=∂Q-∂W
В случае работы, совершаемой в гидростатической системе, содержащей жидкости, дифференциальное уравнение можно упростить, как показано ниже, где p — давление, а V — объем системы. Следовательно, первый закон термодинамики также может быть записан, как показано ниже, при изменении объема жидкости.
Следовательно, первый закон термодинамики также может быть записан, как показано ниже, при изменении объема жидкости.
∂W=-p∂V∂U=∂Q+p∂V
Знак минус указывает на то, что изменения объема всегда противоположны знаку изменения работы. Например, если работа положительна, dV будет отрицательной, и наоборот.
Примеры первого закона термодинамики
Наиболее распространенным применением первого закона термодинамики является тепловой двигатель, который используется в поездах, транспортных средствах и т. д.
Другие приложения включают авиационные двигатели, холодильные установки и тепловые насосы.
Какую работу совершает газ, сжатый с 35 л до 15 л при постоянном внешнем давлении 3 атм?
Решение :
∂W=-p∂V=-p·(Vf-Vi)
При сжатии газа работа положительна, а dV отрицательна:
∂W=-3атм·(15л-35л)=60латм
Поскольку нам нужно преобразовать это в Джоули, мы умножаем на газовую постоянную Дж/моль К и делим на газовую постоянную 0,08206 л атм/моль К.
Latm·Jmol·KLatmmol·K
∂W=60 атм·8,31447 Дж/моль·K0,08206L·атм/моль·K=6079J
Первый закон термодинамики: термодинамические системы
Существуют три типа систем, которые могут можно наблюдать в термодинамике:
Открытые системы , которые обмениваются энергией и веществом с окружающей средой. Например, при кипячении воды в кастрюле энергия и вещество передаются из кастрюли в окружающую атмосферу в виде пара.
Закрытые системы , которые обмениваются с окружающей средой только энергией. Например, горячая чашка кофе с закрытой крышкой передает энергию от кофе в окружающую атмосферу в виде пара.
Изолированные системы , которые являются частным случаем закрытых систем, которые не передают ни энергии, ни вещества другим системам или их окружению.
 Например, идеально изолированный и закрытый резервуар с азотом не передает в окружающую среду ни энергии, ни вещества.
Например, идеально изолированный и закрытый резервуар с азотом не передает в окружающую среду ни энергии, ни вещества.
Как первый закон термодинамики применим к газам?
Газы чувствительны к изменениям макроскопических величин, таких как объем, температура и плотность. Например, при повышении температуры газы имеют тенденцию к расширению из-за увеличения кинетической энергии молекул газа. При понижении температуры газы стремятся сжаться. Для постоянного давления можно использовать приведенную ниже формулу, где p — давление, а Δv — изменение объема. Знак минус указывает на то, что работа совершается над системой.
W=-p·ΔV
С точки зрения термодинамики применимо следующее:
Когда газ расширяется, энергия передается окружающей системе. Работа совершается газом над окружающей средой. Здесь работа отрицательна (-W) по отношению к системе (газу), так как из системы выделяется энергия.

При сжатии газа энергия из окружающей среды передается газу. Над газом работают окружающие. Следовательно, работа положительна (+W) по отношению к системе (газу).
Если проделанная работа рассматривается относительно окружающей среды, то знак в уравнении становится положительным. Совершенная работа становится положительной, когда газ расширяется, а совершаемая работа становится отрицательной, когда газ сжимается.
Первый закон термодинамики. Ключевые выводы
- Термодинамика — это изучение энергии, тепла и температуры вещества.
- Первый закон термодинамики был получен из теоремы о сохранении энергии.
- Первый закон термодинамики гласит, что изменения внутренней энергии равны произведенной работе за вычетом подвода тепла.
- Наиболее распространенным применением первого закона термодинамики является тепловая машина.

Первый закон термодинамики: что это такое?
Во Вселенной существует ограниченное количество энергии, которую нельзя уничтожить или создать, а только преобразовать. (Изображение предоставлено PixaBay)Первый закон термодинамики говорит нам, что количество энергии во Вселенной постоянно и не может быть ни уничтожено, ни создано.
Таким образом, эволюция вселенной связана с постоянным преобразованием энергии из одной формы в другую. Но независимо от того, сколько звезд и планет создала Вселенная, сколько цивилизаций возникло на этих планетах, всегда будет столько же энергии, сколько было в секунду после Большого Взрыва .
Преобразование энергии — вот что заставляет наш мир работать. Люди и животные преобразуют химическую энергию съеденной ими пищи в кинетическую энергию своего движения и действия и энергию химических процессов в своих клетках. Зеленые растения поглощают энергию солнца и превращают ее в химическую энергию в виде кислорода и сахаров, из которых строятся их ткани — в процессе, известном как фотосинтез . Солнечные электростанции используют тот же солнечный свет для производства электроэнергии. Солнце, благодаря которому мы все живы, сжигает водород в своем ядре для производства света и тепла, которые нам нужны, медленно и постепенно рассеивая свою энергию в окружающем пространстве.
Солнечные электростанции используют тот же солнечный свет для производства электроэнергии. Солнце, благодаря которому мы все живы, сжигает водород в своем ядре для производства света и тепла, которые нам нужны, медленно и постепенно рассеивая свою энергию в окружающем пространстве.
Связанный: Фантомная энергия и темная гравитация: объяснение темной стороны вселенной
История первого закона термодинамики
Однако первый закон термодинамики возник не в результате изучения Вселенной, а в результате усилий ученых 17 и 18 веков понять природу тепла, по словам физика Стивен Вольфрам (открывается в новой вкладке). Выдвигались различные идеи, в том числе о том, что тепло может быть текучим веществом или результатом микроскопических частиц, из которых состоит материя, которую мы видим. К началу 19 века ученые пришли к выводу, что тепло — это форма энергии.
В то время паровой двигатель представлял собой горячую новую технологию, основанную на тепле для преобразования воды в пар, который затем мог приводить в движение сложные механические приспособления, способные выполнять все виды задач, от приведения в движение локомотивы для питания заводского оборудования. Поэтому многие одаренные умы того времени занимались вопросом, как сделать эту теплозависимую технологию более эффективной.
Поэтому многие одаренные умы того времени занимались вопросом, как сделать эту теплозависимую технологию более эффективной.
Первым, кто заложил фундамент того, что позже станет первым законом термодинамики, был немецкий физик Рудольф Клаузиус, согласно Университет Сент-Эндрюс. В 1850 году Клаузиус опубликовал статью, которая сделала его знаменитым. Название статьи несколько многословно: « О движущей силе тепла и выводимых отсюда законах тепла».
В этой статье Клаузиус заявил, что «во всех случаях, когда работа производится с помощью теплоты, потребляется количество теплоты, пропорциональное выполненной работе, и, наоборот, при затрате равного количества теплоты. совершая работу, выделяется равное количество теплоты».
Паровой двигатель и первый закон термодинамики
Но что именно означает утверждение Клаузиуса? Давайте посмотрим на старый добрый паровой двигатель.
Паровая машина состоит из камеры с подвижным поршнем. Камера может содержать воду или некоторое количество газа. Когда камера нагревается с помощью внешнего источника тепла, газ внутри расширяется (вода превращается в пар), увеличивающееся тепло вызывает большее расширение газа, что приводит к движению поршня. Затем поршень снаружи двигателя производит полезную работу (например, приводит в движение колеса локомотива).
Когда камера нагревается с помощью внешнего источника тепла, газ внутри расширяется (вода превращается в пар), увеличивающееся тепло вызывает большее расширение газа, что приводит к движению поршня. Затем поршень снаружи двигателя производит полезную работу (например, приводит в движение колеса локомотива).
Наоборот, прикладывая внешнюю силу к поршню, можно сжать газ внутри, что вызовет его нагрев. В обоих случаях количество тепла, использованного или произведенного, будет равно количеству приложенной или выполненной работы. Суммарная энергия двигателя и его окружения останется постоянной.
Первый закон термодинамики можно выразить следующим уравнением: ΔU = Q — W , где ΔU — изменение внутренней энергии, Q — теплота, подведенная к системе, а W — работа, выполненная системой.
Полная энергия системы равна подведенному теплу минус количество выполненной работы. Работа и теплота — это процессы, которые добавляют или убывают энергию.
Термодинамика и роль тепла
Дисциплина, возникшая из работ Клаузиуса и других физиков той эпохи, в том числе британца Уильяма Томсона (позже известного как первый барон Кельвин) и француза Сади Карно, стала известна как термодинамика. Тепло играет центральную роль в термодинамике, действуя как сила, которая преобразует энергию из ее сырой формы (вспомните, например, уголь) в реальную механическую работу (движение локомотива).
Термодинамика изучает не только связь между теплом и механической работой, но и роль температуры, объема и давления в обмене энергией.
Термодинамическая система имеет энтальпию , которая представляет собой сумму ее внутренней энергии в сочетании с эффектами ее давления и объема, согласно НАСА .
Энтропия — мера способности системы выполнять работу, основанная на ее упорядоченности. По существу, системы различаются по количеству работы, которую они могут выполнить на единицу тепловой энергии, в зависимости от того, насколько они организованы.
Так называемая свободная энергия Гельмгольца термодинамической системы описывает, сколько «полезной» работы может произвести замкнутая термодинамическая система при постоянной температуре и объеме.
Свободная энергия Гиббса , с другой стороны, описывает максимальную обратимую работу, которую может выполнить термодинамическая система при постоянной температуре и давлении.
Эти четыре качества плюс энергия используются для описания свойств всех термодинамических систем.
Термодинамические системы
В термодинамике существуют три типа систем. (Изображение предоставлено Getty images)В термодинамике есть три типа систем: закрытые, изолированные и открытые.
Изолированных систем практически не существует. Единственной действительно изолированной системой является сама Вселенная.
Истории по теме:
Закрытые системы стремятся быть как можно более изолированными от своего окружения и обмениваться со своим окружением только энергией, но не материей. Паровой двигатель был бы закрытой системой, но такой же была бы охлаждающая термос с чаем или белый карлик звезда постепенно теряет тепло в космическом вакууме.
Паровой двигатель был бы закрытой системой, но такой же была бы охлаждающая термос с чаем или белый карлик звезда постепенно теряет тепло в космическом вакууме.
Все живые организмы представляют собой открытые системы, обменивающиеся с окружающей средой как энергией (тепло), так и веществом (пища, пот, воздух).
Дополнительные ресурсы
Узнайте больше о первом законе термодинамики на нашем родственном веб-сайте Живая наука . Или посмотрите это забавное видео от Королевского института. Изучите все три закона термодинамики на образовательном веб-сайте Lumen Learning .
Библиография
Смит, К.В., Уильям Томсон и создание термодинамики: 1840-1855, История точных наук, Springer, 1977
https://www.jstor.org/stable/41133471
Хариш, Т. и др. и др., Первый закон термодинамики и возникновение космического пространства в неплоской Вселенной, Журнал космологии и физики астрофизики, декабрь 2019 г. https://iopscience. iop.org/article/10.1088/1475-7516/2019/12 /024
iop.org/article/10.1088/1475-7516/2019/12 /024
Зохури, Б., Первый закон термодинамики, Физическая химия, 2017 https://www.sciencedirect.com/topics/chemistry/first-law-of-thermodynamics
Britannica, Первый закон термодинамики https://www.britannica.com/science/thermodynamics/The-second- закон термодинамики
Следите за Терезой Пултаровой в Твиттере @TerezaPultarova . Следите за нами в Твиттере @Spacedotcom и в Facebook .
Присоединяйтесь к нашим космическим форумам, чтобы продолжать обсуждать последние миссии, ночное небо и многое другое! А если у вас есть новость, исправление или комментарий, сообщите нам об этом по адресу: [email protected].
Тереза — лондонский журналист, работающий в области науки и технологий, начинающий писатель-фантаст и гимнастка-любитель. Родом из Праги, Чешская Республика, она провела первые семь лет своей карьеры, работая репортером, сценаристом и ведущей различных телепрограмм Чешского общественного телевидения. Позже она сделала перерыв в карьере, чтобы продолжить образование, и добавила степень магистра естественных наук Международного космического университета во Франции к степени бакалавра журналистики и магистра культурной антропологии Карлова университета в Праге. Она работала репортером в журнале Engineering and Technology, работала внештатным сотрудником в ряде изданий, включая Live Science, Space.com, Professional Engineering, Via Satellite and Space News, а также работала научным редактором в Европейском космическом агентстве.
Позже она сделала перерыв в карьере, чтобы продолжить образование, и добавила степень магистра естественных наук Международного космического университета во Франции к степени бакалавра журналистики и магистра культурной антропологии Карлова университета в Праге. Она работала репортером в журнале Engineering and Technology, работала внештатным сотрудником в ряде изданий, включая Live Science, Space.com, Professional Engineering, Via Satellite and Space News, а также работала научным редактором в Европейском космическом агентстве.
термодинамика | Законы, определения и уравнения
- Ключевые люди:
- Макс Планк Джеймс Клерк Максвелл Гилберт Н. Льюис Дж. Уиллард Гиббс Илья Пригожин
- Похожие темы:
- нагревать энергия классическая термодинамика Транспортное уравнение Больцмана система
Просмотреть весь связанный контент →
Самые популярные вопросы
Что такое термодинамика?
Термодинамика изучает отношения между теплотой, работой, температурой и энергией. Законы термодинамики описывают, как изменяется энергия в системе и может ли система выполнять полезную работу над окружающей средой.
Законы термодинамики описывают, как изменяется энергия в системе и может ли система выполнять полезную работу над окружающей средой.
Является ли термодинамика физикой?
Да, термодинамика — это раздел физики, изучающий изменение энергии в системе. Ключевое понимание термодинамики заключается в том, что тепло — это форма энергии, соответствующая механической работе (то есть действующая на объект сила на расстоянии).
Сводка
Прочтите краткий обзор этой темы
термодинамика , наука о взаимосвязи между теплотой, работой, температурой и энергией. В широком смысле термодинамика имеет дело с переносом энергии из одного места в другое и из одной формы в другую. Ключевое понятие состоит в том, что теплота — это форма энергии, соответствующая определенному количеству механической работы.
Тепло не было официально признано формой энергии примерно до 179 г.8, когда граф Румфорд (сэр Бенджамин Томпсон), британский военный инженер, заметил, что при сверлении пушечных стволов может выделяться неограниченное количество тепла и что количество выделяемого тепла пропорционально работе, выполняемой при повороте тупого сверлильного инструмента. . Наблюдение Румфордом пропорциональности между произведенным теплом и выполненной работой лежит в основе термодинамики. Другим пионером был французский военный инженер Сади Карно, который в 1824 г. ввел понятие теплового цикла и принцип обратимости. высокотемпературный теплообмен как его движущая сила. Позже в том же столетии эти идеи были развиты Рудольфом Клаузиусом, немецким математиком и физиком, в первый и второй законы термодинамики соответственно.
. Наблюдение Румфордом пропорциональности между произведенным теплом и выполненной работой лежит в основе термодинамики. Другим пионером был французский военный инженер Сади Карно, который в 1824 г. ввел понятие теплового цикла и принцип обратимости. высокотемпературный теплообмен как его движущая сила. Позже в том же столетии эти идеи были развиты Рудольфом Клаузиусом, немецким математиком и физиком, в первый и второй законы термодинамики соответственно.
Наиболее важные законы термодинамики:
Нулевой закон термодинамики. Когда две системы находятся в тепловом равновесии с третьей системой, первые две системы находятся в тепловом равновесии друг с другом. Это свойство делает целесообразным использование термометров в качестве «третьей системы» и для определения температурной шкалы.
Первый закон термодинамики или закон сохранения энергии. Изменение внутренней энергии системы равно разнице между теплом, переданным системе из окружающей среды, и работой, совершенной системой над окружающей средой.

Второй закон термодинамики. Теплота не перетекает самопроизвольно из более холодной области в более горячую, или, что то же самое, теплота при данной температуре не может быть полностью преобразована в работу. Следовательно, энтропия замкнутой системы, или тепловая энергия на единицу температуры, со временем увеличивается до некоторого максимального значения. Таким образом, все закрытые системы стремятся к равновесному состоянию, в котором энтропия максимальна и нет энергии для выполнения полезной работы.
Третий закон термодинамики. Энтропия идеального кристалла элемента в его наиболее стабильной форме стремится к нулю, когда температура приближается к абсолютному нулю. Это позволяет установить абсолютную шкалу энтропии, которая со статистической точки зрения определяет степень случайности или беспорядка в системе.
Хотя термодинамика быстро развивалась в 19 веке в связи с необходимостью оптимизации характеристик паровых двигателей, широкая общность законов термодинамики делает их применимыми ко всем физическим и биологическим системам. В частности, законы термодинамики дают полное описание всех изменений энергетического состояния любой системы и ее способности совершать полезную работу над своим окружением.
В частности, законы термодинамики дают полное описание всех изменений энергетического состояния любой системы и ее способности совершать полезную работу над своим окружением.
Викторина «Британника»
Наука: правда или вымысел?
Вы загорелись физикой? Устали от геологии? С помощью этих вопросов отделите научный факт от вымысла.
Эта статья посвящена классической термодинамике, которая не включает рассмотрение отдельных атомов или молекул. Такие проблемы находятся в центре внимания раздела термодинамики, известного как статистическая термодинамика или статистическая механика, которая выражает макроскопические термодинамические свойства с точки зрения поведения отдельных частиц и их взаимодействий. Он уходит своими корнями во вторую половину XIX в.ХХ века, когда стали общепринятыми атомарная и молекулярная теории материи.
Фундаментальные концепции
Термодинамические состояния
Применение термодинамических принципов начинается с определения системы, которая в некотором смысле отличается от своего окружения. Например, системой может быть образец газа внутри цилиндра с подвижным поршнем, целая паровая машина, марафонец, планета Земля, нейтронная звезда, черная дыра или даже вся Вселенная. В общем, системы могут свободно обмениваться теплом, работой и другими формами энергии со своим окружением.
Например, системой может быть образец газа внутри цилиндра с подвижным поршнем, целая паровая машина, марафонец, планета Земля, нейтронная звезда, черная дыра или даже вся Вселенная. В общем, системы могут свободно обмениваться теплом, работой и другими формами энергии со своим окружением.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подписаться сейчас
Состояние системы в любой момент времени называется ее термодинамическим состоянием. Для газа в цилиндре с подвижным поршнем состояние системы определяется по температуре, давлению и объему газа. Эти свойства являются характеристическими параметрами, которые имеют определенные значения в каждом состоянии и не зависят от того, каким образом система пришла в это состояние. Другими словами, любое изменение значения свойства зависит только от начального и конечного состояний системы, а не от пути, пройденного системой из одного состояния в другое. Такие свойства называются функциями состояния. Напротив, работа, совершаемая при движении поршня и расширении газа, и тепло, поглощаемое газом из окружающей среды, зависят от подробного способа, которым происходит расширение.
Напротив, работа, совершаемая при движении поршня и расширении газа, и тепло, поглощаемое газом из окружающей среды, зависят от подробного способа, которым происходит расширение.
Поведение сложной термодинамической системы, такой как атмосфера Земли, можно понять, если сначала применить принципы состояний и свойств к ее составным частям — в данном случае к воде, водяному пару и различным газам, составляющим атмосферу. Изолируя образцы материала, состояния и свойства которых можно контролировать и манипулировать ими, можно изучать свойства и их взаимосвязи по мере изменения системы от состояния к состоянию.
Первый закон термодинамики. Основы теплоты, света и звука
Люмен Обучение
Цели обучения
К концу этого раздела вы сможете:
- Дать определение первому закону термодинамики.
- Опишите, как сохранение энергии связано с первым законом термодинамики.
- Определить случаи применения первого закона термодинамики в повседневных ситуациях, включая биологический метаболизм.

- Рассчитать изменения внутренней энергии системы после учета теплопередачи и выполненной работы.
Если нас интересует, как теплопередача преобразуется в работу, то важен принцип сохранения энергии. Первый закон термодинамики применяет принцип сохранения энергии к системам, в которых передача тепла и совершение работы являются методами передачи энергии в систему и из нее. Первый закон термодинамики гласит, что изменение внутренней энергии системы равно чистой передаче тепла в систему за вычетом чистой работы, выполненной системой. В форме уравнения первый закон термодинамики выглядит так: Δ U = Q − Вт .
Здесь Δ U — изменение внутренней энергии U системы. Q чистая теплота, передаваемая в систему — то есть Q — это сумма всей теплопередачи в систему и из нее. W — это чистая работа, выполненная системой — то есть W — это сумма всей работы, выполненной системой или системой. Мы используем следующие соглашения о знаках: если Q положительное, то в систему идет чистый перенос тепла; если Вт положительно, то система совершает чистую работу. Итак, положительный Q добавляет энергии в систему, а положительный Вт забирает энергию из системы. Таким образом, Δ U = Q − Вт . Обратите также внимание, что если в систему передается больше тепла, чем совершается работа, разница сохраняется в виде внутренней энергии. Хорошим примером этого являются тепловые двигатели — в них происходит передача тепла, чтобы они могли совершать работу. (См. рис. 2.) Теперь мы рассмотрим Q , W и Δ U .
(См. рис. 2.) Теперь мы рассмотрим Q , W и Δ U .
Установление соединений: закон термодинамики и закон сохранения энергии
Первый закон термодинамики на самом деле является законом сохранения энергии, сформулированным в форме, наиболее полезной в термодинамике. Первый закон устанавливает связь между теплопередачей, выполненной работой и изменением внутренней энергии системы.
Нагрев
Q и Работа Вт Теплопередача ( Q ) и выполнение работы ( W ) – это два повседневных способа подачи энергии в систему или ее вывода из системы. Процессы совсем другие. Теплопередача, менее организованный процесс, обусловлена разницей температур. Работа, вполне организованный процесс, включает в себя действие макроскопической силы на расстоянии. Тем не менее, теплота и работа могут давать одинаковые результаты. Например, и то, и другое может вызвать повышение температуры. Передача тепла в систему, например, когда солнце нагревает воздух в велосипедной шине, может повысить его температуру, и, таким образом, над системой может совершаться работа, например, когда велосипедист накачивает воздух в шину. После того, как произошло повышение температуры, невозможно сказать, было ли оно вызвано теплопередачей или совершением работы. Эта неопределенность является важным моментом. Теплопередача и работа — это энергия в пути — ни одна из них не хранится как таковая в системе. Однако оба могут изменить внутреннюю энергию У системы. Внутренняя энергия — это форма энергии, совершенно отличная от теплоты или работы.
Однако оба могут изменить внутреннюю энергию У системы. Внутренняя энергия — это форма энергии, совершенно отличная от теплоты или работы.
Внутренняя энергия
U Мы можем думать о внутренней энергии системы двумя разными, но непротиворечивыми способами. Первый — это атомно-молекулярный взгляд, который исследует систему в атомном и молекулярном масштабе. внутренняя энергия U системы представляет собой сумму кинетической и потенциальной энергий ее атомов и молекул. Напомним, что кинетическая плюс потенциальная энергия называется механической энергией. Таким образом, внутренняя энергия представляет собой сумму атомной и молекулярной механической энергии. Поскольку невозможно уследить за всеми отдельными атомами и молекулами, мы должны иметь дело со средними значениями и распределениями. Второй способ представления внутренней энергии системы — ее макроскопические характеристики, которые очень похожи на средние атомные и молекулярные значения.
Макроскопически мы определяем изменение внутренней энергии Δ U как соответствующее первому закону термодинамики: Δ U = Q − Вт .
Многочисленные детальные эксперименты подтвердили, что Δ U = Q − Вт , где Δ U — изменение полной кинетической и потенциальной энергии всех атомов и молекул в системе. Экспериментально установлено также, что внутренняя энергия U системы зависит только от состояния системы и не как дошло до такого состояния . Более конкретно, U оказывается функцией нескольких макроскопических величин (например, давления, объема и температуры), не зависящих от прошлой истории, например, от того, происходил ли теплообмен или совершалась работа. Эта независимость означает, что если мы знаем состояние системы, мы можем рассчитать изменения ее внутренней энергии U по нескольким макроскопическим переменным.
Установление связей: макроскопические и микроскопические
В термодинамике мы часто используем макроскопическую картину при расчетах поведения системы, в то время как атомарная и молекулярная картина дает основные объяснения в терминах средних значений и распределений.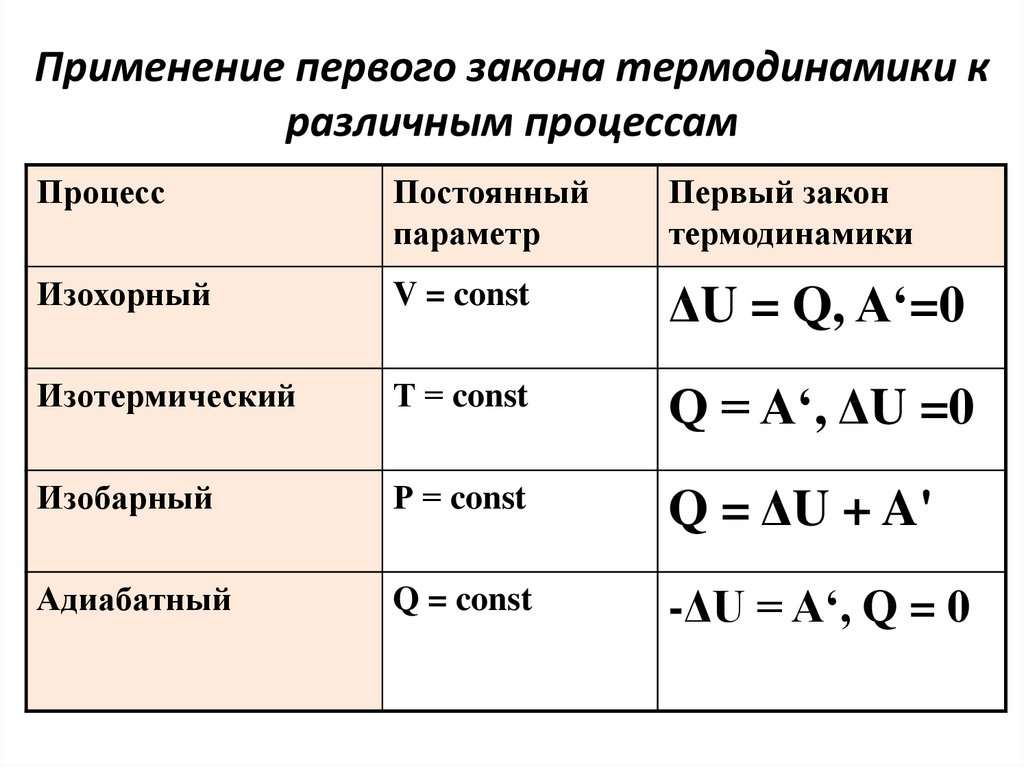 Мы еще увидим это в следующих разделах этой главы. Например, в теме энтропии расчеты будут производиться с использованием атомарно-молекулярного представления.
Мы еще увидим это в следующих разделах этой главы. Например, в теме энтропии расчеты будут производиться с использованием атомарно-молекулярного представления.
Чтобы получить лучшее представление о внутренней энергии системы, давайте рассмотрим систему, переходящую из состояния 1 в состояние 2. Внутренняя энергия системы равна 9.0050 U 1 в Состоянии 1, и имеет внутреннюю энергию U 2 в Состоянии 2, независимо от того, как он попал в любое состояние. Таким образом, изменение внутренней энергии Δ U = U 2 − U 1 не зависит от того, что вызвало изменение. Другими словами, Δ U не зависит от пути . Под путем мы подразумеваем способ добраться из начальной точки в конечную. Почему важна эта независимость? Обратите внимание, что Δ U = Q − Вт . И Q , и W зависят от пути , а Δ U — нет. Эта независимость от пути означает, что внутреннюю энергию U легче учитывать, чем теплопередачу или выполненную работу.
Пример 1. Расчет изменения внутренней энергии: одно и то же изменение
U производится двумя различными процессами- Предположим, что системе передается теплота 40,00 Дж, в то время как система совершает работу 10,00 Дж. Затем из системы передается 25,00 Дж тепла, а над системой совершается работа 4,00 Дж. Каково чистое изменение внутренней энергии системы?
- Как изменится внутренняя энергия системы, если из системы будет передано 150,00 Дж теплоты, а над системой будет совершено 159,00 Дж работы? (См. рис. 3).

Стратегия
В части 1 мы должны сначала найти чистую теплопередачу и чистую работу, выполненную на основе данной информации. Затем можно использовать первый закон термодинамики (Δ U = Q − Вт ), чтобы найти изменение внутренней энергии. В части (b) даны чистая теплопередача и проделанная работа, поэтому уравнение можно использовать напрямую.
Решение для части 1
Чистая теплопередача представляет собой теплопередачу в систему за вычетом теплопередачи из системы, или
Q = 40,00 Дж − 25,00 Дж = 15,00 Дж.
Аналогично, общая работа – это работа, совершаемая системой, за вычетом работы, совершаемой системой, или
Вт = 10,00 Дж − 4,00 Дж = 6,00 Дж.
Таким образом, изменение внутренней энергии определяется первым законом термодинамики:
Δ U = Q − Вт = 15,00 Дж − 6,00 Дж = 9,00 Дж.
Мы также можем найти изменение внутренней энергии для каждого из двух шагов. Во -первых, рассмотрим 40,00 j теплопередачи в и 10,00 j тренировки, или Δ U 1 = Q 1 – W 1 = 40,00 J – 10,00 J = 30,00 J.
Во -первых, рассмотрим 40,00 j теплопередачи в и 10,00 j тренировки, или Δ U 1 = Q 1 – W 1 = 40,00 J – 10,00 J = 30,00 J.
9 = 40,00 J – 10,00 J = 30,00 J.
9 = 40,00 J – 10,00 J = 30,00 J.
9 = 40,00 J – 10,00 J = 30,00.00. Теперь рассмотрим 25,00 Дж теплопередачи наружу и 4,00 Дж работы внутрь, или
∆ U 2 = Q 2 − Вт 2 = –25,00 Дж −(–4,00 Дж) = –21,00 Дж. Δ U 2 = 30,00 Дж + (-21,00 Дж) = 9,00 Дж.
Обсуждение части 1 такой же.
Решение для части 2
Здесь чистая теплопередача и полная работа непосредственно равны Q = –150,00 J и W = –159,00 J, так что
Δ U = Q – W = –150,00 J – ( – 159,00 J) = 9,00 J.
Dirsporting On On Dursing On On Dressing On On On Dressing On On On Dressing ON ON ON DRESSIN Часть 2
Совершенно другой процесс в части 2 вызывает то же изменение внутренней энергии на 9,00 Дж, что и в части 1. Обратите внимание, что изменение в системе в обеих частях связано с Δ U , а не с отдельным Q с или Вт с. Система заканчивается на же состояние в обеих частях. Части 1 и 2 представляют два разных пути, по которым система должна следовать между одними и теми же начальной и конечной точками, и изменение внутренней энергии для каждого одинаково – оно не зависит от пути.
Обратите внимание, что изменение в системе в обеих частях связано с Δ U , а не с отдельным Q с или Вт с. Система заканчивается на же состояние в обеих частях. Части 1 и 2 представляют два разных пути, по которым система должна следовать между одними и теми же начальной и конечной точками, и изменение внутренней энергии для каждого одинаково – оно не зависит от пути.
Метаболизм человека и первый закон термодинамики
Метаболизм человека — это преобразование пищи в теплопередачу, работу и накопление жира. Метаболизм — интересный пример действия первого закона термодинамики. Теперь мы еще раз взглянем на эти темы через первый закон термодинамики. Рассматривая тело как интересующую нас систему, мы можем использовать первый закон для изучения теплопередачи, выполнения работы и внутренней энергии в различных видах деятельности, от сна до тяжелых упражнений. Каковы некоторые из основных характеристик теплообмена, совершения работы и энергии в организме? Во-первых, температура тела обычно поддерживается постоянной за счет передачи тепла в окружающую среду. Это означает Q отрицательный. Другой факт заключается в том, что тело обычно воздействует на внешний мир. Это означает, что Вт является положительным. В таких ситуациях тело теряет внутреннюю энергию, поскольку Δ U = Q − Вт отрицательно.
Это означает Q отрицательный. Другой факт заключается в том, что тело обычно воздействует на внешний мир. Это означает, что Вт является положительным. В таких ситуациях тело теряет внутреннюю энергию, поскольку Δ U = Q − Вт отрицательно.
Теперь рассмотрим последствия еды. Прием пищи увеличивает внутреннюю энергию тела за счет добавления химической потенциальной энергии (это неромантичный взгляд на хороший стейк). Тело усваивает всю пищу, которую мы потребляем. По сути, обмен веществ представляет собой процесс окисления, при котором высвобождается химическая потенциальная энергия пищи. Это означает, что потребление пищи осуществляется в форме работы. Энергия пищи сообщается в специальной единице, известной как калория. Эта энергия измеряется путем сжигания пищи в калориметре, так определяются единицы измерения.
В химии и биохимии одна калория ( в нижнем регистре пишется как c) определяется как энергия (или теплопередача), необходимая для повышения температуры одного грамма чистой воды на один градус Цельсия. Диетологи и люди, следящие за весом, обычно используют диетических калорий, которые часто называют калориями ( пишется с большой буквы C). Одна пищевая калория — это энергия, необходимая для повышения температуры одного килограммов воды на один градус Цельсия. Это означает, что для химика одна диетическая калория равна одной килокалории, и нужно быть осторожным, чтобы не путать их.
Диетологи и люди, следящие за весом, обычно используют диетических калорий, которые часто называют калориями ( пишется с большой буквы C). Одна пищевая калория — это энергия, необходимая для повышения температуры одного килограммов воды на один градус Цельсия. Это означает, что для химика одна диетическая калория равна одной килокалории, и нужно быть осторожным, чтобы не путать их.
Опять же, рассмотрим внутреннюю энергию, потерянную телом. Эта внутренняя энергия может быть использована в трех направлениях: для теплопередачи, для выполнения работы и для накопления жира (крошечная часть также идет на восстановление и рост клеток). Теплообмен и совершение работы забирают внутреннюю энергию из организма, а пища возвращает ее. Если вы едите только нужное количество пищи, то ваша средняя внутренняя энергия остается постоянной. Все, что вы теряете при теплопередаче и выполнении работы, заменяется пищей, так что в долгосрочной перспективе Δ U =0. Если вы постоянно переедаете, то Δ U всегда положительна, и ваше тело откладывает эту дополнительную внутреннюю энергию в виде жира. Обратное верно, если вы едите слишком мало. Если Δ U отрицателен в течение нескольких дней, то организм метаболизирует собственный жир для поддержания температуры тела и выполнения работы, забирающей энергию у организма. Этот процесс заключается в том, как диета приводит к потере веса.
Если вы постоянно переедаете, то Δ U всегда положительна, и ваше тело откладывает эту дополнительную внутреннюю энергию в виде жира. Обратное верно, если вы едите слишком мало. Если Δ U отрицателен в течение нескольких дней, то организм метаболизирует собственный жир для поддержания температуры тела и выполнения работы, забирающей энергию у организма. Этот процесс заключается в том, как диета приводит к потере веса.
Жизнь не всегда так проста, как знает любой сидящий на диете. Организм накапливает жир или усваивает его, только если потребление энергии изменяется в течение нескольких дней. После того, как вы сели на основную диету, следующая будет менее успешной, потому что ваше тело меняет реакцию на низкое потребление энергии. Ваш основной уровень метаболизма (BMR) — это скорость, с которой пища преобразуется в теплопередачу и совершается работа, когда тело находится в полном покое. Организм регулирует скорость основного обмена, чтобы частично компенсировать переедание или недоедание. Тело снизит скорость метаболизма, а не устранит собственный жир, чтобы заменить потерянное потребление пищи. Вы будете легче остывать и чувствовать себя менее энергичным в результате более низкой скорости обмена веществ, и вы не будете терять вес так быстро, как раньше. Упражнения помогают похудеть, потому что они производят как теплопередачу от вашего тела, так и работу, а также повышают скорость метаболизма, даже когда вы находитесь в состоянии покоя. Снижению веса способствует также довольно низкая эффективность преобразования внутренней энергии тела в работу, так что потери внутренней энергии в результате выполнения работы намного больше, чем выполненная работа. Следует, однако, отметить, что живые системы не в тепловом равновесии.
Тело снизит скорость метаболизма, а не устранит собственный жир, чтобы заменить потерянное потребление пищи. Вы будете легче остывать и чувствовать себя менее энергичным в результате более низкой скорости обмена веществ, и вы не будете терять вес так быстро, как раньше. Упражнения помогают похудеть, потому что они производят как теплопередачу от вашего тела, так и работу, а также повышают скорость метаболизма, даже когда вы находитесь в состоянии покоя. Снижению веса способствует также довольно низкая эффективность преобразования внутренней энергии тела в работу, так что потери внутренней энергии в результате выполнения работы намного больше, чем выполненная работа. Следует, однако, отметить, что живые системы не в тепловом равновесии.
Тело дает нам отличный показатель того, что многие термодинамические процессы являются необратимыми . Необратимый процесс может идти в одном направлении, но не в обратном, при заданном наборе условий. Например, хотя жировые отложения могут быть преобразованы для выполнения работы и передачи тепла, работа, совершаемая над телом, и перенос тепла в него не могут быть преобразованы в жировые отложения. В противном случае мы могли бы пропустить обед, загорая или спускаясь по лестнице. Другим примером необратимого термодинамического процесса является фотосинтез. Этот процесс представляет собой поглощение растениями одной формы энергии — света — и преобразование ее в химическую потенциальную энергию. Оба применения первого закона термодинамики проиллюстрированы на рис. 4. Большое преимущество законов сохранения, таких как первый закон термодинамики, заключается в том, что они точно описывают начало и конец сложных процессов, таких как метаболизм и фотосинтез, без учета осложнения между ними. В Таблице 1 представлена сводка терминов, относящихся к первому закону термодинамики.
В противном случае мы могли бы пропустить обед, загорая или спускаясь по лестнице. Другим примером необратимого термодинамического процесса является фотосинтез. Этот процесс представляет собой поглощение растениями одной формы энергии — света — и преобразование ее в химическую потенциальную энергию. Оба применения первого закона термодинамики проиллюстрированы на рис. 4. Большое преимущество законов сохранения, таких как первый закон термодинамики, заключается в том, что они точно описывают начало и конец сложных процессов, таких как метаболизм и фотосинтез, без учета осложнения между ними. В Таблице 1 представлена сводка терминов, относящихся к первому закону термодинамики.
 Этот процесс называется фотосинтезом.
Этот процесс называется фотосинтезом.| Таблица 1. Сводка терминов для первого закона термодинамики, ΔU = Q − W | |
|---|---|
| Срок | Определение |
| У | Внутренняя энергия — сумма кинетической и потенциальной энергий атомов и молекул системы. Можно разделить на множество подкатегорий, таких как тепловая и химическая энергия. Зависит только от состояния системы (например, ее P , V и T ), а не от того, как энергия попала в систему. Изменение внутренней энергии не зависит от пути. |
| Q | Тепло — энергия, передаваемая из-за разницы температур. Характеризуется беспорядочным движением молекул. Сильно зависит от пути. Q вход в систему положительный. |
| Ш | Работа — энергия, переданная силой, движущейся на расстояние. Организованный, упорядоченный процесс. Зависит от пути. Вт , совершаемое системой (либо против внешней силы, либо для увеличения объема системы), положительна. |
Резюме раздела
- Первый закон термодинамики записывается как вся теплопередача в систему и из нее), а Вт является чистой выполненной работой (сумма всей работы, выполненной системой или системой).
- Оба Q и W являются энергией в пути; только Δ U представляет собой независимую величину, которую можно хранить.
- Внутренняя энергия U системы зависит только от состояния системы, а не от того, как она достигла этого состояния.
- Обмен веществ живых организмов и фотосинтез растений являются специализированными видами теплообмена, совершения работы и внутренней энергии систем.
Концептуальные вопросы
- Опишите фотографию чайника в начале этого раздела с точки зрения передачи тепла, выполненной работы и внутренней энергии.
 Как передается тепло? Какая работа сделана и что она делает? Как чайник сохраняет свою внутреннюю энергию?
Как передается тепло? Какая работа сделана и что она делает? Как чайник сохраняет свою внутреннюю энергию? - Первый закон термодинамики и закон сохранения энергии, как обсуждалось в книге «Сохранение энергии», явно связаны между собой. Чем они различаются по рассматриваемым видам энергии?
- Теплопередача Q и выполненная работа Вт всегда представляют собой энергию в пути, тогда как внутренняя энергия U является энергией, хранящейся в системе. Приведите пример каждого типа энергии и конкретно укажите, как она либо находится в пути, либо находится в системе.
- Чем отличаются теплопередача и внутренняя энергия? В частности, что можно хранить как таковое в системе, а что нельзя?
- Если вы сбежите по лестнице и остановитесь, что произойдет с вашей кинетической энергией и вашей начальной гравитационной потенциальной энергией?
- Объясните, как энергию пищи (калории) можно рассматривать как молекулярную потенциальную энергию (в соответствии с атомарным и молекулярным определением внутренней энергии).

- Определите тип энергии, передаваемой вашему телу в каждом из следующих случаев: внутренняя энергия, теплопередача или выполнение работы: (а) купание в солнечных лучах; б) прием пищи; в) подняться на лифте на верхний этаж.
Задачи и упражнения
- Как изменится внутренняя энергия автомобиля, если в его бак залить 12,0 галлонов бензина? Энергоемкость бензина составляет 1,3 × 10 8 Дж/галлон. Все остальные факторы, например температура автомобиля, постоянны.
- Какой объем теплоты происходит от системы, если ее внутренняя энергия уменьшилась на 150 Дж при совершении работы 30,0 Дж?
- Система совершает 1,80 × 10 8 Дж работы при 7,50 × 10 8 Дж происходит передача тепла в окружающую среду. Каково изменение внутренней энергии системы при отсутствии других изменений (например, температуры или добавления топлива)?
- Как изменится внутренняя энергия системы, которая совершает работу 4,50×10 5 Дж, при этом теплопередача в систему составляет 3,00×10 6 Дж, а теплопередача 8,00×10 6 Дж.
 к окружающей среде?
к окружающей среде? - Предположим, что женщина выполняет работу 500 Дж и 9При этом в окружающую среду происходит передача 500 Дж тепла. а) Каково уменьшение ее внутренней энергии при условии отсутствия изменения температуры или потребления пищи? (То есть другого переноса энергии нет.) (б) Каков ее КПД?
- (а) Сколько энергии пищи усвоит человек в процессе выполнения работы в 35,0 кДж с КПД 5,00%? б) Какой объем теплоты передается окружающей среде, чтобы поддерживать ее температуру постоянной?
- (a) Какова средняя скорость метаболизма в ваттах у человека, который усваивает 10 500 кДж пищевой энергии за один день? б) Какую максимальную работу в джоулях он может совершить без расщепления жира при максимальном КПД 20,0 %? (c) Сравните производительность его работы с дневной мощностью двигателя мощностью 187 Вт (0,250 л.с.).
- (a) Как долго хватит энергии чашки йогурта 1470 кДж (350 ккал) на женщину, выполняющую работу мощностью 150 Вт с эффективностью 20,0% (например, при неторопливом подъеме по лестнице)? (б) Означает ли время, указанное в части (а), что легко потреблять больше энергии пищи, чем вы можете обоснованно ожидать от работы с помощью физических упражнений?
- (a) Женщина, взбирающаяся на монумент Вашингтона, усваивает 6,00 × 10 2 кДж пищевой энергии.
 Если ее КПД составляет 18,0%, сколько тепла передается окружающей среде, чтобы поддерживать ее температуру постоянной? (b) Обсудите величину теплопередачи, найденную в (a). Соответствует ли это тому, что вы быстро разогреваетесь во время тренировки?
Если ее КПД составляет 18,0%, сколько тепла передается окружающей среде, чтобы поддерживать ее температуру постоянной? (b) Обсудите величину теплопередачи, найденную в (a). Соответствует ли это тому, что вы быстро разогреваетесь во время тренировки?
Глоссарий
первый закон термодинамики: утверждает, что изменение внутренней энергии системы равно чистой передаче тепла в систему за вычетом чистой работы, выполненной системой
внутренняя энергия: сумма кинетической и потенциальной энергий атомов и молекул системы
метаболизм человека: преобразование пищи в теплопередачу, работу и накопление жира
Избранные решения задач и упражнений
1. 1,6 × 10 9 Дж
3. –9,30 × 10 8 Дж
5. (а) –1,0 × 10 4 Дж, или –2,39 ккал; (б) 5,00%
7. (а) 122 Вт; (б) 2.10 × 10 6 Дж; в) работа, совершаемая двигателем, равна 1,61 × 10 7 Дж; таким образом, двигатель производит работу, в 7,67 раз превышающую работу человека
9.


 д ……/ / Термодинамика. / / Первый закон термодинамики, внутренняя энергия, тепло, работа, энтальпия, энтропия.
д ……/ / Термодинамика. / / Первый закон термодинамики, внутренняя энергия, тепло, работа, энтальпия, энтропия. 

 Например, у стакана с водой комнатной температы, стоящего на столе нет, на первый взгляд, никакой энергии: ни кинетической, ни потенциальной относительно стола. Но, с помощью микроскопа становится заметна “бурлящая” масса быстро двигающихся молекул. Если выплеснуть воду из стакана, эта микроскопическая энергия не обязательно заметно изменится, когда мы усредним добавленную кинетическую энергию на все молекулы воды.
Например, у стакана с водой комнатной температы, стоящего на столе нет, на первый взгляд, никакой энергии: ни кинетической, ни потенциальной относительно стола. Но, с помощью микроскопа становится заметна “бурлящая” масса быстро двигающихся молекул. Если выплеснуть воду из стакана, эта микроскопическая энергия не обязательно заметно изменится, когда мы усредним добавленную кинетическую энергию на все молекулы воды.
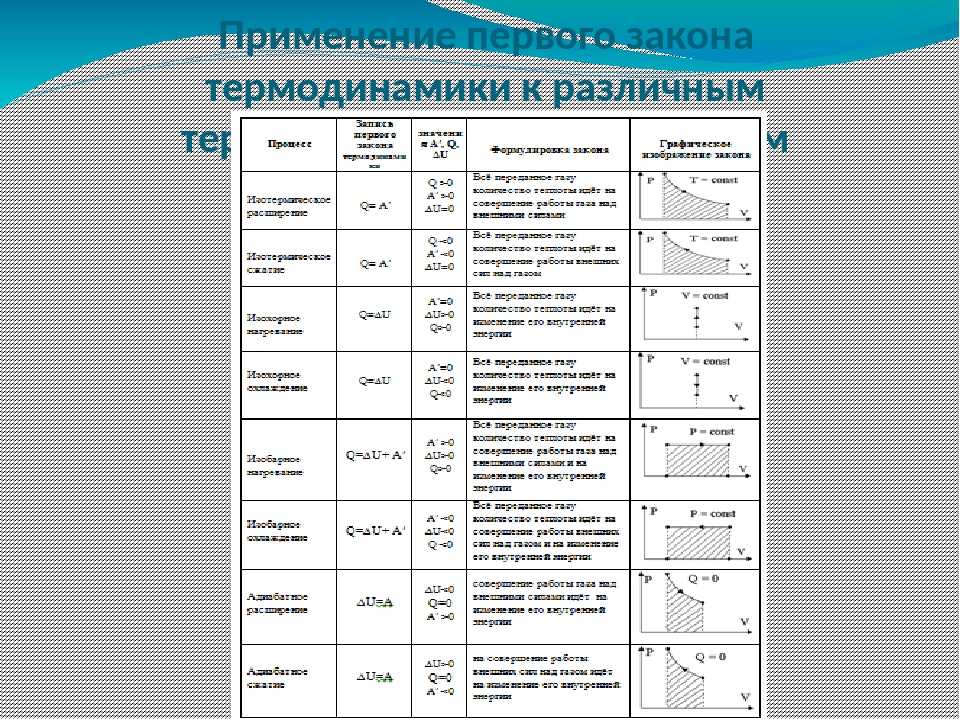




 пособие для 11-го кл. общеобразоват. шк. с рус. яз. обучения / В.В. Жилко, А.В.Лавриненко, Л.Г. Маркович. – Мн.: Нар. асвета, 2002. – С. 125, 128-132.
пособие для 11-го кл. общеобразоват. шк. с рус. яз. обучения / В.В. Жилко, А.В.Лавриненко, Л.Г. Маркович. – Мн.: Нар. асвета, 2002. – С. 125, 128-132.
 Все количество теплоты, переданное системе, расходуется на совершение этой системой механической работы.
Все количество теплоты, переданное системе, расходуется на совершение этой системой механической работы.
 Часть тепла расходуется на совершение работы, а часть – на увеличениевнутр. энергии.
Часть тепла расходуется на совершение работы, а часть – на увеличениевнутр. энергии.




 рис. 3).
рис. 3).

 к окружающей среде?
к окружающей среде? Если ее КПД составляет 18,0%, сколько тепла передается окружающей среде, чтобы поддерживать ее температуру постоянной? (b) Обсудите величину теплопередачи, найденную в (a). Соответствует ли это тому, что вы быстро разогреваетесь во время тренировки?
Если ее КПД составляет 18,0%, сколько тепла передается окружающей среде, чтобы поддерживать ее температуру постоянной? (b) Обсудите величину теплопередачи, найденную в (a). Соответствует ли это тому, что вы быстро разогреваетесь во время тренировки?
 Например, идеально изолированный и закрытый резервуар с азотом не передает в окружающую среду ни энергии, ни вещества.
Например, идеально изолированный и закрытый резервуар с азотом не передает в окружающую среду ни энергии, ни вещества.



 Как передается тепло? Какая работа сделана и что она делает? Как чайник сохраняет свою внутреннюю энергию?
Как передается тепло? Какая работа сделана и что она делает? Как чайник сохраняет свою внутреннюю энергию?
 к окружающей среде?
к окружающей среде? Если ее КПД составляет 18,0%, сколько тепла передается окружающей среде, чтобы поддерживать ее температуру постоянной? (b) Обсудите величину теплопередачи, найденную в (a). Соответствует ли это тому, что вы быстро разогреваетесь во время тренировки?
Если ее КПД составляет 18,0%, сколько тепла передается окружающей среде, чтобы поддерживать ее температуру постоянной? (b) Обсудите величину теплопередачи, найденную в (a). Соответствует ли это тому, что вы быстро разогреваетесь во время тренировки?