Таблицы DPVA.ru – Инженерный Справочник | Адрес этой страницы (вложенность) в справочнике dpva.ru: главная страница / / Техническая информация / / Химический справочник / / Кислотность pH. Водородный показатель pH. Таблицы показателей pH. Перевод единиц кислотности. Поделиться:
| ||
| Если Вы не обнаружили себя в списке поставщиков, заметили ошибку, или у Вас есть дополнительные численные данные для коллег по теме, сообщите , пожалуйста. Вложите в письмо ссылку на страницу с ошибкой, пожалуйста. | |||
Проект является некоммерческим. Информация, представленная на сайте, не является официальной и предоставлена только в целях ознакомления. Владельцы сайта www.dpva.ru не несут никакой ответственности за риски, связанные с использованием информации, полученной с этого интернет-ресурса.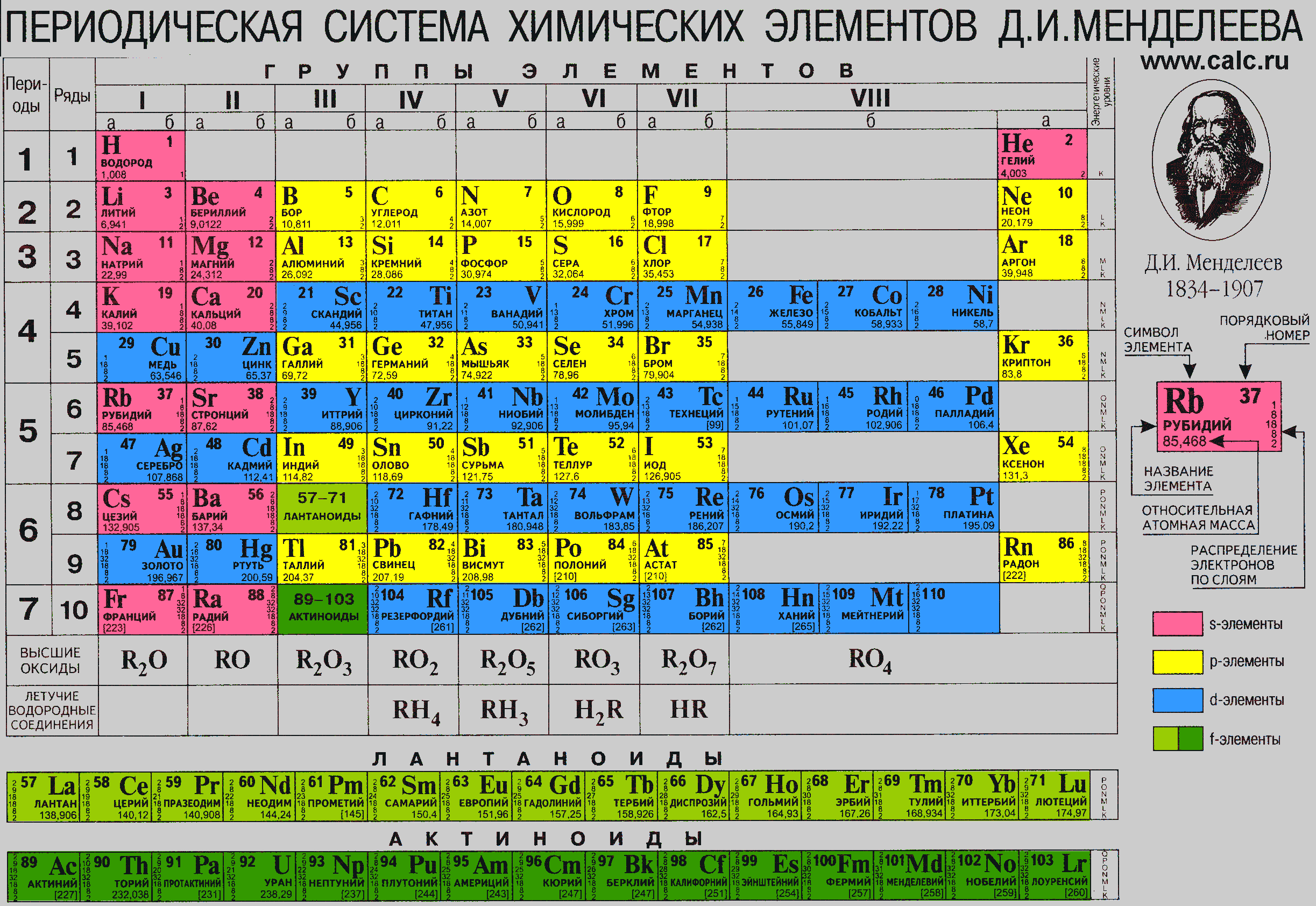 | |||
Справочники – Старшеклассник
1. Библиотека ARHIBOOK – большая подбрка книг, ситематизированных по темам:- Художественная дитература
- Компьютерная литература
- Гуманитарные науки
- Естественные науки
- Технические издания
- Работа, бизнес, экономика
- Дом и семейный очег
- Медицина и здравоохранение
- Культура и искусство
- Аудиокниги
 …), формулы перевода градусов в радианы, длин, площадей и
объемов основных геометрических фигур, элементарные поверхности второго
порядка, канонические уравнения.
…), формулы перевода градусов в радианы, длин, площадей и
объемов основных геометрических фигур, элементарные поверхности второго
порядка, канонические уравнения.3. Справочник физический
– принятые обозначения физических величин (время, вес…) , влажность,
вязкость, число Рейнольдса (Re), давление, звук, ультразвук., плотность,
растворимость, свет и цвет, сокращения (кратные и дольные единицы),
стандартные ошибки измерений, твердость, тепловые величины, трение,
электрические и магнитные величины, система СИ, СГС, USCS внесистемные
единицы.
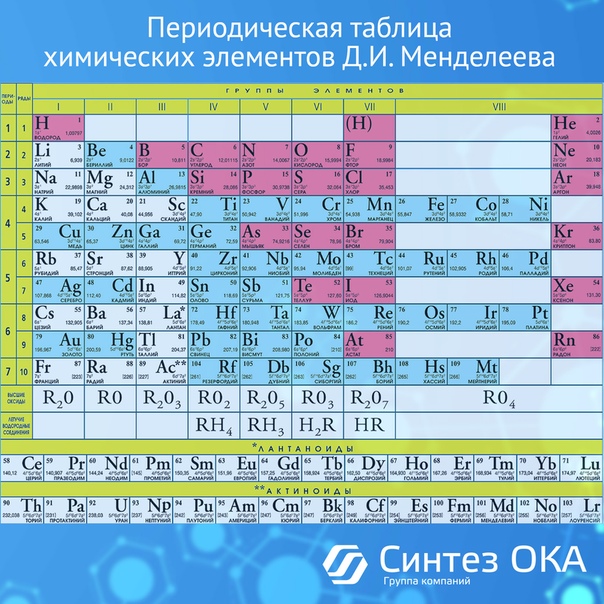
4. Справочник химический
– периодическая система химических элементов Д.И.Менделеева. Таблица
Менделеева, горение и взрывы, водородный показатель pH, таблицы
показателей pH, свойства растворов, классы, категории, обозначения
опасности (токсичности) химических веществ, электрохимическая коррозия
металла, катодная защита, анодная защита, пассивная защита, электродные
потенциалы – таблица, химические формулы против повседневных
(загадочных) названий веществ, шпаты, соли, селитры, воды, кислоты,
касцы, реактивы.
5. Конвертор величин
– авто-перевод величин: работа и энергия, давление, объем, площадь,
масса, длина, скорость, нефть и газ, сила, мощность, температура.
Константы: физико-химические, нейтрон, дейтрон, протон, мюон, момент
электрона, электрон, атомные, электромагнитные, температура,
универсальные.
6. Бесплатный онлайн переводчик текстов и сайтов – переводчик текстов по различным категориям: общение, бизнес, компьютеры, автомобили, путешествия, спорт, другое.
7. Бесплатный онлайн переводчик текстов – переводы на множество языков, в т.ч. и на украинский и с украинского.
8. Словари и энциклопедии – большая подборка Яндекса : 11 словарей, 82 энциклопедии, переводчики.
Формулы для расчёта pH растворов электролитов
ТаблицыАвтор Владислав Панарин На чтение 2 мин. Просмотров 2.2k. Опубликовано Обновлено
Полезные формулы для расчёта pH растворов электролитов (сильных и слабых кислот и оснований, солей, амфолитов, буферных растворов).
Информация
Ka — константа диссоциации кислоты.
Kb — константа диссоциации основания.
pKa = -lg Ka — отрицательный десятичный логарифм константы диссоциации кислоты.
pKb = -lg Kb — отрицательный десятичный логарифм константы диссоциации основания.
Ca — концентрация кислоты.
Cb — концентрация основания.
Cs — концентрация соли.
n — основность кислоты или кислотность основания.
| Раствор электролита | Пример | Формула для расчёта рН |
| Чистая вода | \[H_2O\] | \[pH=-lg[H^+]\] |
| Сильная кислота | \[HCl\] | \[pH=-lg(C_a*n)\] |
| Сильное основание | \[NaOH\] | \[pH=14-pOH=14+lg(C_b*n)\] |
| Слабая кислота | \[CH_3COOH\] | \[pH=1/2pK_a–1/2lgC_a\] |
| Слабое основание | \[NH_4OH\] | \[pH=14-1/2pK_b+1/2lgC_b\] |
| Соль, гидролиз по катиону | \[NH_4Cl\] | \[pH=7-1/2pK_b-1/2lgC_s\] |
| Соль, гидролиз по аниону | \[Na_2CO_3\] | \[pH=7+1/2pK_a+1/2lgC_s\] |
| Соль, гидролиз по катиону и аниону | \[CH_3COONH_4\] | \[pH=7-1/2pK_b-1/2pK_a\] |
| Амфолит | \[NaHCO_3\] | \[pH=7-1/2pK_b+1/2pK_a=1/2(pK_{a1}+pK_{a2})\] |
| Буферная система 1 типа (кислотная) | \[CH_3COOH+CH_3COONa\] | \[pH=pK_a-lgC_a/C_s\] |
| Буферная система 2 типа (основная) | \[NH_4OH+NH_4Cl\] | \[pH=14-pK_b+lgC_b/C_s=pKa+lgC_b/C_s\] |
Индикаторы.
 Кислотно-основные индикаторы. Изменение окраски в зависимости от рН (кислотности среды)
Кислотно-основные индикаторы. Изменение окраски в зависимости от рН (кислотности среды) Изменение окраски индикаторов в зависимости от pH
Кислотно-основные индикаторы – это соединения, окраска которых меняется в зависимости от кислотности среды.
Например, лакмус в кислой среде окрашен в красный цвет, а в щелочной – в синий. Это свойство можно использовать для быстрой оценки pH растворов.
Кислотно-основные индикаторы находят широкое применение в химии. Известно, например, что многие реакции по-разному протекают в кислой и щелочной средах. Регулируя pH, можно изменить направление реакции. Индикаторы можно использовать не только для качественной, но и для количественной оценки содержания кислоты в растворе (метод кислотно-основного титрования).
Применение индикаторов не ограничивается “чистой” химией. Кислотность среды необходимо контролировать во многих производственных процессах, при оценке качества пищевых продуктов, в медицине и т. д.
д.
В таблице 1 указаны наиболее “популярные” индикаторы и отмечена их окраска в нейтральной, кислой и щелочной средах.
Таблица 1
| Кислая среда | Нейтральная среда | Щелочная среда | |
| Лакмус | Красный | Фиолетовый | Синий |
| Метилоранж | Красный | Оранжевый | Желтый |
| Фенолфталеин | Бесцветный | Бесцветный | Малиновый |
Лакмус
Метилоранж
Фенолфталеин
В действительности, каждый индикатор характеризуется своим интервалом рН, в котором происходит изменение цвета (интервал перехода). Изменение окраски происходит из-за превращения одной формы индикатора (молекулярной) в другую (ионную). По мере понижения кислотности среды (с ростом рН) концентрация ионной формы повышается, а молекулярной – падает. В таблице 2 перечислены некоторые кислотно-основные индикаторы и соответствующие интервалы перехода.
В таблице 2 перечислены некоторые кислотно-основные индикаторы и соответствующие интервалы перехода.
| Название индикатора | Цвет в кислой среде | Интервал перехода (pH) | Цвет в щелочной среде |
| Метиловый оранжевый | Красный | 3 – 5 | Желтый |
| Метиловый красный | Красный | 4-6 | Желтый |
| Бромкрезоловый пурпурный | Желтый | 5,5 – 7,5 | Фиолетовый |
| Феноловый красный | Желтый | 7-9 | Красный |
| Фенолфталеин | Бесцветный | 8-10 | Малиновый |
Увидев ( https://telegra.
 ph/file/4a6785582cec602389e30.jpg)… – мир сквозь призму восприятия — LiveJournalУвидев (https://telegra.ph/file/4a6785582cec602389e30.jpg) оригинальную периодическую таблицу Д. Менделеева вы обнаружите расхождения с нынешней таблицей. Из неё стёрли нулевую группу и нулевой ряд, где располагался Ньютоний, тот самый мировой эфир.
ph/file/4a6785582cec602389e30.jpg)… – мир сквозь призму восприятия — LiveJournalУвидев (https://telegra.ph/file/4a6785582cec602389e30.jpg) оригинальную периодическую таблицу Д. Менделеева вы обнаружите расхождения с нынешней таблицей. Из неё стёрли нулевую группу и нулевой ряд, где располагался Ньютоний, тот самый мировой эфир.Нулевой-значит основа. Как химик, могу сказать что это означает только одно- все Формулы ошибочны. Вы же понимаете что это значит? Фармацевтика, хим пром- это гигантский масштаб лжи и обмана, просто катастрофический. Я уже не говорю о физике.
Последний раз в неискажённом виде настоящая Таблица Менделеева увидела свет в 1906 году в Санкт-Петербурге (учебник “Основы химии”, VIII издание (https://egorovs.art/auction12/lot28)).
Предоставим слово самому Д. И. Менделееву:
«Положение аргоновых аналогов в нулевой группе составляет логическое следствие периодического закона, а потому (помещение в группе VIII явно не верно) принято не только мною, но и Браизнером, Пиччини и другими. ..
..
Задачу тяготения и задачи всей энергетики нельзя представить реально решёнными без реального понимания эфира, как мировой среды, передающей энергию на расстояния.»- после смерти учёного эфир безвозвратно исчез.
Он был стёрт, само понятие было уничтожено, так же впрочем, как сейчас уничтожаются и подтасовываются многие факты и понятия на наших глазах.
М.Филиппов, в 1903г. экспериментировавший с переносом энергии по воздуху: «Речь об изобретенном мною способе электрической передачи на расстояние волны взрыва, причем передача эта возможна на расстояние тысяч километров… Но при таком ведении война фактически становится безумием и должна быть упразднена» – учёного нашли мёртвым на следующий день, а бумаги и наработки вывезены властями в неизвестном направлении.
Пока мы радуемся беспроводной зарядке телефона и говорим о новейших технологиях, ещё 100 лет назад способы передачи энергии посредством эфира были озвучены самыми передовыми учеными!
Достоверный факт в том, что после смерти Д.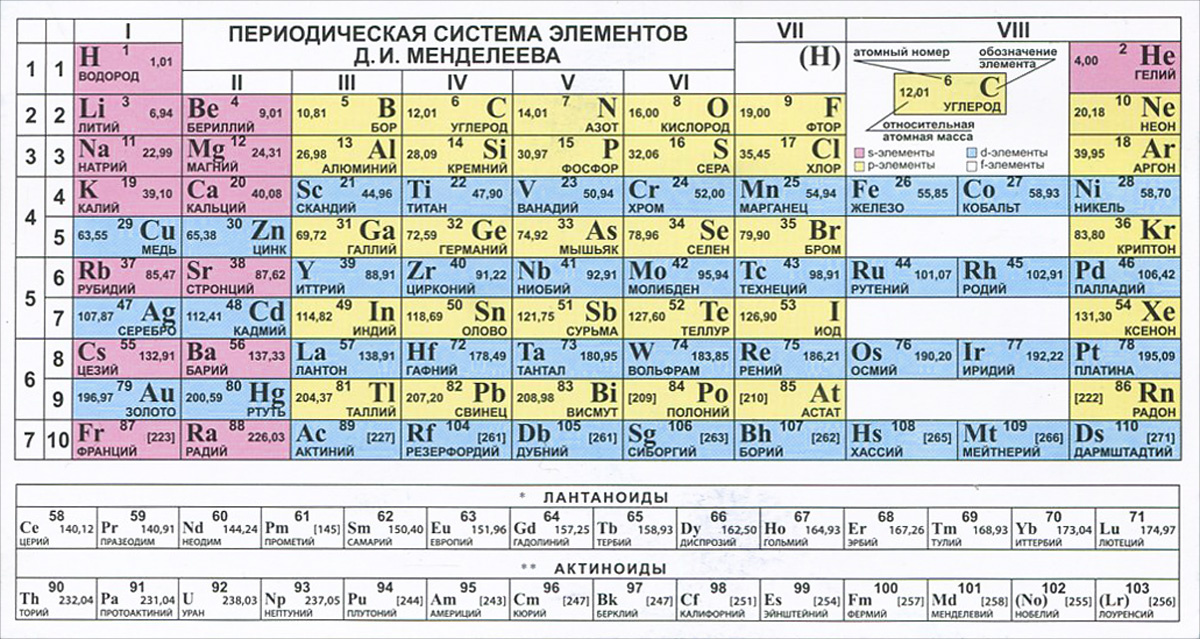 И. Менделеева в 1907 году, его главное открытие – было умышленно и повсеместно фальсифицировано мировой академической наукой.
И. Менделеева в 1907 году, его главное открытие – было умышленно и повсеместно фальсифицировано мировой академической наукой.
119 элемент Унуненний — в разработке после открытия 117 Унунсептия
119 элемент — в разработке после открытия 117 Унунсептия.
Унуненний — временное название химического элемента в периодической таблице, с временным обозначением Uue и атомным номером 119, с прогнозированной атомной массой 316 а.е.м ]. Как другие щелочные металлы, он, вероятнее всего, будет чрезвычайно реакционноспособен по отношению к воде в случае его получения в достаточных количествах (и гораздо более реакционноспособен, чем цезий). Вероятно, при комнатной температуре унуненний — твердое вещество.
Элемент 119 после его синтеза будет первым элементом в восьмом периоде периодической таблицы химических элементов Д. И. Менделеева.
Российские физики будут пытаться получить 119-й и 120-й элементы. Российские физики в течение ближайших пяти лет намерены проводить эксперименты по синтезу новых сверхтяжелых элементов таблицы Менделеева — 119-го и 120-го, сказал РИА Новости руководитель Объединенного института ядерных исследований (ОИЯИ) Алексей Сисакян.
В ОИЯИ ранее был получен самый тяжелый на данный момент элемент, имеющий атомный номер 118, а также ряд других сверхтяжелых элементов.
«В науке довольно трудно планировать, я могу только обещать, что в течение следующей пятилетки мы будем атаковать эти элементы», — сказал ученый после церемонии закладки комплекса по производству фильтров для плазмы крови на территории особой экономической зоны «Дубна». Ученые из ОИЯИ являются авторами технологии, на которой основано это производство.
Сисакян напомнил, что летом физики из Лаборатории ядерных реакций имени Флерова в ОИЯИ будут проводить эксперименты по синтезу «пропущенного» 117-го элемента, который ранее никем не был синтезирован.
Для этого эксперимента американские коллеги специально синтезируют небольшое количество чрезвычайно дорогого элемента — берклия, из которого в российском НИИ атомных реакторов в Димитровграде сделают мишень. Эту мишень будут обстреливать на ускорителе лаборатории Флерова тяжелыми ионами кальция с тем, чтобы синтезировать 117-й элемент.
Разновидности жесткости воды – смягчение воды | О воде
Жесткость воды можно определить как содержание растворенных в ней солей магния, кальция, а также ряда других элементов из периодической таблицы Д. И. Менделеева. К примеру, это могут быть соли железа и марганца, однако, содержание последних в воде, как правило, на порядок ниже в сравнении с содержанием солей кальция и магния, поэтому, говоря об общей жесткости воды, подразумевают именно содержание в воде растворенных солей кальция и магния. Общая жесткость включает в себя временную и постоянную жесткость, которые также иногда называют карбонатной и некарбонатной, соответственно.
Временная (карбонатная жесткость): Имеет обозначение KH. Она напрямую зависит содержания в воде гидрокарбонатов и карбонатов магния и кальция. Карбонатная жесткость называется временной, поскольку она может быть устранена путем кипячения воды. При кипячении данные соли выпадают в осадок и образуют накипь. Карбонатная жесткость определяет буферные свойства воды, в связи с чем, препятствует резким колебаниям уровня pH воды. Этот тип жесткости определяет ее пригодность для использования в быту, поскольку образование накипи на сантехнике и водонагревательных элементах бытовых приборов может легко вывести их из строя.
Карбонатная жесткость определяет буферные свойства воды, в связи с чем, препятствует резким колебаниям уровня pH воды. Этот тип жесткости определяет ее пригодность для использования в быту, поскольку образование накипи на сантехнике и водонагревательных элементах бытовых приборов может легко вывести их из строя.
Постоянная жесткость (некарбонатная жесткость): Имеет обозначение GH. Она обусловлена количественным содержанием в воде хлоридов, сульфатов и ряда других солей магния и кальция. При кипячении воды, такие соли в осадок выпадать не будут. Именно эта разновидность жесткости определяет степень пригодности воды для целей питья и приготовления пищи, т.к. ввиду невозможности ее удаления посредством кипячения, все соли кальция и магния, определяющие данные тип жесткости, попадут в организм человека. Кальций и магний – важнейшие макроэлементы, необходимые для нормального функционирования человеческого организма, однако, все хорошо в меру, и потребление воды с избыточным содержанием солей кальция и магния на протяжении длительного периода времени может привести к развитию мочекаменной болезни. Данный показатель может быть снижен путем применения технологии – смягчение.
Данный показатель может быть снижен путем применения технологии – смягчение.
Успешно справиться с избыточной жесткостью поможет фильтр, в котором реализована технология смягчения воды, которая позволит привести качество воды по данному показателю к приемлемому уровню.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались.
 Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie. - Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie
потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
2.5: Факторы, определяющие кислотность
Периодические тенденции
Сначала мы сосредоточимся на отдельных атомах и подумаем о тенденциях, связанных с положением элемента в периодической таблице. Мы будем использовать в качестве наших первых моделей простые органические соединения этан, метиламин и этанол, но концепции в равной степени применимы и к более сложным биомолекулам, таким как боковые цепи аланина, лизина и серина.
Мы можем видеть четкую тенденцию кислотности, двигаясь слева направо по второму ряду таблицы Менделеева от углерода к азоту и к кислороду.Ключом к пониманию этой тенденции является рассмотрение гипотетического сопряженного основания в каждом случае : чем стабильнее (слабее) сопряженное основание, тем сильнее кислота . Посмотрите, где заканчивается отрицательный заряд в каждом сопряженном основании. В анионе этила отрицательный заряд несет углерод, в то время как в анионе метиламина и анионе этоксида заряды расположены на азоте и кислороде соответственно. Вспомните периодический тренд электроотрицательности: она также увеличивается по мере продвижения слева направо по ряду, а это означает, что кислород является наиболее электроотрицательным из трех, а углерод — наименее. Чем более электроотрицательный атом, тем лучше он способен нести отрицательный заряд . Таким образом, анион этоксида является наиболее стабильным (самая низкая энергия, наименее основный) из трех сопряженных оснований, а анион этила является наименее стабильным (самая высокая энергия, самый основный).
Мы можем использовать тот же набор идей для объяснения разницы в основности воды и аммиака.
Глядя на значения pK и для соответствующих сопряженных кислот, мы знаем, что аммиак является более щелочным, чем вода.Кислород, как более электроотрицательный элемент, крепче держится за свою неподеленную пару, чем азот. Таким образом, неподеленная пара азота с большей вероятностью оторвется и образует новую связь с протоном — другими словами, она является более основной. Опять же, более реакционноспособное (более сильное) сопряженное основание означает менее реакционноспособную (более слабую) сопряженную кислоту.
При перемещении по вертикали в пределах данного столбца таблицы Менделеева мы снова наблюдаем четкую периодическую тенденцию кислотности. Лучше всего это иллюстрируется галогенидами: основность, как и электроотрицательность, увеличивается по мере продвижения вверх по колонке.
И наоборот, кислотность галоидокислот увеличивается по мере продвижения вниз по колонке.
Чтобы понять эту тенденцию, мы еще раз рассмотрим устойчивость сопряженных оснований. Поскольку фтор является наиболее электроотрицательным элементом галогена, можно было бы ожидать, что фторид также является наименее основным ионом галогена. Но на самом деле это наименее стабильная , и самая основная! Оказывается, при вертикальном движении в таблице Менделеева размер атома превосходит его электроотрицательность по отношению к основности.Атомный радиус йода примерно в два раза больше, чем у фтора, поэтому в ионе йода отрицательный заряд распределен по значительно большему объему:
Это иллюстрирует фундаментальное понятие органической химии, достаточно важное, чтобы выделить его красным цветом:
Электростатические заряды, как положительные, так и отрицательные, более стабильны, когда они «рассредоточены», чем когда они ограничены одним атомом .
Мы будем видеть, как эта идея снова и снова выражается на протяжении всего нашего изучения реактивности органических веществ в различных контекстах. Пока эта концепция применяется только к влиянию атомного радиуса на стабильность аниона. Поскольку фторид является наименее стабильным (наиболее основным) из сопряженных галогенидных оснований, HF является наименее кислой из галогенокислот, лишь немного более сильной, чем уксусная кислота. HI с pK a около -9 является одной из самых сильных известных кислот.
Пока эта концепция применяется только к влиянию атомного радиуса на стабильность аниона. Поскольку фторид является наименее стабильным (наиболее основным) из сопряженных галогенидных оснований, HF является наименее кислой из галогенокислот, лишь немного более сильной, чем уксусная кислота. HI с pK a около -9 является одной из самых сильных известных кислот.
Что еще более важно для изучения биологической органической химии, эта тенденция говорит нам о том, что тиолы более кислые, чем спирты. Например, pK a тиоловой группы на боковой цепи цистеина составляет приблизительно 8.3, в то время как pK a для гидроксила в боковой цепи серина составляет порядка 17,
.Повторяю: сила кислоты увеличивается при движении вправо по строке периодической таблицы и при движении вниз по столбцу.
| Пример 7.6 |
|---|
Нарисуйте структуру сопряженного основания, которое образовалось бы, если соединение, указанное ниже, прореагировало с 1 молярным эквивалентом гидроксида натрия: Решение |
Эффект резонанса
В предыдущем разделе мы обратили внимание на периодические тенденции — различия кислотности и основности между группами, где обменный протон был связан с разными элементами. Теперь пришло время подумать о том, как структура различных органических групп влияет на их относительную кислотность или основность, даже когда мы говорим об одном и том же элементе, действующем как донор/акцептор протонов. Первая модельная пара, которую мы рассмотрим, — это этанол и уксусная кислота, но полученные нами выводы будут в равной степени справедливы для всех групп спирта и карбоновой кислоты.
Теперь пришло время подумать о том, как структура различных органических групп влияет на их относительную кислотность или основность, даже когда мы говорим об одном и том же элементе, действующем как донор/акцептор протонов. Первая модельная пара, которую мы рассмотрим, — это этанол и уксусная кислота, но полученные нами выводы будут в равной степени справедливы для всех групп спирта и карбоновой кислоты.
Несмотря на то, что они оба являются кислородными кислотами, значения pK и этанола и уксусной кислоты сильно различаются.Что делает карбоновую кислоту намного более кислой, чем спирт? Как и прежде, начнем с рассмотрения сопряженных базисов.
У обоих видов отрицательный заряд сопряженного основания удерживается кислородом, поэтому периодические тренды вызывать нельзя. Однако для уксусной кислоты есть ключевое отличие: можно привлечь резонансный вкладчик, в котором отрицательный заряд локализован на втором кислороде группы. Согласно нашим «правилам резонанса», две формы резонанса для сопряженного основания равны по энергии. Как вы, возможно, помните, это означает, что отрицательный заряд ацетат-иона не находится ни на одном кислороде, ни на другом: скорее, он разделен между ними двумя. Химики используют термин «делокализация заряда» для описания этой ситуации. В ионе этоксида, напротив, отрицательный заряд «заперт» на одном кислороде — ему больше некуда деться.
Как вы, возможно, помните, это означает, что отрицательный заряд ацетат-иона не находится ни на одном кислороде, ни на другом: скорее, он разделен между ними двумя. Химики используют термин «делокализация заряда» для описания этой ситуации. В ионе этоксида, напротив, отрицательный заряд «заперт» на одном кислороде — ему больше некуда деться.
Теперь пришло время вспомнить утверждение из предыдущего раздела, которое было настолько важным, что было выделено жирным шрифтом в отдельном абзаце — на самом деле, оно настолько важно, что мы просто повторим его еще раз: «Электростатические заряды , будь то положительные или отрицательные, более стабильны, когда они «растянуты», чем когда они ограничены одним атомом.«Теперь мы видим эту концепцию в другом контексте, где заряд «распыляется» (другими словами, делокализуется) в результате резонанса , а не просто из-за размера задействованного атома
. Делокализация заряда в результате резонанса оказывает очень сильное влияние на реакционную способность органических молекул, достаточное для того, чтобы объяснить разницу более чем в 12 pK a единиц между этанолом и уксусной кислотой (и помните, что pK a — это логарифмическое выражение). , поэтому мы говорим о разнице более чем на 10 12 между константами кислотности для двух молекул).Ион ацетата намного более стабилен, чем ион этоксида, и все из-за эффектов делокализации резонанса.
, поэтому мы говорим о разнице более чем на 10 12 между константами кислотности для двух молекул).Ион ацетата намного более стабилен, чем ион этоксида, и все из-за эффектов делокализации резонанса.
Эффект резонанса также прекрасно объясняет, почему атом азота является основным, когда он находится в амине, но , а не , когда он является частью амидной группы. Напомним, что в амиде связь углерод-азот имеет значительный характер двойной связи из-за второго резонансного фактора, в котором неподеленная пара азота является частью р-связи.
В то время как неподеленная электронная пара аминного азота «застревает» в одном месте, неподеленная пара амидного азота делокализована в результате резонанса.Обратите внимание, что в данном случае мы расширяем наше основное утверждение, чтобы сказать, что плотность электронов — в форме неподеленной пары — стабилизируется резонансной делокализацией, даже если в этом нет отрицательного заряда. Вот еще один способ подумать об этом: неподеленная пара на амидном азоте недоступна для связи с протоном — эти два электрона слишком «комфортны», будучи частью делокализованной системы пи-связи. Напротив, неподеленная пара на атоме азота амина не является частью делокализованной р-системы и очень готова к образованию связи с любым кислотным протоном, который может оказаться поблизости.
Часто требуется тщательное размышление, чтобы предсказать самый кислый протон в молекуле. Аскорбиновая кислота, также известная как витамин С, имеет pK и 4,1.
В этой молекуле четыре гидроксильных группы – какая из них наиболее кислая? Если мы рассмотрим все четыре возможных сопряженных основания, то обнаружим, что есть только одно, для которого мы можем делокализовать отрицательный заряд по двум атомам кислорода.
| Пример 7.7 |
|---|
Расположите приведенные ниже соединения от наиболее кислых до наименее кислых и объясните свои рассуждения. Решение |
Индуктивный эффект
Сравните значения pK и уксусной кислоты и ее моно-, ди- и трихлорпроизводных:
Присутствие хлора явно увеличивает кислотность группы карбоновой кислоты, но аргумент здесь не имеет отношения к делокализации резонанса, потому что для хлорированных молекул нельзя привлечь никаких дополнительных резонансных вкладчиков. Скорее, объяснение этого явления связано с так называемым индуктивным эффектом . Атом хлора более электроотрицателен, чем водород, и поэтому способен «индуцировать» или «притягивать» электронную плотность к себе, от карбоксилатной группы. По сути, атомы хлора способствуют дальнейшему распределению электронной плотности сопряженного основания, что, как мы знаем, оказывает стабилизирующее действие. В этом контексте заместитель хлора называется электроноакцепторной группой .Обратите внимание, что эффект снижения pK a каждого атома хлора, хотя и значительный, не столь драматичен, как эффект делокализирующего резонанса, иллюстрируемый разницей значений pK a между спиртом и карбоновой кислотой. В целом резонансные эффекты более мощные, чем индуктивные эффекты .
Скорее, объяснение этого явления связано с так называемым индуктивным эффектом . Атом хлора более электроотрицателен, чем водород, и поэтому способен «индуцировать» или «притягивать» электронную плотность к себе, от карбоксилатной группы. По сути, атомы хлора способствуют дальнейшему распределению электронной плотности сопряженного основания, что, как мы знаем, оказывает стабилизирующее действие. В этом контексте заместитель хлора называется электроноакцепторной группой .Обратите внимание, что эффект снижения pK a каждого атома хлора, хотя и значительный, не столь драматичен, как эффект делокализирующего резонанса, иллюстрируемый разницей значений pK a между спиртом и карбоновой кислотой. В целом резонансные эффекты более мощные, чем индуктивные эффекты .
Индуктивный электроноакцепторный эффект хлора проявляется через ковалентные связи, и его влияние заметно уменьшается с расстоянием — таким образом, хлор, находящийся на расстоянии двух атомов углерода от группы карбоновой кислоты, имеет уменьшенный эффект по сравнению с хлором, удаленным всего на один углерод.
| Пример |
|---|
Расположите приведенные ниже соединения от наиболее кислых до наименее кислых и объясните свои рассуждения. Решение |
Периодические тренды и оксиды
Оксиды
Основные оксиды
Оксид-ион является очень сильно основным анионом из-за его очень малого размера и высокого заряда. Поскольку ион гидроксида является самым сильным основанием, которое может сохраняться в воде, ион оксида количественно реагирует с водой с образованием ионов гидроксида.Это пример выравнивающего свойства очень прочных оснований. Согласно обобщенным правилам растворимости, в воде растворяются только оксиды металлов некислого и слабокислого катиона. Растворение является сильно экзотермическим с образованием гидроксида катиона. Эти водные растворы являются сильно щелочными. Оксиды металлов, которые проявляют такое поведение, называются основными оксидами, потому что они действуют как основания.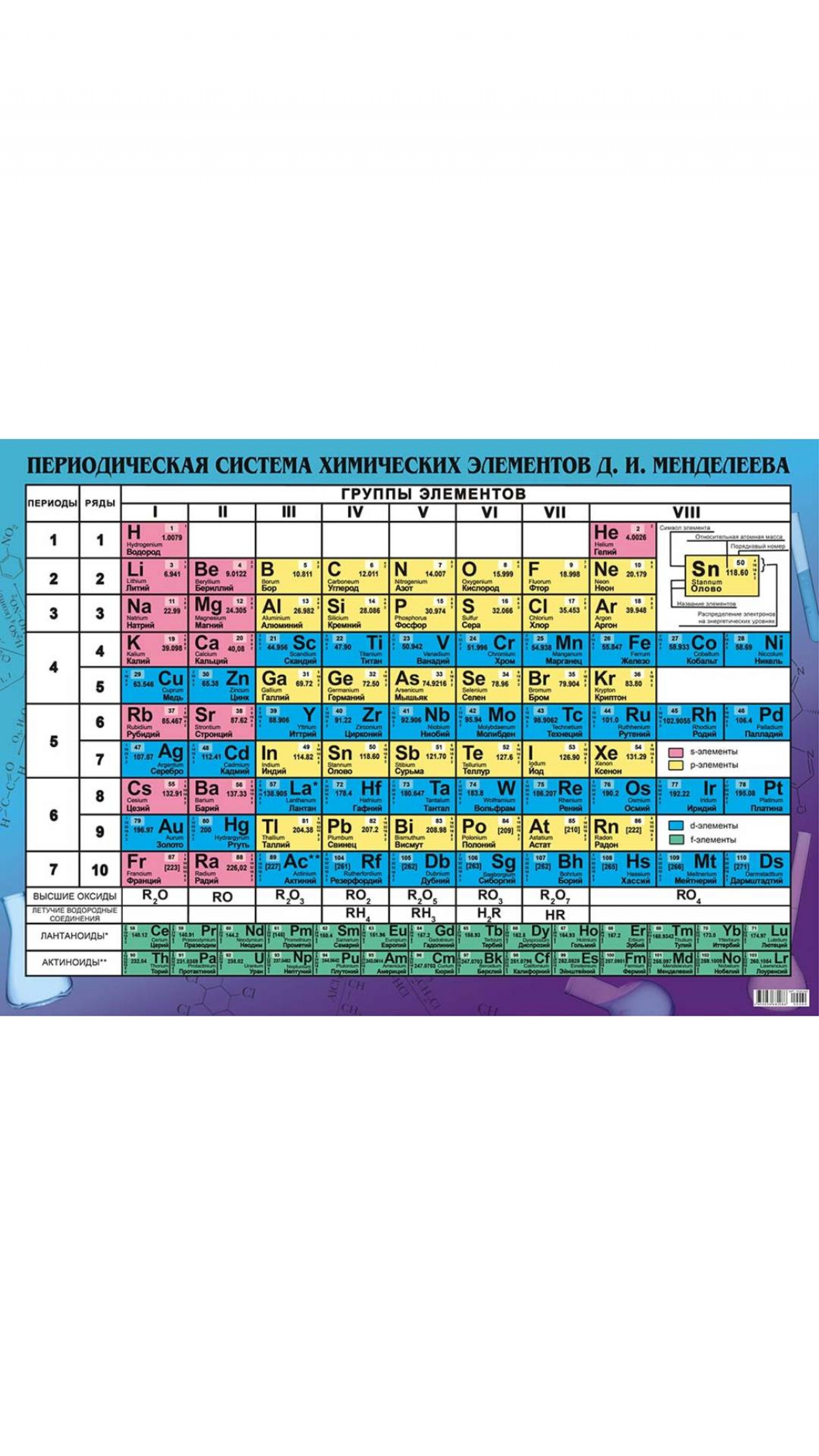 Оксиды некислотных катионов настолько реагируют с водой, что их редко можно увидеть.Эти оксиды нельзя получить путем обезвоживания гидроксида при высокой температуре.
Оксиды некислотных катионов настолько реагируют с водой, что их редко можно увидеть.Эти оксиды нельзя получить путем обезвоживания гидроксида при высокой температуре.
Более распространены оксиды слабокислых катионов. Например, известь, CaO. Известь можно получить в промышленных масштабах путем термического разложения известняка.
Оксиды слабокислых катионов экзотермически реагируют с водой с образованием гидроксида.
Гидроксиды слабокислых катионов не расплываются.
Оксиды слабокислых катионов и умереннокислых катионов нерастворимы в воде.Эти оксиды не вносят в раствор значительных количеств иона O 2-, поэтому ионы гидроксида не образуются. Хотя эти оксиды существенно не изменяют рН воды, они все же являются основаниями и нейтрализуют сильные кислоты.
FeO + 2 H 3 O + (водн.) Fe 2+ (водн.) + 3 H 2 OОксиды кислот (ангидриды кислот)
Многие из ковалентных оксидов очень кислых катионов (гипотетических) проявляют кислотные свойства.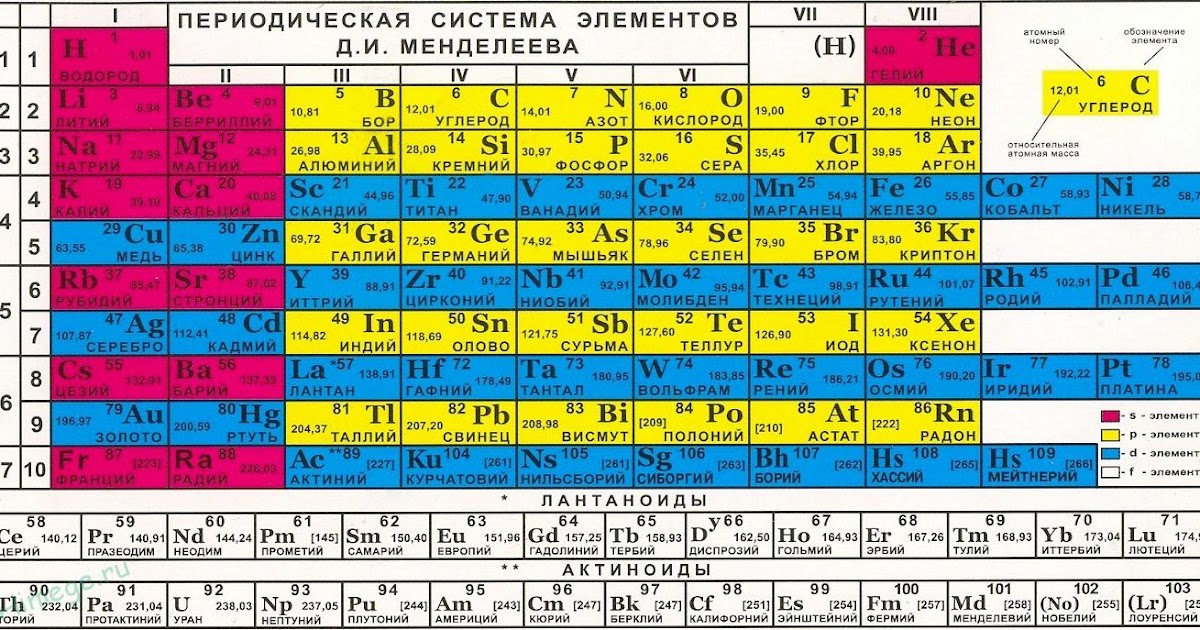 Многие из этих оксидов растворяются в воде с образованием оксоаниона, в котором элемент имеет ту же степень окисления, что и оксид.
Оксид будет растворим, если при его реакции с водой образуется сильная или очень сильная кислота, поскольку эти кислоты полностью ионизируются, сдвигая равновесие в сторону растворения. Если реакция с водой дает умеренно кислую оксокислоту, оксид может быть или не быть растворимым. Если образующаяся оксокислота является слабокислой, оксид обычно, но не всегда, нерастворим в воде.
Многие из этих оксидов растворяются в воде с образованием оксоаниона, в котором элемент имеет ту же степень окисления, что и оксид.
Оксид будет растворим, если при его реакции с водой образуется сильная или очень сильная кислота, поскольку эти кислоты полностью ионизируются, сдвигая равновесие в сторону растворения. Если реакция с водой дает умеренно кислую оксокислоту, оксид может быть или не быть растворимым. Если образующаяся оксокислота является слабокислой, оксид обычно, но не всегда, нерастворим в воде.Некоторые кислотные оксиды, такие как оксиды серы и азота, загрязняют воздух, потому что они реагируют с влагой в воздухе, вызывая кислотные дожди.
Нерастворимые в воде оксиды классифицируются как кислотные, если они реагируют с основаниями с образованием солей.
Есть несколько оксидов, таких как NO 2 и ClO 2 , в которых центральный атом степень окисления не соответствует степени окисления этого элемента в стабильном или известная оксокислота.
 Такие оксиды образуют смесь оксокислот или анионов при диспропорционировании.
Такие оксиды образуют смесь оксокислот или анионов при диспропорционировании.Оксиды амфотерные
Некоторые оксиды проявляют как кислотные, так и основные свойства.Общие правила
В общем, электроположительный характер центрального атома оксида будет определять, будет ли оксид будет кислотным или основным. Чем более электроположителен центральный атом, тем более основным является оксид.Чем более электроотрицательным является центральный атом, тем более кислым является оксид. Электроположительный характер увеличивается справа влево по периодической таблице и увеличивается вниз по столбцу.Результирующая граница между основными и кислотными оксидами проходит по диагонали.
| Свойства s – и p – Блочные элементы | ||||||
| Ли | Быть | Б | С | Н | О | Ф |
| Нет данных | мг | Ал | Си | Р | С | Кл |
| К | Са | Га | Ге | Как | Se | Бр |
| Руб | Старший | В | Сн | Сб | Те | я |
| Cs | Ба | Тл | Пб | Би | ПО | В |
| Основные оксиды | Амфотерные оксиды | Кислотные оксиды | ||||
Есть три оксида неметаллов из верхней правой части периодической таблицы, CO, NO и N 2 O, которые имеют
такие низкие степени окисления центрального атома, что они дают нейтральные водные растворы.
Поскольку кислотность катиона быстро возрастает с увеличением заряда, d – блокируют элементы, которые проявляют широкий спектр степеней окисления, могут иметь один или несколько оксидов, проявляющих только основные свойства и один или несколько оксидов, проявляющих только кислотные свойства. Чем выше степень окисления тем более кислый соответствующий оксид. Хром является примером такого элемента.
| Оксид | Номер окисления | Категория |
| CrO | Кр 2+ | базовый |
| Cr 2 O 3 | Кр 3+ | амфотерный |
| CrO 3 | Кр 6+ | кислый |
Основные оксиды реагируют с кислыми оксидами с образованием солей оксоанионов.
Поскольку вода не содержит солей оксо-анионов, которые являются слишком основными, чтобы сохраняться в может образовываться вода. Эти реакции кислотных и основных анионов имеют важное практическое значение. применения, такие как контроль газообразных кислотных оксидов, которые при выбросе в атмосферу приводит к кислотным дождям. Ca(OH) 2 + SO 2 + 1/2 O 2 CaSO 4 + H 2 O
Эти реакции также используются в производстве таких материалов, как бетон, стекло и керамика.
Значение pH – обзор
3.5 Протонные кислоты и основания
(38)Многие соединения, содержащие водород, могут отдавать протоны растворителю, такому как вода, и поэтому ведут себя как кислоты. Сама вода в небольшой степени подвергается ионной диссоциации путем автопротолиза; формально этот процесс обычно описывается равновесием
, хотя следует помнить, что оба иона в дальнейшем сольватируются и что время, которое протон проводит в тесной ассоциации с какой-либо одной молекулой воды, составляет, вероятно, лишь около 10 -13 с. (См. также стр. 630-2 для структурных исследований [H(OH 2 ) n ] + n = 1-6.) В зависимости от того, какой аспект процесса подчеркивается, виды H 3 O + (водн.) можно назвать ионом оксония, ионом водорода или просто сольватированным (гидратированным) протоном. Константа равновесия для автопротолиза составляет
(См. также стр. 630-2 для структурных исследований [H(OH 2 ) n ] + n = 1-6.) В зависимости от того, какой аспект процесса подчеркивается, виды H 3 O + (водн.) можно назвать ионом оксония, ионом водорода или просто сольватированным (гидратированным) протоном. Константа равновесия для автопротолиза составляет
, и, поскольку концентрация воды практически постоянна, ионное произведение воды можно записать как
Значение К w зависит от температуры и равно 0.69 х 10 -14 моль 2 1 -2 при 0°С, 1.00 х 10 -14 при 25°С и 47.6 х 10 -14 при 100°С. Отсюда следует, что концентрация ионов водорода в чистой воде при 25°С составляет 10 -7 моль 1 -1 . Кислоты увеличивают эту концентрацию за счет реакции растворе, а символ НА подразумевает только то, что (водные) виды могут действовать как доноры протонов: это могут быть нейтральные виды (т. г. H 2 S), анион (например, H 2 PO 4 − ) или катион, такой как [Fe(H 2 O) 6 ] 3+ Концентрация ионов водорода обычно выражается как рН (см. панель). В разбавленном растворе концентрация молекул воды постоянна при 25°С (55,345 моль л -1 ), а диссоциацию кислоты часто записывают как
г. H 2 S), анион (например, H 2 PO 4 − ) или катион, такой как [Fe(H 2 O) 6 ] 3+ Концентрация ионов водорода обычно выражается как рН (см. панель). В разбавленном растворе концентрация молекул воды постоянна при 25°С (55,345 моль л -1 ), а диссоциацию кислоты часто записывают как
HA+⇌H++A-;ka=[H+][ A-]/[HA]mol 1-1
Кислотная константа K a также может быть выражена соотношением
PKa=-logKa.Следовательно, as Ka=55,345 KPKa=pK−1,0734
Далее, поскольку свободная энергия диссоциации определяется выражением
ΔG° =-RTlnk =-2,3026RTlogk,
, стандартная свободная энергия диссоциации равна 9003 5,708pk =5,708(pKa+1,734)kJmo1-1
Дополнительные сведения об ионизации слабых кислот и оснований, теории индикаторов, буферных растворах и кислотно-щелочном титровании см. в учебниках по аналитической химии. (39–41)
(39–41)
Давно отмечаются различные тенденции в силе кислот многих бинарных гидридов и оксокислот. (38) Значения для некоторых простых гидридов приведены в табл. 3.4, из которой видно, что сила кислоты увеличивается с увеличением атомного номера как в любом одном горизонтальном периоде, так и в любой вертикальной группе. Было предпринято несколько попыток интерпретировать эти тенденции, по крайней мере качественно, но ситуация сложная. Тенденцию к увеличению кислотности слева направо в таблице Менделеева можно было бы приписать увеличению электроотрицательности элементов, что способствовало бы высвобождению протона, но это явно не доминирующий эффект в какой-либо одной группе, поскольку тенденция наблюдается именно в этой группе. противоположное направление.Внутри группы преобладает уменьшение прочности связи с увеличением атомного номера, также важны энтрофии сольватации. Следует, пожалуй, также подчеркнуть, что термодинамические расчеты не «объясняют» наблюдаемые силы кислот; они просто относят общие значения Δ G , Δ H и Δ S к различным условным подпроцессам, таким как энергии диссоциации связи, энергии ионизации, сродство к электрону, теплота и энтрофия гидратации и т.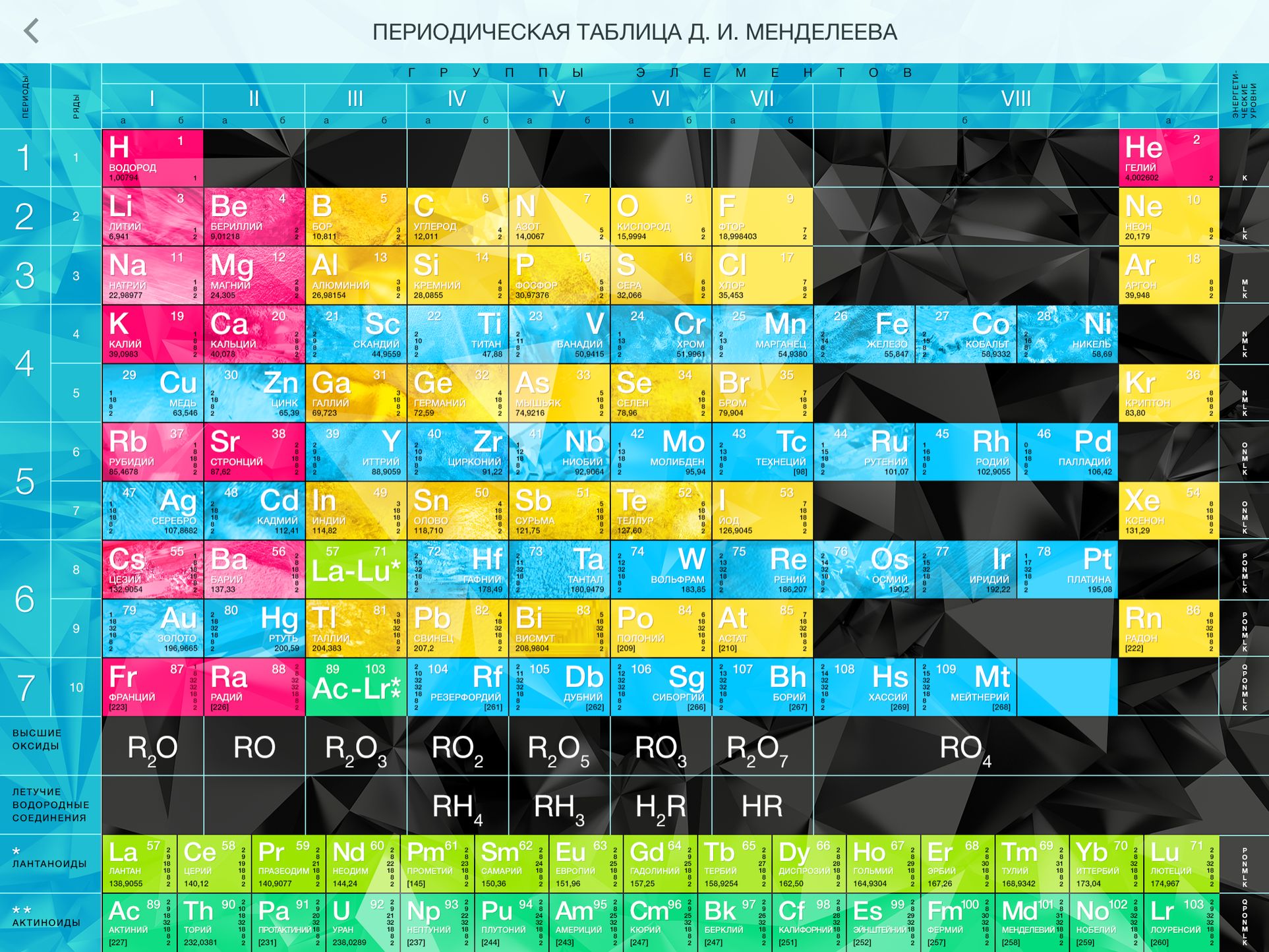 д., которые сами имеют эмпирически наблюдаемые значения, которые трудно вычислить ab initio.
д., которые сами имеют эмпирически наблюдаемые значения, которые трудно вычислить ab initio.
Таблица 3.4. Приблизительные значения P K A для простых гидридов
- (i)
для многоосновных одноядерных оксокислот последовательные константы диссоциации кислот уменьшаются примерно в соотношении 1 :10 −5 :10 −10 :…;
- (ii)
значение первой константы ионизации для кислот формулы XO m (OH) n n чувствительно зависит от 904 n m
и приблизительно не зависит от 904 n m для постоянной м , будучи ⩽10 −8 для м = 0, ˜10 −2 для м = 1, ˜10 3 для м = 1 0,8 и 43 >1 на м = 3.
- 12 XO (OH) N (слабый) (слабый)
(OH) N (сильный)
XO 3 (OH) n (очень сильный) - 1
P K 2 K ΔP K - 2
H 2 S 7 14 7 9 2 SE 2 SE 4 12 8 H 2 TE 3 11 8 - 2
- 1
– H 0 9 HSO 3 F + SBF 5 1 5 15-27 HF + SBF 5 (1 м) (1 м)9 20.420.4 9 HSO 3 F9 15.0 - 2
H 2 SO 4 12.0 HF ~ 111 H 3 Po 4 4
5.0 H 2 SO 4 (63% в H 2 O) 4.9 HCO 2 H 2.2 - 2
- литий (Li),
- натрий (Na),
- калий (K),
- рубидий (Rb),
- цезий (Cs)
- франций (Fr)
| 46 | NH 3 | 351 | OH 2 | 16 | FH | 3 | |
| PH 3 | 27 2 | 7 | 7 | CLH | -7 | ||
| 0 | SEH 2 | 4 | BRH | -9 | |||
| 0 | TEH 2 | 3 | IH | -10 | -10 |
Концепция pH
Концепция PH
На сегодняшний день универсально используемая мера концентрации водорода ионов была введена в 1909 году. датский биохимик С.PL Sørensen во время работы в Carlsberg Breweries ( Biochem. Z. 21, 131, 1909):
датский биохимик С.PL Sørensen во время работы в Carlsberg Breweries ( Biochem. Z. 21, 131, 1909):
pH =-log[H+]
показатель степени или «десятая степень», используемый для выражения концентрации. Таким образом, концентрация ионов водорода 10 -7 моль -1 обозначается как pH 7, в то время как кислые растворы с более высокими концентрациями ионов водорода имеют более низкий pH. Например, сильная кислота с концентрацией 1 ммоль -1 имеет рН 3, тогда как сильная щелочь той же концентрации имеет рН 11, так как − ] = 10 −11 .
К сожалению, определить pH гораздо проще, чем измерить его, несмотря на наличие в продаже приборов, предназначенных для этого. В большинстве инструментов используется электрохимическая ячейка, такая как
стеклянный электрод | тестовое решение| 3.5 M KCl(aq)|Hg2Cl2|Hg
Если предположить, что стеклянный электрод показывает идеальный отклик водородного электрода, то ЭДС ячейки по-прежнему зависит от величины потенциала жидкостного перехода E j и коэффициентов активности γ ионных частиц:
E =E°-RTFln γc1[C1-]+Ej-RTFln γH[H+]
По этой причине pH, измеренный любым из существующих национальных стандартов, является рабочей величиной, которая не имеет простое фундаментальное значение. Он определяется уравнением
Он определяется уравнением
pH(χ) =pH(S)+(Ex-Es)FRTln 10
, где pH(S) — это присвоенный pH стандартного буферного раствора, такого как те, которые поставляются с pH-метрами. .
Только в случае разбавленных водных растворов (<0,1 моль -1 ), которые не являются ни сильнокислыми, ни щелочными (2 < pH < 12), значение pH(X) такое, что
pH(X) =log[H+ ]γ±±0,02
где γ ± , средний коэффициент ионной активности типичного одновалентного электролита, определяется как
-logγ± =AI1/2(1+l)-12
I — ионная сила раствора, а A — константа, зависящая от температуры (0.511 1/2 моль -1/2 при 25°С; 0,501 1/2 моль -1/2 при 15°С). Очевидно, что неразумно связывать показания рН-метра слишком близко с рН, за исключением очень контролируемых условий, и еще менее разумно связывать показания с фактической концентрацией ионов водорода в растворе. Для дальнейшего обсуждения измерений pH см. Pure Appl. хим. 57, 531–42 (1985): Определение шкал pH, стандартные справочные значения, измерение pH и соответствующая терминология.Также C&E News , 20 октября 1997 г., с. 6.
Pure Appl. хим. 57, 531–42 (1985): Определение шкал pH, стандартные справочные значения, измерение pH и соответствующая терминология.Также C&E News , 20 октября 1997 г., с. 6.
Закономерности наблюдаемых сил оксокислот сформулированы в виде двух правил Л. Полинга и др.:
Таким образом, чтобы проиллюстрировать первое правило: НРО42-;
k2=[H+][HPO42-][h3PO4-]=6,31X10-8моль1-1;pK2=7,20HPO42-⇌H++PO43-;k3=[H+][PO43-][HPO42-]=4,22 Х10-13моль1-1; pK3=12,37
Качественно уменьшение p K a для каждой последующей стадии ионизации следует ожидать, поскольку протон должен отделяться от аниона с возрастающим отрицательным зарядом, хотя коэффициент уменьшения примерно 10 5 труднее рационализировать количественно.
Кислоты, иллюстрирующие второе правило, приведены в таблице 3.5. Качественное объяснение этой закономерности состоит в том, что с увеличением числа атомов кислорода одиночный отрицательный заряд на анионе может распространяться шире, уменьшая тем самым электростатическую энергию, притягивающую протон и облегчающую ионизацию. На этом основании можно было бы ожидать еще более резкого эффекта, если бы анион был одноатомным (например, S 2-, Se 2-, Te 2-), так как притяжение этих дианионов к протонам будет очень сильным и константы кислотной диссоциации SH – , SeH – и TeH – соответственно малы; это действительно наблюдается, и отношение первой и второй констант диссоциации составляет ~10 8 , а не 10 5 (табл. 3.6).
Таблица 3.5. Значения P K A для некоторых мононуклеарных оксоацидов XO M (OH) N (P K A ≈ 8 – 5 N )
| Cl(OH) | 7. 2 2 | NO (OH) | 3.3 | № 2 (OH) | -1.4 | -1.4 | (OH) | (OH) | (-10) |
| BR (OH) | 8.7 | CLO (OH) | 2.0 | CLO9 (OH) | 9 -1-1 | MNO 3 (OH) | 9 –|||
| I (OH) | 10.0 | CO (OH) 2 | 3,9 (а) | ИО 2 (ОН) | 0.8 | ||||
| B (OH) 3 | 9.2 | 9 9.2 2 21.9 | SO 2 (OH) 2 | & lt; 0 | |||||
| AS (OH) 3 | 9.2 | SEO (OH) 2 | 9 2.6SEO 2 (OH) 2 1 2 | & lt; 0 | |||||
| SB (Oh ) 3 | 11,0 | TeO(OH) 2 | 2. 7 7 | ||||||
| PO (OH) 3 1 3 | 2.1 | ||||||||
| GE (OH) 4 | 8.6 | ASO (OH) 3 | 2.3 | 0 | |||||
| 1.6 | |||||||||
| ГПО(ОН) 2 | 1.8 (б) | ||||||||
| 2.0 (B) |
Таблица 3.6. Первые и второе ионизация констант для H 2 S, H 2 SE и H 2 SE
2 TE Результаты для двуядерных и многоядерных оксокислот также согласуются с этой интерпретацией. Так, для фосфорной кислоты H 4 P 2 O 7 последовательные значения p K и составляют 1,5, 2,4, 6,6 и 9,2; уменьшение в ~10 раз между p K 1 и p K 2 (вместо уменьшения в 10 5 ) связано с тем, что ионизация происходит от двух разных звеньев ПО 4 . Однако ионизация третьей ступени примерно на 10 5 меньше, чем первой ступени, а разница между средним значением первых двух и последних двух констант ионизации составляет ˜5 × 10 5 .
Так, для фосфорной кислоты H 4 P 2 O 7 последовательные значения p K и составляют 1,5, 2,4, 6,6 и 9,2; уменьшение в ~10 раз между p K 1 и p K 2 (вместо уменьшения в 10 5 ) связано с тем, что ионизация происходит от двух разных звеньев ПО 4 . Однако ионизация третьей ступени примерно на 10 5 меньше, чем первой ступени, а разница между средним значением первых двух и последних двух констант ионизации составляет ˜5 × 10 5 .
Другим явлением, тесно связанным с кислотно-основным равновесием, является так называемый гидролиз катионов металлов в водном растворе, который, вероятно, лучше рассматривать как протолиз гидратированных катионов, например:
«гидролиз»:
Fe3+ + h3O ⇌ [Fe(OH)]2++H+
протолиз:
[Fe(h3O)6]3++h3O⇌ [Fe(h3O)5(OH)]2++h4O+; pka 3,05[Fe(h3O)5(OH)]2++h3O⇌[Fe(h3O)4(OH)2]++h4O+; pka 3,26
Именно эти реакции придают водным растворам солей железа (III) характерную окраску гидроксоаквот от желтой до красновато-коричневой, тогда как недиссоциированный ион [Fe(H 2 O) 6 ] 3+ имеет бледно-лиловый цвет, как видно из кристаллов квасцов железа (III) {[Fe(H 2 O) 6 ][K(H 2 O) 6 ] (SO 4 ) 2 } и нитрат железа (III) {[Fe(H 2 O) 6 ](NO 3 ) 3 . 3H 2 О}. Такие реакции могут переходить к стадии, когда уменьшенный заряд гидратированного катиона позволяет образовывать полиядерные соединения с оксо- или гидроксо-мостиками, которые в конечном итоге осаждаются в виде водных оксидов (см. обсуждение химии многих элементов в последующих главах). Полезное резюме представлено на рис. 3.4. Напротив, обширные исследования значений p K a гидратированных ионов металлов в растворе дали множество числовых данных, но не привели к каким-либо обобщениям, подобным тем, которые только что обсуждались для гидридов и оксокислот неметаллов. (42) Типичный p K a значения попадают в диапазон 3–14, и, как и ожидалось, существует общая тенденция к увеличению протолиза (p K a значения до быть ниже) тем выше заряд катиона. Например, водные растворы солей железа (III) более кислые, чем растворы соответствующих солей железа (II). Однако какие-либо закономерности в р К а для рядов катионов с одинаковым ионным зарядом обнаружить трудно, и ясно, что необходимо учитывать и специфические «химические» эффекты.
3H 2 О}. Такие реакции могут переходить к стадии, когда уменьшенный заряд гидратированного катиона позволяет образовывать полиядерные соединения с оксо- или гидроксо-мостиками, которые в конечном итоге осаждаются в виде водных оксидов (см. обсуждение химии многих элементов в последующих главах). Полезное резюме представлено на рис. 3.4. Напротив, обширные исследования значений p K a гидратированных ионов металлов в растворе дали множество числовых данных, но не привели к каким-либо обобщениям, подобным тем, которые только что обсуждались для гидридов и оксокислот неметаллов. (42) Типичный p K a значения попадают в диапазон 3–14, и, как и ожидалось, существует общая тенденция к увеличению протолиза (p K a значения до быть ниже) тем выше заряд катиона. Например, водные растворы солей железа (III) более кислые, чем растворы соответствующих солей железа (II). Однако какие-либо закономерности в р К а для рядов катионов с одинаковым ионным зарядом обнаружить трудно, и ясно, что необходимо учитывать и специфические «химические» эффекты.
Рисунок 3.4. График эффективных ионных радиусов в зависимости от степени окисления для различных элементов.
Кислотность по Бренстеду не ограничивается разбавленными водными растворами, и идеи, развитые на предыдущих страницах, могут быть распространены на доноры протонов в неводных растворах. (43) , (44) В органических растворителях и безводных протонных жидкостях понятия концентрации ионов водорода и рН если и не бессмысленны, то, безусловно, практически неприменимы, и кислотность должна определяться в какой-то другой шкале.Наиболее часто используется функция кислотности Гаммета H 0 , которая позволяет сравнивать различные кислоты в данном растворителе и данную кислоту в различных растворителях. Для равновесия между основанием и его сопряженной кислотой (часто цветной индикатор)
функция кислотности определяется как
В очень разбавленных растворах
так, что в воде H 0 становится таким же, как pH. Некоторые значения типичных безводных кислот приведены в таблице 3.7, и они обсуждаются более подробно в соответствующих разделах последующих глав.
Некоторые значения типичных безводных кислот приведены в таблице 3.7, и они обсуждаются более подробно в соответствующих разделах последующих глав.
Таблица 3.7. Функции кислотности Хамметта для некоторых безводных кислот
| Acid |
|---|
Следует отметить, что добавление SbF 5 к HF значительно повышает его кислотность, и такой же эффект может быть достигнут. и TaF 5 :
и TaF 5 :
Повышение кислотности HSO 3 F добавлением SbF 5 является более сложным, и соответствующие равновесия обсуждаются на стр.570.
Щелочные металлы: факты об элементах первого столбца периодической таблицы
Щелочные металлы окружают вас повсюду. Натрий содержится в поваренной соли, литий в аккумуляторе телефона и калий в бананах. Щелочные металлы составляют шесть различных элементов, находящихся в первом столбце периодической таблицы. Это:

Щелочные металлы называются так потому, что при взаимодействии с водой они образуют сильнощелочные вещества. Щелочность относится к pH вещества или способности нейтрализовать кислоту. Вещества с высокой щелочностью могут образовывать сильные основания, способные нейтрализовать кислоты и поддерживать стабильный уровень pH.
У каждого элемента есть ядро, состоящее из протонов и нейтронов, и щелочные металлы не исключение. Ядра атомов окружают электроны, представляющие собой частицы с отрицательным зарядом. Эти электроны существуют в энергетических оболочках вокруг ядер атомов, каждая из которых может содержать различное количество электронов. Первая оболочка может содержать до двух электронов, вторая — до восьми, третья — 18 и четвертая — 32. Именно эти электронные оболочки и то, как устроены щелочные металлы, делают их такими реактивными.
Все атомы, естественно, хотят иметь полностью заполненную внешнюю оболочку электронов. Однако все элементы в этом первом столбце периодической таблицы имеют один электрон на внешней оболочке. Эта самая внешняя оболочка также называется валентной оболочкой, а электроны, которые там находятся, называются валентными электронами.
Эта самая внешняя оболочка также называется валентной оболочкой, а электроны, которые там находятся, называются валентными электронами.
Наличие только одного электрона на самой внешней оболочке позволяет атомам щелочных металлов очень легко достигать точки стабильности — им достаточно потерять один электрон! Эта готовность и легкость потери электрона для достижения состояния равновесия известна как высокая реактивность.На самом деле реактивность в химии определяется количеством электронов на самой внешней оболочке. Благородные газы (такие элементы, как неон и гелий) очень неактивны, потому что их самые внешние электронные оболочки заполнены.
«Поскольку щелочные металлы имеют только один валентный электрон, они обычно достигают этого состояния, отдавая этот электрон. В этом процессе говорят, что щелочной металл окисляется, и все, что отбирает электрон у щелочного металла, восстанавливается. Все щелочные металлы любят отдавать свой единственный валентный электрон», — говорит д-р. Чип Натаро, профессор химии в колледже Лафайет в Истоне, штат Пенсильвания. «Поскольку электроны имеют заряд -1, потеря электрона заставляет атом иметь заряд +1. Когда это происходит, атом называется ионом, а поскольку он будет иметь положительный заряд, его называют катионом. … Итак, все щелочные металлы любят образовывать катионы с зарядом +1».
Чип Натаро, профессор химии в колледже Лафайет в Истоне, штат Пенсильвания. «Поскольку электроны имеют заряд -1, потеря электрона заставляет атом иметь заряд +1. Когда это происходит, атом называется ионом, а поскольку он будет иметь положительный заряд, его называют катионом. … Итак, все щелочные металлы любят образовывать катионы с зарядом +1».
Поскольку щелочные металлы очень реакционноспособны, они обычно встречаются в природе в сочетании с другими металлами.
Если элемент обладает высокой реакционной способностью, его труднее найти в природе.
«Все эти элементы были впервые обнаружены в соединениях, [и] некоторые открытия трудно объяснить из-за обилия и использования соединений», — говорит Натаро. «По мере того, как вы спускаетесь по периодической таблице, щелочные металлы становятся более склонными терять свой валентный электрон», и, таким образом, «количество элемента, встречающегося в природе, также уменьшается, [что приводит к] более поздним датам открытия».
Когда были открыты щелочные металлы?
Литий был впервые обнаружен в 1817 году, когда Йохан Август Арфведсон, шведский химик, анализировал минеральную руду.Цезий и рубидий были открыты в 1860 и 1861 годах, соответственно, немецкими химиками Робертом Бунзеном (который дал свое имя горелке Бунзена) и Густавом Кирхгофом (который разработал законы Кирхгофа для электрического тока). Франций, наиболее реакционноспособный из известных нам щелочных металлов, был открыт в 1939 году французским ученым Маргаритой Перей в Институте Кюри в Париже.
Натрий и калий, два очень распространенных щелочных металла, имеют неизвестные даты открытия, они использовались так долго.Но в чистом виде они не были выделены до 1807 года (известным химиком Хамфри Дэви). Рубидий не был выделен до 1928 года также Бунзеном и Кирхгофом.
Одной из наиболее распространенных характеристик щелочных металлов является их реакционная способность по отношению к воде и воздуху. Эти элементы будут танцевать, шипя из-за образования газообразного водорода, и часто взрываются. Они становятся более реактивными по мере продвижения вниз по периодической таблице, причем цезий и франций настолько реактивны, что могут загореться, просто находясь на воздухе.Элементы также увеличивают атомный радиус, уменьшают электроотрицательность и уменьшают точки плавления и кипения по мере продвижения вниз по периодической таблице.
Они становятся более реактивными по мере продвижения вниз по периодической таблице, причем цезий и франций настолько реактивны, что могут загореться, просто находясь на воздухе.Элементы также увеличивают атомный радиус, уменьшают электроотрицательность и уменьшают точки плавления и кипения по мере продвижения вниз по периодической таблице.
Вы можете удивиться, как щелочные металлы были обнаружены в природе, если они так бурно реагируют на воздух и воду. Что ж, как оказалось, большинство щелочных металлов встречаются в природе в виде ионов из-за их сильного желания реагировать и терять этот один валентный электрон. В своей ионной форме металлы гораздо менее реакционноспособны.
Щелочные металлы в повседневной жизни
Щелочные металлы имеют интересную химическую двойственность, потому что они очень распространены в повседневной жизни, но также очень необычны в своих необработанных элементарных формах.
Например, натрий не встречается в природе и должен быть получен из соединений. Натрий и калий являются важными элементами в повседневной жизни, а натрий помогает регулировать кровяное давление и перемещать электролиты по клеткам. Натрий также соединяется с другими соединениями, образуя поваренную соль и пищевую соду. Калий помогает регулировать кровяное давление и уровень глюкозы и содержится в удобрениях. Литий, как упоминалось ранее, используется в производстве аккумуляторов, а также является лекарством, стабилизирующим настроение.
Натрий и калий являются важными элементами в повседневной жизни, а натрий помогает регулировать кровяное давление и перемещать электролиты по клеткам. Натрий также соединяется с другими соединениями, образуя поваренную соль и пищевую соду. Калий помогает регулировать кровяное давление и уровень глюкозы и содержится в удобрениях. Литий, как упоминалось ранее, используется в производстве аккумуляторов, а также является лекарством, стабилизирующим настроение.
Более химически активные элементы, цезий, рубидий и франций, имеют меньше естественных применений.Цезий используется в атомных часах, сверлении и производстве оптического стекла среди других узкоспециализированных приложений. Рубидий используется в медицинской визуализации и вакуумных трубках. Франций, который встречается очень редко, не имеет большого коммерческого применения, но используется в исследованиях и для диагностики некоторых форм рака.
Наконец, все щелочные металлы также являются невероятно полезными учебными пособиями в области химии. Учителя любят демонстрировать принцип реактивности, бросая щелочной металл в воду только для того, чтобы класс с благоговением наблюдал, как он изрыгает огонь и взрывается.
Учителя любят демонстрировать принцип реактивности, бросая щелочной металл в воду только для того, чтобы класс с благоговением наблюдал, как он изрыгает огонь и взрывается.
Научный директор SLAS Майк Тарселли, доктор философии, включен в «Периодическую таблицу молодых химиков» ИЮПАК
Научный директор SLAS Майк Тарселли, доктор философии, внесенный в «Периодическую таблицу молодых химиков» ИЮПАК Директор Майк Тарселли, доктор философии, к «Периодической таблице молодых химиков» за 2019 год. Это признание является частью празднования 100 года 90 137 летия ИЮПАК и чествует разнообразную группу из 118 выдающихся молодых химиков со всего мира, которые воплощают в себе миссию и основные ценности ИЮПАК, включая содействие всемирным коммуникациям в области химических наук и объединение академических, промышленных и химия госсектора на общем языке.
Начиная с июля 2018 года, IUPAC ежемесячно выявляет десять элементов; О признании Тарселли было объявлено в Генте, Бельгия, в воскресенье, 19 мая. Тарселли представлен элементом америций, синтетическим радиоактивным химическим элементом с символом Am и атомным номером 95.
«Для меня большая честь быть выбранным IUPAC и Международная сеть молодых химиков. Замечательно быть в числе многих достойных ученых и лидеров со всего мира.Я надеюсь использовать это признание для достижения наших образовательных целей и подготовить следующее поколение к карьере на стыке химии, биологии, автоматизации и данных», — сказал Тарселли. Среди других лауреатов — профессора, руководители промышленных лабораторий и престижные научные сотрудники со всего мира. См. полный список награжденных на сегодняшний день.
До прихода в SLAS в сентябре 2018 года Тарселли занимал должность заместителя директора по информационным системам в Novartis; провел лабораторные исследования и развитие бизнеса в стартапе Biomedisy; провел год в контрактных исследованиях и создал медицинские молекулы в Millennium Pharmaceuticals и Ariad в Бостоне.Он совмещал свой опыт работы с ролью волонтера в некоммерческих советах, наставничеством студентов и работой с общественностью.
Майк был признан научным сотрудником Википедии 2018 года, победителем конкурса Novartis 2017 года «Что возможно?» конкурса, VIP-наставник Массачусетского университета (UMass), лауреат премии за развитие лидерства Американского химического общества, в центре внимания выпускников исследований Scripps и научный сотрудник отдела химических коммуникаций Национального научного фонда. Он воспитал более 70 студентов, постдоков и молодых специалистов, а также провел более 30 плакатных семинаров и групп по вопросам карьеры.Майк является автором 24 рецензируемых публикаций по таким темам, как полный синтез, катализ золота, соединение титана, наука о данных, рекомендательные системы и научная политика.
Майк получил степень бакалавра химии в Массачусетском университете в Амхерсте, докторскую степень. получил степень бакалавра металлоорганической химии в Университете Северной Каролины в Чапел-Хилл и закончил докторантуру в Scripps Research, изучая антиноцицептивные натуральные продукты.
В настоящее время он входит в совет директоров Ассоциации выпускников UMass-Amherst, оценивает проекты на ежегодной ярмарке науки и техники штата Массачусетс, является наставником в качестве консультанта выпускников UMass и ведет работу Shadow Host, а также возглавляет в качестве капитана-волонтера ежегодную Кембриджскую (Mass .) Фестиваль науки.
*****
SLAS (Общество лабораторной автоматизации и скрининга) — международное сообщество, объединяющее 18 000 профессионалов и студентов, занимающихся открытиями и технологиями в области наук о жизни. Миссия SLAS состоит в том, чтобы объединить исследователей из научных кругов, промышленности и правительства для продвижения открытий и технологий в области наук о жизни посредством образования, обмена знаниями и создания глобального сообщества. Для получения дополнительной информации посетите www.slas.org .
###
Получить периодическую таблицу — Microsoft Store en-PH
Это приложение может
Получите доступ к интернет-соединениюМайкрософт.
 storeFilter.core.notSupported_8wekyb3d8bbwe
storeFilter.core.notSupported_8wekyb3d8bbwe Более
Получите доступ к интернет-соединению
Microsoft.storeFilter.core.notSupported_8wekyb3d8bbwe
Закрывать
Установка
Получите это приложение, войдя в свою учетную запись Microsoft, и установите его на десять устройств с Windows 10.Language supported
English (United States)中文(中国)
中文(香港特別行政區)
Français (France)
Deutsch (Deutschland)
Italiano (Italia)
Português (Brasil)
Türkçe (Türkiye)
Español (España, Alfabetización Internacional)
Nederlands (Nederland)
More
English (United States)
中文(中国)
中文(香港特別行政區)
Français (France)
Deutsch (Deutschland)
Italiano (Italia)
Português (Brasil)
Türkçe (Türkiye)
Español (España, Alfabetización Internacional)
Nederlands (Nederland)
Close
.


 Основные оксиды, основания и их растворимость. Амфотерные оксиды и соответствующие им гироксиды. Таблица.
Основные оксиды, основания и их растворимость. Амфотерные оксиды и соответствующие им гироксиды. Таблица.
.jpg) Подробнейший справочник технолога. Физические, химические, тепловые и прочие свойства веществ.
Подробнейший справочник технолога. Физические, химические, тепловые и прочие свойства веществ.