pH-метрия, водородный показатель, понятие рН
Понятие pH
Вода является слабым электролитом; она слабо диссоциирует по уравнению
H2O = H+ + OH–
При 25 °С в 1 л воды распадается на ионы 10-7 моль H2O. Концентрация ионов H+ и OH– (в моль/л) будет равна
[H+]=[OH–]=10-7
Чистая вода имеет нейтральную реакцию. При добавлении в нее кислоты концентрация ионов H+ увеличивается, т.е. [H+]>10-7 моль/л; концентрация ионов OH– уменьшается, т.е. [OH–]<10-7 моль/л. При добавлении щелочи концентрация ионов OH– увеличивается, т.е. [OH–]>10-7 моль/л; следовательно, [H+]<10-7 моль/л. На практике, для выражения кислотности или щелочности раствора вместо концентрации [H+] используют ее отрицательный десятичный логарифм, который называют водородным показателем pH:
pH=-lg[H+]
В нейтральной воде pH=7. Для растворов с кислой реакцией pH<7. Для растворов со щелочной реакцией pH>7.
Для растворов с кислой реакцией pH<7. Для растворов со щелочной реакцией pH>7.
Если учесть, что свойства растворов зависят от активностей находящихся в них ионов, то следует приведенное выражение записать в виде:
pH = lg aH+
В разбавленных растворах значения концентрации и активности совпадают и только при высокой минерализации могут быть значительные расхождения.
В настоящее время pH считается характеристикой активности ионов водорода. Поэтому, иногда в символ pH вводят нижний индекс “a”: pHa или paH. Обычно, это делается, когда необходимо явно подчеркнуть отличие определения водородного показателя через концентрацию или активность.
Буферные растворы
Многие аналитические реакции проводят при строго определенном значении pH, которое должно сохраниться в течение всего времени проведения реакции. В ходе некоторых реакций pH может изменяться в результате связывания или высвобождения ионов H+. Для сохранения постоянного значения pH применяют буферные растворы.
Для сохранения постоянного значения pH применяют буферные растворы.
Буферные растворы представляют собой чаще всего смеси слабых кислот с солями этих кислот или смеси слабых оснований с солями этих же оснований. Если, например, в ацетатный буферный раствор, состоящий из уксусной кислоты CH3COOH и ацетата натрия CH3COONa добавить некоторое количество такой сильной кислоты, как HCl, она будет реагировать с ацетат-ионами с образованием малодиссоциирующей CH3COOH:
CH3COO– + H+ = CH3COOH
Таким образом, добавленные в раствор ионы H+ не останутся свободными, а будут связаны ионами CH3COO–, и поэтому pH раствора почти не изменится.
При добавлении раствора щелочи к ацетатному буферному раствору ионы OH– будут связаны недиссоциированными молекулами уксусной кислоты CO3COOH:
OH– + CH3COOH = H2O + CH3COO–
Следовательно, pH раствора и в этом случае также почти не изменится.
Буферные растворы сохраняют свое буферное действие до определенного предела, т. е. они обладают определенной буферной емкостью. Если ионов H+ или OH– оказалось в растворе больше, чем позволяет буферная емкость раствора, то pH будет изменяться в значительной степени, как и в небуферном растворе.
Обычно в методиках анализа указывается, каким именно буферным раствором следует пользоваться при выполнении данного анализа и как его следует приготовить.
Для настройки pH-метров применяют стандартные буферные растворы с точными значениями pH.
Принятая в России по стандарту 8.134-74 шкала pH основана на воспроизводимых значениях pH нескольких растворов. Шкала pH обладает внутренней согласованностью, т.е. экспериментально измеренная величина pH не зависит от того, какой из растворов был выбран в качестве стандартного.
Способы измерения pH
Для определения величины pH существуют два основных метода: колориметрический и потенциометрический.
Колориметрический метод основан на изменении окраски индикатора, добавленного к исследуемому раствору, в зависимости от величины pH. Этот метод недостаточно точен, требует введения солевых и температурных поправок, дает значительную погрешность при очень малой минерализации исследуемой воды (менее 30 мг/л) и при определении pH окрашенных и мутных вод. Метод нельзя применять для вод, содержащих сильные окислители или восстановители. Используется обычно в экспедиционных условиях и для ориентировочных определений.
Потенциометрический метод намного точнее, лишен в значительной мере всех перечисленных недостатков, но требует оборудования лабораторий специальными приборами – pH-метрами. Потенциометрический метод основан на измерении ЭДС электродной системы, состоящей из индикаторного электрода и электрода сравнения. Электрод сравнения иногда называют вспомогательным электродом.
Наибольшее практическое применение нашел стеклянный индикаторный электрод, который можно использовать в широком диапазоне pH и в присутствии окислителей.
Кроме стеклянного электрода, для определения величины pH применяются также водородный, хингидронный, сурьмяный и другие электроды. Однако широкого распространения они не получили.
Стеклянный электрод
Стеклянный электрод изготовляется из специальный сортов стекла, о бладающих некоторой электропроводностью, достаточной, чтобы тонкую пленку из такого стекла можно было бы включить в качестве составляющей электрической цепи. Для измерения pH используется стекло, электропроводность которого обусловлена перемещением в стекле ионов H+ (электропроводность любого стекла обусловлена способностью к перемещению катионов относительно неподвижного остова – полианиона полимерной кремниевой кислоты).
Собственно стеклянный электрод представляет собой стеклянную трубку с выдутым на ее конце шариком с очень тонкой стенкой, в которую залита суспензия AgCl в растворе HCl и погружена серебряная проволока. Таким образом, внутри трубки с шариком находится хлорсеребряный электрод.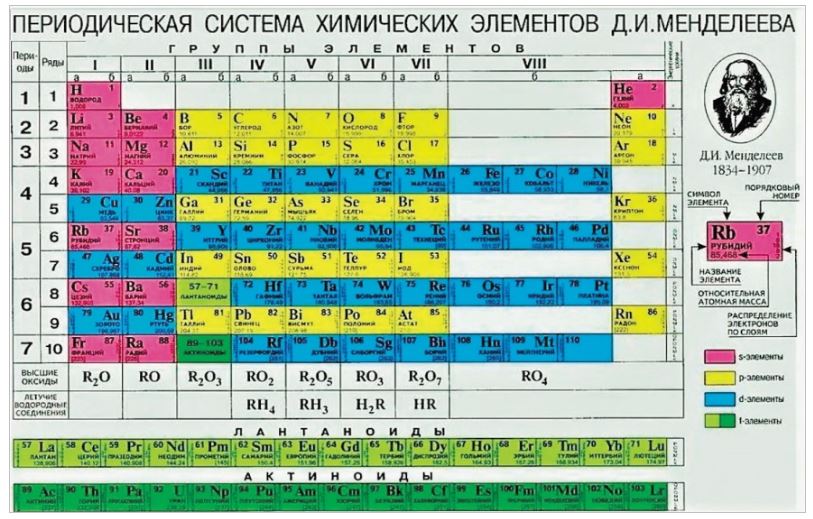 Для измерения pH стеклянный электрод погружают в испытуемый раствор (тем самым не внося в него никаких посторонних веществ). В этот же раствор напрямую или через электролитический ключ погружают электрод сравнения.
Для измерения pH стеклянный электрод погружают в испытуемый раствор (тем самым не внося в него никаких посторонних веществ). В этот же раствор напрямую или через электролитический ключ погружают электрод сравнения.
Таким образом, образуется гальванический элемент, состоящий из хлорсеребрянного электрода и электрода сравнения, но внутренняя электролитическая цепь этого элемента включает электропроводную стеклянную пленку, а также исследуемый раствор.
В полученной системе перенос электронов от хлорсеребрянного электрода к электроду сравнения, происходящий под действием непосредственно измеряемой разности потенциалов, неизбежно сопровождается переносом эквивалентного количества протонов из внутренней части стеклянного электрода в испытуемый раствор. Если считать концентрацию ионов H+ внутри стеклянного электрода постоянной, то измеряемая ЭДС является функцией только активности ионов водорода, т.е. pH исследуемого раствора.
Определение рН в воде
Определение величины рН воды имеет большое значение при оценке качества природных вод, при оценке коррозивности воды в системах питьевого и промышленного водоснабжения. Этот показатель также важен при обработке питьевой воды, подготовке воды для промышленных установок, при утилизации бытовых и заводских стоков.
Этот показатель также важен при обработке питьевой воды, подготовке воды для промышленных установок, при утилизации бытовых и заводских стоков.
Величина концентрации ионов водорода в речных водах обычно колеблется в пределах 6,5-8,5; атмосферных осадках 4,6 – 6,1; болотах 5,5 – 6,0; океане 7,9 – 8,3 рН. рН воды шахт и рудников достигает иногда единицы, а содовых озер и термальных источников десяти. Концентрация ионов водорода подвержена сезонным колебаниям. Зимой величина рН для большинства речных систем составляет 6,8 – 7,4; летом 7,4 – 8,2.
pH-метры, иономеры
Васильев В. П. Аналитическая химия. В 2 кн. Кн. 2. Физико-химические методы анализа: Учеб. для студ. вузов, обучающихся по химико-технол. спец. – 2-е изд., перераб. и доп. – М.:Дрофа, 2002. – 384 с., ил. – с. 191.
Кнорре Д. Г., Крылова Л. Ф., Музыкантов В. С. Физическая химия: Учеб. пособие для вузов. – М.: Высш. школа, 1981. – 328 с., ил., с. 263-264.
Коростелев П. П. Лабораторная техника химического анализа. – Под ред. докт. хим. наук А. И. Бусеева, – М.: Химия, 1981. – 312 с., ил., с. 226-232.
П. Лабораторная техника химического анализа. – Под ред. докт. хим. наук А. И. Бусеева, – М.: Химия, 1981. – 312 с., ил., с. 226-232.
Руководство по химическому анализу поверхностных вод суши. Под ред. д. х. н. проф. А. Д. Семенова. Л.: Гидрометеоиздат, 1977., с. 31-36.
Фомин Г. С. Вода. Контроль химической, бактериальной и радиационной безопасности по международным стандартам. Энциклопедический справочник. – 2-е изд. перераб. и доп. – М:. Издательство “Протектор”, 1995. – 624 с., ил., с. 95-96.
Dagens Nyheter (Швеция): в феврале 1869 года Менделеев навел порядок в химии
Материалы ИноСМИ содержат оценки исключительно зарубежных СМИ и не отражают позицию редакции ИноСМИ
6 марта 1869 года Дмитрий Менделеев представил Русскому химическому обществу способ организации химических элементов. Самое интересное, что русский химик не мог знать, почему его таблица выглядит именно так, но все же упорядочил химические элементы по правильному принципу и даже предсказал открытие трех элементов, о которых еще не было известно, пишет «Дагенс нюхетер».
Мария Гунтер (Maria Gunther)
6 марта 1869 года Дмитрий Менделеев представил Русскому химическому обществу способ организации химических элементов. Чтобы отпраздновать 150-летний юбилей этого события, Генеральная ассамблея ООН и ЮНЕСКО объявили 2019 год Международным годом периодической системы.
Когда французский химик Поль Эмиль Лекок де Буабодран (Paul-Émile Lecoq de Boisbaudran) в 1875 году исследовал минералы Пиренейских гор, он открыл новый элемент, которому дал название галлий в честь римского названия Франции. Он сообщил о своем открытии, но вскоре получил письмо, в котором его просили еще раз исследовать плотность элемента, потому что он, вероятно, измерил ее неверно. Де Буабодран так и сделал и обнаружил, что отправитель письма, российский химик Дмитрий Менделеев, был прав. Плотность элемента была не 4,7 грамма на квадратный сантиметр, как он изначально думал, а 5,9 — практически такая, как предсказал Менделеев.
«Именно после этого таблица Менделеева и прославилась на весь мир», — говорит Майкл Гордин (Michael Gordin), профессор современной истории в Принстонском университете и автор книги «Хорошо упорядоченная вещь: Дмитрий Менделеев и тень периодической таблица» (A Well-Ordered Thing: Dmitrii Mendeleev and the Shadow of the Periodic Table).
Все началось в Санкт-Петербурге в феврале 1869 года. Дмитрий Менделеев писал учебник по химии в двух томах. Первая часть уже была готова: первые 500 страниц книги он посвятил четырем элементам — углероду, кислороду, водороду и азоту. В последней главе Менделеев описывает так называемые галогены: фтор, хлор, бром и йод — группу элементов, чьи свойства очень похожи. Например, они легко реагируют с металлами и образуют соли, такие как хлорид натрия, то есть обычная пищевая соль.
Второй том должен был стать не менее толстым. Но из 63 известных элементов химик рассказал в первой части лишь о восьми.
«У него оставались 55 элементов, которые следовало представить во втором томе. Поэтому он пытался найти способ организовать их так, чтобы можно было описать их как можно более экономично», — говорит Майкл Гордин.
Для начала Дмитрий Менделеев задумался о щелочных металлах — литии, натрии, калии и рубидии. Все это мягкие и легкие металлы, которые активно взаимодействуют с водой, образуя щелочную основу, иными словами — раствор с высоким pH. Сравнив их атомный вес, или атомную массу (показатель, сколько весит один атом вещества), он обнаружил, что разница между двумя щелочными металлами очень похожа на разницу между двумя галогенами.
Сравнив их атомный вес, или атомную массу (показатель, сколько весит один атом вещества), он обнаружил, что разница между двумя щелочными металлами очень похожа на разницу между двумя галогенами.
«Он начал думать, что, возможно, существует некая естественная система, объясняющая это явление», — говорит Майкл Гордин.
Есть много распространенных мифов о том, как Дмитрий Менделеев додумался до периодической системы. Одни говорят, что у него была карточная игра со свойствами химических элементов на картах, другие — что финальное решение пришло к нему во сне. Но, по словам Майкла Гордина, это не соответствует действительности. Документы Менделеева свидетельствуют, что он выстраивал таблицу шаг за шагом, в процессе работы отталкивался от галогенов и щелочных металлов, а затем старался найти подходящие места для других элементов.
Наконец он понял, что все готово, переписал начисто рукопись и отправил ее в печать. Работа вышла 17 февраля 1869 года, что на самом деле означает 1 марта 1869, ведь тогда Россия еще не перешла на грегорианский календарь. Заголовок Дмитрий Менделеев написал на русском и на французском: «Опыт классификации элементов, основанной на их атомном весе и химическом сходстве» (склонности реагировать с другими элементами). Затем он передумал и вычеркнул слово «классификация», написав вместо нее «система», но забыл внести поменять артикль во французском варианте: оставил une от classification («классификация», женский род) вместо un для système («система», мужской род).
Заголовок Дмитрий Менделеев написал на русском и на французском: «Опыт классификации элементов, основанной на их атомном весе и химическом сходстве» (склонности реагировать с другими элементами). Затем он передумал и вычеркнул слово «классификация», написав вместо нее «система», но забыл внести поменять артикль во французском варианте: оставил une от classification («классификация», женский род) вместо un для système («система», мужской род).
«Вот откуда в самых первых печатных версиях периодической системы опечатка», — объясняет Майкл Гордин.
Первая таблица Дмитрия Менделеева не была похожа на периодические системы, которые сейчас висят в каждом классе химии по всему миру. Но его идея была правильной, а прорыв в науке — настолько значительным, что Генеральная ассамблея ООН и ЮНЕСКО объявили 2019 год Международным годом периодической системы, чтобы отметить ее 150-летний юбилей.
Удивительнее всего, что Менделеев не мог знать, почему его таблица выглядит именно так. Элементы в ней упорядочены по атомному номеру, то есть по количеству протонов в ядре атома. Но британский физик Генри Мозли (Henry Moseley) выяснил это только в 1913 году — через шесть лет после смерти Менделеева. То, в какой столбец попадает элемент, определяется организацией электронов на валентной оболочке атома, но электроны были открыты лишь в 1897 году Джозефом Джоном Томпсоном (Joseph John Thomson), другим британским физиком.
Но британский физик Генри Мозли (Henry Moseley) выяснил это только в 1913 году — через шесть лет после смерти Менделеева. То, в какой столбец попадает элемент, определяется организацией электронов на валентной оболочке атома, но электроны были открыты лишь в 1897 году Джозефом Джоном Томпсоном (Joseph John Thomson), другим британским физиком.
«Менделеев относился к электронам с большим подозрением, он не определился, верить в них или нет. И он точно ничего не знал о квантовой механике. Нильс Бор (Niels Bohr) сформулировал периодическую систему в терминах квантовой теории лишь в 1923 году», — рассказывает Майкл Гордин.
С самого начала Дмитрий Менделеев понял, что в его таблице не хватает как минимум трех элементов. Когда в 1871 году он опубликовал улучшенную версию таблицы, он дал им названия экабор, экаалюминий и экакремний, где «эка» значит «один» на санскрите. Он также сделал очень подробные предсказания об их свойствах и о том, как их можно обнаружить. Вот почему он был настолько уверен, что Буабодран неверно измерил плотность галлия, ведь все остальные его свойства совпадали с экаалюминием. Затем в 1879 году был открыт скандий, а в 1886 — германий.
Затем в 1879 году был открыт скандий, а в 1886 — германий.
«В первую очередь германий невероятно напоминал экакремний. Когда его открыли, это был блестящий успех периодической системы, который по-настоящему прославил Менделеева на весь мир», — говорит Майкл Гордин.
Химический состав меда идентичен составу человеческой крови
16.08.2017
Пчелиный мед – один из самых сложных природных ресурсов, в составе которого обнаружено более 300 разных компонентов. В этом продукте содержится почти вся таблица Менделеева, а по составу аминокислот ему нет аналогов среди всех натуральных пищевых продуктов.
Исследования ученых подтвердили, что по своему химическому составу мед близок к составу человеческой крови, ведь и соотношение, и количество отдельных микроэлементов в этих веществах идентичны.
Такое сходство позволяет нашему организму быстрее и легче усваивать полезные микроэлементы, содержащиеся в меде. Таким образом, организм способен использовать составляющие меда на 100%, а биологическая ценность этого продукта является незаменимой.
Таким образом, организм способен использовать составляющие меда на 100%, а биологическая ценность этого продукта является незаменимой.
А еще сходство меда и крови объясняет тот факт, что его регулярное употребление в умеренном количестве оказывает благотворное воздействие на состав крови – восстанавливает общее количество эритроцитов, повышает гемоглобин и снижает показатель вязкости крови.
Что же содержится в меде?
Химический состав меда довольно сложный и разнообразный. В нем находится большое разнообразие полезных для человеческого организма веществ – углеводов, органических кислот и их солей, азотистых соединений (аминокислот, белков, амидов, аминов), минеральных веществ, витаминов, гормонов, ферментов, эфирных масел и много других ценных компонентов.
Наиболее изученный фермент меда –

Диастазное число колеблется от 0 до 50 ед. Готе. Содержание диастазы в меде зависит от ряда факторов, среди которых наиболее важные: ботаническое происхождение источника нектара (вид растений, с которых собран нектар), состав почвы, где растут медоносы, возраст и фаза развития медоносных растений, погодные условия во время сбора нектара, интенсивность медосбора, степень зрелости откачиваемого меда, сроки его хранения, а также способы товарной переработки.
Темные виды меда существенно отличаются от светлых. Акациевый и шалфеевый мед характеризуются низкой диастазой (от 0 до 10 ед. Готе), а гречневый и вересковый – высокой (20–50 ед. Готе).
Среди дисахаридов в меде встречаются чаще всего сахароза и мальтоза.
Содержание мальтозы в разных видах меда составляет порядка 4–6% относительно общего количества углеводов. Мальтоза образовывается при созревании меда и зависит от его ботанического происхождения.
Азотистые вещества в меде представлены белковыми и небелковыми соединениями. Они поступают в продукт с цветочной пыльцой и секретом желез пчел.
Белковых соединений в цветочных видах меда содержится от 0,08% до 0,4%. Таким образом, вересковый и гречневый мед содержит их меньше 1%, а падевый – 1–1,9%.
Основную долю составляют ферменты. Именно они выступают в качестве биологических катализаторов, ускоряющих многочисленные реакции распада и синтеза. Каждый из видов ферментов может катализировать только один определенный тип химической реакции.
Небелковые азотистые соединения представлены, в основном, аминокислотами в небольшом количестве – от 0,6 до 500 мг на 100 г меда. содержание и спектр их действия зависят от ботанического происхождения меда, условий медосбора, а также переработки нектара (пади) пчелами. Во всех сортах меда содержатся аланин, аргинин, аспарагиновая и глутаминовая кислоты, лейцин, лизин, фенилаланин, тирозин, треонин; отдельные сорта содержат также метионин, триптофан и пролин.
Во всех сортах меда содержатся аланин, аргинин, аспарагиновая и глутаминовая кислоты, лейцин, лизин, фенилаланин, тирозин, треонин; отдельные сорта содержат также метионин, триптофан и пролин.
Аминокислоты обладают способностью вступать в соединения с сахарами меда, образовывая меланоидины. Формирование этих соединений происходит намного быстрее при высокой температуре. Таким образом, потемнение меда при длительном хранении или нагревании происходит, наряду с другими причинами, в результате наличия в его составе аминокислот.
К азотосодержащим веществам, обнаруженным в меде, относятся также алкалоиды, которые содержатся в разных частях растений. Эти вещества являются сильно ядовитыми. Многие алкалоиды в малых дозах обладают лекарственным воздействием на организм человека. Возможно, этим объясняются некоторые целебные свойства меда.
Во всех видах меда содержится порядка 0,3% органических и 0,03% неорганических кислот. Большая доля кислот представлены глюконовой, яблочной, лимонной и молочной. Среди других кислот, содержащихся в меде, выделяют винную, щавелевую, янтарную и линолевую. Среди неорганических кислот, в меде содержатся фосфорная и соляная кислоты.
Большая доля кислот представлены глюконовой, яблочной, лимонной и молочной. Среди других кислот, содержащихся в меде, выделяют винную, щавелевую, янтарную и линолевую. Среди неорганических кислот, в меде содержатся фосфорная и соляная кислоты.
Кислоты попадают в мед вместе с нектаром, падью, пыльцой и выделениями из желез пчел. Также они синтезируются в процессе ферментативного разложения и окисления сахаров. Органические кислоты придают меду приятный кисловатый привкус.
Наличие свободных кислот в меде определяют по концентрации водородных ионов, являющейся показателем активной кислотности (рН).
Для цветочных видов меда показатель рН колеблется от 3,5 до 4,1. Исключением является только липовый мед, рН которого достигает 4,5–7.
Падевый мед имеет более высокий уровень рН, чем цветочный, – от 3,95 до 5,15.
Мед, как природный продукт, по количеству зольных элементов не имеет равных. В нем обнаружено порядка 40 макро- и микроэлементов, среди которых преобладают калий, фосфор, кальций, хлор, сера, магний и медь.
В нем обнаружено порядка 40 макро- и микроэлементов, среди которых преобладают калий, фосфор, кальций, хлор, сера, магний и медь.
Именно схожесть минерального состава крови и меда обуславливает быстрое усвоение продукта, его пищевые, диетические и лечебные свойства. Многие минеральные вещества, особенно микроэлементы, играют важную роль в обеспечении деятельности жизненно важных органов.
Мед также содержит большое количество витаминов, однако в небольших дозировках. Сочетаясь с другими важными для организма веществами, содержащимися в меде, эти витамины играют важную роль в целебном воздействии меда. Источниками витаминов, содержащихся в меде, являются нектар и цветочная пыльца. Порция меда, весом 100 г, содержит:
– витамина В1 – 4–6 мкг;
– витамина В2 – 20–60 мкг;
– витамина В3 – 20–110 мкг;
– витамина В5 – 0,068 мг;
– витамина В6 – 8–320 мг;
– витамина В9 (фолиевой кислоты) – 2 мкг;
– витамина Н – в среднем, 380 мг;
– витамина РР – 310 мг;
– витамина Е – 1000;
– витамина С – порядка 30 000 мг.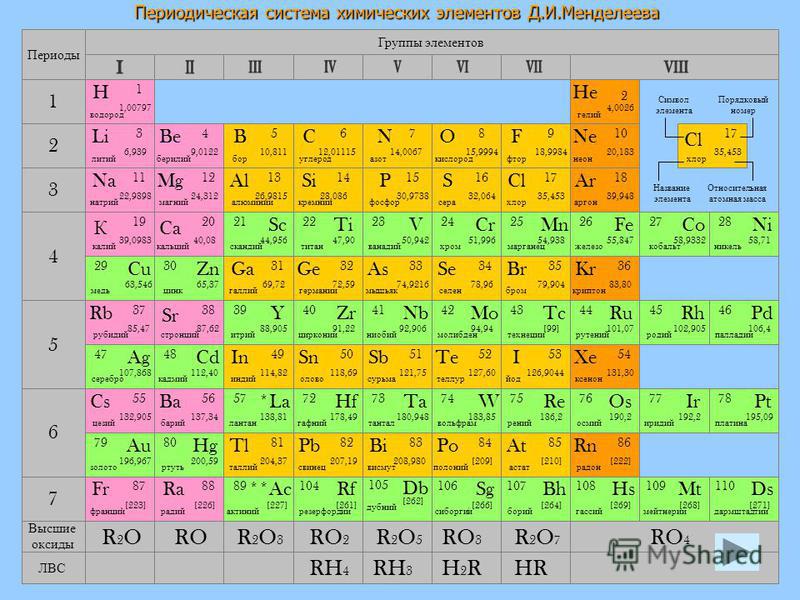
В меде содержатся, в основном, водорастворимые витамины, которые долго хранятся, поскольку мед имеет кислую среду.
Зрелый мед содержит 15–21% воды. Влажность меда зависит от степени зрелости продукта, условий хранения, времени сбора нектара, климатических условий, соотношения сахаров, а также вида тары, в которой мед хранится. Мед с повышенной влажностью может испортиться, поэтому влажность меда является одним из главных показателей качества.
Микрофлора меда представлена 40 видами грибов и осмофильных дрожжей, которые попадают в мед вместе с нектаром, из воздуха и другими путями. В среднем, на 1 г меда приходится порядка 1 тыс. таких микроорганизмов. В отдельных видах содержится от 10 тыс. до 1 млн. клеток дрожжей и от 30 до 3 тыс. клеток грибов.
В верхнем слое меда, толщина которого составляет до 5 см, присутствуют бактерии, набор и количество которых зависят от ботанического происхождения и условий хранения продукта.
Благодаря богатому минеральному составу меда и его сходству с составом сыворотки крови, великий целитель древности Авиценна считал его продуктом долголетия. Действительно, учеными замечено, что среди пчеловодов много долгожителей.
Поделиться в соцсетях:
Химия: pH-таблицы
Таблица pH бытовых веществ, материалов и продуктов
| Вещество | pH |
| Электролит в свинцовых аккумуляторах | <1.0 |
| Желудочный сок | 1,0—2,0 |
| Лимонный сок | 2,5±0,5 |
| Лимонад Кола | 2,5 |
| Уксус | 2,9 |
| Яблочный сок | 3,5±1,0 |
| Пиво | 4,5 |
| Кофе | 5,0 |
| Модный шампунь | 5,5 |
| Чай | 5,5 |
| Кислотный дождь | < 5,6 |
| Кожа здорового человека | ~6,5 |
| Слюна | 6,35—6,85 |
| Молоко | 6,6-6,9 |
| Чистая вода | 7,0 |
| Кровь | 7,36—7,44 |
| Морская вода | 8,0 |
| Мыло (жировое) для рук | 9,0—10,0 |
| Нашатырный спирт | 11,5 |
| Отбеливатель (хлорка) | 12,5 |
| Раствор соды | 13,5 |
Изменение окраски кислотно-основных индикаторов в зависимости от pH раствора.
 Лакмус, фенолфтолеин, метилоранж
Лакмус, фенолфтолеин, метилоранж| Название | Окраска индикатора в среде | ||
| Кислая [H+]* > [OH-] рН < 7 |
Нейтральная[H+] = [OH-] рН = 7 |
Щелочная [OH-] > [H+] рН > 7 |
|
| Лакмус | красный | фиолетовый | синий |
| Фенолфталеин | бесцветный | бесцветный | малиновый |
| Метилоранж | розовый | оранжевый | желтый |
Водородный показатель (pH) некоторых распространенных продуктов питания
| Продукт | Приблизительный уровень pH |
Продукт | Приблизительный уровень pH |
| Абрикосовый нектар | 3. 8 8 |
Малина | 3.2 – 3.6 |
| Абрикосы | 3.3 – 4.8 | Мамалыга | 6.8 – 8.0 |
| Авокадо | 6.3 – 6.6 | Манго | 5.8 – 6.0 |
| Алое Вера | 6.1 | Маслины | 6.0 – 7.0 |
| Апельсины | 3.0 – 4.0 | Масло | 6.1 – 6.4 |
| Арахисовое масло | 6.3 | Меласса (черная патока) | 4.9 – 5.4 |
| Арбуз | 5. 2 – 5.6 2 – 5.6 |
Молоко | 6.4 – 6.8 |
| Артишоки | 5.5 – 6.0 | Морковь | 5.9 – 6.3 |
| Бананы | 4.5 – 5.2 | Морское ушко | 6.1 – 6.5 |
| Батат (сладкий картофель) | 5.3 – 5.6 | Мука пшеничная | 5.5 – 6.5 |
| Батат (сладкий картофель), вареный. |
5.5 – 6.8 | Мякоть томата | 4.3 – 4.5 |
| Белый хлеб | 5.0 – 6.2 | Нектарины | 3. 9 – 4.2 9 – 4.2 |
| Бобы | 5.6 – 6.5 | Овощной сок | 3.9 – 4.3 |
| Брокколи | 5.3 | Окунь, морской, жаренный | 6.6 – 6.8 |
| Вино | 2.8 – 3.8 | Оливки | 3.6 – 3.6 |
| Виноград | 3.5 – 4.5 | Пахта | 4.4 – 4.8 |
| Вишня | 3.2 – 4.5 | Персики | 3.4 – 4.1 |
| Газированные напитки | 2.0 – 4. 0 0 |
Печень трески | 6.2 |
| Горох | 5.8 – 6.4 | Пиво | 4.0 – 5.0 |
| Горчица | 3.5 – 6.0 | Питьевая вода | 6.5 – 8.0 |
| Грейпфрут | 3.0 – 3.7 | Помидоры | 4.3 – 4.9 |
| Груши | 3.6 – 4.0 | Ревень | 3.1 – 3.2 |
| Дыня | 6.0 – 6.7 | Сардины | 5.7 – 6.6 |
| Ежевика | 3. 9 – 4.5 9 – 4.5 |
Свежие яйца | 7.6 – 8.0 |
| Изюм | 2.8 – 3.0 | Свекла | 4.9 – 6.6 |
| Кактус | 4.7 | Сельдерей | 5.7 – 6.0 |
| Кальмары | 5.8 | Сельдь | 6.1 |
| Каперсы | 6.0 | Сидр | 2.9 – 3.3 |
| Капуста | 5.2 – 5.4 | Соевое молоко | 7.0 |
| Каракатица | 6. 3 3 |
Соевый соус | 4.4 – 5.4 |
| Карп | 6.0 | Соус Карри | 6.0 |
| Картофель | 5.6 – 6.0 | Соус Чили | 2.8 – 3.7 |
| Кетчуп | 3.9 | Спаржа | 6.0 – 6.7 |
| Кислая капуста | 3.4 – 3.6 | Сыр | 4.8 – 6.4 |
| Кленовый сироп | 4.6 – 5.5 | Томатный сок | 4.1 – 4.6 |
| Клубника, земляника | 3. 0 – 3.9 0 – 3.9 |
Тунец | 5.9 -6.1 |
| Клубничный (земляничный) джем | 3.0 – 3.4 | Турнепс (репа) | 5.2 – 5.6 |
| Клюквенный сок | 2.3 – 2.5 | Тыква | 4.8 – 5.2 |
| Кокос | 5.5 – 7.8 | Уксус | 2.4 – 3.4 |
| Кокосовое молоко | 6.1 – 7.0 | Уксус яблочный | 3.1 |
| Крабовое мясо | 6.5 – 7.0 | Устрицы | 5. 7 – 6.2 7 – 6.2 |
| Красный перец | 4.6 – 5.2 | Финики | 6.5 – 8.5 |
| Креветки | 6.8 – 7.0 | Фруктовое желе | 2.8 – 3.4 |
| Крекеры | 6.5 – 8.5 | Фруктовый джем | 3.5 – 4.0 |
| Крыжовник | 2.8 – 3.1 | Фруктовый коктейль | 3.6 – 4.0 |
| Кукуруза | 5.9 – 7.3 | Херес | 3.4 |
| Курага( сушеные абрикосы) | 3.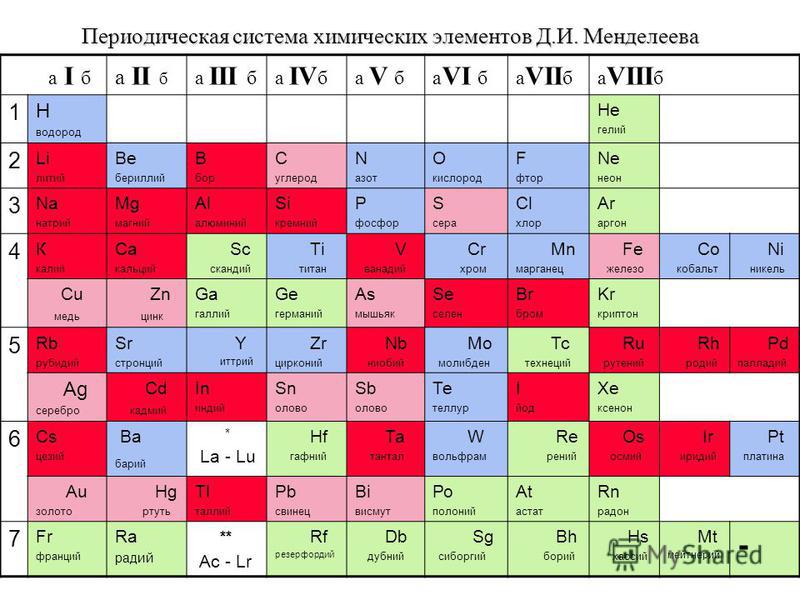 4 – 3.8 4 – 3.8 |
Хрен | 5.4 |
| Лайм | 1.8 – 2.0 | Чай | 7.2 |
| Лаймовый сок | 2.0 – 2.4 | Черника | 3.1 – 3.4 |
| Лимоны | 2.2 – 2.4 | Шпинат | 5.5 – 6.8 |
| Лимонный сок | 2.0 – 2.6 | Яблоки | 3.3 – 3.9 |
| Лосось | 6.1 – 6.3 | ||
| Лук-порей | 5. 5 – 6.2 5 – 6.2 |
Химические свойства фосфора и его соединений, основное применение в таблице
4.8
Средняя оценка: 4.8
Всего получено оценок: 330.
4.8
Средняя оценка: 4.8
Всего получено оценок: 330.
Фосфор – жизненно важный элемент из пятой группы периодической таблицы Менделеева. Химические свойства фосфора зависят от его модификации. Наиболее активным веществом является белый фосфор, окисляющийся на воздухе. Фосфор имеет две валентности (III и V) и три степени окисления – +5, +3, -3.
Фосфор и соединения
Фосфор имеет три аллотропические модификации, отличающиеся химическими и физическими свойствами:
- белый;
- красный;
- чёрный.
Под фосфором в химических реакциях чаще всего понимают белый фосфор (P4). Красный фосфор вступает в реакции при определённых условиях. Например, реагирует с водой при нагревании и под давлением. Чёрный фосфор практически инертен.
Чёрный фосфор практически инертен.
Фосфор реагирует с простыми и сложными веществами, образуя:
- фосфин;
- фосфорную кислоту;
- фосфиды;
- оксиды.
Фосфин (РН3) – плохо растворимый в воде ядовитый газ, аналог аммиака. В отсутствии кислорода при нагревании разлагается на простые вещества – фосфор и водород.
Рис. 2. Фосфин.Фосфорная или ортофосфорная кислота (H3PO4) образуется при взаимодействии фосфора или оксида фосфора (V) с водой.
Фосфиды – соли, образующиеся при взаимодействии с металлами или неметаллами. Они неустойчивы и легко разлагаются под действием кислот или воды.
Фосфор может образовывать два оксида – P2O3 и P2O5.
H3PO4 – кислота средней силы, проявляющая амфотерные свойства при взаимодействии с сильной кислотой. Фосфорная кислота образует фосфаты.
Химические свойства
Основные химические свойства фосфора и его соединений описаны в таблице.
Вещество | Реакция | Особенности | Уравнение |
Фосфор | С O2 | При избытке O2 образует оксид фосфора (V) | – 4P + 5O2 → 2P2O5; – 4P + 3O2 → 2P2O3 |
С металлом | Является окислителем | 3Mg + 2P → Mg3P2 | |
С галогенами и неметаллами | Не реагирует с водородом | 2P + 3S → P2S3 | |
С Н2О | 8Р + 12Н2О → 5РН3 + 3Н3РО2 | ||
С кислотами | 2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O | ||
Со щелочами | P4 + 3NaOH + 3H2O → PH3 + 3NaH2PO2 | ||
РН3 | С O2 | Воспламеняется на воздухе | РН3 + 2O2 → H3PO4 |
С галогенами и неметаллами | РН3 + 2I2 + 2H2O → H(PH2O2) + 4HI | ||
С кислотами | Проявляет свойства восстановителя | РН3 + 3H2SO4 → H2(PHO2) + 3SO2 + 3H2O | |
H3PO4 | С металлами | С активными металлами | 2H3PO4 + 3Ca → Ca3(PO4)2 + 3H2↑ |
С Н2О | Подвергается диссоциации | H3PO4 + H2O ↔ H3O+ + h3PO4– | |
Со щелочами | Образует кислые или щелочные фосфаты | H3PO4 + 3NaOH → Na3PO4 + 3H2O | |
С оксидами | 2H3PO4 + 3K2O → 2K3PO4 + 3H2O | ||
С солями | 2H3PO4 + 3CaCO3 → Ca3(PO4)2 + 3H2O + 3CO2↑ | ||
С аммиаком | H3PO4 + 3NH3 → (NH4)3PO4 | ||
P2O3 | С галогенами и неметаллами | – 2P2O3 + 6Cl2 → 4PCl3O + O2; – 2P2O3 + 9S → P4S6 + 3SO2 | |
С Н2О | Медленно реагирует с холодной водой и быстро – с горячей | P2O3 + 3H2O → 2H3PO3 | |
Со щелочами | P2O3 + 4NaOH → 2Na2HPO3 + H2O | ||
P2O5 | С Н2О | Реагирует с взрывом | 2P2O5 + 6H2O → 4H3PO4 |
С кислотами | Реакция замещения | 4HNO3 + 2P2O5 → 4HPO3 + 2N2O5 | |
Фосфиды | С Н2О | Образуют гидроксиды металлов и фосфин | Ca3P2 + 6H2O → 3Ca(OH)2 + 2PH3 |
С кислотами | Реакция замещения | Ca3P2 + 6HCl → 3CaCl2 + 2PH3 |
При нагревании оксид фосфора распадается. Причём P2O3 образует красный фосфор, а P2O5 – оксид фосфора (III) и кислород.
Причём P2O3 образует красный фосфор, а P2O5 – оксид фосфора (III) и кислород.
Использование
Широкое применение имеют соединения фосфора:
- из фосфатов получают удобрения и моющие средства;
- фосфорная кислота используется для окрашивания ткани;
- оксид фосфора (V) осушает жидкости и газы.
Красный фосфор используется в производстве спичек и взрывчатых веществ.
Что мы узнали?
Фосфор – активный неметалл, реагирующий с простыми и сложными веществами. В результате реакций образует оксиды (III) и (V), фосфин, фосфорную кислоту и фосфиды. Соединения фосфора вступают в реакцию с металлами, неметаллами, кислотами, щелочами, водой. Фосфор и его соединения используются в промышленности и сельском хозяйстве.
Тест по теме
Доска почёта
Чтобы попасть сюда – пройдите тест.
Алина Батарова
5/5
Оценка доклада
4. 8
8
Средняя оценка: 4.8
Всего получено оценок: 330.
А какая ваша оценка?
Алюминий и его химия | ChemToday – химический портал
Содержание
- Геохимия алюминия
- Способы получения
- Химические свойства алюминия
- Алюмотермия
- Отношение к кислотам
- Отношение к щелочам. Амфотерность
- Нестабильные соединения
- Одновалентный алюминий
Здравствуй, уважаемый читатель! Сейчас мы будем разбираться с таким интереснейшим элементом, как алюминий, и подробно узнаем о его свойствах.
Алюминий является самым распространенным металлом, находящимся в соединениях в составе земной коры, следом за ним идёт железо. Но несмотря на этот факт, алюминий — не самый дешёвый в производстве металл (самый дешёвый — свинец) и на его получение тратится значительно больше энергии, чем на производство железа. Немного позже вы узнаете почему.
Алюминий — уникальный металл в том смысле, что изготавливать из него можно почти всё что угодно: фольгу, банки для напитков, кружки, ложки, крючки для одежды — он необычайно ковкий. Однако, из-за этой ковкости его трудно использовать в несущих деталях конструкций, например арматуры или газовых баллонов, для изготовления которых используются более твёрдые материалы.
Алюминиевая коллекционная монетаЧтобы узнать, как можно получать алюминий, нужно узнать о том, в каком виде он встречается в природе.
Геохимия алюминия
Самый распространенный минерал алюминия — это его оксид Al2O3. В природе он встречается в разных минералах, из которых самый распространённый — боксит Al2O3 * xH2O:
БокситВключения других элементов в состав минерала делают его необычайно красивым. Прекрасные рубин, сапфир, топаз, аквамарин представляют из себя минералы, состоящие в основном из оксида алюминия, цвет которых обеспечивается за счет примесей — соединений хрома(II и III), железа, титана, марганца и многих других.
- Рубин
- Сапфир
- Топаз
Вместе с кремнием алюминий образует группу самых распространённых в земной коре минералов. Их объединяют под общим названием — алюмосиликаты, подчёркивая наличие алюминия и кремния (silicium) в их составе.
АквамаринСпособы получения
Как мы уже выяснили, всё или почти всё, что из себя представляет природный алюминий, — это его оксид Al2O3. Алюминий — очень активный металл, поэтому его извлечь из оксида непросто. Приведём некоторые цифры: энергия Гиббса сродства к кислороду, то есть образования оксида, составляет около -300 кДж/моль! А электродный потенциал реакции восстановления алюминия(3+) составляет -1,7 В, что ставит его рядом с бериллием и марганцем.
Поэтому одним из самых распространённых способов для его получения служит электролиз расплава.
Сам оксид алюминия (корунд) чрезвычайно тугоплавкий, поэтому к нему добавляют гексафторалюминат натрия — природный минерал криолит.
КриолитОн имеет формулу Na3[AlF6] — это комплексное соединение, которое можно получить из водного оксида алюминия по следующей реакции:
\(2Al(OH)_3 + 3Na_2CO_3 + 18HF = 2Na_3[AlF_6] + 3CO_2\uparrow + 9H_2O\)
На территории России криолит встречается в непригодном для получения алюминия виде (загрязнённом), поэтому для электролиза расплава его получают по вышеприведённой реакции.
Вместе с ним к оксиду алюминия добавляют также фторид кальция CaF2, и в результате смесь начинает плавиться при 950оС.
В расплавленную смесь погружают графитовые электроды и создают напряжение, в результате чего происходит процесс электролиза, который в данном случае точно описать довольно сложно, поэтому ограничимся приблизительными реакциями. – — 2\overline{e} = [O] + Al_2O_3\)
– — 2\overline{e} = [O] + Al_2O_3\)
Вместе с этим графитовые электроды довольно быстро сгорают при такой высокой температуре и количестве кислорода, который выделяется на них:
\(C + O_2 = CO_2\uparrow\)
Суммируя всё вышесказанное, в процессе электролиза расплава на катоде выделяется алюминий, который из-за большей, нежели расплав, плотности собирается на дне жидким слоем; на аноде же выделяется кислород. Выглядит это вживую вот так:
Ванна электролиза расплаваХимические свойства алюминия
Алюмотермия
Как мы уже сказали, алюминий — активный металл. Настолько активный, что может применяться как восстановитель железа, марганца, хрома и других подобных металлов, при этом переходя в очень стабильный оксид. Данный метод получения других металлов из их оксидов реакцией с алюминиевой пудрой носит название алюмотермия, или реакция термит:
\(3Fe_3O_4 + 8Al = 4Al_2O_3 + 9Fe\) \(3MnO_2 + 4Al = 3Mn + 2Al_2O_3\) \(Cr_2O_3 + 2Al = 2Cr + Al_2O_3\)
ТермитКак вы уже заметили, в своём оксиде алюминий находится в степени окисления +3. oC\)
oC\)
Многие из образующихся в подобных реакциях соединения легко гидролизуются:
\(Al_2S_3 + 6H_2O = 3H_2S\uparrow + 2Al(OH)_3\downarrow, \text{быстро}\) \(AlN + 4HCl = AlCl_3 + NH_4Cl, \text{медленно}\)
Отношение к кислотам
Алюминий не реагирует с концентрированными азотной и серной кислотами — то есть пассивируется.
Однако с разбавленными кислотами-неокислителями (то есть разбавленной серной, соляной) реагирует с умеренной скоростью из-за довольно инертной плёнки оксида на поверхности, которая медленно «съедается» кислотой:
\(2Al + 6HCl = 2AlCl_3 + 3H_2\uparrow\)
Гидроксид алюминия очень легко взаимодействует с кислотами, образуя соли алюминия:
\(Al(OH)_3 + 3HCl = AlCl_3 + 3H_2O\)
Отношение к щелочам. Амфотерность
Алюминий — амфотерный металл. Это значит, что он и его соединения проявляют как кислотные, так и основные свойства.
Например, он реагирует с раствором щелочи:
\(2Al + 2NaOH + 6H_2O = 2Na[Al(OH)_4] + 3H_2\uparrow\)
Экспериментально замечено, что эта реакция идет с большей скоростью, нежели алюминия с кислотой, а значит мы можем сделать вывод, что кислотные свойства алюминия выражены сильнее, чем основные.
Помимо реакции с кислотой, гидроксид алюминия также легко растворяется и в растворе щёлочи!
\(Al(OH)_3 + NaOH = Na[Al(OH)_4]\)
В результате этих реакций образуется комплексное соединение — тетрагидроксоалюминат натрия, которое имеет переменный состав, сильно зависящий от pH. В водных растворах при pH 13-14 (сильнощелочных средах) существуют тетрагидроксоалюминат-ионы, а при понижении pH (подкислении среды) между ионами начинают происходить процессы полимеризации через кислородные мостики. Например, охарактеризовано существование и строение ионов следующих составов:
\([Al_{13}O_4(OH)_{24}(H_2O)_{12}]^{7+},\quad [Al_{13}(OH)_{35}]^{4+}\)
А вместе с однозарядными катионами (катионами щелочных металлов и аммония) образует устойчивые кристаллизующиеся соединения квасцы (название происходит от слова кислый, так как соединения алюминия гидролизуются и растворы солей имеют кислую реакцию среды):
\((NH_4)_2SO_4 + Al_2(SO_4)_3 + 24H_2O = 2NH_4Al(SO_4)_2 * 12H_2O\)
В их структуре присутствуют тетраэдрические гексаакваионы [Al(H2O)6]3+.
При сплавлении со щелочами алюминий образует соль мета- или ортоалюминиевой кислоты. При этом также могут образоваться алюминаты более сложного состава:
\(Al(OH)_3 + NaOH = NaAlO_2 + 2H_2O\) \(NaAlO_2 + Na_2O = Na_3AlO_3\)
Нестабильные соединения
Говоря о неустойчивых соединениях алюминия, начнём с гидрида. Обменной реакцией алан (гидрид алюминия) может быть получен в эфирном растворе:
\(3LiH + AlCl_3 = 3LiCl + AlH_3\downarrow\)
Продукт этой реакции — твёрдое белое полимерное вещество. Структурные фрагменты [Al2H6] напоминают бораны, и из эфирных растворов может осаждаться также сольват AlH3 * xEt2O.
Выше 150оС алан разлагается на простые вещества:
\(2AlH_3 = 2Al + 3H_2\uparrow\)
Одновалентный алюминий
Вот мы и дошли до места, где упомянем соединения алюминия в степени окисления +1. Да, они немногочисленны, но сказать о них стоит.
Да, они немногочисленны, но сказать о них стоит.
Выше 1000 градусов Цельсия существует оксид Al2O, получаемый реакцией обычного оксида с кремнием:
\(Al_2O_3 + 2Si = Al_2O\uparrow + 2SiO\)
А при нагревании фторида алюминия(III) с металлическим алюминием образуется субфторид алюминия — синий газ:
\(AlF_3 + 2Al = 3AlF\uparrow\)
Так как подобные соединения являются летучими и легко разлагаются, их можно использовать в транспортных реакциях для очистки алюминия. Это такие реакции, где в одной части прибора из грязного источника получается летучий оксид или субфторид, а в другой части прибора, скажем, на раскалённой проволоке, этот неустойчивый газ разлагается, образуя высокочистый алюминий.
Также известен сульфид:
\(Al_2S_3 + 4Al = 3Al_2S\)
Эти соединения необходимо получать в инертной атмосфере.
Любите химию!
Шкала pH обычных химических веществ химическое вещество находится в водном растворе (в смеси с водой). Шкала имеет значения от 0 (самая кислая) до 14 (самая щелочная или основная), где 7 — нейтральный pH. Химические вещества со значениями pH от 0 до 7 являются кислотами, вещества со значением pH 7 — нейтральными, а вещества со значениями pH от 7 до 14 — основаниями. Вот таблица значений pH распространенных химических веществ.
pH Values of Common Chemicals
| pH | Chemical |
| 0 | Hydrochloric acid (muriatic acid) – HCl |
| 1.0 | Stomach acid, battery acid (sulfuric acid ) |
| 2.0 | Lemon juice |
| 2.2 | Vinegar (Acetic acid) |
| 3.0 | Apples, soda |
| 3.0-3.5 | Sauerkraut |
3. 5-3.9 5-3.9 | Pickles |
| 4.0 | Wine, beer |
| 4.5 | Tomatoes |
| 4.5-5.2 | Bananas |
| ~5.0 | Acid rain |
| 5.0 | Coffee |
| 5.3-5.8 | Bread |
| 5.4-6.2 | Red meat |
| 5.9 | Cheddar cheese |
| 6.1-6.4 | Butter |
| 6.4-6.9 | Milk |
| 6.6-6.8 | Fish |
| 7.0 | Pure water |
| 7.0-10.0 | Shampoo |
| 7.4 | Human tears, human blood |
| 7.8 | Eggs |
| ~8.0 | Seawater |
| 8.3 | Baking soda (Sodium bicarbonate) |
| ~9.0 | Toothpaste |
10. 5 5 | Milk of magnesia, Dead Sea |
| 11.0 | Ammonia |
| 11-12 | Soapy water |
| 11.5-14.0 | Химические вещества для выпрямления волос |
| 12,4 | Лайм (гидроксид кальция) |
| 13,0 | LYE |
| 13,8 | 16 ropen ленер |
| 13,8 | 16 ropen leaner |
| 13,8 | 16 |
| 13,8 | .0024 |
| 14.0 | Очиститель канализации (гидроксид натрия) |
Вы увидите диаграммы, в которых значения pH для некоторых химических веществ немного различаются. Обычно для вещества существует диапазон pH. Например, кислотность плодов зависит от почвы, температуры, степени зрелости и других факторов. pH мыла зависит от других ингредиентов в его формуле. pH почвы колеблется от 3 до 10. Так что не зацикливайтесь на цифрах.
Обычные кислоты
Кислоты включают химические вещества со словом «кислота» в названии. Примеры включают соляную кислоту, уксусную кислоту и гиалуроновую кислоту. Большинство фруктов и овощей кислые. То же самое можно сказать и о коже и волосах человека, которые имеют низкий уровень pH, что помогает защитить организм от патогенов. Кофе, чай, вино и молоко кислые. Желудочная кислота, конечно, кислая.
Примеры включают соляную кислоту, уксусную кислоту и гиалуроновую кислоту. Большинство фруктов и овощей кислые. То же самое можно сказать и о коже и волосах человека, которые имеют низкий уровень pH, что помогает защитить организм от патогенов. Кофе, чай, вино и молоко кислые. Желудочная кислота, конечно, кислая.
Нейтральные химикаты
Чистая вода нейтральна. Однако водопроводная вода может быть слабокислой или щелочной. Растворение поваренной соли в воде не меняет ее pH, поэтому обычная соленая вода нейтральна. Морская вода щелочная и не нейтральная. Свежее молоко почти нейтрально, но по мере скисания оно становится более кислым. Растительное масло (которое не является водным раствором) обычно регистрируется лакмусовой бумажкой как нейтральное.
Общие основания
Кровь человека слабощелочная. Пищевая сода (бикарбонат натрия) и стиральная сода (карбонат натрия) являются основаниями. Чистящие средства — это основы, в том числе мыло, моющие средства, отбеливатели, аммиак и средства для чистки канализации.
Что такое рН?
Цифры на шкале pH взяты из формулы концентрации ионов водорода (H + ). Уравнение для pH:
pH = -log[H + ]
Как работает логарифмическая шкала, химические вещества, которые отдают больше ионов водорода (протонов), имеют более низкие значения pH. Это кислоты. Химические вещества, которые принимают ионы водорода, имеют более высокие значения pH и являются основаниями. Поскольку в основаниях нет свободных ионов водорода, иногда проще вычислить pOH. pOH является мерой гидроксид-иона (OH – ) концентрация.
pOH = -log[OH – ]
pH и pOH взаимосвязаны. При комнатной температуре:
pH + pOH = 14
Как измерить pH
Существует несколько способов измерения pH.
- В лаборатории для наиболее чувствительных показаний можно использовать рН-метр. Однако рН-метры дороги и требуют калибровки.
- Универсальный индикатор представляет собой жидкую смесь, отображающую все цвета радуги.
 Добавление капли образца в пятно универсального индикатора окрашивает его в цвет, соответствующий диапазону рН. Другие индикаторы используются для более точных показаний в узких диапазонах pH.
Добавление капли образца в пятно универсального индикатора окрашивает его в цвет, соответствующий диапазону рН. Другие индикаторы используются для более точных показаний в узких диапазонах pH. - Бумажные тест-полоски для определения pH – хороший вариант для дома или школы. Лакмусовая бумага окрашивается в красный, фиолетовый или синий цвет, что позволяет приблизительно оценить значения pH. Впрочем, лакмусовую бумагу покупать не нужно. Изготовить бумажные тест-полоски для определения pH в домашних условиях несложно, используя капустный сок или другой природный индикатор pH.
Ссылки
- Слесарев Е.В.; Лин, Ю.; Бингхэм, Н.Л.; Джонсон, Дж. Э.; Дай, Ю.; Шимель, JP; Чедвик, О.А. (ноябрь 2016 г.). «Водный баланс создает порог рН почвы в глобальном масштабе». Природа . 540 (7634): 567–569. doi:10.1038/nature20139
Кислоты, щелочи и шкала pH – сложные проценты
Нажмите, чтобы увеличить Шкала pH – это то, с чем мы все знакомы; большинство людей помнят его со школьных уроков химии. Это шкала, используемая для оценки того, насколько сильным является раствор кислоты (или щелочи). Цвета, связанные с каждым числом, соответствуют цвету универсального индикатора в растворах с этим конкретным pH. Изрядная часть людей, вероятно, не знает химии, лежащей в основе шкалы pH, но откуда именно берутся эти цифры?
Это шкала, используемая для оценки того, насколько сильным является раствор кислоты (или щелочи). Цвета, связанные с каждым числом, соответствуют цвету универсального индикатора в растворах с этим конкретным pH. Изрядная часть людей, вероятно, не знает химии, лежащей в основе шкалы pH, но откуда именно берутся эти цифры?
Подсказки частично скрыты в названии весов. «H» в pH означает элемент, водород. На простом уровне шкалу pH можно рассматривать как ранжирование количества ионов водорода в растворе: чем больше ионов водорода, тем ниже число pH. «p» в pH, по крайней мере, для химиков означает математическую операцию «-log 10 ». Тогда pH просто равен -log 10 [H + ], где [H + ] — концентрация ионов водорода в конкретном растворе. (Обратите внимание, что, строго говоря, мы обычно используем H 3 O + для обозначения ионов водорода, так как именно такую форму они принимают в растворах. Однако для простоты мы продолжим использовать здесь H + ).
Глядя на график выше, вы можете видеть, что увеличение pH на одну точку фактически влечет за собой десятикратное уменьшение концентрации ионов водорода в растворе. Шкала — это так называемая логарифмическая шкала. Зачем нам вообще заниматься этой математической манипуляцией? Что ж, очевидно, что гораздо проще указать одну цифру, когда речь идет о кислотности (или щелочности) раствора, чем указать многозначную концентрацию ионов водорода. Точечный рН 7 означает нейтральный раствор (ни кислый, ни щелочной). Любой рН ниже 7 является кислым, в то время как любой рН выше 7 называется щелочным.
Молекулы воды имеют химическую формулу H 2 O. Однако эти молекулы способны слегка расщепляться в растворе на ионы H + и OH – (гидроксид). В нейтральном растворе концентрации этих двух ионов равны. Однако добавление кислоты или щелочи может привести к их изменению. Кислоты являются источником ионов водорода, и добавление их в воду увеличивает концентрацию ионов водорода в растворе, снижая концентрацию гидроксид-ионов. Для щелочей верно обратное: они уменьшают концентрацию ионов водорода, увеличивая при этом концентрацию ионов гидроксида.
Для щелочей верно обратное: они уменьшают концентрацию ионов водорода, увеличивая при этом концентрацию ионов гидроксида.
Многие люди не понимают, что pH зависит от температуры. Строго говоря, чистая вода имеет pH 7 только при «комнатной температуре» (25°C). Выше и ниже этой температуры он может меняться: например, при 100°С рН чистой воды составляет 6,14, а при 0°С — 7,47. Это не означает, что чистая вода становится кислой или щелочной, но что при этих температурах именно эти значения pH представляют собой нейтральную точку. В качестве примечания также стоит отметить, что шкала pH не ограничивается обычным показанным здесь диапазоном от 0 до 14 — некоторые сильные кислоты и щелочи могут выходить за пределы этого диапазона, приводя к отрицательным значениям pH или значениям выше 14.
Еще одно распространенное заблуждение относительно pH касается человеческого тела. Такие диеты, как щелочная диета, утверждают, что можно повлиять на значение pH вашего тела, изменив свой рацион, включив в него «подщелачивающие» продукты, которые делают pH вашего тела более щелочным. Хотя то, что на самом деле предлагается, диета, богатая фруктами и овощами, безусловно, ни в коем случае не является вредной для здоровья, то, что вы едите, практически невозможно изменить рН вашего тела. Я не буду вдаваться в подробности, поскольку Кэт из блога The Chronicle Flask уже проделала отличную работу по развенчанию щелочных диет, но стоит повторить несколько ключевых моментов.
Хотя то, что на самом деле предлагается, диета, богатая фруктами и овощами, безусловно, ни в коем случае не является вредной для здоровья, то, что вы едите, практически невозможно изменить рН вашего тела. Я не буду вдаваться в подробности, поскольку Кэт из блога The Chronicle Flask уже проделала отличную работу по развенчанию щелочных диет, но стоит повторить несколько ключевых моментов.
pH желудка может варьироваться от 1,5 до 3,5 по шкале pH. Однако это никак не влияет на pH нашего тела или, точнее, на нашу кровь. Человеческая кровь имеет значение рН, которое всегда слегка щелочное, между 7,35-7,45. Если бы мы могли целенаправленно изменять рН крови за пределами этого небольшого диапазона, мы могли бы на самом деле причинить себе немало вреда; даже изменение pH на 0,5 в любом случае может привести к необратимому повреждению клеток. К счастью, пища, которую мы едим, практически не влияет на рН крови.
То, что мы едим , может влиять на рН нашей мочи. pH мочи имеет среднее значение около 6, но может колебаться от 4,5 до 8. Однако, хотя вы можете иметь малейшее влияние на pH мочи с помощью диеты, это не связано с pH вашей крови; это остается в ранее указанном диапазоне, независимо от любого изменения рН мочи.
pH мочи имеет среднее значение около 6, но может колебаться от 4,5 до 8. Однако, хотя вы можете иметь малейшее влияние на pH мочи с помощью диеты, это не связано с pH вашей крови; это остается в ранее указанном диапазоне, независимо от любого изменения рН мочи.
Идем дальше, и пока мы говорим о кислотах, стоит поговорить о силе кислот. Строго говоря, трудно разместить определенные химические соединения в определенных точках на шкале pH, поскольку их положение зависит от концентрации. Концентрация – это мера того, сколько вещества растворено в растворе. Если у нас есть много кислоты, растворенной в относительно небольшом количестве воды, мы бы сказали, что у нас есть раствор с высокой концентрацией. Точно так же, если бы у нас было очень мало кислоты, растворенной в большом количестве воды, у нас был бы раствор с низкой концентрацией.
Поскольку концентрацию растворов можно легко изменять, растворы одной и той же кислоты с различной концентрацией могут иметь разные значения pH. Однако некоторые кислоты сильнее других. Соляная кислота, та же кислота, что и желудочная кислота, является сильной кислотой, поскольку она может легко разделяться на составляющие ее ионы. С другой стороны, уксусная кислота, содержащаяся в уксусе, является сравнительно слабой кислотой — она не распадается на составляющие ее ионы. Другим примером слабой кислоты является фтористоводородная кислота; вопреки тому, во что вас уверяют в одном популярном телешоу на химическую тематику, на самом деле это довольно слабая кислота, которая, конечно же, не может растворить тело. Это неприятное соединение по разным причинам. Мы можем ранжировать кислоты с точки зрения их силы (или того, насколько легко они распадаются на составляющие их ионы), но это тема для другого поста!
Однако некоторые кислоты сильнее других. Соляная кислота, та же кислота, что и желудочная кислота, является сильной кислотой, поскольку она может легко разделяться на составляющие ее ионы. С другой стороны, уксусная кислота, содержащаяся в уксусе, является сравнительно слабой кислотой — она не распадается на составляющие ее ионы. Другим примером слабой кислоты является фтористоводородная кислота; вопреки тому, во что вас уверяют в одном популярном телешоу на химическую тематику, на самом деле это довольно слабая кислота, которая, конечно же, не может растворить тело. Это неприятное соединение по разным причинам. Мы можем ранжировать кислоты с точки зрения их силы (или того, насколько легко они распадаются на составляющие их ионы), но это тема для другого поста!
Понравился этот пост и графика? Рассмотрите возможность поддержки Compound Interest на Patreon и получайте превью предстоящих публикаций и многое другое!
Изображение в этой статье находится под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4. 0 International License. Ознакомьтесь с рекомендациями по использованию контента сайта.
0 International License. Ознакомьтесь с рекомендациями по использованию контента сайта.
Ссылки и дополнительная литература
- Удивительные щелочные лимоны – K Day, The Chronicle Flask
- Несколько замечаний по pH – M Leger, Atoms & Numbers
- Этот столб pH-сбалансирован для всех – M Leger, Atoms & Numbers
- pH, pOH и K a – Bodner Research Web
Нравится Загрузка…
Роль pH в нашем здоровье
pH, объяснение
pH может выглядеть так, как будто он относится к периодической таблице элементов, но на самом деле это единица измерения. Аббревиатура pH означает потенциальный водород и говорит нам, сколько водорода содержится в жидкости и насколько активен ион водорода.
Как появился pH
Датский химик Сорен Соренсен впервые придумал понятие pH еще в 1893 году, когда изучал процесс производства пива. Он обнаружил, что измерение рН жидкости может сказать нам, насколько она кислая, и, что наиболее важно, что 7 — это сбалансированный рН для воды. Все, что ниже 7, является кислым, все, что выше 7, — щелочным, а нейтральные растворы имеют pH 7, как объясняет Science Buddies.
Все, что ниже 7, является кислым, все, что выше 7, — щелочным, а нейтральные растворы имеют pH 7, как объясняет Science Buddies.
В поисках баланса: рН и организм человека
Что для вас лучше: лимон пососать или перекусить гроздью бананов? Чтобы ответить на этот вопрос, вам сначала нужно понять влияние pH на ваше тело и как управлять его хрупким балансом.
Тонкая грань между кислотой и щелочью
Человеческое тело имеет естественный pH 7,4, и ему необходимо поддерживать этот уровень, чтобы функционировать на пике. Все, что мы потребляем, имеет свой уровень pH. Поэтому наши тела постоянно работают над восстановлением хрупкого баланса, который временно нарушается всякий раз, когда мы едим или пьем что-то слишком кислое или щелочное. Этот процесс называется клеточным гомеостазом — способностью организма сохранять равновесие перед лицом внешних вызовов.
pH и пресная вода
Человеческое тело на 70 процентов состоит из воды. Поэтому неудивительно, что h3O играет ключевую роль в стабилизации нашего естественного уровня pH. Это одна из причин, по которой нам всегда говорят пить много воды. Но не любую воду. Вода с pH от 7,2 до 7,8 идеальна для поддержания хорошего здоровья.
Это одна из причин, по которой нам всегда говорят пить много воды. Но не любую воду. Вода с pH от 7,2 до 7,8 идеальна для поддержания хорошего здоровья.
Когда мы пьем слишком кислые или слишком щелочные жидкости, это может нарушить хрупкий баланс организма, что может привести к развитию бактерий, вирусов, грибков, дрожжей и паразитов. Нижняя линия? Выбирайте воду с умом и пейте много.
Не забывайте про овощи
Достижение идеального баланса pH зависит не только от воды. Пища, которую мы едим, тоже играет роль. Ацидоз, состояние, которое возникает, когда наша внутренняя среда становится слишком кислой, может быть вызвано употреблением слишком большого количества мяса или сахара. Чтобы избежать стресса от ацидоза, а также усталости и потери энергии, которые он вызывает, ешьте много овощей, фруктов и семян с подщелачивающими свойствами, таких как зеленая фасоль, спаржа, огурцы, морковь, гречка, лебеда, коричневый рис, кокос и авокадо. .
Минералы и их многочисленные преимущества
Нарушить баланс организма могут не только кислые продукты. Питьевая вода, из которой были удалены минералы, тоже может это сделать. Содержащиеся в воде минералы не только помогают придать ей характерный вкус, но и оказывают положительное влияние на уровень pH. Каждый минерал в зависимости от собственного ионного состава напрямую влияет на уровень pH и чистоту воды.
Питьевая вода, из которой были удалены минералы, тоже может это сделать. Содержащиеся в воде минералы не только помогают придать ей характерный вкус, но и оказывают положительное влияние на уровень pH. Каждый минерал в зависимости от собственного ионного состава напрямую влияет на уровень pH и чистоту воды.
Стакан идеально сбалансированной воды, пожалуйста
Знаете ли вы, что более щелочная вода (с pH выше 7) может помочь восстановить баланс вашего тела за счет снижения уровня внутренней кислотности? Это также может помочь вам сэкономить на счетах за стоматолога, поскольку кислые напитки являются одной из основных причин кариеса!
Следуйте своей истинной природе и увлажняйте свое тело природной родниковой водой
Зачем пытаться подражать природе, если она совершенна сама по себе? Как правило, сильно очищенная вода, даже реминерализованная, имеет pH ниже 7. С другой стороны, вода, взятая из подземных источников, которая не подвергалась какой-либо обработке или минерализации, почти всегда имеет pH между 7,2 и 7,8, что делает природную родниковую воду идеальной для поддержания естественного баланса рН нашего организма.
При pH от 7,3 до 7,8 Eska является одной из самых здоровых и сбалансированных родниковых вод. Еще один повод поднять бокал (эски) за ваше здоровье!
Вкус и здоровье
Как наслаждаться газированной водой?
Безкалорийная, простая или ароматизированная: многоликая газированная вода Чтобы избежать обезвоживания и наслаждаться жизнью в полной мере, ничто не сравнится с газированной водой Eska. Безкалорийная, простая или ароматизированная, наша вода идеально подходит для любого случая и является идеальной альтернативой негазированной воде. Вот как наслаждаться этим так часто, как вы хотите. Готов к некоторым […]
Вкус и здоровье
Газированная вода полезна для здоровья?
6 часто задаваемых вопросов Всем известно, что гидратация необходима для хорошего здоровья. В то время как достоинства негазированной воды хорошо известны, где стоит газированная вода? Это так же полезно для вашего здоровья или что-то скрывает? Все ли газированные воды одинаковы? Мы подробно рассмотрим эти вопросы и поможем […]
Вкус и здоровье
На пляже, в походе или после тренировки безалкогольные коктейли всегда идеальны в дороге
Что может быть лучше освежающего напитка в жаркий солнечный день? У бассейна, на пляже, после тренировки или с друзьями на даче — все причины утолить жажду стильно. Для здорового напитка, которым можно наслаждаться в любое время, ничто не сравнится с освежающим безалкогольным коктейлем со вкусом […]
Для здорового напитка, которым можно наслаждаться в любое время, ничто не сравнится с освежающим безалкогольным коктейлем со вкусом […]
2.5: Факторы, определяющие кислотность
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 30261
Периодические тенденции
Сначала мы сосредоточимся на отдельных атомах и подумаем о тенденциях, связанных с положением элемента в периодической таблице. Мы будем использовать в качестве наших первых моделей простые органические соединения этан, метиламин и этанол, но концепции в равной степени применимы и к более сложным биомолекулам, таким как боковые цепи аланина, лизина и серина.
Мы можем видеть четкую тенденцию в кислотности, двигаясь слева направо по второму ряду таблицы Менделеева от углерода к азоту и к кислороду. Ключом к пониманию этой тенденции является рассмотрение гипотетического сопряженного основания в каждом случае : чем стабильнее (слабее) сопряженное основание, тем сильнее кислота . Посмотрите, где заканчивается отрицательный заряд в каждом сопряженном основании. В анионе этила отрицательный заряд несет углерод, в то время как в анионе метиламина и анионе этоксида заряды расположены на азоте и кислороде соответственно. Вспомните периодический тренд электроотрицательности: она также увеличивается по мере продвижения слева направо по ряду, а это означает, что кислород является наиболее электроотрицательным из трех, а углерод — наименее. Чем более электроотрицательный атом, тем лучше он способен нести отрицательный заряд . Таким образом, анион этоксида является наиболее стабильным (самая низкая энергия, наименее основный) из трех сопряженных оснований, а анион этила является наименее стабильным (самая высокая энергия, самый основный).
Ключом к пониманию этой тенденции является рассмотрение гипотетического сопряженного основания в каждом случае : чем стабильнее (слабее) сопряженное основание, тем сильнее кислота . Посмотрите, где заканчивается отрицательный заряд в каждом сопряженном основании. В анионе этила отрицательный заряд несет углерод, в то время как в анионе метиламина и анионе этоксида заряды расположены на азоте и кислороде соответственно. Вспомните периодический тренд электроотрицательности: она также увеличивается по мере продвижения слева направо по ряду, а это означает, что кислород является наиболее электроотрицательным из трех, а углерод — наименее. Чем более электроотрицательный атом, тем лучше он способен нести отрицательный заряд . Таким образом, анион этоксида является наиболее стабильным (самая низкая энергия, наименее основный) из трех сопряженных оснований, а анион этила является наименее стабильным (самая высокая энергия, самый основный).
Мы можем использовать тот же набор идей, чтобы объяснить разницу в щелочности воды и аммиака.
Глядя на значения pK a для соответствующих сопряженных кислот, мы знаем, что аммиак является более щелочным, чем вода. Кислород, как более электроотрицательный элемент, крепче держится за свою неподеленную пару, чем азот. Таким образом, неподеленная пара азота с большей вероятностью оторвется и образует новую связь с протоном — другими словами, она является более основной. Опять же, более реакционноспособное (более сильное) сопряженное основание означает менее реакционноспособную (более слабую) сопряженную кислоту.
При перемещении по вертикали в пределах данного столбца таблицы Менделеева мы снова наблюдаем четкую периодическую тенденцию кислотности. Лучше всего это иллюстрируется галогенидами: основность, как и электроотрицательность, увеличивается по мере продвижения вверх по колонке.
Наоборот, кислотность галоидокислот увеличивается, когда мы перемещаем вниз по колонке.
Чтобы понять эту тенденцию, мы еще раз рассмотрим устойчивость сопряженных оснований. Поскольку фтор является наиболее электроотрицательным элементом галогена, можно было бы ожидать, что фторид также является наименее основным ионом галогена. Но на самом деле это хоть стабильная, а самая основная! Получается, что при вертикальном движении в таблице Менделеева размер атома превосходит его электроотрицательность по отношению к основности. Атомный радиус йода примерно в два раза больше, чем у фтора, поэтому отрицательный заряд иона йода распределяется по значительно большему объему:
Поскольку фтор является наиболее электроотрицательным элементом галогена, можно было бы ожидать, что фторид также является наименее основным ионом галогена. Но на самом деле это хоть стабильная, а самая основная! Получается, что при вертикальном движении в таблице Менделеева размер атома превосходит его электроотрицательность по отношению к основности. Атомный радиус йода примерно в два раза больше, чем у фтора, поэтому отрицательный заряд иона йода распределяется по значительно большему объему:
Это иллюстрирует фундаментальное понятие органической химии, достаточно важное, чтобы выделить его красным цветом. :
Электростатические заряды, как положительные, так и отрицательные, более стабильны, когда они «рассредоточены», чем когда они ограничены одним атомом .
Мы будем видеть, как эта идея снова и снова выражается в ходе нашего изучения органической реактивности в различных контекстах. Пока эта концепция применяется только к влиянию атомного радиуса на стабильность аниона. Поскольку фторид является наименее стабильным (наиболее основным) из сопряженных галогенидных оснований, HF является наименее кислой из галогенкислот, лишь немного более сильной, чем уксусная кислота. Привет, с pK a около -9, является одной из самых сильных известных кислот.
Поскольку фторид является наименее стабильным (наиболее основным) из сопряженных галогенидных оснований, HF является наименее кислой из галогенкислот, лишь немного более сильной, чем уксусная кислота. Привет, с pK a около -9, является одной из самых сильных известных кислот.
Что еще более важно для изучения биологической органической химии, эта тенденция говорит нам о том, что тиолы более кислые, чем спирты. Например, pK a тиоловой группы на боковой цепи цистеина составляет приблизительно 8,3, тогда как pK a для гидроксильной группы на боковой цепи серина составляет порядка 17.
Повторим: сила кислоты увеличивается при движении вправо по строке периодической таблицы и при движении вниз по столбцу.
| Пример 7.6 |
|---|
Изобразите структуру сопряженного основания, которое образовалось бы, если соединение, указанное ниже, прореагировало с 1 молярным эквивалентом гидроксида натрия: Решение |
Эффект резонанса
В предыдущем разделе мы сосредоточили наше внимание на периодических тенденциях – различиях в кислотности и щелочности между группами, где обменный протон был связан с разными элементами. Теперь пришло время подумать о том, как структура различных органических групп влияет на их относительную кислотность или основность, даже когда мы говорим об одном и том же элементе, действующем как донор/акцептор протонов. Первая модельная пара, которую мы рассмотрим, — это этанол и уксусная кислота, но полученные нами выводы будут в равной степени справедливы для всех групп спирта и карбоновой кислоты.
Теперь пришло время подумать о том, как структура различных органических групп влияет на их относительную кислотность или основность, даже когда мы говорим об одном и том же элементе, действующем как донор/акцептор протонов. Первая модельная пара, которую мы рассмотрим, — это этанол и уксусная кислота, но полученные нами выводы будут в равной степени справедливы для всех групп спирта и карбоновой кислоты.
Несмотря на то, что они оба являются кислородными кислотами, значения pK и этанола и уксусной кислоты сильно различаются. Что делает карбоновую кислоту намного более кислой, чем спирт? Как и прежде, начнем с рассмотрения сопряженных базисов.
У обоих видов отрицательный заряд сопряженного основания удерживается кислородом, поэтому периодические тренды вызывать нельзя. Однако для уксусной кислоты есть ключевое отличие: можно привлечь резонансный вкладчик, в котором отрицательный заряд локализован на втором кислороде группы. Согласно нашим «правилам резонанса», две формы резонанса для сопряженного основания равны по энергии. Как вы, возможно, помните, это означает, что отрицательный заряд ацетат-иона не находится ни на одном кислороде, ни на другом: скорее, он разделен между ними двумя. Химики используют термин «делокализация заряда» для описания этой ситуации. В ионе этоксида, напротив, отрицательный заряд «заперт» на одном кислороде — ему больше некуда деться.
Как вы, возможно, помните, это означает, что отрицательный заряд ацетат-иона не находится ни на одном кислороде, ни на другом: скорее, он разделен между ними двумя. Химики используют термин «делокализация заряда» для описания этой ситуации. В ионе этоксида, напротив, отрицательный заряд «заперт» на одном кислороде — ему больше некуда деться.
Теперь пришло время вспомнить утверждение из предыдущего раздела, которое было настолько важным, что было выделено жирным шрифтом в отдельном абзаце — на самом деле, оно настолько важно, что мы просто повторим его еще раз: «Электростатический заряды, как положительные, так и отрицательные, более стабильны, когда они «рассредоточены», чем когда они ограничены одним атомом». Теперь мы видим эту концепцию в другом контексте, где заряд «распространяется» (другими словами, делокализуется) посредством резонанса , а не просто размером задействованного атома.
Делокализация заряда в результате резонанса оказывает очень сильное влияние на реакционную способность органических молекул, достаточное для того, чтобы объяснить разницу более чем в 12 pK a единиц между этанолом и уксусной кислотой (и помните, что pK a — это логарифм выражение, поэтому мы говорим о разнице более чем на 10 12 между константами кислотности для двух молекул). Ион ацетата намного более стабилен, чем ион этоксида, и все из-за эффектов делокализации резонанса.
Ион ацетата намного более стабилен, чем ион этоксида, и все из-за эффектов делокализации резонанса.
Эффект резонанса также прекрасно объясняет, почему атом азота является основным, когда он находится в амине, но , а не , когда он является частью амидной группы. Напомним, что в амиде связь углерод-азот имеет значительный характер двойной связи из-за второго резонансного фактора, в котором неподеленная пара азота является частью р-связи.
В то время как неподеленная электронная пара аминного азота «застревает» в одном месте, неподеленная пара амидного азота делокализована в результате резонанса. Обратите внимание, что в данном случае мы расширяем наше основное утверждение, говоря, что плотность электронов — в форме неподеленной пары — стабилизируется резонансной делокализацией, даже если в ней не участвует отрицательный заряд. Вот еще один способ подумать об этом: неподеленная пара на амидном азоте недоступна для связи с протоном — эти два электрона слишком «комфортны», будучи частью делокализованной системы пи-связи. Напротив, неподеленная пара на атоме азота амина не является частью делокализованной р-системы и очень готова к образованию связи с любым кислотным протоном, который может оказаться поблизости.
Напротив, неподеленная пара на атоме азота амина не является частью делокализованной р-системы и очень готова к образованию связи с любым кислотным протоном, который может оказаться поблизости.
Часто требуется тщательное размышление, чтобы предсказать самый кислый протон в молекуле. Аскорбиновая кислота, также известная как витамин С, имеет pK и 4,1.
В этой молекуле четыре гидроксильных группы – какая из них наиболее кислая? Если мы рассмотрим все четыре возможных сопряженных основания, то обнаружим, что есть только одно, для которого мы можем делокализовать отрицательный заряд по двум атомам кислорода.
| Пример 7.7 |
|---|
Расположите приведенные ниже соединения от наиболее кислых до наименее кислых и объясните свои рассуждения. Решение |
Индуктивный эффект
Сравните значения pK a уксусной кислоты и ее моно-, ди- и трихлорпроизводных:
Присутствие хлора явно увеличивает кислотность карбоновой кислоты группе, но аргумент здесь не имеет отношения к делокализации резонанса, потому что для хлорированных молекул нельзя привлечь никаких дополнительных резонансных вкладчиков. Скорее, объяснение этого явления связано с чем-то, что называется индуктивный эффект . Атом хлора более электроотрицателен, чем водород, и поэтому способен «индуцировать» или «притягивать» электронную плотность к себе, от карбоксилатной группы. По сути, атомы хлора способствуют дальнейшему распределению электронной плотности сопряженного основания, что, как мы знаем, оказывает стабилизирующее действие. В этом контексте заместитель хлора называется электроноакцепторной группой . Обратите внимание, что pK a -понижающий эффект каждого атома хлора, хотя и значительный, не столь драматичен, как эффект делокализации резонанса, иллюстрируемый разницей в pK a значений между спиртом и карбоновой кислотой. В общем, резонансные эффекты более мощные, чем индуктивные эффекты .
Скорее, объяснение этого явления связано с чем-то, что называется индуктивный эффект . Атом хлора более электроотрицателен, чем водород, и поэтому способен «индуцировать» или «притягивать» электронную плотность к себе, от карбоксилатной группы. По сути, атомы хлора способствуют дальнейшему распределению электронной плотности сопряженного основания, что, как мы знаем, оказывает стабилизирующее действие. В этом контексте заместитель хлора называется электроноакцепторной группой . Обратите внимание, что pK a -понижающий эффект каждого атома хлора, хотя и значительный, не столь драматичен, как эффект делокализации резонанса, иллюстрируемый разницей в pK a значений между спиртом и карбоновой кислотой. В общем, резонансные эффекты более мощные, чем индуктивные эффекты .
Индуктивное электроноакцепторное действие хлора проявляется через ковалентные связи, и его влияние заметно уменьшается с расстоянием – таким образом, хлор, находящийся на расстоянии двух атомов углерода от группы карбоновой кислоты, имеет уменьшенный эффект по сравнению с хлором, находящимся всего на расстоянии одного атома углерода.
| Пример |
|---|
Расположите приведенные ниже соединения от наиболее кислых до наименее кислых и объясните свои рассуждения. Решение |
- Органическая химия с акцентом на биологию Тима Содерберга (Университет Миннесоты, Моррис)
- Лэйн А. Морш (Университет Иллинойса, Спрингфилд)
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Показать страницу TOC
- нет на странице
- Теги

Факторы, контролирующие относительную силу кислот и оснований
Факторы которые контролируют относительную силу кислот и оснований
| Полярность XH Бонд | Размер атома X |
| Плата за Кислота или основание | Степень окисления Центральный Атом |
Полярность Х Н Bond
Когда все остальные факторы остаются постоянными, кислоты становятся
сильнее, чем X H
связь становится более полярной. Гидриды неметаллов второго ряда, для
например, становятся более кислыми, поскольку разница между
увеличивается электроотрицательность атомов X и H. ВЧ
самая сильная из этих четырех кислот, и CH 4 является одним из
самые слабые из известных кислот Бренстеда.
| ВЧ | К a = 7,2 x 10 -4 | ЕН = 1,8 | |||
| Н 2 О | К и = 1,8 х 10 -16 | ЕН = 1,2 | |||
| НХ 3 | К a = 1 x 10 -33 | ЕН = 0,8 | |||
| СН 4 | К a = 1 x 10 -49 | ЕН = 0,4 |
Когда эти соединения действуют как кислоты, связь H- X распадается на ионы H + и X – . Чем полярнее эта связь, тем легче образуются эти ионы. Таким образом,
чем полярнее связь, тем сильнее кислота.
Чем полярнее эта связь, тем легче образуются эти ионы. Таким образом,
чем полярнее связь, тем сильнее кислота.
Раствор 0,1 M HF умеренно кислый. Вода гораздо менее кислая, а кислотность аммиака настолько мала, что В химии водных растворов этого соединения преобладают его способность выступать в качестве базы.
| ВЧ | рН = 2,1 | |
| Н 2 О | рН = 7 | |
| НХ 3 | рН = 11,1 |
Размер атома X
На первый взгляд можно было бы ожидать, что HF, HCl, HBr и HI
стали бы более слабыми кислотами по мере того, как мы спускаемся по этой колонке
периодической таблицы, потому что связь X -H становится менее полярной. Экспериментально мы обнаруживаем обратную тенденцию. Эти кислоты на самом деле
становиться сильнее по мере того, как мы спускаемся по этой колонке.
Экспериментально мы обнаруживаем обратную тенденцию. Эти кислоты на самом деле
становиться сильнее по мере того, как мы спускаемся по этой колонке.
Это происходит потому, что размер атома X влияет на кислотность связи X -Н. Кислоты становятся сильнее, как X -H связь становится слабее, а связи обычно становятся слабее по мере того, как атомы становятся больше, как показано на рисунке ниже.
Данные K a для HF, HCl, HBr и HI отражают тот факт, что энтальпия диссоциации связи X -H ( BDE ) становится меньше X атом становится больше.
|
Заряд кислоты или основание
Заряд молекулы или иона может влиять на их способность
действовать как кислота или основание. Это хорошо видно, когда рН
0,1 M растворы H 3 PO 4 и H 2 PO 4 – ,
HPO 4 2- и PO 4 3- сравниваются ионы.
Это хорошо видно, когда рН
0,1 M растворы H 3 PO 4 и H 2 PO 4 – ,
HPO 4 2- и PO 4 3- сравниваются ионы.
| H 3 Заказ на покупку 4 | рН = 1,5 | |
| Н 2 Заказ на покупку 4 – | рН = 4,4 | |
| ГПО 4 2- | рН = 9,3 | |
| Заказ на поставку 4 3- | рН = 12,0 |
Соединения становятся менее кислотными и более щелочными по мере отрицательного заряд увеличивается.
Кислотность: H 3 PO 4 > H 2 PO 4 – > HPO 4 2-
Основность: H 2 PO 4 – < HPO 4 2- < PO 4 3-
Состояние окисления Central Atom
Нет разницы в полярности, размере или заряде при
мы сравниваем оксикислоты одного и того же элемента, такие как H 2 SO 4 и H 2 SO 3 или HNO 3 и HNO 2 ,
тем не менее, есть существенная разница в силе этих
кислоты. Рассмотрим следующие данные K a ,
Например.
Рассмотрим следующие данные K a ,
Например.
| H 2 SO 4 : | К a = 1 x 10 3 | HNO 3 : | К а = 28 | ||||
| H 2 SO 3 : | К a = 1,7 х 10 -2 | ГНО 2 : | К a = 5,1 x 10 -4 |
Кислотность этих оксикислот значительно возрастает по мере
степень окисления центрального атома становится больше. H 2 SO 4 является гораздо более сильной кислотой, чем H 2 SO 3 и HNO 3 является гораздо более сильной кислотой, чем HNO 2 . Эта тенденция
легче всего увидеть в четырех оксикислотах хлора.
Эта тенденция
легче всего увидеть в четырех оксикислотах хлора.
| Оксикислота | К а | Окисление Номер Хлор | ||
| HOCl | 2,9 x 10 -8 | +1 | ||
| HClO | 1,1 x 10 -2 | +3 | ||
| HClO 2 | 5,0 x 10 2 | +5 | ||
| HClO 3 | 1 х 10 3 | +7 |
Этот коэффициент 10 11 разница в значении K a для хлорноватистой кислоты (HOCl) и хлорной кислоты (HOClO 3 )
можно проследить за тем, что существует только одно значение для
электроотрицательность элемента, но склонность атома к
притягивать к себе электроны увеличивается по мере того, как степень окисления
атом увеличивается.
По мере увеличения степени окисления атома хлора атом становится более электроотрицательным. Это имеет тенденцию притягивать электроны от атомов кислорода, окружающих хлор, тем самым делая атомы кислорода более электроотрицательными, как показано на рисунок ниже. В результате связь OH становится более полярной, а соединение становится более кислым.
| Практическая задача 6: Для каждой из следующих пар, давайте предскажем, какое соединение является более сильной кислотой. (а) H 2 O или NH 3 (b) NH 4 + или NH 3 (c) NH 3 или PH 3 (d) H 3 PO 4 или H 3 PO 3 Нажмите здесь, чтобы проверить свой ответ на практическое задание 6 |
Относительная сила оснований Бренстеда
можно предсказать по относительной силе их сопряженных
кислоты в сочетании с общим правилом, что более сильная из пары
кислот всегда имеет более слабое сопряженное основание.
| Практическая задача 7: Для каждой из следующих пар соединений, определить, какое соединение является более сильным основанием. (а) ОН – или NH 2 – (a) OH – или NH 2 – (c) NH 2 – или PH 2 – (d) № 3 – или № 2 – Нажмите здесь, чтобы проверить свой ответ на практическое задание 7 |
Сильные кислоты и основания | ChemTalk
Основные понятия
В этом руководстве вы узнаете о свойствах и pH сильных кислот и оснований , а также о том, как рассчитать их значения pH, pOH, pKa и pKb.
Темы, освещенные в других статьях
- Кислотно-основная химия
- Типы химических реакций
- Что такое pKa?
- Свойства кислот и оснований
- Список общих многоатомных ионов
- Кислотно-основная реакция нейтрализации
Словарь
pH – мера концентрации ионов водорода в растворе.
pOH – мера концентрации гидроксид-иона в растворе.
Сильные кислоты – Введение
Сильная кислота (ГК) полностью диссоциирует в растворе. Другими словами, он ионизирует 100% в водном растворе. Кроме того, сильные кислоты являются хорошими донорами протонов и могут оставаться в водном растворе. Сильный донор протона определяется как молекула, в которой водород присоединен к электроотрицательному атому, такому как кислород или галоген (фтор, хлор, бром, йод, астат и теннессин). В воде сильная кислота теряет протон и передает его Н 2 молекулы O, образующие H 3 O — ион гидроксония.
HA + H 2 O → H 3 O + (водн. ) + A – (водн.)
) + A – (водн.)
7 например, ион хлорида или нитрата.
Сильные кислоты имеют большое значение Ka (константа диссоциации кислоты) и маленькое значение pKa (логарифмическая константа диссоциации кислоты).
pH и pKa сильной кислоты
Сильные кислоты, такие как соляная кислота (HCl), имеют рН от 0 до 1. Чем ниже значение рН, тем выше концентрация ионов водорода в растворе, следовательно, более сильная кислота.
pH = -log [H + ]
Константа диссоциации кислоты Ka измеряет, насколько полностью кислота диссоциирует в водном растворе. Большое значение Ka указывает на сильную кислоту, поскольку это означает, что кислота в значительной степени диссоциирована на свои ионы. Так как сильные кислоты полностью диссоциируют в растворе, они имеют небольшое значение Ка.
Логарифмическая константа диссоциации кислоты pKa напрямую связана с Ka. Следовательно, чем ниже значение pKa, тем сильнее кислота.
pKa = -log [Ka ]
Сопряженное основание сильной кислоты
Сопряженное основание кислоты представляет собой ион, который образуется, когда кислота теряет протон. Например, сопряженным основанием HCl является ион хлорида, Cl – . Сопряженное основание сильной кислоты является очень слабым основанием. Соли, образованные из этих сопряженных оснований, часто имеют рН 7 или чуть выше 7. Например, хлорид натрия, сульфат натрия и нитрат натрия имеют анионы, которые являются сопряженными основаниями сильных кислот. Все эти соли имеют рН около 7 в растворе, что является нейтральным рН.
Сильные основания
Сильное основание (BOH) также полностью диссоциирует и на 100% ионизируется в водном растворе. Кроме того, сильные основания являются хорошими акцепторами протонов, которые не могут оставаться в водном растворе. Например, все ионы O 2- превращаются в гидроксид-ионы OH – , принимая протоны от молекул H 2 O. В результате молекулы H 2 O превращаются в OH – . Важно отметить, что катионы сильных оснований растворимы в воде. Другими словами, если катион растворим в воде, он может образовать сильное основание.
В результате молекулы H 2 O превращаются в OH – . Важно отметить, что катионы сильных оснований растворимы в воде. Другими словами, если катион растворим в воде, он может образовать сильное основание.
BOH + H 2 O → B + (aq) + OH – (AQ)
POH и PKB of A Сильной базы 9001 2
POH и PKB из сильной основы 9001 2
POH и PKB из сильной основы 9001 2
и PKB из сильной основы 9001 2
и Pkb of A Сильной базы 9001 2
. концентрация иона (ОН-). Чем ниже значение рОН, тем выше концентрация гидроксид-ионов в растворе, следовательно, более сильное основание.
pOH = -log [OH – ]
Константа диссоциации основания, Kb, измеряет степень диссоциации основания в водном растворе. Большое значение Kb указывает на сильное основание, поскольку это означает, что основание в значительной степени диссоциировано на его ионы.
По значению Kb можно рассчитать pKb. Чем ниже значение pKb, тем прочнее основание.
pKb = -log [Kb]
pH и pOH водного раствора связаны следующим уравнением:
pH + pOH = 14
известен, другой можно вычислить. Сильные основания обычно имеют рН от 13 до 14.
Расчет рН сильных кислот и оснований Примеры
Q1. Предположим, у вас есть 0,1М раствор HCl. Рассчитайте его рН.
HCl + H 2 O → H 3 O + (водн.) + Cl – (водн.)
O,1M также является концентрацией ионов гидроксония.
Для расчета pH подставьте 0,1M в уравнение pH:
pH = -log [H 3 O + ] = -log (0,1) = 1
Q2. Предположим, у вас есть 0,1 М раствор NaOH. Рассчитайте его рН.
NaOH + H 2 O → Na + (водн.) + OH – (водн. )
)
Поскольку гидроксид натрия является сильным основанием, диссоциация 100%. O,1M также является концентрацией гидроксид-ионов.
Чтобы рассчитать pH, подставьте 0,1M в уравнение pOH:
pOH = -log [OH – ] = -log (0,1) = 1
Затем используйте следующее уравнение для определения pH:
pH + pOH = 14
pH = 14 – pOH = 14 – 1 = 13
Список сильных кислот и оснований
Давайте рассмотрим несколько примеров распространенных сильных кислот и распространенных сильных оснований.
Список сильных кислот (7):
- HCl (гидрохлорная кислота)
- HNO 3 (азотная кислота)
- H 2 SO 4 (SULE HALDFIC ( (SULE HARDFIC ( (SULE WIRDFINGINGIRIP) 2 SO 4 (SULE HALDFIC 2 (SO 4 (SULE HARDFIC 2 (SO 4 (SULE .
- HI (йодистоводородная кислота)
- HClO 3 (хлорная кислота)
- HClO 4 (хлорная кислота)
Список сильных оснований (8):
- LiOH (гидроксид лития)
- NaOH (гидроксид натрия)
- KOH (гидроксид калия)
- Ca(OH) 2
- 8 (гидроксид кальция 927рубидий) гидроксид)
- Sr(OH) 2 (гидроксид стронция)
- CsOH (гидроксид цезия)
- Ba(OH) 2 (гидроксид бария)


 Добавление капли образца в пятно универсального индикатора окрашивает его в цвет, соответствующий диапазону рН. Другие индикаторы используются для более точных показаний в узких диапазонах pH.
Добавление капли образца в пятно универсального индикатора окрашивает его в цвет, соответствующий диапазону рН. Другие индикаторы используются для более точных показаний в узких диапазонах pH.