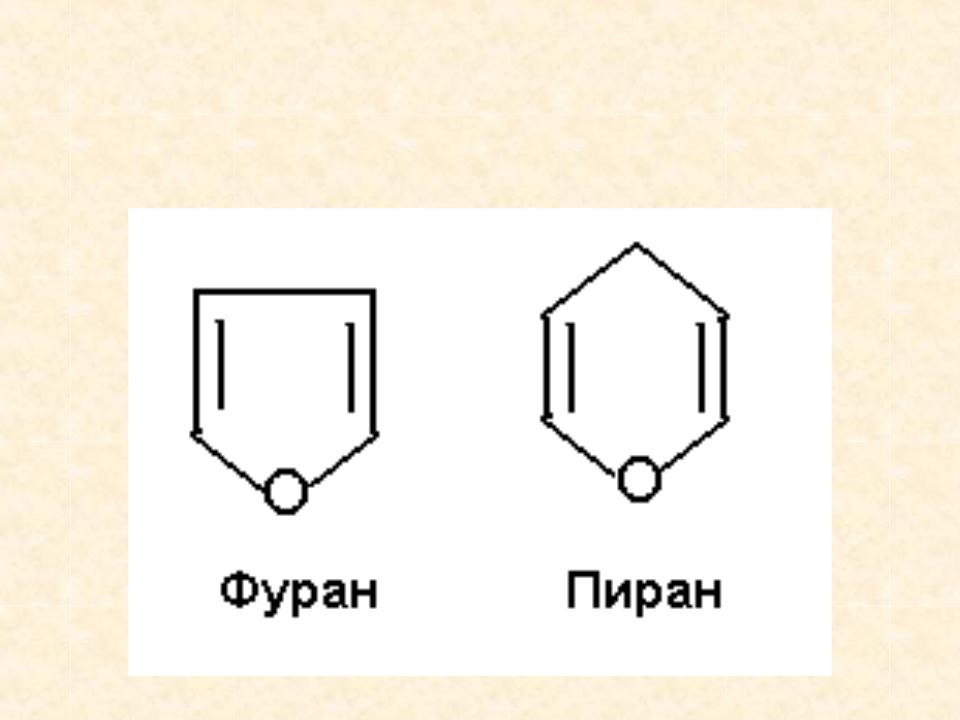
Пираны и восстановленные фураны / Химия гетероциклических соединений
27.1.2. Пираны и восстановленные фураны
3,4-Дигидро-2Н-пиран и 2,3-дигидрофуран ведут себя как эфиры енола. Первый из них широко используется для защиты спиртов [7], с которыми он быстро реагирует в условиях кислотного катализа с образованием ацеталей, устойчивых даже в сильноосновных условиях, но легко гидролизующихся до спиртов в мягких условиях в кислых растворах.
4Н-Пиран, по-видимому, несколько менее устойчив, чем дигидропиран, но в реакции вступает подобным же образом: например, он литиируется по положению 2 и вступает в реакции Дильса-Альдера как эфир енола [8].
Гидроксилированные тетрагидрофураны и тетрагидропираны изучены достаточно подробно, так как подобные циклические системы встречаются в различных сахарах и соединениях, содержащих остатки сахаров; в качестве примеров [9] можно привести сахарозу и РНК (разд. 24.1.).
Тетрагидропиран, так же как и пиперидин, принимает конформацию кресла. Один из интересных аспектов, возникающих при изучении алкоксизамещённых тетрагидропиранов, заключается в том, что 2-алкоксигруппа находится преимущественно в аксиальном положении (аномерный эффект [10]). Причина заключается в том, что с экваториальной ориентацией связаны невыгодные диполь-дипольные взаимодействия между свободными электронными парами двух атомов кислорода, и выигрыш энергии от аксиальной ориентации заместителя в положении 2 с избытком компенсирует возникающее при этом невыгодное 1,3-диаксиальное взаимодействие.
Один из интересных аспектов, возникающих при изучении алкоксизамещённых тетрагидропиранов, заключается в том, что 2-алкоксигруппа находится преимущественно в аксиальном положении (аномерный эффект [10]). Причина заключается в том, что с экваториальной ориентацией связаны невыгодные диполь-дипольные взаимодействия между свободными электронными парами двух атомов кислорода, и выигрыш энергии от аксиальной ориентации заместителя в положении 2 с избытком компенсирует возникающее при этом невыгодное 1,3-диаксиальное взаимодействие.
Глюкоза существует преимущественно в циклических полуацетальных формах, содержащих тетрагидропирановый цикл, хотя во многих химических реакциях она участвует в виде находящейся в малых концентрациях ациклической полигидроксиальдегидной формы. Преобладание циклической формы свидетельствует о стабильности, присущей насыщенным шестичленным циклам, находящимся в конформации кресла. Склонность к циклизации — общее свойство 5-гидроксиальдегидов, 5-гидроксикетонов и 5-гидроксикислот, поскольку все они легко образуют шестичленные кислородсодержащие циклы — лактолы и лактоны соответственно.
Сравнительно легко образуются и пятичленные циклы: в зависимости от условий производные глюкозы могут легко образовывать формы фураноз, то есть производные тетрагидрофурана
Циклические насыщенные эфиры инертны подобно ациклическим эфирам и для разрыва связи C-O необходимы жёсткие условия [11]. Эти их свойства противоположны свойствам гетероциклических систем с малыми циклами.
Пиран – Справочник химика 21
Полная номенклатура моносахаридов иллюстрируется на примере р-Д-глюкопиранозы (45). Слово -пираноза обозначает шестичленный цикл (пиран), слог оза обозначает сахар ГЛЮКО- характеризует относительную конфигурацию при С-2, С-3, С-4 и С-5 р — указывает на конфигурацию при аномерном атоме С-1 О — однозначно говорит об энантиомерной форме всей молекулы. [c.170]
Калибруют эти приборы известным методом с помощью вакуумметра Мак-Леода при использовании предварительно осушенного воздуха.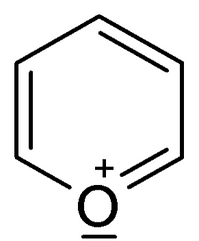 Соответствующие калибровочные кривые представлены в технической документации на прибор. Точность измерения манометра Пирани составляет 5% в интервале давления от 1 до 5-10″ мм рт. ст., а ионизационного вакуумметра —3% в интервале давления от 10 до 10 мм рт. ст. Для подсоединения этих приборов к вакуумированной ректификационной установке они снабжаются штуцером со стандартным шлифом NS 14,5/28 или небольшим фланцем.
Соответствующие калибровочные кривые представлены в технической документации на прибор. Точность измерения манометра Пирани составляет 5% в интервале давления от 1 до 5-10″ мм рт. ст., а ионизационного вакуумметра —3% в интервале давления от 10 до 10 мм рт. ст. Для подсоединения этих приборов к вакуумированной ректификационной установке они снабжаются штуцером со стандартным шлифом NS 14,5/28 или небольшим фланцем.
З-дигндро-1, 4-бенз-пиран см. а-Токоферол [c.1090]
Имеются также случаи, когда локанты суффиксов не могут быть перемещены влево, например когда другой локант на основании специального правила должен занять это место. Таковы, например, названия 5а-холестан-3-он, 2Н-пиран-3-ол или бицикло [3,3,0] окт-2-ен. [c.66]
Манометр Пирани, основанный на измерении теплопроводности Общее давление Зависят 10-1—10- [c.447]
Особую группу тепловых вакуумметров составляют термопарные вакуумметры (ВТ), отличающиеся от вакуумметров Пирани тем, что температуру нити измеряют термопарой.
ОКСИ-4-ОКСО-1, 4-пиран- [c.776]
I, 4-Пиран-2, В-дикарбоно-вая к-та, З-окси-4-оксо- [c.884]
Пиран-5-карбоновая к-та, 2-оксо- [c.884]
Пиразолон, 3-метил-1-фенил-Пираконитин Пиран, тетрагидро- [c.884]
Уббелоде получил измеримые количества продуктов, кипящих выше температур кипения карбонильных соединений от С до С4 при окислении н-пентана при атмосферном давлении. Он проводил окисление в системе с циркуляцией при температурах от 320 до 350° С, отделяя к-пентан и низкокипящие продукты от конденсата и возвращая их в реактор [63]. Во фракции конденсата 65—95° С он выделил 2-метилтетрагидрофуран и обнаружил несколько ненасыщенных соединений, вероятно, дигидро-пиранов. Предположение Уббелоде относительно образования циклической окиси путем внутренней дегидратаций гидроперекиси является, по-видимому, наиболее удовлетворительным объяснением из всех, которые могут быть предложены.
Об автоматическом регулировании остаточного давления в областях среднего и высокого вакуума в литературе имеется сравнительно мало сведений. При использовании вакуумметров, основанных на принципе измерения теплопроводности газа, Лапорт [49] рекомендует подключить к мостовой схеме Пирани сигнальное устройство, которое дает звуковой сигнал при увеличении давления выше заданного предела. Нисбет [54 ] описал прибор, позволяющий поддерживать в сосуде, продуваемом воздухом, постоянное давление 10″ мм рт. ст. Мельпольдер [55] описал регулятор давления, обеспечивающий в интервале от 10″ до 10″ мм рт. ст. точность регулирования, равную 10″ мм рт. ст. Схема данного регулятора приведена на рис. 384. Принцип его работы заключается во введении в манометр Мак-Леода четырех впаянных контактов 9—12. С помощью устройства 13 в манометре Мак-Леода каждую минуту поднимают уровень ртути. Регулирование давления осуществляется с помощью контактов 9 и При уменьшешш-давления в системе ниже заданного контакт 10 замыкается, при этом он через реле 5 и 2 закрывает электромагнитный клапан 5.

Принцип действия тейповых вакуумметров (тер Л1сторных и термопарных) основан на методах косвенного измерения зависимости теплопередачи через раарежецный газ от давления этого газа. Впервые такой вакуумметр был предложен Пирани более 70 пет назад. [c.36]
Кроме ]- н а-пиронов, рассмотренных в предыдущей главе, производными гетероциклических систем и а-пиранов являются также [c.687]
Из, них пиран и тиопиран известны до сих пор лишь в виде производных. Важнейшие из этих производных — пироны, ксантоны и пирилиевые красители (антоцианы) — уже были рассмотрены в предыдущих разделах вследствие их тесной связи с чисто ароматическими соединениями. Поэтому здесь будут описаны главным образом пиридин и его многочисленные производные. Однако сначала мы рассмотрим еще некоторые простейшие нирановые соединения, так как это позволит прийти к интересным выводам о распределении валентностей в таких кольцевых системах.
Основы неорганической химии для студентов нехимических специальностей (1989) — [ c.267 ]
Общая химия в формулах, определениях, схемах (1996) — [ c.313 ]
Названия органических соединений (1980) — [ c.217 ]
Общая химия в формулах, определениях, схемах (0) — [ c.313 ]
Успехи органической химии Том 3 (1966) — [ c.53 ]
Органическая химия (1974) — [ c.958 ]
Общая химия в формулах, определениях, схемах (1985) — [ c.313 ]
Биохимия (2004) — [ c.226 ]
Общая химия в формулах, определениях, схемах (0) — [
c.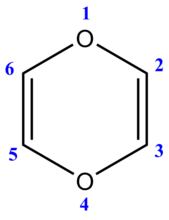
Органическая химия Том2 (2004) — [ c.475 ]
Справочник Химия изд.2 (2000) — [ c.539 , c.542 ]
Основы биохимии Т 1,2,3 (1985) — [ c.306 , c.308 ]
Органическая химия (1976) — [ c.195 ]
Курс органической химии (1967) — [ c.605 ]
Органическая химия 1965г (1965) — [ c.261 ]
Органическая химия 1969г (1969) — [ c.293 ]
Органическая химия 1973г (1973) — [ c.352 ]
Курс органической химии (1979) — [ c.340 ]
Органическая химия для студентов медицинских институтов (1963) — [
c. 221
,
c.223
]
221
,
c.223
]
Основы биологической химии (1970) — [ c.258 ]
Органическая химия Издание 3 (1977) — [ c.212 , c.533 , c.589 ]
Основы органической химии 2 Издание 2 (1978) — [ c.425 , c.426 ]
Курс органической химии (1970) — [ c.224 ]
ЭПР Свободных радикалов в радиационной химии (1972) — [ c.252 ]
Органическая химия (1972) — [ c.371 , c.406 ]
Основные начала органической химии Том 2 1957 (1957) — [
c.512
,
c. 517
,
c.575
,
c.589
]
517
,
c.575
,
c.589
]
Основные начала органической химии Том 2 1958 (1958) — [ c.512 , c.517 , c.575 , c.589 ]
Органическая химия Издание 3 (1963) — [ c.280 ]
Органическая химия (1956) — [ c.275 ]
Химия органических лекарственных препаратов (1949) — [ c.512 ]
Химия и технология ароматических соединений в задачах и упражнениях (1971) — [ c.24 ]
Органическая химия (1972) — [ c.371 , c.406 ]
Органическая химия Издание 2 (1976) — [
c.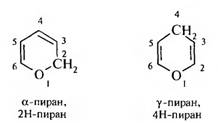 403
]
403
]
Органическая химия Издание 3 (1980) — [ c.343 , c.366 ]
Курс органической и биологической химии (1952) — [ c.265 , c.281 , c.285 ]
Органическая химия (1964) — [ c.518 ]
Химия органических лекарственных веществ (1953) — [ c.19 ]
Основы органической химии Ч 2 (1968) — [ c.331 , c.332 ]
Курс органической химии _1966 (1966) — [ c.496 ]
Биохимия Издание 2 (1962) — [ c.60 ]
Химия Справочник (2000) — [
c. 417
]
417
]
Пиран, производные – Справочник химика 21
Пиран и его производные. В данном разделе рассмотрены отдельные представители шестичленных кислородсодержащих гетероциклов, дигидропиран, а- и у-пираны, а- и 7-пироны. [c.558]Пираны и тетрагидропиран. Важнейшими шестичленными гетероциклами с одним атомом кислорода и двумя двойными связями являются а-пиран и у-пиран. Как свободные вещества эти гетероциклы не получены и известны лишь их многочисленные производные. Тетрагидропроизводное называется тетрагидропираном. Оно получено в свободном виде содержит на четыре атома водорода больше, чем пираны, и не имеет двойных связей [c.427]
ПИ РАНЫ. а-Пиран (ф-ла I) известен только в виде производных. у Пиран (ф-ла II жидк., (кип 84 °С) быстро разлагается при комнатной температуре. П.— структурные фрагменты молекул мн.
 прир. соединений. [c.440]
прир. соединений. [c.440]Каталитическое превращение тетрагидрофурилового спирта в дигидро-пиран, впервые отмеченное Полем [151], происходит при пропусканий паров спирта над окисью алюминия при температурах выше 300 . Эта реакция делает доступными самые разнообразные производные дигидропирана (стр. 272). Течение реакции дегидратации может быть представлено как нормальная перегруппировка не выделенного первичного продукта дегидратации по Вагнеру—Меервейну . [c.130]
Правила валентности не допускают существования полных кислородных аналогов пиридина. Родоначальным максимально ненасыщенным соединением (т. е. с двумя двойными связями) является пиран. Следует указывать положение экстра -водородных атомов, чтобы различать два возможных изомера, т. е. 2Н-пиран (а-пиран, 51) и 4Н-пиран ( -пиран, 52). Возможно существование двух дигидропиранов А – (53) и ДЗ-дигидропирана (54) Д (дельта) обозначает положение сохраняющейся двойной связи. Полностью гидрированное производное — тетрагидропиран. [c.28]
[c.28]
Этот ион, как и его предшественник, может реагировать различным образом. Он может присоединить еще одну молекулу формальдегида с образованием диоксанового производного, которое будет находиться в равновесии с триолом (не представленным на схеме). За счет потери протона он образует непредельный диол, который при отщеплении молекулы воды образует внутренний эфир — пиран (IV) [c.47]
Изучены дгасс-спектры 4-алкенил-1,3-диоксанов, 5,6-дигидро-(2Н)-пиранов, производных тетрагидропирана и непредельных спиртов. Установлены признаки, позволяющие идентифицировать подобные соединения. [c.133]
Кроме ]- н а-пиронов, рассмотренных в предыдущей главе, производными гетероциклических систем и а-пиранов являются также [c.687]
Из, них пиран и тиопиран известны до сих пор лишь в виде производных. Важнейшие из этих производных — пироны, ксантоны и пирилиевые красители (антоцианы) — уже были рассмотрены в предыдущих разделах вследствие их тесной связи с чисто ароматическими соединениями.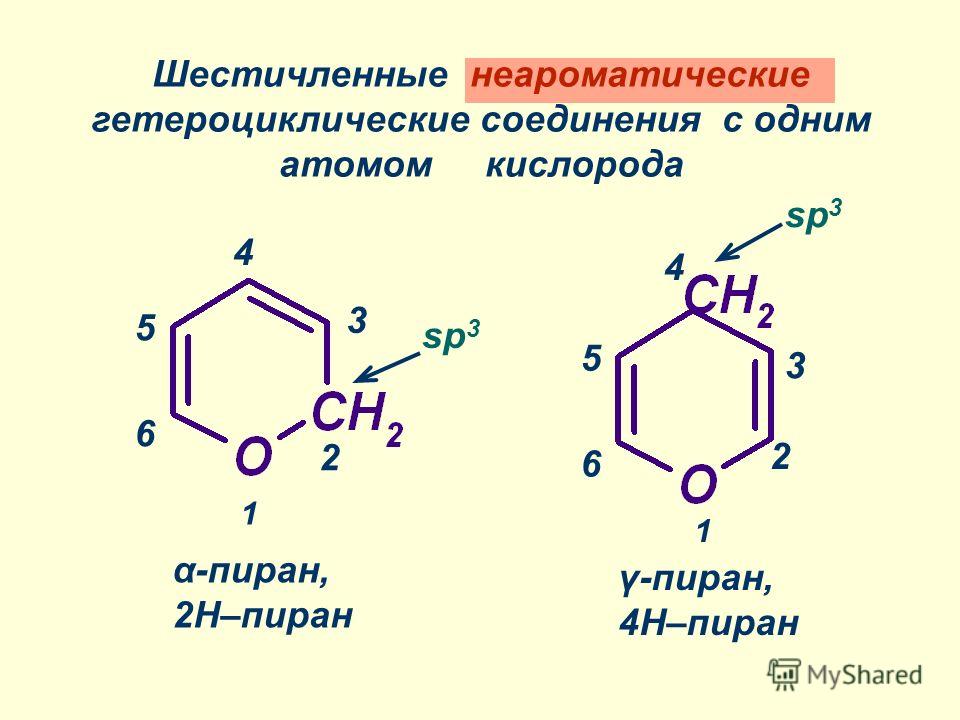 Поэтому здесь будут описаны главным образом пиридин и его многочисленные производные. Однако сначала мы рассмотрим еще некоторые простейшие нирановые соединения, так как это позволит прийти к интересным выводам о распределении валентностей в таких кольцевых системах. [c.1013]
Поэтому здесь будут описаны главным образом пиридин и его многочисленные производные. Однако сначала мы рассмотрим еще некоторые простейшие нирановые соединения, так как это позволит прийти к интересным выводам о распределении валентностей в таких кольцевых системах. [c.1013]
Из шестичленных гетероциклов с одним атомом кислорода наиболее важными являются производные -пирана (1,4-пира-на). Сам 7-пиран до сих пор не получен. Его тетра гидропроизводное представляет собой внутренний эфир пентандиола-1,5, из которого он может быть получен нагреванием с 60%-ной серной кислотой [c.605]
По разработанной нами схеме 2-метил-5-н-бутилпиридин был синтезирован из метилвинилкетона и гексен-1-илэтилово-го эфира. Полученный из этих соединений конденсацией Дильса—Альдера 2-этокси-3-н-бутил-6-метил-3,4-дигидро-1,2-пиран омылялся в соответствующее 1,5-дикарбонильное производное, которое, без выделения из реакционной массы, вводилось в конденсацию с гидроксиламином с образованием [c.
 55]
55]Производные пирона-2, пиридина и индол в синтезе аннелированных пиранов [c.550]
Некоторые производные пиранов, в том числе и конденсированные 2-амино- [c.557]
Соединения, относящиеся к ряду дигидропиранов и их производных, обладают широким спектром полезных свойств. Несмотря на определенные успехи химии пиранов, этот класс соединений остается недостаточно изз енным. Целью данной работы является разработка новых методов синтеза пиранилариламинов. [c.42]
Предполагается, что в качестве промежуточных продуктов могут выступать производные 2-амино-4Н-пиранов [997]. [c.97]
Производные 2-амино-4Н-пиранов [1018, ИЗО], 3-циаио-2Н-пира-нонов [11311 и 3-циано-2Н-пирантионов [П32] в присутствии ацетата [c.118]
Диамино4-фенил-5-цианопиразоло [3,4-Ь] пиран [536]. Следовательно, промежуточный аддукт Михаэля циклизуется за счет атома кислорода, а не азота аминогруппы. В указанную реакцию вступают и другие гетероциклы, содержащие по соседству с карбонилом активную метиленовую группу, например производные пирана [535], пиримидиндиона [535, 537]. [c.86]
В указанную реакцию вступают и другие гетероциклы, содержащие по соседству с карбонилом активную метиленовую группу, например производные пирана [535], пиримидиндиона [535, 537]. [c.86]
Простые методы получения производных 2-амиио-3-циан-4Н-пиранов / Ю.Т.Лб-рамсяко, Н.А.Борщев, Н.Б.Всеволожская и др. – В кн. Новые химические средства защиты растений. М. НИИТЭХИМ, 1979, с. 7-11. [c.167]
Заслуживают также упоминания два важных типа производных во-первых, дигидропроизводные — 2Я-пиран (9) и 4Я-пиран (10) соединения этого типа часто являются интермедиатами в реакциях пирилиевых соединений во-вторых, соответствующие карбонильные производные — а-пирон (11) и Y-пирон (12) (иногда называемые пиранонами). [c.16]
Трифтор-4-этокси-3-бутен-2-он и 3-трифторацетил-3,4-дигидро-2Н-пиран реагируют с фенилгидразином в этиловом спирте с образованием соответствующих трифторметильных производных пиразина [178а]. Строение [c.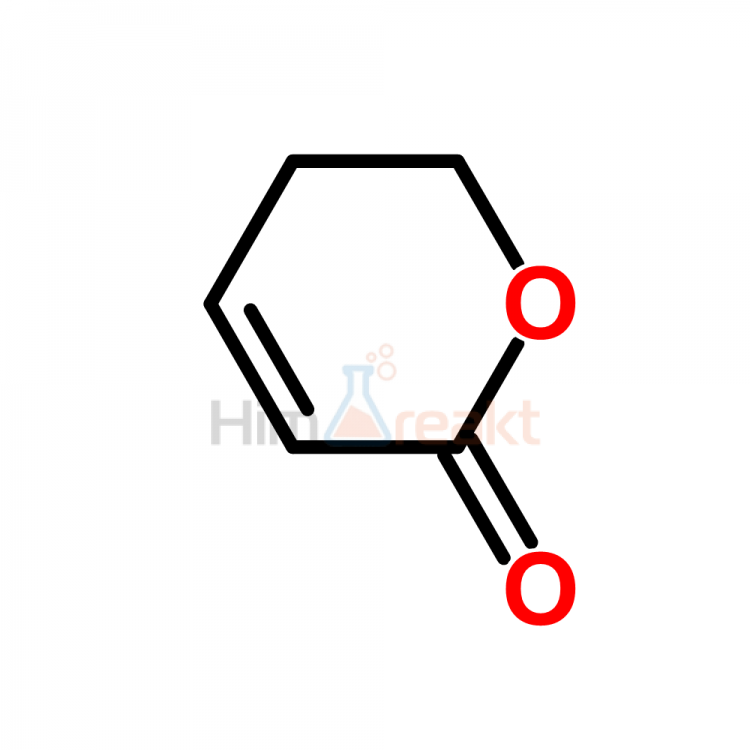 243]
243]
В этой главе рассматриваются моноциклические пираны, пироны, пи-рилиевые соли и их частично или полностью гидрированные производные. Основным соединением рассматриваемого класса является пиран, содержащий дважды ненасыщенный шестичленный цикл с атомом кислорода в качестве гетероатома. Две двойные связи могут быть сопряженными, как в а- или 1,2-пиране, или изолированными, как в – – или 1,4-пиране [c.269]
Тетрагидро-4-метил-3-(Ы-метилкарбамоилоксимино)пиран предложен в качестве инсектицида [127]. Инсектицидным действием обладают некоторые производные хромена (31) [128], другие производные хромена предложены в качестве средств борьбы с обрастанием морских судов [129]. [c.509]
Шестичленные гетероциклы с атомом кислорода — а-пиран и у-пиран — не относятся к ароматическим соединениям, так как в каждом из них имеется атом углерода в состоянии л/ -гибридизации и поэтому отсутствует единая сопряженная система р-электронов двойных связей и атома кислорода. Эти соединения представляют собой ненасыщенные циклические эфиры, обладающие высокой реакционной способностью, вследствие чего они неустойчивы, а а-пиран вообще в свободном виде неизвестен. Стабильными являются производные пиранов, в частноеги тетрагидропиран и его гидрокси-производные, относящиеся к классу моносахаридов (см. 15.1). [c.370]
Эти соединения представляют собой ненасыщенные циклические эфиры, обладающие высокой реакционной способностью, вследствие чего они неустойчивы, а а-пиран вообще в свободном виде неизвестен. Стабильными являются производные пиранов, в частноеги тетрагидропиран и его гидрокси-производные, относящиеся к классу моносахаридов (см. 15.1). [c.370]
ПИРАНЫ. а-Пиран (ф-ла I) известен только в виде производных. -у-Пиран (ф-ла II жидк., (кяя 84 °С) быстрораэ-лагается при комнатной температуре. П.— структурные фрагменты мо- J лекул мн. прир. соединений. [c.440]
Изонитрилы в мультикомпонентных реакциях с оксокарбениевыми и иминиевыми ионами
Настоящий проект относится к одному из наиболее актуальных направлений синтетической и фармацевтической химии – созданию эффективных методов синтеза биологически активных гетероциклических соединений посредством домино-реакций. Домино-процессы – удобные инструменты для создания молекулярного разнообразия.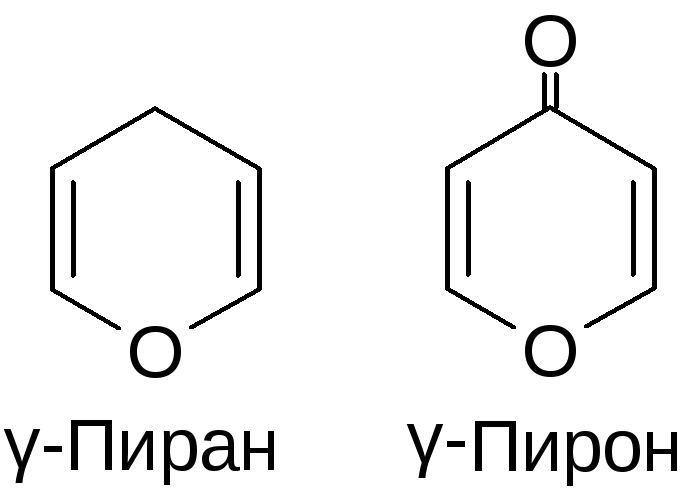 Они экологичны, просты в оформлении и обладают высоким синтетическим потенциалом.
Они экологичны, просты в оформлении и обладают высоким синтетическим потенциалом.
Домино-реакции нашли широкое применение как в синтезе библиотек соединений для проведения биоскрининга, так и в полном синтезе биологически активных алкалоидов.
Первое направление исследования – взаимодействие ацеталей с изонитрилами и азидами, приводящая к производным тетразола. Исследование сфокусировано на реакциях ацеталей неустойчивых и полифункциональных альдегидов, а также циклических ацеталях, таких как производные 2-метокситетрагидропирана. В последнем случае получающиеся производные тетразола можно рассматривать как устойчивые к гидролизу аналоги нуклеозидов – потенциальные противовирусные и противоопухолевые препараты.
Второе направление исследований – изучение реакций трансформации активированных ацетиленов с тетразолами, полученными в реакции иминиевых солей дигидроизохинолина с изонитрилами и азидами. Исследование сконцентрировано на изучении влияния изонитрильного фрагмента на направление трансформации изохинолинового цикла. Поскольку замещенные или аннелированные гетероциклами тетразолы проявляют широкий спектр биологической активности, включающей болеутоляющее, противовоспалительное, противораковое действие, их направленный синтез и дальнейшая функционализация является актуальной задачей.
Поскольку замещенные или аннелированные гетероциклами тетразолы проявляют широкий спектр биологической активности, включающей болеутоляющее, противовоспалительное, противораковое действие, их направленный синтез и дальнейшая функционализация является актуальной задачей.
Третье направление исследования – трехкомпонентные реакции с участием винилогов иминиевых ионов – солей 3-метилениндолениния (3H-индолия). Ранее подобного типа субстраты не были изучены в реакциях с изонитрилами. При использовании солей, содержащих арилиденовый заместитель, изонитрилов и триметилсилилазида метод позволяет получать триарилметаны. Среди этого класса соединений найдены вещества, обладающие противоопухолевой активностью, в частности, летрозол и ворозол.
Задачи проекта
В процессе выполнения проекта будут решаться как фундаментальные задачи химии – исследование механизмов новых реакций, их регио- и стереоселективности, так и прикладные – создание удобных препаративных методов синтеза гетероциклических соединений и проведение биоскрининга наиболее перспективных структур.
Поддержка проекта
РНФ – Российский научный фонд.
Пиран – обзор | ScienceDirect Topics
2.22.8.1.2 Пиран-4-он и хромон
Ранняя работа по ароматичности пиран-4-она была рассмотрена 〈68T923〉.
Пиран-4-оновое кольцо ( 18 ) подвергается замещению в С-3 обычными электрофильными реагентами (см. Раздел 2.23.8.3). Расщепление кольца происходит в присутствии основания. Однако пиран-4-он лишен обычных кетоновых свойств. Реакция Дильса-Альдера пропагандируется как средство оценки ароматичности пиран-4-онов и родственных соединений 〈75JHC785〉.Если пиран-4-он обладает локализованной структурой ( 18 ), то он должен проявлять диенофильные свойства, подобные свойствам 1,4-бензохинона. Реакция 2,3-диметилбута-1,3-диена с пиран-4-оном не привела к образованию аддукта ( 209 ). 4 H -тиопиран-4-он ( 210 ) также был инертен, хотя сульфон ( 211 ) легко вступал в реакцию.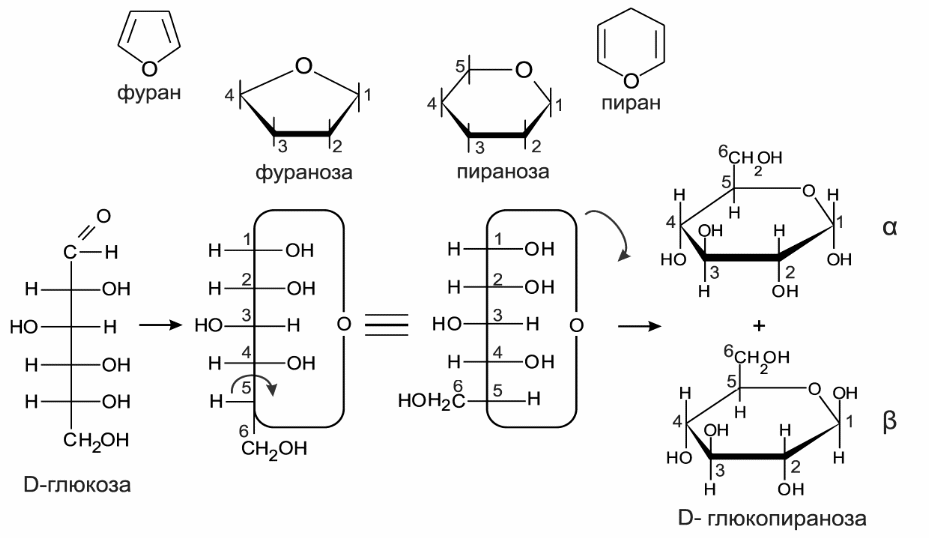 Из этих наблюдений был сделан вывод, что как ( 18 ), так и ( 210 ) имеют существенную делокализацию π-электронов, соответствующую структуре бетаина ( 212 ).Сульфон ( 211 ) ведет себя как диенофил, поскольку нет возможности участия гетероатома в создании ароматической 6π-электронной системы.
Из этих наблюдений был сделан вывод, что как ( 18 ), так и ( 210 ) имеют существенную делокализацию π-электронов, соответствующую структуре бетаина ( 212 ).Сульфон ( 211 ) ведет себя как диенофил, поскольку нет возможности участия гетероатома в создании ароматической 6π-электронной системы.
id209.
Основность пиран-4-она, которая значительно выше, чем у простых ароматических и алифатических кетонов, очевидна из его p K a , равного 0,1, и была рационализирована с точки зрения бетаиновой структуры ( 212 ; X = O). Бензо-плавление увеличивает основность: p K a хромона ( 20 ) равно 2.0 〈65ZOB1707〉. В силу своей основности и пиран-4-он, и хромон имеют большую склонность к образованию солей с кислотами 〈63CJC505〉.
Данные о теплотах сгорания простых пиран-4-онов отсутствуют, поэтому значения ERE недоступны.
Энергия делокализации МО (DE), рассчитанная с использованием простого подхода LCAO, показала, что пиран-4-он (DE, 2,868β) обладает большей ароматичностью, чем бензол (DE 2β) 〈62CCC1242〉. Последующие более точные расчеты дали значительно более низкие значения, но все же указывали на значительную ароматичность пиран-4-она.Значения DE, DE sp и индексов ароматичности пиран-4-она и хромона, полученные различными методами МО, представлены в табл. 9.
Последующие более точные расчеты дали значительно более низкие значения, но все же указывали на значительную ароматичность пиран-4-она.Значения DE, DE sp и индексов ароматичности пиран-4-она и хромона, полученные различными методами МО, представлены в табл. 9.
Расчетные плотности π-электронов и орбитальные энергии, полученные для хромона с использованием полуэмпирическим методом ППП, было показано, что они хорошо коррелируют с химическими сдвигами 1 H ЯМР и полярографическими полуволновыми потенциалами 〈78IJC(A)531〉.
УФ-спектры пиран-4-онов ничем не примечательны и напоминают спектры циклических енонов и хинонов.
Исследования с использованием ИК-спектроскопии были предприняты в попытках оценить порядок связи карбонильной группы и, следовательно, степень сопряжения π-электронов в кольцевой системе пиран-4-она 〈73MI22203〉. Частота валентных колебаний карбонила в самом пиран-4-оне находится в диапазоне 1661–1678 см -1 〈62BCJ1323, 59CJC2007〉. Бензосинтез снижает частоту и хромон поглощает в области 1650–1665 см −1 〈63PMH(2)254, 63PMH(2)257〉 ( ср. ок. 1730 см −1 для пирана-2 -единицы).На первый взгляд может показаться, что карбонильная группа имеет значительный характер одинарной связи, что согласуется со структурой бетаина ( 212 ; X = O). Однако сравнение с циклогексадиенонами, которые потенциально не являются ароматическими, показывает, что v (CO) в этих системах составляет около 1650 см -1 . Следовательно, кажется излишним ссылаться на бетаиновую структуру для объяснения низкой частоты карбонильных групп. Более того, в гидрохлориде ( 213 ) протонированная карбонильная группа по-прежнему имеет значительный характер двойной связи.Поглощение CO составляет 1500 см -1 , в то время как против (CO) в фенолах намного ниже и обычно происходит при 1140–1230 см -1 . Расчетами МО установлено, что, как и пиран-2-он, пиран-4-он и хромон имеют высокие порядки π-связи карбонильной группы.
Бензосинтез снижает частоту и хромон поглощает в области 1650–1665 см −1 〈63PMH(2)254, 63PMH(2)257〉 ( ср. ок. 1730 см −1 для пирана-2 -единицы).На первый взгляд может показаться, что карбонильная группа имеет значительный характер одинарной связи, что согласуется со структурой бетаина ( 212 ; X = O). Однако сравнение с циклогексадиенонами, которые потенциально не являются ароматическими, показывает, что v (CO) в этих системах составляет около 1650 см -1 . Следовательно, кажется излишним ссылаться на бетаиновую структуру для объяснения низкой частоты карбонильных групп. Более того, в гидрохлориде ( 213 ) протонированная карбонильная группа по-прежнему имеет значительный характер двойной связи.Поглощение CO составляет 1500 см -1 , в то время как против (CO) в фенолах намного ниже и обычно происходит при 1140–1230 см -1 . Расчетами МО установлено, что, как и пиран-2-он, пиран-4-он и хромон имеют высокие порядки π-связи карбонильной группы. Наблюдались удовлетворительные корреляции между расчетными и экспериментальными частотами карбонильных групп 〈74BSF545〉.
Наблюдались удовлетворительные корреляции между расчетными и экспериментальными частотами карбонильных групп 〈74BSF545〉.
Расчетные порядки связей EHT MO и частоты ИК-карбонилов для пиран-4-она и хромона приведены в таблице 10.
Если пиран-4-он представляет собой ароматическую систему с 6π-электронами, она должна иметь бетаиновую структуру ( 212 ; X = O), которая будет демонстрировать большой дипольный момент. Наблюдаемый момент для ( 18 ) равен 3,7 D. Дипольный момент 1,9 D получается путем векторного суммирования моментов связей и групп. Ясно, что если бы мезомерные эффекты отсутствовали, разница между расчетным и наблюдаемым моментами была бы очень мала. Величина наблюдаемого дипольного момента свидетельствует о значительной делокализации π-электронов в пиран-4-оне.Однако рассчитанное значение для структуры бетаина ( 212 ; X = O) равно 21 D 〈73MI22203〉, и, таким образом, оказывается, что степень делокализации, в конце концов, довольно мала.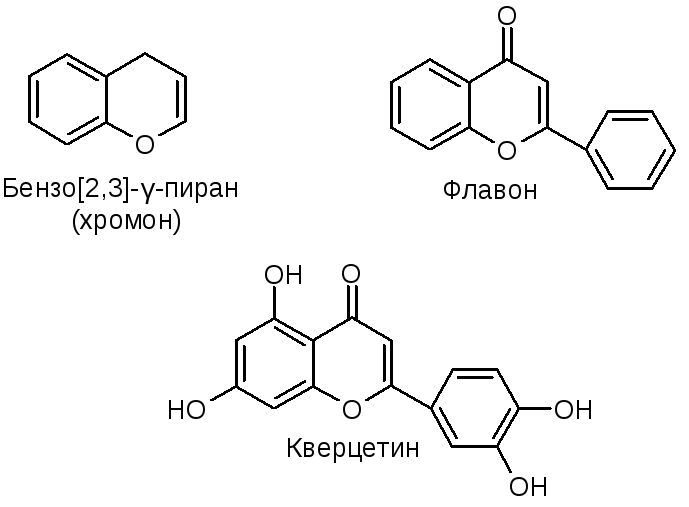
В целом применение дипольных моментов для получения информации об ароматичности сопряжено с трудностями 〈B-75MI22206〉.
Химические сдвиги протонов и константы связи для некоторых пиран-4-онов представлены на рисунках 1 и 4. Химические сдвиги, наблюдаемые для пиран-4-онов, предполагают наличие диамагнитного кольцевого тока.Для оценки величины кольцевого тока в 2,6-диметилпиран-4-оне ( 214 ) по сравнению с бензолом были использованы химические сдвиги 1 Н. Дигидросоединение ( 215 ) использовали в качестве модели для оценки диамагнитного анизотропного эффекта кольцевого тока в ( 214 ). Был сделан вывод, что пиранон ( 214 ) и бензол имеют сравнимые кольцевые токи 〈68T923〉. Однако, поскольку величина константы взаимодействия J 2,3 практически одинакова в пиран-4-оне и дигидросоединении ( 215 ) (см. рис. 1), может показаться, что ( 214 ) не имеет ярко выраженной ароматности.
Дополнительным доказательством наличия кольцевого тока в пиран-4-оне является наблюдение, что кольцевые протоны деэкранируются при 1 м.д. по сравнению с таковыми в 2,3-дигидропиран-4-оне.
Замена гетероатома кислорода на серу индуцирует сдвиг кольцевых протонов в слабое поле, что свидетельствует об увеличении кольцевых токов и большей ароматичности соединений серы (рис. 13) 〈65JPC1〉.
Рис. 13. Средние химические сдвиги для некоторых пиран-4-онов и тионов и родственных соединений 〈65JPC1〉
Спектры ЯМР 13 С напоминают как α,β-ненасыщенные кетоны, так и, в меньшей степени, гетероароматические системы.Данные представлены на рис. 6. Химические сдвиги пиран-4-она следуют той же схеме, что и у пиран-2-она, хотя карбонильный углерод (С-4) находится в гораздо более низком поле. Константы сочетания одинарной связи 13 CH для пиран-4-она и фурана сравнимы и приведены в таблице 11. Из исследования ЯМР 13 C койевой кислоты ( 81 ) был сделан вывод, что пиран-4 -один обладает некоторой степенью ароматичности 〈76JOC2777〉.
Анизотропия магнитной восприимчивости пиран-4-она была определена с помощью микроволнового молекулярного эффекта Зеемана.Данные для 2- и 4-пиранона приведены в таблице 12. Поскольку пиран-4-он проявляет незначительный нелокальный эффект, было высказано предположение, что эту молекулу лучше всего рассматривать как неароматическую 〈73JA2766〉.
Точные и полные структуры пиран-4-она и некоторых аналогов были определены с помощью микроволновой спектроскопии 〈81JCS(F2)79〉 и представлены на рисунке 11. Сравнение этих молекулярных размеров с соответствующими данными для неароматических соединений, таких как как циклопентадиен или акролеин подтверждает вывод, сделанный в более ранних исследованиях Зеемана 〈73JA2766〉, что пиран-4-оновое кольцо в значительной степени неароматическое.Однако есть свидетельства небольшой степени делокализации. Связь оказывается более делокализованной в пиран-4-тионе ввиду укорочения связи С(3)С(4) и увеличения длины связи С(2)С(3). Следовательно, тион более ароматичен, чем сам пиран-4-он.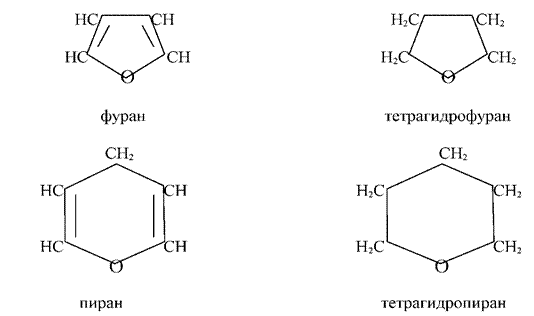
Пиран – обзор | ScienceDirect Topics
5.07.3.4.1.(ii) Пираноны, их бензологи и восстановленные производные
Спектр пиран-2-она состоит из двух комплексных мультиплетов с центром в положении 6.4 м.д. (H(3) и H(5)) и 7,6 м.д. (H(4) и H(6)). Заместители мало влияют на константы взаимодействия протонов пиранонового кольца, поэтому 1 H ЯМР может быть полезен для установления положения заместителей 〈69JHC1, 69JOC2239〉. На рис. 9 приведены параметры спектра пиран-2-она, также доступны данные по замещенным производным 〈68JHC275〉.
Рис. 9. Спектры ЯМР Н 1 типичных пиранонов и солей пирилия 〈64AJC1305, 64SA871, 65SA1277, 69JHC1, 73OMR(5)251, 75JA5472, 81JHC1325, 85SA(A)913〈
В 5,6-дизамещенных производных 5,6-дигидропиран-2-она между H(4) и H(6) наблюдается дальнодействующая связь около 2 Гц, что указывает на диаксиальную конфигурацию транс- 5- и 6-заместители, что обеспечивает почти плоское расположение H(4), C(4), C(5), C(6) и H(6) 〈69JHC1〉.
Большая часть работ по ЯМР 1 H пиран-4-онов была связана с ароматической природой системы, и несколько сообщений об ароматической природе основаны на сдвигах в слабое поле по сравнению со сдвигами для неароматических дигидроаналогов 〈 68Т923〉.Данные протонного ЯМР для пиран-4-она приведены на фиг.9; спектр состоит из двух мультиплетов, при этом сигнал сильного поля связан с Н(3) и Н(5). Всем связям в пиран-4-оне присвоены 〈64SA871, 67SA(A)55〉. Спектральные данные для замещенных пиран-4-онов можно найти в 〈84CHEC-I(3)573〉.
Химические сдвиги H(3) и H(4) в кумарине аналогичны сдвигам в пиран-2-оне (рис. 9). Сигнал для H(3) обычно находится в более сильном поле, чем для H(4), так что возможно различие между 3- и 4-замещенными производными.Связь между алкеновыми протонами J 3,4 составляет 9,8 Гц, и эта пара дублетов является характерной особенностью спектров ЯМР 1 Н кумаринов. Рассчитанные плотности электронов для ароматического кольца хорошо коррелируют с наблюдаемыми химическими сдвигами, при этом H (5) и H (7) происходят в более слабом поле по сравнению с H (6) и H (8). В дополнение к ожидаемым константам взаимодействия ароматических протонов, между H(4) и H(8) наблюдаются дальнодействующие взаимодействия ( Дж ок. 0,6 Гц) 〈67JCS(C)2000〉, а другие межкольцевые взаимодействия имеют был идентифицирован 〈68AJC2445〉.Замещение в ароматическом кольце оказывает небольшое влияние на сигналы Н(3) и Н(4). Замещение в C (5) снимает экранирование H (4), но заместители, высвобождающие электроны, в C (5) и C (7) сдвигают сигнал от H (3) в сильное поле. На заместители в положениях 3 и 4 также влияет замещение в ароматическом кольце 〈72MI 507-01, 78T1221〉. Правила были разработаны, чтобы помочь в выяснении структуры кумаринов 〈72MI 507-02〉, а дополнительная информация получена из сдвигов, вызванных растворителем 〈66T3301, 88JIC630〉.Реагенты сдвига лантанидов также оказались полезными для выяснения моделей замещения в кумаринах 〈78JCS(P2)391〉. Имеются данные протонного ЯМР
В дополнение к ожидаемым константам взаимодействия ароматических протонов, между H(4) и H(8) наблюдаются дальнодействующие взаимодействия ( Дж ок. 0,6 Гц) 〈67JCS(C)2000〉, а другие межкольцевые взаимодействия имеют был идентифицирован 〈68AJC2445〉.Замещение в ароматическом кольце оказывает небольшое влияние на сигналы Н(3) и Н(4). Замещение в C (5) снимает экранирование H (4), но заместители, высвобождающие электроны, в C (5) и C (7) сдвигают сигнал от H (3) в сильное поле. На заместители в положениях 3 и 4 также влияет замещение в ароматическом кольце 〈72MI 507-01, 78T1221〉. Правила были разработаны, чтобы помочь в выяснении структуры кумаринов 〈72MI 507-02〉, а дополнительная информация получена из сдвигов, вызванных растворителем 〈66T3301, 88JIC630〉.Реагенты сдвига лантанидов также оказались полезными для выяснения моделей замещения в кумаринах 〈78JCS(P2)391〉. Имеются данные протонного ЯМР
для 4-аминокумаринов 〈94JHC1353〉, пиранокумаринов с различной аннелизацией 〈87MRC740, 91MRC631〉 и для -один 〈93JCS(P1)1019〉.
В изокумаринах H-3 резонирует в более слабом поле, чем H(4), и на оба сигнала влияет замена в 3-й и 4-й позициях (рис. 9) 〈67BSF2224, 85SA(A)913〉.
Были исследованы относительные конфигурации и конформационные аспекты некоторых 3,4-дизамещенных 3,4-дигидрокумаринов. В случае цис – и транс -4-алкил-3-фенилпроизводных ( 77 ) и ( 78 ) фенильный заместитель расположен аксиально в обоих изомерах (75МИ 507-01). Для 3-замещенных сложных эфиров 2-оксо-4-хромуксусной кислоты соединение транс- существует в виде диаксиального конформера полукресла ( 79 ), но конформация цис-изомера неизвестна 〈85MI 507- 01〉.
Соединение кольца в циклоаддуктах, полученных из 6-метилпиран-2-она и кумарина с 2-(триалкилсилил)оксидиенами, установлено как цис , где J = 4,4–4,8 Гц. Транс-изомер , полученный протонолизом триметилсилиленолового эфира цис -аддукта, имеет Дж ≃ 14 Гц. Подробные спектральные данные представлены для нескольких частично восстановленных дибензо[ b , d ]пиран-6-онов ( 80 ) и 6,9-дионов ( 81 ) 〈91JOC5052〉 и некоторых 2,3- слитые хроман-4-оны 〈91JOC2058〉.
Подробные спектральные данные представлены для нескольких частично восстановленных дибензо[ b , d ]пиран-6-онов ( 80 ) и 6,9-дионов ( 81 ) 〈91JOC5052〉 и некоторых 2,3- слитые хроман-4-оны 〈91JOC2058〉.
Химические сдвиги протонов гетероциклического кольца хромона (рис. 9) очень похожи на сдвиги кумарина и пиран-4-она. На них в значительной степени не влияет бензаннелирование, что подразумевает небольшую ароматичность в гетерокольце или ее отсутствие. Однако близость карбонильной группы к конденсированному ароматическому кольцу приводит к сдвигу в слабое поле всех ароматических протонов по сравнению с таковыми в кумарине. Этот эффект максимален для C(5) и достаточно силен, чтобы отделить сигнал H(5) от сигналов других ароматических протонов.Детальное изучение спектра ЯМР 1 Н хромона показало, что химические сдвиги хорошо согласуются с предсказанными расчетами электронной плотности 〈64SA871〉. Расположение заместителей в хромоне часто можно определить по спектрам ЯМР, и этот метод использовался для выяснения структур встречающихся в природе хромонов 〈92TL5977, 93JCS(P1)1153, 93TL419, 94TL4693〉. Имеются данные для 2-метил-2-хромен-4-тиона 〈83PS(14)139〉. Производные хромона, для которых доступны данные ЯМР 1 Н, включают 2-стирилхромоны 〈95JCR(S)58〉 и их различные аддукты Дильса-Альдера 〈92JCR(S)248〉, некоторые гетеродиеновые аддукты 3-ацилхромонов 〈94T11755 〉 и метаболиты плесени 〈83JCS(P1)1365〉.
Имеются данные для 2-метил-2-хромен-4-тиона 〈83PS(14)139〉. Производные хромона, для которых доступны данные ЯМР 1 Н, включают 2-стирилхромоны 〈95JCR(S)58〉 и их различные аддукты Дильса-Альдера 〈92JCR(S)248〉, некоторые гетеродиеновые аддукты 3-ацилхромонов 〈94T11755 〉 и метаболиты плесени 〈83JCS(P1)1365〉.
Спектральные параметры 1 H ЯМР хроман-4-она приведены на рисунке 9. Метиленовые группы проявляются в виде триплетов при δ 2,8 (3-CH 2 ) и δ 4,55 (2-CH 2 ) 〈68JHC133〉. Обычно встречающаяся система 2,2-диметилхроман-4-она обладает значительно упрощенным спектром, сигналы как для гем -диметила, так и для 3-метиленовых звеньев проявляются в виде синглетов примерно при 1,6 м.д. и 2,7 м.д. соответственно. В 3-замещенных хроман-4-онах атом галогена расположен аксиально в преобладающей конформации 〈68JHC745〉, тогда как метильная группа расположена экваториально 〈73BCJ1839〉.В 3,3-дихлор-2,2-диметилхроман-4-оне сигнал гем -диметила является широким при комнатной температуре, но становится четким синглетом при 50 °C. И наоборот, при -20 °C наблюдаются два отдельных сигнала, соответствующие псевдоаксиальной и экваториальной метильным группам. По-видимому, атомы галогена заметно замедляют инверсию кольца 〈94T5245〉.
И наоборот, при -20 °C наблюдаются два отдельных сигнала, соответствующие псевдоаксиальной и экваториальной метильным группам. По-видимому, атомы галогена заметно замедляют инверсию кольца 〈94T5245〉.
Вызванные растворителем сдвиги во флаванонах значительно различаются в зависимости от растворителя и основности атомов кислорода в субстрате. Таким образом, трифторуксусная кислота вызывает сдвиги в слабое поле, а бензол сдвигает в сильное поле ацетокси-, метокси-, ароматические и гетероциклические протоны 〈94IJC17〉.Бензол-индуцированные сдвиги могут помочь дифференцировать линейные и угловатые хроменофлавоны 〈90MI 507-01〉. Методы, доступные для определения структур флаванонов, были рассмотрены в 〈B-89MI 507-01〉.
Рассмотрено применение спектроскопии ЯМР 1 H к флавоноидам и их гликозидам. Большая часть информации сведена в таблицы и представлены типичные спектры 〈B-94MI 507-01〉.
Константа связи для протонов 6a, 12a в ротиноидах ( 82 ) намного больше (около 12 Гц) для транс- -изомера, чем для цис- -B/C кольцевого конденсированного соединения (около 4 Гц ) 〈93JCS(P1)2605〉.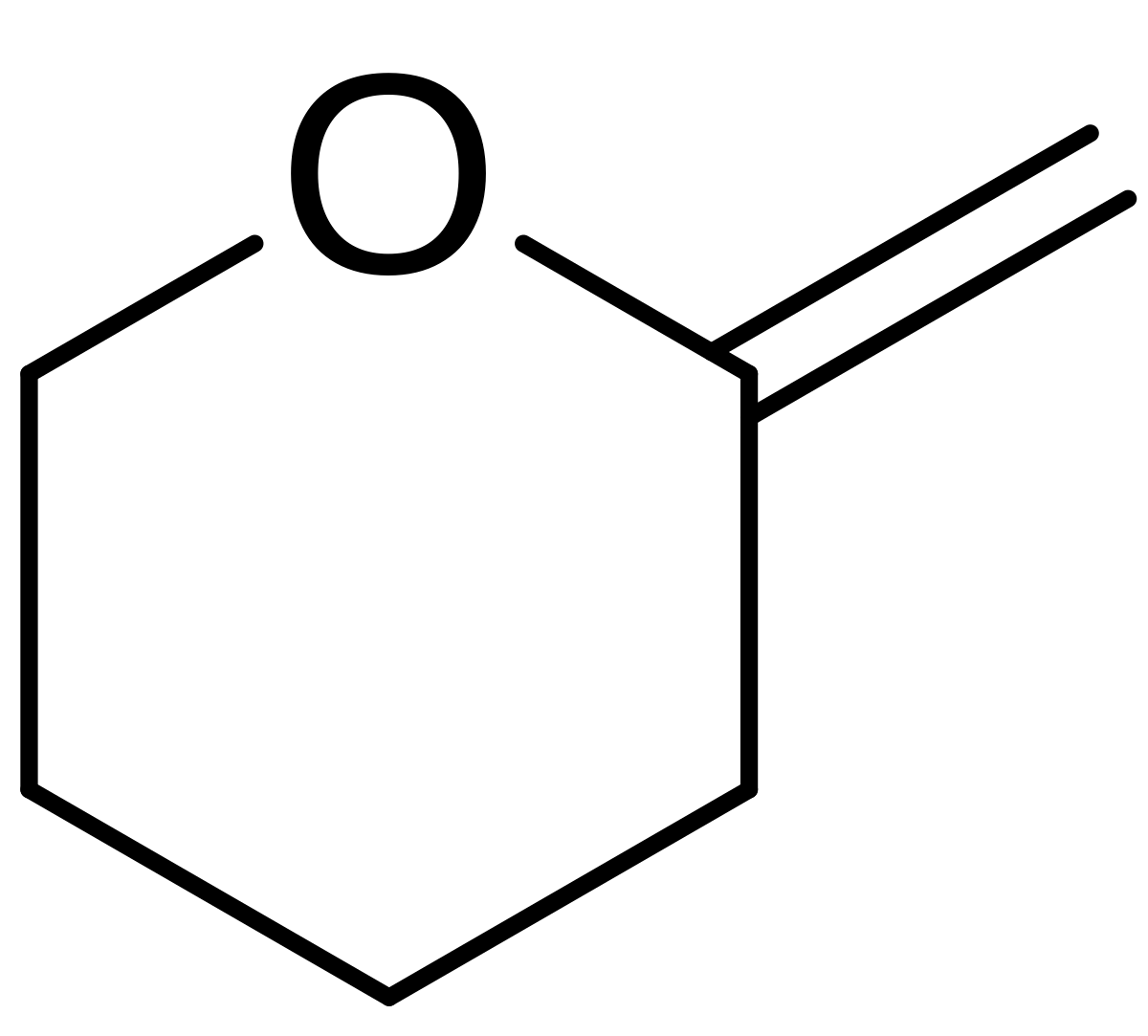 Химический сдвиг H(1) в 12a-гидроксиротиноидах является диагностическим признаком способа слияния колец; -транс--система является деэкранированной (δ от 7,6 до 8,0) по сравнению с -цис--структурой (δ от 6,4 до 6,8) 〈62JCS775〉. Были опубликованы полные отнесения резонансов 1 H и 13 C в ротеноне ( 82 ) 〈88JHC351〉.
Химический сдвиг H(1) в 12a-гидроксиротиноидах является диагностическим признаком способа слияния колец; -транс--система является деэкранированной (δ от 7,6 до 8,0) по сравнению с -цис--структурой (δ от 6,4 до 6,8) 〈62JCS775〉. Были опубликованы полные отнесения резонансов 1 H и 13 C в ротеноне ( 82 ) 〈88JHC351〉.
Хроман-3-он ( 83 ) показывает синглеты для 2-CH 2 (δ 4,32) и 4-CH 2 (δ 3,51) и, в отличие от 4-one, сигнал H(5) больше не отделен от других ароматических протонов 〈70JHC197, 81JHC1123〉.
Спектр ксантона показывает деэкранирование H(1) и H(8) карбонильной группой 〈65T1833〉. Проведен полный анализ спектров ксантона и некоторых оксигенированных аналогов 〈70JCS(B)603〉. Как сдвиги, вызванные ароматическими растворителями, так и реагенты сдвига лантанидов были полезны для выяснения структуры ксантонов 〈72JCS(P1)1382, 75JCS(P1)1563〉. Ксангидролы, включающие краун-эфиры через 1- и 8-гидроксигруппы, обнаруживают сдвиги в слабое поле всех резонансов 1 H при добавлении трифторуксусной кислоты к их раствору в CDCl 3 . Считается, что полученные растворы содержат карбокатионные частицы 〈95JCS(P2)697〉.
Считается, что полученные растворы содержат карбокатионные частицы 〈95JCS(P2)697〉.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie.Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie.
 Попробуйте другой браузер, если вы подозреваете это.
Попробуйте другой браузер, если вы подозреваете это. - Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie.Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.

- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.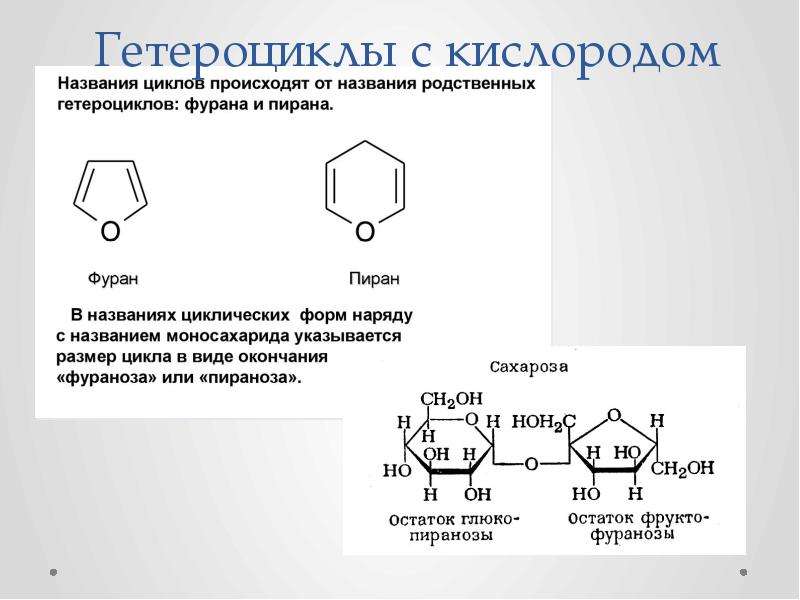 Предоставить доступ без файлов cookie
потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Предоставить доступ без файлов cookie
потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
ДИГИДРО-2H-ПИРАН | Камео Химикаты | НОАА
Химический паспорт
Химические идентификаторы
То Поля химического идентификатора включают общие идентификационные номера, алмаз NFPA Знаки опасности Министерства транспорта США и общий описание хим. Информация в CAMEO Chemicals поступает
из множества
источники данных.
Информация в CAMEO Chemicals поступает
из множества
источники данных.| Номер CAS | Номер ООН/НА | Знак опасности DOT | Береговая охрана США КРИС Код |
|---|---|---|---|
| никто | ||
| Карманный справочник NIOSH | Международная карта химической безопасности | ||
| никто | никто | ||
NFPA 704
| Алмаз | Опасность | Значение | Описание |
|---|---|---|---|
| Здоровье | 1 | Может вызывать сильное раздражение. | |
| Воспламеняемость | 3 | Может воспламеняться практически при любых температурах окружающей среды. | |
| нестабильность | 1 | Обычно стабилен, но может стать нестабильным при повышенных температурах и давлениях. | |
| Специальный |
(NFPA, 2010 г.)
Общее описание
Прозрачная бесцветная жидкость с эфирным запахом.Менее плотный, чем вода. Пары тяжелее воздуха.
Опасности
Предупреждения о реактивности
Реакции воздуха и воды
Легковоспламеняющиеся. Мало растворим в воде.
Пожароопасность
Выдержка из Руководства ERG 127 [Горючие жидкости (смешивающиеся с водой)]: ЛЕГКО ОГНЕОПАСНО: Легко воспламеняется от тепла, искр или пламени. Пары могут образовывать взрывоопасные смеси с воздухом. Пары могут перемещаться к источнику воспламенения и вспыхивать обратно.Большинство паров тяжелее воздуха. Они будут распространяться по земле и собираться в низких или ограниченных пространствах (канализация, подвалы, резервуары). Опасность взрыва паров в помещении, на открытом воздухе или в канализации. Вещества, обозначенные буквой (P), могут полимеризоваться со взрывом при нагревании или попадании в огонь. Слив в канализацию может создать опасность пожара или взрыва. Контейнеры могут взорваться при нагревании. Многие жидкости легче воды. (ЭРГ, 2016)
Пары могут образовывать взрывоопасные смеси с воздухом. Пары могут перемещаться к источнику воспламенения и вспыхивать обратно.Большинство паров тяжелее воздуха. Они будут распространяться по земле и собираться в низких или ограниченных пространствах (канализация, подвалы, резервуары). Опасность взрыва паров в помещении, на открытом воздухе или в канализации. Вещества, обозначенные буквой (P), могут полимеризоваться со взрывом при нагревании или попадании в огонь. Слив в канализацию может создать опасность пожара или взрыва. Контейнеры могут взорваться при нагревании. Многие жидкости легче воды. (ЭРГ, 2016)
Опасность для здоровья
Выдержка из Руководства ERG 127 [Горючие жидкости (смешивающиеся с водой)]:Вдыхание или контакт с материалом может вызвать раздражение или ожог кожи и глаз.При пожаре могут выделяться раздражающие, коррозионные и/или токсичные газы. Пары могут вызвать головокружение или удушье. Сток от пожаротушения может вызвать загрязнение. (ЭРГ, 2016)
Профиль реактивности
Простые эфиры, такие как 2,3-ДИГИДРОПИРАН, могут выступать в качестве оснований. Они образуют соли с сильными кислотами и комплексы присоединения с кислотами Льюиса. Примером может служить комплекс между диэтиловым эфиром и трифторидом бора. Эфиры могут бурно реагировать с сильными окислителями. В других реакциях, которые обычно включают разрыв связи углерод-кислород, простые эфиры относительно инертны.
Они образуют соли с сильными кислотами и комплексы присоединения с кислотами Льюиса. Примером может служить комплекс между диэтиловым эфиром и трифторидом бора. Эфиры могут бурно реагировать с сильными окислителями. В других реакциях, которые обычно включают разрыв связи углерод-кислород, простые эфиры относительно инертны.
Принадлежит к следующей реакционной группе (группам)
Потенциально несовместимые абсорбенты
Будьте осторожны: жидкости с этой классификацией реактивной группы были Известно, что он реагирует с абсорбент перечислено ниже. Больше информации о абсорбентах, в том числе о ситуациях, на которые следует обратить внимание…
Рекомендации по ответу
То Поля рекомендации ответа включают в себя расстояния изоляции и эвакуации, а также рекомендации по пожаротушение, пожарное реагирование, защитная одежда и первая помощь.То информация в CAMEO Chemicals поступает из различных источники данных.
Изоляция и эвакуация
Выдержка из Руководства ERG 127 [Горючие жидкости (смешивающиеся с водой)]:В качестве непосредственной меры предосторожности изолируйте место разлива или утечки не менее чем на 50 метров (150 футов) во всех направлениях.
КРУПНЫЙ РАЗЛИВ: Рассмотрите начальную эвакуацию по ветру на расстояние не менее 300 метров (1000 футов).
ПОЖАР: Если цистерна, железнодорожный вагон или автоцистерна вовлечены в пожар, ИЗОЛИРОВАТЬ на расстоянии 800 метров (1/2 мили) во всех направлениях; также рассмотрите первоначальную эвакуацию на 800 метров (1/2 мили) во всех направлениях.(ЭРГ, 2016)
Пожаротушение
Выдержка из Руководства ERG 127 [Горючие жидкости (смешивающиеся с водой)]: ПРЕДОСТЕРЕЖЕНИЕ: Все эти продукты имеют очень низкую температуру воспламенения: Использование распыления воды при тушении пожара может быть неэффективным. ОСТОРОЖНО: При возгорании, связанном с UN1170, UN1987 или UN3475, следует использовать спиртостойкую пену.
НЕБОЛЬШОЙ ПОЖАР: Сухой химикат, CO2, распыление воды или спиртоустойчивая пена.
БОЛЬШОЙ ПОЖАР: Распыление воды, туман или спиртоустойчивая пена. Не используйте прямые потоки.Переместите контейнеры из зоны пожара, если вы можете сделать это без риска.
ПОЖАР, СВЯЗАННЫЙ С БАЧКАМИ ИЛИ АВТОМОБИЛЯМИ/ТРЕЙЛЕРАМИ: Тушить огонь с максимального расстояния или использовать автоматические держатели шлангов или мониторные насадки. Охладите контейнеры заливающим количеством воды до тех пор, пока огонь не погаснет. Немедленно отозвать в случае усиления звука от вентиляционных предохранительных устройств или обесцвечивания бака. ВСЕГДА держитесь подальше от танков, охваченных огнем. При массовом возгорании используйте автоматические держатели шлангов или мониторные насадки; если это невозможно, отойдите от зоны и дайте огню гореть.(ЭРГ, 2016)
Непожарный ответ
Выдержка из Руководства ERG 127 [Горючие жидкости (смешивающиеся с водой)]: УСТРАНИТЕ все источники воспламенения (не курите, не используйте факелы, искры или пламя в непосредственной близости).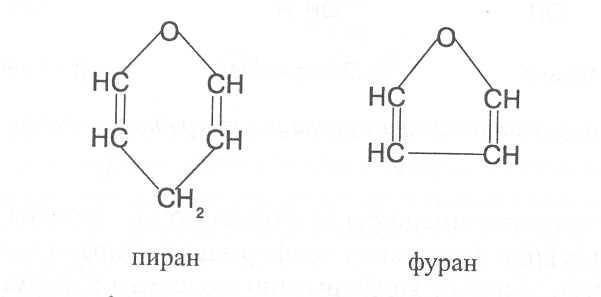 Все оборудование, используемое при работе с продуктом, должно быть заземлено. Не прикасайтесь к рассыпанному материалу и не ходите по нему. Остановите утечку, если вы можете сделать это без риска. Не допускать попадания в водные пути, канализацию, подвалы или замкнутые пространства. Для уменьшения паров можно использовать пароподавляющую пену. Впитать или засыпать сухой землей, песком или другим негорючим материалом и переложить в контейнеры.Используйте чистые, искробезопасные инструменты для сбора абсорбированного материала.
Все оборудование, используемое при работе с продуктом, должно быть заземлено. Не прикасайтесь к рассыпанному материалу и не ходите по нему. Остановите утечку, если вы можете сделать это без риска. Не допускать попадания в водные пути, канализацию, подвалы или замкнутые пространства. Для уменьшения паров можно использовать пароподавляющую пену. Впитать или засыпать сухой землей, песком или другим негорючим материалом и переложить в контейнеры.Используйте чистые, искробезопасные инструменты для сбора абсорбированного материала.
БОЛЬШОЙ РАЗЛИВ: Оборудуйте дамбу далеко впереди разлива жидкости для последующего удаления. Распыление воды может уменьшить испарение, но не может предотвратить возгорание в закрытых помещениях. (ЭРГ, 2016)
Защитная одежда
Выдержка из Руководства ERG 127 [Горючие жидкости (смешивающиеся с водой)]: Наденьте автономный дыхательный аппарат с положительным давлением (SCBA). Структурная защитная одежда пожарных обеспечивает лишь ограниченную защиту. (ЭРГ, 2016)
(ЭРГ, 2016)
Ткани для костюмов DuPont Tychem®
Нет доступной информации.
Первая помощь
Выдержка из Руководства ERG 127 [Горючие жидкости (смешивающиеся с водой)]:Убедитесь, что медицинский персонал знает о соответствующих материалах и принимает меры предосторожности для своей защиты. Вынести пострадавшего на свежий воздух. Позвоните 911 или в службу неотложной медицинской помощи. Сделайте искусственное дыхание, если пострадавший не дышит. Дайте кислород, если дыхание затруднено. Снять и изолировать загрязненную одежду и обувь. В случае контакта с веществом немедленно промойте кожу или глаза проточной водой в течение не менее 20 минут.Вымойте кожу водой с мылом. При ожогах немедленно охладите пораженные участки кожи как можно дольше холодной водой. Не снимайте одежду, если она прилипла к коже. Держите пострадавшего в покое и тепле. (ЭРГ, 2016)
Физические свойства
Точка возгорания: 0°F (НФПА, 2010 г. )
)
Нижний предел взрываемости (НПВ): данные недоступны
Верхний предел взрываемости (ВПВ): данные недоступны
Температура самовоспламенения: данные недоступны
Точка плавления: данные недоступны
Давление паров: данные недоступны
Плотность пара (относительно воздуха): данные недоступны
Удельный вес: данные недоступны
Точка кипения: данные недоступны
Молекулярная масса: данные недоступны
Растворимость в воде: данные недоступны
Потенциал ионизации: данные недоступны
ИДЛХ: данные недоступны
AEGL (рекомендуемые уровни острого воздействия)
Информация об AEGL отсутствует.ERPG (Руководство по планированию реагирования на чрезвычайные ситуации)
Информация о ERPG отсутствует.PAC (критерии защитных действий)
| Химическая | ПАК-1 | ПАК-2 | ПАК-3 |
|---|---|---|---|
| Дигидро-2H-пиран, 3,4- (110-87-2) | 3,5 частей на миллион | 38 частей на миллион | 230 частей на миллион |
(Министерство энергетики, 2016 г. )
)
Нормативная информация
То Поля нормативной информации включить информацию из У.S. Раздел III Агентства по охране окружающей среды Сводный список списки, Химический завод Министерства внутренней безопасности США антитеррористические стандарты, и Управление по охране труда и здоровья США Перечень стандартов по управлению безопасностью технологического процесса при работе с особо опасными химическими веществами (подробнее об этих источники данных).Сводный перечень списков EPA
Отсутствует нормативная информация.Антитеррористические стандарты DHS Chemical Facility (CFATS)
Отсутствует нормативная информация.Список стандартов управления безопасностью процессов (PSM) OSHA
Отсутствует нормативная информация.Альтернативные химические названия
В этом разделе представлен список альтернативных названий этого химического вещества,
включая торговые названия и синонимы.
- ДЕЛЬТА2-ДИГИДРОПИРАН
- 3,4-ДИГИДРО-2(Н)-ПИРАН
- ДИГИДРО-2H-ПИРАН
- 3,4-ДИГИДРО-2H-ПИРАН
- 3,6-ДИГИДРО-2H-ПИРАН
- 5,6-ДИГИДРО-2H-ПИРАН
- 2,3-ДИГИДРО-4H-ПИРАН
- 5,6-ДИГИДРО-4H-ПИРАН
- 2,3-ДИГИДРО-ГАММА-ПИРАН
- ДИГИДРОПИРАН
- 2,3-ДИГИДРОПИРАН
- 2H-3,4-ДИГИДРОПИРАН
- ПИРАН, ДИГИДРО-
Гетероциклы, представляющие химический и биологический интерес
K.Аджай Кумар и др. J. Chem. фарм. рез., 2015, 7(11):693-700
________________________________________________________________________________
699
Соединения (Е)-2-Амино-4-(3-нитрофенил)-8-(4-трифторметил)бензилиден)-5 ,6,7,8-тетрагидро-4H-хромен-
3-карбонитрил (10) и (E)-2-амино-6-метил-4-(нафталин-2-ил)-8-(4-( трифторметил)бензилиден)-5,6,7,8-
тетрагидро-4H-пирано[3,2-c]пиридин-3-карбонитрил (11) проявлял заметную ингибирующую активность в отношении
протестированных линий опухолевых клеток человека, таких как как рак толстой кишки человека (HCT116), рак шейки матки человека (Hela) и не-
мелкоклеточный рак легкого (h2975) [13].
10
N
O
NH3
NC
NC
CF3
CH4O
NH3
NC
CF3
NO2
11
Вывод
Вывод
В этом обзоре попытка была сделана для представления актуальной информации об источнике, синтетических стратегиях,
реакциях и фармацевтических применениях аналогов пирана. Регулярно обнаруживается или синтезируется широкий спектр природных источников и новых аналогов пирана
.Их физико-химические, физиологические, антиоксидантные, противоопухолевые бактериостатические свойства и т. д. делают их новым классом для терапевтического применения. Были критически обсуждены синтетическая процедура
и клиническое применение пиранов.
Благодарности
Авторы выражают благодарность Комиссии по университетским грантам Нью-Дели за финансовую помощь в виде гранта на крупный исследовательский проект
(F: 42-230/2013 (SR) от 25
th
марта 2013 г. ).
).
ССЫЛКИ
[1] Т. Моригучи; Х. Мацуура; Ю. Итакура; Х. Кацуки; Х. Сайто; Н. Нисияма. Life Sci., 1997, 61, 1420.
[2] Г.Х. Абу Эль-Фотоух; Усама I Абд Эль-Салам; М.М. Ашраф; А. Х. Нагла. Ind. J. Chem., 2005, 44B, 1893.
[3] D.Armesto; В.М. Хорспул; Н. Мартин; А. Рамос; К. Сеоан. Дж. Орг. Chem., 1989, 54, 3069.
[4] J.A. Вынести; И.Р. Смит; Доктор медицины Сазерленд. Ауст. J. Chem., 1976, 29(5), 1087.
[5] D. Kumar; В.Б. Редди; С. Шарад; У. Дубе; К А. Суман. Евро. Дж. Мед. Chem., 2009, 44, 3805.
[6] Yong Rok Lee; Сюэ Ван; Ликай Ся. Молекулы, 2007, 12, 1420.
[7] Х. Джунек; Х. Айгнер. хим. Ber., 1973, 106, 921.
[8] HH Otto. Арка Pharm., 1974, 307, 444.
[9] В. Колатта; Д. Катарци; Ф. Варано; Ф. Мелани; Дж. Филаккиони; Л. Чеччи; Л. Тринкавелли; К. Мартини; А. Лукаккини.
Иль Фармако.1998, 53, 189.
[10] П. М. Андрей; В.Д. Александр; О.G. Oleksandr; A.T. Andrey. Arkivoc, 2012, 8, 226.
[11] Utpal Das; Chan-Hui Huang; Wenwei Lin.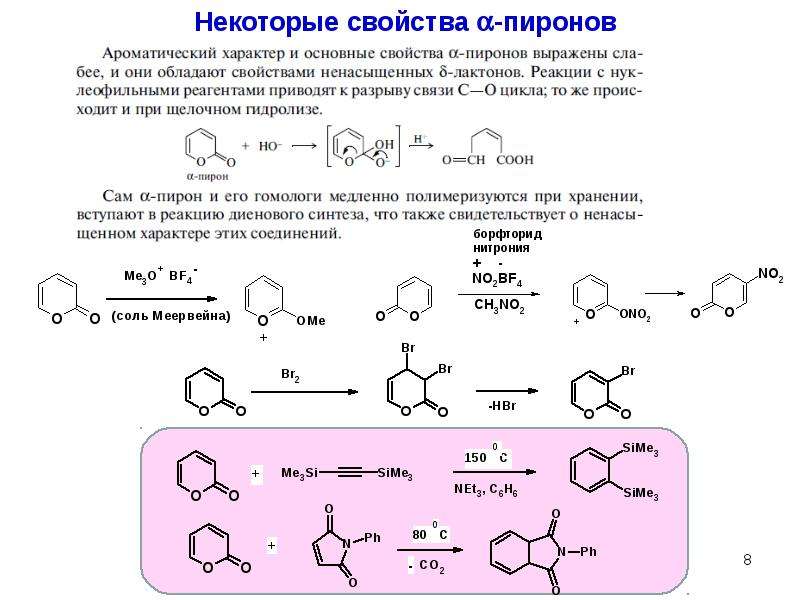 Chem. Commun., 2012, 48, 5590.
Chem. Commun., 2012, 48, 5590.
[12] T. Wang; J. Liu; H. Zhong; H. Chen; Zhiliang Lv; Y. Zhang; M. Zhang; D. Geng; C. Niu; Y. Li; Ke Li. Bioorg.
Med. Chem. Lett., 2011, 21, 3381.
[13] Dao-Cai Wanga; Yong-Mei Xie; Chen Fan; Shun Yao; Hang Song. Chin. Chem. Lett., 2014, 25, 1011.
[14] J.T. Nilesh; P.P. Manish. Arkivoc, 2009, 8, 363.
[15] R.М. Мохареб; Ф. Аль-Омран; Р.А. Аззам. Стероиды. 2014, 84, 46.
[16] Х. Кияни; Х.А. самими; Ф. Горбани; С. Эсмаэли. Кур. хим. Lett., 2013, 2, 197.
[17] Субба Редди Б.В.; Д. Н. Чая; Дж. С. Ядав; Д. Чаттерджи; AC Кунвар. Tetrahedron Lett., 2011, 52, 2961.
[18] Редди Мохан Найду Калла; Ми Ри Ким; Иль Ким. Tetrahedron Lett., 2015, 56, 717.
[19] Q. Chong; К. Ван; Д. Ван; Х. Ван; Фан Ву, С. Синь; Б. Ван. Tetrahedron Lett., 2015, 56, 401.
[20] С.Яо; Б. Цзян; Т. Ли; Б. Цинь; X. Фэн; Х. Чжан; К. Ван; С. Ту. биоорг. Мед. хим. Lett., 2011, 21, 599.
[21] P. Das; А. Дутта; А. Бхаумик; К. Мухопадхьяй. Green Chem., 2014, 16, 1426.
Дутта; А. Бхаумик; К. Мухопадхьяй. Green Chem., 2014, 16, 1426.
[22] C.-L Ni; Х.-Х. Песня; Х. Ян; Х.-К. Песня; Р.-Г. Чжун. Ультрасон. Sonochem., 2010, 17, 367.
[23] Мансур С.С.; К. Логайя; К. Асвин; П.Н. Судхан. Университет Дж. Тайба. наук, 2015, 9, 213.
[24] Т.С. Салех; Н. М. Абд Эль-Рахман; А.А. Элькатеб; НЕТ. шейкер; Н.А. Махмуд; С. А. Габал. Ultrasonics
Sonochem., 2012, 19, 491.
[25] S.H. Банитаба; Дж. Сафари; С.Д. Халили. Ultrasonics Sonochem., 2013, 20, 401.
[26] R. Cano; Д.Дж. Рамон; М. Юс. Synlett, 2011, 2017.
[27] С. Ахмад; С. Эбрахим; С. Афшин; Р.А. Хоссейн. биоорг. Мед. хим. Lett., 2008, 18, 3968.
Синтез новых фотохромных пиранов с помощью реакций, опосредованных палладием
Исходные материалы, пропаргиловый спирт 9 и фенол 8b , были приготовлены в основном в соответствии с описанными в литературе методиками (схема 3).Синтез предшественников пирана -10- и -12a/b осуществляли с использованием ПФТС и триметилортоформиата в ДХЭ по стандартному протоколу, разработанному Каррейрой [27] для перегруппировки по типу Клайзена образующихся in situ пропаргилариловых эфиров. Все попытки оптимизировать выход 12a/b не увенчались успехом из-за реакций разложения, наблюдаемых при длительном времени реакции, и трудностей, возникающих при разделении побочных продуктов флэш-хроматографией.Обработка 10 и 12a/b NBS во влажном ДМСО дает промежуточные соединения бромгидрина 11 и 13a/b с выходами от хороших до превосходных. Бромзамещенные конденсированные пираны 1 и 2a/b были получены с высокими выходами при использовании TsOH в толуоле с последующим удалением воды [25].
Все попытки оптимизировать выход 12a/b не увенчались успехом из-за реакций разложения, наблюдаемых при длительном времени реакции, и трудностей, возникающих при разделении побочных продуктов флэш-хроматографией.Обработка 10 и 12a/b NBS во влажном ДМСО дает промежуточные соединения бромгидрина 11 и 13a/b с выходами от хороших до превосходных. Бромзамещенные конденсированные пираны 1 и 2a/b были получены с высокими выходами при использовании TsOH в толуоле с последующим удалением воды [25].
Схема 3: Синтез 2-бром-3 H -нафто[2,1- b ]пирана 1 и 3-бром-2 H -1-бензопиранов 2a/b .
Схема 3: Синтез 2-бром-3 H -нафто[2,1- b ]пирана 1 и 3-бром-2 H -1-бензопиранов 2a/b .
Поскольку ареннитрилы важны для тонкой химической промышленности, недавно были разработаны различные методы эффективного цианирования арилгалогенидов в мягких условиях.Применяя электронно-богатые фосфаны и либо Zn(CN) 2 , либо K 4 [Fe(CN) 6 ], удалось успешно осуществить превращение хлоридов в нитрилы в достаточно мягких условиях. Однако протоколы для виниловых систем все еще встречаются редко.
При использовании Zn(CN) 2 (0,6 экв) в присутствии Pd(dba) 2 /[( t -Bu) 3 PH]BF 4 с Zn (0.05 экв) в качестве добавки во влажном NMP (0,2% воды, 0,03 М) при 45 °C превращения бромзамещенного нафтопирана 1 не наблюдалось через 17 часов. Дополнительные эксперименты показали, что конверсию 1 можно улучшить путем активации порошка цинка с использованием TMSCl или йода, тогда как бром был менее эффективен (таблица 1).
Дополнительные эксперименты показали, что конверсию 1 можно улучшить путем активации порошка цинка с использованием TMSCl или йода, тогда как бром был менее эффективен (таблица 1).
Таблица 1: Оптимизация катализируемых палладием реакций цианирования с Zn(CN) 2 .
| Вход | конк (M) | Zn(CN) 2 (экв.) | добавка (экв. ) ) | время (ч) | конверсия в (%) | выход a,b,c (%) |
|---|---|---|---|---|---|---|
| 1 | 0.03 | 0,6 | 0,2 Бр 2 | 18 | 7 | 5 |
| 2 | 0. 03 03 | 0,6 | 0,2 ТМСCl | 19 | 29 | 23 |
| 3 | 0.03 | 0,6 | 0,2 л 2 | 17 | 56 | 54 |
| 4 | 0.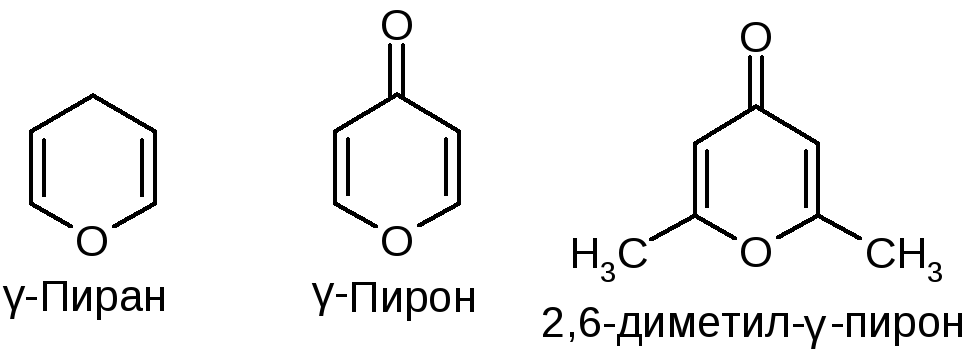 50 д 50 д | 1.1 | 0,2 л 2 | 41 | 100 | 97 и |
a Определено с помощью ОФ-ВЭЖХ при 210 нм. b Выход на основе ВЭЖХ. c 2–5% побочного продукта, который не был дополнительно охарактеризован, наблюдали с помощью ВЭЖХ. d 8% [( t -Bu) 3 PH]BF 4 . e Выход выделенного продукта после очистки флэш-хроматографией: 83%.
При использовании йода с помощью ОФ-ВЭЖХ определена конверсия 56% (таблица 1, запись 3). В родственных условиях реакции с выбором других лигандов (PEPPSI, dppf, dpppe) трансформация не может быть дополнительно усилена.
Для полной конверсии концентрацию реакционной смеси повышали с 0,03 М до 0,5 М, применяли 1,1 экв. Zn(CN) 2 и время реакции удваивали. Таким образом, соединение 3 может быть выделено с выходом 83% после обработки и флэш-хроматографии. В других растворителях реакция либо не шла (толуол, ТГФ), либо была менее эффективной (ДМФА).
Цианирование винилбромида 1 также исследовали с использованием K 4 [Fe(CN) 6 ] в присутствии Pd(OAc)/dppf и Na 2 CO 3 в NMP при 120°С. °С в течение 44 ч (схема 4) [28]. Однако только перегруппированный и гидродегалогенированный бензофуран 14 был выделен с выходом 65% после флэш-хроматографии.
°С в течение 44 ч (схема 4) [28]. Однако только перегруппированный и гидродегалогенированный бензофуран 14 был выделен с выходом 65% после флэш-хроматографии.
Схема 4: Сокращение кольца, наблюдаемое во время цианирования, приближается к синтезу 3 .
Схема 4: Сокращение кольца, наблюдаемое во время цианирования, приближается к синтезу 3 .
Образование бензофурана можно объяснить расщеплением бензопиранового кольца и последующей реакцией перегруппировки [29,30]. Однако при использовании стандартных условий Соногаширы в ТГФ (триметилсилил)ацетилен подвергали реакции с 1 в течение 45 часов с получением 4 в 53% после обработки и очистки флэш-хроматографией (схема 5).
Однако при использовании стандартных условий Соногаширы в ТГФ (триметилсилил)ацетилен подвергали реакции с 1 в течение 45 часов с получением 4 в 53% после обработки и очистки флэш-хроматографией (схема 5).
Схема 5: Катализируемая палладием реакция Соногашира-сочетание 2-бром-3 H -нафто[2,1- b ]пирана 1 .
Схема 5: Катализируемая палладием реакция Соногашира-сочетание 2-бром-3 H -нафто[2,1- b ]пирана 1 .
Протокол цианирования на основе Zn(CN) 2 также был успешно использован для трансформации стерически требовательных винилбромидов 2a/b , что дало 5a и 5b с выходами от хороших до превосходных (схема 6).
Схема 6: Катализируемое палладием цианирование и карбонилирование 3-бром-2 H -1-бензопиранов 2a/b .
Схема 6: Катализируемое палладием цианирование и карбонилирование 3-бром-2 H -1-бензопиранов 2a/b .
Начиная с бромзамещенного пирана 2b конечная стадия карбонилирования (схема 6) непосредственно завершает синтез Fmoc-защищенной ω-аминокислоты. Хотя известно много протоколов карбонилирования Хека, только в некоторых из них сообщается о нейтральных условиях реакции, необходимых здесь из-за чувствительности защитной группы Fmoc. Однако в процедуре, опубликованной Urata et al. [31] использование молекулярного сита вместо основания оказалось успешным. Исход реакции зависел от типа молекулярных сит, поскольку диаметр пор должен соответствовать размеру ионов используемых галогенидов. Мы были рады выделить 200 мг ω-аминокислоты 6 , начиная с реакционной массы 2,3 ммоль 2b , при использовании воды в ТГФ в течение 72 ч при 100 °C и 50 атм CO в присутствии PdCl 2 (PPh 3 ) 2 и молекулярные сита 4 Å.Низкий выход 14% можно объяснить разложением исходного материала и продукта в жестких условиях реакции. Все попытки использовать MeOH в ТГФ в аналогичных условиях не привели к получению обнаружимых количеств желаемого метилового эфира.
Однако в процедуре, опубликованной Urata et al. [31] использование молекулярного сита вместо основания оказалось успешным. Исход реакции зависел от типа молекулярных сит, поскольку диаметр пор должен соответствовать размеру ионов используемых галогенидов. Мы были рады выделить 200 мг ω-аминокислоты 6 , начиная с реакционной массы 2,3 ммоль 2b , при использовании воды в ТГФ в течение 72 ч при 100 °C и 50 атм CO в присутствии PdCl 2 (PPh 3 ) 2 и молекулярные сита 4 Å.Низкий выход 14% можно объяснить разложением исходного материала и продукта в жестких условиях реакции. Все попытки использовать MeOH в ТГФ в аналогичных условиях не привели к получению обнаружимых количеств желаемого метилового эфира.
Фотохимия бензопиранов: соединение
5a Фотофизические свойства новых пиранов приведены на примере соединения 5a : в стационарных измерениях признаков образования открытой формы нет, т. е.е. появление видимой полосы поглощения после УФ-освещения. Поэтому для регистрации динамики реакции 5a и поиска его форм с «разомкнутым кольцом» применялись спектроскопические методы с гораздо более высоким временным разрешением. Фотореакцию инициировали короткими световыми импульсами с длиной волны 340 нм. Соответствующие переходные изменения поглощения (375–650 нм) в зависимости от времени задержки между насосом и зондом показаны на рисунке 1a. Проверка данных на ранних временах задержки (0.2 пс) обнаруживает широкое и неструктурированное наведенное поглощение во всем спектральном диапазоне. Эта особенность исчезает на быстрых временах < 1 пс и приводит к слабому увеличению поглощения в диапазоне 400 нм. На шкале времени 30 пс появляется ярко выраженная полоса поглощения в видимой области с максимумом при ~460 нм.
е.е. появление видимой полосы поглощения после УФ-освещения. Поэтому для регистрации динамики реакции 5a и поиска его форм с «разомкнутым кольцом» применялись спектроскопические методы с гораздо более высоким временным разрешением. Фотореакцию инициировали короткими световыми импульсами с длиной волны 340 нм. Соответствующие переходные изменения поглощения (375–650 нм) в зависимости от времени задержки между насосом и зондом показаны на рисунке 1a. Проверка данных на ранних временах задержки (0.2 пс) обнаруживает широкое и неструктурированное наведенное поглощение во всем спектральном диапазоне. Эта особенность исчезает на быстрых временах < 1 пс и приводит к слабому увеличению поглощения в диапазоне 400 нм. На шкале времени 30 пс появляется ярко выраженная полоса поглощения в видимой области с максимумом при ~460 нм.
Рисунок 1: Данные измерений с временным разрешением соединения 5a . a) и b): результаты спектроскопии fs-pump-probe. Обратите внимание на линейную шкалу времени от −1 пс до 1 пс, а затем на логарифмическую шкалу. а) Двумерный обзорный график переходных изменений поглощения при кодировании ложным цветом. а.е. = произвольные единицы. b) Временное поведение изменений поглощения при длине волны обнаружения 470 нм. c) Результаты импульсного лазерного фотолиза. Переходный процесс был записан при 470 нм (черный) и показан вместе с одноэкспоненциальной аппроксимацией (красный), дающей время затухания 12 мкс.
a) и b): результаты спектроскопии fs-pump-probe. Обратите внимание на линейную шкалу времени от −1 пс до 1 пс, а затем на логарифмическую шкалу. а) Двумерный обзорный график переходных изменений поглощения при кодировании ложным цветом. а.е. = произвольные единицы. b) Временное поведение изменений поглощения при длине волны обнаружения 470 нм. c) Результаты импульсного лазерного фотолиза. Переходный процесс был записан при 470 нм (черный) и показан вместе с одноэкспоненциальной аппроксимацией (красный), дающей время затухания 12 мкс.
Рисунок 1: Данные измерений с временным разрешением соединения 5a . a) и b): Результаты fs-pump-probe-spectros…
Такое спектральное и временное поведение уже известно для других нафто- и бензопиранов, а также для спиропиранов [20,32]. Начальные переходные процессы отнесены к первому возбужденному синглетному состоянию [32]. Глобальная подгонка набора данных показывает биэкспоненциальный спад поглощения в возбужденном состоянии с постоянными времени 0,15 пс и 0,9 пс. Низкое поглощение и спектральное положение (~400 нм) наблюдаемой впоследствии полосы указывают на образование молекул с разомкнутым циклом и искаженной неплоской структурой с такими постоянными времени. Цветные «открытые» формы появляются в более длительном временном масштабе ( τ = 31 пс), что связано с появлением интенсивной полосы с центром на ~ 460 нм (рис. 1a/b).Спектральная характеристика этой полосы позволяет отнести ее к открытым формам с более плоской структурой из-за sp 2 -гибридизации на бывшем sp 3 -гибридизированном углероде, несущем арильные остатки. Теперь π-система распространяется на значительную часть молекулы.
Начальные переходные процессы отнесены к первому возбужденному синглетному состоянию [32]. Глобальная подгонка набора данных показывает биэкспоненциальный спад поглощения в возбужденном состоянии с постоянными времени 0,15 пс и 0,9 пс. Низкое поглощение и спектральное положение (~400 нм) наблюдаемой впоследствии полосы указывают на образование молекул с разомкнутым циклом и искаженной неплоской структурой с такими постоянными времени. Цветные «открытые» формы появляются в более длительном временном масштабе ( τ = 31 пс), что связано с появлением интенсивной полосы с центром на ~ 460 нм (рис. 1a/b).Спектральная характеристика этой полосы позволяет отнести ее к открытым формам с более плоской структурой из-за sp 2 -гибридизации на бывшем sp 3 -гибридизированном углероде, несущем арильные остатки. Теперь π-система распространяется на значительную часть молекулы.
Постоянная времени образования открытой формы (31 пс) медленнее, чем динамика реакции, зарегистрированная для других бензопиранов [20,32]. Низкая скорость реакции может быть связана с цианозаместителем в положении 3 в бензопирановом фрагменте (сравните схему 2). Готовится подробная публикация, в которой сравниваются вещества с заместителями и без заместителей в этом положении.
Низкая скорость реакции может быть связана с цианозаместителем в положении 3 в бензопирановом фрагменте (сравните схему 2). Готовится подробная публикация, в которой сравниваются вещества с заместителями и без заместителей в этом положении.
Результаты, представленные на рисунке 1a/b, ясно демонстрируют, что реакция раскрытия цикла протекает в пикосекундном масштабе. Поскольку стационарные измерения не обнаруживают изменения поглощения под действием света, открытый интермедиат должен быть недолговечным.Эксперименты с лазерной вспышкой на рисунке 1c показывают кинетику обратной реакции. Полоса открытой формы (например, рис. 1а, t D = 1000 пс) исчезает моноэкспоненциально с постоянной времени 12 мкс (рис. 1в). Аналогичные времена жизни были найдены для родственных систем [20].
Фотохимию исследованного бензопирана 5a можно резюмировать следующим образом: как известно из литературы [32], после фотовозбуждения в полосу S 1 наблюдается очень короткоживущее возбужденное состояние, которое затухает за время -масштаб < 1 пс. Молекула достигла открытой формы с некоторым искажением. Планаризация и возникающее в результате сильное поглощение в видимом диапазоне происходит во временном масштабе в несколько десятков пикосекунд. Открытая форма существует только в течение ограниченного времени: видно, что полоса поглощения в видимом диапазоне с центром при 460 нм исчезает на шкале времени в десять микросекунд.
Молекула достигла открытой формы с некоторым искажением. Планаризация и возникающее в результате сильное поглощение в видимом диапазоне происходит во временном масштабе в несколько десятков пикосекунд. Открытая форма существует только в течение ограниченного времени: видно, что полоса поглощения в видимом диапазоне с центром при 460 нм исчезает на шкале времени в десять микросекунд.


 Попробуйте другой браузер, если вы подозреваете это.
Попробуйте другой браузер, если вы подозреваете это.