Элементы – главная побочная подгруппа
Cтраница 2
Рассмотрим, как с помощью таблицы Менделеева можно определить основные степени окисления элементов. Следует различать элементы главных и побочных подгрупп. Элементы главных подгрупп расположены в группах под элементами II и III периодов, а элементы побочных подгрупп смещены влево. [16]
Рассмотрим, как с помощью таблицы Менделеева можно определить основные степени окисления элементов. Следует различать элементы главных и побочных подгрупп. Элементы главных подгрупп расположены в группах под элементами II и III периодов, а элементы побочных подгрупп смещены по горизонтали. [17]
Поэтому в правой части периодической системы различия в свойствах элементов главных и побочных подгрупп проявляются особенно резко. Однако в тех случаях, когда элементы главной и побочной подгруппы находятся в высшей степени окисленности, их аналогичные соединения проявляют существенное сходство.
Поэтому в правой части периодической системы различия в свойствах элементов главных я побочных подгрупп проявляются особенно резко. Однако в тех случаях, когда элементы главной и побочной подгруппы находятся в высшей степени окисленности, их аналогичные соединения проявляют существенное сходство. [19]
Поэтому в правой части периодической системы различия в свойствах элементов главных и побочных подгрупп проявляются особенно резко. Однако в тех случаях, когда элементы главной и побочной подгруппы находятся в высшей степени окисленности, их аналогичные соединения проявляют существенное сходство. Оба эти вещества в обычных условиях находятся в твердом состоянии и образуют при взаимодействии с водой кислоты состава НгЭО Точно так же оксиды марганца и хлора, соответствующие высшей степени окисленности этих элементов, – МпгО7 и СЬО. [20]
Поэтому в правой части ( ериодической системы различия в свойствах элементов главных i побочных подгрупп проявляются особенно резко. Однако в тех: лучаях, когда элементы главной и побочной подгруппы находятся i высшей степени окисленности, их аналогичные соединения про-шляют существенное сходство.
[21]
Однако в тех: лучаях, когда элементы главной и побочной подгруппы находятся i высшей степени окисленности, их аналогичные соединения про-шляют существенное сходство.
[21]
Кластеры, содержащие осмий, германий, олово, свинец, мышьяк, сурьму и висмут, описаны в обзоре [500], содержащем 44 ссылки. Рассмотрены методы синтеза, структурные особенности, их описание с позиций смешанно-металлических кластеров,
Почти все элементы главных подгрупп IV-VII групп периодической системы представляют собой неметаллы, в то время как элементы побочных подгрупп – металлы. Поэтому в правой части периодической системы различия в свойствах элементов главных и побочных подгрупп проявляются особенно резко. Однако в тех случаях, когда элементы главной и побочной подгруппы находятся в высшей степени окисленности, их аналогичные соединения проявляют существенное сходство. Точно так же оксиды марганца и хлора, соответствующие высшей степени окисленности этих элементов, – Мп2О7 и СЬОг – обладают сходными свойствами и представляют собой ангидриды сильных кислот, отвечающих общей формуле НЭО.
Почти все элементы главных подгрупп IV-VII групп периодической системы представляют собой неметаллы, в то время как элементы побочных подгрупп – металлы. Поэтому в правой части периодической системы различия в свойствах элементов главных и побочных подгрупп проявляются особенно резко. Однако в тех случаях, когда
Большинство элементов главных подгрупп IV – VII групп периодической системы представляют собой неметаллы, в то время как элементы побочных подгрупп – металлы. Поэтому в правой части периодической системы различия в свойствах элементов главных и побочных подгрупп проявляются особенно резко. Однако в тех случаях, когда элементы главной и побочной подгруппы находятся в высшей степени окисления, их аналогичные соединения проявляют существенное сходство. [25]
Главными называют подгруппы, в которые входят элементы малых периодов ( типические элементы) и элементы больших периодов.
Главными называют подгруппы, в которые входят элементы малых периодов ( типические элементы) и элементы больших периодов. Побочными называют подгруппы, содержащие только элементы больших периодов. Главные v подгруппы объединяют элементы, у которых все валентные электроны находятся во внешнем слое атома. У элементов побочных подгрупп валентные электроны находятся во внешнем и предпоследнем слоях атомов. Поэтому
В главные подгруппы входят элементы малых периодов, называемые типическими элементами, и сходные с ними элементы больших периодов; остальные элементы первых семи групп составляют побочные подгруппы.

Страницы: 1 2
Структура периодической системы Менделеева
Анализируя данные о внутренней связи между группами сходных по свойствам элементов, Д. И. Менделеев пришел к выводу, что их свойства должны быть обусловлены какими-то фундаментальными общими характеристиками. Такой фундаментальной характеристикой для химического элемента он выбрал атомную массу элемента и кратко сформулировал периодический закон (1869 г.):
Свойства элементов, а также свойства образуемых ими простых и сложных тел находятся в периодической зависимости от величин атомных весов элементов.
Заслуга Менделеева состоит в том, что он понял проявленную зависимость как объективную закономерность природы, чего не смогли сделать его предшественники.
Во-первых, из известных в то время 63 элементов Менделеев изменил атомные массы почти у 20 элементов (Be, In, La, Y, Ce, Th, U). Во-вторых, он предсказал существование около 20 новых элементов и оставил для них место в периодической системе. Три из них, а именно экабор, екаалюминий и екасилиций были описаны достаточно подробно и с удивительной точностью. Это триумфально подтвердилось в течение последующих пятнадцати лет, когда были открыты элементы Галлий (екаалюминий), скандий (экабор) и Германий (екасилиций).
Периодический закон является одним из фундаментальных законов природы. Его влияние на развитие научного мировоззрения можно сравнить только с законом сохранения массы и энергии или квантовой теории.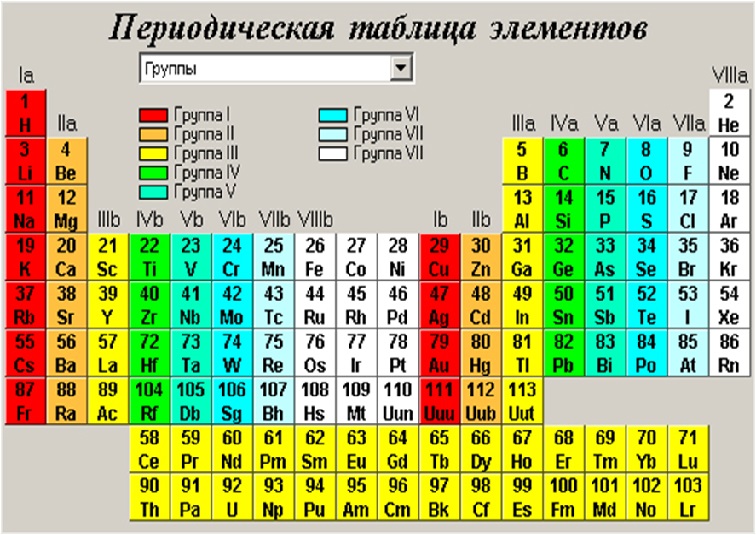 Еще во времена Д. И. Менделеева периодический закон стал основой химии. Дальнейшие открытия строения атома и явления изотопии показали, что главной количественной характеристикой элемента является не атомная масса, а заряд ядра(Z). В 1913 г. Мозли и Резерфорд ввели понятие «порядковый номер элемента», пронумеровали в периодической системе все символы и показали, что в основу классификации элементов является порядковый номер элемента, равный заряда ядер их атомов.
Еще во времена Д. И. Менделеева периодический закон стал основой химии. Дальнейшие открытия строения атома и явления изотопии показали, что главной количественной характеристикой элемента является не атомная масса, а заряд ядра(Z). В 1913 г. Мозли и Резерфорд ввели понятие «порядковый номер элемента», пронумеровали в периодической системе все символы и показали, что в основу классификации элементов является порядковый номер элемента, равный заряда ядер их атомов.
Это утверждение известно сейчас как закон Мозли.
Поэтому современное определение периодического закона формулируется следующим образом:
Свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от значения заряда их атомных ядер (или от порядкового номера элемента в периодической системе).
Электронные структуры атомов элементов наглядно показывают, что при росте заряда ядра происходит закономерное периодическое повторение электронных структур, а значит, и повторение свойств элементов. Это отражается в периодической системе элементов, для которой предложено несколько сотен вариантов. Чаще всего используют две формы таблиц — сокращенную и развернутую, — содержащие все известные элементы и имеющие свободные места для пока не открытых.
Это отражается в периодической системе элементов, для которой предложено несколько сотен вариантов. Чаще всего используют две формы таблиц — сокращенную и развернутую, — содержащие все известные элементы и имеющие свободные места для пока не открытых.
Каждый элемент занимает в периодической таблице определенную ячейку, в которой указано символ и название элемента, его порядковый номер, относительную атомную массу, а для радиоактивных элементов в квадратных скобках приведены массовое число наиболее стабильного или доступного изотопа. В современных таблицах часто приводятся и некоторые другие справочные сведения: плотность, температуры кипения и плавления простых веществ и т.п.
Периоды
Основными структурными единицами периодической системы есть периоды и группы — естественные совокупности, на которые делятся химические элементы по электронным структурами.
Период — это горизонтальный последовательный ряд элементов, в атомах которых электроны заполняют одинаковое количество энергетических уровней.
Номер периода совпадает с номером внешнего квантового уровня. Например, элемент кальций ( 4s2 ) находится в четвертом периоде, то есть его атом имеет четыре энергетические уровни, а валентные электроны находятся на внешнем, четвертом уровне. Разница в последовательности заполнения как внешних, так и более близких к ядру электронных слоев объясняет причину различной длины периодов.
В атомов s- и р-элементов идет застройка внешнего уровня, в d-элементов — второго снаружи, а в f-элементов — третьего снаружи энергетического уровня.
Поэтому различие в свойствах наиболее отчетливо проявляется в соседних s- или р-элементах. В d- и особенно f-элементах одного и того же периода различие в свойствах менее значительно.
Как уже упоминалось, по признаку номера энергетического подуровня застраиваемого электронами, элементы объединяются в электронные семьи. Например, в IV-VI периодах находятся семьи, которые содержат по десять d-элементов: 3d-семья (Sc-Zn), 4d- семья (Y-Cd), 5d- семья (La, Hf-Hg). В шестом и седьмом периодах по четырнадцать элементов составляют f-семьи: 4f-семью (Се-Lu), которая носит название лантаноидной, и 5f-семью (Th-Lr) — актиноидную. Эти семьи размещают под периодической таблицей.
В шестом и седьмом периодах по четырнадцать элементов составляют f-семьи: 4f-семью (Се-Lu), которая носит название лантаноидной, и 5f-семью (Th-Lr) — актиноидную. Эти семьи размещают под периодической таблицей.
Первые три периода называются малыми, или типичными периодами, поскольку свойства элементов этих периодов является основой для распределения всех других элементов на восемь групп. Все остальные периоды, включая и седьмой, незавершенный, называются большими периодами .
Все периоды, кроме первого, начинаются с щелочных металлов (Li, Na, K, Rb, Cs, Fr) и заканчиваются, за исключением седьмого, незавершенного, инертными элементами (He, Ne, Ar, Kr, Xe, Rn). Щелочные металлы имеют одну и ту же внешнюю электронную конфигурацию ns1 , где n — номер периода. Инертные элементы, кроме гелия ( 1s2 ), имеют одинаковое строение внешнего электронного слоя: ns2 np6 , то есть электронными аналогами.
Рассмотренная закономерность дает возможность прийти к выводу:
Периодическое повторение одинаковых электронных конфигураций внешнего электронного слоя является причиной сходства физических и химических свойств у элементов-аналогов, так как именно внешние электроны атомов в основном определяют их свойства .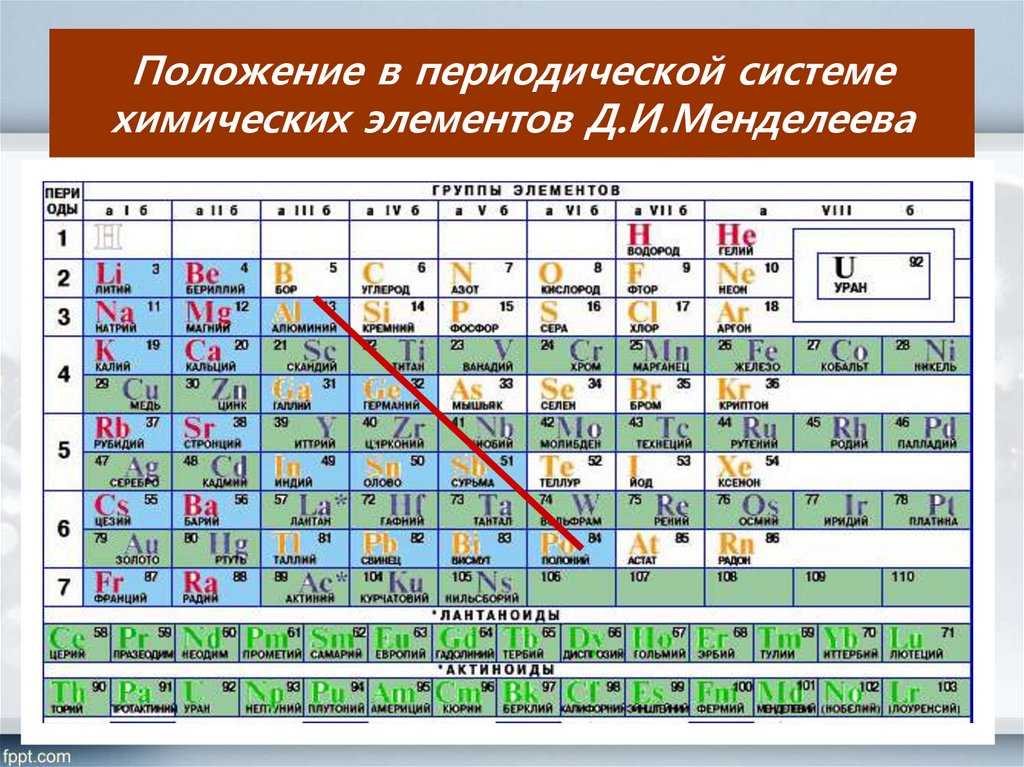
В малых типовых периодах с увеличением порядкового номера наблюдается постепенное уменьшение металлических и рост неметаллических свойств, поскольку увеличивается количество валентных электронов на внешнем энергетическом уровне. Например, атомы всех элементов третьего периода имеют по три электронных слоя. Строение двух внутренних слоев одинаково для всех элементов третьего периода (1s2 2s2 2p6), а строение внешнего, третьего, слоя различно. При переходе от каждого предыдущего элемента к каждому последующему заряд ядра атома возрастает на единицу и соответственно увеличивается количество внешних электронов. В результате их притяжение к ядру усиливается, а радиус атома уменьшается. Это приводит к ослаблению металлических свойств и росту неметаллических.
Третий период начинается очень активным металлом натрием ( 11Na — 3s1 ), за которым следует несколько менее активный магний ( 12Mg — 3s2 ). Оба эти металлы относятся к 3s-семье. Первый р-элемент третьего периода алюминий ( 13Al — 3s2 3p1 ), металлическая активность которого меньше, чем у магния, имеет амфотерные свойства, то есть в химических реакциях может вести себя и как неметалл. Далее следуют неметаллы кремний ( 14Si — 3s2 3p2 ), фосфор ( 15P — 3s2 3p3 ), сера ( 16S — 3s2 3p4 ), хлор ( 17Cl — 3s2 3p5 ). Их неметаллические свойства усиливаются от Si к Cl, который является активным неметаллом. Период заканчивается инертным элементом аргоном ( 18Ar — 3s2 3p6 ).
Первый р-элемент третьего периода алюминий ( 13Al — 3s2 3p1 ), металлическая активность которого меньше, чем у магния, имеет амфотерные свойства, то есть в химических реакциях может вести себя и как неметалл. Далее следуют неметаллы кремний ( 14Si — 3s2 3p2 ), фосфор ( 15P — 3s2 3p3 ), сера ( 16S — 3s2 3p4 ), хлор ( 17Cl — 3s2 3p5 ). Их неметаллические свойства усиливаются от Si к Cl, который является активным неметаллом. Период заканчивается инертным элементом аргоном ( 18Ar — 3s2 3p6 ).
В пределах одного периода свойства элементов меняются постепенно, а при переходе от предыдущего периода к следующему наблюдается резкое изменение свойств, поскольку начинается застройка нового энергетического уровня.
Постепенность изменения свойств характерна не только для простых веществ, но и для сложных соединений, как это представлено в таблице 1.
Таблица 1 — Некоторые свойства элементов третьего периода и их соединений
| Электронная семья | s-элементы | р-элементы | ||||||
|---|---|---|---|---|---|---|---|---|
| Символ элемента | Na | Mg | Al | Si | P | S | Cl | Ar |
| Заряд ядра атома | +11 | +12 | +13 | +14 | +15 | +16 | +17 | +18 |
| Внешняя электронная конфигурация | 3s 1 | 3s 2 | 3s 2 3p 1 | 3s 2 3p2 | 3s 2 3p 3 | 3s 2 3p 4 | 3s 2 3p 5 | 3s 2 3p 6 |
| Атомный радиус, нм | 0,189 | 0,160 | 0,143 | 0,118 | 0,110 | 0,102 | 0,099 | 0,054 |
| Максимальная валентность | I | II | III | IV | V | VI | VII | — |
| Высшие оксиды и их свойства | Na 2 O | MgO | Al 2 O 3 | SiO 2 | P 2 O 5 | SO 3 | Cl 2 O 7 | — |
| Основные свойства | Амфотерные свойства | Кислотные свойства | — | |||||
| Гидраты оксидов (основы или кислоты) | NaOH | Mg (OH) 2 | Al (OH) 3 | H 2 SiO 3 | H 3 PO 4 | H 2 SO 4 | HСlO 4 | — |
| Основание | Слабое основание | Амфотерный гидроксид | Слабая кислота | Кислота средней силы | Сильная кислота | Сильная кислота | — | |
| Соединения с водородом | NaH | MgH 2 | AlH 3 | SiH 4 | PH 3 | H 2 S | HCl | — |
| Твердые солеобразные вещества | Газообразные вещества | — | ||||||
В больших периодах металлические свойства ослабляются медленнее.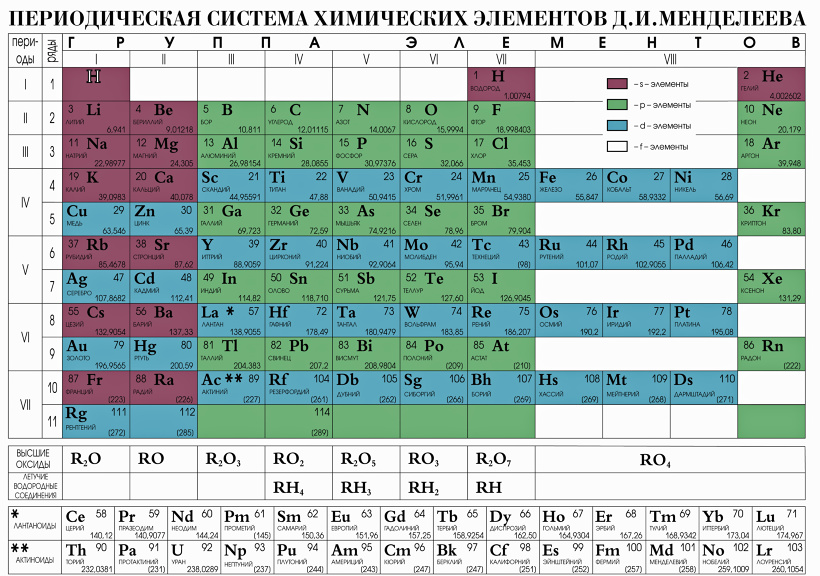 Это связано с тем, что, начиная с четвертого периода, появляются десять переходных d-элементов, в которых застраивается не внешний, а второй снаружи d-подуровень, а на внешнем слое d-элементов находятся один или два s-электрона, которые и определяют в известной степени свойства этих элементов. Таким образом, для d-элементов закономерность несколько усложняется. Например, в пятом периоде металлические свойства постепенно уменьшаются от щелочного Rb, достигают минимальной силы у металлов семьи платины (Ru, Rh, Pd).
Это связано с тем, что, начиная с четвертого периода, появляются десять переходных d-элементов, в которых застраивается не внешний, а второй снаружи d-подуровень, а на внешнем слое d-элементов находятся один или два s-электрона, которые и определяют в известной степени свойства этих элементов. Таким образом, для d-элементов закономерность несколько усложняется. Например, в пятом периоде металлические свойства постепенно уменьшаются от щелочного Rb, достигают минимальной силы у металлов семьи платины (Ru, Rh, Pd).
Однако после неактивного Ag серебра размещается кадмий Cd, у которого наблюдается скачкообразный рост металлических свойств. Далее с ростом порядкового номера элемента появляются и постепенно усиливаются неметаллические свойства вплоть до типового неметалла йода. Заканчивается этот период, как и все предыдущие, инертным газом. Периодическая смена свойств элементов внутри больших периодов позволяет разделить их на два ряда, в которых вторая часть периода повторяет первую.
Группы
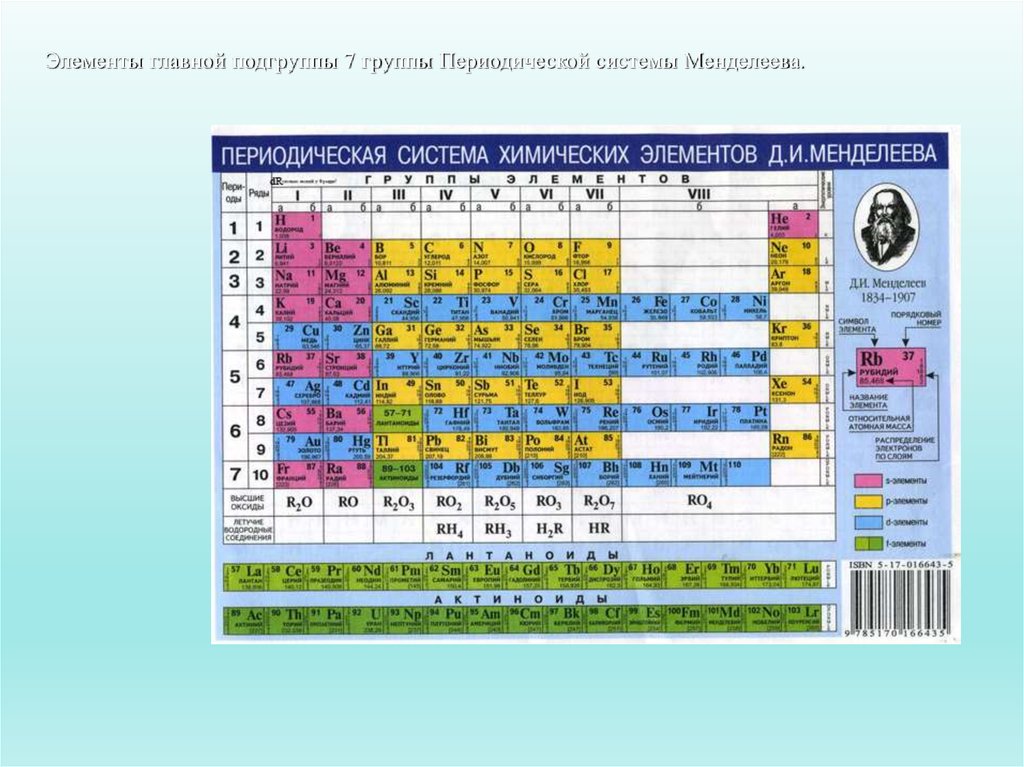
Вертикальные столбики элементов в периодической таблице — группы состоят из подгрупп: главной и побочной, они иногда обозначаются буквами А и Б соответственно.
В состав главных подгрупп входят s- и р-элементы, а в состав побочных — d- и f-элементы больших периодов.
Главная подгруппа — это совокупность элементов, которая размещается в периодической таблице вертикально и имеет одинаковую конфигурацию внешнего электронного слоя в атомах.
Как следует из приведенного определения, положения элемента в главной подгруппе определяется общим количеством электронов (s- и р-) внешнего энергетического уровня, равным номеру группы. Например, сера (S — 3s2 3p4 ), в атоме которого на внешнем уровне содержится шесть электронов, относится к главной подгруппе шестой группы, аргон (Ar — 3s2 3p6 ) — к главной подгруппе восьмой группы, а стронций (Sr — 5s2 ) — к ІІА-подгруппе.
Элементы одной подгруппы характеризуются сходством химических свойств.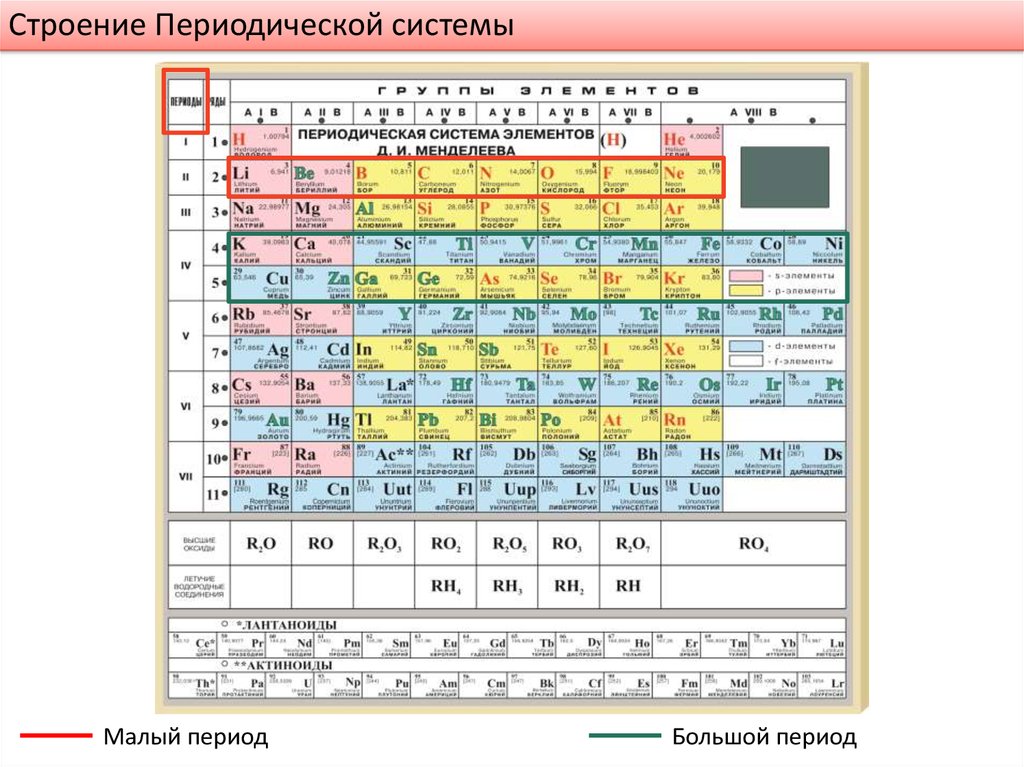 В качестве примера рассмотрим элементы ІА и VІІА подгрупп (табл.2). С ростом заряда ядра увеличивается количество электронных слоев и радиус атома, но количество электронов на внешнем энергетическом уровне остается постоянной: для щелочных металлов (подгруппа IА) — один, а для галогенов (подгруппа VIIА) — семь. Поскольку именно внешние электроны наиболее существенно влияют на химические свойства, то понятно, что каждая из рассмотренных групп элементов-аналогов имеет подобные свойства.
В качестве примера рассмотрим элементы ІА и VІІА подгрупп (табл.2). С ростом заряда ядра увеличивается количество электронных слоев и радиус атома, но количество электронов на внешнем энергетическом уровне остается постоянной: для щелочных металлов (подгруппа IА) — один, а для галогенов (подгруппа VIIА) — семь. Поскольку именно внешние электроны наиболее существенно влияют на химические свойства, то понятно, что каждая из рассмотренных групп элементов-аналогов имеет подобные свойства.
Но в пределах одной подгруппы наряду с подобием свойств наблюдается их некоторое изменение. Так, элементы подгруппы ІА все, кроме Н — активные металлы. Но с ростом радиуса атома и количества электронных слоев экранирующих влияние ядра на валентные электроны, металлические свойства усиливаются. Поэтому Fr более активный металл, чем Сs, a Cs — более активный, чем R в и т.д. А в подгруппе VIIA по той же причине ослабляются неметаллические свойства элементов при росте порядкового номера. Поэтому F — более активный неметалл по сравнению с Cl, a Cl — более активный неметалл сравнению с Br и т. д.
д.
Таблица 2 — Некоторые характеристики элементов ІА и VІІА-подгрупп
| период | Подгруппа IA | Подгруппа VIIA | ||||||
|---|---|---|---|---|---|---|---|---|
| Символ элемента | Заряд ядра | Радиус атома, нм | Внешняя электронная конфигурацiя | Символ элемента | Заряд ядра | Радиус атома, нм | Внешняя электронная конфигурацiя | |
| II | Li | +3 | 0,155 | 2 s 1 | F | +9 | 0,064 | 2 s 2 2 p 5 |
| III | Na | +11 | 0,189 | 3 s 1 | Cl | +17 | 0,099 | 3 s 2 3 p 5 |
| IV | K | +19 | 0,236 | 4 s 1 | Br | 35 | 0,114 | 4 s 2 4 p 5 |
| V | Rb | +37 | 0,248 | 5 s 1 | I | +53 | 0,133 | 5 s 2 5 p 5 |
| VI | Cs | 55 | 0,268 | 6 s 1 | At | 85 | 0,140 | 6 s 2 6 p 5 |
| VII | Fr | +87 | 0,280 | 7 s 1 | — | — | — | — |
Побочные подгруппа — это совокупность элементов, размещаемых в периодической таблице вертикально и имеют одинаковое количество валентных электронов за счет застройки внешнего s- и втором снаружи d-энергетических подуровней.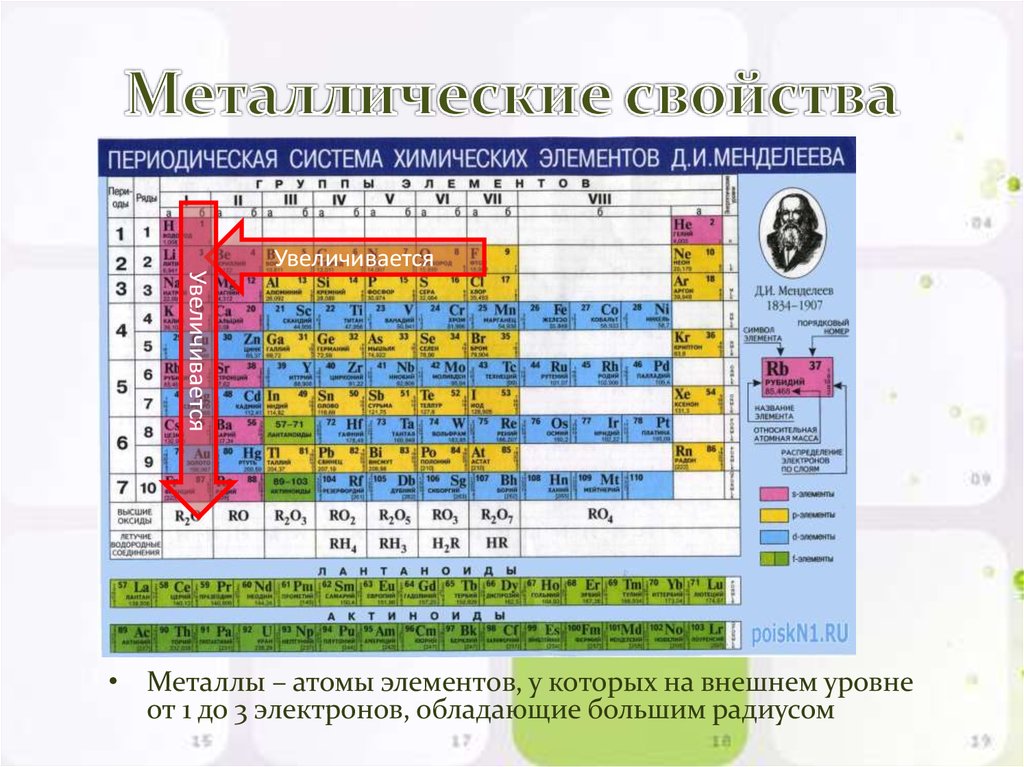
Все элементы побочных подгрупп относятся к d-семейству. Эти элементы иногда называют переходными металлами. В побочных подгруппах свойства изменяются более медленно, поскольку в атомах d-элементов электроны застраивают второй извне энергетический уровень, а на внешнем уровне находятся только один или два электрона.
Положение первых пяти d-элементов (подгруппы IIIБ- VIIБ) каждого периода можно определить с помощью суммы внешних s-электронов и d-электронов второго снаружи уровня. Например, из электронной формулы скандия (Sc — 4s2 3d1 ) видно, что он размещается в побочной подгруппе (поскольку является d-элементом) третьей группы (поскольку сумма валентных электронов равна трем), а марганец (Mn — 4s2 3d5 ) размещается в побочной подгруппе седьмой группы.
Положение последних двух элементов каждого периода (подгруппы IБ и IIБ) можно определить по количеству электронов на внешнем уровне, поскольку в атомах этих элементов предыдущий уровень является полностью завершенным. Например, Ag ( 5s1 5d10 ) размещается в побочной подгруппе первой группы, Zn ( 4s2 3d10 ) — в побочной подгруппе второй группы.
Например, Ag ( 5s1 5d10 ) размещается в побочной подгруппе первой группы, Zn ( 4s2 3d10 ) — в побочной подгруппе второй группы.
Триады Fe-Co-Ni, Ru-Rh-Pd и Os-Ir-Pt размещены в побочной подгруппе восьмой группы. Эти триады образуют две семьи: железа и платиноидов. Кроме указанных семей отдельно выделяют семью лантаноидов (четырнадцать 4f-элементов) и семью актиноидов (четырнадцать 5f-элементов). Эти семьи принадлежат к побочной подгруппе третьей группы.
Рост металлических свойств элементов в подгруппах сверху вниз, а также уменьшение этих свойств в пределах одного периода слева направо обусловливают появление в периодической системе диагональной закономерности. Так, Be очень похож на Al, B — на Si, Ti — на Nb. Это ярко проявляется в том, что в природе эти элементы образуют подобные минералы. Например, в природе Те всегда бывает с Nb, образуя минералы — титанониобаты.
Почему элементы в правой части периодической таблицы неметаллы и газы при комнатной температуре?
спросил
Изменено 3 года, 9 месяцев назад
Просмотрено 66 тысяч раз
$\begingroup$
Элементы в левой части таблицы Менделеева имеют тенденцию быть твердыми и металлическими, элементы в правой части таблицы Менделеева являются неметаллами и имеют тенденцию быть газами при комнатной температуре, а полуметаллы находятся между ними. Почему это? Почему элементы справа неметаллические и находятся в газовой фазе?
Почему это? Почему элементы справа неметаллические и находятся в газовой фазе?
- периодическая таблица
- периодическая тенденция
$\endgroup$
1
$\begingroup$
Элементы в левой части периодической таблицы относительно электронодефицитны (т. е. у них мало валентных электронов) и из-за их сравнительно низких эффективных ядерных зарядов (суммарный положительный заряд протонов за вычетом электронов экранирующего остова ниже валентный уровень), их электростатическое сцепление с этими электронами слабое. Следовательно, электроны атомов металлов имеют тенденцию быть сильно делокализованными, не образуя локализованных ковалентных связей или обладая прочно удерживаемыми неподеленными парами. В металлах электроны эффективно распределяются между многими атомами, слабо связанными в том, что часто называют электронным «морем», и атомы металлов организуют максимально эффективную упаковку в кристаллической решетке, через которую электроны (особенно наиболее экстенсивно делокализованные электроны на s- и p-орбиталях на высшем основном энергетическом уровне) движутся свободно. Плотная упаковка кристаллической решетки объясняет плотность и твердость металлов, а обширная делокализация электронов частично объясняет их пластичность и проводимость.
Плотная упаковка кристаллической решетки объясняет плотность и твердость металлов, а обширная делокализация электронов частично объясняет их пластичность и проводимость.
С другой стороны, элементы справа в периодической таблице имеют более высокие эффективные заряды ядер и более эффективно стабилизируют электроны, что приводит к локализованным ковалентным связям и образованию молекул (по сравнению с ионными связями и кристаллическими решетками металлов). Электростатические силы межмолекулярного притяжения обычно слабее, чем ионная связь или делокализованная металлическая связь, поэтому неметаллы и молекулярные соединения с большей вероятностью существуют в жидкой или газообразной фазе при сравнительно низких температурах, чем металлы или ионные соединения.
$\endgroup$
1
Зарегистрируйтесь или войдите в систему
Зарегистрируйтесь с помощью Google
Зарегистрироваться через Facebook
Зарегистрируйтесь, используя электронную почту и пароль
Опубликовать как гость
Электронная почта
Требуется, но не отображается
Опубликовать как гость
Электронная почта
Требуется, но не отображается
Нажимая «Опубликовать свой ответ», вы соглашаетесь с нашими условиями обслуживания, политикой конфиденциальности и политикой использования файлов cookie
.
Модуль 1b – Аннотации – Правило октета
В разделе 3.2 было введено понятие валентных электронов . Это электроны, находящиеся на самом высоком занятом энергетическом уровне или оболочке атома элемента. В наших обсуждениях мы сосредоточимся на элементах в первых двух столбцах левой части таблицы Менделеева и последних шести столбцах правой части таблицы. Вместе эти элементы называются основной группой или репрезентативными элементами 9.0062 . На рис. 3.6 в Raymond используются структуры электронных точек Льюиса, чтобы показать количество валентных электронов в некоторых репрезентативных элементах. Обратите внимание, что количество валентных электронов, которое имеет каждый элемент, равно его номеру группы, , например. , элементы группы IA имеют один валентный электрон (одна точка), элементы группы IIA имеют два валентных электрона (2 точки), и т. д.
Оказывается, в природе есть что-то особенное, когда на валентной оболочке восемь электронов. Это самая стабильная ситуация для атома. Элементы, которые имеют это число в своих чистых нейтральных формах, являются элементами группы VIIIA. Эти элементы, как группа, называются инертные газы . Все инертные газы имеют 8 валентных электронов, за исключением гелия, у которого их 2. Это связано с тем, что первый энергетический уровень может содержать только 2 электрона, тогда как другие энергетические уровни могут содержать 8 или более электронов. (Каждый энергетический уровень может содержать до 2 n электронов, где n — энергетический уровень; см. раздел 3. 2 и таблицу 3.4 у Раймонда). Даже если энергетический уровень может содержать более 8 электронов, наиболее стабильным числом будет 8. Инертные газы называются инертными, потому что они очень не вступают в реакцию с самими собой и другими элементами. Это говорит об их высокой стабильности. Все остальные элементы в периодической таблице хотели бы быть похожими на инертный газ с точки зрения количества электронов, которые они имеют в своей валентной оболочке. Химию можно рассматривать как следствие того, что все элементы периодической таблицы пытаются получить такое же количество валентных электронов, как один из инертных газов. Они делают это, реагируя друг на друга , чтобы получить, потерять или разделить электроны. так что каждый атом имеет 8 электронов в своей валентной оболочке . Это формулировка так называемого правила октетов .
2 и таблицу 3.4 у Раймонда). Даже если энергетический уровень может содержать более 8 электронов, наиболее стабильным числом будет 8. Инертные газы называются инертными, потому что они очень не вступают в реакцию с самими собой и другими элементами. Это говорит об их высокой стабильности. Все остальные элементы в периодической таблице хотели бы быть похожими на инертный газ с точки зрения количества электронов, которые они имеют в своей валентной оболочке. Химию можно рассматривать как следствие того, что все элементы периодической таблицы пытаются получить такое же количество валентных электронов, как один из инертных газов. Они делают это, реагируя друг на друга , чтобы получить, потерять или разделить электроны. так что каждый атом имеет 8 электронов в своей валентной оболочке . Это формулировка так называемого правила октетов .
Таблица Менделеева отражает эту ситуацию. Первоначально элементы располагались в периодической таблице слева направо в соответствии с их атомным номером и в столбцах в соответствии с их химическими и физическими свойствами. Например, крайний правый столбец содержит химически инертные газы. На рис. 3.8 в Raymond показаны репрезентативные элементы:
Например, крайний правый столбец содержит химически инертные газы. На рис. 3.8 в Raymond показаны репрезентативные элементы:
Периодическая таблица также дает подсказки об электронной структуре элемента. Если сосредоточиться на репрезентативных элементах, строки сообщают вам, на каком энергетическом уровне находятся валентные электроны: строка 1 — это 9-й.0067 n =1 уровень, вторая строка n =2 уровень, и т.д. . Столбцы указывают для нейтральной формы элемента, сколько валентных электронов находится в валентной оболочке: первый столбец (группа IA) содержит 1 валентный электрон, второй столбец (группа IIA) содержит 2 валентных электрона, и т. д. . , а последний столбец (группа VIIIA) содержит 8 валентных электронов.
д. . , а последний столбец (группа VIIIA) содержит 8 валентных электронов.
Правило октета можно использовать для предсказания заряда одноатомных ионов , которые образуются из репрезентативных элементов. Это показано на рис. 3.8. Один из способов, которым атомы получают 8 электронов на своей валентной оболочке, состоит в том, чтобы терять или приобретать электроны. Элементы в левой части периодической таблицы имеют тенденцию терять электроны, это металлы , в то время как элементы в правой части периодической таблицы имеют тенденцию приобретать электроны, это неметаллы . Когда металлы и неметаллы объединяются, металлы отдают свои валентные электроны неметаллам, так что каждый в итоге имеет 8 электронов на своем внешнем энергетическом уровне. При этом металлы образуют положительные ионы (катионы), а неметаллы — отрицательные ионы (анионы). На рис. 3.8 показаны структуры электронных точек Льюиса для обычных ионов, образованных репрезентативными элементами. Неметаллы, расположенные в правой части периодической таблицы, имеют каждый получил электронов в количестве, равном их заряду, и, как показывают структуры точек Льюиса, каждая из них имеет 8 электронов в своей валентной оболочке. Металлы, расположенные в левой части таблицы Менделеева, потеряли электронов в количестве, равном их заряду (теперь положительному), и, как показывают структуры точек Льюиса, каждый из них имеет 0 электронов, оставшихся в их валентности. оболочка! Следствием этого является то, что на следующем более низком энергетическом уровне, который теперь является самым высоким занятым энергетическим уровнем, будет 8 электронов (см. Таблицу 3.4 у Раймонда).
Неметаллы, расположенные в правой части периодической таблицы, имеют каждый получил электронов в количестве, равном их заряду, и, как показывают структуры точек Льюиса, каждая из них имеет 8 электронов в своей валентной оболочке. Металлы, расположенные в левой части таблицы Менделеева, потеряли электронов в количестве, равном их заряду (теперь положительному), и, как показывают структуры точек Льюиса, каждый из них имеет 0 электронов, оставшихся в их валентности. оболочка! Следствием этого является то, что на следующем более низком энергетическом уровне, который теперь является самым высоким занятым энергетическим уровнем, будет 8 электронов (см. Таблицу 3.4 у Раймонда).
Атомы и ионы с одинаковым числом электронов называются изоэлектронными . Li + представляет собой , изоэлектронный с Не (2 электрона), и это показано красными прямоугольниками на рис. 3.8; N 3- , O 2- , F – , Na + , Mg 2+ и Al 3+ являются изоэлектронными с Ne (10 электронов) розовые прямоугольники на рис. 3.8; и P 3-, S 2-, Кл – , K + и Ca 2+ являются изоэлектронными с Ar (18 электронов), и это показано синими прямоугольниками на рис. 3.8. Применение правила октета предсказывает, что это ионы, которые должны образовываться из репрезентативных элементов.
3.8; и P 3-, S 2-, Кл – , K + и Ca 2+ являются изоэлектронными с Ar (18 электронов), и это показано синими прямоугольниками на рис. 3.8. Применение правила октета предсказывает, что это ионы, которые должны образовываться из репрезентативных элементов.
Углерод (C) и кремний (Si) относятся к Группе IVA. (См. рис. 3.2 Раймонда, который также показан выше.) Элементы этой группы имеют 4 валентных электрона. Эти элементы могут либо получить, либо потерять 4 электрона, чтобы стать одноатомным ионом, изоэлектронным с инертным газом. Однако из-за высокого заряда либо C 4+ или С 4- для углерода и Si 4+ или Si 4- для кремния, это маловероятно. Вот почему они не показаны в столбце Группа IVA на рис. 3.8, показанном выше. Мы увидим, что углерод использует другую стратегию для соблюдения правила октета.
Правило октета не работает для предсказания зарядов ионов переходных металлов .

 6 от Raymond ): Валентные электроны . Типичные элементы одной и той же группы имеют одинаковое количество валентных электронов. В используемых здесь электронных точечных структурах валентные электроны показаны точками.
6 от Raymond ): Валентные электроны . Типичные элементы одной и той же группы имеют одинаковое количество валентных электронов. В используемых здесь электронных точечных структурах валентные электроны показаны точками.