Почему органическую химию выделили в отдельный раздел химии? Вопрос 3 параграф 1-4 химия 10 класс Рудзитис Г.Е. – Рамблер/класс
Почему органическую химию выделили в отдельный раздел химии? Вопрос 3 параграф 1-4 химия 10 класс Рудзитис Г.Е. – Рамблер/классИнтересные вопросы
Школа
Подскажите, как бороться с грубым отношением одноклассников к моему ребенку?
Новости
Поделитесь, сколько вы потратили на подготовку ребенка к учебному году?
Школа
Объясните, это правда, что родители теперь будут информироваться о снижении успеваемости в школе?
Школа
Когда в 2018 году намечено проведение основного периода ЕГЭ?
Новости
Будет ли как-то улучшаться система проверки и организации итоговых сочинений?
Вузы
Подскажите, почему закрыли прием в Московский институт телевидения и радиовещания “Останкино”?
Спасайте! Завтра обязательно спросит! В заголовке впрочем вся суть вопроса, почему органическую химию выделили в отдельный раздел химии?
ответы
Помню помню! Тоже в прошлом году с дочкой искали, лови ответ) Сначала органическими называли вещества, встречающиеся в природе в живых организмах. Позднее было установлено, что четкой границы между органическими и неорганическими веществами не существует, и органические вещества могут получаться из неорганических. Общее свойство всех органических веществ ‒ в их состав входит углерод. Сейчас органической химией называют раздел химии, изучающий соединения углерода. Еще одна причина выделения органической химии в отдельный раздел химии ‒ огромное разнообразие соединений углерода (их известно около 8 миллионов). Это объясняется тем, что атомы углерода могут образовывать длинные цепочки, в отличие от атомов других элементов
Позднее было установлено, что четкой границы между органическими и неорганическими веществами не существует, и органические вещества могут получаться из неорганических. Общее свойство всех органических веществ ‒ в их состав входит углерод. Сейчас органической химией называют раздел химии, изучающий соединения углерода. Еще одна причина выделения органической химии в отдельный раздел химии ‒ огромное разнообразие соединений углерода (их известно около 8 миллионов). Это объясняется тем, что атомы углерода могут образовывать длинные цепочки, в отличие от атомов других элементов
ваш ответ
Можно ввести 4000 cимволов
отправить
дежурный
Нажимая кнопку «отправить», вы принимаете условия пользовательского соглашения
похожие темы
ЕГЭ
9 класс
11 класс
Физика
похожие вопросы 5
Почему сейчас школьники такие агрессивные ?
Читали новость про 10 классника который растрелял ? как вы к этому относитесь
Новости10 классБезопасность
На какие даты намечено проведение основного периода ЕГЭ? Расскажите, пожалуйста, известно ли уже? (Подробнее.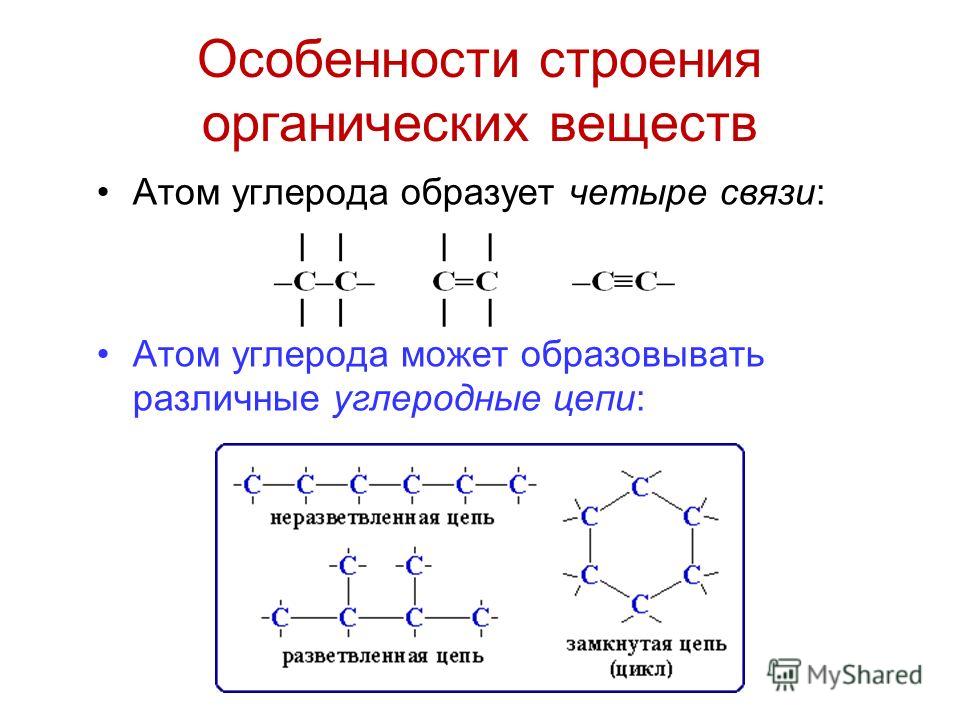 ..)
..)
ШколаЕГЭВыпускнойЭкзаменыНовости
Здравствуйте.
(Подробнее…)
Химия
Это правда, что будут сокращать иностранные языки в школах?
Хочется узнать, когда собираются сократить иностранные языки в школе? Какой в итоге оставят? (Подробнее…)
ШколаНовостиИностранные языки
18.
Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)
в предложении должна(-ы) стоять запятая(-ые). (Подробнее…)
ГДЗЕГЭРусский языкЦыбулько И.П.
Ответы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
| Похожие вопросы |
Структурная формула всех изомеров С7Н16
Решено
Вычислите эквивалент и молярную массу эквивалентов Н3РО4 в каждой из следующих реакций, выраженных уравнениями:
В каком году была сформулирована теория – предшественница кислородной теории горения.
электронный баланс Nh4+O2=NO+h3O
Решено
Пользуйтесь нашим приложением
Структура органических молекул – Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 844
Здесь вы научитесь понимать, писать, рисовать и говорить об органических молекулах. Почему были разработаны различные техники рисования? Органические молекулы могут стать сложными и большими. Утомительно постоянно вытягивать каждую деталь, особенно когда в этом нет необходимости, поэтому о-химики прошлого разработали эти методы, чтобы сделать их более удобными и простыми. Кроме того, некоторые из этих сокращенных способов рисования молекул дают нам представление об углах связи, относительном положении атомов в молекуле, а некоторые устраняют многочисленные атомы водорода, которые могут мешать смотреть на основу структуры.
Утомительно постоянно вытягивать каждую деталь, особенно когда в этом нет необходимости, поэтому о-химики прошлого разработали эти методы, чтобы сделать их более удобными и простыми. Кроме того, некоторые из этих сокращенных способов рисования молекул дают нам представление об углах связи, относительном положении атомов в молекуле, а некоторые устраняют многочисленные атомы водорода, которые могут мешать смотреть на основу структуры.
Введение
Обратите внимание на следующие рисунки структуры ретинола, наиболее распространенной формы витамина А. Первый рисунок следует прямолинейной (также известной как Кекуле) структуре, которая полезна, когда вы хотите рассмотреть каждый отдельный атом; однако отображение всех атомов водорода затрудняет сравнение общей структуры с другими подобными молекулами и затрудняет сосредоточение внимания на двойных связях и группе ОН.
Ретинол: прямолинейный рисунок Кекуле
Ниже приведена формула ретинола в виде линии связи (также известной как зигзаг). При таком упрощенном представлении можно легко увидеть углерод-углеродные связи, двойные связи, группу ОН и группы CH 3 , отходящие от основного кольца и цепи. Кроме того, это намного быстрее нарисовать, чем тот, что выше. Вы научитесь ценить этот тип написания формулы после того, как нарисуете бесчисленное количество органических молекул.
При таком упрощенном представлении можно легко увидеть углерод-углеродные связи, двойные связи, группу ОН и группы CH 3 , отходящие от основного кольца и цепи. Кроме того, это намного быстрее нарисовать, чем тот, что выше. Вы научитесь ценить этот тип написания формулы после того, как нарисуете бесчисленное количество органических молекул.
Ретинол: формула Bond-Line или зигзаг
Важность структуры
Изучение и применение на практике основ органической химии очень поможет вам в долгосрочной перспективе, когда вы будете изучать новые концепции и реакции. Некоторые люди говорят, что органическая химия похожа на другой язык, и в некоторых аспектах это так. Поначалу это может показаться трудным или непосильным, но чем больше вы будете практиковаться в рассмотрении и рисовании органических молекул, тем лучше вы будете знакомиться со структурами и формулами. Еще одна хорошая идея — приобрести комплект моделей и физически создать молекулы, которые вам сложно представить в голове.
Изучая общую химию, вы, возможно, уже изучали молекулярную структуру. Различные способы рисования органических молекул включают Кекуле (прямая линия), сокращенные формулы и формулы линий связи (зигзаг). Будет полезнее, если вам будет удобно переходить от одного стиля рисования к другому, смотреть на рисунки и понимать, что они означают, чем знать, какой вид рисунка как называется.
Примером рисунка, который включает в себя все три способа рисования органических молекул, может быть следующий дополнительный рисунок ретинола. Большая часть рисунка выполнена по формуле Bond-line (зигзаг), но -CH 3 записываются в виде сокращенных формул, а группа -ОН записывается в форме Кекуле.
Широко используемый способ отображения трехмерной структуры молекул — использование штрихов, клиньев и прямых линий. Этот метод рисования важен, потому что размещение разных атомов может дать разные молекулы, даже если молекулярные формулы будут точно такими же. Ниже приведены два рисунка четырехуглеродной молекулы с двумя присоединенными атомами хлора и двумя атомами брома.
Ниже приведены два рисунка четырехуглеродной молекулы с двумя присоединенными атомами хлора и двумя атомами брома.
4-углеродная молекула с 2 атомами хлора и 2 бромами 4-углеродная молекула с 2 атомами хлора и 2 бромами
Оба рисунка выглядят так, как будто они представляют одну и ту же молекулу; однако, если мы добавим черточки и заштрихуем, то увидим, что можно изобразить две разные молекулы:
Две вышеуказанные молекулы разные, докажите это себе, построив модель. Более простой способ сравнить две молекулы — повернуть одну из связей (здесь это связь справа):
Обратите внимание, что молекула справа имеет бром на одной стороне и хлор на одной стороне, тогда как первая молекула отличается. Прочтите о структурах пунктирно-клинообразных линий внизу страницы, чтобы понять, о чем было сказано выше. Вы узнаете больше о важности связи атомов в молекулах, продолжая изучать стереохимию.
Рисунок структуры органических молекул
Хотя более крупные молекулы могут показаться сложными, их можно легко понять, разбив их на части и рассмотрев более мелкие компоненты.
Все атомы хотят, чтобы их валентная оболочка была полной, «закрытой оболочкой». Водород хочет иметь 2 e – , тогда как углерод, кислород и азот хотят иметь 8 e – . Рассматривая различные представления молекул, помните о правиле октетов. Также помните, что водород может связать один раз, кислород может связать до двух раз, азот может связать до трех раз, а углерод может связать до четырех раз.
Кекуле (также известные как прямолинейные конструкции)
Структуры Кекуле аналогичны структурам Льюиса, но вместо ковалентных связей, представленных электронными точками, два общих электрона показаны линией.
(A) (B)(C)
Неподеленные пары остаются в виде двух электронных точек или иногда не учитываются, даже если они все еще существуют . Обратите внимание, что три неподеленные пары электронов не были втянуты вокруг хлора в примере B.
Сокращенные формулы
Сокращенная формула состоит из символов элементов. Порядок атомов предполагает связность. Сокращенные формулы можно читать с любого направления и H 3 C совпадает с CH 3 , хотя последний более распространен, потому что посмотрите на примеры ниже и сопоставьте их с их идентичной молекулой по структурам Кекуле и формулам линий связи.
Порядок атомов предполагает связность. Сокращенные формулы можно читать с любого направления и H 3 C совпадает с CH 3 , хотя последний более распространен, потому что посмотрите на примеры ниже и сопоставьте их с их идентичной молекулой по структурам Кекуле и формулам линий связи.
(a) Ch 3 CH 2 OH (B) CLCH 2 CH 2 CH (OCH 3 ) CH 3 (C) H 3 CNHCH 2 (C) H 3 CNHCH 2 4 (C).
Давайте внимательно посмотрим на пример B. Когда вы работаете с сокращенной формулой, вы хотите сосредоточиться на углероде и других элементах, которые не являются водородом. Водороды важны, но обычно они используются для завершения октетов. Также обратите внимание на -OCH 3 написано в круглых скобках, что говорит вам, что это не часть основной цепи углерода. Когда вы читаете сокращенную формулу, если вы достигаете атома, который не имеет полного октета к тому времени, когда вы достигаете следующего водорода, то, возможно, существуют двойные или тройные связи. В примере C углерод имеет двойную связь с кислородом и одинарную связь с другим кислородом. Обратите внимание, что COOH означает C(=O)-OH вместо CH 3 -C-O-O-H, потому что углерод не имеет полного октета и кислорода.
В примере C углерод имеет двойную связь с кислородом и одинарную связь с другим кислородом. Обратите внимание, что COOH означает C(=O)-OH вместо CH 3 -C-O-O-H, потому что углерод не имеет полного октета и кислорода.
Bond-Line (также известный как зигзаг) Формулы
Название говорит о том, как работает эта формула. Эта формула полна связей и линий, и из-за типичных (более стабильных) связей, которые атомы склонны образовывать в молекулах, они часто в конечном итоге выглядят как зигзагообразные линии. Если вы работаете с набором молекулярных моделей, вам будет трудно собрать прямые молекулы (если только они не содержат sp-тройные связи), тогда как зигзагообразные молекулы и связи гораздо более осуществимы.
(А) (Б) (В)
Эти молекулы соответствуют точно таким же молекулам, которые изображены для структур Кекуле и сокращенных формул. Обратите внимание, что углероды больше не нарисованы и заменены концами и изгибами линий. Кроме того, водороды были опущены, но их можно было легко втянуть (см. Практические задачи). Хотя мы обычно не рисуем Н, которые связаны с углеродом, мы рисуем их, если они связаны с другими атомами, помимо углерода (примером является группа ОН выше в примере А). Это делается потому, что не всегда ясно, окружен ли неуглеродный атом неподеленными парами или атомами водорода. Также в примере A обратите внимание, как ОН нарисован со связью со вторым углеродом, но это не означает, что на конце этой связи/линии есть третий углерод.
Практические задачи). Хотя мы обычно не рисуем Н, которые связаны с углеродом, мы рисуем их, если они связаны с другими атомами, помимо углерода (примером является группа ОН выше в примере А). Это делается потому, что не всегда ясно, окружен ли неуглеродный атом неподеленными парами или атомами водорода. Также в примере A обратите внимание, как ОН нарисован со связью со вторым углеродом, но это не означает, что на конце этой связи/линии есть третий углерод.
Структура штрих-клиновидной линии
Как вы уже догадались, структура штрих-клиновидной линии состоит из линий, штрихов и клиньев. Поначалу это может показаться запутанным, но с практикой понимание структуры штриховых линий станет для вас второй натурой. Ниже приведены примеры каждого и то, как их можно использовать вместе.
Выше приведены 4-углеродные цепи с присоединенными ОН-группами или атомами Cl и Br. Помните, что каждая линия представляет собой связь, а атомы углерода и водорода опущены. Когда вы смотрите на эти структуры или рисуете их, прямые линии изображают атомы и связи, находящиеся в одной плоскости, плоскости бумаги (в данном случае экрана компьютера). Пунктирные линии показывают атомы и связи, которые уходят на страницу, за плоскость, от вас. В приведенном примере группа ОН уходит в плоскость, в то же время выходит (заклинивается) водород.
Пунктирные линии показывают атомы и связи, которые уходят на страницу, за плоскость, от вас. В приведенном примере группа ОН уходит в плоскость, в то же время выходит (заклинивается) водород.
Синий шарик = группа ОН; Белая бусина=H
Клинообразные линии иллюстрируют связи и атомы, которые выходят из страницы перед плоскостью к вам. На двухмерной диаграмме выше группа ОН выходит из плоскости бумаги, а водород входит внутрь (пунктир).
Синяя бусина = группа ОН; Белая бусина = H
Как указывалось ранее, прямые линии иллюстрируют атомы и связи, которые находятся в той же плоскости, что и бумага, но в двумерном примере прямая линия связи для OH означает, что неясно или не имеет значения, уходит ли OH или к вам. Также предполагается, что водород также связан с тем же углеродом, на котором находится ОН.
Синий шарик = группа ОН; H не показана
Попробуйте с помощью комплекта моделей убедиться, что группа ОН не может лежать в одной плоскости в углеродной цепи (не забудьте свои атомы водорода!). В последнем примере 2D используются как пунктирные, так и клиновидные линии, поскольку присоединенные атомы не являются атомами водорода (хотя пунктирные и клиновидные линии можно использовать для водорода ). Хлор выходит из страницы, а бром входит в страницу.
В последнем примере 2D используются как пунктирные, так и клиновидные линии, поскольку присоединенные атомы не являются атомами водорода (хотя пунктирные и клиновидные линии можно использовать для водорода ). Хлор выходит из страницы, а бром входит в страницу.
Синий шарик=Cl; Красная бусина=Br
Практические задачи
- Сколько атомов углерода на следующем рисунке? Сколько водородов?
- Сколько атомов углерода на следующем рисунке? Сколько водородов?
- Сколько атомов углерода на следующем рисунке? Сколько водородов?
- Посмотрите на следующую молекулу витамина А и нарисуйте скрытые атомы водорода и пары электронов.
(подсказка: все ли атомы углерода имеют 4 связи? Все атомы кислорода имеют полный октет?) - Сколько связей может образовывать водород?
- Сколько связей может образовывать хлор?
- Пунктирные линии означают, что атомная связь идет ___________ (в сторону/в сторону) от вас.

- Draw ClCH 2 CH 2 CH(OCH 3 )CH 3 в форме Кекуле и зигзага.
- Могут быть обнаружены дополнительные практические проблемы ______?
Ответы
- Вспомните правило октета и сколько раз атомы углерода и водорода способны связываться с другими атомами.
-
-
- Электронные пары нарисованы синим цветом, а атомы водорода — красным.
- Гигроген может создать одну связь.
- Хлор может образовать одну связь.
- На выезде
- См. (B) по формулам Кекуле и линии Бонда (зигзаг).
- Дополнительные практические задачи можно найти: в учебнике, домашнем задании, конспектах лекций, в Интернете, справочниках и т. д. Попробуйте составить свои собственные молекулы, они могут существовать!
Ссылки
- Фоллхардт, К. Питер С. и Нил Э. Шор. Органическая химия: структура и функции .
 5-е изд. Нью-Йорк: Компания WH Freeman, 2007. 38–40.
5-е изд. Нью-Йорк: Компания WH Freeman, 2007. 38–40. - Кляйн, Дэвид Р. Органическая химия I как второй язык . 2-е изд. Хобокен, Нью-Джерси: John Wiley & Sons, Inc., 2007. 1–14.
Авторы
- Чу, Эзен (2009, UCD ’11)
Structure of Organic Molecules распространяется по лицензии CC BY-NC-SA 4.0, автором, ремиксом и/или куратором является LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
12.1: Природа органических молекул
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 86258
- Лиза Шарп Эллес
- Канзасский университет
Цели обучения
- Описать основные структурные свойства простых органических молекул.
Органическая химия — это изучение химии углеродсодержащих соединений. Углерод выделен потому, что он обладает химическим разнообразием, не имеющим себе равных среди других химических элементов. Его разнообразие основано на следующем:
Его разнообразие основано на следующем:
- Атомы углерода достаточно сильно связаны с другими атомами углерода.
- Атомы углерода достаточно прочно связаны с атомами других элементов.
- Атомы углерода образуют большое количество ковалентных связей (четыре).
Любопытно, что элементарного углерода не так много. Его даже нет в списке самых распространенных элементов в земной коре. Тем не менее, все живое состоит из органических соединений. Большинство органических химических веществ представляют собой ковалентные соединения, поэтому мы вводим здесь органическую химию. По соглашению соединения, содержащие ионы карбоната и ионы бикарбоната, а также двуокись и окись углерода, не считаются частью органической химии, даже если они содержат углерод.
Структурные свойства соединений углерода
Атом углерода имеет четыре валентных электрона, он четырехвалентен . Углерод может образовывать четыре ковалентных связей , или делят электроны с до четырех атомов, чтобы получить полный октет. Простейшие соединения углерода содержат только углерод и водород и называются углеводородами . Метан, простейший углеводород, содержит один углерод с четырьмя ковалентно связанными атомами водорода. Вспоминая то, что вы узнали о молекулярных структурах и ВСЕПР, мы знаем, что метан — это тетраэдрический (четыре электронные группы и без неподеленных пар).
Простейшие соединения углерода содержат только углерод и водород и называются углеводородами . Метан, простейший углеводород, содержит один углерод с четырьмя ковалентно связанными атомами водорода. Вспоминая то, что вы узнали о молекулярных структурах и ВСЕПР, мы знаем, что метан — это тетраэдрический (четыре электронные группы и без неподеленных пар).
Углерод также может образовывать двойных связей путем совместного использования четырех электронов с соседним атомом углерода или тройных связей путем совместного использования шести электронов с соседним атомом углерода. атом углерода. Как показано на рисунке \(\PageIndex{2}\) ниже, углерод с тремя присоединенными электронными группами будет тригонально-плоским , а углерод с двумя присоединенными электронными группами будет линейный .
Рисунок \(\PageIndex{2}\): Два атома углерода могут быть соединены одинарной, двойной или тройной связью. Обратите внимание, в каждом примере углерод образует всего четыре связи. Количество атомов водорода в каждой молекуле уменьшается по мере увеличения количества углерод-углеродных связей.
Обратите внимание, в каждом примере углерод образует всего четыре связи. Количество атомов водорода в каждой молекуле уменьшается по мере увеличения количества углерод-углеродных связей.
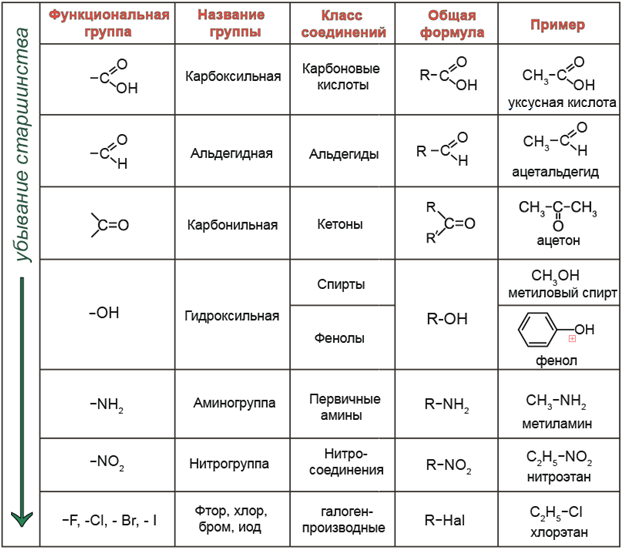
Простые углеводородные соединения являются неполярными из-за формы и небольшой разницы в электроотрицательности между атомами углерода и водорода. Когда углерод связан с атомом галогена или кислорода, в результате образуется связь полярный . Может быть полезно просмотреть раздел об электроотрицательности и полярности связей и молекул, чтобы иметь возможность описать свойства различных органических соединений, в частности, как они реагируют и взаимодействуют с другими молекулами.
Сравнение органических и неорганических соединений
Органические соединения, как и неорганические соединения, подчиняются всем законам природы. Часто нет четкого различия в химических или физических свойствах органических и неорганических молекул. Тем не менее полезно сравнить типичные члены каждого класса, как в таблице \(\PageIndex{1}\). Однако имейте в виду, что для каждой категории в этой таблице есть исключения.
Однако имейте в виду, что для каждой категории в этой таблице есть исключения.
| Органические свойства | Пример: Гексан | Неорганические свойства | Пример: NaCl |
|---|---|---|---|
| низкая температура плавления | −95°С | высокие температуры плавления | 801°С |
| низкие температуры кипения | 69°С | высокие точки кипения | 1413°С |
| низкая растворимость в воде; высокая растворимость в неполярных растворителях | нерастворим в воде; растворим в бензине | большая растворимость в воде; низкая растворимость в неполярных растворителях | растворим в воде; нерастворим в бензине |
| легковоспламеняющиеся | легковоспламеняющийся | негорючий | негорючий |
| водные растворы не проводят электричество | непроводящий | водные растворы проводят электричество | проводящий в водном растворе |
| имеют ковалентную связь | ковалентные связи | проявляют ионную связь | ионные связи |
Эта страница под названием 12.





 5-е изд. Нью-Йорк: Компания WH Freeman, 2007. 38–40.
5-е изд. Нью-Йорк: Компания WH Freeman, 2007. 38–40.