Читать онлайн «Элементы», Сен Гук Ким – ЛитРес
«Всё сущее есть число»
Пифагор
Предисловие
Пифагор не только к тексту, но и к тесту. Тесту на математичность окружающего Мира, Вещественного Мира из химических элементов. Химические элементы – числа: номера химических элементов; числа электронов и нуклонов в атомах химических элементов; квантовые числа… Вся материя в Вещественном Мире из химических элементов: атомы, молекулы, наночастицы, тела, газопылевые туманности, небесные тела, скопления галактик…. Всё (на сегодня) множество химических элементов, составляющих 118 номеров, традиционно распределяют в Периодических Таблицах. Исходя из своих таблиц, известных на то время химических элементов, Д. И. Менделеев открыл Периодический Закон. Но этот фундаментальный Закон Природы оформлен только таблично, сформулирован только словесно, и не имеет математических формул. Таблицы без формул – числовые шифры без ключей. Математические формулы – ключи к числовым шифрам.
Математические формулы – ключи к числовым шифрам.
Часть I
Введение к Части I
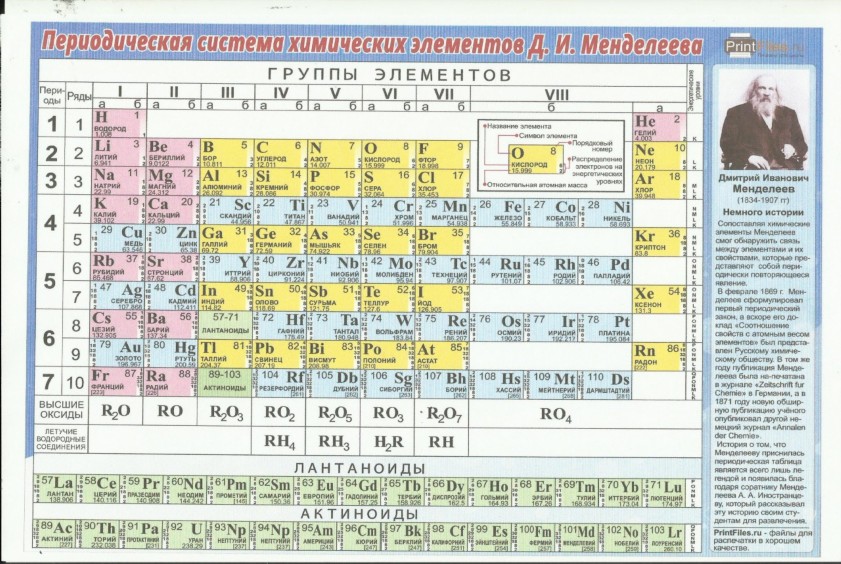
В более чем двухвековой истории систематизации химических элементов наибольших успехов в XIX веке достигли британец Джон Александр Ньюлендс, германец Юлиус Лотар Мейер и россиянин Дмитрий Иванович Менделеев. В последней прижизненной Таблице Менделеева было IX групп:
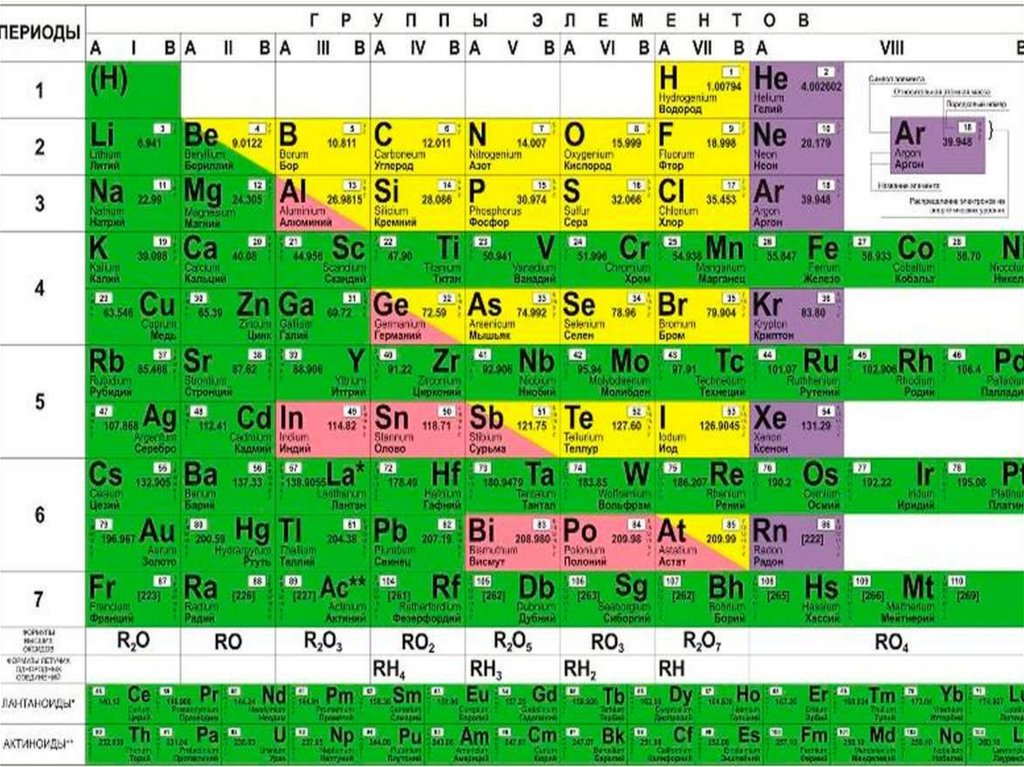
Рис. 1. Последняя прижизненная Периодическая Таблица Д.И. Менделеева
Как видно на рис. 1, у Менделеева была нулевая группа элементов, которая содержала доводородные элементы под номером, очевидно, 0 – Ньютоний (эфир), а под номером 1 – Короний. Водород, по-видимому, имел номер 2, Гелий – номер 3…., и т. д. Дмитрий Иванович почему-то не ставил номера элементам, видимо, полагая это очевидным по порядку расположения элементов в его Периодической Таблице: слева направо в рядах (писал и говорил именно о рядах, а не о периодах) и сверху вниз самих рядов (периодов). В восьмой (девятой от нулевой) группе были только триады: Fe, Со, Ni; Ru, Rh, Pd; Os, Ir, Pt.
Музыкальная октавная гармония, воплощённая в «Законе октав» Ньюлендса в его систематизации химических элементов, имела столь завораживающее воздействие на людей, что 120 лет после открытия Менделеевым Периодического Закона в Мире пользовались Периодической Таблицей химических элементов из VIII гомологических групп элементов-аналогов. В постменделеевский период вплоть до 1989 г. наиболее популярной и повсеместно используемой была Периодическая Таблица вида:
Рис. 2. Наиболее распространённая форма Периодической Таблицы химических элементов до 1989 г.
По сравнению с последней прижизненной Периодической Таблицей Менделеева нулевой группы вместе с нулевым элементом, Коронием и инертными элементами нет, первый номер у Водорода, Гелий и инертные газы из бывшей нулевой группы перенесены в группу VIII, где размещены и триады благородных металлов. Гелий поднялся на один ряд выше и стоит номером 2 в одном ряду с Водородом через 6 групп в крайней правой главной подгруппе VIII группы.
Размещение Гелия над Неоном и другими инертными газами было вполне понятно и оправдано во времена Менделеева, когда не знали о строении атомов, и не было квантовой механики. В самом деле, газ Гелий более инертен, чем все другие благородные газы и имеет наименьшую атомную массу среди них. Поэтому логично было ставить Гелий на первое место типозадающего элемента в гомологической группе инертных атомарных элементов-аналогов.
Но, когда открыли строение атомов, и было установлено, что в явлении периодичности свойств химических элементов лежит квантово-механическая основа формирования электронных оболочек, становится непонятным положение Гелия на рис. 2. Это в таблицах из VIII групп. Но, такая же картина сохраняется и в современных, после 1989 г., типах Периодических Таблиц с 18-ю группами.
Рис. З.Периодическая Таблица химических элементов с 18-тью группами, рекомендуемая IUPAC с 1989 г.
Уже с беглого взгляда на рис. 2 и рис. З отчётливо видно, будто Гелий вырван из естественного положения рядом с Водородом и перекинут на самую правую и верхнюю позицию над Неоном. При этом на обоих рис. 2 и 3 видно, что ячейка с Гелием, по цвету такая же, как у двух групп s-элементов. Как s-элемент Гелий может быть типозадающим в группе p-элементов? Авторы этих Таблиц, по-видимому, таким вопросом не задавались. Если же задавались, то предпочли не выходить за рамки сложившихся в XIX веке традиций. А, ведь, Таблицы на рис. 2 и рис. 3 создавались в середине XX века, когда строение атомов и формирование электронных оболочек на квантово-механической основе были повсеместно признаны и приняты.
При этом на обоих рис. 2 и 3 видно, что ячейка с Гелием, по цвету такая же, как у двух групп s-элементов. Как s-элемент Гелий может быть типозадающим в группе p-элементов? Авторы этих Таблиц, по-видимому, таким вопросом не задавались. Если же задавались, то предпочли не выходить за рамки сложившихся в XIX веке традиций. А, ведь, Таблицы на рис. 2 и рис. 3 создавались в середине XX века, когда строение атомов и формирование электронных оболочек на квантово-механической основе были повсеместно признаны и приняты.
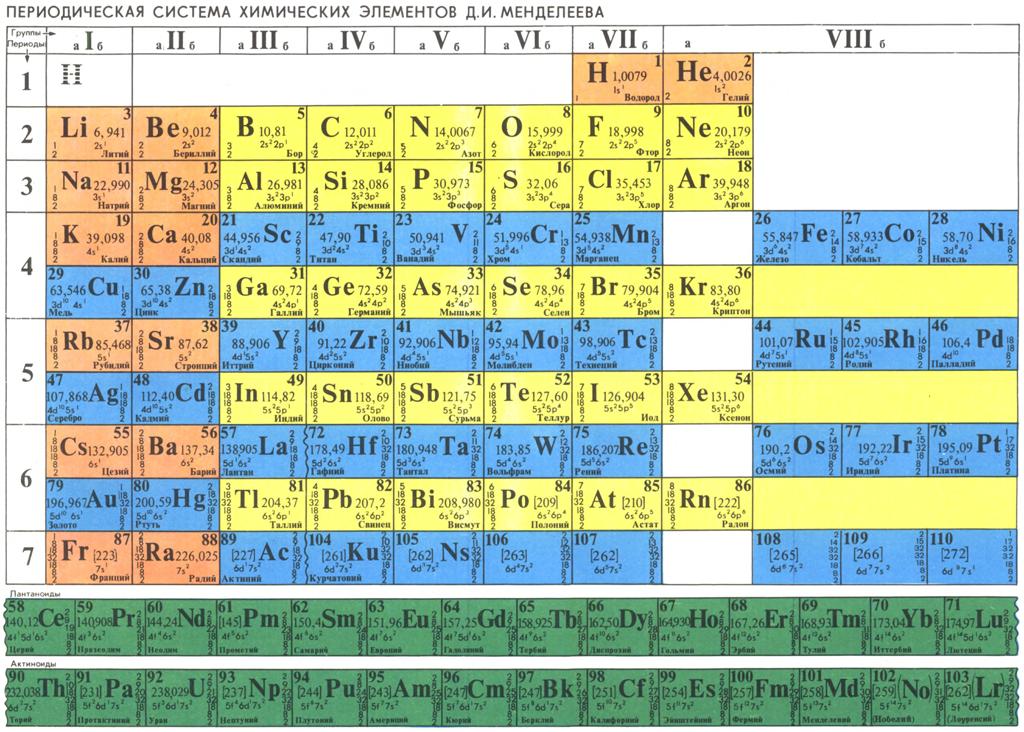
Между тем, существует Периодическая Таблица химических элементов по версии Жанета с четырьмя s-элементами в начале (на самом верху, справа, над всеми остальными s-элементами) Таблицы, которую он разработал ещё в конце 20-х годов XX века.
Рис. 4. Периодическая Таблица химических элементов по версии Жанета
Прямоугольные блоки s-, р-, d-, f-элементов компактны и непрерывно последовательны справа налево. Расцветка блоков несколько отличается от привычных для нас красного, желто-оранжевого, синего и зелёного цветов. Но расцветка условна и может отличаться в зависимости от предпочтений и традиций разных народов.
Но расцветка условна и может отличаться в зависимости от предпочтений и традиций разных народов.
Инертный Гелий возглавляет группу химически очень активных щелочноземельных металлов. Это для подавляющего большинства образованных (со средних школ, лицеев и гимназий) людей совершенно непривычно, более того, не приемлемо. Но если исходить из строения электронных оболочек атомов, то такое расположение Гелия научно оправдано.
Гелий является s-элементом, как щелочноземельные металлы, тогда как все благородные газы, над которыми его традиционно ставят в роли типозадающего в гомологической группе инертных элементов-аналогов, являются р-элементами.
Видно, что проблемы с общепринятыми Периодическими Таблицами химических элементов довольно глубокие. Они связаны с тем, что до сих пор у Периодического Закона химических элементов нет логического обоснования. Для фундаментальных Законов Природы, каковым, безусловно, является Периодический Закон химических элементов, логическим обоснованием может и должно быть математическое обоснование на математических принципах.
В истории систематизации химических элементов было множество попыток охватить все элементы математической формулой. Были попытки и с тригонометрическими, и с экспоненциальными, и со степенными функциями. Но все они потерпели неудачу. По-видимому, по причине того, что фундаментальные законы природы на самом деле просты, и выражаться должны простыми уравнениями. Как Закон всемирного тяготения, Закон электрического взаимодействия, Закон интенсивности света. И в самом деле, выжил и господствовал на протяжении 120 лет простейший математический закон октав из музыкальной гармонии, заложенный Ньюлендсом. Но и здесь были изначально и нарастали со временем проблемы, которые через сто с лишним лет привели к отказу от октавной простоты. В самом деле, Закону октав подчиняются только элементы s и р блоков, от Лития до Оганесона. Химические элементы с номерами 119 и 120 ещё не обнаружены и не синтезированы. Элементы s-, p-блоков отцвечены соответственно бардово-красным и жёлтым цветами на рис.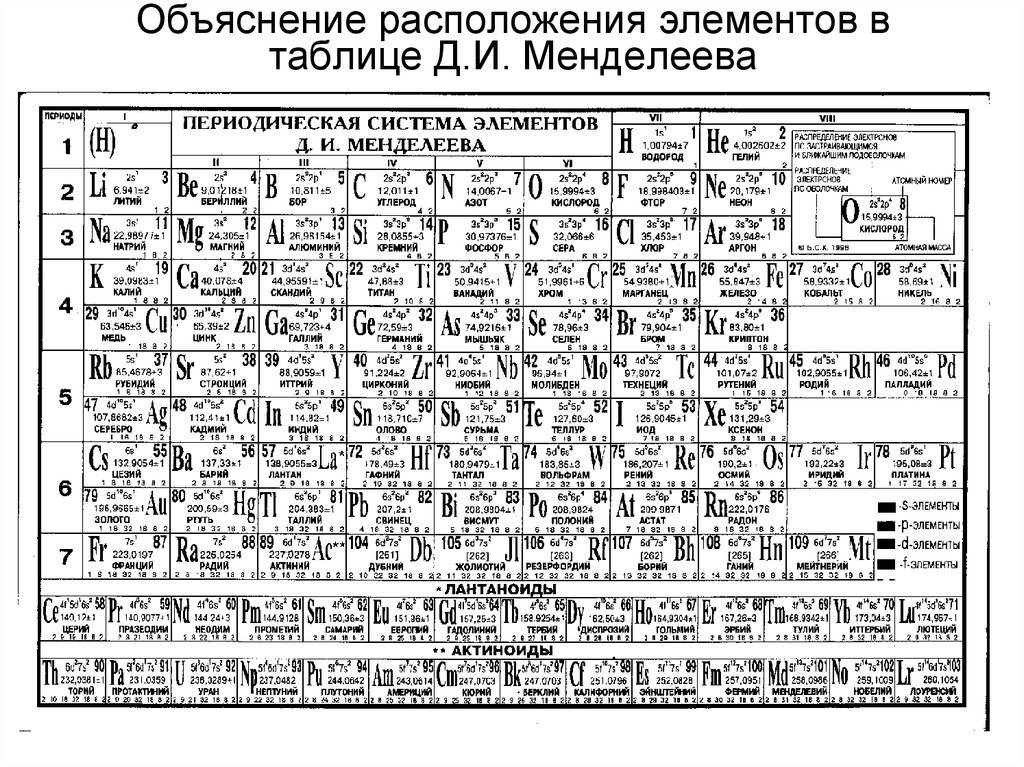 3. Полных рядов из октавы (восьми) «красных и жёлтых» химических элементов только 6, а элементов соответственно 48 из 118 известных на сегодня химических элементов. Это примерно 40,7 % всех химических элементов. Для истинного, математически выраженного Закона Природы, правомерно ожидать 100 %-го охвата элементов.
3. Полных рядов из октавы (восьми) «красных и жёлтых» химических элементов только 6, а элементов соответственно 48 из 118 известных на сегодня химических элементов. Это примерно 40,7 % всех химических элементов. Для истинного, математически выраженного Закона Природы, правомерно ожидать 100 %-го охвата элементов.
Индуктивный (от частного к общему) подход к систематизации химических элементов по мере открытия всё новых элементов оправдан с исторической точки зрения. Но к сегодняшнему дню открытия и синтез новых химических элементов подошли к верхнему пределу множества химических элементов. Настало время для дедуктивной (от общего к частному) систематизации множества химических элементов. Это не означает пренебрежения индуктивным методом, в особенности результатами, полученными к сегодняшнему дню. Напротив, результаты дедуктивного выявления общих математических закономерностей в распределении химических элементов (номеров) должны сопоставляться с известным ныне порядком (нумерацией) распределения химических элементов, полученным индуктивно в течение более двухсот лет.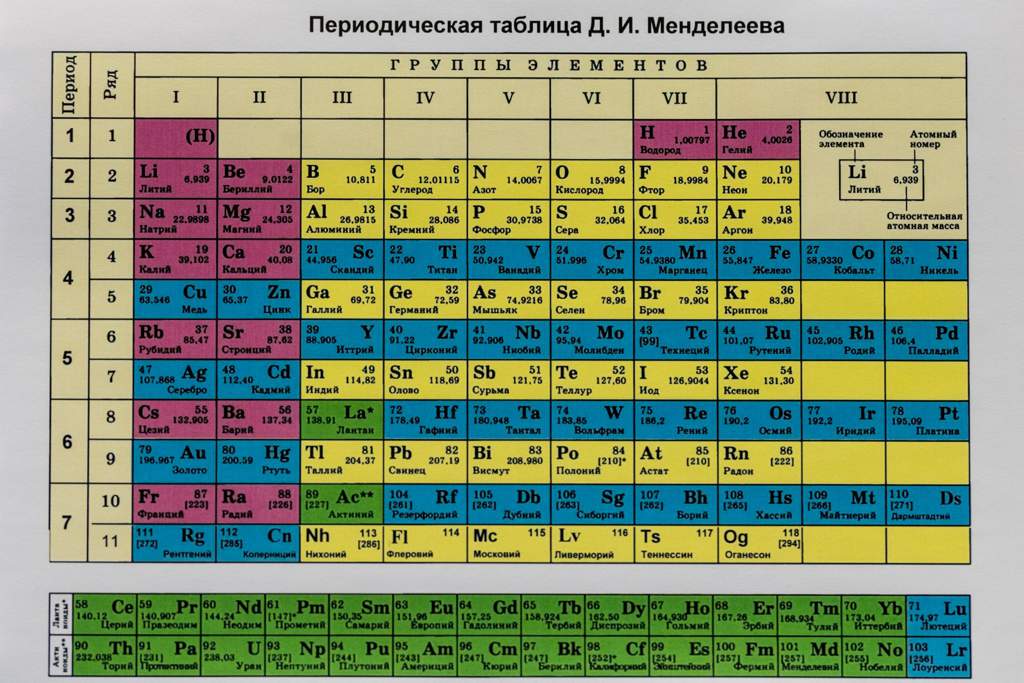
Наука и просвещение/образование
Обучение, учёба – освоение познанного. Познание – продвижение к непознанному, от освоенного. Наиболее динамичные продвижения в познании за последние 2–3 века сделаны в математике, физике, химии. Тон задавала математика. Что такое теорема? Она формулируется в начале математического исследования, т. е. задаётся сформулированная цель. Остальное – доказательство теоремы, т. е. продвижение к сформулированному в теореме утверждению (истине). Хоть и не столь чётко как в математике, но и в теоретической физике, и в теоретической химии процесс познания идёт по такой же схеме, по такому же алгоритму. Физика и химия – наиболее математизированные естественные науки.
И мы изначально поставим цель – решить Менделеевскую Проблему отсутствия математической формулы у фундаментального естественного Закона Природы – Периодического Закона химических элементов Д.И. Менделеева. Решение будем искать в виде числовой (номерной) систематизации химических элементов.
Всякое научное достижение без его истории, истоков выглядит оторванным, изолированным от общего процесса и потока познания. Поэтому обратимся к числовым истокам и идеям систематизации химических элементов.
1. Двумерное представление множества химических элементов
Изначально, ещё с конца XVIII века химические элементы выстраивали по порядку возрастания атомных весов (масс). Всё множество химических элементов, а их уже в первой четверти XIX века насчитывалось более десятка, выстраивали в ряд. К 60-ым годам XIX века число химических элементов превысило уже 60. Ряд химических элементов стал слишком длинным. Скорее всего, это было главной причиной отступления от прямолинейного отображения множества химических элементов. Первым в этом направлении следует признать Александра де Шанкуртуа, который в 1862 году представил цилиндрическую форму отображения множества химических элементов.
В 1864 году Александр Ньюлендс предложил «закон октав» в двумерном размещении множества химических элементов. Годом позже Лотар Мейер предложил две таблицы по 28 и 22 элемента. Через 5 лет, в 1869 году представил свою Периодическую Таблицу химических элементов Дмитрий Иванович Менделеев. Именно он впервые сформулировал Периодический Закон распределения в системе химических элементов. До 1989 года в мире пользовались короткопериодной Периодической Таблицей химических элементов Д.И. Менделеева с некоторыми изменениями. Примечательно, что в короткопериодной Периодической Таблице химических элементов придерживались «закона октав» Ньюлендса. Таким образом, именно в 60-х годах XIX века произошёл переход от одномерного множества химических элементов к их двумерному множеству. Периодический Закон химических элементов, говорят, «приснился» Д. И. Менделееву именно на двумерном табличном представлении множества известных ему химических элементов.
Годом позже Лотар Мейер предложил две таблицы по 28 и 22 элемента. Через 5 лет, в 1869 году представил свою Периодическую Таблицу химических элементов Дмитрий Иванович Менделеев. Именно он впервые сформулировал Периодический Закон распределения в системе химических элементов. До 1989 года в мире пользовались короткопериодной Периодической Таблицей химических элементов Д.И. Менделеева с некоторыми изменениями. Примечательно, что в короткопериодной Периодической Таблице химических элементов придерживались «закона октав» Ньюлендса. Таким образом, именно в 60-х годах XIX века произошёл переход от одномерного множества химических элементов к их двумерному множеству. Периодический Закон химических элементов, говорят, «приснился» Д. И. Менделееву именно на двумерном табличном представлении множества известных ему химических элементов.
Как бы то ни было на самом деле, но то, что Периодический Закон распределения химических элементов был выявлен на двумерном табличном представлении химических элементов – исторический факт.
Имеет смысл рассмотреть некоторые конкретные формы таблиц, в клеточках которых будем размещать химические элементы в последовательности 118 номеров, полученной к настоящему времени.
2. Двумерная числовая таблица 10 × 12
Возьмём множество первых 120 чисел натурального ряда, которыми пронумеруем клеточки-квадратики в таблице 10 × 12. Это наиболее простая таблица для чисел привычной всем десятеричной системы счисления. На рисунке ниже представлена такая таблица.
Рис. 5. Таблица 10 × 12 первых 120 чисел натурального ряда
Видна периодичность во всей таблице всех чисел первого разряда в 1-12 строках. Вся таблица периодична. В десятеричной системе счисления так и должно быть. Разряд из 1-10 задаёт (определяет) периодичность любых таблиц из строк в 10 чисел.
Посмотрим, как будет выглядеть таблица 10 × 12 с 118-ю известными на сегодня химическими элементами.
Рис. 6. Номера химических элементов в таблице 10 × 12
Все химические элементы делятся на 4 вида (блока). Они называются блоками s-, р-, d-, f-элементов или s-, р-, d-, f-блоками. Это из квантовой химии, довольно сложной науки. Но для нас важно сейчас только то, что любой химический элемент обязательно является членом одного из 4-х блоков. Нет химических элементов вне этих блоков. Все s-элементы у нас (в СНГ, со времён СССР) традиционно окрашивают в красный цвет, р-элементы – в жёлто-оранжевый, d-элементы – в синий и f-элементы – в зелёный.
Они называются блоками s-, р-, d-, f-элементов или s-, р-, d-, f-блоками. Это из квантовой химии, довольно сложной науки. Но для нас важно сейчас только то, что любой химический элемент обязательно является членом одного из 4-х блоков. Нет химических элементов вне этих блоков. Все s-элементы у нас (в СНГ, со времён СССР) традиционно окрашивают в красный цвет, р-элементы – в жёлто-оранжевый, d-элементы – в синий и f-элементы – в зелёный.
Периодичность химических элементов означает, что какие-то ряды полностью повторяются в своих расцветках хотя бы один раз. На рис. 6 таких рядов только 4 из 12, т. е. только ЪЪ,Ъ%. Из этого можно сделать вывод: 12-ти рядная таблица из 10 химических элементов в рядах не пригодна для числового шифрования Периодического Закона.
3. Двумерная числовая таблица 8 × 15
Здесь также 120 чисел. Но 8-ми разрядный «октавный Закон» Ньюлендса был математическим законом Периодической Таблицы химических элементов до 1989 года. Поэтому и мы будем ожидать высокой периодичности во множестве химических элементов в таблице 8 × 15. На рисунке ниже представлена таблица 8 × 15 химических элементов.
На рисунке ниже представлена таблица 8 × 15 химических элементов.
Рис. 7. Таблица 8 × 15 химических элементов
Повторяющихся строк 9 из 15 или 72 химических элемента из 118. Это составляет 61 %. Действительно большой процент периодизуемости. Но до 100 % далеко.
Если первые 1–4 химических элемента вынести за пределы таблицы, то получим:
Рис. 8. Таблица 8 × 15 с вынесенными за пределы таблицы первыми 1–4 химическими элементами
Здесь мы имеем 11 периодизирующихся рядов, т. е. 88 из 118 химических элементов. Это составляет около 74,6 %, что выше предыдущего случая на 13,6 %. Хорошая периодизируемость, но также далека от 100 процентной.
4. Двумерная числовая таблица 16 × 8
16-разрядную таблицу рассматриваем в связи с тем, что она кратна 8-ми разрядной таблице, а на 8-ми разрядной таблице достигли максимальной периодичности в 74,6 %. В этом случае в таблице 128 числовых элементов. Таблица химических элементов для этого случая:
Рис. 9. Таблица 16 × 8 химических элементов
9. Таблица 16 × 8 химических элементов
Элементы 121–128 относятся к следующему за f-бло-ком g-блоку ожидаемых химических элементов. Но их пока нет. Поэтому химических элементов и в этом случае только 118. В такой таблице имеются 4 периодизи-рующихся рядов, и в них 64 химических элемента. Они составляют примерно 54,23 %. Это намного меньше максимального 74,6 %. Уменьшать или повышать далее разрядность таблиц смысла не имеет. Мы получили весь диапазон «хорошей» периодизируемости химических элементов. К искомому результату – 100 %-му охвату всех химических элементов не подошли и близко.
Вывод: разрядность чисел не может служить основой систематизации химических элементов. Следует искать другие закономерности.
Таблица Менделеева – периодическая система элементов
Сложно ли было Менделееву создать собственную таблицу? Почему именно она прошла испытание временем и располагается на данный момент у людей? Сложно ли читать по ней что-либо об элементе?
Каждому школьнику, перешедшему порог восьмого класса понятие «Периодическая система химических элементов» («Таблица Менделеева») становится понятным даже при упоминании первого слова. Созданная величайшим Дмитрием Ивановичем Менделеевым, она очень хорошо помогает людям, работающим в химической сфере. Даже нет, не так. Это основное, чем они пользуются при проведении собственных опытов.
Созданная величайшим Дмитрием Ивановичем Менделеевым, она очень хорошо помогает людям, работающим в химической сфере. Даже нет, не так. Это основное, чем они пользуются при проведении собственных опытов.
Периодическая система элементов
Каждому, наверное, известно, как она появилась. Однажды Дмитрий Иванович засыпал в собственной кровати, думая над тем, как же можно классифицировать все известные на тот момент химические элементы. По отдельным группам? Нет, тогда их будет слишком много. Может, по каким-то свойствам? А что тогда делать с теми, у кого их несколько и они входят сразу в несколько сфер? Может, тогда по каким-то признакам, которые они проявляют при соединении с чем-нибудь? Нет, тоже не то. Может же встретиться что-то такое, что обязательно не будет ни с чем контактировать. И что тогда? Выкидывать?
Менделеев Дмитрий ИвановичНо долго мучиться мужчине не пришлось. Во сне к нему пришла полная периодическая таблица химических элементов, которая на данный момент украшает стены очень многих кабинетов химии в школах. Конечно, всё было не так уж и просто, да и сам Менделеев высказался по этому поводу таким образом, что никакое глобальное изобретение не приходит по щелчку пальцев. Можно ли тогда считать его систему одним из самых великих изобретений? Но почему именно она, да и вообще, по какому принципу, в каком порядке там поставлены все элементы?
Конечно, всё было не так уж и просто, да и сам Менделеев высказался по этому поводу таким образом, что никакое глобальное изобретение не приходит по щелчку пальцев. Можно ли тогда считать его систему одним из самых великих изобретений? Но почему именно она, да и вообще, по какому принципу, в каком порядке там поставлены все элементы?
Менделеев Дмитрий Иванович — был 17 ребёнком в семье
Как пользоваться Таблицей Менделеева
Честно говоря, в первый раз смотря на таблицу, невозможно её прочитать. Почему где-то есть пропуски, а где-то целые десятки элементов входят в одну ячейку? По какому принципу летучие вещества были расположены в конце группы, в то время как те, у которых более выражены металлические свойства, располагаются ближе к началу? На большую часть этих вопросов отвечают уроки химии, на которых учитель тратит огромное время на обучение детей прочтению таблицы Менделеева. Но, если в памяти это не отложилось, или что-то осталось непонятным — не беда, всё не так уж и сложно.
Наверное, многие успели заметить то, что все элементы расположены по порядку, а у каждого есть свой собственный номер. Именно он характеризует количество протонов в ядре, а также количество электронов, движущихся вокруг него. Чем оно больше – тем больше уровней, так называемых, «орбиталей», по которым они в состоянии передвигаться.
Следующее, на что обращается внимание – иногда даже огромное число внизу. Это относительная атомная масса элемента, характеризующая, сколько будет весить один его моль. Как правило, она измеряется в граммах на моль, поэтому нетрудно предположить, насколько же легка. Как правило, кстати, это усреднённое значение, поэтому записывается с числами после запятой. Исключения составляют лишь элементы, стоящие в седьмом периоде, то есть, радиоактивные.
Иногда также сбоку подписываются несколько чисел, которые в сумме дают порядковый номер. Это не случайно. Это расположение электронов по тем самым орбиталям, о которых ранее шла речь. Это довольно-таки удобно для использования в будущем, но, к сожалению, не всегда присутствует.
Это довольно-таки удобно для использования в будущем, но, к сожалению, не всегда присутствует.
Самое главное же, что осталось на конец, – это группы и периоды в данной таблице. Столбики и строчки, простыми словами. Это один из самых важных моментов, характеризующий элементы в таблице Менделеева. Чтобы проще запомнить, стоит понять, что в группе, как правило, расположены элементы со сходными химическими свойствами, в то время, как в периоде они изменяются.
Период, как правило, совпадает с валентной оболочкой элемента. Как правило, чем правее вещество расположено, тем более выражены его металлические (восстановительные) свойства, в то время как в левой части больший акцент делается на окислительных.
Таблица Менделеева в цветеГруппа же, в свою очередь, это валентность элемента. Это число электронов, которые могут вступать в сложные химические связи. Но не стоит сразу же бежать писать и уравнивать соединения, в которых «неправильно» поставлены индексы. На самом же деле, валентность не всегда совпадает с номером группы. Но не стоит сомневаться в первых трёх – там всё более, чем нормально.
Но не стоит сомневаться в первых трёх – там всё более, чем нормально.
2018 в Дании был введен запрет на изучение таблицы Менделеева. В министерстве иностранных дел посчитали, что «русские используют Периодическую систему в качестве пиара интеллектуальных достижений России». А также она опасна для детей.
Таким образом, несложно понять, что таблица Менделеева – очень полезная вещь в химии, без которой невозможно было бы выполнять огромного количества действий. А сама её история создания просто завораживает дух!
Полная таблица растворимости всех элементов
Таблица Менделеева является фундаментом нашего современного знания о химии.
- Сколько элементов в таблице Менделеева?
- Классический вид периодической таблицы Менделеева
- Таблица Менделеева для ЕГЭ по химии
- Периодический закон Менделеева
Ответ: 118 или 126 элементов в зависимости от вида таблицы.
Почему такая разница?
В природе люди обнаружили 94 элемента. Другие 24 элемента были созданы в лабораториях. Всего получается 118 штук. Еще 8 элементов являются лишь гипотетическими вариантами.
Классический вид периодической таблицы Менделеева Таблица Менделеева для ЕГЭ по химииНиже приведена таблица, которую можно использовать на ЕГЭ по химии, входит в пакет разрешенных документов.
Периодический закон МенделееваСуществуют две формулировки периодического закона химических элементов: классическая и современная.
Классическая, в изложении его первооткрывателя Д.И. Менделеева:
«Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов».
Современная:
«Свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера)».
Таблица растворимости солей, кислот и оснований – фундамент, без которого невозможно полноценное освоение химических знаний. Растворимость оснований и солей помогает в обучении не только школьникам, но и профессиональным людям. Создание многих продуктов жизнедеятельности не может обойтись без данных знаний.
Таблица растворимости кислот, солей и оснований в воде
Таблица растворимости солей и оснований в воде – это пособие, которое помогает в освоении химических основ. Разобраться с представленной ниже таблицей помогут следующие примечания.
- Р – указывает на растворимое вещество;
- Н – не растворимое вещество;
- М – вещество мало растворяется в водной среде;
- РК – вещество способно растворятся только при воздействии сильных органических кислот;
- Прочерк будет говорить о том, что такого существа не существует в природе;
- НК – не растворяется ни в кислотах, ни в воде;
- ? – вопросительный знак говорит о том, что на сегодняшний день нет точных сведений о растворении вещества.

Зачастую таблицу используют химики и школьники, студенты для проведения лабораторных исследований, в ходе которых необходимо установить условия протекания определённых реакций. По таблице получается обнаружить, как поведёт себя вещество в соляной или кислотной среде, возможно ли появление осадка. Осадок при проведении исследований и опытов говорит о необратимости реакции. Это существенный момент, который может повлиять на ходе всей лабораторной работы.
Таблица Менделеева является одним из величайших открытий человечества, позволившим упорядочить знания об окружающем мире и открыть новые химические элементы . Она является необходимой для школьников, а так же для всех, кто интересуется химией. Кроме того, данная схема является незаменимой и в других областях науки.
Данная схема содержит все известные человеку элементы, причем они группируются в зависимости от
 Первая группа содержит водород, литий, калий, медь, латинское произношение на русском которой купрум. А так же аргентум — серебро, цезий, золото — аурум и франций. Во второй группе расположены бериллий, магний, кальций, цинк, за ними идут стронций, кадмий, барий, заканчивается группа ртутью и радием.
Первая группа содержит водород, литий, калий, медь, латинское произношение на русском которой купрум. А так же аргентум — серебро, цезий, золото — аурум и франций. Во второй группе расположены бериллий, магний, кальций, цинк, за ними идут стронций, кадмий, барий, заканчивается группа ртутью и радием.В состав третьей группы вошли бор, алюминий, скандий, галлий, потом следуют иттрий, индий, лантан, завершается группа таллием и актинием. Четвертая группа начинается с углерода, кремния, титана, продолжается германием, цирконием, оловом и завершается гафнием, свинцом и резерфордием. В пятой группе имеются такие элементы, как азот, фосфор, ванадий, ниже расположены мышьяк, ниобий, сурьма, потом идут тантал висмут и завершает группу дубний. Шестая начинается с кислорода, за которым лежат сера, хром, селен, потом следуют молибден, теллур, далее вольфрам, полоний и сиборгий.
В седьмой группе первый элемент – фтор, потом следует хлор, марганец, бром, технеций, за ним находится йод, потом рений, астат и борий.
Данная схема включает в себя все виды элементов, которые делятся на 2 большие группы –
 Существуют специальные картинки и фото, на которых можно детально ознакомиться с положением этих элементов. Стоит отметить, что те элементы, которые находятся на этой линии, проявляют одинаково свойства и металлов и неметаллов.
Существуют специальные картинки и фото, на которых можно детально ознакомиться с положением этих элементов. Стоит отметить, что те элементы, которые находятся на этой линии, проявляют одинаково свойства и металлов и неметаллов.Отдельный список составляют и амфотерные элементы, которые обладают двойственными свойствами и могут образовывать в результате реакций 2 вида соединений. При этом у них проявляются одинаково как основные, так и кислотные свойства . Преобладание тех или иных свойств зависит от условий реакции и веществ, с которыми амфотерный элемент реагирует.
Стоит отметить, что данная схема в традиционном исполнении хорошего качества является цветной. При этом разными цветами для удобства ориентирования обозначаются
Однако в настоящее время наряду с цветной схемой очень распространенной является периодическая таблица Менделеева черно белая.
 Такой ее вид используется для черно-белой печати. Несмотря на кажущуюся сложность, работать с ней так же удобно, если учесть некоторые нюансы. Так, отличить главную подгруппу от побочной в таком случае можно по отличиям в оттенках, которые хорошо заметны. К тому же в цветном варианте элементы с наличием электронов на разных слоях обозначаются
Такой ее вид используется для черно-белой печати. Несмотря на кажущуюся сложность, работать с ней так же удобно, если учесть некоторые нюансы. Так, отличить главную подгруппу от побочной в таком случае можно по отличиям в оттенках, которые хорошо заметны. К тому же в цветном варианте элементы с наличием электронов на разных слоях обозначаются Стоит отметить, что в одноцветном исполнении ориентироваться по схеме не очень трудно. Для этого будет достаточно информации, указанной в каждой отдельной клеточке элемента.
Егэ сегодня является основным видом испытания по окончанию школы, а значит, подготовке к нему необходимо уделять особое внимание. Поэтому при выборе итогового экзамена по химии , необходимо обратить внимание на материалы, которые могут помочь в его сдаче. Как правило, школьникам на экзамене разрешено пользоваться некоторыми таблицами, в частности, таблицей Менделеева в хорошем качестве. Поэтому, чтобы она принесла на испытаниях только пользу, следует заблаговременно уделить внимание ее строению и изучению свойств элементов, а так же их последовательности.
Помимо основной таблицы, характеризующей свойства элементов и их зависимость от атомной массы, существуют и другие схемы, которые могут оказать помощь при изучении химии. Например, существуют таблицы растворимости и электроотрицательности веществ . По первой можно определить, насколько растворимо то или иное соединение в воде при обычной температуре. При этом по горизонтали располагаются анионы – отрицательно заряженные ионы, а по вертикали – катионы, то есть положительно заряженные ионы. Чтобы узнать
Если это буква «р», то вещество полностью растворимо в воде в нормальных условиях. При наличии буквы «м» — вещество малорастворимое, а при наличии буквы «н» — оно почти не растворяется. Если стоит знак «+», — соединение не образует осадок и без остатка реагирует с растворителем. Если присутствует знак «-», это означает, что такого вещества не существует. Иногда так же в таблице можно увидеть знак «?», тогда это обозначает, что степень растворимости этого соединения доподлинно не известна. Электроотрицательность элементов может варьироваться от 1 до 8, для определения этого параметра так же существует специальная таблица.
Если стоит знак «+», — соединение не образует осадок и без остатка реагирует с растворителем. Если присутствует знак «-», это означает, что такого вещества не существует. Иногда так же в таблице можно увидеть знак «?», тогда это обозначает, что степень растворимости этого соединения доподлинно не известна. Электроотрицательность элементов может варьироваться от 1 до 8, для определения этого параметра так же существует специальная таблица.
Еще одна полезная таблица – ряд активности металлов. В нем располагаются все металлы по увеличении степени электрохимического потенциала. Начинается ряд напряжения металлов с лития, заканчивается золотом. Считается, что чем левее занимает место в данном ряду металл, тем он более активен в химических реакциях. Таким образом, самым активным металлом считается металл щелочного типа литий. В списке элементов ближе к концу так же присутствует водород. Считается, что металлы, которые расположены после него, являются практически неактивными. Среди них такие элементы, как медь, ртуть, серебро, платина и золото.
Среди них такие элементы, как медь, ртуть, серебро, платина и золото.
Таблица Менделеева картинки в хорошем качестве
Данная схема является одним из крупнейших достижений в области химии. При этом существует немало видов этой таблицы – короткий вариант, длинный, а так же сверхдлинный. Самой распространенной является короткая таблица, так же часто встречается и длинная версия схемы. Стоит отметить, что короткая версия схемы в настоящее время не рекомендуется ИЮПАК для использования.
Всего было разработано больше сотни видов таблицы , отличающихся представлением, формой и графическим представлением. Они используются в разных областях науки, либо совсем не применяются. В настоящее время новые конфигурации схемы продолжают разрабатываться исследователями. В качестве основного варианта используется либо короткая, либо длинная схема в отличном качестве.
Завершение периодической таблицы Менделеева
Автор Роберт М. Хейзен, доктор философии. , Университет Джорджа Мейсона
, Университет Джорджа МейсонаДмитрий
Менделеев поместил наиболее однозначные группы сходных элементов в вертикальные столбцы периодической таблицы. Он расположил элементы слева направо и сверху вниз, увеличивая вес. Таким образом, у него было расположение бок о бок и сверху вниз в зависимости от веса. Ученые с готовностью приняли концепцию периодической таблицы не только потому, что она систематизировала многое из того, что было известно, но и потому, что она сделала очень конкретные проверяемые предсказания о том, что было неизвестно. Каждый столбец периодической таблицы содержит элементы со схожими свойствами. (Изображение: Марина Яковчук/Shutterstock)Составление периодической таблицы
Чтобы составить периодическую таблицу, Дмитрий Менделеев поместил литий, натрий, калий и рубидий в одну колонку. Бериллий, магний, кальций и барий находятся в другой колонке. Хлор, бром, йод будут в третьей колонке и так далее. Таким образом, натрий был рядом с магнием, калий был рядом с кальцием и так далее. Он также оставил места для элементов, которые, казалось, отсутствовали.
Таким образом, натрий был рядом с магнием, калий был рядом с кальцием и так далее. Он также оставил места для элементов, которые, казалось, отсутствовали.
В четвертом ряду между кальцием и титаном находился один явно отсутствующий элемент: это скандий, элемент 21. Он был открыт в 1876 году, как и предсказывал Менделеев. Другой разрыв, по-видимому, возник в столбце, возглавляемом углеродом. Элемент под ним — кремний, а над оловом — пустое место. Германий, элемент 32, был открыт в 1886 году и заполнил этот пробел. Новые элементы продолжали заполнять и расширять периодическую таблицу.
Это стенограмма из серии видео Радость науки . Смотрите прямо сейчас на Wondrium.
Новые методы обнаружения недостающих элементов
Спектроскопия пламени использовалась для обнаружения многих тяжелых элементов. (Изображение: Rabbitmindphoto/Shutterstock) В течение более десяти лет между 1863 и 1875 годами не было обнаружено ни одного нового элемента. Старая техника электролиза была доведена до предела. Анализ паяльной трубки больше не был эффективен для поиска новых элементов.
Старая техника электролиза была доведена до предела. Анализ паяльной трубки больше не был эффективен для поиска новых элементов.
Именно развитие пламенной спектроскопии, с помощью которой элементы можно было идентифицировать по характерному спектру ярких линий, когда они были нагреты до свечения накаливания, вызвало новую волну открытий элементов в середине 1870-х – 1890 с.
Каждый новый элемент можно было узнать по его уникальному отпечатку, когда он светился. Напомним, что у каждого элемента есть свои отличительные отдельные электронные энергетические уровни. Таким образом, каждый элемент, когда он нагревается до высокой температуры, имеет свой уникальный набор длин волн, которые излучаются, когда электроны нагреваются и возвращаются обратно.
И их можно использовать в качестве характерного линейчатого спектра для распознавания новых элементов. Более двух десятков редких элементов, с 57-го по 71-й, были открыты таким образом в конце XIX в.-й -й век. Эти тяжелые элементы химически настолько похожи, что всегда встречались вместе в минералах в естественном мире. Все они имеют очень похожие химические свойства, но их можно различить и выделить с помощью пламенной фотометрии.
Эти тяжелые элементы химически настолько похожи, что всегда встречались вместе в минералах в естественном мире. Все они имеют очень похожие химические свойства, но их можно различить и выделить с помощью пламенной фотометрии.
Уильям Рамзи и открытие инертных газов
Между 1895 и 1898 годами были открыты многие инертные газы. И эти открытия были сделаны шотландским химиком Уильямом Рамзаем, жившим с 1852 по 1916 год. Он использовал спектроскопию для идентификации пяти таких инертных газов. Иногда их называют благородными газами. Это элементы, которые настолько нереактивны, что ни к чему не привязываются.
В природе они встречались только в виде изолированных атомов газа. Таблица Менделеева предсказала, что это будут элементы 2, 10 и 18. Сейчас они известны как гелий, неон и аргон. Эти ранее неразделенные элементы добавили в периодическую таблицу целый новый столбец, и этот столбец также был дополнен криптоном и ксеноном, которые являются частью этих групп. Рамзи, кстати, получил Нобелевскую премию и множество других наград за эту работу по добавлению в таблицу Менделеева целой новой колонки.
Узнайте больше о фазовых превращениях и химических реакциях.
Попытки выделения фтора
Периодическая таблица Менделеева была неполной и в других отношениях. Он должен был включить элемент фтор, который, как было хорошо известно, является основным компонентом многих распространенных минералов, особенно фторида кальция, минерала флюорита. Тем не менее, никому не удавалось выделить фтор, и эта попытка стала серьезной проблемой в конце 19 -го -го века — попытка выделить элемент фтор, чтобы показать, какими могут быть свойства фтора.
Таблица Менделеева дала исследователям несколько полезных подсказок. Фтор находился в верхней части колонны, содержащей хлор, бром и йод. Все это чрезвычайно реакционноспособные неметаллы, и их можно получить путем электролиза соединений натрия или кальция. Периодические свойства предполагают, что для фтора потребуется чрезвычайно высокое напряжение. Это было бы чрезвычайно реакционноспособно — очень, очень опасное вещество.
Так получилось, что ранние попытки выделить фтор с помощью электрического тока оказались катастрофическими. Они причинили травмы и смерть многим химикам. Сильные батареи действительно могли отделить фтор от кальция. Например, с помощью фторида кальция, минерала флюорита, можно отделить фтор. Но газ оказывается настолько реактивным, что почти сразу атакует и разрушает ткани.
Узнайте больше о свойствах материалов.
Анри Муассан
Анри Муассан успешно выделил газообразный фтор. (Изображение: Bibliothèque interuniversitaire de Santé, License Ouverte/Public domain)Таким образом, выделение фтора стало серьезной проблемой в конце 19 -го -го века. В 1886 году французский химик Анри Муассан успешно выделил этот элемент после почти трех лет усилий. Он пропускал сильный электрический ток через раствор солей фтора, как это делали его предшественники. И действительно, газообразный фтор запузырился.
Но он сделал по-другому, он построил весь свой аппарат из флюорита, который, вероятно, является единственным веществом, которое будет содержать газообразный фтор, потому что он уже полностью насыщен фтором. За эту работу он получил Нобелевскую премию. И даже несмотря на то, что он был в состоянии сделать это, он сказал, что эта успешная попытка выделения фтора, вероятно, отняла у него 10 лет жизни. Это была большая химическая задача, но люди, которые справились с ней, действительно заплатили свою цену.
За эту работу он получил Нобелевскую премию. И даже несмотря на то, что он был в состоянии сделать это, он сказал, что эта успешная попытка выделения фтора, вероятно, отняла у него 10 лет жизни. Это была большая химическая задача, но люди, которые справились с ней, действительно заплатили свою цену.
Общие вопросы о заполнении периодической таблицы Менделеева
В: Как были открыты элементы 57-71 в периодической таблице?
В конце 19 -го -го века было открыто более двух десятков редких элементов с 57-го по 71-й в таблице Менделеева. Все они имеют очень похожие химические свойства, и их можно различить и выделить с помощью пламенной фотометрии. Каждый элемент имеет отчетливый спектр ярких линий, по которому он идентифицируется.
В: Почему первые попытки выделения фтора оказались безуспешными?
Газообразный фтор очень реакционноспособен, и ранние попытки выделить фтор с помощью электрического тока оказались катастрофическими. Это привело к травмам и смерти многих химиков.
Это привело к травмам и смерти многих химиков.
В: Кем был Анри Муассан?
Анри Муассан был французским химиком, который, наконец, смог безопасно выделить элемент фтор и заполнить пробел в периодической таблице. Для этого он пропускал сильный электрический ток через раствор соли фтора, чтобы высвободить газ. Чтобы фтор не вступал в реакцию, он сделал весь свой аппарат из флюорита.
Продолжайте читать
Последствия второго закона термодинамики
Понимание энтропии с точки зрения энергии
Понятие энтропии
Периодические таблицы Менделеева | Feature
В этой второй праздничной статье о Менделееве мы видим, как он скорректировал атомные веса In, Ce и U и таким образом построил замечательную Периодическую таблицу 1871 года. формы его периодической таблицы
Источник: Гордон Вудс
Гигантская Периодическая таблица на стене Бюро мер и весов в Санкт-Петербурге
Важно то, что Таблицы Менделеева 1869 и 1871 годов совершенно разные по внешнему виду. 1 На рисунке 1 показана его Таблица 1869 г.. Элементы упорядочены по атомному весу с «группами», расположенными горизонтально, , например, Li, Na, K, Rb и Cs. Н стоит один. Элементы In, Ce и Ur расположены в соответствии с их неправильным атомным весом; и есть пробелы для еще не открытых элементов с атомным весом 45, 68 и 70. Здесь Менделеев уверен. Но у него проблемы с тяжелыми металлами. Hg и Au расположены неправильно, как и Tl и Pb. Именно устойчивые степени окисления +1 и +2 этих последних двух элементов побудили его поставить их ниже Cs и Ba соответственно.
1 На рисунке 1 показана его Таблица 1869 г.. Элементы упорядочены по атомному весу с «группами», расположенными горизонтально, , например, Li, Na, K, Rb и Cs. Н стоит один. Элементы In, Ce и Ur расположены в соответствии с их неправильным атомным весом; и есть пробелы для еще не открытых элементов с атомным весом 45, 68 и 70. Здесь Менделеев уверен. Но у него проблемы с тяжелыми металлами. Hg и Au расположены неправильно, как и Tl и Pb. Именно устойчивые степени окисления +1 и +2 этих последних двух элементов побудили его поставить их ниже Cs и Ba соответственно.
Изменение макета
К 1871 г. макет изменился на вертикальные группы, а элементы In, Ce и U находятся в исправленном положении. 2 (см. рис. 2 ). Есть пробелы для элементов с атомным весом 44, 68, 72 и 100 (в 1940 году стал технецием). Теперь вертикальные группы содержат два семейства, связанных общей степенью окисления, , например , группа II — Be, Mg, Zn, Cd и Hg, а также Ca, Sr и Ba. Это отличается от аранжировки 1869 г.где семейство Be to Cd удалено от Ca до Ba. Мы также замечаем, что элементы Cu, Ag и Au дублируются в Группе I и Группе VIII, заключенные в скобки в Группе I. Hg теперь правильно размещена ниже Cd, а Au ниже Ag. Атомные массы Os и Ir отмечены знаком «?». Химически они правильно размещены ниже Ru и Rh – вызывает сомнение именно их атомный вес.
Это отличается от аранжировки 1869 г.где семейство Be to Cd удалено от Ca до Ba. Мы также замечаем, что элементы Cu, Ag и Au дублируются в Группе I и Группе VIII, заключенные в скобки в Группе I. Hg теперь правильно размещена ниже Cd, а Au ниже Ag. Атомные массы Os и Ir отмечены знаком «?». Химически они правильно размещены ниже Ru и Rh – вызывает сомнение именно их атомный вес.
Рисунок 1 – Таблица 1869 года
Точно так же Te (128?) беспокоит Менделеева. Он настаивает на том, что 128 слишком велико, а атомный вес должен быть меньше и его следует определить заново. В данном случае он ошибся. Водород, H, по-прежнему одинок, хотя и находится на вершине группы I. Это основная структура краткой формы Периодической таблицы, которая широко использовалась до 19 века.40-х годов, когда стала популярной средняя/длинная форма.
К 1886 году были обнаружены три недостающих элемента Sc, Ga и Ge, а инертные газы были выделены в 1890-х годах. Теперь периодическая система показала свою мощь и гибкость. Это позволило включить эти новые загадочные газообразные элементы в группу 0, после группы VII, галогенов, и перед группой I. Это показано на рис. 3 , таблице из учебника Менделеева 1905 г. 3
Это позволило включить эти новые загадочные газообразные элементы в группу 0, после группы VII, галогенов, и перед группой I. Это показано на рис. 3 , таблице из учебника Менделеева 1905 г. 3
Группа инертных газов красиво отделена слева. Существует четко определенный пробел для элемента с атомным весом 99 и ряд пробелов для элементов, которые в конечном итоге станут лантаноидами. (Менделеев в сноске к этой таблице отмечает трудности, с которыми он сталкивается при размещении тех немногих, которые были однозначно идентифицированы.) Радиоактивные элементы Rd, Th и U размещены правильно, с промежутками для отсутствующих элементов в горизонтальном ряду 12. Cu, Ag и Au по-прежнему дублируются. Чувство полной уверенности ощущается вплоть до 8-го ряда и снова для ряда от Au до Bi в 11-м ряду. Однако Менделеев также предлагает таблицу «Группы по горизонтали», показанную как 9.0022 Рис. 4 .
Рисунок 2. Таблица 1871 года
Здесь мы видим дублирование газов группы 0 сверху и снизу.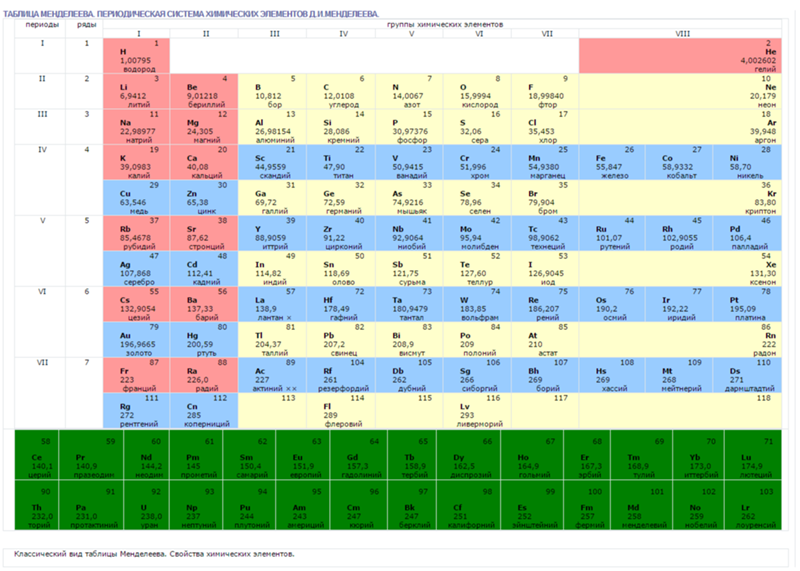 Атомные веса в каждом вертикальном столбце увеличиваются вниз, и если таблицу повернуть на 90 градусов, она очень похожа на типичную таблицу после 1950 года, за исключением того, что атомные веса теперь увеличиваются справа налево, , например, ряд Ar, K, Ca до Se, Br и Kr. Такое расположение с непрерывным рядом в столбце делает очевидным, что ряд от Os до Bi связан с Ru до Sb и от Fe до As. Fe, Co, Ni головная группа VIII (опечатка VII). От He до Ne и от Ne до Ar помечены как «Типичные элементы». Вот две аранжировки, которые кажутся совершенно отличными от первооткрывателя Периодического Закона, но обе следуют Системе. 4
Атомные веса в каждом вертикальном столбце увеличиваются вниз, и если таблицу повернуть на 90 градусов, она очень похожа на типичную таблицу после 1950 года, за исключением того, что атомные веса теперь увеличиваются справа налево, , например, ряд Ar, K, Ca до Se, Br и Kr. Такое расположение с непрерывным рядом в столбце делает очевидным, что ряд от Os до Bi связан с Ru до Sb и от Fe до As. Fe, Co, Ni головная группа VIII (опечатка VII). От He до Ne и от Ne до Ar помечены как «Типичные элементы». Вот две аранжировки, которые кажутся совершенно отличными от первооткрывателя Периодического Закона, но обе следуют Системе. 4
Дилемма Менделеева
При более внимательном рассмотрении таблицы на рис. 4 видно, что Ar = 38 имеет верхний индекс, а также Ni = 59 и J (йод) = 127. В сопроводительном тексте Менделеева говорит, что эти цифры должны быть правильными атомными весами, чтобы соответствовать Системе, потому что эти элементы должны подчиняться периодическому закону.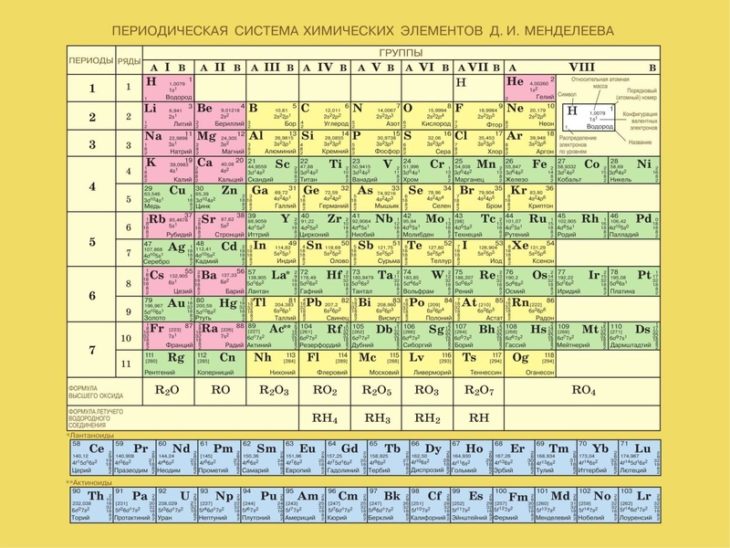 Перед ним стоит серьезная философская проблема, и он стоит перед научной дилеммой. На самом деле атомные веса (которые он не принимает) были точно определены и показали, что порядок Ar/K, Co/Ni, Te/J должен быть обратным (!) вопреки любым химическим критериям. Только с открытием атомного числа, нейтрона и изотопов (много лет спустя после смерти Менделеева) эта трудность была преодолена.
Перед ним стоит серьезная философская проблема, и он стоит перед научной дилеммой. На самом деле атомные веса (которые он не принимает) были точно определены и показали, что порядок Ar/K, Co/Ni, Te/J должен быть обратным (!) вопреки любым химическим критериям. Только с открытием атомного числа, нейтрона и изотопов (много лет спустя после смерти Менделеева) эта трудность была преодолена.
Пронумерованные ряды в Рис. 3 (и на Памятной Таблице в Санкт-Петербурге) именно таковы – ряды, русский термин ряды . Нумерация Периодов в нашей текущей Периодической таблице основана на главном квантовом числе n и принята на международном уровне. Этого не существовало, когда Менделеев выбирал себе ярлыки. Его ряды ( ряды ) 6 и 7 (в рис. 3 и Петербургской таблице) соответствуют сегодняшнему 5-му периоду, за исключением включенного Кр и опущенного Хе. В 1871 ( Рис. 2 ) он использовал термин «Типичные элементы» для линии от Li до F и второго периода (ряды 3 и 4) для (Cu) до Br, Rb до Ag, с нашими группами 7 и 1 в середине ряда. . Это использование периода исчезло из таблиц 1905 и 1934 годов.
. Это использование периода исчезло из таблиц 1905 и 1934 годов.
Рис. 3. Версия Таблицы 1905 г. Рис. 3 ), но были добавлены новые радиоактивные элементы Po, Rn, Ac, Pa, а также лантаноиды (они все еще создают проблемы, куда их поместить). 5 H стоит особняком, и до сих пор ведутся споры о том, где разместить этот элемент. Интересна небольшая деталь: обратите внимание, как заглавная буква J используется вместо заглавной I для обозначения йода, Jn — это индий, а Jr — иридий. J означает иллиний, позже выяснилось, что он ложный. Вместо заглавной I используется заглавная J. Это сделано потому, что в шрифте без засечек, используемом для букв в этой таблице, заглавная I и строчная l почти неразличимы. На немецком языке йод обозначается буквой J; зовут йод. Кроме того, идеальные формулы для оксидов и гидридов имеют надстрочные числа 9.0022, например R 2 O 5 и RH 3 для группы V. Это более правильные индексы в таблице 1905 г. (а также в таблице 1871 г.). Заметьте также, что нет ни атомных весов, ни атомных номеров.
(а также в таблице 1871 г.). Заметьте также, что нет ни атомных весов, ни атомных номеров.
Много Таблиц, но одна Система
Нельзя быть зашоренным и верить, что существует только одна совершенная Периодическая Таблица. Это неправда. Существует множество способов расположения элементов для получения таблиц разного вида 6-8 – но все расположения должны подчиняться Системе химически сходных элементов, расположенных рядом, либо по вертикали, либо по горизонтали. Менделеев показывает это достаточно ясно, см. рис. 3 и рис. 4 . Его вполне устраивали обе эти альтернативные аранжировки, иначе он не опубликовал бы их в своей книге.
Рис. 4. Версия «Группы по горизонтали», 1905 г.
На самом деле существуют два черновых варианта его первой «Системы Элементов». 9 В одном элементы упорядочены по возрастанию атомного веса вверх, а во втором – по возрастанию атомного веса
вниз ( Рис. 5 ). Этот черновик рукописи в конечном итоге стал в 1869 году его первой опубликованной Периодической таблицей.
5 ). Этот черновик рукописи в конечном итоге стал в 1869 году его первой опубликованной Периодической таблицей.
Источник: Gordon Woods/RSC
. С ним можно связаться по адресу: 61 Baines Road, Durban 4001, Южно-Африканская Республика (электронная почта: [email protected]).
Санкт-Петербург | Карта, достопримечательности и история
Сводка
Прочтите краткий обзор этой темы
Санкт-Петербург , Россия Санкт-Петербург , ранее (1914–24) Петроград и (1924–91) Ленинград , город и порт, крайний северо-запад России. Крупный исторический и культурный центр и важный порт, Санкт-Петербург находится примерно в 400 милях (640 км) к северо-западу от Москвы и всего в 7° к югу от Полярного круга. Это второй по величине город России и один из крупнейших городов мира. Санкт-Петербург играл жизненно важную роль в истории России с момента своего основания в 1703 году. В течение двух столетий (1712–1919 гг.)18) это была столица Российской империи. Город запомнился как место проведения Февральской (Мартовской, по новому стилю) и Октябрьской (ноябрьской, по новому стилю) революций 1917 года, а также его ожесточенной обороной во время осады во время Второй мировой войны. С архитектурной точки зрения он считается одним из самых роскошных и близких по духу городов Европы. Его исторический район был внесен в список Всемирного наследия ЮНЕСКО в 1990 году. Площадь города составляет 550 квадратных миль (1400 квадратных километров). Поп. (2010) 4 879 566; (оценка 2012 г.) 4 953 219.
В течение двух столетий (1712–1919 гг.)18) это была столица Российской империи. Город запомнился как место проведения Февральской (Мартовской, по новому стилю) и Октябрьской (ноябрьской, по новому стилю) революций 1917 года, а также его ожесточенной обороной во время осады во время Второй мировой войны. С архитектурной точки зрения он считается одним из самых роскошных и близких по духу городов Европы. Его исторический район был внесен в список Всемирного наследия ЮНЕСКО в 1990 году. Площадь города составляет 550 квадратных миль (1400 квадратных километров). Поп. (2010) 4 879 566; (оценка 2012 г.) 4 953 219.
Характер города
Санкт-Петербург – мекка культурных, исторических и архитектурных памятников. Основанный царем Петром I (Великим) как российское «окно в Европу», он носит неофициальный статус культурной столицы России и самого европейского города, и этот статус он стремится сохранить в своем вечном соперничестве с Москвой. Привлекают внимание три отличительные черты Санкт-Петербурга. Во-первых, это гармоничное сочетание в городе западноевропейской и русской архитектуры. Во-вторых, в Санкт-Петербурге отсутствует однозначный центр города, который в других русских городах средневекового происхождения определяется Кремлем и его окрестностями. Третьей характерной чертой города является множество водных путей. Короткие, но полноводные притоки и каналы Невы, тянущиеся к побережью Балтийского моря, неотделимы от петербургской панорамы. Многие из самых известных архитектурных объектов города тянутся вдоль исторических набережных Невы. Более того, мосты и естественные каналы реки принесли Санкт-Петербургу прозвище «Северная Венеция». Из-за северного расположения Санкт-Петербурга в городе царят «белые ночи» с 11 июня по 2 июля, когда световой день длится почти до 19 часов.часов — еще одна из самых известных характеристик Санкт-Петербурга. Среди культурных мероприятий, посвященных празднованию Белых ночей, – фестивали, организованные Мариинским и Эрмитажным театрами, Санкт-Петербургской государственной консерваторией им.
Во-первых, это гармоничное сочетание в городе западноевропейской и русской архитектуры. Во-вторых, в Санкт-Петербурге отсутствует однозначный центр города, который в других русских городах средневекового происхождения определяется Кремлем и его окрестностями. Третьей характерной чертой города является множество водных путей. Короткие, но полноводные притоки и каналы Невы, тянущиеся к побережью Балтийского моря, неотделимы от петербургской панорамы. Многие из самых известных архитектурных объектов города тянутся вдоль исторических набережных Невы. Более того, мосты и естественные каналы реки принесли Санкт-Петербургу прозвище «Северная Венеция». Из-за северного расположения Санкт-Петербурга в городе царят «белые ночи» с 11 июня по 2 июля, когда световой день длится почти до 19 часов.часов — еще одна из самых известных характеристик Санкт-Петербурга. Среди культурных мероприятий, посвященных празднованию Белых ночей, – фестивали, организованные Мариинским и Эрмитажным театрами, Санкт-Петербургской государственной консерваторией им. Римского-Корсакова. Каждую ночь во время белых ночей мосты через Неву разводят, чтобы пропустить судно. После распада Советского Союза Санкт-Петербург впитал в себя новую энергию: обветшавшие фасады, дороги с выбоинами и культурные достопримечательности были отремонтированы.
Римского-Корсакова. Каждую ночь во время белых ночей мосты через Неву разводят, чтобы пропустить судно. После распада Советского Союза Санкт-Петербург впитал в себя новую энергию: обветшавшие фасады, дороги с выбоинами и культурные достопримечательности были отремонтированы.
Ландшафт
Городской участок
Санкт-Петербург расположен в дельте реки Невы, в истоке Финского залива. Город раскинулся на 42 островах дельты и прилегающих частях материковой поймы. Очень низкое и изначально заболоченное место подвергало город периодическим затоплениям, особенно осенью, когда сильные циклонические ветры гонят воды залива вверх по течению, а также во время весенней распутицы. Исключительно сильные наводнения произошли в 1777, 1824 и 19 гг.24; последние два были самыми высокими за всю историю наблюдений и затопили большую часть города. Чтобы контролировать разрушительные паводковые воды, город построил в 1980-х годах дамбу длиной 18 миль (29 км) через Финский залив. Ряд каналов также был прорезан для облегчения дренажа.
Большой Санкт-Петербург — сам город с его городами-спутниками — образует подковообразную форму вокруг истока Финского залива и включает в себя остров Котлин в заливе. На севере он тянется на запад вдоль берега почти на 50 миль (80 км), включая Зеленогорск. Это северное продолжение представляет собой район спальных городков, санаториев, санаториев и детских лагерей, расположенных среди обширных хвойных лесов и окаймленных прекрасными пляжами и песчаными дюнами. У некоторых петербуржцев из высшего сословия также есть дачи в этом районе. На южной стороне залива границы мегаполиса простираются на запад, включая Петергоф и Ломоносов. На восток Большой Санкт-Петербург простирается вверх по Неве до Ивановского.
Britannica Quiz
47 вопросов из самых популярных викторин по географии Britannica
Только самые лучшие и самые целеустремленные мастера должны справиться с этой викториной. Он состоит из вопросов, взятых из самых популярных викторин Britannica. Сможете ли вы победить его?
Климат
Смягчающее воздействие Атлантического океана обеспечивает Санкт-Петербургу более мягкий климат, чем можно было бы ожидать для его крайнего севера.