положительные и отрицательные примеры, как определить
Химия является достаточно сложной и интересной наукой. Большое количество исследований касается органической химии. Все элементы обладают определенными связями, понять характер и природу которых можно с помощью фундаментальных законов.
Что такое индуктивный (индукционный) эффект
Источник: vogazeta.ruЯвление индуктивного эффекта можно наблюдать в органических соединениях. Причиной, по которой смещается электронная плотность молекулы, является наличие у нее дипольного момента. В составе молекулы органического соединения присутствуют заменители с электроотрицательностью, отличной от электроотрицательности атома углерода.
Индуктивным или индукционным эффектом называют процесс, в котором электронные плотности химических связей смещаются по направлению σ-связей.
Особенность индуктивного эффекта заключается в его быстром затухании во время удаления от заместителя.
Данное определение может рассматриваться с разных точек зрения:
- суммарный дипольный момент в виде векторной суммы диполей отдельных связей в органическом соединении;
- молекула, представляющая собой систему нескольких фрагментов, которые поляризуются в поле диполя полярной группы.
Когда индукционный эффект называют отрицательным и положительным
Процесс занимает короткий промежуток времени. В веществе при удалении от заместителя на 3 или 4 связи он затухает. Причиной этого является слабая поляризуемость σ-связей. Индукционный эффект отличается по природе возникновения и характеру протекания.
Выделяют два типа такого явления:
- положительный +I-эффект;
- отрицательный −I-эффект.
При положительном индукционном эффекте увеличение электронной плотности углерода под действием заместителя, который приобретает правильный положительный заряд, индуцируя при этом на атоме частичный отрицательный заряд. +I- эффект производят заместители, в которых содержатся атомы, характеризующиеся низкой электроотрицательностью.
+I- эффект производят заместители, в которых содержатся атомы, характеризующиеся низкой электроотрицательностью.
К ним относятся:
- магний;
- литий;
- алифатические углеводородные радикалы.
Явление будет отрицательным, если с помощью заместителя электронная плотность на атоме углерода, связанного с ним, уменьшается. В этом случае для заместителя будет характерен частичный отрицательный заряд, а атом углерода будет заряжен частично положительно. −I-эффект наблюдается при наличии заместителей с более высокой степенью электроотрицательности по сравнению с аналогичными показателями у атома водорода.
К таким элементам относятся:
- железо;
- кальций;
- бром;
- органический радикал Nh3;
- гидроксид кальция.
Как определить индуктивный эффект
Согласно теории Льюиса, процессы смещения электронов в молекуле происходят попарно, а не по одному. Для того чтобы понять, как определить индуктивный эффект, можно рассмотреть практический пример молекулы н-пропилхлорида. Так как величина заряда ядра атома хлора достаточно велика, пара σ-связи С-СI смещается в направлении атома хлора.
Для того чтобы понять, как определить индуктивный эффект, можно рассмотреть практический пример молекулы н-пропилхлорида. Так как величина заряда ядра атома хлора достаточно велика, пара σ-связи С-СI смещается в направлении атома хлора.
В результате можно наблюдать следующие преобразования:
- атом хлора обладает частично отрицательным зарядом;
- атом углерода, который соединяется с атомом хлора непосредственно, характеризуется частично положительным зарядом.
При таком взаимодействии наблюдается притяжение атомом углерода электронных пар соседнего атома углерода, который в свою очередь не обладает связью с атомами хлора. Подобный процесс приводит к тому, что хлор способствует последовательному смещению электронных пар σ-связи в рамках всей молекулы.
Исходя из практического опыта, можно сделать вывод о том, что индуктивный эффект представляет собой свойство электроотрицательного заместителя оказывать определенное действие на σ-электронные пары по направлению цепочки атомов углерода, которые включены в состав органических молекул.
В результате такого процесса возрастает дипольный момент органических молекул, характерных для одного гомологического ряда по мере того, как растет длина углеводородной цепочки.
Имея представление о природе и характеристиках индуктивного эффекта, достаточно просто объяснить изменения постоянных величин скоростей и равновесий в случаях, когда в молекулу вводят какой-либо полярный заместитель.
В органической химии еще много интересных фактов. Более углубленно дисциплина изучается в специализированных вузах. Если в процессе обучения у студентов возникают какие-либо сложности, получить квалифицированную помощь можно на портале Феникс.Хелп.
Индуктивный эффект влияние – Справочник химика 21
Атомы и группы атомов в молекулах взаимно влияют друг на друга. Например, в толуоле проявляется взаимное влияние группы СНз и бензольного кольца. Так, толуол легче, чем бензол, вступает в реакции замещения, и замещение проходит преимущественно в положения 2-и 4- за счет положительного индуктивного эффекта метальной группы [c. 61]
61] Такая же последовательность влияния алкильных групп наблюдается по значениям констант диссоциации соответствующих бензойных кислот. В то же время индуктивный эффект этих заместителей меняется в обратном порядке
Сравним глицин и уксусную кислоту первая кислота более чем в сто раз сильнее второй (табл. 2.1), несмотря па сходство их строения. Таким образом, наличие аминогруппы сильно влияет па свойства карбоксильной группы. Ацетилирование аминогруппы (устранение положительного заряда) понижает кислотность глицина примерно в десять раз, но тем не менее карбоксильная группа ацетилированиого глицина проявляет свойства значительно более сильной кислоты, чем уксусная кислота. Более высокая кнслотиость глицина по сравнению с уксусной кислотой объясняется двумя факторами. Индуктивный эффект положительно заряженной аммонийной группы н ацетнлированиой аминогруппы понижает электронную плотность на карбоксиле, так что протон диссоциирует гораздо легче.

Итак, индуктивный эффект — влияние, передающееся по цепи насыщенных атомов и их ординарных связей и быстро затухающее. Мезомерный (или резонансный) эффект передается по цепи сопряженных двойных связей, мало ослабевая.
Индуктивный эффект. Влияние заместителей на физические и химические свойства частицы, связанное с различием в их сродстве к валентным электронам, называется индуктивным эффектом. Индуктивный эффект передается по а-связям и быстро затухает по мере удаления от заместителя. Индуктивный эффект, повышающий электронную плотность на данном атоме, считается положительным +/-эффектом, а понижающий электронную плотность считается отрицательным —/-эффектом. [c.133]
Подобно индуктивным эффектам мезомерные эффекты обусловливают поляризацию молекул в основном состоянии и поэтому отражаются на физических свойствах соединений.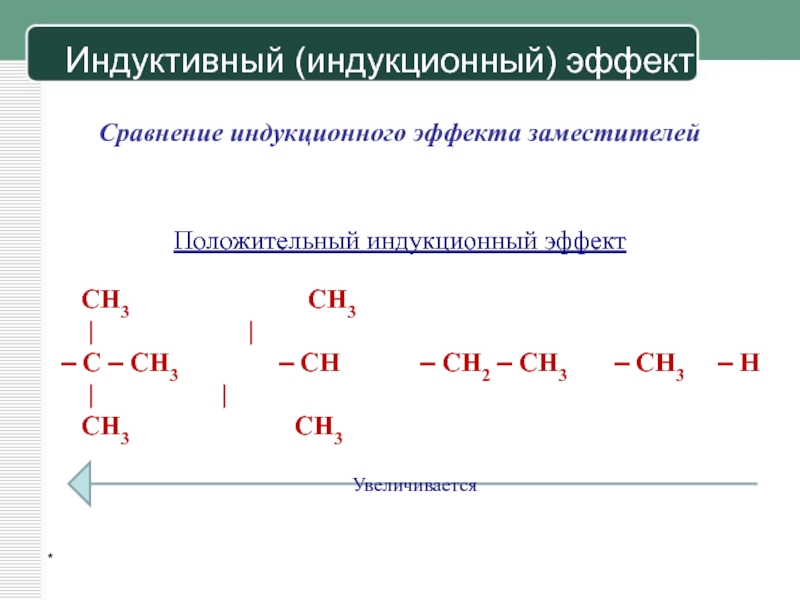
На реакционную способность мономера оказывают влияние индуктивный эффект и эффект сопряжения, которые вызываются действием заместителей.
 Действительно, способность непредельных мономеров к полимеризации зависит также и от природы заместителей, их числа, расположения в молекуле мономера двойных связей. Введение в молекулу этилена различных по своей электронной, природе замещающих групп вызывает поляризацию двойной связи, что ведет к увеличению реакционной способности мономера. Как будет показано, процесс полимеризации часто связан с возникновением свободных радикалов, которые реагируют с мономерами (радикальная полимеризация). При этом со свободным радикалом, обладающим электрофильными свойствами, легче будет реагировать именно поляризованная, а значит, реакционноспособная моле
Действительно, способность непредельных мономеров к полимеризации зависит также и от природы заместителей, их числа, расположения в молекуле мономера двойных связей. Введение в молекулу этилена различных по своей электронной, природе замещающих групп вызывает поляризацию двойной связи, что ведет к увеличению реакционной способности мономера. Как будет показано, процесс полимеризации часто связан с возникновением свободных радикалов, которые реагируют с мономерами (радикальная полимеризация). При этом со свободным радикалом, обладающим электрофильными свойствами, легче будет реагировать именно поляризованная, а значит, реакционноспособная моле В соответствии с ожидаемым (при любом способе интерпретации индуктивного эффекта) влияние последнего на Ка быстро убывает по мере увеличения расстояния от заместителя до карбоксильной группы. Это легко можно видеть из большого различия значений Ка для а-, р- и у-хлормасляных кислот (см. табл. 16-3). [c.553]
Введение в молекулу бензола различных заместителей вызывает изменение максимума поглощения. Это связано с электронным влиянием заместителей на я-электронную систему бензольного кольца за счет эффекта сопряжения и индуктивного эффекта. При этом может наблюдаться смещение главного максимума бензольной полосы в сторону больших длин волн с увеличением интенсивности поглощения (табл. 4). [c.136]
Это связано с электронным влиянием заместителей на я-электронную систему бензольного кольца за счет эффекта сопряжения и индуктивного эффекта. При этом может наблюдаться смещение главного максимума бензольной полосы в сторону больших длин волн с увеличением интенсивности поглощения (табл. 4). [c.136]
В настоящее время нет других экспериментальных данных, подтверждающих правильность одного из этих предположений, факт же такого, обращенного по сравнению с индуктивными эффектами, влияния алкильных групп и условий, при которых это влияние проявляется, установлен твердо. [c.78]
Смещение электронной плотности по а-связям в молекуле на- зывают индукционной поляризацией, индуктивным влиянием или индуктивным эффектом (1-эффект). Индуктивный эффект — эффект, обусловленный стремлением атома или группы атомов подавать или отнимать электроны. Индуктивный сдвиг электронной плотности осуществляется в одном направлении по насыщенной цепи (смещение о-электронов) и не сопровождается переходом электронов из оболочки одного атома в оболочку другого. Индуктивный эффект — влияние быстро затухающее. [c.162]
Индуктивный эффект — влияние быстро затухающее. [c.162]
Поляризация одной двухэлектронной связи в сложной молекуле влияет на состояние соседних связей. Дипольный момент индуцирует Б них также дипольные моменты, правда, значительно меньшие. Этот индуктивный эффект (/-эффект) оказывает влияние на реакционную способность молекулы и особенно наглядно проявляется при сравнении констант диссоциации замещенных кислот. Так, константы диссоциации [c.52]
Механизм реакции 2 представляется следующим образом. В молекуле алкилгалогенида влияние отрицательного индуктивного эффекта (—/-эффект) атоми брома передается по о-связям к -водородным атомам, вследствие чего они приобретают большую, чем в незамещенном этане, способность отщепляться в виде протона [c.106]
Несмотря на то что орто-положений два, а лара-положение одно, при нитровании количество образующегося орто-изомера обычно значительно меньше, чем пара-изомера. По-видимому, это следует приписать влиянию отрицательного индуктивного эффекта, который в орго-положении ощущается более сильно, чем в лара-положении.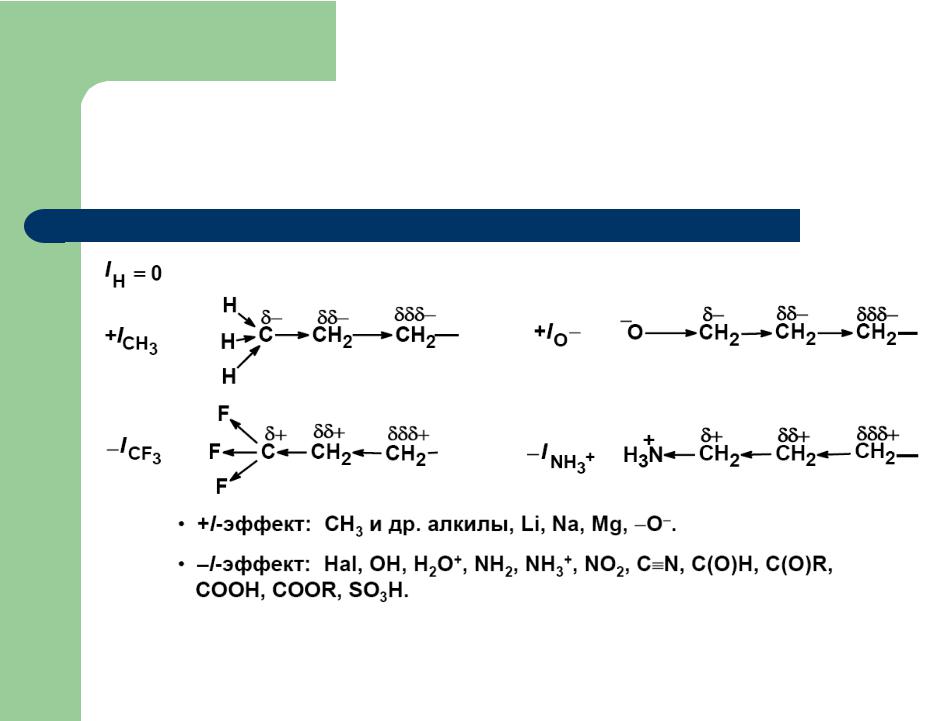 В пользу этого предположения говорят и изменения соотношения орто- и лара-изомеров у различных [c.339]
В пользу этого предположения говорят и изменения соотношения орто- и лара-изомеров у различных [c.339]
По-видимому, здесь оказывает влияние сильный индуктивный эффект атома галогена, дезактивирующий орго-положе-ния. [c.348]
СНз — С1. в результате этого ст-связь поляризуется, оказывая влияние на соседние связи. Эффект, связанный со смещением электронной плотности вдоль ст-связей под влиянием различных по своей электронной природе атомов или групп, называется индуктивным эффектом (I). Этот эффект является наиболее простой формой проявления взаимного влияния атомов в молекуле. По мере удаления от атома (или группы атомов), вызывающего частичное смещение электронной плотности, влияние индуктивного эффекта в насыщенных системах быстро ослабевает, например [c.26]
Индуктивный эффект оказывает больщое влияние на свойства органических соединений и направление химических реакций. [c.26]
В реакциях, идущих по механизму 5. у2, переходное состояние возникает тем легче, чем выше 6+ заряд на атоме углерода, являющемся реакционным центром. Поэтому заместители, уменьшающие электронную плотность на реакционном центре, т. е. проявляющие отрицательный индуктивный эффект и эффект сопряжения (—/, —С), способствуют этому типу замещения. Однако влияние элект ройных факторов в реакциях 5у2 сравнительно невелико. Большее влияние на течение реакций по механизму 5.у2 оказывают пространственные факторы, так как чем больше объем заместителей у реакционного центра, тем труднее реализуется переходное состояние, в котором центральный атом углерода находится в окружении пяти групп. [c.93]
у2, переходное состояние возникает тем легче, чем выше 6+ заряд на атоме углерода, являющемся реакционным центром. Поэтому заместители, уменьшающие электронную плотность на реакционном центре, т. е. проявляющие отрицательный индуктивный эффект и эффект сопряжения (—/, —С), способствуют этому типу замещения. Однако влияние элект ройных факторов в реакциях 5у2 сравнительно невелико. Большее влияние на течение реакций по механизму 5.у2 оказывают пространственные факторы, так как чем больше объем заместителей у реакционного центра, тем труднее реализуется переходное состояние, в котором центральный атом углерода находится в окружении пяти групп. [c.93]
Смещение электронной плотиости вдоль а-связи в молекуле под влиянием атомов или атомных групп называется индуктивным эффектом. [c.296]
С полярностью связей тесно связан индуктивный эффект, под которым понимается влияние некоторого атома или группы атомов на полярность связи. Если, например, к одному из атомов углерода связи С—С мы присоединим атом элемента с больщой электроотрицательностью или какой-либо атом с целым или дробным положительным зарядом, то электроны ковалентной связи С—С сместятся по направлению к этому атому, например [c.61]
Если, например, к одному из атомов углерода связи С—С мы присоединим атом элемента с больщой электроотрицательностью или какой-либо атом с целым или дробным положительным зарядом, то электроны ковалентной связи С—С сместятся по направлению к этому атому, например [c.61]
Как видно, строение и свойства вытесняемого заместителя очень сильно влияют на скорость нуклеофильного замещения, изменяя ее на 5—6 порядков. Этот эффект является суммарным. Он складывается из влияния заместителя на скорость образования о-комплекса и на скорость его разрушения с образованием конечного продукта. Как уже сообщалось, скорость образования о-комплекса зависит от электрофильности реакционного центра субстрата, на которую влияет индуктивный эффект заместителя. Скорость отрыва вытесняемого заместителя зависит прежде всего от его нуклеофильности, но также и от условий в которых проводится реакция, которые могут содействовать или препятствовать стабилизации образующегося аниона. [c. 160]
160]
Положительный заряд в их катионах в основном локализован на атоме азота, связанном с ароматическим кольцом, но вследствие индуктивного эффекта и показанного в формуле эффекта сопряжения частично передается и на смежный атом азота. Частичный положительный заряд на нем возрастает под влиянием электроноакцепторных заместителей в ароматическом кольце и уменьщается под действием донорных заместителей, что существенно сказывается на реакционной способности катиона. [c.250]
По-видимому, было бы неправильно сводить влияние алкильных заместителей к какому-либо одному эффекту. Так, например, отмеченные выше различия между высокотемпературными катализаторами нельзя объяснить лишь стерическими факторами, поскольку спи действуют только в условиях низких температур. Если же все свести к энергетическим факторам, то следовало бы ожидать, что заместители, имеюш ие положительный или отрицательный индуктивные эффекты, оказывают противоположное влияние. Между тем из кинетических данных следует, что аналогичное алкильным заместителям влияние оказывают не только гидроксильные и метоксиль-ные, но и фенильные и карбоксильные группы (см. табл. 12). [c.143]
табл. 12). [c.143]
С2Н5ОН) катализатор и алкилирующий агент образуют ионную пару или поляризованное промежуточное соединение. В первом случае преобладающее влияние на реакционную способность ароматических ядер оказывают индуктивные эффекты имеющихся в них заместителей, поэтому толуол и этилбензол, например, более реакционноспособны, чем бензол. Во втором случае главную роль играет стереохимия и вероятностный фактор, в связи с чем бензол проявляет большую активность, чем алкилароматические соединения. [c.104]
Реакционная способность карбонильных соединений тем выше, чем больше степень поляризации группы СО — чем больше положительный заряд на ее атоме углерода. В этом случае электростатически облегчается взаимное сближение реа гентов и, кроме того, уже в исходном веществе частично реализуется сдвиг электронов, необходимый для реакции. Поскольку алкильные группы оказывают положительный индуктивный эффект, т. е. они в какой-то степени нейтрализуют положительный заряд на карбонильном углероде, удлинение и разветвление алкильной группы ведут к снижению реакционной способности карбонильных соединений. Кетоны обладают значительно меньшей реакционной способностью вследствие индуктивного влияния двух алкильных групн. [c.329]
Кетоны обладают значительно меньшей реакционной способностью вследствие индуктивного влияния двух алкильных групн. [c.329]
Группы с положительным индуктивным эффектом повышают электронную плотность в любом положении бензольного кольца, но преимущественно в орто- и тгаро-положениях относительно группы У. Напротив, группы с отрицательным индуктивным эффектом вызывают общее обеднение л-электронной плотности бензольного кольца, причем в наибольшей степени это влияние сказывается также в орто- и ара-положениях. [c.324]
Известно, что индуктивный эффект быстро затухает по цепи а-связей. Однако девять ато.мов водорода трех метильных групп в грег-бутильной группе, несмотря на большее удаление их от бензольного кольца по сравнению с атомами водорода метильной группы, оказывают более сильное влияние на электронодонорные свойства трет-бутильной группы, чем три атома водорода в метильной группе. В соответствии с этим при нитровании трет-бутилбензола образуются большие количества мета- и лара-изомеров, чем при нитровании толуола (табл. 5.2). [c.332]
5.2). [c.332]
Заместители первого рода обладают электронодонорным характером и увеличивают электронную плотность ароматического кольца, заместители второго рода действуют в противоположном направлении, оказывают электроноакцепторное влияние. Как электронодонорное, так и электроноакцепторное действие заместителей является результатом их индуктивного эффекта и эффекта сопряжения. Считают, что индуктивный эффект передается по 0-связям и быстро уменьшается с расстоянием орто- > > мета- > пара-. Эффект сопряжения распространяется по я-свя-зям, затухает значительно медленнее и передается только в сопряженные орто- и пара-положения, не затрагивая дгета-положение. Индуктивный эффект и эффект сопряжения могут оказывать согласованное или не согласованное влияние на распределение электронной плотности ароматического субстрата. [c.42]
На соотношение изомеров, образующихся в результате электрофильного замеи ения, наряду с индуктивным эффектом и эффектом сопряжения влияние оказывает и о-эффект заместителей. Это влияние будет отмечено при рассмотрении отдельных примеров электрофильного замещения. [c.168]
Это влияние будет отмечено при рассмотрении отдельных примеров электрофильного замещения. [c.168]
Полярность о-саязи, индуктивный эффект. Механизм реакций нуклеофильного замещения атома галогена в галогеналкилах. Переходное состояние, энергетика реакции. Сравнительная активность атомов галогена в разтичного типа галогенопроизводных (объяснение). Неподвижность галогена у кратной связи. Сравнительная кислотность гидроксила а разного типа соединениях (объяснение). Водородная связь. Взаимное влияние гидроксила и ароматического ядра в феноле. Влияние заместителей и их положения в ядре ((кнола на кислотность гидроксильной группы. Спектры (ПМР, ИК и УФ) галогенопроизводных, спиртов и с нолов. Гербициды. [c.250]
СН2-группы, обладающие большим объемом, затрудняют доступ молекул растворителей к координированной МНг-группе, что способствует повышению кислотного характера комплекса. Кроме того, при рассмотрении кислотно-основных свойств важно учитывать так называемый индуктивный эффект. Он состоит в следующем. В результате координации молекулы амина центральным ионом электронная пара азота оттягивается к центральному атому. При этом происходит смещение электронной плотности от атомов водорода к азоту, что приводит к усилению тенденции к отщеплению ионов водорода. В случае этилендиамина смещение электронного облака от азота к центральному атому может быть компенсировано не только за счет электронов связи азот — водород, но и за счет связей углерод — азот. Поэтому тенденция к отщеплению протона не должна проявляться столь сильно. Таким образом индуктивное влияние направлено на ослабление кислотных свойств. Действием индуктивного эффекта объясняют уменьшение скорости обмена дейтерием с тяжелой водой при переходе от (Со (МНз)6 + к [СоЕпзР+. Одновременное и противоположное действие этих факторов приводит к усилению кислотных свойств этилендиаминовых комплексов по сравнению с аммиачными. [c.289]
Он состоит в следующем. В результате координации молекулы амина центральным ионом электронная пара азота оттягивается к центральному атому. При этом происходит смещение электронной плотности от атомов водорода к азоту, что приводит к усилению тенденции к отщеплению ионов водорода. В случае этилендиамина смещение электронного облака от азота к центральному атому может быть компенсировано не только за счет электронов связи азот — водород, но и за счет связей углерод — азот. Поэтому тенденция к отщеплению протона не должна проявляться столь сильно. Таким образом индуктивное влияние направлено на ослабление кислотных свойств. Действием индуктивного эффекта объясняют уменьшение скорости обмена дейтерием с тяжелой водой при переходе от (Со (МНз)6 + к [СоЕпзР+. Одновременное и противоположное действие этих факторов приводит к усилению кислотных свойств этилендиаминовых комплексов по сравнению с аммиачными. [c.289]
Кроме геометрических факторов существенно влияние некоор динируемых заместителей. С одной стороны, за счет индуктивного эффекта они могут сильно изменять о-донорную способность коор динируемого атома. Так, значения для комплекса 8с+ (/=- [c.366]
С одной стороны, за счет индуктивного эффекта они могут сильно изменять о-донорную способность коор динируемого атома. Так, значения для комплекса 8с+ (/=- [c.366]
Небольшой индуктивный эффект, вызываемый обычно ме-гильными группами, хотя и может привести к некоторому повышению основности, однако он не достаточен для того, чтобы заметно дестабилизировать катион важную роль играют здесь также стерические факторы и возможные изменения сольватации. Группа, обусловливающая более мощный индуктивный эффект (например, NO2), оказывает гораздо более сильное влияние. Этот эффект усиливается, если нитрогруппа находится.. [c.87]
Существует два важнейших эффекта влияния ааме-стителей на распределение электронной плотности и молекуле — индуктивный и мезомерный эффекты. [c.446]
Большинство атомов и групп, связанных с углеродом, оказывают такого рода индуктивное влияние в том же направлении, что и атомы хлора вследствие большей, по сравнению с атомами углерода, электроотрицательности они оттягивают от него электроны. Исключение составляют алкильные группы, являющиеся донорами электронов . Хотя в количественном отношении индуктивный эффект является довольно слабым, тем не менее он ответственен за возрастание основности, наблюдаемое при замещении атомов водорода в аммиаке на алкильную группу (см. стр. 83), и частично объясняет тот факт, что атомы водорода ароматического кольца в толуоле легче замещаются, чем Б бензоле. Предложено несколько объяснений электроно-донорных свойств групп СНз, СНгК, СНКг и СНз, однако ни одно из них нельзя считать полностью убедительным и строгим. Этот вопрос до сих пор остается открытым. [c.37]
Исключение составляют алкильные группы, являющиеся донорами электронов . Хотя в количественном отношении индуктивный эффект является довольно слабым, тем не менее он ответственен за возрастание основности, наблюдаемое при замещении атомов водорода в аммиаке на алкильную группу (см. стр. 83), и частично объясняет тот факт, что атомы водорода ароматического кольца в толуоле легче замещаются, чем Б бензоле. Предложено несколько объяснений электроно-донорных свойств групп СНз, СНгК, СНКг и СНз, однако ни одно из них нельзя считать полностью убедительным и строгим. Этот вопрос до сих пор остается открытым. [c.37]
Замещенные алифатические кислоты. Еще более заметное влияние оказывает введение в молекулы жирных кислот элек-гроноакцепторных заместителей. Так, введение галогенов, индуктивный эффект которых действует в обратном направлении по сравнению с алкильными группами, должно вызывать усиление кислотности, что действительно и наблюдается, как это видно из приведенных ниже значений р/Са ряда кислот [c. 77]
77]
Взаимное влияние атомов в молекулах органических соединений » HimEge.ru
Реакционная способность органических соединений определяется
– смещением электронной плотности в простых связях;
– смещением электронной плотности в кратных связях.
Электронные эффекты — смещение электронной плотности в молекуле, ионе или радикале под влиянием заместителей. Заместителем считается любой атом (кроме водорода) или группа атомов, связанные с атомом углерода.
Различают индуктивный (I) и мезомерный (M) эффекты заместителей.
Заместители А, вызывающие отрицательный индуктивный эффект, являются электроноакцепторами: -NO2, -CN, -COOH, -F, — Cl, -Br, -I, -COOR, -COR, -OR, -OH, -NH2, -Ar
Заместители B, вызывающие положительный индуктивный эффект, являются электронодонорами: — CR3, -CHR2, -CH2R, -CH3
- Индуктивный эффект проявляется всегда при наличии в молекуле атомов с различной электроотрицательностью.

- Индуктивный эффект распространяется только через σ-связи и всегда в одном направлении.
- Индуктивный эффект затухает в цепи через 3 – 4 σ-связи.
Пример влияния индуктивного эффекта на направление химической реакции — присоединение галогенводородов к алкенам по правилу Марковникова и против правила Марковникова.
Мезомерный эффект действует в сопряженных системах.
Сопряженная система состоит из чередующихся простых и кратных связей. В сопряжение также может вступать атом с неподеленной парой р-электронов или атом с вакантной р-орбиталью.
Мезомерный эффект проявляется лишь в том случае, когда заместитель включен в сопряженную систему молекулы.
Заместители А, вызывающие отрицательный мезомерный эффект:
-NO2, -CN, -COOH, -COOR, — CONH2.
Заместители В, вызывающие положительный мезомерный эффект:
-NH2, -OH, -F, -Cl, -Br.
РАЗНИЦА МЕЖДУ ИНДУКЦИОННЫМ ЭФФЕКТОМ И МЕЗОМЕРНЫМ ЭФФЕКТОМ | СРАВНИТЕ РАЗНИЦУ МЕЖДУ ПОХОЖИМИ ТЕРМИНАМИ – НАУКА
Индуктивный эффект и мезомерный эффект – это два типа электронных эффектов в многоатомных молекулах. Однако индукционный эффект и мезомерный эффект возникают из-за двух разных факторов. Например, инду
Однако индукционный эффект и мезомерный эффект возникают из-за двух разных факторов. Например, инду
Индуктивный эффект и мезомерный эффект – это два типа электронных эффектов в многоатомных молекулах. Однако индукционный эффект и мезомерный эффект возникают из-за двух разных факторов. Например, индуктивный эффект является результатом поляризации σ-связей, а мезомерный эффект является результатом заместители или функциональные группы в химическое соединение. В некоторых сложных молекулах может существовать как мезомерный, так и индуктивный эффект.
Что такое индуктивный эффект?
Индуктивный эффект – это электронный эффект в полярных молекулах или ионах, вызванный поляризацией σ-связей. Основная причина индуктивного эффекта – разность электроотрицательности между атомами на обоих концах связи. Это создает некоторую полярность связи между двумя атомами. Большинство электроотрицательных атомов притягивают электроны связи к себе, и это приводит к поляризации связи. Некоторыми примерами являются связи O-H и C-Cl.
Это создает некоторую полярность связи между двумя атомами. Большинство электроотрицательных атомов притягивают электроны связи к себе, и это приводит к поляризации связи. Некоторыми примерами являются связи O-H и C-Cl.
Диполь воды
Что такое мезомерный эффект?
Мезомерный эффект возникает из-за заместителей или функциональных групп в химическом соединении и обозначается буквой М. Этот эффект представляет собой качественный метод описания электроноакцепторных или высвобождающих свойств заместителей, основанный на соответствующих резонансных структурах. Это постоянный эффект в химических соединениях, состоящих по крайней мере из одной двойной связи и другой двойной связи или неподеленной пары, разделенных простой связью. Мезомерный эффект можно разделить на «отрицательный» и «положительный» в зависимости от свойств заместителя. Эффект положительный (+ M), когда заместитель является группой, высвобождающей электроны, и эффект отрицательный (-M), когда заместитель является группой, выделяющей электроны.
В чем разница между индуктивным эффектом и мезомерным эффектом?
Свойства:
Индуктивный эффект:Индуктивный эффект – это постоянное состояние поляризации. Когда существует сигма-связь между двумя разными атомами (когда электроотрицательные значения двух атомов не похожи), электронная плотность между этими двумя атомами неоднородна. Электронная плотность более плотная по направлению к более электроотрицательному атому. Несмотря на то, что это постоянный эффект, он относительно слабый, и поэтому его можно легко превзойти другими сильными электронными эффектами.
Мезомерный эффект:Мезомерный эффект обусловлен делокализацией электронов. Он может передаваться по любому количеству атомов углерода в сопряженной системе. Его можно рассматривать как постоянную поляризацию, которая в основном встречается в ненасыщенных цепях.
Факторы воздействия:
Индуктивный эффект:Разница электроотрицательностей между двумя атомами в связи напрямую влияет на индуктивный эффект.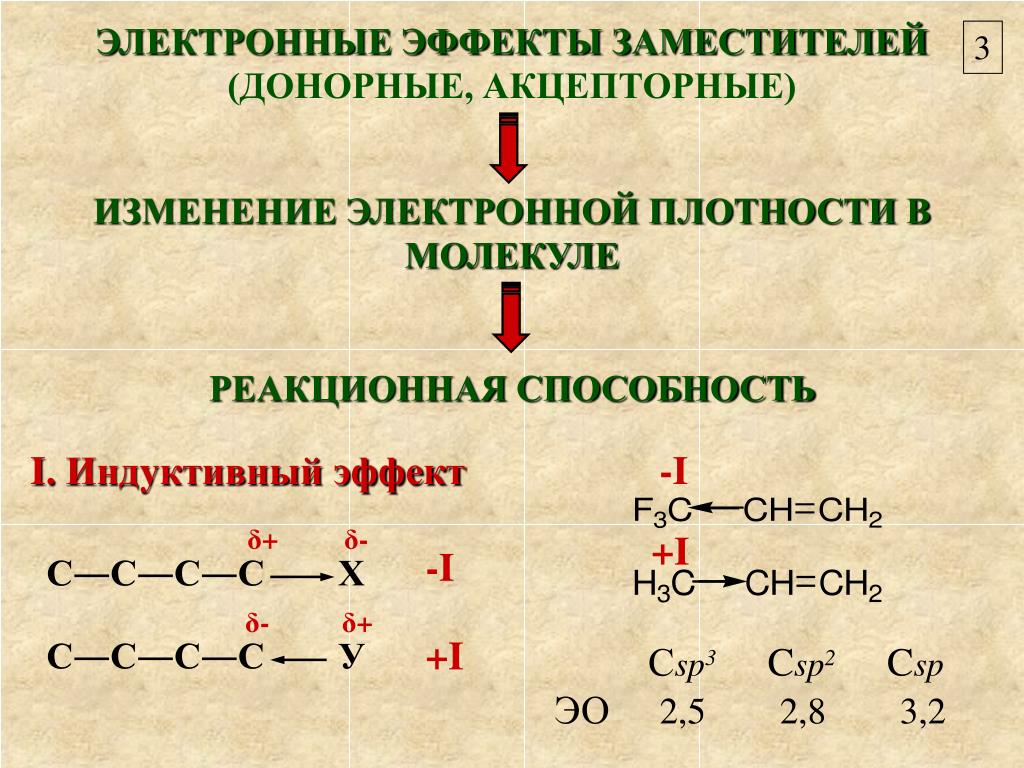 Кроме того, это явление зависит от расстояния; следовательно, длина связи также является другим влияющим фактором; чем больше расстояние, тем слабее эффект.
Кроме того, это явление зависит от расстояния; следовательно, длина связи также является другим влияющим фактором; чем больше расстояние, тем слабее эффект.
Мезомерный эффект: Мезомерный эффект – это постоянный эффект, который зависит от заместителей или функциональных групп в химическом соединении. Он содержится в химических соединениях, содержащих по крайней мере одну двойную связь и другую двойную связь или неподеленную пару, разделенную одинарной связью.
Категории:
Индуктивный эффект:Индуктивный эффект делится на две категории в зависимости от их эффекта удаления электронов или высвобождения электронов по отношению к водороду.
Отрицательный индуктивный эффект (-I):
Группы или атомы, обладающие электроноакцепторными свойствами, вызывают отрицательный индукционный эффект. Некоторые примеры перечислены ниже в порядке убывания эффекта –I.
NH3+ > НЕТ2 > CN> SO3H> CHO> CO> COOH> COCl> CONH2 > F> Cl> Br> I> OH> OR> NH2 > C6ЧАС5 > H
Положительный индуктивный эффект (-I):
Группы или атомы, обладающие свойствами высвобождения электронов, вызывают положительный индуктивный эффект. Некоторые примеры перечислены ниже в порядке убывания эффекта + I.
Некоторые примеры перечислены ниже в порядке убывания эффекта + I.
C (CH3)3 > CH (CH3)2 > CH2CH3 > CH3 > H
Мезомерный эффект:
Положительный мезомерный эффект (+ M):
Когда заместитель можно рассматривать как группу, высвобождающую электроны, на основе резонансных структур, эффект положительный (+ M).
+ M заместители: спирт, амин, бензол
Отрицательный мезомерный эффект (- M):
Когда заместитель представляет собой электроноакцепторную группу, мезомерный эффект отрицательный (-M)
–M заместители: ацетил (этаноил), нитрил, нитро
Органическая химия 2 | Взаимное влияние атомов в молекулах органических соединений
Продолжаем разбирать основы органической химии. В теории Бутлерова сказано, что одна из особенностей строения веществ — взаимное влияние атомов друг на друга. Химические связи определяют свойства соединений. Например, в зависимости от радикалов и полярности связей в бензольном кольце новые атомы замещаются в разных положениях. Теория взаимного влияния атомов в молекуле — достаточно сложная тема. В статье мы разберем ее основы. Если вы хотите понимать химию лучше, запишитесь на курсы подготовки к ЕГЭ, где каждый раздел изучается подробно.
Химические связи определяют свойства соединений. Например, в зависимости от радикалов и полярности связей в бензольном кольце новые атомы замещаются в разных положениях. Теория взаимного влияния атомов в молекуле — достаточно сложная тема. В статье мы разберем ее основы. Если вы хотите понимать химию лучше, запишитесь на курсы подготовки к ЕГЭ, где каждый раздел изучается подробно.
Химические связи в органических веществах
Прежде чем изучать влияние атомов друг на друга, нужно разобраться в природе связей в молекулах органических соединений. Вещества в органике образованы неметаллами — углеродом, кислородом, водородом, азотом, серой. Элементы связаны между собой ковалентными полярными связями. Они образуются в результате появления общих электронных пар. Рассмотрим на примере неорганического вещества — HCl. Водород имеет всего один электрон. Он и участвует в образовании соединений. У хлора на внешнем уровне 7 валентных электронов. Происходит объединение, при котором образуется общая плотность с 8 электронами. Хлор — более электроотрицательный элемент, поэтому он оттягивает на себя электронную плотность.
Хлор — более электроотрицательный элемент, поэтому он оттягивает на себя электронную плотность.
Это влияет на свойства органических соединений. Когда молекула HCl распадается (например, в водных растворах), хлор забирает себе электроны и становится анионом с зарядом —. Он будет взаимодействовать с электроположительными областями, то есть является нуклеофилом. Водород лишается электрона, поэтому становится катионом с зарядом +. В реакциях он выступает в роли электрофила, взаимодействуя с электроотрицательными участками. Напомним, что при распаде молекул с неполярной связью образуются радикалы — нейтральные частицы.
Смещение электронной плотности
Разберем влияние атомов в молекуле на примере хлорметана Ch4Cl. В нем присутствуют три типа связей: С-С, С-Н и С-Cl. Связь С-С неполярна, поэтому ее мы рассматривать не будем. В группе Ch4- углерод является более электроотрицательным элементом. Электронные плотности всех трех атомов водорода стянуты к нему. Они приобретают частично положительный заряд, а углерод — частично отрицательный.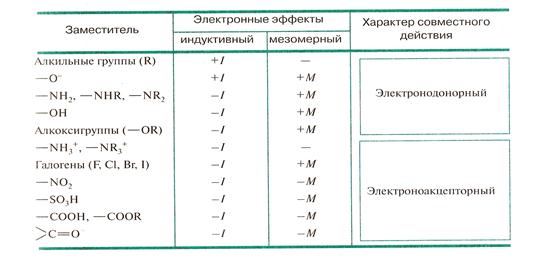 В связи C-Cl более электроотрицательным является хлор. Он забирает на себя электронную плотность со всей группы -Ch4. В химии это обозначают стрелками: Ch4→Cl. Метильный радикал передает электроны хлору, то есть является донором. Хлор, в свою очередь, выступает в роли акцептора. Если мы рассмотрим этан Ch4-Ch4, то не увидим такого явного донорно-акцепторного взаимодействия. Небольшое смещение наблюдается только по направлению от Н к С. В органических молекулах донорами являются все углеводородные радикалы. Акцепторами — группы, содержащие кислород, азот, галогены.
В связи C-Cl более электроотрицательным является хлор. Он забирает на себя электронную плотность со всей группы -Ch4. В химии это обозначают стрелками: Ch4→Cl. Метильный радикал передает электроны хлору, то есть является донором. Хлор, в свою очередь, выступает в роли акцептора. Если мы рассмотрим этан Ch4-Ch4, то не увидим такого явного донорно-акцепторного взаимодействия. Небольшое смещение наблюдается только по направлению от Н к С. В органических молекулах донорами являются все углеводородные радикалы. Акцепторами — группы, содержащие кислород, азот, галогены.
Индуктивный эффект
Первый вариант взаимного влияния атомов в молекулах органических веществ — индуктивный эффект. Он характеризует смещение плотности по сигма-связям. Эффект возникает в полярных молекулах, распространяется в одном направлении и быстро затухает. Пример индуктивного влияния — рассмотренный нами хлорметан Ch4→Cl. Метильная группа — это электрофильный (донорный) участок, обладающий положительным индуктивным эффектом +I. Галоген выступает в роли нуклеофильного участка с отрицательным эффектом -I. Важный момент: в акцепторной области всегда есть элемент с высокой электроотрицательностью (O, N, Hal).
Галоген выступает в роли нуклеофильного участка с отрицательным эффектом -I. Важный момент: в акцепторной области всегда есть элемент с высокой электроотрицательностью (O, N, Hal).
Мезомерный эффект
Перед изучением мезомерного влияния атомов в молекулах органических веществ разберемся в таком понятии, как π-система. Как вам наверное известно, π-связь — часть кратной. Если в молекуле есть одна двойная или тройная связь, то она локализована, так как взаимодействует только с ядрами соседних атомов. Если же таких связей несколько и они разделены одним простым (сигма) переходом, то они делокализуются. Электронная плотность распределяется между всеми атомами, благодаря чему образуется сопряженная система. Простейшей π-системой является бутадиен-1,3. Кроме того, она реализуется в бензольном кольце. Сопряженные связи являются чем-то средним между одинарными и двойными. Они меняют свойства органических веществ.
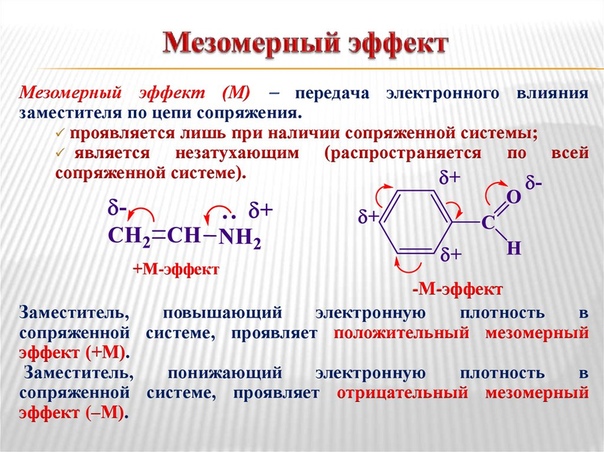
Мезомерный эффект — это взаимное влияние атомов в молекуле с π-связями. В случае отрицательного эффекта электронная плотность притягивается атомом, в случае положительного — отталкивается.
В случае отрицательного эффекта электронная плотность притягивается атомом, в случае положительного — отталкивается.
Определение свойств веществ
Разберем примеры взаимного влияния атомов в молекулах. Сравним кислотные свойства фенола, этанола и азотной кислоты. Все три соединения можно описать общей формулой Х-О-Н. При этом электронная плотность смещается к более отрицательному кислороду, что обеспечивает отщепление водорода и, соответственно, кислотные свойства: Х-О←Н. Осталось определить, насколько сильно это взаимодействие:
-
В азотной кислоте есть нитрогруппа -NO2, обладающая отрицательными мезомерным и индуктивным эффектами. Азот — электроотрицательный элемент, он стягивает на себя электронную плотность, поэтому водород становится еще более активным. Вещество является сильной кислотой.
-
У этанола вместо Х стоит углеводородный радикал. Он обладает положительным индуктивным эффектом, из-за чего полярность связи О-Н снижается.
 У вещества очень слабые кислотные свойства.
У вещества очень слабые кислотные свойства. -
Особенность фенола — наличие бензольного кольца. У кислорода есть неподеленная электронная пара, которая вступает в сопряжение с π-системой. Благодаря этому электронная плотность стягивается в кольцо, водород становится более подвижным. Кислотные свойства фенола сильнее, чем у этанола, но слабее азотной кислоты.
Итак, мы разобрались с взаимным влиянием атомов в молекуле, узнали о мезомерном и индуктивном эффектах. Эти термины не встречаются в ЕГЭ по химии, но они позволяют лучше понимать природу соединений и предсказывать их химические свойства. Разберитесь с теорией из статьи, а также уделите время практике, определяя эффекты у разных веществ. Это можно делать самостоятельно, а можно записаться на курсы и решать задачи под руководством преподавателя. В любом случае мы уверены — при должной подготовке вы сможете набрать высокие баллы на ЕГЭ.
Тест Взаимное влияние функциональных групп в молекуле
Тест по химии по теме «Взаимное влияние функциональных групп в молекуле» призван оценить знания студентов по курсу «Химия».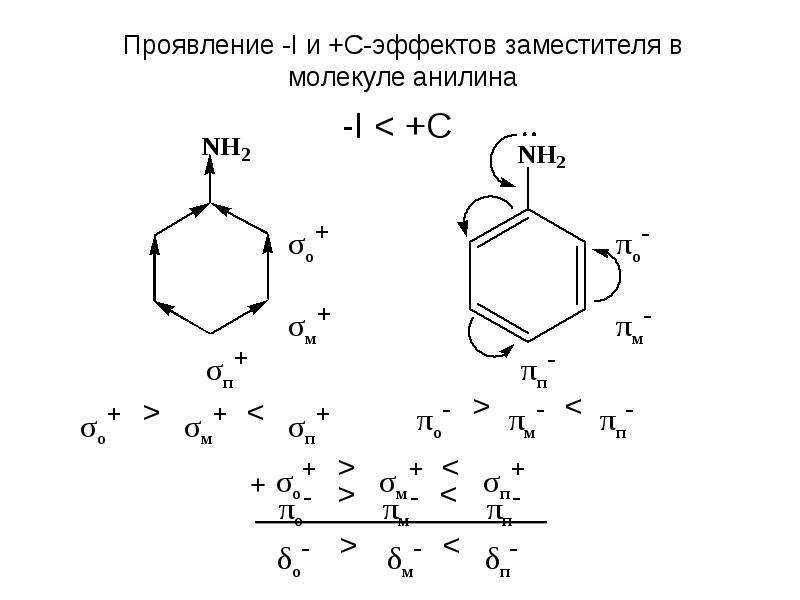 В тесте правильные ответы выделены «+»
В тесте правильные ответы выделены «+»
Смещение электронной плотности по цепи σ –связей называется
+: индуктивным эффектом;
-: электронным эффектом;
-: мезомерным эффектом;
-: среди ответов нет верного.
Положительный индуктивный эффект способны проявлять:
электроноакцепторные заместители;
+: электронодонорные заместители;
-: и электроноакцепторные заместители, и электоронодонорные заместители;
-: среди ответов нет верного.
Отрицательный индуктивный эффект способны проявлять:
+: электроноакцепторные заместители;
-: электронодонорные заместители;
-: и электроноакцепторные заместители, и электоронодонорные заместители;
-: среди ответов нет верного.
Влияние заместителя, передающееся по цепи π -связей,называется:
-: индуктивным эффектом;
-: электронным эффектом;
+: мезомерным эффектом;
-: среди ответов нет верного.
Положительный мезомерный эффект способны проявлять:
-: электроноакцепторные заместители;
+: электронодонорные заместители;
-: и электроноакцепторные заместители, и электоронодонорные заместители;
-: среди ответов нет верного.
Электронодонорные заместители в сопряженной системе:
+: повышают электронную плотность;
-: понижают электронную плотность;
-: не влияют на электронную плотность;
-: среди ответов нет верного.
Электроакцепторные заместители в сопряженной системе:
-: повышают электронную плотность;
+: понижают электронную плотность;
-: не влияют на электронную плотность;
-: среди ответов нет верного.
Отрицательный мезомерный эффект способны проявлять:
+: электроноакцепторные заместители;
-: электронодонорные заместители;
-: и электроноакцепторные заместители, и электоронодонорные заместители;
-: среди ответов нет верного.
В соответствии с теорией химического строения А.М Бутлерова:
+: атомы в молекулах соединены друг с другом химическими связями в соответствии с их валентностью;
-: атомы в молекулах соединены с друг другом химическими связями;
-: свойства органических соединений зависят только от числа и природы входящих в их —состав атомов;
-: свойства органических соединений зависят только от химического строения молекул;
В соответствии с теорией химического строения А.
 М Бутлерова:
М Бутлерова:-: атомы в молекулах соединены с друг другом химическими связями;
+: атомы в молекулах органических веществ соединяются между собой в определенной последовательности, что обуславливает химическое строение молекулы;
-: свойства органических соединений зависят только от числа и природы входящих в их -состав атомов;
-: свойства органических соединений зависят только от химического строения молекул;
В соответствии с теорией химического строения А.М Бутлерова:
-: атомы в молекулах соединены с друг другом химическими связями;
-: свойства органических соединений зависят только от числа и природы входящих в их состав атомов;
-: свойства органических соединений зависят только от химического строения молекул;
+: свойства органических соединений зависят не только от числа и природы входящих в их состав атомов, но и от химического строения молекул;
Согласно теории химического строения А.М Бутлерова:
+: в молекулах существует взаимное влияние атомов как связанных, так и непосредственно
друг с другом связанных;
-: важным ее следствием является то, что органическое соединение может иметь не одну химическую формулу, отражающую его строение;
-: химическое строение вещества нельзя определить в результате изучения его химических превращений и, наоборот, по строению вещества сложно характеризовать его свойства;
-: в молекулах существует взаимное влияние атомов, только непосредственно связанных с друг другом;
Согласно теории химического строения А.
 М Бутлерова:
М Бутлерова:-: важным ее следствием является то, что органическое соединение может иметь не одну химическую формулу, отражающую его строение;
-: химическое строение вещества нельзя определить в результате изучения его химических превращений и, наоборот, по строению вещества сложно характеризовать его свойства;
+: химическое строение вещества можно определить в результате изучения его химических превращений и, наоборот, по строению вещества можно характеризовать его свойства;
-: в молекулах существует взаимное влияние атомов, только непосредственно связанных с друг другом;
Согласно теории химического строения А.М Бутлерова:
-: важным ее следствием является то, что органическое соединение может иметь не одну химическую формулу, отражающую его строение;
-: химическое строение вещества нельзя определить в результате изучения его химических превращений и, наоборот, по строению вещества сложно характеризовать его свойства;
-: в молекулах существует взаимное влияние атомов, только непосредственно связанных с друг другом;
+: важным ее следствием является то, что каждое органическое соединение должно иметь одну химическую формулу, отражающую его строение.
Примеры графического изображения индуктивного эффекта
Мезомерный эффект (М) – ϶ᴛᴏ передача электронного влияния заместителя по системе сопряжения. В отличие от быстро затухающего индуктивного эффекта͵ мезомерный эффект по сопряженной системе передается на большие расстояния. Положительный мезомерный эффект (+М) имеет место в случае смещения электронной плотности по системе сопряжения от заместителя, отрицательный (-М) – к заместителю. Графически мезомерный эффект обозначается изогнутыми стрелками, начало которых показывает, какие р- или p-электроны смещаются, а конец – связь или атом, к которому они смещаются. На концах сопряженной системы указывают частичные заряды.
Примеры графического изображения мезомерного эффекта
Заместители, отличающиеся от атома водорода, всегда проявляют индуктивный эффект, а проявление ими мезомерного эффекта обусловлено наличием сопряженной системы. Электронные эффекты, проявляемые заместителем, бывают как одного знака, так и различными.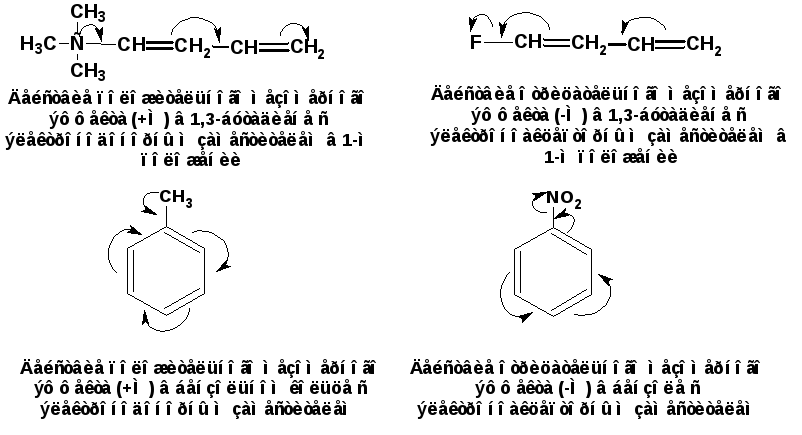 Различают электронодонорные и электроноакцепторные заместители.
Различают электронодонорные и электроноакцепторные заместители.
Электронодонорные заместители – заместители, увеличивающие электронную плотность в молекуле. Это достигается в результате проявления заместителем положительных индуктивного и мезомерного эффектов, либо только положительного индуктивного эффекта͵ либо за счёт проявления более сильного положительного мезомерного эффекта по сравнению с отрицательным индуктивным.
Примеры электронодонорных заместителей
Электроноакцепторные заместители – заместители, уменьшающие электронную плотность в молекуле. Это достигается в результате проявления ими отрицательных индуктивного и мезомерного эффектов, либо преобладания отрицательного индуктивного эффекта над положительным мезомерным.
Примеры графического изображения индуктивного эффекта – понятие и виды. Классификация и особенности категории “Примеры графического изображения индуктивного эффекта” 2017, 2018.
ИНДУКТИВНЫЙ ЭФФЕКТ-Положительное-отрицательное-определение-Примеры-Приложения
Поляризация σ-связи за счет электронов отводящий или электронодонорный эффект соседних групп или атомов упоминается to as индуктивный эффект .
Сигма-связь между двумя атомами, которые различаются своей электроотрицательностью, поляризован из-за смещения пары связей в сторону более электроотрицательный атом. В этом процессе электроотрицательный атом получает частичную отрицательный заряд, в то время как другой атом получает частичный положительный заряд.Таким образом индуцированная полярность передается через сигма-связи в молекуле посредством создание постоянного диполя. Это явление называется индуктивным. эффект.
Представлен стрелкой, указывающей на более электроотрицательный атом, несущий частичный отрицательный заряд.
Основные особенности индуктивного эффекта * Возникает из-за разницы электроотрицательностей двух атомов, образующих
сигма-облигация.
* Передается через сигма-облигации . Пи-облигации не вовлеченный.
* Величина индуктивного эффекта уменьшается при удалении от группы, вызывающие это.
* Это постоянный эффект . Это может создать постоянный диполь в молекуле.
* В целом индуктивный эффект относительно слабый и невысокий. другими электронными эффектами, такими как резонанс эффект, гиперконъюгация и т. д.
* Влияет на химические и физические свойства соединений.
Связь C-Cl в бутилхлориде, CH 3 -CH 2 -CH 2 -CH 2 -Cl
поляризован из-за разницы электроотрицательностей. Электроны выводятся
атом хлора. Таким образом, первый атом углерода получает частичный положительный заряд. В
в свою очередь, этот атом углерода частично увлекает электронную плотность от следующего углерода,
который также получает частичный положительный заряд. Это будет продолжаться и дальше, и вот как возникает индуктивный эффект.
передается через углеродную цепь.
Это будет продолжаться и дальше, и вот как возникает индуктивный эффект.
передается через углеродную цепь.
Следует отметить, что индуктивный эффект ослабевает вдоль цепи и не это очень важно за 3-м атомом углерода.
Также обратите внимание, что индуктивный эффект является постоянным и присущ молекула, в то время как электромерный эффект – временный эффект – только создается в присутствии атакующих электрофильных или нуклеофильных реагентов.
Индуктивный эффект делится на два типа в зависимости от отводящий или высвобождающий электроны природа атома / группы, вызывающая это. В сила индуктивного эффекта измеряется путем сравнения с водородом.
1) Отрицательный индуктивный эффект (-I):Электроноакцепторная природа группы или атомы называется отрицательным индуктивным эффектом.Обозначается -I. Ниже приведены примеры групп в порядке убывания их эффекта -I:
NH 3 + > NO 2 > CN> SO 3 H > CHO> CO> COOH> COCl> CONH 2 > F> Cl> Br> I> OH> OR> NH 2 > C 6 H 5 > H
2) Положительный индуктивный эффект (+ I): Относится к высвобождению электронов. характер групп или атомов и обозначается + I.Ниже приведены примеры
групп в порядке убывания их + I-эффекта.
характер групп или атомов и обозначается + I.Ниже приведены примеры
групп в порядке убывания их + I-эффекта.
C (CH 3 ) 3 > CH (CH 3 ) 2 > CH 2 CH 3 > CH 3 > H
Почему алкильные группы проявляют положительный индуктивный эффект?
Хотя связь C-H практически считается неполярной, существует частичная положительный заряд на атоме водорода и частичный отрицательный заряд на атоме углерода.Поэтому каждый атом водорода действует как электронодонорная группа. Это совокупное донорство превращает алкильный фрагмент в электронодонорную группу.
Устойчивость карбокатионов (ионы карбония): Стабильность карбокатионов повышается, когда группы + I, такие как алкил
группы присутствуют рядом с положительно заряженным углеродом. Группы + I уменьшают
положительный заряд на углероде за счет передачи отрицательной плотности заряда через
положительный индуктивный эффект. Это приводит к
большая стабильность карбокатиона.
Группы + I уменьшают
положительный заряд на углероде за счет передачи отрицательной плотности заряда через
положительный индуктивный эффект. Это приводит к
большая стабильность карбокатиона.
Принимая во внимание, что группы -I дестабилизируют карбокатионы, поскольку они увеличивают положительный заряд за счет удаления электронной плотности.
Обратите внимание, что любой фактор, увеличивающий заряд (отрицательный или положительный) на ионе приводит к дестабилизации, в то время как любой фактор, уменьшающий заряд приводит к стабилизации этого иона.
Например, порядок стабильности нескольких карбокатионов, содержащих алкильные группы, следующий: следует:
Третичный карбокатион, содержащий три алкильные группы, более стабилен, чем вторичный карбокатион с двумя алкильными группами, который, в свою очередь, более стабилен чем первичный карбокатион. Метилкарбокатион наименее устойчив среди данный.
Стабильность свободных радикалов: Точно так же стабильность свободных радикалов увеличивается с увеличением
количество алкильных групп.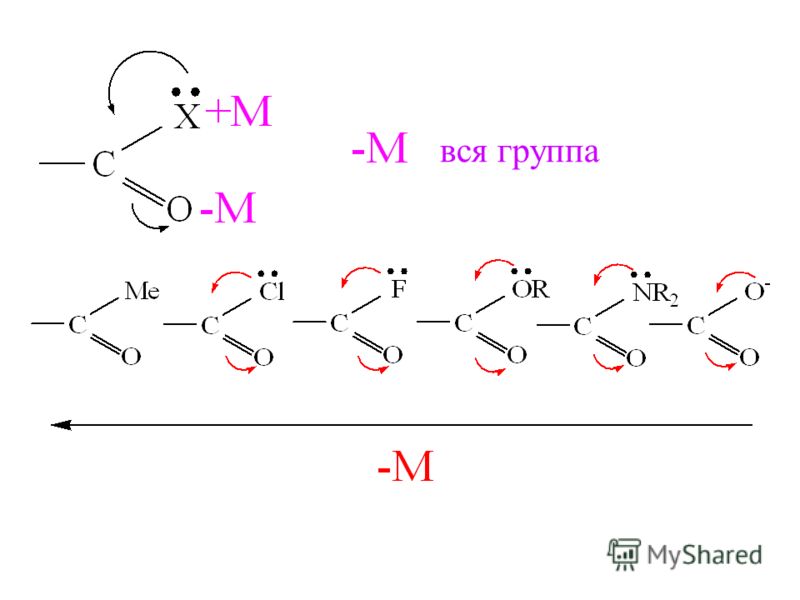
Таким образом, стабильность различных свободных радикалов составляет:
Устойчивость карбанионы:Однако группы + I снижают стабильность карбанионов, в то время как -I группы увеличивает их устойчивость.
Например, алкильные группы (+ I) отдают электронную плотность отрицательно заряженный углерод, приводящий к дестабилизации карбаниона.
Таким образом, порядок устойчивости следующих карбанионов:
Теперь порядок обратный. Третичный карбанион наименее стабилен, в то время как метилкарбанион является наиболее устойчивым из представленных.
Кислотная сила карбоновых кислот и фенолов: Протонная кислота всегда находится в равновесии со своим сопряженным основанием, которое
образуется при потере протона.Любой фактор, стабилизирующий отрицательно заряженный
конъюгат основания способствует большей ионизации кислоты.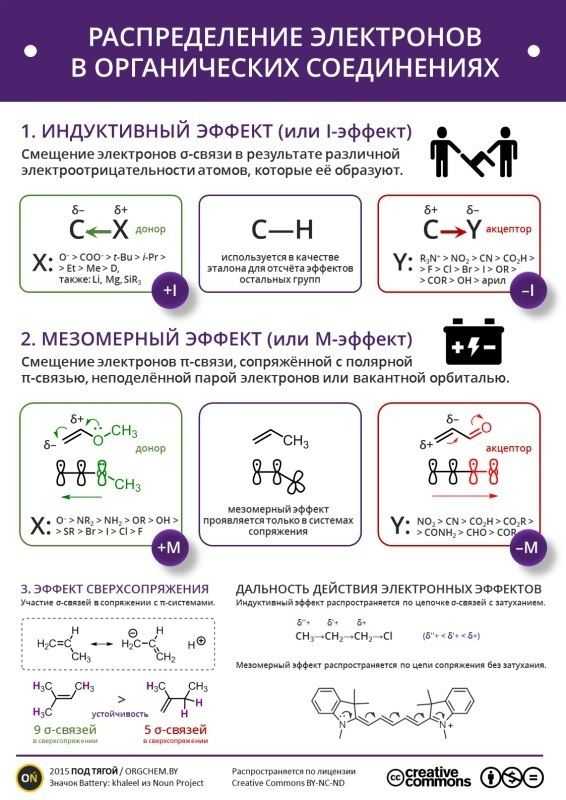 т.е. увеличивает кислотный
сила.
т.е. увеличивает кислотный
сила.
Электроноакцепторные группы, демонстрирующие отрицательный индуктивный эффект (-I), уменьшают отрицательный заряд на конъюгировать основание (например, карбоксилат-ион), вытягивая электронную плотность и, таким образом, стабилизируя ее. Следовательно, кислотная сила увеличивается. когда присутствуют группы -I.
Напротив, группы + I уменьшают кислотную силу, поскольку они дестабилизируют сопряженное основание кислоты (анионное), высвобождая электронную плотность что, в свою очередь, увеличивает отрицательный заряд аниона и, таким образом, дестабилизирует Это.
Например,
i) Сила кислоты увеличивается с увеличением числа электронов. удаление атомов фтора, как показано ниже.
CH 3 COOH
ii) Муравьиная кислота является более сильной кислотой, чем уксусная кислота, так как –CH 3 группа дестабилизирует карбоксилат-ион.
Аналогичным образом, кислотная сила фенолов увеличивается, когда группы -I присутствуют на кольце.
Например, П-нитрофенол является более сильной кислотой, чем фенол, так как -NO 2 группа -I, которая забирает электронную плотность. Принимая во внимание, что пара-крезол более слабая кислота, чем фенол, так как -CH 3 группа показывает положительный индуктивный эффект (+ I).
Например, кислотность после фенолов имеет следующий порядок:
- Основная сила аминов:
Электронодонорные группы, такие как алкильные группы, увеличивают основную прочность аминов, тогда как электроноакцепторные группы, такие как арильные группы, уменьшают основная природа.Следовательно, алкиламины являются более сильными основаниями Льюиса, чем аммиак, тогда как ариламины слабее аммиака.
Таким образом, порядок основной прочности алкил- и ариламинов по отношению к аммиак: CH 3 NH 2 > NH 3 > C 6 H 5 NH 2
Реакционная способность карбонильных соединений: The + I
группы увеличивают электронную плотность у карбонильного углерода. Отсюда их реактивность
в сторону нуклеофилов уменьшается. Таким образом, формальдегид более реакционноспособен, чем
ацетальдегид и ацетон по отношению к реакциям нуклеофильного присоединения.
Отсюда их реактивность
в сторону нуклеофилов уменьшается. Таким образом, формальдегид более реакционноспособен, чем
ацетальдегид и ацетон по отношению к реакциям нуклеофильного присоединения.
Таким образом, порядок реактивности следующий:
Вопрос: Что из перечисленного является применением индуктивный эффект?
1) Устойчивость карбокатионов
2) Основная сила аминов
3) Кислотная сила карбоновых кислот
4) Все вышеперечисленное
Ответ: 4
В целом индуктивный эффект на меньше влияющих, чем другие эффекты, такие как эффект резонанса и гиперконъюгация.
Например, Электроноакцепторная природа нитрогруппы, -NO 2 является в основном из-за эффекта резонанса, а не из-за индуктивного эффекта.
Но есть исключения. Например, в случае галогенов отрицательный
индуктивный эффект преобладает над положительным резонансным эффектом.
Вопрос-1) Эффект индукции лучше всего можно описать как:
а) сопряжение σ-связывающей орбитали с соседней π-орбиталью.
б) способность атома или группы вызывать поляризацию связи
c) перенос неподеленной пары электронов от более электроотрицательного атома к менее электроотрицательному атому в молекуле.
г) Все вышеперечисленное.
Ответ: b
Вопрос-2) Какое из следующих утверждений относительно индуктивного эффекта неверно?
а) Это постоянный эффект
б) Уменьшается с увеличением на расстоянии от полярной группы, вызывающей индукционный эффект.
c) Он включает делокализацию π-электронов
г) Это смещение σ-электронов
Ответ: d
Вопрос-3) Что из следующего показывает положительный (+ I) индуктивный эффект?
а) – НЕТ 2
б) –OCH 3
в) –COOH
г) –CH 3
Ответ: d
Вопрос-4) Какая из следующих групп показывает отрицательный (-I) индуктивный эффект?
а) –канал 2 канал 3
б) –C (CH 3 ) 3
c) –C 6 H 5
г) –CH 3
Ответ: c
Вопрос-5) Какой из следующих порядков верен в отношении -I влияние заместителей?
а) –NH 2 <–ИЛИ> –F
б) -CR 3 <–NR 2 <–OR <–F
c) -CR 3 > –NR 2 > –OR> –F
г) – + NR 3 > – + OR 2
Ответ: b
6) Правильный порядок по величине отрицательного индуктивный эффект для данных групп составляет:
a) –SO 3 H> –SO 2 R> –SR> –SOR
б) –SR> –SO 2 R> – SOR> –SO 3 H
c) –SO 3 H> –SO 2 R> –SOR> –SR
г) –SR> –SOR> –SO 2 R> –SO 3 H
Ответ: c
Вопрос-7) Самый стабильный ион карбония среди следующих:
а) канал 3 + б) канал 3 канал 2 + в) (канал 3 ) 2 канал + г) (канал 3 ) 3 C +
Ответ: d
Вопрос-8) Наименее стабильный радикал среди следующих:
a) CH 3 • b) CH 3 CH 2 • c) (CH 3 ) CH • d) (CH 3 ) 3 C •
Ответ: d
Вопрос-9) Правильный порядок кислотной силы данных кислот:
a) Муравьиная кислота> Уксусная кислота> Пропановая кислота
б) Муравьиная кислота> Уксусная кислота <Пропановая кислота
c) Муравьиная кислота <Уксусная кислота> Пропановая кислота
d) Муравьиная кислота <Уксусная кислота <Пропановая кислота
Ответ:
Вопрос-10) Правильный порядок силы кислоты:
a) CH 3 CH 2 CHFCOOH> CH 3 CHFCH 2 COOH > FCH 2 CH 2 CH 2 COOH
b) CH 3 CH 2 CHFCOOH
c) CH 3 CH 2 CHFCOOH> CH 3 CHFCH 2 COOH
d) CH 3 CH 2 CHFCOOH
Подсказка: сила индуктивного эффекта зависит от количества
фтор и их расстояние от группы -COOH.
Вопрос-11) Какая из следующих кислот самая сильная?
a) Класс 3 CCOOH
б) Класс 2 CHCOOH
c) ClCH 2 COOH
г) CH 3 COOH
Ответ:
Вопрос-12) Какой из следующих карбанионов более устойчив?
а) канал 3 – б) канал 3 канал 2 – c) CF 3 CH 2 – d) (CH 3 ) 2 CH –
Ответ: c
Вопрос-13) Правильный порядок кислотной силы следующих замещенные фенолы составляет:
Ответ: 2
Вопрос-14) Каков характер% s в гибридизации углерода, когда он показывает сильнейший -I эффект?
а) 25% б) 50% в) 75% г) 66.6%
Ответ: c
Информация: Электроотрицательность углерода увеличивается с увеличением
% s-орбитального характера в гибридизации. Таким образом, порядок
Электроотрицательность sp> sp 2 > sp 3 . Следовательно
углерод с sp гибридизацией (как в алкинах) показывает наибольшую индуктивную
эффект.
Следовательно
углерод с sp гибридизацией (как в алкинах) показывает наибольшую индуктивную
эффект.
Вопрос-15) Какой из следующих порядков верен в отношении кислотность карбоновых кислот?
a) (CH 3 ) 3 CCOOH> (CH 3 ) 2 CHCOOH > Канал 3 Канал 2 COOH
b) (CH 3 ) 3 CCOOH> (CH 3 ) 2 CHCOOH
c) (CH 3 ) 3 CCOOH <(CH 3 ) 2 CHCOOH > Канал 3 Канал 2 COOH
d) (CH 3 ) 3 CCOOH <(CH 3 ) 2 CHCOOH
Вопрос-16) Самая сильная база Льюиса среди следующих:
a) CH 3 NH 2
б) (CH 3 ) 2 NH
c) (CH 3 ) 3 N
г) C 6 H 5 NH 2
Вопрос-17) Определите правильные утверждения об электроотрицательности групп, указанных ниже: (CSIR NET ИЮНЬ 2018)
(A) Группа CF 3 имеет большее значение, чем у группы NF 2
(B) Группа NH 2 имеет более низкое значение, чем у группы NF 2
(C) Группа OH имеет большее значение, чем у NF 2
(D) CH 3 и C 2 H 5 группы имеют почти аналогичные значения
Правильный ответ:
1) A, B и D
2) B и C
3) B, C и D
4) B и D
Ответ: 4
Вопрос-18) Что из следующего является неверным утверждением о индуктивный эффект?
A) Электроноакцепторный индуктивный эффект (-I) группы ослабляет Связь O-H в -COOH и способствует ионизации карбоновой кислоты
B) Он действует в пространстве.
C) Анилин является более слабым основанием, чем аммиак, из-за отрицательного индуктивного эффекта. показаны фенильной группой.
D) Алкильные группы являются хорошими примерами положительного индуктивного эффекта.
Ответ: B
Вопрос-19) Выберите правильное утверждение относительно индуктивного эффекта.
а) Усиливается с увеличением расстояния от атома или группы вызывая поляризацию.
б) Включает смещение неподеленной пары.
c) Включает делокализацию пи-электронов.
г) Он действует через σ-связи.
Ответ: d
Вопрос-20) Какая из следующих групп имеет наибольший индуктивный эффект.
а) Класс
б)
рублейc) F
г) Я
Ответ: c
Вопрос-21) Какое из следующих утверждений об индуктивном эффект правильный?
а) Это также известно как гиперконъюгация.
б) Величина индуктивного эффекта увеличивается с увеличением расстояния.
от группы, вызывающей поляризацию.
c) Он включает делокализацию π-электронов
г) Это смещение σ-электронов
Ответ: d
Вопрос-22) В какой из следующих групп отображается электрон? снятие индуктивного эффекта?
а) –канал 2 канал 3
б) – НЕТ 2
c) –C 6 H 5
г) –CH 3
Ответ: b
Вопрос-23) индуктивный эффект в молекуле возникает из-за:
а) наличие неполярной связи
б) поляризация сигма-связи, смежной либо с акцептирующим электроном, либо с группа высвобождения электронов.
в) делокализация π-электронов
г) делокализация сигма-электронов.
Ответ: b
Вопрос-24) Какой из следующих эффектов может дестабилизировать 3 o бутилкарбоанион? :
а) положительный индуктивный эффект
б) отрицательный индуктивный эффект.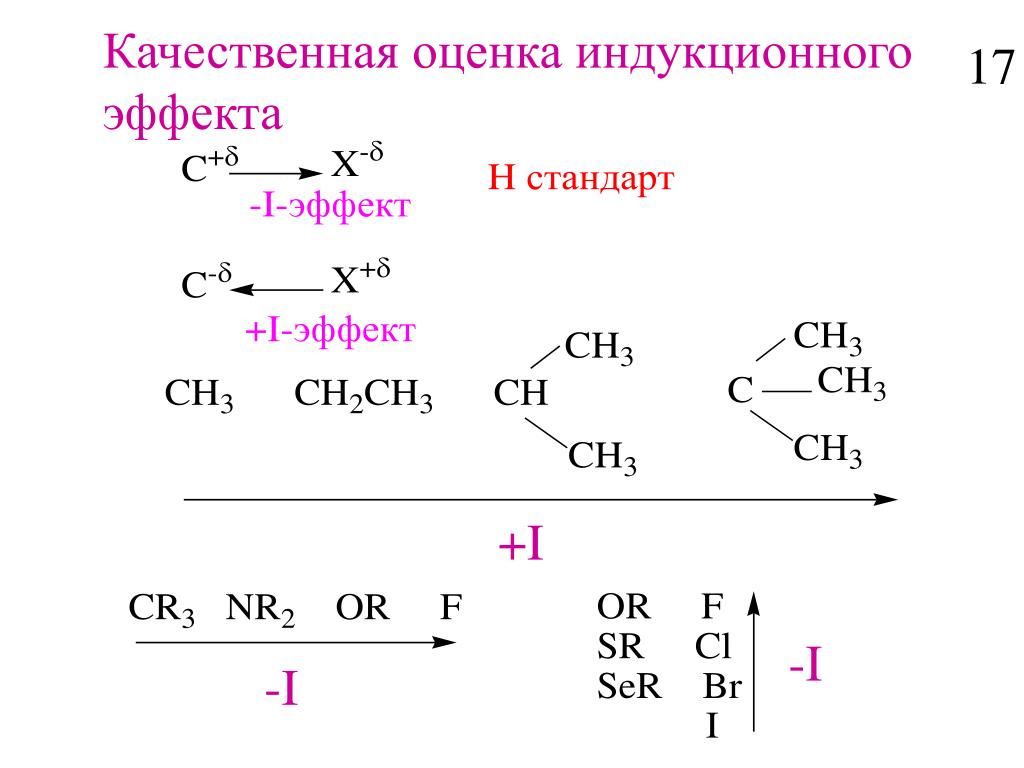
c) нейтральный индуктивный эффект
d) Ничего из вышеперечисленного.
Ответ:
Индуктивный эффект – обзор
29 Моделирование: нарушение индуктивности и симметрии
Как обсуждалось в разделе 27, первоначальная теоретическая и вычислительная работа 172 , 180 , 182 на дробных гигантских ступенях Шапиро представляла собой моделирование с использованием решений связанных уравнений RCSJ в передемпфированных пределах ( β c = 0) и λ ⊥ / a ≫ 1.Хотя эти теории успешно объясняют целочисленные и дробные гигантские шаги Шапиро в этих пределах (то есть в массивах SNS), объяснение субгармонических шагов в лучшем случае является частичным.
Один из ключей к пониманию субгармонических эффектов, по-видимому, заключается в понимании роли, которую индуктивность играет в двумерных массивах. Собственные и взаимные геометрические индуктивности должны быть введены в связанные уравнения RCSJ, которые используются для моделирования свойств массивов. Когда кто-то изучает связанные дифференциальные уравнения, индуктивности (или емкости) образуют матрицу.Мы будем ссылаться на матрицу индуктивности или емкости в следующих обсуждениях.
Когда учитываются индукционные эффекты, перпендикулярная глубина проникновения λ ⊥ становится важным масштабным параметром. Он определяет, насколько быстро затухает магнитное возбуждение, устанавливая диапазон взаимодействия между вихрями с учетом их собственных полей. Действительно, как показали Phillips et al. 199 способность массива синхронизировать фазу с внешним приводом переменного тока ограничена тем, насколько мало λ относительно размера выборки. (Отметим, что большинство рабочих в этой области сравнивают λ ⊥ с размером плакетки a , а не с L). Обратите внимание, что λ ⊥ зависит от критического тока и, через него, температуры, поэтому можно легко переключаться между различными режимами λ ⊥ / и в одном эксперименте.
(Отметим, что большинство рабочих в этой области сравнивают λ ⊥ с размером плакетки a , а не с L). Обратите внимание, что λ ⊥ зависит от критического тока и, через него, температуры, поэтому можно легко переключаться между различными режимами λ ⊥ / и в одном эксперименте.
Домингес, Хосе и его сотрудники тщательно изучили все ступени – гигантские, дробно-гигантские и субгармонические – в массивах в пределах слабого и сильного экранирования, λ ⊥ / a 1 и λ ⊥ / a ≪ 1, а в промежуточном режиме.Их работа подробно обсуждается в недавнем обзоре 9 , и мы коснемся только важных моментов.
Домингес и Хосе ввели собственное магнитное поле в свои модели RCSJ 9 , 197 сверхдемпфированных решеток. Они использовали модель локального экранирования для матрицы индуктивности, включающую только индуктивности собственной личности и взаимных индуктивностей ближайших соседей.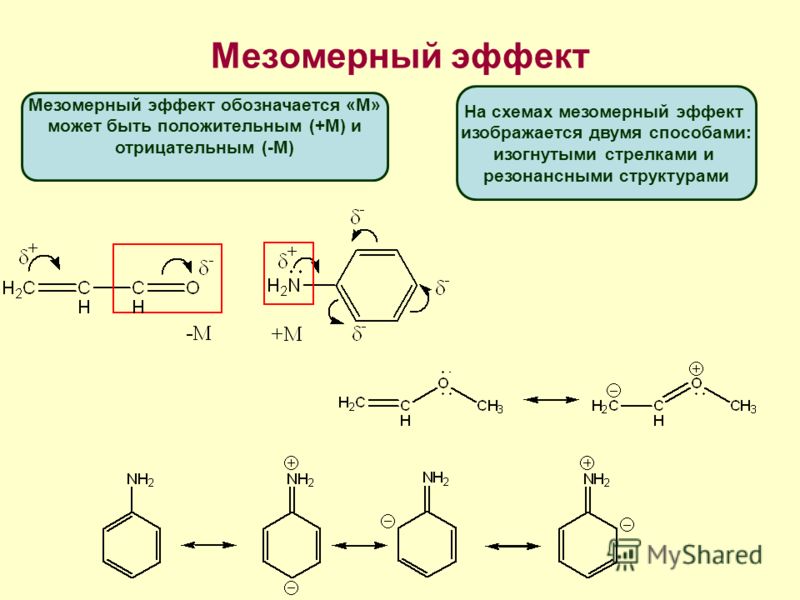 Они обнаружили, что включение собственного магнитного поля влияет на формирование дробных гигантских ступеней Шапиро и создает субгармонические ступени.В нулевом магнитном поле учет асимметричного собственного поля порождает субгармонические ступени, предложенные и экспериментально продемонстрированные Х.-К. Ли и др. 194 Эти субгармонические ступени создаются семейством осциллирующих когерентных вихревых состояний, точная структура которых также зависит от λ ⊥ / a .
Они обнаружили, что включение собственного магнитного поля влияет на формирование дробных гигантских ступеней Шапиро и создает субгармонические ступени.В нулевом магнитном поле учет асимметричного собственного поля порождает субгармонические ступени, предложенные и экспериментально продемонстрированные Х.-К. Ли и др. 194 Эти субгармонические ступени создаются семейством осциллирующих когерентных вихревых состояний, точная структура которых также зависит от λ ⊥ / a .
Phillips et al. 199 , 200 также включали индуктивные эффекты в свои расчеты, и их работа согласуется с работой Домингеса и Хосе 197 в том, что индукционные эффекты действительно генерируют субгармонические шаги Шапиро и влияют на другие гигантские шаги Шапиро.То есть собственные поля приводят к субгармоническим ступеням. Однако они включали полную матрицу индуктивности, а не только усеченную модель ближайшего соседа. (Домингес и Хосе, в более поздней работе, 9 также использовали полную матрицу индуктивности в моделировании и получили результаты, аналогичные результатам Филлипса и др. ) Использование полной матрицы индуктивности оказывается очень важным, поскольку усеченная матрица дает аномально сильная экранировка, преждевременно разрушающая фазовую синхронизацию.
) Использование полной матрицы индуктивности оказывается очень важным, поскольку усеченная матрица дает аномально сильная экранировка, преждевременно разрушающая фазовую синхронизацию.
На рисунке 78 показана ВАХ для массива с избыточным демпфированием в нулевом поле с нормированной частотой Ω = 0.6 и I AC = I c . Показаны три значения глубины проникновения: λ / a = 0,1, 1 и 20. Целочисленный гигантский шаг Шапиро имеет место для всех λ ⊥ / a и при высоких λ ⊥ . / a это единственная структура. При меньших λ ⊥ / становится наблюдаемым (λ ⊥ меньше размера выборки) 1/2 и 3/2 ступени. Для еще меньших λ ⊥ / и можно наблюдать много ступеней более высокого порядка.Ширина целочисленных шагов уменьшается по мере уменьшения λ ⊥ / a . Филлипс и др. также посмотрел на тот же массив для I AC = 2I C и Ω = 2. Результаты были практически одинаковыми – целые ступени всегда появляются, а их ширина уменьшается как λ ⊥ / a сокращено. Субгармонический полушаг присутствует и для более высоких λ ⊥ / a , но шаги более высокого порядка ( n> 1) исчезают.Интересно, что Домингес и Хосе 9 искусственно подавили собственное поле массива, поддерживая взаимодействие вихря с вихрем через матрицу индуктивности, они обнаружили, что субгармонические ступени исчезают – собственное поле явно отвечает за субгармоническую структуру в них. симуляции.
Результаты были практически одинаковыми – целые ступени всегда появляются, а их ширина уменьшается как λ ⊥ / a сокращено. Субгармонический полушаг присутствует и для более высоких λ ⊥ / a , но шаги более высокого порядка ( n> 1) исчезают.Интересно, что Домингес и Хосе 9 искусственно подавили собственное поле массива, поддерживая взаимодействие вихря с вихрем через матрицу индуктивности, они обнаружили, что субгармонические ступени исчезают – собственное поле явно отвечает за субгармоническую структуру в них. симуляции.
Рис. 78. Смоделированные вольт-амперные характеристики в нулевом поле матрицы SNS плакеток 11 × 11, смещенной переменным и постоянным током. f = 0, β c = 0, Ω = 0.6 и I AC = 1.01 c . По вертикальной оси отложено нормированное усредненное по времени напряжение постоянного тока; по горизонтальной оси отложен нормированный постоянный ток, подаваемый на край массива, (а) λ ⊥ / a = 0,1, (b) λ ⊥ / a = 1, и (c) λ ⊥ / a = 20. Последовательные кривые смещены по горизонтальной оси на 0,75 единицы. (Из работы 199, рис. 1.)
Последовательные кривые смещены по горизонтальной оси на 0,75 единицы. (Из работы 199, рис. 1.)
Путем тщательного изучения токов и потоков можно получить приблизительное описание вихревого движения.В общем, для массива N × N Phillips et al. обнаружили, что субгармоника 1 / q шагов Шапиро является результатом N вихрей и антивихрей, движущихся по массиву и аннигилирующих внутри – процесс, который происходит с периодом v AC / q. Аналогичные результаты, но отличающиеся в деталях из-за усеченной матрицы индуктивности, были получены Домингесом и Хосе. 9 , 197 Однако детали этого движения очень сильно зависят от λ ⊥ / a , то есть от растрирования.
На целочисленных шагах, в каждом цикле переменного тока, один столбец из N вихрей и один столбец из N антивихрей перемещаются от внешних краев массива в центр, где они аннигилируют. Это происходит для всех значений λ ⊥ / и . На f = 1/2 шага ( q = 2) то, что происходит, сильно зависит от λ ⊥ / a . При λ ⊥ / a> N субгармонических ступеней не наблюдается. Для N> λ ⊥ / a> 1, на всех остальных столбцах цикла переменного тока из м изолированных вихрей ( м ≈ N / 2 ) перемещаются поперек и аннигилируют, при этом антивихри движутся с противоположного края.В чередующихся циклах N – м вихрей и антивихрей пересекают массив, поэтому результирующий эффект заключается в перемещении N вихрей (антивихрей) по массиву за время, в два раза превышающее период переменного тока. Для λ ⊥ / a <1 один столбец из N вихрей перемещается по массиву и аннигилирует, а столбец из N антивихрей движется с противоположного края – точно так же, как для q = 1 шагов, за исключением того, что период вдвое длиннее.Филлипс и др. обнаружил, что механика для субгармонических ступеней по существу аналогична.
На f = 1/2 шага ( q = 2) то, что происходит, сильно зависит от λ ⊥ / a . При λ ⊥ / a> N субгармонических ступеней не наблюдается. Для N> λ ⊥ / a> 1, на всех остальных столбцах цикла переменного тока из м изолированных вихрей ( м ≈ N / 2 ) перемещаются поперек и аннигилируют, при этом антивихри движутся с противоположного края.В чередующихся циклах N – м вихрей и антивихрей пересекают массив, поэтому результирующий эффект заключается в перемещении N вихрей (антивихрей) по массиву за время, в два раза превышающее период переменного тока. Для λ ⊥ / a <1 один столбец из N вихрей перемещается по массиву и аннигилирует, а столбец из N антивихрей движется с противоположного края – точно так же, как для q = 1 шагов, за исключением того, что период вдвое длиннее.Филлипс и др. обнаружил, что механика для субгармонических ступеней по существу аналогична. Домингес и Хосе 9 получили очень похожие результаты, которые они назвали осесимметричными когерентными вихревыми состояниями. Филлипс и др. также смоделировали большие массивы и обнаружили, что это движение линейных столбов вихрей является доминирующим эффектом.
Домингес и Хосе 9 получили очень похожие результаты, которые они назвали осесимметричными когерентными вихревыми состояниями. Филлипс и др. также смоделировали большие массивы и обнаружили, что это движение линейных столбов вихрей является доминирующим эффектом.
Как уже упоминалось, H.-C. Ли и др. 194 предположил, что субгармонический полушаг был вызван зарождением вихревого состояния f = 1/2 на краях массива в результате токов смещения массива.Хеббул и Гарланд 177 , 188 видели субгармонические ступени с токами смещения массива, которые, по их мнению, были слишком малы для создания такого вихревого состояния f = 1/2 на краях образца, и приписали субгармонические ступени вариациям в критические токи. Результаты Филлипса и др. Показывают, что собственное поле действительно вызывает субгармонические скачки даже при очень слабых токах смещения. Однако они не обнаружили и свидетельств какого-либо особого вихревого состояния вблизи краев образца; фактически они обнаружили, что вихри, движущиеся в массиве, не всегда зарождаются на краях.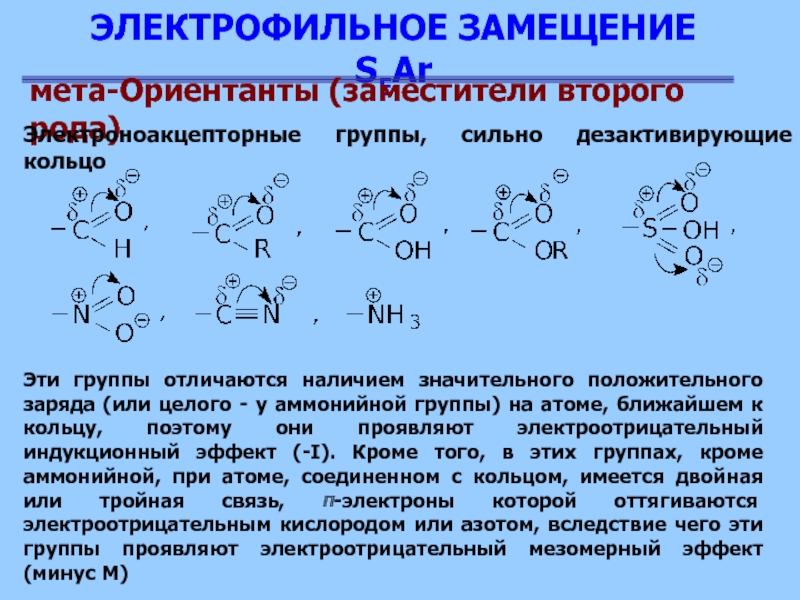 Вероятно, будет правильным сказать, что собственные поля являются одним из нескольких типов механизмов нарушения симметрии, каждый из которых, по-видимому, приводит к субгармоническому отклику. К такому выводу пришли также Домингес и Хосе. 9 Фактически, кажется, что, хотя возможно множество механизмов нарушения симметрии, в упорядоченном массиве источником субгармонических ступеней Шапиро является собственное поле массива.
Вероятно, будет правильным сказать, что собственные поля являются одним из нескольких типов механизмов нарушения симметрии, каждый из которых, по-видимому, приводит к субгармоническому отклику. К такому выводу пришли также Домингес и Хосе. 9 Фактически, кажется, что, хотя возможно множество механизмов нарушения симметрии, в упорядоченном массиве источником субгармонических ступеней Шапиро является собственное поле массива.
Phillips et al. также исследовал экранирование транспортных токов геометрическими индуктивностями.На рисунке 79 (a) показано, как изменяются ВАХ при наличии переменного тока, когда N увеличивается для фиксированных λ ⊥ / a . На рисунке показана смоделированная ВАХ для массива 63 × 63 с параметрами, аналогичными массиву 11 × 11, показанному на рис. 78. Шаги субгармоники на 1/2 и 2/3 отчетливо видны, но форма кривой около Целочисленные шаги явно сильно отличаются от таковых на рис. 78 – восходящая сторона шага довольно закруглена, а ширина шага существенно уменьшена – область постоянного тока смещения, где матрица синхронизирована по фазе, значительно уменьшилась. Для дальнейшего изучения этого вопроса они исследовали распределение тока по массиву. На рисунке 79 (b) показаны эти распределения тока, нормированные на то, что произошло бы при λ ⊥ / a = ∞, что является равномерным распределением тока. Жирная сплошная кривая соответствует λ ⊥ / a = 2, без вихрей или приложенного поля и включает полную матрицу индуктивности. Собственные поля заставляют ток собираться около краев массива, что подразумевает распределение токов в переходах по ширине массива.Поскольку ток подается равномерно на концы массива, это также подразумевает распределение переходных токов по длине массива. Конечный результат состоит в том, что разные переходы несут разные токи, что снижает способность массива синхронизировать фазу с током привода переменного тока. Обнаружено, что степень неоднородности транспортных токов увеличивается с уменьшением λ / a , и мы ожидаем, что способность массива к фазовой синхронизации будет уменьшаться по мере того, как λ ⊥ / a становится малой.
Для дальнейшего изучения этого вопроса они исследовали распределение тока по массиву. На рисунке 79 (b) показаны эти распределения тока, нормированные на то, что произошло бы при λ ⊥ / a = ∞, что является равномерным распределением тока. Жирная сплошная кривая соответствует λ ⊥ / a = 2, без вихрей или приложенного поля и включает полную матрицу индуктивности. Собственные поля заставляют ток собираться около краев массива, что подразумевает распределение токов в переходах по ширине массива.Поскольку ток подается равномерно на концы массива, это также подразумевает распределение переходных токов по длине массива. Конечный результат состоит в том, что разные переходы несут разные токи, что снижает способность массива синхронизировать фазу с током привода переменного тока. Обнаружено, что степень неоднородности транспортных токов увеличивается с уменьшением λ / a , и мы ожидаем, что способность массива к фазовой синхронизации будет уменьшаться по мере того, как λ ⊥ / a становится малой. (Подобный размерный эффект обсуждался в разделе VII). Таким образом, собственные поля очень важны для определения ВАХ больших массивов даже при наличии слабых индуцированных полей.
(Подобный размерный эффект обсуждался в разделе VII). Таким образом, собственные поля очень важны для определения ВАХ больших массивов даже при наличии слабых индуцированных полей.
Рис. 79. (a) Смоделированные ВАХ решетки переходов SNS 63 × 63, λ ⊥ / a = 1, Ω = 0,6, I AC = I c и β c = 0. (б) Распределение тока в поперечном сечении массива 63 × 63, для λ ⊥ / a = 2.Жирная сплошная кривая соответствует полной матрице индуктивности. Светлая сплошная кривая соответствует усеченной матрице индуктивности, которая учитывает только самоиндуктивности при расчете наведенных полей. Светлая пунктирная кривая также представляет собой усеченную матрицу индуктивности, которая включает взаимные индуктивности как собственных, так и ближайших соседей. Все кривые нормированы на равномерный ток перехода, который будет течь, если λ ⊥ / a = ∞. (c) Ширина целочисленного гигантского шага Шапиро под действием собственного поля. Δ I / I C – ширина первого целочисленного гигантского шага Шапиро для массива N × N . Ω = 0,6, I AC = I c и β c = 0. N варьировалось от 7 до 80, а λ ⊥ / a варьировалось от 1 до 5 для небольших массивов и λ ⊥ / a = 1 для больших массивов ( N & gt; 31). (d) ВАХ в нулевом поле для массива SIS 11 × 11 с f = 0, Ω = 1.0, I AC = I c , β c = 0,7 и λ ⊥ / a = 1. Пунктирная кривая соответствует массиву в свободном пространстве. Сплошная кривая соответствует массиву с идеальной заземляющей поверхностью, расположенной рядом с антенной. (Из работы 199, рис. 5.)
Δ I / I C – ширина первого целочисленного гигантского шага Шапиро для массива N × N . Ω = 0,6, I AC = I c и β c = 0. N варьировалось от 7 до 80, а λ ⊥ / a варьировалось от 1 до 5 для небольших массивов и λ ⊥ / a = 1 для больших массивов ( N & gt; 31). (d) ВАХ в нулевом поле для массива SIS 11 × 11 с f = 0, Ω = 1.0, I AC = I c , β c = 0,7 и λ ⊥ / a = 1. Пунктирная кривая соответствует массиву в свободном пространстве. Сплошная кривая соответствует массиву с идеальной заземляющей поверхностью, расположенной рядом с антенной. (Из работы 199, рис. 5.)
Ожидаемые эффекты на ширину ступеньки показаны на рис. 79 (c), где нормированная ширина ступеньки Δ I / I C нанесена на график по сравнению с Na / λ ⊥ . Δ I – это диапазон токов смещения постоянного тока для фиксированного Ω и I AC , в котором матрица остается на ступени Шапиро.Δ I / I C уменьшается с увеличением Na / λ ⊥ , как и ожидалось из приведенных выше аргументов.
Δ I – это диапазон токов смещения постоянного тока для фиксированного Ω и I AC , в котором матрица остается на ступени Шапиро.Δ I / I C уменьшается с увеличением Na / λ ⊥ , как и ожидалось из приведенных выше аргументов.
Один из способов уменьшить влияние собственного поля – это ввести плоскость заземления, где токи изображения помогают подавить собственное магнитное поле. На рисунке 79 (d) показано моделирование недемпфированной решетки. В этом моделировании заземляющая плоскость была помещена рядом с массивом, и, как видно на рисунке, результаты без заземляющей плоскости (пунктирная линия) заметно отличаются от результатов с ней (сплошная линия).В плоскости заземления целочисленные шаги резче и шире, то есть происходит лучшая синхронизация по фазе. Кроме того, субгармонические шаги меньше.
Phillips et al. также посмотрел, что происходит, когда матрица индуктивности усекается. Рисунок 79 (b) показывает, что происходит. Светлая сплошная кривая – это распределение тока по образцу, когда вклад вносят только самоиндукции. Пунктирная линия – это распределение тока с учетом индуктивности собственной личности и индуктивности ближайшего соседа. Мы видим, что при N → ∞ для фиксированных λ / a области образца на расстоянии более нескольких λ ⊥ дюймов от краев несут по существу нулевой транспортный ток.Расчет наведенных полей с усеченной матрицей индуктивности приводит к моделированию с нереально сильным экранированием.
Светлая сплошная кривая – это распределение тока по образцу, когда вклад вносят только самоиндукции. Пунктирная линия – это распределение тока с учетом индуктивности собственной личности и индуктивности ближайшего соседа. Мы видим, что при N → ∞ для фиксированных λ / a области образца на расстоянии более нескольких λ ⊥ дюймов от краев несут по существу нулевой транспортный ток.Расчет наведенных полей с усеченной матрицей индуктивности приводит к моделированию с нереально сильным экранированием.
Использование усеченной матрицы индуктивности также влияет на конфигурации вихрей, которые можно увидеть при моделировании. В усеченной модели, где нет тока за пределами нескольких глубин проникновения в образец, на вихри внутри не будут влиять транспортные токи – сила Лоренца будет очень слабой. Вихри будут быстро втягиваться в массив с краев, но затем они будут медленно двигаться к центру, собираясь внутри, прежде чем исчезнуть.При использовании полной матрицы вихри быстро перемещаются по массиву – столбцы вихрей и антивихрей быстро аннигилируют.
Индуктивный эффект – обзор
15.6 Анализ электронной плотности и модификации структуры в материалах LIB
Помимо подтверждения и обобщения индуктивного эффекта, вычисления DFT могут использоваться для интерпретации модуляции электронной структуры и переноса заряда, которые происходят при ( де) литиирование, которое, в свою очередь, может служить рационализацией напряжений.Например, плотность состояний или эволюция карты электронной плотности использовались при исследовании модификации связи в VOXO 4 / Li x VOXO 4 (X = P, As, S) (Launay et al. , 2003), TiS 2 -LiTi 2 S 4 (Benco et al., 1999) MSO 4 F / LiMSO 4 F (M = Fe, Co, Ni) таворитовые системы (Frayret et al. др., 2010). Различия в электрохимических характеристиках между LiNiO 2 и LiCoO 2 , несмотря на изоструктурную слоистую структуру, объясняются расчетами из первых принципов. Эти аспекты действительно были связаны с различием в электронной структуре переходных ионов двух металлов. Ni, с частично заполненным e g уровней (( t 2g ) 6 – (d z 2 ) 1 электронная природа Ni 3 + ) и потеря вырожденности (из-за к искажению Яна-Теллера NiO 6 ), проявляет тенденцию к достижению максимальной локализации заряда, в то время как Со, в отличие от этого, предпочитает достичь максимальной делокализации заряда (Laubach et al., 2009).
Эти аспекты действительно были связаны с различием в электронной структуре переходных ионов двух металлов. Ni, с частично заполненным e g уровней (( t 2g ) 6 – (d z 2 ) 1 электронная природа Ni 3 + ) и потеря вырожденности (из-за к искажению Яна-Теллера NiO 6 ), проявляет тенденцию к достижению максимальной локализации заряда, в то время как Со, в отличие от этого, предпочитает достичь максимальной делокализации заряда (Laubach et al., 2009).
В целом изменение электронной структуры обязательно должно изучаться в тесной связи со структурными изменениями и фазовой стабильностью. Например, в результате электрохимического цикла или высокой температуры исходные слоистые структуры-хозяева претерпевают нежелательные фазовые превращения или разложения, вызванные взаимодействием Li-вакансии, изменениями упаковки кислорода и вариациями количества электронов (Ceder and Van der Ven, 1999; Wang et al. , 2011; Wu et al., 2011).
, 2011; Wu et al., 2011).
С другой стороны, помимо исследования зонной структуры и карт разности электронной плотности, общий перенос атомного заряда также может быть непосредственно оценен путем интегрирования зарядов внутри атомных бассейнов на основе разделения электронной плотности, обеспечиваемого, например, атомами Бадера в теории молекул. (Бадер, 1990).Применяя эту концепцию к фазам Li x MSO 4 F (M = Fe, Co, Ni) (Frayret et al., 2010), было продемонстрировано, что заряд, возникающий в результате почти полностью ионизированного лития, был преимущественно переносится на металл, но также в меньшей степени на атомы кислорода, фтора и серы внутри интеркалированного соединения. Доля заряда лития, идущего к разным атомам, варьируется от одного переходного металла к другому в пределах ряда M = Fe, Co, Ni.Для переходного металла она уменьшается с 0,5 до 0,4 и 0,1 для M = Fe, Co, Ni. Подобные диапазоны переноса заряда (0,5, 0,3, 0,1 для Fe, Co, Ni) были получены на оливин-фосфатных катодах, исследованных в рамках следующей серии LiMPO 4 (M = Mn, Fe, Co, Ni), также показывающих возрастающие значения потенциала от Fe до Ni (Bhowmik et al. , 2013; Yu et al., 2011). Как для NiSO 4 F (Frayret et al., 2010), так и для NiPO 4 (Yu et al., 2011) заряд преимущественно переносится на кислород.Для семейства фторсульфатов оценка парных компонентов электростатического взаимодействия, как правило, указывает на то, что различия в дальнодействующем электростатическом взаимодействии в различных хозяевах могут объяснять, по крайней мере, частично (и в дополнение к стабилизации, обеспечиваемой наполовину заполненными орбиталями в случае FeSO 4). F), увеличение напряжения при переходе от Fe к Co и от Co к Ni (рисунок 15.10).
, 2013; Yu et al., 2011). Как для NiSO 4 F (Frayret et al., 2010), так и для NiPO 4 (Yu et al., 2011) заряд преимущественно переносится на кислород.Для семейства фторсульфатов оценка парных компонентов электростатического взаимодействия, как правило, указывает на то, что различия в дальнодействующем электростатическом взаимодействии в различных хозяевах могут объяснять, по крайней мере, частично (и в дополнение к стабилизации, обеспечиваемой наполовину заполненными орбиталями в случае FeSO 4). F), увеличение напряжения при переходе от Fe к Co и от Co к Ni (рисунок 15.10).
Рисунок 15.10. (а) Расчетные составляющие парного притяжения и отталкивания электростатического взаимодействия в фазах LiMSO 4 F и MSO 4 F (M = Fe, Co, Ni) (для U = 4 эВ, 6 эВ и 7 эВ соответственно) .(б) Сравнение результирующих парных компонент электростатического взаимодействия.
Из Frayret et al. (2010). Aurbach et al. (Osnis et al., 2013) завершили работу по оливиновым фосфатам путем исследования смешанных составов LiM 1 – y Mʹ y PO 4 (M / Mʹ = Mn, Fe и Co) и коррелированные изменения объема ячейки с общей эволюцией атомных объемов Бадера в ходе электрохимического процесса в зависимости от состава переходного металла. Было показано, что модуляция объемов кислорода имеет заметный эффект, в то время как размер катионов металлов имеет незначительное влияние.
Было показано, что модуляция объемов кислорода имеет заметный эффект, в то время как размер катионов металлов имеет незначительное влияние.
Одна из интересных особенностей решеток на основе полианионов основана на богатстве полиморфных фаз, присущих многим соединениям. Интересно, но не удивительно, что дифференциация напряжения сопровождает различия в кристаллических формах. Например, в полностью упорядоченной таворитовой и полностью неупорядоченной триплитной формах LiFeSO 4 F средние напряжения соответственно составляют 3.6 и 3,9 В. Из-за различий в многогранной связности и пространственном расположении полиморфизм обязательно влияет на результирующие связи (сила перекрытия / механизмы обмена), а также на общее дальнодействующее электростатическое / короткодействующее отталкивание электронов. Вследствие вовлечения всех этих параметров в окислительно-восстановительный потенциал, характеризующий электрохимически активные частицы, сдвиги напряжения от одного полиморфа к другому можно рационализировать посредством точного анализа этих характеристик при условии, что соответствующие структуры известны из эксперимента или легко переносятся на модели. для использования в качестве входов ДПФ.Изучая такие аспекты для сравнения таворитовой и триплитной форм LiFeSO 4 F, Doublet et al. (Ben Yahia et al., 2012) продемонстрировали, что происхождение повышения напряжения в основном лежит в различии между обеими анионными сетками, а точнее в различии в степени электростатического отталкивания, вызванного различными конфигурациями атомов фтора вокруг переходный металл ( транс – против цис – конфигурации в таворите vs.триплитные полиморфы). Arroyo-de Dompablo et al. (Saracibar et al., 2012) исследовали взаимосвязь между стабильностью полиморфов Li 2 – x FeSiO 4 и электрохимией. Они показали, что стабильность полиморфов делитированного Li 2 – x FeSiO 4 контролируется сильным кулоновским отталкиванием между катионами Fe 3 + (или Fe 4 + ) и Si 4 + . Снижение напряжения примерно на 0,3 В для первой электронной реакции было приписано превращению полиморфов 2D-Li 2 FeSiO 4 в трехмерный каркас в результате делитирования.
для использования в качестве входов ДПФ.Изучая такие аспекты для сравнения таворитовой и триплитной форм LiFeSO 4 F, Doublet et al. (Ben Yahia et al., 2012) продемонстрировали, что происхождение повышения напряжения в основном лежит в различии между обеими анионными сетками, а точнее в различии в степени электростатического отталкивания, вызванного различными конфигурациями атомов фтора вокруг переходный металл ( транс – против цис – конфигурации в таворите vs.триплитные полиморфы). Arroyo-de Dompablo et al. (Saracibar et al., 2012) исследовали взаимосвязь между стабильностью полиморфов Li 2 – x FeSiO 4 и электрохимией. Они показали, что стабильность полиморфов делитированного Li 2 – x FeSiO 4 контролируется сильным кулоновским отталкиванием между катионами Fe 3 + (или Fe 4 + ) и Si 4 + . Снижение напряжения примерно на 0,3 В для первой электронной реакции было приписано превращению полиморфов 2D-Li 2 FeSiO 4 в трехмерный каркас в результате делитирования.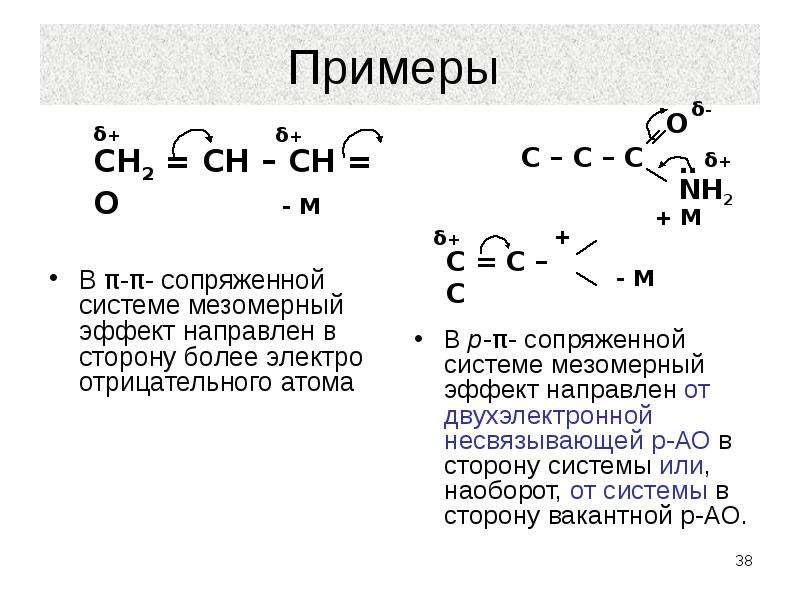
В целом дифференциация полиморфов в отношении их электрохимического профиля имеет тенденцию раздвигать пределы единственного рассмотрения индуктивного эффекта, чтобы предложить новые и все более эффективные материалы, по крайней мере, с точки зрения увеличения напряжения катодов. Подходы к тонкой настройке также должны охватывать структурное расположение строительных блоков и их последствия по отношению к глобальному изменению общей энергетической и электронной структуры ландшафта. Такая методология может служить для обеспечения более глубокого понимания основных движущих сил и правил выбора для выбора оптимизированных ингредиентов, а также их связи.
Попытки использовать DFT для прямого руководства экспериментальной работой были предприняты недавно (Armand et al., 2011; Chen et al., 2012; Hautier et al., 2011a, b). Во-первых, систематическая замена в рамках существующих структурных типов может избежать экспериментальных испытаний методом проб и ошибок. Например, было высказано предположение, что замена O на N / F соответственно улучшит / ухудшит электрохимические характеристики Li 2 FeSiO 4 (Armand et al.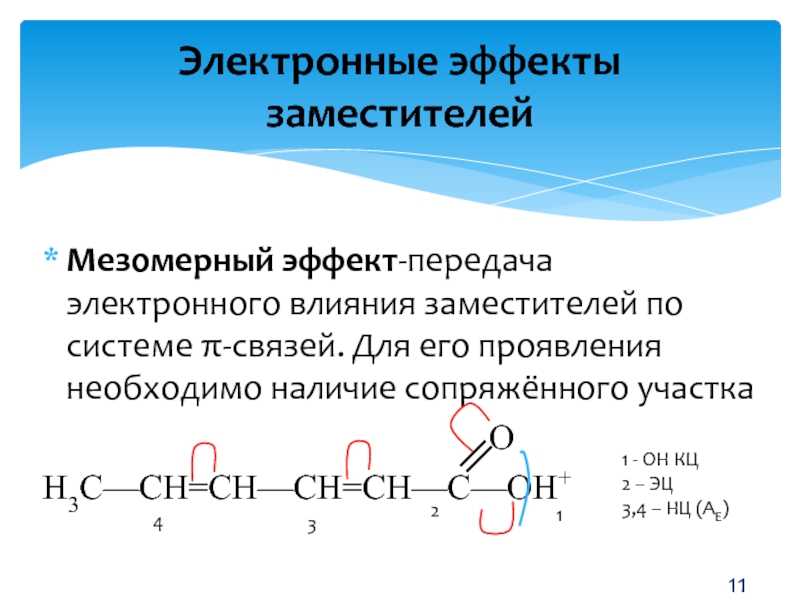 , 2011). С другой стороны, вычислительный подход с высокой пропускной способностью (Chen et al., 2012; Hautier et al., 2011a, b) использовался группой Ceder для скрининга большого количества возможных полианионных соединений для использования в качестве катодов. Сравнение вычисленных значений стабильности, напряжений и плотностей энергии показало, что различные карбонофосфаты и карбоносиликаты являются многообещающими материалами для хранения энергии. После этих исследований комбинированный теоретический и экспериментальный подходы были посвящены изучению Na 3 MnPO 4 CO 3 , который показал редко наблюдаемую реакцию двухэлектронной интеркаляции, в которой и Mn 3 + / Mn 2 + и Mn 4 + / Mn 3 + окислительно-восстановительные пары были электрохимически активными (Chen et al., 2013).
, 2011). С другой стороны, вычислительный подход с высокой пропускной способностью (Chen et al., 2012; Hautier et al., 2011a, b) использовался группой Ceder для скрининга большого количества возможных полианионных соединений для использования в качестве катодов. Сравнение вычисленных значений стабильности, напряжений и плотностей энергии показало, что различные карбонофосфаты и карбоносиликаты являются многообещающими материалами для хранения энергии. После этих исследований комбинированный теоретический и экспериментальный подходы были посвящены изучению Na 3 MnPO 4 CO 3 , который показал редко наблюдаемую реакцию двухэлектронной интеркаляции, в которой и Mn 3 + / Mn 2 + и Mn 4 + / Mn 3 + окислительно-восстановительные пары были электрохимически активными (Chen et al., 2013).
Что такое индуктивные эффекты – “I” и + “I”?
Эффект -I или Отрицательный индуктивный эффект возникает, когда заместитель отводит электроны.
Эффект + I или Положительный индуктивный эффект возникает, когда заместитель отдает электроны.
Индуктивные эффекты
Рассмотрим облигацию # “C-F” #.
Сильно электроотрицательный атом # “F” # будет притягивать электроны в связи # “C-F” # ближе к себе.”+”) (“R”) #
Опять же, эффект передается по цепочке атомов углерода, но с расстоянием быстро исчезает.
-И эффект
Сила карбоновой кислоты зависит от степени ее ионизации: чем больше она ионизирована, тем она сильнее.
По мере того, как кислота становится сильнее, численное значение ее # “p” K_text (a) # падает.
Так, например. порядок кислотности, показанный значениями # “p” K_text (a) #, составляет
#underbrace (“Br-CH” _2 “CH” _2 “CH” _2 “COO-H”) _ цвет (красный) (4.59) <нижний брейс ("Br-CH" _2 "CH" _2 "COO-H") _ цвет (красный) (4.01) <нижний бейдж ("Br-CH" _2 "COO-H") _ цвет (красный) (2,86) #
Электроотрицательный атом # “Br” # удаляет электронную плотность у соседних атомов, в конечном итоге ослабляя связь # “O-H” # на другом конце цепи и делая соединение более кислым.
Поскольку этот эффект вызван индуктивным удалением электронов, он называется
a -I эффект
+ I эффект
Таким же образом электронодонорная алкильная группа снижает кислотность карбоновой кислоты.
Так, например. порядок кислотности, показанный значениями # “p” K_text (a) #, составляет
#underbrace (“CH” _3 “-CH” _2 “COO-H”) _ цвет (красный) (4.87) Таким образом, уксусная кислота слабее муравьиной кислоты, а пропионовая кислота слабее уксусной кислоты. Поскольку этот эффект вызван индуктивным донором электронов, он называется Заместитель в бензольном кольце может влиять на размещение дополнительных заместителей на этом кольце во время электрофильного Ароматическая замена. Три основных положения дизамещенного бензольного кольца: орто , мета и пара . Fi gure 1 : Влияние электронодонорных групп на бензольное кольцо Первый сценарий добавления электрофила к монозамещенному бензольному кольцу – это когда заместителем является электронодонорная группа .Электронодонорные группы представляют собой алкильные группы, фенильные группы или заместители, которые имеют неподеленную пару электронов на атоме, непосредственно связанном с кольцом. Группы доноров электронов жертвуют посредством индукции (Активация и Деактивация бензольных колец) и резонанса. Электронодонорные группы заставляют второй заместитель присоединиться к пара или орто-положению на бензольном кольце.Причину этого можно объяснить разными резонансными структурами карбокатиона в орто-, мета- и пара-положениях. Некоторые электронодонорные группы имеют дополнительную резонансную форму, при которой существует двойная связь между атомом и углеродом бензола. Это очень устойчивая резонансная форма. Это связано с управляющими эффектами заместителей при сопряжении с бензольным кольцом. Когда электрофил добавляется в орто-положение, возможны три различные формы резонанса.Формы 1 и 2 карбокатиона являются вторичными карбокатионами, но положение 3 образует третичный карбокатион, и положительный заряд находится на углероде, непосредственно присоединенном к группе донора электронов, которая является наиболее стабильной. Если электрофил добавлен к монозамещенному бензольному кольцу в пара-положении, одной из трех резонансных форм карбокатионов будет третичный карбокатион, который очень стабилен из-за эффекта + I, если три -CH 3 . Этот интермедиат карбокатиона такой же, как и тот, который образуется в результате орто-замещения. Для резонансных структур мета-замещенного карбокатиона существует три возможных резонанса, которые являются вторичными карбокатионами.Эти формы не так стабильны, как форма третичного карбокатиона в орто- и пара-замещенных карбокатионах. Следовательно, двумя основными продуктами реакции монозамещенного бензольного кольца с электронодонорной группой и дополнительным электрофилом являются положения орто и пара . H-ЯМР может использоваться для определения того, имеет ли соединение второй заместитель в орто- или параположении.В орто-положении есть четыре различных сигнала, но для пара-положения есть только два сигнала, потому что молекула симметрична. Сообщается, что электронодонорные группы на бензольном кольце активируют , потому что они увеличивают скорость второго замещения, так что она на выше на , чем у стандартного бензола. Электронодонорные группы называются орто / пара-направляющими и являются активаторами. Другое обстоятельство – это когда вы добавляете дополнительный электрофил к монозамещенному бензольному кольцу с электроноакцепторной группой на нем.У электроноакцепторных групп есть атом с небольшим положительным или полным положительным зарядом, непосредственно связанный с бензольным кольцом. Когда второй электрофил добавляется к бензольному кольцу в орто-положении, образуются те же три резонансные формы карбокатиона.Опять же, одна из форм представляет собой третичный карбокатион с положительным зарядом на углероде, непосредственно присоединенным к электроноакцепторной группе. В отличие от случая с электронодонорной группой, эта резонансная форма намного менее устойчива . Это происходит из-за того, что электроноакцепторная группа отталкивает электроны от углерода, создавая еще более сильный положительный заряд. Эта ситуация верна и для пара-замещенной резонансной формы третичного карбокатиона. Для мета-позиции все образующиеся карбокатионы вторичны.Хотя они не совсем стабильны, они более предпочтительны, чем резонансные формы орто- и пара-положений. Основным продуктом монозамещенного бензольного кольца с электроноакцепторной группой и дополнительным электрофилом является продукт с мета-замещением . В отличие от электронодонорных групп, электроноакцепторные группы деактивируют . Это означает, что скорость второго замещения ниже, чем у стандартного бензола. Галогены очень электроотрицательны. Группы вывода электронов являются мета-директорами и деактиваторами. Индуктивный эффект – это постоянное состояние поляризации. Атом XXX выше приобретает слегка отрицательный заряд (δ -), (\ delta -), (δ−), а атом углерода – слегка положительный заряд (δ +), (\ delta +), (δ +), что означает, что связь поляризована: Если электроотрицательный атом XXX связан с цепочкой атомов углерода, то положительный заряд передается другим атомам углерода. C1C_ {1} C1, с его положительным зарядом δ \ deltaδ, притягивает электроны C2C_2C2, но притяжение слабее, чем между XXX на C1C_1C1.\ text {rd} .3rd. Эффект индукции постоянный, но относительно слабый, и его можно легко затмить электронными эффектами, которые обсуждаются позже. Есть две категории индуктивных эффектов: электроноакцепторный (-I-эффект) и -высвобождающий электроны (+ I-эффект). Последний также называется электронодонорным эффектом . На изображении выше XXX отводит электроны, а YYY отдает электроны. Эти относительные индуктивные эффекты измерены применительно к водороду: NO2> COOH> F> Cl> Br> I> OR> OH> C6H5 (бензол)> H> Me3C-> Me2CH-> MeCh3-> Ch4-. Эффект -I наблюдается вокруг более электроотрицательного атома или группы, и электронная плотность там выше, чем где-либо в молекуле. Электроноакцепторные группы включают галоген, нитро (-NO2), (- \ text {NO} _2), (- NO2), циано (-CN), (- \ text {CN}), (- CN), карбокси (-COOH), (- \ text {COOH}), (- COOH), сложный эфир (-COOR), (- \ text {COOR}), (- COOR) и арилокси (-OAr).(- \ text {OAr}). (- OAr). Эффект + I наблюдается среди менее электроотрицательных атомов молекулы посредством электрон-освобождающих (или электронодонорных) групп. Алкильные группы обычно считаются электронодонорными (или электронодонорными) группами. Написано CM Jana Последнее обновление В этой статье вы узнаете об индуктивном эффекте, включая определение, примеры, порядок и приложения. В ковалентной σ-связи между двумя атомами с разной электроотрицательностью более электроотрицательный атом притягивает связывающую электронную пару к себе из-за своего большего сродства к электронам. Как следствие, частичный отрицательный заряд (δ–) возникает на более электроотрицательном атоме, а частичный положительный заряд (δ +) возникает на другом. Таким образом, ковалентная связь может быть поляризована из-за неравного распределения связывающего электрона, что приводит к постоянному диполю в связи.Это постоянное состояние поляризации связи называется индуктивным эффектом. Эффект индукции обычно обозначается символом (-> -), где стрелка всегда направлена в сторону более электроотрицательного атома. В соединении с длинной цепью индуктивный эффект передается от одного атома к другому, но эффект быстро спадает и становится незначительным. Таким образом, в длинноцепочечном углеродном соединении, если концевой атом углерода связан с электроотрицательным атомом галогена (электроноакцепторной группой), тогда положительный заряд передается по углеродной цепи, и индуктивный эффект может быть представлен как в следующая диаграмма, Аналогичным образом, когда электронодонорная группа или атом присоединены к концевому атому углерода углеродной цепи, отрицательный заряд передается по углеродной цепи, и индуктивный эффект может быть представлен, как на следующей диаграмме, Когда атом или группа отдает электроны связи и приобретает частичный положительный заряд, атом или группа называется группой + I, а соответствующий эффект называется положительным индуктивным эффектом или эффектом + I. Пример групп + I: – O – , – COO – , –CR 3 , –CHR 2 , –CH 2 R, –Ch4, –D Когда атом или группа притягивает связывающие электроны к себе и приобретает частичный отрицательный заряд, атом или группа называется группой -I, а соответствующий эффект называется индуктивным эффектом отвода электронов или эффектом -I. Пример групп -I: –NO 2 , – SO 2 R, –CN, –SO 2 Ar, –COOH, –F, – Cl, – Br, – I, –OAr, –COOR , –OR, –COR, –SH, –SR, –OH, –Ar, – CH = CR 2 Следующие группы перечислены приблизительно в порядке убывания силы для обоих эффектов – I и + I. – O – > – COO – > –CR 3 > –CHR 2 > –CH 2 R> –Ch4> –D -NR 3 + > -SR 2 + > -NH 3 + > –NO 2 > – SO 2 R> –CN> –SO 2 Ar > –COOH> –F> – Cl> – Br> – I> –OAr> –COOR> –OR> –COR> –SH> –SR> –OH> –Ar> – CH = CR 2 Индуктивный эффект влияет на следующие важные свойства органических соединений, которые могут составлять
эффект + I Индуктивные эффекты алкильных групп
 Как мы узнаем, где, скорее всего, будет размещен дополнительный заместитель? Ответ на этот вопрос заключается в индуктивных и резонансных эффектах. Индуктивные эффекты напрямую связаны с электроотрицательностью. Заместители могут быть мета-направлениями или орто-пара-направлениями.
Как мы узнаем, где, скорее всего, будет размещен дополнительный заместитель? Ответ на этот вопрос заключается в индуктивных и резонансных эффектах. Индуктивные эффекты напрямую связаны с электроотрицательностью. Заместители могут быть мета-направлениями или орто-пара-направлениями. Введение
 Примеры электронодонорных групп: -CH 3, -OCH 3 , -OH, -NH 2
Примеры электронодонорных групп: -CH 3, -OCH 3 , -OH, -NH 2  Этот карбокатион также стабилизируется электронами из электронодонорной группы. Более стабильные промежуточные соединения (карбокатион) имеют более низкую энергию переходного состояния и, следовательно, более высокую скорость реакции, с образованием большего количества этого продукта. Это причина того, что орто-положение является одним из основных продуктов.
Этот карбокатион также стабилизируется электронами из электронодонорной группы. Более стабильные промежуточные соединения (карбокатион) имеют более низкую энергию переходного состояния и, следовательно, более высокую скорость реакции, с образованием большего количества этого продукта. Это причина того, что орто-положение является одним из основных продуктов.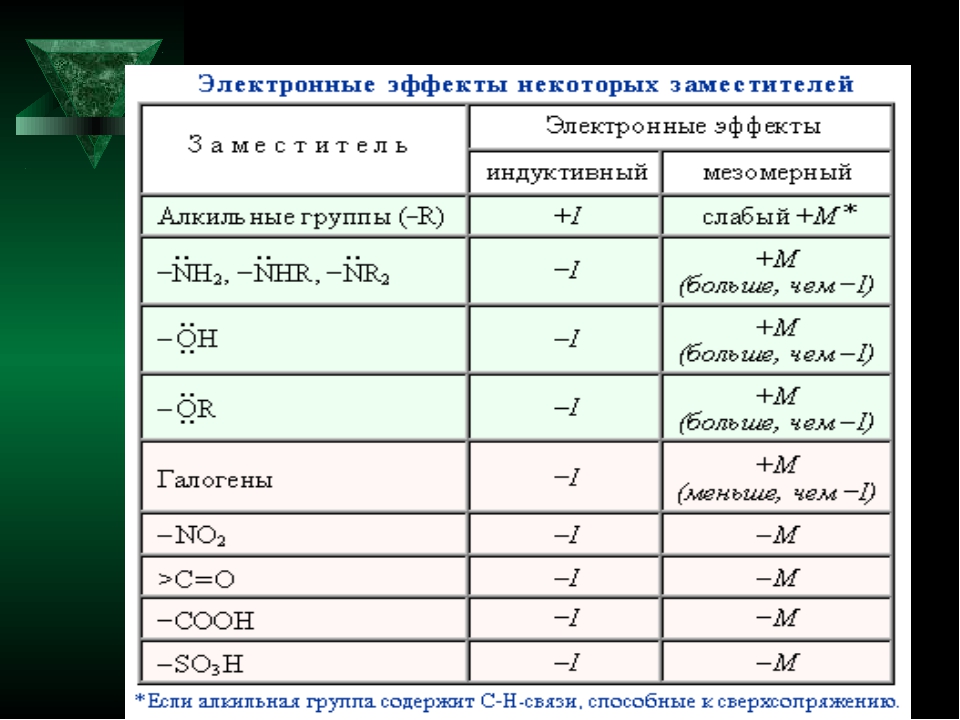 Важно отметить, что пара-продукт встречается немного чаще, чем орто-продукт из-за стерических затруднений.
Важно отметить, что пара-продукт встречается немного чаще, чем орто-продукт из-за стерических затруднений. Влияние группы отвода электронов на бензольное кольцо
 Примеры электроноакцепторных групп: -CF 3, – COOH, -CN. У электроноакцепторных групп есть только один основной продукт, второй заместитель добавляет в мета-положение . Опять же, это можно объяснить резонансными формами интермедиатов карбокатиона.
Примеры электроноакцепторных групп: -CF 3, – COOH, -CN. У электроноакцепторных групп есть только один основной продукт, второй заместитель добавляет в мета-положение . Опять же, это можно объяснить резонансными формами интермедиатов карбокатиона.
Орте- и пара-дирекция Мета-направление Сильная активация Умеренно активирующий Слабая активация Слабо отключается Умеренное отключение Полное отключение -NH 2 -NHR -OH -OCH 3 -NHCOR -OCOR -CH 3 -фенил -F -Cl -Br -I -COH -COCH 3 -COOCH 3 -SO 3 H -НО 2 -CF 3 -CCl 3 Галогены: особый случай
 Это означает, что они индуктивно отводят электроны. Однако из-за их способности отдавать неподеленную пару электронов в резонансных формах, они являются активаторами и орто / пара направляющими. В режиссуре побеждают формы резонанса. Поскольку галогены поглощают электроны, они являются очень слабыми активаторами.
Это означает, что они индуктивно отводят электроны. Однако из-за их способности отдавать неподеленную пару электронов в резонансных формах, они являются активаторами и орто / пара направляющими. В режиссуре побеждают формы резонанса. Поскольку галогены поглощают электроны, они являются очень слабыми активаторами. Список литературы
Проблемы
Авторы
Индуктивный эффект, электромерный эффект, резонансные эффекты и гиперконъюгация
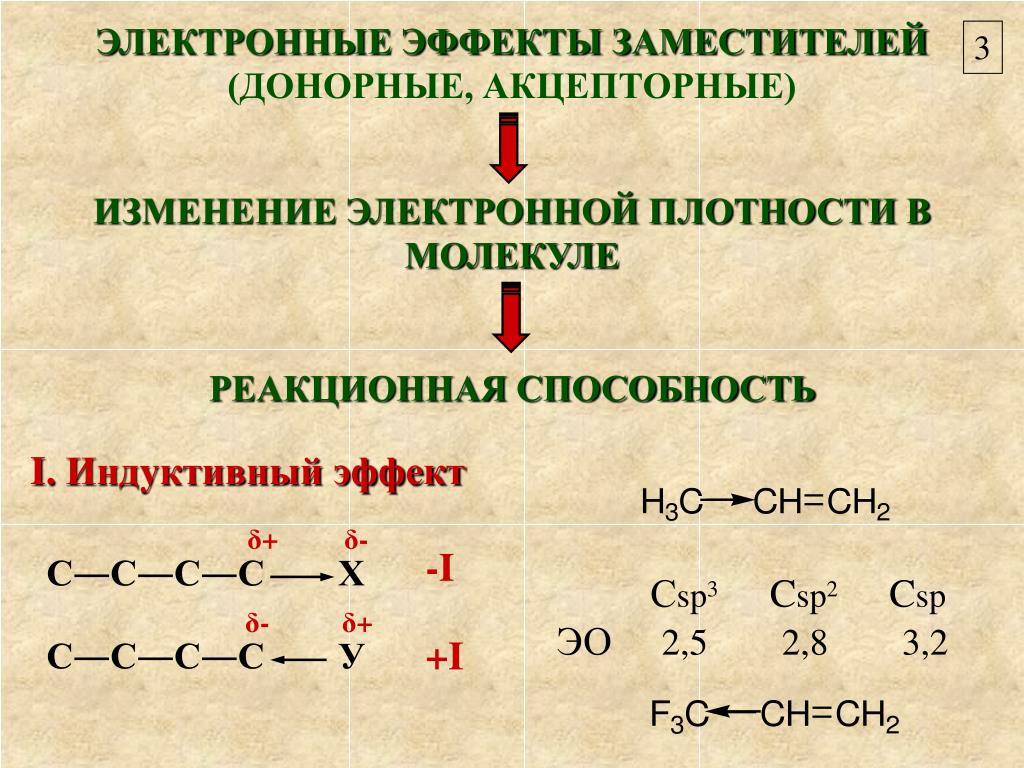 {\ delta-} Cδ + −Xδ−
{\ delta-} Cδ + −Xδ− -.NO2> COOH> F> Cl> Br> I> OR> OH> C6 H5 (бензол)> H> Me3 C-> Me2 CH-> MeCh3 -> Ch4 -.
-.NO2> COOH> F> Cl> Br> I> OR> OH> C6 H5 (бензол)> H> Me3 C-> Me2 CH-> MeCh3 -> Ch4 -.
-I эффект:
+ I эффект: Что такое индукционный эффект? Виды, порядок, применение индукционного эффекта

+ I Эффект

-I эффект



 У вещества очень слабые кислотные свойства.
У вещества очень слабые кислотные свойства.