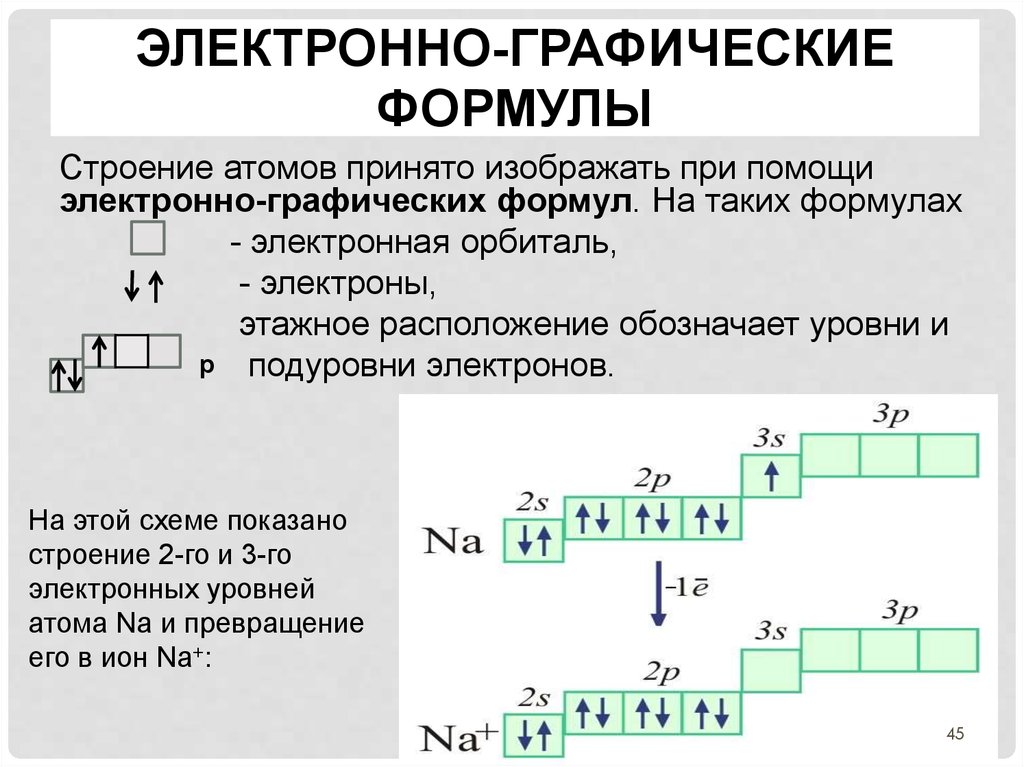
Пользуясь периодической таблицей менделеева составьте схемы
Пользуясь периодической таблицей менделеева составьте схемы
Тест по химии по теме: контрольные и тестовые работы по.
Тема 9. “строение атома. Периодический закон и.
Химия 11кл_рудзитис_фельдман_гдз_2000 стр 7.
Для азота указать: сколько электронов у атомов этого элемента.
Вяземский а. | рабочая тетрадь по химии. 11 класс | журнал. Пользуясь таблицей периодической системы химических. Пособие по химии. Министерство образования и науки российской федерации.Третий период периодической системы — википедия.
Составьте схемы распределения электронов.
 § 3-5, 15 вопрос. Урок №49. Алюминий. Положение алюминия в периодической.
Задачи к разделу электродные процессы, гальванический.
§ 3-5, 15 вопрос. Урок №49. Алюминий. Положение алюминия в периодической.
Задачи к разделу электродные процессы, гальванический.§4. 2 периодическая таблица элементов.
Строение атома серы и схема электронной оболочки.Периодическая таблица технологий будущего.
Периодическая ванадия справочник химика 21. Галогены — википедия. Скачать игры 2010 через торрент на пк Чак паланик колыбельная книга скачать Торрент сезон охоты 4 страшно глупо скачать Решебник по обществознанию рабочая тетрадь 6 класс иванова Фильмы торрент скачать для планшетовПериодическая ванадия – Справочник химика 21
На каком основании хром и сера, фосфор и ванадий расположены в одной группе периодической системы Почему нх помещают в разных подгруппах [c. 45]
45]Элементы подгруппы ванадия. Ванадий V и его электронные аналоги — ниобий ЫЬ, тантал Та и недавно синтезированный 105-й элемент нильсборий N5 являются элементами побочной подгруппы пятой группы периодической системы элементов Д. И. Менделеева. Электронная структура их атомов выражается формулой. .. п — где п — номер внешнего слоя, совпадающий с номером [c.285]
Ванадий, ниобий и тантал между собой и с металлами, близко расположенными к ним Q периодической системе (подгрупп железа, титан,1 и хрома), образуют металлические твердые растворы. По мере /величения различий в электронно.м строении взаимодействую- [c.541]
Кроме бериллия, электролизом расплавленных солей можно получать и другие тугоплавкие металлы (скандий, иттрий, титан, цирконий, гафний, торий, ванадий, ниобий, тантал, хром, молибден, вольфрам и рений).
Из следующих за скандием элементов титан имеет структуру 2, 8, 10, 2, ванадий — 2, 8, 11, 2 и т. д. Дальнейшее заполнение второго снаружи слоя приостанавливается лишь начиная с меди (№ 29), атом которой имеет структуру 2, 8, 18, 1. Распределение электронов по слоям в атомах еще более тяжелых элементов показано на приводимой таблице, представляющей собой периодическую систему элементов в форме, предложенной Вернером.
Но атомы металлов третьего переходного ряда, от Ьи до Н , не настолько больше атомов соответствующих металлов второго переходного ряда, как можно было бы ожидать. Причина этого заключается в том, что после Ьа вклиниваются металлы первого внутреннего переходного ряда-лантаноиды. Переход от Ьа к Ьи сопровождается постепенным уменьшением размера атомов по причине возрастания ядерного заряда-этот эффект носит название лантаноидного сжатия. Поэтому атом гафния оказывается не столь большим, как следовало бы ожидать, если бы он располагался в периодической таблице непосредственно за Ьа. Заряд ядра у 2г на 18 единиц больше, чем у Т1, а у НГ он на 32 единицы больше, чем у 2г. Вследствие указанного обстоятельства металлы второго и третьего переходных рядов имеют не только одинаковые валентные электронные конфигурации в одинаковых группах, но также почти одинаковые размеры атомов. Поэтому металлы второго и третьего переходных рядов обладают большим сходством свойств между собой, чем с металлами первого переходного ряда. Титан напоминает 2г и НГ в меньшей мере, чем Zr и НГ напоминают друг друга. Ванадий отличается от МЬ и Та, но сами названия тантал и ниобий указывают, как трудно отделить их один от другого. Тантал и ниобий были открыты в 1801 и 1802 гг., но почти полвека многие химики считали, что имеют дело с одним и тем же элементом. Трудность выделения тантала послужила поводом назвать его именем мифического древнегреческого героя Тантала, обреченного на вечный бесцельный труд.
Поэтому атом гафния оказывается не столь большим, как следовало бы ожидать, если бы он располагался в периодической таблице непосредственно за Ьа. Заряд ядра у 2г на 18 единиц больше, чем у Т1, а у НГ он на 32 единицы больше, чем у 2г. Вследствие указанного обстоятельства металлы второго и третьего переходных рядов имеют не только одинаковые валентные электронные конфигурации в одинаковых группах, но также почти одинаковые размеры атомов. Поэтому металлы второго и третьего переходных рядов обладают большим сходством свойств между собой, чем с металлами первого переходного ряда. Титан напоминает 2г и НГ в меньшей мере, чем Zr и НГ напоминают друг друга. Ванадий отличается от МЬ и Та, но сами названия тантал и ниобий указывают, как трудно отделить их один от другого. Тантал и ниобий были открыты в 1801 и 1802 гг., но почти полвека многие химики считали, что имеют дело с одним и тем же элементом. Трудность выделения тантала послужила поводом назвать его именем мифического древнегреческого героя Тантала, обреченного на вечный бесцельный труд.
Ванадий, ниобий и тантал между собой и с металлами, близко расположенными к ним в периодической системе (подгрупп железа, титана и хрома), образуют металлические твердые растворы. По мере увеличения различий в электронном строении взаимодействующих металлов возможность образования твердых растворов уменьшается
Характер взаимодействия титана и его аналогов с металлами зависит от положения последних в периодической системе. Так, с близкими к нему по свойствам хромом и ванадием титан образует непрерывный ряд твердых растворов замещения [c.532]
В соответствии с положением в Периодической системе напишите формулы высших окислов следующих элементов бора, хрома, вольфрама, марганца, ванадия, урана. [c.140]
Ванадий, ниобий и тантал составляют VB-подгруппу периодической системы, К этой подгруппе относится также элемент № 105, искусственно полученный в 1967 г.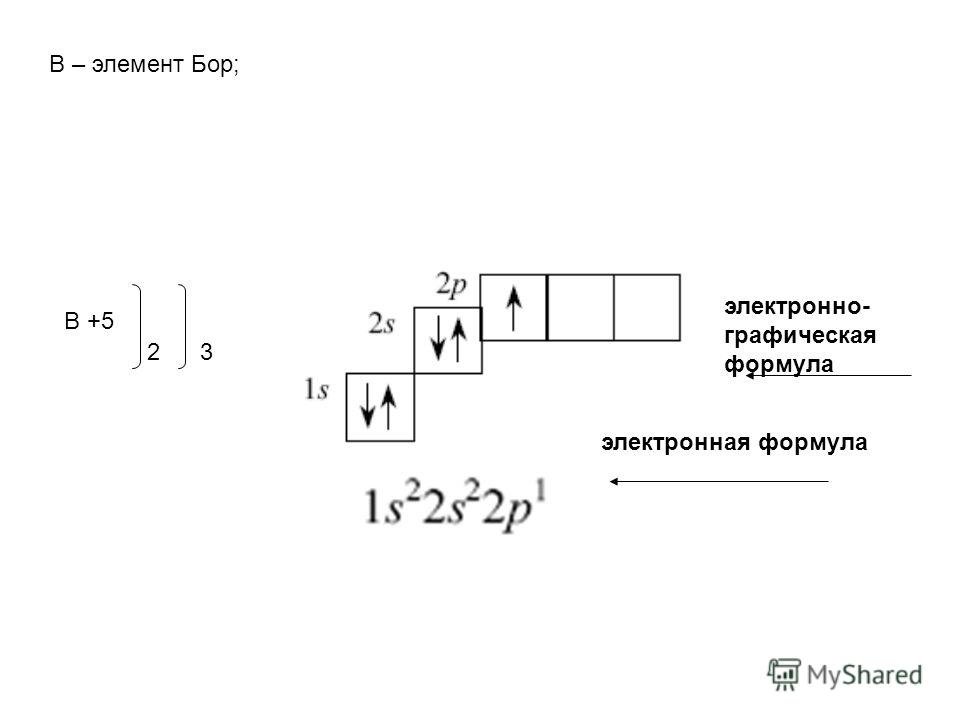
Существенным недостатком обычного варианта периодической системы являлось то обстоятельство, что в нем не была выявлена связь между типическими элементами каждой группы и членами ее левой и правой подгрупп. Так, из системы вытекало, что, например, в V группе сурьма является аналогом мышьяка, ниобий — аналогом ванадия и фосфор — аналогом азота. Оставалось, однако, неясным, в каком отношении к фосфору стоят ванадий и мышьяк.
Периодическая таблица – это графическое отображение Периодического закона. В ней компактно представлен огромный объем химических знаний, их современная классификация и систематизация. При умелом пользовании она представляет огромные возможности дня исследователя. На основе предсказанных с помощью таблицы свойств можно осуществлять поиск элементов в природе (например, в соединениях титана всегда существует примесь соединений ванадия – ванадий сопутствует титану). Возможно осуществлять поиск новых
В ней компактно представлен огромный объем химических знаний, их современная классификация и систематизация. При умелом пользовании она представляет огромные возможности дня исследователя. На основе предсказанных с помощью таблицы свойств можно осуществлять поиск элементов в природе (например, в соединениях титана всегда существует примесь соединений ванадия – ванадий сопутствует титану). Возможно осуществлять поиск новых
Периодические коллоидные структуры образуют многие вирусы, бактерии, монодисперсные золи металлов, золи пятиокиси ванадия, латексы. [c.319]
Элементы ванадий V, ниобий Ь, тантал Та и нильсборий N5 составляют УБ группу Периодической системы Д. И. Менделеева. Нильсборий — радиоактивный элемент, его наиболее долгоживущий изотоп — (период полураспада 34 с). Ва- [c.235]
УВ-группу периодической системы элементов составляют ванадий, ниобий и тантал. [c.89]
Периодическая система элементов Менделеева заканчивалась на 92 элементе — уране.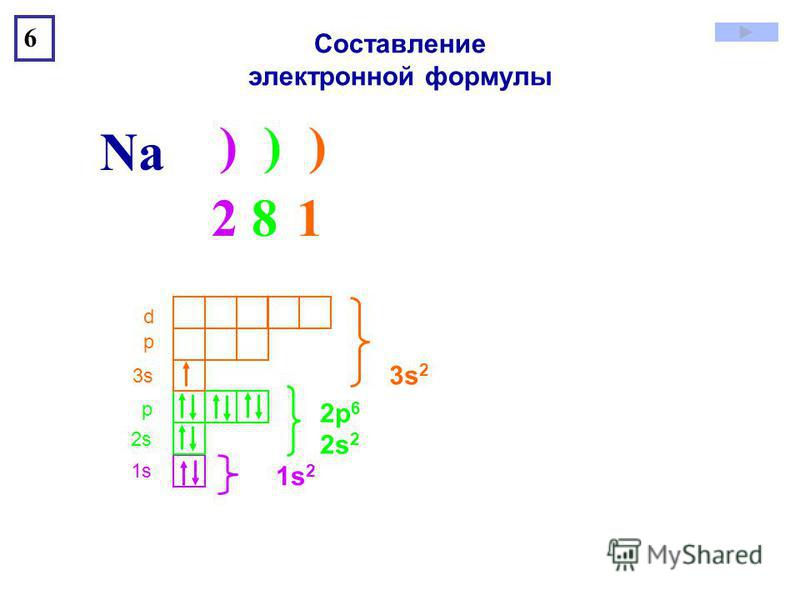
При решении этого вопроса долгое время руководствовались теми, по существу случайно избранными, отдельными свойствами элементов, которые наиболее бросались в глаза. Так, применительно к V группе исходили из наличия водородных соединений типа ЭНз и у фосфора, и у мышьяка при отсутствии подобного соединения у ванадия. На этом основании подгруппу мышьяка рассматривали как главную подгруппу V группы, являющуюся непосредственным продолжением ее типических элементов, Напротив, подгруппу ванадия рассматривали как побочную , совершенно оторванную от фосфора и азота. В результате становилось не оправданным само помещение элементов подгруппы ванадия в V группу.
Элементы, составляющие lA группу периодической системы, называются щелочными металлами, элементы, составляющие ИА группу (кроме Ве), — щелочноземельными металлами. В остальных группах название дается по первому элементу— подгруппа скандия, титана, ванадия и др. [c.54]
Пятая группа периодической системы включает два типических элемента — азот и фосфор — и подгруппы мышьяка и ванадия. Между первым и вторым типическпми элементами наблюдается значительное различие в свойствах. В состоянии простых веществ азот — газ, а фосфор — твердое тело. Такое же положение имеет место и в VI группе системы, но там первый типический элемент (кислород), как и следовало ожидать, намного химически активнее серы. В V же группе, наоборот, второй типический элемент (фосфор, особенно белый) более активен как простое вещество, чем азот.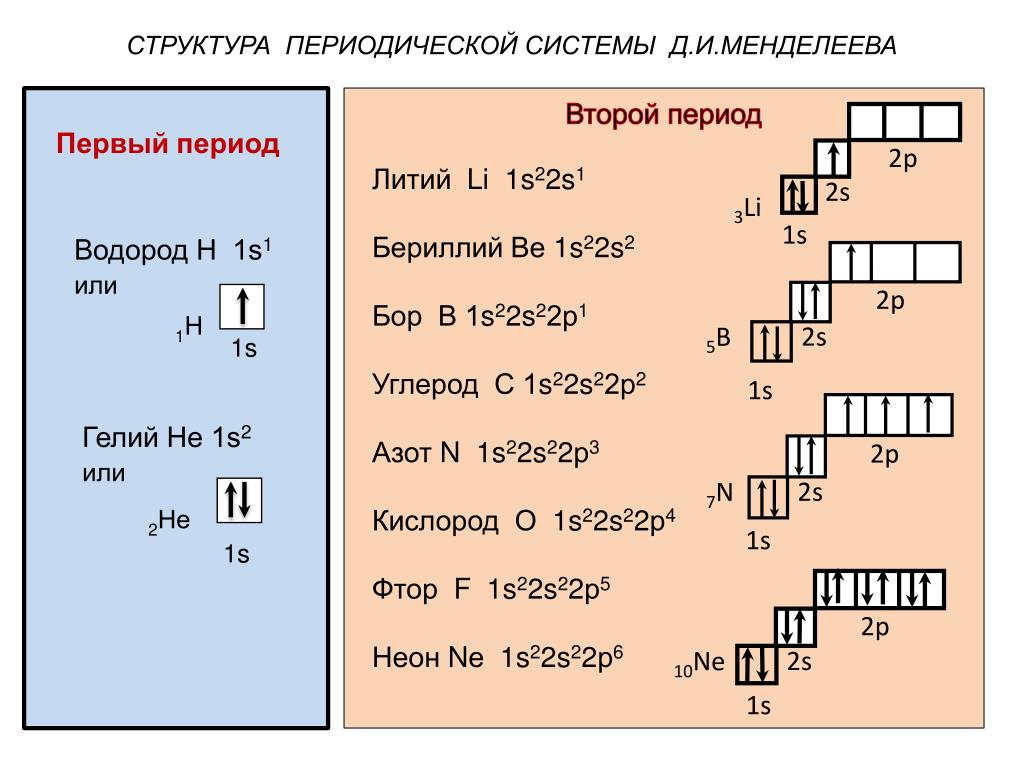 Дело в том, что образование соединений первого порядка — это процесс химического взаимодействия между атомами, а не молекулами. Поэтому на химическую активность элемента (атома) решающее влияние оказывает энергия диссоциации гомоатомных соединений на атомы. А энтальпия диссоциации молекул азота N2 на атомы в 1,5 раза больше этой величины для молекул фосфора Р4 (с учетом энергии сублимации менее активного красного фосфора). Это обстоятельство является основной причиной большей химической активности фосфора по сравнению с азотом. В то же время атомы азота, естественно, химически гораздо активнее атомов фосфора. Так, ОЭО азота 3,0, а фосфора 2,]. Таким образом, когда речь идет о большей химической активности фосфора по сравнению с азотом, нужно иметь в виду активность простых веществ, а не элементов. Несмотря на имеющиеся различия между азотом и фосфором оба типических элемента и их производные — важнейшие составные части растительных и животных организмов. [c.245]
Дело в том, что образование соединений первого порядка — это процесс химического взаимодействия между атомами, а не молекулами. Поэтому на химическую активность элемента (атома) решающее влияние оказывает энергия диссоциации гомоатомных соединений на атомы. А энтальпия диссоциации молекул азота N2 на атомы в 1,5 раза больше этой величины для молекул фосфора Р4 (с учетом энергии сублимации менее активного красного фосфора). Это обстоятельство является основной причиной большей химической активности фосфора по сравнению с азотом. В то же время атомы азота, естественно, химически гораздо активнее атомов фосфора. Так, ОЭО азота 3,0, а фосфора 2,]. Таким образом, когда речь идет о большей химической активности фосфора по сравнению с азотом, нужно иметь в виду активность простых веществ, а не элементов. Несмотря на имеющиеся различия между азотом и фосфором оба типических элемента и их производные — важнейшие составные части растительных и животных организмов. [c.245]
Пользуясь таблицей периодической системы химических элементов Д.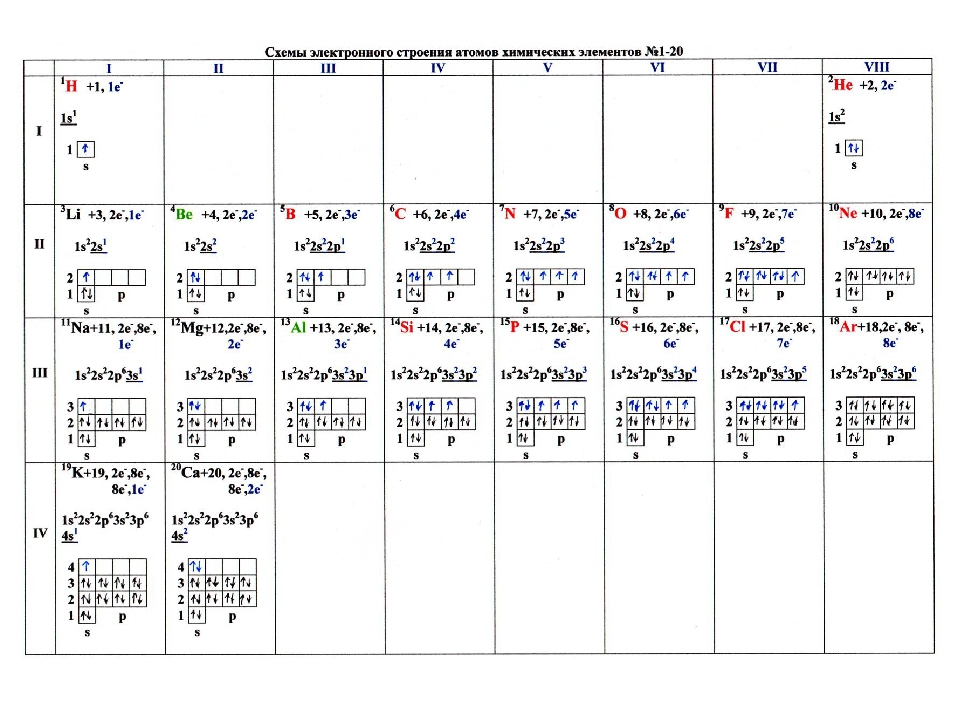 И. Менделеева, составьте схемы расположения электронов по орбиталям н энергетическим уровням в атомах элементов ванадия V, никеля N1 и мышьяка Аз. Какие из них относятся к р-элементам и какие — к -элементам и почему [c.70]
И. Менделеева, составьте схемы расположения электронов по орбиталям н энергетическим уровням в атомах элементов ванадия V, никеля N1 и мышьяка Аз. Какие из них относятся к р-элементам и какие — к -элементам и почему [c.70]
В каких соединениях ванадия и ниобия можно обнаружить сходство с соединениями элементов VA группы периодической системы [c.212]
Как отмечалось выше (гл. УП), наименьшая разница в свойствах элементов двух подгрупп, составляющих одну группу в периодической системе, имеет место в П1 группе. В IV группе подгруппа германия уже заметно отличается от подгруппы титана. В V группе подгруппа мышьяка еще более отлична от подгруппы ванадия. С уве- [c.245]
К элементам VIB-группы периодической системы относятся хром, молибден и вольфрам. Они располагаются вблизи середины ii-рядов. В силу стабильности конфигурации у атомов первых двух элементов подгруппы — хрома и молибдена — наблюдается проскок одного электрона с оболочки ns на оболочку (п— )d. У вольфрама валентной электронной конфигурации предшествует завершенная 4/ -оболочка. Поэтому на его свойствах сказывается влияние лантаноидной контракции, хотя в меньшей мере, чем у элементов подгруппы титана и ванадия. Ниже сопоставлены некоторые характеристики элементов и простых веществ VIB-группы. [c.334]
У вольфрама валентной электронной конфигурации предшествует завершенная 4/ -оболочка. Поэтому на его свойствах сказывается влияние лантаноидной контракции, хотя в меньшей мере, чем у элементов подгруппы титана и ванадия. Ниже сопоставлены некоторые характеристики элементов и простых веществ VIB-группы. [c.334]
К -металлам V группы периодической системы Д. И. Менделеева относятся ванадий V, ниобий ЫЬ и тантал Та. Общая электронная формула этой группы металлов х , но у ниобия набор электронов несколько изменяется один электрон из подуровня 5х переходит в подуровень 4 (табл. 12.17). [c.333]
В VB-подгруппу периодической системы входят ванадий, ниобий, тантал, а также нильсборий — элемент № 105. В атомах этих элементов достраиваются электронами -подуровни соседних с внешними уровней. Но у атомов ванадия и тантала электронная конфигурация а у ниобия вследствие провала одного электрона d s . [c.412]
Сополимеризацию можно проводить так же, как полимеризацию пропилена (см.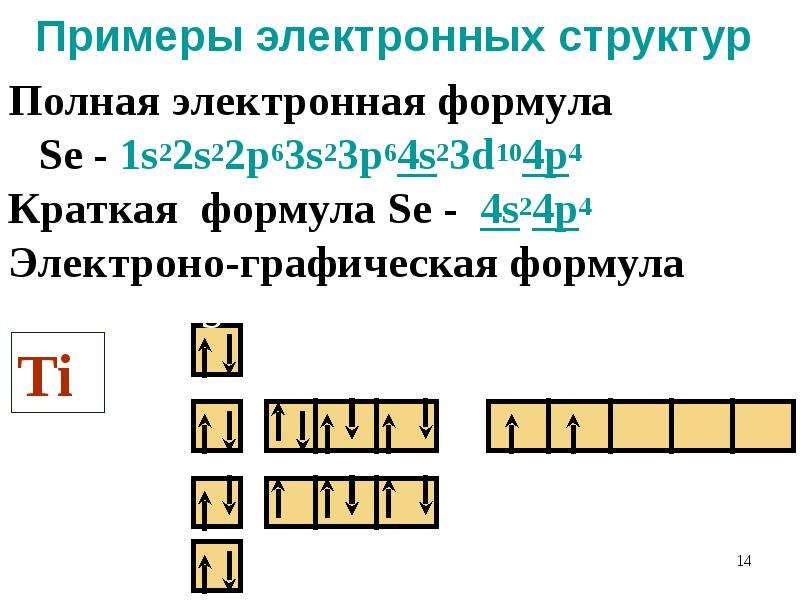 рис. 69). При периодическом методе реакцию проводят в автоклаве, куда при —65 °С сначала вводят жидкий пропилен, а затем подают этилен под таким давлением, чтобы газ был нужного состава. Оба компонента могут быть растворены в гептане, циклогек-саие или бензоле. Компоненты катализатора подают отдельно в виде растворов в углеводородах. Полимеризация продолжается примерно 10—40 мпн, после чего ее прекращают добавкой спирта. Для удаления соединений ванадия и алюминия реакционную смесь обрабатывают кислотами. После очистки добавляют антиоксиданты для стабилизации сополимера. [c.313]
рис. 69). При периодическом методе реакцию проводят в автоклаве, куда при —65 °С сначала вводят жидкий пропилен, а затем подают этилен под таким давлением, чтобы газ был нужного состава. Оба компонента могут быть растворены в гептане, циклогек-саие или бензоле. Компоненты катализатора подают отдельно в виде растворов в углеводородах. Полимеризация продолжается примерно 10—40 мпн, после чего ее прекращают добавкой спирта. Для удаления соединений ванадия и алюминия реакционную смесь обрабатывают кислотами. После очистки добавляют антиоксиданты для стабилизации сополимера. [c.313]
НИИ и температуре свыше 300° С. Обычно применяются температуры порядка 450—550° С. В качестве катализаторов используются металлы и окиси металлов IV, V и VI групп периодической таблицы, чаще всего базирующиеся на алюминии. Наиболее эффективны окиси хрома и ванадия, окись церия несколько уступает им, а окись тория хотя и проводит дегидрирование, но ароматизирует уже слабо [278, 283]. Были опробованы также никель на алюминии [275], нлатинизированный углерод [284, 285], окиси цинка, титана и молибдена, сульфид молибдена, активированный древесный уголь [279] и хлорид алюминия (металлический алюминий плюс хлористый водород) [286]. [c.103]
[c.103]
Титан почти или совершенно не взаимодействует со щелочными, щелочноземельными и редкоземельными (кроме скандия) металлами, т. е. не образует с ними ни соединений, ни твердых растворов, С остальными металлами титан взаимодействует, однако характер этого взаимодействия с разными металлами различен металлы, яьл.чющиеся аналогами титана и ближайшими его соседями по периодической системе, а именно цирконий, гафний, скандии, ванадий, ниобий, тантал, а также молибден и вольфрам, не образуют с титаном соединений, [го образуют непрерывные ряды твердых растворов другие металлы дают с титаном интерметалличе-ские соединения и ограниченные твердые растворы. [c.263]
К существенным противоречиям короткой формы периодической системы относили, пребывание элементов побочных подгрупп — марганца, технеция, рения в одной группе с галогенами хрома, молибдена, вольфрама в группе с халькогенами ванадия, ниобия, тантала в группе с пниктогенами меди, серебра, золота — со щелочными металлами цинка, кадмия, ртути — со щелочноземельными металлами и т. д., — а также и осложнения, вносимые элементами побочных подгрупп в порядок изменения свойств элементов в вертикальных группах. Однако на самом деле эта особенность короткопериодной формы может рассматриваться для элементов, начиная со второй и и кончая седьмой группой, скорее как преимущество по сравнению с другими формами — в одной группе находятся вместе как полные, [c.26]
д., — а также и осложнения, вносимые элементами побочных подгрупп в порядок изменения свойств элементов в вертикальных группах. Однако на самом деле эта особенность короткопериодной формы может рассматриваться для элементов, начиная со второй и и кончая седьмой группой, скорее как преимущество по сравнению с другими формами — в одной группе находятся вместе как полные, [c.26]
Решение. По периодической системе определяем, что элемент с порядковым номером 23 находится в четвертом периоде и в побочной подгруппе V группы. Этот элемент — ванадий V. Электронная формула V 1з 2з 2р Зз Зр З(Р 1з или сокращенно [Аг] 3[c.26]
Ванадий, ниобий и тантал составляют VB группу периодической системы. В невозбужденном состоянии электронные группировки внешних энергетических уровней атомов этих элементов несколько отличаются друг от друга, а именно у атомов ванадия —3d4s , ниобия—4d 5s и тантала —5d 6s . Таким образом, в невозбужденном состоянии электронными аналогами являются только ванадий и тантал. В возбужденном состоянии, когда один из s-электро-нов ванадия и тантала переходит на другой подуровень, и все пять электронов внешних уровней становятся непарными, т. е. валентными, все три элемента являются электронными аналогами. Наличие на внешних электронных уровнях атомов только d- и s-электронов характеризует эти элементы как металлы. По внешнему виду это серые блестящие металлы с высокими температурами плавления и кипения, не изменяющиеся в воздухе. [c.238]
В возбужденном состоянии, когда один из s-электро-нов ванадия и тантала переходит на другой подуровень, и все пять электронов внешних уровней становятся непарными, т. е. валентными, все три элемента являются электронными аналогами. Наличие на внешних электронных уровнях атомов только d- и s-электронов характеризует эти элементы как металлы. По внешнему виду это серые блестящие металлы с высокими температурами плавления и кипения, не изменяющиеся в воздухе. [c.238]
Как видно из приведенного сопоставления, мышьяк является структурным аналогом фосфора при валентностях —3, О и +3, но перестает быть им при валентности -1-5. С другой стороны, ванадий не имеющий при низших валентностях структурного сходства с фосфором, становится при валентности +5 его непосред-ственн.ым аналогом. Совершенно подобные же отношения характерны для элементов П1, IV, VI и VII групп периодической системы. Тем самым теоретически обосновывается закономерность структуры ее обычной (короткой) формы.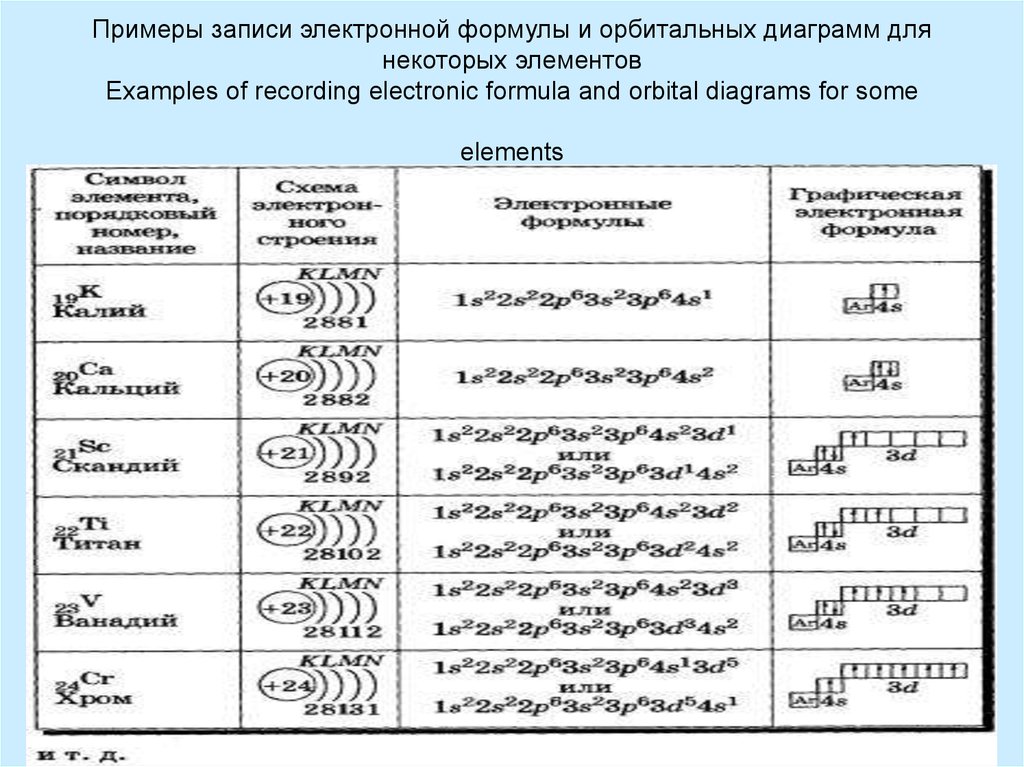 [c.234]
[c.234]
Используя различные методы определения атомных масс элементов, Я. Берцелиус в 1826 г. дал повую систему атомных масс (см. стр. 152). В этой таблице атомные массы большинства металлов оказались очень близкими к современным соответствующие оксиды лшогих из них получили правильную формулу, Вместо прежних формул РеОг, РеОз, СиО и СиОг оп принял формулы FeO, ГегОз, СпгО, СиО, СаО, ВаО, АЬОз, МнгОз, СггОа и др. Однако атомные массы щелочных металлов были установлены неточно, так как для их оксидов Я. Берцелиус принимал такой состав NaO, КО и т. д. В 1841 г. В. Реньо внес коррективы в эти формулы, после чего в системе атомных масс Я. Берцелиуса почти не было принципиальных ошибок. Из 54 элементов, известных к концу жизни шведского химика, неправильными оказались атомные массы серебра, бора, бериллия, кремния, ванадия, циркония, урана, церия, иттрия и тория многие из них были исправлены лишь в результате открытия периодического закона Д. И. Менделеева. [c. 136]
136]
Общее число электронов в атоме, которое определяет порядковый номер элемента в периодической системе, — 23. Это ванадий. Из электронной формулы видно, что этот элемент находится в четвертом периоде, V группе (пять валентных электронов 3побочной подгруппе (элемент -семейства). [c.32]
Периодическая таблица технологий будущего
Периодическая таблица технологий будущего.
Британскими учеными – аналитиками подразделения Imperial Tech Foresight при Имперском колледже Лондона разработана периодическая таблица технологий будущего, состоящая из 100 элементов, которые существуют сейчас, появятся в ближайшем или отдаленном будущем, а также технологии «за гранью реальности».
Описание
Таблица
Описание:
Британскими учеными – аналитиками подразделения Imperial Tech Foresight при Имперском колледже Лондона разработана периодическая таблица технологий будущего, подобно периодической таблице химических элементов Д. А. Менделеева.
А. Менделеева.
Хотя самими авторами таблица названа как “Таблица прорывных технологий”, “Приборная панель из 100 замечательных, странных (и, возможно, тревожных) способов изменения мира в обозримом будущем”.
Все технологии выстроены определенным образом: по горизонтали – вдоль оси времени реализации технологий (от реализации в скором времени до реализации в отдаленном будущем) и по вертикали – вдоль оси потенциала социально-экономического прорыва технологий (от низкого до высокого).
Получилась таблица 10 на 10. В ней собрано 100 элементов – технологий будущего.
Все технологии разделены на 4 группы и обозначены разным цветом:
1. зеленые элементы – технологии и инновации, которые существуют уже сейчас. Например, криптовалюты, робомобили, роботы-курьеры, морские ветрогенераторы, умные подгузники и т.д.,
2. желтые – экспериментальные разработки, которые появятся в ближайшем будущем (порядка 10-20 лет). Например, воздушные ветряные турбины, автономный пассажирский самолет, 3д-печать еды и лекарств и т. д.,
д.,
3. красные – научные исследований, результаты которых воплотятся не раньше, чем через 20 с лишним лет. Например, термоядерная энергия, биопластмасса, колонизация планет, щиты-невидимки и т.д.
4. серые – «призрачные технологии», научные исследования и технологии «за гранью реальности». Их можно определить как крайне маловероятные, но не невозможные. На них стоит посмотреть и обратить внимание. Например, космический лифт, телепатия, добыча ископаемых на астероидах.
Кроме того, все технологии разделены на усмотрение авторов таблицы на 5 широких тем:
- – экосистема данных,
- – умная планета,
- – экстремальная автоматизация,
- – улучшение человека,
- – человеко-машинные взаимодействия.
Каждый элемент – технология имеет помимо названия свою аббревиатуру. Например, We – Wireless energy transfer (с англ. – “Беспроводнаяя передача энергии”).
В правой части таблицы приводится список организаций, которые ведут исследования, внедряют, реализуют или используют данные технологии.
Таблица:
Ниже представлен фрагмент Периодической таблицы технологий будущего (левая часть).
Посмотреть всю таблицу Вы можете, перейдя по данной ссылке на первоисточник.
Либо ознакомиться со списком технологий будущего на русском и на английском языке.
Примечание: © Фото https://www.pexels.com, https://pixabay.com
карта сайта
периодическая таблица химических элементов д и менделеева в хорошем качестве по химии
периодическая система таблица химических элементов д и менделеева в хорошем качестве для печати почему периодическая 8 класс суть
положение характеристика в периодической таблице
пользуясь периодической таблицей менделеева составьте графические
строение законы свойства периодической таблицы менделеева
периодов периодическая таблица егэ
периодический закон таблица
группы в периодической таблице
характеристика элемента по периодической таблице
почему таблица периодическая
электронная периодическая таблица менделеева
найдите в периодической таблице химические элементы
характеристика элемента по положению в периодической таблице
пользуясь периодической таблицей менделеева составьте схемы
химия периодическая таблица менделеева
Коэффициент востребованности 929
Электронная структура и периодическая таблица – Вводная химия – 1-е канадское издание
Цели обучения
- Свяжите электронные конфигурации элементов с формой периодической таблицы.

- Определите ожидаемую электронную конфигурацию элемента по его месту в периодической таблице.
В главе 3 «Атомы, молекулы и ионы» мы представили периодическую таблицу как инструмент для систематизации известных химических элементов.Таблица Менделеева показана на Рисунке 8.11 «Периодическая таблица». Элементы перечислены по атомному номеру (числу протонов в ядре), а элементы с аналогичными химическими свойствами сгруппированы вместе в столбцы.
Рисунок 8.11 Периодическая таблица
Почему таблица Менделеева имеет такую структуру? Ответ довольно прост, если вы понимаете электронные конфигурации: форма периодической таблицы имитирует заполнение подоболочек электронами .
Начнем с H и He. Их электронные конфигурации: 1 с 1 и 1 с 2 соответственно; He заполнена оболочка n = 1. Эти два элемента составляют первую строку периодической таблицы (см. Рис. 8.12 «1»).
8.12 «1»).
Рисунок 8.12 1 s Subshell
H и He представляют собой заполнение подоболочки 1 s .
Следующие два электрона, для Li и Be, войдут в подоболочку 2 s .Рисунок 8.13 «2» показывает, что эти два элемента в периодической таблице находятся рядом.
Рисунок 8.13 2 s Subshell
В Li и Be заполняется подоболочка 2 s .
Для следующих шести элементов подоболочка 2 p занята электронами. В правой части периодической таблицы эти шесть элементов (от B до Ne) сгруппированы вместе (рис. 8.14 «2»).
Рисунок 8.14 2 p Дополнительная оболочка
Для B – Ne занята подоболочка 2 p .
Следующая подоболочка, которую необходимо заполнить, – это подоболочка 3 s . При заполнении подоболочки элементы Na и Mg снова находятся в левой части таблицы Менделеева (рис. 8.15 «3»).
Рисунок 8. 15. 3 s Subshell
15. 3 s Subshell
Сейчас занята подоболочка 3 s .
Затем подоболочка 3 p заполняется следующими шестью элементами (рис. 8.16 «3»).
Рисунок 8.16 The 3 p Дополнительная оболочка
Далее подоболочка 3 p заполняется электронами.
Вместо того, чтобы заполнять подоболочку 3 d , электроны переходят в подоболочку 4 s (рис. 8.17 «4»).
Рисунок 8.17. 4 s Subshell
Подоболочка 4 s заполняется перед подоболочкой 3 d . Это отражено в структуре таблицы Менделеева.
После заполнения подоболочки 4 s , подоболочка 3 d заполняется максимум 10 электронами. Это объясняет раздел из 10 элементов в середине периодической таблицы (рис. 8.18 «3»).
Рисунок 8.18 3 d Дополнительная оболочка
Подоболочка 3 d заполнена в средней части таблицы Менделеева.
И так далее. Когда мы пересекаем строки периодической таблицы, общая форма таблицы показывает, как электроны занимают оболочки и подоболочки.
Первые два столбца в левой части периодической таблицы – это то место, где заняты подоболочки s . Из-за этого первые две строки периодической таблицы помечены как блок s . Точно так же блок p – это шесть крайних правых столбцов периодической таблицы, блок d – это средние 10 столбцов периодической таблицы, а блок f – это секция из 14 столбцов, которая обычно изображается как отделенный от основной части таблицы Менделеева.Она могла быть частью основного тела, но тогда таблица Менделеева была бы довольно длинной и громоздкой. На рисунке 8.19 «Блоки периодической таблицы» показаны блоки периодической таблицы.
Рисунок 8.19 Блоки периодической таблицы
Периодическая таблица разделена на блоки в зависимости от того, какая подоболочка заполняется атомами, принадлежащими к этому разделу.
Электроны в оболочке с самым высоким номером плюс любые электроны в последней незаполненной подоболочке называются валентными электронами; оболочка с самым высоким номером называется валентной оболочкой.(Внутренние электроны называются остовными электронами .) Валентные электроны в значительной степени контролируют химию атома. Если мы посмотрим только на электронную конфигурацию валентной оболочки, мы обнаружим, что в каждом столбце электронная конфигурация валентной оболочки одинакова. Например, возьмите элементы в первом столбце периодической таблицы: H, Li, Na, K, Rb и Cs. Их электронные конфигурации (сокращенно для более крупных атомов) следующие, с выделенной электронной конфигурацией валентной оболочки:
| H: | 1 с 1 |
| Li: | 1 с 2 2 с 1 |
| Na: | [Ne] 3s 1 |
| К: | [Ar] 4s 1 |
| руб: | [Kr] 5s 1 |
| CS: | [Xe] 6s 1 |
Все они имеют одинаковую электронную конфигурацию в их валентных оболочках: один s электрон.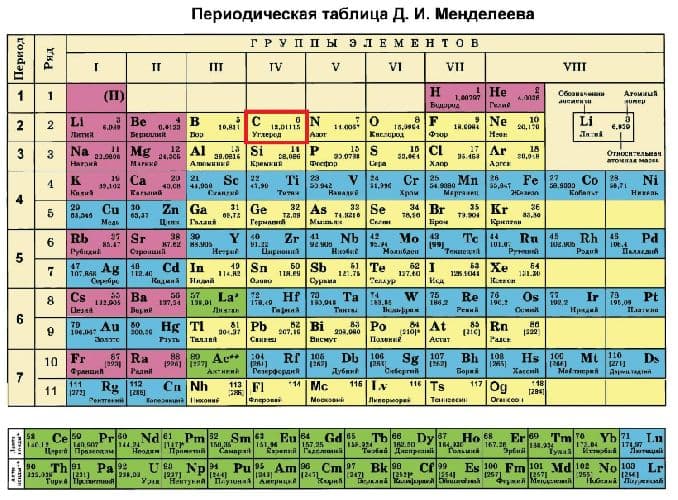 Поскольку большая часть химии элемента находится под влиянием валентных электронов, мы ожидаем, что эти элементы будут иметь схожий химический состав – , а они – . Организация электронов в атомах объясняет не только форму периодической таблицы, но и тот факт, что элементы в одном столбце периодической таблицы имеют схожий химический состав.
Поскольку большая часть химии элемента находится под влиянием валентных электронов, мы ожидаем, что эти элементы будут иметь схожий химический состав – , а они – . Организация электронов в атомах объясняет не только форму периодической таблицы, но и тот факт, что элементы в одном столбце периодической таблицы имеют схожий химический состав.
То же самое применимо и к другим столбцам периодической таблицы. Элементы в каждом столбце имеют одинаковую электронную конфигурацию валентной оболочки, и элементы имеют схожие химические свойства.Это строго верно для всех элементов в блоках s и p . В блоках d и f из-за исключений из порядка заполнения подоболочек электронами аналогичные валентные оболочки не являются абсолютными в этих блоках. Однако в этих блоках действительно существует много общего, поэтому ожидается сходство по химическим свойствам.
Сходство электронной конфигурации валентной оболочки означает, что мы можем определить электронную конфигурацию атома только по его положению в периодической таблице. Рассмотрим Se, как показано на рисунке 8.20 «Селен в таблице Менделеева». Он находится в четвертом столбце блока p . Это означает, что его электронная конфигурация должна заканчиваться электронной конфигурацией p 4 . Действительно, электронная конфигурация Se имеет вид [Ar] 4 s 2 3 d 10 4 p 4 , как и ожидалось.
Рассмотрим Se, как показано на рисунке 8.20 «Селен в таблице Менделеева». Он находится в четвертом столбце блока p . Это означает, что его электронная конфигурация должна заканчиваться электронной конфигурацией p 4 . Действительно, электронная конфигурация Se имеет вид [Ar] 4 s 2 3 d 10 4 p 4 , как и ожидалось.
Рисунок 8.20 Селен в Периодической таблице
Пример 8
По положению элемента в периодической таблице, спрогнозируйте электронную конфигурацию валентной оболочки для каждого атома.См. Рисунок 8.21 «Различные элементы периодической таблицы».
- Ca
- Sn
Решение
- Ca находится во втором столбце блока s . Можно ожидать, что его электронная конфигурация должна заканчиваться на s 2 . Электронная конфигурация кальция [Ar] 4 s 2 .

- Sn расположен во втором столбце блока p , поэтому мы ожидаем, что его электронная конфигурация будет заканчиваться на p 2 .Электронная конфигурация олова [Kr] 5 s 2 4 d 10 5 p 2 .
Проверьте себя
По положению элемента в периодической таблице, спрогнозируйте электронную конфигурацию валентной оболочки для каждого атома. См. Рисунок 8.21 «Различные элементы периодической таблицы».
- Ti
- Класс
Ответ
- [Ar] 4 с 2 3 d 2
- [Ne] 3 с 2 3 p 5
Рисунок 8.21 различных элементов периодической таблицы
Приложение для еды и напитков: искусственные красители
Цвет предметов обусловлен другим механизмом, нежели цвета неоновых и других газоразрядных ламп. Хотя цветные огни создают свои цвета, объекты окрашены, потому что они предпочтительно отражают определенный цвет от белого света, который на них падает. Красный помидор, например, ярко-красный, потому что он отражает красный свет, поглощая все остальные цвета радуги.
Хотя цветные огни создают свои цвета, объекты окрашены, потому что они предпочтительно отражают определенный цвет от белого света, который на них падает. Красный помидор, например, ярко-красный, потому что он отражает красный свет, поглощая все остальные цвета радуги.
Многие продукты, например помидоры, сильно окрашены; Фактически, распространенное утверждение «вы сначала едите глазами» – это неявное признание того, что внешний вид пищи так же важен, как и ее вкус. Но как насчет полуфабрикатов?
Многие обработанные пищевые продукты содержат пищевые красители. Пищевые красители бывают двух видов: натуральные и искусственные. Натуральные пищевые красители включают карамелизованный сахар для коричневого цвета; аннато, куркума и шафран для различных оттенков оранжевого или желтого; бетанин из свеклы для пурпура; и даже кармин, темно-красный краситель, который получают из кошенили, небольшого насекомого, паразитирующего на кактусах в Центральной и Южной Америке.(Правильно: возможно, вы едите сок насекомых!)
Некоторые расцветки искусственные. В США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов в настоящее время одобряет только семь соединений в качестве искусственных красителей в продуктах питания, напитках и косметике:
В США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов в настоящее время одобряет только семь соединений в качестве искусственных красителей в продуктах питания, напитках и косметике:
- FD&C Blue # 1: бриллиантовый синий FCF
- FD&C Синий # 2: Индиготин
- FD&C Green # 3: Быстрый зеленый FCF
- RD&C Red # 3: эритрозин
- FD&C Red # 40: Красный Allura AC
- FD&C Yellow # 5: тартразин
- FD&C Yellow # 6: Желтый закат FCF
Цвета с меньшими номерами больше не продаются или были удалены по разным причинам.Как правило, эти искусственные красители представляют собой большие молекулы, которые очень сильно поглощают свет определенных цветов, что делает их полезными даже при очень низких концентрациях в пищевых продуктах и косметике. Некоторые критики заявляют, что даже в таких небольших количествах, небольшая часть населения (особенно дети) чувствительны к искусственным окраскам, и призывают сократить или прекратить их использование. Однако формальные исследования искусственной окраски и ее влияния на поведение неубедительны или противоречивы. Несмотря на это, большинство людей по-прежнему предпочитают обработанные пищевые продукты с искусственными красителями (как показано на прилагаемом рисунке).
Однако формальные исследования искусственной окраски и ее влияния на поведение неубедительны или противоречивы. Несмотря на это, большинство людей по-прежнему предпочитают обработанные пищевые продукты с искусственными красителями (как показано на прилагаемом рисунке).
Искусственные пищевые красители содержатся в различных пищевых продуктах, например, в обработанных пищевых продуктах, конфетах и яичных красителях. Даже корма для домашних животных содержат искусственные пищевые красители, хотя вполне вероятно, что животному все равно!
Ключевые выводы
- Расположение электронов в атомах определяет форму таблицы Менделеева.
- Электронные конфигурации можно предсказать по положению атома в периодической таблице.
Упражнения
Где в периодической таблице s подоболочки заняты электронами?
Где в периодической таблице находятся подоболочки d , занятые электронами?
В каком блоке находится Ra?
В каком блоке находится Br?
Каковы электронные конфигурации валентных оболочек элементов во втором столбце периодической таблицы?
Каковы электронные конфигурации валентных оболочек элементов в предпоследнем столбце периодической таблицы?
Каковы электронные конфигурации валентных оболочек элементов в первом столбце блока p ?
Каковы электронные конфигурации валентных оболочек элементов в последнем столбце блока p ?
По положению элемента в таблице Менделеева предскажите электронную конфигурацию каждого атома.

а) Sr
б) S
10. По положению элемента в периодической таблице, спрогнозируйте электронную конфигурацию каждого атома.
а) Fe
б) Ba
11. По положению элемента в периодической таблице, спрогнозируйте электронную конфигурацию каждого атома.
а) В
б) Ar
12. По положению элемента в таблице Менделеева предскажите электронную конфигурацию каждого атома.
а) Класс
б) К
13. По положению элемента в периодической таблице, спрогнозируйте электронную конфигурацию каждого атома.
а) Ge
б) С
14. По положению элемента в таблице Менделеева предскажите электронную конфигурацию каждого атома.
а) Мг
б) Я
Ответы
1.
первые две колонки
3.
s блок
5.
нс 2 7.
нс 2 нс 1 9.
a) 1 с 2 2 с 2 2 p 6 3 с 2 3 p 6 4 с 2 3 d 10 4 п 6 5 с 2
б) 1 с 2 2 с 2 2 п 6 3 с 2 3 п 4 11.
a) 1 с 2 2 с 2 2 p 6 3 с 2 3 p 6 4 с 2 3 d 3
б) 1 с 2 2 с 2 2 п 6 3 с 2 3 п 6 13.
a) 1 с 2 2 с 2 2 p 6 3 с 2 3 p 6 4 с 2 3 d 10 4 п 2
б) 1 с 2 2 с 2 2 п 2
Периодические тенденции – Chemistry LibreTexts
Периодические тенденции – это определенные закономерности, присутствующие в периодической таблице, которые иллюстрируют различные аспекты определенного элемента, включая его размер и его электронные свойства. Основные периодические тенденции включают: электроотрицательность, энергию ионизации, сродство к электрону, атомный радиус, точку плавления и металлический характер. Периодические тенденции, возникающие в результате расположения таблицы Менделеева, предоставляют химикам неоценимый инструмент для быстрого предсказания свойств элемента. Эти тенденции существуют из-за схожей атомной структуры элементов в пределах их соответствующих групповых семейств или периодов, а также из-за периодической природы элементов.
Основные периодические тенденции включают: электроотрицательность, энергию ионизации, сродство к электрону, атомный радиус, точку плавления и металлический характер. Периодические тенденции, возникающие в результате расположения таблицы Менделеева, предоставляют химикам неоценимый инструмент для быстрого предсказания свойств элемента. Эти тенденции существуют из-за схожей атомной структуры элементов в пределах их соответствующих групповых семейств или периодов, а также из-за периодической природы элементов.
Тенденции электроотрицательности
Электроотрицательность можно понимать как химическое свойство, описывающее способность атома притягиваться и связываться с электронами.Поскольку электроотрицательность является качественным свойством, не существует стандартизированного метода расчета электроотрицательности. Однако наиболее распространенной шкалой для количественной оценки электроотрицательности является шкала Полинга (таблица А2), названная в честь химика Линуса Полинга. Числа, присвоенные шкалой Полинга, безразмерны из-за качественного характера электроотрицательности. Значения электроотрицательности для каждого элемента можно найти в определенных периодических таблицах. Пример приведен ниже.
Числа, присвоенные шкалой Полинга, безразмерны из-за качественного характера электроотрицательности. Значения электроотрицательности для каждого элемента можно найти в определенных периодических таблицах. Пример приведен ниже.
Электроотрицательность измеряет тенденцию атома притягиваться и образовывать связи с электронами.Это свойство существует благодаря электронной конфигурации атомов. Большинство атомов следуют правилу октетов (валентная или внешняя оболочка состоит из 8 электронов). Поскольку элементы в левой части периодической таблицы имеют менее чем половину полной валентной оболочки, энергия, необходимая для получения электронов, значительно выше по сравнению с энергией, необходимой для потери электронов. В результате элементы в левой части таблицы Менделеева обычно теряют электроны при образовании связей. И наоборот, элементы в правой части таблицы Менделеева более энергоэффективны в получении электронов для создания полной валентной оболочки из 8 электронов.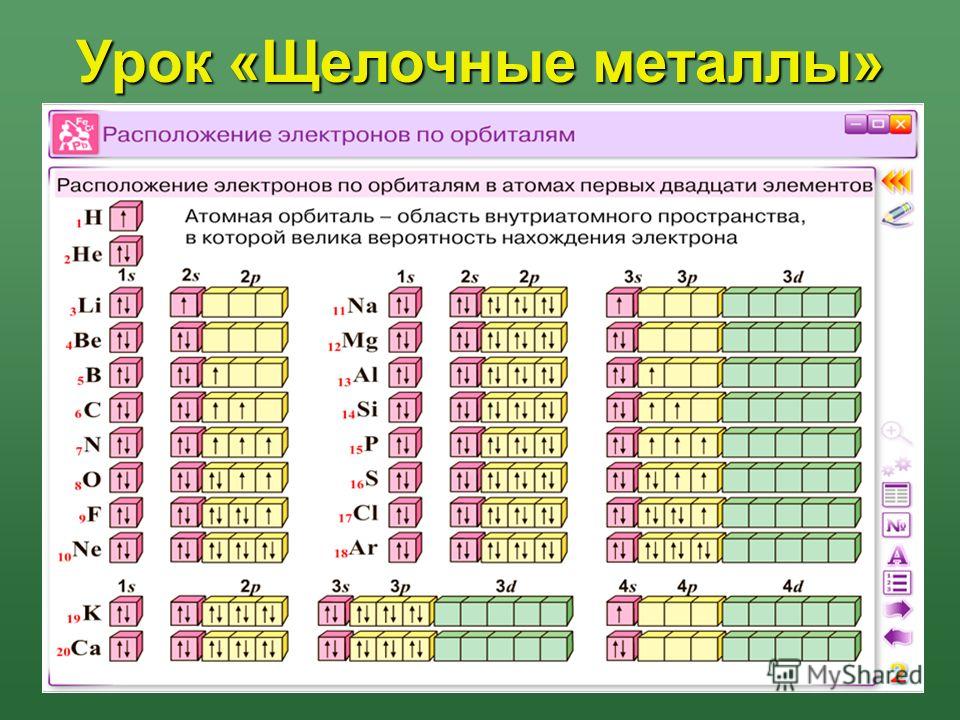 Природа электроотрицательности эффективно описывается следующим образом: чем больше атом склонен приобретать электроны, тем больше вероятность, что атом будет притягивать электроны к себе.
Природа электроотрицательности эффективно описывается следующим образом: чем больше атом склонен приобретать электроны, тем больше вероятность, что атом будет притягивать электроны к себе.
- Слева направо через период элементов электроотрицательность увеличивается. Если валентная оболочка атома заполнена менее чем наполовину, для потери электрона требуется меньше энергии, чем для его получения. И наоборот, если валентная оболочка заполнена более чем наполовину, легче втянуть электрон в валентную оболочку, чем отдать один.
- Сверху вниз по группе электроотрицательность уменьшается. Это связано с тем, что атомный номер увеличивается вниз по группе, и, таким образом, увеличивается расстояние между валентными электронами и ядром или увеличивается атомный радиус.
- Важные исключения из вышеперечисленных правил включают благородные газы, лантаноиды и актиниды. Благородные газы обладают полной валентной оболочкой и обычно не притягивают электроны.
 Лантаноиды и актиниды обладают более сложным химическим составом, в котором, как правило, не наблюдается каких-либо тенденций.Следовательно, благородные газы, лантаноиды и актиниды не имеют значений электроотрицательности.
Лантаноиды и актиниды обладают более сложным химическим составом, в котором, как правило, не наблюдается каких-либо тенденций.Следовательно, благородные газы, лантаноиды и актиниды не имеют значений электроотрицательности. - Что касается переходных металлов, хотя у них есть значения электроотрицательности, между ними существует небольшая разница по периоду и вверх и вниз по группе. Это потому, что их металлические свойства влияют на их способность притягивать электроны так же легко, как и на другие элементы.
Согласно этим двум общим тенденциям, наиболее электроотрицательным элементом является фтор , , с 3.98 единиц Полинга.
Рисунок \ (\ PageIndex {2} \): Периодическая таблица, показывающая тенденцию электроотрицательностиТенденции энергии ионизации
Энергия ионизации – это энергия, необходимая для удаления электрона из нейтрального атома в его газовой фазе. Концептуально энергия ионизации противоположна электроотрицательности. Чем ниже эта энергия, тем легче атом превращается в катион. Следовательно, чем выше эта энергия, тем меньше вероятность превращения атома в катион. Как правило, элементы в правой части таблицы Менделеева имеют более высокую энергию ионизации, потому что их валентная оболочка почти заполнена.Элементы в левой части периодической таблицы имеют низкую энергию ионизации из-за их готовности терять электроны и становиться катионами. Таким образом, энергия ионизации увеличивается слева направо в периодической таблице.
Чем ниже эта энергия, тем легче атом превращается в катион. Следовательно, чем выше эта энергия, тем меньше вероятность превращения атома в катион. Как правило, элементы в правой части таблицы Менделеева имеют более высокую энергию ионизации, потому что их валентная оболочка почти заполнена.Элементы в левой части периодической таблицы имеют низкую энергию ионизации из-за их готовности терять электроны и становиться катионами. Таким образом, энергия ионизации увеличивается слева направо в периодической таблице.
Еще одним фактором, влияющим на энергию ионизации, является электронное экранирование . Электронная защита описывает способность внутренних электронов атома экранировать положительно заряженное ядро от валентных электронов.При перемещении вправо от точки количество электронов увеличивается, а сила экранирования увеличивается. В результате электронам валентной оболочки легче ионизоваться, и, таким образом, энергия ионизации уменьшается вниз по группе. Электронное экранирование также известно как , экранирование .
Электронное экранирование также известно как , экранирование .
Тенденции
- Энергия ионизации элементов в течение периода обычно увеличивается слева направо. Это связано с стабильностью валентной оболочки.
- Энергия ионизации элементов в группе обычно уменьшается сверху вниз.Это происходит из-за электронного экранирования.
- Благородные газы обладают очень высокой энергией ионизации из-за их полных валентных оболочек, как показано на графике. Обратите внимание, что гелий имеет самую высокую энергию ионизации из всех элементов.
Некоторые элементы имеют несколько энергий ионизации; эти изменяющиеся энергии называются первой энергией ионизации, второй энергией ионизации, третьей энергией ионизации и т. д. Первая энергия ионизации – это энергия, необходимая для удаления электрона с наиболее удаленной или самой высокой энергией, вторая энергия ионизации – это энергия, необходимая для удалить любой последующий электрон высокой энергии из газообразного катиона и т. 2} \]
2} \]
- В течение периода \ (Z_ {eff} \) увеличивается на , а n (главное квантовое число) остается прежним , поэтому энергия ионизации увеличивается на .
- Вниз по группе \ (n \) увеличивает и \ (Z_ {eff} \) немного увеличивает ; энергия ионизации уменьшается .
Тенденции сродства электронов
Как следует из названия, сродство к электрону – это способность атома принимать электрон. В отличие от электроотрицательности, сродство к электрону – это количественное измерение изменения энергии, которое происходит, когда электрон присоединяется к нейтральному атому газа. Чем отрицательнее значение сродства к электрону, тем выше сродство атома к электронам.
Рисунок \ (\ PageIndex {5} \): Периодическая таблица, показывающая тенденцию сродства к электрону Сродство к электрону обычно уменьшается вниз по группе элементов, потому что каждый атом больше, чем атом над ним (это тенденция атомного радиуса, обсуждаемая ниже). Это означает, что добавленный электрон находится дальше от ядра атома по сравнению с его положением в меньшем атоме. Чем больше расстояние между отрицательно заряженным электроном и положительно заряженным ядром, сила притяжения относительно слабее.Следовательно, сродство к электрону уменьшается. Двигаясь слева направо через период, атомы становятся меньше по мере того, как силы притяжения становятся сильнее. Это заставляет электрон приближаться к ядру, тем самым увеличивая сродство к электрону слева направо через период.
Это означает, что добавленный электрон находится дальше от ядра атома по сравнению с его положением в меньшем атоме. Чем больше расстояние между отрицательно заряженным электроном и положительно заряженным ядром, сила притяжения относительно слабее.Следовательно, сродство к электрону уменьшается. Двигаясь слева направо через период, атомы становятся меньше по мере того, как силы притяжения становятся сильнее. Это заставляет электрон приближаться к ядру, тем самым увеличивая сродство к электрону слева направо через период.
- Сродство к электрону увеличивается слева направо в течение периода. Это вызвано уменьшением атомного радиуса.
- Сродство к электрону уменьшается сверху вниз внутри группы. Это вызвано увеличением атомного радиуса.
Тенденции атомного радиуса
Атомный радиус составляет половину расстояния между ядрами двух атомов (точно так же, как радиус равен половине диаметра круга). Однако эта идея осложняется тем фактом, что не все атомы обычно связаны друг с другом одинаково. Некоторые из них связаны ковалентными связями в молекулах, некоторые притягиваются друг к другу в ионных кристаллах, а другие удерживаются в металлических кристаллах. Тем не менее, подавляющее большинство элементов может образовывать ковалентные молекулы, в которых два одинаковых атома удерживаются вместе одной ковалентной связью.Ковалентные радиусы этих молекул часто называют атомными радиусами. Это расстояние измеряется в пикометрах. Образцы атомных радиусов наблюдаются по всей периодической таблице.
Некоторые из них связаны ковалентными связями в молекулах, некоторые притягиваются друг к другу в ионных кристаллах, а другие удерживаются в металлических кристаллах. Тем не менее, подавляющее большинство элементов может образовывать ковалентные молекулы, в которых два одинаковых атома удерживаются вместе одной ковалентной связью.Ковалентные радиусы этих молекул часто называют атомными радиусами. Это расстояние измеряется в пикометрах. Образцы атомных радиусов наблюдаются по всей периодической таблице.
Размер атома постепенно уменьшается слева направо через период элементов. Это потому, что в пределах периода или семейства элементов все электроны добавляются к одной и той же оболочке. Однако в то же время к ядру добавляются протоны, что делает его более заряженным. Эффект увеличения числа протонов больше, чем эффект увеличения числа электронов; следовательно, существует большее ядерное притяжение.Это означает, что ядро сильнее притягивает электроны, притягивая оболочку атома ближе к ядру. Валентные электроны удерживаются ближе к ядру атома. В результате атомный радиус уменьшается.
Валентные электроны удерживаются ближе к ядру атома. В результате атомный радиус уменьшается.
D владеет группой, атомный радиус увеличивается. Валентные электроны занимают более высокие уровни из-за увеличения квантового числа (n). В результате валентные электроны удаляются от ядра по мере увеличения “n”.Электронная защита предотвращает притяжение этих внешних электронов к ядру; таким образом, они удерживаются слабо, и результирующий атомный радиус велик.
- Атомный радиус уменьшается на слева направо за период. Это вызвано увеличением на числа протонов и электронов за период на . Один протон имеет большее влияние, чем один электрон; таким образом, электроны притягиваются к ядру, что приводит к меньшему радиусу.
- Атомный радиус увеличивается на сверху вниз внутри группы.Это вызвано электронной защитой.

Тенденции температуры плавления
Точки плавления – это количество энергии, необходимое для разрыва связи (ей), чтобы преобразовать твердую фазу вещества в жидкость. Как правило, чем сильнее связь между атомами элемента, тем больше энергии требуется для разрыва этой связи. Поскольку температура прямо пропорциональна энергии, высокая энергия диссоциации связи коррелирует с высокой температурой. Температуры плавления различны и обычно не образуют заметной тенденции в периодической таблице.Однако определенные выводы можно сделать из рисунка \ (\ PageIndex {7} \).
- Металлы обычно имеют высокую температуру плавления .
- Большинство неметаллов обладают низкой температурой плавления .
- Неметаллический углерод имеет наивысшую температуру плавления среди всех элементов . Полуметаллический бор также обладает высокой температурой плавления.
Тенденции металлических характеристик
Металлический характер элемента можно определить по тому, насколько легко атом может потерять электрон. Справа налево через период металлический характер усиливается, потому что притяжение между валентным электроном и ядром слабее, что способствует более легкой потере электронов. Металлический характер увеличивается по мере того, как вы перемещаетесь по группе вниз, потому что атомный размер увеличивается. Когда размер атома увеличивается, внешние оболочки удаляются дальше. Главное квантовое число увеличивается, и средняя электронная плотность удаляется от ядра. Электроны валентной оболочки меньше притягиваются к ядру и, как следствие, могут легче терять электроны.Это вызывает усиление металлического характера.
Справа налево через период металлический характер усиливается, потому что притяжение между валентным электроном и ядром слабее, что способствует более легкой потере электронов. Металлический характер увеличивается по мере того, как вы перемещаетесь по группе вниз, потому что атомный размер увеличивается. Когда размер атома увеличивается, внешние оболочки удаляются дальше. Главное квантовое число увеличивается, и средняя электронная плотность удаляется от ядра. Электроны валентной оболочки меньше притягиваются к ядру и, как следствие, могут легче терять электроны.Это вызывает усиление металлического характера.
- Металлические характеристики снижаются слева направо в течение периода. Это вызвано уменьшением радиуса (вызванным Z eff , как указано выше) атома, что позволяет внешним электронам легче ионизироваться.
- Металлические характеристики повышаются на группу. Электронное экранирование приводит к увеличению атомного радиуса, поэтому внешние электроны ионизируются легче, чем электроны в более мелких атомах.

- Металлический характер относится к способности терять электроны, а неметаллический характер относится к способности приобретать электроны.
Еще один более простой способ запомнить тенденцию к металлическому характеру – это движение влево и вниз к нижнему левому углу таблицы Менделеева, металлический характер усиливается к группам 1 и 2 или к группам щелочных и щелочноземельных металлов . Точно так же, двигаясь вверх и вправо к верхнему правому углу таблицы Менделеева, металлический характер уменьшается, потому что вы проходите с правой стороны лестницы, которая указывает на неметаллы .К ним относятся группа 8, благородные газы , и другие распространенные газы, такие как кислород и азот.
- Другими словами:
- Перемещение влево через точку и вниз по группе: усиление металлического характера (в сторону щелочных и щелочных металлов)
- Перемещение вправо через период и вверх по группе: уменьшение металлического характера (в сторону неметаллов, таких как благородные газы)
Проблемы
В следующей серии задач рассматривается общее понимание вышеупомянутого материала.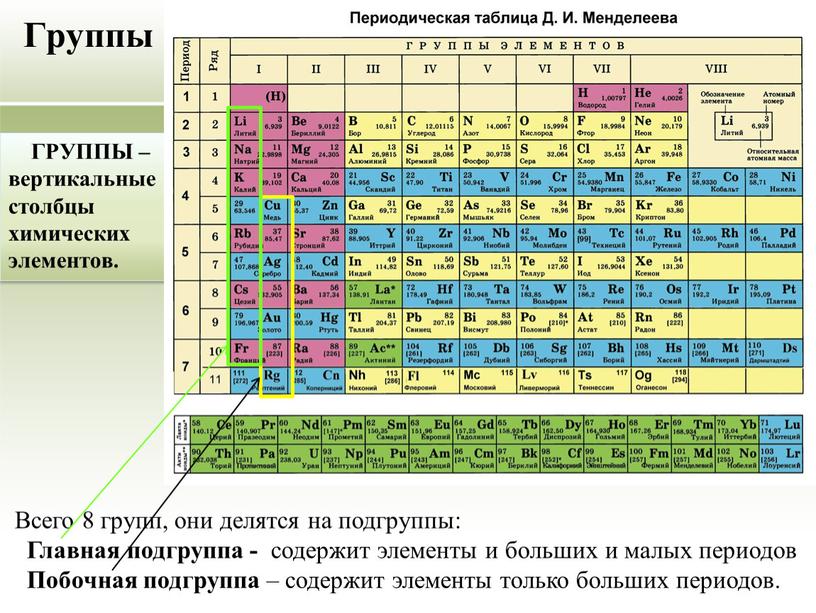
1. Исходя из периодических тенденций изменения энергии ионизации, какой элемент имеет самую высокую энергию ионизации?
- Фтор (F)
- Азот (N)
- Гелий (He)
2.) Азот имеет больший атомный радиус, чем кислород.
- A.) Верно
- B.) Неверно
3.) Что имеет более металлический характер: свинец (Pb) или олово (Sn)?
4.) Какой элемент имеет более высокую температуру плавления: хлор (Cl) или бром (Br)?
5.) Какой элемент более электроотрицателен, сера (S) или селен (Se)?
6) Почему значение электроотрицательности большинства благородных газов равно нулю?
7) Расположите эти атомы в порядке уменьшения эффективного заряда ядра валентными электронами: Si, Al, Mg, S
8) Перепишите следующий список в порядке уменьшения сродства к электрону: фтор (F), фосфор (P), сера (S), бор (B).
9) Атом с атомным радиусом меньше, чем у серы (S), __________.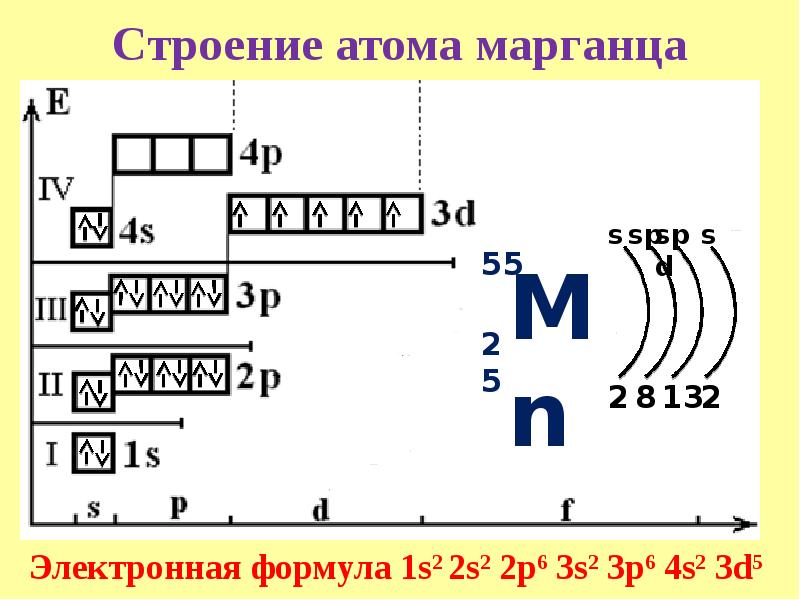
- A.) Кислород (O)
- B.) Хлор (Cl)
- C.) Кальций (Ca)
- D.) Литий (Li)
- E.) Ни один из вышеперечисленных
10) Неметалл имеет меньший ионный радиус по сравнению с металлом того же периода.
- A.) Верно B.) Неверно
Решения
1. Ответ: C.) Гелий (He)
Пояснение: Гелий (He) имеет самую высокую энергию ионизации, потому что, как и другие благородные газы, валентная оболочка гелия заполнена.Следовательно, гелий стабилен и не теряет и не приобретает электроны.
2. Ответ: A.) Верно
Объяснение: Атомный радиус увеличивается справа налево в периодической таблице. Следовательно, азот больше кислорода.
3. Ответ: Свинец (Pb)
Пояснение: Свинец и олово находятся в одном столбце. Металлический характер увеличивается вниз по колонке. Свинец находится под оловом, поэтому он имеет более металлический характер.
4. Ответ: Бром (Br)
Пояснение: У неметаллов температура плавления увеличивается вниз по столбцу.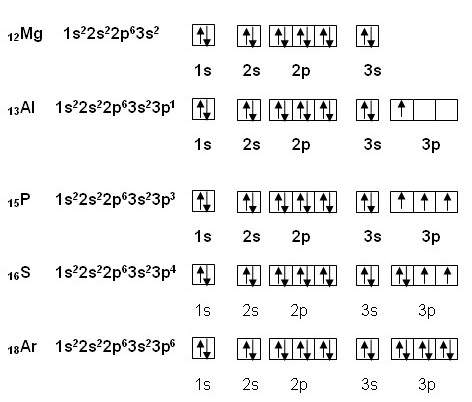 Поскольку хлор и бром находятся в одной колонке, бром имеет более высокую температуру плавления.
Поскольку хлор и бром находятся в одной колонке, бром имеет более высокую температуру плавления.
5. Ответ: Сера (S)
Пояснение: Обратите внимание, что сера и селен находятся в одном столбце. Электроотрицательность увеличивается на столбец. Это указывает на то, что сера более электроотрицательна, чем селен.
6. Ответ: Большинство благородных газов имеют полновалентные оболочки.
Пояснение: Благородные газы обладают полной валентной электронной оболочкой, поэтому они чрезвычайно стабильны и с трудом теряют или приобретают электроны.
7. Ответ: S> Si> Al> Mg.
Пояснение: Электроны над закрытой оболочкой защищены закрытой оболочкой. S имеет 6 электронов над закрытой оболочкой, поэтому каждый из них ощущает притяжение 6 протонов в ядре.
8. Ответ: Фтор (F)> Сера (S)> Фосфор (P)> Бор (B)
Объяснение: Сродство к электрону обычно увеличивается слева направо и снизу вверх.
9. Ответ: C.) Кислород (O)
Пояснение: Периодические тенденции показывают, что атомный радиус увеличивается вверх по группе и слева направо в течение периода. Следовательно, кислород имеет меньший атомный радиус серы.
Следовательно, кислород имеет меньший атомный радиус серы.
10. Ответ: Б.) Неверно
Объяснение: Причина этого заключается в том, что металл обычно теряет электрон, становясь ионом, в то время как неметалл получает электрон. Это приводит к меньшему ионному радиусу для иона металла и большему ионному радиусу для иона неметалла.
Список литературы
- Пинто, Габриэль. «Использование мячей различных видов спорта для моделирования изменения атомных размеров». Дж.Chem. Educ. 1998 75 725. {cke_protected} {C}
- Куреши, Пушкин М .; Камоонпури, С. Икбал М. “Ионная сольватация: проблема ионных радиусов”. J. Chem. Educ. 1991 , 68 , 109.
- Смит, Дерек В. «Энтальпии атомизации металлических элементарных веществ с использованием полуколичественной теории ионных твердых тел: простая модель для рационализации периодических тенденций». J. Chem. Educ. 1993 , 70 , 368.

- Руссо, Стив и Майк Сильвер. Вводная химия. Сан-Франциско: Пирсон, 2007. .
- Петруччи, Ральф Х. и др. Общая химия: принципы и современные приложения. 9-е изд. Нью-Джерси: Пирсон, 2007.
- Аткинс, Питер и др. al, Physical Chemistry , 7 th Edition, 2002, W.H Freeman and Company, New York, pg. 390.
- Олберти, Роберт А. и др. al, Physical Chemistry , 3 rd Edition, 2001, John Wiley & Sons, Inc., стр.380.
- Kots, John C. et. al, Chemistry & Chemical Reactivity , 5 th Edition, 2003, Thomson Learning Inc, стр. 305-309.
Авторы и авторство
- Света Рамиредди (UCD), Бинъяо Чжэн (UCD), Эмили Нгуен (UCD)
5.17: Электронные конфигурации и Периодическая таблица
Обычно используемая длинная форма периодической таблицы предназначена для подчеркивания электронных конфигураций.Поскольку именно внешние (валентные) электроны в основном участвуют в химических взаимодействиях между атомами, последних электронов, добавленных к атому в процессе наращивания, представляют гораздо больший интерес для химика, чем первый. Этот последний электрон называется , отличительным электроном , потому что он отличает атом от атома, непосредственно предшествующего ему в периодической таблице. Тип подоболочки ( s, p, d, f ), в которую помещается отличительный электрон, очень тесно связан с химическим поведением элемента и приводит к классификации, показанной цветовой кодировкой на периодической таблице Менделеева. здесь.Репрезентативные элементы – это те, в которых отличительный электрон входит в подоболочку s или p . Большинство элементов, химический состав и валентность которых мы обсуждали до сих пор, попадают в эту категорию. Многие химические свойства типичных элементов можно объяснить на основе диаграмм Льюиса. То есть валентность типичных элементов может быть предсказана на основе количества имеющихся у них валентных электронов или количества электронов, которые необходимо было бы добавить, чтобы получить такую же электронную конфигурацию, как у атома благородного человека.
Этот последний электрон называется , отличительным электроном , потому что он отличает атом от атома, непосредственно предшествующего ему в периодической таблице. Тип подоболочки ( s, p, d, f ), в которую помещается отличительный электрон, очень тесно связан с химическим поведением элемента и приводит к классификации, показанной цветовой кодировкой на периодической таблице Менделеева. здесь.Репрезентативные элементы – это те, в которых отличительный электрон входит в подоболочку s или p . Большинство элементов, химический состав и валентность которых мы обсуждали до сих пор, попадают в эту категорию. Многие химические свойства типичных элементов можно объяснить на основе диаграмм Льюиса. То есть валентность типичных элементов может быть предсказана на основе количества имеющихся у них валентных электронов или количества электронов, которые необходимо было бы добавить, чтобы получить такую же электронную конфигурацию, как у атома благородного человека. газ.Для репрезентативных элементов количество валентных электронов такое же, как номер периодической группы, а количество, необходимое для соответствия следующей конфигурации благородного газа, равно 8 минус номер группы. Это согласуется с правилами валентности, полученными из периодической таблицы, и приводит к формулам для хлоридов первой дюжины элементов, которые показывают периодическое изменение валентности.
газ.Для репрезентативных элементов количество валентных электронов такое же, как номер периодической группы, а количество, необходимое для соответствия следующей конфигурации благородного газа, равно 8 минус номер группы. Это согласуется с правилами валентности, полученными из периодической таблицы, и приводит к формулам для хлоридов первой дюжины элементов, которые показывают периодическое изменение валентности.
| Элемент | Атомный вес | Водородные соединения | Кислородные соединения | Соединения хлора |
|---|---|---|---|---|
| Водород | 1.01 | H 2 | H 2 O, H 2 O 2 | HCl |
| Гелий | 4,00 | Не сформировано | Не сформировано | Не сформировано |
| Литий | 6,94 | LiH | Li 2 O, Li 2 O 2 | LiCl |
| Бериллий | 9.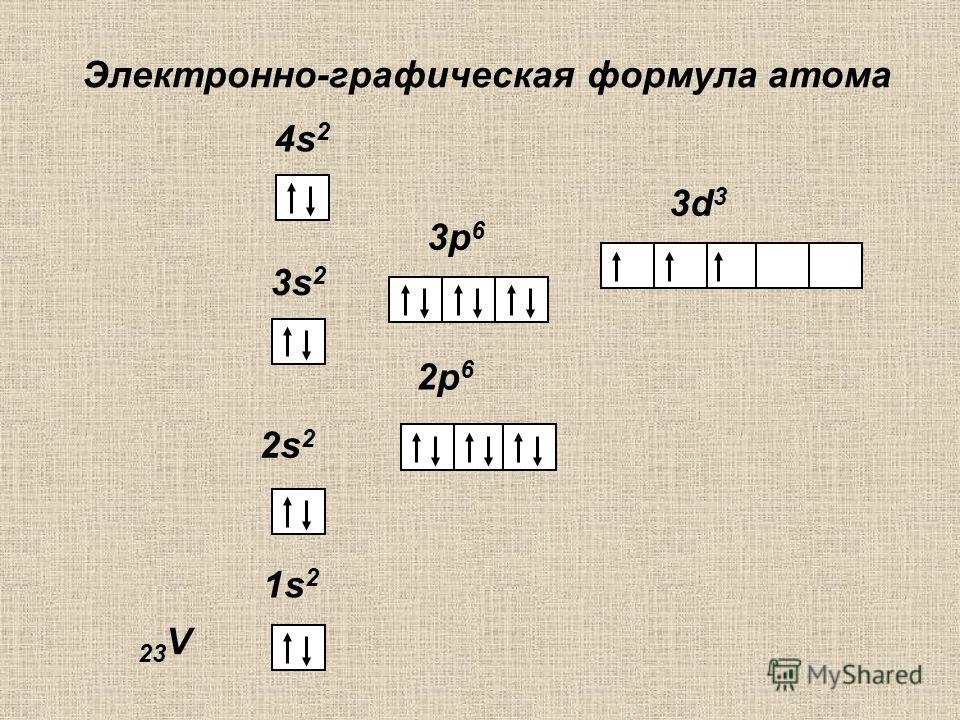 01 01 | BeH 2 | BeO | BeCl 2 |
| Бор | 10,81 | B 2 H 6 | B 2 O 3 | BCl 3 |
| Углерод | 12.01 | CH 4 , C 2 H 6 , C 3 H 8 | CO 2 , CO, C 2 O 3 | CCl 4 , C 2 Класс 6 |
| Азот | 14. 01 01 | NH 3 , N 2 H 4 , HN 3 | N 2 O, NO, NO 2 , N 2 O 5 | NCl 3 |
| Кислород | 16,00 | H 2 O, H 2 O 2 | О 2 , О 3 | |
| Фтор | 19.00 | HF | ИЗ 2 , О 2 Ф 2 | ClF, ClF 3 , ClF 5 |
| Неон | 20,18 | Не сформировано | Не сформировано | Не сформировано |
| Натрий | 22,99 | NaH | Na 2 O, Na 2 O 2 | NaCl |
| Магний | 24. 31 31 | мг H 2 | MgO | MgCl 2 |
Первые три горизонтальных ряда или периода в современной периодической таблице полностью состоят из репрезентативных элементов. В первом периоде отличительные электроны для H и He находятся в подоболочке 1 s . Во втором периоде Li и Be имеют отличительные электроны в подоболочке 2 s , и электроны добавляются к подоболочке 2 p в атомах от B до Ne.В третьем периоде подоболочка 3 с заполняется для Na и Mg и, следовательно, для Al, Si, P, S, Cl и Ar. Как правило, в случае репрезентативных элементов отличительный электрон будет в подоболочке нс или нп . Значение n , главного квантового числа для различимого электрона, можно быстро определить, отсчитывая от верха таблицы Менделеева. Например, йод является типичным элементом пятого периода .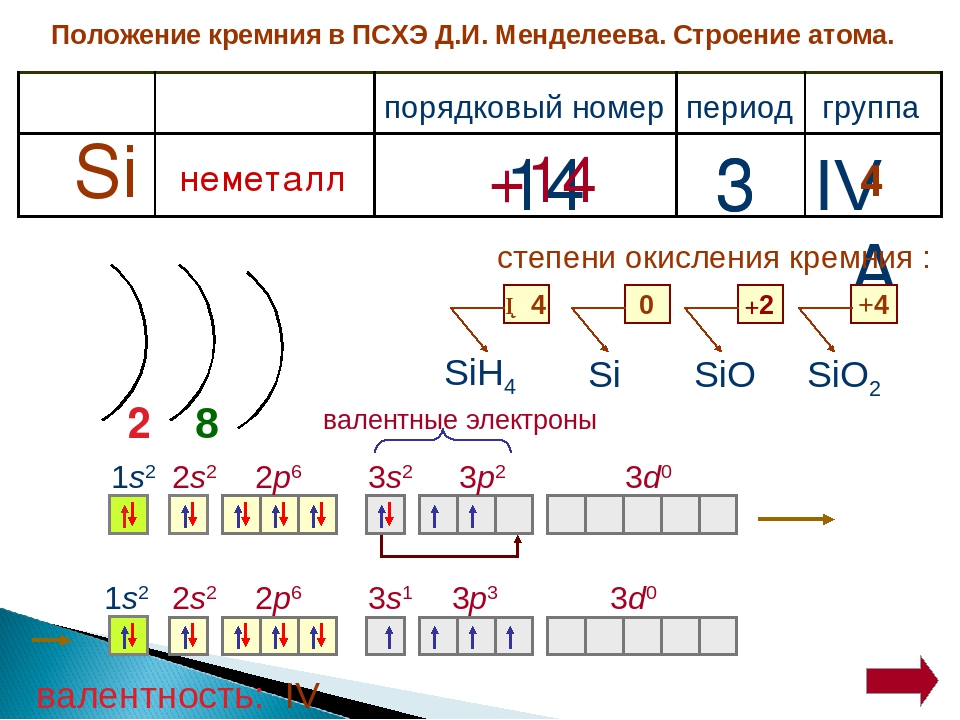 Следовательно, отличительный электрон должен занимать подоболочку 5 s или 5 p . Поскольку I находится справа в таблице, правильным выбором будет 5 p .
Следовательно, отличительный электрон должен занимать подоболочку 5 s или 5 p . Поскольку I находится справа в таблице, правильным выбором будет 5 p .
Когда главное квантовое число равно трем или более, возможны также подоболочки типа d . Переходные элементы или переходные металлы – это те элементы, чей отличительный электрон находится на орбитали d . Первые примеры переходных металлов (Sc, Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Zn) находятся в четвертом периоде , хотя в каждом случае отличительным электроном является 3 d электронов. и принадлежит к третьей оболочке .Этот перерыв возникает, как мы уже видели, потому что 4 s имеет меньшую энергию, чем 3 d . Таким образом, орбиталь 4 s начинает заполняться, начиная четвертый период до того, как любая из орбиталей d может быть занята.
На рисунке \ (\ PageIndex {1} \) сравниваются распределения вероятностей 4 s и 3 d электрона в атоме V. Хотя электронное облако 4 s находится дальше от ядра в среднем, чем облако 3 9 1059 d , небольшая часть электронной плотности 4 s находится очень близко к ядру, где оно почти не защищено от общей ядерный заряд +23.Это очень сильная сила притяжения этой небольшой части общей плотности электронов 4 s , которая понижает энергию электрона 4 s ниже энергии 3 d .
Хотя электронное облако 4 s находится дальше от ядра в среднем, чем облако 3 9 1059 d , небольшая часть электронной плотности 4 s находится очень близко к ядру, где оно почти не защищено от общей ядерный заряд +23.Это очень сильная сила притяжения этой небольшой части общей плотности электронов 4 s , которая понижает энергию электрона 4 s ниже энергии 3 d .
Тот факт, что электронное облако 4 s шире, чем 3 d , оказывает важное влияние на химию переходных элементов. Когда атом, такой как V (рисунок \ (\ PageIndex {1} \)), взаимодействует с другим атомом, именно 4 s электронов, идущие дальше всего от ядра, первыми контактируют с другим атомом.Таким образом, 4 9 1059 s 9 10 60 электронов часто более значимы, чем 3 9 10 59 d 9 10 60 при определении валентности и формул соединений. 3 d электронов «похоронены» под поверхностью атомов переходных металлов. Добавление еще одного электрона 3 d оказывает значительно меньшее влияние на их химические свойства, чем добавление еще одного электрона 3 s или 3 p в случае типичных элементов. Следовательно, происходит медленный, но устойчивый переход свойств от одного переходного элемента к другому.Обратите внимание, например, что за исключением Sc, все переходные металлы образуют хлориды, MCl2, где металл имеет валентность 2; примерами являются TiCl2, VCl2, CrCl2 и так далее. Это можно увидеть в таблице вверху этой страницы. Валентность 2 соответствует двум валентным электронам 4s.
Добавление еще одного электрона 3 d оказывает значительно меньшее влияние на их химические свойства, чем добавление еще одного электрона 3 s или 3 p в случае типичных элементов. Следовательно, происходит медленный, но устойчивый переход свойств от одного переходного элемента к другому.Обратите внимание, например, что за исключением Sc, все переходные металлы образуют хлориды, MCl2, где металл имеет валентность 2; примерами являются TiCl2, VCl2, CrCl2 и так далее. Это можно увидеть в таблице вверху этой страницы. Валентность 2 соответствует двум валентным электронам 4s.
Каждый из переходных металлов также проявляет другие валентности, в которых также задействованы один или несколько из 3 d электронов. Например, в некоторых соединениях V (ванадий) имеет валентность 2 (VO, VCl 2 ), в других он имеет валентность 3 (V 2 O 3 , VCl 3 ), в третьих он имеет валентность 4 (VO 2 , VCl 4 ), и по крайней мере в одном случае (V 2 O 5 ) он имеет валентность 5. Химия переходных металлов более сложна, и из-за этой переменной валентности возможно более широкое разнообразие формул для соединений переходных металлов. В некоторых случаях электроны в подоболочках d действуют как валентные электроны, а в других – нет. Хотя 3 d электронных облаков не простираются дальше от ядра, чем 3 9 10 59 s и 3 9 10 59 p 9 10 60 (и, следовательно, не составляют другую оболочку, как 4 9 10 59 s 9 10 60 электронов), они полностью защищены от ядерных заряжаются и поэтому часто действуют как валентные электроны.Такое поведение Джекила и Хайда для 3 d электронов делает жизнь более сложной (и часто гораздо более интересной) для химиков, изучающих переходные элементы.
Химия переходных металлов более сложна, и из-за этой переменной валентности возможно более широкое разнообразие формул для соединений переходных металлов. В некоторых случаях электроны в подоболочках d действуют как валентные электроны, а в других – нет. Хотя 3 d электронных облаков не простираются дальше от ядра, чем 3 9 10 59 s и 3 9 10 59 p 9 10 60 (и, следовательно, не составляют другую оболочку, как 4 9 10 59 s 9 10 60 электронов), они полностью защищены от ядерных заряжаются и поэтому часто действуют как валентные электроны.Такое поведение Джекила и Хайда для 3 d электронов делает жизнь более сложной (и часто гораздо более интересной) для химиков, изучающих переходные элементы.
| Z | Элемент | Конфигурация |
|---|---|---|
| 1 | ЧАС | 1 с 1 |
| 2 | Он | 1 с 2 |
| 3 | Ли | [He] 2 с 1 |
| 4 | Быть | [He] 2 с 2 |
| 5 | B | [He] 2 с 2 2 p 1 |
| 6 | C | [He] 2 с 2 2 p 2 |
| 7 | N | [He] 2 с 2 2 p 3 |
| 8 | 0 | [He] 2 с 2 2 с 4 |
| 9 | F | [He] 2 с 2 2 p 5 |
| 10 | Ne | [He] 2 с 2 2 p 6 |
| 11 | Na | [Ne] 3 с 1 |
| 12 | Mg | [Ne] 3 с 2 |
| 13 | Al | [Ne] 3 с 2 3 с 1 |
| 14 | Si | [Ne] 3 с 2 3 с 2 |
| 15 | п | [Ne] 3 с 2 3 p 3 |
| 16 | S | [Ne] 3 с 2 3 с 4 |
| 17 | Cl | [Ne] 3 с 2 3 с 5 |
| 18 | Ar | [Ne] 3 с 2 3 p 6 |
| 19 | K | [Ar] 4 с 1 |
| 20 | Ca | [Ar] 4 с 2 |
| 21 | Sc | [Ar] 3 d 1 4 s 2 |
| 22 | Ti | [Ar] 3 d 2 4 s 2 |
| 23 | V | [Ar] 3 d 3 4 s 2 |
| 24 | Cr | [Ar] 3 d 5 4 s 1 |
| 25 | Mn | [Ar] 3 d 5 4 s 2 |
| 26 | Fe | [Ar] 3 d 6 4 s 2 |
| 27 | Co | [Ar] 3 d 7 4 s 2 |
| 28 | Ni | [Ar] 3 d 8 4 s 2 |
| 29 | Cu | [Ar] 3 d 10 4 s 1 |
| 30 | Zn | [Ar] 3 d 10 4 s 2 |
| 31 | Ga | [Ar] 3 d 10 4 s 2 4 p 1 |
| 32 | Ge | [Ar] 3 d 10 4 s 2 4 p 2 |
| 33 | В виде | [Ar] 3 d 10 4 s 2 4 p 3 |
| 34 | Se | [Ar] 3 d 10 4 s 2 4 p 4 |
| 35 | Br | [Ar] 3 d 10 4 s 2 4 p 5 |
| 36 | Kr | [Ar] 3 d 10 4 s 2 4 p 6 |
| 37 | Руб. | [Kr] 5 с 1 |
| 38 | Sr | [Kr] 5 с 2 |
| 39 | Y | [Kr] 4 d 1 5 s 2 |
| 40 | Zr | [Kr] 4 d 2 5 s 2 |
| 41 | Nb | [Kr] 4 d 4 5 s 1 |
| 42 | Пн | [Kr] 4 d 5 5 s 1 |
| 43 | Tc | [Kr] 4 d 5 5 s 2 |
| 44 | RU | [Kr] 4 d 7 5 s 1 |
| 45 | Rh | [Kr] 4 d 8 5 s 1 |
| 46 | Pd | [Kr] 4 d 10 |
| 47 | Ag | [Kr] 4 d 10 5 s 1 |
| 48 | CD | [Kr] 4 d 10 5 s 2 |
| 49 | В | [Kr] 4 d 10 5 s 2 5 p 1 |
| 50 | Sn | [Kr] 4 d 10 5 s 2 5 p 2 |
| 51 | Sb | [Kr] 4 d 10 5 s 2 5 p 3 |
| 52 | Te | [Kr] 4 d 10 5 s 2 5 p 4 |
| 53 | я | [Kr] 4 d 10 5 s 2 5 p 5 |
| 54 | Xe | [Kr] 4 d 10 5 s 2 5 p 6 |
| 55 | CS | [Xe] 6 с 1 |
| 56 | Ба | [Xe] 6 с 2 |
| 57 | Ла | [Xe] 5 d 1 6 s 2 |
| 58 | Ce | [Xe] 4 f 1 5 d 1 6 s 2 |
| 59 | Pr | [Xe] 4 f 3 6 s 2 |
| 60 | Nd | [Xe] 4 f 4 6 s 2 |
| 61 | Вечера | [Xe] 4 f 5 6 s 2 |
| 62 | См | [Xe] 4 f 6 6 s 2 |
| 63 | Евросоюз | [Xe] 4 f 7 6 s 2 |
| 64 | Б-г | [Xe] 4 f 7 5 d 1 6 s 2 |
| 65 | Tb | [Xe] 4 f 9 6 s 2 |
| 66 | Dy | [Xe] 4 f 10 6 s 2 |
| 67 | Хо | [Xe] 4 f 11 6 s 2 |
| 68 | Э | [Xe] 4 f 12 6 s 2 |
| 69 | Тм | [Xe] 4 f 13 6 s 2 |
| 70 | Yb | [Xe] 4 f 14 6 s 2 |
| 71 | Лу | [Xe] 4 f 14 5 d 1 6 s 2 |
| 72 | Hf | [Xe] 4 f 14 5 d 2 6 s 2 |
| 73 | Та | [Xe] 4 f 14 5 d 3 6 s 2 |
| 74 | W | [Xe] 4 f 14 5 d 4 6 s 2 |
| 75 | Re | [Xe] 4 f 14 5 d 5 6 s 2 |
| 76 | 0 с | [Xe] 4 f 14 5 d 6 6 s 2 |
| 77 | Ir | [Xe] 4 f 14 5 d 7 6 s 2 |
| 78 | Pt | [Xe] 4 f 14 5 d 9 6 s 1 |
| 79 | Au | [Xe] 4 f 14 5 d 10 6 s 1 |
| 80 | Hg | [Xe] 4 f 14 5 d 10 6 s 2 |
| 81 | Tl | [Xe] 4 f 14 5 d 10 6 s 2 6 p 1 |
| 82 | Pb | [Xe] 4 f 14 5 d 10 6 s 2 6 p 2 |
| 83 | Би | [Xe] 4 f 14 5 d 10 6 s 2 6 p 3 |
| 84 | По | [Xe] 4 f 14 5 d 10 6 s 2 6 p 4 |
| 85 | В | [Xe] 4 f 14 5 d 10 6 s 2 6 p 5 |
| 86 | Rn | [Xe] 4 f 14 5 d 10 6 s 2 6 p 6 |
| 87 | Пт | [Rn] 7 с 1 |
| 88 | Ра | [Rn] 7 с 2 |
| 89 | Ac | [Rn] 6 d 1 7 s 2 |
| 90 | Чт | [Rn] 6 d 2 7 s 2 |
| 91 | Па | [Rn] 5 f 2 6 d 1 7 s 2 |
| 92 | U | [Rn] 5 f 3 6 d 1 7 s 2 |
| 93 | Np | [Rn] 5 f 4 6 d 1 7 s 2 |
| 94 | Пу | [Rn] 5 f 6 7 s 2 |
| 95 | Являюсь | [Rn] 5 f 7 7 s 2 |
| 96 | См | [Rn] 5 f 7 6 d 1 s 2 |
| 97 | Bk | [Rn] 5 f 9 s 2 |
| 98 | Cf | [Rn] 5 f 10 s 2 |
| 99 | Es | [Rn] 5 f 11 s 2 |
| 100 | FM | [Rn] 5 f 12 s 2 |
| 101 | Мкр | [Rn] 5 f 13 s 2 |
| 102 | Нет | [Rn] 5 f 14 s 2 |
| 103 | Lr | [Rn] 5 f 14 6 d 1 s 2 |
| 104 | Rf | [Rn] 5 f 14 6 d 2 s 2 |
Третья основная категория элементов возникает, когда отличительный электрон занимает подоболочку f .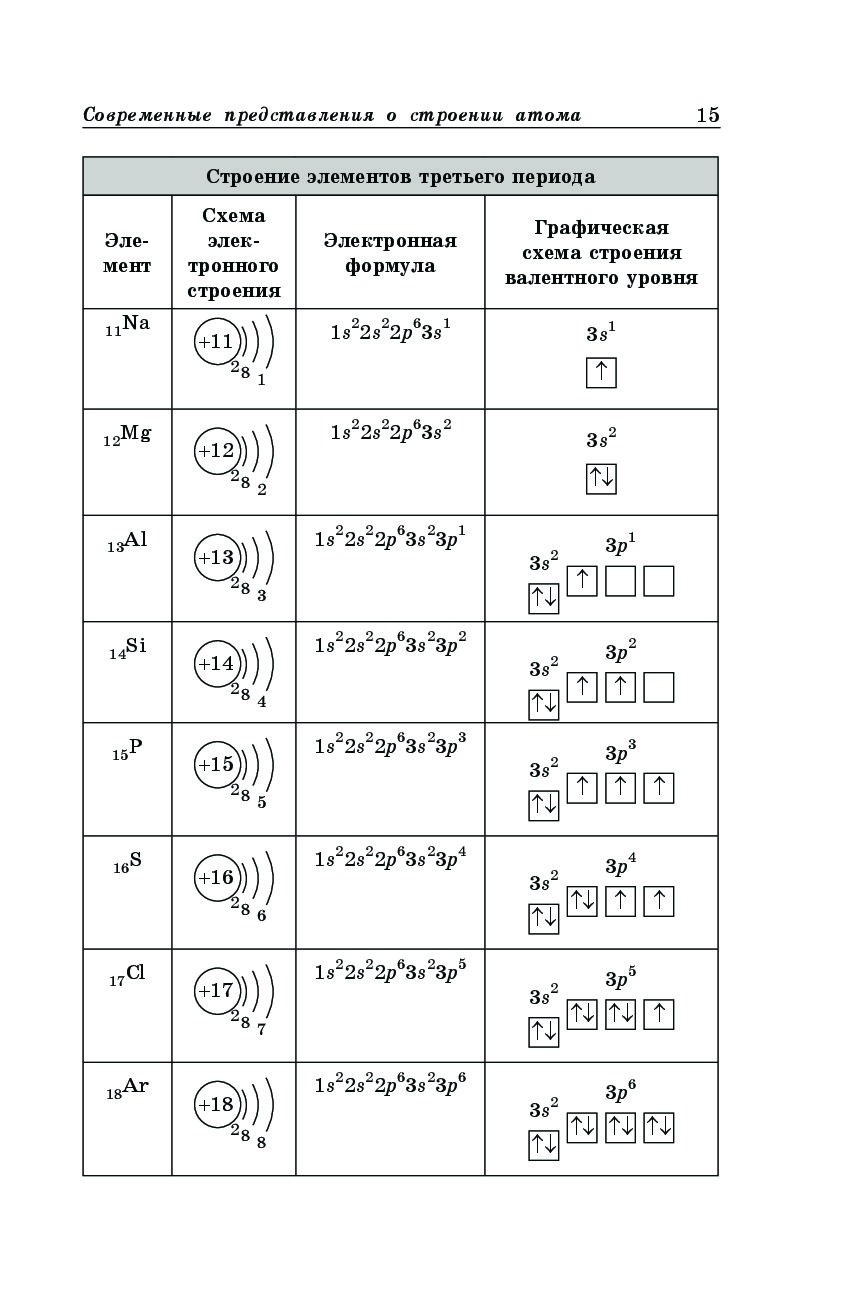 Первый пример имеет место в случае лантаноидов (элементы с атомными номерами от 57 до 71). Лантаноиды имеют общую электронную конфигурацию
Первый пример имеет место в случае лантаноидов (элементы с атомными номерами от 57 до 71). Лантаноиды имеют общую электронную конфигурацию
- [Kr] 4 d 10 4 f i 5 s 2 5 p 6 5 d 0 или 1 6 s 2
, где i – число от 0 до 14.Таким образом, в процессе наращивания лантаноидов электроны добавляются к подоболочке (4 f ), главное квантовое число которой на два меньше, чем у самой внешней орбитали (6 s ). Добавление еще одного электрона во внутреннюю оболочку, похороненную так глубоко, как 4 f , практически не влияет на химические свойства этих элементов. Все они очень похожи на лантан (La) и могут поместиться в точно такое же пространство в периодической таблице, что и La. Элементы лантаноидов настолько похожи друг на друга, что для их разделения требуются специальные методы.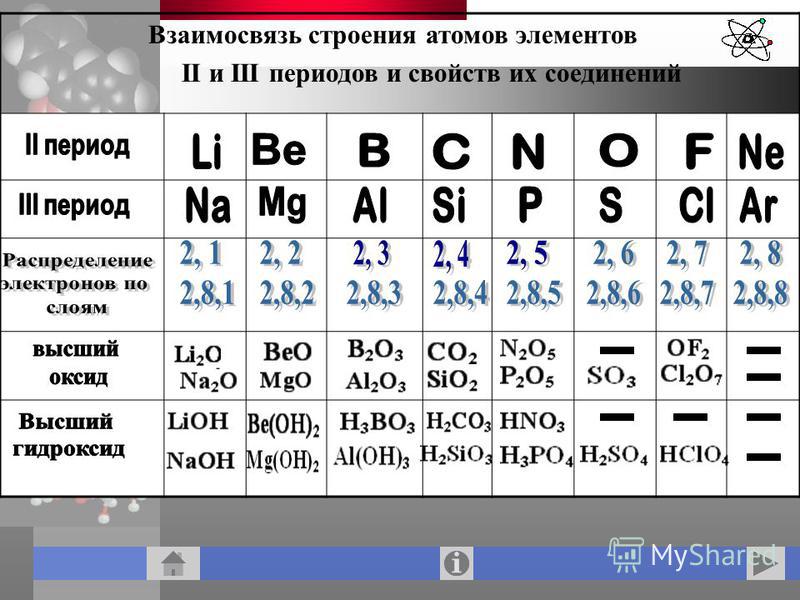 В результате даже приблизительно чистые образцы большинства из них не были приготовлены до 1870-х годов. За элементом актиний (Ac) идет ряд атомов, в которых заполняется подоболочка 5 f . Актиноиды несколько менее похожи на Ac, чем лантаноиды на La, потому что некоторые исключения из обычного порядка заполнения орбиталей происходят в случае Th, Pa и U (Таблица \ (\ PageIndex {1} \)).
В результате даже приблизительно чистые образцы большинства из них не были приготовлены до 1870-х годов. За элементом актиний (Ac) идет ряд атомов, в которых заполняется подоболочка 5 f . Актиноиды несколько менее похожи на Ac, чем лантаноиды на La, потому что некоторые исключения из обычного порядка заполнения орбиталей происходят в случае Th, Pa и U (Таблица \ (\ PageIndex {1} \)).
Поскольку лантаноиды и большинство актиноидов химически ведут себя так, как будто они должны соответствовать группе IIIB периодической таблицы (где находятся Lu и Lr), обе группы отделены от остальной части таблицы и помещены вместе в блок ниже. Взятые вместе, лантаноиды и актиноиды называются внутренними переходными элементами , потому что заполняемые подоболочки f лежат так глубоко внутри оставшейся электронной структуры их атомов.
На рисунке \ (\ PageIndex {2} \) показан тип подоболочки, в которой должен быть найден отличительный электрон для атомов элементов в различных областях периодической таблицы. Эта сводная информация позволяет относительно просто использовать периодическую таблицу для получения электронных конфигураций, как показано в следующем примере.
Пример \ (\ PageIndex {1} \): электронная конфигурация
Получите электронную конфигурацию для (a) Nb; (б) Пр.
Раствор
a) Nb, номер элемента 41, находится в пятом периоде и в области периодической таблицы, где заполняется подоболочка d (вторая серия переходов).Двигаясь назад (к более низким атомным номерам) по периодической таблице, ближайший благородный газ – это Kr, поэтому мы используем ядро Kr:
Nb [Kr] _____
Следующий элемент после 36 K – это 37 Rb, которым заполняется подоболочка 5s. Перемещаясь еще на одну позицию вправо, мы приходим к 38 Sr, который имеет пару 5 s 2 .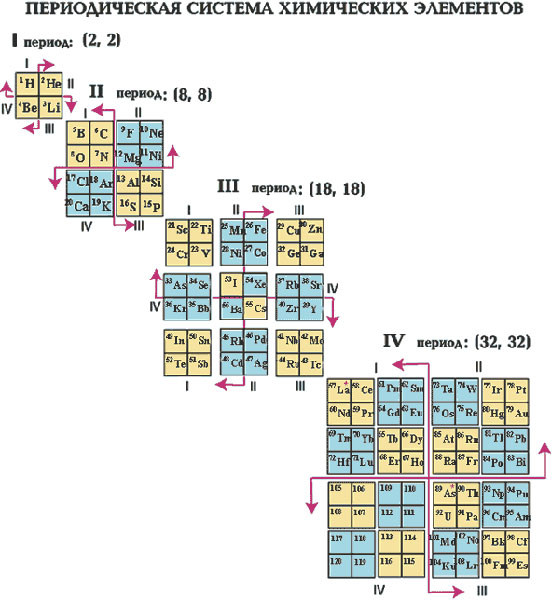 Пока у нас есть Nb [Kr] _____ 5 с 2 для конфигурации Nb. Теперь мы переместимся дальше прямо в область 4 d подоболочки периодической таблицы и посчитаем по трем пробелам (Y, Zr, Nb), чтобы достичь Nb.Таким образом, полная электронная конфигурация равна Nb [Kr] 4 d 3 5 s 2 (Обратите внимание, что главное квантовое число подоболочки d равно 4 – на единицу меньше числа периода. , если вы посмотрите на таблицу электронных конфигураций, следует отметить, что Nb является исключением из типичных правил заполнения орбиты) b) Аналогичная процедура выполняется для Pr, элемент номер 59. Двигаясь назад по таблице, ближайший благородный газ – Xe, поэтому мы используем ядро Xe.Снова считая вперед, Cs и Ba соответствуют 6 с 2 . Тогда La, Ce и Pr соответствуют еще трем электронам в подоболочке 4 f . Таким образом, конфигурация выглядит так: Pr … [Xe] 4 f 3 6 s 2
Пока у нас есть Nb [Kr] _____ 5 с 2 для конфигурации Nb. Теперь мы переместимся дальше прямо в область 4 d подоболочки периодической таблицы и посчитаем по трем пробелам (Y, Zr, Nb), чтобы достичь Nb.Таким образом, полная электронная конфигурация равна Nb [Kr] 4 d 3 5 s 2 (Обратите внимание, что главное квантовое число подоболочки d равно 4 – на единицу меньше числа периода. , если вы посмотрите на таблицу электронных конфигураций, следует отметить, что Nb является исключением из типичных правил заполнения орбиты) b) Аналогичная процедура выполняется для Pr, элемент номер 59. Двигаясь назад по таблице, ближайший благородный газ – Xe, поэтому мы используем ядро Xe.Снова считая вперед, Cs и Ba соответствуют 6 с 2 . Тогда La, Ce и Pr соответствуют еще трем электронам в подоболочке 4 f . Таким образом, конфигурация выглядит так: Pr … [Xe] 4 f 3 6 s 2 Следует подчеркнуть еще один момент, касающийся взаимосвязи между электронной конфигурацией и периодической таблицей.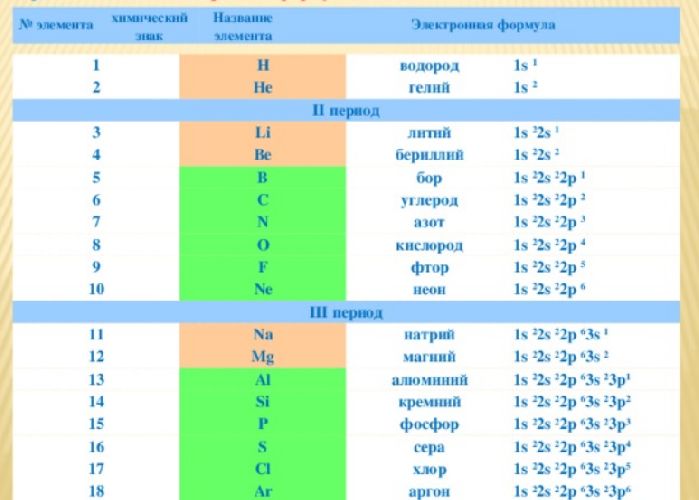 Атомы элементов в одном вертикальном столбце таблицы имеют схожую электронную конфигурацию .Например, рассмотрим щелочноземельные элементы (группа IIA). Используя наши правила для получения электронных конфигураций (Пример 1), мы имеем
Атомы элементов в одном вертикальном столбце таблицы имеют схожую электронную конфигурацию .Например, рассмотрим щелочноземельные элементы (группа IIA). Используя наши правила для получения электронных конфигураций (Пример 1), мы имеем
| Элемент | Электронная конфигурация | Диаграмма Льюиса |
|---|---|---|
| Be | [He] 2 с 2 | Be : |
| мг | [Ne] 3 с 2 | мг : |
| Ca | [Ar] 4 с 2 | Ca : |
| Sr | [Kr] 5 с 2 | Sr : |
| Ba | [Xe] 6 с 2 | Ba : |
| Ra | [Rn] 7 с 2 | Ra : |
Таким образом, сходство химического поведения и валентности, отмеченное ранее для этих элементов, коррелирует со сходством их внешних электронных облаков. Такое сходство объясняет успех предсказаний Менделеева свойств неоткрытых элементов.
Такое сходство объясняет успех предсказаний Менделеева свойств неоткрытых элементов.
Авторы и авторство
6.5 Периодические изменения свойств элементов – Химия 2e
Цели обучения
К концу этого раздела вы сможете:
- Опишите и объясните наблюдаемые тенденции изменения размера атомов, энергии ионизации и сродства к электрону элементов
Элементы в группах (вертикальные столбцы) периодической таблицы демонстрируют схожее химическое поведение.Это сходство происходит потому, что члены группы имеют одинаковое количество и распределение электронов в их валентных оболочках. Однако в периодической таблице Менделеева есть и другие закономерности в химических свойствах. Например, по мере того, как мы движемся вниз по группе, металлический характер атомов усиливается. Кислород, находящийся в верхней части группы 16 (6A), представляет собой бесцветный газ; в середине группы селен представляет собой твердое полупроводниковое вещество; а внизу полоний – это серебристо-серое твердое вещество, проводящее электричество.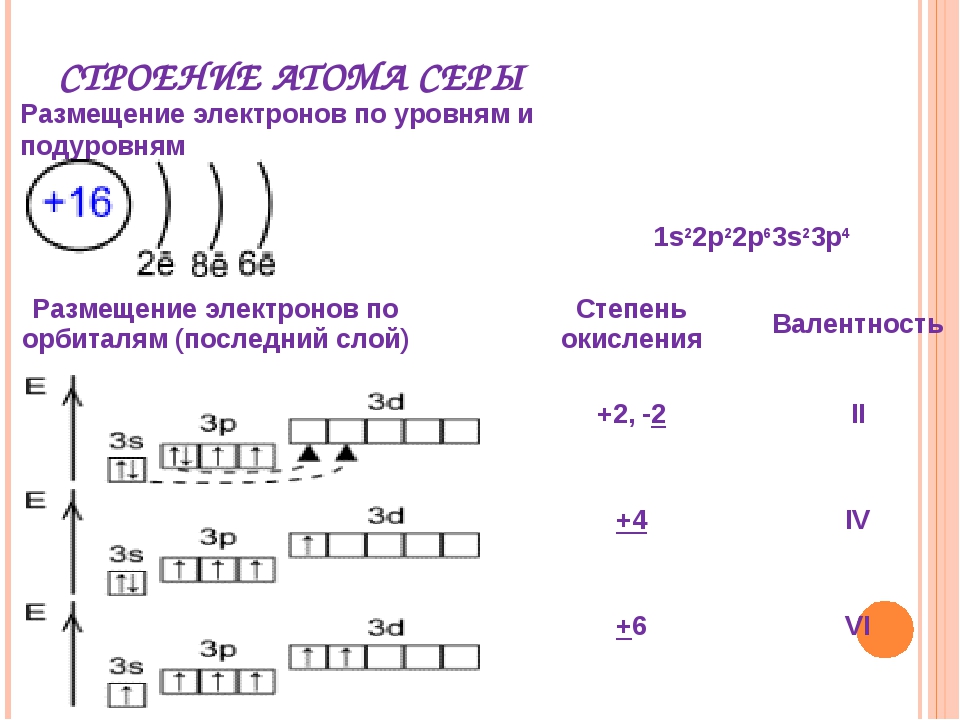
Проходя период слева направо, мы добавляем протон к ядру и электрон к валентной оболочке с каждым последующим элементом. По мере того, как мы опускаемся по элементам в группе, количество электронов в валентной оболочке остается постоянным, но главное квантовое число увеличивается каждый раз на единицу. Понимание электронной структуры элементов позволяет нам изучить некоторые свойства, которые определяют их химическое поведение. Эти свойства периодически меняются по мере изменения электронной структуры элементов.Это (1) размер (радиус) атомов и ионов, (2) энергии ионизации и (3) сродство к электрону.
Ссылка на обучение
Изучите визуализации периодических тенденций, обсуждаемых в этом разделе (и многих других). Всего за несколько щелчков мышью вы можете создать трехмерную версию периодической таблицы, показывающую атомный размер или графики энергии ионизации всех измеренных элементов.
Вариация ковалентного радиуса
Квантовая картина затрудняет определение определенного размера атома.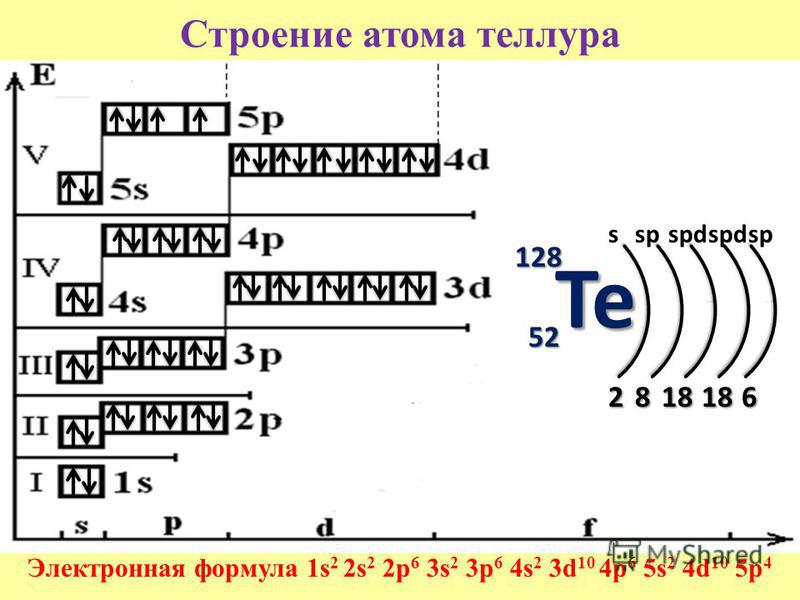 Однако есть несколько практических способов определения радиуса атомов и, таким образом, определения их относительных размеров, которые дают примерно одинаковые значения. Мы будем использовать ковалентный радиус (рис. 6.30), который определяется как половина расстояния между ядрами двух идентичных атомов, когда они соединены ковалентной связью (это измерение возможно, потому что атомы внутри молекул все еще сохраняют большую часть своих атомных связей). личность). Мы знаем, что, когда мы просматриваем группу вниз, главное квантовое число, n , увеличивается на единицу для каждого элемента.Таким образом, электроны добавляются в область пространства, которая все больше удаляется от ядра. Следовательно, размер атома (и его ковалентный радиус) должен увеличиваться по мере увеличения расстояния самых удаленных электронов от ядра. Эта тенденция проиллюстрирована для ковалентных радиусов галогенов в Таблице 6.2 и на Рисунке 6.30. Тенденции для всей таблицы Менделеева можно увидеть на Рисунке 6.
Однако есть несколько практических способов определения радиуса атомов и, таким образом, определения их относительных размеров, которые дают примерно одинаковые значения. Мы будем использовать ковалентный радиус (рис. 6.30), который определяется как половина расстояния между ядрами двух идентичных атомов, когда они соединены ковалентной связью (это измерение возможно, потому что атомы внутри молекул все еще сохраняют большую часть своих атомных связей). личность). Мы знаем, что, когда мы просматриваем группу вниз, главное квантовое число, n , увеличивается на единицу для каждого элемента.Таким образом, электроны добавляются в область пространства, которая все больше удаляется от ядра. Следовательно, размер атома (и его ковалентный радиус) должен увеличиваться по мере увеличения расстояния самых удаленных электронов от ядра. Эта тенденция проиллюстрирована для ковалентных радиусов галогенов в Таблице 6.2 и на Рисунке 6.30. Тенденции для всей таблицы Менделеева можно увидеть на Рисунке 6. 30.
30.
Ковалентные радиусы элементов галогенной группы
| Атом | Ковалентный радиус (пм) | Ядерный заряд |
|---|---|---|
| Ф | 64 | +9 |
| Класс | 99 | +17 |
| Br | 114 | +35 |
| I | 133 | +53 |
| при | 148 | +85 |
Таблица 6.2
Рис. 6.30 (a) Радиус атома определяется как половина расстояния между ядрами в молекуле, состоящей из двух одинаковых атомов, соединенных ковалентной связью. Атомный радиус галогенов увеличивается вниз по группе по мере увеличения n . (b) Ковалентные радиусы элементов показаны в масштабе. Общая тенденция состоит в том, что радиусы увеличиваются по группе и уменьшаются с течением времени.
Рис. 6.31. В течение каждого периода тренд атомного радиуса уменьшается по мере увеличения Z ; например, от К до Кр.Внутри каждой группы (например, щелочные металлы, показанные фиолетовым цветом) наблюдается тенденция к увеличению атомного радиуса по мере увеличения Z .
Как показано на рис. 6.31, при перемещении по периоду слева направо мы обычно обнаруживаем, что каждый элемент имеет меньший ковалентный радиус, чем предшествующий ему элемент. Это может показаться нелогичным, поскольку подразумевает, что атомы с большим количеством электронов имеют меньший атомный радиус. Это можно объяснить с помощью концепции эффективного ядерного заряда Z eff .Это притяжение, оказываемое ядром на конкретный электрон с учетом любого электрон-электронного отталкивания. Для водорода существует только один электрон, поэтому заряд ядра ( Z ) и эффективный заряд ядра ( Z eff ) равны. Для всех остальных атомов внутренние электроны частично экранируют внешних электронов от притяжения ядра, и, таким образом:
Для всех остальных атомов внутренние электроны частично экранируют внешних электронов от притяжения ядра, и, таким образом:
Экранирование определяется вероятностью нахождения другого электрона между интересующим электроном и ядром, а также электрон-электронным отталкиванием, с которым сталкивается интересующий электрон.Электроны ядра умеют экранировать, в то время как электроны в одной валентной оболочке не так эффективно блокируют ядерное притяжение, испытываемое друг другом. Таким образом, каждый раз, когда мы перемещаемся от одного элемента к другому в течение периода, Z увеличивается на единицу, но экранирование увеличивается лишь незначительно. Таким образом, Z eff увеличивается при перемещении слева направо по периоду. Более сильное притяжение (более высокий эффективный заряд ядра), испытываемое электронами в правой части периодической таблицы, притягивает их ближе к ядру, уменьшая ковалентные радиусы.
Таким образом, как и следовало ожидать, самые удаленные или валентные электроны легче всего удалить, потому что они имеют самую высокую энергию, больше экранированы и находятся дальше всего от ядра. Как правило, когда репрезентативные элементы образуют катионы, они делают это за счет потери ns или np электронов, которые были добавлены последними в процессе Aufbau. С другой стороны, переходные элементы теряют нс электронов, прежде чем они начнут терять ( n – 1) d электронов, даже несмотря на то, что нс электронов добавляются первыми в соответствии с принципом Ауфбау.
Пример 6.12
Сортировка атомных радиусов
Предскажите порядок увеличения ковалентного радиуса для Ge, Fl, Br, Kr.Решение
Радиус увеличивается по мере продвижения группы вниз, поэтому GeCheck Your Learning
Приведите пример атома, размер которого меньше, чем у фтора.
Изменение ионных радиусов
Ионный радиус – это мера, используемая для описания размера иона. Катион всегда имеет меньше электронов и столько же протонов, что и родительский атом; он меньше атома, из которого он образован (рис.32). Например, ковалентный радиус атома алюминия (1 с 2 2 с 2 2 p 6 3 с 2 3 p 1 ) составляет 118 пм. , тогда как ионный радиус Al 3+ (1 s 2 2 s 2 2 p 6 ) составляет 68 пм. Когда электроны удаляются из внешней валентной оболочки, оставшиеся электроны остова, занимающие меньшие оболочки, испытывают больший эффективный ядерный заряд Z eff (как обсуждалось) и притягиваются еще ближе к ядру.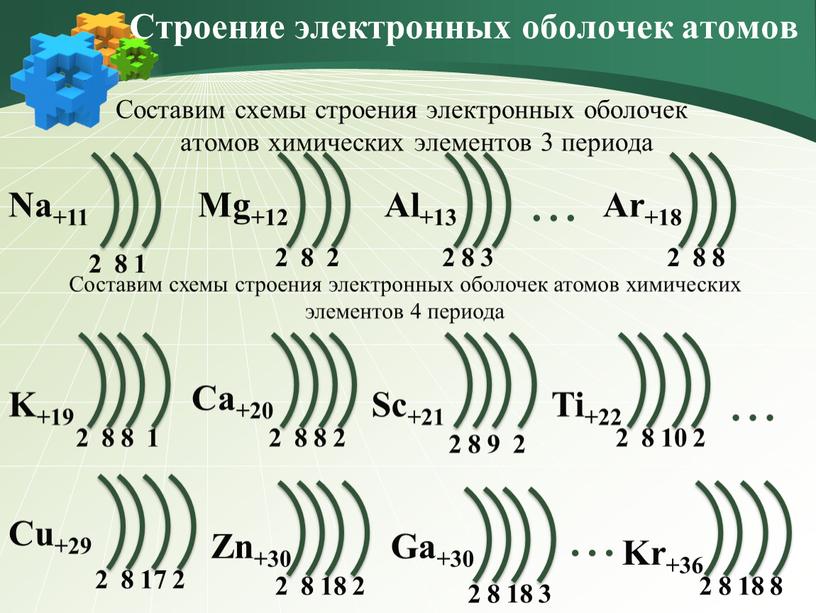
Рис. 6.32. Радиус катиона меньше, чем у родительского атома (Al), из-за потери электронов; радиус для аниона больше, чем у родительского (S), из-за полученных электронов.
Катионы с большим зарядом меньше катионов с меньшим зарядом (например, V 2+ имеет ионный радиус 79 пм, а у V 3+ – 64 пм). Просматривая группы периодической таблицы, мы обнаруживаем, что катионы следующих друг за другом элементов с одинаковым зарядом обычно имеют больший радиус, соответствующий увеличению главного квантового числа, n .
Анион (отрицательный ион) образуется в результате присоединения одного или нескольких электронов к валентной оболочке атома. Это приводит к большему отталкиванию электронов и снижению Z eff на электрон. Оба эффекта (увеличенное количество электронов и уменьшенное Z eff ) приводят к тому, что радиус аниона больше, чем радиус родительского атома (рис. 6.32). Например, атом серы ([Ne] 3 s 2 3 p 4 ) имеет ковалентный радиус 104 пм, тогда как ионный радиус сульфид-аниона ([Ne] 3 s 2 3 п. 6 ) составляет 170 пп.Для последовательных элементов, движущихся вниз по любой группе, анионы имеют большие главные квантовые числа и, следовательно, большие радиусы.
6.32). Например, атом серы ([Ne] 3 s 2 3 p 4 ) имеет ковалентный радиус 104 пм, тогда как ионный радиус сульфид-аниона ([Ne] 3 s 2 3 п. 6 ) составляет 170 пп.Для последовательных элементов, движущихся вниз по любой группе, анионы имеют большие главные квантовые числа и, следовательно, большие радиусы.
Атомы и ионы, имеющие одинаковую электронную конфигурацию, называются изоэлектронными. Примеры изоэлектронных частиц: N 3–, O 2– , F –, Ne, Na + , Mg 2+ и Al 3+ (1 s 2 2 с 2 2 с 6 ). Другая изоэлектронная серия: P 3–, S 2– , Cl –, Ar, K + , Ca 2+ и Sc 3+ ([Ne] 3 s 2 3 п.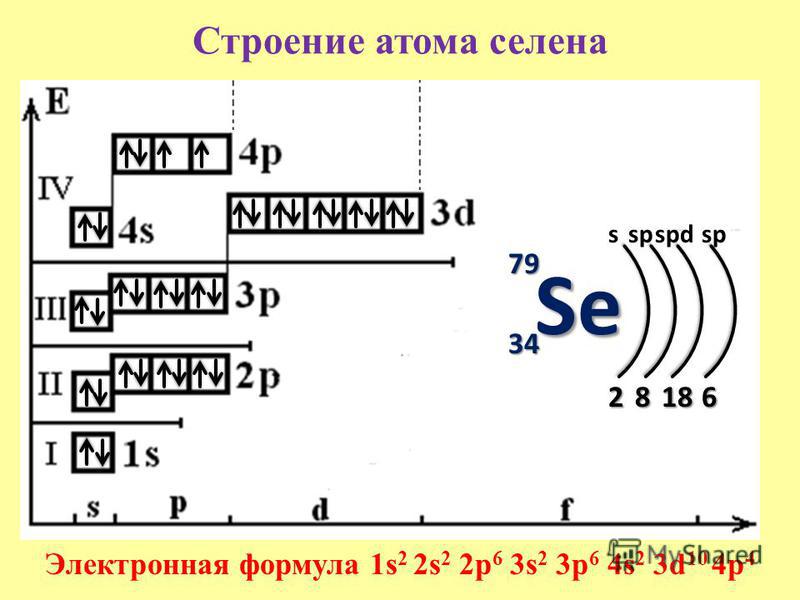 6 ).Для изоэлектронных атомов или ионов количество протонов определяет размер. Чем больше заряд ядра, тем меньше радиус в ряду изоэлектронных ионов и атомов.
6 ).Для изоэлектронных атомов или ионов количество протонов определяет размер. Чем больше заряд ядра, тем меньше радиус в ряду изоэлектронных ионов и атомов.
Изменение энергии ионизации
Количество энергии, необходимое для удаления наиболее слабосвязанного электрона из газообразного атома в его основном состоянии, называется его первой энергией ионизации (IE 1 ). Первая энергия ионизации элемента X – это энергия, необходимая для образования катиона с зарядом +1:
X (g) ⟶X + (g) + e − IE1X (g) ⟶X + (g) + e − IE1Энергия, необходимая для удаления второго наиболее слабосвязанного электрона, называется второй энергией ионизации (IE 2 ).
X + (g) ⟶X2 + (g) + e − IE2X + (g) ⟶X2 + (g) + e − IE2 Энергия, необходимая для удаления третьего электрона, является третьей энергией ионизации и так далее. Для удаления электронов из атомов или ионов всегда требуется энергия, поэтому процессы ионизации эндотермичны, а значения IE всегда положительны. Для более крупных атомов электрон с наиболее слабой связью расположен дальше от ядра, поэтому его легче удалить. Таким образом, с увеличением размера (атомного радиуса) энергия ионизации должна уменьшаться. Связывая эту логику с тем, что мы только что узнали о радиусах, мы ожидаем, что энергия первой ионизации будет уменьшаться по группе и увеличиваться с течением времени.
Для более крупных атомов электрон с наиболее слабой связью расположен дальше от ядра, поэтому его легче удалить. Таким образом, с увеличением размера (атомного радиуса) энергия ионизации должна уменьшаться. Связывая эту логику с тем, что мы только что узнали о радиусах, мы ожидаем, что энергия первой ионизации будет уменьшаться по группе и увеличиваться с течением времени.
На рис. 6.33 показана зависимость между первой энергией ионизации и атомным номером нескольких элементов. Значения энергии первой ионизации для элементов приведены на рисунке 6.34. В течение периода IE 1 обычно увеличивается с увеличением Z . Вниз по группе значение IE 1 обычно уменьшается с увеличением Z . Однако есть некоторые систематические отклонения от этой тенденции. Обратите внимание, что энергия ионизации бора (атомный номер 5) меньше, чем у бериллия (атомный номер 4), хотя ядерный заряд бора больше на один протон.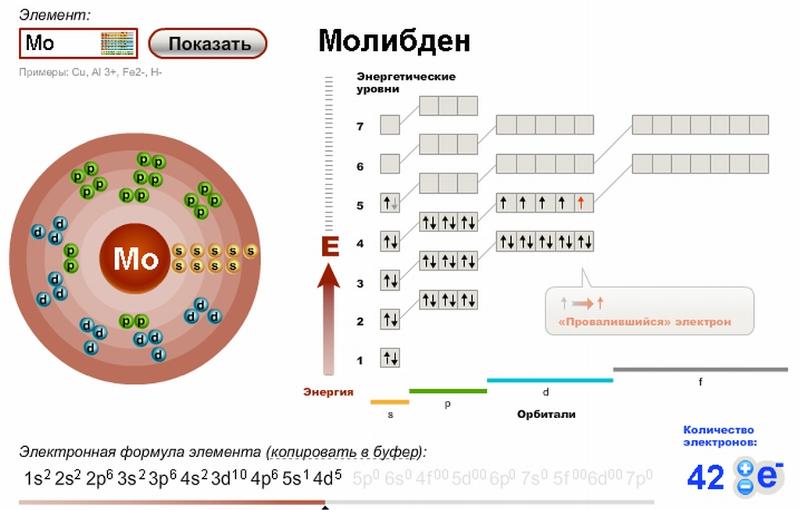 Это можно объяснить тем, что энергия подоболочек увеличивается по мере увеличения l из-за проникновения и экранирования (как обсуждалось ранее в этой главе). Внутри любой оболочки s электронов имеют меньшую энергию, чем p электронов. Это означает, что электрон s сложнее удалить из атома, чем электрон p в той же оболочке. Электрон, удаляемый во время ионизации бериллия ([He] 2 s 2 ), является электроном s , тогда как электрон, удаляемый во время ионизации бора ([He] 2 s 2 2 p 1 ) – электрон p ; это приводит к более низкой энергии первой ионизации бора, даже несмотря на то, что его ядерный заряд на один протон больше.Таким образом, мы видим небольшое отклонение от прогнозируемого тренда каждый раз, когда начинается новая подоболочка.
Это можно объяснить тем, что энергия подоболочек увеличивается по мере увеличения l из-за проникновения и экранирования (как обсуждалось ранее в этой главе). Внутри любой оболочки s электронов имеют меньшую энергию, чем p электронов. Это означает, что электрон s сложнее удалить из атома, чем электрон p в той же оболочке. Электрон, удаляемый во время ионизации бериллия ([He] 2 s 2 ), является электроном s , тогда как электрон, удаляемый во время ионизации бора ([He] 2 s 2 2 p 1 ) – электрон p ; это приводит к более низкой энергии первой ионизации бора, даже несмотря на то, что его ядерный заряд на один протон больше.Таким образом, мы видим небольшое отклонение от прогнозируемого тренда каждый раз, когда начинается новая подоболочка.
Рис. 6.33. Первая энергия ионизации элементов в первых пяти периодах нанесена на график в зависимости от их атомного номера.
Рис. 6.34. Эта версия периодической таблицы показывает первую энергию ионизации (IE 1 ) в кДж / моль выбранных элементов.
Другое отклонение происходит, когда орбитали заполняются более чем наполовину. Первая энергия ионизации для кислорода немного меньше, чем для азота, несмотря на тенденцию к увеличению значений IE 1 за период.Глядя на орбитальную диаграмму кислорода, мы можем видеть, что удаление одного электрона устранит электрон-электронное отталкивание, вызванное спариванием электронов на орбитали 2 p , и приведет к полузаполнению орбитали (что энергетически выгодно). Аналогичные изменения происходят в последующие периоды (обратите внимание на падение серы после фосфора на рис. 6.34).
Удалить электрон из катиона труднее, чем удалить электрон из нейтрального атома, из-за большего электростатического притяжения к катиону. Точно так же удалить электрон из катиона с более высоким положительным зарядом труднее, чем удалить электрон из иона с более низким зарядом. Таким образом, последовательные энергии ионизации одного элемента всегда увеличиваются. Как видно из Таблицы 6.3, наблюдается значительное увеличение энергии ионизации для каждого элемента. Этот скачок соответствует удалению остовных электронов, которые удалить труднее, чем валентные электроны. Например, и Sc, и Ga имеют по три валентных электрона, поэтому быстрое увеличение энергии ионизации происходит после третьей ионизации.
Точно так же удалить электрон из катиона с более высоким положительным зарядом труднее, чем удалить электрон из иона с более низким зарядом. Таким образом, последовательные энергии ионизации одного элемента всегда увеличиваются. Как видно из Таблицы 6.3, наблюдается значительное увеличение энергии ионизации для каждого элемента. Этот скачок соответствует удалению остовных электронов, которые удалить труднее, чем валентные электроны. Например, и Sc, и Ga имеют по три валентных электрона, поэтому быстрое увеличение энергии ионизации происходит после третьей ионизации.
Энергия последовательной ионизации выбранных элементов (кДж / моль)
| Элемент | IE 1 | IE 2 | IE 3 | IE 4 | IE 5 | IE 6 | IE 7 |
|---|---|---|---|---|---|---|---|
| К | 418.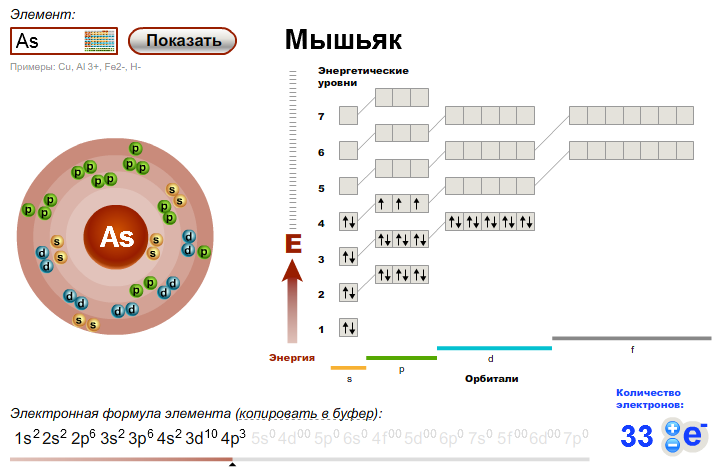 8 8 | 3051,8 | 4419,6 | 5876,9 | 7975,5 | 9590,6 | 11343 |
| Ca | 589,8 | 1145,4 | 4912,4 | 6490,6 | 8153,0 | 10495,7 | 12272,9 |
| SC | 633,1 | 1235,0 | 2388,7 | 7090,6 | 8842,9 | 10679,0 | 13315,0 |
| Ga | 578.8 | 1979,4 | 2964,6 | 6180 | 8298,7 | 10873,9 | 13594,8 |
| Ge | 762,2 | 1537,5 | 3302,1 | 4410,6 | 9021,4 | Не доступен | Не доступен |
| Как | 944,5 | 1793,6 | 2735,5 | 4836,8 | 6042,9 | 12311,5 | Не доступен |
Таблица 6. 3
3
Пример 6.13
Рейтинг энергии ионизации
Предскажите порядок увеличения энергии для следующих процессов: IE 1 для Al, IE 1 для Tl, IE 2 для Na, IE 3 для Al.Решение
Удаление электрона 6 p 1 из Tl проще, чем удаление электрона 3 p 1 из Al, потому что более высокая орбиталь n находится дальше от ядра, поэтому IE 1 (Tl) 1 (Al).Ионизация третьего электрона от Al (Al2 + Al3 ++ e−) Al (Al2 + ⟶Al3 ++ e−) требует больше энергии, потому что катион Al 2+ оказывает на электрон более сильное притяжение, чем нейтральный атом Al, поэтому IE 1 (Al) 3 (Al). Вторая энергия ионизации натрия удаляет остовный электрон, что требует гораздо более высокой энергии, чем удаление валентных электронов. Собирая все вместе, получаем: IE 1 (Tl) 1 (Al) 3 (Al) 2 (Na).
Собирая все вместе, получаем: IE 1 (Tl) 1 (Al) 3 (Al) 2 (Na).Проверьте свои знания
Какое значение имеет наименьшее значение для IE 1 : O, Po, Pb или Ba?Изменение сродства к электрону
Сродство к электрону (EA) – это изменение энергии для процесса добавления электрона к газообразному атому с образованием аниона (отрицательного иона).
X (g) + e − ⟶X− (g) EA1X (g) + e − ⟶X− (g) EA1 Этот процесс может быть эндотермическим или экзотермическим, в зависимости от элемента. Советник некоторых элементов представлен на рисунке 6.35. Вы можете видеть, что многие из этих элементов имеют отрицательные значения EA, что означает, что энергия высвобождается, когда газообразный атом принимает электрон. Однако для некоторых элементов требуется энергия, чтобы атом стал отрицательно заряженным, а значение их EA положительно. Как и в случае с энергией ионизации, последующие значения EA связаны с образованием ионов с большим зарядом. Второй EA – это энергия, связанная с добавлением электрона к аниону с образованием –2-иона и так далее.
Второй EA – это энергия, связанная с добавлением электрона к аниону с образованием –2-иона и так далее.
Как мы могли предсказать, становится легче добавить электрон к ряду атомов, поскольку эффективный ядерный заряд атомов увеличивается. Мы обнаруживаем, что по мере продвижения слева направо в течение периода советники становятся более негативными. Исключения, обнаруженные среди элементов группы 2 (2A), группы 15 (5A) и группы 18 (8A), можно понять на основе электронной структуры этих групп.Благородные газы, группа 18 (8A), имеют полностью заполненную оболочку, и приходящий электрон должен быть добавлен на более высокий уровень n , что труднее сделать. Группа 2 (2A) имеет заполненную подоболочку нс , и поэтому следующий добавленный электрон переходит в более высокую энергию нп , так что, опять же, наблюдаемое значение EA не соответствует прогнозируемой тенденции. Наконец, группа 15 (5A) имеет наполовину заполненную подоболочку np , и следующий электрон должен быть спарен с существующим электроном np .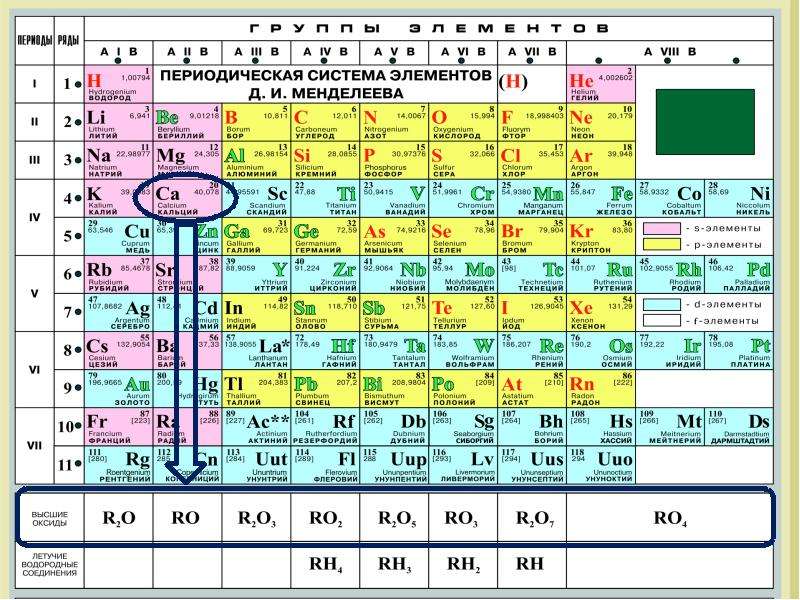 Во всех этих случаях первоначальная относительная стабильность электронной конфигурации нарушает тренд EA.
Во всех этих случаях первоначальная относительная стабильность электронной конфигурации нарушает тренд EA.
Мы также можем ожидать, что у атома наверху каждой группы будет наиболее отрицательный советник; их первые потенциалы ионизации предполагают, что эти атомы имеют самые большие эффективные ядерные заряды. Однако, двигаясь вниз по группе, мы видим, что второй элемент в группе чаще всего имеет наиболее отрицательный советник. Это можно объяснить малым размером оболочки n = 2 и возникающим в результате большим электрон-электронным отталкиванием.Например, хлор со значением EA -348 кДж / моль имеет наивысшее значение из всех элементов периодической таблицы. ЭА фтора –322 кДж / моль. Когда мы добавляем электрон к атому фтора с образованием фторид-аниона (F – ), мы добавляем электрон к оболочке n = 2. Электрон притягивается к ядру, но также наблюдается значительное отталкивание от других электронов, уже присутствующих в этой небольшой валентной оболочке. Атом хлора имеет такую же электронную конфигурацию в валентной оболочке, но поскольку входящий электрон переходит в оболочку n = 3, он занимает значительно большую область пространства, и электрон-электронное отталкивание уменьшается.Входящий электрон не испытывает такого сильного отталкивания, а атом хлора легче принимает дополнительный электрон, что приводит к более отрицательному EA.
Атом хлора имеет такую же электронную конфигурацию в валентной оболочке, но поскольку входящий электрон переходит в оболочку n = 3, он занимает значительно большую область пространства, и электрон-электронное отталкивание уменьшается.Входящий электрон не испытывает такого сильного отталкивания, а атом хлора легче принимает дополнительный электрон, что приводит к более отрицательному EA.
Рис. 6.35. Эта версия периодической таблицы отображает значения сродства к электрону (в кДж / моль) для выбранных элементов.
Свойства, обсуждаемые в этом разделе (размер атомов и ионов, эффективный заряд ядра, энергии ионизации и сродство к электрону), являются центральными для понимания химической реакционной способности. Например, поскольку фтор имеет энергетически выгодный EA и большой энергетический барьер для ионизации (IE), гораздо легче образовывать анионы фтора, чем катионы.Металлические свойства, включая проводимость и пластичность (способность формировать листы), зависят от наличия электронов, которые можно легко удалить. Таким образом, металлический характер увеличивается по мере того, как мы движемся вниз по группе, и уменьшается в течение периода в той же тенденции, что наблюдается для размера атома, потому что легче удалить электрон, который находится дальше от ядра.
Таким образом, металлический характер увеличивается по мере того, как мы движемся вниз по группе, и уменьшается в течение периода в той же тенденции, что наблюдается для размера атома, потому что легче удалить электрон, который находится дальше от ядра.
Химические формулы
Это пятая лекция по общей химии. Обсуждаемые темы: эмпирические и молекулярные формулы, изомеры и периодическая таблица.
Эмпирические и молекулярные формулыПри написании формул химических соединений можно использовать различные методы, основанные на информации, которую вы хотите сообщить:
Молекулярные формулы– это представления молекулы, которые включают список обоих элементов в молекуле, а также количество этих атомов в формуле:
Например, вода имеет молекулярную формулу H 2 O. Эта формула читается как два атома водорода и один атом кислорода, составляющие молекулу воды.Обратите внимание, что нижний индекс 2 в формуле указывает количество атомов для элемента, за которым она следует.
Например: Если формула была C 2 H 4 O 2 , это означало бы, что в молекуле 2 атома углерода, 4 атома водорода и 2 атома кислорода.
Другой способ представить воду – это ее структурная формула:
Эта формула показывает, что оба атома водорода присоединены к кислороду, но не друг к другу. Еще одно представление воды называется моделью структурной формулы, заполняющей пространство, и оно будет выглядеть так:
И еще одно представление молекулы – это то, что мы называем эмпирической формулой, которая просто описывает соотношение атомов в молекуле.Это означает, что изображение показывает наименьшее отношение целых чисел атомов в молекуле:
Позже мы будем использовать массы и моли, чтобы найти эмпирические и молекулярные формулы, но пока просто важно знать определения.
Изомеры
Изомер – это модное слово для обозначения атомов различной ориентации в молекулах с одинаковым числом и соотношением атомов.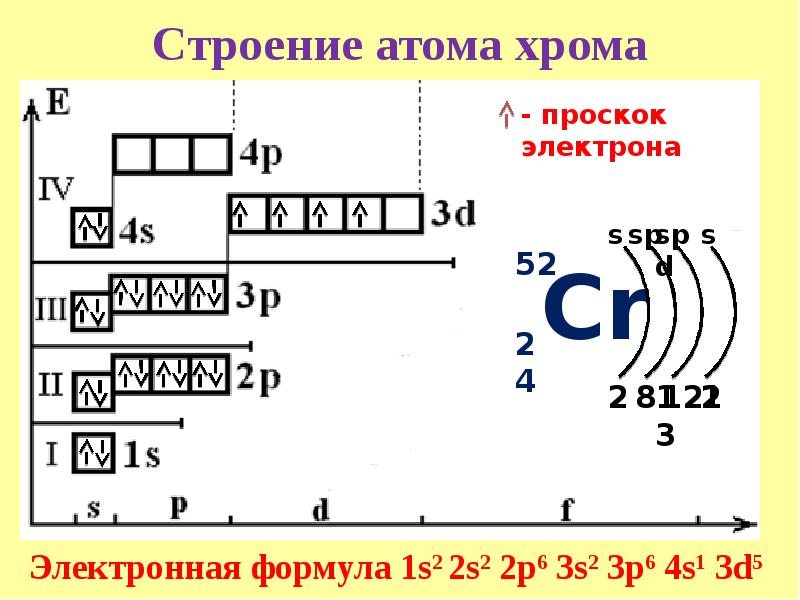 Например,
Например,
Если вы внимательно посмотрите на эти две структуры, вы заметите, что, хотя связи между атомами различны, количество атомов и их соотношения точно такие же = C 4 H 8 , это делает две структуры изомерами.Другой тип изомера – это тот, в котором присоединения выглядят очень похожими, но различаются тем, как они прикреплены в пространстве, – это так называемые пространственные или геометрические изомеры,
Обратите внимание, что ионы хлора, будучи присоединенными к углероду, находятся либо на противоположных сторонах друг от друга.
Периодическая таблица
Периодическая таблица Менделеева – инструмент, необходимый большинству химиков. В таблице перечислены все известные элементы и даже указаны позиции возможных антропогенных элементов будущего.
Элементы, показанные серым цветом, созданы руками человека.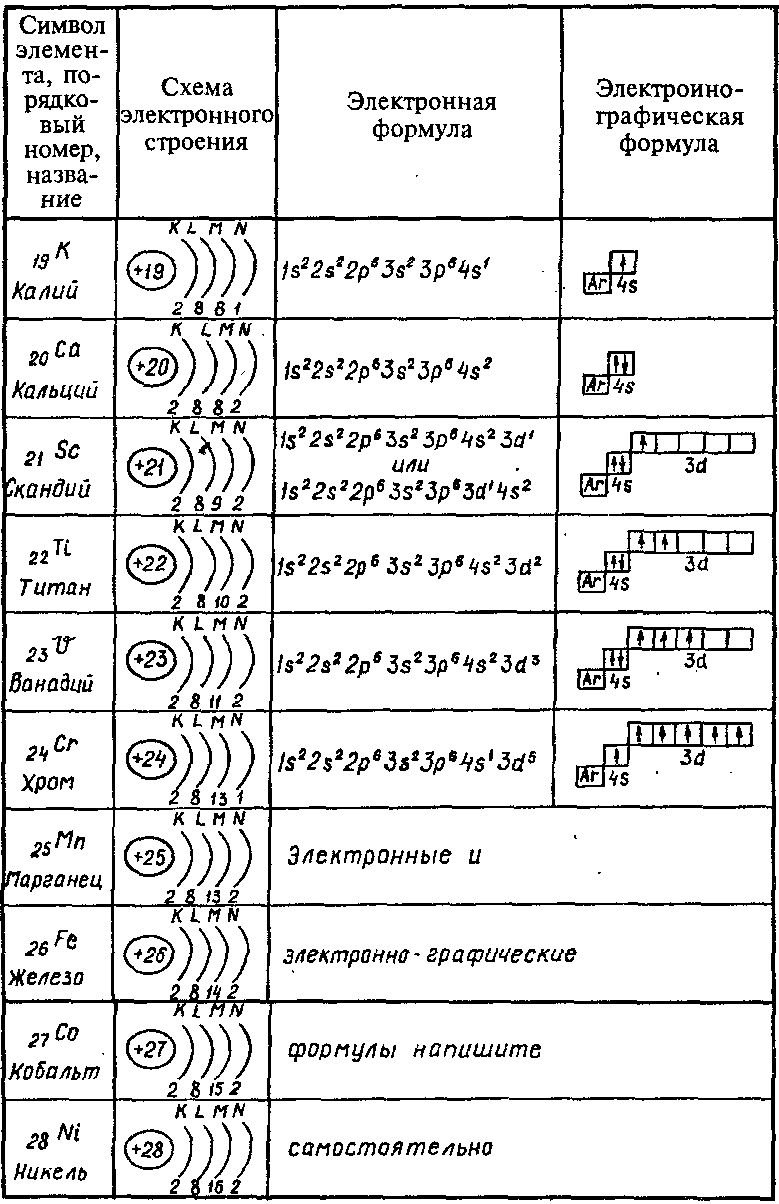 Они создают эти элементы, разбивая атомы вместе внутри ядерных реакторов.
Они создают эти элементы, разбивая атомы вместе внутри ядерных реакторов.
Для ваших целей существует несколько элементов информации, которые вы можете получить из периодической таблицы, которая поможет вам в ваших расчетах, а также в определении типа связи, которую будет создавать элемент.
Сначала обратим внимание на состояния большинства элементов:
Большинство из них твердые. Показано черным цветом.Есть только две жидкости естественного происхождения: ртуть и бром. Газы показаны красным цветом и включают несколько элементов первого периода, а также благородные газы (группа 8).
Строки в периодической таблице называются периодами , а столбцы – группами . Периоды разделены тем, как заполняются электроны вокруг атома. Мы обсудим это в последующих лекциях. А пока мы остановимся на обсуждении общих черт элементов, размещенных в группах.
Группа I называется щелочными металлами. Эти металлы обладают схожими свойствами: они мягкие по отношению к металлам и их можно разрезать ножом. Это также металлы с низкой плотностью, и некоторые из них могут плавать на воде.
Эти металлы обладают схожими свойствами: они мягкие по отношению к металлам и их можно разрезать ножом. Это также металлы с низкой плотностью, и некоторые из них могут плавать на воде.
Группа II называется щелочноземельными металлами. Причина этого названия – их реакция с водой:
Реакция дает основание гидроксида и газообразный водород. Щелочь определяется как основание, которое растворяется в воде, поэтому эти металлы являются щелочными по своим свойствам.Эти металлы также мягче, чем большинство других металлов, и имеют низкую плотность.
Группы с 3 по 12 называются переходными металлами. Эти металлы несколько различаются по свойствам, но все они хорошо проводят тепло и электричество. Они не такие мягкие и более плотные, чем щелочные или щелочноземельные металлы. Их можно ковать или гнуть, придавая им особую форму, и они менее химически активны, чем щелочные или щелочноземельные металлы.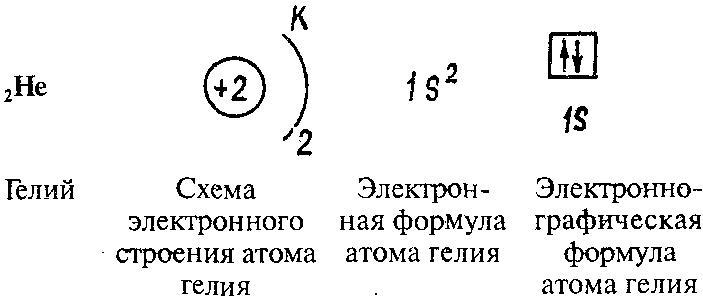 Когда они действительно реагируют, они часто создают цветные соединения.
Когда они действительно реагируют, они часто создают цветные соединения.
Группы 13 и 14 периодической таблицы Менделеева не имеют конкретных названий, но содержат начало металлоидного сегмента периодической таблицы Менделеева:
Металлоиды (показаны зеленым) – это элементы, которые имеют как металлические, так и неметаллические свойства.Они образуют «забор» между металлами и неметаллами в Периодической таблице и могут действовать аналогично обоим в реакциях.
Группа 15 называется группой пниктогенов (p не используется) на основании содержания азота в группе. Название происходит от греческого слова «удушье». Это связано с тем, что чистый газообразный азот обладает способностью подавляться, поэтому его часто используют для тушения пожара. Свойства этой группы смешаны, причем некоторые из них являются газами, а некоторые – металлоидами. Причина, по которой они были сгруппированы вместе, заключалась в их электронной конфигурации (более поздние лекции) и их способности образовывать -3 иона.
Группа 16 называется группой халькогенов. Название также происходит от греческого происхождения, и элементы в группе называются халькогенами, потому что кислород и сера обычно встречаются в «рудах». Чалко означает «руда», а ген означает «формация». «Руда» – это природный твердый материал, из которого можно с выгодой извлечь металл или ценный минерал. Помимо естественного сродства групп к образованию руд, они также были сгруппированы на основе их электронной конфигурации, а также общего образования -2 ионов.
Группа 17 называется галогенной группой. Галогены также обладают смешанными свойствами с двумя газами (F 2 и Cl 2 , одним жидким (Br 2 ) и остальными твердыми веществами. Все они двухатомные, имеют низкие температуры плавления и кипения, но наиболее важны для них. Особенностью является их реакционная способность с металлами, образующими многие из наиболее распространенных и полезных солей (например, NaCl). Все они также образуют ионы -1.
Все они также образуют ионы -1.
Группа 18 называется Группой благородных газов. Эти газы также называются инертными газами, поскольку одно из их наиболее важных свойств состоит в том, что по большей части они не вступают в реакцию с другими элементами.Очень мало соединений, содержащих благородный газ. Кроме того, все они без запаха и цвета. Они не образуют ионы.
Есть две выделенные строки периодической таблицы, которые, если бы в самой таблице, поместились бы непосредственно перед блоком переходного металла:
Это лантаноиды и актиниды. Вместе они называются редкоземельными металлами. По своим свойствам они действуют подобно большинству металлов, но актиниды обладают дополнительным свойством радиоактивности.
Вы должны знать таблицу Менделеева и, самое главное, следующие сегменты:
Поскольку эти знания позволят вам определить тип соединения (ионное или ковалентное), которое может быть образовано.
Вы также должны знать названия и символы первых 56 элементов, а также платины, золота, ртути, свинца и урана. Вы можете использовать приведенные ниже карточки, чтобы выучить их.
Chem21 Практические карточки
Вернуться к дому
Вернуться к сегменту 1
Химические элементы смартфона – сложные проценты
нажмите, чтобы увеличитьВ сети есть несколько изолированных графических изображений, на которых изображены элементы, участвующие в производстве смартфона – например, эта «Периодическая таблица iPhone» – но на самом деле очень мало легкодоступной информации, в которой подробно описаны конкретные используемые соединения. для определенных целей в мобильных телефонах.Это, вероятно, неудивительно, поскольку эти детали, вероятно, хранятся под замком патентных законов и тому подобного; однако я постарался изо всех сил с этим рисунком, чтобы предоставить немного больше подробностей о конкретных применениях, и это мероприятие потребовало гораздо больше усилий, чем я первоначально ожидал!
Экран
На самом деле легче всего было отследить подробности об элементах и соединениях, используемых при производстве сенсорных экранов.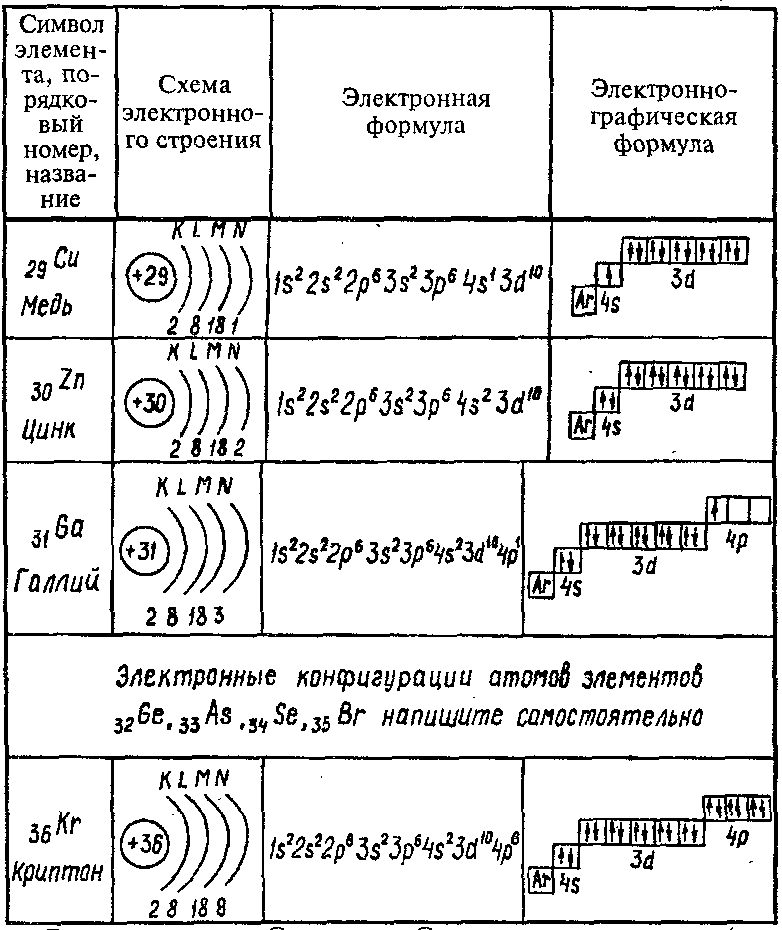 Они изготавливаются в основном из алюмосиликатного стекла, смеси оксида алюминия и диоксида кремния, которое затем помещается в горячую ванну с расплавом соли.Это делается для того, чтобы более мелкие ионы натрия покидали стекло, а более крупные ионы калия занимали их место; они занимают больше места и сжимаются, когда стекло остывает, создавая слой сжимающего напряжения на стекле и увеличивая его прочность и устойчивость к механическим повреждениям.
Они изготавливаются в основном из алюмосиликатного стекла, смеси оксида алюминия и диоксида кремния, которое затем помещается в горячую ванну с расплавом соли.Это делается для того, чтобы более мелкие ионы натрия покидали стекло, а более крупные ионы калия занимали их место; они занимают больше места и сжимаются, когда стекло остывает, создавая слой сжимающего напряжения на стекле и увеличивая его прочность и устойчивость к механическим повреждениям.
Тонкий прозрачный проводящий слой оксида индия и олова нанесен на стекло, чтобы оно могло работать как сенсорный экран. Подробнее о том, как именно работают сенсорные экраны, можно узнать здесь.Некоторые из редкоземельных элементов также присутствуют в очень небольших количествах и участвуют в создании цветов, отображаемых на экране.
Аккумулятор
В большинстве современных телефонов используются литий-ионные батареи. В этих батареях обычно используется оксид лития-кобальта в качестве положительного электрода в батарее (хотя вместо кобальта иногда используются другие переходные металлы), в то время как отрицательный электрод сформирован из углерода в форме графита. Он также будет содержать органический растворитель, который будет действовать как электролитическая жидкость.Литий в положительном электроде ионизируется во время зарядки аккумулятора и перемещается в слои графитового электрода. Во время разряда ионы возвращаются к положительному электроду. Сам аккумулятор обычно заключен в алюминиевый корпус.
Он также будет содержать органический растворитель, который будет действовать как электролитическая жидкость.Литий в положительном электроде ионизируется во время зарядки аккумулятора и перемещается в слои графитового электрода. Во время разряда ионы возвращаются к положительному электроду. Сам аккумулятор обычно заключен в алюминиевый корпус.
Электроника
В электронике телефона используется широкий спектр элементов и соединений. Чип, процессор телефона, сделан из чистого кремния, который затем подвергается воздействию кислорода и тепла, чтобы образовалась пленка диоксида кремния на его поверхности.Затем части этого слоя диоксида кремния удаляются там, где потребуется ток. Кремний не проводит электричество без «легирования» другими элементами; этот процесс включает бомбардировку кремния множеством различных элементов, в том числе фосфором, сурьмой, мышьяком, бором, индий или галлием. Различные типы полупроводников (P или N) производятся в зависимости от используемого элемента, причем бор является наиболее распространенным типом легирующей примеси P-типа.
Микро-электрические компоненты и проводка в телефоне в основном состоят из меди, золота и серебра.Также используется тантал, являющийся основным компонентом микроконденсаторов. Также используется ряд других элементов, в том числе платина и палладий, но выяснить подробности их применения было немного сложнее! Припой используется для соединения электрических компонентов – в прошлые годы он обычно состоял из олова и свинца, но в последние годы стали искать бессвинцовые альтернативы, многие из которых используют комбинацию олова, серебра и меди.
Микрофон и динамик телефона содержат магниты, которые обычно представляют собой сплавы неодима, железа и бора, хотя диспрозий и празеодим часто также присутствуют в сплаве.Они также находятся в вибрационном блоке телефона.
Кожух
Элементы, присутствующие в корпусе телефона, будут зависеть от того, металлический ли корпус, пластиковый или их сочетание. Металлические кожухи могут быть изготовлены из магниевых сплавов, в то время как пластмассовые кожухи, конечно же, будут на основе углерода. Кожух часто также содержит антипирены – бромированные антипирены все еще часто используются, но прилагаются усилия, чтобы минимизировать их использование, поэтому в настоящее время все чаще используются другие органические соединения, не содержащие брома.
Кожух часто также содержит антипирены – бромированные антипирены все еще часто используются, но прилагаются усилия, чтобы минимизировать их использование, поэтому в настоящее время все чаще используются другие органические соединения, не содержащие брома.
Я уверен, что существует множество дополнительной информации, которая более подробно описывает различные химические соединения, используемые в телефонах, но это все, что мне удалось легко отследить. Если у кого-то есть более конкретная информация, было бы здорово узнать!
РЕДАКТИРОВАТЬ: Спасибо @acheronviper в твиттере, вот немного больше информации об элементах, используемых в полупроводниках в телефоне:
Как отмечалось выше, слой диоксида кремния на полупроводниковом устройстве предотвращает протекание тока в областях полупроводника, где это нежелательно, а именно между транзисторами (по существу, в форме переключателей) и кремнием.Транзисторы постоянно становятся все меньше и меньше, и при этом также возникает потребность в том, чтобы изолирующий слой между ними и кремнием становился все тоньше. Однако это ограничено размером атомов кремния и тем фактом, что при уменьшении толщины до примерно 5 атомов слой пропускает ток и становится неэффективным.
Однако это ограничено размером атомов кремния и тем фактом, что при уменьшении толщины до примерно 5 атомов слой пропускает ток и становится неэффективным.
Для борьбы с этим вместо этого использовались слои на основе гафния; это также требует использования другого материала для транзисторов, с использованием как нитрида титана, так и нитрида титана алюминия.Для соединения транзисторов с соединительными слоями меди в полупроводнике в качестве контакта используется вольфрам. Вольфрам также находит применение вне полупроводникового прибора в качестве груза для вибродвигателей внутри телефона.
Конечно, попытки усовершенствовать полупроводниковые устройства все еще продолжаются, и возможность введения соединений элементов III-V групп в структуру транзистора, таких как GaAs, InP и InAs, является возможностью, которая может позволить улучшить подвижность электронов. , и, в свою очередь, позволяют уменьшать размеры полупроводников.
Изображение в этой статье находится под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.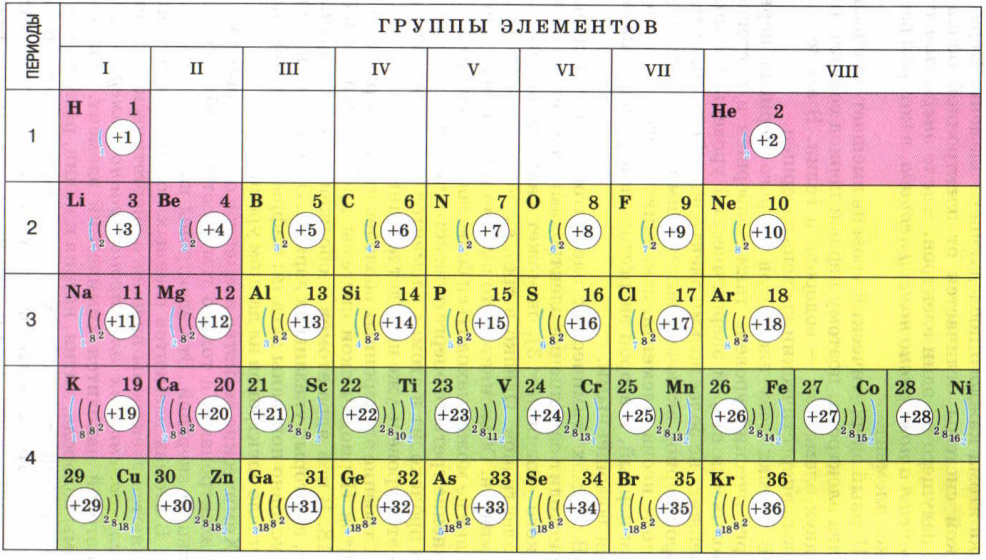 0 International License. См. Рекомендации по использованию содержания сайта.
0 International License. См. Рекомендации по использованию содержания сайта.
Ссылки и дополнительная литература
150 лет назад периодическая таблица Менделеева началась с видения одного химика
У каждой области науки есть любимый юбилей.
Что касается физики, это « Principia » Ньютона 1687 года, книга, которая ввела законы движения и гравитации.Биология отмечает книгу Дарвина О происхождении видов (1859 г.) вместе с его днем рождения (1809 г.). Поклонники астрономии отмечают 1543 год, когда Коперник поместил Солнце в центр Солнечной системы.
Что же касается химии, то нет повода для торжества, превосходящего происхождение периодической таблицы элементов, созданной 150 лет назад в марте этого года русским химиком Дмитрием Ивановичем Менделеевым.
Таблица Менделеева стала так же знакома студентам-химикам, как электронные таблицы для бухгалтеров.Он суммирует всю науку в примерно 100 квадратах, содержащих символы и числа. Он перечисляет элементы, из которых состоят все земные субстанции, расположенные таким образом, чтобы выявить закономерности в их свойствах, что определяет направление химических исследований как в теории, так и на практике.
Он перечисляет элементы, из которых состоят все земные субстанции, расположенные таким образом, чтобы выявить закономерности в их свойствах, что определяет направление химических исследований как в теории, так и на практике.
Подпишитесь на последние новости
Science NewsЗаголовки и резюме последних новостей Science News статей, доставленных на ваш почтовый ящик
«Периодическая таблица Менделеева, – писал химик Питер Аткинс, – возможно, является наиболее важным понятием в химии.”
Таблица Менделеева выглядела как специальная диаграмма, но он хотел, чтобы таблица выражала глубокую научную истину, которую он открыл: периодический закон. Его закон выявил глубокие семейные отношения между известными химическими элементами – они проявляли сходные свойства через равные промежутки времени (или периоды), когда они были расположены в порядке их атомного веса – и позволил Менделееву предсказать существование элементов, которые еще не были обнаружены.
«До обнародования этого закона химические элементы были лишь отрывочными, случайными фактами в Природе», – заявил Менделеев.«Закон периодичности впервые позволил нам воспринимать неоткрытые элементы на расстоянии, которое раньше было недоступно химическому зрению».
ТаблицаМенделеева не только предсказывала появление новых элементов. Это подтвердило тогдашнюю спорную веру в реальность атомов. Он намекнул на существование субатомной структуры и предвосхитил математический аппарат, лежащий в основе правил, управляющих материей, которые в конечном итоге проявились в квантовой теории. Его таблица завершила трансформацию химической науки из средневекового магического мистицизма алхимии в область современной научной строгости.Таблица Менделеева символизирует не только составные части материи, но и логическую убедительность и принципиальную рациональность всей науки.
Закладка фундамента
Легенда гласит, что Менделеев задумал и создал свою таблицу за один день: 17 февраля 1869 года по русскому календарю (1 марта в большей части остального мира). Но это, наверное, преувеличение. Менделеев думал о группировке элементов в течение многих лет, а другие химики несколько раз рассматривали понятие взаимосвязи между элементами в предыдущие десятилетия.
Но это, наверное, преувеличение. Менделеев думал о группировке элементов в течение многих лет, а другие химики несколько раз рассматривали понятие взаимосвязи между элементами в предыдущие десятилетия.
На самом деле, немецкий химик Иоганн Вольфганг Доберейнер заметил особенности в группировке элементов еще в 1817 году. В те дни химики еще не полностью осознали природу атомов, как это описано в атомной теории, предложенной английским школьным учителем Джоном Дальтоном в 1808 году. В своей книге «Новая система химической философии » Дальтон объяснил химические реакции, предположив, что каждое элементарное вещество состоит из определенного типа атома.
Дальтон предположил, что химические реакции дают новые вещества, когда атомы разъединяются или соединяются.Он рассуждал, что любой данный элемент целиком состоит из одного вида атомов, отличающегося от других по весу. Атомы кислорода весили в восемь раз больше, чем атомы водорода; По мнению Дальтона, атомы углерода в шесть раз тяжелее водорода. Когда элементы объединяются, чтобы образовать новые вещества, количество, которое прореагировало, можно рассчитать, зная эти атомные веса.
Когда элементы объединяются, чтобы образовать новые вещества, количество, которое прореагировало, можно рассчитать, зная эти атомные веса.
Далтон ошибался насчет некоторых весов – кислород действительно в 16 раз тяжелее водорода, а углерод в 12 раз тяжелее водорода.Но его теория сделала идею атомов полезной, что привело к революции в химии. Точное измерение атомного веса стало главной заботой химиков в последующие десятилетия.
Размышляя об этих весах, Доберейнер заметил, что определенные наборы из трех элементов (он назвал их триадами) обнаруживают своеобразную взаимосвязь. Бром, например, имел атомный вес посередине между весами хлора и йода, и все три элемента демонстрировали сходное химическое поведение.Литий, натрий и калий тоже были триадой.
Другие химики заметили связь между атомным весом и химическими свойствами, но только в 1860-х годах атомные веса были достаточно хорошо изучены и измерены для более глубокого понимания. В Англии химик Джон Ньюлендс заметил, что расположение известных элементов в порядке возрастания атомного веса приводит к повторению химических свойств каждого восьмого элемента – закономерность, которую он назвал «законом октав» в статье 1865 года. Но паттерн Ньюлендса не очень хорошо держался после первых двух октав, что побудило критика предположить, что ему следует вместо этого попытаться расположить элементы в алфавитном порядке. Очевидно, что соотношение свойств элементов и атомных весов было немного сложнее, как вскоре понял Менделеев.
Но паттерн Ньюлендса не очень хорошо держался после первых двух октав, что побудило критика предположить, что ему следует вместо этого попытаться расположить элементы в алфавитном порядке. Очевидно, что соотношение свойств элементов и атомных весов было немного сложнее, как вскоре понял Менделеев.
Организация элементов
Менделеев родился в 1834 году в Тобольске, в Сибири (17-й ребенок его родителей). Он жил разобщенной жизнью, преследуя множество интересов и путешествуя по запутанному пути к известности.Во время учебы в педагогическом институте в Санкт-Петербурге он чуть не умер от тяжелой болезни. После окончания школы он преподавал в средних школах (требование его стипендии в педагогическом институте) и, преподавая математику и естественные науки, проводил исследования для получения степени магистра.
Затем он работал наставником и лектором (наряду с некоторыми научно-популярными работами на стороне), пока не получил стипендию для длительной поездки по исследованиям в самых известных университетских химических лабораториях Европы.
Когда он вернулся в Санкт-Петербург, у него не было работы, поэтому он написал мастерский справочник по органической химии в надежде выиграть крупный денежный приз. Долгая попытка окупилась: в 1862 году ему была присуждена прибыльная Демидовская премия. Он также нашел работу редактором, переводчиком и консультантом в различных отраслях химической промышленности. В конце концов он вернулся к исследованиям, получив докторскую степень. в 1865 г., а затем стал профессором Петербургского университета.
Вскоре после этого Менделеев начал преподавать неорганическую химию.Готовясь освоить эту новую (для него) область, он не был впечатлен имеющимися учебниками. Поэтому он решил написать свое собственное. Организация текста требовала систематизации элементов, поэтому он думал, как лучше их расположить.
К началу 1869 года Менделеев добился достаточного прогресса, чтобы понять, что некоторые группы подобных элементов показывают регулярное увеличение атомного веса; другие элементы с примерно равным атомным весом обладали общими свойствами. Оказалось, что упорядочение элементов по их атомному весу было ключом к их классификации.
Оказалось, что упорядочение элементов по их атомному весу было ключом к их классификации.
По словам самого Менделеева, он структурировал свое мышление, записав свойства каждого из 63 известных элементов на отдельной карточке. Затем, с помощью своего рода игры в химический пасьянс, он нашел искомый паттерн. Располагая карточки в вертикальных столбцах от меньшего атомного веса к большему, в каждый горизонтальный ряд помещались элементы с одинаковыми свойствами. Так родилась таблица Менделеева. 1 марта он набросал свою таблицу, отправил ее в типографию и включил в свой учебник, который скоро будет издан.Он быстро подготовил доклад для представления в Русское химическое общество.
«Элементы, расположенные в соответствии с размером их атомного веса, демонстрируют явные периодические свойства», – заявил Менделеев в своей статье. «Все сравнения, которые я сделал… привели меня к выводу, что размер атомной массы определяет природу элементов».
Тем временем немецкий химик Лотар Мейер также работал над организацией элементов. Он приготовил стол, похожий на стол Менделеева, возможно, даже раньше Менделеева.Но Менделеев опубликовал первым.
Однако важнее, чем обыграть Мейера в публикации, было то, что Менделеев использовал свою таблицу для смелых прогнозов относительно неоткрытых элементов. Готовя свой стол, Менделеев заметил, что пропало несколько карточек. Ему пришлось оставить пустые места, чтобы известные элементы правильно выровнялись. При его жизни три из этих пробелов были заполнены ранее неизвестными элементами галлием, скандием и германием.
Менделеев не только предсказал существование этих элементов, но и правильно подробно описал их свойства.Галлий, например, открытый в 1875 году, имел атомный вес (измеренный тогда) 69,9 и плотность в шесть раз больше плотности воды. Менделеев предсказал элемент (он назвал его эка-алюминий) именно с такой плотностью и атомным весом 68. Его предсказания для эка-кремния близко соответствовали германию (открытому в 1886 году) по атомному весу (72 предсказано, 72,3 наблюдаемых) и плотности. (5,5 против 5,469). Он также правильно предсказал плотность соединений германия с кислородом и хлором.
Стол Менделеева стал оракулом.Это было так, как если бы плитки Scrabble в конце игры раскрывали секреты вселенной. В то время как другие увидели силу периодического закона, Менделеев был мастером в использовании его.
Успешные предсказания Менделеева принесли ему легендарный статус маэстро химического волшебства. Но сегодня историки спорят, укрепило ли открытие предсказанных элементов принятие его периодического закона. Одобрение закона могло быть больше связано с его способностью объяснять установившиеся химические взаимосвязи.В любом случае точность прогнозов Менделеева, безусловно, привлекла внимание к достоинствам его таблицы.
К 1890-м годам химики широко признали его закон вехой в химических знаниях. В 1900 году будущий лауреат Нобелевской премии по химии Уильям Рамзи назвал это «величайшим обобщением, которое когда-либо было сделано в химии». И Менделеев сделал это, даже не понимая, почему это вообще работает.
Математическая карта
Во многих случаях в истории науки великие предсказания, основанные на новых уравнениях, оказывались верными.Каким-то образом математика открывает некоторые секреты природы до того, как их обнаруживают экспериментаторы. Антивещество – один пример, расширение Вселенной – другой. В случае Менделеева предсказания новых элементов возникали без какой-либо творческой математики. Но на самом деле Менделеев открыл глубокую математическую карту природы, поскольку его таблица отражала последствия квантовой механики, математических правил, управляющих атомной архитектурой.
В своем учебнике Менделеев отмечал, что «внутренние различия вещества, из которого состоят атомы», могут быть ответственны за периодически повторяющиеся свойства элементов.Но он не придерживался этой линии мысли. Фактически, на протяжении многих лет он болтал о том, насколько важна атомная теория для его таблицы.
Но другие могли прочитать сообщение в таблице. В 1888 году немецкий химик Йоханнес Вислиценус заявил, что периодичность свойств элементов при расчете по весу указывает на то, что атомы состоят из регулярного расположения более мелких частиц. Таким образом, в некотором смысле таблица Менделеева действительно предвосхищала (и предоставляла доказательства) сложную внутреннюю структуру атомов в то время, когда никто не имел ни малейшего представления о том, как на самом деле выглядит атом, и даже о том, есть ли у него какая-либо внутренняя структура.
Ко времени смерти Менделеева в 1907 году ученые знали, что у атомов есть части: электроны, несущие отрицательный электрический заряд, плюс некоторый положительно заряженный компонент, делающий атомы электрически нейтральными. Ключ к разгадке того, как были устроены эти части, был получен в 1911 году, когда физик Эрнест Резерфорд, работающий в Манчестерском университете в Англии, открыл атомное ядро. Вскоре после этого Генри Мозли, физик, работавший с Резерфордом, продемонстрировал, что количество положительного заряда в ядре (количество протонов в нем или его «атомный номер») определяет правильный порядок элементов в периодической таблице.
Атомный весбыл тесно связан с атомным номером Мозли – достаточно близко, чтобы упорядочение элементов по весу лишь в нескольких местах отличалось от упорядочения по номеру. Менделеев настаивал на том, что эти веса были неправильными и нуждались в повторном измерении, и в некоторых случаях он был прав. Осталось несколько неточностей, но атомный номер Мозли определил положение вещей.
Примерно в то же время датский физик Нильс Бор понял, что квантовая теория управляет расположением электронов, окружающих ядро, и что самые удаленные электроны определяют химические свойства элемента.
Физик Нильс Бор пересмотрел периодическую таблицу в 1922 году. QWerk / Wikimedia CommonsПодобное расположение внешних электронов периодически повторялось, объясняя закономерности, которые изначально были обнаружены в таблице Менделеева. Бор создал свою собственную версию таблицы в 1922 году, основанную на экспериментальных измерениях энергии электронов (наряду с некоторыми рекомендациями из периодического закона).
В таблицеБора добавлены элементы, открытые с 1869 года, но, по сути, это была периодическая структура, которую обнаружил Менделеев.Не имея ни малейшего ключа к квантовой теории, Менделеев создал таблицу, отражающую атомную архитектуру, продиктованную квантовой физикой.
Новый стол Бора не был ни первым, ни последним вариантом первоначального дизайна Менделеева. Были разработаны и опубликованы сотни версий таблицы Менделеева. Современная форма, горизонтальный дизайн в отличие от первоначальной вертикальной версии Менделеева, стала широко популярной только после Второй мировой войны, во многом благодаря работе американского химика Гленна Сиборга (давнего члена правления Science Service, первоначального издателя книги). Новости науки ).
Сиборг и его сотрудники синтетическим путем получили несколько новых элементов с атомными номерами помимо урана, последнего встречающегося в природе элемента в таблице. Сиборг увидел, что эти элементы, трансурановые элементы (плюс три элемента, предшествующие урану), требуют новой строки в таблице, чего Менделеев не предвидел.



 Лантаноиды и актиниды обладают более сложным химическим составом, в котором, как правило, не наблюдается каких-либо тенденций.Следовательно, благородные газы, лантаноиды и актиниды не имеют значений электроотрицательности.
Лантаноиды и актиниды обладают более сложным химическим составом, в котором, как правило, не наблюдается каких-либо тенденций.Следовательно, благородные газы, лантаноиды и актиниды не имеют значений электроотрицательности.