Атом – это… Что такое Атом?
Атом гелияА́том (от др.-греч. ἄτομος — неделимый) — наименьшая, химически неделимая часть химического элемента, являющаяся носителем его свойств.[1] Атом состоит из атомного ядра и электронов. Ядро атома состоит из положительно заряженных протонов и незаряженных нейтронов, связанных между собой при помощи сильного взаимодействия. Если число протонов в ядре совпадает с числом электронов, то атом в целом оказывается электрически нейтральным. В противном случае он обладает некоторым положительным или отрицательным зарядом и называется ионом. Атомы классифицируются по количеству протонов и нейтронов в ядре: количество протонов определяет принадлежность атома некоторому химическому элементу, а число нейтронов — изотопу этого элемента.
Атомы различного вида в разных количествах, связанные межатомными связями, образуют молекулы.
История становления понятия
Понятие об атоме как о наименьшей неделимой части материи было впервые сформулировано древнеиндийскими и древнегреческими философами (см.
На международном съезде химиков в Карлсруэ (Германия) в 1860 году были приняты определения понятий молекулы и атома. Атом — наименьшая частица химического элемента, входящая в состав простых и сложных веществ.
Модели атомов
- Кусочки материи. Демокрит полагал, что свойства того или иного вещества определяются формой, массой, и пр. характеристиками образующих его атомов. Так, скажем, у огня атомы остры, поэтому огонь способен обжигать, у твёрдых тел они шероховаты, поэтому накрепко сцепляются друг с другом, у воды — гладки, поэтому она способна течь. Даже душа человека, согласно Демокриту, состоит из атомов.
 [2]
[2] - Модель атома Томсона (модель «Пудинг с изюмом»). Дж. Дж. Томсон предложил рассматривать атом как некоторое положительно заряженное тело с заключёнными внутри него электронами. Была окончательно опровергнута Резерфордом после проведённого им знаменитого опыта по рассеиванию альфа-частиц.
- Ранняя планетарная модель атома Нагаоки. В 1904 году японский физик Хантаро Нагаока предложил модель атома, построенную по аналогии с планетой Сатурн. В этой модели вокруг маленького положительного ядра по орбитам вращались электроны, объединённые в кольца. Модель оказалась ошибочной.
- Планетарная модель атома Бора-Резерфорда. В 1911 году[3] Эрнест Резерфорд, проделав ряд экспериментов, пришёл к выводу, что атом представляет собой подобие планетной системы, в которой электроны движутся по орбитам вокруг расположенного в центре атома тяжёлого положительно заряженного ядра («модель атома Резерфорда»). Однако такое описание атома вошло в противоречие с классической электродинамикой.

Квантово-механическая модель атома
Современная модель атома является развитием планетарной модели. Согласно этой модели, ядро атома состоит из положительно заряженных протонов и не имеющих заряда нейтронов и окружено отрицательно заряженными электронами. Однако представления квантовой механики не позволяют считать, что электроны движутся вокруг ядра по сколько-нибудь определённым траекториям (неопределённость координаты электрона в атоме может быть сравнима с размерами самого атома).
Однако представления квантовой механики не позволяют считать, что электроны движутся вокруг ядра по сколько-нибудь определённым траекториям (неопределённость координаты электрона в атоме может быть сравнима с размерами самого атома).
Химические свойства атомов определяются конфигурацией электронной оболочки и описываются квантовой механикой. Положение атома в таблице Менделеева определяется электрическим зарядом его ядра (то есть количеством протонов), в то время как количество нейтронов принципиально не влияет на химические свойства; при этом нейтронов в ядре, как правило, больше, чем протонов (см.: атомное ядро). Если атом находится в нейтральном состоянии, то количество электронов в нём равно количеству протонов. Основная масса атома сосредоточена в ядре, а массовая доля электронов в общей массе атома незначительна (несколько сотых процента массы ядра).
Массу атома принято измерять в атомных единицах массы, равных 1⁄12 от массы атома стабильного изотопа углерода 12C.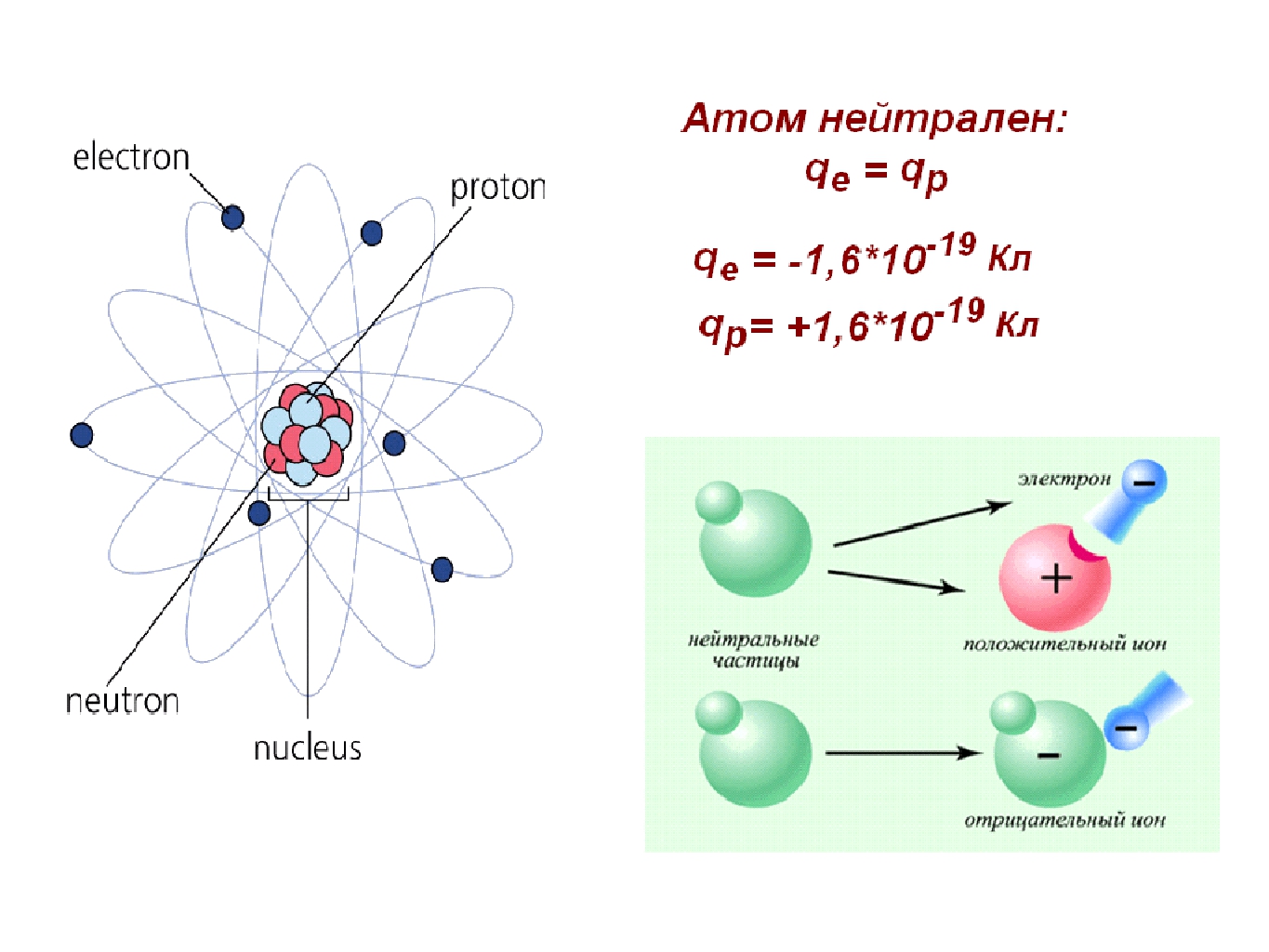
Строение атома
Субатомные частицы
Хотя слово атом в первоначальном значении обозначало частицу, которая не делится на меньшие части, согласно научным представлениям он состоит из более мелких частиц, называемых субатомными частицами. Атом состоит из электронов, протонов, все атомы, кроме водорода-1, содержат также нейтроны.
Электрон является самой лёгкой из составляющих атом частиц с массой 9,11·10−31кг, отрицательным зарядом и размером, слишком малым для измерения современными методами.
При этом масса ядра меньше суммы масс составляющих его протонов и нейтронов из-за эффекта дефекта массы. Нейтроны и протоны имеют сравнимый размер, около 2,5·10−15м, хотя размеры этих частиц определены плохо. [6]
[6]
В стандартной модели элементарных частиц как протоны, так и нейтроны состоят из элементарных частиц, называемых кварками. Наряду с лептонами, кварки являются одной из основных составляющих материи. И первые и вторые являются фермионами. Существует шесть типов кварков, каждый из которых имеет дробный электрический заряд, равный +
Электроны в атоме
При описании электронов в атоме в рамках квантовой механики, обычно рассматривают распределение вероятности в 3n-мерном пространстве для системы n электронов.
Электроны в атоме притягиваются к ядру, между электронами также действует кулоновское взаимодействие.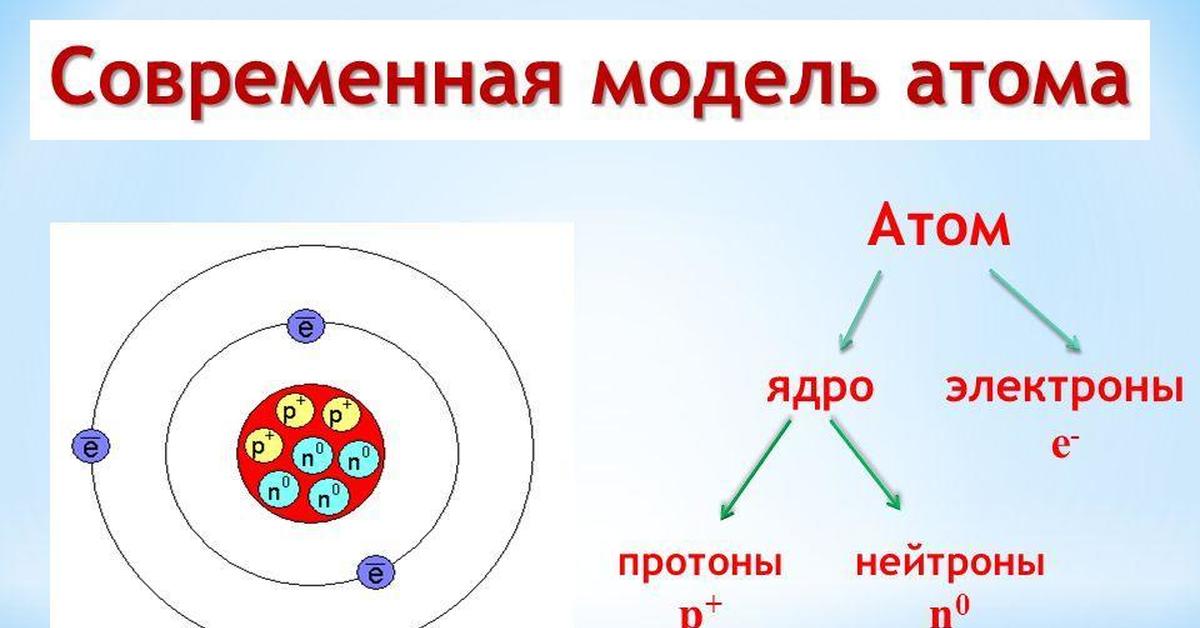 Эти же силы удерживают электроны внутри потенциального барьера, окружающего ядро. Для того, чтобы электрон смог преодолеть притяжение ядра, ему необходимо получить энергию от внешнего источника. Чем ближе электрон находится к ядру, тем больше энергии для этого необходимо.
Эти же силы удерживают электроны внутри потенциального барьера, окружающего ядро. Для того, чтобы электрон смог преодолеть притяжение ядра, ему необходимо получить энергию от внешнего источника. Чем ближе электрон находится к ядру, тем больше энергии для этого необходимо.
Электронам, как и другим частицам, свойственен корпускулярно-волновой дуализм. Иногда говорят, что электрон движется по орбитали, что неверно. Состояние электронов описывается волновой функцией, квадрат модуля которой характеризует плотность вероятности нахождения частиц в данной точке пространства в данный момент времени, или, в общем случае, оператором плотности. Существует дискретный набор атомных орбиталей, которым соответствуют стационарные чистые состояния электронов в атоме.
Каждой орбитали соответствует свой уровень энергии. Электрон может перейти на уровень с большей энергией, поглотив фотон. При этом он окажется в новом квантовом состоянии с большей энергией. Аналогично, он может перейти на уровень с меньшей энергией, излучив фотон. Энергия фотона при этом будет равна разности энергий электрона на этих уровнях (см.: постулаты Бора).
Энергия фотона при этом будет равна разности энергий электрона на этих уровнях (см.: постулаты Бора).
Свойства атома
По определению, любые два атома с одним и тем же числом протонов в их ядрах относятся к одному химическому элементу. Атомы с одним и тем же количеством протонов, но разным количеством нейтронов называют изотопами данного элемента. Например, атомы водорода всегда содержат один протон, но существуют изотопы без нейтронов (водород-1, иногда также называемый протием — наиболее распространённая форма), с одним нейтроном (дейтерий) и двумя нейтронами (тритий).[9] Известные элементы составляют непрерывный натуральный ряд по числу протонов в ядре, начиная с атома водорода с одним протоном и заканчивая атомом унуноктия, в ядре которого 118 протонов.
Масса
Поскольку наибольший вклад в массу атома вносят протоны и нейтроны, суммарное число этих частиц называют массовым числом. Массу покоя атома часто выражают в атомных единицах массы (а. е. м.), которая также называется дальтоном (Да). Эта единица определяется как 1⁄12 часть массы покоя нейтрального атома углерода-12, которая приблизительно равна 1,66·10−24 г.[13]Водород-1 — наилегчайший изотоп водорода и атом с наименьшей массой, имеет атомный вес около 1,007825 а. е. м.[14] Масса атома приблизительно равна произведению массового числа на атомную единицу массы[15] Самый тяжёлый стабильный изотоп — свинец-208[11] с массой 207,9766521 а. е. м.[16]
Массу покоя атома часто выражают в атомных единицах массы (а. е. м.), которая также называется дальтоном (Да). Эта единица определяется как 1⁄12 часть массы покоя нейтрального атома углерода-12, которая приблизительно равна 1,66·10−24 г.[13]Водород-1 — наилегчайший изотоп водорода и атом с наименьшей массой, имеет атомный вес около 1,007825 а. е. м.[14] Масса атома приблизительно равна произведению массового числа на атомную единицу массы[15] Самый тяжёлый стабильный изотоп — свинец-208[11] с массой 207,9766521 а. е. м.[16]
Так как массы даже самых тяжёлых атомов в обычных единицах (например, в граммах) очень малы, то в химии для измерения этих масс используют моли. В одном моле любого вещества по определению содержится одно и то же число атомов (примерно 6,022·1023). Это число (число Авогадро) выбрано таким образом, что если масса элемента равна 1 а. е. м., то моль атомов этого элемента будет иметь массу 1 г. Например, углерод имеет массу 12 а. е. м., поэтому 1 моль углерода весит 12 г.[13]
Например, углерод имеет массу 12 а. е. м., поэтому 1 моль углерода весит 12 г.[13]
Размер
Атомы не имеют отчётливо выраженной внешней границы, поэтому их размеры определяются по расстоянию между ядрами соседних атомов, которые образовали химическую связь (Ковалентный радиус) или по расстоянию до самой дальней из стабильных орбит электронов в электронной оболочке этого атома (Радиус атома). Радиус зависит от положения атома в периодической системе, вида химической связи, числа ближайших атомов (координационного числа) и квантово-механического свойства, известного как спин.[17] В периодической системе элементов размер атома увеличивается при движении сверху вниз по столбцу и уменьшается при движении по строке слева направо.[18] Соответственно, самый маленький атом — это атом гелия, имеющий радиус 32 пм, а самый большой — атом цезия (225 пм).[19] Эти размеры в тысячи раз меньше длины волны видимого света (400—700 нм), поэтому атомы нельзя увидеть в оптический микроскоп. Однако отдельные атомы можно наблюдать с помощью сканирующего туннельного микроскопа.
Однако отдельные атомы можно наблюдать с помощью сканирующего туннельного микроскопа.
Малость атомов демонстрируют следующие примеры. Человеческий волос по толщине в миллион раз больше атома углерода.[20] Одна капля воды содержит 2 секстиллиона (2·1021) атомов кислорода, и в два раза больше атомов водорода.[21] Один карат алмаза с массой 0,2 г состоит из 10 секстиллионов атомов углерода.[22] Если бы яблоко можно было увеличить до размеров Земли, то атомы достигли бы исходных размеров яблока.[23]
Учёные из Харьковского физико-технического института представили первые в истории науки снимки атома. Для получения снимков учёные использовали электронный микроскоп, фиксирующий излучения и поля (field-emission electron microscope, FEEM). Физики последовательно разместили десятки атомов углерода в вакуумной камере и пропустили через них электрический разряд в 425 вольт. Излучение последнего атома в цепочке на фосфорный экран позволило получить изображение облака электронов вокруг ядра. [24]
[24]
Радиоактивный распад
Диаграмма времени полураспада (T½) в секундах для различных изотопов с Z протонами и N нейтронами.У каждого химического элемента есть один или более изотопов с нестабильными ядрами, которые подвержены радиоактивному распаду, в результате чего атомы испускают частицы или электромагнитное излучение. Радиоактивность возникает, когда радиус ядра больше радиуса действия сильных взаимодействий (расстояний порядка 1 фм[25]).
Существуют три основные формы радиоактивного распада[26][27]:
- Альфа-распад происходит, когда ядро испускает альфа-частицу — ядро атома гелия, состоящее из двух протонов и двух нейтронов. В результате испускания этой частицы возникает элемент с меньшим на два атомным номером.
- Бета-распад происходит из-за слабых взаимодействий, и в результате нейтрон превращается в протон или наоборот. В первом случае происходит испускание электрона и антинейтрино, во втором — испускание позитрона и нейтрино.
 Электрон и позитрон называют бета-частицами. Бета-распад увеличивает или уменьшает атомный номер на единицу.
Электрон и позитрон называют бета-частицами. Бета-распад увеличивает или уменьшает атомный номер на единицу. - Гамма-излучение происходит из-за перехода ядра в состояние с более низкой энергией с испусканием электромагнитного излучения. Гамма-излучение может происходить вслед за испусканием альфа- или бета-частицы после радиоактивного распада.
Каждый радиоактивный изотоп характеризуется периодом полураспада, то есть временем, за которое распадается половина ядер образца. Это экспоненциальный распад, который вдвое уменьшает количество оставшихся ядер за каждый период полураспада. Например, по прошествии двух периодов полураспада в образце останется только 25 % ядер исходного изотопа.[25]
Магнитный момент
Элементарные частицы обладают внутренним квантовомеханическим свойством известным как спин. Оно аналогично угловому моменту объекта вращающегося вокруг собственного центра масс, хотя строго говоря, эти частицы являются точечными и нельзя говорить об их вращении. Спин измеряют в единицах приведённой планковской постоянной (), тогда электроны, протоны и нейтроны имеют спин равный ½ . В атоме электроны обращаются вокруг ядра и обладают орбитальным угловым моментом помимо спина, в то время как ядро само по себе имеет угловой момент благодаря ядерному спину.[28]
Спин измеряют в единицах приведённой планковской постоянной (), тогда электроны, протоны и нейтроны имеют спин равный ½ . В атоме электроны обращаются вокруг ядра и обладают орбитальным угловым моментом помимо спина, в то время как ядро само по себе имеет угловой момент благодаря ядерному спину.[28]
Магнитное поле, создаваемое магнитным моментом атома, определяется этими различными формами углового момента, как и в классической физике вращающиеся заряженные объекты создают магнитное поле. Однако, наиболее значительный вклад происходит от спина. Благодаря свойству электрона, как и всех фермионов, подчиняться правилу запрета Паули, по которому два электрона не могут находиться в одном и том же квантовом состоянии, связанные электроны спариваются друг с другом, и один из электронов находится в состоянии со спином вверх, а другой — с противоположной проекцией спина — состояние со спином вниз. Таким образом магнитные моменты электронов сокращаются, уменьшая полный магнитный дипольный момент системы до нуля в некоторых атомах с чётным числом электронов. [29]
[29]
В ферромагнитных элементах, таких как железо, нечётное число электронов приводит к появлению неспаренного электрона и к ненулевому полному магнитному моменту. Орбитали соседних атомов перекрываются, и наименьшее энергетическое состояние достигается, когда все спины неспаренных электронов принимают одну ориентацию, процесс известный как обменное взаимодействие. Когда магнитные моменты ферромагнитных атомов выравниваются, материал может создавать измеримое макроскопическое магнитное поле. Парамагнитные материалы состоят из атомов, магнитные моменты которых разориентированы в отсутствии магнитного поля, но магнитные моменты отдельных атомов выравниваются при приложении магнитного поля.[29][30]
Ядро атома тоже может обладать ненулевым полным спином. Обычно при термодинамическом равновесии спины ядер ориентированы случайным образом. Однако, для некоторых элементов (таких как ксенон-129) возможно поляризовать значительную часть ядерных спинов для создания состояния с сонаправленными спинами —состояния называемого гиперполяризацией. Это состояние имеет важное прикладное значение в магнитно-резонансной томографии.[31][32]
Это состояние имеет важное прикладное значение в магнитно-резонансной томографии.[31][32]
Энергетические уровни
Когда электрон находится в связанном состоянии в атоме, он обладает потенциальной энергией, которая обратно пропорциональна его расстоянию от ядра. Эта энергия обычно измеряется в электронвольтах (эВ) и равна энергии, которую надо передать электрону, чтобы сделать его свободным (оторвать от атома). Согласно квантовомеханической модели атома связанный электрон может занимать только дискретный набор разрешённых энергетических уровней — состояний с определённой энергией. Наинизшее из разрешённых энергетических состояний называется основным, а все остальные — возбуждёнными.[33]
Для перехода электрона с одного энергетического уровня на другой нужно передать ему или отнять у него энергию. Это происходит путём соответственно поглощения или испускания фотона, причём энергия этого фотона равна абсолютной величине разности энергий начального и конечного уровней электрона.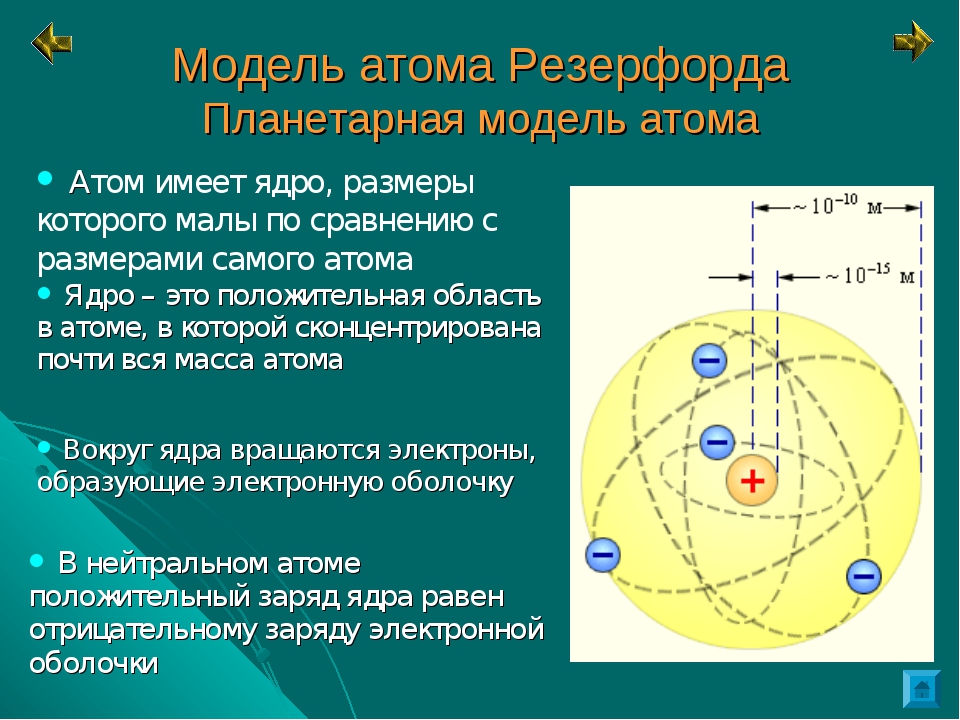 Энергия испущенного фотона пропорциональна его частоте, поэтому переходы между разными энергетическими уровнями проявляются в различных областях электромагнитного спектра.[34] Каждый элемент имеет уникальный спектр испускания, который зависит от заряда ядра, заполнения электронных подоболочек, взаимодействия электронов, а также других факторов.[35]
Энергия испущенного фотона пропорциональна его частоте, поэтому переходы между разными энергетическими уровнями проявляются в различных областях электромагнитного спектра.[34] Каждый элемент имеет уникальный спектр испускания, который зависит от заряда ядра, заполнения электронных подоболочек, взаимодействия электронов, а также других факторов.[35]
Когда излучение с непрерывным спектром проходит через вещество (например, газ или плазму), некоторые фотоны поглощаются атомами или ионами, вызывая электронные переходы между энергетическим состояниями, разность энергий которых равна энергии поглощённого фотона. Затем эти возбуждённые электроны спонтанно переходят на уровень, лежащий ниже по энергии, снова испуская фотоны. Таким образом, вещество ведёт себя как фильтр, превращая исходный непрерывный спектр в спектр поглощения, в котором имеются серии тёмных полос. При наблюдении с тех углов, куда не направлено исходное излучение, можно заметить излучение с эмиссионным спектром, испускаемое атомами. Спектроскопические измерения энергии, амплитуды и ширины спектральных линий излучения позволяют определить вид излучающего вещества и физические условия в нём.[36]
Спектроскопические измерения энергии, амплитуды и ширины спектральных линий излучения позволяют определить вид излучающего вещества и физические условия в нём.[36]
Более детальный анализ спектральных линий показал, что некоторые из них обладают тонкой структурой, то есть расщеплены на несколько близких линий. В узком смысле «тонкой структурой» спектральных линий принято называть их расщепление, происходящее из-за спин-орбитального взаимодействия между спином и вращательным движением электрона.[37]
Взаимодействие магнитных моментов электрона и ядра приводит к сверхтонкому расщеплению спектральных линий, которое, как правило, меньше, чем тонкое.
Если поместить атом во внешнее магнитное поле, то также можно заметить расщепление спектральных линий на две, три и более компонент — это явление называется эффектом Зеемана. Он вызван взаимодействием внешнего магнитного поля с магнитным моментом атома, при этом в зависимости от взаимной ориентации момента атома и магнитного поля энергия данного уровня может увеличиться или уменьшиться. При переходе атома из одного расщеплённого состояния в другое будет излучаться фотон с частотой, отличной от частоты фотона при таком же переходе в отсутствие магнитного поля. Если спектральная линия при помещении атома в магнитное поле расщепляется на три линии, то такой эффект Зеемана называется нормальным (простым). Гораздо чаще в слабом магнитном поле наблюдается аномальный (сложный) эффект Зеемана, когда происходит расщепление на 2, 4 или более линий (аномальный эффект происходит из-за наличия спина у электронов). При увеличении магнитного поля вид расщепления упрощается, и аномальный эффект Зеемана переходит в нормальный (эффект Пашена — Бака).[38] Присутствие электрического поля также может вызвать сравнимый по величине сдвиг спектральных линий, вызванный изменением энергетических уровней. Это явление известно как эффект Штарка.[39]
При переходе атома из одного расщеплённого состояния в другое будет излучаться фотон с частотой, отличной от частоты фотона при таком же переходе в отсутствие магнитного поля. Если спектральная линия при помещении атома в магнитное поле расщепляется на три линии, то такой эффект Зеемана называется нормальным (простым). Гораздо чаще в слабом магнитном поле наблюдается аномальный (сложный) эффект Зеемана, когда происходит расщепление на 2, 4 или более линий (аномальный эффект происходит из-за наличия спина у электронов). При увеличении магнитного поля вид расщепления упрощается, и аномальный эффект Зеемана переходит в нормальный (эффект Пашена — Бака).[38] Присутствие электрического поля также может вызвать сравнимый по величине сдвиг спектральных линий, вызванный изменением энергетических уровней. Это явление известно как эффект Штарка.[39]
Если электрон находится в возбуждённом состоянии, то взаимодействие с фотоном определённой энергии может вызвать вынужденное излучение дополнительного фотона с такой же энергией — для этого должен существовать более низкий уровень, на который возможен переход, и разность энергий уровней должна равняться энергии фотона. При вынужденном излучении эти два фотона будут двигаться в одном направлении и иметь одинаковую фазу. Это свойство используется в лазерах, которые могут испускать когерентный пучок света в узком диапазоне частот.[40]
При вынужденном излучении эти два фотона будут двигаться в одном направлении и иметь одинаковую фазу. Это свойство используется в лазерах, которые могут испускать когерентный пучок света в узком диапазоне частот.[40]
Валентность
Внешняя электронная оболочка атома, если она не полностью заполнена, называется валентной оболочкой, а электроны этой оболочки называются валентными электронами. Число валентных электронов определяет то, как атом связывается с другими атомами посредством химической связи. Путём образования химических связей атомы стремятся заполнить свои внешние валентные оболочки.[41]
Чтобы показать повторяющиеся химические свойства химических элементов, их упорядочивают в виде периодической таблицы. Элементы с одинаковым числом валентных электронов формируют группу, которая изображается в таблице в виде столбца (движение по горизонтальному ряду соответствуют заполнению валентной оболочки электронами). Элементы, находящиеся в самом правом столбце таблицы, имеют полностью заполненную электронами внешнюю оболочку, поэтому они отличаются крайне низкой химической активностью и называются инертными или благородными газами. [42][43]
[42][43]
Дисперсионное притяжение
Важным свойством атома является его склонность к дисперсионному притяжению. Происхождение дисперсионных сил было объяснено в 1930 году Ф. Лондоном. Межатомное взаимодействие возникает вследствие флуктуаций заряда в двух атомах, находящихся близко друг от друга. Поскольку электроны движутся, каждый атом обладает мгновенным дипольным моментом, отличным от нуля. Если бы флуктуации электронной плотности в двух атомах были бы несогласованными, то не было бы результирующего притяжения между атомами. Однако мгновенный диполь на одном атоме наводит противоположно направленный диполь в соседнем атоме. Эти диполи притягиваются друг к другу за счёт возникновения силы притяжения, которая называется дисперсионной силой, или силой Лондона. Энергия такого взаимодействия прямо пропорциональна квадрату электронной поляризуемости атома α и обратно пропорциональна r6, где r — расстояние между двумя атомами.[44]
См.
 также
такжеПримечания
- ↑ Атом — статья из Большой советской энциклопедии
- ↑ Демокрит // Школьная энциклопедия «Руссика». История Древнего мира / А. О. Чубарьян. — М.: Olma Media Group, 2003. — С. 281—282. — 815 с. — ISBN 5-948-49307-5
- ↑ http://www.ido.rudn.ru/nfpk/fizika/mkt/1.html Планетарная модель атома]
- ↑ Demtröder, 2002
- ↑ Woan, 2000
- ↑ MacGregor, 1992
- ↑ The Particle Adventure. Particle Data Group. Lawrence Berkeley Laboratory (2002). Архивировано из первоисточника 21 августа 2011. Проверено 3 января 2009.
- ↑ James Schombert. Elementary Particles. University of Oregon (18 апреля 2006). Архивировано из первоисточника 21 августа 2011. Проверено 3 января 2007.
- ↑ Howard S. Matis. The Isotopes of Hydrogen. Guide to the Nuclear Wall Chart. Lawrence Berkeley National Lab (9 августа 2000). Архивировано из первоисточника 21 августа 2011. Проверено 21 декабря 2007.
- ↑ Rick Weiss. Scientists Announce Creation of Atomic Element, the Heaviest Yet. Washington Post (17 октября 2006). Архивировано из первоисточника 21 августа 2011. Проверено 21 декабря 2007.
- ↑ 1 2 Sills, 2003
- ↑ Belle Dumé. Bismuth breaks half-life record for alpha decay. Physics World (23 апреля 2003). Архивировано из первоисточника 21 августа 2011. Проверено 21 декабря 2007.
- ↑ 1 2 Mills и др. (1993).
- ↑ Chung Chieh. Nuclide Stability. University of Waterloo (22 января 2001). Проверено 4 января 2007.
- ↑ Atomic Weights and Isotopic Compositions for All Elements. National Institute of Standards and Technology. Архивировано из первоисточника 21 августа 2011. Проверено 4 января 2007.
- ↑ G. Audi, A. H. Wapstra, C. Thibault. (2003). «The Ame2003 atomic mass evaluation (II)». Nuclear Physics A729: 337–676. Проверено 2008-02-07.
- ↑ R. D. Shannon. (1976). «Revised effective ionic radii and systematic studies of interatomic distances in halides and chalcogenides». Acta Crystallographica, Section A 32: 751. DOI:10.1107/S0567739476001551. Проверено 2007-01-03.
- ↑ Judy Dong. Diameter of an Atom. The Physics Factbook (1998). Архивировано из первоисточника 21 августа 2011. Проверено 19 ноября 2007.
- ↑ Zumdahl, 2002
- ↑ Small Miracles: Harnessing nanotechnology. Oregon State University (2007).(недоступная ссылка — история) Проверено 7 января 2007.(недоступная ссылка — история) — описывает толщину человеческого волоса как 105 нм и 10 углеродных атомов по толщине как 1 нм.
- ↑ «There are 2 000 000 000 000 000 000 000 (that’s 2 sextillion) atoms of oxygen in one drop of water—and twice as many atoms of hydrogen» // Padilla et al., 2002, p. 32
- ↑ Карат равен 200 миллиграмм. По определению, углерод-12 имеет 12 грамм на моль. Постоянная Авогадро равна 6,02·1023 атомов на моль.
- ↑ Feynman, 1995
- ↑ First Detailed Photos of Atoms. Inside Science News Service (14 сентября 2009).(недоступная ссылка — история) Проверено 16 сентября 2009.(недоступная ссылка — история)
- ↑ 1 2 Radioactivity. Splung.com. Архивировано из первоисточника 21 августа 2011. Проверено 19 декабря 2007.
- ↑ L’Annunziata (2003).
- ↑ Richard B. Firestone. Radioactive Decay Modes. Berkeley Laboratory (22 мая 2000). Архивировано из первоисточника 21 августа 2011. Проверено 7 января 2007.
- ↑ J. P. Hornak. Chapter 3: Spin Physics. The Basics of NMR. Rochester Institute of Technology (2006).(недоступная ссылка — история) Проверено 20 марта 2011.(недоступная ссылка — история)
- ↑ 1 2 Paul A. Schroeder. Magnetic Properties. University of Georgia (22 февраля 2000).(недоступная ссылка — история) Проверено 7 января 2007.(недоступная ссылка — история)
- ↑ Greg Goebel. [4.3] Magnetic Properties of the Atom. Elementary Quantum Physics. In The Public Domain website (1 сентября 2007). Архивировано из первоисточника 21 августа 2011. Проверено 7 января 2007.
- ↑ Lynn Yarris. (весна 1997). «Talking Pictures». Berkeley Lab Research Review. Проверено 2008-01-09.(недоступная ссылка — история)
- ↑ Liang, Haacke, 1999
- ↑ Bart J. Van Zeghbroeck. Energy levels. Shippensburg University (1998). Проверено 23 декабря 2007.
- ↑ Fowles, 1989
- ↑ W. C. Martin, W. L. Wiese. Atomic Spectroscopy: A Compendium of Basic Ideas, Notation, Data, and Formulas. National Institute of Standards and Technology (май 2007). Архивировано из первоисточника 21 августа 2011. Проверено 8 января 2007.
- ↑ Atomic Emission Spectra — Origin of Spectral Lines. Avogadro Web Site. Архивировано из первоисточника 21 августа 2011. Проверено 10 августа 2006.
- ↑ Richard Fitzpatrick. Fine structure. University of Texas at Austin (16 февраля 2007). Архивировано из первоисточника 21 августа 2011. Проверено 14 февраля 2008.
- ↑ Michael Weiss. The Zeeman Effect. University of California-Riverside (2001). Архивировано из первоисточника 21 августа 2011. Проверено 6 февраля 2008.
- ↑ Beyer, 2003
- ↑ Thayer Watkins. Coherence in Stimulated Emission. San José State University. Архивировано из первоисточника 21 августа 2011. Проверено 23 декабря 2007.
- ↑ William Reusch. Virtual Textbook of Organic Chemistry. Michigan State University (16 июля 2007). Архивировано из первоисточника 21 августа 2011. Проверено 11 января 2008.
- ↑ Husted Robert и др. Periodic Table of the Elements. Los Alamos National Laboratory (11 декабря 2003). Архивировано из первоисточника 21 августа 2011. Проверено 11 января 2008.
- ↑ Rudy Baum. It’s Elemental: The Periodic Table. Chemical & Engineering News (2003). Архивировано из первоисточника 21 августа 2011. Проверено 11 января 2008.
- ↑ Даниэльс Ф., Олберти Р. Физическая химия / под ред. К.В.Топчиевой. — М.: Мир, 1978. — С. 453. — 646 с.
Литература
- На английском языке
- Michael F. L’Annunziata. Handbook of Radioactivity Analysis. — 2003. — ISBN 0-12-436603-1
- H. F. Beyer, V. P. Shevelko. Introduction to the Physics of Highly Charged Ions. — CRC Press, 2003. — ISBN 0-75-030481-2
- Gregory R. Choppin, Jan-Olov Liljenzin, Jan Rydberg. Radiochemistry and Nuclear Chemistry. — Elsevier, 2001. — ISBN 0-75-067463-6
- J. Dalton. A New System of Chemical Philosophy, Part 1. — London and Manchester: S. Russell, 1808.
- Wolfgang Demtröder. Atoms, Molecules and Photons: An Introduction to Atomic- Molecular- and Quantum Physics. — 1st ed. — Springer, 2002. — ISBN 3-540-20631-0
- Richard Feynman. Six Easy Pieces. — The Penguin Group, 1995. — ISBN 978-0-140-27666-4
- Grant R. Fowles. Introduction to Modern Optics. — Courier Dover Publications, 1989. — ISBN 0-48-665957-7
- Mrinalkanti Gangopadhyaya. Indian Atomism: History and Sources. — Atlantic Highlands, New Jersey: Humanities Press, 1981. — ISBN 0-391-02177-X
- David L. Goodstein. States of Matter. — Courier Dover Publications, 2002. — ISBN 0-48-649506-X
- Edward Robert Harrison. Masks of the Universe: Changing Ideas on the Nature of the Cosmos. — Cambridge University Press, 2003. — ISBN 0-52-177351-2
- Tatjana Jevremovic. Nuclear Principles in Engineering. — Springer, 2005. — ISBN 0-38-723284-2
- James Lequeux. The Interstellar Medium. — Springer, 2005. — ISBN 3-540-21326-0
- Z.-P. Liang, E. M. Haacke. Encyclopedia of Electrical and Electronics Engineering: Magnetic Resonance Imaging / J. G. Webster. — John Wiley & Sons, 1999. — Т. 2. — P. 412—26. — ISBN 0-47-113946-7
- Malcolm H. MacGregor. The Enigmatic Electron. — Oxford University Press, 1992. — ISBN 0-19-521833-7
- Oliver Manuel. Origin of Elements in the Solar System: Implications of Post-1957 Observations. — Springer, 2001. — ISBN 0-30-646562-0
- Robert M. Mazo. Brownian Motion: Fluctuations, Dynamics, and Applications. — Oxford University Press, 2002. — ISBN 0-19-851567-7
- Ian Mills, Tomislav Cvitaš, Klaus Homann, Nikola Kallay, Kozo Kuchitsu. Quantities, Units and Symbols in Physical Chemistry. — 2nd ed. — Oxford: International Union of Pure and Applied Chemistry, Commission on Physiochemical Symbols Terminology and Units, Blackwell Scientific Publications, 1993. — ISBN 0-632-03583-8
- Richard Myers. The Basics of Chemistry. — Greenwood Press, 2003. — ISBN 0-31-331664-3
- Michael J. Padilla, Ioannis Miaoulis, Martha Cyr. Prentice Hall Science Explorer: Chemical Building Blocks. — Upper Saddle River, New Jersey USA: Prentice-Hall, 2002. — ISBN 0-13-054091-9
- Linus Pauling. The Nature of the Chemical Bond. — Cornell University Press, 1960. — ISBN 0-80-140333-2
- Jeremy I. Pfeffer, Shlomo Nir. Modern Physics: An Introductory Text. — Imperial College Press, 2000. — ISBN 1-860-94250-4
- Leonid Ivanovich Ponomarev. The Quantum Dice. — CRC Press, 1993. — ISBN 0-75-030251-8
- J. Kenneth Shultis, Richard E. Faw. Fundamentals of Nuclear Science and Engineering. — CRC Press, 2002. — ISBN 0-82-470834-2
- Robert Siegfried. From Elements to Atoms: A History of Chemical Composition. — DIANE, 2002. — ISBN 0-87-169924-9
- Alan D. Sills. Earth Science the Easy Way. — Barron’s Educational Series, 2003. — ISBN 0-76-412146-4
- Boris M. Smirnov. Physics of Atoms and Ions. — Springer, 2003. — ISBN 0-38-795550-X
- Dick Teresi. Lost Discoveries: The Ancient Roots of Modern Science. — Simon & Schuster, 2003. — P. 213—214. — ISBN 0-74-324379-X
- Graham Woan. The Cambridge Handbook of Physics. — Cambridge University Press, 2000. — ISBN 0-52-157507-9
- Charles Adolphe Wurtz. The Atomic Theory. — New York: D. Appleton and company, 1881.
- Marco Zaider, Harald H. Rossi. Radiation Science for Physicians and Public Health Workers. — Springer, 2001. — ISBN 0-30-646403-9
- Steven S. Zumdahl. Introductory Chemistry: A Foundation. — 5th ed. — Houghton Mifflin, 2002. — ISBN 0-618-34342-3
Ссылки
Атом – это… Что такое Атом?
Атом гелияА́том (от др.-греч. ἄτομος — неделимый) — наименьшая, химически неделимая часть химического элемента, являющаяся носителем его свойств.[1] Атом состоит из атомного ядра и электронов. Ядро атома состоит из положительно заряженных протонов и незаряженных нейтронов, связанных между собой при помощи сильного взаимодействия. Если число протонов в ядре совпадает с числом электронов, то атом в целом оказывается электрически нейтральным. В противном случае он обладает некоторым положительным или отрицательным зарядом и называется ионом. Атомы классифицируются по количеству протонов и нейтронов в ядре: количество протонов определяет принадлежность атома некоторому химическому элементу, а число нейтронов — изотопу этого элемента.
Атомы различного вида в разных количествах, связанные межатомными связями, образуют молекулы.
История становления понятия
Понятие об атоме как о наименьшей неделимой части материи было впервые сформулировано древнеиндийскими и древнегреческими философами (см.: атомизм). В XVII и XVIII веках химикам удалось экспериментально подтвердить эту идею, показав, что некоторые вещества не могут быть подвергнуты дальнейшему расщеплению на составляющие элементы с помощью химических методов. Однако в конце XIX — начале XX века физиками были открыты субатомные частицы и составная структура атома, и стало ясно, что атом в действительности не является неделимым.
На международном съезде химиков в Карлсруэ (Германия) в 1860 году были приняты определения понятий молекулы и атома. Атом — наименьшая частица химического элемента, входящая в состав простых и сложных веществ.
Модели атомов
- Кусочки материи. Демокрит полагал, что свойства того или иного вещества определяются формой, массой, и пр. характеристиками образующих его атомов. Так, скажем, у огня атомы остры, поэтому огонь способен обжигать, у твёрдых тел они шероховаты, поэтому накрепко сцепляются друг с другом, у воды — гладки, поэтому она способна течь. Даже душа человека, согласно Демокриту, состоит из атомов.[2]
- Модель атома Томсона (модель «Пудинг с изюмом»). Дж. Дж. Томсон предложил рассматривать атом как некоторое положительно заряженное тело с заключёнными внутри него электронами. Была окончательно опровергнута Резерфордом после проведённого им знаменитого опыта по рассеиванию альфа-частиц.
- Ранняя планетарная модель атома Нагаоки. В 1904 году японский физик Хантаро Нагаока предложил модель атома, построенную по аналогии с планетой Сатурн. В этой модели вокруг маленького положительного ядра по орбитам вращались электроны, объединённые в кольца. Модель оказалась ошибочной.
- Планетарная модель атома Бора-Резерфорда. В 1911 году[3] Эрнест Резерфорд, проделав ряд экспериментов, пришёл к выводу, что атом представляет собой подобие планетной системы, в которой электроны движутся по орбитам вокруг расположенного в центре атома тяжёлого положительно заряженного ядра («модель атома Резерфорда»). Однако такое описание атома вошло в противоречие с классической электродинамикой. Дело в том, что, согласно классической электродинамике, электрон при движении с центростремительным ускорением должен излучать электромагнитные волны, а, следовательно, терять энергию. Расчёты показывали, что время, за которое электрон в таком атоме упадёт на ядро, совершенно ничтожно. Для объяснения стабильности атомов Нильсу Бору пришлось ввести постулаты, которые сводились к тому, что электрон в атоме, находясь в некоторых специальных энергетических состояниях, не излучает энергию («модель атома Бора-Резерфорда»). Постулаты Бора показали, что для описания атома классическая механика неприменима. Дальнейшее изучение излучения атома привело к созданию квантовой механики, которая позволила объяснить подавляющее большинство наблюдаемых фактов.
Квантово-механическая модель атома
Современная модель атома является развитием планетарной модели. Согласно этой модели, ядро атома состоит из положительно заряженных протонов и не имеющих заряда нейтронов и окружено отрицательно заряженными электронами. Однако представления квантовой механики не позволяют считать, что электроны движутся вокруг ядра по сколько-нибудь определённым траекториям (неопределённость координаты электрона в атоме может быть сравнима с размерами самого атома).
Химические свойства атомов определяются конфигурацией электронной оболочки и описываются квантовой механикой. Положение атома в таблице Менделеева определяется электрическим зарядом его ядра (то есть количеством протонов), в то время как количество нейтронов принципиально не влияет на химические свойства; при этом нейтронов в ядре, как правило, больше, чем протонов (см.: атомное ядро). Если атом находится в нейтральном состоянии, то количество электронов в нём равно количеству протонов. Основная масса атома сосредоточена в ядре, а массовая доля электронов в общей массе атома незначительна (несколько сотых процента массы ядра).
Массу атома принято измерять в атомных единицах массы, равных 1⁄12 от массы атома стабильного изотопа углерода 12C.
Строение атома
Субатомные частицы
Хотя слово атом в первоначальном значении обозначало частицу, которая не делится на меньшие части, согласно научным представлениям он состоит из более мелких частиц, называемых субатомными частицами. Атом состоит из электронов, протонов, все атомы, кроме водорода-1, содержат также нейтроны.
Электрон является самой лёгкой из составляющих атом частиц с массой 9,11·10−31кг, отрицательным зарядом и размером, слишком малым для измерения современными методами.[4] Протоны обладают положительным зарядом и в 1836 раз тяжелее электрона (1,6726·10−27 кг). Нейтроны не обладают электрическим зарядом и в 1839 раз тяжелее электрона (1,6929·10−27 кг).[5]
При этом масса ядра меньше суммы масс составляющих его протонов и нейтронов из-за эффекта дефекта массы. Нейтроны и протоны имеют сравнимый размер, около 2,5·10−15м, хотя размеры этих частиц определены плохо.[6]
В стандартной модели элементарных частиц как протоны, так и нейтроны состоят из элементарных частиц, называемых кварками. Наряду с лептонами, кварки являются одной из основных составляющих материи. И первые и вторые являются фермионами. Существует шесть типов кварков, каждый из которых имеет дробный электрический заряд, равный +2⁄3 или −1⁄3 элементарного. Протоны состоят из двух u-кварков и одного d-кварка, а нейтрон — из одного u-кварка и двух d-кварков. Это различие объясняет разницу в массах и зарядах протона и нейтрона. Кварки связаны между собой сильными ядерными взаимодействиями, которые передаются глюонами.[7][8]
Электроны в атоме
При описании электронов в атоме в рамках квантовой механики, обычно рассматривают распределение вероятности в 3n-мерном пространстве для системы n электронов.
Электроны в атоме притягиваются к ядру, между электронами также действует кулоновское взаимодействие. Эти же силы удерживают электроны внутри потенциального барьера, окружающего ядро. Для того, чтобы электрон смог преодолеть притяжение ядра, ему необходимо получить энергию от внешнего источника. Чем ближе электрон находится к ядру, тем больше энергии для этого необходимо.
Электронам, как и другим частицам, свойственен корпускулярно-волновой дуализм. Иногда говорят, что электрон движется по орбитали, что неверно. Состояние электронов описывается волновой функцией, квадрат модуля которой характеризует плотность вероятности нахождения частиц в данной точке пространства в данный момент времени, или, в общем случае, оператором плотности. Существует дискретный набор атомных орбиталей, которым соответствуют стационарные чистые состояния электронов в атоме.
Каждой орбитали соответствует свой уровень энергии. Электрон может перейти на уровень с большей энергией, поглотив фотон. При этом он окажется в новом квантовом состоянии с большей энергией. Аналогично, он может перейти на уровень с меньшей энергией, излучив фотон. Энергия фотона при этом будет равна разности энергий электрона на этих уровнях (см.: постулаты Бора).
Свойства атома
По определению, любые два атома с одним и тем же числом протонов в их ядрах относятся к одному химическому элементу. Атомы с одним и тем же количеством протонов, но разным количеством нейтронов называют изотопами данного элемента. Например, атомы водорода всегда содержат один протон, но существуют изотопы без нейтронов (водород-1, иногда также называемый протием — наиболее распространённая форма), с одним нейтроном (дейтерий) и двумя нейтронами (тритий).[9] Известные элементы составляют непрерывный натуральный ряд по числу протонов в ядре, начиная с атома водорода с одним протоном и заканчивая атомом унуноктия, в ядре которого 118 протонов.[10] Все изотопы элементов периодической системы, начиная с номера 83 (висмут), радиоактивны.[11][12]
Масса
Поскольку наибольший вклад в массу атома вносят протоны и нейтроны, суммарное число этих частиц называют массовым числом. Массу покоя атома часто выражают в атомных единицах массы (а. е. м.), которая также называется дальтоном (Да). Эта единица определяется как 1⁄12 часть массы покоя нейтрального атома углерода-12, которая приблизительно равна 1,66·10−24 г.[13]Водород-1 — наилегчайший изотоп водорода и атом с наименьшей массой, имеет атомный вес около 1,007825 а. е. м.[14] Масса атома приблизительно равна произведению массового числа на атомную единицу массы[15] Самый тяжёлый стабильный изотоп — свинец-208[11] с массой 207,9766521 а. е. м.[16]
Так как массы даже самых тяжёлых атомов в обычных единицах (например, в граммах) очень малы, то в химии для измерения этих масс используют моли. В одном моле любого вещества по определению содержится одно и то же число атомов (примерно 6,022·1023). Это число (число Авогадро) выбрано таким образом, что если масса элемента равна 1 а. е. м., то моль атомов этого элемента будет иметь массу 1 г. Например, углерод имеет массу 12 а. е. м., поэтому 1 моль углерода весит 12 г.[13]
Размер
Атомы не имеют отчётливо выраженной внешней границы, поэтому их размеры определяются по расстоянию между ядрами соседних атомов, которые образовали химическую связь (Ковалентный радиус) или по расстоянию до самой дальней из стабильных орбит электронов в электронной оболочке этого атома (Радиус атома). Радиус зависит от положения атома в периодической системе, вида химической связи, числа ближайших атомов (координационного числа) и квантово-механического свойства, известного как спин.[17] В периодической системе элементов размер атома увеличивается при движении сверху вниз по столбцу и уменьшается при движении по строке слева направо.[18] Соответственно, самый маленький атом — это атом гелия, имеющий радиус 32 пм, а самый большой — атом цезия (225 пм).[19] Эти размеры в тысячи раз меньше длины волны видимого света (400—700 нм), поэтому атомы нельзя увидеть в оптический микроскоп. Однако отдельные атомы можно наблюдать с помощью сканирующего туннельного микроскопа.
Малость атомов демонстрируют следующие примеры. Человеческий волос по толщине в миллион раз больше атома углерода.[20] Одна капля воды содержит 2 секстиллиона (2·1021) атомов кислорода, и в два раза больше атомов водорода.[21] Один карат алмаза с массой 0,2 г состоит из 10 секстиллионов атомов углерода.[22] Если бы яблоко можно было увеличить до размеров Земли, то атомы достигли бы исходных размеров яблока.[23]
Учёные из Харьковского физико-технического института представили первые в истории науки снимки атома. Для получения снимков учёные использовали электронный микроскоп, фиксирующий излучения и поля (field-emission electron microscope, FEEM). Физики последовательно разместили десятки атомов углерода в вакуумной камере и пропустили через них электрический разряд в 425 вольт. Излучение последнего атома в цепочке на фосфорный экран позволило получить изображение облака электронов вокруг ядра.[24]
Радиоактивный распад
Диаграмма времени полураспада (T½) в секундах для различных изотопов с Z протонами и N нейтронами.У каждого химического элемента есть один или более изотопов с нестабильными ядрами, которые подвержены радиоактивному распаду, в результате чего атомы испускают частицы или электромагнитное излучение. Радиоактивность возникает, когда радиус ядра больше радиуса действия сильных взаимодействий (расстояний порядка 1 фм[25]).
Существуют три основные формы радиоактивного распада[26][27]:
- Альфа-распад происходит, когда ядро испускает альфа-частицу — ядро атома гелия, состоящее из двух протонов и двух нейтронов. В результате испускания этой частицы возникает элемент с меньшим на два атомным номером.
- Бета-распад происходит из-за слабых взаимодействий, и в результате нейтрон превращается в протон или наоборот. В первом случае происходит испускание электрона и антинейтрино, во втором — испускание позитрона и нейтрино. Электрон и позитрон называют бета-частицами. Бета-распад увеличивает или уменьшает атомный номер на единицу.
- Гамма-излучение происходит из-за перехода ядра в состояние с более низкой энергией с испусканием электромагнитного излучения. Гамма-излучение может происходить вслед за испусканием альфа- или бета-частицы после радиоактивного распада.
Каждый радиоактивный изотоп характеризуется периодом полураспада, то есть временем, за которое распадается половина ядер образца. Это экспоненциальный распад, который вдвое уменьшает количество оставшихся ядер за каждый период полураспада. Например, по прошествии двух периодов полураспада в образце останется только 25 % ядер исходного изотопа.[25]
Магнитный момент
Элементарные частицы обладают внутренним квантовомеханическим свойством известным как спин. Оно аналогично угловому моменту объекта вращающегося вокруг собственного центра масс, хотя строго говоря, эти частицы являются точечными и нельзя говорить об их вращении. Спин измеряют в единицах приведённой планковской постоянной (), тогда электроны, протоны и нейтроны имеют спин равный ½ . В атоме электроны обращаются вокруг ядра и обладают орбитальным угловым моментом помимо спина, в то время как ядро само по себе имеет угловой момент благодаря ядерному спину.[28]
Магнитное поле, создаваемое магнитным моментом атома, определяется этими различными формами углового момента, как и в классической физике вращающиеся заряженные объекты создают магнитное поле. Однако, наиболее значительный вклад происходит от спина. Благодаря свойству электрона, как и всех фермионов, подчиняться правилу запрета Паули, по которому два электрона не могут находиться в одном и том же квантовом состоянии, связанные электроны спариваются друг с другом, и один из электронов находится в состоянии со спином вверх, а другой — с противоположной проекцией спина — состояние со спином вниз. Таким образом магнитные моменты электронов сокращаются, уменьшая полный магнитный дипольный момент системы до нуля в некоторых атомах с чётным числом электронов.[29]
В ферромагнитных элементах, таких как железо, нечётное число электронов приводит к появлению неспаренного электрона и к ненулевому полному магнитному моменту. Орбитали соседних атомов перекрываются, и наименьшее энергетическое состояние достигается, когда все спины неспаренных электронов принимают одну ориентацию, процесс известный как обменное взаимодействие. Когда магнитные моменты ферромагнитных атомов выравниваются, материал может создавать измеримое макроскопическое магнитное поле. Парамагнитные материалы состоят из атомов, магнитные моменты которых разориентированы в отсутствии магнитного поля, но магнитные моменты отдельных атомов выравниваются при приложении магнитного поля.[29][30]
Ядро атома тоже может обладать ненулевым полным спином. Обычно при термодинамическом равновесии спины ядер ориентированы случайным образом. Однако, для некоторых элементов (таких как ксенон-129) возможно поляризовать значительную часть ядерных спинов для создания состояния с сонаправленными спинами —состояния называемого гиперполяризацией. Это состояние имеет важное прикладное значение в магнитно-резонансной томографии.[31][32]
Энергетические уровни
Когда электрон находится в связанном состоянии в атоме, он обладает потенциальной энергией, которая обратно пропорциональна его расстоянию от ядра. Эта энергия обычно измеряется в электронвольтах (эВ) и равна энергии, которую надо передать электрону, чтобы сделать его свободным (оторвать от атома). Согласно квантовомеханической модели атома связанный электрон может занимать только дискретный набор разрешённых энергетических уровней — состояний с определённой энергией. Наинизшее из разрешённых энергетических состояний называется основным, а все остальные — возбуждёнными.[33]
Для перехода электрона с одного энергетического уровня на другой нужно передать ему или отнять у него энергию. Это происходит путём соответственно поглощения или испускания фотона, причём энергия этого фотона равна абсолютной величине разности энергий начального и конечного уровней электрона. Энергия испущенного фотона пропорциональна его частоте, поэтому переходы между разными энергетическими уровнями проявляются в различных областях электромагнитного спектра.[34] Каждый элемент имеет уникальный спектр испускания, который зависит от заряда ядра, заполнения электронных подоболочек, взаимодействия электронов, а также других факторов.[35]
Пример линейного спектра поглощенияКогда излучение с непрерывным спектром проходит через вещество (например, газ или плазму), некоторые фотоны поглощаются атомами или ионами, вызывая электронные переходы между энергетическим состояниями, разность энергий которых равна энергии поглощённого фотона. Затем эти возбуждённые электроны спонтанно переходят на уровень, лежащий ниже по энергии, снова испуская фотоны. Таким образом, вещество ведёт себя как фильтр, превращая исходный непрерывный спектр в спектр поглощения, в котором имеются серии тёмных полос. При наблюдении с тех углов, куда не направлено исходное излучение, можно заметить излучение с эмиссионным спектром, испускаемое атомами. Спектроскопические измерения энергии, амплитуды и ширины спектральных линий излучения позволяют определить вид излучающего вещества и физические условия в нём.[36]
Более детальный анализ спектральных линий показал, что некоторые из них обладают тонкой структурой, то есть расщеплены на несколько близких линий. В узком смысле «тонкой структурой» спектральных линий принято называть их расщепление, происходящее из-за спин-орбитального взаимодействия между спином и вращательным движением электрона.[37]
Взаимодействие магнитных моментов электрона и ядра приводит к сверхтонкому расщеплению спектральных линий, которое, как правило, меньше, чем тонкое.
Если поместить атом во внешнее магнитное поле, то также можно заметить расщепление спектральных линий на две, три и более компонент — это явление называется эффектом Зеемана. Он вызван взаимодействием внешнего магнитного поля с магнитным моментом атома, при этом в зависимости от взаимной ориентации момента атома и магнитного поля энергия данного уровня может увеличиться или уменьшиться. При переходе атома из одного расщеплённого состояния в другое будет излучаться фотон с частотой, отличной от частоты фотона при таком же переходе в отсутствие магнитного поля. Если спектральная линия при помещении атома в магнитное поле расщепляется на три линии, то такой эффект Зеемана называется нормальным (простым). Гораздо чаще в слабом магнитном поле наблюдается аномальный (сложный) эффект Зеемана, когда происходит расщепление на 2, 4 или более линий (аномальный эффект происходит из-за наличия спина у электронов). При увеличении магнитного поля вид расщепления упрощается, и аномальный эффект Зеемана переходит в нормальный (эффект Пашена — Бака).[38] Присутствие электрического поля также может вызвать сравнимый по величине сдвиг спектральных линий, вызванный изменением энергетических уровней. Это явление известно как эффект Штарка.[39]
Если электрон находится в возбуждённом состоянии, то взаимодействие с фотоном определённой энергии может вызвать вынужденное излучение дополнительного фотона с такой же энергией — для этого должен существовать более низкий уровень, на который возможен переход, и разность энергий уровней должна равняться энергии фотона. При вынужденном излучении эти два фотона будут двигаться в одном направлении и иметь одинаковую фазу. Это свойство используется в лазерах, которые могут испускать когерентный пучок света в узком диапазоне частот.[40]
Валентность
Внешняя электронная оболочка атома, если она не полностью заполнена, называется валентной оболочкой, а электроны этой оболочки называются валентными электронами. Число валентных электронов определяет то, как атом связывается с другими атомами посредством химической связи. Путём образования химических связей атомы стремятся заполнить свои внешние валентные оболочки.[41]
Чтобы показать повторяющиеся химические свойства химических элементов, их упорядочивают в виде периодической таблицы. Элементы с одинаковым числом валентных электронов формируют группу, которая изображается в таблице в виде столбца (движение по горизонтальному ряду соответствуют заполнению валентной оболочки электронами). Элементы, находящиеся в самом правом столбце таблицы, имеют полностью заполненную электронами внешнюю оболочку, поэтому они отличаются крайне низкой химической активностью и называются инертными или благородными газами.[42][43]
Дисперсионное притяжение
Важным свойством атома является его склонность к дисперсионному притяжению. Происхождение дисперсионных сил было объяснено в 1930 году Ф. Лондоном. Межатомное взаимодействие возникает вследствие флуктуаций заряда в двух атомах, находящихся близко друг от друга. Поскольку электроны движутся, каждый атом обладает мгновенным дипольным моментом, отличным от нуля. Если бы флуктуации электронной плотности в двух атомах были бы несогласованными, то не было бы результирующего притяжения между атомами. Однако мгновенный диполь на одном атоме наводит противоположно направленный диполь в соседнем атоме. Эти диполи притягиваются друг к другу за счёт возникновения силы притяжения, которая называется дисперсионной силой, или силой Лондона. Энергия такого взаимодействия прямо пропорциональна квадрату электронной поляризуемости атома α и обратно пропорциональна r6, где r — расстояние между двумя атомами.[44]
См. также
Примечания
- ↑ Атом — статья из Большой советской энциклопедии
- ↑ Демокрит // Школьная энциклопедия «Руссика». История Древнего мира / А. О. Чубарьян. — М.: Olma Media Group, 2003. — С. 281—282. — 815 с. — ISBN 5-948-49307-5
- ↑ http://www.ido.rudn.ru/nfpk/fizika/mkt/1.html Планетарная модель атома]
- ↑ Demtröder, 2002
- ↑ Woan, 2000
- ↑ MacGregor, 1992
- ↑ The Particle Adventure. Particle Data Group. Lawrence Berkeley Laboratory (2002). Архивировано из первоисточника 21 августа 2011. Проверено 3 января 2009.
- ↑ James Schombert. Elementary Particles. University of Oregon (18 апреля 2006). Архивировано из первоисточника 21 августа 2011. Проверено 3 января 2007.
- ↑ Howard S. Matis. The Isotopes of Hydrogen. Guide to the Nuclear Wall Chart. Lawrence Berkeley National Lab (9 августа 2000). Архивировано из первоисточника 21 августа 2011. Проверено 21 декабря 2007.
- ↑ Rick Weiss. Scientists Announce Creation of Atomic Element, the Heaviest Yet. Washington Post (17 октября 2006). Архивировано из первоисточника 21 августа 2011. Проверено 21 декабря 2007.
- ↑ 1 2 Sills, 2003
- ↑ Belle Dumé. Bismuth breaks half-life record for alpha decay. Physics World (23 апреля 2003). Архивировано из первоисточника 21 августа 2011. Проверено 21 декабря 2007.
- ↑ 1 2 Mills и др. (1993).
- ↑ Chung Chieh. Nuclide Stability. University of Waterloo (22 января 2001). Проверено 4 января 2007.
- ↑ Atomic Weights and Isotopic Compositions for All Elements. National Institute of Standards and Technology. Архивировано из первоисточника 21 августа 2011. Проверено 4 января 2007.
- ↑ G. Audi, A. H. Wapstra, C. Thibault. (2003). «The Ame2003 atomic mass evaluation (II)». Nuclear Physics A729: 337–676. Проверено 2008-02-07.
- ↑ R. D. Shannon. (1976). «Revised effective ionic radii and systematic studies of interatomic distances in halides and chalcogenides». Acta Crystallographica, Section A 32: 751. DOI:10.1107/S0567739476001551. Проверено 2007-01-03.
- ↑ Judy Dong. Diameter of an Atom. The Physics Factbook (1998). Архивировано из первоисточника 21 августа 2011. Проверено 19 ноября 2007.
- ↑ Zumdahl, 2002
- ↑ Small Miracles: Harnessing nanotechnology. Oregon State University (2007).(недоступная ссылка — история) Проверено 7 января 2007.(недоступная ссылка — история) — описывает толщину человеческого волоса как 105 нм и 10 углеродных атомов по толщине как 1 нм.
- ↑ «There are 2 000 000 000 000 000 000 000 (that’s 2 sextillion) atoms of oxygen in one drop of water—and twice as many atoms of hydrogen» // Padilla et al., 2002, p. 32
- ↑ Карат равен 200 миллиграмм. По определению, углерод-12 имеет 12 грамм на моль. Постоянная Авогадро равна 6,02·1023 атомов на моль.
- ↑ Feynman, 1995
- ↑ First Detailed Photos of Atoms. Inside Science News Service (14 сентября 2009).(недоступная ссылка — история) Проверено 16 сентября 2009.(недоступная ссылка — история)
- ↑ 1 2 Radioactivity. Splung.com. Архивировано из первоисточника 21 августа 2011. Проверено 19 декабря 2007.
- ↑ L’Annunziata (2003).
- ↑ Richard B. Firestone. Radioactive Decay Modes. Berkeley Laboratory (22 мая 2000). Архивировано из первоисточника 21 августа 2011. Проверено 7 января 2007.
- ↑ J. P. Hornak. Chapter 3: Spin Physics. The Basics of NMR. Rochester Institute of Technology (2006).(недоступная ссылка — история) Проверено 20 марта 2011.(недоступная ссылка — история)
- ↑ 1 2 Paul A. Schroeder. Magnetic Properties. University of Georgia (22 февраля 2000).(недоступная ссылка — история) Проверено 7 января 2007.(недоступная ссылка — история)
- ↑ Greg Goebel. [4.3] Magnetic Properties of the Atom. Elementary Quantum Physics. In The Public Domain website (1 сентября 2007). Архивировано из первоисточника 21 августа 2011. Проверено 7 января 2007.
- ↑ Lynn Yarris. (весна 1997). «Talking Pictures». Berkeley Lab Research Review. Проверено 2008-01-09.(недоступная ссылка — история)
- ↑ Liang, Haacke, 1999
- ↑ Bart J. Van Zeghbroeck. Energy levels. Shippensburg University (1998). Проверено 23 декабря 2007.
- ↑ Fowles, 1989
- ↑ W. C. Martin, W. L. Wiese. Atomic Spectroscopy: A Compendium of Basic Ideas, Notation, Data, and Formulas. National Institute of Standards and Technology (май 2007). Архивировано из первоисточника 21 августа 2011. Проверено 8 января 2007.
- ↑ Atomic Emission Spectra — Origin of Spectral Lines. Avogadro Web Site. Архивировано из первоисточника 21 августа 2011. Проверено 10 августа 2006.
- ↑ Richard Fitzpatrick. Fine structure. University of Texas at Austin (16 февраля 2007). Архивировано из первоисточника 21 августа 2011. Проверено 14 февраля 2008.
- ↑ Michael Weiss. The Zeeman Effect. University of California-Riverside (2001). Архивировано из первоисточника 21 августа 2011. Проверено 6 февраля 2008.
- ↑ Beyer, 2003
- ↑ Thayer Watkins. Coherence in Stimulated Emission. San José State University. Архивировано из первоисточника 21 августа 2011. Проверено 23 декабря 2007.
- ↑ William Reusch. Virtual Textbook of Organic Chemistry. Michigan State University (16 июля 2007). Архивировано из первоисточника 21 августа 2011. Проверено 11 января 2008.
- ↑ Husted Robert и др. Periodic Table of the Elements. Los Alamos National Laboratory (11 декабря 2003). Архивировано из первоисточника 21 августа 2011. Проверено 11 января 2008.
- ↑ Rudy Baum. It’s Elemental: The Periodic Table. Chemical & Engineering News (2003). Архивировано из первоисточника 21 августа 2011. Проверено 11 января 2008.
- ↑ Даниэльс Ф., Олберти Р. Физическая химия / под ред. К.В.Топчиевой. — М.: Мир, 1978. — С. 453. — 646 с.
Литература
- На английском языке
- Michael F. L’Annunziata. Handbook of Radioactivity Analysis. — 2003. — ISBN 0-12-436603-1
- H. F. Beyer, V. P. Shevelko. Introduction to the Physics of Highly Charged Ions. — CRC Press, 2003. — ISBN 0-75-030481-2
- Gregory R. Choppin, Jan-Olov Liljenzin, Jan Rydberg. Radiochemistry and Nuclear Chemistry. — Elsevier, 2001. — ISBN 0-75-067463-6
- J. Dalton. A New System of Chemical Philosophy, Part 1. — London and Manchester: S. Russell, 1808.
- Wolfgang Demtröder. Atoms, Molecules and Photons: An Introduction to Atomic- Molecular- and Quantum Physics. — 1st ed. — Springer, 2002. — ISBN 3-540-20631-0
- Richard Feynman. Six Easy Pieces. — The Penguin Group, 1995. — ISBN 978-0-140-27666-4
- Grant R. Fowles. Introduction to Modern Optics. — Courier Dover Publications, 1989. — ISBN 0-48-665957-7
- Mrinalkanti Gangopadhyaya. Indian Atomism: History and Sources. — Atlantic Highlands, New Jersey: Humanities Press, 1981. — ISBN 0-391-02177-X
- David L. Goodstein. States of Matter. — Courier Dover Publications, 2002. — ISBN 0-48-649506-X
- Edward Robert Harrison. Masks of the Universe: Changing Ideas on the Nature of the Cosmos. — Cambridge University Press, 2003. — ISBN 0-52-177351-2
- Tatjana Jevremovic. Nuclear Principles in Engineering. — Springer, 2005. — ISBN 0-38-723284-2
- James Lequeux. The Interstellar Medium. — Springer, 2005. — ISBN 3-540-21326-0
- Z.-P. Liang, E. M. Haacke. Encyclopedia of Electrical and Electronics Engineering: Magnetic Resonance Imaging / J. G. Webster. — John Wiley & Sons, 1999. — Т. 2. — P. 412—26. — ISBN 0-47-113946-7
- Malcolm H. MacGregor. The Enigmatic Electron. — Oxford University Press, 1992. — ISBN 0-19-521833-7
- Oliver Manuel. Origin of Elements in the Solar System: Implications of Post-1957 Observations. — Springer, 2001. — ISBN 0-30-646562-0
- Robert M. Mazo. Brownian Motion: Fluctuations, Dynamics, and Applications. — Oxford University Press, 2002. — ISBN 0-19-851567-7
- Ian Mills, Tomislav Cvitaš, Klaus Homann, Nikola Kallay, Kozo Kuchitsu. Quantities, Units and Symbols in Physical Chemistry. — 2nd ed. — Oxford: International Union of Pure and Applied Chemistry, Commission on Physiochemical Symbols Terminology and Units, Blackwell Scientific Publications, 1993. — ISBN 0-632-03583-8
- Richard Myers. The Basics of Chemistry. — Greenwood Press, 2003. — ISBN 0-31-331664-3
- Michael J. Padilla, Ioannis Miaoulis, Martha Cyr. Prentice Hall Science Explorer: Chemical Building Blocks. — Upper Saddle River, New Jersey USA: Prentice-Hall, 2002. — ISBN 0-13-054091-9
- Linus Pauling. The Nature of the Chemical Bond. — Cornell University Press, 1960. — ISBN 0-80-140333-2
- Jeremy I. Pfeffer, Shlomo Nir. Modern Physics: An Introductory Text. — Imperial College Press, 2000. — ISBN 1-860-94250-4
- Leonid Ivanovich Ponomarev. The Quantum Dice. — CRC Press, 1993. — ISBN 0-75-030251-8
- J. Kenneth Shultis, Richard E. Faw. Fundamentals of Nuclear Science and Engineering. — CRC Press, 2002. — ISBN 0-82-470834-2
- Robert Siegfried. From Elements to Atoms: A History of Chemical Composition. — DIANE, 2002. — ISBN 0-87-169924-9
- Alan D. Sills. Earth Science the Easy Way. — Barron’s Educational Series, 2003. — ISBN 0-76-412146-4
- Boris M. Smirnov. Physics of Atoms and Ions. — Springer, 2003. — ISBN 0-38-795550-X
- Dick Teresi. Lost Discoveries: The Ancient Roots of Modern Science. — Simon & Schuster, 2003. — P. 213—214. — ISBN 0-74-324379-X
- Graham Woan. The Cambridge Handbook of Physics. — Cambridge University Press, 2000. — ISBN 0-52-157507-9
- Charles Adolphe Wurtz. The Atomic Theory. — New York: D. Appleton and company, 1881.
- Marco Zaider, Harald H. Rossi. Radiation Science for Physicians and Public Health Workers. — Springer, 2001. — ISBN 0-30-646403-9
- Steven S. Zumdahl. Introductory Chemistry: A Foundation. — 5th ed. — Houghton Mifflin, 2002. — ISBN 0-618-34342-3
Ссылки
Атом – это… Что такое Атом?
Атом гелияА́том (от др.-греч. ἄτομος — неделимый) — наименьшая, химически неделимая часть химического элемента, являющаяся носителем его свойств.[1] Атом состоит из атомного ядра и электронов. Ядро атома состоит из положительно заряженных протонов и незаряженных нейтронов, связанных между собой при помощи сильного взаимодействия. Если число протонов в ядре совпадает с числом электронов, то атом в целом оказывается электрически нейтральным. В противном случае он обладает некоторым положительным или отрицательным зарядом и называется ионом. Атомы классифицируются по количеству протонов и нейтронов в ядре: количество протонов определяет принадлежность атома некоторому химическому элементу, а число нейтронов — изотопу этого элемента.
Атомы различного вида в разных количествах, связанные межатомными связями, образуют молекулы.
История становления понятия
Понятие об атоме как о наименьшей неделимой части материи было впервые сформулировано древнеиндийскими и древнегреческими философами (см.: атомизм). В XVII и XVIII веках химикам удалось экспериментально подтвердить эту идею, показав, что некоторые вещества не могут быть подвергнуты дальнейшему расщеплению на составляющие элементы с помощью химических методов. Однако в конце XIX — начале XX века физиками были открыты субатомные частицы и составная структура атома, и стало ясно, что атом в действительности не является неделимым.
На международном съезде химиков в Карлсруэ (Германия) в 1860 году были приняты определения понятий молекулы и атома. Атом — наименьшая частица химического элемента, входящая в состав простых и сложных веществ.
Модели атомов
- Кусочки материи. Демокрит полагал, что свойства того или иного вещества определяются формой, массой, и пр. характеристиками образующих его атомов. Так, скажем, у огня атомы остры, поэтому огонь способен обжигать, у твёрдых тел они шероховаты, поэтому накрепко сцепляются друг с другом, у воды — гладки, поэтому она способна течь. Даже душа человека, согласно Демокриту, состоит из атомов.[2]
- Модель атома Томсона (модель «Пудинг с изюмом»). Дж. Дж. Томсон предложил рассматривать атом как некоторое положительно заряженное тело с заключёнными внутри него электронами. Была окончательно опровергнута Резерфордом после проведённого им знаменитого опыта по рассеиванию альфа-частиц.
- Ранняя планетарная модель атома Нагаоки. В 1904 году японский физик Хантаро Нагаока предложил модель атома, построенную по аналогии с планетой Сатурн. В этой модели вокруг маленького положительного ядра по орбитам вращались электроны, объединённые в кольца. Модель оказалась ошибочной.
- Планетарная модель атома Бора-Резерфорда. В 1911 году[3] Эрнест Резерфорд, проделав ряд экспериментов, пришёл к выводу, что атом представляет собой подобие планетной системы, в которой электроны движутся по орбитам вокруг расположенного в центре атома тяжёлого положительно заряженного ядра («модель атома Резерфорда»). Однако такое описание атома вошло в противоречие с классической электродинамикой. Дело в том, что, согласно классической электродинамике, электрон при движении с центростремительным ускорением должен излучать электромагнитные волны, а, следовательно, терять энергию. Расчёты показывали, что время, за которое электрон в таком атоме упадёт на ядро, совершенно ничтожно. Для объяснения стабильности атомов Нильсу Бору пришлось ввести постулаты, которые сводились к тому, что электрон в атоме, находясь в некоторых специальных энергетических состояниях, не излучает энергию («модель атома Бора-Резерфорда»). Постулаты Бора показали, что для описания атома классическая механика неприменима. Дальнейшее изучение излучения атома привело к созданию квантовой механики, которая позволила объяснить подавляющее большинство наблюдаемых фактов.
Квантово-механическая модель атома
Современная модель атома является развитием планетарной модели. Согласно этой модели, ядро атома состоит из положительно заряженных протонов и не имеющих заряда нейтронов и окружено отрицательно заряженными электронами. Однако представления квантовой механики не позволяют считать, что электроны движутся вокруг ядра по сколько-нибудь определённым траекториям (неопределённость координаты электрона в атоме может быть сравнима с размерами самого атома).
Химические свойства атомов определяются конфигурацией электронной оболочки и описываются квантовой механикой. Положение атома в таблице Менделеева определяется электрическим зарядом его ядра (то есть количеством протонов), в то время как количество нейтронов принципиально не влияет на химические свойства; при этом нейтронов в ядре, как правило, больше, чем протонов (см.: атомное ядро). Если атом находится в нейтральном состоянии, то количество электронов в нём равно количеству протонов. Основная масса атома сосредоточена в ядре, а массовая доля электронов в общей массе атома незначительна (несколько сотых процента массы ядра).
Массу атома принято измерять в атомных единицах массы, равных 1⁄12 от массы атома стабильного изотопа углерода 12C.
Строение атома
Субатомные частицы
Хотя слово атом в первоначальном значении обозначало частицу, которая не делится на меньшие части, согласно научным представлениям он состоит из более мелких частиц, называемых субатомными частицами. Атом состоит из электронов, протонов, все атомы, кроме водорода-1, содержат также нейтроны.
Электрон является самой лёгкой из составляющих атом частиц с массой 9,11·10−31кг, отрицательным зарядом и размером, слишком малым для измерения современными методами.[4] Протоны обладают положительным зарядом и в 1836 раз тяжелее электрона (1,6726·10−27 кг). Нейтроны не обладают электрическим зарядом и в 1839 раз тяжелее электрона (1,6929·10−27 кг).[5]
При этом масса ядра меньше суммы масс составляющих его протонов и нейтронов из-за эффекта дефекта массы. Нейтроны и протоны имеют сравнимый размер, около 2,5·10−15м, хотя размеры этих частиц определены плохо.[6]
В стандартной модели элементарных частиц как протоны, так и нейтроны состоят из элементарных частиц, называемых кварками. Наряду с лептонами, кварки являются одной из основных составляющих материи. И первые и вторые являются фермионами. Существует шесть типов кварков, каждый из которых имеет дробный электрический заряд, равный +2⁄3 или −1⁄3 элементарного. Протоны состоят из двух u-кварков и одного d-кварка, а нейтрон — из одного u-кварка и двух d-кварков. Это различие объясняет разницу в массах и зарядах протона и нейтрона. Кварки связаны между собой сильными ядерными взаимодействиями, которые передаются глюонами.[7][8]
Электроны в атоме
При описании электронов в атоме в рамках квантовой механики, обычно рассматривают распределение вероятности в 3n-мерном пространстве для системы n электронов.
Электроны в атоме притягиваются к ядру, между электронами также действует кулоновское взаимодействие. Эти же силы удерживают электроны внутри потенциального барьера, окружающего ядро. Для того, чтобы электрон смог преодолеть притяжение ядра, ему необходимо получить энергию от внешнего источника. Чем ближе электрон находится к ядру, тем больше энергии для этого необходимо.
Электронам, как и другим частицам, свойственен корпускулярно-волновой дуализм. Иногда говорят, что электрон движется по орбитали, что неверно. Состояние электронов описывается волновой функцией, квадрат модуля которой характеризует плотность вероятности нахождения частиц в данной точке пространства в данный момент времени, или, в общем случае, оператором плотности. Существует дискретный набор атомных орбиталей, которым соответствуют стационарные чистые состояния электронов в атоме.
Каждой орбитали соответствует свой уровень энергии. Электрон может перейти на уровень с большей энергией, поглотив фотон. При этом он окажется в новом квантовом состоянии с большей энергией. Аналогично, он может перейти на уровень с меньшей энергией, излучив фотон. Энергия фотона при этом будет равна разности энергий электрона на этих уровнях (см.: постулаты Бора).
Свойства атома
По определению, любые два атома с одним и тем же числом протонов в их ядрах относятся к одному химическому элементу. Атомы с одним и тем же количеством протонов, но разным количеством нейтронов называют изотопами данного элемента. Например, атомы водорода всегда содержат один протон, но существуют изотопы без нейтронов (водород-1, иногда также называемый протием — наиболее распространённая форма), с одним нейтроном (дейтерий) и двумя нейтронами (тритий).[9] Известные элементы составляют непрерывный натуральный ряд по числу протонов в ядре, начиная с атома водорода с одним протоном и заканчивая атомом унуноктия, в ядре которого 118 протонов.[10] Все изотопы элементов периодической системы, начиная с номера 83 (висмут), радиоактивны.[11][12]
Масса
Поскольку наибольший вклад в массу атома вносят протоны и нейтроны, суммарное число этих частиц называют массовым числом. Массу покоя атома часто выражают в атомных единицах массы (а. е. м.), которая также называется дальтоном (Да). Эта единица определяется как 1⁄12 часть массы покоя нейтрального атома углерода-12, которая приблизительно равна 1,66·10−24 г.[13]Водород-1 — наилегчайший изотоп водорода и атом с наименьшей массой, имеет атомный вес около 1,007825 а. е. м.[14] Масса атома приблизительно равна произведению массового числа на атомную единицу массы[15] Самый тяжёлый стабильный изотоп — свинец-208[11] с массой 207,9766521 а. е. м.[16]
Так как массы даже самых тяжёлых атомов в обычных единицах (например, в граммах) очень малы, то в химии для измерения этих масс используют моли. В одном моле любого вещества по определению содержится одно и то же число атомов (примерно 6,022·1023). Это число (число Авогадро) выбрано таким образом, что если масса элемента равна 1 а. е. м., то моль атомов этого элемента будет иметь массу 1 г. Например, углерод имеет массу 12 а. е. м., поэтому 1 моль углерода весит 12 г.[13]
Размер
Атомы не имеют отчётливо выраженной внешней границы, поэтому их размеры определяются по расстоянию между ядрами соседних атомов, которые образовали химическую связь (Ковалентный радиус) или по расстоянию до самой дальней из стабильных орбит электронов в электронной оболочке этого атома (Радиус атома). Радиус зависит от положения атома в периодической системе, вида химической связи, числа ближайших атомов (координационного числа) и квантово-механического свойства, известного как спин.[17] В периодической системе элементов размер атома увеличивается при движении сверху вниз по столбцу и уменьшается при движении по строке слева направо.[18] Соответственно, самый маленький атом — это атом гелия, имеющий радиус 32 пм, а самый большой — атом цезия (225 пм).[19] Эти размеры в тысячи раз меньше длины волны видимого света (400—700 нм), поэтому атомы нельзя увидеть в оптический микроскоп. Однако отдельные атомы можно наблюдать с помощью сканирующего туннельного микроскопа.
Малость атомов демонстрируют следующие примеры. Человеческий волос по толщине в миллион раз больше атома углерода.[20] Одна капля воды содержит 2 секстиллиона (2·1021) атомов кислорода, и в два раза больше атомов водорода.[21] Один карат алмаза с массой 0,2 г состоит из 10 секстиллионов атомов углерода.[22] Если бы яблоко можно было увеличить до размеров Земли, то атомы достигли бы исходных размеров яблока.[23]
Учёные из Харьковского физико-технического института представили первые в истории науки снимки атома. Для получения снимков учёные использовали электронный микроскоп, фиксирующий излучения и поля (field-emission electron microscope, FEEM). Физики последовательно разместили десятки атомов углерода в вакуумной камере и пропустили через них электрический разряд в 425 вольт. Излучение последнего атома в цепочке на фосфорный экран позволило получить изображение облака электронов вокруг ядра.[24]
Радиоактивный распад
Диаграмма времени полураспада (T½) в секундах для различных изотопов с Z протонами и N нейтронами.У каждого химического элемента есть один или более изотопов с нестабильными ядрами, которые подвержены радиоактивному распаду, в результате чего атомы испускают частицы или электромагнитное излучение. Радиоактивность возникает, когда радиус ядра больше радиуса действия сильных взаимодействий (расстояний порядка 1 фм[25]).
Существуют три основные формы радиоактивного распада[26][27]:
- Альфа-распад происходит, когда ядро испускает альфа-частицу — ядро атома гелия, состоящее из двух протонов и двух нейтронов. В результате испускания этой частицы возникает элемент с меньшим на два атомным номером.
- Бета-распад происходит из-за слабых взаимодействий, и в результате нейтрон превращается в протон или наоборот. В первом случае происходит испускание электрона и антинейтрино, во втором — испускание позитрона и нейтрино. Электрон и позитрон называют бета-частицами. Бета-распад увеличивает или уменьшает атомный номер на единицу.
- Гамма-излучение происходит из-за перехода ядра в состояние с более низкой энергией с испусканием электромагнитного излучения. Гамма-излучение может происходить вслед за испусканием альфа- или бета-частицы после радиоактивного распада.
Каждый радиоактивный изотоп характеризуется периодом полураспада, то есть временем, за которое распадается половина ядер образца. Это экспоненциальный распад, который вдвое уменьшает количество оставшихся ядер за каждый период полураспада. Например, по прошествии двух периодов полураспада в образце останется только 25 % ядер исходного изотопа.[25]
Магнитный момент
Элементарные частицы обладают внутренним квантовомеханическим свойством известным как спин. Оно аналогично угловому моменту объекта вращающегося вокруг собственного центра масс, хотя строго говоря, эти частицы являются точечными и нельзя говорить об их вращении. Спин измеряют в единицах приведённой планковской постоянной (), тогда электроны, протоны и нейтроны имеют спин равный ½ . В атоме электроны обращаются вокруг ядра и обладают орбитальным угловым моментом помимо спина, в то время как ядро само по себе имеет угловой момент благодаря ядерному спину.[28]
Магнитное поле, создаваемое магнитным моментом атома, определяется этими различными формами углового момента, как и в классической физике вращающиеся заряженные объекты создают магнитное поле. Однако, наиболее значительный вклад происходит от спина. Благодаря свойству электрона, как и всех фермионов, подчиняться правилу запрета Паули, по которому два электрона не могут находиться в одном и том же квантовом состоянии, связанные электроны спариваются друг с другом, и один из электронов находится в состоянии со спином вверх, а другой — с противоположной проекцией спина — состояние со спином вниз. Таким образом магнитные моменты электронов сокращаются, уменьшая полный магнитный дипольный момент системы до нуля в некоторых атомах с чётным числом электронов.[29]
В ферромагнитных элементах, таких как железо, нечётное число электронов приводит к появлению неспаренного электрона и к ненулевому полному магнитному моменту. Орбитали соседних атомов перекрываются, и наименьшее энергетическое состояние достигается, когда все спины неспаренных электронов принимают одну ориентацию, процесс известный как обменное взаимодействие. Когда магнитные моменты ферромагнитных атомов выравниваются, материал может создавать измеримое макроскопическое магнитное поле. Парамагнитные материалы состоят из атомов, магнитные моменты которых разориентированы в отсутствии магнитного поля, но магнитные моменты отдельных атомов выравниваются при приложении магнитного поля.[29][30]
Ядро атома тоже может обладать ненулевым полным спином. Обычно при термодинамическом равновесии спины ядер ориентированы случайным образом. Однако, для некоторых элементов (таких как ксенон-129) возможно поляризовать значительную часть ядерных спинов для создания состояния с сонаправленными спинами —состояния называемого гиперполяризацией. Это состояние имеет важное прикладное значение в магнитно-резонансной томографии.[31][32]
Энергетические уровни
Когда электрон находится в связанном состоянии в атоме, он обладает потенциальной энергией, которая обратно пропорциональна его расстоянию от ядра. Эта энергия обычно измеряется в электронвольтах (эВ) и равна энергии, которую надо передать электрону, чтобы сделать его свободным (оторвать от атома). Согласно квантовомеханической модели атома связанный электрон может занимать только дискретный набор разрешённых энергетических уровней — состояний с определённой энергией. Наинизшее из разрешённых энергетических состояний называется основным, а все остальные — возбуждёнными.[33]
Для перехода электрона с одного энергетического уровня на другой нужно передать ему или отнять у него энергию. Это происходит путём соответственно поглощения или испускания фотона, причём энергия этого фотона равна абсолютной величине разности энергий начального и конечного уровней электрона. Энергия испущенного фотона пропорциональна его частоте, поэтому переходы между разными энергетическими уровнями проявляются в различных областях электромагнитного спектра.[34] Каждый элемент имеет уникальный спектр испускания, который зависит от заряда ядра, заполнения электронных подоболочек, взаимодействия электронов, а также других факторов.[35]
Пример линейного спектра поглощенияКогда излучение с непрерывным спектром проходит через вещество (например, газ или плазму), некоторые фотоны поглощаются атомами или ионами, вызывая электронные переходы между энергетическим состояниями, разность энергий которых равна энергии поглощённого фотона. Затем эти возбуждённые электроны спонтанно переходят на уровень, лежащий ниже по энергии, снова испуская фотоны. Таким образом, вещество ведёт себя как фильтр, превращая исходный непрерывный спектр в спектр поглощения, в котором имеются серии тёмных полос. При наблюдении с тех углов, куда не направлено исходное излучение, можно заметить излучение с эмиссионным спектром, испускаемое атомами. Спектроскопические измерения энергии, амплитуды и ширины спектральных линий излучения позволяют определить вид излучающего вещества и физические условия в нём.[36]
Более детальный анализ спектральных линий показал, что некоторые из них обладают тонкой структурой, то есть расщеплены на несколько близких линий. В узком смысле «тонкой структурой» спектральных линий принято называть их расщепление, происходящее из-за спин-орбитального взаимодействия между спином и вращательным движением электрона.[37]
Взаимодействие магнитных моментов электрона и ядра приводит к сверхтонкому расщеплению спектральных линий, которое, как правило, меньше, чем тонкое.
Если поместить атом во внешнее магнитное поле, то также можно заметить расщепление спектральных линий на две, три и более компонент — это явление называется эффектом Зеемана. Он вызван взаимодействием внешнего магнитного поля с магнитным моментом атома, при этом в зависимости от взаимной ориентации момента атома и магнитного поля энергия данного уровня может увеличиться или уменьшиться. При переходе атома из одного расщеплённого состояния в другое будет излучаться фотон с частотой, отличной от частоты фотона при таком же переходе в отсутствие магнитного поля. Если спектральная линия при помещении атома в магнитное поле расщепляется на три линии, то такой эффект Зеемана называется нормальным (простым). Гораздо чаще в слабом магнитном поле наблюдается аномальный (сложный) эффект Зеемана, когда происходит расщепление на 2, 4 или более линий (аномальный эффект происходит из-за наличия спина у электронов). При увеличении магнитного поля вид расщепления упрощается, и аномальный эффект Зеемана переходит в нормальный (эффект Пашена — Бака).[38] Присутствие электрического поля также может вызвать сравнимый по величине сдвиг спектральных линий, вызванный изменением энергетических уровней. Это явление известно как эффект Штарка.[39]
Если электрон находится в возбуждённом состоянии, то взаимодействие с фотоном определённой энергии может вызвать вынужденное излучение дополнительного фотона с такой же энергией — для этого должен существовать более низкий уровень, на который возможен переход, и разность энергий уровней должна равняться энергии фотона. При вынужденном излучении эти два фотона будут двигаться в одном направлении и иметь одинаковую фазу. Это свойство используется в лазерах, которые могут испускать когерентный пучок света в узком диапазоне частот.[40]
Валентность
Внешняя электронная оболочка атома, если она не полностью заполнена, называется валентной оболочкой, а электроны этой оболочки называются валентными электронами. Число валентных электронов определяет то, как атом связывается с другими атомами посредством химической связи. Путём образования химических связей атомы стремятся заполнить свои внешние валентные оболочки.[41]
Чтобы показать повторяющиеся химические свойства химических элементов, их упорядочивают в виде периодической таблицы. Элементы с одинаковым числом валентных электронов формируют группу, которая изображается в таблице в виде столбца (движение по горизонтальному ряду соответствуют заполнению валентной оболочки электронами). Элементы, находящиеся в самом правом столбце таблицы, имеют полностью заполненную электронами внешнюю оболочку, поэтому они отличаются крайне низкой химической активностью и называются инертными или благородными газами.[42][43]
Дисперсионное притяжение
Важным свойством атома является его склонность к дисперсионному притяжению. Происхождение дисперсионных сил было объяснено в 1930 году Ф. Лондоном. Межатомное взаимодействие возникает вследствие флуктуаций заряда в двух атомах, находящихся близко друг от друга. Поскольку электроны движутся, каждый атом обладает мгновенным дипольным моментом, отличным от нуля. Если бы флуктуации электронной плотности в двух атомах были бы несогласованными, то не было бы результирующего притяжения между атомами. Однако мгновенный диполь на одном атоме наводит противоположно направленный диполь в соседнем атоме. Эти диполи притягиваются друг к другу за счёт возникновения силы притяжения, которая называется дисперсионной силой, или силой Лондона. Энергия такого взаимодействия прямо пропорциональна квадрату электронной поляризуемости атома α и обратно пропорциональна r6, где r — расстояние между двумя атомами.[44]
См. также
Примечания
- ↑ Атом — статья из Большой советской энциклопедии
- ↑ Демокрит // Школьная энциклопедия «Руссика». История Древнего мира / А. О. Чубарьян. — М.: Olma Media Group, 2003. — С. 281—282. — 815 с. — ISBN 5-948-49307-5
- ↑ http://www.ido.rudn.ru/nfpk/fizika/mkt/1.html Планетарная модель атома]
- ↑ Demtröder, 2002
- ↑ Woan, 2000
- ↑ MacGregor, 1992
- ↑ The Particle Adventure. Particle Data Group. Lawrence Berkeley Laboratory (2002). Архивировано из первоисточника 21 августа 2011. Проверено 3 января 2009.
- ↑ James Schombert. Elementary Particles. University of Oregon (18 апреля 2006). Архивировано из первоисточника 21 августа 2011. Проверено 3 января 2007.
- ↑ Howard S. Matis. The Isotopes of Hydrogen. Guide to the Nuclear Wall Chart. Lawrence Berkeley National Lab (9 августа 2000). Архивировано из первоисточника 21 августа 2011. Проверено 21 декабря 2007.
- ↑ Rick Weiss. Scientists Announce Creation of Atomic Element, the Heaviest Yet. Washington Post (17 октября 2006). Архивировано из первоисточника 21 августа 2011. Проверено 21 декабря 2007.
- ↑ 1 2 Sills, 2003
- ↑ Belle Dumé. Bismuth breaks half-life record for alpha decay. Physics World (23 апреля 2003). Архивировано из первоисточника 21 августа 2011. Проверено 21 декабря 2007.
- ↑ 1 2 Mills и др. (1993).
- ↑ Chung Chieh. Nuclide Stability. University of Waterloo (22 января 2001). Проверено 4 января 2007.
- ↑ Atomic Weights and Isotopic Compositions for All Elements. National Institute of Standards and Technology. Архивировано из первоисточника 21 августа 2011. Проверено 4 января 2007.
- ↑ G. Audi, A. H. Wapstra, C. Thibault. (2003). «The Ame2003 atomic mass evaluation (II)». Nuclear Physics A729: 337–676. Проверено 2008-02-07.
- ↑ R. D. Shannon. (1976). «Revised effective ionic radii and systematic studies of interatomic distances in halides and chalcogenides». Acta Crystallographica, Section A 32: 751. DOI:10.1107/S0567739476001551. Проверено 2007-01-03.
- ↑ Judy Dong. Diameter of an Atom. The Physics Factbook (1998). Архивировано из первоисточника 21 августа 2011. Проверено 19 ноября 2007.
- ↑ Zumdahl, 2002
- ↑ Small Miracles: Harnessing nanotechnology. Oregon State University (2007).(недоступная ссылка — история) Проверено 7 января 2007.(недоступная ссылка — история) — описывает толщину человеческого волоса как 105 нм и 10 углеродных атомов по толщине как 1 нм.
- ↑ «There are 2 000 000 000 000 000 000 000 (that’s 2 sextillion) atoms of oxygen in one drop of water—and twice as many atoms of hydrogen» // Padilla et al., 2002, p. 32
- ↑ Карат равен 200 миллиграмм. По определению, углерод-12 имеет 12 грамм на моль. Постоянная Авогадро равна 6,02·1023 атомов на моль.
- ↑ Feynman, 1995
- ↑ First Detailed Photos of Atoms. Inside Science News Service (14 сентября 2009).(недоступная ссылка — история) Проверено 16 сентября 2009.(недоступная ссылка — история)
- ↑ 1 2 Radioactivity. Splung.com. Архивировано из первоисточника 21 августа 2011. Проверено 19 декабря 2007.
- ↑ L’Annunziata (2003).
- ↑ Richard B. Firestone. Radioactive Decay Modes. Berkeley Laboratory (22 мая 2000). Архивировано из первоисточника 21 августа 2011. Проверено 7 января 2007.
- ↑ J. P. Hornak. Chapter 3: Spin Physics. The Basics of NMR. Rochester Institute of Technology (2006).(недоступная ссылка — история) Проверено 20 марта 2011.(недоступная ссылка — история)
- ↑ 1 2 Paul A. Schroeder. Magnetic Properties. University of Georgia (22 февраля 2000).(недоступная ссылка — история) Проверено 7 января 2007.(недоступная ссылка — история)
- ↑ Greg Goebel. [4.3] Magnetic Properties of the Atom. Elementary Quantum Physics. In The Public Domain website (1 сентября 2007). Архивировано из первоисточника 21 августа 2011. Проверено 7 января 2007.
- ↑ Lynn Yarris. (весна 1997). «Talking Pictures». Berkeley Lab Research Review. Проверено 2008-01-09.(недоступная ссылка — история)
- ↑ Liang, Haacke, 1999
- ↑ Bart J. Van Zeghbroeck. Energy levels. Shippensburg University (1998). Проверено 23 декабря 2007.
- ↑ Fowles, 1989
- ↑ W. C. Martin, W. L. Wiese. Atomic Spectroscopy: A Compendium of Basic Ideas, Notation, Data, and Formulas. National Institute of Standards and Technology (май 2007). Архивировано из первоисточника 21 августа 2011. Проверено 8 января 2007.
- ↑ Atomic Emission Spectra — Origin of Spectral Lines. Avogadro Web Site. Архивировано из первоисточника 21 августа 2011. Проверено 10 августа 2006.
- ↑ Richard Fitzpatrick. Fine structure. University of Texas at Austin (16 февраля 2007). Архивировано из первоисточника 21 августа 2011. Проверено 14 февраля 2008.
- ↑ Michael Weiss. The Zeeman Effect. University of California-Riverside (2001). Архивировано из первоисточника 21 августа 2011. Проверено 6 февраля 2008.
- ↑ Beyer, 2003
- ↑ Thayer Watkins. Coherence in Stimulated Emission. San José State University. Архивировано из первоисточника 21 августа 2011. Проверено 23 декабря 2007.
- ↑ William Reusch. Virtual Textbook of Organic Chemistry. Michigan State University (16 июля 2007). Архивировано из первоисточника 21 августа 2011. Проверено 11 января 2008.
- ↑ Husted Robert и др. Periodic Table of the Elements. Los Alamos National Laboratory (11 декабря 2003). Архивировано из первоисточника 21 августа 2011. Проверено 11 января 2008.
- ↑ Rudy Baum. It’s Elemental: The Periodic Table. Chemical & Engineering News (2003). Архивировано из первоисточника 21 августа 2011. Проверено 11 января 2008.
- ↑ Даниэльс Ф., Олберти Р. Физическая химия / под ред. К.В.Топчиевой. — М.: Мир, 1978. — С. 453. — 646 с.
Литература
- На английском языке
- Michael F. L’Annunziata. Handbook of Radioactivity Analysis. — 2003. — ISBN 0-12-436603-1
- H. F. Beyer, V. P. Shevelko. Introduction to the Physics of Highly Charged Ions. — CRC Press, 2003. — ISBN 0-75-030481-2
- Gregory R. Choppin, Jan-Olov Liljenzin, Jan Rydberg. Radiochemistry and Nuclear Chemistry. — Elsevier, 2001. — ISBN 0-75-067463-6
- J. Dalton. A New System of Chemical Philosophy, Part 1. — London and Manchester: S. Russell, 1808.
- Wolfgang Demtröder. Atoms, Molecules and Photons: An Introduction to Atomic- Molecular- and Quantum Physics. — 1st ed. — Springer, 2002. — ISBN 3-540-20631-0
- Richard Feynman. Six Easy Pieces. — The Penguin Group, 1995. — ISBN 978-0-140-27666-4
- Grant R. Fowles. Introduction to Modern Optics. — Courier Dover Publications, 1989. — ISBN 0-48-665957-7
- Mrinalkanti Gangopadhyaya. Indian Atomism: History and Sources. — Atlantic Highlands, New Jersey: Humanities Press, 1981. — ISBN 0-391-02177-X
- David L. Goodstein. States of Matter. — Courier Dover Publications, 2002. — ISBN 0-48-649506-X
- Edward Robert Harrison. Masks of the Universe: Changing Ideas on the Nature of the Cosmos. — Cambridge University Press, 2003. — ISBN 0-52-177351-2
- Tatjana Jevremovic. Nuclear Principles in Engineering. — Springer, 2005. — ISBN 0-38-723284-2
- James Lequeux. The Interstellar Medium. — Springer, 2005. — ISBN 3-540-21326-0
- Z.-P. Liang, E. M. Haacke. Encyclopedia of Electrical and Electronics Engineering: Magnetic Resonance Imaging / J. G. Webster. — John Wiley & Sons, 1999. — Т. 2. — P. 412—26. — ISBN 0-47-113946-7
- Malcolm H. MacGregor. The Enigmatic Electron. — Oxford University Press, 1992. — ISBN 0-19-521833-7
- Oliver Manuel. Origin of Elements in the Solar System: Implications of Post-1957 Observations. — Springer, 2001. — ISBN 0-30-646562-0
- Robert M. Mazo. Brownian Motion: Fluctuations, Dynamics, and Applications. — Oxford University Press, 2002. — ISBN 0-19-851567-7
- Ian Mills, Tomislav Cvitaš, Klaus Homann, Nikola Kallay, Kozo Kuchitsu. Quantities, Units and Symbols in Physical Chemistry. — 2nd ed. — Oxford: International Union of Pure and Applied Chemistry, Commission on Physiochemical Symbols Terminology and Units, Blackwell Scientific Publications, 1993. — ISBN 0-632-03583-8
- Richard Myers. The Basics of Chemistry. — Greenwood Press, 2003. — ISBN 0-31-331664-3
- Michael J. Padilla, Ioannis Miaoulis, Martha Cyr. Prentice Hall Science Explorer: Chemical Building Blocks. — Upper Saddle River, New Jersey USA: Prentice-Hall, 2002. — ISBN 0-13-054091-9
- Linus Pauling. The Nature of the Chemical Bond. — Cornell University Press, 1960. — ISBN 0-80-140333-2
- Jeremy I. Pfeffer, Shlomo Nir. Modern Physics: An Introductory Text. — Imperial College Press, 2000. — ISBN 1-860-94250-4
- Leonid Ivanovich Ponomarev. The Quantum Dice. — CRC Press, 1993. — ISBN 0-75-030251-8
- J. Kenneth Shultis, Richard E. Faw. Fundamentals of Nuclear Science and Engineering. — CRC Press, 2002. — ISBN 0-82-470834-2
- Robert Siegfried. From Elements to Atoms: A History of Chemical Composition. — DIANE, 2002. — ISBN 0-87-169924-9
- Alan D. Sills. Earth Science the Easy Way. — Barron’s Educational Series, 2003. — ISBN 0-76-412146-4
- Boris M. Smirnov. Physics of Atoms and Ions. — Springer, 2003. — ISBN 0-38-795550-X
- Dick Teresi. Lost Discoveries: The Ancient Roots of Modern Science. — Simon & Schuster, 2003. — P. 213—214. — ISBN 0-74-324379-X
- Graham Woan. The Cambridge Handbook of Physics. — Cambridge University Press, 2000. — ISBN 0-52-157507-9
- Charles Adolphe Wurtz. The Atomic Theory. — New York: D. Appleton and company, 1881.
- Marco Zaider, Harald H. Rossi. Radiation Science for Physicians and Public Health Workers. — Springer, 2001. — ISBN 0-30-646403-9
- Steven S. Zumdahl. Introductory Chemistry: A Foundation. — 5th ed. — Houghton Mifflin, 2002. — ISBN 0-618-34342-3
Ссылки
Атом – это… Что такое Атом?
Атом гелияА́том (от др.-греч. ἄτομος — неделимый) — наименьшая, химически неделимая часть химического элемента, являющаяся носителем его свойств.[1] Атом состоит из атомного ядра и электронов. Ядро атома состоит из положительно заряженных протонов и незаряженных нейтронов, связанных между собой при помощи сильного взаимодействия. Если число протонов в ядре совпадает с числом электронов, то атом в целом оказывается электрически нейтральным. В противном случае он обладает некоторым положительным или отрицательным зарядом и называется ионом. Атомы классифицируются по количеству протонов и нейтронов в ядре: количество протонов определяет принадлежность атома некоторому химическому элементу, а число нейтронов — изотопу этого элемента.
Атомы различного вида в разных количествах, связанные межатомными связями, образуют молекулы.
История становления понятия
Понятие об атоме как о наименьшей неделимой части материи было впервые сформулировано древнеиндийскими и древнегреческими философами (см.: атомизм). В XVII и XVIII веках химикам удалось экспериментально подтвердить эту идею, показав, что некоторые вещества не могут быть подвергнуты дальнейшему расщеплению на составляющие элементы с помощью химических методов. Однако в конце XIX — начале XX века физиками были открыты субатомные частицы и составная структура атома, и стало ясно, что атом в действительности не является неделимым.
На международном съезде химиков в Карлсруэ (Германия) в 1860 году были приняты определения понятий молекулы и атома. Атом — наименьшая частица химического элемента, входящая в состав простых и сложных веществ.
Модели атомов
- Кусочки материи. Демокрит полагал, что свойства того или иного вещества определяются формой, массой, и пр. характеристиками образующих его атомов. Так, скажем, у огня атомы остры, поэтому огонь способен обжигать, у твёрдых тел они шероховаты, поэтому накрепко сцепляются друг с другом, у воды — гладки, поэтому она способна течь. Даже душа человека, согласно Демокриту, состоит из атомов.[2]
- Модель атома Томсона (модель «Пудинг с изюмом»). Дж. Дж. Томсон предложил рассматривать атом как некоторое положительно заряженное тело с заключёнными внутри него электронами. Была окончательно опровергнута Резерфордом после проведённого им знаменитого опыта по рассеиванию альфа-частиц.
- Ранняя планетарная модель атома Нагаоки. В 1904 году японский физик Хантаро Нагаока предложил модель атома, построенную по аналогии с планетой Сатурн. В этой модели вокруг маленького положительного ядра по орбитам вращались электроны, объединённые в кольца. Модель оказалась ошибочной.
- Планетарная модель атома Бора-Резерфорда. В 1911 году[3] Эрнест Резерфорд, проделав ряд экспериментов, пришёл к выводу, что атом представляет собой подобие планетной системы, в которой электроны движутся по орбитам вокруг расположенного в центре атома тяжёлого положительно заряженного ядра («модель атома Резерфорда»). Однако такое описание атома вошло в противоречие с классической электродинамикой. Дело в том, что, согласно классической электродинамике, электрон при движении с центростремительным ускорением должен излучать электромагнитные волны, а, следовательно, терять энергию. Расчёты показывали, что время, за которое электрон в таком атоме упадёт на ядро, совершенно ничтожно. Для объяснения стабильности атомов Нильсу Бору пришлось ввести постулаты, которые сводились к тому, что электрон в атоме, находясь в некоторых специальных энергетических состояниях, не излучает энергию («модель атома Бора-Резерфорда»). Постулаты Бора показали, что для описания атома классическая механика неприменима. Дальнейшее изучение излучения атома привело к созданию квантовой механики, которая позволила объяснить подавляющее большинство наблюдаемых фактов.
Квантово-механическая модель атома
Современная модель атома является развитием планетарной модели. Согласно этой модели, ядро атома состоит из положительно заряженных протонов и не имеющих заряда нейтронов и окружено отрицательно заряженными электронами. Однако представления квантовой механики не позволяют считать, что электроны движутся вокруг ядра по сколько-нибудь определённым траекториям (неопределённость координаты электрона в атоме может быть сравнима с размерами самого атома).
Химические свойства атомов определяются конфигурацией электронной оболочки и описываются квантовой механикой. Положение атома в таблице Менделеева определяется электрическим зарядом его ядра (то есть количеством протонов), в то время как количество нейтронов принципиально не влияет на химические свойства; при этом нейтронов в ядре, как правило, больше, чем протонов (см.: атомное ядро). Если атом находится в нейтральном состоянии, то количество электронов в нём равно количеству протонов. Основная масса атома сосредоточена в ядре, а массовая доля электронов в общей массе атома незначительна (несколько сотых процента массы ядра).
Массу атома принято измерять в атомных единицах массы, равных 1⁄12 от массы атома стабильного изотопа углерода 12C.
Строение атома
Субатомные частицы
Хотя слово атом в первоначальном значении обозначало частицу, которая не делится на меньшие части, согласно научным представлениям он состоит из более мелких частиц, называемых субатомными частицами. Атом состоит из электронов, протонов, все атомы, кроме водорода-1, содержат также нейтроны.
Электрон является самой лёгкой из составляющих атом частиц с массой 9,11·10−31кг, отрицательным зарядом и размером, слишком малым для измерения современными методами.[4] Протоны обладают положительным зарядом и в 1836 раз тяжелее электрона (1,6726·10−27 кг). Нейтроны не обладают электрическим зарядом и в 1839 раз тяжелее электрона (1,6929·10−27 кг).[5]
При этом масса ядра меньше суммы масс составляющих его протонов и нейтронов из-за эффекта дефекта массы. Нейтроны и протоны имеют сравнимый размер, около 2,5·10−15м, хотя размеры этих частиц определены плохо.[6]
В стандартной модели элементарных частиц как протоны, так и нейтроны состоят из элементарных частиц, называемых кварками. Наряду с лептонами, кварки являются одной из основных составляющих материи. И первые и вторые являются фермионами. Существует шесть типов кварков, каждый из которых имеет дробный электрический заряд, равный +2⁄3 или −1⁄3 элементарного. Протоны состоят из двух u-кварков и одного d-кварка, а нейтрон — из одного u-кварка и двух d-кварков. Это различие объясняет разницу в массах и зарядах протона и нейтрона. Кварки связаны между собой сильными ядерными взаимодействиями, которые передаются глюонами.[7][8]
Электроны в атоме
При описании электронов в атоме в рамках квантовой механики, обычно рассматривают распределение вероятности в 3n-мерном пространстве для системы n электронов.
Электроны в атоме притягиваются к ядру, между электронами также действует кулоновское взаимодействие. Эти же силы удерживают электроны внутри потенциального барьера, окружающего ядро. Для того, чтобы электрон смог преодолеть притяжение ядра, ему необходимо получить энергию от внешнего источника. Чем ближе электрон находится к ядру, тем больше энергии для этого необходимо.
Электронам, как и другим частицам, свойственен корпускулярно-волновой дуализм. Иногда говорят, что электрон движется по орбитали, что неверно. Состояние электронов описывается волновой функцией, квадрат модуля которой характеризует плотность вероятности нахождения частиц в данной точке пространства в данный момент времени, или, в общем случае, оператором плотности. Существует дискретный набор атомных орбиталей, которым соответствуют стационарные чистые состояния электронов в атоме.
Каждой орбитали соответствует свой уровень энергии. Электрон может перейти на уровень с большей энергией, поглотив фотон. При этом он окажется в новом квантовом состоянии с большей энергией. Аналогично, он может перейти на уровень с меньшей энергией, излучив фотон. Энергия фотона при этом будет равна разности энергий электрона на этих уровнях (см.: постулаты Бора).
Свойства атома
По определению, любые два атома с одним и тем же числом протонов в их ядрах относятся к одному химическому элементу. Атомы с одним и тем же количеством протонов, но разным количеством нейтронов называют изотопами данного элемента. Например, атомы водорода всегда содержат один протон, но существуют изотопы без нейтронов (водород-1, иногда также называемый протием — наиболее распространённая форма), с одним нейтроном (дейтерий) и двумя нейтронами (тритий).[9] Известные элементы составляют непрерывный натуральный ряд по числу протонов в ядре, начиная с атома водорода с одним протоном и заканчивая атомом унуноктия, в ядре которого 118 протонов.[10] Все изотопы элементов периодической системы, начиная с номера 83 (висмут), радиоактивны.[11][12]
Масса
Поскольку наибольший вклад в массу атома вносят протоны и нейтроны, суммарное число этих частиц называют массовым числом. Массу покоя атома часто выражают в атомных единицах массы (а. е. м.), которая также называется дальтоном (Да). Эта единица определяется как 1⁄12 часть массы покоя нейтрального атома углерода-12, которая приблизительно равна 1,66·10−24 г.[13]Водород-1 — наилегчайший изотоп водорода и атом с наименьшей массой, имеет атомный вес около 1,007825 а. е. м.[14] Масса атома приблизительно равна произведению массового числа на атомную единицу массы[15] Самый тяжёлый стабильный изотоп — свинец-208[11] с массой 207,9766521 а. е. м.[16]
Так как массы даже самых тяжёлых атомов в обычных единицах (например, в граммах) очень малы, то в химии для измерения этих масс используют моли. В одном моле любого вещества по определению содержится одно и то же число атомов (примерно 6,022·1023). Это число (число Авогадро) выбрано таким образом, что если масса элемента равна 1 а. е. м., то моль атомов этого элемента будет иметь массу 1 г. Например, углерод имеет массу 12 а. е. м., поэтому 1 моль углерода весит 12 г.[13]
Размер
Атомы не имеют отчётливо выраженной внешней границы, поэтому их размеры определяются по расстоянию между ядрами соседних атомов, которые образовали химическую связь (Ковалентный радиус) или по расстоянию до самой дальней из стабильных орбит электронов в электронной оболочке этого атома (Радиус атома). Радиус зависит от положения атома в периодической системе, вида химической связи, числа ближайших атомов (координационного числа) и квантово-механического свойства, известного как спин.[17] В периодической системе элементов размер атома увеличивается при движении сверху вниз по столбцу и уменьшается при движении по строке слева направо.[18] Соответственно, самый маленький атом — это атом гелия, имеющий радиус 32 пм, а самый большой — атом цезия (225 пм).[19] Эти размеры в тысячи раз меньше длины волны видимого света (400—700 нм), поэтому атомы нельзя увидеть в оптический микроскоп. Однако отдельные атомы можно наблюдать с помощью сканирующего туннельного микроскопа.
Малость атомов демонстрируют следующие примеры. Человеческий волос по толщине в миллион раз больше атома углерода.[20] Одна капля воды содержит 2 секстиллиона (2·1021) атомов кислорода, и в два раза больше атомов водорода.[21] Один карат алмаза с массой 0,2 г состоит из 10 секстиллионов атомов углерода.[22] Если бы яблоко можно было увеличить до размеров Земли, то атомы достигли бы исходных размеров яблока.[23]
Учёные из Харьковского физико-технического института представили первые в истории науки снимки атома. Для получения снимков учёные использовали электронный микроскоп, фиксирующий излучения и поля (field-emission electron microscope, FEEM). Физики последовательно разместили десятки атомов углерода в вакуумной камере и пропустили через них электрический разряд в 425 вольт. Излучение последнего атома в цепочке на фосфорный экран позволило получить изображение облака электронов вокруг ядра.[24]
Радиоактивный распад
Диаграмма времени полураспада (T½) в секундах для различных изотопов с Z протонами и N нейтронами.У каждого химического элемента есть один или более изотопов с нестабильными ядрами, которые подвержены радиоактивному распаду, в результате чего атомы испускают частицы или электромагнитное излучение. Радиоактивность возникает, когда радиус ядра больше радиуса действия сильных взаимодействий (расстояний порядка 1 фм[25]).
Существуют три основные формы радиоактивного распада[26][27]:
- Альфа-распад происходит, когда ядро испускает альфа-частицу — ядро атома гелия, состоящее из двух протонов и двух нейтронов. В результате испускания этой частицы возникает элемент с меньшим на два атомным номером.
- Бета-распад происходит из-за слабых взаимодействий, и в результате нейтрон превращается в протон или наоборот. В первом случае происходит испускание электрона и антинейтрино, во втором — испускание позитрона и нейтрино. Электрон и позитрон называют бета-частицами. Бета-распад увеличивает или уменьшает атомный номер на единицу.
- Гамма-излучение происходит из-за перехода ядра в состояние с более низкой энергией с испусканием электромагнитного излучения. Гамма-излучение может происходить вслед за испусканием альфа- или бета-частицы после радиоактивного распада.
Каждый радиоактивный изотоп характеризуется периодом полураспада, то есть временем, за которое распадается половина ядер образца. Это экспоненциальный распад, который вдвое уменьшает количество оставшихся ядер за каждый период полураспада. Например, по прошествии двух периодов полураспада в образце останется только 25 % ядер исходного изотопа.[25]
Магнитный момент
Элементарные частицы обладают внутренним квантовомеханическим свойством известным как спин. Оно аналогично угловому моменту объекта вращающегося вокруг собственного центра масс, хотя строго говоря, эти частицы являются точечными и нельзя говорить об их вращении. Спин измеряют в единицах приведённой планковской постоянной (), тогда электроны, протоны и нейтроны имеют спин равный ½ . В атоме электроны обращаются вокруг ядра и обладают орбитальным угловым моментом помимо спина, в то время как ядро само по себе имеет угловой момент благодаря ядерному спину.[28]
Магнитное поле, создаваемое магнитным моментом атома, определяется этими различными формами углового момента, как и в классической физике вращающиеся заряженные объекты создают магнитное поле. Однако, наиболее значительный вклад происходит от спина. Благодаря свойству электрона, как и всех фермионов, подчиняться правилу запрета Паули, по которому два электрона не могут находиться в одном и том же квантовом состоянии, связанные электроны спариваются друг с другом, и один из электронов находится в состоянии со спином вверх, а другой — с противоположной проекцией спина — состояние со спином вниз. Таким образом магнитные моменты электронов сокращаются, уменьшая полный магнитный дипольный момент системы до нуля в некоторых атомах с чётным числом электронов.[29]
В ферромагнитных элементах, таких как железо, нечётное число электронов приводит к появлению неспаренного электрона и к ненулевому полному магнитному моменту. Орбитали соседних атомов перекрываются, и наименьшее энергетическое состояние достигается, когда все спины неспаренных электронов принимают одну ориентацию, процесс известный как обменное взаимодействие. Когда магнитные моменты ферромагнитных атомов выравниваются, материал может создавать измеримое макроскопическое магнитное поле. Парамагнитные материалы состоят из атомов, магнитные моменты которых разориентированы в отсутствии магнитного поля, но магнитные моменты отдельных атомов выравниваются при приложении магнитного поля.[29][30]
Ядро атома тоже может обладать ненулевым полным спином. Обычно при термодинамическом равновесии спины ядер ориентированы случайным образом. Однако, для некоторых элементов (таких как ксенон-129) возможно поляризовать значительную часть ядерных спинов для создания состояния с сонаправленными спинами —состояния называемого гиперполяризацией. Это состояние имеет важное прикладное значение в магнитно-резонансной томографии.[31][32]
Энергетические уровни
Когда электрон находится в связанном состоянии в атоме, он обладает потенциальной энергией, которая обратно пропорциональна его расстоянию от ядра. Эта энергия обычно измеряется в электронвольтах (эВ) и равна энергии, которую надо передать электрону, чтобы сделать его свободным (оторвать от атома). Согласно квантовомеханической модели атома связанный электрон может занимать только дискретный набор разрешённых энергетических уровней — состояний с определённой энергией. Наинизшее из разрешённых энергетических состояний называется основным, а все остальные — возбуждёнными.[33]
Для перехода электрона с одного энергетического уровня на другой нужно передать ему или отнять у него энергию. Это происходит путём соответственно поглощения или испускания фотона, причём энергия этого фотона равна абсолютной величине разности энергий начального и конечного уровней электрона. Энергия испущенного фотона пропорциональна его частоте, поэтому переходы между разными энергетическими уровнями проявляются в различных областях электромагнитного спектра.[34] Каждый элемент имеет уникальный спектр испускания, который зависит от заряда ядра, заполнения электронных подоболочек, взаимодействия электронов, а также других факторов.[35]
Пример линейного спектра поглощенияКогда излучение с непрерывным спектром проходит через вещество (например, газ или плазму), некоторые фотоны поглощаются атомами или ионами, вызывая электронные переходы между энергетическим состояниями, разность энергий которых равна энергии поглощённого фотона. Затем эти возбуждённые электроны спонтанно переходят на уровень, лежащий ниже по энергии, снова испуская фотоны. Таким образом, вещество ведёт себя как фильтр, превращая исходный непрерывный спектр в спектр поглощения, в котором имеются серии тёмных полос. При наблюдении с тех углов, куда не направлено исходное излучение, можно заметить излучение с эмиссионным спектром, испускаемое атомами. Спектроскопические измерения энергии, амплитуды и ширины спектральных линий излучения позволяют определить вид излучающего вещества и физические условия в нём.[36]
Более детальный анализ спектральных линий показал, что некоторые из них обладают тонкой структурой, то есть расщеплены на несколько близких линий. В узком смысле «тонкой структурой» спектральных линий принято называть их расщепление, происходящее из-за спин-орбитального взаимодействия между спином и вращательным движением электрона.[37]
Взаимодействие магнитных моментов электрона и ядра приводит к сверхтонкому расщеплению спектральных линий, которое, как правило, меньше, чем тонкое.
Если поместить атом во внешнее магнитное поле, то также можно заметить расщепление спектральных линий на две, три и более компонент — это явление называется эффектом Зеемана. Он вызван взаимодействием внешнего магнитного поля с магнитным моментом атома, при этом в зависимости от взаимной ориентации момента атома и магнитного поля энергия данного уровня может увеличиться или уменьшиться. При переходе атома из одного расщеплённого состояния в другое будет излучаться фотон с частотой, отличной от частоты фотона при таком же переходе в отсутствие магнитного поля. Если спектральная линия при помещении атома в магнитное поле расщепляется на три линии, то такой эффект Зеемана называется нормальным (простым). Гораздо чаще в слабом магнитном поле наблюдается аномальный (сложный) эффект Зеемана, когда происходит расщепление на 2, 4 или более линий (аномальный эффект происходит из-за наличия спина у электронов). При увеличении магнитного поля вид расщепления упрощается, и аномальный эффект Зеемана переходит в нормальный (эффект Пашена — Бака).[38] Присутствие электрического поля также может вызвать сравнимый по величине сдвиг спектральных линий, вызванный изменением энергетических уровней. Это явление известно как эффект Штарка.[39]
Если электрон находится в возбуждённом состоянии, то взаимодействие с фотоном определённой энергии может вызвать вынужденное излучение дополнительного фотона с такой же энергией — для этого должен существовать более низкий уровень, на который возможен переход, и разность энергий уровней должна равняться энергии фотона. При вынужденном излучении эти два фотона будут двигаться в одном направлении и иметь одинаковую фазу. Это свойство используется в лазерах, которые могут испускать когерентный пучок света в узком диапазоне частот.[40]
Валентность
Внешняя электронная оболочка атома, если она не полностью заполнена, называется валентной оболочкой, а электроны этой оболочки называются валентными электронами. Число валентных электронов определяет то, как атом связывается с другими атомами посредством химической связи. Путём образования химических связей атомы стремятся заполнить свои внешние валентные оболочки.[41]
Чтобы показать повторяющиеся химические свойства химических элементов, их упорядочивают в виде периодической таблицы. Элементы с одинаковым числом валентных электронов формируют группу, которая изображается в таблице в виде столбца (движение по горизонтальному ряду соответствуют заполнению валентной оболочки электронами). Элементы, находящиеся в самом правом столбце таблицы, имеют полностью заполненную электронами внешнюю оболочку, поэтому они отличаются крайне низкой химической активностью и называются инертными или благородными газами.[42][43]
Дисперсионное притяжение
Важным свойством атома является его склонность к дисперсионному притяжению. Происхождение дисперсионных сил было объяснено в 1930 году Ф. Лондоном. Межатомное взаимодействие возникает вследствие флуктуаций заряда в двух атомах, находящихся близко друг от друга. Поскольку электроны движутся, каждый атом обладает мгновенным дипольным моментом, отличным от нуля. Если бы флуктуации электронной плотности в двух атомах были бы несогласованными, то не было бы результирующего притяжения между атомами. Однако мгновенный диполь на одном атоме наводит противоположно направленный диполь в соседнем атоме. Эти диполи притягиваются друг к другу за счёт возникновения силы притяжения, которая называется дисперсионной силой, или силой Лондона. Энергия такого взаимодействия прямо пропорциональна квадрату электронной поляризуемости атома α и обратно пропорциональна r6, где r — расстояние между двумя атомами.[44]
См. также
Примечания
- ↑ Атом — статья из Большой советской энциклопедии
- ↑ Демокрит // Школьная энциклопедия «Руссика». История Древнего мира / А. О. Чубарьян. — М.: Olma Media Group, 2003. — С. 281—282. — 815 с. — ISBN 5-948-49307-5
- ↑ http://www.ido.rudn.ru/nfpk/fizika/mkt/1.html Планетарная модель атома]
- ↑ Demtröder, 2002
- ↑ Woan, 2000
- ↑ MacGregor, 1992
- ↑ The Particle Adventure. Particle Data Group. Lawrence Berkeley Laboratory (2002). Архивировано из первоисточника 21 августа 2011. Проверено 3 января 2009.
- ↑ James Schombert. Elementary Particles. University of Oregon (18 апреля 2006). Архивировано из первоисточника 21 августа 2011. Проверено 3 января 2007.
- ↑ Howard S. Matis. The Isotopes of Hydrogen. Guide to the Nuclear Wall Chart. Lawrence Berkeley National Lab (9 августа 2000). Архивировано из первоисточника 21 августа 2011. Проверено 21 декабря 2007.
- ↑ Rick Weiss. Scientists Announce Creation of Atomic Element, the Heaviest Yet. Washington Post (17 октября 2006). Архивировано из первоисточника 21 августа 2011. Проверено 21 декабря 2007.
- ↑ 1 2 Sills, 2003
- ↑ Belle Dumé. Bismuth breaks half-life record for alpha decay. Physics World (23 апреля 2003). Архивировано из первоисточника 21 августа 2011. Проверено 21 декабря 2007.
- ↑ 1 2 Mills и др. (1993).
- ↑ Chung Chieh. Nuclide Stability. University of Waterloo (22 января 2001). Проверено 4 января 2007.
- ↑ Atomic Weights and Isotopic Compositions for All Elements. National Institute of Standards and Technology. Архивировано из первоисточника 21 августа 2011. Проверено 4 января 2007.
- ↑ G. Audi, A. H. Wapstra, C. Thibault. (2003). «The Ame2003 atomic mass evaluation (II)». Nuclear Physics A729: 337–676. Проверено 2008-02-07.
- ↑ R. D. Shannon. (1976). «Revised effective ionic radii and systematic studies of interatomic distances in halides and chalcogenides». Acta Crystallographica, Section A 32: 751. DOI:10.1107/S0567739476001551. Проверено 2007-01-03.
- ↑ Judy Dong. Diameter of an Atom. The Physics Factbook (1998). Архивировано из первоисточника 21 августа 2011. Проверено 19 ноября 2007.
- ↑ Zumdahl, 2002
- ↑ Small Miracles: Harnessing nanotechnology. Oregon State University (2007).(недоступная ссылка — история) Проверено 7 января 2007.(недоступная ссылка — история) — описывает толщину человеческого волоса как 105 нм и 10 углеродных атомов по толщине как 1 нм.
- ↑ «There are 2 000 000 000 000 000 000 000 (that’s 2 sextillion) atoms of oxygen in one drop of water—and twice as many atoms of hydrogen» // Padilla et al., 2002, p. 32
- ↑ Карат равен 200 миллиграмм. По определению, углерод-12 имеет 12 грамм на моль. Постоянная Авогадро равна 6,02·1023 атомов на моль.
- ↑ Feynman, 1995
- ↑ First Detailed Photos of Atoms. Inside Science News Service (14 сентября 2009).(недоступная ссылка — история) Проверено 16 сентября 2009.(недоступная ссылка — история)
- ↑ 1 2 Radioactivity. Splung.com. Архивировано из первоисточника 21 августа 2011. Проверено 19 декабря 2007.
- ↑ L’Annunziata (2003).
- ↑ Richard B. Firestone. Radioactive Decay Modes. Berkeley Laboratory (22 мая 2000). Архивировано из первоисточника 21 августа 2011. Проверено 7 января 2007.
- ↑ J. P. Hornak. Chapter 3: Spin Physics. The Basics of NMR. Rochester Institute of Technology (2006).(недоступная ссылка — история) Проверено 20 марта 2011.(недоступная ссылка — история)
- ↑ 1 2 Paul A. Schroeder. Magnetic Properties. University of Georgia (22 февраля 2000).(недоступная ссылка — история) Проверено 7 января 2007.(недоступная ссылка — история)
- ↑ Greg Goebel. [4.3] Magnetic Properties of the Atom. Elementary Quantum Physics. In The Public Domain website (1 сентября 2007). Архивировано из первоисточника 21 августа 2011. Проверено 7 января 2007.
- ↑ Lynn Yarris. (весна 1997). «Talking Pictures». Berkeley Lab Research Review. Проверено 2008-01-09.(недоступная ссылка — история)
- ↑ Liang, Haacke, 1999
- ↑ Bart J. Van Zeghbroeck. Energy levels. Shippensburg University (1998). Проверено 23 декабря 2007.
- ↑ Fowles, 1989
- ↑ W. C. Martin, W. L. Wiese. Atomic Spectroscopy: A Compendium of Basic Ideas, Notation, Data, and Formulas. National Institute of Standards and Technology (май 2007). Архивировано из первоисточника 21 августа 2011. Проверено 8 января 2007.
- ↑ Atomic Emission Spectra — Origin of Spectral Lines. Avogadro Web Site. Архивировано из первоисточника 21 августа 2011. Проверено 10 августа 2006.
- ↑ Richard Fitzpatrick. Fine structure. University of Texas at Austin (16 февраля 2007). Архивировано из первоисточника 21 августа 2011. Проверено 14 февраля 2008.
- ↑ Michael Weiss. The Zeeman Effect. University of California-Riverside (2001). Архивировано из первоисточника 21 августа 2011. Проверено 6 февраля 2008.
- ↑ Beyer, 2003
- ↑ Thayer Watkins. Coherence in Stimulated Emission. San José State University. Архивировано из первоисточника 21 августа 2011. Проверено 23 декабря 2007.
- ↑ William Reusch. Virtual Textbook of Organic Chemistry. Michigan State University (16 июля 2007). Архивировано из первоисточника 21 августа 2011. Проверено 11 января 2008.
- ↑ Husted Robert и др. Periodic Table of the Elements. Los Alamos National Laboratory (11 декабря 2003). Архивировано из первоисточника 21 августа 2011. Проверено 11 января 2008.
- ↑ Rudy Baum. It’s Elemental: The Periodic Table. Chemical & Engineering News (2003). Архивировано из первоисточника 21 августа 2011. Проверено 11 января 2008.
- ↑ Даниэльс Ф., Олберти Р. Физическая химия / под ред. К.В.Топчиевой. — М.: Мир, 1978. — С. 453. — 646 с.
Литература
- На английском языке
- Michael F. L’Annunziata. Handbook of Radioactivity Analysis. — 2003. — ISBN 0-12-436603-1
- H. F. Beyer, V. P. Shevelko. Introduction to the Physics of Highly Charged Ions. — CRC Press, 2003. — ISBN 0-75-030481-2
- Gregory R. Choppin, Jan-Olov Liljenzin, Jan Rydberg. Radiochemistry and Nuclear Chemistry. — Elsevier, 2001. — ISBN 0-75-067463-6
- J. Dalton. A New System of Chemical Philosophy, Part 1. — London and Manchester: S. Russell, 1808.
- Wolfgang Demtröder. Atoms, Molecules and Photons: An Introduction to Atomic- Molecular- and Quantum Physics. — 1st ed. — Springer, 2002. — ISBN 3-540-20631-0
- Richard Feynman. Six Easy Pieces. — The Penguin Group, 1995. — ISBN 978-0-140-27666-4
- Grant R. Fowles. Introduction to Modern Optics. — Courier Dover Publications, 1989. — ISBN 0-48-665957-7
- Mrinalkanti Gangopadhyaya. Indian Atomism: History and Sources. — Atlantic Highlands, New Jersey: Humanities Press, 1981. — ISBN 0-391-02177-X
- David L. Goodstein. States of Matter. — Courier Dover Publications, 2002. — ISBN 0-48-649506-X
- Edward Robert Harrison. Masks of the Universe: Changing Ideas on the Nature of the Cosmos. — Cambridge University Press, 2003. — ISBN 0-52-177351-2
- Tatjana Jevremovic. Nuclear Principles in Engineering. — Springer, 2005. — ISBN 0-38-723284-2
- James Lequeux. The Interstellar Medium. — Springer, 2005. — ISBN 3-540-21326-0
- Z.-P. Liang, E. M. Haacke. Encyclopedia of Electrical and Electronics Engineering: Magnetic Resonance Imaging / J. G. Webster. — John Wiley & Sons, 1999. — Т. 2. — P. 412—26. — ISBN 0-47-113946-7
- Malcolm H. MacGregor. The Enigmatic Electron. — Oxford University Press, 1992. — ISBN 0-19-521833-7
- Oliver Manuel. Origin of Elements in the Solar System: Implications of Post-1957 Observations. — Springer, 2001. — ISBN 0-30-646562-0
- Robert M. Mazo. Brownian Motion: Fluctuations, Dynamics, and Applications. — Oxford University Press, 2002. — ISBN 0-19-851567-7
- Ian Mills, Tomislav Cvitaš, Klaus Homann, Nikola Kallay, Kozo Kuchitsu. Quantities, Units and Symbols in Physical Chemistry. — 2nd ed. — Oxford: International Union of Pure and Applied Chemistry, Commission on Physiochemical Symbols Terminology and Units, Blackwell Scientific Publications, 1993. — ISBN 0-632-03583-8
- Richard Myers. The Basics of Chemistry. — Greenwood Press, 2003. — ISBN 0-31-331664-3
- Michael J. Padilla, Ioannis Miaoulis, Martha Cyr. Prentice Hall Science Explorer: Chemical Building Blocks. — Upper Saddle River, New Jersey USA: Prentice-Hall, 2002. — ISBN 0-13-054091-9
- Linus Pauling. The Nature of the Chemical Bond. — Cornell University Press, 1960. — ISBN 0-80-140333-2
- Jeremy I. Pfeffer, Shlomo Nir. Modern Physics: An Introductory Text. — Imperial College Press, 2000. — ISBN 1-860-94250-4
- Leonid Ivanovich Ponomarev. The Quantum Dice. — CRC Press, 1993. — ISBN 0-75-030251-8
- J. Kenneth Shultis, Richard E. Faw. Fundamentals of Nuclear Science and Engineering. — CRC Press, 2002. — ISBN 0-82-470834-2
- Robert Siegfried. From Elements to Atoms: A History of Chemical Composition. — DIANE, 2002. — ISBN 0-87-169924-9
- Alan D. Sills. Earth Science the Easy Way. — Barron’s Educational Series, 2003. — ISBN 0-76-412146-4
- Boris M. Smirnov. Physics of Atoms and Ions. — Springer, 2003. — ISBN 0-38-795550-X
- Dick Teresi. Lost Discoveries: The Ancient Roots of Modern Science. — Simon & Schuster, 2003. — P. 213—214. — ISBN 0-74-324379-X
- Graham Woan. The Cambridge Handbook of Physics. — Cambridge University Press, 2000. — ISBN 0-52-157507-9
- Charles Adolphe Wurtz. The Atomic Theory. — New York: D. Appleton and company, 1881.
- Marco Zaider, Harald H. Rossi. Radiation Science for Physicians and Public Health Workers. — Springer, 2001. — ISBN 0-30-646403-9
- Steven S. Zumdahl. Introductory Chemistry: A Foundation. — 5th ed. — Houghton Mifflin, 2002. — ISBN 0-618-34342-3
Ссылки
Атомы — урок. Химия, 8–9 класс.
Термин «атом» предложил Дж. Дальтон в начале \(19\) века. Он назвал атомами мельчайшие частицы, не изменяющиеся в химических реакциях.
Атомы — мельчайшие химически неделимые частицы, из которых состоят вещества.
На сегодняшний день известно \(118\) видов атомов. Более \(90\) из них существуют в природе, а остальные получены искусственно.
Атомы характеризуются:
- определёнными очень малыми размерами;
- определённой, тоже очень малой, массой;
- определённым строением.
Размеры атомов настолько малы, что увидеть их невозможно даже в самый мощный микроскоп. Радиусы атомов составляют \(0,046\)–\(0,25\) нм (\(1\) нм \(=\) 10−9 м). Самый маленький — атом гелия, а самый большой — франция.
Рис. \(1\). Атомы гелия и франция
Массы атомов тоже ничтожно малы. Так масса атома водорода составляет всего 1,67⋅10−24 г.
До конца \(19\)-го столетия атомы считали неделимыми частицами. Но учёные доказали, что атом имеет сложное строение.
Согласно современным представлениям каждый атом состоит из положительно заряженного ядра и движущихся вокруг него электронов. Электроны имеют отрицательный заряд и нейтрализуют положительный заряд ядра.
Ядро намного меньше самого атома. Так, радиус атома водорода составляет \(0,046\) нм, а радиус его ядра — всего \(0,00000065\) нм. В его состав входят ещё более мелкие частицы: протоны (\(p\)) и нейтроны (\(n\)). Протоны заряжены положительно и определяют заряд ядра. Нейтроны — частицы без заряда.
Заряд протона равен по величине заряду электрона, а число протонов в ядре равно числу электронов в атоме. Поэтому атомы нейтральны.
Атомы различаются между собой строением (числом содержащихся в них частиц), а также массой и размерами.
Рис. \(2\). Атом гелия
Рис. \(3\). Атом кислорода
В химических реакциях атомы не изменяются, а только перегруппировываются — объединяются в новых комбинациях.
Атом — мельчайшая химически неделимая электронейтральная частица вещества, состоящая из положительного ядра и отрицательных электронов.
Атомы не изменяются в химических реакциях, но существуют ядерные реакции, при протекании которых их строение изменяется.
Атомы редко встречаются в изолированном виде. Обычно они соединяются друг с другом в молекулы или более крупные структуры. Число вариантов соединения атомов практически бесконечно, и их относительно небольшое число приводит к образованию огромного количества разнообразных веществ.
Пример:
атомы кислорода образуют два вещества. Когда они соединяются попарно, то образуется кислород.
Рис. \(4\). Молекула кислорода
Если же три атома кислорода образуют молекулу, то образуется озон.
Рис. \(5\). Молекула озона
В молекулах атомы соединены друг с другом химическими связями.
Источники:
Рис. 1. Атомы гелия и франция © ЯКласс
Рис. 2. Атом гелия https://image.shutterstock.com/image-vector/ten-atoms-illustration-600w-1147406696.jpg
Рис. 3. Атом кислорода https://image.shutterstock.com/image-vector/ten-atoms-illustration-600w-1147406696.jpg
Рис. 4. Молекула кислорода https://image.shutterstock.com/image-vector/molecules-ozone-oxygen-process-photochemical-600w-171095117.jpg
Рис. 5. Молекула озона https://image.shutterstock.com/image-vector/molecules-ozone-oxygen-process-photochemical-600w-171095117.jpg
Российские химики нашли несоответствие в формуле нобелевского лауреата
https://ria.ru/20210407/elektrootritsatelnost-1727163698.html
Российские химики нашли несоответствие в формуле нобелевского лауреата
Российские химики нашли несоответствие в формуле нобелевского лауреата – РИА Новости, 21.04.2021
Российские химики нашли несоответствие в формуле нобелевского лауреата
Ученые из Сколтеха по-новому определили одно из фундаментальных химических понятий — электроотрицательность, и предложили свою шкалу для его оценки, которая… РИА Новости, 21.04.2021
2021-04-07T12:44
2021-04-07T12:44
2021-04-21T10:29
наука
сколковский институт науки и технологий
химия
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdnn21.img.ria.ru/images/155879/51/1558795189_0:25:3555:2025_1920x0_80_0_0_d01961a41c153d1a8e26628dc2946d68.jpg
МОСКВА, 7 апр — РИА Новости. Ученые из Сколтеха по-новому определили одно из фундаментальных химических понятий — электроотрицательность, и предложили свою шкалу для его оценки, которая отличается от классической шкалы Полинга. Статья опубликована в журнале Nature Communications.Электроотрицательность — количественная характеристика способности атома оттягивать к себе электроны других атомов. Это одно из важнейших понятий в химии, необходимое для объяснения многих свойств — от энергии химических связей и стабильности соединений до цвета и твердости кристаллов.Современное понятие об электроотрицательности атомов было введено американским химиком, нобелевским лауреатом Линусом Полингом в 1930-х годах. Он же предложил первую шкалу относительных атомных электроотрицательностей, основанную на способности атома притягивать электронную плотность. В химической связи более электроотрицательный атом получает дополнительные электроны, становясь отрицательно заряженными, в то время как менее электроотрицательный атом теряет электроны и становится положительно заряженным. Шкала Полинга охватывает значения от 0,7 для атомов франция до 4,0 для атомов фтора. Фтор — наиболее электроотрицательный элемент, за ним следует кислород со значением 3,5, потом азот, хлор и так далее. Полинг вывел свои значения электроотрицательности из термохимии, используя энергии некоторых химических связей. Он предложил простейшую формулу для расчета стабилизации связи из-за разницы в электроотрицательности между атомами. Однако со временем стало ясно, что формула Полинга дает довольно низкую точность.Поэтому различные ученые в разное время предлагали свои определения электроотрицательности, которые грубо можно разделить на спектроскопические — для изолированных атомов — и термохимические — характеризующие энергии связи и теплоты образования соединений.Российские химики из Сколтеха профессор Артем Оганов и исследователь Кристиан Тантардини внесли изменения в формулу Полинга и на ее основе создали новую термохимическую шкалу электроотрицательности. “Все началось с того, что мы решили вычислить электроотрицательность Полинга под давлением, — приводятся в пресс-релизе Сколтеха слова Артема Оганова. — Химия высоких давлений довольно экзотична. Тем не менее, вы, вероятно, сможете понять многое, как только узнаете, как электроотрицательность элементов изменяется под давлением. Мы использовали определение Полинга для расчета электроотрицательности в нормальных условиях и были поражены, обнаружив, что ее масштаб не соответствует ни теоретическим, ни экспериментальным энергиям связи. Более того, многие публикации в химической литературе упоминают об этом несоответствии, но ни одна не предлагает последовательного решения”. “Я понял, что основная причина заключалась в том, что Полинг рассматривал ионную стабилизацию молекулы как аддитивный эффект. Если рассматривать ее как мультипликативный эффект, то многие недостатки будут устранены. С помощью новой формулы и экспериментально полученных энергий химических связей мы определили электроотрицательность всех элементов и получили красивую шкалу, которая работает как для малых, так и для больших разностях в электроотрицательности”, — отмечает ученый.В новой формуле, в отличие от шкалы Полинга, электроотрицательность является безразмерной величиной и, по словам авторов, лучше описывает химические связи, энергии молекул и реакции.
https://ria.ru/20210204/magnony-1596017192.html
https://ria.ru/20201105/khimiya-1583166856.html
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2021
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
https://cdnn21.img.ria.ru/images/155879/51/1558795189_413:0:3144:2048_1920x0_80_0_0_147b5c917658c5d742890be50f3af8a3.jpgРИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
сколковский институт науки и технологий, химия
МОСКВА, 7 апр — РИА Новости. Ученые из Сколтеха по-новому определили одно из фундаментальных химических понятий — электроотрицательность, и предложили свою шкалу для его оценки, которая отличается от классической шкалы Полинга. Статья опубликована в журнале Nature Communications.Электроотрицательность — количественная характеристика способности атома оттягивать к себе электроны других атомов. Это одно из важнейших понятий в химии, необходимое для объяснения многих свойств — от энергии химических связей и стабильности соединений до цвета и твердости кристаллов.
Современное понятие об электроотрицательности атомов было введено американским химиком, нобелевским лауреатом Линусом Полингом в 1930-х годах. Он же предложил первую шкалу относительных атомных электроотрицательностей, основанную на способности атома притягивать электронную плотность. В химической связи более электроотрицательный атом получает дополнительные электроны, становясь отрицательно заряженными, в то время как менее электроотрицательный атом теряет электроны и становится положительно заряженным.
Шкала Полинга охватывает значения от 0,7 для атомов франция до 4,0 для атомов фтора. Фтор — наиболее электроотрицательный элемент, за ним следует кислород со значением 3,5, потом азот, хлор и так далее.
4 февраля, 14:39НаукаФизики получили новое состояние материиПолинг вывел свои значения электроотрицательности из термохимии, используя энергии некоторых химических связей. Он предложил простейшую формулу для расчета стабилизации связи из-за разницы в электроотрицательности между атомами. Однако со временем стало ясно, что формула Полинга дает довольно низкую точность.
Поэтому различные ученые в разное время предлагали свои определения электроотрицательности, которые грубо можно разделить на спектроскопические — для изолированных атомов — и термохимические — характеризующие энергии связи и теплоты образования соединений.
Российские химики из Сколтеха профессор Артем Оганов и исследователь Кристиан Тантардини внесли изменения в формулу Полинга и на ее основе создали новую термохимическую шкалу электроотрицательности.
“Все началось с того, что мы решили вычислить электроотрицательность Полинга под давлением, — приводятся в пресс-релизе Сколтеха слова Артема Оганова. — Химия высоких давлений довольно экзотична. Тем не менее, вы, вероятно, сможете понять многое, как только узнаете, как электроотрицательность элементов изменяется под давлением. Мы использовали определение Полинга для расчета электроотрицательности в нормальных условиях и были поражены, обнаружив, что ее масштаб не соответствует ни теоретическим, ни экспериментальным энергиям связи. Более того, многие публикации в химической литературе упоминают об этом несоответствии, но ни одна не предлагает последовательного решения”.
“Я понял, что основная причина заключалась в том, что Полинг рассматривал ионную стабилизацию молекулы как аддитивный эффект. Если рассматривать ее как мультипликативный эффект, то многие недостатки будут устранены. С помощью новой формулы и экспериментально полученных энергий химических связей мы определили электроотрицательность всех элементов и получили красивую шкалу, которая работает как для малых, так и для больших разностях в электроотрицательности”, — отмечает ученый.
В новой формуле, в отличие от шкалы Полинга, электроотрицательность является безразмерной величиной и, по словам авторов, лучше описывает химические связи, энергии молекул и реакции.
5 ноября 2020, 13:44НаукаРоссийские химики раскрыли смысл загадочных менделеевских чиселАтом / Философский словарь
Атом
(Atom; от греч. atomon — «неделимое») — греческие философы Левкипп и Демокрит, а вслед за ними Эпикур называли атомами мельчайшие составные частицы материи, из которых состоит все сущее, в том числе душа, образованная из тончайших атомов. Атомы вечны, они не возникают и не исчезают, пребывая в постоянном движении; различаются по форме и величине, порядку и положению. В XVII в. Сеннерт и Гассенди возродили это учение, атомизм; Бойль и в особенности Дальтон («Новая система философии химии», 1808) ввели понятие атома в химию, что оказалось для неё весьма плодотворным. В настоящее время атом является предметом исследования со стороны физики (атомная физика). Оказалось, что атом не неделим. Согласно бытующим в атомной физике модельным представлениям, он имеет сферическую, планетообразную структуру (см. Микрофизика).Ядро атома состоит из протонов и нейтронов; оно окружено электронной оболочкой. Число протонов равно порядковому номеру данного химического элемента, число нейтронов равно разности между атомным весом и порядковым номером. Диаметр атома равен 10-8 см, диаметр ядра — 10-12 см. В ядре сосредоточена вся масса атома, так что если мысленно представить себе электронные оболочки отсутствующими, то Земля, при сохранении того же веса, оказалась бы шаром с диаметром, равным 320 м. Подобные наглядные представления являются, однако, вторичными в исследованиях современных представителей атомной физики, которые все атомарные структуры и взаимосвязи воспроизводят лишь на языке математических формул. Атом можно «расщепить», «выбивая» из ядра с помощью продуктов распада радиоактивных элементов протоны и нейтроны (которые в свою очередь могут быть разложены на мезоны).
При этом высвобождается огромное количество энергии, которая применяется в первую очередь для производства электрического тока (для работы электростанции мощностью в 100 000 кВт ежедневно требуется 400 г расщепляемого урана вместо 800 т каменного угля), для производства атомных бомб и для судовых силовых установок; см. также Волновая механика. По аналогии с атомистическим рассмотрением материи говорят о логическом атомизме (Б. Рассел), согласно которому логические предложения путём исчерпывающего анализа можно свести к конечным элементарным предложениям (элементарным мыслям). Л. Витгенштейн говорил о «логических атомах» мира.
Смотрите также:
Микрофизика
Концепций – Атомы
Атомы очень и очень маленькие. С ядром протоны (или протоны и нейтроны) и на орбите электроны, атомы составляют фундаментальные элементы Вселенная. А атомы можно разбить на их собственные основные части, такие элементы, как водород или Сера не может быть разделена на «меньшие» элементы – таким образом являются фундаментальными.
Все элементы составляют то, что мы называем Периодической таблицей элементов.Этот инструмент подробно описывает информацию о каждом элемент, например, сколько компонентов протонов, нейтроны и электроны есть.
Лучший источник периодической таблицы Менделеева в Интернете. Элементы Веб-элементы.
Молекула – это совокупность элементов. An Например, молекула воды: H 2 O – два части водорода, одна часть кислорода.
Подробнее о специфике элементов находится на Веб-сайт веб-элементов.Цель этого раздел – посетить типичный атом. Мы кратко посещение:
Уровни энергии
Ионизация
Изотопы
Уровни энергии:
| Атом состоит как минимум из одной части:
протон. Эта положительно заряженная частица
находится в центре атома. В
атомный вес элемента зависит от
сколько протонов в атоме. Это модель атома Бора, названная после Нильса Бора. Модель Бора разработана чтобы продемонстрировать, как поглощение и излучение линии появляются в спектрах, полученных от Солнца. |
Атом состоит из нескольких возможных орбит для электрон. Орбита зависит от энергии электрон:
Когда электрон поглощает фотон (пакет свет), электрон набирает энергию и движется вверх на орбита.На изображении выше показан атом водорода. с 4-мя возможными орбитами (их может быть больше). Только один электрон может одновременно находиться на одной орбите (фактически, два электрона могут занимать орбиту, пока они имеют разную “раскрутку” – см. Квантовая физика раздел).
Когда электрон набирает энергию и движется вверх по орбите возникает спектр поглощения. Когда электрон теряет энергию и движется обратно по орбите, возникают спектры излучения (см. Спектроскопия).
Эти уровни энергии следуют схеме:
На самом деле существует три конкретных серии излучения. линии:
- Серия Бальмера – происходит выброс в видимом спектре
- Серия Лаймана – происходит выброс в ультрафиолетовом спектре
- Серия Пашена – происходит выброс в инфракрасном спектре
Вот посмотрите на частоты Линии Balmer:
Вернуться к началу
Ионизация:
Иногда, если энергия поглощенного фотона электроном больше разрешенного энергетические уровни орбит, электрон будет быть убранным этим фотон.Это называется ионизация. Для атома водорода бесконечное орбита имеет разрешенную энергию 13,6 эВ. Если энергия фотонов больше этой, ионизация происходит:
Что касается водорода, то атом водорода в его нормальное состояние также называется H I. Атом водорода который был лишен своего электрона, также называется H II. Астрономы используют H I и H II, чтобы помочь в изучении межзвездного мусора и пылевых облаков.
Вернуться к началу
Изотопы:
An изотоп – это элемент (атом), имеющий дополнительные нейтроны. Атом водорода, то есть ваш стандартный водород в комплекте с электроном, есть только протон. Однако водород может иметь добавил к нему нейтрон. Нейтрон – это частица который не имеет заряда, поэтому он не добавляет атомный вес.Атом водорода, у которого есть один нейтрон называется дейтерием.
Дейтерий = 2 H
В соответствии с Википедия дейтерий – встречающийся в природе элемент – примерно 1 из 6500 атомы водорода – дейтерий. Дейтерий – это считается стабильным изотопом в том смысле, что нейтрон не распадется. Любой элемент, теряющий нейтроны нестабильно и, как говорят, распадается – также Знаю, как радиоактивность.
Наверх
Определение атома – Вселенная сегодня
[/ caption] Определение атома: Единица материи, наименьшая единица элемента, имеющая все характеристики этого элемента и состоящая из плотного центрального положительно заряженного ядра, окруженного системой электронов. Вся структура имеет приблизительный диаметр 10 -8 сантиметров и, как правило, остается неразделенной в химических реакциях, за исключением ограниченного удаления, переноса или обмена определенных электронов.По сути, это наименьшая возможная часть элемента, которая все еще остается элементом.
В нормальных условиях атом можно разбить на любые более мелкие частицы, но мы, люди, изобрели способы разбить атом на части. В этом вся основа атомной бомбы, коллайдеров частиц и кварков. Чтобы разбить атом, требуется высокая скорость и высокая энергия, чтобы разбить частицы. Коллайдер частиц делает это и помогает нам понять некоторые теории физики элементарных частиц. Результаты атомной бомбы широко известны.Кварки – это чрезвычайно маленькие частицы, которые существуют не одни. Они должны сгруппироваться, чтобы сформировать протоны, электроны и нейтроны, обычно присутствующие в одном атоме элемента. Они были обнаружены только в результате использования коллайдера частиц и теоретически.
Сам атом состоит из трех крошечных видов частиц, называемых субатомными частицами: протонов, нейтронов и электронов. Протоны и нейтроны составляют центр атома, называемый ядром, а электроны летают над ядром в небольшом облаке.Электроны несут отрицательный заряд, а протоны несут положительный заряд. В нормальном (нейтральном) атоме количество протонов и количество электронов равны. Часто, но не всегда, количество нейтронов тоже одинаково. Противодействующие силы (отрицательные и положительные) притягивают и отталкивают друг друга правильным образом, чтобы удерживать атом вместе. Вселенную можно рассматривать как один большой атом. Все в космосе как раз притягивает и отталкивает, чтобы удерживать единое целое.
Один из типов теоретических космических аппаратов с ионной двигательной установкой должен был бы использовать преимущества этого атомного притяжения и отталкивания для своей работы.Он использует магнетизм и электричество, чтобы продвигать корабль в космосе. Электричество, вырабатываемое солнечными панелями корабля, дает положительный электрический заряд атомам внутри камеры. Под действием магнетизма они притягиваются к задней части корабля, а затем под действием магнитного отталкивания выталкиваются из корабля. Этот устойчивый поток атомов, выходящий из космического корабля, дает ему тягу, необходимую для продвижения вперед в космосе. НАСА провело испытания других типов ионных двигателей и обнаружило их недостаток.
Вот еще одно определение атома.Здесь, в Universe Today, у нас есть отличная статья об атомах. У Astronomy Cast есть хороший эпизод вопросов и ответов о межзвездных путешествиях, включая ссылку НАСА об ионном двигателе.
Источник:
Википедия
Как это:
Нравится Загрузка …
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно.Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в cookie-файлах может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Наука об электричестве – Управление энергетической информации США (EIA)
Все состоит из атомов
Для понимания электричества будет полезна некоторая основная информация об атомах.Атомы – это строительные блоки вселенной. Все во Вселенной состоит из атомов – каждая звезда, каждое дерево и каждое животное. Человеческое тело состоит из атомов. Воздух и вода тоже состоят из атомов. Атомы настолько малы, что миллионы их поместятся на булавочной головке.
Атомы состоят из еще более мелких частиц
Центр атома называется ядром . Ядро состоит из частиц, называемых протонов, и нейтронов, . Электроны вращаются вокруг ядра в оболочках . Если бы ядро было размером с теннисный мяч, атом был бы размером со сферу диаметром около 1450 футов или размером с один из крупнейших спортивных стадионов в мире. Атомы – это в основном пустое пространство.
Если бы невооруженный глаз мог видеть атом, он был бы немного похож на крошечное скопление шаров, окруженное гигантскими невидимыми пузырями (или оболочек ). Электроны будут на поверхности пузырьков, постоянно вращаясь и перемещаясь, чтобы держаться как можно дальше друг от друга.Электроны удерживаются в своих оболочках за счет электрической силы.
Протоны и электроны атома притягиваются друг к другу. Оба они несут электрический заряд . Протоны имеют положительный заряд (+), а электроны – отрицательный заряд (-). Положительный заряд протонов равен отрицательному заряду электронов. Противоположные заряды притягивают друг друга. Атом находится в равновесии, когда в нем равное количество протонов и электронов.Нейтроны не несут заряда, и их количество может меняться.
Число протонов в атоме определяет вид атома, или элемент , это. Элемент – это вещество, состоящее из одного типа атомов. Периодическая таблица элементов показывает элементы с их атомными номерами – количеством протонов, которые они имеют. Например, каждый атом водорода (H) имеет один протон, а каждый атом углерода (C) имеет шесть протонов.
Электричество – это движение электронов между атомами
Электроны обычно остаются на постоянном расстоянии от ядра атома в точных оболочках.Ближайшая к ядру оболочка может содержать два электрона. Следующий снаряд может вместить до восьми штук. Внешние оболочки могут вместить даже больше. Некоторые атомы с множеством протонов могут иметь до семи оболочек с электронами в них.
Электроны в ближайших к ядру оболочках обладают сильной силой притяжения к протонам. Иногда электроны в самых внешних оболочках атома не обладают сильной силой притяжения к протонам. Эти электроны можно вытолкнуть со своих орбит.Применение силы может заставить их переходить от одного атома к другому. Эти перемещающиеся электроны представляют собой электричество.
Статическое электричество существует в природе
Молния – это форма электричества. Молния – это электроны, перемещающиеся из одного облака в другое, или электроны, прыгающие из облака на землю. Вы когда-нибудь испытывали шок, когда дотрагивались до предмета после прогулки по ковру? От этого объекта к вам прыгнул поток электронов. Это называется статическим электричеством .
Вы когда-нибудь заставляли волосы встать дыбом, натирая их воздушным шариком? Если да, то вы стерли с воздушного шара несколько электронов. Электроны переместились в ваши волосы из воздушного шара. Электроны пытались уйти подальше друг от друга, двигаясь к кончикам ваших волос. Они толкались или отталкивались друг от друга, заставляя ваши волосы шевелиться. Подобно тому, как противоположные заряды притягиваются друг к другу, как заряды отталкиваются.
Последнее обновление: 8 января 2020 г.
Эволюция концепции атома
предыдущий дом следующий
Майкл Фаулер, Университет Вирджинии
Ранние греческие идеи
Первыми «теоретиками-атомщиками», о которых мы знаем, были двое греки пятого века до нашей эры, Левкипп Милетский (город в настоящее время в Турции) и Демокрит Абдерский.Их теории, естественно, были более философскими, чем экспериментальный по происхождению. Основная идея заключалась в том, что если бы вы могли смотреть на материю все меньшие и меньшие масштабы (что они, конечно, не могли) в конечном итоге вы бы увидеть отдельные атомов – объект, которые нельзя разделить дальше (это было определение атома). Все было составлено из этих атомов, которые двигались вокруг в пустоте (вакууме). Различные физические свойства – цвет, вкус, и так далее – материалов возникло потому, что атомы в них имели разную форму и / или расположения и ориентации относительно друг друга.
Это все было чистое предположение, но физические изображения описанные иногда кажутся невероятно точными. Например, вот цитата из Лукреций, современник Юлия Цезаря, по идеям Эпикура, который был последователь Демокрита:
… присмотритесь, как только попадут лучи, и залейте солнечный свет сквозь темные места в домах … вы увидите множество частиц там, возбужденные невидимыми ударами, меняют курс и поворачивают назад, гонимые назад на их пути, то теперь сюда, то теперь, во всех направлениях и везде.Возможно, вы знаете, что это смещающееся движение исходит от всех атомов *. Во-первых, атомы вещей движутся сами по себе; затем те тела, которые образованы крошечным союзом и как бы наиболее близки к силам атомы поражены и потрясены их невидимыми ударами, и они, в свою очередь, разбудить тела чуть крупнее. И так движение идет вверх от атомов, и мало-помалу приходит в наши чувства, так что эти тела тоже двигаться, что мы можем различить в солнечном свете; но это не ясно видно какие удары они это делают.
(* позвонил «Первые начинания» Лукреция – мы поместим «атомы», он имел в виду то же самое.)
Возможно ли, что у некоторых молодых греков было достаточно острое зрение? увидеть броуновское движение?
Эти греческие философы считали, что атомы постоянное движение, и всегда было, по крайней мере, в газах и жидкостях. Иногда, однако, в результате их плотно закрывающейся формы, они соединялись в плотно упакованные соединения, формовочные материалы, такие как камень или железо. По сути, Демокрит и его у последователей была очень механическая картина Вселенной.Они думали, что все природные явления в принципе можно понять с точки зрения взаимодействия, обычно движущиеся, атомы. Это не оставляло места для вмешательства богов. Их атомные картина включала разум и даже душу, поэтому не сохранилась смерть. Фактически это была веселая альтернатива популярным религиям день, в который боги постоянно вмешивались, часто неприятными способами, и смерти следовало бояться, потому что за ней обязательно последуют наказания.
Небольшой концептуальный прогресс в теории атома был достигнут. следующие две тысячи лет, во многом потому, что Аристотель дискредитировал его, и его взгляды господствовали в Средние века.
Галилео
С эпохой Возрождения дела пошли на поправку. Галилео верил в атомы, хотя, как и первые греки, казалось, путал идея физической неделимости с идеей нулевой пространственной протяженности, т. е. математическая точка. Тем не менее его идеи в этой области, по-видимому, попал в теологическую горячую воду. Церковь считала, что доктрина пресуществление – вера в то, что хлеб и вино буквально стали телом и кровь Христа – в это трудно было поверить, если бы все было составлено из атомы.Это было отголоском напряженности между атомами и религией две тысячи годами ранее.
Теория атомов Галилея была не очень хорошо развита. Он производит впечатление местами они были бесконечно малы ( Two New Sciences , стр. 51, 52), и ввиду его прекрасного понимания размерных масштабируя аргументы, он мог подумать, что вакуумное всасывание между бесконечно малых поверхностей было бы достаточно, чтобы удерживать твердые тела вместе, поскольку объекты меньшего размера имеют пропорционально большую поверхность.Конечно, это было на неправильный трек. (По иронии судьбы, вскоре после смерти Галилея его ученик Торричелли был первым, кто понял, что сила всасывания на самом деле является результатом действия воздуха давление от веса атмосферы.)
Ньютон
Гораздо более современный взгляд на атомы и межатомное пространство. силы были изложены позже в семнадцатом веке Исааком Ньютоном, который писал ( Opticks , Книга 3, Часть 1):
Квест. 31. Не имейте мелких частиц тел определенные Силы, Добродетели или Силы, с помощью которых они действуют на расстоянии, а не только на Лучи Света для отражения, преломления и отклонения их, но также друг на друга для создания большой части явлений природы? Для хорошо известно, что тела действуют друг на друга посредством притяжения Гравитация, магнетизм и электричество; и эти экземпляры показывают тенор и Естественным путем, и не исключено, что есть более привлекательные Силы, чем эти….Ибо мы должны узнать из явлений природы, что Тела притягиваются друг к другу, и каковы законы и свойства Влечение, прежде чем мы исследуем Причину, по которой происходит влечение. Аттракционы гравитации, магнетизма и электричества достигают очень разумного расстояния, и так наблюдались вульгарными глазами, а могут быть и другие которые достигают столь малых расстояний, что до сих пор ускользают от наблюдения, и, возможно, электрическое притяжение может достигать таких малых расстояний, даже не будучи возбуждается трением.
На самом деле, хотя силы, связывающие атомы вместе в молекулы невозможно правильно понять без квантовой механики, многие из эти силы – это электрические силы «ближнего действия» – силы между телами. имеют общую электрическую нейтральность, но искажают распределение заряда. Эти сил определенно можно отнести к категории «электрическое притяжение, достигающее небольшие расстояния ». Обратите внимание, что Ньютон также оставляет дверь открытой для других силы ближнего действия, которые были наконец открыты в 1930-х годах!
Ньютон продолжает утверждать, что, допуская существование силы притяжения между частицами предлагают очень естественные объяснения различных явления типа физической химии, такие как плавучесть, легкость перегонки и теплота смешивания:
Ибо, когда соль винного камня течет по Деликвиуму, разве это не осуществляется притяжением между частицами соли винного камня и Частицы воды, которые плавают в воздухе в виде паров? … А также откуда она, как не от этой привлекательной Силы, та Вода, которая одна извлекает на мягком теплом огне, вы не сможете отогнать соль винного камня без сильная жара? … И когда вода и масло купороса последовательно лились в тот же Сосуд становится очень горячим при перемешивании, разве эта жара не спорит с большим Движение частей спиртных напитков? И разве это Движение не утверждает, что Части двух спиртных напитков при смешивании сливаются с насилием, и, как следствие, несутся навстречу друг другу ускоренным движением?
Очевидно, Ньютон уже понял, что тепло молекулярное движение, и как такое тепло генерируется, когда разнородные молекулы, притягиваются друг к другу, смешиваются, поэтому их потенциальная энергия переводится в кинетическую энергии, когда они движутся навстречу друг другу.
Наконец, я не могу удержаться от следующей цитаты сэра Исаака:
Квест. 30. Не являются крупногабаритными кузовами и легкими кабриолетами. друг в друга, и Органы могут не получать большую часть своей Деятельности от Частицы Света, входящие в их состав?… Изменение тел. в свет и свет в тела очень соответствует естественному ходу. который, кажется, в восторге от Трансмутаций…
(Конечно, несмотря на всю эту ньютоновскую проницательность, мы не должны увлечься: Ньютон не верил в кинетическую теорию газов – он думал, что атомы в газе более или менее статичны, давление, возникающее из-за взаимное отталкивание между соседними атомами.Он также твердо верил, что свет состоит из частиц, а не волн, хотя, оглядываясь назад, может быть, и не так неправильно.)
Предварительная химия
Трудно представить современную химию, не задумываясь. в терминах атомов – центральное понятие, химическая реакция, выражается как уравнение, показывающее, как атомы, некоторые из которых находятся в молекулах, становятся несвязанными, связанными или менять партнеров для образования различных наборов молекул и атомов, высвобождая или поглощая энергию в процессе.
Вышеупомянутые цитаты Ньютона звучат так, будто он правильный путь, не рассказывай всю историю.Он думал, что часть химии (особенно физическая часть) можно объяснить с точки зрения механики тельца, но было что-то более важное – жизненный дух, который был основой жизни, а также как-то связан с Меркурий; по крайней мере, такое впечатление у меня складывается, просматривая некоторые из его алхимические работы. Не то чтобы это слишком важно для разработки Речь идет об атомарной концепции. Алхимики в своем бесплодном стремлении превратить привести в золото (и найти эликсир жизни и т. д.) очень умел управляя большим разнообразием химических реакций, и таким образом изучил свойства многих веществ.
Точка зрения алхимиков основана на четырех элементы, земля, воздух, огонь и вода, но они добавили принципов. Например, в воздухе было активное начало, важное для дыхания и горения. Было кислотное начало. А потом был флогистон. Смотря на что-то в огне, кажется довольно очевидным, что что-то ускользает от материал.Это они назвали флогистоном. После того, как Бойль обнаружил, что металлы стали на тяжелее при сгорании, было решено, что флогистон имеет отрицательный вес.
Лавуазье
Первый крупный шаг к современной количественной химии был захвачен Лавуазье ближе к концу восемнадцатого века. Он понял это горение было химической реакцией между горящим материалом и компонент воздуха. Он проводил реакции в закрытых сосудах, так что он может отслеживать количество различных задействованных реагентов.Один из его великие открытия заключались в том, что при реакциях общий конечный вес всех задействованных материалов в точности равна общему начальному весу . Это было первый шаг на пути к пониманию химии в терминах атомов. Он также установлено, что чистая вода была , а не преобразована в землю при нагревании, как давно считалось – остатки, оставшиеся после кипячения, произошли от емкость, если вода была чистой.
Лавуазье открыл кислород. Он первым понял этот воздух состоит из двух (основных) компонентов, только один из которых поддерживает дыхание, смысл жизни и горения.В 1783 году, работая с математиком Лапласом, и морскую свинку в маске, он количественно проверил, что животное использовало вдыхал кислород, чтобы сформировать то, что мы теперь называем углекислым газом (это происхождение «морской свинки» в качестве объекта эксперимента).
Лавуазье ужесточил очень свободную терминологию, используемую в в то время: не было общепринятых определений элементов, принципов или атомов, хотя столетием ранее Бойль предположил, что элемент быть зарезервировано для веществ, которые не могут быть далее химически разделены.
В своих Элементах химии (1789) Лавуазье пишет:
… если под термином элементы мы подразумеваем выражение тех простые и неделимые атомы, из которых состоит материя, чрезвычайно вероятно, что мы ничего о них не знаем; но если мы применим термин элементы , или принципы тел , чтобы выразить наше представление о последнем пункте, который анализ способен достичь, мы должны признать в качестве элементов все вещества в которые мы способны любыми способами сводить тела путем разложения.Нет что мы вправе подтвердить, что эти вещества, которые мы считаем простыми, могут не состоять из двух или даже большего числа принципов; но с тех пор эти принципы не могут быть разделены, или, скорее, поскольку мы до сих пор не открыли способы их разделения, они действуют в отношении нас как простые вещества, и мы никогда не должны предполагать, что они составлены, пока эксперимент и наблюдения доказали, что это так.
Итак, Лавуазье начал современное изучение химии: он настаивал на точной терминологии и точных измерениях и предлагал как В части повестки дня классификация веществ на элементов и соединения.Когда эта программа действительно началась, атомная интерпретация вскоре появился.
К несчастью для химии, через пять лет после этой книги Оказалось, что Лавуазье отправился на гильотину. В дореволюционной Франции государственный сбор налогов был приватизирован, и Лавуазье был одним из самых непопулярные «налогоплательщики». Немногие из них пережили революцию. Лавуазье был также обвинялся в антифранцузской деятельности, в том, что он переписывался с иностранцы. Дело в том, что вся переписка была обменом научными газеты не произвели впечатления на революционеров, которые отметили, что «республика имеет не нужны ученые », когда они отправили его на гильотину.
Далтон
Джон Далтон (1766-1844) родился в бедной семье недалеко от Манчестер, Англия. В какой-то мере он поддерживал себя, обучая возраст двенадцати лет. Дальтон написал A New System of Chemical Philosophy , из из которых взяты следующие цитаты:
Материя, хотя и делится на крайнюю степень , является тем не менее не бесконечно делимое. То есть должна быть какая-то точка за пределы которого мы не можем выйти в делении материи.Существование этих Вряд ли можно сомневаться в конечных частицах материи, хотя они, вероятно, слишком мал, чтобы его можно было показать микроскопическими улучшениями. Я выбрал слово атом для обозначения этих элементарных частиц….
Он предположил, что все атомы элемента идентичны, и атомы одного элемента не могут быть преобразованы в атомы другого элемента « путем любая сила, которую мы можем контролировать ». Далее он предположил, что соединения элементов имеют атомы соединения:
Я называю элементарную частицу угольной кислоты соединением атом .Теперь, хотя этот атом можно разделить, он перестает быть угольным. кислота, распадающаяся при таком разделении на древесный уголь и кислород .
Он также утверждал, что все составные атомы (молекулы, как мы сказал бы) для определенного соединения были идентичны, и, кроме того: « Chemical анализ и синтез не идут дальше, чем разделение на частицы. от другого и до их воссоединения. Нет создания или разрушения материи внутри досягаемость химического агентства ».
Ко времени Дальтона стало ясно, что когда элементы объединяются в определенное соединение, они всегда образуют одно и то же соотношение по весу.Например, когда водород сгорает в кислороде с образованием воды, один грамм водорода соединяется с восемью граммами кислорода. Это постоянство должно быть ожидается в теории Дальтона, предположительно составной атом или молекула вода имеет фиксированное количество атомов водорода и фиксированное количество кислорода. атомы. Конечно, весовое соотношение не дает нам цифр, поскольку мы не знать относительный вес атома водорода и атома кислорода. Сделать любой прогресс, необходимы некоторые предположения. Далтон предложил правило величайшего простота: если два элемента образуют только одно соединение, предположим, что составной атом имеет только один атом каждого элемента.Поскольку H 2 O 2 не было было обнаружено, он предположил, что вода была HO. (На самом деле он использовал символы, чтобы представляют собой элементы, H – круг с точкой в центре. Однако просто как и мы, он использовал цепочки таких символов для представления реальной молекулы, а не макроскопическая смесь.) Собрав данные по множеству различных реакций, Дальтону стало очевидно, что правило величайшей простоты не обязательно правильно, к 1810 году он предположил, что молекула воды, возможно, содержал три атома.
предыдущий дом следующий
RadTown Radioactive Atom: информация для учителя
Активность радиоактивного атома
Атомы – это основные строительные блоки всей материи. Ионизирующее излучение может исходить от нестабильных (радиоактивных) атомов или производиться машинами. Когда нестабильные атомы распадаются и пытаются стать стабильными, ядра выделяют энергию в виде ионизирующего излучения (альфа-частицы, бета-частицы и гамма-лучи). Выделяемая энергия называется ионизирующим излучением, потому что у нее достаточно энергии, чтобы сбить прочно связанные электроны с орбиты атома.Это заставляет атом стать заряженным ионом.
На этой странице:
Справочная информация для учителей
В начале 20 века новозеландский ученый Эрнест Резерфорд провел эксперимент, в котором он стрелял относительно большими электрически заряженными частицами (альфа-частицами) в тонкую золотую фольгу. Он обнаружил, что большая часть частиц проходит прямо через фольгу, но некоторые отрываются под разными углами, как если бы они были отклонены. Резерфорд пришел к выводу, что атомы в основном представляют собой пустое пространство, но каждый из них содержит плотную область – центральную массу, через которую альфа-частицы не могут проходить.Он определил, что эта центральная масса должна иметь положительный заряд, чтобы отклонять положительно заряженные альфа-частицы. Это связано с тем, что одинаковые заряды или магнитные поля (от положительного к положительному или от отрицательного к отрицательному) отталкиваются, что было продемонстрировано при попытке разместить вместе одинаковые полюса магнитов (с севера на север или с юга на юг).
Теория атомной структуры Резерфорда-Бора
Простая схема атома.
Резерфорд и датский ученый Нильс Бор разработали способ размышления о структуре атома, в котором атом выглядит как наша солнечная система.В центре каждого атома находится ядро, которое можно сравнить с солнцем. Электроны движутся вокруг ядра по орбитам, подобным тому, как планеты вращаются вокруг Солнца.
Атомы состоят из протонов, нейтронов и электронов. Ядро содержит протоны и нейтроны; вместе они называются нуклонами.
Протоны – положительно (+) заряженные частицы. Нейтроны электрически нейтральны и не имеют электрического (0) заряда. Протоны и нейтроны примерно в 1800 раз тяжелее электрона, который вращается вокруг ядра как облако.Электроны заряжены отрицательно (-) и уравновешивают положительный электрический заряд протонов в ядре. Понимание ученых об атомной структуре продолжало развиваться. Тем не менее, мы отдаем должное Теории атомной структуры Резерфорда-Бора за то, что она предоставила нам основу для понимания атомного
.Определение структуры нейтрального атома
Нейтральные атомы имеют одинаковое количество протонов (+) и электронов (-). Мы можем использовать периодическую таблицу, в частности атомный номер и атомную массу для каждого элемента, чтобы определить структуру нейтральных атомов.Атомный номер, уникальный для каждого элемента, указывает количество протонов в атоме. Например, все атомы водорода имеют 1 протон, все атомы углерода имеют 6 протонов и все атомы кислорода имеют 8 протонов. Нейтральные атомы имеют одинаковое количество протонов и электронов. Следовательно, атомы водорода имеют 1 протон и 1 электрон, атомы углерода имеют 6 протонов и 6 электронов, а атомы кислорода имеют 8 протонов и 8 электронов.
Атомы настолько малы, что нет смысла вычислять их массу, используя те же единицы, которые мы используем каждый день, например, унции или граммы.Ранние ученые-радиологи разработали единицу атомной массы (AMU) для расчета атомной массы. Атомная масса указывает количество нуклонов (протонов и нейтронов). Чтобы вычислить количество нейтронов в атоме, мы округляем атомную массу до ближайшего целого числа и вычитаем атомный номер или количество протонов из атомной массы. Например:
- Углерод: 12 (атомная масса) – 6 (атомный номер) = 6. Результат показывает, что атом углерода имеет 6 нейтронов, 6 протонов и 6 электронов.
Что удерживает вместе части атома?
Противоположные электрические заряды протонов и электронов удерживают электроны на орбите вокруг ядра атома. Внутри ядра электромагнитные силы стремятся оттолкнуть положительно заряженные протоны (и, как следствие, все ядро) друг от друга. Однако ядро удерживается вместе с помощью так называемой сильной ядерной силы притяжения между нуклонами: протон-протон, нейтрон-нейтрон и протон-нейтрон. Это сильное ядерное взаимодействие чрезвычайно мощно и распространяется только на очень короткое расстояние – около диаметра протона или нейтрона.Сильному ядерному взаимодействию помогает присутствие нейтронов (чтобы помочь противостоять конкурирующим или отталкивающим силам протонов) или обмен частицей, называемый мезоном.
Почему некоторые атомы радиоактивны?
Тонкий баланс сил между частицами обеспечивает стабильность ядра. Любое изменение числа, расположения или энергии нуклонов может нарушить этот баланс и привести к тому, что ядро станет нестабильным и создаст радиоактивный атом. Разрушение электронов вблизи ядра также может вызвать излучение атома.
Могут ли нестабильные атомы стать стабильными?
Когда нестабильное ядро пытается стать стабильным, оно испускает излучение и превращается в другой элемент по мере изменения количества протонов. Этот процесс называется радиоактивным распадом, и он продолжается до тех пор, пока силы в ядре не уравновесятся и не станут стабильными. Другая сила, так называемая слабая ядерная сила, ответственна за радиоактивный распад. Примером слабого ядерного взаимодействия являются реакции ядерного синтеза, которые приводят в действие наше Солнце и дают энергию для поддержания жизни на Земле.Нестабильные атомы будут пытаться стать стабильными, превратившись в новый изотоп или элемент, и энергия будет высвобождаться в форме ионизирующего излучения до тех пор, пока силы в ядре не уравновесятся и не станут стабильными. Серия изменений, которым подвергается данный радиоактивный элемент, называется цепочкой распада. Ниже приводится пример цепочки распада урана-238.
Источник: Геологическая служба США (USGS)
Каждый радиоактивный элемент распадается с уникальной скоростью. Эта скорость известна как период полураспада; время, необходимое примерно половине радиоактивных атомов в образце, чтобы распасться в более стабильную форму.Изображение выше показывает, что период полураспада радия-226 составляет 1602 года. Таким образом, каждые 1602 года примерно половина атомов радия-226 в образце распадается и превращается в радон-222 (следующий элемент в цепочке распада). Обратите внимание, что уран, радий и свинец являются металлами, а радон – инертным газом при нормальных условиях. Возможно, что при распаде радиоактивных элементов их форма (металл, газ, жидкость и т. Д.) Может измениться.
Период полураспада медленно распадающихся элементов, таких как уран-238 и углерод-14, можно использовать для определения возраста органического вещества.Рентгенологи также используют информацию о периоде полураспада для корректировки времени экспонирования пленки для рентгеновских лучей и сканирования с использованием других форм ионизирующего излучения.
Все ли ионизирующие излучения одинаковы?
При распаде радиоактивных атомов они выделяют энергию в виде ионизирующего излучения (альфа-частицы, бета-частицы и / или гамма-лучи). Эта энергия называется ионизирующим излучением, потому что ее энергии достаточно, чтобы сбить прочно связанные электроны с орбиты атома. Это заставляет атом стать заряженным ионом.
Альфа-частицы
Изображение альфа-частицы, испускаемой ядром.
Когда отношение нейтронов к протонам в ядре слишком низкое, определенные атомы восстанавливают баланс, испуская альфа-частицы. Альфа-частица – это положительно заряженная (+2) частица, состоящая из двух нейтронов и двух протонов. Это относительно тяжелые частицы высокой энергии, которые не могут проникнуть через большую часть материи. Листа бумаги или мертвых внешних слоев кожи достаточно, чтобы остановить альфа-частицы.Эксперимент Резерфорда (описанный выше) включал чрезвычайно тонкую золотую фольгу, через которую проникали альфа-частицы. Радиоактивный материал, излучающий альфа-частицы (альфа-излучатели), может быть очень вредным при вдыхании, проглатывании или абсорбции в кровоток, поскольку внутренние органы подвергаются большему воздействию без защитного слоя клеток кожи.
Бета-частицы
Изображение бета-частицы.
Эмиссия бета-частиц происходит, когда отношение нейтронов к протонам в ядре слишком велико.В этом случае избыточный нейтрон превращается в протон и электрон. Протон остается в ядре, а электрон (-1) выбрасывается энергично. Этот процесс уменьшает количество нейтронов на один и увеличивает количество протонов на один. Поскольку количество протонов в ядре атома определяет элемент, преобразование нейтрона в протон фактически превращает радиоактивный элемент (радионуклид) в другой элемент.
Скорость отдельных бета-частиц зависит от того, сколько у них энергии, и варьируется в широких пределах.Бета-частицы можно остановить одним или двумя слоями одежды или несколькими миллиметрами вещества, такого как алюминий. Они способны проникать через кожу и вызывать радиационные повреждения, например ожоги кожи. Как и в случае с альфа-излучателями, бета-излучатели наиболее опасны при вдыхании или проглатывании.
Гамма-лучи
Изображение гамма-луча.
Гамма-излучение – это ионизирующее излучение очень высокой энергии. Гамма-лучи не имеют массы и электрического заряда – это чистая электромагнитная энергия.Гамма-лучи движутся со скоростью света и могут преодолевать от сотен до тысяч метров по воздуху, прежде чем расходовать свою энергию. Они могут легко преодолевать препятствия, такие как кожа и одежда. Гамма-лучи обладают такой проникающей способностью, что может потребоваться несколько дюймов плотного материала, такого как свинец, или несколько футов бетона, чтобы остановить их. Гамма-лучи могут легко полностью проходить через человеческое тело; при прохождении через них возможно повреждение тканей и ДНК.
Целевая аудитория и темы занятий
Мероприятия RadTown Radioactive Atom разработаны, чтобы помочь учащимся средних и старших классов определить структуру атома и описать структурные изменения, которые происходят в нестабильных (радиоактивных) атомах при их распаде.Студенты узнают о теории атомной структуры Резерфорда-Бора и будут использовать периодическую таблицу для определения атомной структуры элемента. Студенты также узнают о процессе радиоактивного распада и типах ионизирующего излучения, испускаемого радиоактивными атомами при их распаде. Кроме того, студенты узнают о часто встречающихся радиоактивных элементах, делении и синтезе.
ПРИМЕЧАНИЕ: Термин «излучение», используемый в деятельности, обычно относится к ионизирующему излучению, если не указано иное.
Время занятий
Все радиационные образовательные мероприятия EPA RadTown можно использовать по отдельности или изменять и комбинировать для создания нескольких уроков. Параметры занятий позволяют настраивать занятия в соответствии с имеющимся у вас временем (например, 1-2 академических часа) и отвечать потребностям и интересам ваших учеников.
Время, необходимое для выполнения действий, составляет от 45 до 60 минут, не считая дополнительных мероприятий или расширений.
Научные стандарты нового поколения
Концепции в этих наборах действий могут использоваться для поддержки следующих научных стандартов:
- PS1.Строения и свойства материи
- PS2. Силы и взаимодействия
Common Core State Standards (CCSS)
Понятия в словарной деятельности соответствуют следующим
- CCSS English Language Arts Standards for Literacy in History / Social Studies, Science, and Technical Subjects:
- CCSS.ELA-LITERACY.RST.6-12.2 Ключевые идеи и детали
- CCSS.ELA-LITERACY.RST.6-12.4 Ремесло и конструкция
- CCSS.ELA-LITERACY.L.6-12.6 Пополнение словарного запаса и использование
Концепции деятельности «Атомные открытия» соответствуют следующим:
- Стандарты CCSS English Language Arts Standards для грамотности по истории / обществознанию, естествознанию и техническим предметам:
- CCSS.ELA-LITERACY.SL6-12.1 Понимание и сотрудничество
- CCSS.ELA-LITERACY.SL6-12.4 Представление знаний и идей
- CCSS.ELA-LITERACY.SL6-12.5 Презентация знаний и идей
- CCSS.ELA-WHST.SL6-12.1 Типы и назначение текста
- Стандарты CCSS English Language Arts Standards для грамотности по истории / обществознанию, естествознанию и техническим предметам:
- CSSS.ELA-Literacy.SL.6-12.1 Понимание и сотрудничество
- CSSS.ELA-Literacy.RST.6-12.4 Craft and Structure
- СССИ.ELA-Literacy.RST.6-12.7 Интеграция знаний и идей
- CSSS.ELA-Literacy.WHST.6-12.9 Исследования для накопления и представления знаний
- Стандарты математики CCSS:
- CCSS.MATH.PRACTICE.MP1
- CCSS.MATH.PRACTICE.MP2
- Стандарты CCSS Language Arts для грамотности по истории / обществознанию, естествознанию и техническим предметам:
- СССИ.ELA-Literacy.SL.6-12.1 Понимание и сотрудничество
- CSSS.ELA-Literacy.RST.6-12.7 Интеграция знаний и идей
- CSSS.ELA-Literacy.WHST.6-12.1 Типы и назначение текста
- CCSS Language Arts Standards for Literacy in History / Social Studies, Science, and Technical Subjects:
- CSSS.ELA-Literacy.SL.6-12.1 Понимание и сотрудничество
- СССИ.ELA-Literacy.SL.6-12.5 Презентация знаний и идей
- CSSS.ELA-Literacy.RST.6-12.7 Интеграция знаний и идей
- CSSS.ELA-Literacy.WHST.6-12.1 Типы и назначение текста
- Стандарты математики CCSS:
- CCSS.MATH.PRACTICE.MP1
- CCSS.MATH.PRACTICE.MP2
- CCSS Language Arts Standards for Literacy in History / Social Studies, Science, and Technical Subjects:
- СССИ.ELA-Literacy.SL.6-12.1 Понимание и сотрудничество
- CSSS.ELA-Literacy.RST.6-12.4 Craft and Structure
- CSSS.ELA-Literacy.RST.6-12.7 Интеграция знаний и идей
- CCSS.ELA-Literacy.WHST.6-12.1 Типы и назначение текстов
- CSSS.ELA-Literacy.WHST.6-12.9 Исследования для накопления и представления знаний
- Стандарты математики CCSS:
- CCSS.MATH.PRACTICE.MP1
- CCSS.MATH.PRACTICE.MP2
- Стандарты CCSS Language Arts для грамотности по истории / обществознанию, естествознанию и техническим предметам:
- СССИ.ELA-Literacy.SL.6-12.4 Презентация знаний и идей
- CSSS.ELA-Literacy.RST.6-12.4 Craft and Structure
- CSSS.ELA-Literacy.RST.6-12.7 Интеграция знаний и идей
- Стандарты математики CCSS:
- CCSS.MATH.PRACTICE.MP1
- CCSS.MATH.PRACTICE.MP2
Понятия в упражнении «Атомарная математика и стенография» соответствуют следующим:
Концепции деятельности Strong Nuclear Forces соответствуют следующим:
Концепции в деятельности по атомной стабильности соответствуют следующим:
Концепции в деятельности Half-Life соответствуют следующим:
Концепции деятельности «Цепочка радиоактивного распада» соответствуют следующим:
Дополнительные ресурсы:
Происхождение слова «атом»: NPR
(ЗВУК УЧЕБНОГО ФИЛЬМА)
(ЗВУК МУЗЫКИ)
Неизвестный человек: В алфавите всего 26 букв.Однако с помощью этих 26 магических символов каждый день пишутся миллионы слов.
IRA FLATOW, Хост:
И это может означать только, что пришло время для выпуска этого месяца «Научной дикции», где мы поговорим об истории научных слов с моим гостем, Говардом Маркелом. Доктор Маркел – профессор истории медицины в Мичиганском университете в Анн-Арборе и директор Центра истории медицины в этой стране. Добро пожаловать назад.
ХОВАРД МАРКЕЛ: Здравствуйте, Ира.
FLATOW: Эй, что мы говорим в этом месяце?
МАРКЕЛ: Слово атом.
FLATOW: А-Т-О-М.
МАРКЕЛЬ: А-Т-О-М. Не парень Адам, а концепт, атом.
(ЗВУК СМЕХА)
FLATOW: Или в Нью-Йорке мы написали бы здесь A-D-E-M.
(ЗВУК СМЕХА)
МАРКЕЛ: Ага.
FLATOW: Кто первым придумал слово «атом» в английском языке?
МАРКЕЛ: Что ж, в английском – до английского, это на самом деле греческий термин.Некоторые люди думают, что клерики индийского джайнизма, возможно, придумали идею неделимых единиц, составляющих материю. И вы знаете, сэр Исаак Ньютон думал, что это был финикийец по имени Моисей Финикийец из 13 века до нашей эры, которого мы (ph) также связываем с настоящим Моисеем или Моисеем из славы Чарльтона Хестона.
Но когда дело доходит до слова «атом», мы должны обратиться к Древней Греции 400 г. до н. Э. И был гениальный философ по имени Демокрит, и он предложил греческое слово «атомос», что означает «неразрешимый».И поэтому, как он объяснил, вся материя в конечном итоге была сведена к дискретным, маленьким частицам или атомам.
FLATOW: И Томас Нортон, он написал книгу под названием «Порядок алхимии» в 1477 году.
МАРКЕЛ: Ну, правильно. Я имею в виду, что вся разница между Демокритом и Томасом Нортоном составляет пару тысяч лет, потому что великие эксперты того времени, первые рощи академической науки, были Платоном и Аристотелем, и у них была другая теория. Они думали, что материя делится на воздух, огонь, землю и воду.Таким образом, им не понравилась его теория, и это было хуже, чем не получить должность в то время.
Таким образом, это появилось только в 1477 году, когда блестящий алхимик и поэт по имени Томас Нортон – он также был придворным короля Англии Эдуарда IV – придумал слово «атомы» в своей поэме «Порядок алхимии».
FLATOW: Мм-хмм. 1-800-989-8255 – наш номер, мы разговариваем с Говардом Маркелом о сообщении на этой неделе о НАУКЕ ПЯТНИЦА от NPR. Я Ира Флатов.
Ховард, когда атом впервые вошел в народный язык? Мы идем от греческого к английскому и тому подобное.
МАРКЕЛЬ: Ну, это начинает завоевывать популярность, вы знаете, конец 17-19 века, золотой век химии, и были все эти великие натурфилософы – Бойль, ла Восье (ph), Пристли, и они все одержимы составом и природой материи. И это вернуло их к пересмотру атома.
И это было в 1803 году, когда Джон Далтон опубликовал свою атомную теорию неделимых элементов и периодическую таблицу периодической таблицы элементов, которую мы все носили с собой и запоминали в школьные годы.И этим занимались ученые на десятилетия.
Но на самом деле это были 1890-е годы, когда ученые начали изучать радиоактивные элементы. Анри Беккерель и Кюри, и они начали изучать – мне это нравится – субатомные частицы. Сначала мы говорим, что атом неделим, но потом мы знаем, что есть протоны, нейтроны, электроны и так далее, а затем все продолжалось и продолжалось.
И, конечно же, самой известной была атомная бомба на Хиросиме и Нагасаки. Мы вступили в атомный век, который является не только научным термином, но и целой эрой популярной культуры, будь то фильмы, научная фантастика или романы.
FLATOW: Вы знаете, мы продолжали нарезать кубиками атом. Как вы сказали, мы перешли к субатомному, а затем суб-субатомному. Нужен ли нам новый термин?
(ЗВУК СМЕХА)
МАРКЕЛ: Хорошо, мы знаем. И я думал об этом, вы знаете, это еще один эпизод из «Science Diction», когда вы переходите от протонов, электронов, нейтронов к кваркам. И это так забавно называть – это что-то вроде гигантской креветки или, как сказал Граучо Маркс, военной разведки. Так что идея субатомных частиц несколько забавна.
FLATOW: Ага. Почему у Платона и Аристотеля возникла такая проблема с идеей бедного Демокрита об атомах как основных единицах материи? Что такого плохого в этой идее?
МАРКЕЛ: Ну, это противоречило их теории.
FLATOW: Ага.
МАРКЕЛ: Они действительно были парнями из земли, ветра, огня и воды, и поэтому они думали, что Демокрит был немного моложе. Платон хотел сжечь все свои книги. Он думал, что его работа была такой дрянной.
Но, знаете, в этом есть настоящий юмор. Мы сейчас об этом говорим. Вы знаете, несколько тысяч лет спустя мы решили вспомнить Демокрита, хотя его представление об атоме сильно отличается от современных представлений. Но его идеи были упущены ведущими светилами того времени, Аристотелем и Платоном.
FLATOW: Насколько сложно было бы придумать новую фразу для суб-субатомных? Я имею в виду, мы можем начать? Есть ли у вас какие-либо предложения?
МАРКЕЛ: Для всего жанра?
FLATOW: Ага.Я имею в виду, вы постоянно говорите о суб-субатомном. Почему – нельзя просто вставить что-то другое?
МАРКЕЛ: Ну, знаете, может, если бы мы придерживались чего-то греческого или латинского, это могло бы быть atomos obscura. Но все они довольно непонятные, не так ли? Я думаю, что субатомный сейчас действительно лучший способ, и мы просто прикусываем язык, когда говорим это.
FLATOW: Ага. Как вы находите слова, которые вам интересно искать в наши дни? У вас есть – вы проводите сортировку? Вы находите вещи, которые сейчас в моде, или то, что мы должны искать, понимаете?
МАРКЕЛ: Я ищу слова везде, потому что все время читаю.
FLATOW: Ага.
МАРКЕЛ: И если когда-нибудь появляется какое-нибудь интересное слово, я думаю об этом. Вы знаете, в следующем месяце мы, вероятно, пересмотрим слово «общий». Это потому, что я пью в кофейне под названием Common Coffee. Но это еще и отличный научный термин.
Но если люди захотят прислать мне несколько слов, я был бы рад их найти, а затем вы начнете с Оксфордского словаря английского языка и, так сказать, продвигаетесь вниз в архивы.
FLATOW: Ну, знаете, вокруг много говорят о сканерах. Все говорят о сканерах в аэропортах. Может сканер слов …
МАРКЕЛ: Я посмотрю, Ира.
FLATOW: Вы знаете, что-то в этом роде.
МАРКЕЛ: Ага. Ага.
FLATOW: Или что-то, что нужно сделать – что угодно. Или у нас есть – у нас есть кое-что по физике, физике элементарных частиц, и даже – как нам захватить это маленькое субатомное – антивещество?
МАРКЕЛ: антивещество…
FLATOW: У нас есть антивещество.
МАРКЕЛ: Ага.
FLATOW: У нас есть анти-где есть-анти тоже было довольно давно, я уверен.
МАРКЕЛ: Ага. Антивещество …
FLATOW: «Анти» – греческое слово?
МАРКЕЛ: Вы знаете, вы меня тут на лету ловите. Я подозреваю, что это так. И, конечно же, у нас есть термин антихрист, если вы посмотрите, знаете ли, на более раннюю литературу, идею чего-то противоположного …
FLATOW: Вправо.
МАРКЕЛ: … вы хотите посмотреть.
FLATOW: Хорошо, я сниму вас с крючка и позволю вам делать уроки.
(ЗВУК СМЕХА)
МАРКЕЛ: Профессора всегда так предпочитают, прежде чем мы выйдем перед аудиторией.
FLATOW: И мы предпочитаем, чтобы вы все поняли правильно, чтобы вам не приходилось возвращаться и ставить звездочку …
МАРКЕЛ: Это хорошо. Это хорошо.
FLATOW: Приятно видеть тебя, как всегда, Ховард.
МАРКЕЛ: Большое спасибо и с Днем благодарения тебе и твоим, Ира.
FLATOW: Ты тоже. Говард Маркел. Доктор Маркел, он доктор медицины и профессор истории медицины в Мичиганском университете в Анн-Арборе, а также директор Центра истории медицины там.
И, как он говорит, если есть слово, по которому вы хотите, чтобы мы нашли вас и поговорили с доктором Маркелом, зайдите на наш веб-сайт. Это sciencefriday.com, и оставьте нам там свое предложение.
Вы также можете пойти туда и посмотреть наш видео-выбор недели, который выходит на этой неделе, о том, как Дисней создавал замки Рапунцель в своем последнем анимационном фильме. И у нас есть замечательная небольшая статья, сделанная нашим мультимедийным редактором Флорой Лихтман о том, как это работает. Некоторые – там тоже красивое видео.
Удачной недели. Увидимся на следующей неделе.
Я Ира Флатоу из Нью-Йорка.
Авторские права © 2010 NPR. Все права защищены. Посетите страницы условий использования и разрешений на нашем веб-сайте www.npr.org для получения дополнительной информации.
стенограмм NPR создаются в срочном порядке Verb8tm, Inc., подрядчиком NPR, и производятся с использованием патентованного процесса транскрипции, разработанного NPR. Этот текст может быть не в окончательной форме и может быть обновлен или изменен в будущем. Точность и доступность могут отличаться. Авторитетной записью программирования NPR является аудиозапись.
.
 [2]
[2]
 Электрон и позитрон называют бета-частицами. Бета-распад увеличивает или уменьшает атомный номер на единицу.
Электрон и позитрон называют бета-частицами. Бета-распад увеличивает или уменьшает атомный номер на единицу.