Понятие органическая химия – Справочник химика 21
Далее даны определения основных понятий органической химии. [c.177]Соображения того же порядка побудили меня ввести коротенькую главу об основных понятиях органической химии, чтобы книга могла читаться лицами, даже не знакомыми с основами этой научной дисциплины. [c.9]
Углеводороды с открытой цепью. Карбоциклические соединения. Органические галогениды. Глоссарий терминов и понятий органической химии. Символика органических реакций [c.1]
Изд-во УГНТУ, 2001. – 4.1. Углеводороды с открытой цепью. Карбоциклические соединения. Органические галогениды Глоссарий терминов и понятий органической химии. Символика органических реакций. 288 с. [c.2]
Глава 21. Основные понятия органической химии [c.269]
Органическая химия, как и все естественные науки, переживает сейчас непрерывный и быстрый подъем во всех своих областях — идет ли речь о теоретической органической химии, об органическом синтезе, о нефтехимических процессах или о достижениях органической химии в целях удовлетворения повседневных нужд общества.

Основные понятия органической химии [c.7]
В 1806 г. для студентов-медиков Я. Берцелиус написал руководство Животная химия . В нем впервые было введено понятие органическая химия . К середине XIX в. органическая химия становится химией углеродных соединений . [c.154]
В вводных главах в сжатой форме даны основные понятия органической химии, необходимые для дальнейшего изучения механизмов реакций. Особое внимание уделено описанию сте-реохимических закономерностей, играющих значительную роль в биологических системах. В книге дается не только представление об основных принципах стереохимии — оптической, геометрической изомерии и конформации, но и специально рассматриваются стереохимические аспекты органических и некоторых прохиральных ферментативных реакций.
Действительно, в органической xимиli почти отсутствует канонический антураж строгой науки в виде математического аппарата, описывающего ее основные закономерности.

В целом система понятий органической химии может быть выражена схемой 3.5. В ней дана классификация по важнейшим научным теориям. Все понятия органической химии сгруппированы в пять групп на основе современной теории строения понятия химического строения, электронной теории и стереохимические, связанные между собой в единую современную теорию строения органических веществ, понятия высокомолекулярной химии, а также понятия о закономерностях химических реакций. [c.243]
[c.243]
ОСНОВНЫЕ ПОНЯТИЯ ОРГАНИЧЕСКОЙ ХИМИИ [c.315]
Если же читатель уже знаком с основными теоретическими понятиями органической химии, он может пропустить главу 1 и приступить к изучению основных глав учебника.
В первой (вводной) главе изложены теория химического строения и основные современные электронные представления и понятия органической химии. Рассмотрен ряд современных физико-химических методов исследования органических веществ в приложениях приведены полученные этими методами цифровые данные, чтобы читатель имел и сведения справочного характера. [c.3]
Хотя принцип химического строения уже давно лежит в основе мышления химика, тем не менее многие основные понятия органической химии традиционно определяются, исх )дя не из строения, а из состава орга,нических соединений. Это в первую очередь относится к гомологии. Распространено определение, согласно которому два соединения гомологичны, если они сходны по свойствам и отличаются по составу на гомологическую разницу СНа, взятую п раз.
Проблема элеетронного и пространственного строения молекулы бензола хорошо известна. Особая термическая устойчивость бензола и его производных, стремление молекул этих соединений сохранять в различного рода химических превращениях неизменной свою главную структурную единицу — шестичленное сопряженное кольцо — привели к выделению этих соединений в самостоятельный, широко разветвленный класс ароматических соединений. Сопряженные циклические углеводороды и гетероциклические соединения, характеризующиеся свойствами, подобными бензолу (термодинамической стабильностью и склонностью к реакциям замещения, но не присоединения или расщепления), названы бензоидными, а соединения, не обладающие этими свойствами, — небензоидными.
Именно это открытие проломило брешь в стене предубеждений, разделявших органическую и минеральную химию, и убедило химиков, что и органические вещества могут быть получены искусственно, без участия гипотетической жизненной силы. Насколько прочно все же держалось это предубеждение, следует из высказывания французского химика Жерара, установившего некоторые основные понятия органической химии, например понятие гомологии, и являющегося одним из авторов закона Авогадро — Жерара. Жерар в 1842 г., когда многие простые органические соединения были уже получены искусственным путем,. ысказал мнение, что синтез столь сложного вещества, как сахар, никогда не сможет быть осуществлен. Это скептическое предсказание было опровергнуто в 1861 г., когда А. М. Бутлеров впервые получил синтетически сахаристые вещества (из формалина).
Процесс изменения значений слов происходит непрерывно, неизбежно и незаметно. Когда в начале 19 века Берцелиус впервые использовал прилагательное органическая для определения специфической области химии, оно совершенно очевидно подчеркивало изучение соединений, сущ,ествуюп1,их в природе как составная часть живой материи. К концу века термин органический , используемый в химическом контексте, давно перестал обозначать Еещ,ества, которые образуются только в живых системах, и когда возник вопрос об определении понятия органическая химия Роско (1871 г.

С 1769 по 1785 гг. Шееле удалось выделить целый ряд кислот, таких как винная, лимонная, яблочная, галловая, молочная, мочевая и щавелевая. В 1773 г. Роуэлл получил из человеческой мочи мочевину. Выделенные из растительных и животных организмов соединения имели между собой много общего, но резко отличались от неорганических веществ. Так появилось понятие органическая химия — раздел науки, изучающий соединения, выделенные из организмов (Берцелиус, 1807 г.). При этом полагали, что органические вещества могут образовываться только в живых организмах благодаря присущей только им жизненной силе vis ultalis). [c.17]
В 1773 г. Роуэлл получил из человеческой мочи мочевину. Выделенные из растительных и животных организмов соединения имели между собой много общего, но резко отличались от неорганических веществ. Так появилось понятие органическая химия — раздел науки, изучающий соединения, выделенные из организмов (Берцелиус, 1807 г.). При этом полагали, что органические вещества могут образовываться только в живых организмах благодаря присущей только им жизненной силе vis ultalis). [c.17]
После того как было установлено, что органические соединения могут быть синтезированы и вне лживого организма, появилась иеобход -мость дать новое определение понятию органическая химия . В середине прошлого века Гмелии, Кольбе и Кекуле иод этим ионятисм подразумевали химию соединений углерода . Такое определение действительно и в настояи ее время, хотя надо иметь в виду, что сам углерод, карбиды, оксид углерода и карбонилы металлов, диоксид углерода и карбонаты, сероуглерод и циановая кислота, синильная кислота и роданистоводородная кислота, а таклнеорганическим соединениям. Понятие органическая химия включает следующий комплекс экспериментальных методов и теоретических представлений. [c.18]
Понятие органическая химия включает следующий комплекс экспериментальных методов и теоретических представлений. [c.18]
Большое влияние на курс органической химии оказывают межпредметные связи, особенно с биологией. Развитие биологии как науки и как учебного предмета оказало влияние на формирование школьного курса органической химии, в который в 1985 г. были введены гетероциклы и нуклеиновые кислоты. Они необходимы для понимания проблем молекулярной биологии, генетики, так как органическая химия формирует для биологии опорные понятия. Органическая химия широко пользуется понятиями физики представления об электрических явлениях в макромире способствуют пониманию микромира органических веществ. Межпредметные связи с историей позволяют ознакомить учащихся с историей органической химии как науки, показать успехи органического синтеза, раскрыть перспективы развития химической промышленности в нашей стране. Межпредметные связи органической химии с другими предметами школьного учебного плана четко определяют ее место в учебно-воспитательном процессе средней школы. [c.241]
[c.241]
Впервые понятие органическая химия использовал в 1807 г. Берцелиус, сравнивая растительный или животный организм с химической лабораторией лишь природа способна производить органические соединения. Эта концепция была опровергнута Вёлером, который синтезировал щавелевую кислоту (1824 г.) и мочевину (1828 г.) из неорганических веществ. В середине XIX в. Гмелин, Кольбе, Кекуле и другие ученые определили органическую химию как учение о химии углерода. [c.193]
В настоящее время особое значение приобретают понятия органической химии, отражающие ее специфику как иаукрг об углероде, углеродистых соединениях и их превращениях. В связи с вскрытой порочностью теории электронного резонанса, покоящейся на враждебной нам основе — идеализме-махизме, особое значение приобретают понятия теории химического строения органической химии, основоположником которой является А. М. Бутлеров. [c.404]
“Предмет органической химии”.
 9-й класс
9-й классЦели:
- Сформировать понятие о предмете органической химии, рассмотреть особенности органических веществ.
- Ознакомить ребят с понятием валентности.
- Раскрыть основные положения теории химического строения органических соединений А.М.Бутлерова. начать формировать навыки составления структурных формул.
- Раскрыть значение органической химии.
- Активизировать познавательную активность учащихся.
- Развивать самостоятельность учащихся в подготовке материала, используя дополнительную литературу; развивать речь.
- Воспитывать ответственность, уважение друг к другу, взаимопонимание, взаимоподдержку, уверенность в себе.
Оборудование: Демонстрация: разнообразные органические вещества.
Форма учебного процесса: классный урок.
Тип урока: урок получения новых знаний.
Методы и приемы: беседа, экспресс-опрос, рассказ (сообщения учащихся), презентация.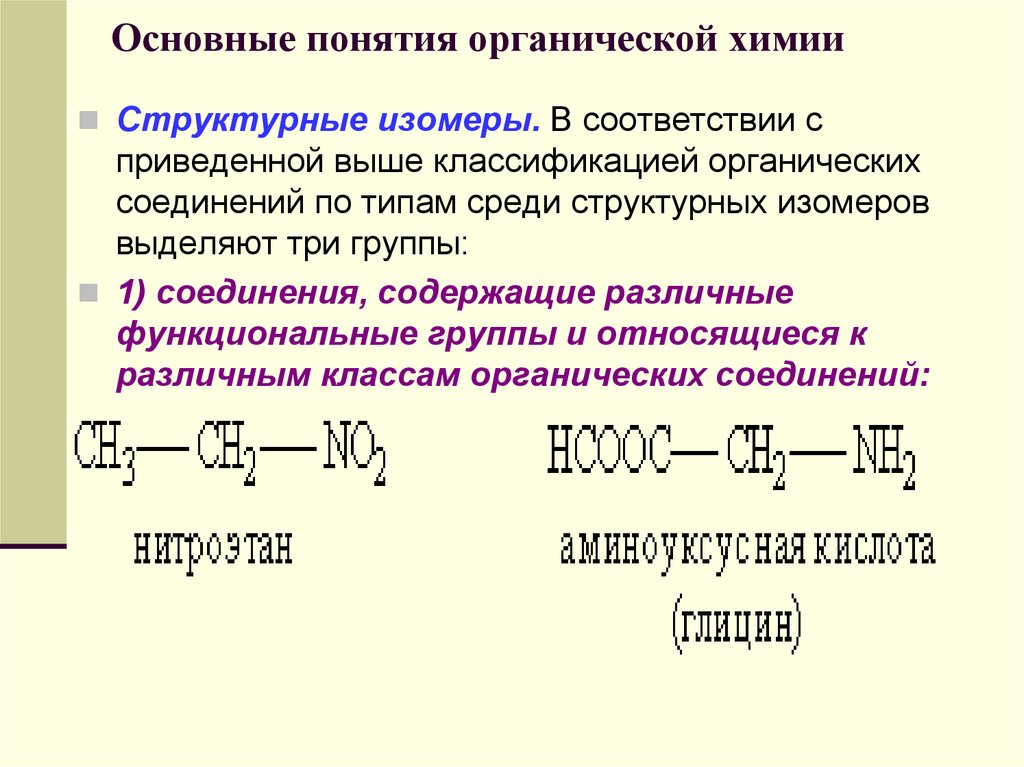
Метод обучения: проблемный.
Вид деятельности: исследовательская работа учащихся при изучении нового материала.
Принципы урока:
- принцип научности;
- принцип наглядности;
- взаимосвязь изученного материала и личного опыта учащихся;
- системный подход к изучению материала.
Технология урока: личностно ориентированная, дифференцированного обучения.
Методы:
- проблемно-поисковый (подготовка сообщений).
- репродуктивный (воспроизведение сообщений).
- исследовательский (анализ прослушанных сообщений).
Ход урока
I.
Добрый день.
Долгожданный дан звонок –
Начинаем наш урок.
Не позволяй душе лениться,
Чтоб воду в ступе не толочь.
Душа обязана трудиться
И день, и ночь, и день, и ночь.
Мы начинаем изучать органические вещества, общая численность которых в настоящее время составляет более 10 млн. веществ, причём каждый год их число увеличивается на 200-300 тысяч новых соединений. Общее число неорганических соединений не превышает 700 тысяч.
веществ, причём каждый год их число увеличивается на 200-300 тысяч новых соединений. Общее число неорганических соединений не превышает 700 тысяч.
Таким образом, число органических соединений превышает в десятки раз число неорганических веществ. Чем обусловлено такое многообразие органических веществ? В чём их особенность? Ответы на эти вопросы вы получите, изучая новый для вас раздел химии – органическую химию.
II. Предмет органической химии.
1. Что такое органическая химия? История возникновения этой науки. (Сообщения учащихся)
Органическая химия – это химия соединений углерода.
С давних времён возникло естественное разделение всех веществ на неорганические (минеральные, не живые) и органические, т.е получаемые из живых организмов – растений, животных. Позже это понятие расширилось, и в настоящее время к органическим веществам относят и такие, которые не имеют никакого отношения к живым организмам, например, полимеры, пластмассы. Синтезированы вещества, которых нет вообще в природе, они получены искусственно. Но главный критерий всегда остаётся – наличие в соединении хотя бы одного углеродного атома.
Синтезированы вещества, которых нет вообще в природе, они получены искусственно. Но главный критерий всегда остаётся – наличие в соединении хотя бы одного углеродного атома.
Угольная кислота, оксиды углерода, карбонаты, карбиды – это неорганические соединения, у них нет свойств органических веществ.
2. Что такое органические вещества? Где они встречаются? (Сообщения учащихся)
Органические вещества отличаются от неорганических тем, что в их состав обязательно входит углерод.
Основные элементы, входящие в большинство органических веществ: C, H, O, S, N, Hal.
Основные элементы в органических соединениях – углерод и водород. Поэтому при их горении всегда образуются углекислый газ и вода.
Дем-но: образцы органических веществ.
Значение и роль органической химии в современной жизни
Трудно представить жизнь современного человека без её достижений. Человек окружён органическими веществами на протяжении всей своей жизни, начиная с продуктов питания, одежды, обуви, синтетических материалов, полимеров, энергоносителей, лекарственных препаратов, синтетических моющих средств, различных красок, лаков, красителей и т.п.
Человек окружён органическими веществами на протяжении всей своей жизни, начиная с продуктов питания, одежды, обуви, синтетических материалов, полимеров, энергоносителей, лекарственных препаратов, синтетических моющих средств, различных красок, лаков, красителей и т.п.
3. А.М.Бутлеров. Факты его биографии. (Сообщения учащихся)
4. Теория А.М.Бутлерова. Положения. Значение. (Сообщения учащихся)
– Атомы, входящие в состав молекул органических веществ, не находятся в беспорядочном состоянии, а соединены друг с другом в определённой последовательности химическими связями, согласно их валентности.
– Свойства веществ зависят не только от того, какие атомы и в каком количестве входят в состав молекулы, но и от того, в какой последовательности они соединены межлу собой в молекуле, т.е. от их химического строения.
5. Химическое строение. Привести примеры. (Сообщения учащихся)
Химическое строение вещества – определённый порядок, последовательность соединения атомов в молекулы.
6. Валентность элементов в органических соединениях. (Сообщения учащихся)
Атомы в молекулы соединяются согласно их валентности.
Валентность – способность атомов химических элементов образовывать определённое число химических связей, которые образует данный атом с другими атомами в молекуле.
H–Cl. В молекуле хлороводорода 1 ковалентная полярная связь. Водород соединён 1 связью с хлором, поэтому он одновалентен. Водород всегда одновалентен. Хлор, в данном случае, также соединён 1 химической связью с водородом, поэтому он одновалентен. Но хлор может проявлять и переменную валентность. Одна связь – это пара электронов.
Чтобы определить валентность элемента в структурной формуле нужно сосчитать число чёрточек (связей), исходящих от каждого элемента. Углерод всегда четырёхвалентен.
Численные значения степени окисления и валентности не всегда совпадают.
H+12O-12
Степень окисления кислорода равна -1, а по структурной формуле валентность кислорода равна 2: H – O – O – H
? Каким видом химической связи соединены атомы в молекуле H2O2? (Атомы водорода и кислорода соединены ковалентной полярной связью, атомы кислорода соединены между собой ковалентной неполярной связью)
Постоянные значения валентности: H – одновалентен, O – двухвалентен, C – четырёхвалентен.
7. Структурная формула. (Сообщения учащихся)
Углеродные атомы обладают способностью соединяться друг с другом в разнообразные цепи: прямые, замкнутые, разветвлённые
8. Классификация органических веществ. (Сообщения учащихся)
9. Что такое углеводороды? Привести примеры. Где они используются? (Сообщения учащихся)
Углеводороды – вещества, состоящие из углерода и водорода.
10. Предельные углеводороды. Общая формула. Основные формулы. Применение. (Сообщения учащихся)
Предельные углеводороды – углеводороды, в которых имеются только простые связи между атомами углерода и которые соединены с максимально возможным числом атомов водорода, т.е. насыщены ими до предела.
Предельные углеводороды – насыщенные, парафины, алканы.
11. Что называется изомерами? Привести примеры. (Сообщения учащихся)
Изомеры – вещества, имеющие одинаковый количественный и качественный состав, но отличающиеся по своему строению и свойствам.
Изомерия – явление существования изомеров.
В углеводородах – изомерия углеродного скелета. Она зависит от порядка соединения между собой атомов углерода в углеродной цепи.
Для пентана C5H12 существует только 3 изомера, а для декана C10H22 уже 75!
12. Что называется гомологами? Привести примеры. (Сообщения учащихся)
Гомологи – органические вещества, сходные по строению и свойствам, но отличающиеся друг от друга на одну или несколько групп – CH2.
Гомологический ряд – ряд органических веществ, расположенных в порядке возрастания относительных атомных масс, сходных по строению и свойствам и отличающихся друг от друга на одну или несколько групп – CH2.
13. Непредельные углеводороды. Общая формула. Основные формулы. Применение. (Сообщения учащихся)
Непредельные углеводороды содержат 1 двойную связь и называются этиленовыми, олефинами, алкенами. Непредельные, т.к. валентности углерода не насыщены до предела атомами водорода.
Непредельные, т.к. валентности углерода не насыщены до предела атомами водорода.
14. Основные типы реакций, в которые вступают углеводороды. (Сообщения учащихся)
Для алканов характерны реакции:
– горения;
– замещения;
– термического разложения;
– дегидрирования.
Для алкенов характерны реакции:
– горения;
– полимеризации;
– присоединения:
- воды (реакция гидратации),
- бромной воды;
– окисления (раствором перманганата калия)
III. Физпауза.
– Как живёшь?
– Как идёшь?
– Как бежишь?
– Как плывешь?
– Как летишь?
– Как шалишь?
– Как молчишь?
– Как сидишь?
IV. Экспресс-опрос. Продолжите фразу: «Органическая химия – это…»
V. Дома: § 32–34, готовиться к тесту.
VI. Итог урока.
Основные понятия — урок.
 Химия, 8–9 класс.
Химия, 8–9 класс.Углеводороды — органические вещества, состоящие из атомов углерода и водорода.
Углеводороды — природные органические соединения. Они входят в состав природного газа, нефти, каменного угля.
Вспомним электронное строение атомов углерода и водорода:
C+62e,4e6 H+11e1
На внешнем электронном уровне атома углерода находятся четыре электрона, каждый из которых способен образовать ковалентную связь. В атоме водорода — один электрон.
Обрати внимание!
Валентность углерода в органических соединениях равна четырём.
Водород всегда одновалентен.
В молекулах углеводородов атомы соединены ковалентными связями: между атомами углерода связь неполярная, а между атомами углерода и водорода связь полярная.
Обрати внимание!
Атомы углерода способны соединяться друг с другом одинарной, двойной или тройной связью и образовывать цепи и циклы.
Углеводороды, в молекулах которых все связи одинарные, называются насыщенными (предельными).
Углеводороды, в молекулах которых есть двойные или тройные связи, называются ненасыщенными (непредельными).
Углеводороды, в молекулах которых атомы углерода образуют замкнутый цикл, называются циклическими.
Два основных понятия органической химии: гомологи и изомеры.
Гомологи — вещества, молекулы которых имеют сходное строение, но отличаются по составу на одну или несколько групп Ch3.
Ch4—Ch4Ch4—Ch3—Ch4Ch4—Ch3—Ch3—Ch4
Изомеры — вещества, имеющие одинаковый состав, но разное строение.
Ch4—Ch3—Ch3—Ch4Ch4—CH—Ch4|Ch4
Предмет органической химии.
 Общие представления об органических веществах.
Общие представления об органических веществах.Тема урока: Предмет органической химии. Общие представления об органических веществах.
Тип урока: Изучение нового материала.
Цель урока: формирование понятия о предмете органической химии.
Задачи урока:
Образовательные: рассмотреть особенности органических веществ, их отличие от неорганических веществ. Выявить причины многообразия органических веществ. Начать формировать навыки составления структурных формул органических веществ, сформировать представление об изомерах и изомерии.
Воспитательные: Продолжить формирование познавательного интереса к предмету, показать значимость химических знаний для современного человека. Воспитание трудолюбия, аккуратности, коммуникативных качеств.
Развивающие:
Развивать учебно-интеллектуальные умения выделять главное, устанавливать
причинно-следственные связи (развивать логическое мышление), умений находить
требуемую информацию в различных источниках и извлекать из предложенной
информации нужные данные. Развивать память и внимание обучающихся.
Развивать память и внимание обучающихся.
Реактивы и оборудование: Образцы органических веществ: уксусная кислота, ацетон, аскорбиновая кислота, сахар, глюкоза, бумага, свеча, спиртовка со спиртом, сухое горючее (уротропин), нефть, образцы изделий из пластмассы и синтетических волокон (линейка, пуговицы, кусочки синтетических тканей), спички, фарфоровая чашка, тигельные щипцы, поваренная соль, металлическая ложка, шаростержневые модели метана, этилена, ацетилена, на каждой парте – набор для собирания шаростержневых моделей. На доске записаны молекулярные формулы органических веществ.
Ход урока.
I. Организационный момент.
Здравствуйте, ребята. Сегодня на уроке мы начинаем знакомиться с новым разделом химической науки – органической химией.
II. Изучение нового материала.
1. Актуализация знаний.
Учитель.
Давайте вспомним, что изучает химия? (Химия изучает вещества, их состав,
свойства и превращения).
Ребята, напишите в центре страницы слова «химические вещества». Какие ассоциации связаны у вас с этими словами? Напишите примеры химических веществ в тетради, разместив их вокруг слов «химические вещества».
На эту работу отводится 1-2 минуты. Затем учитель оформляет ответы обучающихся на доске в виде схемы, поочерёдно спрашивая всех и следя, чтобы названия веществ не повторялись.
Схема.
Кислород Алмаз Белки Жиры
Химические вещества
Карбид
Серная Сахар Хлорид натрия
кальция кислота
Ребята,
в 8 и 9 классе мы с вами изучали неорганическую химию. Какие вещества изучает
неорганическая химия? (Неорганические или минеральные вещества). Какие вещества
из названных веществ относятся к неорганическим? (Серная кислота, хлорид натрия,
кислород, алмаз, карбид кальция). Какие вещества мы ещё не изучали? (белки,
жиры, сахар).
Какие вещества изучает
неорганическая химия? (Неорганические или минеральные вещества). Какие вещества
из названных веществ относятся к неорганическим? (Серная кислота, хлорид натрия,
кислород, алмаз, карбид кальция). Какие вещества мы ещё не изучали? (белки,
жиры, сахар).
Эти вещества и ещё очень многие другие относятся к органическим и изучает их органическая химия. Что же это за наука? Что она изучает? Давайте послушаем небольшое сообщение из истории органической химии.
Сообщение ученика.
Как произошёл термин
«органические вещества»? До начала XIX
века вещества делились по происхождению на минеральные, животные и
растительные. В 1807 году шведский химик Й.Я Берцелиус ввёл в науку термин
«органические вещества», объединив в одну группу вещества растительного и
животного происхождения. Науку об этих веществах он предложил назвать
органической химией. В начале XIX
века
считалось, что все органические вещества в искусственных условиях получить
нельзя, они образуются только в живых организмах под влиянием так называемой «жизненной
силы». Ошибочность этого учения о «жизненной силе», называемого
виталистическим, была доказана синтезами органических веществ в лабораторных
условиях: в 1828 году немецкий учёный-химик Ф. Вёллер синтезирует мочевину, в
1845 году его соотечественник А.В. Кольбе получает уксусную кислоту, в 1854
году французский химик П.Э. Бертло – жиры, в 1861 году русский химик А.М.
Бутлеров – сахаристое вещество (информация предварительно написана на доске, во
время сообщения ученик открывает эту запись).
Ошибочность этого учения о «жизненной силе», называемого
виталистическим, была доказана синтезами органических веществ в лабораторных
условиях: в 1828 году немецкий учёный-химик Ф. Вёллер синтезирует мочевину, в
1845 году его соотечественник А.В. Кольбе получает уксусную кислоту, в 1854
году французский химик П.Э. Бертло – жиры, в 1861 году русский химик А.М.
Бутлеров – сахаристое вещество (информация предварительно написана на доске, во
время сообщения ученик открывает эту запись).
Учитель. Как видите, ребята, резкой границы между органическими и неорганическими веществами не существует, они состоят из одних и тех же химических элементов и могут быть превращены друг в друга. Почему же органические вещества выделяют в отдельную группу, каковы их отличительные признаки? Давайте вместе попытаемся разобраться.
Учитель демонстрирует
образцы органических веществ, называет их и показывает молекулярные формулы,
записанные на доске: уксусная кислота С2Н4О2,
ацетон С3Н6О, этиловый спирт в спиртовке С2Н6О,
сухое горючее уротропин С6Н12N4,
аскорбиновая кислота С6Н8О6, сахар С12Н22О11,
глюкоза С6Н12О6, парафиновая свеча и нефть, в
состав которых входят вещества с обще формулой СxHy,
бумага, состоящая из целлюлозы (С6Н10О5)n.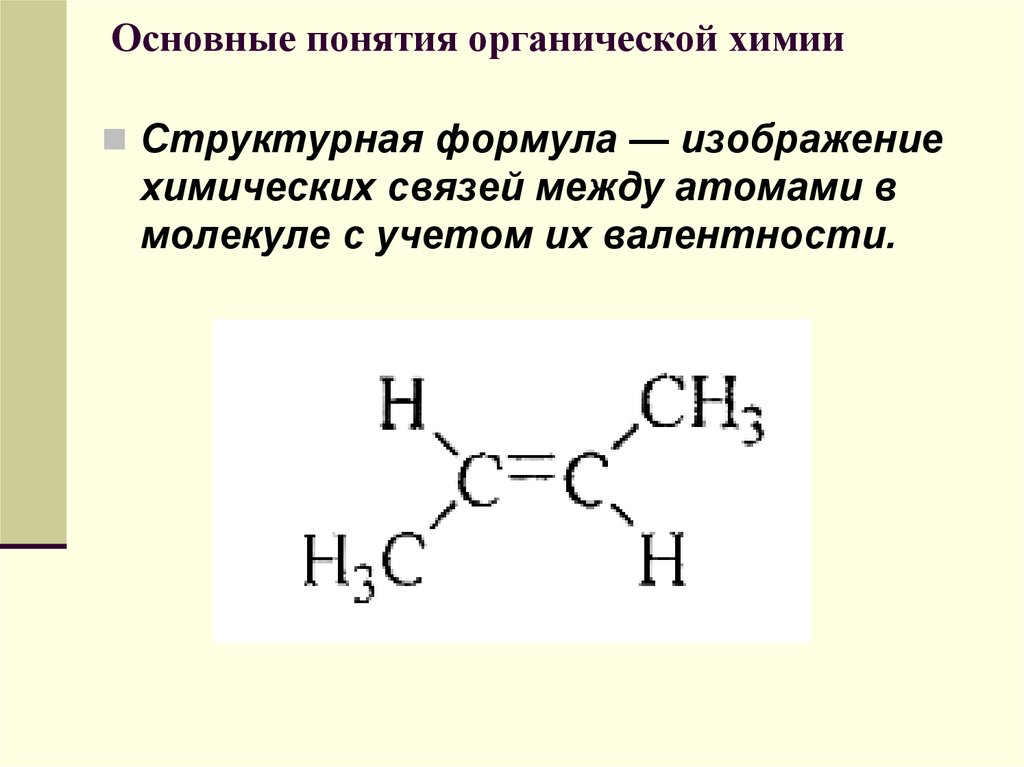
Учитель. Что общего вы заметили в составе этих веществ? Какое химическое свойство вы можете предположить у этих веществ?
Ученики отвечают, что все перечисленные вещества содержат атомы углерода и водорода. Предполагают, что все они горят. Учитель демонстрирует горение уротропина, свечи и этилового спирта в спиртовке, обращая внимание на характер пламени и внося поочерёдно в пламя фарфоровую чашку, показывает, что от пламени свечи образуется копоть. Далее обсуждается вопрос какие вещества образуются при горении органических веществ. Ученики приходят к выводу, что образовываться может углекислый газ, угарный газ, углерод (сажа, копоть). Учитель сообщает, что не все органические вещества горят, но все они обугливаются при нагревании и демонстрирует обугливание сахара при нагревании.
Учитель. Ребята, приведите примеры из жизни, когда происходит разложение веществ, т.е. их обугливание.
Ученики:
Если пережарить картошку, блины, хлеб, происходит обугливание крахмала,
входящего в состав картофеля и муки. При подгорании яиц и мяса обугливается
белок, содержащийся в этих продуктах.
При подгорании яиц и мяса обугливается
белок, содержащийся в этих продуктах.
Учитель. Ребята, определите тип химической связи в органических веществах, исходя из их состава.
Ученики. Органические вещества состоят из атомов неметаллов, поэтому связь в их молекулах ковалентная.
Учитель демонстрирует опыт: в металлической ложке нагревает над пламенем спиртовки сахар и поваренную соль. Сахар быстро начинает плавиться, соль – не плавится.
Учитель. Ребята, какой вывод мы можем сделать из этого опыта?
Ученики отвечают, что поваренная соль и сахар имеют разные кристаллические решётки. Сахар имеет низкую температуру плавления, следовательно, молекулярную кристаллическую решётку. Поваренная соль – вещество с высокой температурой плавления, имеет ионную кристаллическую решётку.
Затем ученики в тетрадях записывают признаки органических веществ:
· содержат атомы углерода и водорода
· горят и (или) разлагаются с образованием углеродсодержащих продуктов
· атомы в молекулах связаны ковалентной связью
· имеют молекулярные кристаллические решётки
Формулируют и записывают в тетради определение понятия «органическая химия». Органическая химия – наука об органических веществах, их составе,
свойствах, получении.
Органическая химия – наука об органических веществах, их составе,
свойствах, получении.
Учитель. Синтезы органических веществ в лабораторных условиях ускорили развитие органической химии, учёные начали экспериментировать и получать вещества, которые не встречаются в природе, но соответствуют всем признакам органических веществ. Это пластмассы, синтетические каучуки и волокна, лаки, краски, лекарства (учитель демонстрирует изделия из пластмасс и волокон). Таким образом, группа органических веществ существенно расширилась. В современном понимании органические вещества – вещества, содержащиеся в живых организмах и продуктах их жизнедеятельности, а также полученные синтетически. Более точное определение органических веществ: органические вещества – это соединения углерода.
А
сейчас, ребята, запишите формулы органических веществ и определите степени
окисления химических элементов: СН4 (степень окисления водорода
равна +1, углерода -4), С2Н2 (степень окисления водорода
+1, углерода -1), С3Н8 (степень окисления водорода +1,
углерода -8/3), С4Н10 (степень окисления водорода +1,
углерода -10/4). Такие степени окисления атомов углерода маловероятно. В
органической химии пользуются понятием валентность. Пользуясь таблицей 1
сравните понятия валентность и степень окисления, в чём их сходства и различия
(приложение 1).
Такие степени окисления атомов углерода маловероятно. В
органической химии пользуются понятием валентность. Пользуясь таблицей 1
сравните понятия валентность и степень окисления, в чём их сходства и различия
(приложение 1).
Ученик. Валентность не имеет знака, а степень окисления может быть положительной или отрицательной. Валентность не может быть нулевой, а степень окисления может иметь значение равное нулю. Валентность показывает количество связей, которые образует химический элемент в молекуле. Степень окисления показывает смещение общих электронных пар между атомами в молекуле.
Учитель.
Ребята, в строении органических веществ существуют особенности: валентность
углерода всегда равна IV,
атомы углерода соединяются в молекулах не только с другими атомами, но и друг с
другом, образуя углеродные цепи. Эти цепи могут быть разной формы. Порядок
соединения атомов в молекулах называется химическим строением.
Химическое строение вещества изображается с помощью структурных формул.
Учитель демонстрирует шаростержневые модели веществ с различными формами углеродных цепей: линейной, разветвлённой, замкнутой.
Учитель. А теперь запишите в тетради структурные формулы веществ С4Н10, С4Н8, используя углеродные цепи разной формы.
Ученики пишут структурные формулы в тетрадях, затем один из них записывает формулы на доске и обсуждают.
|
| H |
| H |
| H |
|
|
|
| | |
| | |
| | |
|
|
H | – | C | – | C | – | C | – | H |
|
| | |
| | | |
| | |
|
|
|
| H |
|
| H |
|
| |
|
| H | – | C | – | H |
|
|
|
|
|
| | |
|
|
|
|
|
|
|
| H |
|
|
|
|
|
| H |
| H |
| H |
|
|
|
| | |
| | |
| | |
|
|
H | – | C | – | C | – | C | – | H |
|
| | |
| | |
| | |
|
|
|
| H |
| H |
| H |
|
|
|
| H |
| H |
|
|
|
| | |
| | |
|
|
H | – | C | – | C | – | H |
|
| | |
| | |
|
|
H | – | C | – | C | – | H |
|
| | |
| | |
|
|
|
| H |
| H |
|
|
Учитель. Ребята, в
дальнейшем мы будем пользоваться сокращёнными структурными формулами.
Ребята, в
дальнейшем мы будем пользоваться сокращёнными структурными формулами.
Учитель записывает сокращенные формулы с пояснениями на доске.
СН3 – СН2 – СН2 – СН3 СН3 – СН – СН3 СН2 – СН2
СН3 СН2 – СН2
Учитель. В настоящее время известно более 27 миллионов органических веществ. Как вы думаете, в чём причины многообразия органических веществ?
Ученики высказывают свои предположения и записывают в тетрадях причины многообразия органических веществ: атомы углерода соединяясь друг с другом, образуют углеродные цепи разной длины и формы – линейные, разветвлённые и замкнутые.
Учитель.
Существует ещё одна причина, которую вы найдёте сами, выполнив лабораторную
работу.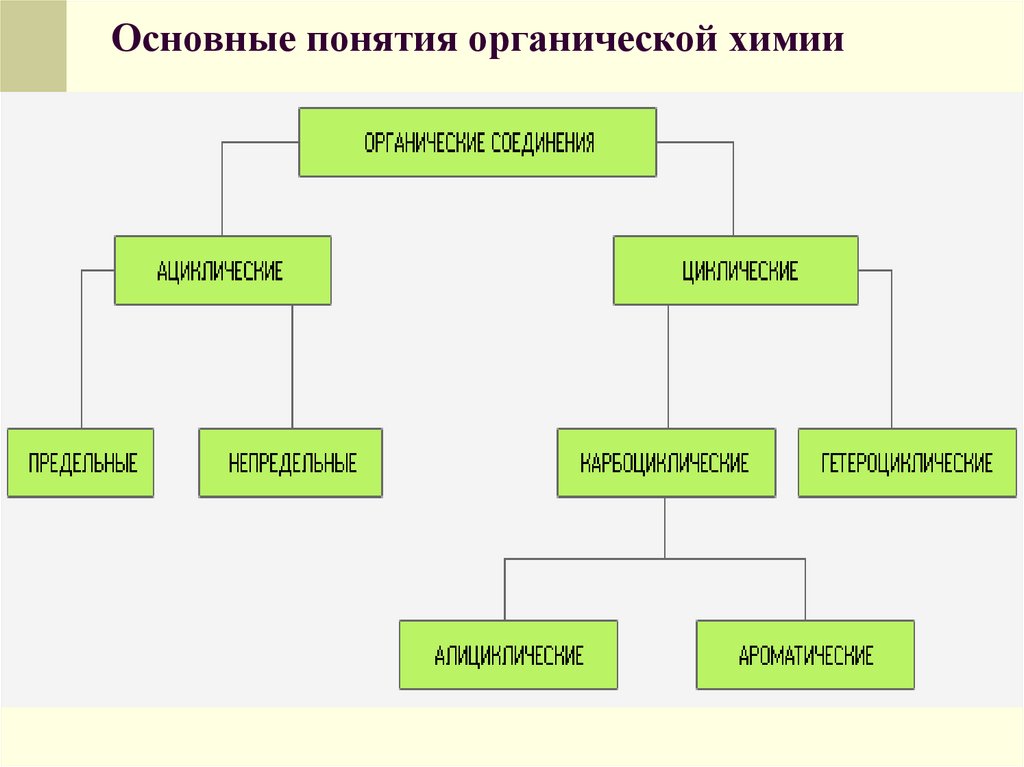 Работаете в парах.
Работаете в парах.
Лабораторная работа. Для работы используйте набор для шаростержневых моделей: 5 чёрных шариков с четырьмя отверстиями каждый (атомы углерода), 12 белых шариков с одним отверстием (атомы водорода), 4 длинных стержня для соединения атомов углерода друг с другом, 12 коротких стержней для соединения атомов водорода с атомами углерода. Задание: используя весь «строительный материал» создайте модель молекулы органического вещества. Изобразите структурную формулу этого вещества в тетради. Постарайтесь сделать как можно больше моделей, запишите их структурные формулы в тетради.
Ученики работают парами. Учитель проверяет правильность сборки моделей и изображения структурных формул, помогает тем, у кого возникли затруднения. На работу отводится 10 минут. После этого структурные формулы записываются на доске и обсуждаются вопросы: что у всех этих веществ одинаковое? чем отличаются приведённые вещества?
СН3 СН3
СН3 – СН2 – СН2 – СН2 – СН3 СН3 – СН – СН2 – СН3 СН3 – С – СН3
СН3
Выясняется,
что у веществ одинаковый состав, а строении разное.
Учитель. Вещества, у которых одинаковый состав, но разное строение и свойства называются изомерами. Явление, которое объясняет существование таких веществ называется изомерия.
Ученики записывают в тетради определения изомеров и изомерии и ещё одну причину многообразия органических веществ – существование изомеров.
III. Закрепление.
1. Задание: составить структурные формулы веществ, имеющих состав С2Н6О. Чем они являются по отношению дуг к другу?
Ученики составляют 2 структурные формулы (1 ученик работает у доски, остальные – в тетрадях), отвечают, что эти вещества – изомеры, т. к. у них одинаковый состав, но разное строение молекул.
СН3 – СН2 – ОН СН3 –О – СН3
2. Учитель. А теперь, ребята,
выполните небольшой тест. Из предложенных вариантов ответов вы должны выбрать
один правильный. (Приложение 2)
(Приложение 2)
На выполнение задания отводится 5 минут. После этого ученики, сидящие за одной партой, обмениваются тетрадями, проверяют работу соседа и выставляют отметку. Ответы на вопросы теста и критерии оценки записаны на доске и после выполнения теста открываются учителем. В конце урока учитель собирает тетради, отметка за выполнение теста выставляется в журнал.
IV. Рефлексия.
Вопросы учителя классу:
1. Что нового узнали на уроке?
2. Какой момент урока вам больше всего понравился?
3. Какое впечатление у вас осталось от урока?
V. Домашнее задание. Учебник О.С. Габриеляна «Химия. 9 класс» (М.: Дрофа, 2006) параграф 32, № 1, 2.
Приложение
1. Таблица
1
Таблица
1
Валентность и степень окисления химических элементов
Понятие | Сущность понятия | Значение |
Степень окисления | Показывает смещение общих электронных пар между атомами элементов в молекуле | Н:Н Н – Н Н20
Н:О:Н Н – О – Н Н2+1О-2
|
Валентность | Показывает число химических связей, соединяющих данный атом с другими атомами в молекуле | Н:Н Н – Н Валентность водорода равна I Н:О:Н Н – О – Н Валентность водорода равна I Валентность кислорода равна II.
|
Приложение 2.
Тест на закрепление.
1. Какой химический элемент входит в состав каждого органического вещества:
а) кислород; б) углерод; в) азот; г) фосфор.
2. Валентность углерода в органических веществах равна:
а) I б) II в) III г) IV
3. Изомеры – это вещества, имеющие:
а) одинаковый состав, но разное строение; б) одинаковый состав и одинаковое строение; в) разный состав и одинаковое строение; разный состав и разное строение.
4. Структурная формула показывает:
а) количественный состав вещества; б) качественный состав вещества; в) порядок соединения атомов в молекуле.
5. Тип химической связи в органических веществах:
а) ионная; б)
ковалентная; в) металлическая; г) водородная.
6. Кристаллическая решётка в органических веществах:
а) атомная; б) молекулярная; в) ионная; г) металлическая.
Органическая химия. История развития – презентация онлайн
1. Органическая химия
ОРГАНИЧЕСКАЯ ХИМИЯИстория развития
2. Органическая Химия
ОРГАНИЧЕСКАЯ ХИМИЯОргани́ческая хи́мия — раздел химии,
изучающий соединения углерода, их
структуру, свойства и методы синтеза.
Органическими называют соединения
углерода с другими элементами.
Мало кто задумывался о том, какова роль органической
химии в жизни современного человека.
 А ведь она
А ведь онаогромна, сложно ее переоценить. С самого утра, когда
человек просыпается и идет умываться, и до самого вечера,
когда он ложится спать, его ежеминутно сопровождают
продукты органической химии. Зубная щетка, одежда,
бумага, косметика, предметы мебели и интерьера и многое
другое – все это дает нам она. Но когда-то все было совсем
не так, и об органической химии знали совсем мало.
Рассмотрим, как складывалась поэтапно история развития
органической химии.
1. Период развития до XIV века, называемый стихийным.
2. XV – XVII века – начало развития или, ятрохимия,
алхимия.
3. Век XVIII – XIX – господствие теории витализма.
4. XIX – XX века – интенсивное развитие, научный этап.
4. Стихийный этап
СТИХИЙНЫЙЭТАП
Начало, или Стихийный этап становления химии органических соединений Данный
период подразумевает само зарождение понятия химии, истоки. А истоки уходят еще
в Древний Рим и Египет, в которых очень способные жители научились добывать
красящие вещества для окраски предметов и одежды из природного сырья – листьев и
стеблей растений.
 Это были индиго, дающий насыщенный синий цвет, и ализорин,
Это были индиго, дающий насыщенный синий цвет, и ализорин,окрашивающий буквально все в сочные и привлекательные оттенки оранжевого и
красного. Необычайно проворные жители разных народностей того же времени также
научились получать уксус, изготавливать спиртные напитки из сахаро- и
крахмалосодержащих веществ растительного происхождения. Известно, что очень
распространенными продуктами в применении в этот исторический период были
животные жиры, смолы и растительные масла, которые использовались
врачевателями и поварами. А также в обиход плотно входили различные яды, как
основное оружие внутриусобных отношений. Все эти вещества являются продуктами
органической химии. Но, к сожалению, как такового понятия “химия” не
существовало, и изучения конкретных веществ с целью выяснения свойств и состава
не происходило. Поэтому данный период и называется стихийным. Все открытия
носили случайный, нецеленаправленный характер бытового значения.
 Так
Такпродолжалось вплоть до следующего столетия.
5. ятрохимия
ЯТРОХИМИЯДействительно, именно в XVI – XVII веках начали зарождаться непосредственные
представления о химии как науке. Благодаря работам ученых того времени были получены
некоторые органические вещества, изобретены простейшие устройства для перегонки и
возгонки веществ, использовалась специальная химическая посуда для измельчения
веществ, разделения продуктов природы на ингредиенты. Основным направлением работы
того времени стала медицина. Стремление получить необходимые лекарства привело к тому,
что из растений выделялись эфирные масла и другие сырьевые компоненты. Так, Карлом
Шееле были получены некоторые органические кислоты из растительного сырья: яблочная;
лимонная; галловая; молочная; щавелевая. На исследование растений и выделение этих
кислот ученому потребовалось 16 лет (с 1769 г. по 1785 г.). Это стало началом развития, были
заложены основы органической химии, которая непосредственно как раздел химии была
определена и названа позднее (начало XVIII века).
 В этот же период средневековья Г. Ф.
В этот же период средневековья Г. Ф.Руэль выделил кристаллы мочевой кислоты из мочевины. Другими химиками была получена
янтарная кислота из янтаря, винная кислота. В обиход входит метод сухой перегонки
растительного и животного сырья, благодаря которому получают уксусную кислоту,
диэтиловый эфир, древесный спирт. Так было положено начало интенсивному развитию
органической химической промышленности в будущем.
6. Теория Якобса Берцелиуса
ТЕОРИЯ ЯКОБСА БЕРЦЕЛИУСАXVIII – XIX века для органической химии весьма двояки: с одной
стороны, происходит целый ряд открытий, которые имеют
грандиозное значение. С другой, долгое время рост и
накопление нужных знаний и правильных представлений
тормозится господствующей теорией витализма. Данную теорию
ввел в обиход и обозначил главной Йенс Якобс Берцелиус,
который при этом сам же дал и определение органической
химии (точный год неизвестен, либо 1807, либо 1808 г.). По
положениям данной теории, органические вещества способны
образовываться только в живых организмах (растениях и
животных, в том числе человека), так как только в живых
существах есть специальная “жизненная сила”, позволяющая
этим веществам вырабатываться.
 В то время как из
В то время как изнеорганических веществ получить органические совершенно
невозможно, так как они являются продуктами неживой
природы, негорючими. Значение органической химии Этим же
ученым была предложена первая классификация всех
известных на тот момент соединений на неорганические
(неживые, все вещества, подобные воде и соли) и органические
(живые, те, что вроде оливкового масла и сахара). Также
Берцелиус первым обозначил конкретно, что такое органическая
химия. Определение звучало так: это раздел химии,
изучающий вещества, выделенные из живых организмов.
В этот период учеными легко осуществлялись превращения
органических веществ в неорганические, например, при
сгорании. Однако о возможности обратных превращений ничего
известно пока не было. Судьбе было угодно распорядиться так,
что именно ученик Йенса Берцелиуса Фридрих Велер
способствовал началу краха теории своего учителя. Немецкий
ученый работал над соединениями цианидов и в одном из
проводимых опытов сумел получить кристаллы, похожие на
мочевую кислоту.
 В результате более тщательного исследования
В результате более тщательного исследованияон убедился, что действительно сумел получить органическое
вещество из неорганического .История развития органической
химии начала набирать обороты.
7. Открытия 19 века
ОТКРЫТИЯ 19 ВЕКА1845 г. – Адольф Кольбе, сумел из простых неорганических веществ С, Н2, О2 многоэтапным полным
синтезом получить уксусную кислоту, которая является веществом органическим.
1812 г. Константином Кирхгофом осуществлен синтез глюкозы из крахмала и кислоты.
1820 г. Анри Браконно денатурировал белок кислотой и затем обработал смесь азотной кислотой и
получил первую из 20 синтезированных позднее аминокислот – глицин.
1809 г. Мишель Шеврель изучал состав жиров, пытаясь расщепить их на составные компоненты. В
итоге он получил жирные кислоты и глицерин.
1854 г. Жан Бертло продолжил работы Шевреля и нагрел глицерин со стеариновой кислотой.
Результат – жир, точно повторяющий структуру природных соединений.
 В дальнейшем он сумел
В дальнейшем он сумелполучить и другие жиры и масла, которые были несколько отличны по строению молекул от
природных аналогов. То есть доказал возможность получения новых органических соединений,
имеющих большое значение, в лабораторных условиях. Ж. Бертло синтезировал метан из сероводорода
(Н2S) и сероуглерода (CS2).
1842 г. Зинин сумел синтезировать анилин, краситель из нитробензола. В дальнейшем ему удалось
получить целый ряд анилиновых красителей. А. Байер создает собственную лабораторию, в которой
занимается активным и успешным синтезом органических красителей, сходных с природными:
ализариновые, индигоидные, антрохиноновые, ксантеновые.
1846 г. синтез нитроглицерина ученым Собреро. Им же разработана теория типов, говорящая о том, что
вещества подобны некоторым из неорганических и их можно получить заменой атомов водорода в
структуре.
1861 г. А. М. Бутлеров синтезировал сахаристое вещество из формалина. Им же были сформулированы
положения теории химического строения органических соединений, актуальные по сей день.

Все эти открытия определили предмет органической химии – углерод и его соединения. Дальнейшие
открытия были направлены на изучение механизмов химических реакций в органике, на
установление электронной природы взаимодействий и на рассмотрение структуры соединений.
8. Вторая половина XIX и XX век – время глобальных химических открытий –
ВТОРАЯ ПОЛОВИНА XIX И XX ВЕК – ВРЕМЯГЛОБАЛЬНЫХ ХИМИЧЕСКИХ ОТКРЫТИЙ
История развития органической химии с течением времени претерпевала все большие
изменения. Работа множества ученых над механизмами внутренних процессов в
молекулах, в реакциях и системах дала свои плодотворные результаты.
Так, в 1857 г. Фридрих Кекуле разрабатывает теорию валентности. Также ему
принадлежит величайшая заслуга – открытие строения молекулы ароматического
углеводорода бензола.
В это же время А. М. Бутлеров формулирует положения теории строения соединений, в
которых указывает на четырехвалентность углерода и на явление существования
изомерии и изомеров.

В. В. Марковников и А. М. Зайцев углубляются в изучение механизмов реакций в
органике и формулируют ряд правил, которые эти механизмы объясняют и подтверждают.
В 1873 – 1875 гг. И. Вислиценус, Вант-Гофф и Ле Бель изучают пространственное
расположение атомов в молекулах, открывают существование стерео-изомеров и
становятся родоначальниками целой науки – стереохимии.
Множество разных людей принимали участие в создании той области органики, которую
мы имеем сегодня. Поэтому ученые органической химии заслуживают внимания. Конец
XIX и XX века – это времена глобальных открытий в фармацевтике, лакокрасочной
промышленности, квантовой химии.
Рассмотрим открытия, обеспечившие максимальное значение органической химии. 1881 г.
М. Конрад и М. Гудцейт синтезировали анестетики, веронал и салициловую кислоту. 1883
г. Л. Кнорр получил антипирин. 1884 г. Ф. Штолль получил пирамидон. 1869 г. братья
Хайатт получили первое искусственное волокно.
 1884 г. Д. Истмен синтезировал
1884 г. Д. Истмен синтезировалцеллулоидную фотопленку. 1890 г. получено медноаммиачное волокно Л. Депасси. 1891 г.
Ч. Кросс с коллегами получил вискозу. 1897 г. Ф. Мишер и Бухнер основали теорию
биологического окисления (было открыто бесклеточное брожение и энзимы как
биокатализаторы). 1897 г. Ф. Мишер открыл нуклеиновые кислоты. –
Начало XX века – новая химия.
1917 г. Льюис открыл электронную природу химической связи в молекулах.
1931 г. Хюккель – основатель квантовых механизмов в химии. 1931-1933 гг. Лаймус
Полинг обосновывает теорию резонанса, а позже его сотрудники раскрывают
сущность направлений в химических реакциях. 1936 г. синтезирован нейлон.
1930-1940 гг. А. Е. Арбузов дает начало развитию фосфоорганических соединений,
которые являются основой для производства пластмасс, лекарств и инсектицидов.
1960 г. академик Несмеянов с учениками создает в лабораторных условиях первую
синтетическую пищу.
1963 г. Дю Винью получает инсулин, что является огромным шагом вперед в
медицине.

1968 г. индиец Х. Г. Корана сумел получить простой ген, что помогло в
расшифровке генетического кода.
10. Современная система органических соединений
СОВРЕМЕННАЯ СИСТЕМАПроделав огромный и
сложный путь в развитии,
органическая химия и
сегодня не стоит на месте.
Известно более 10 млн.
соединений, и это число с
каждым годом растет.
Поэтому существует
определенная
систематизированная
структура расположения
веществ, которые нам дает
органическая химия.
Классификация
органических соединений
представлена в таблице.
Изучение всего
многообразия веществ и
реакций, в которые они
вступают, и составляет
предмет органической
химии на сегодняшний день.
ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
11. Разновидности формул веществ в органике
РАЗНОВИДНОСТИ ФОРМУЛ ВЕЩЕСТВ В ОРГАНИКЕСамые распространенные формулы, выражающие количественный состав
соединения, называются эмпирическими.
 Такие формулы существуют для
Такие формулы существуют длякаждого неорганического вещества. Но когда дело коснулось составления
формул в органике, перед учеными встало множество проблем. Во-первых,
масса многих из них исчисляется сотнями, а то и тысячами. Сложно
определить эмпирическую формулу для такого громадного вещества.
Поэтому со временем появился такой раздел органической химии, как
органический анализ. Основоположниками его считаются ученые Либих,
Велер, Гей-Люссак и Берцелиус. Именно они, совместно с трудами А. М.
Бутлерова, определили существование изомеров – веществ, имеющих
одинаковый качественный и количественный состав, но различающихся
строением молекулы и свойствами. Именно поэтому строение органических
соединений выражается на сегодняшний день не эмпирической, а
структурной полной или структурной сокращенной формулой. Эти структуры
– характерная и отличительная особенность, которую имеет органическая
химия. Формулы записываются при помощи черточек, обозначающих
химические связи.
 например, сокращенная структурная формула бутана
например, сокращенная структурная формула бутанабудет иметь вид Ch4 – СН2 – СН2 – СН3. Полная структурная формула
показывает все имеющиеся в молекуле химические связи. Также существует
способ записывания молекулярных формул органических соединений. Он
выглядит так же, как эмпирические у неорганических. Для бутана,
например, она будет такой: С4Н10. То есть молекулярная формула дает
представление только о качественном и количественном составе соединения.
Структурные же характеризуют связи в молекуле, поэтому по ним можно
предсказать будущие свойства и химическое поведение вещества. Это те
особенности, которые имеет органическая химия. Формулы записываются в
любом виде, каждый из них считается верным.
12. Типы реакций в органической химии
ТИПЫ РЕАКЦИЙ В ОРГАНИЧЕСКОЙХИМИИ
Существует определенная классификация
органической химии по типу происходящих реакций.
Причем таких классификаций несколько, по
различным признакам.
 Рассмотрим основные из
Рассмотрим основные изних. Механизмы химических реакций по способам
разрыва и образования связей: гомолитические или
радикальные; гетеролитические или ионные.
Реакции по типам превращений: цепные
радикальные; нуклеофильного алифатического
замещения; нуклеофильного ароматического
замещения; реакции элиминирования;
электрофильного присоединения; конденсации;
циклизации; электрофильного замещения; реакции
перегруппировок. По способу запуска реакции
(инициирования) и по кинетическому порядку также
иногда реакции классифицируются. Это основные
особенности реакций, которыми обладает
органическая химия. Теория, описывающая
подробности протекания каждой химической
реакции, была открыта еще в середине XX века и
подтверждается и дополняется до сих пор с каждым
новым открытием и синтезом. Следует заметить, что
вообще реакции в органике протекают при более
жестких условиях, чем в неорганической химии.
 Это
Этосвязано с большей стабилизацией молекул
органических соединений за счет образования
внутри и межмолекулярных прочных связей.
Поэтому практически ни одна реакция не обходится
без повышения температуры, давления или
применения катализатора.
13. Современное определение органической химии
СОВРЕМЕННОЕ ОПРЕДЕЛЕНИЕ ОРГАНИЧЕСКОЙХИМИИ
В целом, развитие органической химии
шло по интенсивному пути на протяжении
нескольких столетий. Накоплено огромное
количество сведений о веществах, их
структурах и реакциях, в которые они
могут вступать. Синтезированы миллионы
полезных и просто необходимых сырьевых
компонентов, используемых в самых
различных областях науки, техники и
промышленности. Понятие органической
химии сегодня воспринимается как нечто
грандиозное и большое, многочисленное и
сложное, разнообразное и
значительное.органическая химия теория
В свое время первым определением этого
великого раздела химии было то, что дал
Берцелиус: это химия, изучающая
вещества, выделенные из организмов.
 С
Стого момента прошло много времени,
совершено множество открытий и осознано
и раскрыто большое количество
механизмов внутрихимических процессов.
Вследствие этого сегодня есть иное
понятие, что такое органическая химия.
Определение ей дается такое: это химия
углерода и всех его соединений, а также
методов их синтеза.
Презентацию выполнил ученик 9 А класса
Мусалов Назар
Конспект урока по химии на тему «Предмет органической химии. Органические вещества»
МБОУ «Средняя общеобразовательная школа № 32»
Конспект урока
по химии в 9 классе
«Предмет органической химии. Органические вещества»
Демьянова Оксана Николаевна,
учитель химии
Тема: «Предмет органической химии. Органические вещества»
Органические вещества»
Цель урока: сформировать представление о составе и строении органических соединений, показать особенности органических веществ в сравнении с неорганическими. Познакомить с понятием валентности. Раскрыть значение органических веществ
Задачи урока:
1. Образовательные: сформировать понятие о предмете органической химии, рассмотреть особенности органических веществ; ознакомить с понятием валентности; начать формировать навыки составления структурных формул; раскрыть значение органических веществ.
2. Развивающие: развивать у учащихся умение сравнивать, анализировать и применять информацию из других областей знаний, делать выводы. Развивать память, логическое мышление, внимание.
3. Воспитательные: воспитывать аккуратность, трудолюбие, патриотические, эстетические и нравственные качества.
Оборудование: Разнообразные органические вещества для демонстрации. Шаростержневые модели органических соединений.
Шаростержневые модели органических соединений.
Ход урока.
1. Организационный момент.
2. Актуализация знаний
Прежде, чем мы приступим к изучению нового материала, давайте вспомним:
Что такое химия?
О.: Химия – это наука о веществах, свойствах веществ и превращениях веществ.
У.: Что такое вещество?
О.: Это то, из чего состоит тело.
У.: Из курса биологии вспомните, на какие две группы делятся все вещества?
О.: неорганические и органические.
У.: в течение двух лет мы изучали состав, строение, свойства и применение неорганических веществ. С сегодняшнего дня мы приступаем к изучению многочисленной группы органических веществ. Я не случайно упомянула о многочисленности этой группы: количество известных неорганических веществ исчисляется сотнями тысяч, а количество органических веществ исчисляется миллионами. На данный момент известно более 27 млн.органических веществ. В связи с этим появилась необходимость выделить отдельный раздел химии, изучающий орг.вещ-ва – органическая химия.
В связи с этим появилась необходимость выделить отдельный раздел химии, изучающий орг.вещ-ва – органическая химия.
Тема урока «Предмет органической химии. Органические вещества».
3. Целеполагание.
У.: Для начала давайте выясним, что будет являться предметом органической химии?
О.: -органические вещества, их строение, свойства и применение.
Органическая химия- наука, изучающая строение, свойства, применение органических веществ.(запись в тетр.)
Попробуйте определить цель сегодняшнего урока, чем мы будем заниматься?
Цель сегодняшнего урока: выяснить, какие вещества называют органическими, рассмотрим состав, строение органических веществ, выясним чем органические вещества отличаются от неорганических, узнаем какое строение имеют органические вещества в жизни человека.
4. Изучение нового материала.
Перед вами находятся образцы органических веществ, которые знакомы вам из повседневной жизни: свечка (парафин), кусок резины (в состав входит каучук), полиэтиленовый пакет (полиэтилен), подсолнечное масло (жиры), сахар (углеводы), мыло (соли жирных кислот), тетрадь, одежда (целлюлоза), упаковка аспирина (ацетилсалициловая кислота), ручка (смолы).
Все эти вещества очень разные, но у них есть один общий признак – все они имеют одинаковый СОСТАВ.
1.Состав органических веществ.
Для того, чтобы выяснить состав органических веществ, предлагаю решить небольшую логическую задачу:
Определите какие химические элементы входят в состав органических веществ если известно, что при их сгорании чаще всего образуются два вещества: углекислый газ и вода: органическое вещество + O2 → CO2↑ + H2O |
О.: в состав орг.вещ-в входит углерод и водород
У.: реже кислород, сера, азот и фосфор.
Давайте вспомним, какие химические элементы входят в состав неорганических веществ
О.: все элементы Периодической Системы Менделеева Д.И.
У.: Зная состав орг.вещ-в, вы сможете выполнить
задание №1 (Приложение):
Из перечня предложенных формул выберите только формулы органических веществ. Из букв, соответствующих правильным вариантам ответа, составьте название органического вещества, которое входит в состав косметических средств.
Из букв, соответствующих правильным вариантам ответа, составьте название органического вещества, которое входит в состав косметических средств.
Б | Г | У | Л | И | М | Ц | Е | К | Р | Д | И | Н |
HCl | CH3COOH | CaCO3 | C7H8 | C3H8 | KNO3 | C2H5NH2 | CH3COONH2 | Na2CO3 | C6H12 | H2CO3 | CH2Cl | С2Н5ОН |
По какому признаку вы выбирали формулы органических веществ.
О.: в их состав входит С и Н.
Какие вещества относятся к органическим?
О.: органические вещества – это вещества в состав которых входит углерод и водород.(зап. в тетр.)
У.: мы выяснили, что органические вещества имеют одинаковый состав, но свойства у них разные. Почему?
О.: они имеют разное строение.
2. Строение органических веществ.
У.: посмотрите на формулы выбранных вами орг.вещ-в, какой тип связи в их молекулах?
О.: ковалентная – связь между атомами неметаллов, за счет образования общих электронных пар.
У.: Большинство химических связей в орг.вещ-вах имеет ковалентный характер. Вспомните, какие типы химической связи были характерны для неорг.вещ-в?
О.: ковалентная, ионная, металлическая.
У.: рассмотрим строение органических веществ на примере молекулы метана, СН4 (Бесцветный газ, легче воздуха, образуется при гниении органических веществ, называется “болотным или рудничным газом”. ).
).
Задание: написать механизм образования связи в молекуле метана. (Приложение)
(1 ученик пишет механизм:)
У.: сколько химических связей образует С и Н? (4 и 1). Какие электроны участвуют в образовании связи (неспаренные электроны)
Способность образовывать определенное число химических связей называется валентностью (запись в тетр.)
Обозначается римскими цифрами. Какова валентность углерода? ( IV).
В органических соединениях углерод всегда 4-хвалентен. (тетр)
Задание: определить валентность N, O, Cl. (Приложение)
Мы выяснили особенности строения органических веществ на примере метана, а теперь попробуем построить модель его молекулы.
Лабораторная опыт. Изготовление моделей молекул углеводородов.
1. составьте модель молекулы метана. Напишите структурную формулу.
2. составьте модель молекулы органического вещества, состоящего из двух атомов углерода. Напишите структурную формулу.
Напишите структурную формулу.
3. составьте модель молекулы органического вещества, состоящего из трех атомов углерода. Напишите структурную формулу.
(Отрабатываются умения составлять полную и сокращенную структурные формулы, молекулярную формулу по структурной формуле)
3. Значение органических веществ в жизни человека (краткое сообщение ученика)
«Значение орг.вещ-в переоценить невозможно, настолько оно велико. Я просто предлагаю вам представить себе каким будет наш мир без орг.вещ-в.
Не станет больше деревянных предметов, не будет шариковой ручки, сумки для книг, самих книг и тетрадей, сделанных из органического вещества – целлюлозы. В классе не будет линолеума, от парт останутся лишь металлические ножки. По улице не будут ездить машины – нет бензина, а от самих машин останутся лишь металлические части. Исчезнут корпуса компьютеров и телевизоров. В аптеках не будет большинства лекарств, и нечего будет есть (вся пища тоже состоит из органических соединений). Нечем будет помыть руки и нечего надеть на себя, ведь и мыло, и шампуни, и любые хлопчатобумажные, шерстяные, синтетические волокна, кожа, кожезаменители , красители для тканей – все это производные углеводородов. Да и смотреть на этот мир будет некому – от нас останется лишь соленая вода да скелет, ведь организмы всех живых существ состоят из органических соединений.»
Нечем будет помыть руки и нечего надеть на себя, ведь и мыло, и шампуни, и любые хлопчатобумажные, шерстяные, синтетические волокна, кожа, кожезаменители , красители для тканей – все это производные углеводородов. Да и смотреть на этот мир будет некому – от нас останется лишь соленая вода да скелет, ведь организмы всех живых существ состоят из органических соединений.»
5. Закрепление нового материала. Рефлексия.
Для того, чтобы узнать насколько хорошо вы усвоили материал урока предлагаю решить тест(Приложение)
6.Рефлексия.
Оцените, насколько вы усвоили материал урока по каждому пункту плана.
1.состав органических веществ
2. строение органических веществ. Валентность.
3. значение органических веществ в жизни человека.
Приложение
Тема: Предмет органической химии. Органические вещества.
Задание №1
Определите, какие химические элементы входят в состав органических веществ, если известно, что при их сгорании чаще всего образуются два вещества: углекислый газ и вода:
органическое вещество + O2 → CO2↑ + H2O |
Задание №2
Из перечня предложенных формул выберите только формулы органических веществ. Из букв, соответствующих правильным вариантам ответа, составьте название органического вещества, которое входит в состав косметических средств.
Из букв, соответствующих правильным вариантам ответа, составьте название органического вещества, которое входит в состав косметических средств.
Б | Г | У | Л | И | М | Ц | Е | К | Р | Д | И | Н |
HCl | CH3COOH | CaCO3 | C7H8 | C3H8 | KNO3 | C2H5NH2 | CH3COONH2 | Na2CO3 | C6H12 | H2CO3 | CH2Cl | С2Н5ОН |
Задание №3
Определите валентность атомов азота (N), кислорода (O), хлора (Cl).
Задание №4
Лабораторный опыт.
Изготовление моделей молекул углеводородов.
А) составьте модель молекулы метана. Напишите структурную формулу.
Б) составьте модель молекулы органического вещества, состоящего из двух атомов углерода. Напишите структурную формулу.
В) составьте модель молекулы органического вещества, состоящего из трех атомов углерода. Напишите структурную формулу.
Г) составьте модель молекулы вещества, структурная формула которого: СН3 – СН – СН3
│
СН3
Задание №5
Тест.
1. выберите формулу органического вещества.
А) HNO3 Б) CaC2 В) C2H2 Г) CO2
2. валентность атом углерода в органических соединениях.
А) II Б) IV В) V Г) VI
3. тип химической связи в молекулах органических веществ:
тип химической связи в молекулах органических веществ:
А) ионная Б) водородная В) ковалентная Г) металлическая
4. выберите структурную формулу вещества состава С4Н10
А) СН3 – СН3 б) СН3 – СН – СН3 В) СН3 –СН – СН2 – СН3 Г) СН3 – СН2 – СН3
│ │
СН3 СН3
5. какая молекулярная формула отражает состав данной молекулы:
СН3 – СН2 – СН – СН2 – СН3
│
СН3
А) С4Н10 Б) С5Н12 В) С6Н12 Г) С6Н14
Тема: Предмет органической химии. Органические вещества.
Задание №1
Определите, какие химические элементы входят в состав органических веществ, если известно, что при их сгорании чаще всего образуются два вещества: углекислый газ и вода:
органическое вещество + O2 → CO2↑ + H2O |
Задание №2
Из перечня предложенных формул выберите только формулы органических веществ. Из букв, соответствующих правильным вариантам ответа, составьте название органического вещества, которое входит в состав косметических средств.
Б | Г | У | Л | И | М | Ц | Е | К | Р | Д | И | Н |
HCl | CH3COOH | CaCO3 | C7H8 | C3H8 | KNO3 | C2H5NH2 | CH3COONH2 | Na2CO3 | C6H12 | H2CO3 | CH2Cl | С2Н5ОН |
Задание №3
Определите валентность атомов азота (N), кислорода (O), хлора (Cl).
Задание №4
Лабораторный опыт.
Изготовление моделей молекул углеводородов.
А) составьте модель молекулы метана. Напишите структурную формулу.
Б) составьте модель молекулы органического вещества, состоящего из двух атомов углерода. Напишите структурную формулу.
В) составьте модель молекулы органического вещества, состоящего из трех атомов углерода. Напишите структурную формулу.
Г) составьте модель молекулы вещества, структурная формула которого: СН3 – СН – СН3
│
СН3
Задание №5
Тест.
1. выберите формулу органического вещества.
А) HNO3 Б) CaC2 В) C2H2 Г) CO2
2. валентность атом углерода в органических соединениях.
А) II Б) IV В) V Г) VI
3. тип химической связи в молекулах органических веществ:
тип химической связи в молекулах органических веществ:
А) ионная Б) водородная В) ковалентная Г) металлическая
4. выберите структурную формулу вещества состава С4Н10
А) СН3 – СН3 б) СН3 – СН – СН3 В) СН3 –СН – СН2 – СН3 Г) СН3 – СН2 – СН3
│ │
СН3 СН3
5. какая молекулярная формула отражает состав данной молекулы:
СН3 – СН2 – СН – СН2 – СН3
│
СН3
А) С4Н10 Б) С5Н12 В) С6Н12 Г) С6Н14
Самые важные основные концепции органической химии
Если вы начинаете
лицо основная органическая химия , вы можете почувствовать себя подавленным
огромное количество материала.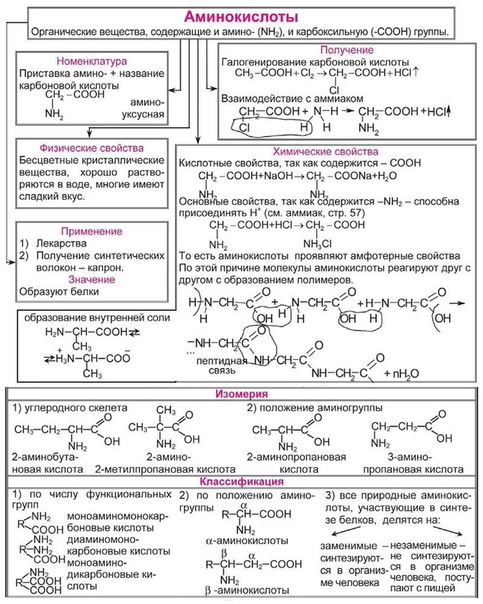
Вводные курсы органической химии могут показаться самыми сложными. Но не волнуйтесь! В этом посте мы поговорим о «хитрости» или ключевой концепции, которая поможет вам на этом пути.
Скажем, эта концепция представляет собой «точку зрения», которую вы можете принять и которая поможет вам взглянуть на органическую химию с более простой точки зрения.Увидеть картину в целом.
Каковы ключи к изучению органической химии?
Не только вы чувствуете, что эта тема особенная. В этом есть смысл, поскольку органическая химия – это уникальная отрасль науки. Процесс обучения, которому ваш мозг должен следовать для o-chem, сильно отличается.
В любом случае надо приготовить . В этом вам помогут хороший учебник по органической химии и хороший набор для молекулярного моделирования.Очевидно, вам также понадобится солидный фон в области общей химии.
И да, тоже помогает научиться управлять идеальным TLC!
Однако есть ключевые концепции, особенно те, которые мы обсудим здесь, которые помогут вам увидеть органическую химию с более яркой стороны.
Продолжайте читать!
Что является наиболее важным понятием в основах органической химии?
В очень простой манере вы можете утверждать, что можно объяснить все в органической химии с помощью аргументов либо «электронных эффектов», «стерических эффектов», либо комбинации двух .
Проще говоря, нуклеофилы атакуют электрофильные позиции из-за электронных эффектов. Более доступные электрофильные центры будут более реактивными из-за стерических эффектов. Эти простые, но важные концепции являются основой большинства рационализаций или моделей органической химии.
Электронные и стерические эффекты лежат в основе большинства моделей органической химии. Стереоэлектроника – это не концепция, которая сама по себе обычно преподается на вводных курсах (например, если вы посмотрите на страницу в Википедии, она покажет значительно расширенное обсуждение).Однако нам нравится рассматривать комбинацию стерических и электронных эффектов как упрощенную версию этой концепции. Эта комбинация является ключом к пониманию общей картины органической химии .
Эта комбинация является ключом к пониманию общей картины органической химии .
Мы объясним, что это за комбинация, пройдя основы того, что такое электронные и стерические эффекты. Мы покажем разные примеры того, как эти два понятия используются для рационализации химии, как независимо, так и в сочетании.
Я бы сказал, что в большинстве учебников отсутствует конкретный общий обзор по этому поводу (хотя вы можете возразить, что это вся основная органическая химия).Итак, мы постараемся восполнить этот пробел в этой статье.
Основы органической химии: что такое электронные эффекты?
Если вы что-нибудь изучали о реакционной способности органических молекул, вы знаете, что движение электронов управляет всем.
Обычно две органические молекулы вступают в реакцию, потому что одна часть (или функциональная группа ) одной из молекул имеет высокую электронную плотность ( нуклеофила ), а другая часть другой молекулы имеет низкую электронную плотность ( электрофил ) .
Что такое нуклеофилы и электрофилы?
Очень простыми словами: мы говорим, что молекула ведет себя как нуклеофил , если у нее есть функциональная группа с большим количеством электронов (высокая электронная плотность), и она хочет атаковать другую функциональную группу, в которой отсутствуют электроны. Этот второй партнер, который имеет низкую электронную плотность и требует электронов, называется электрофилом .
На предыдущем рисунке Схема наиболее типичного электрофила в органической химии: карбонила группа.
Это отличный пример того, как работает электроника. В этой молекуле электроотрицательный атом (O) ковалентно присоединен к углероду. Кислород более электроотрицателен, чем углерод, поэтому он хочет удерживать электроны ковалентной связи больше, чем углерод . Это комбинация индукционного и резонансного эффектов.
Но результат очевиден: частичный отрицательный заряд (-) генерируется у атома кислорода, а частичный положительный заряд (𝛿-) генерируется у карбонильного атома углерода. Такое распределение заряда делает атом углерода карбонильной группы потенциальным электрофилом, который может реагировать с различными нуклеофилами.
Такое распределение заряда делает атом углерода карбонильной группы потенциальным электрофилом, который может реагировать с различными нуклеофилами.
Как распределение заряда влияет на тенденции реактивности?
Плюс и минус хотят, чтобы собрались вместе. Таким образом, нуклеофилы могут реагировать с электрофилами.
Типичными нуклеофилами кетонов являются органические или металлоорганические реагенты с высокой электронной плотностью. В этом примере отрицательно заряженный атом углерода реактива Гриньяра , такого как PhMgBr (фенилмагнийбромид), действует как нуклеофил.
Нуклеофильное присоединение металлоорганических реагентов к электрофильным кетонамДобавление нуклеофила к кетон высвобождает эту поляризацию заряда на электрофильном кетоне (это движущая сила реакции), давая промежуточный алкоксид, который после обработки источником протонов (H + ), дает соответствующий третичный спирт.
Это наверное один из первых
примеры, которые вам будут преподавать в любом курсе реакционной способности органической химии,
и это действительно просто. Не правда ли?
Не правда ли?
Что ж, хорошие новости! Большинство реакций между органическими соединениями можно объяснить, просто используя его принцип распределение электронов!
Итак, как определить положительный и отрицательный заряд в каждой органической молекуле, чтобы мы могли знать, что с чем будет реагировать?
Давайте исследуем общие тенденции в электронной плотности. Продолжай читать!
Карты электронной плотности молекул
Эту плотность электронов внутри молекулы можно отобразить очень визуально.Взгляните на несколько основных примеров на рисунке ниже:
Распределение электронной плотности в малых молекулах: этан и хлорэтан.Первый пример – простой углеводород: этан. Этан – очень неполярная молекула. Их электроны распределены равномерно по всей молекуле. Поляризации заряда нет, поэтому будет нереактивная молекула.
С другой стороны, хлорэтан – это сильно поляризованная молекула. Как вы можете видеть на карте плотности, в атоме хлора много электронной плотности (красная зона). Это связано с тем, что хлор более электроотрицателен, чем углерод, к которому он присоединен, создавая частичный положительный заряд на соседнем углероде.
Это связано с тем, что хлор более электроотрицателен, чем углерод, к которому он присоединен, создавая частичный положительный заряд на соседнем углероде.
То же самое происходит с хлорметаном или вообще с любым органическим алкилгалогенидом. Это полностью контролирует реактивность этого типа молекул. Научиться определять, где находятся электроны, – одна из самых важных вещей, которую нужно понять!
Управляемые электроникой реакции замещения
Эта поляризация связей делает углерод, непосредственно прикрепленный к хлориду, электрофильным центром.Такие электрофильные центры, как этот, могут быть атакованы нуклеофилами посредством реакции нуклеофильного замещения (SN2).
Реакция нуклеофильного замещения (S N 2) Реакции нуклеофильного замещения и электрофильное присоединение, вместе с реакциями элиминирования, как правило, являются всей реакционной способностью, описанной в любом введении к курсам органической химии.
Чтобы глубже погрузиться в концепцию электронной плотности, давайте вернемся к нашему первому примеру из предыдущего раздела.Другая карта плотности может легко объяснить реакционную способность карбонильной группы:
Как вы можете видите, сильно поляризованная связь порождает частичный отрицательный заряд в кислород (красная зона) и частичный положительный заряд в углероде C = O (синяя зона).
Это простая концепция, но она действительно помогает увидеть более широкую картину органического химия. Если вы понимаете, что органических реакции происходят из-за того, что зоны с высокой электронной плотностью молекул «атакуют» низкую зоны электронной плотности других молекул , это большое дело!
Другой
отличным примером органической реакции, управляемой электроникой, является электрофильный ароматический
подмена.Однако мы рассмотрим это в конце этой статьи, так как
он также работает как отличный пример a
комбинация электронных и стерических эффектов .
Но сначала нам нужно взглянуть на другую сторону медали. Стерические эффекты , или стерические помехи .
Что такое стерические эффекты?
Представьте органические соединения в виде больших скоплений электронов.
Электроны заряжены отрицательно, поэтому, как правило, при приближении одной молекулы к другой существует штраф за энергию (хотя есть исключения для положительных нековалентных взаимодействий).
Представьте себе двоих отрицательные полюса двух магнитов: они держатся подальше друг от друга, если не больше сила, соединяет их.
То же самое и с органическими молекулами. В этом случае, как мы видели в разделе об электронных эффектах, эта большая сила, которая может соединить электрофилы и нуклеофилы вместе, является электронной поляризацией. Более высокая термодинамическая стабильность, которая достигается при соединении электрофила и нуклеофила, перекрывает естественное отталкивание между молекулами.
Аналогичная концепция проиллюстрирована на диаграмме потенциальной энергии. Система из двух атомов приобретает минимальную энергию (наиболее устойчивая ситуация) на данном расстоянии связи. Если вы сдвинете их ближе друг к другу, электронное отталкивание станет слишком большим (смещение влево по оси x), и энергия системы возрастет. В основном это означает, что он дестабилизируется из-за отталкивания ядро-ядро (+) или электрон-электрон (-).
Диаграмма потенциальной энергии. Кредит Chemistry: The Central Science Браун и соавторы (Pearson, 2012)Но не волнуйтесь, если вы не получили физического объяснения! Концепция стерических эффектов на самом деле намного больше просто чем это!
Это сводится к такому: Это будет много нуклеофилу легче приблизиться к электрофильному центру, если последний более доступный (что означает, если вокруг него меньше объемных заместителей).
Как стерические эффекты влияют на химические реакции?
Следующий пример, взятый из книги Уэйда Organic Chemistry , идеально подходит для визуализации этой базовой концепции органической химии:
Стерические эффекты в реакциях замещения. Кредит Organic Chemistr г. 7-е издание. L. G. Wade, Jr. et al.
Кредит Organic Chemistr г. 7-е издание. L. G. Wade, Jr. et al.Реакция SN2 в бромистом этиле протекает очень быстро (слева). Электрофильный углерод очень доступен, и реакция будет протекать гладко.
На с другой стороны, изопропилбромид имеет вторичный электрофильный углерод.Этот центр будет намного более защищенным (вокруг него более объемная среда), поэтому реакция нуклеофильного замещения может иметь место, но будет намного медленнее чем для основного. Это связано с более высокими взаимодействиями отталкивания, которые будет существовать между нуклеофильной молекулой (в данном случае OH – ) и две метильные группы электрофильной молекулы.
В третьем случае мы имеем третичный алкилбромид. Электрофильный углерод будет полностью блокирован бутильной группой трет .Электрофил не может приблизиться к электрофильному центру, и реакция S N 2 никогда не будет происходить на этой подложке.
Однако есть и другие механизмы (S N 1), которые могут позволить этой реакции в некоторых случаях протекать. Но это определенно никогда не произойдет через пента-скоординированный переход состояния, типичный для согласованных реакций S N 2.
Но это определенно никогда не произойдет через пента-скоординированный переход состояния, типичный для согласованных реакций S N 2.
Мы рассмотрели это в другом учебном обзоре о реакциях SN2 и SN1 и о том, как они связаны со стерическими эффектами.
Реальный пример стерических эффектов в основной органической химииWe может углубиться в основную концепцию стерических эффектов органической химии с помощью пример из реальной жизни.
Посмотрите на реакцию Финкельштейна дибромалкана ниже:
Это реакция идет по простой согласованной (это означает, что нуклеофил -иодид- атак в то же время, когда уходящая группа – бромид – покидает молекулы) нуклеофильная атака I – от йодида натрия до алкилбромид.
Есть два электрофильных углерода, присоединенные к бромиду, которые в принципе могут реагировать. Однако получается только продукт замены первичного! В третичный бромид не поврежден.
Это
стерические эффекты в действии.
Эффект дистальных объемных групп в органических реакциях
Стерические препятствия также могут играть роль, если физически большие заместители находятся в атомах углерода, которые фактически не вступают в реакцию. Соседние заместители с большим объемом может определить скорость химической реакции.
Пример представляет собой простой гидролиз сложного эфира.
Чем больше заместителей, находящихся поблизости, тем менее доступным будет реактивный электрофильный центр, и в результате гидролиз будет медленнее:
Стерические эффекты можно легко визуализировать с помощью набора молекулярных моделей. Ранее мы обсуждали, как их использовать для этих и других целей.
Это приносит нас к финалу этого обзора концепции: слияние вместе электронные и стерические эффекты .
Как совместить электронные и стерические эффекты в одной концепции?
Сейчас что мы прекрасно знаем, что такое электронные и стерические эффекты, понимание ситуации, в которой они оба играют роль одновременно, будьте довольно прямолинейны!
Но
реакционной способностью молекулы можно управлять за счет обоих эффектов одновременно.
Теперь это может быть как угодно сложным или сложным, но в качестве примеров можно использовать очень простые реакции, такие как электрофильное ароматическое замещение (EAS).
Введение в электрофильные ароматические замены
Мы не собираемся рассматривать эту классическую реакцию с нуля, это было бы слишком долго для целей данной статьи. На других сайтах есть много материалов об этой трансформации.
Но мы, очевидно, рассмотрим основы. Наиболее типичным примером EAS является нитрование ароматического соединения обработкой HNO 3 и H 2 SO 4 .
Бензольное кольцо действует как нуклеофил, атакующий катион NO 2 + , электрофил, генерируемый in situ.
Реакция проходит через положительно заряженный промежуточный продукт Веланда, который затем реоматизируется путем отрыва протона (H + ). Это дает нитрованное ароматическое кольцо.
Основной механизм электрофильных ароматических замещений (ЭАЗ). Кредит на V8rik через Википедия.
Кредит на V8rik через Википедия.Интересно, что вместо простого бензола мы используем замещенные бензолы в качестве исходных материалов.
Электронные эффекты в ШАЛ: основная концепция органической химии
заместители в ароматическом кольце определяют его реакционную способность по отношению к электрофильному ароматическое замещение.
Как мы уже упоминали, ароматическое кольцо действует как нуклеофил. Следовательно, он будет гораздо более реактивным, если в нем будут заместители, которые отдают электроны кольцу. Это увеличивает электронную плотность на делокализованных ароматических связях, делая его лучшим нуклеофилом.
Как вы можете видеть на картинке, помещая группу донора электронов (такую как Me, MeO или NMe 2 ) в кольце, будет активировано . Кольцо будет иметь большую плотность электронов и будет более нуклеофильный (фактически более реактивный).
Вкл.
с другой стороны, если вы добавите электроноакцепторную группу (например, CF 3 ,
CO 2 R или NO 2 ) эффект будет противоположным. Кольцо
становится беднее электронами, поэтому деактивировал .
Кольцо
становится беднее электронами, поэтому деактивировал .
Добавление стерических эффектов к основам органической химии
Природа заместителей влияет на большее количество факторов, таких как региоселективность реакции (в каком положении будет происходить электрофильное замещение). На этом сайте есть много информации об этом.
Но для В целях этой публикации стоит отметить, что алкильных группы, таких как метил, являются активирующими группами ( через индукцию ), которые также направляют EAS к орто и пара позиции кольца.
Вы наверное уже догадываюсь, куда это идет…
Ну, если вы возьмете толуол (метилбензол), вы получите, как и ожидалось, почти 50:50 смесь замещенных продуктов орто и п. , в размере примерно в 20 раз быстрее, чем для чистого бензола.
С другой стороны, если вы возьмете трет, -бутилбензол, вы получите гораздо более высокую селективность. Хотя в электронном виде обе группы Me и tBu почти одинаковы, t Bu является гораздо более крупным заместителем. В игру вступают стерические эффекты!
Хотя в электронном виде обе группы Me и tBu почти одинаковы, t Bu является гораздо более крупным заместителем. В игру вступают стерические эффекты!
с большая алкильная группа, соотношение не является почти статистическим (1: 1) орто / пара распределение. Вместо этого вы получаете соотношение 75: 8, отдавая предпочтение замене на .
Почему? Поскольку трет, -бутильная группа настолько объемна, что из-за стерических эффектов, учитывая выбор между двумя электронно-предпочтительными положениями ( орто и пара ), электрофил будет приближаться к кольцу через то, что дальше вдали (меньше отталкивания) от большой группы (позиция , пункт ).
Сочетание стерических и электронных эффектов в селективности реакции Это отличный пример слияния электронных эффектов и стерических эффектов . Как видите, ответ на наш первоначальный вопрос о том, «что является наиболее важной базовой концепцией органической химии», очевиден. На самом деле это не одна концепция, а комбинация этих двух.
На самом деле это не одна концепция, а комбинация этих двух.
Надеюсь, вам понравились эти определения и примеры по органической химии. Обязательно ознакомьтесь с нашим руководством о том, почему химические вещества вступают в реакцию с точки зрения термодинамики и кинетики.
Пришло время принять участие!
Перейдите в раздел комментариев и опубликуйте любые предложения, вопросы или другие примеры, которые могут вас заинтересовать в этих концепциях.
Кроме того, не стесняйтесь поделиться этим контентом со своими учениками или коллегами, или на своем веб-сайте , я надеюсь, что это может помочь как можно большему количеству людей!
Концептуальные карты органической химии A Level для бесплатной загрузки
По органической химии учащимся необходимо запоминать все реакции различных функциональных групп.
Часто им приходится рассматривать несколько реакций в одном вопросе.
Студенты должны быть знакомы с этими реакциями, чтобы применять их в сложных вопросах.
Часто учащимся не рекомендуется запоминать такое количество органических реакций.
К сожалению, нет простого способа решить эту проблему.
Студентам просто придется полагаться на постоянную практику и исправления.
Рисование собственных концептуальных карт – отличный способ запомнить органические реакции.
Студенты также могут устанавливать связи между функциональными группами.
Ваша личная концептуальная карта превосходит любую модную концептуальную карту, которую вы можете найти в учебниках или путеводителях.
Чтобы помочь студентам начать работу, вот мои концептуальные карты для большинства органических реакций в программе A Level Chemistry.
Концептуальная карта Алкена
Концептуальная карта бензола
Концептуальная карта Алкилгалогенида
Концептуальная карта алкоголя
Концептуальная карта фенола
Концептуальная карта альдегида
Концептуальная карта кетонов
Концептуальная карта карбоновых кислот
Концептуальная карта амина
Загрузите эти концептуальные карты в одном документе (на Google Диске в формате pdf):
Концептуальные карты уровня органической химии
Хотите проверить, сколько из эти реакции вы запомнили?
Загрузите эти 3 упражнения (на Google Диске в формате pdf), отсортированные по уровню сложности:
1. Вызов органических соединений (с учетом реагентов и условий)
Вызов органических соединений (с учетом реагентов и условий)
2. Вызов реагентов и условий (с учетом органических соединений)
3. Вызов ВСЕХ (с учетом основной функциональной группы)
Удачи в запоминании этих реакций органической химии!
A Level h3 Видео уроки химииУ меня есть огромная коллекция коротких видеоуроков, посвященных важным концепциям химии h3 и общим вопросам.
Присоединяйтесь к моим 5000+ подписчикам на моем канале YouTube, чтобы получать новые видеоуроки каждую неделю!
Подпишитесь на меня в Instagram, чтобы увидеть видео h3 Chemistry и (не очень смешные) мемы!
Вы также можете посмотреть другие видео по химии A Level h3 здесь, на моем веб-сайте.
Нужен опытный репетитор, который поможет вам упростить химию?Мои еженедельные занятия в Сингапуре идеально подходят для студентов, которые предпочитают более структурированную программу.
Создайте прочную основу и сдавайте экзамены на высшем уровне!
Запишитесь сейчас на пробное занятие по цене Только 50 $ (промо-акция за полцены) !
Зарегистрируйтесь сейчас и получите скидку с фиксированным тарифом: 360 долларов США в течение четырехнедельного месяца и 450 долларов США в течение пяти недель !
Ознакомьтесь с расписанием занятий и темами, которые рассматриваются на наших популярных классах JC1 и JC2 в Бишане, Сингапур.
Нужна структурированная программа с удобством онлайн-обучения? Наши еженедельные вебинары в прямом эфире идеально подходят для вас!
Учитесь в любое время, в любом месте и в удобном для вас темпе! Уроки по запросу теперь доступны за половину стоимости обычного обучения в классе.
Концепции органической химии: подход EFL 1, Роос, Грегори, Роос, Катрин
Доступный учебник для читателей по английскому как второму языку, охватывающий важные функциональные классы органических соединений, реакции и избранные типы натуральных продуктов
– Этот текст относится к изданию в мягкой обложке. Концепции органической химии: подход EFL – это первый вводный учебник по органической химии, специально написанный в доступном для языка формате для тех, для кого английский язык не является родным. За исключением основных технических терминов, почти весь словарный запас в учебнике составлен из 2000 наиболее употребительных английских слов и 570 наиболее употребительных академических слов. Материал представлен простым языком и в формате без ущерба для научного содержания. Главы этого учебника были протестированы на международном уровне как с носителями английского языка, так и с теми, для кого английский не является родным.Уникальный охват и организация призваны подчеркнуть общие проблемные области. С акцентом на ограниченное количество функциональных классов, Organic Chemistry Concepts: An EFL Approach вводит эти органические соединения в начале книги. Как только читатели получат основы концепций и языка органической химии, они могут расширить эти знания для работы с относительно сложными молекулами, включая ряд классов натуральных продуктов. Механизмы реакции базового уровня описаны только там, где они особенно поучительны.По возможности используются иллюстрации, чтобы подчеркнуть трехмерную природу органических молекул.
Материал представлен простым языком и в формате без ущерба для научного содержания. Главы этого учебника были протестированы на международном уровне как с носителями английского языка, так и с теми, для кого английский не является родным.Уникальный охват и организация призваны подчеркнуть общие проблемные области. С акцентом на ограниченное количество функциональных классов, Organic Chemistry Concepts: An EFL Approach вводит эти органические соединения в начале книги. Как только читатели получат основы концепций и языка органической химии, они могут расширить эти знания для работы с относительно сложными молекулами, включая ряд классов натуральных продуктов. Механизмы реакции базового уровня описаны только там, где они особенно поучительны.По возможности используются иллюстрации, чтобы подчеркнуть трехмерную природу органических молекул.
Ключевые особенности
- Структурированная структура, которая создает основу из ключевого материала, на котором учащиеся могут легко расширить свое понимание
- Контент, прошедший проверку в классе, по всем основным концепциям, написанный простым и доступным способом для тех, для кого английский не является родным
- Полезные педагогические функции для поддержки понимания: вопросы по главам, рабочие примеры, глоссарий, иллюстрации, резюме и приложения
- Программы самообучения по всем ключевым понятиям
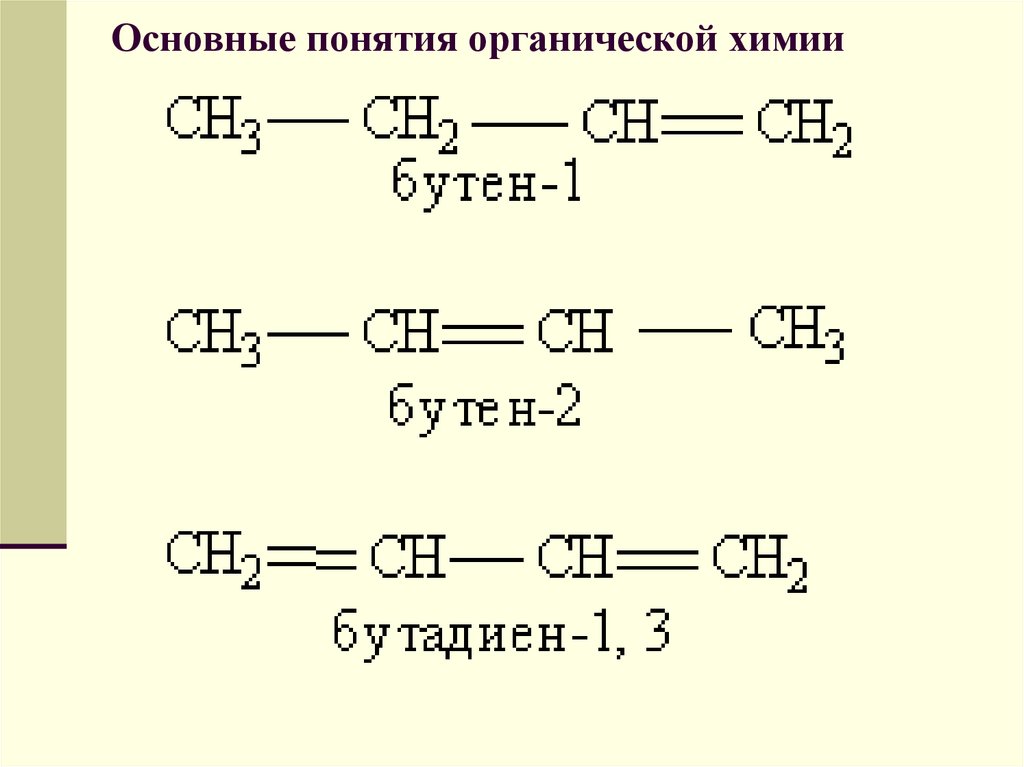
Об авторе
Формальное образование Грега Рооса включало в себя степень бакалавра наук (1971 год), степень бакалавра с отличием (1972 год) и докторскую степень в области органического синтеза (1976 год) в Кейптаунском университете. После докторантуры Ричарда Куксона в Университете Саутгемптона последовали несколько лет опыта работы в фармацевтической промышленности. Его академическая карьера на постоянной основе включала Натальский университет, Южная Африка (1981-1994), Университет Мердока, Австралия (1994-1997), и продолжительный период работы на Ближнем Востоке, включая Университет Султана Кабуса, Оман (1998-2004) и Университет Султана Кабуса в Омане (1998-2004). Нефтяной институт, Абу-Даби (2004-2008).Он успешно преподавал в различных культурах и получил награды за свой педагогический вклад и инновации. С 2009 года в качестве адъюнкт-профессора в Университете Мердока он живет в Австралии и Дубае. Его исследовательские интересы были сосредоточены на развитии синтетической методологии с особым интересом к асимметричным процессам. Это обеспечило многочисленные публикации в области реакции Бейлиса-Хиллмана, хиральных вспомогательных веществ имидазолидинона, разработки и применения диродиевых катализаторов.Этот период также включал ряд продуктивных совместных визитов с Тони МакКервей (Университетский колледж Корка и Королевский университет, Белфаст), CK Sha (Университет Шин Хуа, Тайвань), Майком Дойлом (Университет Тринити, Сан-Антонио) и Роном Уорренером (CQU Rockhampton). , Квинсленд). В 2001 году он получил золотую медаль Merck за исследования от Южноафриканского химического института.
Это обеспечило многочисленные публикации в области реакции Бейлиса-Хиллмана, хиральных вспомогательных веществ имидазолидинона, разработки и применения диродиевых катализаторов.Этот период также включал ряд продуктивных совместных визитов с Тони МакКервей (Университетский колледж Корка и Королевский университет, Белфаст), CK Sha (Университет Шин Хуа, Тайвань), Майком Дойлом (Университет Тринити, Сан-Антонио) и Роном Уорренером (CQU Rockhampton). , Квинсленд). В 2001 году он получил золотую медаль Merck за исследования от Южноафриканского химического института.
Кэтрин Роос имеет степень магистра учебной программы Университета Торонто, сертификат TESL Университета Карлтона и степень бакалавра антропологии Университета Манитобы.В настоящее время она преподает английский язык в Университете Зайда в Дубае, Объединенные Арабские Эмираты. Ранее она работала в Нефтяном институте в Абу-Даби, Университете Султана Кабуса в Омане и Управлении образования Торонто в Канаде. Она также преподавала в Японии и Нигерии. На протяжении своей карьеры, работая с изучающими английский язык из разных культур, она разрабатывала учебные материалы и учебные программы, специально предназначенные для таких дисциплин, как инженерия, общие науки, дошкольное образование, офисные навыки и компьютерные приложения.- Этот текст относится к изданию в мягкой обложке.
На протяжении своей карьеры, работая с изучающими английский язык из разных культур, она разрабатывала учебные материалы и учебные программы, специально предназначенные для таких дисциплин, как инженерия, общие науки, дошкольное образование, офисные навыки и компьютерные приложения.- Этот текст относится к изданию в мягкой обложке.
Какие основные концепции я должен знать в области органической химии?
Большинство концепций органической химии можно объяснить, вернувшись к аргументам электроотрицательности , резонанса , pKa , стерических препятствий и орбитального взаимодействия , поэтому вы должны по крайней мере вспомнить, что это за , прежде чем войдите, если хотите продвинуться вперед. 🙂
Вот некоторые сведения о них.
ЭЛЕКТРОНЕГАТИВНОСТЬ
Вот некоторые вещи, которые вы можете объяснить с помощью электроотрицательности:
- A больше электроотрицательный атом притягивает электроны больше к он , чем другой менее электроотрицательный атом, поляризуя его, поэтому функциональная группа, такая как карбонил (# “C” = “O” #), будет иметь тенденцию к электроположительному при именно этот углерод.
Это поможет вам решить, что такое нуклеофил , а какой – электрофил .
Это чрезвычайно важно, и вы будете постоянно это видеть.
- Электроотрицательные атомы, такие как бром и хлор, иногда говорят, что индуктивно отводят электроны , что поляризует определенные связи, за исключением того, что они могут находиться на расстоянии нескольких связей. (Это также объясняет, почему химические сдвиги ядерного магнитного резонанса (ЯМР) более “слабые”, когда присоединен более электроотрицательный атом.)
РЕЗОНАНС
Многое можно объяснить резонансом.Некоторые из них:
- Прочность или стабильность конъюгатов кислот / оснований
- Определение , где электрофильный участок имеет тенденцию быть
- Основное условие ароматичности (классификация соединений, стандартной моделью которых является бензол)
- Тенденция сопряженных систем повышать вероятность появления определенных промежуточных соединений карбокатиона , когда двойная связь находится на расстоянии одного углерода или когда бензольное кольцо находится рядом с электроположительным углеродом
- Доказательство способности # бета # -кетокислоты и неспособности # альфа # -кетокислоты к декарбоксилированию (в конце O-Chem II; немного неясно.
)
pKa
Запоминание pKas не обязательно, но действительно полезно знать хотя бы несколько , чтобы вы могли определять такие вещи, как:
- что делает хорошим уходящим из группы во время реакции замещения (# “S” _N1 # или # “S” _N2 #)
- крепость кислот и щелочей
Некоторые общие pKas:
- Вода # ~~ 15,7 #
- Этанол № ~~ 15.9 #
- Аммоний # ~~ 9,4 #
- Гидроний # ~~ -2.4 #
- # алканов = 50 ~ 60 #
- Алкен # = 43 ~ 44 #
- Алкин # ~~ 25 #
СТЕРИЧЕСКАЯ ЗАЩИТА
Основная идея состоит в том, что больших вещей создают беспорядок . Получите представление о том, когда пространственный беспорядок может заставить определенные группы атомов столкнуться с другим способом сделать молекулу более стабильной в целом. Это может помочь в таких ситуациях, как:
Это может помочь в таких ситуациях, как:
- Циклогексан Соответствие креслу
- Вероятность реакции замещения НЕ , происходящей из-за стерической блокировки / препятствия
ОРБИТАЛЬНЫЕ ВЗАИМОДЕЙСТВИЯ
Это то, что я хотел бы знать тогда, но это не так уж плохо, если вы обратите внимание и потренируетесь рисовать.3 # углерод, поэтому связь # “C” = “C” # обычно короче, чем связь # “C” – “C” #.
Концепции физико-органической химии для разработки процессов – Научное обновление
Сессия 1
Модуль 1: Введение в курс Что мы подразумеваем под дизайном всего процесса:
Введение преподавателей курса, обзор курс и ожидаемые результаты курса. Будет представлен обзор концепции всего процесса проектирования с упором на требования к данным для оптимизации всего процесса и использование концептуальных моделей процессов для определения потребностей в сборе данных и интерпретации собранных данных.
Модуль 2: Кинетика реакций и профили реакций:
Представлен новый обзор кинетики реакций и важность их применения для разработки процесса. Будут представлены профили реакций и их важность для интерпретации и понимания кинетики различных технологических стратегий, а также рекомендации по сбору соответствующих данных в рамках рутинной разработки.
Модуль 3: Равновесия до реакции:
В этом модуле исследуется общее равновесие в реакционноспособных частицах (например,грамм. протонирование / депротонирование) и потенциальное влияние, которое эти равновесия могут иметь на скорости реакции, селективность и переработку.
Сессия 2
Модуль 4: Конкурирующие реакции:
Выявление потенциальных конкурирующих реакций является ключом к оптимизации выхода / селективности. Обсуждаются факторы, влияющие на селективность, и подходы к предпочтению желаемого химического состава по сравнению с нежелательными конкурирующими реакциями.
Модуль 5: Гетерогенные равновесия:
Многие реакции и почти все технологические процессы включают более одной фазы.Представлено простое разделение и разделение в сочетании с процессами ионизации в одной фазе. Будет представлено введение в трехфазное (тройное) равновесие.
Модуль 6: Эффекты смешивания в псевдооднородных системах:
Представлено введение в эффекты смешивания в однофазных системах с обзором чувствительности смешивания, ее влияния на селективность и простых тестов для выявления и характеристики потенциала. чувствительность.
Сессия 3
Модуль 7: Смешивание в многофазных системах:
Этот модуль расширяет рассмотрение влияния смешивания на скорость и селективность на многофазные системы.Он рассматривает непрерывность фаз и инверсию фаз в жидкостно-жидкостных системах, а также вопросы, связанные с суспензией твердых частиц и дисперсией газа в емкостях с мешалкой.
Модуль 8: Реакции и массоперенос в многофазных системах:
Кинетика и селективность реакции в многофазных системах могут значительно отличаться от наблюдаемых в однофазных системах. Этот модуль обеспечивает введение в фундаментальную науку о связанных процессах массопереноса и скорости реакции.
Модуль 9: Актуальность концепций физико-органической химии для увеличения масштаба:
В этом модуле будет рассмотрено применение предыдущих модулей, чтобы помочь в снижении технических рисков, связанных с расширением масштабов, на основе обзора общепринятых масштабов: поднимите вопросы и как соответствующее понимание лежащей в основе физической органической химии может помочь в уменьшении масштабов риска.
Что такое физико-органическая химия?
Поздний цветущий: открытие этого поля
Это было в начале двадцатого века, когда мир стал свидетелем зарождения этого нового поля.Ученый по имени Луи Хэммет написал и опубликовал несколько статей, в которых подчеркивается взаимосвязь между структурой и реакцией органических молекул. В конце концов он стал пионером в развитии нового раздела химии: физической органической химии.
В конце концов он стал пионером в развитии нового раздела химии: физической органической химии.
Ученые были заняты открытием органических молекул и объяснением механизмов, используемых для их синтеза или создания. Хэммет, с другой стороны, смотрел далеко за пределы механизма органической химии. Фактически, он разработал математическое уравнение, которое доказало, что вы можете количественно определить химическую реакционную способность.Помимо переноса электронов и расположения атомов, его первоначальное открытие побудило ученых рассмотреть множество различных аспектов химической реакции, например:
- , сколько продуктов образуется в конце химической реакции
- сколько энергии выделяется или поглощается молекулами во время реакции
- как быстро происходит реакция
Почему эта область важна для науки?
В научном сообществе значение этой области химии часто ставится под сомнение.У нас уже есть область физической химии, которая использует физику для объяснения химического поведения. Между тем, химики-органики стремятся модифицировать или обновлять механизмы по мере новых открытий.
Между тем, химики-органики стремятся модифицировать или обновлять механизмы по мере новых открытий.
Какими бы уникальными ни были органическая и физическая химия, физическая органическая химия связывает эти две области. Таким образом, такие ученые, как Хэмметт, осознали необходимость использования методов физической химии (таких как термодинамика или кинетика) и их применения к поведению органических молекул в химических реакциях.
Применение физической органической химии очевидно в нашем промышленном секторе, который производит большинство продуктов, которые мы используем ежедневно. Многочисленные продукты – от мыла, которое мы используем, до нашей мебели – создаются с помощью химических реакций. Возьмем, к примеру, конструкцию материалов, требующих использования хладагентов. Хладагенты – это вещества, которые помогают поддерживать охлаждение таких приборов, как холодильники. Также подумайте о пластиковых изделиях, которые существуют вокруг нас. Пластмассы создаются в результате химических реакций, протекающих с большими соединениями, называемыми полимерами.
В обоих случаях область физической органической химии может помочь ученому понять, как создавать эти продукты с учетом химической структуры и свойств. Например, физический химик-органик может изучить, как быстро должна протекать реакция, чтобы производить полимеры для пластмассовых изделий в больших объемах производства. Они могут оценить, как те же молекулы, которые используются для создания хладагента, могут быть преобразованы в другие полезные органические вещества.
Будь то дизайн материала или более глубокое понимание органической молекулы, физическая органическая химия имеет ценность. Эта область подтверждает представление о том, что иногда разные научные дисциплины могут быть смешаны вместе, чтобы помочь людям ответить на научные вопросы, особенно в том, что касается органических соединений.
Краткое содержание урока
Физическая органическая химия – это научная дисциплина, в которой основное внимание уделяется использованию принципов физической химии для изучения реакций органической химии. Физическая химия использует основные концепции физики для объяснения поведения атомов или молекул. Физики-органики могут сосредоточиться на кинетике или скорости, с которой протекает химическая реакция. Они также могут исследовать термодинамику реакции.
Физическая химия использует основные концепции физики для объяснения поведения атомов или молекул. Физики-органики могут сосредоточиться на кинетике или скорости, с которой протекает химическая реакция. Они также могут исследовать термодинамику реакции.
Логическая структура органической химии и эмпирическая адекватность классической концепции молекулы
% PDF-1.4 % 1 0 объект > эндобдж 2 0 obj > эндобдж 3 0 obj > эндобдж 4 0 obj > транслировать GPL Ghostscript 9.07Философия химии; Эмпирическая адекватность; молекулярная структура; молекулярный дизайн; Метод анализа и синтеза; сведение органической химии к квантовой механике2013-12-20T16: 38: 30 + 01: 002013-12-20T16: 15: 00 + 01: 00PDFCreator Version 1.7.1uuid: 1389afc5-6be5-11e3-0000-80d3b24445a6uuid: 1389afc5-6be5- 11e3-0000-80d3b24445a6application / pdf
 Хотя эта концепция в некоторых отношениях не согласуется с тем, что предлагает квантовая механика, она раскрывает новое свойство молекул: молекулы поддаются конструированию. Благодаря этому свойству мы можем синтезировать химические соединения по своему желанию с точным контролем молекулярных превращений. Органический синтез, особенно высокоселективный синтез хиральных веществ, демонстрирует, что эта концепция эмпирически адекватна. Также показано, что органическая химия рациональна и автономна как наука в отношении метода анализа и синтеза.
Хотя эта концепция в некоторых отношениях не согласуется с тем, что предлагает квантовая механика, она раскрывает новое свойство молекул: молекулы поддаются конструированию. Благодаря этому свойству мы можем синтезировать химические соединения по своему желанию с точным контролем молекулярных превращений. Органический синтез, особенно высокоселективный синтез хиральных веществ, демонстрирует, что эта концепция эмпирически адекватна. Также показано, что органическая химия рациональна и автономна как наука в отношении метода анализа и синтеза.$ @
.


 Это поможет вам решить, что такое нуклеофил , а какой – электрофил .
Это поможет вам решить, что такое нуклеофил , а какой – электрофил . )
)