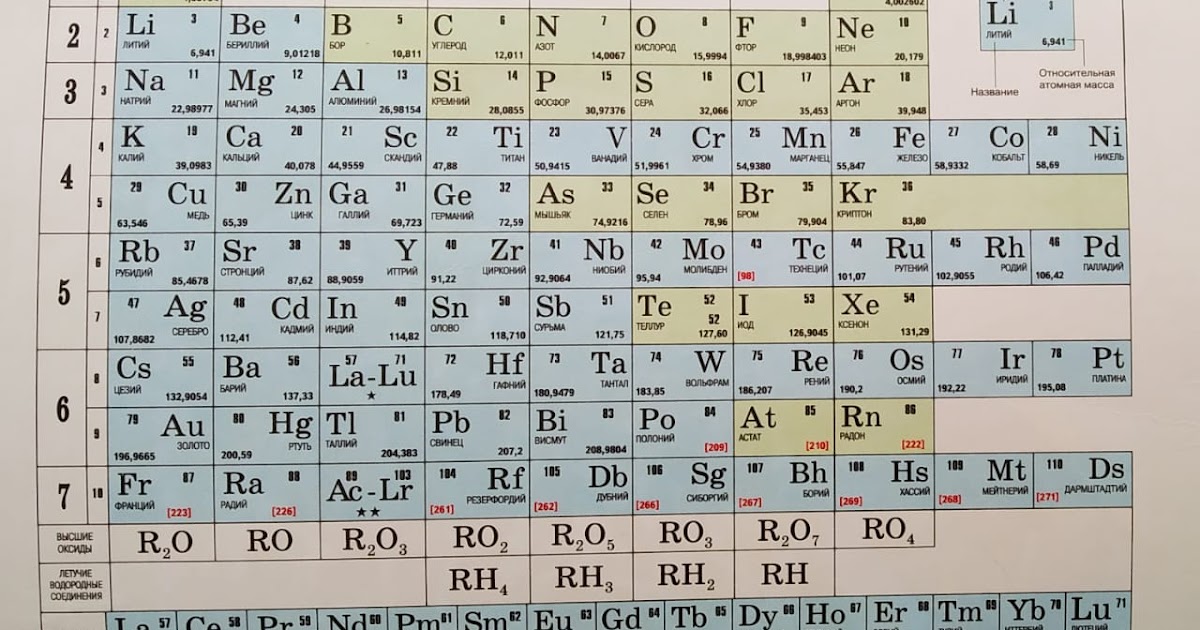
Первоначальная периодическая таблица Д.И.Менделеева – презентация онлайн
Похожие презентации:
Периодическая система химических элементов Д.И. Менделеева
Периодический закон и Периодическая система химических элементов
Периодический закон и периодическая система химических элементов Д.И. Менделеева
Значение периодического закона Д. И. Менделеева
Тайна великого открытия периодической таблицы
Периодический закон и периодическая система химических элементов
Классификация химических элементов. Периодический закон
Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон Д.И. Менделеева (лекция 3)
Периодический закон и периодическая система химических элементов Д.И. Менделеева
1. Первоначальная периодическая таблица Д.И.Менделеева
2. Одна из первых таблиц (1878г.)
Нетрудно заметить, что группы группировались в ряды, а не в колонки.
Неоткрытые элементы обозначаются прочерком.
3. Немного о предсказанных элементах
Чтобы дать предсказанным элементам«временные» названия, Менделеев использовал
приставки «эка», «дви» и «три», в зависимости от того,
на сколько позиций вниз от уже открытого
элемента с похожими свойствами находился
предсказанный элемент. Так, германий до своего
открытия в 1886 году носил название «экасилиций», а
рений, открытый в 1926 году, назывался
«двимарганец».
Первоначально, в 1870 году, он предсказал экабор (Eb), экаалюминий (Ea),
экамарганец (Em) и экасилиций (Es), в последствии они стали известны, как
скандий, галлий, технеций и германий соответственно.
Его предсказания, почти полностью совпали. Экабор по его предсказанию,
должен был иметь массу около 44, а атомная масса скандия оказалась равна 44,955910.
Для экамарганца, что атомная масса около 100, а у технеция, наиболее
стабильным изотопом является 98Tc
Свойство
Экаалюминий
Галлий
Атомная масса
68
69,72
Плотность (г/см³)
6,0
5,904
Темп.
 плавления
плавления(°C)
низкая
29,78
Формула оксида
Ea2O3 (плотность 5,5 г см−3, растворяется и
в кислотах, и в основаниях)
Ga2O3 (плотность 5,88 г см−3, раствор.
и в кислотах, и в основаниях)
Формула хлорида
Ea2Cl6 (летучий)
Ga2Cl6 (летучий)
Свойство
Экасилиций
Германий
Атомная масса
72
72,61
Плотность (г/см³)
5,5
5,35
Температура плавления (°C)
высокая
947
Цвет
серый
серый
Тип оксида
тугоплавкий диоксид
тугоплавкий диоксид
Плотность оксида (г/см³)
4,7
4,7
Реакция оксида
слабое основание
слабое основание
Температура кипения хлорида
ниже 100 °C
86 °C (GeCl4)
Плотность хлорида (г/см³)
1,9
1,9
5. Интересная теория
В некоторых источниках считается, что всеми привычная периодическаятаблица – фальшивка и то что это сплошной заговор. Согласно, этой
теории всё состоит из мирового эфира, это некая частица идущая
перед водородом.

Небольшая вырезка из «правдивой» статьи:
После скоропостижной смерти Д.И. Менделеева и ухода из жизни его верных научных коллег по Русскому ФизикоХимическому Обществу, впервые поднял руку на бессмертное творение Менделеева сын друга и соратника Д.И.
Менделеева по Обществу — Борис Николаевич Меншуткин. Конечно, тот Борис Николаевич тоже действовал не в
одиночку — он лишь выполнял заказ. Ведь новая парадигма релятивизма требовала отказа от идеи мирового эфира;
и потому это требование было возведено в ранг догмы, а труд Д.И. Менделеева был фальсифицирован.
Главное искажение Таблицы — перенос «нулевой группы» Таблицы в её конец, вправо, и введение т.н. «периодов».
сознательное устранение главного методологического звена в открытии Менделеева: периодическая система
элементов в своём начале, истоке, т.е. в верхнем левом углу Таблицы, должна иметь нулевую группу и нулевой ряд,
где
располагается
элемент
«Х»
(по
Менделееву
—
«Ньютоний»),
—
т.
 е.
е.мировой
эфир.
Более того, являясь единственным системообразующим элементом всей Таблицы производных элементов, этот
саму
идею
этой
первоосновы
всей
системы
элементов
по
Менделееву.
Чтобы вытравить из сознания всех последующих поколений учёных идею исключительной роли мирового эфира (а
этого как раз и требовала новая парадигма релятивизма), специально были перенесены элементы нулевой группы из
левой части Таблицы Менделеева в правую часть, сместив на ряд ниже соответствующие элементы и совместив
нулевую группу с т.н. «восьмой». Разумеется, ни элементу «у», ни элементу «х» в фальсифицированной таблице
места не осталось.
Гипотетически,
правильная
таблица.
Можно заметить,
что инертные
газы находятся в
0-ой группе и то
что присутствуют
Короний и
Ньютоний
Наиболее вероятные
последние таблицы
English Русский Правила
Периодическую таблицу элементов Юлиус Мейер создал на 5 лет раньше Дмитрия Ивановича Менделеева — Александр Макеев — NewsLand
Уже почти полторы сотни лет россияне гордятся тем, что автором Периодической системы элементов, этой величайшей азбучной истиной для всех химиков, физиков, биологов и учёных других специальностей является великий российский химик Дмитрий Иванович Менделеев. Всем известно, что в феврале-марте 1869 года
Всем известно, что в феврале-марте 1869 года
Во всём мире никто не оспаривает то, что ныне повсеместно принятая Периодическая система элементов, где все периоды оканчиваются благородным газом, является научной истиной в последней инстанции, в которой все элементы расположены абсолютно правильно и ничего в этой таблице невозможно сколько-нибудь существенно исправить или улучшить.
Правда, приоритет Дмитрия Менделеева робко и безуспешно пытаются оспаривать французы (с приоритетом Александра Эмиля Бегуйе де Шанкуртуа от 1862 года), англичане (с приоритетом Уильяма Одлинга от 1864 года и с приоритетом Джона Александра Рейна Ньюлендс от 1864 года) и немцы (с приоритетом Юлиуса Лотара Мейера от 1864 года).
Но никто в мире не смеет оспаривать того, что Менделеев открыл Периодический закон, гласящий о том, что
Как выяснилось теперь, надо честно признать то, что Дмитрий Иванович Менделеев не был тем первым человеком на Земле, который построил по-настоящему научную классификацию элементов. Раньше Менделеева оказался всё-таки великий немецкий врач и химик Юлиус Лотар Мейер. Именно он в 1864 году опубликовал в научной печати фрагмент таблицы, где периоды оканчиваются щёлочноземельным металлом. Только опираясь на Периодическую систему элементов Мейера можно было открыть настоящие периодические законы, которые описывают строение и порядок формирования электронного облака атома по мере роста заряда ядра атома.
Раньше Менделеева оказался всё-таки великий немецкий врач и химик Юлиус Лотар Мейер. Именно он в 1864 году опубликовал в научной печати фрагмент таблицы, где периоды оканчиваются щёлочноземельным металлом. Только опираясь на Периодическую систему элементов Мейера можно было открыть настоящие периодические законы, которые описывают строение и порядок формирования электронного облака атома по мере роста заряда ядра атома.
Свыше пятнадцати настоящих периодических законов и фундаментальных научных положений были действительно открыты, записаны словесными формулами и многие были воплощены также в простые математические формулы москвичом, простым российским врачом, ныне пенсионером, членом Московского общества испытателей природы Александром Константиновичем Макеевым именно при опоре на разработанную им независимо от Ю. Л. Мейера, Чарльза Жанета, К. Е. Цименса и В. М. Клечковского Периодическую систему элементов, где все периоды оканчиваются щёлочноземельным металлом!
В Естественной системе элементов материи, этой Периодической системе элементов с правильным окончанием всех периодов атомного мира материи на щёлочноземельный металл, Макеев поместил символы четырёх гипотетических элементов, предшествующих водороду. В качестве предъэлементов Александр Макеев предположил подквантовые и квантовые вихри электростаического поля – электрино и магнитного поля магнитон, подквантовые и квантовые вихри движения-изменения фотон и глюон в среде нуклонной плотности ядер атомов и нейтронных звёзд; и квантовые вихри структуры-функции ядер атомов и электронных облаков атомов –
В качестве предъэлементов Александр Макеев предположил подквантовые и квантовые вихри электростаического поля – электрино и магнитного поля магнитон, подквантовые и квантовые вихри движения-изменения фотон и глюон в среде нуклонной плотности ядер атомов и нейтронных звёзд; и квантовые вихри структуры-функции ядер атомов и электронных облаков атомов –
В подавляющем большинстве стран Периодическая система элементов называется просто: “Периодическая система элементов“. И никаких прибавок про её автора, или авторов!
Зато про Периодический закон везде пишут, что его первую редакцию сформулировал великий российский химик Дмитрий Менделеев. Хотя формулировка, периодического, якобы, закона, на самом деле есть формулировка периодического явления, которое не даёт однозначные сведения о том как следует определять свойства элемента в периодах ПСЭ: от начала к окончанию или от окончания к началу периода, или равно и от начала к окончанию и от окончания к началу периода?
Эта статья не столько о дате приоритета, – кто первым создал Периодическую Таблицу Элементов, сколько о том, какая форма периодической таблицы элементов более правильная!
Мейеровская, где все периоды оканчиваются на щёлочноземельный металл?
Или менделеевская, где все периоды оканчиваются на благородный газ, при этом, 1-ый период начинается с неметалла химически активного газа водорода, а все остальные периоды начинаются с химически активного щелочного металла, хотя заявляется, что все периоды начинаются с щелочного металла?
Ниже привожу простой метод проверки научности или не научности той или иной редакции Периодической системы элементов.
1. Определяются ли свойства элемента строго, без единого исключения, от универсального для всех периодов порядкового места, отсчитываемого от начала к окончанию периода, где расположен элемент?
2. Или определяются ли свойства элемента строго, без единого исключения, от универсального для всех периодов порядкового места, отсчитываемого от окончания к началу периода, где расположен элемент?
3. Или определяются ли свойства элемента строго, без единого исключения, от универсального для всех периодов порядкового места в периоде, отсчитываемого РАВНО как от начала к окончанию периода, где расположен элемент, так и от окончания к началу периода, где расположен элемент?
Если ни один из этих вариантов в пределах данной редакции ПСЭ не действует, значит данная редакция ПСЭ ненаучна!
Если в данной редакции ПСЭ действует хотя бы один из этих вариантов, значит данная редакция ПСЭ научна!
Источник информации:
1. научная монография Макеев А. К. Синергия сферовекторных фракталов мироздания. На сайте научно-технической библиотеки: http://www.sciteclibrary.ru/texsts/rus/stat/st3795.pdf
научная монография Макеев А. К. Синергия сферовекторных фракталов мироздания. На сайте научно-технической библиотеки: http://www.sciteclibrary.ru/texsts/rus/stat/st3795.pdf
2. http://shkolazhizni.ru/archive/0/n-47658/
3. Макеев А.К. Частицы электростатического и магнитного полей в системе материи фотона движутся намного быстрее, чем движется сам фотон. // Научная дискуссия: материалы IV международной заочной научно-практической конференции. Часть I. (20 августа 2012) – Москва: Изд. «Международный центр науки и образования», 2012. 142 с., С. 47-65. ISBN 978-5-905945-37-3 УДК 08. ББК 94. Н 34. http://www.internauka.org/node/479
Источник: http://www.sciteclibrary.ru/rus/avtors/m.html
менделеев периодическая система период мейер жанет макеев
383
26247
Видео с вопросами: Описание Периодической таблицы как развивающейся научной модели
Стенограмма видео
Периодическая таблица является примером
модель. Это позволяет ученым делать
предсказания путем выделения закономерностей в свойствах элементов. Открытие новых элементов
позволило ученым заполнить пробелы и исправить ошибки в исходном периодическом
стол. Какое из следующих слов лучше всего
описывает модель, использованную для построения исходной таблицы Менделеева?
Это позволяет ученым делать
предсказания путем выделения закономерностей в свойствах элементов. Открытие новых элементов
позволило ученым заполнить пробелы и исправить ошибки в исходном периодическом
стол. Какое из следующих слов лучше всего
описывает модель, использованную для построения исходной таблицы Менделеева?
Вероятно, самый первый периодический стол пришел в 1863 году от Александра-Эмиля Бегуйе де Шанкуртуа, который поставил элементы на спираль на листе бумаги. Элементы располагались на цилиндр слева направо по относительной атомной массе и расположен вертикально с помощью спираль по химическому поведению. Однако эта версия не обычно считается традиционным столом.
Традиционно оригинал
Периодическая таблица принадлежит Дмитрию Ивановичу Менделееву в 1869 году., который устроил
элементов снизу вверх по относительной атомной массе и слева направо в периодическом
химическое поведение. В 1871 году Менделеев произвел
исправленная версия, в которой периоды располагались сверху вниз, а группы — слева направо.
как наша современная таблица Менделеева. Ключевой признак, отличавший
Система Менделеева от предыдущих систем заключалась в том, что он оставлял пробелы, используя существующие данные
предсказывать свойства неизвестных элементов. Это сделало таблицу Менделеева очень
хорошая модель, потому что она позволяла делать точные прогнозы. Новые элементы любят скандий,
галлий и германий были обнаружены позже и естественным образом вставлены в щели,
очень точно соответствует предсказаниям.
В 1871 году Менделеев произвел
исправленная версия, в которой периоды располагались сверху вниз, а группы — слева направо.
как наша современная таблица Менделеева. Ключевой признак, отличавший
Система Менделеева от предыдущих систем заключалась в том, что он оставлял пробелы, используя существующие данные
предсказывать свойства неизвестных элементов. Это сделало таблицу Менделеева очень
хорошая модель, потому что она позволяла делать точные прогнозы. Новые элементы любят скандий,
галлий и германий были обнаружены позже и естественным образом вставлены в щели,
очень точно соответствует предсказаниям.
Теперь давайте посмотрим на
вопрос. Нам нужно посмотреть на пять слов и
найдите тот, который лучше всего описывает модель, использованную в исходной периодической таблице. Эти три принципа организации
составляют модель, используемую для изготовления стола. Вот это было бы совершенно точно
сказать, что таблица Менделеева неверна. Было много вещей, которые
с момента изменения.
Вот это было бы совершенно точно
сказать, что таблица Менделеева неверна. Было много вещей, которые
с момента изменения.
Но вопрос не в том, чтобы просто задать для любого описания. Мы ищем лучших описание, которое отдает должное великой работе, которой это было. Таким образом, исходная таблица была неправильной в некоторые отношения. Но это также было правильно во многих уважает. Также было бы справедливо сказать, что Таблицы Менделеева были в корне ошибочны, потому что в них использовалась относительная атомная масса. а не атомный номер, как мы используем сегодня.
Однако на основании данных
время теллур и йод были единственной парой элементов,
последовательность. У теллура был более высокий родственник
атомная масса, но его химическое поведение означало, что он лучше подходил, если он был до йода
а не после. Что было бы несправедливо, так это называть
Таблицы Менделеева ненаучны, потому что они отражают понимание данных
доступны в то время.
Что было бы несправедливо, так это называть
Таблицы Менделеева ненаучны, потому что они отражают понимание данных
доступны в то время.
То, что Менделеев оставил пробелы на это указывают данные и тот факт, что он поменял местами теллур и йод несмотря на то, что это не соответствует принципу относительной атомной массы, предполагается, что он был искренне думал о том, что он делает. Он не хотел просто делать данные соответствуют его теории.
Последнее слово, которое мы могли применить
разумно для таблиц Менделеева просто «неполна». Это было сделано до того, как мы поняли
атомов более подробно и до того, как мы поняли протоны и их влияние на
химическое поведение. Из всех ответов это самый
прекраснейший. Пока были неправильные и правильные
и недостатки в таблице, это был шаг в правильном направлении, решающий
поворот в нашем понимании элементов.
Как и многие научные модели и теории, развитие происходит поэтапно. И нам не обязательно отказаться от модели только потому, что она не идеальна. Итак, из пяти слов, которые мы заданной, которая лучше всего описывает модель, используемую для построения исходного периодического таблица «неполная».
Организация периодической таблицы: Свойства | StudySmarter
Задумывались ли вы когда-нибудь, как можно повысить продуктивность? Как бы вы могли эффективно организовать свое расписание или школьные заметки? Возможно, у вас были деньги, и вам нужно было составить бюджет, чтобы правильно их распределить? Ну, я готов поспорить, что вы в конечном итоге использовали либо список, если все задачи разные, либо таблицу Excel, если вы хотите аккуратно сгруппировать некоторые из них. Теперь вы видите прошлое, и мы действительно говорим о том, что в 1800-х годах не было превосходства, и людям все еще удавалось выживать, что, откровенно говоря, ошеломляет меня.
Но они по-прежнему делали таблицы для организации своего времени, финансов, а некоторые люди, такие как Менделеев, использовали таблицы для организации самых разных вещей. Что он решил организовать? Что ж, все, из чего состоит мир, все элементы в одной таблице! Неплохая задача, верно? Давайте посмотрим, что он придумал и как это выдержало испытание временем!
.
- Менделеев Организовал Элементы Периодической Таблицы: Проходим историю Периодической Таблицы и знакомимся с открытиями Менделеева.
- Организация элементов периодической таблицы: подробное объяснение иерархии и порядка периодической таблицы.
- Организация периодической таблицы Упражнение: подробное и подробное объяснение периодов и групп вместе с их подмножествами.
- Периодическая таблица, организованная по металлам: объяснение и определение металлов, металлоидов и неметаллов.
Периодическая таблица элементов является важным инструментом в изучении химии, и каждый старшеклассник сталкивался с ней в какой-то момент. Однако откуда взялась периодическая таблица? Кстати, а почему он вообще называется периодическим?
Однако откуда взялась периодическая таблица? Кстати, а почему он вообще называется периодическим?
Начиная с девятнадцатого века ученые использовали множество параметров и критериев для идентификации и группировки элементов. Например, немецкий ученый Иоганн Вольфганг Доберейнер заметил, что кальция, бария и стронция имеют сходных качества , поэтому этот набор из трех элементов назван триадой . В 1863 году британский химик Джон Ньюлендс разделил известные элементы на семь групп по восемь элементов в каждой и определил закон октав .
Согласно закону октав , каждый восьмой элемент , организованный в порядке убывания его атомной массы , будет иметь аналогичные свойства.
Сегодня известно, что этот закон неверен, однако, это все еще важная часть истории химии.
Я уверен, вы уже знаете, что во всем, что связано с наукой, много проб и ошибок. Периодическая таблица также прошла через аналогичный процесс. Разные ученые пытались составить периодическую таблицу, в которой были представлены все элементы (как природные, так и искусственные). Тем не менее, человек, внесший наибольший вклад в периодическую таблицу, был русский ученый Дмитрий Менделеев.
Периодическая таблица также прошла через аналогичный процесс. Разные ученые пытались составить периодическую таблицу, в которой были представлены все элементы (как природные, так и искусственные). Тем не менее, человек, внесший наибольший вклад в периодическую таблицу, был русский ученый Дмитрий Менделеев.
Дмитрий Менделеев, Википедия
https://en.wikipedia.org/wiki/Dmitri_Mendeleev
В 1869 году Менделеев предположил, что свойства элементов зависят от их атомной массы. Российский ученый вместе со своим коллегой Мейером построил восьмиколонную таблицу элементов, в которой были сгруппированы компоненты со схожими свойствами.
Таблица Менделеева, в которой сгруппированы элементы в порядке возрастания атомной массы , показала, что свойства элементов повторяются в точном порядке:
Согласно Менделееву, свойства элементов являются периодической функцией их атомной массы (периодический закон) .
Как вы увидите ниже, периодическая таблица Менделеева 1871 года несколько отличается от той, которую мы используем сегодня, но вносит ключевой вклад в современную периодическую таблицу.
Периодическая таблица Менделеева
https://corrosion-doctors.org/Periodic/Periodic-Mendeleev.htm
Что особенного было в периодической таблице Менделеева? Что ж, он предвидел открытие новых элементов и предусмотрел места в своей периодической таблице для их размещения. Однако, рассматривая периодичность как основной закон, определяющий природу элементов, он пошел значительно дальше своих предшественников.
Основываясь на этом откровении, он, как известно, оставил пустую позицию в своей таблице для элементов, которые оставались неоткрытыми, если качества конкретного элемента не соответствовали общей схеме. Тогда русский ученый назвал бы эти «гипотетические» элементы такими префиксами, как , эка, дви, и три. Это Санскрит для раз, два и три.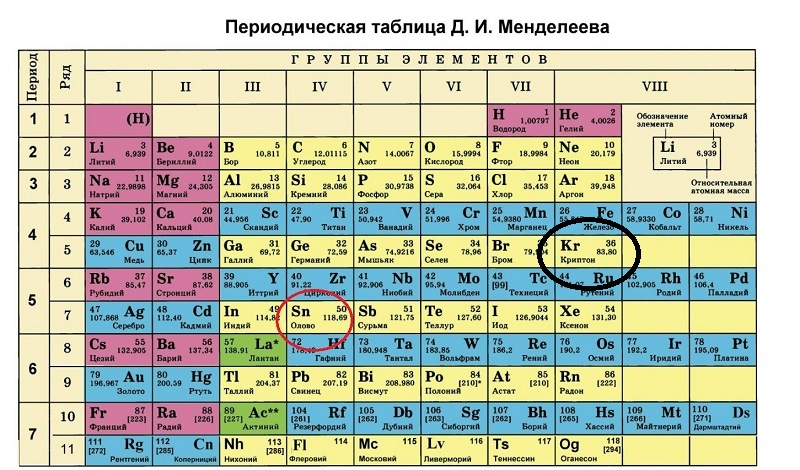
Тогда Менделеев присвоил эти префиксы восьми неизвестным элементам. Например, эка-алюминий был назван так потому, что в таблице Менделеева он располагался под алюминием, который позже был переименован в галлий.
Интересно, как он выбрал санскрит нет? Не латинский, французский, немецкий, русский или английский. Санскрит! Это так случайно – как же так?
Ну, считается, что Менделеев во время учебы в Санкт-Петербургском университете в России изучал санскрит. Но зачем ему использовать древний индийский язык в своих исследованиях?
Санскритский алфавит, в котором хорошо разбирался наставник Менделеева, сам по себе был периодической системой: устройство санскритского алфавита объясняло, как буквы могут соединяться, чтобы производить звуки, точно так же, как периодическая таблица элементов демонстрирует, как отдельные элементы могут смешиваться. образовывать соединения.
Однако с успехом приходят неудачи. Помните процесс проб и ошибок, о котором я упоминал выше? Что ж, наши российские ученые пали его жертвой.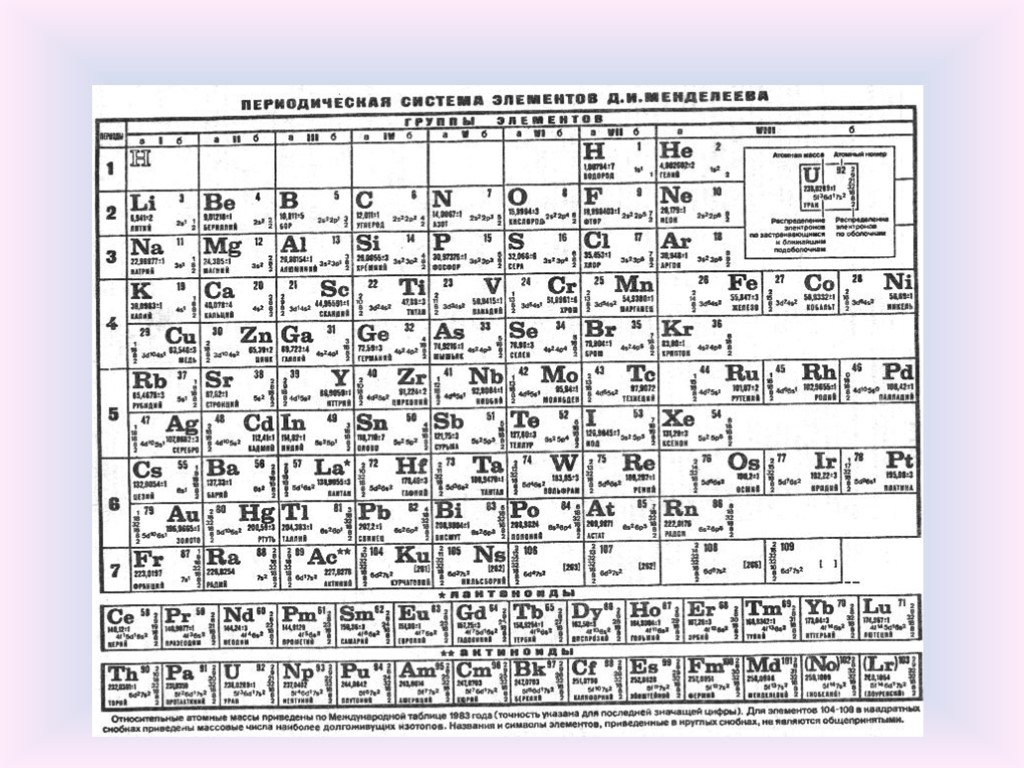
К сожалению, у периодической таблицы Менделеева были некоторые ограничения. На самом деле его таблица не могла объяснить некоторые вещи, такие как тот факт, что кобальт, несмотря на то, что его атомная масса больше, чем у никеля, обладает свойствами, которые могли бы поставить его перед этим элементом. Эти несоответствия затрудняли правильное понимание элементов.
Итак, как вы можете видеть, атомная масса не является идеальным предиктором свойств элементов, сегодня чаще используется число протонов (также известное как атомный номер ). Современная таблица Менделеева находится рядом, и мы можем увидеть это проявление там!
Организация элементов в периодической таблице:
Как упоминалось выше, периодический закон был пересмотрен из-за некоторых несоответствий в классификации элементов на основе атомной массы.
Периодический закон сегодня основан на том факте, что свойства элементов являются функцией их атомного номера , а не их массы.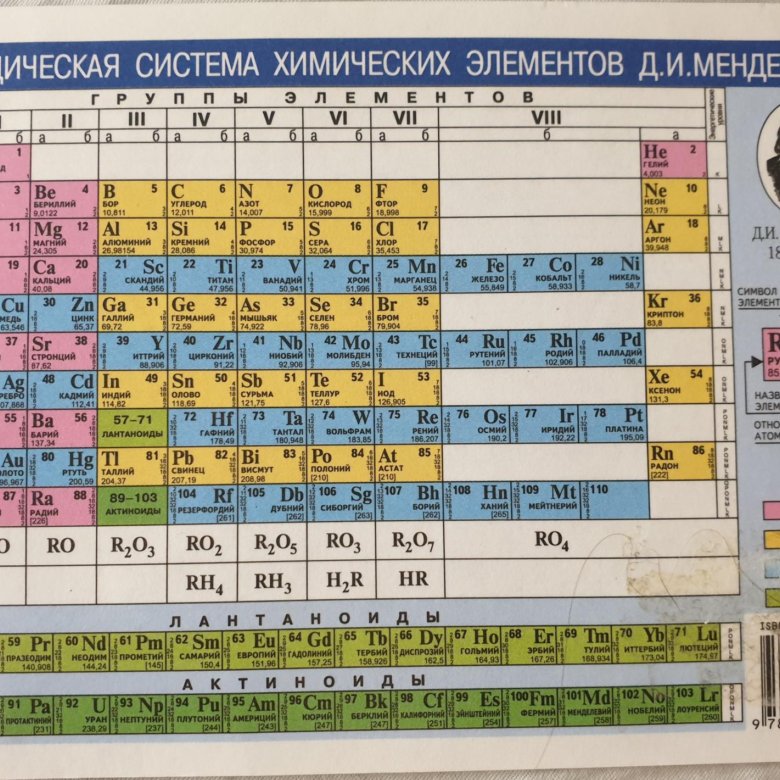
Теперь, когда мы разобрались с историей, давайте перейдем к самой важной части таблицы Менделеева: ее организации и тому, как ее понимать!
Периодическая таблица Организация Деятельность:
Периодическая таблица представляет собой список химических элементов, упорядоченных по их атомному номеру, качествам и свойствам.
Международный союз теоретической и прикладной химии (IUPAC) подтвердил 118 элементов , среди которых:
- 94 элемента названы «природными» (поскольку они были найдены в природе).
- 24 элемента названы «синтетическими» (так как были сделаны искусственно).
Периодическая таблица элементов: https://www.britannica.com/science/periodic-table
Периодическая таблица систематизирует и локализует все известные элементы в группы, периоды, блоки, металлы, неметаллы, неметаллы , лантаноиды и актиноиды на основе их характеристик и взаимоотношений друг с другом.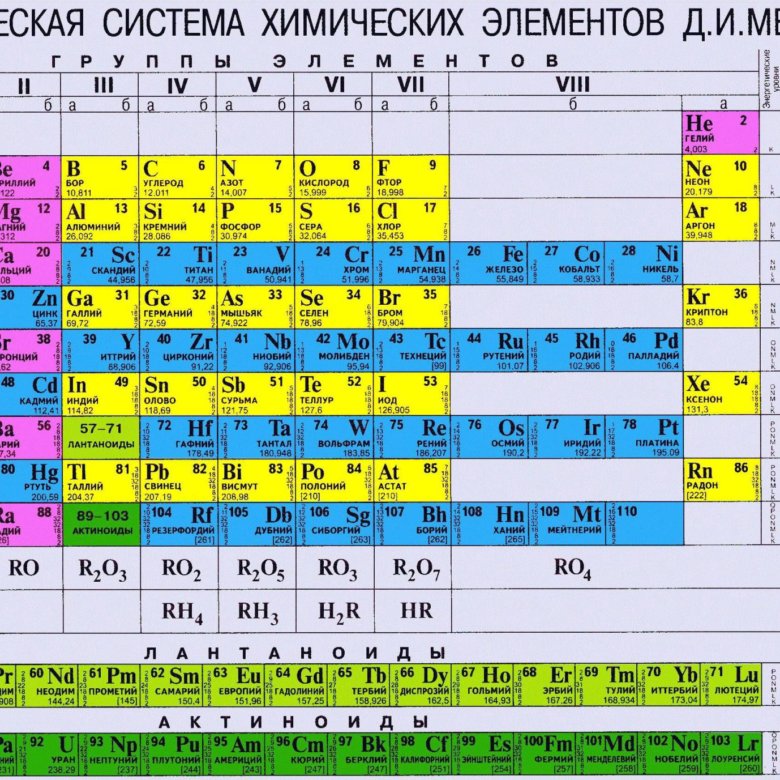
Периодическая таблица: группы
Группы — это столбцы периодической таблицы. Они обозначают химические элементы с сходными химическими и физическими свойствами.
- Группы A (типичные/репрезентативные элементы): Каждая группа пронумерована от 1 до 8. Номер группы соответствует валентным электронам. Например, все элементы группы VII А имеют внешнюю электронную конфигурацию s 2 р 5 .
- Группа B (переходные элементы): Располагаются на более низком уровне, чем точка. Переходными элементами являются все те, которые в периодической таблице химических элементов попадают в группы от 3 до 12.
Некоторые группы имеют свои особенности, давайте проверим их!
Группа IA: Щелочные металлы
Щелочные металлы в периодической таблице: https://periodictableguide.com/alkali-metals-located-on-the-periodic-table/
Щелочные металлы характеризуются высокой реакционной способностью, низкой энергией ионизации, низкой электроотрицательностью и отрицательным восстановительным потенциалом.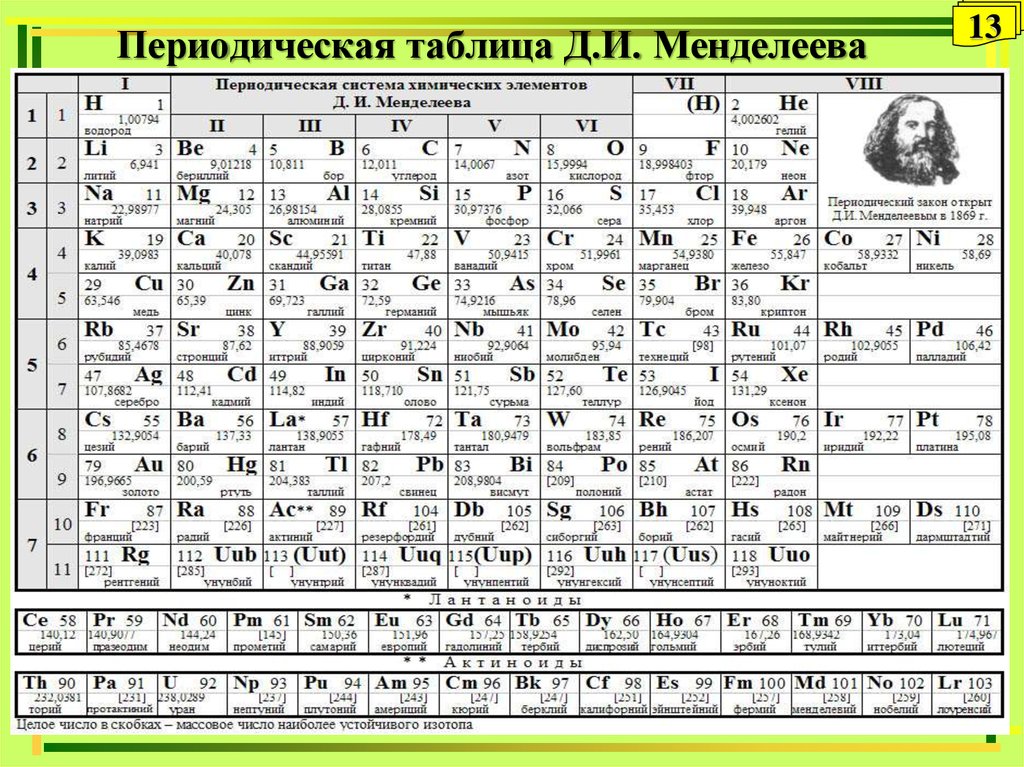 Они склонны образовывать соединения только в степени окисления +1.
Они склонны образовывать соединения только в степени окисления +1.
Группа IIA: Щелочноземельные металлы
Щелочноземельные металлы: https://periodictableguide.com/alkaline-earth-metals-on-periodic-table/
Щелочноземельные металлы мягкие и имеют низкую плотность, они очень реакционноспособны, хотя и меньше, чем у представителей группы 1, и образуют соединения только в степени окисления +2.
Группа VII: Галогены
Таблица Менделеева: Галогены
https://periodictableguide.com/halogens-located-on-the-periodic-table
Галогены являются высокореактивными элементами, которые при взаимодействии с металлами , образуют соли. Например,
, если мы соединим 2 Na, металл с 2 Cl 2 , галогеном, мы получим 2 NaCl и много тепла. Это называется «эксперимент с соляной лампой». Здесь вы опускаете расплавленный натрий в атмосферу хлора и получаете ярко-оранжевый свет и немного соли.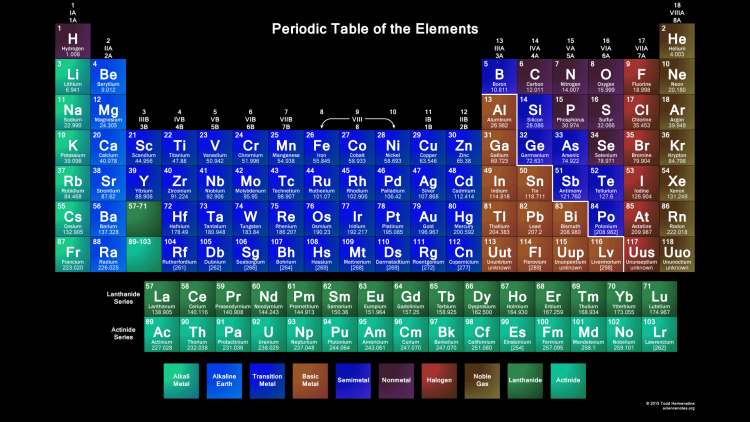
Группа VIII: благородные газы (или инертные газы)
Периодическая таблица: благородные газы https://periodictableguide.com/noble-gases-located-on-the-periodic-table/
характеризуется закрытой электронной структурой, дуэтом для гелия и октетом для остальных. Эти конфигурации особенно стабильны и объясняют их нулевую или низкую реакционную способность. Они одноатомные, бесцветные, без запаха, без вкуса и негорючие.
Периодическая таблица: периоды
В периодической таблице есть семь горизонтальных линий, известных как периоды. Они расположены в порядке их атомных номеров. Они связаны с понятием главного квантового числа, по существу, номер строки соответствует главному кванту орбиталей валентного электрона. Здесь сбивает с толку пример:
Если самая внешняя орбиталь называется 5s, вы получите 5 как главное квантовое число и, следовательно, она будет в 5-м ряду элементов. Теперь, если самая внешняя орбиталь вашего элемента трехмерна, этот парень будет помещен в 3-й ряд, легко, верно?
Период: строки периодической таблицы
строки периодической таблицы: https://www.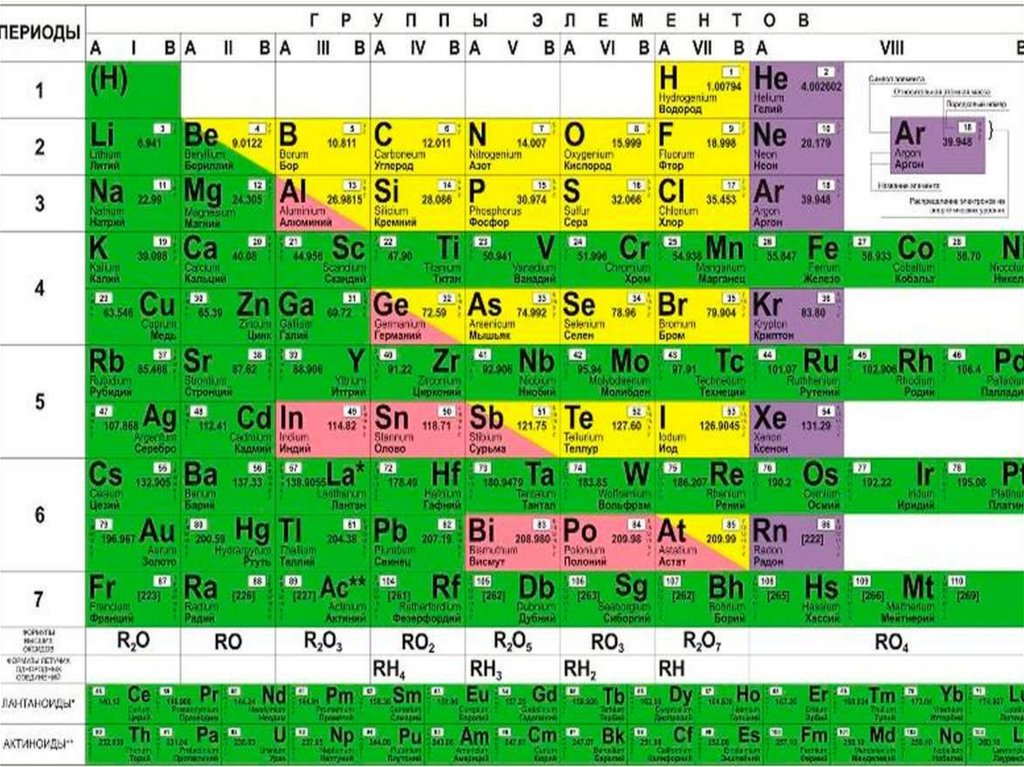 ck12.org/book/ck-12-chemistry-second-edition/r18/section/8.2/
ck12.org/book/ck-12-chemistry-second-edition/r18/section/8.2/
Первый период самый короткий, так как в нем всего два элемента (H и He), потому что у элементов есть электроны только на s-орбитах l. Они представляют собой первый энергетический уровень (n = 1).
Второй и третий периоды состоят из восьми элементов. Электроны здесь только в s и p орбитали. Они представляют собой химические элементы второго (n = 2) и третьего (n = 3) энергетических уровней соответственно.
В четвертом и пятом периодах по 18 элементов, а электроны здесь имеют орбитали d-типа.
Начиная с 6-го можно получить и f орбитали.
Переходные металлы:
Переходные металлы: https://periodictableguide.com/transition-metals-located-on-periodic-table/
Переходные металлы податливы и пластичны, проводят тепло и электричество и образуют положительные ионы.
Лантиниды и актиниды: внутренние переходные металлы
Внутренние переходные металлы: https://periodictableguide.com/inner-transition-metals-on-periodic-table/
Внутренние переходные металлы, , как указано выше , являются расширением группы 3. Их можно разделить на две подкатегории:
- Лантаниды: встречаются в природе в земной коре, за исключением
- Актиниды: создаются в лаборатории и радиоактивны по своей природе.
В то время как лантаноиды никогда не проявляют более двух степеней окисления и образуют в основном ионные соединения, актиниды проявляют большее количество степеней окисления, а наличие степеней окисления стабилизирует ковалентные связи и облегчает образование комплексов.
Классификация групп и периодов: https://sciencenotes.org/periodic-table-groups-and-periods/
Периодическая таблица, организованная по металлам:
Существует три типа элементов, составляющих периодическую таблицу, в зависимости от их химических и физических свойств: металлы, металлоиды и неметаллы.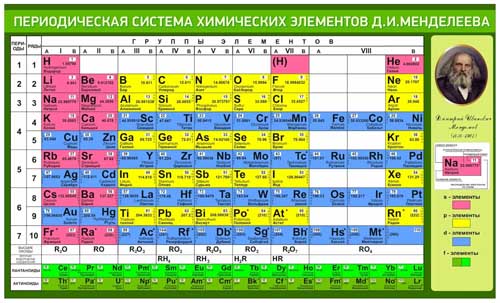
- Металлы: твердые при комнатной температуре (исключением является ртуть – при комнатной температуре она находится в жидком состоянии). Металлы ковкие, и прочные. Кроме того, они являются хорошими проводниками тепла и электричества. Металлы находятся на левой стороне стола.
- Неметаллы: в основном это газы и твердые вещества, но бром является единственным исключением. Он жидкий при комнатной температуре. Они являются ужасными проводниками электричества и, как правило, между их молекулами присутствуют слабые межмолекулярные силы.
- Металлоиды (также известные как полуметаллы): они называются так, потому что они обладают свойствами как металлов, так и неметаллов (отсюда и «полуметаллы»). Их электропроводность ниже, чем у металлов, но выше, чем у неметаллов. Они с левой стороны стола, между металлом и неметаллом.
Классификация металлов, неметаллов и металлоидов: https://sciencenotes. org/metalloids-nonmetals/
org/metalloids-nonmetals/
Периодическая таблица — довольно сложный зверь, и мы могли бы рассказать о ней гораздо больше, но надеюсь, что этого было достаточно для вас, чтобы получить самые важные части этого. Если вы все еще хотите большего, продолжайте читать наши другие статьи на эту тему!
Организация таблицы Менделеева – основные выводы
- Элементы упорядочены в соответствии с увеличение атомного номера ; атомный номер (обозначается буквой Z) указывает количество протонов, присутствующих в ядре атома.
- В таблице Менделеева 7 горизонтальных линий, то есть 7 периодов . Период элемента указывает энергетический уровень, на котором находятся валентные электроны.
- В таблице Менделеева 18 вертикальных линий, то есть 18 групп. Группы таблицы Менделеева имеют двойную нумерацию: первая арабскими цифрами от 1 до 18; второй, более важный, римскими цифрами от I до VIII.