расчет концентрации эмульсии и формула разбавления
Главная » Блог » Расчет концентрации эмульсии и формула разбавления
Если в ходе мониторинга было установлено, что концентрация эмульсии не соответствует установленным требованиям, потребуется провести коррекцию ее состава. Если этот показатель ниже установленной границы, нужно добавить в эмульсию концентрат. Если же состав, наоборот, слишком концентрированный, нужно влить в него дистиллированной воды или, что предпочтительнее, слабый раствор СОЖ.
При этом важно точно определить, какое количество концентрата или разбавочной жидкости нужно влить в эксплуатируемый состав. В этом случае нужно воспользоваться двумя основными формулами определения уровня концентрации эмульсии.
Закон разбавления
Этот способ применим в случае, когда необходимо снизить концентрацию состава. В других случаях эта методика отличается сложностями в применении. Соотношение выглядит так:
Соотношение выглядит так:
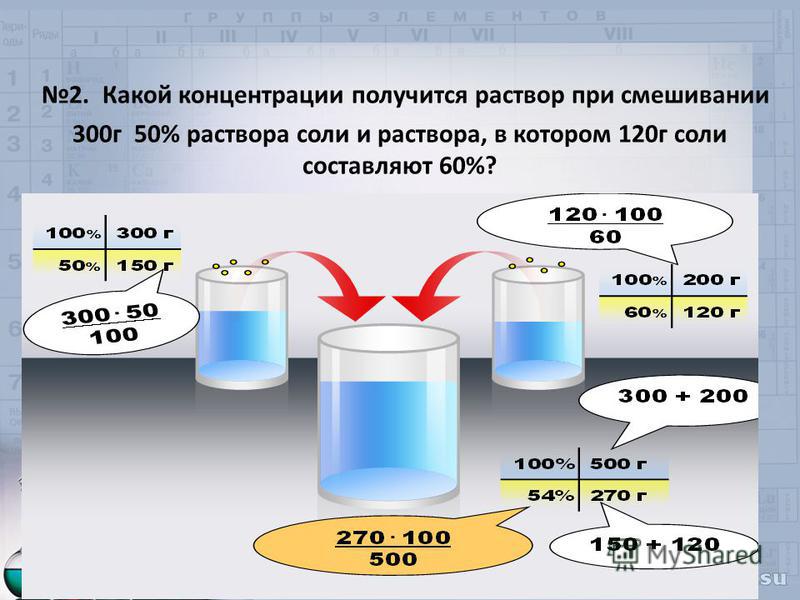
С1V1 = C2V2, где C1 – начальная концентрация, C2 – требуемая концентрация, V1 – первоначальный объем СОЖ, V2 – конечный объем эмульсии.
Например, на предприятии есть станок с баком для эмульсии 1 м³. В него залита СОЖ концентрацией 10%. Это оборудование должно работать при использовании смазочного материала с концентрацией 7%. Нужно рассчитать количество воды, которое нужно влить в бак.
Согласно приведенной выше формуле, имеются следующие данные:
С1 = 10%
C2 = 7%
V1 = 1000 л
V2 = 10 * 1000/7 = 1429 л
Соответственно, в бак потребуется влить 429 л воды.
Правило креста
Второй метод определения правильной концентрации состава и количества его элементов позволяет узнать пропорцию при смешении двух растворов с целью получения третьего состава.
В этом случае С1>С2, нужно найти Сх. При этом V1 и V2 являются условными показателями объемов каждого вещества, которые нужно будет смешать. Правило креста имеет ряд особенностей.
- Есть два раствора. В первом концентрация больше (С1), а во втором – меньше (С2). Требуется получить эмульсию с составом С3.
- Нужно записать концентрацию первого состава в верхнем углу, а второго вещества – в нижнем углу листа. Требуемая концентрация должна быть на уровне между ними.
- Нужно вычесть из показателя С1 концентрацию Сх. Этот результат будет соответствовать объему V2.
- После этого из показателя Сх вычитают концентрацию С2. Получается результат V1.
- Нужно составить пропорцию, в которой в числителе будет V1, а в знаменателе V2. Так определяется соотношение между объемами эмульсий для смешения.
Например, есть раствор с концентрацией 11%. Его разбавляют раствором с концентрацией 1%. При этом требуется получить эмульсию с показателем 7%. Сначала нужно записать все данные для расчетов:
С1 = 11%
С2 = 1%
С3 = 7%
Далее проводится расчет:
V2 = C1 – C3 = 11- 7 = 4
V1 = C3 – C1 = 7 – 1 = 6
Чтобы получить состав с требуемой концентрацией, потребуется смешать 6 частей эмульсии с концентрацией 11% с 4 частями однопроцентного состава.
Это же правило можно применять для увеличения концентрации. В этом случае С1 должно равняться 100% (это чистый концентрат). Например, для повышения концентрации эмульсии 3% применяется чистый концентрат. При этом нужно создать смазочный состав с показателем 14%. Расчет будет следующим:
С1 = 100%
С2 = 3%
С3 = 14%
Получаем объем каждой жидкости:
V1 = 11
V2 = 86
Нужно смешать 11 частей концентрата с 86 частями эмульсии.
Вас заинтересуют
Ваш вопрос успешно отправлен. Спасибо!
Если в ходе мониторинга было установлено, что концентрация эмульсии не соответствует установленным требованиям, потребуется провести коррекцию ее состава. Если этот показатель ниже установленной границы, нужно добавить в эмульсию концентрат. Если же состав, наоборот, слишком концентрированный, нужно влить в него дистиллированной воды или, что предпочтительнее, слабый раствор СОЖ.
Если же состав, наоборот, слишком концентрированный, нужно влить в него дистиллированной воды или, что предпочтительнее, слабый раствор СОЖ.
При этом важно точно определить, какое количество концентрата или разбавочной жидкости нужно влить в эксплуатируемый состав. В этом случае нужно воспользоваться двумя основными формулами определения уровня концентрации эмульсии.
Закон разбавления
Этот способ применим в случае, когда необходимо снизить концентрацию состава. В других случаях эта методика отличается сложностями в применении. Соотношение выглядит так:
С1V1 = C2V2, где C1 – начальная концентрация, C2 – требуемая концентрация, V1 – первоначальный объем СОЖ, V2 – конечный объем эмульсии.
Например, на предприятии есть станок с баком для эмульсии 1 м³. В него залита СОЖ концентрацией 10%. Это оборудование должно работать при использовании смазочного материала с концентрацией 7%. Нужно рассчитать количество воды, которое нужно влить в бак.
Согласно приведенной выше формуле, имеются следующие данные:
С1 = 10%
C2 = 7%
V1 = 1000 л
V2 = 10 * 1000/7 = 1429 л
Соответственно, в бак потребуется влить 429 л воды.
Правило креста
Второй метод определения правильной концентрации состава и количества его элементов позволяет узнать пропорцию при смешении двух растворов с целью получения третьего состава.
В этом случае С1>С2, нужно найти Сх. При этом V1 и V2 являются условными показателями объемов каждого вещества, которые нужно будет смешать. Правило креста имеет ряд особенностей.
- Есть два раствора. В первом концентрация больше (С1), а во втором – меньше (С2). Требуется получить эмульсию с составом С3.
- Нужно записать концентрацию первого состава в верхнем углу, а второго вещества – в нижнем углу листа. Требуемая концентрация должна быть на уровне между ними.
- Нужно вычесть из показателя С1 концентрацию Сх. Этот результат будет соответствовать объему V2.
- После этого из показателя Сх вычитают концентрацию С2. Получается результат V1.
- Нужно составить пропорцию, в которой в числителе будет V1, а в знаменателе V2. Так определяется соотношение между объемами эмульсий для смешения.

Например, есть раствор с концентрацией 11%. Его разбавляют раствором с концентрацией 1%. При этом требуется получить эмульсию с показателем 7%. Сначала нужно записать все данные для расчетов:
С1 = 11%
С2 = 1%
С3 = 7%
Далее проводится расчет:
V2 = C1 – C3 = 11- 7 = 4
V1 = C3 – C1 = 7 – 1 = 6
Чтобы получить состав с требуемой концентрацией, потребуется смешать 6 частей эмульсии с концентрацией 11% с 4 частями однопроцентного состава. Если представить это соотношение в виде дроби 6/4 можно произвести сокращение. Получается пропорция 3/2. В таком количестве можно смешивать заданные составы.
Это же правило можно применять для увеличения концентрации. В этом случае С1 должно равняться 100% (это чистый концентрат). Например, для повышения концентрации эмульсии 3% применяется чистый концентрат. При этом нужно создать смазочный состав с показателем 14%. Расчет будет следующим:
С1 = 100%
С2 = 3%
С3 = 14%
Получаем объем каждой жидкости:
V1 = 11
V2 = 86
Нужно смешать 11 частей концентрата с 86 частями эмульсии.
Степень окисления – презентация онлайн
Похожие презентации:
Степень окисления веществ
Степень окисления
Степень окисления. Бинарные соединения
Степень окисления
Степень окисления
Валентность и степень окисления
Степень окисления. Составление формул бинарных соединений
Степень окисления. Бинарные соединения
Соединения химических элементов. Валентность и степень окисления элементов
Степень окисления. Ряд напряжений. (Лекция 2.1)
Глава1 – понятие о степени окисления.
Глава2 – определение степени окисления.
Глава3 – степень окисления в ионе.
Глава4 – составление формул по
степеням окисления.
Глава5 – правило креста.
Глава6 – тренировочные задания.
Глава7 – правильные ответы.
Глава8 – проверочная работа, ответы.
Глава9 – степень окисления углерода.
Степень окисления – это условный
заряд атома химического элемента
основе предположения, что все
соединения (и ионные, и
ковалентные полярные) состоят
только из ионов .

1)
2)
3)
4)
a)
b)
c)
d)
e)
f)
Степень окисления простых веществ равна нулю
Например: S0, H02, Cl02, O02, Na0.
Максимальная (высшая) степень окисления равна + номер
группы (элемент на первом месте)
Например: P2+5O5 , S+6F6.
Если степень окисления переменная – будет указано в скобках.
Минимальная степень окисления равна – ( 8 – номер группы)
(элемент на втором месте)
Например: SCl2-1 , Li3P-3.
Постоянные степени окисления:
O-2 (кроме O+2F2, h3O2-1,пероксидов металлов)
F-1
+1
металлы первой группы (кроме Cu, Au) –степень окисления
металлы второй группы (кроме Hg) – степень окисления+2
+3
B и металлы третьей группы – степень окисления
Cl
+7
2
+14
O
-2
7
-14 =0
В соединениях суммарная степень окисления всегда равна
нулю. Зная это и степень одного из элементов, всегда можно
найти степень окисления другого элемента по формуле
бинарного соединения.
 Например, найдём степень окисления
Например, найдём степень окисленияхлора в соединении Cl2O7. Обозначим степень окисления
иметь общий отрицательный заряд(-2).7=-14. Тогда общий заряд
двух атомов хлора будет равен+14, а степень окисления одного
атома:
(+14):2=+7
6. Определение степени окисления
+6 -2• SO3
+7
+1 -3
• h4N
-2
• Mn2O7
+5 -2
• P2O5
+1 -2
+2 -1
• BaCl2
+6 -1
• SF6
+2 -1
• Li2O
• Mgh3
+3 -2
+2 -2
• B2O3
• CaS
Правило: алгебраическая сумма степеней окисления в
сложном ионе равна суммарному заряду этого иона.
(S2 O3-2)2Рассмотрим пример:
+4
-6
=-2
Обозначим степень окисления кислорода-2 .Три иона
кислорода будут иметь общий отрицательный заряд
(-2).3=-6. Тогда общий заряд двух ионов серы будет
равен+4, а одного иона (+4):2=+2
(S22+O3-2)2-
Zn+2S-2, Ca+23N-32
N2+3 O3-2
Si+4 O-22
+4
+3
Fe
+3
+6
-4 =0
+4
C
+2
+4
+1
-2
O
3
-6 =0
Na +1 Cl+7 O-24
+1
+7
+6
-6 =0
H+1 N+5 O-23
Cl3-1
-3 =0
Ba +2
S+6
-8 =0
+5
-6 =0
K+13 P+5
+3
+5
O-24
-8 =0
O3-2
-6 =0
9.
 Правило крестаПравило креста: для составления химических
Правило крестаПравило креста: для составления химическихформул по названию вещества надо записать
соответствующие знаки химических элементов
и указать степени окисления каждого из них.
Например, оксид алюминия – Al+3O-2. Затем по
«правилу креста» степень окисления кислорода
равна индексу у атома Al, а степень окисления
алюминия-индексу у атома O.
Al+3
2
O-2
3
Al2O3
10. Составление формул по степени окисления
+1 -2Na
Оксид натрия 2O
+3 -1
Fe
Cl 3
Хлорид железа (III) +2 -3
Mg
N2
Нитрид магния 3
+4 -2
S
O4
Оксид серы (IV) 2
сокращается на два – SO
2
+3 -2
Al
Сульфид алюминия – 2 S 3
Mg+2H-12
Гидрид магния –
1)
Расставьте
степени
окисления в
соединениях и в
ионах:
MgO
Zn
KNO3
HMnO4
CaSo3
Na3PO4
(CrO4)-2
(IO4)-
2) Составьте формулы
следующих соединений:
Хлорид железа(III)
Оксид серы(VI)
Гидрид калия
Нитрид бария
3) Назовите вещества,
представленные формулами:
P2O5
AgBr
CuS
NaH
Mg+2O-2 , Zn0
1)
K+1 N+5 O-23
+1
+5
-6 =0
Ca+2 S+4
+2
+4
O-23
-6 =0
(Cr+6 O-24)-2
+6
-8 = -2
H+1
+1
Mn+7 O-24
+7
Na+13 P+5
+3
+5
(I+7 O-24)+7
-8 = -1
-8 =0
O-24
-8 =0
2) Хлорид железа(III) – Fe+3Cl3 -1
Оксид серы(VI) – S+6O3-2
Гидрид калия – K+1H-1
Нитрид бария – Ba3+2N2 -1
3) P2O5 – оксид фосфора(V)
AgBr – бромид серебра
CuS – сульфид меди(II)
NaH – гидрид натрия
14.
 Расставьте степени окисления в соединениях и в ионах:Проверочная работа
Расставьте степени окисления в соединениях и в ионах:Проверочная работаI вариант
II вариант
1) Расставьте степени окисления в соединениях и в ионах:
h3SO3 h5P2O7 ZnF2
BaCO3 O2 Na2SO4
(PO4)3-, (MnO4)-
CaBr2 KClO4 S8
Na2Cr2O7 Li2SO4 MgSiO3
(ClO2)- ,(NO3)-
2) Составьте формулы следующих соединений:
Хлорид магния
Сульфид железа (III)
Оксид бора
Нитрид кальция
Оксид азота(II)
Фторид алюминия
Гидрид бария
Оксид серы(IV)
Сульфид магния
Нитрид лития
3) Назовите вещества, представленные формулами:
LiH , CuO, FeCl3, Ag2S
FeCl2, Cah3, CO2, Al2S3
15. Ответы к проверочной работе
I вариант1
h3+1S+4O3-2
h5+1P2+5O7-2
Zn+2F2-1
Ba+2C+4O3-2
O20
Na2+1S+6O4-2
(P+5O4-2)3(Mn+7O4-2)-
II вариант
1
Ca+2Br2-1
K+1CL+7O4-2
S80
Na2+1Cr2+6O7-2
Li2+1S+6O4-2
Mg+2Si+4O3-2
(Cl+3O2-2)(N+5O3-2)-
2.
Хлорид магния- MgCl2,
Сульфид железа (III)- Fe2S3
Оксид бора – B2O3
Нитрид кальция – Ca3N2
Оксид азота(II) – NO
3.

Гидрид лития – LiH
Оксил меди(II) – CuO
Хлорид железа(III) – FeCl3
Сульфид серебра – Ag2S
2.
Фторид алюминия – AlF3
Гидрид бария – Bah3
Оксид серы(IV) – SO2
Сульфид магния – MgS
Нитрид лития – Li3N
3.
Хлорид железа(II) – FeCl2
Гидрид кальция – Cah3
Оксид углерода(IV) – CO2
Сульфид алюминия – Al2S3
English Русский Правила
5.5: Написание формул для ионных соединений
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 98009
Цели обучения
- Напишите правильную формулу ионного соединения.
- Распознавать многоатомные ионы в химических формулах.

Ионные соединения не существуют в виде молекул. В твердом состоянии ионные соединения находятся в кристаллической решетке, содержащей множество ионов, каждый из катиона и аниона. Ионная формула, такая как \(\ce{NaCl}\), является эмпирической формулой. Эта формула просто указывает на то, что хлорид натрия состоит из равного количества ионов натрия и хлорида. Сульфид натрия, другое ионное соединение, имеет формулу \(\ce{Na_2S}\). Эта формула указывает на то, что это соединение состоит из вдвое большего количества ионов натрия, чем ионов сульфида. Этот раздел научит вас, как найти правильное соотношение ионов, чтобы вы могли написать правильную формулу.
Если вы знаете название бинарного ионного соединения, вы можете написать его химическую формулу . Начните с того, что напишите ион металла с его зарядом, а затем ион неметалла с его зарядом. Поскольку в целом соединение должно быть электрически нейтральным, решите, сколько ионов каждого иона необходимо, чтобы положительные и отрицательные заряды нейтрализовали друг друга.
Пример \(\PageIndex{1}\): нитрид алюминия и оксид лития
Напишите формулы для нитрида алюминия и оксида лития. 9{2-}}\)
общий заряд катионов = общий заряд анионов
1(3+) = 1(3-)
+3 = -3
общий заряд катионов = общий заряд анионов
2(1+) = 1(2-)
+2 = -2
 Запишите окончательную формулу. Опустите все заряды и все индексы, равные 1.
Запишите окончательную формулу. Опустите все заряды и все индексы, равные 1.Альтернативным способом написания правильной формулы для ионного соединения является использование метода крест-накрест . В этом методе числовое значение заряда каждого иона пересекается, чтобы стать нижним индексом другого иона. Признаки обвинения сняты.
Пример \(\PageIndex{2}\): Метод крест-накрест для оксида свинца (IV)
Напишите формулу оксида свинца (IV).
Решение
| Метод крест-накрест | Напишите формулу оксида свинца (IV) 9{2-}}\) |
|---|---|
2. Переставьте только номер положительного заряда в нижний индекс аниона, а номер только отрицательного заряда в нижний индекс катиона. Переставьте только номер положительного заряда в нижний индекс аниона, а номер только отрицательного заряда в нижний индекс катиона. | |
| 3. Уменьшить до минимального соотношения. | \(\ce{Pb_2O_4}\) |
| 4. Запишите окончательную формулу. Опустите все индексы, равные 1. | \(\ce{PbO_2}\) |
Упражнение \(\PageIndex{2}\)
Напишите химическую формулу ионного соединения, состоящего из каждой пары ионов.
- ион кальция и ион кислорода
- ион меди 2+ и ион серы
- ион меди 1+ и ион серы
- Ответ a:
- СаО
- Ответ б:
- CuS
- Ответ c:
- Медь 2 С
Имейте в виду, что ионные соединения являются эмпирическими формулами и поэтому должны быть записаны как наименьшее соотношение ионов.
Пример \(\PageIndex{3}\): Соединение серы
Напишите формулу соединения натрия с серой.
Решение
| Метод крест-накрест | Напишите формулу соединения натрия с серой 9{2-}}\) |
|---|---|
| 2. Переставьте только номер положительного заряда в нижний индекс аниона, а номер только отрицательного заряда в нижний индекс катиона. | |
| 3. Уменьшить до минимального соотношения. | Этот шаг необязателен. |
4. Запишите окончательную формулу. Опустите все индексы, равные 1. | \(\ce{Na_2S}\) |
Упражнение \(\PageIndex{3}\)
Напишите формулы для каждого ионного соединения.
- бромид натрия
- хлорид лития
- оксид магния
- Ответ a:
- NaBr
- Ответ б:
- LiCl
- Ответ c:
- MgO
Многоатомные ионы
Некоторые ионы состоят из групп связанных вместе атомов и имеют общий электрический заряд. Поскольку эти ионы содержат более одного атома, их называют многоатомными ионами. Многоатомные ионы имеют характерные формулы, названия и заряды, которые следует запомнить. Например № 3 − – нитрат-ион; он имеет один атом азота и три атома кислорода и общий заряд 1-. В таблице \(\PageIndex{1}\) перечислены наиболее распространенные многоатомные ионы.
| Имя | Формула |
|---|---|
| ион аммония | НХ 4 + |
| ацетат-ион | C 2 H 3 O 2 − (также пишется CH 3 CO 2 − ) |
| карбонат-ион | СО 3 2 − |
| хромат-ион | CrO 4 2 − |
| дихромат-ион | Кр 2 О 7 2 − |
| гидрокарбонат-ион (бикарбонат-ион) | ОХС 3 − |
| цианид-ион | CN − |
| гидроксид-ион | ОХ − |
| нитрат-ион | НЕТ 3 − |
| нитрит-ион | НЕТ 2 − |
| перманганат-ион | MnO 4 − |
| ион фосфата | ЗП 4 3 − |
| ион гидрофосфата | ГПО 4 2 − |
| ион дигидрофосфата | Н 2 ПО 4 − |
| сульфат-ион | СО 4 2 − |
| гидросульфат-ион (бисульфат-ион) | ХСО 4 − |
| сульфит-ион | СО 3 2 − |
Правило построения формул для ионных соединений, содержащих многоатомные ионы, такое же, как и для формул, содержащих одноатомные (одноатомные) ионы: положительный и отрицательный заряды должны уравновешиваться. Если для балансировки заряда требуется более одного определенного многоатомного иона, вся формула для многоатомного иона должна быть заключена в круглые скобки, а числовой индекс ставится вне скобок . Это должно показать, что нижний индекс относится ко всему многоатомному иону. Примером может служить Ba(NO 3 ) 2 .
Если для балансировки заряда требуется более одного определенного многоатомного иона, вся формула для многоатомного иона должна быть заключена в круглые скобки, а числовой индекс ставится вне скобок . Это должно показать, что нижний индекс относится ко всему многоатомному иону. Примером может служить Ba(NO 3 ) 2 .
Написание формул для ионных соединений, содержащих многоатомные ионы
Написание формулы для ионных соединений, содержащих многоатомные ионы, также включает те же шаги, что и для бинарного ионного соединения. Запишите символ и заряд катиона, а затем символ и заряд аниона. 9-}\)

Пример \(\PageIndex{5}\)
Напишите химическую формулу ионного соединения, состоящего из иона калия и сульфат-иона.
Раствор
| Пояснение | Ответить |
|---|---|
Ионы калия имеют заряд 1+, тогда как ионы сульфата имеют заряд 2−. Нам понадобятся два иона калия, чтобы сбалансировать заряд сульфат-иона, поэтому правильная химическая формула будет \(\ce{K2SO4}\). | \(\ce{K_2SO_4}\) |
Упражнение \(\PageIndex{5}\)
Напишите химическую формулу ионного соединения, состоящего из каждой пары ионов.
- ион магния и карбонат-ион
- ион алюминия и ацетат-ион
- Ответ a:
- \(\ce{MgCO3}\)
- Ответ б:
- \(\ce{Al(Ch4COO)3}\)
Распознавание ионных соединений
Существует два способа распознавания ионных соединений.
Метод 1
Соединения металлических и неметаллических элементов обычно являются ионными. Например, \(\ce{CaBr2}\) содержит металлический элемент (кальций, металл группы 2 [или 2A]) и неметаллический элемент (бром, неметалл группы 17 [или 7A]). Следовательно, это, скорее всего, ионное соединение (на самом деле 90 498 — это 90 499 ионное). Напротив, соединение \(\ce{NO2}\) содержит два элемента, которые оба являются неметаллами (азот из группы 15 [или 5A] и кислород из группы 16 [или 6A]. Это не ионное соединение; он принадлежит к категории ковалентных соединений, обсуждаемых в другом месте.Также обратите внимание, что эта комбинация азота и кислорода не имеет определенного электрического заряда, поэтому она равна 9{2+}}\) ион, при этом заряд 2+ уравновешивает общий заряд 2- от двух нитрат-ионов. Таким образом, это соединение также является ионным.
Это не ионное соединение; он принадлежит к категории ковалентных соединений, обсуждаемых в другом месте.Также обратите внимание, что эта комбинация азота и кислорода не имеет определенного электрического заряда, поэтому она равна 9{2+}}\) ион, при этом заряд 2+ уравновешивает общий заряд 2- от двух нитрат-ионов. Таким образом, это соединение также является ионным.
Пример \(\PageIndex{6}\)
Идентифицируйте каждое соединение как ионное или неионное.
- \(\ce{Na2O}\)
- \(\ce{PCl3}\)
- \(\ce{Nh5Cl}\)
- \(\ce{OF2}\)
Раствор
| Пояснение | Ответить |
|---|---|
| а. Натрий — это металл, а кислород — неметалл. Поэтому ожидается, что \(\ce{Na2O}\) будет ионным по методу 1. | \(\ce{Na2O}\), ионный |
б. {+}}\), что указывает на то, что это соединение является ионным по методу 2 {+}}\), что указывает на то, что это соединение является ионным по методу 2 | \(\ce{Nh5Cl}\), ионный |
| д. И кислород, и фтор неметаллы. Следовательно, \(\ce{OF2}\) не является ионным по методу 1 | \(\ce{OF2}\), неионный |
Упражнение \(\PageIndex{6}\)
Идентифицируйте каждое соединение как ионное или неионное.
- \(\ce{N2O}\)
- \(\ce{FeCl3}\)
- \(\ce{(Nh5)3PO4}\)
- \(\ce{SOCl2}\)
- Ответ a:
- неионогенный
- Ответ б:
- ионный
- Ответ c:
- ионный
- Ответ д:
- неионогенный
Резюме
Формулы для ионных соединений содержат символы и число каждого атома, присутствующего в соединении, в наименьшем соотношении целых чисел.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Показать страницу TOC
- № на стр.
- Теги
4.8: Ковалентное связывание и написание формул
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 96867
- Элизабет Гордон
- Университет Фурмана
Цели обучения
- Знать, какие типы соединений элементов образуют ковалентные соединения.

- Чтобы понять, как атомы делят свои валентные электроны при ковалентной связи.
- Запоминание числовых префиксов, используемых в ковалентной номенклатуре
- Поймите, что ковалентные составные индексы никогда не сокращаются.
Обмен электронами
Ранее мы обсуждали ионную связь, при которой электроны могут передаваться от одного атома к другому, так что оба атома имеют энергостабильную внешнюю электронную оболочку. Поскольку большинство заполненных электронных оболочек содержат восемь электронов, химики назвали эту тенденцию правилом октета. Однако есть и другой способ, которым атом может достичь полной валентной оболочки: атомы могут делят электронов. Этот тип связи будет ковалентной связью. Этот тип связи может создаваться двумя комбинациями атомов: неметалл/неметалл или металлоид/неметалл. В этом классе мы не будем обсуждать вариант металлической связи, которая является формой ковалентной связи.
Рисунок \(\PageIndex{1}\): Совместное использование означает заботу, особенно об атомах, которые участвуют в ковалентных связях.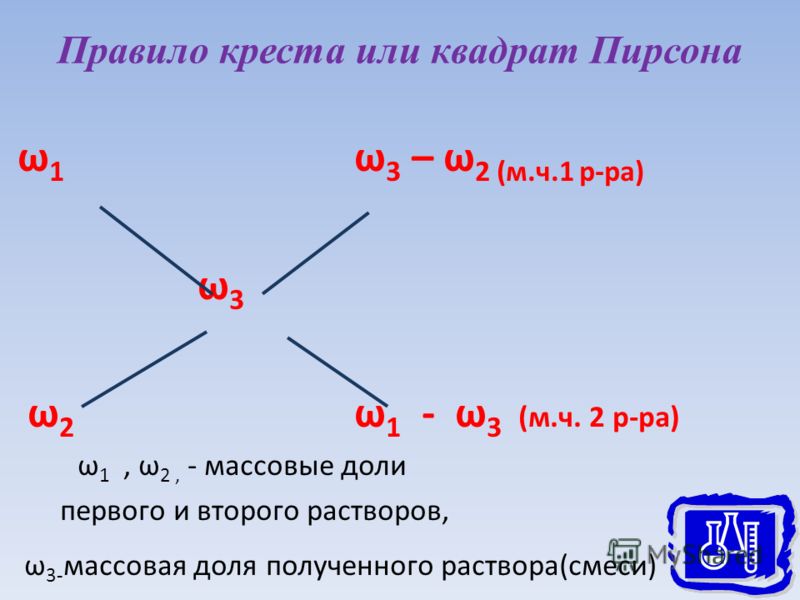 (CC BY-2.0; Карлос Майя).
(CC BY-2.0; Карлос Майя).Эту концепцию можно проиллюстрировать с помощью двух атомов водорода, каждый из которых имеет один электрон в своей валентной оболочке. (Для небольших атомов, таких как атомы водорода, валентная оболочка будет первой оболочкой, которая содержит только два электрона.) Мы можем представить два отдельных атома водорода следующим образом:0032
Напротив, когда два атома водорода становятся достаточно близко друг к другу, чтобы разделить свои электроны, их можно представить следующим образом:
Совместно используя свои валентные электроны, оба атома водорода теперь имеют по два электрона в своих соответствующих валентных оболочках. Поскольку каждая валентная оболочка теперь заполнена, такое расположение более стабильно, чем когда два атома разделены. Совместное использование электронов между атомами называется ковалентной связью, а два электрона, которые соединяют атомы в ковалентной связи, называются связывающей парой электронов. Дискретная группа атомов, соединенных ковалентными связями, называется молекулой — наименьшей частью соединения, которая сохраняет химическую идентичность этого соединения.
Химики часто используют диаграммы Льюиса для представления ковалентных связей в молекулярных веществах. Например, диаграммы Льюиса двух отдельных атомов водорода выглядят следующим образом:
Диаграмма Льюиса двух атомов водорода с общими электронами выглядит следующим образом:
Ковалентная связь. Молекула водорода представлена следующим образом:
Помните, что черточка, также называемая одинарной связью, представляет собой пара электронов.
Связь в молекуле водорода, измеряемая как расстояние между двумя ядрами, составляет около 7,4 × 10 90 282 −11 90 283 м, или 74 пикометра (пм; 1 пм = 1 × 10 90 282 −12 90 283 м). Эта конкретная длина связи представляет собой баланс между несколькими силами: притяжением между противоположно заряженными электронами и ядрами, отталкиванием между двумя отрицательно заряженными электронами и отталкиванием между двумя положительно заряженными ядрами. Если бы ядра были ближе друг к другу, они сильнее отталкивались бы друг от друга; если бы ядра были дальше друг от друга, между положительными и отрицательными частицами было бы меньше притяжения.
Фтор — еще один элемент, атомы которого соединяются парами, образуя двухатомных (двухатомных) молекул. Два отдельных атома фтора имеют следующие электронные точечные диаграммы:
Каждый атом фтора вносит один валентный электрон, образуя одинарную связь и давая каждому атому полную валентную оболочку, что соответствует правилу октета:
Кружки показывают, что каждый атом фтора имеет восемь электронов вокруг него. Как и в случае с водородом, мы можем представить молекулу фтора тире вместо связывающих электронов:
Каждый атом фтора имеет шесть электронов или три пары электронов, которые не участвуют в ковалентной связи. Вместо того, чтобы быть общими, они считаются принадлежащими одному атому. Они называются несвязывающими парами (или неподеленными парами ) электронов.
Ковалентные связи между различными атомами
Теперь, когда мы рассмотрели обмен электронами между атомами одного и того же элемента, давайте рассмотрим образование ковалентных связей между атомами разных элементов. Рассмотрим молекулу, состоящую из одного атома водорода и одного атома фтора:
Рассмотрим молекулу, состоящую из одного атома водорода и одного атома фтора:
Каждому атому требуется один дополнительный электрон, чтобы заполнить его валентную оболочку. Вкладывая каждый электрон, они образуют следующую молекулу:
В этой молекуле атом водорода не имеет несвязывающих электронов, а атом фтора имеет шесть несвязывающих электронов (три неподеленные электронные пары). Кружками показано, как заполнены оболочки валентных электронов для обоих атомов.
Пример \(\PageIndex{1}\)
Нарисуйте диаграмму Льюиса для каждого соединения.
- молекула, состоящая из двух атомов хлора
- молекула, состоящая из атома водорода и атома брома
Раствор
Хлор имеет такую же конфигурацию электронов валентной оболочки, что и фтор, поэтому диаграмма Льюиса для молекулы, состоящей из двух атомов хлора, похожа на диаграмму для фтора:
Бром имеет ту же конфигурацию электрона валентной оболочки, что и фтор, поэтому диаграмма Льюиса для молекулы, состоящей из атома водорода и атома брома, аналогична диаграмме для водорода и фтора:
Упражнение \(\PageIndex{1}\)
Нарисуйте диаграмму Льюиса для каждого соединения (покажите оба формата).
- молекула, состоящая из одного атома хлора и одного атома фтора
- молекула, состоящая из одного атома водорода и одного атома йода
- Ответить на
Монофторид хлора представляет собой летучее межгалогеновое соединение.
- Ответ б
\(\ce{HI}\) используется в органическом и неорганическом синтезе как один из первичных источников йода.
Более крупные молекулы устроены аналогичным образом, при этом некоторые атомы участвуют более чем в одной ковалентной связи. Например, вода с двумя атомами водорода и одним атомом кислорода может быть представлена следующим образом:
, а метан (CH 4 ) с одним атомом углерода и четырьмя атомами водорода также может быть представлена следующим образом:
На рисунке \(\PageIndex{1}\) показано количество ковалентных связей, которые обычно образуют различные атомы.
Правила рисования ковалентных структур Льюиса
Они применяются либо к комбинациям неметалл/неметалл, либо металлоид/неметалл.
- Подсчитайте все валентные электроны, которые должны быть использованы. Помните, что валентные электроны — это римские цифры над элементом.
- Определите, какой атом должен быть центральным. Углерод всегда является центральным, а водород — концевым атомом. Если этих атомов нет, тогда используйте атом, которого у вас меньше всего в формуле.
- Сначала соедините каждый атом с центральным атомом, используя одинарные связи.
- Для простых молекул или ионов (имеющих только два атома) попробуйте одинарные связи, затем двойные и, наконец, тройные, чтобы получить октеты вокруг каждого атома (кроме B, Be и H)
- Для более сложных молекул или ионов (3 или более атомов) попробуйте по одной кратной связи за раз, если одинарные связи достигают октетов.
- Мои серии для молекул/ионов, которым требуется больше, чем одинарные связи, можно увидеть ниже (имея в виду, что H, B и Be имеют только одинарные связи)
- Одиночный/одинарный (\(\ce{-}\), \(\ce{-}\)) ,
- , затем одинарный/двойной (\(\ce{-}\), \(\ce{=}\)),
- , затем двойной/двойной (\(\ce{=}\), \(\ce{=}\)),
- , и если это не сработает, попробуйте тройной/одинарный (\(\ce{#}\), \(\ce{-}\))
- В нашем классе мы не используем кратные связи для галогенов.

Двойные и тройные связи
При ковалентной связи использование двойных (всего четыре электрона) или тройных (всего шесть электронов) вариантов для получения стабильного октета. Если одинарная связь не работает, вы можете включить множественную связь. Обратите внимание на приведенные выше правила, согласно которым атомы никогда не достигнут октетов (водород и бор). Хотя это математически осуществимо, галогены также не будут использовать множественные связи, чтобы стать стабильными.
Давайте рассмотрим несколько молекул, которые используют множественные связи:
Атомами, которые могут использовать множественные связи, будут кислород, азот, сера, фосфор и углерод. Если октет может быть получен с помощью одинарной связи, не включайте в структуру множественные связи.
Множественные связи включают более одного типа соединения. По этой причине разорвать или расщепить кратную связь труднее, чем это было бы одинарной связью или связью более низкого порядка (при сравнении одинаковых связанных атомов). Например, тройную связь в монооксиде углерода разорвать труднее, чем одну из двойных связей в диоксиде углерода. Читая о производстве смога или разрушении озонового слоя, учитывайте силу связи химических веществ, связанных с этими экологическими проблемами.
Например, тройную связь в монооксиде углерода разорвать труднее, чем одну из двойных связей в диоксиде углерода. Читая о производстве смога или разрушении озонового слоя, учитывайте силу связи химических веществ, связанных с этими экологическими проблемами.
Пример \(\PageIndex{1}\)
Прежде чем рисовать приведенные ниже структуры, ознакомьтесь с документами Moodle Университета Фурмана CHM101. Здесь вы увидите лайтборд-видео, в котором ваш инструктор рисует структуры Льюиса для различных ковалентных соединений. Затем попробуйте построить структуры других молекул в этом примере.
- О 3 (озон)
- N 2 (азот)
- SO 3 (триоксид серы)
- CCl 4 (четыреххлористый углерод)
Растворы
Написание формул для ковалентных соединений
Ковалентные соединения используют префиксы для обозначения количества атомов в их формулах. Для написания правильных формул вам потребуется запомнить Таблицу \(\PageIndex{1}\) ниже.
Для написания правильных формул вам потребуется запомнить Таблицу \(\PageIndex{1}\) ниже.
| Имя префикса | Количество атомов |
|---|---|
| Моно | 1 |
| Ди (не би) | 2 |
| Три | 3 |
| Тетра (не четырехъядерный) | 4 |
| Пента | 5 |
| Шестигранник | 6 |
| Гепта (не септа) | 7 |
| Окта | 8 |
| Нона | 9 |
| Дека | 10 |
Правила написания ковалентных формул
- Ковалентные соединения не требуют заряда.

- Интерпретируйте префиксы как число атомов или нижний индекс.
- Не пересекайте и не сокращайте нижние индексы (в отличие от ионных соединений).
- Формула должна отражать название соединения.
Пример \(\PageIndex{1}\)
Напишите формулы для следующих ковалентных соединений:
- пятиокись азота
- тригидрид бора
- гексафторид серы
- четыреххлористый углерод
- диоксид кремния
- диоксид водорода диоксид
- Ответить на
Н 2 О 5
- Ответ б
ВН 3
- Ответ c
СФ 6
- Ответ d
ККл 4
- Ответ e
SiO 2
- Ответить f
H 2 O 2 , не уменьшать нижние индексы в ковалентных соединениях
Авторы и ссылки
Элизабет Р.








