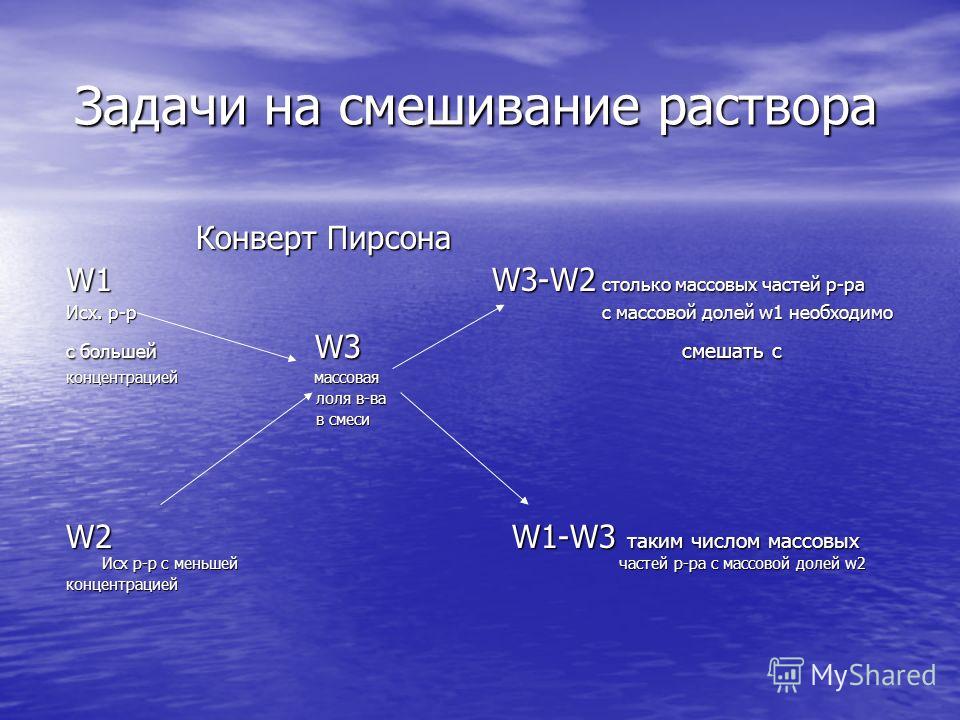
ShuricHimik: Правило креста
В школьном курсе химии среди расчётных задач встречаются те, которые связаны с приготовлением раствора заданной концентрации смешением двух растворов, концентрации которых известны. Решение подобных задач обычно производится с применением так называемого «правила креста». Оно весьма просто для запоминания, но по причине некоторой неочевидности может восприниматься как некое «шаманство». Разумеется, ничего необычного в правиле креста нет, оно достаточно просто обосновывается математически. Именно это обоснование изложено ниже, причём для понимания его достаточно школьных знаний по алгебре 8 класса.
Задача:
Дано два раствора вещества с массовыми концентрациями (массовыми долями) wx и wy. В каком соотношении их нужно смешать между собой, чтобы получить раствор с промежуточной концентрацией
Решение:
Введём следующие обозначения. Пусть для получения раствора с концентрацией (массовой долей) wz требуется смешать x г раствора с концентрацией wx и y г раствора с концентрацией wy. Таким образом в задаче требуется найти величину x/y (отношение масс смешиваемых растворов). Будем считать, что
Пусть для получения раствора с концентрацией (массовой долей) wz требуется смешать x г раствора с концентрацией wx и y г раствора с концентрацией wy. Таким образом в задаче требуется найти величину x/y (отношение масс смешиваемых растворов). Будем считать, что
wx < wz < wy .
Обозначим массу раствора с концентрацией wz как z г. Очевидно, что
x + y = z .
wx·x
Масса вещества в y г раствора с концентрацией wy составит:
wy·y
Масса вещества в z г раствора с концентрацией wz будет:
wz·z
При смешивании растворов массы растворённых в них веществ складываются, то есть
wx·x + wy·y = wz·z
Таким образом получаем следующую систему линейных алгебраических уравнений:
Для решения этой системы умножим правую и левую части верхнего уравнения на wx, после чего вычтем его из нижнего уравнения. Получим:
Получим:
Найдём теперь x:
Таким образом, исходная система уравнений имеет следующее решение:
Теперь остаётся найти отношение x/y:
Иными словами, для получения раствора с концентрацией wz нужно смешать растворы с концентрациями wx и wy в следующем соотношении:
Данная пропорция и является математическим выражением правила креста, поскольку оно графически изображается следующим образом:
x: | wx |
|
|
| wy – wz |
|
|
|
| ||
|
|
| wz |
|
|
|
|
|
| ||
y: | wy |
|
|
| wz – wx |
Приведённая мнемоническая схема означает, что для приготовления раствора с концентрацией wz нужно смешать (wy – wz) массовых частей раствора с концентрацией wx и (wz – wx) массовых частей раствора с концентрацией wy.
Правило креста справедливо и для случая, когда вместо массовой концентрации
Введя обозначения: x л – объём раствора с концентрацией cx, y л – объём раствора с концентрацией cy и z л – суммарный объём конечного раствора с концентрацией cz (cx < cz <
В связи с этим искомое соотношение объёмов растворов x/y будет иметь аналогичный вид:
Как легко догадаться, мнемоническая схема для молярных концентраций будет иметь вид, подобный случаю с массовыми концентрациями.
Добавлено: 06.12.2015
Изменено: 19.08.2020
Скачать в pdf
Формулы для пересчета концентраций растворов
В приводимой ниже таблице приняты следующие обозначения:
М — мольная масса растворенного вещества, г/моль; Э — эквивалентная масса растворенного вещества, г/моль; р — плотность раствора, г/мл.
* Дли жидкостей может применяться величина Pv, % (об.) —число миллилитров растворенной жидкости в 100 мл раствора.
РАСЧЕТНЫЕ ФОРМУЛЫ, ИСПОЛЬЗУЕМЫЕ ДЛЯ ПРИГОТОВЛЕНИЯ РАСТВОРОВ
Для приготовления определенного количества раствора какого-либо вещества заданной концентрации исходят из следующих данных: а) из количества чистого вещества и растворителя; б) из количества раствора данного вещества с более высокой концентрацией, чем заданная, и количества чистого растворителя или в) из количества двух растворов того же вещества, один из которых имеет концентрацию больше нужной, а другой — меньше.
Растворение вещества в воде
Пусть требуется приготовить А граммов раствора концентрации P [в % (масс. ) ]. Тогда:
) ]. Тогда:
(I)
(2)
где х— необходимая масса растворяемого вещества, г; b—необходимая масса воды, г.
Если нужно приготовить определенный объем V раствора (в мл) концентрации Р, находят по таблицам плотность р (в г/см3) раствора данного вещества требуемой концентрации. Поскольку А = Vp, формула (1) будет иметь вид:
(3)
В тех случаях, когда растворяемое вещество представляет собой кристаллогидрат, т. е. содержит кристаллизационную воду, для расчета необходимого его количества используют формулу:
(4)
(5)
где х— необходимая масса кристаллогидрата, г; M1—мольная масса кристаллогидрата; М2—моль-мая масса вещества без кристаллизационной воды; b — необходимая масса воды, г.
Если нужно приготовить раствор объемом V (в мл) заданной нормальности N, вычисляют значение эквивалентной массы Э растворяемого вещества, после чего находят необходимую его навеску (в г) по формуле:
(6)
При приготовлении раствора заданной молярной концентрации применяют аналогичную формулу:
(7)
где М — молярная концентрация раствора; Мв — мольная масса растворяемого вещества; V — заданный объем раствора, мл.
Разбавление раствора водой
Пусть требуется приготовить раствор концентрации Р2 из имеющегося раствора с более высокой концентрацией Р1. Обозначим массу раствора до разбавления А1, а массу раствора после разбавления— А2. Тогда массу воды b (в г), необходимую для разбавления, находят по формуле (8) или (9) в зависимости от того, задано ли значение А\ или А2.
(8)
(9)
(10)
В тех случаях, когда известна не масса, а объем раствора, необходимо по таблицам найти плотности растворов данного вещества исходной и конечной концентраций — p1 и р2 соответственно. Тогда, если нужно приготовить раствор объемом V2 (в мл) концентрации Р2 [в % (масс.)], а концентрация исходного раствора равна P1 [(в % (масс.)], то объем исходного раствора вычисляется по формуле:
(11)
Объем воды (в мл) для разбавления: b = V2 – V1
Смешивание двух растворов различной концентрации
Пусть требуется приготовить раствор заданной концентрации из двух растворов того же вещества, один из которых имеет концентрацию больше нужной, а другой — меньше. Чтобы определить, в каких пропорциях следует смешивать растворы, пользуются «правилом креста», которое наглядно показано на следующем примере:
Чтобы определить, в каких пропорциях следует смешивать растворы, пользуются «правилом креста», которое наглядно показано на следующем примере:
Смешиваемые растворы можно измерять в объемных или массовых частях в зависимости от того, в объемных или массовых процентах выражают концентрацию растворов.
«Правило креста» можно применять и в случаях разбавления раствора чистым растворителем. При этом концентрацию вещества в чистом растворителе считают равной нулю:
Для получения более концентрированного раствора растворением в нем дополнительного количества компонента твердое вещество условно считают раствором с концентрацией 100%:
К оглавлению
см. также
- Формулы для пересчета концентраций растворов
- Общие правила приготовления растворов
1.1: Растворимость — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 367707
- Мухаммад Ариф Малик
- Hampton University, Hampton, VA
Раствор
Раствор представляет собой гомогенную смесь двух или более веществ.
Терминология, связанная с растворами
- Смешиваемые вещества образуют раствор при смешивании друг с другом в любой пропорции. Например, этанол и вода смешиваются друг с другом.
- Несмешивающиеся вещества не образуют растворов при смешивании в любой пропорции.
- Частично смешивающиеся вещества могут образовывать раствор при смешивании до определенной степени, но не во всех пропорциях.
- Растворитель – вещество в большем количестве в растворе.
- Растворенное вещество — это вещество в меньшем количестве в растворе.
- Ненасыщенный раствор – это раствор, в котором растворитель удерживает растворенное вещество меньше максимального предела, т. е. в котором может быть растворено большее количество растворенного вещества.
- Насыщенный раствор – это раствор, в котором растворитель содержит максимальное количество растворенного вещества, которое он может растворить.

Вода — универсальный растворитель
Вода — один из самых важных растворителей, потому что она присутствует повсюду вокруг нас — она покрывает более 70% земли и составляет более 60% массы нашего тела. Вода представляет собой полярную молекулу, имеющую частичный отрицательный конец на атоме кислорода и частично положительный конец на атоме водорода. которые могут растворять большинство полярных и ионных соединений. В ионных соединениях катионы удерживаются анионами посредством электростатического взаимодействия. Когда ионное соединение растворяется в воде, оно диссоциирует на катионы и анионы, каждый из которых окружен слоем молекул воды, удерживаемых ионно-дипольными взаимодействиями. Молекулы воды вокруг ионов осуществляют ионно-дипольное взаимодействие, ориентируя свой частичный отрицательный конец к катионам, а частичный положительный конец к анионам. Энергия, необходимая для разрыва ион-ионного взаимодействия в ионных соединениях, частично компенсируется энергией, выделяемой при установлении ион-дипольных взаимодействий. Энергия, полученная за счет ионно-дипольных взаимодействий и склонности природы к рассеянию, является движущей силой, ответственной за растворение ионных соединений.
Энергия, полученная за счет ионно-дипольных взаимодействий и склонности природы к рассеянию, является движущей силой, ответственной за растворение ионных соединений.
Растворимость
Растворимость — это способность вещества образовывать раствор с другим веществом.
Растворимость растворенного вещества в определенном растворителе количественно выражается как концентрация растворенного вещества в насыщенном растворе. Обычно растворимость указывается в граммах растворенного вещества на 100 мл растворителя (г/100 мл). Растворимость ионных соединений в воде колеблется в широких пределах. Все ионные соединения в той или иной степени растворяются.
Для практических целей вещество считается нерастворимым , если его растворимость составляет менее 0,1 г на 100 мл растворителя.
Например, йодид свинца (II) ( \(\ce{PbI2}\)) и хлорид серебра (\(\ce{AgCl}\)) нерастворимы в воде, поскольку растворимость \(\ce{PbI2}\ ) составляет 0,0016 моль/л раствора, а растворимость \(\ce{AgCl}\) составляет около 1,3 x 10-5 моль/л раствора. Йодид калия (\(\ce{KI}\)) и \(\ce{Pb(NO3)2}\) растворимы в воде. При смешивании водных растворов \(\ce{KI}\) и \(\ce{Pb(NO3)2}\) нерастворимая комбинация ионов, т. е. \(\ce{PbI2}\) , в этом случае , выпадает в осадок, как показано на рисунке \(\PageIndex{1}\).
Йодид калия (\(\ce{KI}\)) и \(\ce{Pb(NO3)2}\) растворимы в воде. При смешивании водных растворов \(\ce{KI}\) и \(\ce{Pb(NO3)2}\) нерастворимая комбинация ионов, т. е. \(\ce{PbI2}\) , в этом случае , выпадает в осадок, как показано на рисунке \(\PageIndex{1}\).
Рисунок \(\PageIndex{1}\): Реакция осаждения: \(\ce{Pb(NO3)2(водн.) + 2KI(водн.) -> PbI2(s)v + 2KNO3(водн.)}\). источник: PRHaney [CC BY-SA (https://creativecommons).
Рекомендации по растворимости ионных соединений в воде
Не существует безотказных рекомендаций по прогнозированию растворимости ионных соединений в воде. Однако следующие рекомендации могут предсказать растворимость большинства ионных соединений.
Растворимые ионы
- 9{2-}}\)) нерастворимы, за исключением случаев, когда катион представляет собой ион щелочного металла или аммония. Например, \(\ce{CaCO3}\) и \(\ce{Fe2O3}\) нерастворимы.
- В случае противоречия между двумя рекомендациями приоритет имеет указанная первой рекомендация.
 Например, \(\ce{CaCO3}\) нерастворим (правило №6), но \(\ce{Na2CO3}\) растворим (правило №1 имеет приоритет над правилом №6).
Например, \(\ce{CaCO3}\) нерастворим (правило №6), но \(\ce{Na2CO3}\) растворим (правило №1 имеет приоритет над правилом №6).
Реакции осаждения
Реакции осаждения представляют собой класс химических реакций, в которых смешиваются два раствора и выделяется твердый продукт, называемый осадком. Реакцию осаждения, происходящую при смешивании растворов ионных соединений в воде, можно предсказать, как показано на рисунке \(\PageIndex{2}\). Первым шагом является составление списка растворимых ионных соединений, а затем перекрестное объединение катионов одного с анионом другого для получения потенциальных продуктов. Если какой-либо из потенциальных продуктов является нерастворимым ионным соединением, он выпадет в осадок. Например, когда раствор \(\ce{NaOH}\) смешивается с раствором \(\ce{MgCl2}\), \(\ce{Mg(OH)2}\) представляет собой перекрестную комбинацию, которая образует нерастворимое соединение. , он выпадет в осадок.
Рисунок \(\PageIndex{2}\): Перекрестное соединение катиона-аниона в реагентах.
 Если какая-либо из перекрестных комбинаций является нерастворимой солью, она выпадет в осадок, например: \).
Если какая-либо из перекрестных комбинаций является нерастворимой солью, она выпадет в осадок, например: \).
На рисунке \(\PageIndex{3}\) показаны осадки некоторых нерастворимых ионных соединений, образующиеся при смешивании водных растворов соответствующих растворимых ионных соединений.
Рисунок \(\PageIndex{3}\): Осадки некоторых нерастворимых ионных соединений, образующиеся при смешивании водного раствора соответствующих растворимых ионных соединений. Осадки слева: белый сульфат кальция (\(\ce{CaSO4}\)), черный гидроксид железа(II) (\(\ce{Fe(OH)2}\)), коричневый гидроксид железа(III) ( \(\ce{Fe(OH)3}\)), и синий гидроксид меди(II) (\(\ce{Cu(OH)2}\)). Обратите внимание, что осадок еще не оседает на дно раствора, в этих примерах он все еще находится в виде суспензии. Источник: https://youtu.be/jltLlzZ6FqU
Эта страница под названием 1.1: Solubility распространяется под лицензией Public Domain, автором, ремиксом и/или куратором которой является Мухаммад Ариф Малик.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Автор
- Мухаммад Малик
- Лицензия
- Общественное достояние
- Показать страницу TOC
- № на стр.
- Теги
ChemTeam: Закон Чарльза — задачи №1
ChemTeam: Закон Чарльза – Задачи №1 – 10Закон Чарльза
Задачи №1 – 10
| Задачи 11-25 | Список всех примеров и задач (без решений) |
| Десять примеров | Вернуться в меню законов ГМТ и газа |
Примечания:
Я использовал:
В 1 / Т 1 = В 2 / Т 2
, чтобы настроить решение для первых нескольких.
Иногда вы увидите символьное уравнение в форме перекрестного умножения:
В 1 Т 2 = В 2 Т 1
Ближе к концу я настроил несколько решений, используя различные перестановки формы перекрестного умножения.
Во всех приведенных ниже задачах давление и количество газа поддерживаются постоянными.
Задача №1: Рассчитайте снижение температуры (в градусах Цельсия) при сжатии 2,00 л при 21,0 °C до 1,00 л.
Решение:
(2,00 л) / 294,0 К) = (1,00 л) / (х)умножить на крест, чтобы получить:
2x = 293
х = 147,0 К
Преобразовывая 147,0 К в градусы Цельсия, мы находим -126,0 °С, при общем снижении на 147,0 °С, с 21,0 °С до -126,0 °С.
Задача №2: 600,0 мл воздуха имеет температуру 20,0 °C. Каков объем при 60,0 °С?
Решение:
(600,0 мл) / (293,0) = (х) / (333,0 К)х = 682 мл
Задача №3: Газ занимает 900,0 мл при температуре 27,0 °C. Каков объем при 132,0 °С?
Каков объем при 132,0 °С?
Решение:
(900,0 мл) / (300,0 К) = (х) / (405,0 К)х = 1215 мл
Задача №4: Как изменится объем, если 60,0 мл газа охладить с 33,0 °C до 5,00 °C?
Решение:
(60,0 мл) / (306,0 К) = (х) / (278,00 К)Перемножить, чтобы получить:
306х = 16680
x = 54,5 мл Объем уменьшается на 5,5 мл.
Задача №5: Дано 300,0 мл газа при 17,0 °C. Каков его объем при 10,0 °С?
Решение:
В перемноженном виде это:В 1 Т 2 = В 2 Т 1
В 2 = (В 1 Т 2 2 2 1 2 2)
х = [(300,0 мл) (283,0 К)] / 290,0 К
Задача №6: Газ занимает 1,00 л при стандартной температуре. Каков объем при 333,0 °С?
Решение:
В перемноженном виде это:V 1 T 2 = V 2 T 1
V 2 = (V 1 ) [T 2 2111221 1 ) [T 2 1 / T 1 ) [T 2 1 / T 1 ) 606,0 К) / (273,0 К)]
х = 2,22 л
Задача № 7: При 27,00 °C газ имеет объем 6,00 л. Какой объем будет при 150,0 °C?
Какой объем будет при 150,0 °C?
Решение:
Два разных набора:
(6,00 л) / (300,0 К) = (х) / (423,0 К)или
(6,00 л) (423,0 К) = (х) (300,0 К)
Тот же ответ:
х = 8,46 л
Задача №8: При температуре 225,0 °C газ имеет объем 400,0 мл. Каков объем этого газа при 127,0 °С?
Решение:
Из №6:
В 2 = (В 1 ) [Т 2 / Т 1 ]х = (400,0 мл) [(400,0 К) / (498,0 К)
х = 321 мл
Вот “традиционный” способ:
(400,0 мл) / (498,0 К) = (х) / (400,0 К)
Задача №9: При температуре 210,0 °C газ имеет объем 8,00 л. Каков объем этого газа при -23,0 °C?
Решение:
(8,00 л) / (483,0 К) = (х) / (250,0 К)Обратите внимание, что у вас может быть отрицательная температура по Цельсию, но не отрицательная температура по Кельвину.
Задача №10: При изменении объема газа с ___ мл до 852 мл температура изменится с 315 °C до 452 °C. Какой стартовый объем?
Решение:
Напишите Закон Чарльза и подставьте значения в:
V 1 / T 1 = V 2 / T 2x / 588 K = 852 мл / 725 K
(х) (725 К) = (852 мл) (588 К)
х = 691 мл
Обратите внимание на большие значения °C, чтобы вы забыли добавить 273. Помните, что в расчетах допускается только температура Кельвина.
Бонусная задача: Открытый «пустой» пластиковый контейнер объемом 2 л, фактический внутренний объем которого составляет 2,05 л, достают из холодильника при температуре 5 °C и дают ему нагреться до 21 °C. Какой объем воздуха, измеренный при температуре 21 °С, выйдет из сосуда при его нагревании?
Решение:
2,05 л / 278 К = В 2 / 294 КРассчитать В 2 .



 Например, \(\ce{CaCO3}\) нерастворим (правило №6), но \(\ce{Na2CO3}\) растворим (правило №1 имеет приоритет над правилом №6).
Например, \(\ce{CaCO3}\) нерастворим (правило №6), но \(\ce{Na2CO3}\) растворим (правило №1 имеет приоритет над правилом №6).