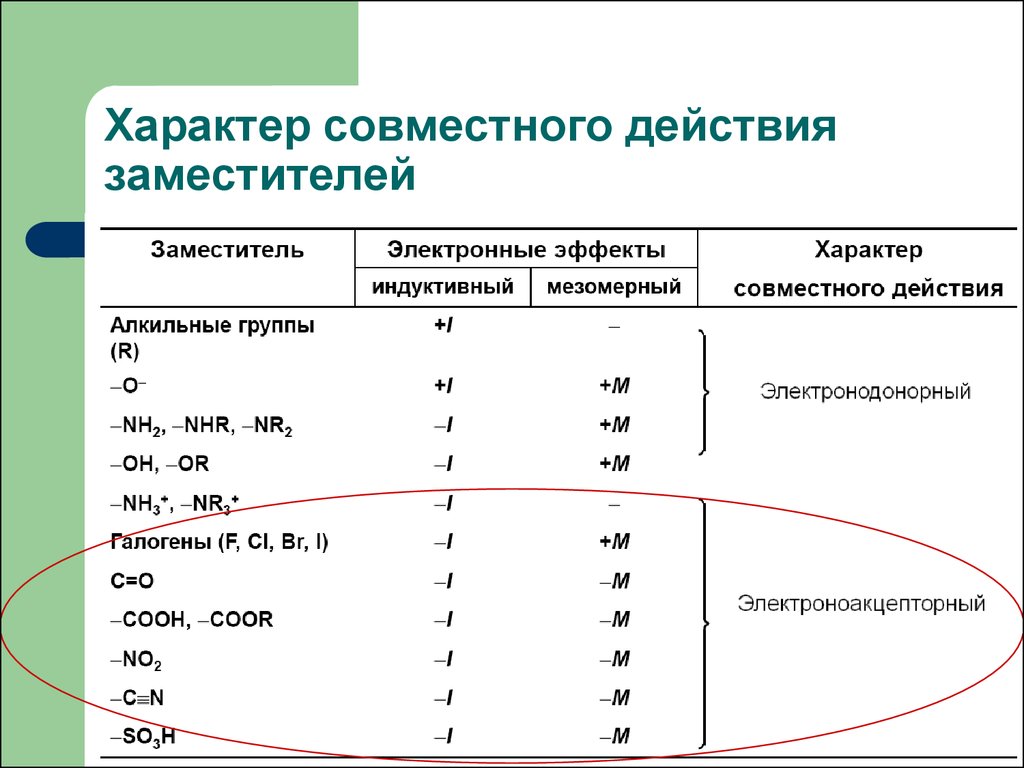
5.1.1. Индуктивный эффект.
10
ЛЕКЦИЯ 5
Схема лекции.
5.1. Электронные эффекты в органической химии.
5.1.1. Индуктивный эффект.
5.1.2. Эффекты сопряжения.
5.1.3. Резонанс.
5.2. Теория кислот и оснований в органической химии.
5.2.1. Кислоты Бренстеда.
5.2.2. Основания Бренстеда.
5.2.3. Кислоты и основания Льюиса.
5.1. ЭЛЕКТРОННЫЕ ЭФФЕКТЫ В ОРГАНИЧЕСКОЙ ХИМИИ.
Химические свойства
органических веществ различных рядов
и классов определяются особенностями
распределения электронной плотности
в молекулах этих веществ, что в свою
очередь определяется строением молекул
и наличием функциональных групп. Строение
функциональных групп и природа атомов,
входящих в их состав находят свое
отражение в так называемых электронных
эффектах.
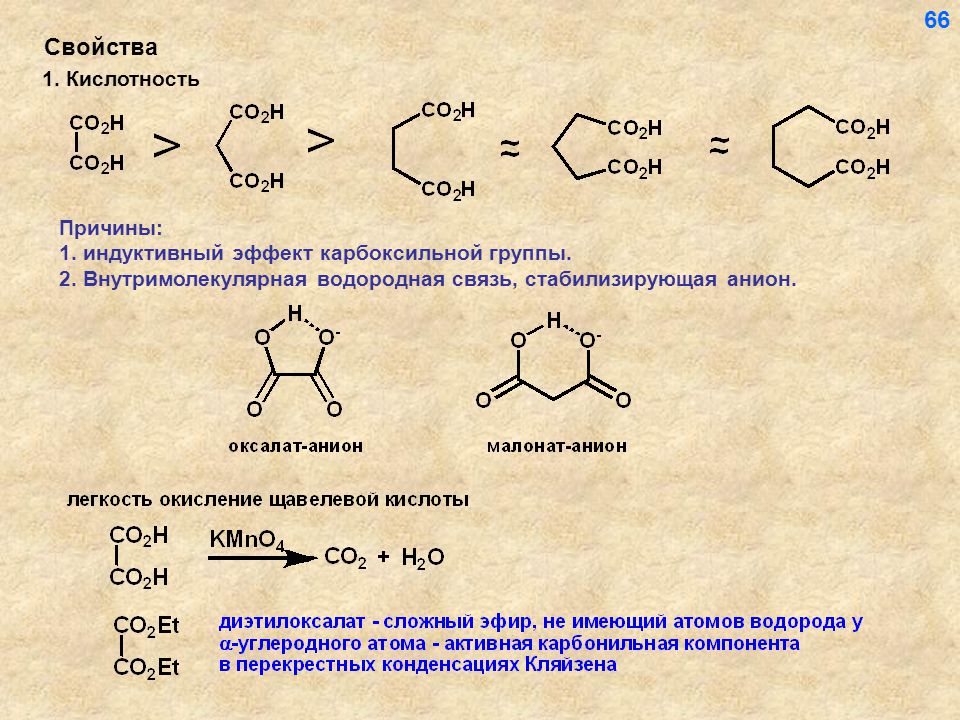
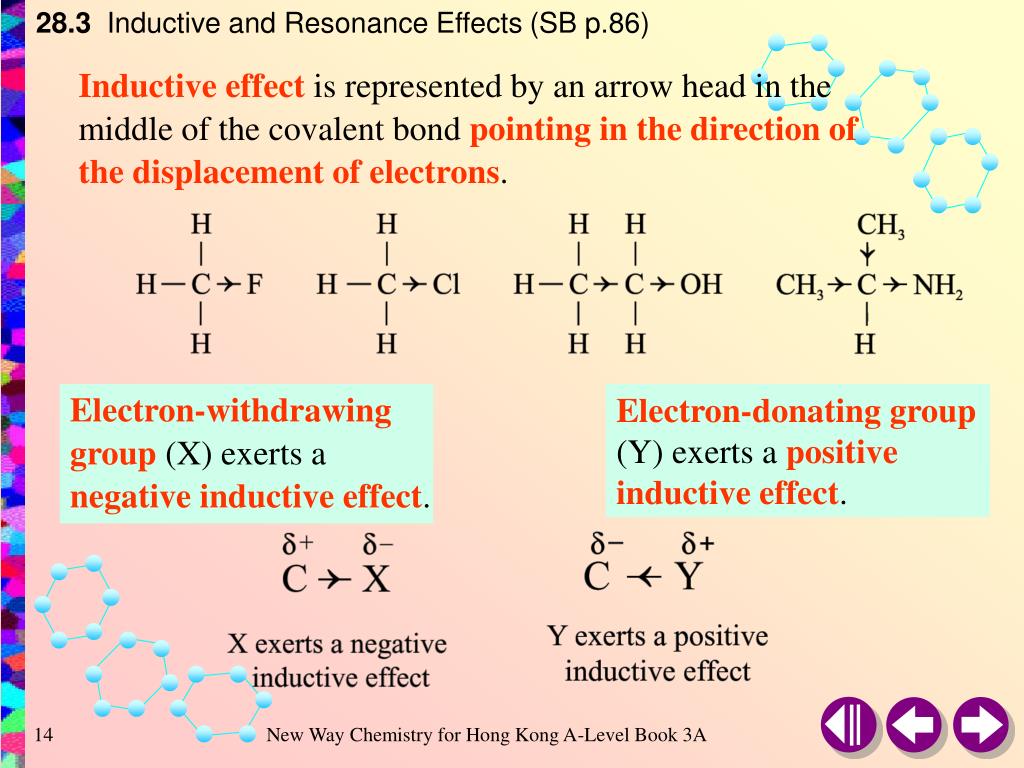
Среди свойств ковалентной связи отмечалось свойство полярности, что выражается в смещении пары электронов, образующих связь в строну более электроотрицательного атома. Мерой полярности ковалентной связи является дипольный момент. Дипольный момент связи оказывает воздействие на соседнюю связь. Эта связь в свою очередь оказывает воздействие на соседнюю связь и т.д. В итоге происходит смещение электронных облаков химических связей вдоль линии σ-связей, вызванное различием в значениях электроотрицательности атомов. Это явление смещения получило название индуктивного эффекта.
Определение: Индуктивным
эффектом называется смещение электронной
плотности σ-связей вдоль линии связи,
вызванное различием в значениях
электроотрицательности атомов.
Индуктивный
эффект имеет электростатическую природу.
Он передается по линии связи и ведет к
появлению дробных электрических зарядов
на атомах. Заряды обозначаются символами
δ+ и δ–.
Степень смещения
электронной плотности зависит от
разности электроотрицательности
соответствующих атомов. Знак индуктивного
эффекта определяется относительно
атома или группы атомов, принятого за
эталон. В качественных оценках его часто
определяют относительно атома водорода.
При количественном рассмотрении за
стандарт принята группа СН
Индуктивный эффект передается по цепи σ-связей с затуханием. Наиболее подвержен действию индуктивного эффекта α-углеродный атом.
Заместители,
притягивающие электроны, характеризуют
отрицательным индуктивным эффектом.
Их называют электроноакцепторными
заместителями.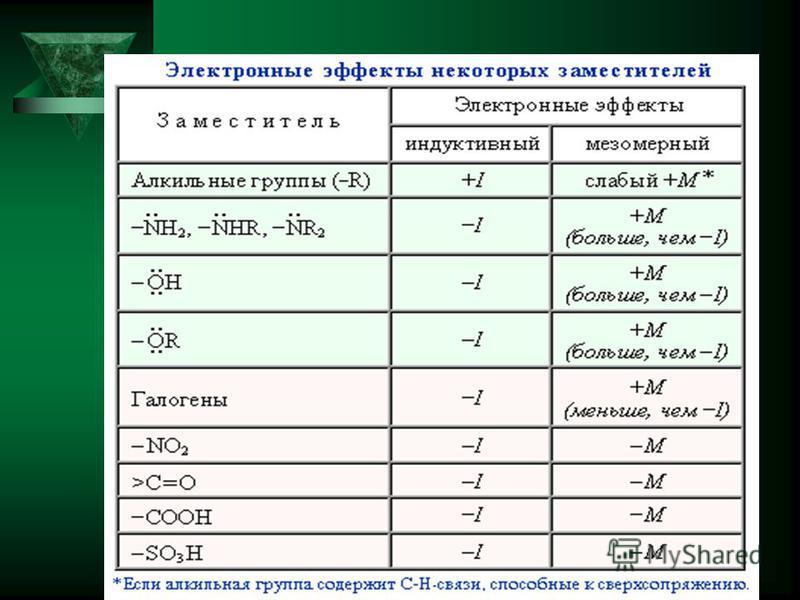
Заместители, отталкивающие электроны от себя проявляют положительный индуктивный эффект (+I-эффект). Такие заместители называются электронодонорными. Положительный индуктивный эффект также определяется относительно метильной группы. Положительным индуктивным эффектом обладают атомы металлов, а также разветвленные алкильные группы:
Заместители,
в которых находится атом углерода в
состояниях sp2-гибридизации
и sp-гибридизации являются электроакцепторами
по сравнению с атомом углерода в состоянии
sp3-гибридизации
и, соответственно, обладают отрицательным
индуктивным эффектом.
Атомы с целым отрицательным зарядом обладают положительным индуктивным эффектом:
Атомы с целым положительным зарядом обладают отрицательным индуктивным эффектом.
Осуществление влияния природы атомов на распределение электронной плотности в молекуле возможно как по системе σ-связей посредством индуктивного эффекта, так и по системе π-связей. Способность π-электронов к смещению особенно ярко выражена в соединениях, в которых существует система чередующихся кратных и простых связей:
Такие соединения построены только из атомов в состоянии sp2-гибридизации. А сами такие системы называются сопряженными. Физической основой сопряжения является взаимодействие (перекрывание) р-орбиталей соседних двойных связей:
Сопряженная
система представляет собой сплошную
π-связь только электронная плотность
концентрированна в большей степени на
двойной связи и в меньшей степени на
простой связи. Т.е. в случае сопряженной
системы отсутствуют разрывы в цепочке
связей как в случае σ-остова. Соответственно
в случае появления в сопряженной системе
атома, электроотрицательность которого
отличается от электроотрицательности
атома углерода в состоянии sp2-гибридизации,
то в зависимости от того донором или
акцептором является функциональная
группа – произойдет смещение электронной
плотности по всей цепи сопряжения.
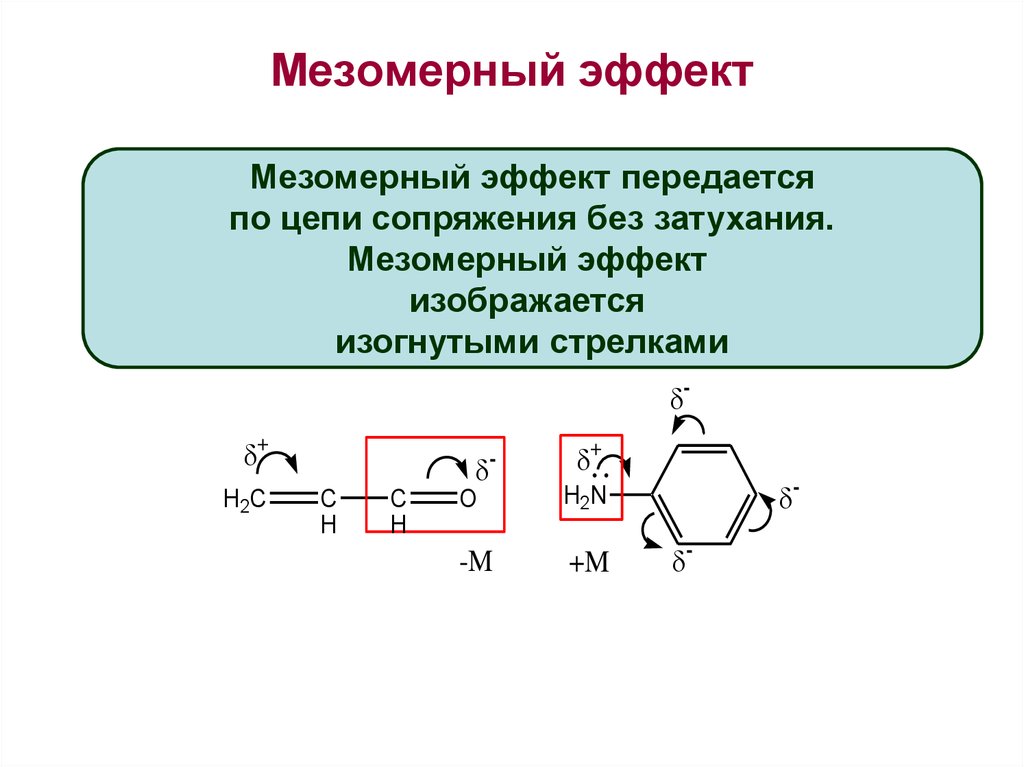
Эффект смещения электронной плотности
по цепи сопряжения называется мезомерным
эффектом (обозначается буквой «М»). В
зависимости от направления смещения
электронной плотности от заместителя
или к нему различают положительный
мезомерный эффект (+М) и отрицательный
мезомерный эффект (-М). Графически
мезомерные эффекты обозначается
изогнутой стрелкой Часто термин
«мезомерный эффект» заменяют термином
«эффект сопряжения». Но сопряжение
обозначает перекрывание орбиталей
соседних связей, а мезомерия обозначает
передачу влияния по цепи сопряженных
связей:
Т.е. в случае сопряженной
системы отсутствуют разрывы в цепочке
связей как в случае σ-остова. Соответственно
в случае появления в сопряженной системе
атома, электроотрицательность которого
отличается от электроотрицательности
атома углерода в состоянии sp2-гибридизации,
то в зависимости от того донором или
акцептором является функциональная
группа – произойдет смещение электронной
плотности по всей цепи сопряжения.
Эффект смещения электронной плотности
по цепи сопряжения называется мезомерным
эффектом (обозначается буквой «М»). В
зависимости от направления смещения
электронной плотности от заместителя
или к нему различают положительный
мезомерный эффект (+М) и отрицательный
мезомерный эффект (-М). Графически
мезомерные эффекты обозначается
изогнутой стрелкой Часто термин
«мезомерный эффект» заменяют термином
«эффект сопряжения». Но сопряжение
обозначает перекрывание орбиталей
соседних связей, а мезомерия обозначает
передачу влияния по цепи сопряженных
связей:
Комбинация
изогнутых стрелок по структурной формуле
отражает перераспределение электронной
плотности в цепи сопряжения.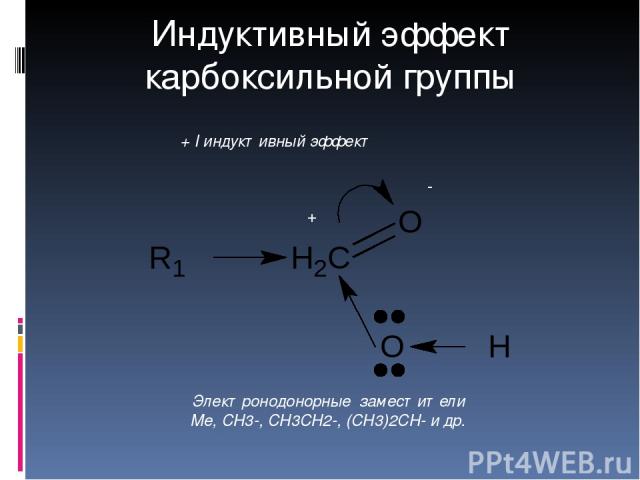
Такие формулы называют мезомерными формулами. Делокализация оказывает большое влияние на свойства сопряженных молекул. Чем выше степень делокализации тем выше термодинамическая стабильность сопряженной системы. Обратите внимание на порядок в своих комнатах. Чаще бывает беспорядок. Т.е. беспорядок более устойчивое состояние. Делокализация – то беспорядок в распределении электронов. Частным случаем делокализации является сверхсопряжение, которое способствует стабилизации неспаренных электронов алкильных радикалов.
Эффекты сопряжения характерны для соединений с кратными связями (двойные, тройные) независимо от природы атомов, соединенных кратными связями, а также для функциональных групп в состав которых входят гетероатомы с неподеленными электронными парами.
Полярные электронные эффекты в органических соединениях
Похожие презентации:
Сложные эфиры. Жиры
Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
ПОЛЯРНЫЕ ЭЛЕКТРОННЫЕ ЭФФЕКТЫ В
ОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ
Одно из положений теории химического строения
указывает на то, что атомы или группы атомов
взаимно влияют друг на друга, от чего зависит
реакционная способность в целом. Это влияние
осуществляется при помощи электронных эффектов.
Различают 2 вида полярных эффектов:
– индуктивный (I-эффект)
-мезомерный (M-эффект)
ПОЛЯРНЫЕ ЭЛЕКТРОННЫЕ ЭФФЕКТЫ В СОЕДИНЕНИЯХ
(I-эффект)
«Тот эффект, который оказывает атом или
группа атомов на электронную плотность у
соседнего центра и который обусловлен
электроотрицательностью атома, называется индуктивным эффектом».
 Он действует
Он действуетчерез σ-связи.
Возникновение этого эффекта связано с тем
обстоятельством, что распределение электронной плотности ковалентной связи между разными атомами почти
никогда не бывает равномерным (симметричным).
Обычно электронная плотность смещена к более
электроотрицательному атому.
ПОЛЯРНЫЕ ЭЛЕКТРОННЫЕ ЭФФЕКТЫ В
σ-связь
А
В
Ось связи
Индуктивный эффект можно определить и так.
«I-эффект – это смещение электронной плотности по
σ-связи». Обычно точкой отсчёта служит С─Н связь.
Она практически не полярна (I=0)
Примеры индуктивного эффекта:
С
δ+
С
δ
X
δ–
X
δ+
δ+
– I- эффект
С
+ I- эффект
Сδ–
δ+
Cl
δ–
Na
ПОЛЯРНЫЕ ЭЛЕКТРОННЫЕ ЭФФЕКТЫ В
ОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ
В целом можно предложить 2 ряда заместителей в
зависимости от природы их индукционного эффекта:
− I-эффект:
-–N+(CН3)3 > NO2 > –C ≡ N > CO > COOR >
> F > Cl > Br > I > OH > Nh3
+ I-эффект:
-СН3 < -СН2СН3 < -СН(СН3)2 < -С(СН3)3
ПОЛЯРНЫЕ ЭЛЕКТРОННЫЕ ЭФФЕКТЫ В
ОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ
Существует
ряд
правил
для
определения
направления величины индуктивного эффекта:
Чем больше I-эффект, тем
+
+
заместителя –N (CН3)3, –O R2
больше
заряд
Отрицательный индуктивный эффект тем больше,
чем выше электроотрицательность, входящего в
состав заместителя гетероатома:
NR2 < OR < F ; F > Cl > Br > I; –CR
NR < CR=O
ПОЛЯРНЫЕ ЭЛЕКТРОННЫЕ ЭФФЕКТЫ В
ОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ
Отрицательный индуктивный эффект тем больше,
чем больше ненасыщенность заместителей:
СН= СН2 < СН = СН – СН = СН2 < С6H5< C ≡ CH <
< –C ≡ CR < –C ≡ N < SO3R < NO2
Положительный
индуктивный
эффект
тем
больше, чем меньше электроотрицательность
заместителя:
Na > Mg > Al > Si
ПОЛЯРНЫЕ ЭЛЕКТРОННЫЕ ЭФФЕКТЫ В
ОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ
Мезомерный эффект.
 Если индуктивный эффект
Если индуктивный эффектдействует
через
σ-связи
(в
насыщенных
соединениях), то мезомерный эффект проявляется
в ненасыщенных соединениях, т.е. в молекулах,
содержащих
π-связь.
Электроны
π-связи
обладают
большей
подвижностью,
по
сравнению с электронами σ-связи, поэтому они
легче смещаются под влиянием внешнего
воздействия и передаются на большие
расстояния. Особенность его величины выражена
в
сопряженных
системах
(системы
с
чередующимися
двойными
и
одинарными
связями).
ПОЛЯРНЫЕ ЭЛЕКТРОННЫЕ ЭФФЕКТЫ В
ОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ
Поскольку М-эффект действует через π-связи,
а также через неподелённые электронные пары),
то ему можно дать такое определение: «Мэффект – это эффект, заключающийся в
смещении π-электронов или неподелёных
электронных пар». Направление мезомерного
эффекта может совпадать, может не совпадать с
направлением индуктивного эффекта.
Для обозначения электронной плотности в
молекуле, содержащую π-связь чаще приходится
записывать не одну, а несколько граничных
(канонических) структур, которые показывают
возможное
предельное
распределение
электронной плотности в частице, но которые
могут на самом деле не реализовываться.
ПОЛЯРНЫЕ ЭЛЕКТРОННЫЕ ЭФФЕКТЫ В
ОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ
М-эффект
Граничные структуры таким образом могут быть
нарисованы, но в действительности они не
существуют.
Истинная
(реальная)
молекула
(частица) представляет собой резонансный гибрид
граничных структур.
Например, распределение электронной плотности в
карбонильной группе (СО-группе) можно представить
двумя граничными структурами:
C=O
.. –
С – .O. :
+
C
δ+
O
δ-
ПОЛЯРНЫЕ ЭЛЕКТРОННЫЕ ЭФФЕКТЫ В
ОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ
М-эффект
Другой пример ─ распределение электронной
плотности в сопряженной системе:
..–
O
Oδ–
:O:
+
δ+
C
C C
C=C C
C C=C
резонансный гибрид
ПОЛЯРНЫЕ ЭЛЕКТРОННЫЕ ЭФФЕКТЫ В
ОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ
Для определения величины и знака мезомерного
эффекта существует ряд правил:
1.
 Величина М-эффекта растет с увеличением
Величина М-эффекта растет с увеличениемзаряда заместителя. Ионы проявляют поэтому очень
сильный М-эффект:
(+М )
O
•
;
•
СН=NR2 ;
•
(–М )
•• −
•• −
S
•
2. – М эффект заместителей будет тем сильнее,
чем больше Э.О. имеющихся в заместителе
гетероатомов:
–СR=CR2 < -CR=NR < CR=O;
-C ≡ N < SO3R < NO2
ПОЛЯРНЫЕ ЭЛЕКТРОННЫЕ ЭФФЕКТЫ В
ОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ
3. + M-эффект будет тем больше, чем меньше э.о.
соответствующего гетероэлемента:
•
NR2 > OR
>
•
•
F
•
•
•
исключением являются галогены:
F > Cl > Br > I.
Для –М эффекта:
NO2 > – C ≡ N > CO > COOH > F > Cl > Br> I
ПОЛЯРНЫЕ ЭЛЕКТРОННЫЕ ЭФФЕКТЫ В ОРГАНИЧЕСКИХ
СОЕДИНЕНИЯХ
М-эффект
Мезомерный эффект играет очень важную роль в
реакционной способности частиц. Наличие протяжённого
М-эффекта может приводить к повышению устойчивости
промежуточной реакционноспособной частицы (карбoкатионов, карбанионов, радикалов).
Пример:
+
– пропильный карбкатион
1) Ch4–Ch3–Ch3
+
– аллильный карбкатион
2) Ch3=CH–CH
Какой карбкатион устойчивее?
ПОЛЯРНЫЕ ЭЛЕКТРОННЫЕ ЭФФЕКТЫ В
ОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ
Ответ на пример:
У аллильного карбкатиона стабильность больше, так
как его заряд рассредоточен между атомами
углерода. У пропильного катиона такой возможности
нет:
+
+
Ch3=CH–Ch3
Ch3–CH=Ch3
аллильный карбкатион
дольше существует, больше возможности вступить в реакцию
ПОЛЯРНЫЕ ЭЛЕКТРОННЫЕ ЭФФЕКТЫ
Один из физических законов гласит, что
устойчивость
заряженной
частицы
повышается при рассредоточении заряда.
..
..–
+
C=O
C
O:
..
..
Чтобы разделить заряды нужно
сообщить энергию.
КОНЦЕПЦИЯ РЕЗОНАНСА
Рассмотренные выше представления о распределении
электронной плотности в молекуле с π -связями составляют
основу теории Резонанса. Коротко суть теории Резонанса
заключается в следующих положениях:
1) Если молекула может быть представлена 2-мя или более
граничными структурами, отличающимися лишь распределением электронов (ядра остаются на месте), то возможен
резонанс (реальная молекула в этом случае представима в
виде гибрида нескольких граничных структур).

2) Резонанс будет тем существенней, чем ближе по энергии
участвующие в резонансе граничные структуры. Вклад
граничной структуры в резонансный гибрид зависит от её
устойчивости:
3) Резонансный гибрид стабильнее чем любая из
участвующих в резонансе структур. Такое увеличение
устойчмвости называют энергией резонанса. Чем ближе по
устойчивости резонирующие структуры тем больше энергия
резонанса.
КОНЦЕПЦИЯ РЕЗОНАНСА
Критерии устойчивости граничных
(канонических) структур:
• Наличие в молекуле
неспареных электронов
минимального
числа
• Локализация заряда (более устойчивой является
структура, в которой «+» заряд локализован на
менее электроотрицательном атоме, а «-» заряд на
более электроотрицательном атоме)
Критерии устойчивости граничных
(канонических) структур:
• Степень разделения заряда (структура с
разделёнными зарядами менее устойчива, чем
структура с неразделёнными зарядами)
..
C=O
.
 .
.+
C
…O.
Вклад первой структуры больше, чем вклад второй
структуры в резонансный гибрид
• Полнота или неполнота заполнения октета
(структура, в которой все атомы имеют октетную
электронную
оболочку,
более
устойчива
по
сравнению с структурой, в которой правило октета не
выполняется)
ПОЛЯРНЫЕ ЭЛЕКТРОННЫЕ ЭФФЕКТЫ В
ОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ
Пример
1. Написать все возможные граничные структуры,
находящиеся в резонансном состоянии
2. Изобразить структуру гибридного резонанса в
соединении
СН =СН-N(СН )
Ch3 = CH
..
N
2
3 2
CН3
. .Ch3
CН3
..
Ch3
δ–
δ+
CH
CН3
N
CН3
CH
+ CН3
N
CН3
ПОЛЯРНЫЕ ЭЛЕКТРОННЫЕ ЭФФЕКТЫ В
ОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ
Теория резонанса
Под термином “РЕЗОНАНС” следует понимать
способ
изображения
молекулы,
который
применяется в том случае, когда для адекватного
(точного) описания данного соединения не может
быть использовано единственное электронное
распределение.

В
теории
резонанса
реальную
молекулу
представляют как гибрид структур, которые могут
быть
нарисованы,
но
сами
по
себе
в
действительности не существуют.
Эти
гипотетические
структуры
называют
резонансными (каноническими,
граничными)
структурами.
ПОЛЯРНЫЕ ЭЛЕКТРОННЫЕ ЭФФЕКТЫ В
ОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ
Например: аллил-катион можно представить двумя
резонансными структурами:
1
2
3
+
h3C = CH – Ch3
1
2
3
+
h3C – CH = Ch3
Положительный заряд делокализован
(«размазан»):
+
Н2С
СН
СН2
ПОЛЯРНЫЕ ЭЛЕКТРОННЫЕ ЭФФЕКТЫ В
ОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ
Положения теории резонанса
1) Если молекула может быть представлена двумя или
более
структурами,
отличающимся
только
распределением электронов, т.е. структурами, в
которых расположение атомных ядер одинаково, то
становится возможным резонанс. Реальная молекула
представляет собой гибрид этих структур и не может
быть удовлетворительно представлена ни одной из них.
2) Хотя каждая из структур вносит свой вклад в
гибрид наилучшее приближение к гибриду дают
структуры с наименьшей энергией: чем устойчивее
структура (с меньшей энергией), тем значительнее её
вклад.
ПОЛОЖЕНИЯ ТЕОРИИ РЕЗОНАНСА
(продолжение)
Из этих положений следует:
2.1. Все структуры, вклады которых существенны,
должны располагать одинаковым (наименьшим)
числом неспаренных электронов
I
II
III- вклад
несущественен
ПОЛОЖЕНИЯ ТЕОРИИ РЕЗОНАНСА
(продолжение)
2.2. Локализация заряда: из двух структур с
разделёнными зарядами более устойчивой будет та
структура, у которой ” ” заряд будет расположен на
более э.о. атоме:
– +
С–О
+ –
С–О
более устойчива
2.3. Чем больше степень разделения зарядов в
граничной структуре, тем меньше значение этой
структуры для описания резонансного гибрида:
+ . .–
h3C = Ch3
h3C – Ch3
более устойчива
ПОЛОЖЕНИЯ ТЕОРИИ РЕЗОНАНСА
(продолжение)
2.
 4. Соблюдение правила октета (полнота
4. Соблюдение правила октета (полнотанеполнота заполнения октета):
+
. –.
h3C – C = CI :
h3C = C – CI
..
H
H
(I)
(II)
или
Несмотря на то, что в структуре II «+” заряд расположен
на более э.о. атоме, вклад этой структуры будет более
существенным, так как соблюдается правило октета: в
валентной оболочке атома Cl находится четыре пары
электронов ( две неподелённые и две связывающие).
Иногда реальный гибрид изображают наиболее
устойчивой структурой.
ПОЛОЖЕНИЯ ТЕОРИИ РЕЗОНАНСА
(продолжение)
ПОЛОЖЕНИЕ 3.
Резонансный гибрид стабильнее чем любая из
участвующих в резонансе структур. Такое
увеличение устойчивости называют энергией
резонанса.
Чем
ближе
по
устойчивости
резонирующие структуры тем больше энергия
резонанса.
ПОЛЯРНЫЕ ЭЛЕКТРОННЫЕ ЭФФЕКТЫ В
ОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ
РЕЗОНАНС
1.
(задания)
:О: – :О:
..
Н3С – С – СН – С – СН3
2.
Н2С = СН – СН2
+
3.
 Н2С = СН – СН – СН = СН – СН3
Н2С = СН – СН – СН = СН – СН3+
4. Н2С = СН – СН – СН = СН – Br
..
: CI :
5.
Н3С – С = СН2
English Русский Правила
Что такое индуктивный эффект в химии? С примерами
Предварительное чтение: Что такое электроотрицательность?
Углерод и водород не имеют значительной разницы в электроотрицательности (< 0,5) и могут образовывать длинные цепи нейтральных углеводородных соединений, таких как бутан, пентан, гексан, гептан, октан и т. д.
Но предположим, что на одном конце углерода -углеродная цепь, в которой находится атом или группа атомов, способные притягивать электроны связи к себе или отталкивать электроны связи от себя, и в меньшей степени передавать эффект соседним атомам углерода через ковалентные связи. В этом случае такой эффект называется индуктивным эффектом.
Как возникает индуктивный эффект Высшие электроотрицательные гетероатомы (N, O, S, галогены и т. д.) в углеводородной цепи вносят различие в полярности между углеродом и гетероатомом. Эта поляризация дополнительно вызывает поляризацию соседних атомов углерода, и ее влияние ослабевает с расстоянием. Эффект пренебрежимо мал после четвертого атома углерода в более длинной цепи.
д.) в углеводородной цепи вносят различие в полярности между углеродом и гетероатомом. Эта поляризация дополнительно вызывает поляризацию соседних атомов углерода, и ее влияние ослабевает с расстоянием. Эффект пренебрежимо мал после четвертого атома углерода в более длинной цепи.
Например, структура н-бутана (состоит из четырех атомов углерода) C 4 H 3 -C 3 H 2 -C 2 H 2 -C 1 H 3 663 1 H 3 , IT IA ONERILING OT THE ONERILILILIN C 1 заменяется на электрон -паутинг, Nitro (-no 2 ), структура C 4 H 3 -C 3 H 2 -C 3 H 2 -C 3 H 2 -C 3 H 2 -C 3 H 2 -C 3 H 2 -C С 2 Н 2 -С 1 H 2 -NO 2 .
Замена H более электроотрицательной нитрогруппой (-NO 2 ) притягивает электроны связи C-NO 2 к NO 2 , создавая поляризацию связи C-NO 2 . Так как более значительная электронная плотность приходится на NO 2 , он приобретает частичный отрицательный заряд (δ-), а Углерод из-за потери электронной плотности получает частичный положительный заряд (δ+).
С 4 H 3 -C 3 H 2 -C 2 H 2 – δ+ C 1 H 2 – δ- НЕТ 2
Потеря электронной плотности C 1 приводит к уменьшению электронной плотности C 2 , поэтому C 3 900 электрон теперь дефицитен. Это смещение электронов C 2 -C 1 Связь с C 1 , а поляризация C 2 показана еще одним Δ+ зарядом в Δ+ Δ+ 2922 2922 2922 2922 2 2922 2922 2 2922 2 9002 2 2 Δ+ 9003 2922 2922 2 9002 2 2 Δ+ 9003 9003 2922 2 2 Δ+ 9003 9002 2 9002 2 Δ+ 2922 2 2 . .
.
C 4 H 3 -C 3 H 2 – δ+ δ+ C 2 H 2 – δ+ C 1 Н 2 – Δ – NO 2
Потягивание электронов связи из C 2 делает его слегка электрооделенным и частично поляризованным, вызывая C 2 , чтобы выделить, еще немного DOTED DIVESTIONE DOVENTIONE ELLICHONSE DOVENTIPRAVE. С 3 . C 3 , в свою очередь, будет тянуться от C 4 , а поляризация связи показана как
δ+ δ+ δ+ δ+ C 4 H 3 – δ+ δ+ δ+ C 3 H 2 – δ+ δ+ C 2 H 2 – δ+ C 1 H 2 – Δ NO 2
Эффект индуцированной полярности неуклонно ослабляется с увеличением расстояния от растущего расстояния от возраста и становится пренебрежимым и становится пренебрежимым и не становится пренебрежимым и становится пренебрежимым.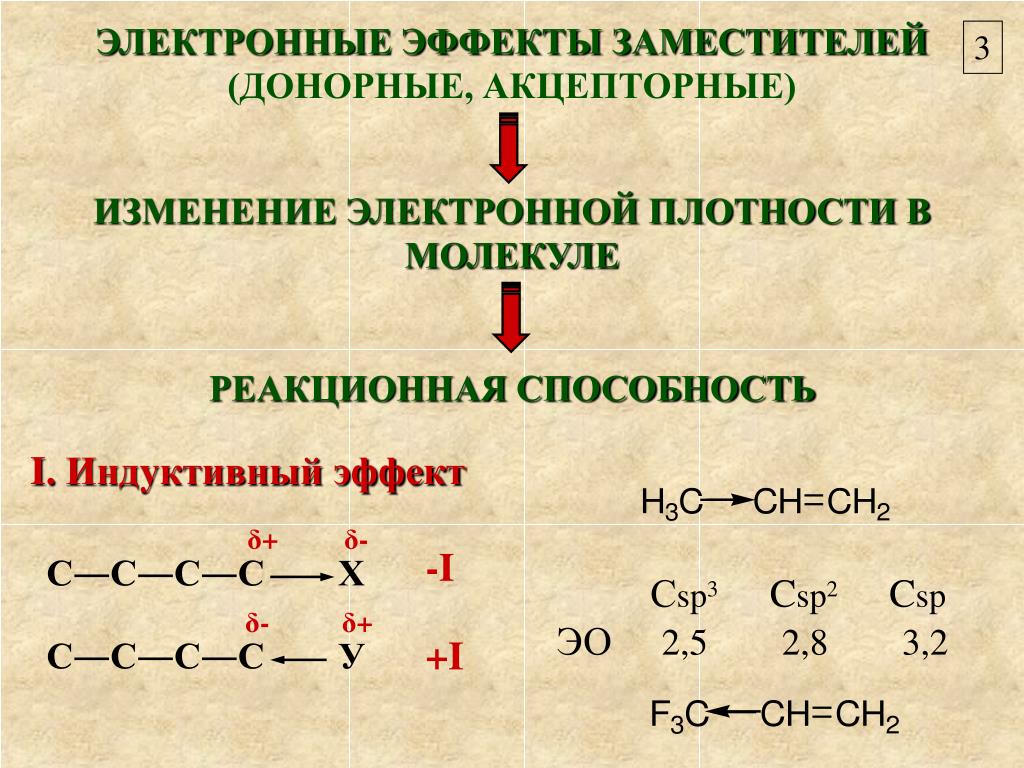 четыре атома углерода. В вышеприведенном примере удар ощущается незначительно или незначителен для C 4 .
четыре атома углерода. В вышеприведенном примере удар ощущается незначительно или незначителен для C 4 .
Короче говоря, соседние атомы углерода приобрели индуцированную электроотрицательность из-за электроотрицательного атома, и поляризация передавалась через одинарные ковалентные связи, пока эффект не уменьшался с расстоянием.
Индуктивный эффект зависит от электроноакцепторной/донорной природы присутствующих атомов и поэтому присущ молекуле. Это постоянный эффект и не требует присутствия каких-либо реагентов или химической среды.
Типы индуктивного эффектаИндуктивный эффект бывает двух типов:
1) Отрицательный индуктивный (-I) эффект притяжения электронов: Если атом или группа атомов притягивает электроны связи, то такой эффект называется отрицательным индуктивным эффектом, записывается как -I эффект. Например, в CH 3 -CH 2 -CH 2 -Cl электроотрицательный хлор забирает электронную плотность у углерод-углеродных связей.
Эффект «притяжения» электроноакцепторной группы (эффект -I) подобен игре в перетягивание каната. Электроноакцепторная группа дергает электроны связи веревки. Притяжение сильно ощущается соседними атомами и в меньшей степени дальними атомами, пока электроны центральной связи не переместятся к электроноакцепторной группе.
Например, на изображении выше функциональная группа Fluoro притягивает к себе два электрона связи связи HF и, следовательно, проявляет эффект -I.
2) Положительный индуктивный (+I) эффект выталкивания электронов: Если атом группы атомов выталкивает электроны связи, то этот эффект называется положительным индуктивным эффектом и записывается как +I эффект.
Например, в толуоле (CH 3 -C 6 H 5 ), CH 3 менее электроотрицателен, чем Ar (в соответствии с порядком убывания электроотрицательности, таблица ниже). Следовательно, метильная группа (-CH 3 ) смещает электронную плотность к фенильному (-C 6 H 5 ) кольцу, где фенил действует как группа -I.
Выталкивающий эффект электронодонорной группы (эффект +I) подобен высвобождению энергии, наблюдаемому при землетрясениях, когда окружение вблизи эпицентра оказывает наибольшее влияние, чем периферийные области. Электронодонорные группы выталкивают электроны вдоль углеродной цепи, и их влияние наиболее слабо для удаленных атомов углерода.
Классификация функциональных групп на основе индуктивного эффектаВсе группы атомов классифицируются как электроноакцепторные (-I) или электронодонорные (+I) по отношению к водороду.
The most common +I and -I functional groups are:
+I group | -I group |
|---|---|
O – | ОН, ИЛИ, ОАр, Ар |
COO – | COOH, COOR |
CH 3 , CHR 2, CH 2 R, CR 3 | NO 2 , CN |
D | NH 2 , NH 3 + , NR 3 + |
| F, Cl, Br, Я, КФ 3 |
| SH, SR, SR 2 + , SO 2 R, SO 2 Ar |
| C_=CR, CH = CR 2 |
CHO, COR |
. 3 + > -NO 2 > -CN> -SO 3 H> -CHO> -CO-> -COOH> -COCl> -CONH 2 > -F> -Cl> -Br > -I> -OH> -OR> -NH 2 > -C 6 H 5 > -CH 3 > -H
3 + > -NO 2 > -CN> -SO 3 H> -CHO> -CO-> -COOH> -COCl> -CONH 2 > -F> -Cl> -Br > -I> -OH> -OR> -NH 2 > -C 6 H 5 > -CH 3 > -H
Эффект +I некоторых алкильных групп атомов в порядке убывания до водорода:
-COO – > R 3 C- > R 2 CH-, RCH 2 -> CH 3 -> D-> H-
Представление индуктивного эффекта (стрелка)
Стрелка в верхней части связи указывает направление притяжения или отталкивания электронов связи.
Стрелка, указывающая на электроноакцепторную группу, указывает на притяжение к ней.
Стрелка, направленная от электронодонорной группы, указывает на толчок электронов связи.
Связанные чтения: Является ли индуктивный эффект таким же, как электроотрицательность?
Типы индуктивных эффектов
Когда пара связей движется к более электроотрицательному атому, она поляризует сигма-связь.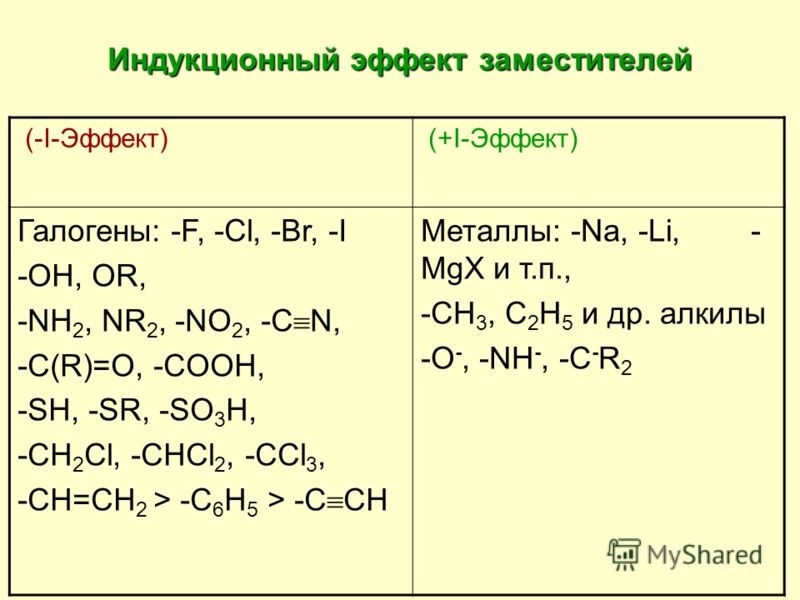 Поляризация возникает между двумя атомами с различной электроотрицательностью. Электроотрицательный атом получает только частичный отрицательный заряд, а другой атом получает частичный положительный заряд.
Поляризация возникает между двумя атомами с различной электроотрицательностью. Электроотрицательный атом получает только частичный отрицательный заряд, а другой атом получает частичный положительный заряд.
Наведенная полярность передается через сигма-связи молекулы, образуя постоянный диполь. Эта передача зарядов от одного атома к другому называется индуктивным эффектом. В этой статье обсуждается индуктивный эффект и его определение, примеры и порядок.
Что такое индуктивный эффект?
В ковалентной σ-связи между двумя атомами с различной электроотрицательностью более электроотрицательный атом притягивает связывающую пару, потому что он имеет гораздо большее сродство к электронам. Из-за этого притяжения более электроотрицательные атомы производят частичный отрицательный заряд (σ-), в то время как другие развивают частичный положительный заряд (σ+). Этот процесс приводит к неравному распределению связывающего электрона.
Ковалентная связь поляризуется, образуя постоянный диполь в связи. Индуктивный эффект относится к непрерывному состоянию поляризации связи. Символ индуктивного эффекта (–>–) со стрелкой. Стрелка всегда указывает на более электроотрицательный атом.
Индуктивный эффект относится к непрерывному состоянию поляризации связи. Символ индуктивного эффекта (–>–) со стрелкой. Стрелка всегда указывает на более электроотрицательный атом.
Индуктивный эффект передается от одного атома к другому в виде соединения с длинной цепью. Но эффект постепенно исчезает и становится несущественным. Например, предположим, что конец атома углерода соединен с электроотрицательным атомом галогена (электроноакцепторная группа). В таком случае положительный заряд передается по всей углеродной цепи. Этот индуктивный эффект виден на диаграмме.
Подобно индуктивному эффекту, когда электронодонорная группа или атом соединены с концевым атомом углерода углеродной цепи, отрицательный заряд передается по углеродной цепи, как показано на диаграмме.
Различные типы индуктивного эффекта
Эффект +I
Когда атом или группа отдает электроны для образования связи и получает частичный положительный заряд, они относятся к группе +I. Здесь эффект называется положительным индуктивным эффектом или эффектом +I. Попробуем разобраться в типах индуктивных эффектов.
Здесь эффект называется положительным индуктивным эффектом или эффектом +I. Попробуем разобраться в типах индуктивных эффектов.
Пример групп +I:
– O –, – COO –, –CR3, –CHR2, –Ch3R, –Ch4, –D
-I эффект
Группа -I образуется, когда атом или группа притягивает к себе связывающие электроны и накапливает частичный отрицательный заряд. Этот эффект также называют электроноакцепторным индуктивным эффектом или эффектом -I.
Пример группы -I:
–NO2, –SO2R, –CN, –SO2Ar, –COOH, –F, – Cl, – Br, – I, –OAr, –COOR, –OR, –COR, – SH, –SR, –OH, –Ar, – CH = CR2
Что такое порядок индуктивного эффекта?
Для индуктивных воздействий – I и + I можно определить следующие группы в порядке убывания силы:
Порядок индуктивного воздействия для групп +I
– O –> – COO –> –CR3> –CHR2 > –Ch3R > –Ch4 > –D
Порядок индуктивного воздействия для групп -I
-NR3+ > – SR2+ > -Nh4+ > –NO3 > – SO2R > –CN > –SO2Ar > –COOH > –F > – Cl > – Br > – I > –OAr > –COOR > –OR > –COR > –SH > –SR > –OH > –Ar > – CH = CR2
Каковы особенности индуктивного эффекта?
Индуктивный эффект возникает из-за различий в электроотрицательности, вызванных двумя атомами, которые образуют сигма (σ) связи.
Индуктивный эффект переносится на сигма-связи, отсутствует часть пи(π)-связей
Если отойти от групп, вызывающих это, амплитуда индуктивного эффекта также уменьшится
Индуктивный эффект длится в течение длительного времени, он также может образовывать постоянный диполь в молекуле
Этот эффект слабый и иногда подавляется другими электронными процессами, такими как резонанс, гиперсопряжение и т. д.
Индуктивные эффекты воздействуют на вещества как химически, так и физически
В чем польза индуктивного эффекта?
Индуктивный эффект влияет на некоторые важные свойства органических соединений. Некоторые из них могут включать:
Для определения кислотной силы алифатических карбоновых кислот
Оценка стабильности алкилкарбокатиона, карбанионов и свободных углеродных радикалов также зависит от индуктивных эффектов
Влияет на дипольный момент и длину связи
Индуктивный эффект влияет на силу органических оснований
углерод, стабильность карбокатионов повысится.
 Используя положительный индуктивный эффект, группы +I помогут уменьшить положительный заряд углерода, создав отрицательную плотность заряда. Благодаря этому карбокатион станет стабильным.
Используя положительный индуктивный эффект, группы +I помогут уменьшить положительный заряд углерода, создав отрицательную плотность заряда. Благодаря этому карбокатион станет стабильным.Группы -I также дестабилизируют карбокатион. Это увеличит положительный заряд за счет удаления электронной плотности. Вы можете видеть, что любой фактор, который способствует увеличению заряда иона, положительного или отрицательного, вызывает дестабилизацию. В то же время любой фактор, уменьшающий заряд, вызывает его стабилизацию.
Порядок устойчивости карбокатионов с алкилом, например, показан ниже:
Если карбокатион имеет две алкильные группы, он более стабилен, чем первичный карбокатион и третичный карбокатион с тремя алкильными группами. Если рассматривать все эти варианты, то наименее устойчивым является метилкарбокатион.
2. Стабильность свободных радикалов:
Стабильность свободных радикалов повысится из-за увеличения количества алкильных групп. Стабильность различных свободных радикалов показана в примере ниже:
Стабильность различных свободных радикалов показана в примере ниже:
2. Стабильность карбанионов:
Группы +I имеют более низкую устойчивость карбанионов, а группы -I способствуют ее повышению. Алкильные группы (+I), например, будут передавать электронную плотность отрицательно заряженному углероду, тем самым увеличивая нестабильность карбанионов. Благодаря этому карбанионы устойчивы в следующем порядке:
Заключение
Индуктивный эффект – это явление, при котором в данной молекуле образуется постоянный диполь из-за неравномерного распределения электронов связи. Это также создает поляризованное состояние, которое длится дольше. В сигма-связи будет два непохожих атома, и электронная плотность тоже не будет однородной. Индуктивные эффекты воздействуют на вещества как химически, так и физически. Это влияет на некоторые критические свойства органических соединений. Его можно использовать для определения кислотной силы алифатических карбоновых кислот, оценки стабильности алкилкарбокатиона, карбанионов и свободных углеродных радикалов, влияния на дипольный момент и длину связи, а также влияния на силу органических оснований, среди прочего.
