Дата рождения: 6.04.1984. В 2006 году окончил Курский государственный медицинский университет, факультет фармацевтический. На факультете работает с: 2009 г. на кафедре фармацевтической химии и фармацевтической технологии. Учёная степень: кандидат фармацевтических наук. Учёное звание: доцент. Должность: доцент, зам. декана по социальной и воспитательной работе. Тема кандидатской диссертации: Исследование соединений группы фторхинолонов, иммобилизированных на различных носителях. Дата защиты кандидатской диссертации: 3 июля 2009 г. Научная специальность по диплому кандидата наук: 15.00.02 – фармацевтическая химия, фармакогнозия. Преподаваемые дисциплины: фармацевтическая химия, токсикологическая химия, контроль качества. Повышение квалификации: Область научных интересов: иммобилизация и стандартизация иммобилизированных форм препаратов с противоопухолевой активностью, капиллярный электрофорез в анализе многокомпонентных смесей. Публикации: научные, методические. Основные научные и методические работы: 4. Хемометрика и фармацевтический анализ [Электронный ресурс] : учебно-методическое пособие : [для ординаторов, обучающихся по специальности 33.  5. Антибиотики различных химических групп [Электронный ресурс] : методические рекомендации для вузов : [для студ. 3 к. очной формы обуч., 4 к. вечер. формы обуч. и интернов фармацевт. фак. специальности 060108 – Фармация] / Воронеж. гос. ун-т ; сост.: П.М. Карлов, Л.Ю. Яковлев .— Электрон. текстовые дан. — Воронеж : ИПЦ ВГУ, 2012 7. Immobilization of cysteine proteases on chitosan with possible portion desorption / В. А. Королева, М. Г. Холявка, Ф. А. Сакибаев, С. М. Панкова, С. С. Ольшанникова, А.  С. Беленова, Д. Ю. Вандышев, Ю. В. Добрина, П. М. Карлов, А. И. Сливкин, А. Н. Пашков, В. Г. Артюхов // FEBS Open Bio .— Кембридж, 2021 .— Vol. 11, Suppl. 1. – P. 260 .— ISSN 2211-5463 С. Беленова, Д. Ю. Вандышев, Ю. В. Добрина, П. М. Карлов, А. И. Сливкин, А. Н. Пашков, В. Г. Артюхов // FEBS Open Bio .— Кембридж, 2021 .— Vol. 11, Suppl. 1. – P. 260 .— ISSN 2211-54639. Regularities of dimeric complexes formation by exo- and endoinulinases / А. Дубовицкая, Ф. А. Сакибаев, М. Г. Холявка, В. А. Королева, Т. Н. Беляева,Т. Н. Беляева, С. М. Панкова, С. С. Ольшанникова, А. С. Беленова, П. М. Карлов, Д. Ю. Вандышев, А. Н. Пашков, В. Г. Артюхов // Biotechnology and Biotechnological Equipment .— София, 2021 .— Vol. 35, Supl. 1. – P. S73-S74 .— ISSN 1310-2818  , growing in the Voronezh region (Russia) / А. А. Гудкова, А. С. Чистякова, Д. Ю. Вандышев, П. М. Карлов, А. А. Сорокина // Research Journal of Pharmacy and Technology .— [Индия], 2020 .— Vol. 13, № 12. – P. 5721-5725 .— ISSN 0974-360X , growing in the Voronezh region (Russia) / А. А. Гудкова, А. С. Чистякова, Д. Ю. Вандышев, П. М. Карлов, А. А. Сорокина // Research Journal of Pharmacy and Technology .— [Индия], 2020 .— Vol. 13, № 12. – P. 5721-5725 .— ISSN 0974-360XОбщее число публикаций: 45. Индекс Хирша (РИНЦ): 3. Контактная информация: |
404 Cтраница не найдена
Размер:
AAA
Изображения Вкл. Выкл.
Обычная версия сайта
К сожалению запрашиваемая страница не найдена.
Но вы можете воспользоваться поиском или картой сайта ниже
|
|
Структуры и функции липидов — биохимия
Все ресурсы по биохимии
6 Диагностические тесты 289 практических тестов Вопрос дня Карточки Learn by Concept
← Предыдущая 1 2 3 4 Следующая →
Биохимия Помощь » Структуры и функции макромолекул » Структура и функции липидов
Молекула стероида состоит из скольких конденсированных углеродных колец?
Возможные ответы:
Правильный ответ:
4
Пояснение:
Стероиды являются производными молекулы циклопентанопергидрофенантрена, состоящей из 4 конденсированных углеродных колец. В структуре стероидов имеется три гексановых кольца и одно пентановое кольцо.
В структуре стероидов имеется три гексановых кольца и одно пентановое кольцо.
Сообщить об ошибке
Структура холестерина наиболее похожа на какой из перечисленных?
Возможные ответы:
Стероид
Гликолипиды
Углеводы
Свободные жирные кислоты
Фосфолипиды
Правильный ответ:
Стероид
Объяснение:
Хотя холестерин является одним из трех основных типов мембранных липидов (наряду с фосфолипидами и гликолипидами), структура холестерина совершенно иная. Это стероид, поэтому он состоит из четырех связанных углеводородных колец, включая три шестичленных кольца и одно пятичленное кольцо.
Сообщить об ошибке
Что из перечисленного не производится из холестерина?
Возможные ответы:
Кортизол
Инсулин
Эстродиол
Прогестерон
Тестостерон
Правильный ответ:
. Пояснение:
Пояснение:
Холестерин является очень важной молекулой по ряду причин. Одной из функций холестерина является регулирование мембранной текучести в плазматической мембране. Еще одна очень важная роль, которую играет холестерин, заключается в том, что он является предшественником ряда стероидных гормонов, включая кортизол, тестостерон, эстрадиол и прогестерон. Однако инсулин представляет собой пептидный гормон, вырабатываемый поджелудочной железой.
Сообщить об ошибке
Все атомы углерода холестерина образуются из атомов углерода какой молекулы?
Возможные ответы:
Мевалонат
Ацетоацетат
Ацетил-КоА
Глюкоза
Глицерил
Правильный ответ:
Ацетил-CoA
. Пояснение:
Холестерин — это молекула с 27 атомами углерода. Чтобы синтезировать этот стероид, необходимо выполнить трехэтапный процесс. Сначала синтезируется изопентенилпирофосфат. Во-вторых, шесть изопентенилпирофосфатов образуют сквален. В-третьих, сквален циклизуется, и продукт этого превращается в холестерин. Строительными блоками, с которых начался весь этот процесс, были углероды из ацетил-КоА.
Сначала синтезируется изопентенилпирофосфат. Во-вторых, шесть изопентенилпирофосфатов образуют сквален. В-третьих, сквален циклизуется, и продукт этого превращается в холестерин. Строительными блоками, с которых начался весь этот процесс, были углероды из ацетил-КоА.
Сообщить об ошибке
Первый из трех этапов синтеза холестерина происходит в цитоплазме. Где соответственно происходят следующие два шага?
Возможные ответы:
Эндоплазматический ретикулум; цитоплазма
Эндоплазматический ретикулум
Цитоплазма
Цитоплазма; эндоплазматический ретикулум
Эндоплазматический ретикулум; Аппарат Гольджи
Правильный ответ:
Эндоплазматический ретикулум
Объяснение:
Первым этапом синтеза холестерина является синтез изопентенилпирофосфата из молекул ацетил-КоА, который происходит в цитоплазме.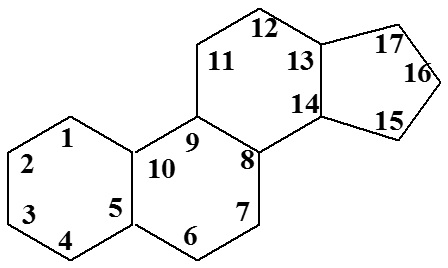 На втором этапе синтеза холестерина происходит соединение шести молекул изопентенилпирофосфата с образованием сквалена. Это происходит в эндоплазматическом ретикулуме. Третьей стадией синтеза холестерина является циклизация сквалена и окончательное превращение молекулы в холестерин. Это происходит в эндоплазматическом ретикулуме.
На втором этапе синтеза холестерина происходит соединение шести молекул изопентенилпирофосфата с образованием сквалена. Это происходит в эндоплазматическом ретикулуме. Третьей стадией синтеза холестерина является циклизация сквалена и окончательное превращение молекулы в холестерин. Это происходит в эндоплазматическом ретикулуме.
Сообщить об ошибке
Какой этап синтеза холестерина является обязательным?
Возможные ответы:
Синтез мевалоната с помощью HMG-CoA REDUCTASE
Изомеризация изопентенил пирофосфата до диметильно-пирофосфата
Цикликации Squalene
440004400044 00044 0004400044 00044000440,0004 400044000440,00044-000440004-синсилент-элеоризит.
Правильный ответ:
Синтез мевалоната с помощью ГМГ-КоА-редуктазы
Объяснение:
Когда молекулы ацетил-КоА превращаются в 3-гидрокси-3-метилглутари-КоА (ГМГ-КоА), происходит восстановление до мевалоната. Этот синтез является необратимым этапом на пути к созданию холестерина и, следовательно, обязательным этапом в синтезе холестерина.
Этот синтез является необратимым этапом на пути к созданию холестерина и, следовательно, обязательным этапом в синтезе холестерина.
Сообщить об ошибке
Лизосомальные болезни накопления возникают, когда мутации вызывают дефекты в каком из следующих факторов?
Possible Answers:
Lysosome formation
Lysosome transformation
Formation of N-acetylgalactosamine derivatives
Sphingolipid degradation enzymes
Sphingolipid biosynthesis enzymes
Correct answer:
Sphingolipid degradation enzymes
Объяснение:
Лизосомальные болезни накопления возникают, когда мутации вызывают дефекты ферментов деградации сфинголипидов. Проще говоря, ключевое слово «деградация», что указывает на наличие болезни. Ни в одном другом варианте ответа нет ключевого слова, указывающего на наличие заболевания.
Сообщить об ошибке
Какой из следующих сфинголипидов является наименьшим по молекулярной массе?
Возможные ответы:
Ганглиозид
Цереброзид
Ceramide
Сфингомиелин
Правильный ответ:
Сфингомилин
Объяснение:
Все четыре из этих сфинголипидов различаются только функциональными группами, присоединенными к сфингозину. Керамид имеет группу жирных кислот; цереброзид имеет моносахаридную группу; ганглиозид имеет полисахаридную группу; сфингомиелин имеет фосфатидилхолиновую или фосфоэтаноламиновую группу. С точки зрения молекулярной массы фосфатидилхолин или фосфоэтаноламин являются наименьшей, а также наименее массивной функциональной группой, что делает сфингомиелин сфинголипидом с наименьшей молекулярной массой.
Сообщить об ошибке
Церамид является предшественником чего из следующего?
Возможные ответы:
Сфингомиелин и гликосфинголипиды
Гликосинголипиды только
Сфингомиелин только
SphingoLipids только
Правильный ответ:
.
SPHINGSOMOLIN
SPHINGSPINGSPINGSPINGINGSOMPLINS
SOMPLINS
SOMPLINS
SPHOMPLINS
SOMOLIN
. Объяснение:
Керамид образован сфингозином. Сфингозин образован длинной цепью сфинголипидов. И сфингомиелин, и гликосфинголипиды образуются из церамида.
Сообщить об ошибке
Какие из перечисленных веществ являются амфипатическими, полярными и образованы длинноцепочечными сфинголипидами?
Возможные ответы:
Sphingosine
Ceramide
Glucosamine
Palmitoyl-Coa
Sphingomyelin
Правильный ответ:
Sphingosine
. Объяснение:
Глюкозамин участвует в структуре гликозилфосфатидилинозитола (GPI). Церамид является предшественником сфингомиелина, сфингозин гидролизуется с образованием церамида.
Сообщить об ошибке
← Предыдущая 1 2 3 4 Следующая →
Уведомление об авторских правах
Все ресурсы по биохимии
6 Диагностические тесты 289 практических тестов Вопрос дня Карточки Learn by Concept
Производные циклопентанопергидрофенантрена и способ их получения
Настоящее изобретение относится к гормоноподобным соединениям типа кортикальных стеролов, в частности к гормоноподобным производным циклопентанопергидрофенантрена, имеющим кислородную функцию при углероде II, и к усовершенствованному методу синтеза этих соединений.
В течение некоторого времени было известно, что надпочечниковые стероиды являются важными медицинскими соединениями, имеющими особое значение в гормональной терапии. Эти соединения характеризуются сложной молекулярной структурой и имеют следующую систему колец: 14 A 2 10 8 3 5 7 Предложенные выше различные способы получения этих соединений оказались относительно неудовлетворительными. Таким образом, известные способы оказались утомительными, сложными и трудно контролируемыми, а получаемые в результате выходы желаемых стеролов слишком малы для практической работы.
Объектом настоящего изобретения является практичный и экономичный способ получения соединений типа гормоноподобных кортикальных стероидов.
Другой целью настоящего изобретения является разработка способа получения гормоноподобного производного циклопентанопергидрофенантрена, имеющего кислородную функцию при углероде I1.
Другие цели будут очевидны из следующего описания изобретения.
Соединения по настоящему изобретению имеют кислородную функцию, т. е. грамм. гидроксильную или кетогруппу, или замещенную гидроксильную или кетогруппу в положении углерода i1 стероидного ядра. При осуществлении изобретения соединения получают из производных циклопентанопергидрофенантрена, т.е. е. соединения со стероидным ядром, характеризующимся наличием кетоновой группы в 12-м положении углерода ядра. Предыдущие попытки ввести кислородную функцию у углерода 11 и при этом сохранить реакционноспособную кетогруппу у углерода 12 не увенчались успехом. В предшествующих способах введение кислородной функции в положение углерода 11 стерольного ядра приводило к образованию продуктов перегруппировки, в которых отсутствует активная кетогруппа в положении углерода 12.
е. грамм. гидроксильную или кетогруппу, или замещенную гидроксильную или кетогруппу в положении углерода i1 стероидного ядра. При осуществлении изобретения соединения получают из производных циклопентанопергидрофенантрена, т.е. е. соединения со стероидным ядром, характеризующимся наличием кетоновой группы в 12-м положении углерода ядра. Предыдущие попытки ввести кислородную функцию у углерода 11 и при этом сохранить реакционноспособную кетогруппу у углерода 12 не увенчались успехом. В предшествующих способах введение кислородной функции в положение углерода 11 стерольного ядра приводило к образованию продуктов перегруппировки, в которых отсутствует активная кетогруппа в положении углерода 12.
Для получения гормоноподобных соединений по настоящему изобретению важно, чтобы кеиогруппа оставалась в положении углерода 12, оставалась активной и восстанавливалась до метиленовой группы без разрушения кислородной функции, введенной в положение углерода 11. .
Это изобретение основано на открытии усовершенствованного способа синтеза соединений типа кортикальных стеролов, имеющих кислородную функцию в положении углерода 11 ядра. Этот процесс включает гидролиз при температуре не выше примерно 40°С, предпочтительно при комнатной температуре (200°С), стероидного ядра, характеризующегося галогеновой группой в положении 11 углерода и кетоновой группой в положении 12 углерода. .
Этот процесс включает гидролиз при температуре не выше примерно 40°С, предпочтительно при комнатной температуре (200°С), стероидного ядра, характеризующегося галогеновой группой в положении 11 углерода и кетоновой группой в положении 12 углерода. .
Температура, при которой проводится гидролиз, имеет первостепенное значение, так как было обнаружено, что в результате гидролиза при выше 400°С. Предпочтительным иллюстративным способом осуществления настоящего изобретения является следующее: 1. Получение алкилдезоксихолата путем этерификации коммерческой дезоксихолевой кислоты; 2. Получение 3-ацильного производного алкилдезоксихолата частичным ацилированием сложноэфирного продукта, полученного на первой стадии; 3. Получение 12-кетопроизводного 3-ацилалкилдезоксихолата путем окисления продукта, полученного на стадии два; 4. Получение 11-бромпроизводного 3-ацил-12-кетоалкилдезоксихолата путем бромирования продукта, полученного на стадии три; 5. Получение 3-11-дигидрокси-12-кетохолановой кислоты путем гидролиза при температуре не выше примерно 40°С 11-бром-продукта, полученного на четвертой стадии.
Целевой продукт или эпимеры, имеющие реакционноспособную кетогруппу при углероде 12, могут быть отделены от нежелательных продуктов фракционной кристаллизацией или различными другими способами, известными в данной области техники. Один предпочтительный способ разделения основан на открытии того, что практически весь целевой продукт находится в виде эпимера, который образует нерастворимую натриевую соль, в то время как нежелательные продукты по большей части образуют растворимые натриевые соли. Нерастворимая натриевая соль может быть выделена 5 и обработана следующим образом: 6. Получение гидразона нерастворимой натриевой соли 3,11-дигидрокси-12-кетохолановой кислоты, полученного на пятой стадии; 7. Восстановление производного гидразона, полученного на шестой стадии, при котором гидразонная группа, замещающая кетогруппу, превращается в метиленовую группу в положении атома углерода 12 ядра; 8. Выделение 3,11-дигидроксихоланской кислоты, полученной на седьмой стадии, в виде алкилового эфира. Следующий пример служит для иллюстрации настоящего изобретения, но не предназначен для его ограничения: I. Метилдезоксихолат: коммерчески доступная дезоксихолевая кислота I3(а). ) 12-дигидроксихолановую кислоту] сначала этерифицируют путем суспендирования 450 г хорошо высушенной дезоксихолевой кислоты примерно в одном литре сухого метанола, добавляя от 0,5 до 1,0 куб. концентрированной серной кислоты в 25 мл. метанола и, закрыв колбу пробкой, оставляют смесь стоять при комнатной температуре в течение суток. За это время растворяется дезоксихолевая кислота и кристаллизуется метиловый эфир. Затем реакционную смесь фильтруют с отсасыванием, осадок хорошо промывают суспензией в очень холодном метаноле и сушат. Полученный материал плавится при 97°-1020°С (с поправкой) и, хотя и несколько нечистый, пригоден для использования на дальнейших стадиях процесса.
Следующий пример служит для иллюстрации настоящего изобретения, но не предназначен для его ограничения: I. Метилдезоксихолат: коммерчески доступная дезоксихолевая кислота I3(а). ) 12-дигидроксихолановую кислоту] сначала этерифицируют путем суспендирования 450 г хорошо высушенной дезоксихолевой кислоты примерно в одном литре сухого метанола, добавляя от 0,5 до 1,0 куб. концентрированной серной кислоты в 25 мл. метанола и, закрыв колбу пробкой, оставляют смесь стоять при комнатной температуре в течение суток. За это время растворяется дезоксихолевая кислота и кристаллизуется метиловый эфир. Затем реакционную смесь фильтруют с отсасыванием, осадок хорошо промывают суспензией в очень холодном метаноле и сушат. Полученный материал плавится при 97°-1020°С (с поправкой) и, хотя и несколько нечистый, пригоден для использования на дальнейших стадиях процесса.
II. 3(а) ацетокси-12-гидроксиметилхоланат: 400 г метилдезоксихолата, полученного на стадии I, растворяют в 750 см 3 . пиридина, перегнанного над окисью бария. К этому раствору 165 куб. Добавляют (1,6 моля) свежеперегнанного уксусного ангидрида и смесь выдерживают при комнатной температуре в течение девятнадцати часов. Затем к раствору пиридина добавляют лед и воду, и этой смеси дают отстояться в течение одного-двух часов. Затем смесь пиридина, воды и уксусной кислоты декантируют, дважды экстрагируют эфиром, эфирный экстракт дважды промывают водой и все водные фракции отбрасывают.
К этому раствору 165 куб. Добавляют (1,6 моля) свежеперегнанного уксусного ангидрида и смесь выдерживают при комнатной температуре в течение девятнадцати часов. Затем к раствору пиридина добавляют лед и воду, и этой смеси дают отстояться в течение одного-двух часов. Затем смесь пиридина, воды и уксусной кислоты декантируют, дважды экстрагируют эфиром, эфирный экстракт дважды промывают водой и все водные фракции отбрасывают.
Полукристаллический остаток, полученный в ходе реакции, затем растворяют в эфире и полученный раствор экстрагируют небольшими порциями пятипроцентной серной кислоты — пятипроцентного карбоната натрия и, наконец, тщательно водой. После сушки над сульфатом натрия эфир отгоняют обычным образом. Полученный кристаллический остаток может быть перекристаллизован из метанола и плавится при температуре около 124-1260°С.
III. 3(а) ацетокси-12-кетометилхоланат: Около 463 г моноацетата, полученного на стадии II, растворяют в 1500 мл. ледяной уксусной кислоты, перегнанной над CrO3. Для воздействия на раствор требуется нагрев, но перед окислением раствор охлаждают до комнатной температуры.
Для воздействия на раствор требуется нагрев, но перед окислением раствор охлаждают до комнатной температуры.
К этому раствору 175 г CrO3 растворяют в 800 мл. воды добавляют при перемешивании в течение одного-двух часов. Реакционной смеси дают постоять при постоянном перемешивании еще час, а затем добавляют около 1500 см 3 . воды добавляют медленно, продолжая перемешивание. Кристаллическую массу отфильтровывают, дважды промывают суспензией в воде, фильтруют как можно насухо и растворяют в этаноле. Для этого требуется большой объем спирта, а поскольку продукт кристаллизуется очень легко, раствор необходимо фильтровать, пока он очень горячий. Полученный кристаллический продукт, 3(а)-ацетокси-12-кетометилхоланат, плавится при температуре около 147°149.° C и является достаточно чистым для целей бромирования.
IV. 3(а) ацетокси-11-бром-12-кетометилхоланат: Около 410 граммов кетоэфира, полученного на стадии III, растворяют в одном литре стабильной уксусной кислоты и 295 куб. добавляют 6,8 н. Br2 в ледяной уксусной кислоте (1,1 моль Br2). Смесь закупоривают и оставляют при комнатной температуре примерно на пять дней. Затем реакционный раствор медленно выливают из капельной воронки в большое количество ледяной воды при постоянном интенсивном перемешивании. Если добавление производится медленно и непрерывное перемешивание, продукт становится песчаным и легко фильтруется. Если добавление к воде происходит слишком быстро, продукт становится маслянистым и его трудно промывать. Полученный продукт фильтруют при слабом отсасывании и пять раз промывают суспендированием в воде и энергичным механическим перемешиванием. Фильтраты имеют желтый цвет и отбрасываются. После последней промывки продукт, представляющий собой порошкообразное твердое вещество от бледно-желтого до белого цвета, фильтруют как можно более сухим и растворяют в шести литрах девяностопятипроцентного этанола.
Br2 в ледяной уксусной кислоте (1,1 моль Br2). Смесь закупоривают и оставляют при комнатной температуре примерно на пять дней. Затем реакционный раствор медленно выливают из капельной воронки в большое количество ледяной воды при постоянном интенсивном перемешивании. Если добавление производится медленно и непрерывное перемешивание, продукт становится песчаным и легко фильтруется. Если добавление к воде происходит слишком быстро, продукт становится маслянистым и его трудно промывать. Полученный продукт фильтруют при слабом отсасывании и пять раз промывают суспендированием в воде и энергичным механическим перемешиванием. Фильтраты имеют желтый цвет и отбрасываются. После последней промывки продукт, представляющий собой порошкообразное твердое вещество от бледно-желтого до белого цвета, фильтруют как можно более сухим и растворяют в шести литрах девяностопятипроцентного этанола.
V. 3,11-дигидрокси-12-кетохолановая кислота: К спиртовому раствору бромкетонов, полученных на стадии IV, добавляют при перемешивании четыре литра 2,6 н. едкого натра, бутылку закрывают и отставляют в сторону. при комнатной температуре в течение примерно двадцати четырех-тридцати часов. Важно, чтобы гидролиз проводился при низкой температуре, т.е. е. не выше примерно 40°С. При нагревании реакционной смеси образующиеся продукты не содержат (или сохраняют) активную кетогруппу при углероде 12. После отстаивания образуется тяжелый осадок; затем раствор охлаждают в течение ночи при -100°С и фильтруют при слабом отсасывании, пока он еще холодный. Осадок дважды промывают суспензией в небольшом объеме ледяной воды и сушат без нагревания.
едкого натра, бутылку закрывают и отставляют в сторону. при комнатной температуре в течение примерно двадцати четырех-тридцати часов. Важно, чтобы гидролиз проводился при низкой температуре, т.е. е. не выше примерно 40°С. При нагревании реакционной смеси образующиеся продукты не содержат (или сохраняют) активную кетогруппу при углероде 12. После отстаивания образуется тяжелый осадок; затем раствор охлаждают в течение ночи при -100°С и фильтруют при слабом отсасывании, пока он еще холодный. Осадок дважды промывают суспензией в небольшом объеме ледяной воды и сушат без нагревания.
Полученный таким образом осадок содержит желаемый (реакционноспособный кето) эпимер в виде нерастворимой натриевой соли, в то время как фильтрат в основном содержит нежелательные продукты в виде растворимых натриевых солей. Один эпимер с реакционноспособной 12-кетогруппой действительно образует растворимую натриевую соль. При желании его можно выделить из фильтрата путем кристаллизации, хотя, поскольку он присутствует только в небольших количествах, его извлечение, как правило, нецелесообразно. Эта разница в растворимости солей натрия обеспечивает необычайно удовлетворительные средства для выделения и извлечения практически всего целевого продукта, характеризующегося реакционноспособной кетогруппой.
Эта разница в растворимости солей натрия обеспечивает необычайно удовлетворительные средства для выделения и извлечения практически всего целевого продукта, характеризующегося реакционноспособной кетогруппой.
Дополнительное количество нерастворимой соли натрия может быть выделено из фильтрата или реакционной смеси путем подкисления фильтрата эфиром, экстракции эфиром, промывки экстракта водой, сушки промытого экстракта над сульфатом натрия, отгонки эфира, растворения маслянистого остатка в этаноле, нейтрализуют едкой щелочью, разбавляют водой и выдерживают продукт при температуре около -10°С. Полученную в виде осадка нерастворимую натриевую соль затем промывают суспензией в холодной воде и сушат без нагревания.
VI. Гидразон нерастворимой натриевой соли 3,11-дигидрокси-12-кетохолановой кислоты. Около 100 г высушенной нерастворимой натриевой соли, полученной на стадии V, растворяют в 1400 мл. абсолютного этанола с обратным холодильником. К полученному раствору 25 куб. 100% гидразингидрата добавляют 60 и продолжают кипячение с обратным холодильником в течение одного часа. Затем отгоняют примерно две трети спирта, а оставшемуся раствору дают кристаллизоваться. Маточные растворы из этой порции кристаллов при дальнейшем концентрировании дают несколько дополнительных порций гидразона. Полученный гидразон достаточно гигроскопичен и должен храниться в эксикаторе.
Затем отгоняют примерно две трети спирта, а оставшемуся раствору дают кристаллизоваться. Маточные растворы из этой порции кристаллов при дальнейшем концентрировании дают несколько дополнительных порций гидразона. Полученный гидразон достаточно гигроскопичен и должен храниться в эксикаторе.
VII. Восстановление по Вольфу-Кишнеру гидразона 3,11-дигидрокси-12-кетохолановой кислоты: около 5 г гидразона, полученного на стадии VI, помещают в стеклянную или стальную трубку бомбы и 50 мл. этилата натрия, приготовленного из 3 граммов натрия, добавленных вместе с 0,5 куб. стопроцентного гидразингидрата. Затем трубку закрывают и нагревают при 200°С в течение пяти часов. После охлаждения пробирку открывают и содержимое промывают спиртом, водой или другим растворителем.
VIII. Выделение 3,11-дигидроксихоланской кислоты в виде метилового эфира: Продукт реакции, полученный на стадии VII, предпочтительно промывают из трубки бомбы 95-процентным этанолом так, чтобы конечный объем составлял один литр этанола на каждые 40 граммов этанола. Гидразон натриевой соли восстановлен. Этот раствор нагревают и нейтрализуют до фенолфталеина разбавленной водной соляной кислотой и добавляют дополнительное количество воды, достаточное для доведения объема до двух литров.
Гидразон натриевой соли восстановлен. Этот раствор нагревают и нейтрализуют до фенолфталеина разбавленной водной соляной кислотой и добавляют дополнительное количество воды, достаточное для доведения объема до двух литров.
Затем к горячему водно-спиртовому раствору добавляют один литр 0,3 н. гидроксида бария и, наконец, медленно добавляют один литр горячей воды при постоянном перемешивании. Затем колбу закрывают пробкой и оставляют охлаждаться в течение ночи. Нерастворимую соль бария удаляют фильтрованием, а фильтрат, содержащий растворимые соли бария, подкисляют эфиром и дважды экстрагируют свежими порциями эфира. Эфирный раствор тщательно промывают водой, OOH I Эстерифляция (MeOH) HO C4HsCOOMe HOr Уксусный ангидрид (пиридин) HO COHsCOOMe AcOV CrO3 O C4HsCOOMe AcO” Brs O C4HaCOOMe B/\ Щелочной Ac \ Гидролиз (NaOH) упаривают досуха, следы воды, удаляемой из остатка двух- или трехкратной перегонкой бензола из остатка (свободная кислота может быть выделена из этой фракции подкислением избытком соляной кислоты и фильтрованием). добавляют небольшое количество концентрированной серной кислоты и раствор оставляют при комнатной температуре на 4-5 часов или на ночь для этерификации.Раствор в метаноле выливают в эфир, экстрагируют раствором карбоната натрия и водой.
добавляют небольшое количество концентрированной серной кислоты и раствор оставляют при комнатной температуре на 4-5 часов или на ночь для этерификации.Раствор в метаноле выливают в эфир, экстрагируют раствором карбоната натрия и водой.
Затем нейтральную фракцию концентрируют и полученный в виде осадка 16 3,11-дигидроксиметилхоланат перекристаллизовывают из смеси бензола и петролейного эфира. Целевой продукт плавится при 132-134°С и имеет [а]D=+13°(этилацетат), [а]D=+7 (хлороформ).
Следующая таблица формул служит иллюстрацией реакции, описанной выше: 0 C4HsCOONa , \T HOvY Гидразин h22N C1HsCOOONa HOOr Восстановление Вольфа-Кишнера C4HC OONa H0/\/\ HOO Реацидивирование C4HsCOOH HO 1 Этерификация (MeOH) OOMe Имея описанное выше Наше изобретение, которое мы заявляем как новое и которое мы хотим защитить патентным письмом, представляет собой: 1. Способ производства 3,11-дигидроксихолановой кислоты, который включает воздействие на метилхоланата до щелочного гидролиза при температуре не выше примерно 400°С с образованием щелочной соли 3,11-дигидрокси-12-кетохолановой кислоты, взаимодействия указанной соли с гидразином с образованием ее производного 3,11-дигидрокси-12гидразона и после этого восстанавливают указанное производное 12-гидразона с образованием 3,11-дигидроксихолановой кислоты.
2. Соединение 3,11-дигидроксихолановая кислота.
3. Способ получения 3,11-дигидроксихолановой кислоты, включающий щелочной гидролиз 3(а)-ацетокси-11-галоген-12-кетоалкилхолоната при температуре не выше примерно 400°С до образуют щелочную соль 3,11-дигидрокси-12-кетохолановой кислоты, объединяя соль Сида с бидразином с образованием ее производного 3,11-дигидрокси-12-гидразона и после этого восстанавливая указанное производное 12-гидразона до 3,11-дигидроксихолановой кислоты. кислота.
4. Способ получения 3,11-дигидроксихолановой кислоты, включающий гидролиз 3(а) ацетокси-11-бром-12-кетометилхолоната гидроксидом натрия при температуре около 20°С с образованием нерастворимого натриевую соль 3,11-дигидрокси-12-кетохолановой кислоты, реакцию указанной соли с гидразином с образованием ее производного 3,11-дигидрокси-12-гидразона и последующее восстановление указанного производного 12-гидразона с образованием 3,11-дигидроксихоланской кислоты.
ТОМАС Ф. ГАЛЛАГЕР.

 Группа веществ, изолируемых перегонкой с водяным паром. Ядовитые газы [Электронный ресурс] : учебное пособие / Воронеж. гос. ун-т ; сост.: А.С. Чистякова, П.М. Карлов, А.И. Сливкин .— Электрон. текстовые дан. — Воронеж : Издательский дом ВГУ, 2021
Группа веществ, изолируемых перегонкой с водяным паром. Ядовитые газы [Электронный ресурс] : учебное пособие / Воронеж. гос. ун-т ; сост.: А.С. Чистякова, П.М. Карлов, А.И. Сливкин .— Электрон. текстовые дан. — Воронеж : Издательский дом ВГУ, 2021 