КАК РЕШАТЬ ПРОСТЕЙШИЕ ЗАДАЧИ ПО ХИМИИ
КАК РЕШАТЬ ПРОСТЕЙШИЕ ЗАДАЧИ ПО ХИМИИКАК РЕШАТЬ ПРОСТЕЙШИЕ ЗАДАЧИ ПО ХИМИИВ реакцию с соляной кислотой вступило 13 г цинкаНовая страница 14.Как решать задачи, где одно из реагирующих веществ дано в избытке?
В реакцию с соляной кислотой вступило 13 г цинка. Определите массы израсходованной кислоты и полученной соли, а также объем выделившегося газа.
Решение.
1. Находим количество вещества цинка, разделив его массу на молярную массу:
n(Zn) = m : M = 13 г : 65 г/моль = 0,2 моль
2.
0,2 моль 0,4 моль 0,2 моль 0,2 моль
Zn + 2HCl => ZnCl2 + h3
m(HCl) = M · n = 36,5 г/моль · 0,4 моль = 14,6 г
m(ZnCl2) = M · n = 136 г/моль · 0,2 моль = 27,2 г
Объем водорода находим аналогично:
V(h3) = Vm · n = 22,4 л/моль · 0,2 моль = 4,48 л
ЗАДАЧИ НА ИЗБЫТОК РЕАГЕНТА
Главный
отличительный признак таких расчетов – это
наличие числовых данных (массы, объема,
количества вещества или необходимых
компонентов для их вычисления) по обоим
веществам, реагирующим между собой. Чаще
всего это говорит о том, что одно из этих
веществ находится в избытке и вступит в
реакцию не полностью. Определить же, что
именно в избытке, удобнее всего, когда
известны количества вещества реагентов.
Если они не указаны в условии, их следует
вычислить по исходным данным.
Чаще
всего это говорит о том, что одно из этих
веществ находится в избытке и вступит в
реакцию не полностью. Определить же, что
именно в избытке, удобнее всего, когда
известны количества вещества реагентов.
Если они не указаны в условии, их следует
вычислить по исходным данным.
Задача 1.
8 г серы нагрели с 28 г железа. Определите массу продукта реакции.
Решение.
1. Так как в условии указаны массы железа и серы одновременно, то одно из этих веществ вполне может оказаться в избытке. Для выяснения этого находим количества вещества реагентов:
n(Fe) = m : M = 28 г : 56 г/моль = 0,5 моль
n(S) = m : M = 8 г : 32 г/моль = 0,25 моль
2. Записываем уравнение реакции и по коэффициентам определяем мольные отношения реагентов:
Fe + S ® FeS
3. Так как железа и серы должно
реагировать равное количество молей, то
ясно, что в этой реакции будет
израсходовано по 0,25 моль их, избыток железа
при этом составит 0,5 – 0,25 + 0,25 моль, и в
реакцию не вступит.
Так как железа и серы должно
реагировать равное количество молей, то
ясно, что в этой реакции будет
израсходовано по 0,25 моль их, избыток железа
при этом составит 0,5 – 0,25 + 0,25 моль, и в
реакцию не вступит.
4. Так как сера взята в недостатке, то по ее количеству определяем количество продукта реакции, а затем его массу:
0,25 моль 0,25 моль 0,25 моль
Fe + S ® FeS
m (FeS) = M · n = 88 г/моль · 0,25 моль = 22 г
Задача 2.
Для реакции взято 56 л хлора и 56 г железа. Определите массу полученного продукта.
Решение.
2Fe + 3Cl2 ® 2 FeCl3
В этом случае расчет избытка более сложен, поэтому можно использовать такую хитрость:
|
Fe |
Cl2 |
|
2 |
3 |
|
1 |
|
|
|
2,5 |
В
первой строке пишем формулы реагирующих
веществ, во второй – их мольные отношения
по уравнению реакции (по коэффициентам), а в
двух следующих – количества
этих веществ,
имеющихся в наличии, причем на разных
строках.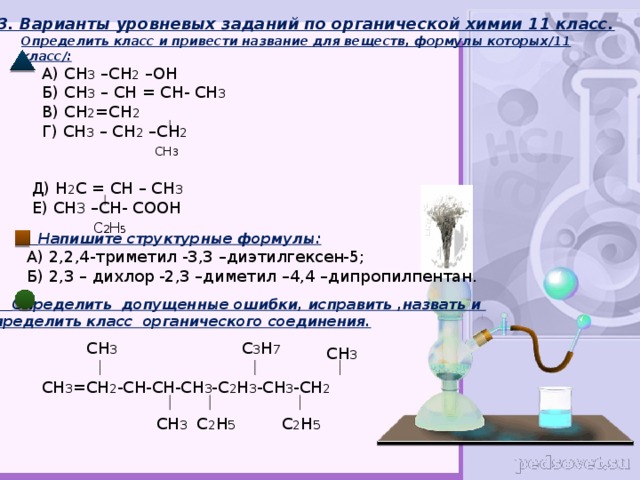
| Fe | Cl2 |
|
2 |
3 |
|
1 |
1,5 |
|
1,67 |
2,5 |
Далее анализируем полученные данные.
Железа есть 1 моль, а
для реакции с 2,5 моль хлора его нужно в
полтора раза меньше, это составляет 1,67 моль,
чего у нас нет. Следовательно, железо в
недостатке, а число 1,67 можно зачеркнуть.
Хлора имеется 2,5 моль, а на реакцию с
железом нужно лишь 1,5 моль, поэтому хлор
взят в избытке. Избыток хлора составляет
2,5 – 1,5 = 1 моль.
Следовательно, железо в
недостатке, а число 1,67 можно зачеркнуть.
Хлора имеется 2,5 моль, а на реакцию с
железом нужно лишь 1,5 моль, поэтому хлор
взят в избытке. Избыток хлора составляет
2,5 – 1,5 = 1 моль.
Таким образом, в недостатке железо, и дальнейшие расчеты ведем по его количеству:
1 моль 1,5 моль 1 моль
2Fe + 3Cl2 ® 2 FeCl3
m (FeСl3) = M · n = 162,5 г/моль · 1 моль = 162,5 г
Задача 3.
К раствору, содержащему 26,1 г нитрата бария, добавлен раствор, содержащий 35,5 г сульфата натрия, осадок отфильтрован. Что находится в фильтрате и в каком количестве?
Решение.
n [Ba(NO3)2] = 26,1 г : 261 г/моль = 0,1 моль
n (Na2SO4) = 35,5 г : 142 г/моль = 0,25 моль (избыток 0,15 моль)
0,1 моль 0,1 моль 0,1 моль 0,2 моль
Ba(NO3)2 + Na2SO4 ® BaSO4 + 2HCl
В растворе после реакции окажется 0,2 моль нитрата натрия и остаток сульфата натрия 0,15 моль. При необходимости можно найти массы этих веществ.
Иногда от количеств вещества реагентов может зависеть не только количество продуктов реакции, но и их состав.
Задача 4.
К
раствору, содержащему 49 г серной кислоты,
добавлено 20 г гидроксида натрия. Определите
состав и массу полученной соли.
Решение.
n (h3SO4) = 49 г : 98 г/моль = 0,5 моль
n (NaOH) = 20 г : 40 г/моль = 0,5 моль
Так как серная кислота двухосновна, то она может образовать два ряда солей:
2 NaOH + h3SO4 ® Na2SO4 + 2h3O средняя соль
NaOH + h3SO4 ® NaHSO4 + h3O кислая соль
В нашей задаче оказалось равное мольное количество кислоты и щелочи, поэтому расчет следует вести по второму уравнению реакции:
0,5 моль 0,5 моль 0,5 моль
NaOH + h3SO4 ® NaHSO4 + h3O
m (NaHSO4) = M ·
n =
120 г/моль ·
0,5 моль =
60 г.
Задача 5.
Через раствор, содержащий 60 г гидроксида натрия, пропущен углекислый газ, полученный при действии избытка соляной кислоты на 200 г карбоната кальция. Определите состав и массу полученной соли.
Решение.
1. Определяем количества вещества веществ, указанных в условии задачи:
n (NaOH) = m : M = 60 г : 40 г/моль = 1,5 моль
n (CaCO3) = m : M = 200 г : 100 г/моль = 2 моль
2. Записываем уравнение реакции, в которой был получен углекислый газ, и по количеству вещества СаСО3 определяем, сколько моль газа выделилось:
2 моль 2 моль
CaCO3 + 2HCl ® CaCl2 + h3O + CO2
3. Таким
образом, для второй реакции у нас имеется 2
моль углекислого газа и 1,5 моль гидроксида
натрия. Так как СО2
– ангидрид двухосновной угольной кислоты Н2СО3,
то при его взаимодействии с щелочами могут
образоваться как средние, так и кислые соли:
Таким
образом, для второй реакции у нас имеется 2
моль углекислого газа и 1,5 моль гидроксида
натрия. Так как СО2
– ангидрид двухосновной угольной кислоты Н2СО3,
то при его взаимодействии с щелочами могут
образоваться как средние, так и кислые соли:
NaOH + CO2 ® NaHCO3
2NaOH + CO2 ® Na2CO3 + h3O
Теперь нужно определиться, по какому из двух уравнений реакций нам вести расчет. Для образования средней соли щелочи должно быть вдвое больше, чем газа. У нас же наоборот, газа больше, чем щелочи. Следовательно, реакция пойдет по первому уравнению, с образованием кислой соли, причем СО2 окажется в избытке (0,5 моль):
1,5 моль 1,5 моль 1,5 моль
NaOH + CO2 ® NaHCO3
m
(NaHCO3)
= M ·
n = 84 г/моль
· 1,5 моль
= 126 г.
Решите самостоятельно.
1. 14 г оксида кальция обработали раствором, содержащим 36 г азотной кислоты. Какова масса полученной соли? (41 г).
2. К раствору, содержащему 40 г сульфата меди (II), добавили 12 г железных опилок. Останется ли в растворе сульфат меди после реакции?
3. Хватит ли 15 л кислорода для сжигания 4 г серы?
(да)
4. В раствор, содержащий 16 г сульфата меди (II), пропустили сероводород объемом 5,6 л. Какова масса выпавшего осадка? (9,6 г).
5. К раствору, содержащему 10,4 г хлорида бария, добавили 9,8 г серной кислоты. Определите массу осадка и состав полученного раствора. (11,65 г)
Методика решения расчетных задач по химии различных уровней сложности
Необходимость уметь решать расчётные задачи
Уметь решать задачи – интегрированный
показатель степени овладения знаниями по химии,
физике, математике и, несомненно, мыслительных
способностей учащихся. Поэтому решение задач -
это не только один из ведущих методов обучения,
но и самый информативный способ контроля.
Процесс усвоения знаний может быть условно
разделён на четыре этапа:
Поэтому решение задач -
это не только один из ведущих методов обучения,
но и самый информативный способ контроля.
Процесс усвоения знаний может быть условно
разделён на четыре этапа:
- понимание;
- запоминание;
- применение в стандартных условиях;
- применение в новых, нестандартных условиях и различных сочетаниях.
На всех этих этапах для обучения и контроля можно использовать различные типы задач.
Первыми преподавателями и методистами, которые выдвинули и отстаивали идею необходимости введения задач в процесс обучения химии, были В.Н. Верховский, Я.Л. Гольдфарб, Л.А. Цветков, Л.М. Сморгонский, С.Г. Шаповаленко, Ю.В. Ходаков.
Несмотря на многообразие подходов к проблеме
обучения школьников решению химических задач,
все признают, что основной формой обучения
должна быть самостоятельная работа.
Самостоятельная работа учащихся эффективна при
наличии достаточных базовых знаний и хороших
пособий, задачников.
В настоящее время существует противоречие между уровнем стандартных задач школьного курса и уровнем задач ЕГЭ. Трудность некоторых задач ЕГЭ часто запредельна не только для школьников, но и для большинства учителей. В различных пособиях приведены примеры решения достаточно трудных задач. Однако, как показывает опыт, химические, физические и математические знания большинства школьников недостаточны для того, чтобы разобраться в них. Поэтому невозможно успешно сдать ЕГЭ без занятий на подготовительных курсах или с репетиторами. А это требует больших затрат времени и средств и приводит к перегрузке старшеклассников.
Отсюда очевидна актуальность проблемы обучения школьников умению решать химические задачи.
Задачи на нахождение массовой доли элемента в веществе
Первый и, естественно, самый простой тип задач,
изучаемых учащимися в VIII классе – это нахождение
массовых долей химических элементов в веществе. Это очень простые задачи, но опыт работы
показывает, что для большинства учащихся
представляет серьёзную проблему запоминание
даже простых формул для расчётов. Я с самого
начала делаю упор на логику учащихся, а, не на их
механическую зубрёжку. Само название “массовая
доля” показывает, что для расчёта берут массы.
Это очень простые задачи, но опыт работы
показывает, что для большинства учащихся
представляет серьёзную проблему запоминание
даже простых формул для расчётов. Я с самого
начала делаю упор на логику учащихся, а, не на их
механическую зубрёжку. Само название “массовая
доля” показывает, что для расчёта берут массы.
Я задаю учащимся простой вопрос:
– Что нужно делать, чтобы каждый получил свою долю от чего-либо?
Учащиеся мгновенно дают ответ:
– Надо делить!
Далее фиксирую их внимание на том, что доля - это часть от целого. Значит при расчёте необходимо часть массы, приходящуюся на химический элемент, делить на массу всей молекулы.
Таким образом, учащиеся легко, при помощи логики, сами выводят формулу, необходимую для нахождения массовой доли химического элемента в веществе.
Задача 1. Вычислить массовую долю водорода и кислорода в молекуле воды.
Решение: Сначала вычисляется относительная молекулярная масса Mr воды:
Mr (H2O) = Ar (H) * 2 + Ar (O) = 1*2+16 = 18;
затем массовая доля водорода: (H) = * 100% = = 11. 1%
1%
и кислорода: (O) = = = 88.9%
Ответ: (H) = 11,1%, ? (О) = 88,9%.
Задачи на нахождение формулы вещества по массовым долям элементов, его составляющих
Затем изучают решение обратной задачи - находят формулу вещества по известным массовым долям входящих в его состав химических элементов. Сам алгоритм решения подобных задач осваивается учащимися довольно легко. Трудность вызывает приведение соотношения атомов химических элементов к простым целым числам. Я объясняю, что необходимо из всех чисел соотношения выбрать самое меньшее и на него делить все числа соотношения. Но и в этом случае могут получиться не целые числа. Тогда приходится все результаты удваивать, утраивать и т.д. до получения целых чисел, которые не сокращаются.
Задача 2. Найти формулу вещества, которое содержит 83,33% углерода и 16,67% водорода.
Решение: Для вещества состава АхВу справедлива формула 1:
: = х : у (1)
Подставляя данные в эту формулу, получаем выражение: :
Несложные вычисления дают ответ: 5 : 12
Ответ: формула вещества С5Н12
Но не всегда ответ находится так легко.
На примере этой задачи в старших классах при работе с более одарёнными учениками можно показать, что в бинарном соединении эквивалентное число атома z численно равно его степени окисления. Для этого условно рассмотрим вещество состава АхВу как продукт взаимодействия атомов элементов А и В:
хА + уВ -> Ах+m By-n;
A0 – me -> A+m;
B0 + ne -> B-n.
Из схемы окислительно-восстановительного процесса следует, что: z(A) = m , z(B) = n .
Существует, однако, немало бинарных
соединений, формулы которых составлены не в
соответствии со степенями окисления элементов. К
ним относятся многие карбиды, нитриды, оксиды,
углеводороды и другие вещества. Например: CaC2,
Cr7C3, Mn8C3, Mn4N, Mo2N,
Fe3O4, U3O8.
Совершенно очевидно, что для любого элемента в веществе, даже если формула составлена не по степеням окисления, можно рассчитать эквивалент или молярную массу элемента. Но у многих таких веществ степени окисления элементов выражаются дробными числами, а значит, и эквивалентные числа также будут дробными. Решим задачу 2, используя понятие “эквивалент”. Для этого в математическое выражение закона эквивалентов
= где M (1/z (A)A) – молярная масса эквивалента А,
M (1/z (B)B) – молярная масса эквивалента В
- нужно ввести массовые доли элементов А и В в составе сложного вещества АхВу.
- как показано выше, z (A) = m , z (B) = n .
Поделим z(A) на z(B): = . Учитывая, что x m = y n , найдём отношение :
= , следовательно = .
Выразим молярные массы А и В через молярные массы эквивалентов:
M (A) = z (A)*M (1/z (A)A),
M (B) = z (B)*M (1/z (B)B).
Подставим в формулу: = = записанные выражения, а отношение эквивалентных чисел выразим через отношение индексов, получим математическое выражение закона эквивалентов:
= = . (2)
Используем эту формулу для решения задачи: подставим значение молярной массы эквивалента водорода и массовые доли элементов:
= .
Отсюда вычислим молярную массу эквивалента углерода в этом веществе:
M (1/z(C)C) = 5 г/моль.
Затем определим эквивалентное число углерода в этом веществе:
= = .
Значит, степень окисления углерода в углеводороде равна -12/5.
Определим его формулу: Сх-12/5 Ну+1;
=1*у;
х : у = 5 : 12,
значит, простейшая формула С5Н12.
Если по условию задачи надо определить формулу бинарного соединения, образованного неизвестным элементом, понятие “эквивалент” можно весьма успешно использовать для её решения.
Задача 3. Определить формулы двух оксидов одного и того же элемента, если его массовая доля в этих оксидах равна 88,11% и 84,75%. Этот элемент образует также фторид, содержащий 32,47% фтора по массе.
Решение
Вычислим эквивалент кислорода в оксидах, учитывая, что степень окисления кислорода равна -2:
z (O) = 2;
М (1/2 О) =
Используя формулу (2), вычислим молярную массу эквивалента неизвестного элемента R в первом оксиде:
; M (1/z (R)R) = 89.28 г/моль.
Далее предположим, что эквивалентное число элемента R в первом оксиде выражается целым числом, и методом подбора определим молярную массу элемента, учитывая, что:
M (R) = z (R) * M (1/z (R)R) получим таблицу 1:
Таблица 1
z (R) M (R) элемент 1 59,28 —- 2 118,6 Sn 3 177,8 —- 4 237,1 Np 5 296,4 —-
Предположим, что число z элемента R во втором оксиде также выражается целым числом, и проведём аналогичные вычисления для второго оксида:
;
Таблица 2
элемент 1 44,46 —- 2 88,92 —- 3 113,4 —- 4 177,78 Hf 5 296,4 Fr
Вычислим молярную массу эквивалента элемента R во фториде и, затем, проведём вычисления аналогично тем, которые были сделаны для оксидов:
;
.
Таблица 3
z2(R) M2(R) элемент 1 39,52 —- 2 79,04 —- 3 118,6 Sn 4 158,1 —- 5 197,6 —- 6 237,1 Np
Из данных таблицы 3 следует, что неизвестным
элементом может быть нептуний, так как фторида
трёхвалентного олова не существует. Тогда первым
оксидом, в котором массовая доля элемента равна
88,11%, может быть NpO2. В то же время вычисления
по второму оксиду дают один реальный ответ:
гафний (оксид Fr2O5 не существует). Как
устранить это противоречие?
Тогда первым
оксидом, в котором массовая доля элемента равна
88,11%, может быть NpO2. В то же время вычисления
по второму оксиду дают один реальный ответ:
гафний (оксид Fr2O5 не существует). Как
устранить это противоречие?
Можно предположить, что во втором оксиде элемент имеет дробную степень окисления и эквивалентное число z (R) во втором оксиде дробное. Исходя из этого предположения, определим эквивалентное число z1 (R), а, затем, формулу второго оксида:
z1 (R) = Rx+16/3Oy-2; ;
Для определения формулы второго оксида можно использовать формулу (1):
= 3 : 8.
Таким образом, формула второго оксида Np3O8.
Решение задач с использованием “правила креста”
“Правило креста” знакомо учащимся с уроков
математики. Я приучаю своих учеников при
химических расчётах, там, где это возможно,
использовать это правило. Таких возможностей
достаточно много, особенно при расчётах,
связанных с приготовлением растворов заданной
концентрации. Для этого “правило креста” можно
записать следующим образом:
Я приучаю своих учеников при
химических расчётах, там, где это возможно,
использовать это правило. Таких возможностей
достаточно много, особенно при расчётах,
связанных с приготовлением растворов заданной
концентрации. Для этого “правило креста” можно
записать следующим образом:
Здесь А и В – концентрации исходных веществ, С – концентрация полученного раствора.
Если концентрация растворов выражена в процентах, то правило можно сформулировать так: чтобы получить (А – В) грамм раствора концентрации С%, необходимо взять (С – В) грамм раствора концентрации А% и (А – С) грамм раствора концентрации В%.
А и В могут принимать значения от 0 (чистый растворитель) до 100 (чистое растворяемое вещество), при этом С всегда будет больше А, но меньше В.
Если концентрация растворов выражена в моль/л,
то это правило можно сформулировать так: чтобы
получить (А – В)мл (или л) раствор концентрации С
моль/л, необходимо взять(С-В)мл (или л)раствора
концентрации А моль/л и (А-С)мл (или л) раствора
концентрации В моль/л.
Применение “правила креста” позволяет упростить решение задач и избежать промежуточных вычислений, в которых очень часто допускаются ошибки, а также сократить время на решение задачи.
Рассмотрим возможности применения “правила креста” на конкретных примерах.
Задача 4. Определить массу поваренной соли и объём дистиллированной воды, необходимых для получения 230 г 12%-ного раствора соли.
Решение:
Составим схему для применения “правила креста”, дополнив её исходными данными: х – масс соли, у – масса воды:
Для определения х и у составим и решим две пропорции:
х = 27,60 г;
Ответ: V (H2O) = 202.4 мл.
Задача 5. Определить объём воды (в мл), который нужно добавить к 400 мл 18%-ного раствора соли плотностью 1,132 г/мл, чтобы получить 11%-ный раствор.
Решение:
Масса исходного раствора составляет: m = p * V;
m = 1. 130 * 400 = 152.8 (г).
130 * 400 = 152.8 (г).
Составим схему и найдём объём воды:
Ответ: V (H2O) = 288.15 мл.
Компьютерные программы для обучения решению задач по химии
Одно из универсальных средств для образования – компьютерные обучающие программы, которые обладают самыми широкими возможностями. Идея использования компьютеров при обучении школьников решению химических задач не нова и нашла отражение даже в названиях ряда задачников и пособий для учителей. У меня в этом плане имеются прекрасные, если не сказать уникальные, возможности: на ряду с химией я ещё преподаю и информатику. В моём распоряжении не только компьютерный кабинет. Имею приличный опыт использования компьютера в обучении учащихся химии, в том числе и решению химических задач.
Практические задачи по химии
Практические задачи по химииДом > Введение в хим. или орг/биохимия > Проблемы с химией | Контакт
Введение
Практические тесты
Образцы испытаний
Домашнее задание
Рабочие листы для самопомощи по избранным вводным темам химии
Нижняя часть страницы; обратные ссылки и контактная информация
Введение
Я пишу наборы задач, рабочие листы, учебные пособия в разное время. В каждом случае существует некоторый исходный контекст, который делает конкретный документ «актуальным». Затем все меняется, и я накапливаю вещи. На этой странице перечислены различные вещи, все из которых в общих чертах представляют собой наборы практических задач, с некоторым ограниченным учебным материалом, включенным в некоторых случаях.
В каждом случае существует некоторый исходный контекст, который делает конкретный документ «актуальным». Затем все меняется, и я накапливаю вещи. На этой странице перечислены различные вещи, все из которых в общих чертах представляют собой наборы практических задач, с некоторым ограниченным учебным материалом, включенным в некоторых случаях.
Эта страница может быть полезна для людей, которые просто просматривают веб-сайт в поисках практики. Студенты моих текущих курсов могут получить доступ ко всем наборам задач с этой страницы, но обратите внимание, что более полная информация по курсу может быть доступна на странице курса.
Те, кто использует материалы моего веб-сайта для самостоятельного изучения… Мы приветствуем — и поощряем — задавать мне вопросы, когда возникают трудности. (Моя контактная информация указана внизу каждой из моих веб-страниц.) Всегда полезно указать, как бы вы ответили на вопрос и почему. Это позволяет мне ответить на то, что вы думаете, позволяет мне сосредоточить свой ответ на том, где у вас возникли проблемы. Кроме того, это дает мне представление об уровне, на котором вы отвечаете на вопрос, который может варьироваться в зависимости от вашего образования и уровня курса. Уровень дискурса — и ваше изучение предмета — повышается, если вы пытаетесь сосредоточиться на причинах, а не просто на ответах.
Кроме того, это дает мне представление об уровне, на котором вы отвечаете на вопрос, который может варьироваться в зависимости от вашего образования и уровня курса. Уровень дискурса — и ваше изучение предмета — повышается, если вы пытаетесь сосредоточиться на причинах, а не просто на ответах.
В чем разница между различными видами материалов, перечисленных здесь в разных разделах? По каждому разделу есть общий описательный материал. Тем не менее, я предлагаю посетителям посмотреть материалы разных типов и решить, что подходит для их ситуации. «Викторину» можно использовать как «рабочий лист», если вам это подходит, или наоборот; у обоих проблемы с работой и пояснительным материалом, просто в разных аранжировках.
верх страницы
Практика викторины
Введение в химию (X11)
Введение в органическую и биохимию (X402)
верх страницы
Образцы тестов
Это настоящие тесты из предыдущих классов. Они размещены здесь с ключами ответов.
Введение в химию (X11)
Введение в органическую и биохимию (X402)
верх страницы
Домашнее задание
Большинство домашних заданий для уроков химии взято из книги. Тем не менее, в некоторых случаях я предоставляю небольшие дополнительные наборы для дополнения определенных областей. Если не указано иное, они распространяются с соответствующими раздаточными материалами к главам, а также доступны здесь в виде файлов PDF. Они включают ответы.
Введение в химию (X11)
* Стехиометрия. Небольшой дополнительный набор с несколькими вопросами разной сложности на одну реакцию. Акцент заключается в том, что сбалансированные уравнения дают вам молярные отношения между химическими веществами в реакции.
* Растворы: весовые проценты и разбавление. Несколько дополнительных вопросов по паре тем, где набор книг очень ограничен. Задачи на разбавление направлены на то, чтобы вы использовали логический двухэтапный метод расчета разбавлений, как я показываю его в классе.
Введение в органическую и биохимию (X402)
* Горение. Написание сбалансированных уравнений горения органических соединений. Это для главы «алканы» курса орг/био, но также может быть полезно для студентов, изучающих общую химию.
* Реакции ароматического замещения. Этот набор фокусируется на простых одношаговых реакциях. Это для главы «ароматики» курса орг/био.
* Назовите эти химические вещества (веб-страница). Сложное упражнение, основанное на рекламе химической компании. Это лучше всего подходит для поздней части курса, когда учащиеся узнали о большинстве функциональных групп.
верх страницы
Рабочие листы для самопомощи по выбранным вводным темам химии
Перечисленные ниже предметы являются раздаточными материалами для самопомощи; большинство из них доступны в виде файлов Microsoft Word DOC или созданных из них файлов RTF или PDF. Некоторые из них изначально были написаны для самостоятельного курса, в котором различные химические расчеты освещались с помощью таких раздаточных материалов. Общий подход заключается в том, что предполагаются базовые знания по теме (то есть они предназначены для ознакомления и практики), основные вопросы представлены кратко, а практических задач много.
Общий подход заключается в том, что предполагаются базовые знания по теме (то есть они предназначены для ознакомления и практики), основные вопросы представлены кратко, а практических задач много.
Пожалуйста, дайте мне знать, если у вас возникнут проблемы с доступом к каким-либо файлам; иногда ваш комментарий — это способ, которым я узнаю, что есть проблема.
Размерный анализ Плотность Изучение химии земной коры (элементы, таблица Менделеева) Формулы ионных соединений Именование химических веществ Взаимопревращения масс-молей Решения: Молярность Решения: Процент Решения: разбавления рН; вода Сильные кислоты Слабые кислоты Буферы
Размерный анализ. Скачать диман.pdf.
Содержание файла diman.pdf:
А. Введение
B. Простые преобразования единиц измерения; идея размерного анализа
C. Многоступенчатые преобразования
D. Скорость и плотность как переводные коэффициенты
Э.Ответы
Скачать “Размерный анализ” (diman.pdf)
Плотность. Скачать плотность.pdf.
Содержание дляdensity.pdf:
А. Введение
B. Рассчитать d
C. Вычислить м
D. Вычислить V
E. Прочие проблемы
F. Больше сложности?
Г. Ответы
Скачать “Плотность” (density.pdf)
Изучение химии земной коры
Практика работы с элементами и таблицей Менделеева. Вам даны некоторые данные о содержании элементов в земной коре и заданы некоторые исследовательские вопросы.
* Рабочий лист: Изучение химии земной коры.
* На прилагаемом графике показаны данные.
* Рабочий лист и график будут открываться в новом окне в виде файла PDF. (Для использования в классе они приложены к раздаточному материалу главы 7.)
* Лист ответов для рабочего листа корки.
* (Электронная таблица включает график и таблицу, на которой он основан.)
Формулы ионных соединений.
 Скачать ionic.pdf.
Скачать ionic.pdf.Чтобы выяснить формулу ионного соединения, вам нужно 1) идентифицировать ионы, затем 2) создать нейтральное соединение из этих ионов. Этот раздаточный материал посвящен второму шагу. Основная концептуальная проблема заключается в том, что ионные соединения нейтральны. Чтобы помочь вам сосредоточиться на этом втором шаге, ионы даны здесь во всех упражнениях. Часть практики связана с воображаемыми ионами, поэтому вы не отвлекаетесь на попытки выяснить, что это за ионы.
Наименование химических веществ.
Этот рабочий лист касается названий простых неорганических соединений, либо ионных соединений, либо ковалентных соединений двух неметаллов. Чтобы определить название химического вещества, вы должны сначала решить, какой тип этого химического вещества. Этот рабочий лист поможет вам сначала классифицировать химические вещества, а затем назвать их.
Этот рабочий лист доступен как в виде веб-страницы, так и в виде файла PDF.
В любом случае ответы есть на веб-странице.
* Веб-страница: Наименование химических веществ. Включает расширенное введение и ответы с пояснениями.
* pdf-файл: Раздаточный материал по присвоению названий химическим веществам. Оригинальный раздаточный материал для занятий с кратким введением и вопросами. Используйте веб-сайт, указанный выше, для получения ответов и пояснений.
Масс-моль взаимопревращений. Скачать gmol.pdf.
Содержание файла gmol.pdf:
А. Введение
B. Взаимопревращения масс-молей: простые
C. Взаимопревращения масс-молей: сложные
Д. Ответы
Скачать “Взаимопревращения масс-молей” (gmol.pdf)
Растворы: Молярность. Скачать моляр.pdf.
Содержание для molar.pdf:
А. Введение
B. Молярность
C. Приготовление “молярных” растворов
D. Использование «молярных» растворов
E. Другие единицы измерения концентрации в молях [факультативно]
Ф.Ответы
Скачать “Решения: Молярность” (molar.pdf)
Решения: Процент. Скачать wtpc.pdf.
Содержание файла wtpc.pdf:
А. Введение
Б. Сравнения; коэффициенты; идея процента
C. Единицы «проценты»
D. Массовая доля, %(мас./мас.)
E. Объемный процент, %(об./об.)
F. Процент массы/объема, %(вес/объем)
г. м.д. и т.д.
H. Преобразование из w/w в w/v
I. Аппроксимация разбавленных водных растворов
Дж. Преобразование масс/масс или масс/объемов в моли или молярность
К. Дополнительные проблемы
Л. Ответы
Скачать “Решения: Процент” (wtpc.pdf)
Растворы: Разведения. Скачать дил.pdf.
Содержание файла dil.pdf:
A. Разведения: введение
B. Уравнение разбавления
C. Логика уравнения разбавления
D. Нужно ли «запоминать» уравнение разбавления? — Внимание студентов X11
E.Практические замечания
F. Разбавления с использованием других единиц концентрации
Г. Проблемы
H. Фактор разбавления
I. Многократные разведения; серийные разведения
Дж. Ответы
Скачать “Растворы: Разведения” (dil.pdf)
рН; вода. Скачать вода.pdf.
Оглавление для воды.pdf:
А. Введение
Б. Вода
C. [H + ] и [OH – ] могут варьироваться…
Д. … но не самостоятельно
Е. рН
F. pThis и pThat [опционально]
Г. Ответы
Скачать “pH; вода” (water.pdf)
Сильные кислоты. Скачать acidstr.pdf.
Содержание для acidstr.pdf:
А. Введение
B. Сильные кислоты: пример
C. Сильные кислоты: общие
D. Сильные основания
E. Больше проблем
F. Что, если у вас есть и то, и другое? [необязательный]
G. Нормальность [опционально]
Ч. Ответы
Скачать “Сильные кислоты” (acidstr.pdf)
Слабые кислоты. Скачать acidwk.pdf.
Содержание для acidwk.pdf:
А. Введение
B. Слабые кислоты: обзор
C. Слабые кислоты: пример; найти Ка
D. Учитывая Ka, рассчитать pH
E. Разновидности слабых кислот
F. Какое место в этой картине занимают сильные кислоты?
Г. Еще задачи и вопросы
H. Полипротоновые кислоты [кратко указано]
I. Серная кислота [кратко указано]
J. Слабые основания [кратко отмечено]
К. Ответы
Скачать “Слабые кислоты” (acidwk.pdf)
Буферы. Скачать буфер.pdf.
Содержание файла buffer.pdf:
А. Введение
Б. Обзор
C. Обратные обратимые реакции
D. Равновесие уксусной кислоты: количественный анализ
E. Обобщение… Уравнение Хендерсона-Хассельбаха
F. Выбор буфера
Г. Некоторые заблуждения
Ч. Ответы
I. Таблица буферов
Скачать “Буферы” (buffer.pdf)
Верх страницы
Другие химические материалы доступны на Страница загрузки.
Домашняя страница для Musings (информационный бюллетень — современная наука) Введение в химию (X11) Органический/биохимический (X402) Биотехнология в новостях (BITN) Молекулярная биология
Контактная информация Домашняя страница сайта
Последнее обновление: 25 июня 2019 г.
http://www.cem.msu.edu/~reusch/VirtualText/Questions/problems.htm Практические задачи по органической химии
http://www.cem.msu.edu/~reusch/VirtualText/Questions/problems.htm Практические задачи по органической химииСледующие задачи предназначены для использования студентами в качестве учебных пособий. участвует в большинстве курсов бакалавриата по органической химии. Проблемы имеют цветовую кодировку, чтобы указать, являются ли они:
1. В целом полезно,
2. Наиболее вероятно, будет полезно для студентов в течение года, а не для обзорных курсов,
3. Скорее всего, будет полезно только для студентов, изучающих курсы химии и// или отличников.
Скорее всего, будет полезно только для студентов, изучающих курсы химии и// или отличников.
В некоторых из этих задач используется приложение для рисования Molecular Editor . Чтобы попрактиковаться в использовании этого редактора, нажмите здесь.
Полное обсуждение тем, затронутых этими проблемами, доступно в Виртуальный учебник органической химии .
Следующая кнопка активирует случайное отображение проблем, связанных с реактивностью общих функциональных групп.
Большой набор задач с множественным выбором, подобных тем, которые используются в стандартизированных экзаменах, можно найти, нажав здесь.
Большинство из этих интерактивных практических задач по органической химии были разработаны профессором Уильямом
Реуш. |
Проблемы с компьютером
Практические задачи, предлагаемые здесь, в основном интерактивны и должны обеспечить полезную оценку понимания на различных этапах развития предмета.
Поскольку решение проблем необходимо для достижения эффективного освоения предмета, рекомендуется работать с большим количеством задач. Большинство учебников по органической химии содержат широкий набор подходящих задач, а также доступны сборники практических задач в мягкой обложке.
На следующих веб-сайтах можно найти хорошие сборники задач и ответов:
MIT Open CourseWare
Тесты на реакцию и резюме от Университета Тоусона
Электронные карточки Университета штата Огайо
Концептуальные вопросы Университета Висконсина
Практические задачи Калифорнийского университета в Лос-Анджелесе
Учебное пособие по стрелке
BestChoice, Университет Окленда Демонстрация может быть использована
Химический факультет
Мичиганский государственный университет
East Lansing, MI 48824
Для получения полезной коллекции учебных материалов, включая ссылки на другие сайты, посетите
Инструментарий по органической химии.


 В любом случае ответы есть на веб-странице.
В любом случае ответы есть на веб-странице.  Ответы
Ответы  Практические замечания
Практические замечания  pdf)
pdf) pdf)
pdf) Нажмите на название, чтобы получить информацию и бесплатную копию.
Нажмите на название, чтобы получить информацию и бесплатную копию.