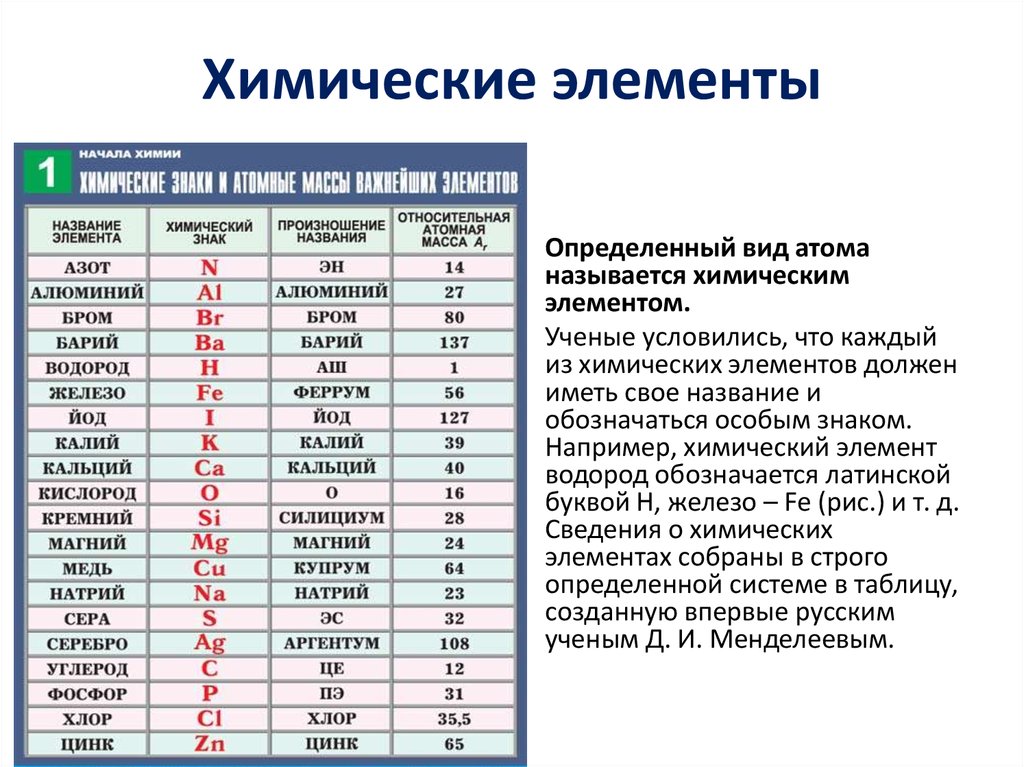
О химии простым языком
Репетиторы ❯ Книжный клуб ❯ О химии простым языком
Автор: Редакция TutorOnline
●
11.01.2021
●
Раздел: Книжный клуб
Какой бы химия ни казалась сложной, в ней всегда можно разобраться. Для этого нужно найти те книги, которые будут понятны именно вам. О разных химических процессах, элементах и металлах вы можете узнать из нашей подборки книг, написанных простым языком.
1. Сэм Кин, Исчезающая ложка
Вы когда-нибудь задумывались, сколько историй хранит в себе обычная таблица Менделеева? “Исчезающая ложка” как раз о таких историях. Автор извлекает их из таблицы одну за другой: смешные, грустные, драматичные, захватывающие. Чего только стоит история о шестнадцатилетнем Дэвиде Хане, решившем соорудить ядерный реактор в сарае на заднем дворе.
Автор извлекает их из таблицы одну за другой: смешные, грустные, драматичные, захватывающие. Чего только стоит история о шестнадцатилетнем Дэвиде Хане, решившем соорудить ядерный реактор в сарае на заднем дворе.
Это одновременно и научный шедевр, и сборник рассказов. “Исчезающая ложка” – книга из тех, что возвращает утраченный в школе интерес к предмету и будит желание самому совершить какое-нибудь открытие.
2. Ларри Гоник, Химия. Естественная наука в комиксах
Можно ли сделать книгу про химию интересной и понятной? Можно. Отличный пример – книга из серии Ларри Гоника “Естественная наука в комиксах”.
В книге рассказывается история химии (смешные шаржи на ученых делают историю более увлекательной), описывается строение атомов (симпатичные монстрики делят между собой электроны), рассматриваются различные энергетические ситуации (веселые персонажи измеряют температуру баночек-скляночек).
3. Илья Леенсон, Занимательная химия
Автор этой книги, доцент химического факультета МГУ, написал ее для всех любознательных людей. “Наука начинается с удивления”, – сказал Аристотель. Прочитав сей труд, вы не раз удивитесь. А заодно узнаете, как работают в автомобиле подушки безопасности, из каких металлов делают монеты разных стран, какие бывают в химии рекорды, почему лекарство может оказаться ядом, как химики разоблачают подделки старинных картин, как журнальная шутка лишила победы “знатоков” в известной телевизионной игре “Что? Где? Когда?”, а также многое другое. Так что книга будет интересна и “дилетантам”, и профессиональным химикам – каждый найдет в ней для себя что-то новое и занимательное.
4.
 Али Бузари, Ингредиенты
Али Бузари, Ингредиенты
Сколько бы ни было ингредиентов в рецепте, все равно все сводится к семи базовым элементам: воде, сахарам, белкам, жирам, углеводам, минералам, газам. Именно от них зависит, получится ли блюдо вкусным и красивым.
В “Ингредиентах” шеф-повар и специалист по биохимии Али Бузари рассказывает о характере основных составляющих пищи. Понимая принципы взаимодействия элементов, вы сможете легко разобраться в кулинарии, готовить без рецептов и всегда быть уверенными в идеальном результате.
Эта книга идеально подойдёт тем, кто любит готовить.
5. Елена Качур, Увлекательная химия
“Увлекательная химия” учит нас совершать химические превращения. Хотя этому и учиться не надо, ведь мы регулярно этим занимаемся, готовя себя чай с лимоном, разводя костер, или добавляя щепотку соды в тесто.
С помощью этой энциклопедии ребенок познакомится с химией, узнает, как она появилась, кто такой Менделеев, и почему он стал знаменитым на весь мир. А также познакомится с химическими элементами и научится проводить опыты в домашних условиях (естественно, предварительно ознакомившись с техникой безопасности, и под строгим надзором взрослых). Увлекательно, познавательно и интересно.
6. Александр Иванов, Игорь Гордий, Химические элементы
Хотите узнать, чем пахнет бром и как получил свое имя полоний? Вы обратились по адресу =)
Александр Иванов и Игорь Гордий – молодые учёные, знающие про мышьяк, фтор и радиоактивный уран столько, сколько не расскажет ни один школьный учитель. Ведь школьная программа охватывает далеко не всё, и как раз то, что она не охватывает, наиболее интересно.
7. Аркадий Курамшин, Жизнь замечательных веществ
Прочитав книгу, вы узнаете настоящие истории, связанные с открытием химических веществ и обнаружением их полезных свойств. Правда гораздо интереснее придуманных легенд. Если вы знаете, что такое иррациональный страх перед химией, эта книга поможет вам от него избавиться раз и навсегда.
Увлекательно поданная информация об истории и происхождении разного рода веществ будет полезна и интересна и школьнику, и взрослому.
© blog.tutoronline.ru,
при полном или частичном копировании материала ссылка на первоисточник обязательна.
Физика
Курсы физики для студентов нефизических специальностей
Математика
Курсы по математике 9 класс
Математика
Алгебра 8 класс
Информатика и ИКТ
Курсы по информатике для студентов
Английский язык
Подготовка к ЕГЭ по английскому
Программирование
Основы программирования на С++
Информатика и ИКТ
Курс подготовки к ОГЭ по дисциплине «Информатика» для учащихся базовой школы (9 класс)
Математика
Курсы по геометрии 7 класс
Science Slam: о химии простым языком
В одном из популярных клубов г. Томска состоялся второй научный Stand Up компании СИБУР.
Томска состоялся второй научный Stand Up компании СИБУР.
Семь ученых, пятеро из которых работают в СИБУРе, в неформальной атмосфере, доступно и интересно рассказали о своих исследованиях в области химии. У каждого слэмера было всего 10 минут, чтобы донести свою идею широкой публике, а победителя выбирал зал: чем громче аплодисменты, тем больше шансов на победу. Метод определения громкости прост – в ход пошёл шумомер.
Участниками мероприятия стали Василий Колесник – начальник отдела разработки инновационных продуктов Химического завода им. Л.Я. Карпова, Андрей Критченков – научный сотрудник лаборатории природных полимеров ИВС РАН, а также представители СИБУРа: Максим Кит – машинист гранулирования пластических масс «Томскнефтехима», Александр Литвинов-главный эксперт «Корпоративного НИОКР», Константин Вернигоров – руководитель направления дирекции «Базовые полимеры» и две прекрасные девушки, выступившие в тандеме Ольга Китаева – главный специалист «Корпоративного НИОКР» и Ксения Хрусталева – специалист отдела поиска новых проектов НИОСТа.
Каждый учёный постарался сделать своё выступления не только информативным и содержательным, но и поэтичным, забавным, а некоторые даже дерзким. В конце каждому слэмеру зрители задавали вопросы и спорили с ним на научные темы.
Главный приз в борьбе умов, боксерские перчатки, получили «Светлые головы»-Ксения и Ольга. Девушки рассказали всем присутствующим, что такое запах, что общего у Chanel №5 и освежителя воздуха, провели прямые включения из носа человека и желудка кита.
«Химия, как наука, имеет сложную методологию, непонятные простому обывателю термины. И это делает ее закрытой для обычного человека. Данный формат мероприятия помогает наладить связи между наукой и обществом. Через шутки, легкую и понятную подачу информации ученые раскрывают суть своих идей. Это хороший способ популяризации науки», – поделился директор «Корпоративного НИОКР» Дмитрий Стёпкин.
Подписаться на новости
Имя
Газопереработка и инфраструктура
- АО «СибурТюменьГаз» (100%)
- ООО «Запсибтрансгаз» (100%)
НЕФТЕХИМИЯ
ОЛЕФИНЫ И ПОЛИОЛЕФИНЫ
- ООО «Томскнефтехим» (100%)
- ООО «РусВинил» (50%) (СП с SolVin)
- ООО «СИБУР-Кстово» (100%)
- OOO «НПП «Нефтехимия» (50%)(СП с группой «Газпром нефть»)
- ООО «ПОЛИОМ» (50%) («СП с группой «Газпром нефть»)
- ОOО «БИАКСПЛЕН» (100%)
- OOO «ЗапСибНефтехим» (100%)
- Амурский ГХК (инвестиционный проект)
- Казаньоргсинтез (64%) (через ТАИФ (100%))
ЭЛАСТОМЕРЫ
- АО «Воронежсинтезкаучук»(100%)
- АО «Красноярский завод синтетического каучука» (100%)(в структуре СП с SINOPEC)
- Reliance Sibur Elastomers Private Limited (25,10%)(СП с Reliance Industries Limited)
- Нижнекамскнефтехим (83%) (через ТАИФ (100%))
ПЛАСТИКИ
- АО «СИБУР-Нефтехим» (100%)
- АО «Сибур-Химпром» (100%)
- АО «ПОЛИЭФ» (100%)
- АО «Сибур-ПЭТФ» (100%)
ЭНЕРГЕТИКА
- ТГК-16 (100%) (через ТАИФ (100%))
УСЛУГИ ПО ПОДДЕРЖКЕ БИЗНЕСА
- ООО “Нефтехимическая транспортная компания” (50%) (СП с АО “СГ-Транс”)
- OOO «УК «СИБУР-Портэнерго» (100%) (перевозки)
- SIBUR International GmbH (100%) (экспорт)
- OOO «НИОСТ» (100%) (НИОКР)
- «Центр обслуживания бизнеса, ОП в Нижнем Новгороде» (100%) (cервисный центр)
- ООО «СИБУР Диджитал» (100%)
- АO «Сибурэнергоменеджмент» (100%) (энергоснабжение)
- Представительство СИБУРа в КНР
- ООО «СК-Ремстроймонтаж» (строительство и ремонт)
- ООО «Корпоративный центр оздоровления «СИБУР-Юг»»
8 простых химических экспериментов, которые ваши дети могут провести дома
Химия — увлекательный предмет. И есть ли лучший способ учиться, чем с помощью научных экспериментов?
И есть ли лучший способ учиться, чем с помощью научных экспериментов?
Вот 8 практических научных экспериментов для детей во время школьных каникул. Эти эксперименты отлично подходят для детей старшего возраста или с помощью мамы или папы. Их можно приготовить дома из продуктов, которые уже есть под рукой.
Безопасность: Это занятие требует использования ножа, ядовитых химикатов и горячей воды. Попросите взрослого помочь вам. Всегда следуйте рекомендациям по безопасности продуктов, которые вы используете.
Всё, что мы едим и пьём, имеет кислую среду, а то, что мы используем для уборки, является щелочным. Это связано с тем, что основные вещества имеют неприятный вкус, но чистящее средство обычно должно быть основным, чтобы удалить грязь и жир.
Кислотные или щелочные вещества вызывают жжение в глазах, поэтому детский шампунь сделан нейтральным.
Кислоты представляют собой очень распространенную группу химических соединений, многие из которых встречаются в природе. Кислоты могут быть сильными и слабыми.
Кислоты могут быть сильными и слабыми.
Лимонная кислота, которая естественным образом содержится в лимонах, является слабой кислотой. Соляная кислота (используется для пайки) и серная кислота (аккумуляторная кислота) являются очень сильными кислотами.
Основания (часто называемые щелочами) представляют собой другую группу химических соединений, химические свойства которых отличаются от свойств кислот. Когда основания и кислоты добавляются вместе, они нейтрализуют свойства друг друга.
Мы описываем, являются ли вещества кислыми, щелочными или нейтральными, используя шкалу, называемую шкалой рН. Шкала рН колеблется от нуля до 14. Вещество с рН:
Кислоты и основания можно обнаружить с помощью группы химических соединений, называемых кислотно-щелочными индикаторами. Одним из первых известных природных индикаторов был тип лишайника, называемый лакмусом. (Лишайники — это наросты, похожие на растения, которые часто встречаются на камнях и коре деревьев.) Лакмус становится красным в присутствии кислоты или синим в присутствии основания.
Большинство индикаторов, используемых сегодня для обнаружения кислот и оснований, созданы руками человека. Однако многие растительные пигменты, такие как краснокочанная капуста, которую вы использовали, содержат химические вещества, действующие как кислотно-щелочные индикаторы.
Узнайте больше о газах, создав фонтанчик для безалкогольных напитков из леденцов/конфет. Какой приятный способ узнать больше о химии!
Вам понадобится
- Рулет с леденцами/конфетами (хорошо подойдут мятные леденцы/конфеты)
- Бутылка безалкогольного напитка 2 л
- Бумага или трубочка для леденцов/конфет
- Открытая площадка
Что делать
Занимайтесь этим на открытом воздухе.
- Откройте бутылку с безалкогольным напитком и поставьте бутылку на землю, чтобы она не опрокинулась.
- Сверните бумагу в цилиндр, ширина которого достаточна для того, чтобы леденцы проходили сквозь него.
- Поместите палец на дно рулона и попросите друга положить леденцы в бумажную трубку.

- Держите трубку с леденцами прямо над бутылкой и уберите палец, чтобы все леденцы упали прямо внутрь. Вам нужно бросить все леденцы в бутылку одновременно.
- Как только вы это сделаете, отойдите от бутылки как можно быстрее.
Советы
- Диетический безалкогольный напиток работает так же хорошо и менее липкий, так как не содержит сахара.
- Апельсиновый безалкогольный напиток не всегда работает. Так же как и Соло, так как он легко шипит.
- Поэкспериментируйте с различными видами леденцов – в этом упражнении использовались мятные конфеты Kool Mints. Попробуйте Mentos или другие леденцы, покрытые сахаром.
- Поэкспериментируйте с безалкогольным напитком комнатной температуры или из холодильника.
Что происходит?
Безалкогольный напиток пенится, потому что в бутылку под давлением нагнетается углекислый газ.
Пока вы не откроете бутылку, газ в основном остается растворенным в жидкости и не может расширяться, образуя пузырьки, которые газ будет делать, когда газ не находится под давлением.
Если встряхнуть бутылку, а затем открыть ее, газ вырвется со свистом, забрав с собой немного безалкогольного напитка. Добавление чего-либо в безалкогольный напиток приводит к образованию и выходу большего количества пузырьков.
Попробуйте размешать безалкогольный напиток ложкой, он станет менее шипучим.
Леденцы очень быстро создают большую площадь поверхности, что означает, что пузырьки газа образуются очень быстро в огромных количествах.
Вам нужны негладкие поверхности, чтобы газ мог образовываться.
И песок, и сахар имеют одинаковый эффект при добавлении в безалкогольный напиток.
Когда вы смотрите на стакан с безалкогольным напитком, обычно видно лишь несколько потоков пузырьков, исходящих из определенных точек на стекле, где поверхность неровная.
Иногда вы видите поток пузырей, исходящий из середины, и, если внимательно присмотреться, часто можно увидеть пылинку с пузырьками, выходящую с ее конца.
Место, где начинают формироваться пузырьки, называется центром зарождения.
Когда леденец растворяется, он образует сотни точек зародышеобразования, которые представляют собой крошечные ямки на поверхности леденца, где могут образовываться дополнительные пузырьки углекислого газа.
Когда весь этот газ высвобождается, он подбрасывает все содержимое бутылки вверх, создавая невероятный взрыв безалкогольного напитка.
Сделайте бомбочки для ванны своими рукамиСледуйте этим инструкциям, чтобы сделать бомбочки для ванны своими руками и узнать о науке, развлекаясь в ванне!
Вам понадобится
пищевой краситель/краситель
лепестки цветов или блестки для тела
масло сладкого миндаля
ароматическое масло, такое как масло лаванды
10 столовых ложек двууглекислой соды
3 столовые ложки лимонной кислоты
2 большие миски
1 большой противень для маффинов
1 небольшая стеклянная банка
резиновые перчатки
ложка
Что делать
Смажьте стенки и дно большой формы для маффинов небольшим количеством миндального масла.

Поместите лимонную кислоту и соду в большую миску. Хорошо перемешайте ингредиенты, чтобы получилась базовая смесь.
Зачерпните примерно полстакана этой смеси и положите ее в другую миску. Из этого количества получится одна-две бомбочки для ванны (в зависимости от размера отверстий в лотке для маффинов). Вы также можете использовать старые пластиковые контейнеры или что-нибудь, что будет держать форму.
Добавьте лепестки цветов или глиттер для тела в базовую смесь.
В небольшой стеклянной баночке смешайте 6 капель ароматического масла, 5 чайных ложек масла сладкого миндаля и примерно 10 капель пищевого красителя.
Постепенно влейте масляную смесь в полстакана базовой смеси. Надев резиновые перчатки, быстро перемешайте все вместе. Смесь готова, когда она держится в руках и не слишком крошится.
Выложите смесь ложкой в форму для маффинов. Плотно прижмите его.

Вы можете использовать оставшуюся смесь с другими видами ароматических масел или пищевых красителей, чтобы сделать больше бомбочек для ванн.
Оставьте бомбы в лотке на несколько дней.
Аккуратно переверните бомбочки для ванны, чтобы извлечь их из формочек.
Набери ванну, запрыгни и сбрось бомбу. Смотри, это шипит!
Что происходит?
Когда бомбочка для ванны растворяется в воде, происходит химическая реакция между лимонной кислотой и бикарбонатом натрия. Результат называется цитратом натрия. В ходе реакции выделяется углекислый газ. Это вызывает «шипение», которое вы видите, как в газированной воде.
В ходе этой реакции высвобождается масло сладкого миндаля. Он образует тонкий слой на вашей коже, который может помочь увлажнить ее. Лавандовое масло для аромата.
Подождите, в библиотеке Reading Eggs есть еще книги с научными экспериментами!
Узнайте, что нового здесь Как приготовить щербетСледуйте этим инструкциям, чтобы вызвать кислотно-щелочную реакцию во рту!
Вам понадобится
- сахарная пудра
- лимонная кислота
- сода двууглекислая
- ароматизированные/ароматизированные желейные кристаллы
- чайная ложка
- десертная ложка
- маленькая чаша для смешивания
- маленькая сумка с защелкой.

Что делать
Для приготовления щербета вам потребуется:
- добавить в чашу 1 чайную ложку кристаллов лимонной кислоты без горки
- добавьте в миску 1 чайную ложку без горки соды
- теперь добавьте 3 десертные ложки сахарной пудры с горкой
- добавить не менее 2 десертных ложек без горки кристаллов желе (или больше по вкусу)
- положите небольшое количество, около половины чайной ложки на язык
- после дегустации вам может понадобиться изменить ингредиенты. Если он слишком горький, добавьте больше сахара, если шипения недостаточно, вам может понадобиться добавить либо соду, либо лимонную кислоту. Убедитесь, что вы добавляете только в небольших количествах, помните, что вы всегда можете добавить больше, но очень трудно удалить часть.
Что происходит?
Вы только что вызвали кислотно-щелочную реакцию во рту. Когда вы смешиваете кислоту (в данном случае лимонную кислоту) и щелочь (бикарбонат соды) со слюной, они смешиваются вместе, образуя газ в виде множества крошечных пузырьков.
Это называется кислотной реакцией, и именно она придает щербету шипение. На самом деле вы чувствуете ощущение пузырьков углекислого газа на языке. Это те же пузырьки, что и в газированных напитках.
Сахарная пудра необходима для придания сладости, так как лимонная кислота и бикарбонатная сода довольно кислые. Лимонная кислота — одна из кислот, содержащихся в лимонах, апельсинах и лаймах. Именно поэтому их называют «лимонными фруктами».
Другая кислота в лимонах и других цитрусовых фруктах называется аскорбиновой кислотой. Это широко известно как витамин С. Кристаллы желе просто добавляют аромат.
Резиновое яйцоСледуйте этим инструкциям, чтобы заставить яйцо подпрыгивать, изучая химические реакции.
Вам понадобится
- яйцо вкрутую со скорлупой
- стакан уксуса.
Что делать
Чтобы яйца подпрыгивали, вам потребуется:
- Поместите яйцо в уксус – вы должны увидеть, как на яйце начнут образовываться пузыри.

- Оставьте яйцо в покое хотя бы на сутки. Вы должны увидеть замечательную форму пены.
- Выньте яйцо из уксуса и промойте его водой. Скорлупа сотрется.
- Ткните яйцо пальцем и осторожно сожмите его.
Что происходит
Уксус или разбавленная уксусная кислота «съедает» карбонат кальция в яичной скорлупе, оставляя только внутреннюю оболочку или кожу яйца. Поскольку карбонат кальция делает скорлупу твердой, яйцо, пропитанное уксусом, кажется мягким и эластичным.
При соединении карбоната кальция (яичной скорлупы) и уксусной кислоты (уксуса) происходит химическая реакция с выделением углекислого газа. Вот почему вы видите пузыри.
Химическая реакция продолжается около суток, пока не будет израсходован весь карбонат кальция в яйце. Карбонат кальция содержится в яичной скорлупе, морских раковинах, известняке и многих других материалах.
Давайте подробнее рассмотрим химическую реакцию. Формула карбоната кальция — CaCO 3 , а уксусной кислоты — CH 2 COOH.
Итак, реакция такова: CaCO 3 + CH 2 COOH -> Ca 2+ (в виде соли) + H 2 О + 2CO 2 .
Ионы кальция (Ca 2+ ) свободно плавают в растворе. Ионы — это атомы или молекулы, которые имеют электрический заряд из-за потери или приобретения электронов.
Области применения
Известняк представляет собой осадочную горную породу, состоящую в основном из карбоната кальция. Обычно он белый, но может быть окрашен примесями; оксид железа делает его коричневым, желтым или красным, а углерод делает его синим, черным или серым. Текстура варьируется от грубой до тонкой.
Большинство известняков образовались в течение тысячелетий из скелетов морских беспозвоночных. Важными разновидностями известняка являются мергель, мел, оолит, травертин, доломит и мрамор.
Кислотный дождь вызывает реакцию, подобную той, что описана в этом упражнении. Один из видов кислотных дождей может происходить из-за загрязнения воздуха, вызванного сжиганием топлива, содержащего атомы серы, которые при сгорании выделяют сернистый газ.
Когда диоксид серы смешивается с дождем, он превращается в слабую серную кислоту. Когда кислотный дождь попадает на известняк, он медленно распадается, как это сделала яичная скорлупа. Люди используют известняк в зданиях и статуях.
Вот почему со временем кислотные дожди повреждают здания и статуи.
Если вы соберете небольшие образцы камней и бросите их в уксус, вы можете увидеть появление пузырьков, как на яйце. Наличие пузырьков указывает на то, что в образце может присутствовать карбонат кальция.
Карбонат кальция реагирует с кислотами с образованием углекислого газа, который мы наблюдаем в виде пузырьков. Это называется «кислотный тест». «Кислотный тест» — один из многих тестов, которые геологи используют для определения подлинности образца горной породы.
Создание кристалловВам понадобится
- Сахар
- Соль
- Сода двууглекислая
- Теплая вода
- 3 пипетки
- 3 ложки
- 3 пластиковых контейнера или миски
- Мерный стакан
- 3 маленьких пластиковых стаканчика
- Маркер
Что делать
- Пометьте контейнеры словами «сахар», «соль» и «биуглеводы».

- Налейте полстакана теплой воды в емкость с надписью «сахар».
- Добавьте в воду ложку сахара и размешайте до растворения. Продолжайте добавлять сахар, пока он не перестанет растворяться.
- Повторите шаги 2 и 3, но с солью вместо сахара.
- Снова повторите шаги 2 и 3, но на этот раз с содовой вместо сахара или соли.
- Пометьте маленькие пластиковые стаканчики «сахар», «соль» и «биуглеводы».
- Используйте отдельные пипетки, чтобы накапать несколько капель раствора из каждого контейнера в соответствующий стаканчик. №
- Поставьте чашки в теплое солнечное место и оставьте до испарения жидкости. Что ты видишь?
Вы можете попробовать это упражнение и с другими кристаллическими веществами.
Что происходит?
Когда твердое вещество (или «растворенное») растворяется в воде до тех пор, пока не перестанет растворяться, раствор считается «насыщенным». Количество вещества, растворяющегося в воде, увеличивается с температурой. Когда раствор снова остывает до комнатной температуры, растворенного вещества в воде становится больше, чем обычно — раствор становится «перенасыщенным».
Когда раствор снова остывает до комнатной температуры, растворенного вещества в воде становится больше, чем обычно — раствор становится «перенасыщенным».
При испарении воды растворенное вещество выпадает из раствора в виде кристаллов. Это пример кристаллизации. Вы заметите, что каждый осадок образует немного разные кристаллы: они могут быть разных размеров и формы. Размер и форма кристалла зависят от ряда факторов, включая химическую формулу, температуру и давление. Как правило, кристаллы, которые образуются медленно, имеют тенденцию быть больше, чем кристаллы, которые образуются быстро.
СлизьВам понадобится
- Кукурузная мука
- Пищевой краситель
- Маленькая чаша для смешивания
- Пластиковая ложка
- Вода
Что делать
- Насыпьте немного кукурузной муки в миску.
- Добавьте небольшое количество воды, пока кукурузная мука не превратится в очень густую пасту.

- Чтобы придать слизи желаемый цвет, тщательно размешайте в смеси около пяти капель пищевого красителя.
- ОЧЕНЬ медленно перемешайте слайм. Это не должно быть сложно сделать.
- ОЧЕНЬ быстро перемешайте слайм. Это должно быть почти невозможно.
- Теперь бейте свою слизь ДЕЙСТВИТЕЛЬНО сильно и быстро. Должно быть ощущение, что ты бьешь по твердому телу.
Смесь кукурузной муки и воды можно хранить в холодильнике в течение нескольких дней. Если кукурузная мука осядет, вам нужно перемешать ее, чтобы она снова хорошо работала.
Что происходит
Все, что течет, называется жидкостью. Это означает, что и газы, и жидкости являются жидкостями.
Жидкости, такие как вода, которые легко текут, имеют низкую вязкость, тогда как жидкости, такие как холодный мед, которые не так легко текут, имеют высокую вязкость.
Слизь из кукурузной муки — это особый тип жидкости, который не подчиняется обычным правилам поведения жидкости..jpeg) Когда на шлам оказывается давление, его вязкость увеличивается, а шлам из кукурузной муки становится гуще.
Когда на шлам оказывается давление, его вязкость увеличивается, а шлам из кукурузной муки становится гуще.
В какой-то момент кажется, что слизь действительно теряет свою текучесть и ведет себя как твердое тело. Слизь из кукурузной муки является примером жидкости, загущающей при сдвиге.
Противоположное происходит в жидкостях, разжижающих сдвиг; они становятся более жидкими, когда вы их перемешиваете или встряхиваете. Например, когда зубная паста находится на зубной щетке, она довольно густая, поэтому вы можете перевернуть зубную щетку вверх дном, и зубная паста не упадет.
Но если он был таким густым, когда вы пытались выдавить его из тюбика, вы никак не могли с этим справиться. К счастью, зубная паста становится более жидкой, когда вы выдавливаете ее из тюбика. К другим разбавляющим сдвиг жидкостям относятся:
- кровь
- краска
- чернила для шариковой ручки
- лак для ногтей
Несмотря на то, что существует множество жидкостей, разжижающихся и загущающихся при сдвиге, никто не имеет четкого представления о том, почему они ведут себя так, а не иначе.
Взаимодействия между атомами в жидкостях настолько сложны, что даже самые мощные в мире суперкомпьютеры не могут смоделировать происходящее. Это может стать настоящей проблемой для тех, кто проектирует машины, использующие разбавляющие сдвиг жидкости, потому что трудно быть уверенным, что они будут работать.
Сопливая слизьВам потребуется
- 1 столовая ложка неароматизированного желатина (из супермаркетов)
- ½ стакана золотого сиропа или глюкозы
- 1 столовая ложка соли
- Горячая вода
- Пищевой краситель
- Жаропрочная чаша
Что делать
- Поместите желатин и соль в миску.
- Добавьте ½ стакана сиропа.
- Добавьте ½ стакана горячей воды. Настало время добавить пищевой краситель, если вы хотите, чтобы сопли были отвратительно-зелеными или желтыми.
- Все смешать и охладить в холодильнике 30 минут.
- Проведите вилкой по сопливой смеси, чтобы посмотреть, как она выглядит.
 Ваша слизь будет становиться все гуще и гуще по мере остывания, если она слишком густая, вы можете добавить больше воды.
Ваша слизь будет становиться все гуще и гуще по мере остывания, если она слишком густая, вы можете добавить больше воды.
Что происходит?
Вы только что сделали реалистичную модель собственных соплей. Слизь состоит из воды, эпителиальных (поверхностных) клеток, мертвых лейкоцитов (лейкоцитов), муцинов (крупных белков) и неорганических солей. Ваша домашняя слизь содержит воду, соль и белки (желатин — это животный белок, обычно изготавливаемый из говяжьей или свиной кожи и копыт), почти как настоящая слизь.
Желатин растворяется в горячей воде, образуя густой раствор, но не растворяется (не растворяется) в холодной воде. При охлаждении частицы набухают, превращаясь в желеобразную слизь.
Применение
Слизь играет важную роль в организме. В вашем носу он задерживает пыль и все остальное нежелательное в воздухе. Слизь высыхает вокруг частиц, которые затвердевают, и это означает, что она может быстро выйти из вашего тела, когда вы сморкаетесь.
Это ваша слизистая оболочка, которая выстилает сопли внутри вашего носа и дыхательной системы. Самые наружные клетки этой мембраны производят густую слизистую жидкость.
Вы можете подумать, что слизь находится только в вашем носу, но знаете ли вы, что она также находится во рту, легких, желудке и кишечнике!
При простуде, инфекции верхних дыхательных путей, ваше тело вырабатывает намного больше слизи, чем обычно, для выведения шлаков. Когда вы больны, ваша слизь может изменить цвет/цвет на желтый или зеленый из-за захваченных бактерий, вирусных частиц и лейкоцитов – причин вашего тела, борющихся с вирусной или бактериальной инфекцией.
Ссылка:
Эти эксперименты проводятся нашими партнерами из CSIRO.
Хотите повысить грамотность или уверенность и навыки вашего ребенка в математике?
Explore Reading Eggs, Mathletics and Mathseeds (для младших школьников)
1.2: Базовая химия — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 233971
- Кевин Ахерн, Индира Раджагопал и Таралин Тан
- Университет штата Орегон
Источник: BiochemFFA_1_2.
 pdf. Весь учебник доступен бесплатно у авторов по адресу http://biochem.science.oregonstate.edu/content/biochemistry-free-and-easy
pdf. Весь учебник доступен бесплатно у авторов по адресу http://biochem.science.oregonstate.edu/content/biochemistry-free-and-easy«Органическая химия — это химия соединений углерода. Биохимия — это химия соединений углерода, которые ползают» — Майкл Адамс.
Чтобы понимать биохимию, нужно иметь хотя бы базовые знания по органической и общей химии. В этом кратком разделе мы дадим краткий обзор простых понятий, необходимых для понимания клеточной химии. Химия — это химия, будь то в клетке или вне ее, но биологическая химия — это особое подмножество органической химии, которое часто включает в себя огромные макромолекулы и происходит в водной среде клетки.
Химические связи: ионные и ковалентные связи
Атомы состоят из ядра (образованного нейтронами и протонами) и электронов, движущихся вокруг ядра. В нейтральном атоме (элементе) количество электронов и протонов равно (атом имеет нулевой суммарный заряд). Правило октетов предусматривает, что атомы реагируют с образованием соединений, пытаясь подражать количеству электронов благородного газа (группа 18), ближе к их местоположению в периодической таблице; то есть атомы любят быть окруженными 8 электронами (исключением является гелий только с двумя электронами).
 Чтобы выполнить правило октета, у атомов есть два варианта: они могут либо передавать электроны, либо делиться электронами.
Чтобы выполнить правило октета, у атомов есть два варианта: они могут либо передавать электроны, либо делиться электронами.Ионная связь возникает, когда металлический элемент (слева в таблице периодов) передает электрон неметаллическому элементу (справа в таблице периодов), образуя катион и анион соответственно. Эти ионов имеют противоположные заряды, поэтому они притягиваются друг к другу, что приводит к образованию ионного соединения. Из-за электростатического притяжения между зарядами ионов ионные соединения имеют очень высокие температуры плавления и кипения. и они формируют кристаллы при комнатной температуре. Образование хлорида натрия является типичным примером ионного соединения.
Рисунок 1.2.1. Образование ионного соединения. Изображение Брюса Блауса, CC BY-SA 4.0, с Wikimedia Commons
Еще одна важная характеристика ионных соединений заключается в том, что многие из них растворимы в воде благодаря межмолекулярному взаимодействию, называемому ион-диполь (см.
 ниже). Когда ионы в ионном соединении вступают в контакт с полярным растворителем, таким как вода, ионы могут взаимодействовать с этим полярным растворителем, и, как следствие, ионное соединение распадается, образуя ионы в растворах. Этот процесс называется диссоциация . Поскольку ионы в растворе могут свободно перемещаться, растворы ионных соединений могут проводить электричество, поэтому их называют электролитами 90 093. Высокополяризованные ковалентные соединения (такие как HCl) также могут подвергаться диссоциации в воде. В этом случае процесс называется ионизацией . При ионизации ион водорода (H+) оставляет свой электрон при выходе (оставляя после себя отрицательный заряд на Cl-).
ниже). Когда ионы в ионном соединении вступают в контакт с полярным растворителем, таким как вода, ионы могут взаимодействовать с этим полярным растворителем, и, как следствие, ионное соединение распадается, образуя ионы в растворах. Этот процесс называется диссоциация . Поскольку ионы в растворе могут свободно перемещаться, растворы ионных соединений могут проводить электричество, поэтому их называют электролитами 90 093. Высокополяризованные ковалентные соединения (такие как HCl) также могут подвергаться диссоциации в воде. В этом случае процесс называется ионизацией . При ионизации ион водорода (H+) оставляет свой электрон при выходе (оставляя после себя отрицательный заряд на Cl-).A ковалентное соединение происходит, когда неметаллический элемент вступает в реакцию с другим неметаллическим элементом, что приводит к совместному использованию электрона для выполнения правила октета. Например, два атома фтора могут иметь общую пару электронов, что приводит к образованию молекулы F 2 .
 Ковалентные соединения, как правило, имеют более низкие температуры плавления и более низкие температуры, чем ионные соединения, а их физические свойства (точка плавления, точка кипения, растворимость и т. д.) зависят от силы сил, с которыми разные молекулы взаимодействуют друг с другом. Эти силы называются межмолекулярные взаимодействия, которые, в свою очередь, связаны с разницей электроотрицательностей между атомами в ковалентной связи (и молекулярной геометрией)
Ковалентные соединения, как правило, имеют более низкие температуры плавления и более низкие температуры, чем ионные соединения, а их физические свойства (точка плавления, точка кипения, растворимость и т. д.) зависят от силы сил, с которыми разные молекулы взаимодействуют друг с другом. Эти силы называются межмолекулярные взаимодействия, которые, в свою очередь, связаны с разницей электроотрицательностей между атомами в ковалентной связи (и молекулярной геометрией)Рисунок 1.2.2. Образование ковалентной связи в молекуле фтора. Изображение Jacek FH, CC BY-SA 3.0, Wikimedia Commons.
Электроотрицательность
Электроотрицательность — это мера сродства ядра к электронам внешней оболочки (таблица 1.2). Высокая электроотрицательность соответствует высокому сродству к электронам. Электроны в ковалентной связи удерживаются ближе к ядру с большей электроотрицательностью по сравнению с ядром с более низкой электроотрицательностью.

Таблица 1.2. Электроотрицательность различных атомов Кислород 3,5 Азот 3,0 Фтор 3,9 Хлор 3,1 Водород 2,1 Углерод 2,5 Например, в молекуле HCl, где водород ковалентно связан с хлором, электроны «притягиваются» к более электроотрицательному хлору. Из-за этого у атома хлора имеется несколько больший отрицательный заряд по сравнению с водородом (который, соответственно, имеет несколько больший положительный заряд). Это неравномерное распределение заряда создает постоянный диполь 90 093 9.0094 , причем одна сторона несколько отрицательная, а другая несколько положительная.
 Из-за этого молекула описывается как полярная .
Из-за этого молекула описывается как полярная . Межмолекулярные силы
Как упоминалось выше, ковалентные молекулы могут взаимодействовать с другими молекулами посредством межмолекулярных сил. Природа этих межмолекулярных взаимодействий определяет многие свойства ковалентных соединений. Межмолекулярные силы всегда слабее химических связей.
Например, постоянные диполи в H-Cl могут взаимодействовать через диполь-дипольные взаимодействия . Это взаимодействие присутствует между всеми полярными ковалентными молекулами и обусловлено электростатическим притяжением между частичными зарядами в постоянных диполях.
Рисунок 1.2.3. Диполь-дипольное взаимодействие в хлороводороде. Изображение P.wormer, CC BY-SA 3.0, через Wikimedia Commons интенсивность электростатического притяжения настолько интенсивна, что сохраняет свое уникальное наименование. Это межмолекулярное взаимодействие известно как водородная связь .
 Водородная связь является основным типом межмолекулярных сил, присутствующих в HF, NH 3 и H 2 O. Водородные связи между молекулами воды являются результатом притяжения частичных положительных и частичных отрицательных зарядов на разных молекулах воды (рис. 1.2.4). Водородные связи могут также образовываться между атомами водорода с частичным положительным зарядом и другими сильно электроотрицательными атомами, такими как азот, с частичным отрицательным зарядом. Важно помнить, что водородные связи — это взаимодействия между молекулами (или частями молекул), а не связи между атомами, как ковалентные или ионные связи.
Водородная связь является основным типом межмолекулярных сил, присутствующих в HF, NH 3 и H 2 O. Водородные связи между молекулами воды являются результатом притяжения частичных положительных и частичных отрицательных зарядов на разных молекулах воды (рис. 1.2.4). Водородные связи могут также образовываться между атомами водорода с частичным положительным зарядом и другими сильно электроотрицательными атомами, такими как азот, с частичным отрицательным зарядом. Важно помнить, что водородные связи — это взаимодействия между молекулами (или частями молекул), а не связи между атомами, как ковалентные или ионные связи.Рисунок 1.2.4 . Водородные связи (пунктирные линии) между молекулами воды. Изображение Qwerter из чешской википедии: Qwerter. Перенесено из cs.wikipedia в Commons пользователем sevela.p. Переведено на английский Михалом Манасом (Пользователь: snek01). Векторизовано Magasjukur2, общественное достояние, через Wikimedia Commons
.
Наличие постоянных диполей в полярных молекулах, таких как вода, объясняет растворимость ионных соединений в этом растворителе. Суммарные заряды, присутствующие в ионных соединениях (катионы с положительным зарядом и анионы с отрицательным зарядом), могут очень эффективно взаимодействовать с частичными зарядами, присутствующими в молекулах диполя, посредством взаимодействия, известного как 9.0093 ион-диполь . Это взаимодействие настолько сильно, что многие ионные соединения растворяются в воде, хотя иногда взаимодействие между ионами в кристалле сильнее, чем ионно-дипольные силы, поэтому не каждое ионное соединение растворимо в воде.
Рисунок 1.2.5. Ионно-дипольные взаимодействия между ионами хлорида натрия и молекулами воды.
Связи между водородом и углеродом не образуют значительных частичных зарядов, поскольку электроотрицательность двух атомов одинакова. Следовательно, молекулы, содержащие много углерод-водородных связей, не будут образовывать водородных связей и, следовательно, плохо смешиваются с водой полярных растворителей.
 Эти соединения, для которых разница электроотрицательности между атомами равна нулю (или почти нулю), известны как неполярные ковалентные соединения . Примерами являются F 2 , O 2 , CO 2 (рассмотрите здесь линейную молекулярную геометрию) или CH 4 . В неполярных соединениях единственные возможные межмолекулярные силы возникают в результате подвижности электронов, которая может создавать неравномерное распределение заряда, при этом один атом становится временно более отрицательно заряженным, а другой атом становится более положительно заряженным. Этот тип диполей очень недолговечен, и притяжение, возникающее в результате этих диполей, очень слабое. Это взаимодействие называется Лондонские дисперсионные силы (LDF). Хотя лондонские дисперсионные силы слабы, они увеличиваются с количеством штормов, поэтому большие молекулы могут демонстрировать довольно сильную LDF.
Эти соединения, для которых разница электроотрицательности между атомами равна нулю (или почти нулю), известны как неполярные ковалентные соединения . Примерами являются F 2 , O 2 , CO 2 (рассмотрите здесь линейную молекулярную геометрию) или CH 4 . В неполярных соединениях единственные возможные межмолекулярные силы возникают в результате подвижности электронов, которая может создавать неравномерное распределение заряда, при этом один атом становится временно более отрицательно заряженным, а другой атом становится более положительно заряженным. Этот тип диполей очень недолговечен, и притяжение, возникающее в результате этих диполей, очень слабое. Это взаимодействие называется Лондонские дисперсионные силы (LDF). Хотя лондонские дисперсионные силы слабы, они увеличиваются с количеством штормов, поэтому большие молекулы могут демонстрировать довольно сильную LDF.Рисунок 1.
 2.6. Временные диполи и лондонские рассеивающие силы. Изображение OpenStax, CC BY 4.0, через Wikimedia Commons
2.6. Временные диполи и лондонские рассеивающие силы. Изображение OpenStax, CC BY 4.0, через Wikimedia CommonsНеполярные молекулы с LDF называются гидрофобными , потому что они плохо смешиваются с водой. Другие полярные соединения, способные растворяться в воде, называются гидрофильный . Молекулы, обладающие обоими характеристиками, называются амфифильными.
В соединениях с одинаковой молекулярной массой сила этих межмолекулярных сил определяется в следующем порядке:
ион-диполь > водородная связь > диполь-диполь > лондонские дисперсионные силы
Функциональные группы os изучение углеродсодержащих соединений. Эти соединения классифицируются в соответствии с особыми структурными особенностями, называемыми
функциональные группы . На рис. 1.2.7 показаны различные органические функциональные группы, распространенные в биохимии. Вы столкнетесь с этими функциональными группами, изучая пути биосинтеза и распада, которые создают и перерабатывают химические соединения, из которых состоят клетки. В дополнение к знанию названий и структур этих групп учащиеся должны иметь базовое представление о ковалентных и ионных связях.
В дополнение к знанию названий и структур этих групп учащиеся должны иметь базовое представление о ковалентных и ионных связях.Рисунок 1.2.7 . Важные функциональные группы в биохимии Изображение Алеи Ким
Ковалентные связи, как известно, являются результатом совместного использования электронов между двумя атомами. Ионные связи, напротив, образуются, когда один атом отдает электрон другому, например, при образовании хлорида натрия. Одинарные ковалентные связи могут свободно вращаться, а двойные связи — нет. Одинарные связи вокруг атома углерода расположены в тетраэдре с валентными углами 109,5° друг относительно друга, с углеродом в центре (рис. 1.19). Углерод с двойными связями образует плоскую структуру с валентными углами обычно около 120°9.0003
Окисление/восстановление органических молекул.Окисление включает потерю электронов (степень окисления увеличивается), а восстановление приводит к приобретению электронов (степень окисления уменьшается).
 Реакции окисления имеют тенденцию высвобождать энергию и являются источником энергии. Каждое окисление всегда сопровождается восстановлением, поэтому эти реакции называются окислительно-восстановительными реакциями. Это определение очень полезно при работе с неорганическими соединениями. Однако большинство молекул, встречающихся в биологических системах, являются органическими. При работе с органическими молекулами нам нужно легче идентифицировать окисление и восстановление, а не подсчитывать степени окисления. Для органических молекул реакции окисления можно понимать как получение кислорода или потерю атомов водорода. С другой стороны, реакции восстановления можно понимать как присоединение атомов водорода или потерю кислорода.
Реакции окисления имеют тенденцию высвобождать энергию и являются источником энергии. Каждое окисление всегда сопровождается восстановлением, поэтому эти реакции называются окислительно-восстановительными реакциями. Это определение очень полезно при работе с неорганическими соединениями. Однако большинство молекул, встречающихся в биологических системах, являются органическими. При работе с органическими молекулами нам нужно легче идентифицировать окисление и восстановление, а не подсчитывать степени окисления. Для органических молекул реакции окисления можно понимать как получение кислорода или потерю атомов водорода. С другой стороны, реакции восстановления можно понимать как присоединение атомов водорода или потерю кислорода.Рисунок 1.2.8. Окислительно-восстановительные реакции в органической химии. Углерод, отмеченный красным цветом, окисляется слева направо и восстанавливается справа налево.
Стереохимия
Углерод способен образовывать четыре одинарные связи (образуя тетраэдрическую структуру), и если он связывается с четырьмя различными химическими группами, их атомы могут располагаться вокруг углерода двумя различными способами, что дает энантиомеры (рис.
 1.2.9). Каждый углерод с таким свойством называется стереогенным центром или хиральным углеродом. Свойство хиральности возникает только тогда, когда к углероду присоединены четыре разные группы. Энантиомеры представляют собой стереоизомеры , которые представляют собой зеркальные отражения друг друга. Энантиомеры обладают одинаковыми химическими и физическими свойствами, но различаются по своим биологическим свойствам. Ферменты имеют очень специфическую трехмерную структуру, поэтому они могут различать стереоизомеры и энантиомеры. Напротив, молекулы, полученные химическим путем (без использования ферментов), в конечном итоге содержат одинаковое количество обоих энантиомеров, называемых рацемическая смесь .
1.2.9). Каждый углерод с таким свойством называется стереогенным центром или хиральным углеродом. Свойство хиральности возникает только тогда, когда к углероду присоединены четыре разные группы. Энантиомеры представляют собой стереоизомеры , которые представляют собой зеркальные отражения друг друга. Энантиомеры обладают одинаковыми химическими и физическими свойствами, но различаются по своим биологическим свойствам. Ферменты имеют очень специфическую трехмерную структуру, поэтому они могут различать стереоизомеры и энантиомеры. Напротив, молекулы, полученные химическим путем (без использования ферментов), в конечном итоге содержат одинаковое количество обоих энантиомеров, называемых рацемическая смесь .Рисунок 1.2.9. Энантиомеры молочной кислоты
Свободная энергия Гиббса
Химические реакции сопровождаются изменениями энергии. Эта энергия может представлять изменения тепла (энтальпия, H) или беспорядка (энтропия, S). С точки зрения энтальпии химическая реакция может сопровождаться выделением тепла (ΔH<0) или поглощением тепла (ΔH>0).
 Первая представляет собой экзотермическую реакцию, а вторая – эндотермическую реакцию. По энтропии реакция может сопровождаться увеличением (ΔS>0) или уменьшением беспорядка (ΔS<0)
Первая представляет собой экзотермическую реакцию, а вторая – эндотермическую реакцию. По энтропии реакция может сопровождаться увеличением (ΔS>0) или уменьшением беспорядка (ΔS<0)Общее изменение энергии в химической реакции может быть выражено через изменение ее свободной энергии, также известное как энергия Гиббса (G).
\[ΔG = ΔH – TΔS\]
Расчет свободной энергии Гиббса позволяет определить, будет ли реакция самопроизвольной, принимая во внимание два фактора: изменение энтальпии (ΔH) и изменение энтропии (ΔS). Изменение свободной энергии ΔG для реакции равно изменению энтальпии (\(ΔH\)) минус абсолютная температура (T), умноженная на изменение энтропии (ΔS):
\[ΔG = ΔH – TΔS\]
Отрицательное значение \(ΔG\) соответствует выделению свободной энергии. Реакции, высвобождающие энергию, называются экзергоническими , тогда как реакции, поглощающие энергию, называются эндергоническими . Экзергонические реакции являются спонтанными , тогда как эндергонические реакции являются неспонтанными.

Изменение свободной энергии Гиббса биологического стандарта (ΔG°’) соответствует ΔG процесса при стандартных условиях температуры, давления и рН = 7. Для реакции 9{o\prime}\]
Обратимые и необратимые реакции
Существует два типа химических реакций. Необратимые реакции — это реакции, для которых конверсия реагентов в продукты близка к 100%, что означает, что после того, как реакция произошла, реагентов почти не остается, и все, что мы находим в реакционном сосуде, — это продукты. Эти реакции обозначены одной стрелкой реакции:
\[aA + bB →cC + dD,\]
Необратимые реакции трудно отменить. Эту же реакцию нельзя использовать для превращения продукта в реагенты.
Химические реакции другого типа являются обратимыми. Для обратимой реакции мы используем двойную стрелку, чтобы указать, что реагенты реагируют с образованием продуктов, но в то же время продукты могут также реагировать с регенерацией реагентов:
\[aA + bB \rightleftharpoons cC + dD,\]
Через определенное время сосуд, в котором протекает обратимая реакция, достигает положения, при котором концентрации реагентов и продукта остаются постоянными, так как скорость прямой реакции равна скорости обратной реакции.
 Когда это происходит, мы говорим, что система достигла равновесия, и мы можем определить константу равновесия \(K_{eq}\), которая равна: 9{o\prime} = -RT \ln K_{eq}\]
Когда это происходит, мы говорим, что система достигла равновесия, и мы можем определить константу равновесия \(K_{eq}\), которая равна: 9{o\prime} = -RT \ln K_{eq}\]Принцип Ле Шателье устанавливает, что равновесная реакция может быть смещена в сторону реагентов или продуктов путем изменения условий реакции, например добавления продуктов или реагентов или удаления продуктов. или реагенты. Другими словами, обратимые реакции могут способствовать образованию реагентов или продуктов, в зависимости от ситуации.
Оба типа реакций, обратимые и необратимые, встречаются в биологических системах, и поэтому они играют решающую роль в поддержании и регулировании метаболического баланса.
Скорость реакции и катализ
Скорость химической реакции зависит от таких факторов, как температура и концентрация реагентов. Повышение температуры или концентрации реагентов может увеличить скорость реакции. Основным фактором, регулирующим скорость химической реакции, является ее энергия активации .
Рисунок 1.2.10 . Глицеральдегид-3-фосфатдегидрогеназа в процессе катализа. Изображение Vossman, CC BY-SA 3.0, через Wikimedia Commons Реакции с высокой энергией активации протекают медленнее, чем реакции с низкой энергией активации, независимо от того, является ли реакция очень самопроизвольной или нет. Следовательно, уменьшение энергии активации — это еще один способ увеличить скорость реакции. Вещество, способное уменьшать энергию активации реакции, называется катализатор . Поскольку катализаторы остаются неизменными в конце реакции, одна молекула катализатора может быть повторно использована во многих реакционных циклах. Белки, катализирующие реакции в клетках, называются ферментами , а рибозимы — это молекулы РНК, действующие как катализаторы.
Реакции с высокой энергией активации протекают медленнее, чем реакции с низкой энергией активации, независимо от того, является ли реакция очень самопроизвольной или нет. Следовательно, уменьшение энергии активации — это еще один способ увеличить скорость реакции. Вещество, способное уменьшать энергию активации реакции, называется катализатор . Поскольку катализаторы остаются неизменными в конце реакции, одна молекула катализатора может быть повторно использована во многих реакционных циклах. Белки, катализирующие реакции в клетках, называются ферментами , а рибозимы — это молекулы РНК, действующие как катализаторы.Авторы
Эта страница под названием 1.2: Базовая химия распространяется под лицензией CC BY-NC-SA, ее авторами, ремиксами и/или кураторами являются Кевин Ахерн, Индира Раджагопал и Таралин Тан.









 Ваша слизь будет становиться все гуще и гуще по мере остывания, если она слишком густая, вы можете добавить больше воды.
Ваша слизь будет становиться все гуще и гуще по мере остывания, если она слишком густая, вы можете добавить больше воды. pdf. Весь учебник доступен бесплатно у авторов по адресу http://biochem.science.oregonstate.edu/content/biochemistry-free-and-easy
pdf. Весь учебник доступен бесплатно у авторов по адресу http://biochem.science.oregonstate.edu/content/biochemistry-free-and-easy.jpg) Чтобы выполнить правило октета, у атомов есть два варианта: они могут либо передавать электроны, либо делиться электронами.
Чтобы выполнить правило октета, у атомов есть два варианта: они могут либо передавать электроны, либо делиться электронами. ниже). Когда ионы в ионном соединении вступают в контакт с полярным растворителем, таким как вода, ионы могут взаимодействовать с этим полярным растворителем, и, как следствие, ионное соединение распадается, образуя ионы в растворах. Этот процесс называется диссоциация . Поскольку ионы в растворе могут свободно перемещаться, растворы ионных соединений могут проводить электричество, поэтому их называют электролитами 90 093. Высокополяризованные ковалентные соединения (такие как HCl) также могут подвергаться диссоциации в воде. В этом случае процесс называется ионизацией . При ионизации ион водорода (H+) оставляет свой электрон при выходе (оставляя после себя отрицательный заряд на Cl-).
ниже). Когда ионы в ионном соединении вступают в контакт с полярным растворителем, таким как вода, ионы могут взаимодействовать с этим полярным растворителем, и, как следствие, ионное соединение распадается, образуя ионы в растворах. Этот процесс называется диссоциация . Поскольку ионы в растворе могут свободно перемещаться, растворы ионных соединений могут проводить электричество, поэтому их называют электролитами 90 093. Высокополяризованные ковалентные соединения (такие как HCl) также могут подвергаться диссоциации в воде. В этом случае процесс называется ионизацией . При ионизации ион водорода (H+) оставляет свой электрон при выходе (оставляя после себя отрицательный заряд на Cl-). Ковалентные соединения, как правило, имеют более низкие температуры плавления и более низкие температуры, чем ионные соединения, а их физические свойства (точка плавления, точка кипения, растворимость и т. д.) зависят от силы сил, с которыми разные молекулы взаимодействуют друг с другом. Эти силы называются межмолекулярные взаимодействия, которые, в свою очередь, связаны с разницей электроотрицательностей между атомами в ковалентной связи (и молекулярной геометрией)
Ковалентные соединения, как правило, имеют более низкие температуры плавления и более низкие температуры, чем ионные соединения, а их физические свойства (точка плавления, точка кипения, растворимость и т. д.) зависят от силы сил, с которыми разные молекулы взаимодействуют друг с другом. Эти силы называются межмолекулярные взаимодействия, которые, в свою очередь, связаны с разницей электроотрицательностей между атомами в ковалентной связи (и молекулярной геометрией)
 Из-за этого молекула описывается как полярная .
Из-за этого молекула описывается как полярная .  Водородная связь является основным типом межмолекулярных сил, присутствующих в HF, NH 3 и H 2 O. Водородные связи между молекулами воды являются результатом притяжения частичных положительных и частичных отрицательных зарядов на разных молекулах воды (рис. 1.2.4). Водородные связи могут также образовываться между атомами водорода с частичным положительным зарядом и другими сильно электроотрицательными атомами, такими как азот, с частичным отрицательным зарядом. Важно помнить, что водородные связи — это взаимодействия между молекулами (или частями молекул), а не связи между атомами, как ковалентные или ионные связи.
Водородная связь является основным типом межмолекулярных сил, присутствующих в HF, NH 3 и H 2 O. Водородные связи между молекулами воды являются результатом притяжения частичных положительных и частичных отрицательных зарядов на разных молекулах воды (рис. 1.2.4). Водородные связи могут также образовываться между атомами водорода с частичным положительным зарядом и другими сильно электроотрицательными атомами, такими как азот, с частичным отрицательным зарядом. Важно помнить, что водородные связи — это взаимодействия между молекулами (или частями молекул), а не связи между атомами, как ковалентные или ионные связи.
 Эти соединения, для которых разница электроотрицательности между атомами равна нулю (или почти нулю), известны как неполярные ковалентные соединения . Примерами являются F 2 , O 2 , CO 2 (рассмотрите здесь линейную молекулярную геометрию) или CH 4 . В неполярных соединениях единственные возможные межмолекулярные силы возникают в результате подвижности электронов, которая может создавать неравномерное распределение заряда, при этом один атом становится временно более отрицательно заряженным, а другой атом становится более положительно заряженным. Этот тип диполей очень недолговечен, и притяжение, возникающее в результате этих диполей, очень слабое. Это взаимодействие называется Лондонские дисперсионные силы (LDF). Хотя лондонские дисперсионные силы слабы, они увеличиваются с количеством штормов, поэтому большие молекулы могут демонстрировать довольно сильную LDF.
Эти соединения, для которых разница электроотрицательности между атомами равна нулю (или почти нулю), известны как неполярные ковалентные соединения . Примерами являются F 2 , O 2 , CO 2 (рассмотрите здесь линейную молекулярную геометрию) или CH 4 . В неполярных соединениях единственные возможные межмолекулярные силы возникают в результате подвижности электронов, которая может создавать неравномерное распределение заряда, при этом один атом становится временно более отрицательно заряженным, а другой атом становится более положительно заряженным. Этот тип диполей очень недолговечен, и притяжение, возникающее в результате этих диполей, очень слабое. Это взаимодействие называется Лондонские дисперсионные силы (LDF). Хотя лондонские дисперсионные силы слабы, они увеличиваются с количеством штормов, поэтому большие молекулы могут демонстрировать довольно сильную LDF. 2.6. Временные диполи и лондонские рассеивающие силы. Изображение OpenStax, CC BY 4.0, через Wikimedia Commons
2.6. Временные диполи и лондонские рассеивающие силы. Изображение OpenStax, CC BY 4.0, через Wikimedia Commons В дополнение к знанию названий и структур этих групп учащиеся должны иметь базовое представление о ковалентных и ионных связях.
В дополнение к знанию названий и структур этих групп учащиеся должны иметь базовое представление о ковалентных и ионных связях. Реакции окисления имеют тенденцию высвобождать энергию и являются источником энергии. Каждое окисление всегда сопровождается восстановлением, поэтому эти реакции называются окислительно-восстановительными реакциями. Это определение очень полезно при работе с неорганическими соединениями. Однако большинство молекул, встречающихся в биологических системах, являются органическими. При работе с органическими молекулами нам нужно легче идентифицировать окисление и восстановление, а не подсчитывать степени окисления. Для органических молекул реакции окисления можно понимать как получение кислорода или потерю атомов водорода. С другой стороны, реакции восстановления можно понимать как присоединение атомов водорода или потерю кислорода.
Реакции окисления имеют тенденцию высвобождать энергию и являются источником энергии. Каждое окисление всегда сопровождается восстановлением, поэтому эти реакции называются окислительно-восстановительными реакциями. Это определение очень полезно при работе с неорганическими соединениями. Однако большинство молекул, встречающихся в биологических системах, являются органическими. При работе с органическими молекулами нам нужно легче идентифицировать окисление и восстановление, а не подсчитывать степени окисления. Для органических молекул реакции окисления можно понимать как получение кислорода или потерю атомов водорода. С другой стороны, реакции восстановления можно понимать как присоединение атомов водорода или потерю кислорода. 1.2.9). Каждый углерод с таким свойством называется стереогенным центром или хиральным углеродом. Свойство хиральности возникает только тогда, когда к углероду присоединены четыре разные группы. Энантиомеры представляют собой стереоизомеры , которые представляют собой зеркальные отражения друг друга. Энантиомеры обладают одинаковыми химическими и физическими свойствами, но различаются по своим биологическим свойствам. Ферменты имеют очень специфическую трехмерную структуру, поэтому они могут различать стереоизомеры и энантиомеры. Напротив, молекулы, полученные химическим путем (без использования ферментов), в конечном итоге содержат одинаковое количество обоих энантиомеров, называемых рацемическая смесь .
1.2.9). Каждый углерод с таким свойством называется стереогенным центром или хиральным углеродом. Свойство хиральности возникает только тогда, когда к углероду присоединены четыре разные группы. Энантиомеры представляют собой стереоизомеры , которые представляют собой зеркальные отражения друг друга. Энантиомеры обладают одинаковыми химическими и физическими свойствами, но различаются по своим биологическим свойствам. Ферменты имеют очень специфическую трехмерную структуру, поэтому они могут различать стереоизомеры и энантиомеры. Напротив, молекулы, полученные химическим путем (без использования ферментов), в конечном итоге содержат одинаковое количество обоих энантиомеров, называемых рацемическая смесь . Первая представляет собой экзотермическую реакцию, а вторая – эндотермическую реакцию. По энтропии реакция может сопровождаться увеличением (ΔS>0) или уменьшением беспорядка (ΔS<0)
Первая представляет собой экзотермическую реакцию, а вторая – эндотермическую реакцию. По энтропии реакция может сопровождаться увеличением (ΔS>0) или уменьшением беспорядка (ΔS<0)
 Когда это происходит, мы говорим, что система достигла равновесия, и мы можем определить константу равновесия \(K_{eq}\), которая равна: 9{o\prime} = -RT \ln K_{eq}\]
Когда это происходит, мы говорим, что система достигла равновесия, и мы можем определить константу равновесия \(K_{eq}\), которая равна: 9{o\prime} = -RT \ln K_{eq}\] Реакции с высокой энергией активации протекают медленнее, чем реакции с низкой энергией активации, независимо от того, является ли реакция очень самопроизвольной или нет. Следовательно, уменьшение энергии активации — это еще один способ увеличить скорость реакции. Вещество, способное уменьшать энергию активации реакции, называется катализатор . Поскольку катализаторы остаются неизменными в конце реакции, одна молекула катализатора может быть повторно использована во многих реакционных циклах. Белки, катализирующие реакции в клетках, называются ферментами , а рибозимы — это молекулы РНК, действующие как катализаторы.
Реакции с высокой энергией активации протекают медленнее, чем реакции с низкой энергией активации, независимо от того, является ли реакция очень самопроизвольной или нет. Следовательно, уменьшение энергии активации — это еще один способ увеличить скорость реакции. Вещество, способное уменьшать энергию активации реакции, называется катализатор . Поскольку катализаторы остаются неизменными в конце реакции, одна молекула катализатора может быть повторно использована во многих реакционных циклах. Белки, катализирующие реакции в клетках, называются ферментами , а рибозимы — это молекулы РНК, действующие как катализаторы.