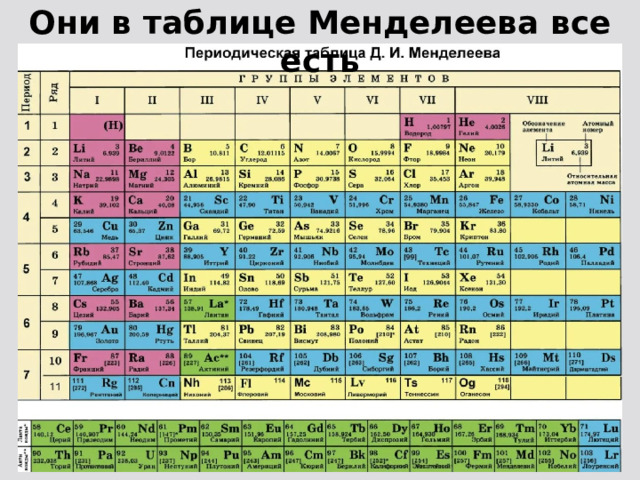
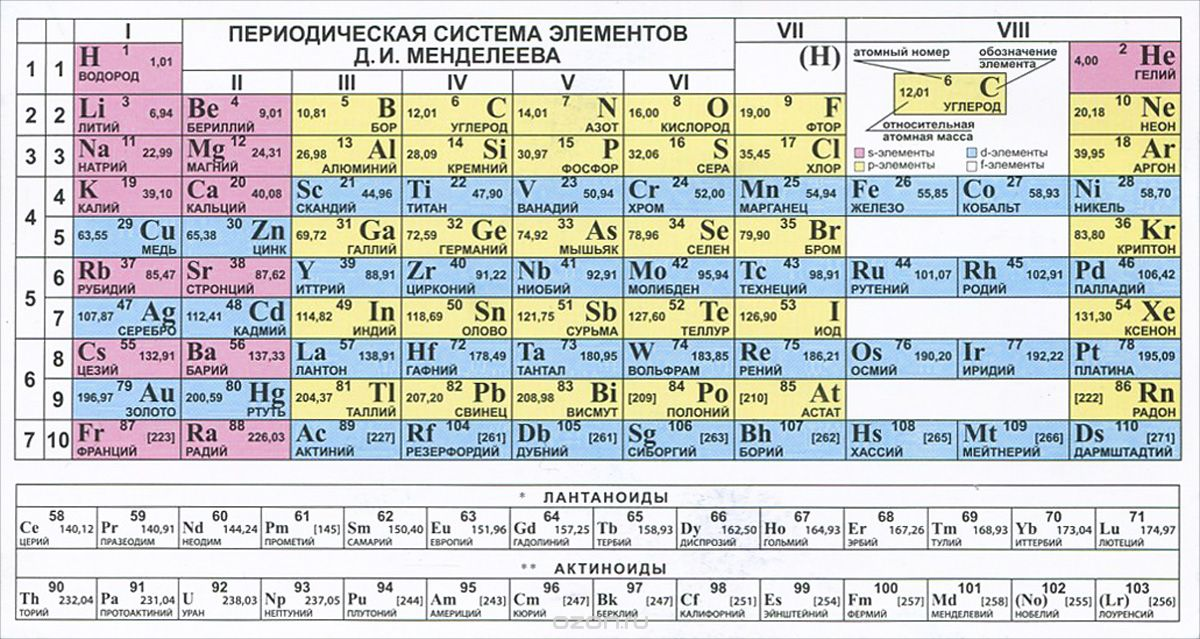
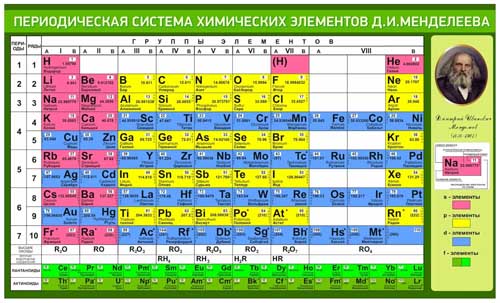
Подлиная периодическая таблица Д.И. Менделеева
Опубликовано 2016-09-27 00:18:25
«… Периодическому Закону будущее не грозит
разрушением, а только надстройку и развитие обещает
хотя, как русского, меня хотели затереть,особенно немцы…».
Д.И.Менделеев.
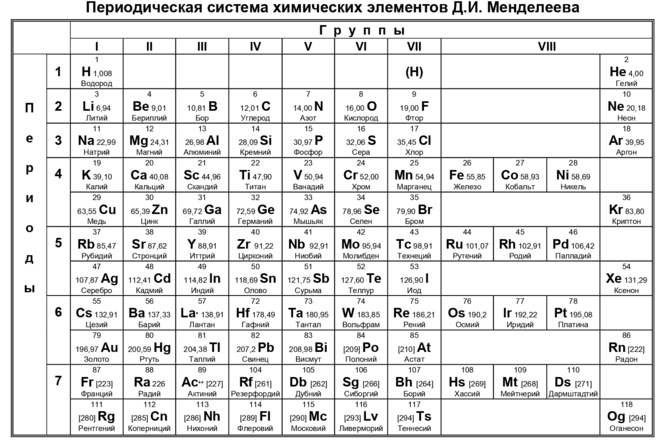
В периодической системе 1902 – 1906г.[2], Д.И. Менделеев ввёл нолевой период, состоящий из одного атома инертного газа «Х» икс – химическая модель элементарной частицы (химического элемента) и нолевой ряд из инертных атомов «Х» и «Y» и последующих атомов инертных газов, открытых Рамзаем и учениками. Сегодня, настоящая ПС Д.И.Менделеева, только в первоисточниках «Основы Химии», а современные искажённые варианты ПС представляемые научно технической и популярной литературой грубо нарушают авторские права Д.И. Менделеева и не соответствуют действительности, потому что нолевой период исключён из ПС, а нолевой ряд инертных газов переставлен в восьмой. А без нолевых значений (ряда и периода) ни какая математизация ПС не возможна.
Выдержка из «Попытка химического понимания мирового эфира .»стр 479 (Д.И.Менделеев о нолевой группе)
«Сколько мне известно, в литературе предмета первое упоминание нолевой группы сделано было г. Ерерра в заседании 5 марта 1900 года в Бельгийской Академии. Это положение аргоновых аналогов в нолевой группе составляет строго логическое следствие периодического закона, а потому (помещение в группу VIII явно не верно) принято не только МНОЮ, но БРАУНЕРОМ, ПИЧЧИНИ и др».
Предсказанные Д.И. Менделеевым два инертных газа «Х» и «Y» не вписывались в систему планетарной модели якобы Резерфорда-БОРА, ставили под сомнение «открытия» Дж. Томсона – отрицательного электрона
Выдержка из «Попытка химического понимания мирового эфира .».стр 494 ( Д.И.Менделеев о электронах)
«Не вдаваясь в развитие изложенной попытки понять эфир, я, однако, желал бы, чтобы читатели не упустили из вида, некоторых, на первый взгляд побочных, обстоятельств, которые руководили ходом моих соображений и заставили выступть с предлагаемой статьёю.
Эти обстоятельства состоят в ряде сравнительно недавно открытых физико – химических явлений, которые не поддаются обычным учениям об истечении света, отчасти ПРИДУМЫВАТЬ
мне мало понятную гипотезу ЭЛЕКТРОНОВ, НЕ СТАРАЯСЬ выяснить до конца ПРЕДСТАВЛЕНИЕ об ЭФИРЕ, как среде, передающей световые колебания.Сюда относятся особенно радиоактвные явления».
и положительного ядра, якобы открытого Резерфордом и, видимо поэтому, после смерти Д.И. Менделеева были проведены необходимые «корректировки» в ПС 1905-1906г. после чего нас «обучают» по изменённой ПС.
Эту периодическую таблицу Д.И. Менделеева запрещают показывать в Политехническом музее в Москве
и в Санкт-Петербурге в кабинете-музее Д.И. Менделеева.
Именно эти таблицы с нулевым рядом и нулевым периодом соответствуют периодической системе Русов.
Об этом подробнее можно прочитать в статье :
Физико – математическое моделирование строения безъядерных электроатомов и периодической системы.
Периодическая таблица Русов полностью по ссылке Периодическая таблица Русов (версия 2.0)
Все материалы по Периодическая таблица Русов здесь
Значение периодического закона химических элементов Менделеева для развития науки
4.7
Средняя оценка: 4.7
Всего получено оценок: 851.
4.7
Средняя оценка: 4.7
Всего получено оценок: 851.
С открытием Менделеева изменилась вся мировая наука. Значение периодического закона химических элементов стало важно не только для химии, но и физики, космологии, геохимии.
Открытие Менделеева
Периодический закон был открыт Дмитрием Менделеевым в 1871 году. Разные учёные XIX века пытались найти закономерность и упорядочить все известные элементы. Менделеев установил, что химические свойства элементов меняются и повторяются с возрастанием относительной атомной массы.
Рис. 1. Менделеев.На основе этого он расставил 63 известных элемента по шести периодам и восьми группам.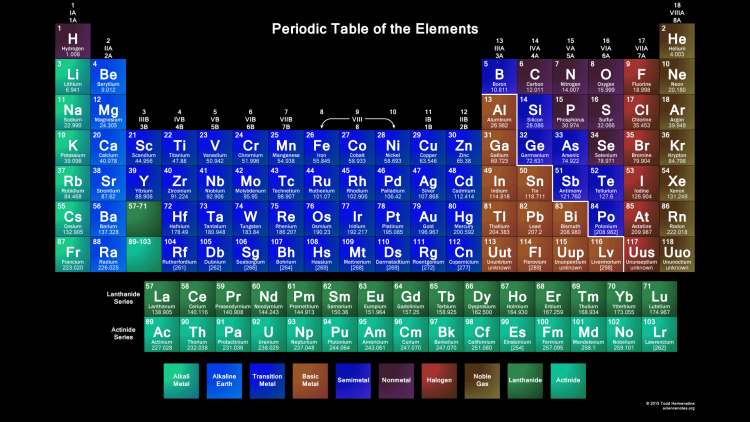 Каждый период начинался металлом и заканчивался неметаллом. Менделеев оставил пробелы в таблице для неоткрытых элементов и сделал перерасчёт относительной атомной массы некоторых элементов.
Каждый период начинался металлом и заканчивался неметаллом. Менделеев оставил пробелы в таблице для неоткрытых элементов и сделал перерасчёт относительной атомной массы некоторых элементов.
Например, считалось, что атомная масса бериллия – 13,5, а не 9, как это известно сейчас. По логике Менделеева металл необходимо было поместить между углеродом с атомной массой 12 и азотом с атомной массой 14. Однако это нарушало бы принцип периодического закона: металл оказался бы между двумя неметаллами. Поэтому Менделеев предположил, что место бериллия между литием (7) и бором (9), т.е. атомная масса бериллия должна быть примерно 9, а валентность – II или III.
Математическая точность Менделеева впоследствии подтвердилась экспериментально, пропущенные учёным клетки постепенно стали заполняться. При этом Менделеев не знал о существовании элементов, их ещё предстояло открыть, но уже смог определить их порядковый номер, атомную массу, валентность, свойства.
В этом заключается главное значение открытия периодического закона Менделеева. Несмотря на новые знания, нахождение новых элементов и расширение таблицы, принцип периодического закона сохраняется и подтверждается до сих пор.
Несмотря на новые знания, нахождение новых элементов и расширение таблицы, принцип периодического закона сохраняется и подтверждается до сих пор.
Наиболее подробно Менделеев описал три фантомных элемента – экабор, экаалюминий, экасилиций. Они были открыты в 70-80-х годах XIX века и названы соответственно скандием, галлием, германием.
Современность
Открытие, сделанное Менделеевым, повлияло на развитие науки. Если раньше новые элементы находились случайно, то с периодической таблицей химики целенаправленно, ориентируясь на пустые клетки, стали искать элементы. Так были открыты многие редко встречающиеся элементы, например, рений.
Рис. 3. Рений.Таблица также дополнилась:
- инертными газами;
- радиоактивными элементами.
Кроме того, в конце XIX века благодаря теории строения атома стало известно, что свойства элементов находятся в зависимости не от относительной массы атомов, как это вывел Менделеев, а от заряда ядер.
Таблица Менделеева охватывает всю неорганическую химию и даёт чёткое представление о химических, физических свойствах элементов и их месте во Вселенной.
Что мы узнали?
Периодический закон Менделеева повлиял на развитие химии и других смежных наук. Менделееву удалось предсказать многие элементы, которые были открыты позже. Он рассчитал для них атомную массу, определил их свойства. Значения подтверждались с нахождением элементов. Периодическая таблица задала направление химии: учёные стали искать элементы, ориентируясь на её пробелы.
Тест по теме
Доска почёта
Чтобы попасть сюда – пройдите тест.
Александр Котков
5/5
Полина Огнева
5/5
Виктория Вайс
5/5
Александр Котков
5/5
Денислам Аблезов
4/5
Александр Котков
5/5
Сергей Макаров
5/5
Оценка доклада
4. 7
7
Средняя оценка: 4.7
Всего получено оценок: 851.
А какая ваша оценка?
ИРН-ПС 4 Периодическая таблица элементов
Периодическая таблица элементов
В конце 1800-х русский ученый по имени Дмитрий Меделеев начал изучать свойства известных элементов, чтобы систематизировать их. Результатом стала периодическая таблица элементов. Давайте исследуем организацию периодической таблицы элементов и то, как ученые используют ее сегодня.
Периодическая таблица элементов — это инструмент, который мы можем использовать для систематизации информации об элементах. Он состоит из горизонтальных рядов, называемых периодами, и вертикальных столбцов, называемых группами или семействами. Каждое поле в таблице содержит информацию о структуре элемента. Элементы в каждой коробке расположены в соответствии с их атомными номерами и свойствами. Идентичность атома напрямую связана с его атомным номером или количеством протонов в его ядре.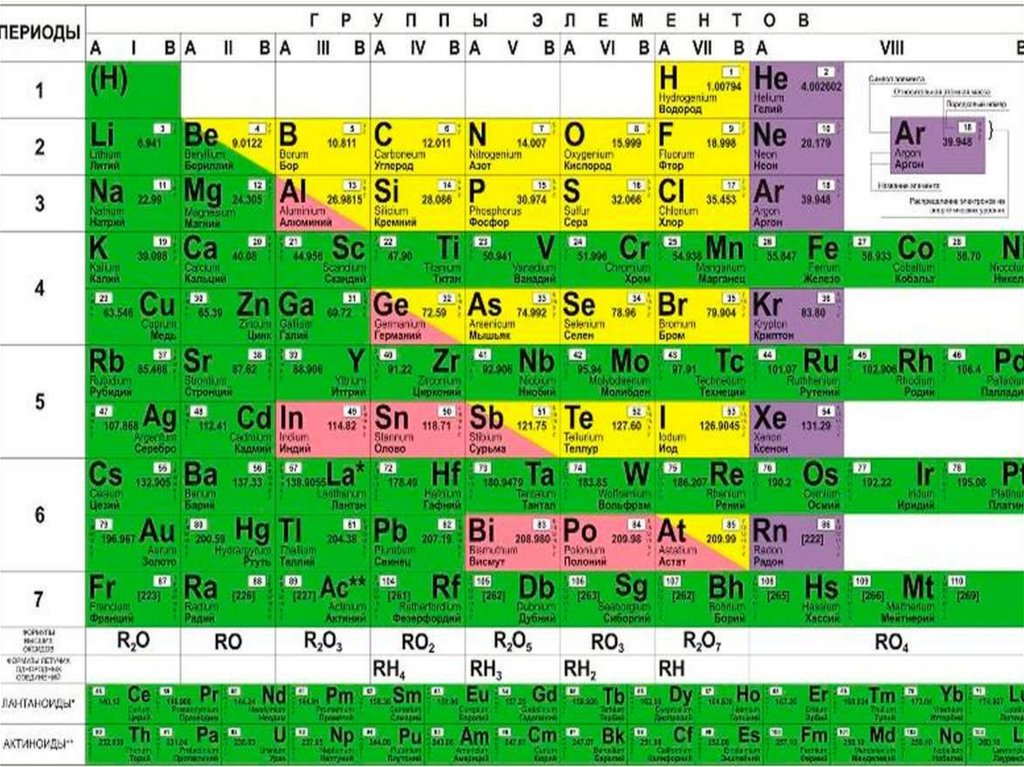
Элементы становятся все более неметаллическими, когда вы перемещаетесь по столу слева направо. Ступенчатая линия в правой части таблицы помогает нам определить три классификации или группы элементов: металлы, неметаллы и металлоиды.
Металлы – это элементы, расположенные слева от линии ступеней. Они имеют тенденцию терять электроны в химических реакциях с образованием положительных ионов — любой элемент, который получает или теряет электроны, становится ионом.
Металлоиды граничат с линией ступеней и обладают некоторыми свойствами как металлов, так и неметаллов.
Неметаллы расположены справа от ступенчатой линии. Они имеют тенденцию приобретать электроны в химических реакциях с образованием отрицательных ионов.
Вертикальные столбцы периодической таблицы содержат элементы с одинаковым количеством электронов на внешнем энергетическом уровне.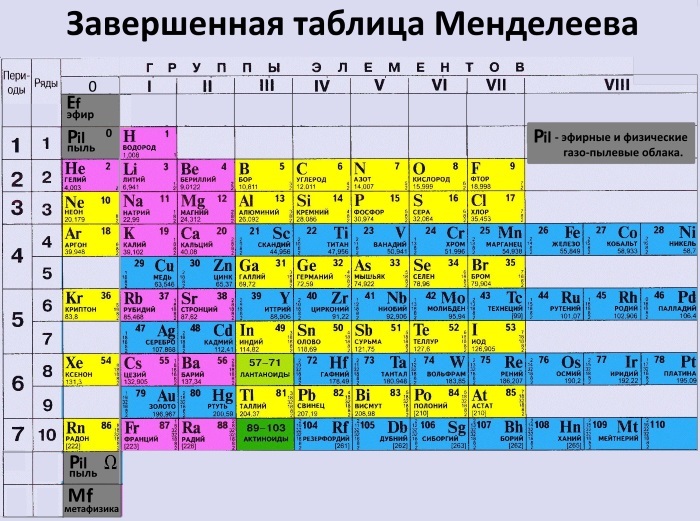 Электроны можно найти в зонах или областях вокруг ядра, называемых энергетическими уровнями. Электроны, расположенные на энергетических уровнях, ближайших к ядру, содержат меньше энергии, чем те, которые расположены на энергетических уровнях, более удаленных от ядра. Это похожее расположение электронов приводит к тому, что элементы в вертикальной группе имеют схожие химические и физические свойства, такие как температуры кипения и реакционная способность. Вертикальные группы часто называют семьями, поскольку они «связаны» сходными свойствами. Это сходство свойств в вертикальных группах приводит к повторяющемуся или повторяющемуся образцу физических и химических свойств при перемещении по периодам в таблице.
Электроны можно найти в зонах или областях вокруг ядра, называемых энергетическими уровнями. Электроны, расположенные на энергетических уровнях, ближайших к ядру, содержат меньше энергии, чем те, которые расположены на энергетических уровнях, более удаленных от ядра. Это похожее расположение электронов приводит к тому, что элементы в вертикальной группе имеют схожие химические и физические свойства, такие как температуры кипения и реакционная способность. Вертикальные группы часто называют семьями, поскольку они «связаны» сходными свойствами. Это сходство свойств в вертикальных группах приводит к повторяющемуся или повторяющемуся образцу физических и химических свойств при перемещении по периодам в таблице.
Мы можем получить много информации об элементах и их атомах, используя периодическую таблицу элементов. Прежде всего, подсчитав количество клеток, составляющих периоды и группы, мы обнаруживаем, что существует более 110 известных элементов. Из них только 92 встречаются в природе на Земле.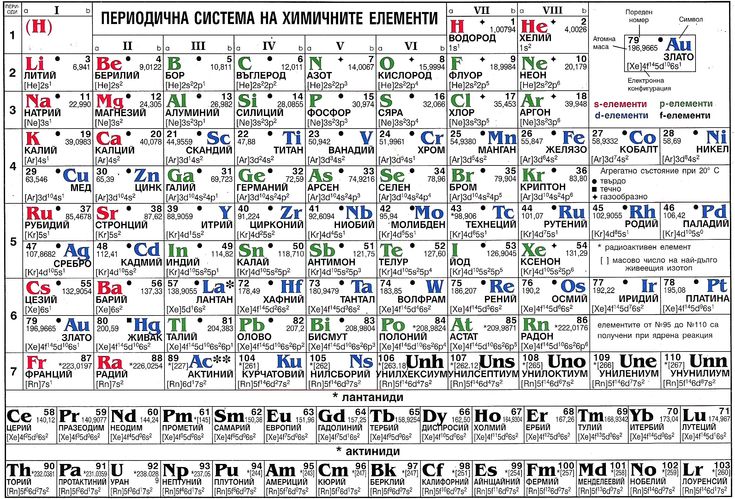 Остальные элементы, называемые синтетическими элементами, производятся искусственно в лабораторных условиях.
Остальные элементы, называемые синтетическими элементами, производятся искусственно в лабораторных условиях.
Многие периодические таблицы также сообщают нам атомный номер атома, атомную массу, фазу вещества при комнатной температуре, количество электронов внешнего уровня (валентности) и химический символ. Химические символы обычно происходят от древнего или современного названия элемента и состоят из одной, двух или трех букв. Первая буква всегда заглавная. Все остальные буквы строчные.
Элементы периодической таблицы могут комбинироваться разными способами, образуя соединения, из которых состоят все другие вещества на Земле. Соединения образуются при химической реакции атомов элементов. Количество электронов на самых внешних энергетических уровнях атома определяет химические свойства и реакционную способность элемента. Когда металлический элемент реагирует или связывается с неметаллическим элементом, их атомы приобретают и теряют электроны, образуя ионные связи. Когда два неметалла реагируют или связываются, атомы обычно имеют общие электроны, образующие ковалентные (молекулярные) связи.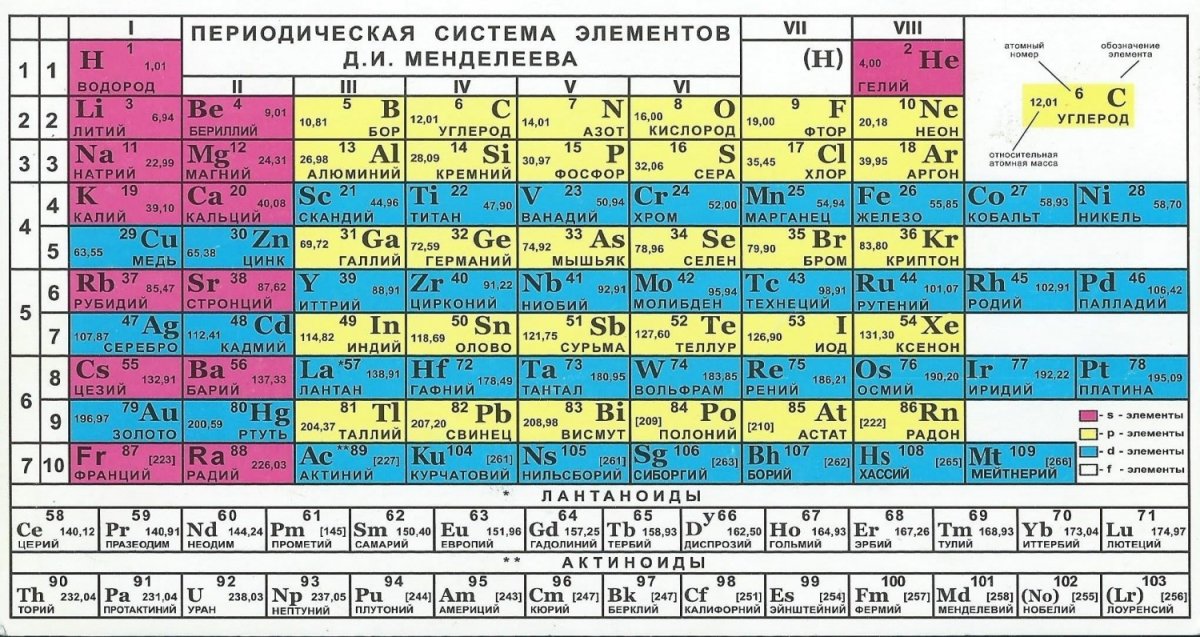 Приобретая, теряя и делясь электронами, атомы становятся химически стабильными. Атомы реагируют с образованием химически стабильных веществ, которые удерживаются вместе химическими связями и представлены химическими формулами.
Приобретая, теряя и делясь электронами, атомы становятся химически стабильными. Атомы реагируют с образованием химически стабильных веществ, которые удерживаются вместе химическими связями и представлены химическими формулами.
Химическая формула — это тип аббревиатуры или сокращения, используемого для представления того, какие элементы присутствуют в соединении и сколько атомов каждого элемента связано для образования соединения. Он записывается с использованием химических символов для связанных элементов и подстрочных номеров. Номера индексов всегда следуют и пишутся под химическим символом. Например, соединение, известное нам как вода, состоит из двух атомов водорода, связанных с одним атомом кислорода. В химической формуле воды (h3O) используются химические символы водорода (H) и кислорода (O) и число в нижнем индексе (2). Эта химическая формула означает, что в каждой молекуле составной воды есть два атома водорода и один атом кислорода, связанные вместе.
Мы узнали, что потеря и приобретение электронов превращают атом в ион. Интересно отметить, что атомы могут подвергаться другим типам изменений. Когда атом получает или теряет нейтроны из своего ядра, он становится изотопом. Изотоп остается тем же элементом, потому что число протонов остается прежним. Большинство элементов имеют несколько изотопов, встречающихся в природе. Изотопы продолжают иметь те же физические и химические свойства, что и исходный элемент. Напротив, если атом приобретает или теряет протон, его атомный номер изменяется, и он становится совершенно другим элементом.
Интересно отметить, что атомы могут подвергаться другим типам изменений. Когда атом получает или теряет нейтроны из своего ядра, он становится изотопом. Изотоп остается тем же элементом, потому что число протонов остается прежним. Большинство элементов имеют несколько изотопов, встречающихся в природе. Изотопы продолжают иметь те же физические и химические свойства, что и исходный элемент. Напротив, если атом приобретает или теряет протон, его атомный номер изменяется, и он становится совершенно другим элементом.
|

 Эти обстоятельства состоят в ряде сравнительно недавно открытых физико – химических явлений, которые не поддаются обычным учениям об истечении света, отчасти ПРИДУМЫВАТЬ
Эти обстоятельства состоят в ряде сравнительно недавно открытых физико – химических явлений, которые не поддаются обычным учениям об истечении света, отчасти ПРИДУМЫВАТЬ