Характеристика элемента по его положению в периодической системе
Характеристика элемента по его положению в периодической системе
План урока
- План характеристики химического элемента
- Характеристика металла и его соединений
- Характеристика неметалла и его соединений
Цели урока
- рассмотреть план характеристики химического элемента на основании его положения в ПС
- научиться описывать свойства химического элемента и его соединений на основе плана характеристики
- расширить и углубить знания о химических элементах, периодической системе и строении атомов
Элементы и атомы,
В менделеевский взятые круг,
Сделали химию самой богатой
И самой творческой из наук.
Г. Санников
Можно предположить, что химические элементы в периодической системе — это герои, и им, как и любым героям, можно давать определённые характеристики.
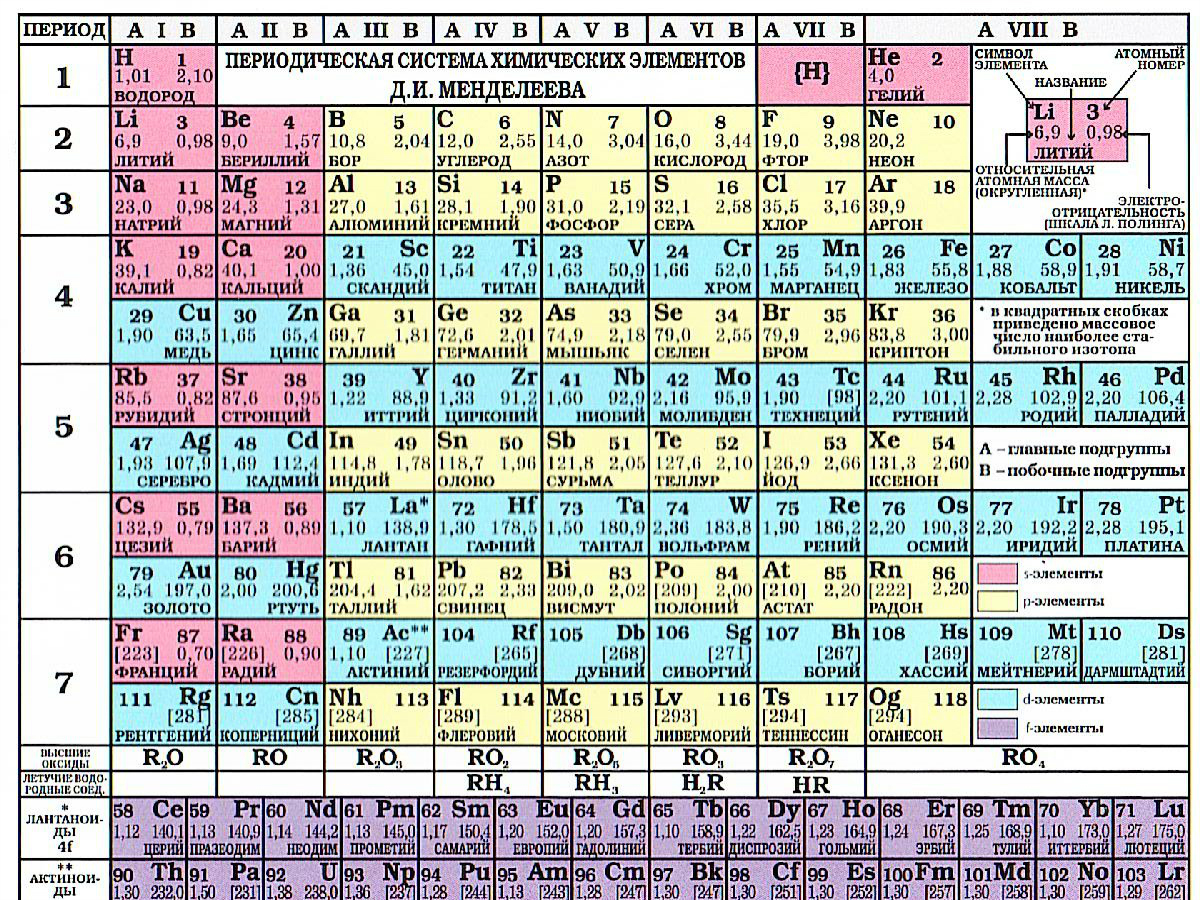
План характеристики элементов по ПСХЭ
- Порядковый номер элемента, относительная атомная масса (Ar), химический знак.
- Строение атома (заряд ядра (Z), количество протонов, нейтронов, электронов).
- Положение элемента в ПС (период, группа, подгруппа), семейство элемента (s, p, d, f).
- Распределение электронов по энергетическим уровням, электронная формула атома.
- Характер элемента (металл, неметалл).
- Характеристика химической связи, физические свойства.
- Сравнение со свойствами соседних элементов (по группе, по периоду).
- Формула высшего оксида, название, его характер.
- Формула гидроксида (основания или кислоты), название, его характер.
- Состав летучего водородного соединения (для неметаллов главных подгрупп), название, характер.
Характеристика металла и его соединений
Охарактеризуем металл калий К
1. Порядковый номер калия, т. е. клетка, в которой он стоит, — 19, относительная атомная масса Ar — 39. Химический символ — K.
Порядковый номер калия, т. е. клетка, в которой он стоит, — 19, относительная атомная масса Ar — 39. Химический символ — K.
2. Значит, заряд его ядра равен Z = +19 (заряд ядра атома равен порядковому номеру элемента, числу протонов и числу электронов). Поэтому в атоме 19 электронов (19 e
(12 n0).
3. Калий расположен в ПС в I группе, главной (A) подгруппе, 4 большом периоде, относится к элементам s-семейства.
4. Так как калий находится в 4-ом периоде, значит, у него будет 4 энергетических уровня, на которых будут располагаться все его электроны. На первом уровне 2 электрона (это максимально), на втором — 8, на третьем — 8, на четвёртом,
значит, — 1 электрон.
Электронная формула атома калия: 1s22s22p63s23p64s1.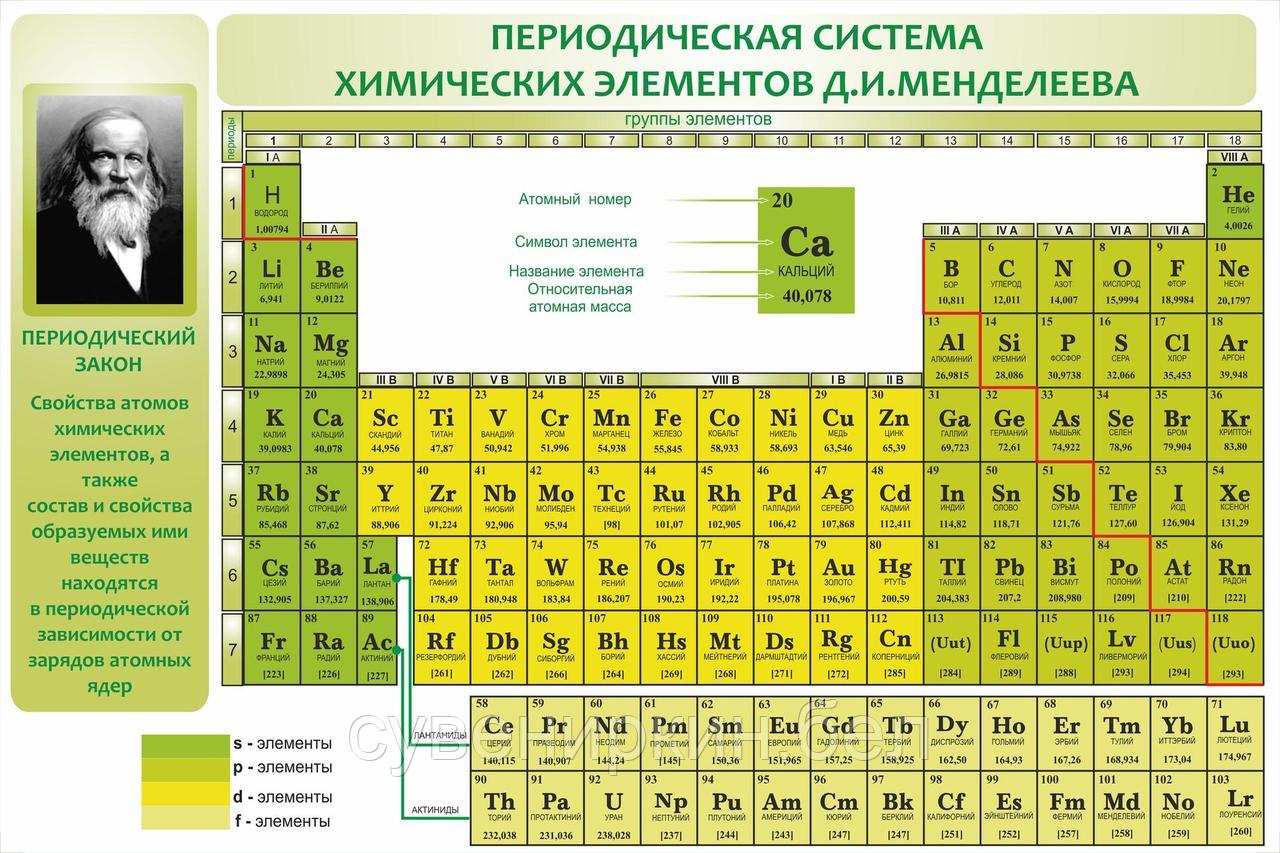
5. Т. к. у калия 1 электрон на внешнем уровне, то этот элемент относится к металлам. В реакциях он будет отдавать 1 электрон, проявляя восстановительные свойства, и получать степень окисления +1.
Рис. 1. Металл калий
6. Раз калий — металл, то для него характерна металлическая химическая связь и металлическая кристаллическая решётка. Поэтому, как и для любого металла, для него характерны такие физические свойства, как металлический блеск, пластичность, тепло- и электропроводность.
7. Сравнение свойств элемента калия со свойствами его соседей по группе: металлические свойства калия выражены сильнее, чем у натрия, но слабее, чем у
рубидия, т. к. в группе сверху вниз увеличивается радиус атома и электроны больше отдаляются от ядра, их становится легче отдавать. Сравнение свойств элемента калия со свойствами его соседей по периоду: металлические свойства натрия выражены сильнее, чем у кальция, т.
8. Калий — металл I A группы, его высшая валентность I (определяется номером группы). Металлу соответствует оксид калия K2O, значит, это основный оксид, он проявляет все свойства, характерные для этих оксидов: реагирует с кислотами и кислотными оксидами, с водой с образованием щёлочи. Это подтверждается уравнениями реакции:
К2О + 2HCl → 2KCl + h3O
K2O + SO3 → K2SO4
K2O + h3O → 2KOH
9. Гидроксид калия (едкое кали) — это KOH, он является щёлочью — растворимым в воде основанием. Для него будут характерны следующие свойства: реакции с кислотами и кислотными оксидами, реакции с солями. Это подтверждается уравнениями реакции:
КОH + HNO3 → KNO3 + h3O
2KOH + CO2 → K2CO3 + h3O
2KOH + CaCl2 → 2KCl + Ca(OH)2
10. Если калий — металл, то он не образует летучих водородных соединений.
Если калий — металл, то он не образует летучих водородных соединений.
Характеристика неметалла и его соединений
Охарактеризуем неметалл сера S
1. Сера находится в клетке номер 16, т. е. её порядковый номер 16, относительная атомная масса Ar — 32.
Химический символ — S.
2. Значит, заряд ядра её атома будет Z = +16, а число протонов, как и число электронов равно 16: (р0 = 16, e– = 16). Число нейтронов будет равно 16, т. к. если мы от относительной атомной массы отнимем число протонов, то будет 16 (n0 = 32 – 16 = 16).
3. Сера расположена в ПС в VI группе, главной (A) подгруппе, 3 малом периоде, относится к элементам p-семейства.
4. Сера находится в третьем периоде, значит, у неё три энергетических уровня: на первом 2 электрона, на втором — 8, а на третьем — 6.
Электронная формула атома серы: 1s22s22p63s23p4.
5. Сера — это неметалл, значит, она может быть как окислителем, так и восстановителем. Как окислитель она может присоединить 2 электрона до завершения внешнего уровня, получая при этом степень окисления -2
(S0 + 2e- → S-2), а как восстановитель она может отдать 4 или 6 электронов и получить степень окисления +4 или +6 (S0 – 4e- → S+4, S0 – 6e- → S+6).
6. Сера — неметалл. Для неё характерно явление аллотропии , т. е. она может образовывать несколько простых веществ, отличающихся своими свойствами.
Рис. 2. Аллотропные модификации серы: а — ромбическая; б — моноклинная; в — пластическая
Наиболее устойчивая модификация серы — ромбическая сера S8, это хрупкое вещество жёлтого цвета. Моноклинная сера, в которой атомы соединены в циклы в виде «короны», представляет собой твёрдое вещество, состоящее из тёмно-жёлтых игл, устойчивое при температуре более 96 °C, а при обычной температуре превращающееся в ромбическую серу. Пластическая сера — длинные полимерные цепи пластической коричневой массы, нерастворимой в воде.
Пластическая сера — длинные полимерные цепи пластической коричневой массы, нерастворимой в воде.
7. Сравнение свойств элемента серы со свойствами её соседей по группе: неметаллические свойства серы выражены сильнее, чем у селена, но слабее, чем у кислорода, так как радиус у кислорода меньше, чем у серы. По сравнению с соседями по периоду свойства серы выражены сильнее, чем у фосфора, но слабее, чем у хлора.
8. Сера имеет высшую валентность 6 и низшую валентность 2 (определяется по формуле: 8-N, где N — номер группы). Высший оксид серы (VI) — SO3. Это кислотный оксид, который проявляет свойства, характерные для этих оксидов: он реагирует с основными оксидами, основаниями и водой с образованием соответствующей кислоты. Это подтверждается уравнениями реакции:
SO3 + BaO → BaSO4
SО3 + 2NaOH → Na2SO4 + h3O
SO3 + h3O → h3SO4
9. Высший гидроксид серы — это серная кислота h3SO4, она проявляет свойства, характерные для всех кислот: реагирует с металлами, основаниями и основными оксидами, с солями. Это подтверждается уравнениями реакции:
Это подтверждается уравнениями реакции:
h3SО4 + Mg → MgSO4 + h3
h3SO4 + Ca(OH)2 → CaSO4 + 2h3O
h3SO4 + CaO → CaSO4 + h3O
h3SO4 + Na2SiO3 → h3SiO3 + Na2SO4
10. Сера — неметалл, поэтому имеет летучее водородное соединение h3S — сероводород.
Пример 1
Охарактеризуем химический элемент кальций по следующим характеристикам:
Характеристика | Элемент | |
Химический знак | ||
Название элемента | кальций | |
Порядковый номер | ||
Номер группы, подгруппа (главная, побочная) | II, главная | |
Металл, неметалл, амфотерный элемент | металл | |
Номер периода (большой, малый) | 4 большой | |
Относительная атомная масса (Аr) | Аr = 40 | |
Формула высшего оксида | ||
Формула высшего гидроксида | ||
Формула летучего водородного соединения | ||
Строение атома: | ||
а) заряд ядра | ||
б) количество электронов и протонов | ||
в) количество нейтронов (n = Ar – Z) | n=40-20=20 | |
г) количество энергетических уровней | ||
д) количество электронов на последнем уровне | ||
е) распределение электронов по энергетическим уровням и подуровням | 1s22s22p63s23p64s2 | |
ж) s-, p-, d-, f-элемент | s-элемент | |
Упражнение
Охарактеризуйте химический элемент кремний по тем же характеристикам, что и в примере.
Контрольные вопросы
- Перечислите пункты плана характеристики химического элемента.
- Каким элементам характерно наличие летучих водородных соединений?
Ответы
Характеристика | Элемент | |
Химический знак | ||
Название элемента | кремний | |
Порядковый номер | ||
Номер группы, подгруппа (главная, побочная) | IV, главная | |
Металл, неметалл, амфотерный элемент | неметалл | |
Номер периода (большой, малый) | 3 малый | |
Относительная атомная масса (Аr) | Аr = 28 | |
Формула высшего оксида | ||
Формула высшего гидроксида | h3SiO3 | |
Формула летучего водородного соединения | ||
Строение атома: | ||
а) заряд ядра | ||
б) количество электронов и протонов | ||
в) количество нейтронов (n = Ar – Z) | n=28-14=14 | |
г) количество энергетических уровней | ||
д) количество электронов на последнем уровне | ||
е) распределение электронов по энергетическим уровням и подуровням | 1s22s22p63s23p2 | |
ж) s-, p-, d-, f-элемент | p-элемент | |
Характеристика химического элемента по положению в псхэ.
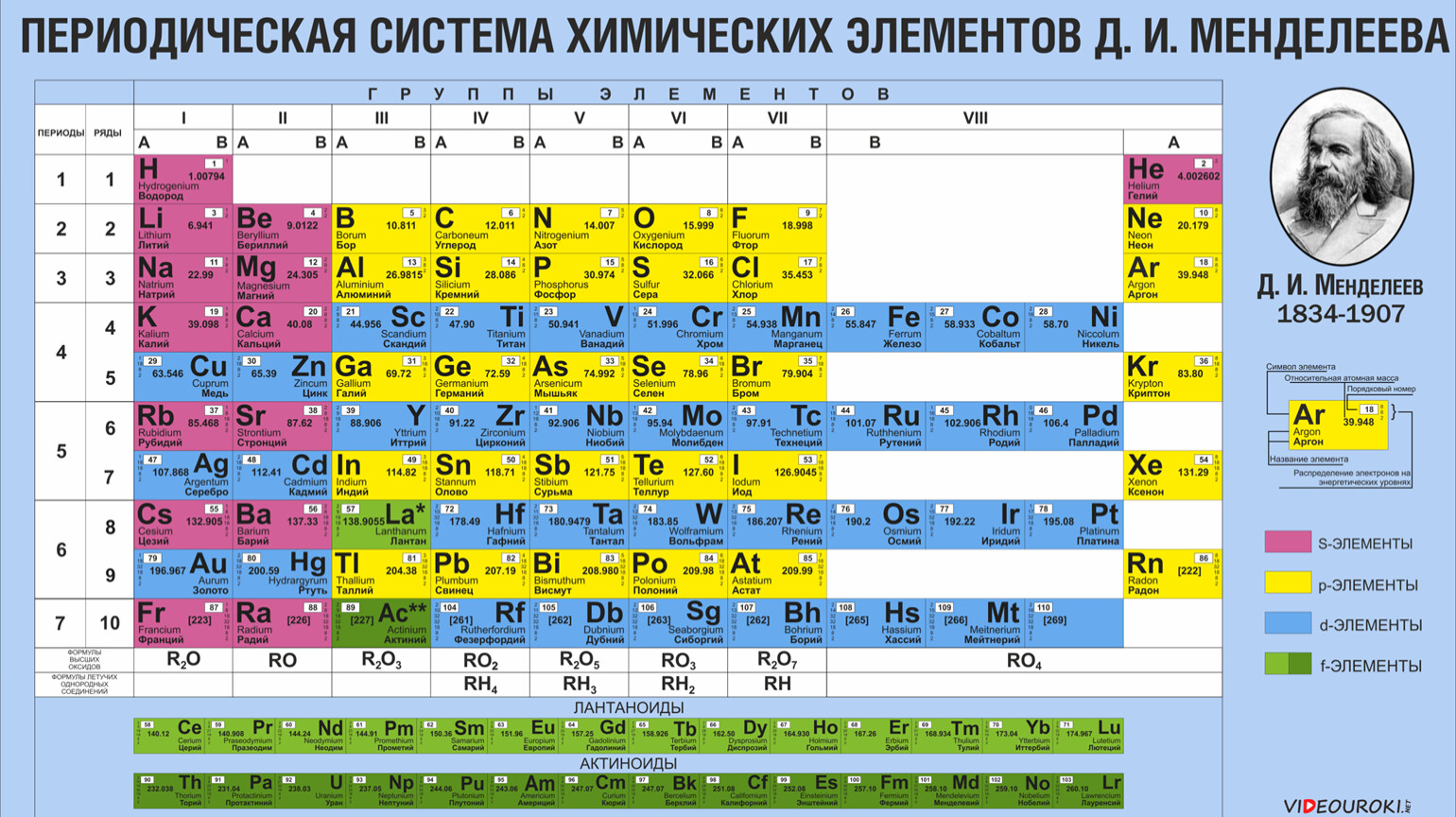 Характеристика химического элемента на основании его положения в псхэ д.и
Характеристика химического элемента на основании его положения в псхэ д.иЗная формулировка периодического закона и используя периодическую систему элементов Д. И. Менделеева, можно дать характеристику любому химическому элементу и его соединениям. Такую характеристику химического элемента удобно складывать по плану.
I. Символ химического элемента и его название.
II. Положение химического элемента в периодической системе элементов Д.И. Менделеева:
- порядковый номер;
- номер периода;
- номер группы;
- подгруппа (главная или побочная).
III. Строение атома химического элемента:
- заряд ядра атома;
- относительная атомная масса химического элемента;
- число протонов;
- число электронов;
- число нейтронов;
- число электронных уровней в атоме.
IV. Электронная и электронно-графическая формулы атома, его валентные электроны.
V. Тип химического элемента (металл или неметалл, s-, p-, d-или f-элемент).
VI. Формулы высшего оксида и гидроксида химического элемента, характеристика их свойств (основные, кислотные или амфотерные).
VII. Сравнение металлических или неметаллических свойств химического элемента со свойствами элементов-соседей по периоду и подгруппой.
VIII. Максимальная и минимальная степень окисления атома.
Например, предоставим характеристику химического элемента с порядковым номером 15 и его соединениям по положению в периодической системе элементов Д. И. Менделеева и строению атома.
I. Находим в таблице Д. И. Менделеева клетку с номером химического элемента, записываем его символ и название.
Химический элемент номер 15 — Фосфор. Его символ Р.
II. Охарактеризуем положение элемента в таблице Д. И. Менделеева (номер периода, группы, тип подгруппы).
Фосфор находится в главной подгруппе V группы, в 3-м периоде.
III. Предоставим общую характеристику состава атома химического элемента (заряд ядра, атомная масса, число протонов, нейтронов, электронов и электронных уровней).
Заряд ядра атома фосфора равен +15. Относительная атомная масса фосфора равна 31. Ядро атома содержит 15 протонов и 16 нейтронов (31 — 15 = 16). Атом фосфора имеет три энергетических уровня, на которых находятся 15 электронов.
IV. Составляем электронной и электронно-графическую формулы атома, отмечаем его валентные электроны.
Электронная формула атома фосфора: 15 P 1s 2 2s 2 2p 6 3s 2 3p 3 .
Электронно-графическая формула внешнего уровня атома фосфора: на третьем энергетическом уровне на 3s-подуровня находятся два электрона (в одной клетке записываются две стрелки, имеющие противоположное направление), на три р-подуровне находятся три электрона (в каждой из трех клеток записываются по одной стрелке, имеющие одинаковое направление).
Валентными электронами являются электроны внешнего уровня, т.е. 3s2 3p3 электроны.
V. Определяем тип химического элемента (металл или неметалл, s-, p-, d-или f-элемент).
Фосфор — неметалл. Поскольку в последнее подуровнем в атоме фосфора, который заполняется электронами, является p-подуровень, Фосфор относится к семейству p-элементов.
VI. Составляем формулы высшего оксида и гидроксида фосфора и характеризуем их свойства (основные, кислотные или амфотерные).
Высший оксид фосфора P 2 O 5 , проявляет свойства кислотного оксида. Гидроксид, соответствующий высшему оксиду, H 3 PO 4 , проявляет свойства кислоты. Подтвердим указанные свойства уравнениями видповиних химических реакций:
P 2 O 5 + 3 Na 2 O = 2Na 3 PO 4
H 3 PO 4 + 3NaOH = Na 3 PO 4 + 3H 2 O
VII. Сравним неметаллические свойства фосфора со свойствами элементов-соседей по периоду и подгруппой.
Соседом фосфора по подгруппе являются азот. Соседями фосфора за периодом является кремний и Сера. Неметаллические свойства атомов химических элементов главных подгрупп с ростом порядкового номера растут в периодах и снижаются в группах. Поэтому неметаллические свойства фосфора более выражены, чем у кремния и менее выражены, чем у азота и серы.
VIII. Определяем максимальную и минимальную степень окисления атома фосфора.
Максимальный положительный степень окисления для химических элементов главных подгрупп равен номеру группы. Фосфор находится в главной подгруппе пятой группы, поэтому максимальная степень окисления фосфора +5.
Фосфор находится в главной подгруппе пятой группы, поэтому максимальная степень окисления фосфора +5.
Минимальная степень окисления для неметаллов в большинстве случаев равен разнице между номером группы и числом восемь. Так, минимальная степень окисления фосфора -3.
уметь характеризовать элемент на основании его положения в периодической системе, систематизировать знания о составе и свойствах соединений, образуемых металлами
Просмотр содержимого документа
«Урок 1 характеристика элемента-металла»
Конспект урока по химии
в 9 классе
«Характеристика химического элемента-металла на основании его положения в Периодической системе Д. И. Менделеева.»
Тема урока: Характеристика химического элемента-металла на основании его положения в Периодической системе Д. И. Менделеева. (1 слайд)
Цели урока: актуализировать знания о структуре периодической системы,
систематизировать знания о составе и строении атома элемента,
уметь характеризовать элемент на основании его положения в периодической системе, систематизировать знания о составе и свойствах соединений, образуемых металлами (2 слайд)
Оборудование: Таблица Д. И. Менделеева. Простые вещества – металлы и неметаллы, компьютер, проектор, презентация по теме.
И. Менделеева. Простые вещества – металлы и неметаллы, компьютер, проектор, презентация по теме.
I . Организационный момент
Приветственное слово учителя. Поздравление ребят с началом нового учебного года.
П. Повторение основных теоретических вопросов программы 8 класса
Основным вопросом программы 8 класса является Периодическая система химических элементов Д. И. Менделеева. Она же является базой для изучения курса химии 9 класса.
Напоминаю, что таблица Д. И. Менделеева представляет собой «дом», в котором живут все химические элементы. Каждый элемент имеет номер (порядковый), который можно сравнить с номером квартиры. «Квартира» расположена на определенном «этаже» (т. е. периоде) и в определенном «подъезде» (т. е. группе). Каждая группа в свою очередь делится на подгруппы: главную и побочную. Пример: элемент магний Mg имеет порядковый номер (№) 12 и расположен в третьем периоде, в главной подгруппе второй группы.
Свойства химического элемента зависят от его положения в таблице Д. И. Менделеева. Поэтому очень важно научиться характеризовать свойства химических элементов на основании их положения в Периодической системе.
И. Менделеева. Поэтому очень важно научиться характеризовать свойства химических элементов на основании их положения в Периодической системе.
III . План характеристики химического элемента на основании его положения в Периодической системе Д. И. Менделеева
Алгоритм характеристики: (3-5 слайды)
1. Положение элемента в ПС
в) группа
д) относительная атомная масса.
а) число протонов (р +), нейтронов (n 0), электронов (е -)
б) заряд ядра
д) электронная формула атома
е) графическая формула атома
ж) семейство элемента.
Три последних пункта, для хорошо подготовленных классов.
3. Свойства атома
Записать в виде схем-уравнений. Сравнить с соседними атомами.
4. Возможные степени окисления.
5. Формула высшего оксида, его характер.
6. Формула высшего гидроксида, его характер.
7. Формула летучего водородного соединения, его характер.
Обратить внимание: При рассмотрении пунктов 5 и 7 все формулы высших оксидов и летучих водородных соединений помещены внизу таблицы Д. И. Менделеева, что фактически является «законной шпаргалкой».
И. Менделеева, что фактически является «законной шпаргалкой».
Так как в начале, при характеристике элементов ребята могут испытывать определенные трудности, поэтому им полезно пользоваться «законными шпаргалками» – табл. 1 и др. Потом, по мере накопления опыта и знаний, эти помощники уже не потребуются.
Задание: Охарактеризуйте химический элемент натрий на основании его положения в периодической системе Д.И. Менделеева. (слайд 6)
Работает весь класс, записи поочередно ведут обучающиеся на доске.
Образец ответа. (слайд 7)
Na – натрий
1) 11, 3 период, малый, 1 группа, А
2) 11 р + , 12n 0 , 11 е –
+ 11 2-8-1
1s 2 2s 2 2p 6 3s 1 3p 0 3d 0 – s – элемент
3) Na 0 – 1 e → Na +
восстановитель
R a: Li Mg
по группе по периоду
Ме св-ва: Li Na K Na Mg
по группе по периоду
4) Na : 0, +1
5) Na 2 O – основный оксид
6) NaOH – основание, щелочь.![]()
7) Не образует
IV
Каждый химический элемент образует простое вещество, обладающее определенным строением и свойствами. Простое вещество характеризуют по следующим параметрам: (слайд 8)
1) Тип связи.
2) Тип кристаллической решетки.
3) Физические свойства.
4) Химические свойства (схема).
Образец ответа : (слайд 9)
Металлическая связь [Na 0 – 1 e → Na + ]
– Металлическая кристаллическая решетка
– Твердое вещество, мягкий металл (режется ножом), белого цвета, блестящий, тепло-и электропроводен.
Металл продемонстрировать. Отметить, что в связи с высокой химической активностью, его хранят под слоем керосина.
– Na 0 – 1 e → Na + → взаимодействует с веществами-окислителями
восстановитель
Неметаллы + оксиды металлов (менее активные)
Кислоты + соли
Задание : Запишите уравнения реакций, характеризующие свойства простого вещества натрия. Рассмотрите уравнения с позиций окислительно-восстановительных процессов. (слайд 10)
Рассмотрите уравнения с позиций окислительно-восстановительных процессов. (слайд 10)
Пять учащихся по желанию работают у доски.
1) 2 Na + Cl 2 → 2 NaCl
Cl 2 0 + 2e → 2Cl – │1 окислитель – восстановление
2) 2 Na + 2HCl → 2 NaCl + H 2
Na 0 – 1e → Na + │2 восстановитель – окисление
3) 2 Na + 2H 2 O → 2 NaOH + H 2
Na 0 – 1e → Na + │2 восстановитель – окисление
2H + + 2e → H 2 0 │1 окислитель – восстановление
4) 2 Na + MgO → Na 2 O + Mg
Na 0 – 1e → Na + │2 восстановитель – окисление
Mg 2+ + 2e → Mg 0 │1 окислитель – восстановление
5) 2 Na + CuCl 2 (расплав) → 2 NaCl + Cu
Na 0 – 1e → Na + │2 восстановитель – окисление
Cu 2+ + 2e → Cu 0 │1 окислитель – восстановление
V
Для каждого химического элемента характерно образование сложных веществ различных классов – оксиды, основания, кислоты, соли. Основными параметрами характеристики сложного вещества являются: (слайд 11)
Формула соединения.
Вид связи.
Характер соединения.
Химические свойства соединения (схема).
Образец ответа:
I . Оксид (слайд 12)
Na 2 O
Ионная связь
Химические свойства:
основный оксид + кислота → соль и вода
основный оксид + кислотный оксид → соль
основный оксид + Н 2 О → щелочь
(растворимый оксид)
II. Гидроксид (слайд 13)
1) NaOH
2) Ионная связь
3) Основание, щелочь.
4) Химические свойства:
основание (любое) + кислота = соль + вода
щёлочь + соль = новое основание + новая соль
щёлочь + оксид неметалла = соль + вода
Самостоятельная работа.
Задание: Запишите уравнения реакций, характеризующие свойства оксида и гидроксида. Уравнения рассмотрите с позиций окислительно-восстановительных процессов и ионного обмена. (слайд 14)
Образец ответов.
Оксид натрия:
l ) Na 2 O + 2HC 1 = 2NaCl + Н 2 О (реакция обмена)
2) Na 2 O + SO 2 = Na 2 SO 3 (реакция соединения)
3) Na 2 O + H 2 O = 2NaOH (реакция соединения)
Гидроксид натрия:
1) 2NaOH + H 2 SO 4 = Na 2 SO 4 + 2Н 2 О (реакция обмена)
2Na + + 2ОН – + 2Н + + SO 4 2- = 2Na + + SO 4 2- + 2Н 2 О
ОН – + Н + = Н 2 О
2) 2NaOH + СО 2 = Na 2 CO 3 + Н 2 О (реакция обмена)
2Na + + 2ОН- + СО 2 = 2Na + + СО 3 2- + Н 2 О
3) 2NaOH + CuSO 4 = Na 2 SO 4 + Cu (OH) 2 (реакцияобмена)
2Na + + 2 ОН – + Cu 2+ + SO 4 2- = 2Na + + SO 4 2- + Cu (OH) 2
2OH – + Cu 2+ = Cu (OH ) 2
Вспомнить условия протекания реакций обмена до конца (образование осадка, газа или слабого электролита).
Для натрия, как и для всех металлов, характерно образование генетического ряда: (слайд 15)
Металл → основный оксид → основание (щелочь) → соль
Na → Na 2 O → NaOH → NaCl (Na 2 SO 4 , NaNO 3 , Na 3 PO 4 )
(слайд 16)
§ 1, упр. 1 (б), 3; составить уравнения реакций для генетического ряда Na
Просмотр содержимого презентации
«Характеристика элемента-металла»
Урок: «Характеристика химического элемента-металла на основании его положения в Периодической системе Д. И. Менделеева» урок химии, 9 класс
- актуализировать знания о структуре периодической системы,
- систематизировать знания о составе и строении атома элемента,
- уметь характеризовать элемент на основании его положения в периодической системе,
- систематизировать знания о составе и свойствах соединений, образуемых металлами
Алгоритм
характеристики элемента
- Положение элемента в ПС
а) порядковый номер химического элемента
б) период (большой или малый).
в) группа
г) подгруппа (главная или побочная)
д) относительная атомная масса
а) число протонов (р+), нейтронов (n 0), электронов (е -)
б) заряд ядра
в) число энергетических уровней в атоме
г) число электронов на уровнях
д) электронная формула атома
е) графическая формула атома
ж) семейство элемента.
- Свойства атома
а) способность отдавать электроны (восстановитель)
б) способность принимать электроны (окислитель).
- Возможные степени окисления.
- Формула высшего оксида, его характер.
- Формула высшего гидроксида, его характер.
- Формула летучего водородного соединения, его характер.
Задание: Охарактеризуйте химический элемент натрий на основании его положения в периодической системе Д.И. Менделеева.
Mg по группе по периоду Ме св-ва: Li Na K Na Mg по группе по периоду Na: 0, +1 Na 2 O – основный оксид NaOH – основание, щелочь. Не образует”
Не образует”
- Na – натрий
- 11, 3 период, малый, 1 группа, А
- 11 р +, 12n 0 , 11 е –
- +11 2-8-1
- 1s 2 2s 2 2p 6 3s 1 3p 0 3d 0 – s – элемент
- Na 0 – 1 e → Na +
- восстановитель
- Ra: Li Na Mg
- по группе по периоду
- Ме св-ва: Li Na K Na Mg
- по группе по периоду
- Na : 0, +1
- Na 2 O – основный оксид
- NaOH – основание, щелочь.
- Не образует
- Тип связи
- Тип кристаллической решетки
- Физические свойства
- Химические свойства (схема)
Образец ответа
- Металлическая связь [ Na 0 – 1 e → Na + ]
- Металлическая кристаллическая решетка
- Твердое вещество, мягкий металл (режется ножом), белого цвета, блестящий, тепло – и электропроводен.

- Na – восстановитель → взаимодействует с веществами-окислителями
Неметаллы + кислоты
Вода + соли
Оксиды металлов (менее активные)
Задание : Запишите уравнения реакций, характеризующие свойства простого вещества натрия.
Рассмотрите уравнения с позиций окислительно-восстановительных процессов.
- Формула соединения.
- Вид связи.
- Характер соединения.
- Химические свойства соединения (схема)
Образец ответа: Оксид натрия
- Na 2 O
- Ионная связь
- Солеобразующий, основный оксид.
- Химические свойства:
Основный оксид + кислота → соль и вода
Основный оксид + кислотный оксид → соль
Основный оксид + Н 2 О → щелочь
(растворимый оксид)
Гидроксид натрия
- Ионная связь
- Основание, щелочь.
- Химические свойства:
Щёлочь + кислота = соль + вода
Щёлочь + соль = новое основание + новая соль
Щёлочь + оксид неметалла = соль + вода
Самостоятельная работа
Задание: Запишите уравнения реакций, характеризующие свойства оксида и гидроксида.
Уравнения рассмотрите с позиций окислительно-восстановительных процессов и ионного обмена.
Генетический ряд натрия
Металл → Основный оксид →
→ Основание (щелочь) → Соль
Na → Na 2 O → NaOH → NaCl ( Na 2 SO 4 , NaNO 3 , Na 3 PO 4 )
- упр. 1 (б), 3
- составьте уравнения реакций для генетического ряда Na .
Все многообразие окружающей нас природы состоит из сочетаний сравнительно небольшого числа химических элементов. Так какова же характеристика химического элемента, и чем он отличается от простого вещества?
Химический элемент: история открытия
В различные исторические эпохи в понятие «элемент» вкладывался различный смысл. Древнегреческие философы в качестве таких «элементов» рассматривали 4 «стихии» – тепло, холод, сухость и влажность. Сочетаясь попарно они образовывали четыре «начала» всего на свете – огонь, воздух, воду и землю.
Сочетаясь попарно они образовывали четыре «начала» всего на свете – огонь, воздух, воду и землю.
В XVII веке Р. Бойль указал на то, что все элементы носят материальный характер и их число может быть достаточно велико.
В 1787 году французский химик А. Лавуазье создал «Таблицу простых тел». В нее вошли все известные к тому времени элементы. Под последними понимались простые тела, которые не удавалось разложить химическими методами на еще более простые. Впоследствии выяснилось, что в таблицу вошли и некоторые сложные вещества.
К моменту, когда Д. И. Менделеев открыл периодический закон, было известно всего 63 химических элементов. Открытие ученого не только привело к упорядоченной классификации химических элементов, а также помогло предсказать существование новых, еще не открытых элементов.
Рис. 1. А. Лавуазье.
Что такое химический элемент?
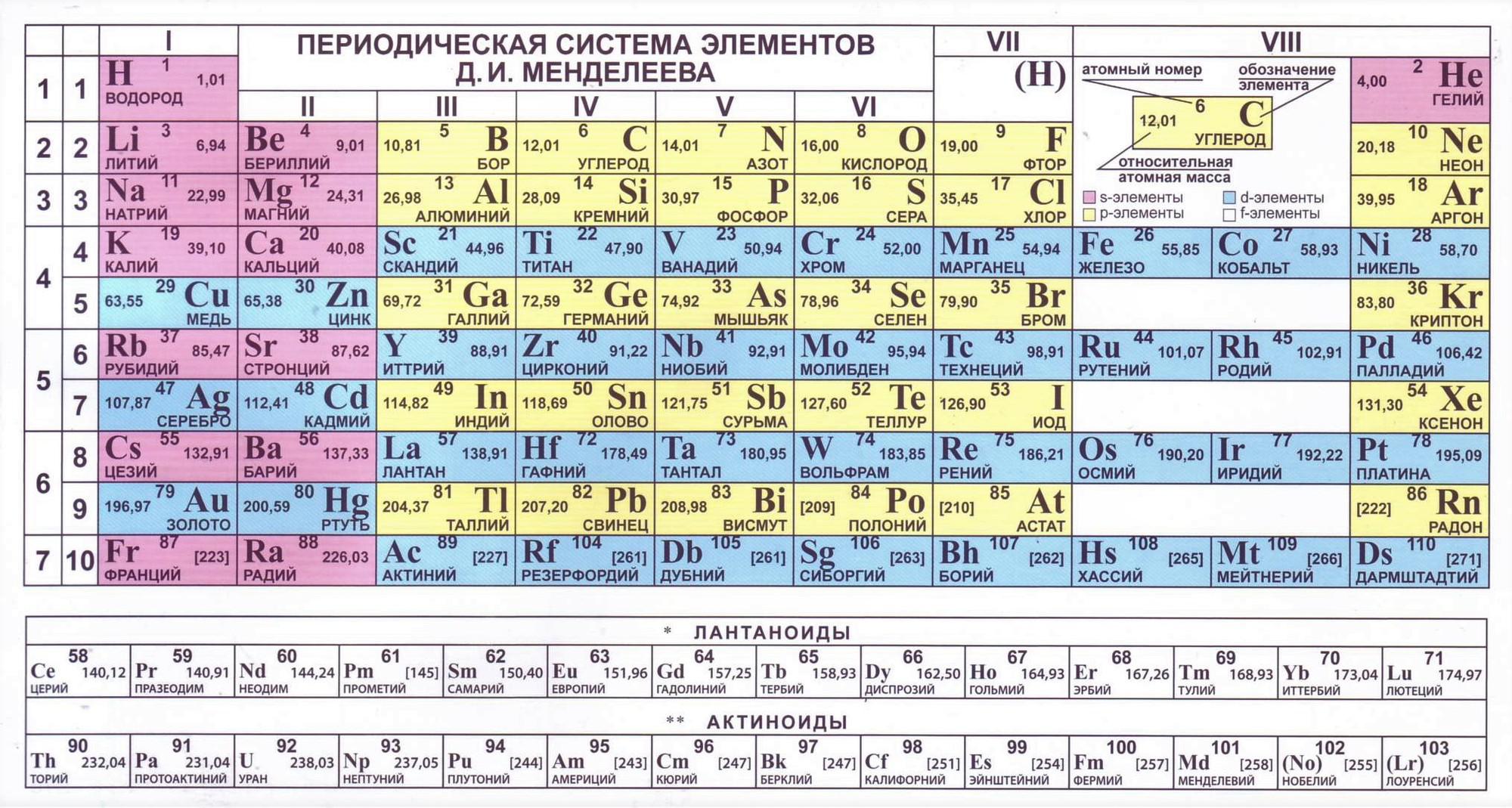
Химическим элементом называют определенный вид атомов. В настоящее время известно 118 химических элементов. Каждый элемент обозначают символом, который представляет одну или две буквы из его латинского названия. Например, элемент водород обозначают латинской буквой H и формулой H 2 – первой буквой латинского названия элемента Hydrogenium. Все достаточно хорошо изученные элементы имеют символы и названия, которые можно найти в главных и побочных подгруппах Периодической системы, где все они расположены в определенном порядке.
Каждый элемент обозначают символом, который представляет одну или две буквы из его латинского названия. Например, элемент водород обозначают латинской буквой H и формулой H 2 – первой буквой латинского названия элемента Hydrogenium. Все достаточно хорошо изученные элементы имеют символы и названия, которые можно найти в главных и побочных подгруппах Периодической системы, где все они расположены в определенном порядке.
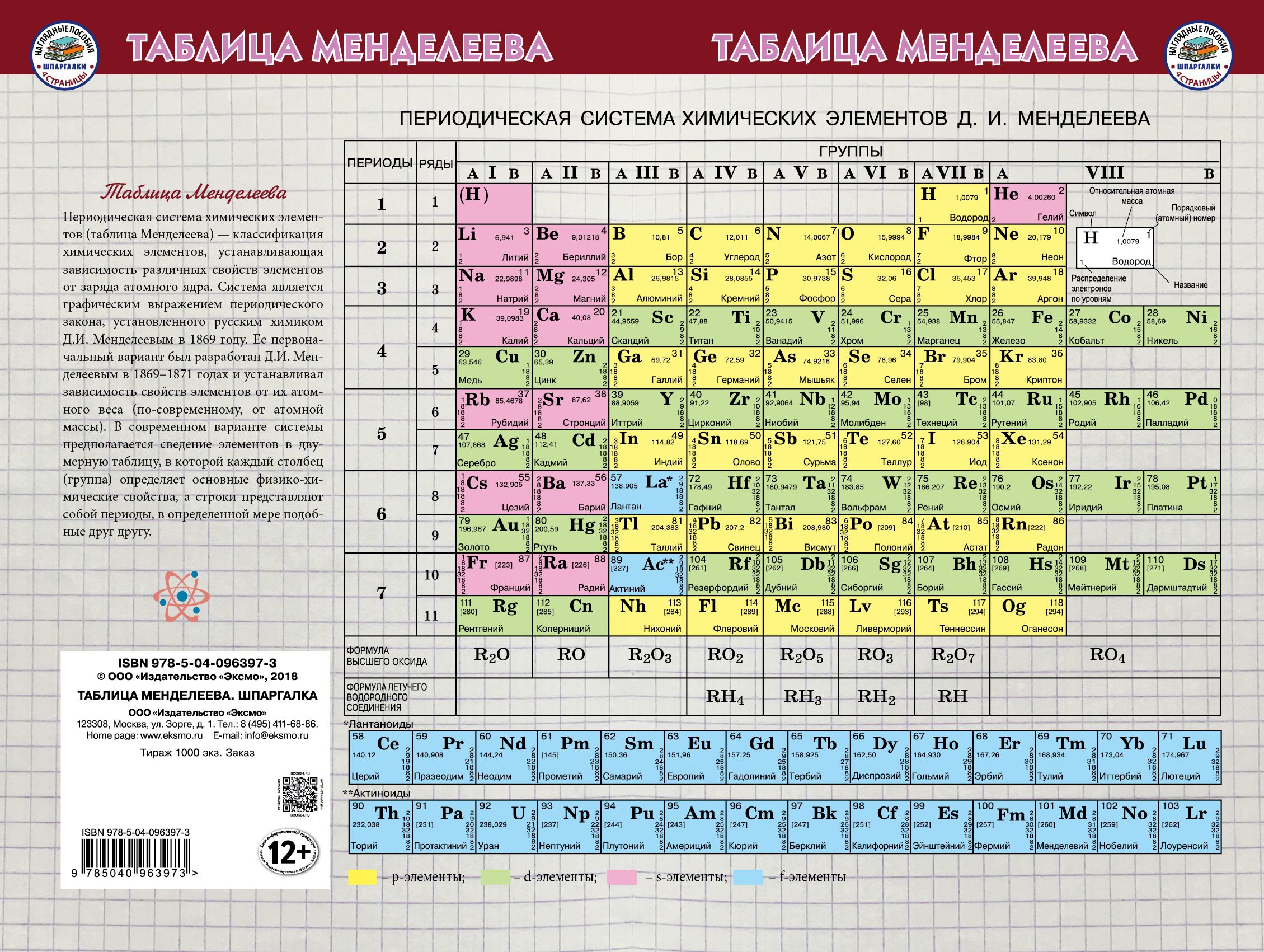
Cуществует много видов систем, но общепринятой является Периодическая система химических элементов Д. И. Менделеева, которая является графическим выражением Периодического закона Д. И. Менделеева. Обычно используют короткую и длинную формы Периодической системы.
Рис. 2. Периодическая система элементов Д. И. Менделеева.
Что же является главным признаком, по которому атом относят к определенному элементу? Д. И. Менделеев и другие ученые-химики XIX века считали главным признаком атома массу как наиболее стабильную его характеристику, поэтому элементы в Периодической системе расположены в порядке возрастания атомной массы (за немногим исключением).
По современным представлениям, главным свойством атома, относящим его к определенному элементу, является заряд ядра. Таким образом, химический элемент – это вид атомов, характеризующихся определенным значением (величиной) части химического элемента – положительного заряда ядра.
Из всех существующих 118 химических элементов большую часть (около 90) можно обнаружить в природе. Остальные же получены искусственно с помощью ядерных реакций. Элементы 104-107 были синтезированы учеными-физиками в Объединенном институте ядерных исследований в городе Дубне. В настоящее время продолжаются работы по искусственному получению химических элементов с более высокими порядковыми номерами.
Все элементы делятся на металлы и неметаллы. Более 80 элементов относятся к металлам. Однако это деление условное. При определенных условиях некоторые металлы могут проявлять неметаллические свойства, а некоторые неметаллы – металлические свойства.
Содержание различных элементов в природных объектах колеблется в широких пределах. 8 химических элементов (кислород, кремний, алюминий, железо, кальций, натрий, калий, магний) составляют 99% земной коры по массе, все остальные – менее 1%. Большинство химических элементов имеют природное происхождение (95), хотя некоторые из них изначально были выведены искусственно (например, прометий).
8 химических элементов (кислород, кремний, алюминий, железо, кальций, натрий, калий, магний) составляют 99% земной коры по массе, все остальные – менее 1%. Большинство химических элементов имеют природное происхождение (95), хотя некоторые из них изначально были выведены искусственно (например, прометий).
Следует различать понятия «простое вещество» и «химический элемент». Простое вещество характеризуется определенными химическими и физическими свойствами. В процессе химического превращения простое вещество утрачивает часть своих свойств и входит в новое вещество в виде элемента. Например, азот и водород, входящие в состав аммиака, содержатся в нем не в виде простых веществ, а в виде элементов.
Некоторые элементы объединяются в группы, такие как органогены (углерод, кислород, водород, азот), щелочные металлы (литий, натрий, калий и т.д.), лантаноиды (лантан, церий и т.д.), галогены (фтор, хлор, бром и т.д.), инертные элементы (гелий, неон, аргон)
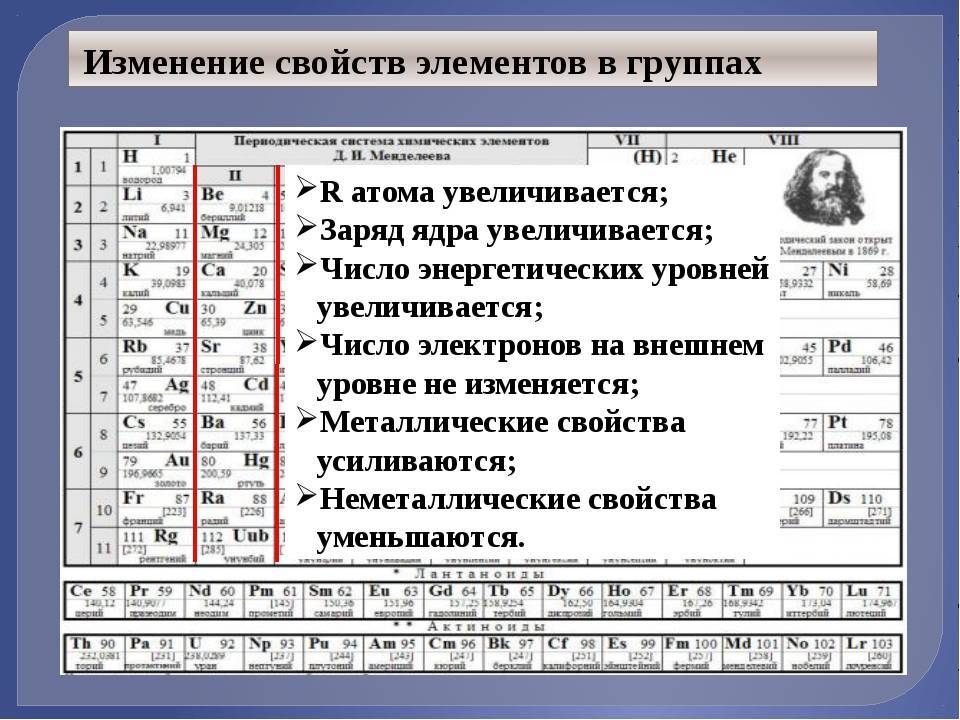
Закономерности изменения некоторых свойств химических элементов в ПС. ХарактеристикаВ пределах периодаВ пределах одной группы (для элементов главных подгрупп) Заряд ядра атома Увеличивается Число энергетических уровней Не изменяется Увеличивается Число электронов на внешнем энергетическом уровне Увеличивается Не изменяется Радиус атома Уменьшается Увеличивается Электроотрицательность УвеличиваетсяУменьшается Восстановительные свойства Уменьшаются Увеличиваются Металлические свойства Уменьшаются Увеличиваются
ХарактеристикаВ пределах периодаВ пределах одной группы (для элементов главных подгрупп) Заряд ядра атома Увеличивается Число энергетических уровней Не изменяется Увеличивается Число электронов на внешнем энергетическом уровне Увеличивается Не изменяется Радиус атома Уменьшается Увеличивается Электроотрицательность УвеличиваетсяУменьшается Восстановительные свойства Уменьшаются Увеличиваются Металлические свойства Уменьшаются Увеличиваются
Натрий Хлор Заряд ядра Число нуклоновp=11, n=12p=17,n=18 Число электроновe=11E=17 Число энергетических уровней 33 Электронная формула 1s 2 2s 2 2p 6 3s 1 1s 2 2s 2 2p 6 3s 2 3p 5 Высшая степень окисления+1+7 Окислительно-восстановительные свойства Восстановитель Окислитель 1. Положение элемента в ПС и строение его атома
Натрий Хлор Оксид натрия Na2O проявляет основные свойства. Ему соответствует основание NaOH. Na 2 O + H 2 O = 2NaOH Na 2 O + 2HCl = 2NaCl + H 2 O Na 2 O + SO 3 = Na 2 SO 4 Высший оксид хлора Cl2O7 является кислотным оксидом. Ему соответствует кислота HClO4. Cl 2 O 7 + H 2 O = 2HClO 4 Cl 2 O 7 + Na 2 O = 2NaClO 4 Cl 2 O 7 + 2NaOH = 2NaClO 4 + H 2 O
Ему соответствует кислота HClO4. Cl 2 O 7 + H 2 O = 2HClO 4 Cl 2 O 7 + Na 2 O = 2NaClO 4 Cl 2 O 7 + 2NaOH = 2NaClO 4 + H 2 O
Натрий Хлор Гидроксид натрия NaOH, является сильным основанием и проявляет свойства, характерные для основания. NaOH + HCl = NaCl + h3O 2NaOH + CO2 = Na2CO3 + h3O 2NaOH + CuCl2 = Cu(OH)2 + 2NaCl Хлорная кислота HClO4 проявляет свойства сильной кислоты. HClO2 + KOH = KClO4 + h3O
(от др.-греч. αλλος «другой», τροπος «поворот, свойство») существование одного и того же химического элемента в виде двух и более простых веществ, различных по строению и свойствам так называемых аллотропических модификаций или аллотропических форм.др.-греч.химического элемента простых веществ
Напишите три характеристики таблицы Менделеева …
Напишите три характеристики таблицы Менделеева.
0 Счастливый Отправить ответ 1084 Взгляды
Любые три характеристики периодической таблицы Менделеева:
- Это было первое ученое и систематическое исследование известных элементов.

- Содержит много групп для неоткрытых элементов.
- Можно изучать свойства нескольких элементов.
0 счастлив
Дополнительные вопросы по классификации элементов
Что подразумевается под классификацией элементов?
Процесс группировки элементов на основе сходства и различия для облегчения распознавания и изучения элемента, его свойств и характеристик называется классификацией элементов.
Запишите вклад Джона Дальтона и Праута в классификацию элементов.
Вклад фон Дальтона в классификацию элементов заключается в том, что он углубил атомную теорию и сказал, что атомы различных элементов имеют разный атомный вес.
Вклад Праута в том, что он сказал, что атомный вес элемента является простым кратным атомного веса водорода.
Что такое периодическая таблица?
Таблица с 7 периодами и 18 группами, составленная таким образом, что в ней можно расположить все элементы в соответствии с их свойствами, сходствами, различиями и т. д., которая помогает в изучении элементов, называется апериодической таблицей.
д., которая помогает в изучении элементов, называется апериодической таблицей.
Что такое закон испытаний Доберейнера? Объясните на подходящих примерах.
Доберейнер расположил элементы в порядке возрастания их атомного веса в хорошо заметные группы из трех элементов, называемые тридами.
Итак, закономерность расположения элементов в каждой триаде, при которой атомный вес средних элементов оказывается средним арифметическим атомных весов двух других элементов, называется законом испытаний Доберейнера.
Например,
Элементы: Li Na K
Атомный вес: 7 23 39
Итак, 23 = (7+39) / 2
Опишите закон октав Ньюленда, говорит подходящий пример.
Закон октав Ньюленда гласил: «Элементы, расположенные в порядке возрастания их атомного веса, показывают сходство физических и химических свойств между восьмым и первым элементами, подобными восьмой и первой нотам музыкальной гаммы».
Например, калий является восьмым элементом после натрия.
Эти элементы имеют схожие физические и химические свойства.
Что легло в основу периодической таблицы Менделеева?
Порядок возрастания атомного веса лег в основу периодической таблицы Менделеева.
Периодическая таблица Менделеева.
Периодическая таблица Менделеева утверждает, что «физические и химические свойства элементов являются периодической функцией их атомного веса».
Укажите любые дефекты или аномалии в периодической таблице Менделеева.
Любые 4 дефекта в периодической таблице Менделеева:
- Инертный газ или инертные газы отсутствовали.
- Он не может упорядочить лантаноиды и актиноиды.
- Восемь его групп не делились на подгруппы.
- Он не мог упорядочить изотопы.
Что легло в основу современной периодической таблицы?
Порядок возрастания атомного номера элементов был основой современной периодической таблицы.
Состояние современного периодического правила.
Современное периодическое правило гласит, что «физические и химические свойства элементов являются периодической функцией их атомного номера».
Как современная таблица Менделеева устраняет все недостатки таблицы Менделеева?
В современной периодической таблице физические и химические свойства элементов заменены периодической функцией их атомных номеров вместо атомного веса, что решает проблему с изотопами. Все изотопы какого-либо элемента представлены одним и тем же атомным номером. Все пробелы периодической таблицы Менделеева заполняются открытием новых элементов. Разработана колонна для инертных газов, и все группы имеют подгруппы. Таким образом, современная периодическая таблица устраняет все недостатки…
Что такое лантаноиды и актиниды? Почему они хранятся или помещаются в конец периодической таблицы?
14 элементов, начиная с церия и заканчивая лютецием, называются лантаноидами.
Элементы от тория до лоуренсия после актиния называются актинидами.
Эти элементы помещены в конец таблицы Менделеева из-за их схожих свойств. Лантаниды являются редкими металлами, тогда как актиниды являются искусственными радиоактивными металлами. Они проявляют сходные свойства с переходными элементами. Поэтому они размещаются отдельно под переходными элементами в блоках современной таблицы Менделеева.
Что такое периоды и группы? Сколько периодов в современной периодической таблице?
Горизонтальные ряды периодической таблицы, в которых элементы расположены в соответствии с их сходством и различием для облегчения их изучения, называются периодами.
Вертикальные столбцы, в которых расположены элементы для распознавания свойств и других исследований, называются группами.
Что такое элементы s-блока и p-блока? Запишите их положение в современной таблице Менделеева.
Элементы, в которых последний электрон выходит на s-орбиталь, называются элементами s-блока.
Элементы, в которых последний электрон выходит на р-орбиталь самой внешней оболочки, называются р-блочными элементами.
Положение элементов s-блока – группы IA и IIA.
Позиции элементов p-блока от IIIB до IIBgroup в таблице Менделеева
Что такое валентные электроны? Какое изменение валентности наблюдается при движении слева направо в периоде?
Электроны, находящиеся на самой внешней оболочке или валентной оболочке атома, называются валентными электронами.
В период валентность увеличивается до 4-й группы и снижается до 8-й группы и снова увеличивается.
Что такое металлоиды? Приведите любые три примера.
Элемент, который проявляет характеристики или свойства как металлов, так и неметаллов, называется металлоидами. Любые 3 примера:
- Кремний (Si)
- Германий (Ge)
- Мышьяк (As)
Дифференциация Менделеева и современной таблицы Менделеева Периоды и группы s-блочные и р-блочные элементыЩелочные металлы и галогеныЩелочные металлы и щелочноземельные металлыДуплетные стабильные и октетные…
а. Менделеев и современная таблица Менделеева.
Менделеев и современная таблица Менделеева.
| Менделеевский | Современный |
| Поддержал первое научное изучение элементов. | Это последняя и стандартная таблица элементов. |
| Элементы расположены в порядке возрастания их атомного веса. | Элементы расположены в порядке возрастания их атомного номера. |
| В нем было несколько пробелов для неоткрытых элементов. | Большинство элементов обнаружено и расставлено. |
| Не удалось расположить изотопы. | Умеет упорядочивать изотопы. |
| Это… |
Почему натрий хранится в s-блоке, а хлор в p-блоке?
Мы знаем, что у натрия положительная валентность, а у хлора отрицательная. Последний электрон натрия переходит на s-орбиталь, а электрон хлора — на р-орбиталь самой внешней оболочки. Таким образом, натрий находится в s-блоке, а хлор — в p-блоке.
Калий более реакционноспособен, чем натрий. Почему?
Мы знаем, что и калий, и натрий являются металлами и теряют валентные электроны. Атомный размер калия больше, чем у натрия. Таким образом, валентный электрон калия легче захватывается другими реагирующими атомами, чем электрон натрия. Следовательно, калий более реакционноспособен, чем натрий.
Почему фтор более активен, чем хлор?
Мы знаем, что атомный размер фтора меньше, чем у хлора. Итак, ядерное притяжение больше на валентной оболочке атома фтора. В результате фтор может легче получить один электрон в ходе химической реакции. Следовательно, фтор более реакционноспособен, чем хлор.
Почему элементы f-блока также называют внутренними переходными элементами?
Мы знаем, что свойства элементов f-блока аналогичны свойствам переходных металлов d-блока, однако их последний электрон переходит на счет f-орбитали. Таким образом, элементы f-блока хранятся отдельно под элементами d-блока или переходными элементами. Следовательно, эти элементы называются внутренними переходными элементами.
Следовательно, эти элементы называются внутренними переходными элементами.
Почему элементы 2 группы называют щелочноземельными металлами?
Мы знаем, что щелочноземельные металлы находятся на поверхности земли в виде оксидов, которые проявляют свойства, подобные свойствам щелочных металлов. Итак, эти элементы называются щелочноземельными металлами.
Элементы нулевой группы называются инертными газами. Почему?
Мы знаем, что каждый элемент нулевой группы достиг стабильной электронной конфигурации, будучи стабильным дуплетом или стабильным октетом. Они имеют нулевую валентность и не принимают участия ни в одной химической реакции. Итак, элементы нулевой группы называются инертным газом.
Реакционная способность металлов увеличивается при движении сверху вниз по группе. Почему?
Когда мы движемся сверху вниз по периодическим группам металлов, атомный размер постепенно увеличивается. За счет этого снижается ядерное притяжение к валентному электрону. В результате возрастает склонность атомов металла к потере электронов. Следовательно, химическая активность металлов возрастает при движении сверху вниз в группе.
В результате возрастает склонность атомов металла к потере электронов. Следовательно, химическая активность металлов возрастает при движении сверху вниз в группе.
Реакционная способность неметаллов уменьшается при движении вниз по группе. Почему?
Когда мы движемся сверху вниз в группе неметаллов, размер атома постепенно увеличивается. Следовательно, ядерное притяжение для входящих электронов уменьшается. В результате тенденция неметаллических атомов к присоединению электронов уменьшается. Поэтому химическая активность неметаллов уменьшается при движении вниз по группе.
Лантаниды и актиноиды хранятся ниже основной таблицы. Почему?
Мы знаем, что лантаноиды — редкоземельные металлы, а актиниды — радиоактивные металлы. Свойства лантаноидов очень похожи друг на друга, но отличаются от остальных элементов из-за преимущественного заполнения f-орбиталей. Так, они размещены отдельно, чтобы избежать ненужного бокового расширения таблицы Менделеева.
От каких факторов зависит период элементов в таблице Менделеева
Периодическая таблица Менделеева – значение, определение, характеристики, недостатки, часто задаваемые вопросы
Периодическая таблица Менделеева – Все мы знаем, что наша периодическая таблица содержит 118 элементов. Природные элементы составляют 94 из 118 элементов, тогда как искусственные элементы составляют 24. В 1800 году было известно только 30 элементов. Ученые с трудом запоминали элементы и их свойства по мере того, как открывалось все больше. Они начали собирать и классифицировать информацию об элементах. Широкое распространение получила табличная категоризация предметов на основе их атрибутов. Периодическая таблица представляет собой структуру табличной формы, в которой различные элементы сгруппированы в соответствии с их свойствами.
Природные элементы составляют 94 из 118 элементов, тогда как искусственные элементы составляют 24. В 1800 году было известно только 30 элементов. Ученые с трудом запоминали элементы и их свойства по мере того, как открывалось все больше. Они начали собирать и классифицировать информацию об элементах. Широкое распространение получила табличная категоризация предметов на основе их атрибутов. Периодическая таблица представляет собой структуру табличной формы, в которой различные элементы сгруппированы в соответствии с их свойствами.
Введение в периодическую таблицу Менделеева
Наиболее важным вкладом в раннее создание периодической таблицы был русский ученый Дмитрий Иванович Менделеев. Было создано много периодических таблиц, но Менделеевская таблица является самой важной.
Периодическая таблица Менделеева была введена в 1869 году после отклонения закона октав Ньюлендса. Элементы были расположены в периодической таблице Менделеева в соответствии с их основными свойствами, атомной массой и химическими характеристиками. Во времена Менделеева было известно всего 63 элемента. Менделеев обнаружил, что свойства элементов периодически связаны с атомной массой после анализа их качеств. Он упорядочил элементы в периодической таблице так, чтобы элементы с сопоставимыми свойствами находились в одних и тех же вертикальных столбцах.
Во времена Менделеева было известно всего 63 элемента. Менделеев обнаружил, что свойства элементов периодически связаны с атомной массой после анализа их качеств. Он упорядочил элементы в периодической таблице так, чтобы элементы с сопоставимыми свойствами находились в одних и тех же вертикальных столбцах.
Менделеев создал ряд элементов в порядке возрастания атомного веса. Он останавливал этот ряд и начинал новый под ним, как только определялось, что атрибуты элементов повторяются. Элемент, который отображал повторение свойств, был помещен в первый слот этой новой строки.
Читайте также:
- Решения NCERT для 11 класса по химии
- NCERT Решения для 12 класса по химии
- NCERT Решения для всех предметов
Что такое Периодический закон Менделеева?
«Физические и химические свойства элементов являются периодическими функциями их атомных весов», — утверждает закон Менделеева.
Что такое метод Менделеева для расположения элементов?
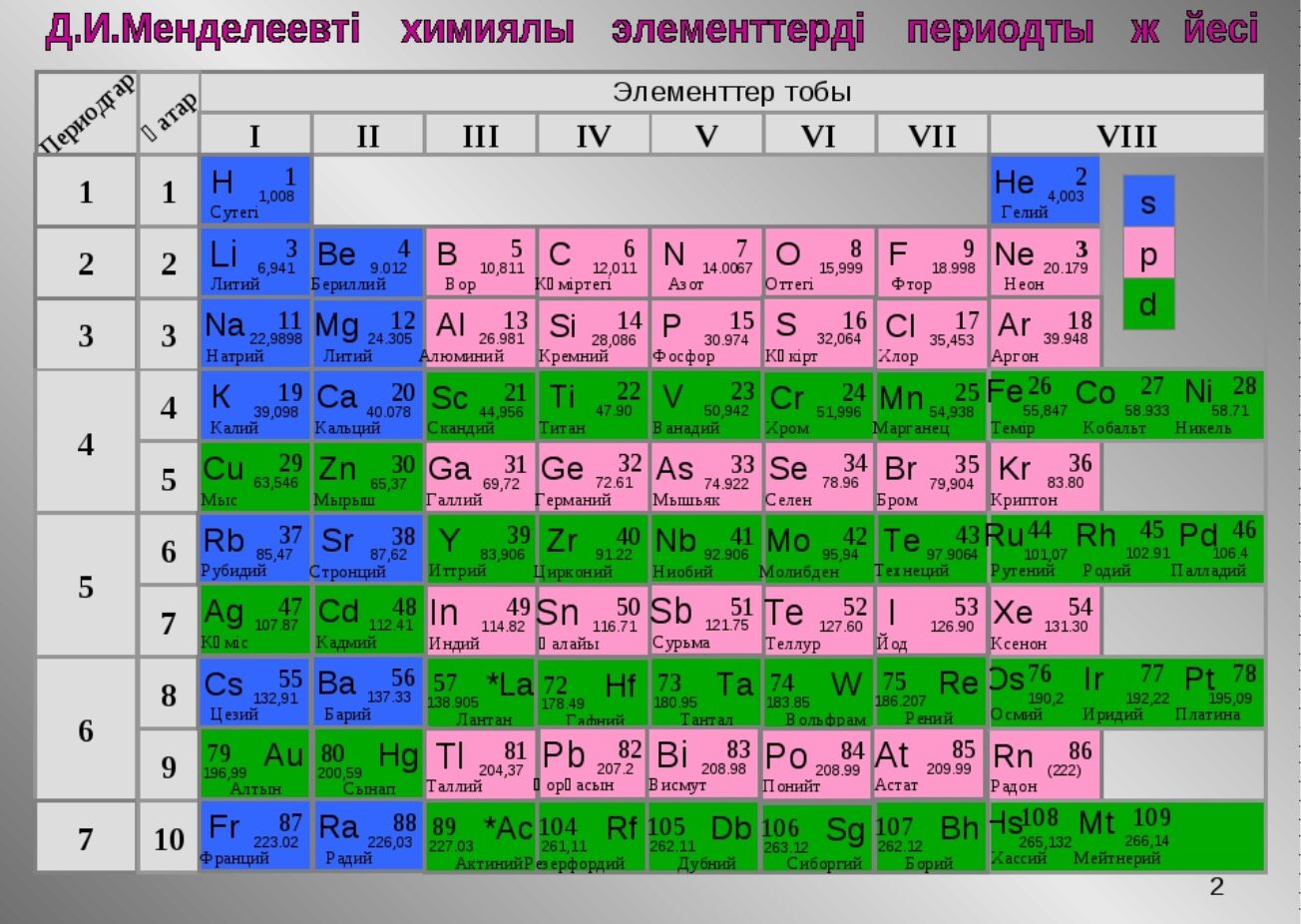
Менделеев впервые расположил элементы в порядке возрастания атомного веса, один под другим. Элементы с сопоставимыми характеристиками группируются вместе. В том же горизонтальном ряду вы найдете элементы с одинаковыми атрибутами. Ниже приводится исходная периодическая таблица Менделеева, опубликованная в 1869 г..
Обратный порядок элементов в периодической таблице Менделеева поможет вам лучше понять ее.
Элементы расположены горизонтально в порядке возрастания атомной массы.
«Точка» — это горизонтальное расположение элементов.
Когда элемент имеет высокую степень сходства с более ранним элементом, новый элемент вставляется непосредственно под более ранним элементом с сопоставимыми свойствами, чтобы начать новый период.
«Столбец» образован периодами, наложенными друг на друга (группа).
 Таким образом, периодическая таблица Менделеева состоит из горизонтальных рядов и вертикальных столбцов, или периодов и групп.
Таким образом, периодическая таблица Менделеева состоит из горизонтальных рядов и вертикальных столбцов, или периодов и групп.Если элементы похожи, но не идентичны, они помещаются ниже, но на некотором расстоянии друг от друга, чтобы различать их. Каждый столбец будет разделен на два подстолбца (A и B), причем компоненты из одних и тех же подстолбцов будут иметь большее сходство.
Характеристики периодической таблицы Менделеева
В периодической таблице Менделеева вертикальные столбцы и горизонтальные строки были классифицированы как группы и периоды соответственно.
Периодическая таблица разделена на семь горизонтальных строк или периодов с номерами от 1 до 7.
Атрибуты компонентов в горизонтальных рядах (периоды) имеют предсказуемый градиент слева направо.
Восемь вертикальных столбцов или групп составляют периодическую таблицу.
 Они пронумерованы от одного до восьми.
Они пронумерованы от одного до восьми.Чтобы различать похожие, но не идентичные элементы, он располагается ниже и немного в стороне от другого. В результате каждый столбец будет иметь два подстолбца A и B, что позволит сделать компоненты в одних и тех же подстолбцах более сопоставимыми.
Нормальные элементы относятся к группам с I по VII, а переходные элементы относятся к группе VIII.
Группы с I по VII разделены на две подгруппы, причем группа VIII включает три элемента.
Классы с 4-го по 7-й делятся на две серии: 1-я и 2-я серии.
Элементы с сопоставимыми характеристиками были сгруппированы вместе. Примерами являются литий, калий, рубидий и другие элементы первой группы.
Читайте также:
- Примечания NCERT Класс 11 Химия Глава 3 Классификация элементов и периодичность свойств
- Решения NCERT для класса 11 по химии, глава 3 Классификация элементов и периодичность свойств
- Образец NCERT, класс 11, решения по химии, глава 3 Классификация элементов и периодичность свойств
Достоинства периодической таблицы Менделеева
В компоновке , подобию в свойствах отдавался больший приоритет, чем атомной массе.

Йод, несмотря на меньшую массу (127), чем теллур (128), расположен позже, потому что он больше похож на хлор и бром, чем на кислород и серу. Точно так же увеличение атомной массы мало влияет на кобальт и никель.
Коррекция атомной массы
Элементы бериллия, индия, золота и платины, согласно прогнозам, имеют неправильную массу на основе периодических свойств, что привело к переоценке их истинной массы.
Предсказание новых элементов
Он смог предсказать существование и свойства трех элементов со свойствами, сравнимыми с бором, алюминием и кремнием. Эка-бор, эка-алюминий и эка-кремний были названиями этих элементов. Они были выделены и получили названия скандий, галлий и германий.
Их оксиды и галогениды имели экспериментально определенные атомный вес, физические свойства и химические формулы, которые были идентичны ожидаемым Менделеевым. Неполные периоды предполагают существование элементов, которые еще предстоит открыть.
Неполные периоды предполагают существование элементов, которые еще предстоит открыть.
Примечания NCERT по химии:
- Примечания NCERT по химии 11 класса
- Примечания NCERT по химии 12 класса
- Примечания NCERT по всем предметам 90 241
Поскольку он содержит свойства как щелочных металлов, так и галогенов, таблица Менделеева не могла присвоить Водороду действительное положение. Водород, как и щелочные металлы, может образовывать соединения с галогенами, кислородом и серой. Водород, как и галогены, имеет двухатомные молекулы и образует ковалентные соединения с металлами и неметаллами.
Поскольку одним из критериев в таблице Менделеева является атомная масса, изотопы одного и того же элемента должны быть помещены в разные ячейки. Это может привести к серьезной ошибке.

Атомные массы элементов не возрастают последовательно, как видно из таблицы. В результате невозможно сказать, сколько будет открыто элементов с атомными массами, попадающими между двумя существующими атомными массами.
- NCERT Exemplar Class 11th Chemistry Solutions
- NCERT Exemplar Class 12th Chemistry Solutions
- NCERT Exe Решения mplar для всех предметов
Недостатки периодической таблицы Менделеева
Также проверьте-
Часто задаваемые вопросы (FAQ) – Периодическая таблица Менделеева – значение, определение, характеристики, недостатки, часто задаваемые вопросы
Вопрос: 6. Периодическая таблица Менделеева основана на _________?Ответ:
Периодическая таблица Менделеева основана на атомной массе.
Вопрос: Чем отличается периодическая таблица Менделеева от современной?Ответ:
Основное отличие состоит в том, что элементы в периодической таблице Менделеева расположены по атомной массе, а в современной таблице Менделеева элементы расположены по атомному номеру. Поскольку элементы постоянно открываются, в периодической таблице Менделеева было значительно меньше элементов.
Поскольку элементы постоянно открываются, в периодической таблице Менделеева было значительно меньше элементов.
Ответ:
Менделеев наиболее известен разработкой периодического закона и периодической таблицы элементов, которые он разработал в 1869 году..
Вопрос: Каково общее количество элементов в современной периодической таблице?Ответ:
Современная таблица Менделеева содержит 118 элементов.
Вопрос: Дайте определение периодическому закону Менделеева?Ответ:
«Физические и химические свойства элементов являются периодическими функциями их атомных масс», согласно периодическому закону Менделеева.
Вопрос: Какие элементы были предсказаны Менделеевым в его периодической таблице до фактического открытия элементов?Ответ:
Менделеев оставил места для эка-алюминия, который позже оказался галлием, а эка-кремний – германием.


 Таким образом, периодическая таблица Менделеева состоит из горизонтальных рядов и вертикальных столбцов, или периодов и групп.
Таким образом, периодическая таблица Менделеева состоит из горизонтальных рядов и вертикальных столбцов, или периодов и групп. Они пронумерованы от одного до восьми.
Они пронумерованы от одного до восьми.