Химические элементы и их соединения. Закономерности изменения свойств.
Задание №1
Для выполнения задания используйте следующий ряд химических элементов. Ответом в задании является последовательность цифр, под которыми указаны химические элементы в данном ряду.- 1. Na
- 2. K
- 3. Si
- 4. Mg
- 5. C
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде.
Расположите выбранные элементы в порядке возрастания их металлических свойств.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
РешениеОтвет: 341
Пояснение:
Из представленных элементов в одном периоде находятся три – это натрий Na, кремний Si и магний Mg.
При движении в рамках одного периода Периодической таблицы Д.И. Менделеева (горизонтальные строки) справа налево усиливается способность атома отдавать электроны, расположенные на внешнем слое, т. е. возрастают металлические свойства элементов. Таким образом, металлические свойства натрия, кремния и магния усиливаются в ряду Si<Mg<Na.
е. возрастают металлические свойства элементов. Таким образом, металлические свойства натрия, кремния и магния усиливаются в ряду Si<Mg<Na.
Задание №2
Для выполнения задания используйте следующий ряд химических элементов. Ответом в задании является последовательность цифр, под которыми указаны химические элементы в данном ряду.
- 1. Ba
- 2. Al
- 3. N
- 4. Cl
- 5. Ca
Из указанных в ряду химических элементов выберите три с выраженными металлическими свойствами.
Расположите выбранные элементы в порядке увеличения их атомного радиуса.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
РешениеОтвет: 251
Пояснение:
Из представленных элементов азот и хлор являются неметаллами, барий и кальций – щелочно-земельные металлы (элементы 2-й группы), алюминий – амфотерный металл (проявляющий в зависимости от условий как кислотные, так и основные свойства). Металлические свойства элементов увеличиваются сверху вниз по группе и справа налево по периоду Периодической системы Д.И. Менделеева.
Металлические свойства элементов увеличиваются сверху вниз по группе и справа налево по периоду Периодической системы Д.И. Менделеева.
Таким образом, металлические свойства (как и способность атома к отрыву электрона) увеличиваются от амфотерных к щелочно-земельным и особенно щелочным. В ряду Al-Ca-Ba возрастает способность атомов к отрыву электрона и усиливаются металлические свойства данных металлов.
Задание №3
Для выполнения задания используйте следующий ряд химических элементов. Ответом в задании является последовательность цифр, под которыми указаны химические элементы в данном ряду.
- 1. Cl
- 2. K
- 3. Br
- 4. F
- 5. Ca
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одной группе.
Расположите выбранные элементы в порядке увеличения числа электронных слоев.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Ответ: 413
Пояснение:
Из представленных элементов калий является элементом 1-й группы, кальций – 2-й группы Периодической системы Д.И. Менделеева.
Неметаллы хлор, бром и фтор являются галогенами и расположены в одной 17-й группе. Число электронных слоев атома соответствует номеру периода Периодической таблицы химических элементов. Таким образом, фтор, находясь во 2-м периоде, содержит 2 электронных слоя, хлор – 3 слоя, бром – 4 слоя.
Задание №4
Для выполнения задания используйте следующий ряд химических элементов. Ответом в задании является последовательность цифр, под которыми указаны химические элементы в данном ряду.
- 1. Cl
- 2. N
- 3. C
- 4. Be
- 5. P
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде.
Расположите выбранные элементы в порядке возрастания их атомного радиуса.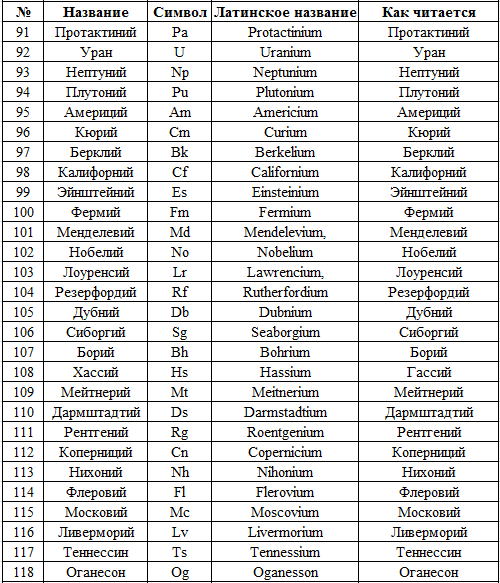
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
РешениеОтвет: 234
Пояснение:
Из представленных элементов в одном периоде расположены бериллий, углерод и азот. Атомный радиус, как и металлические свойства, возрастают при переходе от неметаллов к металлам, т.е. сверху вниз по группе и справа налево по периоду Периодической системы Д.И. Менделеева. Размер радиуса атома коррелирует с количеством электронов на внешнем электронном слое: при движении слева направо по периоду таблицы Д.И. Менделеева (т.е. с увеличением количества электронов на внешнем слое атома) валентные электроны сильнее притягиваются к ядру и, следовательно, радиус атома уменьшается.
Таким образом, в ряду N-C-Be размер радиуса увеличивается.
Задание №5
Для выполнения задания используйте следующий ряд химических элементов. Ответом в задании является последовательность цифр, под которыми указаны химические элементы в данном ряду.
- 1. Cl
- 2. F
- 3. Br
- 4. Cu
- 5. Fe
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в главной подгруппе.
Расположите выбранные элементы в порядке увеличения их электроотрицательности.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
РешениеОтвет: 312
Пояснение:
Из представленных элементов железо и медь расположены в побочных подгруппах 8-й и 11-й групп Периодической таблицы химических элементов соответственно.
Неметаллы хлор, бром и фтор являются галогенами и расположены в главной подгруппе 7-й группы. Наиболее электроотрицательным элементом является фтор, обладающий жесткой электронной оболочкой, у которого до завершения внешнего электронного слоя не хватает одного электрона.
Электроотрицательность галогенов по группе сверху вниз (с увеличением числа электронных слоев) уменьшается, следовательно, в ряду Br-Cl-F электроотрицательность элементов возрастает.
Задание №6
Для выполнения задания используйте следующий ряд химических элементов. Ответом в задании является последовательность цифр, под которыми указаны химические элементы в данном ряду.
- 1. He
- 2. P
- 3. Al
- 4. Cl
- 5. Li
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде.
Расположите выбранные элементы в порядке возрастания их неметаллических свойств.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
РешениеОтвет: 324
Пояснение:
Из представленных элементов три элемента, расположенные в одном периоде Периодической таблицы Д.И. Менделеева, – это Al, P, Cl (3-й период).
Неметаллические свойства элементов возрастают слева направо по периоду и снизу вверх по группе Д.И. Менделеева. Среди трех элементов Al, P, Cl наибольшими неметаллическими свойствами обладает хлор, у которого для завершения внешнего электронного уровня не хватает одного электрона.
Таким образом, в ряду Al-P-Cl усиливается способность атомов притягивать электрон, следовательно, неметаллические свойства элементов возрастают.
Задание №7
Для выполнения задания используйте следующий ряд химических элементов. Ответом в задании является последовательность цифр, под которыми указаны химические элементы в данном ряду.
- 1. B
- 2. Al
- 3. F
- 4. Fe
- 5. N
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде.
Расположите выбранные элементы в порядке уменьшения электроотрицательности.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
РешениеОтвет: 351
Пояснение:
Алюминий – амфотерный металл 3-го периода, железо – металл 4-го периода Периодической системы Д.И. Менделеева.
Оставшиеся элементы – бор, фтор, азот – расположены во 2-м периоде Периодической таблицы химических элементов.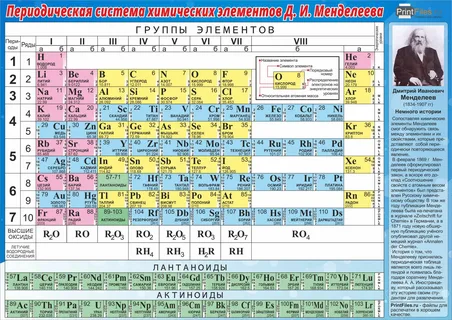
Фтор, обладающий жесткой электронной оболочкой (7 электронов на внешнем слое и 2 электронных уровня), является наиболее электроотрицательным элементом. До завершения внешнего электронного слоя у него не хватает одного электрона.
Электроотрицательность элементов, расположенных в одном периоде, уменьшается справа налево, следовательно, электроотрицательность элементов уменьшается в ряду F>N>B.
Задание №8
Для выполнения задания используйте следующий ряд химических элементов. Ответом в задании является последовательность цифр, под которыми указаны химические элементы в данном ряду.
- 1. Cs
- 2. C
- 3. Al
- 4. Rb
- 5. Ca
Из указанных в ряду химических элементов выберите три элемента, простые вещества которых при взаимодействии с водой образуют щелочи.
Расположите выбранные элементы в порядке возрастания их активности в реакции с водой.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Ответ: 541
Пояснение:
Щелочи – растворимые в воде сильные основания, или гидроксиды щелочных и щелочно-земельных металлов.
Среди представленных элементов щелочными металлами (элементы главной подгруппы первой группы) являются рубидий и цезий, щелочно-земельным металлом (элементы главной подгруппы второй группы, кроме магния и бериллия) – кальций.
При взаимодействии с водой наиболее бурно взаимодействуют щелочные металлы, чья активность увеличивается сверху вниз по группе и связана с легкостью отрыва электрона с внешнего энергетического уровня. Таким образом, металлические свойства среди представленных металлов увеличиваются в ряду Ca>Rb>Cs. В такой же последовательности возрастает активность их взаимодействия с водой.
Задание №9
Для выполнения задания используйте следующий ряд химических элементов. Ответом в задании является последовательность цифр, под которыми указаны химические элементы в данном ряду.
- 1. Cu
- 2. N
- 3. P
- 4. Cr
- 5. Fe
Из указанных в ряду химических элементов выберите три переходных элемента.
Расположите выбранные элементы в порядке увеличения заряда их ядра.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
РешениеОтвет: 451
Все переходные элементы расположены в таблице Менделеева между двумя первыми и шестью последними элементами каждого периода. Азот и фосфор находятся во 2-м и 3-м периодах соответственно и, как можно заметить, в данных периодах между двумя первыми элементами и шестью последними химических элементов нет. Таким образом переходными элементами являются медь, хром, железо.
Заряд ядра атома химического элемента равен его порядковому номеру в таблице Менделеева. Таким образом, в порядке увеличения заряда ядра выбранные элементы расположатся в следующую последовательность: хром-железо-медь (451).
Задание №10
Для выполнения задания используйте следующий ряд химических элементов. Ответом в задании является последовательность цифр, под которыми указаны химические элементы в данном ряду.
Ответом в задании является последовательность цифр, под которыми указаны химические элементы в данном ряду.
- 1. Al
- 2. Mg
- 3. Br
- 4. F
- 5. Na
Из указанных в ряду химических элементов выберите три, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде.
Расположите выбранные элементы в порядке возрастания их атомного радиуса.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
РешениеОтвет: 125
Пояснение:
В одном периоде находятся алюминий, магний и натрий. Размер атома увеличивается при движении по таблице влево и вниз. Таким образом, ответ 125.
Задание №11
Для выполнения задания используйте следующий ряд химических элементов. Ответом в задании является последовательность цифр, под которыми указаны химические элементы в данном ряду.
- 1. Ne
- 2. He
- 3.
 Na
Na - 4. F
- 5. O
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева расположены в одном периоде.
Расположите выбранные элементы в порядке заполнения внешнего электронного слоя.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
РешениеОтвет: 541
Пояснение:
В одном периоде находятся Ne, F, O. Выбранные элементы в порядке заполнения внешнего электронного слоя (в порядке увеличения количества электронов внешнего слоя) O-F-Ne.
Задание №12
Для выполнения задания используйте следующий ряд химических элементов. Ответом в задании является последовательность цифр, под которыми указаны химические элементы в данном ряду.
- 1. Cr
- 2. Zn
- 3. O
- 4. S
- 5. Fe
Из указанных в ряду химических элементов выберите три элемента, способные образовывать сложные соединения, проявляющие амфотерные свойства.
Расположите выбранные элементы в порядке увеличения их относительной атомной массы.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
РешениеОтвет: 152
Пояснение:
Амфотерные свойства проявляют оксиды и гидроксиды металлов в степени окисления +3,+4, а также оксиды и гидроксиды цинка и бериллия (как исключение). Хром и железо могут образовывать амфотерные соединения, т.к. для них существуют оксиды и гидроксиды, содержащие металл в степени окисления +3 (Cr2O3 , Cr(OH)3 и Fe2O3 , Fe(OH)3). Оксид и гидроксид двухвалентного металла цинка относятся к амфотерным как исключение (аналогично Be). Выбранные элементы в порядке увеличения их атомной массы: Cr-Fe-Zn (152).
Задание №13
Для выполнения задания используйте следующий ряд химических элементов. Ответом в задании является последовательность цифр, под которыми указаны химические элементы в данном ряду.
- 1. Al
- 2. Si
- 3. Mg
- 4. C
- 5. N
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде.
Расположите выбранные элементы в порядке уменьшения электроотрицательности.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
РешениеОтвет: 213
Пояснение:
В одном периоде находятся алюминий, кремний и магний. Электроотрицательность элементов главных групп возрастает при движении по таблице Менделеева вверх и вправо, т.е. последовательность, в соответствии с увеличением электроотрицательности, будет иметь вид 213.
Задание №14
Для выполнения задания используйте следующий ряд химических элементов. Ответом в задании является последовательность цифр, под которыми указаны химические элементы в данном ряду.
- 1. P
- 2.
 Cu
Cu - 3. Zn
- 4. Si
- 5. Cl
Из указанных в ряду химических элементов выберите три элемента, относящихся к неметаллам и расположите их порядке возрастания восстановительных свойств.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
РешениеОтвет: 514
Пояснение:
Неметаллы среди прочих элементов можно распознать по их положению в таблице Менделеева – неметаллы расположены выше диагонали бор-астат в главных подгруппах (кроме VIIIA):
Восстановительные свойства простых веществ, образованных различными химическими элементами, в таблице Менделеева возрастают справа-налево и сверху-вниз.
Задание №15
Для выполнения задания используйте следующий ряд химических элементов. Ответом в задании является последовательность цифр, под которыми указаны химические элементы в данном ряду.
- 1. Na
- 2. B
- 3. Al
- 4. As
- 5. P
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке уменьшения электроотрицательности.
И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке уменьшения электроотрицательности.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
РешениеОтвет: 531
Пояснение:
В одном периоде находятся натрий, алюминий и фосфор. Поскольку электроотрицательность атомов химических элементов уменьшается при движении влево и вниз по таблице Менделеева, указанные элементы следует расположить в следующем порядке: P, Al, Na.
Задание №16
Для выполнения задания используйте следующий ряд химических элементов. Ответом в задании является последовательность цифр, под которыми указаны химические элементы в данном ряду.
- 1. C
- 2. N
- 3. F
- 4. Be
- 5. Ne
Из указанных в ряду химических элементов выберите три элемента, которые способны образовывать оксиды. Расположите выбранные элементы в порядке уменьшения кислотного характера их высших оксидов.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
РешениеОтвет: 214
Пояснение:
Из указанных элементов оксиды способны образовывать:
* углерод (CO, CO2)
* азот (N2O, NO, N2O3, NO2, N2O5)
* бериллий (BeO).
Фтор тоже способен образовывать соединение с кислородом (OF2), однако, данное соединение не относится к оксидам, поскольку степень окисления кислорода в нем равна не -2, а +2.
Неон, будучи благородным газом, оксидов не образует.
Кислотный характер высших оксидов химических элементов уменьшается при движении влево по периоду и вниз по подгруппе. Таким образом, кислотный характер наиболее выражен у высшего оксида азота (N2O5), затем у углерода (CO2) и в еще меньшей степени у оксида бериллия (BeO).
Задание №17
Для выполнения задания используйте следующий ряд химических элементов. Ответом в задании является последовательность цифр, под которыми указаны химические элементы в данном ряду.
Ответом в задании является последовательность цифр, под которыми указаны химические элементы в данном ряду.
- 1. Na
- 2. S
- 3. Se
- 4. K
- 5. O
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одной группе.
Расположите выбранные элементы в порядке усиления окислительных свойств образуемых ими простых веществ.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
РешениеОтвет: 325
Пояснение:
В одной группе находятся сера, селен и кислород. Окислительные свойства простых веществ зависят от положения элемента, атомами которого они образованы, в таблице Менделеева. Чем выше и правее элемент, тем как правило, сильнее окислительные свойства простых веществ им образованных. Таким образом, правильный ответ – последовательность Se < S < O2 (325).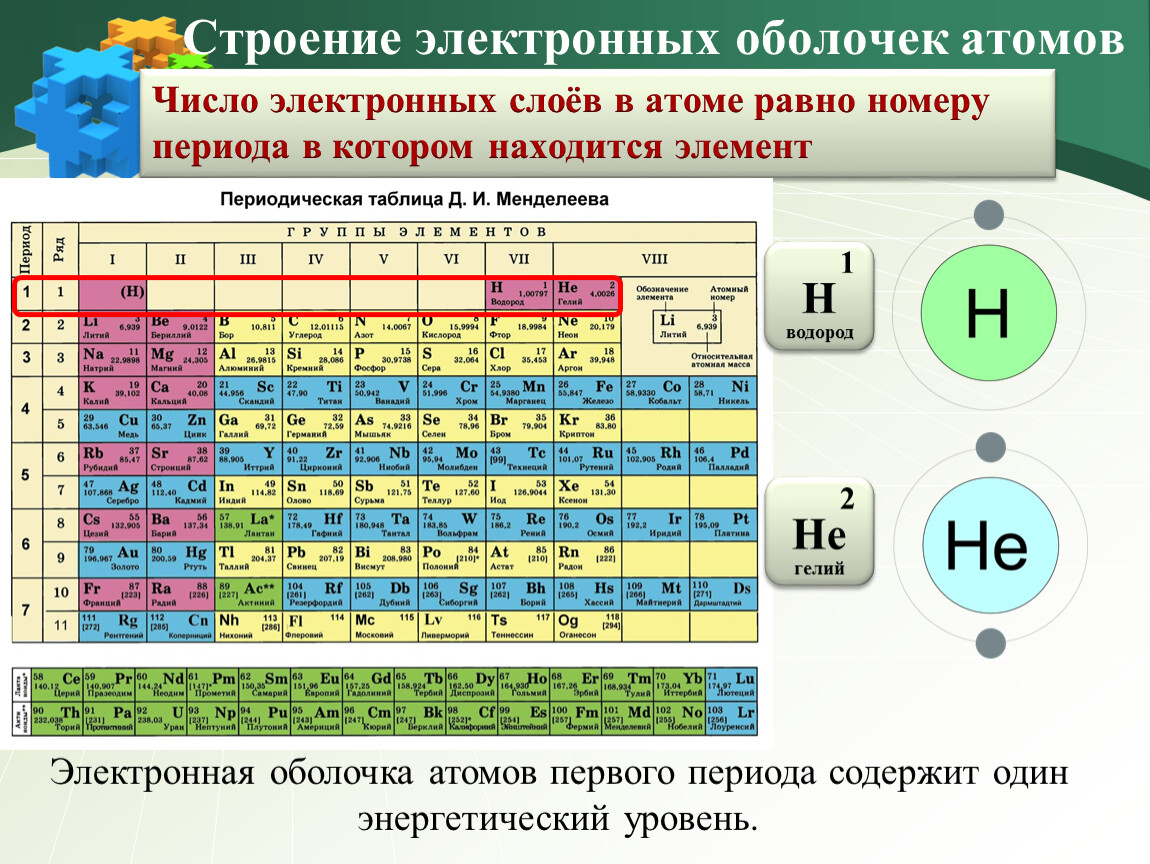
Задание №18
Для выполнения задания используйте следующий ряд химических элементов. Ответом в задании является последовательность цифр, под которыми указаны химические элементы в данном ряду.
- 1. Cr
- 2. C
- 3. Ge
- 4. Fe
- 5. Pb
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева расположены в одной группе.
Расположите выбранные элементы в порядке возрастания их металлических свойств.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
РешениеОтвет: 235
Пояснение:
В одной группе находятся углерод, германий и свинец. Металлические свойства элементов возрастают влево по периоду и вниз по подгруппе. Таким образом, среди указанных химических элементов, металлические свойства наименее выражены у углерода, затем у германия и в наибольшей степени выражены у свинца.
Задание №19
Для выполнения задания используйте следующий ряд химических элементов. Ответом в задании является последовательность цифр, под которыми указаны химические элементы в данном ряду.
- 1. N
- 2. Li
- 3. H
- 4. F
- 5. O
Из указанных в ряду химических элементов выберите три элемента-неметалла, которые в Периодической системе химических элементов Д.И. Менделеева расположены в одном периоде.
Расположите выбранные элементы в порядке возрастания количества неспаренных электронов в их атомах.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
РешениеОтвет: 451
Пояснение:
Неметаллы среди прочих элементов можно распознать по их положению в таблице Менделеева – неметаллы расположены выше диагонали бор-астат в главных подгруппах (кроме VIIIA):
Таким образом, к элементам-неметаллам одного периода из представленного списка относятся азот, кислород и фтор.
Электронное строение внешнего энергетического уровня атома азота:
Атома кислорода:
Атома фтора:
Как можно видеть, наименьшее число неспаренных электронов у атома фтора, затем у атома кислорода и наибольшее у атома азота.
Задание №20
Для выполнения задания используйте следующий ряд химических элементов. Ответом в задании является последовательность цифр, под которыми указаны химические элементы в данном ряду.
- 1. P
- 2. Se
- 3. Si
- 4. Cr
- 5. S
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева расположены в одном периоде.
Расположите выбранные элементы в порядке возрастания кислотных свойств образуемых ими высших гидроксидов.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
РешениеОтвет: 315
Пояснение:
В одном периоде находятся фосфор, кремний и сера.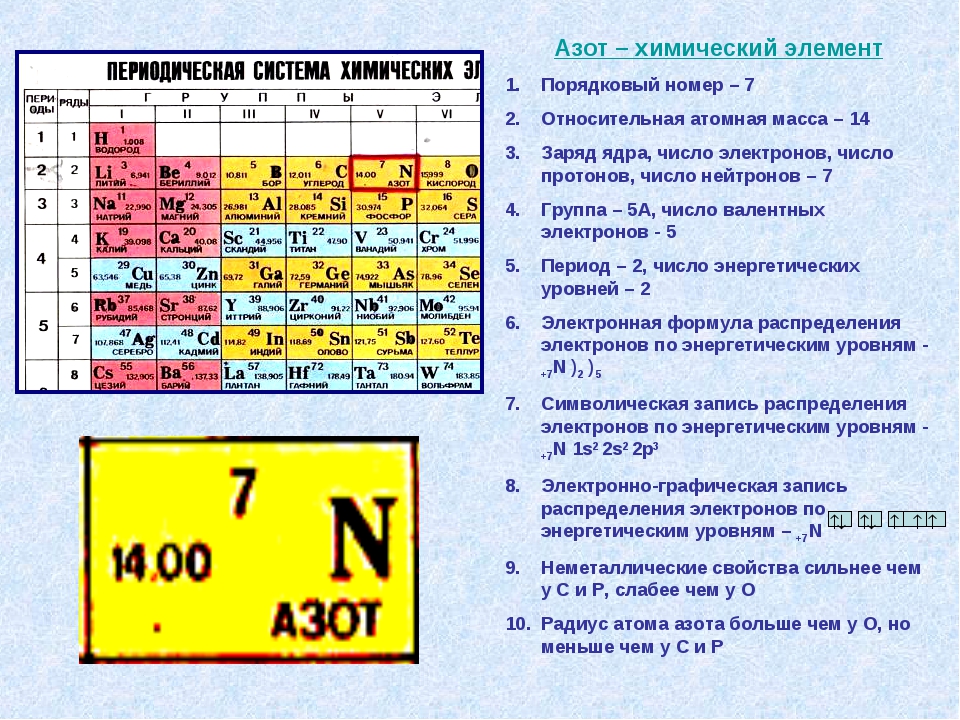
К гидроксидам химических элементов, помимо соединений вида Me(OH)x, относятся также все неорганические кислородсодержащие кислоты. Высшими оксидами/гидроксидами химического элемента называют такие, в которых этот химический элемент находится в высшей (максимально возможной) степени окисления. Кислотные свойства высших оксидов/гидроксидов химических элементов возрастают вправо по периоду и вверх в таблице Д.И. Менделеева.
Таким образом, располагая три выбранных элемента в порядке увеличения кислотного характера их высших гидроксидов, получаем ряд: Si, P, S.
Задание №21
Для выполнения задания используйте следующий ряд химических элементов. Ответом в задании является последовательность цифр, под которыми указаны химические элементы в данном ряду.
- 1. Al
- 2. S
- 3. Cr
- 4. P
- 5. Si
Из указанных в ряду химических элементов выберите три элемента-неметалла.
Расположите выбранные элементы в порядке уменьшения восстановительных свойств этих неметаллов.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
РешениеЗадание №22
Для выполнения задания используйте следующий ряд химических элементов. Ответом в задании является последовательность цифр, под которыми указаны химические элементы в данном ряду.
- 1. Na
- 2. Cl
- 3. Si
- 4. Mn
- 5. Cr
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде.
Расположите выбранные элементы в порядке уменьшения их атомного радиуса.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
РешениеЗадание №23
Для выполнения задания используйте следующий ряд химических элементов. Ответом в задании является последовательность цифр, под которыми указаны химические элементы в данном ряду.
- 1. Al
- 2. Si
- 3. Mg
- 4. C
- 5.
 N
N
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде.
Расположите выбранные элементы в порядке уменьшения электроотрицательности.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
РешениеЗадание №24
Для выполнения задания используйте следующий ряд химических элементов. Ответом в задании является последовательность цифр, под которыми указаны химические элементы в данном ряду.
- 1. B
- 2. Al
- 3. F
- 4. Fe
- 5. N
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде.
Расположите выбранные элементы в порядке уменьшения электроотрицательности.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
РешениеЗадание №25
Для выполнения задания используйте следующий ряд химических элементов. Ответом в задании является последовательность цифр, под которыми указаны химические элементы в данном ряду.
Ответом в задании является последовательность цифр, под которыми указаны химические элементы в данном ряду.
- 1. S
- 2. Na
- 3. Al
- 4. Si
- 5. Mg
Из указанных в ряду химических элементов выберите три элемента-металла.
Расположите выбранные элементы в порядке возрастания восстановительных свойств.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
РешениеЗадание №26
Для выполнения задания используйте следующий ряд химических элементов. Ответом в задании является последовательность цифр, под которыми указаны химические элементы в данном ряду.
- 1. P
- 2. C
- 3. Si
- 4. Cr
- 5. S
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде.
Расположите выбранные элементы в порядке увеличения их атомного радиуса.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Задание №27
Для выполнения задания используйте следующий ряд химических элементов. Ответом в задании является последовательность цифр, под которыми указаны химические элементы в данном ряду.
- 1. C
- 2. N
- 3. F
- 4. Be
- 5. Ne
Из указанных в ряду химических элементов выберите три элемента, которые образуют оксиды.
Расположите выбранные элементы в порядке уменьшения кислотного характера их высших оксидов.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
РешениеXenoEnergy
|
http://www.xenoenergy.com/ |
КАТАЛОГ | ПРИМЕНЕНИЕ | РУКОВОДСТВО ПО ЭКСПЛУАТИЦИИ XenoEnergy – компания, которая специализируется в разработке и производстве литий тионил хлоридных (Li-SOCl2) 3,6В первичных элементов питания, применяемых на индустриальном рынке. Преимуществами их являются широкий температурный диапазон, низкий саморазряд, высокая ёмкость, лучшие параметры выходного напряжения и безопасности по сравнению с другими известными типами батареек. Высокое качество обеспечивается как современным производственным оборудованием, тщательным входным контролем материалов и 100% выходным контролем продукции, так и более чем 15 летним опытом разработки и производства элементов питания. Головной офис и фабрика компании располагаются в Южной Корее – одной из наиболее динамично развивающихся стран региона. Обратите внимание, что наша компания может помочь вам в расчете времени жизни элементов питания Xeno для вашего приложения и подборе батарейки. Для этого надо заполнить форму Lithium Battery Questionnaires. |
Каталог продукции Xeno Energy
Xeno Energy Full Catalog
Xeno Energy Short Form Catalog
Xeno Catalog Terminal
| Product | XL-050F | XL-055F | XL-060F | XL-100F | XL-145F | XL-205F | XL-210F | XLP-050F | XLP-055F | XLP-060F | XL-414F | XL-420F |
| ANSI Standart | 1/2AA | 2/3AA | AA | A | C | D | 1/10D | 1/2AA | 2/3AA | AA | CC | DD |
| IEC Standart | ER14252 | ER14335 | ER14505 | ER17500 | ER26500 | ER32L615 | ER33L65 | ER14252 | ER14335 | ER14505 | ER261020 | ER341245 |
| Nominal Voltage | 3. 6V 6V |
3.6V | 3.6V | 3.6V | 3.6V | 3.6V | 3.6V | 3.6V | 3.6V | 3.6V | 3.6V | 3.6V |
| Nominal Capacity | 1.2Ah | 1.65Ah | 2.4Ah | 3.6Ah | 8.5Ah | 19Ah | 1.0Ah | 1.2Ah | 1.65Ah | 2.4Ah | 15Ah | 35Ah |
| Max. Cont. Current |
30mA | 40mA | 60mA | 100mA | 150mA | 230mA | 20mA | 30mA | 40mA | 60mA | 250mA | 450mA |
| Max. Pulse Current | 60mA | 90mA | 120mA | 200mA | 230mA | 400mA | 40mA | 100mA | 150mA | 200mA | 530mA | 1000mA |
| Operating Tempreture | -55~+85’C | -55~+85’C | -55~+85’C | -55~+85’C | -55~+85’C | -55~+85’C | -55~+85’C | -55~+85’C | -55~+85’C | -55~+85’C | -55~+85’C | |
| Diameter (Max) | 14.5mm | 14.5mm | 14.5mm | 16.8mm | 25.8mm | 33.6mm | 33.2mm | 14.5mm | 14.5mm | 14.5mm | 26mm | 32.9mm |
| Height (Max) | 25.1mm | 33.3mm | 50.1mm | 50.7mm | 49.0mm | 59.0mm | 7.0mm | 25.1mm | 33.3mm | 50.1mm | 100mm | |
| Weight | 9g | 12g | 17g | 24g | 51g | 98g | 19.2g | 9g | 12g | 17g | 95g | 205g |
Области применение продукцкии Xeno Energy
Li-SOCl2 элементы питания широко используется в промышленности. Основные области применения продиктованы свойствами батареек:
- Средства измерения расхода энергии: электричества, газа, воды, тепла.
- Средства контроля условий хранения и транспортировки на основе RF ID (Toll Tags).
- Питание памяти и/или часов реального времени.
- Системы идентификации RF ID и трэкинг контроля.
- Системы безопасности и пожарной сигнализации, такие как контроль доступа или датчики разбития стекла, открывания дверей/окон, датчики дыма, огня, температуры и.д.
- Медицинские устройства. Портативные измерители уровня сахара в крови, средства мониторинга давления, ритмов сердца, температуры и т.д.
- Средства для научных исследований: океанографии, миграции зверей и птиц, контроля сейсмической активности и метеорологии.
- Портативные датчики: давления, вибраций, температуры, например в нефте и газодобыче.
- Военная и космическая техника, например резервное питание датчиков и систем управления в авиатехнике.
- Информационные технологии: беспроводные сети, средства измерения и контроля состояния проводных/беспроводных сетей, резервное питание, интеллектуальные здания и т.д.
Руководство по эксплуатации продукции Xeno Energy
1. Введение
1.1 Литий-тионилхлоридный элемент питания Показать/скрыть детальную информацию
В течение нескольких последних десятилетий быстрое продвижение вперед в области разработки и миниатюризации электронных устройств создало спрос на легкие, компактные и высокоэффективные источники питания для широкого диапазона различных условий. Литиевые элементы питания, которые дают максимум энергии на выходе за счет использования лития – металла с самым большим известным электродным потенциалом, привлекли к себе повышенное внимание как оптимальные источники питания для удовлетворения этого спроса. Как следует из их названия, в данных гальванических элементах в качестве анода используется литий, при этом различные системы отличаются материалами катода, электролитом, а также конструкцией элемента и другими химическими добавками. Таким образом, каждый тип литиевых элементов питания имеет свои характеристики в силу вышеуказанных причин.Литиевые элементы питания делятся на три категории в зависимости от типа катода и электролита, как показано в следующей ниже таблице 1-1.
ТАБЛИЦА 1-1 Основные типы первичных литиевых элементов питания
Каждый из типов литиевых элементов питания имеет свои собственные специализированные характеристики, такие как электрическое напряжение, максимальный возможный ток, плотность энергии и рабочую температуру.
Среди литиевых гальванических элементов тионилхлоридные Li-SOCI2-батареи являются в настоящее время самым лучшим выбором для имеющихся электронных и промышленных устройств по совокупным характеристикам, особенно электрической надежности в различных условиях, большому сроку хранения, длительному сроку службы и безопасности.
1.2 Литиевые элементы питания производства XenoEnergy Показать/скрыть детальную информацию
XenoEnergy – это компания, занимающаяся НИОКР и производством, которая специализируется в области элементов питания на основе Li-SOCI2 и имеет 15-летний практический опыт НИОКР, производства и продаж. Пользуется теоретической поддержкой Корейского университета, специализирующегося в области технологий элементов питания. XenoEnergy – это компания, занимающаяся Li-SOCI2-элементами питания, которая путем проб и экспериментов приобрела ценный опыт. Благодаря сотрудничеству с Корейским университетом, XenoEnergy в настоящее время является ведущей компанией в этой области и компанией, которая очень хорошо понимает как технологии, так и потребности своих клиентов и потому имеет преимущества по отношению к своим конкурентам.
1.3 Общие характеристикиПоказать/скрыть детальную информацию
Общие характеристики литий-тионилхлоридных элементов питания производства XenoEnergy перечислены ниже.
- Высокое напряжение
Этот элемент питания имеет напряжение разомкнутой цепи 3,67 В и является одним из самых высоких среди литиевых элементов питания. Поэтому он может заменить два или три обычных элемента питания. - Стабильность напряжения
Рабочее напряжение этого элемента питания остается стабильным в течение его срока службы. - Широкий диапазон температур
Такой элемент питания можно использовать в широком диапазоне температур, от -55°C до +85°C. По специальному заказу возможна поставка элементов питания с расширенным диапазоном температур, до +130°C (макс. +150°C). - Очень большой срок хранения
Эти элементы питания демонстрируют значительно меньшую скорость саморазряда, не более 1% в год при комнатной температуре без нагрузки, и их фактический срок хранения превышает 10 лет. Низкий саморазряд обеспечивают пассивационная пленка на поверхности лития и герметичная конструкция. - Высокая плотность энергии
Этот элемент питания имеет самую высокую плотность энергии (до 700 Вт-ч/кг и 1380 Вт-ч/л), превышающую аналогичный показатель любого другого первичного элемента питания. - Безопасность
Поскольку данный гальванический элемент не является системой, находящейся под давлением, ему не требуется защитное устройство для стравливания давления. Из элемента питания не выделяются никакие газы, так как его корпус герметичен. Элемент питания также имеет безопасную внутреннюю конструкцию, включая очень ограниченное количество лития и размещение лития вдоль внутренней стенки корпуса элемента, поэтому исключена опасность какого-либо происшествия или взрыва под действием токов короткого замыкания и в условиях теплового пробоя. Компания XenoEnergy не смогла выявить никаких проблем с точки зрения безопасности в ходе испытаний изделий во внештатных условиях. Вся продукция XenoEnergy имеет международную сертификацию UL (см. главу 6).
1.4 Сравнение различных литиевых гальванических элементов Показать/скрыть детальную информацию
На рисунке 1-1 показаны сравнительные данные нескольких основных типов первичных элементов питания.
Литий-тионилхлоридные элементы производства XenoEnergy демонстрируют наилучшие и наивысшие значения основных характеристик, таких как номинальное напряжение, плотность энергии, максимальный срок службы и диапазон рабочих температур.
Благодаря сварному и герметичному корпусу литиевых элементов питания XenoEnergy их срок службы может превышать 10 лет. Поэтому такие элементы питания лучше всего подходят для применения там, где требуются небольшие непрерывные токи в течение длительных периодов и умеренные импульсные токи. К примерам таких систем относятся системы дистанционных датчиков в устройствах обеспечения безопасности, различные приборы учета ресурсов, устройства радиочастотной идентификации (RFID) и системы резервного питания запоминающих устройств.
В частности, беспроводным пассивным инфракрасным (PIR) датчикам для систем безопасности обычно требуются очень маленькие токи (десятки микроампер) в состоянии покоя и 7,5 – 10 мА при передаче. При таких условиях работы литий-тионилхлоридный элемент питания обеспечивает срок службы до 1, 5 – 2 раз больший, чем литиевые элементы той же емкости на основе диоксида марганца.
И хотя химия литий-тионилхлоридного элемента питания несколько сложнее, это наилучшее решение для тех потребителей, которые ищут решение для питания своих систем с длительным сроком службы, превышающим сроки службы всех остальных конкурирующих вариантов.
РИСУНОК 1.1 Сравнение основных типов первичных элементов питания
2. Химический состав элемента питания и химическая реакция
2.1 Химический состав элемента питания Показать/скрыть детальную информацию
Анод
Анод литиевого элемента питания XenoEnergy представляет собой фольгу из чистого лития высшего класса очистки (содержание лития свыше 99,8%). Она располагается в свернутом виде вдоль стенки корпуса элемента, обеспечивая большую надежность электрического соединения и безопасность.
Катод
В качестве материала катода в литиевых элементах питания XenoEnergy используется порошок углерода, связанный политетрафторэтиленом. Он обеспечивает эффективное электрическое соединение. Обычно, когда к элементу подключается нагрузка, SOCI2 может восстанавливаться на поверхности углеродного катода. Также происходит выделение LiCI и S и их отложение на углеродном катоде. На катоде происходит химическая реакция между тионилхлоридом и ионами лития.
Сепаратор
В изделиях XenoEnergy используются сепараторы между катодом и анодом, выполненные из нетканого стекловолокна. Это помогает движению ионов при разрядке и препятствует внутренним коротким замыканиям, обеспечивая надежность при хранении.
Электролит
Электролитом литиевого элемента XenoEnergy служит сочетание тионилхлорида (SOCI2), хлорида лития (LiCI) и тетрахлорида алюминия (AICI3). Тионилхлорид имеет низкую температуру замерзания, -105°C , и высокую температуру кипения, 79°C. Он демонстрирует хорошее восстановление во время разрядки элемента вне зависимости от условий окружающей среды и низкий саморазряд в условиях хранения.
Коллектор тока
Коллекторы тока литиевого элемента питания XenoEnergy разные для каждого типоразмера элемента. Пожалуйста, обратитесь к рисунку 2-1 , где представлены чертежи элементов питания малых типоразмеров (1/2AA, 2/3AA, AA, A), больших типоразмеров (C, D) и плоских элементов питания (1/10D). Коллектор тока обеспечивает наилучшую эффективность электрического соединения между катодом и клеммой положительного полюса.
Корпус и крышка элемента
Корпус и крышка литиевого элемента питания XenoEnergy выполняются из нержавеющей стали марки 304L (наш аналог – ГОСТ 03Х18Н11). Она очень хорошо подходит для использования там, где требуются немагнитные условия при разрядке и хранении. Корпус и крышка также рассчитаны на то, чтобы выдерживать механические напряжения и суровые условия окружающей среды.
Герметизация
При изготовлении изделий XenoEnergy используются два способа герметизации. Один из них – это уплотнение типа «стекло – металл» (GM) между клеммой положительного полюса, выполненной на 52% из никелевого сплава, и верхней крышкой, которая является отрицательным полюсом и выполняется из нержавеющей стали в сборке днища. Другой способ – это уплотнение между корпусом и сборкой днища. Для этого в XenoEnergy используется технология лазерной сварки. Такие герметичные сварные швы используются для того, чтобы обеспечить лучшее сохранение рабочих характеристик при длительном хранении, длительный период разрядки и надежность. Эти герметичные швы обеспечивают более высокий уровень безопасности, чем другие типы герметизации.
Важно! Уплотнение типа «стекло-металл» является очень ответственным элементом с точки зрения контроля качества ввиду возможности микроскопических трещин, которые могут привести к выходу элемента из строя в будущем. Сборка с уплотнением «стекло-металл» поставляется изготовителем, который имеет многолетний опыт, и проходит повторную аттестацию в ходе окончательного контроля в компании XenoEnergy с применением наших специальных методик. Этот метод контроля имеется только в компании XenoEnergy, и он позволяет выявить любые проблемы герметизации «стекло-металл», а также обнаруживать другие возможные трещины, возникшие из-за сварки. Методы и технологии контроля, используемые в XenoEnergy, доказали свою успешность тем, что никаких жалоб, связанных со сваркой и герметизацией типа GM, не возникало.
РИСУНОК 2-1 Конструкция литиевого элемента питания XenoEnergy
2.2 Химическая реакция Показать/скрыть детальную информацию
В литий-тионилхлоридных элементах питания XenoEnergy жидкий тионилхлорид (SOCI2) используется в качестве положительного активного материала, а литий (Li) – в качестве отрицательного активного материала. Он выполнен из неорганических материалов.
В литиевых элементах питания XenoEnergy протекают следующие химические реакции;
Окисление анода (отрицательного полюса): 4 Li ? 4 Li+ + 4e-
Восстановление катода (положительного полюса): 2 SOCI2 + 4e- -> SO2 + S + 4 CI- (SOCI2 покрыт углеродным катодом)
Вся реакция выглядит следующим образом: 4 Li + 2 SOCI2 ? 4 LiCI + S + SO2 Вышеуказанный диоксид серы (SO2) растворяется в электролите.
3. Рабочие характеристики
3.1 Характеристики напряжения Показать/скрыть детальную информацию
3.1.1 Стандартное напряжение Показать/скрыть детальную информацию
Типичным диапазоном рабочего напряжения литиевых элементов питания XenoEnergy является диапазон 3,4~3,6 В, как показано на рисунке 3-1. Это достаточно высокий диапазон по сравнению с другими конкурирующими Li-SOCI2-элементами питания, который достигается благодаря специальному строению катода, разработанному компанией XenoEnergy. В условиях непрерывной разрядки с определенными умеренными значениями тока напряжение остается постоянным и стабильным до конца срока службы элемента.
РИСУНОК 3-1 Разрядная характеристика при температуре +20°C (элемент типоразмера 1/2AA, XL-050F)
3.1.2 Задержка напряжения Показать/скрыть детальную информацию
Если литиевые элементы питания XenoEnergy хранятся в течение определенного периода времени, не разряжаясь или при очень низком токе разрядки, а затем подключаются к некоторой нагрузке, происходит резкое падение первоначального напряжения.
Это общее свойство всех литий-тионилхлоридных элементов питания, которое обусловлено образованием пленки LiCI на поверхности литиевого анода, как показано в п. 2.2, «Химическая реакция». Такая пленка называется «пассивационной пленкой». Эта пленка не только обеспечивает длительный срок хранения и службы элемента питания, превышающий аналогичные показатели других типов элементов питания, но и вызывает задержку напряжения из-за того, что требуется некоторое время на сжигание пассивационной пленки под действием протекающего тока нагрузки. При первом подключении нагрузки после периода хранения низшее минимальное напряжение можно проверить, и оно называется «МНПП (Минимальное напряжение переходного процесса)». В соответствии с условиями окружающей среды элемента питания, такими как время хранения, температура, амплитуда импульса, коэффициент заполнения импульсов, базовый ток, вибрация и механические воздействия, диапазон задержки напряжения может быть разным при тонкой или толстой пленке LiCI.
Если элемент питания хранится без непрерывной разрядки, толщина пленки LiCI может сначала увеличиваться в течение определенного периода времени. Затем толщина стабилизируется, лишь слегка увеличиваясь, как показано на рисунке 3-2.
РИСУНОК 3-2 Образование пассивационной (LiCI) пленки
Если элемент питания хранится в условиях температуры, циклически меняющейся от комнатной до некоторой более высокой температуры, толщина пассивационной пленки может увеличиваться активнее, чем в случае хранения при постоянной комнатной температуре. Амплитуда импульсов и коэффициент заполнения импульсов также могут влиять на толщину пленки LiCI. Более высокая амплитуда импульсов и более короткие периоды импульсов уменьшают толщину пленки LiCI.
Базовый ток и регулярная вибрация также могут уменьшить пассивационную пленку. Обычно базовые токи 2 мкА/см2 на поверхности анода могут предотвращать пассивацию, помогая элементу питания реагировать на определенные нагрузки соответствующим образом без серьезной задержки напряжения. Однако если в том или ином случае имеют место регулярные циклы импульсов и базовый ток, это может способствовать уменьшению пассивации и помогать депассивации анода.
3.1.3 Кривые задержки напряжения Показать/скрыть детальную информацию
На рисунке 3-3 показаны различные кривые задержки напряжении в зависимости от протекающего тока.
Низкий уровень тока (Кривая A)
Во время начальной разрядки напряжения постоянны и стабильны, задержка напряжения отсутствует, и такие кривые используются в системах резервного питания запоминающих устройств.
Средний уровень тока (Кривая В)
Во время начальной разрядки имеется небольшая задержка напряжения, но МНПП выше напряжения отсечки. Обычно напряжение отсечки находится в диапазоне 2,5~3,0 В.
Высокий уровень тока (Кривая С)
Во время начальной разрядки происходит сильное падение напряжения, и в течение некоторого времени напряжение остается ниже уровня отсечки, а затем возвращается к уровню отсечки. Если напряжение остается ниже уровня отсечки, даже в течение очень короткого времени, содержимое памяти подключенных устройств может оказаться потеряно. В этом случае необходима дополнительная поддержка, например, увеличение базового тока, установка конденсатора или подключение дополнительного элемента питания.
РИСУНОК 3-3 Кривые задержки напряжения
3.1.4 Характеристики напряжения Показать/скрыть детальную информацию
Литий-тионилхлоридный элемент питания XenoEnergy обладает хорошими характеристиками задержки напряжения и коротким временем восстановления, а также имеет довольно широкий диапазон амплитуд импульсов. Компания XenoEnergy разработала эти элементы питания специально для улучшения показателя МНПП. Компания выпускает семейство элементов XLP, которое разработано в основном с целью уменьшения пассивации и достижения хороших показателей восстановления напряжения при различных температурах и обеспечения длительного срока хранения
3.2 Емкость элемента питания
3.2.1 Зависимость емкости от времени разрядки и тока разрядки Показать/скрыть детальную информацию
Емкость элемента питания в течение срока службы – это величина тока, которую может давать элемент питания, умноженная на время в часах, в течение которого элемент питания способен давать этот ток при определенном конечном напряжении. Емкость элемента питания в основном зависит от тока разрядки и времени разрядки. На рисунке 3-4 представлено изменение емкости в зависимости от времени разрядки.
РИСУНОК 3-4 Изменение емкости в зависимости от времени разрядки (XL-060F)
В номинальном диапазоне тока, указанном в каталоге XenoEnergy для данной модели, номинальная емкость отражает максимальные значения без учета эффекта саморазряда. В случае разрядки при токах ниже номинального скорость саморазряда будет выше, чем химическая реакция, вызванная длительным временем разрядки при низких токах. Поэтому имеющаяся емкость в этом случае обычно меньше. В случае разрядки при токах выше номинального внутреннее сопротивление возрастает вследствие быстрого движения ионов. В результате имеющаяся емкость также будет меньше при более высоком отклонении.
3.2.2 Зависимость емкости от импульсной разрядки Показать/скрыть детальную информацию
В настоящее время наблюдается тенденция использовать в большинстве электронных устройств, работающих на литий-тионилхлоридных элементах питания, сочетание очень низкого непрерывного базового тока и периодического или случайного импульсного тока с высоким значением, как показано на рисунке 3-5. Обычно базовый ток служит для того, чтобы поддерживать память входного сигнала и чтобы не допускать или уменьшать задержку напряжения путем увеличения базового тока, а импульсный ток используется для распознавания определенных изменений или передачи данных.
В соответствии с решаемой задачей количество циклов импульсов может быть разным, и отношение между временем включения и выключения обычно составляет от 1:10 до 1:10 000. Эти циклы импульсов аналогичны определенному среднему значению тока, Iср1 и Iср2. Среднее значение тока также связано с емкостью элемента питания. Обычно при среднем значении тока, таком как Iср1 и Iср2, емкость несколько выше, чем в случае разрядки при данном базовом токе или пиковом токе (Iпик). При меньшей частоте циклов импульсов (1:10 000) средний ток намного ниже пикового тока, но несколько выше базового тока, как в случае Iср1. При более частых циклах импульсов (1:10) средний ток немного ниже пикового тока, но намного выше базового тока, как в случае Iср2.
3.3 Влияние температуры Показать/скрыть детальную информацию
Литий-тионилхлоридные элементы питания XenoEnergy можно использовать в чрезвычайно широком диапазоне рабочих температур, от -55°C до 85°C. При низких температурах диапазон рабочего напряжения и емкости будет ниже, чем при комнатной температуре или при высоких температурах, из-за меньшего движения ионов и более высокой плотности защитного слоя. При более высоких температурах диапазон рабочих напряжений будет несколько выше, но емкость будет меньше, чем при комнатной температуре, из-за быстрого движения ионов и меньшей плотности пассивирующей пленки.
В частности, изделия XenoEnergy демонстрируют наилучшие рабочие характеристики и рабочее напряжение при циклической смене хранения при высоких температурах и разрядки.
На рисунке 3-6 показана разница емкостей элемента питания XL-050F в зависимости от тока при различных температурах, а на рисунке 3-7 показана зависимость рабочего напряжения от изменений температуры при различных нагрузках. Температурные характеристики каждой модели имеются в каталоге продукции XenoEnergy.
РИСУНОК 3-6 Зависимость емкости от тока (XL-050F, типоразмер 1/2AA)
РИСУНОК 3-7 Зависимость рабочего напряжения от температуры (XL-050F, типоразмер 1/2AA)
Компания XenoEnergy может дать более точную и достоверную оценку срока службы с помощью нашей методики оценки зависимости фактической емкости от тока при различных температурах, если заказчик предоставит подробные графики изменения температуры, как показано в нижеследующем примере.
3.4 Длительное хранение и разрядка Показать/скрыть детальную информацию
Компания XenoEnergy понимает, что литий-тионилхлоридные элементы питания в основном используются там, где требуется длительное хранение, гарантированный и длительный срок службы (обычно более 10 лет). Поэтому XenoEnergy начала испытания фактического длительного хранения и испытания разрядки опытных образцов элементов питания еще в 2000 г. Это было сделано для демонстрации потребителям высокой надежности продукции XenoEnergy путем предоставления фактических данных по саморазряду и результатов длительного хранения вплоть до конца срока службы элементов питания.
3.4.1 Характеристики длительного хранения Показать/скрыть детальную информацию
XenoEnergy продолжает проводить испытания по фактическому долгосрочному хранению с 2000 г. Для проверки саморазряда в компании XenoEnergy используется микрокалориметрия. Этот метод относится к методам неразрушающего контроля и является эффективным и точным способом измерения саморазряда по измерению теплового потока от батарейки.
Порядок измерения выглядит следующим образом;
- 1) Испытуемый образец взвешивается
- 2) Берется контрольный образец той же массы но без литиевой фольги
- 3) Контрольный образец помещаются в калориметр и выдерживаются несколько часов до состояния теплового равновесия
- 4) Измеряется тепловой поток контрольного образца – это диссипация, не связанная с саморазрядом, по этому параметру определяется нулевой уровень «фон».
- 5) Аналогично проводятся измерения на испытуемом образце
- 6) После вычитания фона получается тепловой поток W вследствие саморазряда
- 7) Рассчитывается скорость саморазряда в год (S) по следующей формуле.
- здесь C – номинальная емкость в ампер-часах
- 8) Имеется небольшое отклонение, вызванное образованием пассивационной пленки, коррозией литиевого анода и разложением SOCI2.
Элемент питания XenoEnergy демонстрирует саморазряд на уровне ниже 1% после хранения в течение 1 года без разрядки при комнатной температуре. Обычно скорость саморазряда сначала несколько выше, но существенно снижается и продолжает неуклонно уменьшаться с течением времени. При более высоких температурах скорость саморазряда увеличивается (при +60?С составит около 3,5%), а при низких – падает. Пожалуйста, обратитесь к рисунку 3-8.
РИСУНОК 3-8 Скорость саморазряда и потеря емкости – элементы XL-050F и XL-060F (при измерении микрокалориметром)
(XL-050F, типоразмер 1/2AA, изготовлен в 2000 г.) (XL-060F, типоразмер AA, изготовлен в 2000 г.)
3.4.2 Характеристики длительной разрядки Показать/скрыть детальную информацию
Компания XenoEnergy также провела испытания фактической разрядки нескольких опытных образов в течение длительного периода при отсутствии нагрузки с 2000 г. По основным моделям эти испытания проводились до настоящего времени при различных условиях базового тока, и проверялась интенсивность отказов, чтобы оценить надежность нашей продукции в долгосрочной перспективе.
На рисунке 3-9 показан результат испытаний разрядки в течение длительного периода времени и интенсивности отказов. Результаты отфиксированы на середину 2007 года.
РИСУНОК 3-9 Разрядка в течение длительного времени и интенсивность отказов
3.5 Ориентация элемента питания Показать/скрыть детальную информацию
Ориентация элемента питания может влиять на емкость во время разрядки, потому что может быть разным положение электролита и его количество, контактирующее с литием и катодом. Существуют три возможных ориентации элемента, когда элемент питания устанавливается в питаемый прибор, как показано на рисунке 3-10.
РИСУНОК 3-10 Возможная ориентация элемента питания при разрядке
- При установке в вертикальном положении на емкость не оказывает влияния величина разрядного тока, будь он высокий, номинальный или низкий.
- В горизонтальном положении на емкость элементов малых типоразмеров (1/2AA, 2/3AA, AA, 1/10D) не оказывает влияния величина разрядного тока, будь он высокий, номинальный или низкий. На емкость элементов больших типоразмеров (C, D) малый или номинальный разрядный ток не оказывает влияния, но если разрядный ток высокий, это может повлиять на емкость. (Можно ожидать снижение емкости при высоких значениях разрядного тока примерно на 15~30%.)
- В перевернутом положении на емкость элементов малых типоразмеров (1/2AA, 2/3AA, AA, 1/1 OD) величина разрядного тока, будь он высокий, номинальный или низкий, оказывает меньшее влияние. Однако разрядный ток оказывает влияние на емкость элементов больших типоразмеров (C, D), особенно если это высокий ток. При установке в перевернутом положении литий и катод находятся в фиксированном положении, тогда как электролит опускается на дно в этом случае, и в верхней части элемента питания образуется область, где анод и катод не покрыты электролитом. Элементы питания большего типоразмера имеют большее пустое пространство, поэтому уменьшение емкости таких элементов в перевернутом положении будет больше, чем у элементов меньших типоразмеров (примерно на 20~40% емкости при таком же высоком токе разрядки.)
4. Руководство по выбору и применению элементов питания
- 4.1 Области применения
4.1.1 Типичные варианты применения Показать/скрыть детальную информацию
Литиевые элементы питания XenoEnergy обладают превосходными характеристиками с точки зрения различных аспектов, поэтому их можно использовать в различных областях. В частности, они хорошо подходят для применения там, где используются небольшие базовые токи и периодические умеренные импульсные токи. Они также обеспечивают надежную работу в системах непрерывного резервного питания запоминающих устройств и в часах реального времени. Ниже приведены некоторые из типичных вариантов применения литиевых элементов питания XenoEnergy.
Приборы учета потребления
Электрические счетчики, калориметры, газовые счетчики, счетчики воды, расходомеры и различные системы автоматического снятия показаний счетчиков (AMR)
Системы безопасности
Датчики движения, беспроводные пассивные инфракрасные (PIR) датчики, дверные/оконные датчики, датчики тревожной сигнализации, звуковые датчики, вибродатчики, беспроводные дымовые извещатели, системы перемещения наличных денег и пульты управления системами безопасности
Резервирование запоминающих устройств и часы реального времени (RTC)
Персональные компьютеры, торговые автоматы, рисоварки, цифровые телевизионные приставки, звуковая аппаратура, видеоаппаратура, игры, игровые автоматы, банкоматы, контрольно-кассовые аппараты и переносные банкоматы
Устройства пропуска для проезда по платным дорогам и устройства радиочастотной идентификации (RFID)
Встроенные системы считывания на автомобилях для оплаты проезда по платным дорогам, системы поиска в реальном времени, регистраторы данных, системы идентификации, системы управления больничным хозяйством, системы управления складами, образовательные системы, системы доения
Автомобильное оборудование
Системы контроля давления в шинах, оборудование GPS, датчики подушек безопасности, автомобильные радиосистемы и системы управления дорожным движением, тахометры
Системы отслеживания
Системы отслеживания перемещения людей, животных, отслеживания перемещения грузового транспорта и контейнеров, системы отслеживания в энергетике и навигационные системы
Передача данных (на основе малогабаритных блоков)
Беспроводные системы кассовых терминалов, беспроводная перьевая мышь, оборудование сбора данных, ПЛК и УАТС
Морское оборудование
Глубиномеры для занятий дайвингом, буи, маяки, морские измерительные устройства, морские платформы и различное океанографическое оборудование
Военная техника
Радиочастотное оборудование, устройства наведения, системы ночного видения, минные и гидроакустические буи
Другие малогабаритные измерительные приборы
Счетчики времени стоянки, ЖК-панели, промышленные часы, регуляторы температуры, оберточные машины, медицинское оборудование, железнодорожные контроллеры, ошейники для животных, измерительные и счетные устройства
4.1.2 Указания по применению Показать/скрыть детальную информацию
Указания по применению содержатся в таблице 4-1 и имеют в своей основе тенденции, наблюдающиеся на рынке. Они предназначены для того, чтобы дать потребителям некоторые параметры, которыми можно воспользоваться, чтобы выбрать наиболее подходящие им модели. Но вы также можете использовать и другие возможные модели, если необходимы большие или меньшие токи и емкости.
ТАБЛИЦА 4-1 Указания по применению
4.2 Основы выбора элементов питания Показать/скрыть детальную информацию
Процесс выбора элемента питания может начинаться с началом разработки нового оборудования или замены имеющейся системы питания. Каталог продукции и технические указания XenoEnergy вместе с другими данными, имеющими отношение к элементам питания, могут помочь потребителям выбрать наиболее эффективные элементы питания для их систем. Однако у каждого поставщика имеются похожие типы элементов питания, в то же время их химические характеристики слегка отличаются. Кроме того, у каждого потребителя свои условия эксплуатации оборудования. Поэтому для помощи в разработке конструкций и решений, отвечающих конкретным потребностям, и для создания новых или замены существующих специализированных решений важно иметь следующую информацию.
Опишите подробности проекта
Название проекта, название заказчика, область применения и сфера действия проекта
Выберите тип элемента питания по каталогу
Тип элемента питания, пространственные ограничения для конструкции элемента питания, если это необходимо, требуемые рабочие характеристики, тип клемм, данные о проводке и разъемах (с подробным указанием длины и толщины проводов, номера деталей корпуса и контактов разъема на чертеже изготовителя) и другие особые требования к конструкции.
Укажите электрические характеристики
Напряжение – рабочее напряжение, напряжение отсечки (линия для запоминающего устройства)
Характеристика тока – базовый ток, импульсный ток, ожидаемая емкость, ожидаемый срок службы
Добавьте информацию об условиях окружающей среды
Температура хранения, рабочая температура, график температуры (распределение по диапазону температур)
Укажите другие условия, если они есть
Другие условия, которые могут повлиять на характеристики элемента питания и его срок службы (поддержка в виде конденсатора, соединение нескольких элементов питания, ударные нагрузки и вибрация)
Рассчитайте срок службы и оцените условия эксплуатации
По запросу компания XenoEnergy поможет вам выбрать элемент питания или батарею элементов питания и рассчитать срок службы. Чтобы получить эту услугу, пожалуйста, заполните «Анкету проекта по литиевым элементам питания», которую можно взять на сайте дистрибьютора XenoEnergy. Она предназначена для того, чтобы заказчики эффективно проанализировали условия эксплуатации своего оборудования, и XenoEnergy смогла предложить оптимальный тип элемента питания с требуемым сроком службы.
5. Проектирование схем элементов питания
5.1 Схема цепи для резервного питания запоминающего устройства Показать/скрыть детальную информацию
Литиевые элементы питания производства XenoEnergy признаны и аттестованы UL, номер файла аттестации Mh38122. Underwriter’s Laboratories (UL) рекомендует следующие требования к электрической схеме для использования литиевых элементов питания XenoEnergy.
Литиевые элементы питания XenoEnergy не должны подключаться последовательно к источнику электропитания, который увеличивает ток прямого направления через эти элементы питания. На рисунке 5-1 изображена общая рекомендуемая схема для резервного питания запоминающего устройства с использованием литиевых элементов питания XenoEnergy.
РИСУНОК 5-1 Общая схема для резервного питания запоминающего устройства
Электрическая цепь для этих элементов питания должна включать в себя один из следующих элементов;
1) Два подходящих диода или эквивалентных элемента, подключаемые последовательно с этими элементами питания для предотвращения всякого обратного тока (тока зарядки). Второй диод используется для обеспечения защиты в случае выхода из строя первого. Изготовитель устройства должен внедрить контроль качества или аналогичную процедуру, чтобы гарантировать правильность подключения полярности диодов в каждом блоке, или
2) Блокирующий диод или эквивалентный элемент для предотвращения всякого обратного тока (тока зарядки) и резистор для ограничения тока в случае отказа диода. Номинал резистора должен быть выбран таким образом, чтобы он ограничивал обратный ток (ток зарядки) максимальным значением, указанным ниже;
Хранение, использование и утилизацию этих элементов питания следует осуществлять в соответствии с «Предупреждением», которое нанесено на элементы питания XenoEnergy и сообщает следующее;
«ПРЕДУПРЕЖДЕНИЕ: Имеется опасность возгорания, взрыва и сильных ожогов. Запрещается перезаряжать, раздроблять, разбирать, нагревать до температуры выше 100°C (212°F), сжигать элементы питания или подвергать их содержимое воздействию воды».
5.2 Поддержка в виде конденсатора Показать/скрыть детальную информацию
Увеличение внутреннего сопротивления литиевого элемента питания после длительного хранения – обычное явление при отсутствии разрядки с достаточной скоростью или при крайне неравномерной импульсной разрядке с высоким значением импульсов.
Увеличение внутреннего сопротивления литиевого элемента питания после длительного хранения – Внутреннее сопротивление также может значительно увеличиваться при непрерывной разрядке на небольшую нагрузку в течение нескольких лет (разрядка порядка 80% емкости). Полная емкость литиевого элемента питания не может быть обеспечена к концу срока службы, потому что рабочее напряжение может упасть из-за увеличившегося внутреннего сопротивления в результате длительной разрядки.
Кроме того, при высоких уровнях тока, как показано на кривой C в п. 3.1.3, «Кривые задержки напряжения», или при низких рабочих температурах падение МНПП может быть значительным, и рабочее напряжение может уменьшиться.
В этом случае XenoEnergy рекомендует использовать элементы питания с поддержкой в виде конденсатора, чтобы обеспечить максимальные рабочие характеристики к концу срока службы.
РИСУНОК 5-2 Типичная схема поддержки в виде конденсатора
Формула для выбора номинала конденсатора может быть предложена изготовителем конденсатора в следующем виде;
Тип конденсатора: Электролитический конденсатор, суперконденсатор (ионистор)
Существуют две формулы для выбора номинала конденсатора:
На практике заказчики должны выбирать номинал конденсатора примерно в 2 раза выше полученного в результате вышеприведенного расчета, чтобы учесть различные условия окружающей среды в достаточной степени.
В конденсаторе имеется некоторый ток утечки, и он может быть связан с потреблением емкости элемента питания. Обычно он мал, но его также необходимо учитывать при расчете емкости элемента питания.
5.3 Соединение нескольких элементов питания Показать/скрыть детальную информацию
Соединение нескольких элементов питания требует опыта. Заказчикам, не обладающим квалификацией в области соединения элементов питания, не следует пытаться соединять элементы питания. Особенно это касается Li-SOCI2-элементов, которые имеют герметизацию типа «стекло – металл» вокруг клеммы в крышке и нижний изолятор внутри нижней части корпуса. Поэтому требуется соблюдать осторожность при соединении, чтобы не допустить никаких механических повреждений и не создать проблем. Компания XenoEnergy не может нести никакой ответственности за проблемы с качеством, возникшие в результате неправильного соединения элементов питания. Поэтому, пожалуйста, обращайтесь в компанию XenoEnergy или к лицу, обладающему соответствующей квалификацией, если требуется осуществить соединение элементов питания.
5.3.1 Предупреждения относительно выбора элементов питания для соединения Показать/скрыть детальную информацию
- Следует выбирать элементы питания одинакового типа и размера
- Элементы питания, прослужившие одинаковое время
- Изделия одного и того же изготовителя ии Элементы питания, имеющие одинаковую структуру и выполненные по одной технологии
5.3.2 Ориентация элементов в зависимости от варианта соединения Показать/скрыть детальную информацию
Как показано выше, в п. 3.6, «Ориентация элемента питания», на емкость элемента питания может оказывать влияние его ориентация во время разрядки. В частности, элементы большего типоразмера (C, D), установленные в перевернутом положении, при высоком разрядном токе демонстрируют заметно меньшую емкость, чем в случае их установки в правильном вертикальном или в горизонтальном положении. Поэтому, чтобы получить наивысшую емкость при разрядке, необходимо выполнять следующие правила при соединении элементов питания больших типоразмеров.
1) Соединение элементов в одинаковом положении установки (при типоразмерах C, D)
В случае последовательных соединений элементы питания следует соединять в одинаковом положении и соединять различные клеммы проводами, как показано на рисунке 5-3. При параллельном соединении элементы питания следует соединять в одинаковом положении, используя обычное параллельное соединение, как показано на рисунке 5-3.
РИСУНОК 5-3 Последовательное и параллельное соединение элементов питания в одинаковом положении (рекомендуемый вариант соединения)
2) Соединение элементов в разных положениях установки (при типоразмерах C, D)
При последовательном соединении можно соединять элементы питания в разных положениях, но соединенные элементы питания должны быть установлены горизонтально. Вертикальная установка не рекомендуется, потому что емкость может уменьшиться из-за перевернутого положения установки элементов, как показано на рисунке 5-4.
РИСУНОК 5-4 Последовательное соединение элементов питания в разном положении (нерекомендуемый вариант сборки)
5.3.3 Предупреждения и порядок соединения элементов питания Показать/скрыть детальную информацию
- Отделите элементы питания друг от друга, чтобы не допустить короткого замыкания.
- Выберите диапазоны напряжений так, чтобы соединенные элементы питания разряжались одинаково, без зарядки.
- Скрепите соединенные элементы клеящим веществом или лентой
- Сваривайте электрические никелевые клеммы (клеммы с маркировкой Т1 XenoEnergy) каждого положительного полюса и отрицательный корпус точечным или лазерным сварочным аппаратом с соответствующим током. Диапазон тока важен, но он будет разным в зависимости от того, какой сварочный аппарат использует монтажник. После точечной сварки следует взять образцы, чтобы проверить качество сварного шва. Клеммы типа T1 не должны отрываться от области сварки под действием силы, направленной вверх и эквивалентной весу в 20 кг.
- Паять выводы клемм следует в течение короткого времени, чтобы не допустить повреждения вследствие чрезмерного нагрева.
- Не сваривайте и не паяйте непосредственно к корпусу элемента, потому что это приводит его перегреву.
- Обмотайте места пайки изоляционной лентой.
- Для защиты наденьте на соединенные элементы питания термоусадочную трубку или кожух.
- Нанесите на элемент питания соответствующие данные путем печати или снабдите его этикеткой с указанием модели, напряжения, информации по обеспечению безопасности, предупреждений, кодовых обозначений дат и другой информации, которая требуется потребителю.
5.3.4 Конфигурации блоков параллельно соединенных элементов
5.3.4 Конфигурации блоков параллельно соединенных элементов питания Показать/скрыть детальную информацию
При параллельном соединении в течение срока службы возможны случаи протекания обратного тока в некоторых элементах. Такие случаи возникают в результате разности напряжений или разных скоростей разрядки элементов питания. Чтобы избежать этой ситуации, необходимы шунтирующие диоды. Функция такого шунтирующего диода заключается в том, чтобы пропускать через себя разрядный ток, если элемент разряжен. Поэтому такой диод может предотвратить переразрядку элемента питания и обеспечить работу батареи элементов питания в течение всего срока службы вне зависимости от наличия разряженных элементов питания.
5.3.5 Конфигурации блоков последовательно соединенных элементов питания Показать/скрыть детальную информацию
При последовательном соединении с отдельными источниками питания некоторые опасения может вызывать чрезмерно высокий ток, влияющий на элемент питания, который вызван неисправностью цепи. Чтобы избежать этой ситуации, необходимы блокирующие диоды. Функция блокирующих диодов заключается в том, чтобы предотвращать протекание тока в элемент питания. Ток утечки диода должен быть ниже 10 мкА.
РИСУНОК 5-5 Предлагаемые варианты соединения нескольких элементов питания с защитными устройствами (Общая конфигурация последовательных и параллельных соединений)
5.4 Пайка Показать/скрыть детальную информацию
Обычно компания XenoEnergy поставляет элементы питания с различными типами клемм для монтажа элементов питания на печатные платы путем пайки. Клеммы изделий производства XenoEnergy выполняются из никеля (клеммы T1, AX) и в некоторых случаях они предварительно лужены сплавом SnPb на конце для облегчения пайки (T2, T3).
Ниже перечислены возможные способы пайки. Более подробную информацию можно получить по запросу.
5.4.1 Пайка вручную Показать/скрыть детальную информацию
Выполняется квалифицированными монтажниками с помощью ручного паяльника.
- Не допускайте контакт паяльника с корпусом элемента питания, это может привести к перегреву элемента питания.
- Паяльные работы необходимо выполнять очень быстро (максимум в течение 5 секунд)
- Не допускайте перегрева элемента питания при пайке.
5.4.2 Пайка волной припоя Показать/скрыть детальную информацию
Выполняется с помощью автоматических ванн с расплавленным припоем на линиях серийного производства.
Меры предосторожности
- Не допускайте падения элементов питания в ванну с расплавленным припоем.
- Поддерживайте температуру ванны с припоем в пределах 260~280°C.
- Время погружения должно быть не более 5 сек.
- Не допускайте перегрева элемента питания при пайке.
6. Хранение и депассивация
6.1.1 Хранение батарей Xeno Показать/скрыть детальную информацию
Хранить батареи Xeno нужно в сухом (влажность до 30%), прохладном (температура окружающей среды до +30?С), вентилируемом помещении в оригинальных упаковках. Свежие батарейки нельзя хранить вместе с уже использованными и тем более с поврежденными. При частичных отгрузках со склада рекомендуется использовать сначала батарейки из более ранних приходов. Следует также учитывать эффект пассивации
6.2.1 Депассивация Показать/скрыть детальную информацию
Если батарейки долгое время хранятся без токоотдачи, то становится заметен эффект пассивации. Нарастание пленки хлорида лития LiCL ведет к резкому первоначальному падению напряжения при включении после долгого хранения – см. пункт 3.1.2. Эффект пассивации становится заметным после полугодичного хранения для стандартных батареек серии XL. Если предполагается хранение дольше полугода, лучше использовать специальную серию XLP. Если профиль тока приложения таков, что падение напряжения после долгого хранения может быть критичным, XenoEnergy рекомендует перед применением провести депассивацию. Простой способ ограничить начальную просадку напряжения значением 3,0В следующий: нужно замкнуть положительный и отрицательный полюсы на короткое время: 3с для моделей XL-050, XL-055, XL-060 и 5с для XL-145 и XL-205. Дополнительная информация доступна по запросу
Основные группы пищевых продуктов и их значение в питании
Человек использует в пищу разнообразные продукты, которые необходимы ему для роста, движения, здоровья. Чтобы расти, нужен белок, жиры; для движения и поддержания температуры тела нужны углеводы, для здоровья костей и зубов – кальций, фосфор. Для здоровья – витамины. Где же находятся эти вещества?
Можно выделить несколько основных групп пищевых продуктов: мясо и мясопродукты; рыба и рыбопродукты; яйца; молоко и молочные продукты; хлеб и хлебобулочные изделия, крупы, макаронные изделия; бобовые; овощи, фрукты и ягоды; орехи и грибы; кондитерские изделия; пищевые жиры; напитки.
Мясо и мясопродукты. Эта группа продуктов включает говядину, баранину, свинину, мясо птиц (куриц, цыплят, индейки), кроликов, а также различные виды сосисок, сарделек, колбас и колбасных изделий. Общее для всех этих продуктов – высокое содержание белка, железа и витамина В12. При этом белки мяса и мясопродуктов обладают высоким качеством. Вот почему мясо рекомендуется ежедневно включать в питание детей. Но колбасы, сардельки и сосиски содержат значительно больше жира и соли, чем мясо. При их изготовлении используется ряд пищевых добавок. Свинина и особенно баранина также содержат больше жира, чем говядина, причем в них преобладает трудноусвояемый (тугоплавкий) жир. Доля жира в курином мясе, как правило, ниже, чем в говядине и тем более свинине и баранине. Поэтому в рационе школьников должны преобладать блюда из птицы и говядины, тогда как баранину, свинину, колбасы, сосиски и сардельки следует использовать ограниченно – не чаще 1-2 раз в неделю.
Рыба и рыбопродукты. Пищевая ценность рыбы и рыбопродуктов близка к мясу. Эта группа – также важнейшие источники высококачественного белка, легкоусвояемого железа и витамина В12. Более того, поскольку в рыбе меньше, чем в мясе, соединительной ткани, то рыба и ее белки легче перевариваются и усваиваются детьми и подростками. В этом одна из причин того, что в вечернее время рекомендуются блюда из рыбы, а не из мяса: желудок и кишечник тоже должны отдыхать ночью, а не заниматься перевариванием пищи. Несмотря на отмеченное сходство в химическом составе рыбы и мяса, первая содержит некоторые пищевые вещества, отсутствующие в мясе. Это прежде всего микроэлемент “йод”. Рыбы богаче мяса витаминами РР и В6.
Третьим важным источником белка в питании человека служат куриные яйца. Но, помимо белка, этот продукт содержит немало и других полезных веществ: жир, витамины А, В12. При этом все пищевые вещества яйца быстро и хорошо всасываются. Поэтому яйца – полезны для детей, если, конечно, они не вызывают аллергию (что бывает нередко). Увлекаться яйцами, однако, не следует. Хороша «золотая середина» – 1-2 яйца в день, не чаще 2-3 раз в неделю.
Следующая группа продуктов – близкие «родственники» первых трех групп. Речь идет о молоке и молочных продуктах, которые «роднит» с мясом и рыбой наличие в них высококачественного белка. Но белок – это не единственное достоинство указанной группы продуктов. Кальций и витамин В2 вы получаете в основном из молока и молочных продуктов. В день вы должны выпивать не менее двух стаканов молока или кефира. Еще выше содержание кальция и витамина В2 в таких продуктах, как творог и сыр, которые являются “природными концентратами” этих веществ.
Кальций особенно необходим детям и подросткам, так как в этот период происходит интенсивное формирование костей и зубов, требующее значительных количеств кальция
Следует особо подчеркнуть важную роль кисломолочных продуктов (кефира, ряженки, йогуртов, простокваш и др.). Эти напитки не только содержат перечисленные пищевые вещества (белок, Са, витамин В2 и др.), но и несут в себе полезные микроорганизмы, «поддерживающие жизнь», которые очень полезны для организма
Хлеб и хлебобулочные продукты, крупы, макаронные изделия. И хлеб, и крупы могут служить источником практически всех основных пищевых веществ – белка, жира, углеводов, некоторых витаминов (В,, В2, РР), минеральных солей (магния, железа, селена и др.). В них имеются растительные волокна, необходимые для нормальной работы кишечника и желчевыделительной системы. Однако в этих продуктах преобладают углеводы (главным образом крахмал), тогда как содержание белка и жира существенно ниже. Более того, белки хлеба характеризуются значительно более низкой биологической ценностью, чем белки мяса, рыбы, молочных продуктов. Поэтому хлеб и крупы должны сочетаться в рационе с мясом, рыбой, молоком и другими продуктами животного происхождения. Традиционное же увлечение хлебом, кашами, блюдами из макарон и вермишели, к сожалению, достаточно часто имеющее место в питании, безусловно, не может быть признано полезным, так как сопровождается избыточным весом. Ассортимент хлеба, круп, макаронных изделий весьма широк. Предпочтение надо отдавать хлебу из муки грубого помола (ржаной, обойной), так как в нем выше содержание растительных волокон, витаминов В,, В2, PP. Среди круп на первое место по пищевой ценности следует поставить гречневую и овсяную, которые содержат большее количество полезных веществ (белков, жиров, углеводов, витаминов, минеральных солей), чем другие крупы. Пищевая ценность манной крупы ниже, чем гречневой и овсяной. Однако ее вкусовые качества позволяют ей занимать достойное место среди других круп.
Овощи и фрукты служат важными источниками ряда минеральных солей (калия, железа), сахаров, растительных волокон, органических кислот, улучшающих процесс пищеварения, некоторых витаминов, в частности витамина С. И овощи, и фрукты наиболее полезны в свежем виде, так как любой вид кулинарной обработки снижает содержание в них витаминов, в первую очередь С.
Вместе с тем овощи и фрукты полезны и в виде различных блюд, а также соков, пищевая ценность которых очень высока. Овощи (морковь, свекла, капуста, томаты, огурцы) широко используются при приготовлении салатов, винегретов, первых блюд (борщей, щей), а фрукты и ягоды – при приготовлении компотов, киселей.
Кондитерские изделия. Эта группа продуктов служит в основном источником углеводов и энергии. Учитывая вашу высокую двигательную активность и связанный с этим большой расход энергии, кондитерские изделия не могут считаться для детей ненужными. Кроме того, нельзя рассматривать питание только как процесс поставки в организм пищевых веществ. Питание – это еще и источник радости, положительных эмоций, и кондитерские изделия в этом отношении доставляют немало удовольствия детям всех возрастов
Пищевые жиры. Эта группа продуктов включает жиры животного происхождения – сливочное масло, сливки, животные жиры (говяжий, бараний) и растительные масла (подсолнечное, кукурузное, соевое, оливковое и др.), а также маргарины. Эти продукты нужны и как источник витаминов А, Е, D, и как необходимые компоненты в формировании вкуса и аромата блюд в процессе их приготовления .
Чтобы пища приносила пользу, надо выполнять правила здорового питания.
- Пища должна быть разнообразной (растительной и животной).
- Необходимо поддерживать нормальный вес.
- Больше употреблять фруктов и овощей.
- Меньше употреблять сладкого, соленого, копченого, газированных напитков.
- Не используйте в пищу немытые овощи, фрукты и ягоды.
- Соблюдайте режим питания.
Избыток углеводов, особенно Сахаров, может привести также к избыточной массе тела. Поэтому конфеты, шоколад, пирожные и т.п. должны присутствовать в рационе школьников, но в разумных количествах. Сахар служит одной из важных причин развития кариеса, который, в свою очередь, может вести в дальнейшем к болезням суставов, почек и др. Сахар и конфеты повышают частоту развития кариеса особенно существенно, если дети едят их не после приема основных блюд, а между приемами пищи, когда зубная эмаль не защищена от сахара другими пищевыми веществами
Г. Гейне: «Человек есть то, что он ест».
В этих словах подчеркивается исключительная роль питания в формировании и тела, и поведения человека. Характер питания оказывает огромное влияние на физическое развитие человека, особенно в детском и подростковом возрасте.
Правильное питание абсолютно необходимо для обеспечения нормального кроветворения, зрения, полового развития, поддержания нормального состояния кожных покровов. Без нормального питания не может работать ни один внутренний орган: ни сердце, ни желудок, ни печень, ни почки. Более того, здоровое питание выполняет еще и защитную функцию, повышая устойчивость детей и взрослых к инфекциям, ядам, радиоактивному
Урок 30. от электронной структуры атома к прогнозированию свойств веществ – Естествознание – 10 класс
Естествознание, 10 класс
Урок 30. От электронной структуры атома к прогнозированию свойств веществ
Перечень вопросов, рассматриваемых в теме:
- Как отличаются классическая атомно-молекулярная теория от атомной теории Дальтона.
- Каково электронное строение атома и принципы заполнения электронной оболочки
- Как утверждение атомно-молекулярной теории повлияло на понимание свойств веществ.
Глоссарий по теме:
Главное квантовое число (n) – характеризует общий запас энергии электрона, размер его электронного облака и нахождение электрона на определенном энергетическом уровне.
Побочное квантовое число (l) – уточняет запас энергии электрона, что ведет к делению энергетического уровня на подуровни, а также определяет форму электронного облака.
Магнитное квантовое число (ml) – определяет положение электронного облака в пространстве.
Спиновое квантовое число (ms) – определяет спин электрона, то есть направление его движения вокруг своей оси.
Атомная орбиталь – это состояние электрона в атоме, характеризующееся определенным набором значений главного, побочного и магнитного квантовых чисел (то есть определенным размером, формой и пространственным расположением электронного облака).
Принцип наименьшей энергии: в первую очередь электрон поступает на атомную орбиталь с наименьшей энергией.
Принцип Паули: в атоме не может быть двух электронов с одинаковыми значениями всех четырех квантовых чисел (см. спиновое квантовое число).
Правило Хунда: при наличии на подуровне нескольких атомных орбиталей электроны сначала располагаются по одному на каждой из свободных орбиталей. После заполнения одним электроном всех орбиталей подуровня они пополняются электронами с противоположными спинами.
Нанотехнология — область прикладной науки и техники, имеющая дело с объектами размером менее 100 нанометров (1 нанометр равен 10-9 метра).
Обязательная литература:
1. Книга для чтения по неорганической химии: Книга для учащихся: В 2-х частях. / Сост. В. А. Крицман. – 3-е изд., перераб. Ч. I. М.: Просвещение, 1993. С. 55 – 68.
2. Энциклопедический словарь юного химика / Сост. В. А. Крицман,
В. В. Станцо. – 2-е изд., испр. М.: Педагогика, 1990. С. 32 – 36. (1-е изд. – 1982).
Дополнительная литература:
3. Становление химии как науки (Всеобщая история химии). / Под ред.
Ю. И. Соловьева. М.: Наука, 1983. С. 298 – 309.
4. «Нанотехнологии. Азбука для всех». Сборник статей под редакцией Ю. Третьякова, М., Физматлит, 2007.
5. Андриевский Р.А., Рагуля А.В. «Наноструктурные материалы», М., Академия, 2005.
Теоретический материал для самостоятельного изучения
Идея структурной организации вещества волновала умы мыслителей и ученых с древних времен.
Разгадав структуру или строение вещества, найдя зависимость между строением и свойствами, можно прогнозировать и создавать вещества с заданными свойствами. Как же это осуществляется?
Родоначальником классического атомно-молекулярного учения является великий русский ученый М.В.Ломоносов. Сущность этого учения изучалась Вами на уроках физики и химии основной школы. Спустя 67 лет после Ломоносова атомистическое учение в химии применил английский ученый Джон Дальтон. Его учение в своей основе похоже на учение Ломоносова. Однако Дальтон отрицает существование молекул у простых веществ, что по сравнению с учением Ломоносова является шагом назад. По Дальтону, простые вещества состоят только из атомов, и лишь сложные вещества — из “сложных атомов” (в современном понимании — молекул). Окончательное утверждение атомно-молекулярного учения в химии произошло лишь в середине XIX в. На международном съезде химиков г. Карлсруэ в 1860 г. были приняты основные положения, определения понятий молекулы и атома.
Еще долгие годы атом считали непросто наименьшей, а элементарной, то есть более неделимой частицей вещества. Последующие открытия XX века показали неправомерность этих представлений и привели к созданию современной орбитальной или квантово-механической теории строения атома.
С точки зрения современных представлений для понимания зависимости (взаимосвязи) между строением атома и свойствами химического элемента надо знать структуру электронной оболочки атома. При ее рассмотрении важную роль играет представление о двойственной природе электрона: он одновременно обладает свойствами частицы (масса, заряд) и волны (длина, амплитуда, частота).
Двойственная природа электрона позволяет характеризовать его как электронное облако, не имеющее четких границ. Это значит, что нахождение электрона в околоядерном пространстве неодинаково: в нем есть области наиболее и наименее вероятного нахождения электрона. Область, где возможность обнаружить электрон особенно велика, обозначают термином атомная орбиталь.
Для описания внутренней структуры электронной оболочки атома применяют основные характеристики орбитали – квантовые числа. Рассмотрите определения и данные в таблице:
Главное квантовое число (n) – характеризует общий запас энергии электрона, размер его электронного облака и нахождение электрона на определенном энергетическом уровне. Значение главного квантового числа определяется номером периода. Чем дальше от ядра формируется энергетический уровень, тем больше запас энергии электрона и размер его электронного облака.
Побочное квантовое число (l) – определяет форму электронного облака, а также конкретизирует запас энергии электрона, что ведет к делению энергетического уровня на подуровни.
В пределах одного энергетического уровня электроны могут незначительно различаться запасом своей энергии. Поэтому, энергетические уровни (кроме первого) расщепляются на подуровни. В атомах известных элементов реализованы четыре вида подуровней: s-, p-, d- и f-подуровни, на которых соответственно располагаются s-, p-, d- и f-электроны.
Магнитное квантовое число (ml) – определяет положение электронного облака в пространстве.
Число таких положений (значений ml) равно количеству атомных орбиталей на подуровне. Поэтому, на s-подуровне всегда располагается одна атомная орбиталь, на p-подуровне – три, на d-подуровне – пять и на f-подуровне – семь.
Итак, каждая атомная орбиталь определяется тремя квантовыми числами – главным, побочным и магнитным. Дадим определение.
Атомная орбиталь – это состояние электрона в атоме, которое характеризуется определенным набором значений главного, побочного и магнитного квантовых чисел (то есть определенным размером, формой и пространственным расположением электронного облака).
На одной атомной орбитале может находиться не более двух электронов. Возможность такого расположения зависит от еще одного квантового числа.
Спиновое квантовое число (ms) – определяет спин электрона, то есть направление его движения вокруг своей оси.
Спин – важное свойство электрона. Оно служит его собственной, индивидуальной характеристикой в атоме. Это значит, что у двух электронов могут совпадать значения главного, побочного и магнитного квантовых чисел. Но при этом они будут различаться значением спинового числа. Такие электроны, располагаясь на одной атомной орбитале, будут обладать антипараллельными спинами (вращаться в разные стороны вокруг своей оси).
Общее представление об устройстве электронной оболочки атома дает следующая таблица. Познакомьтесь с ее содержанием.
Энергетический | Обозначение подуровня (nl) | Число АО | Число электронов | |||
Уровень (n) | подуро-вень (l) | на подуровне (ml) | на уровне | на подуровне | на уровне | |
1 | s | 1s | 1 | 1 | 2 | 2 |
2 | s p | 2s 2p | 1 3 | 4 | 2 6 | 8 |
3 | s p d | 3s 3p 3d | 1 3 5 | 9 | 2 6 10 | 18 |
4 | s p d f | 4s 4p 4d 4f | 1 3 5 7 | 16 | 2 6 10 14 | 32 |
Не менее важным для понимания структуры электронной оболочки атома является знание правил (принципов) ее заполнения электронами. Назовем их.
Принцип наименьшей энергии: в первую очередь электрон поступает на атомную орбиталь с наименьшей энергией.
Принцип наименьшей энергии задает следующую последовательность заполнения подуровней в атоме:
1s > 2s > 2p > 3s > 3p > 4s ≈ 3d > 4p > 5s ≈ 4d > 5p > 6s …
В зависимости от того, какой подуровень в атоме заполняется электронами последним, различают четыре семейства химических элементов: s-, p-, d- и f-элементы.
Принцип Паули: в атоме не может быть двух электронов с одинаковыми значениями всех четырех квантовых чисел (см. спиновое квантовое число).
Правило Хунда: при наличии на подуровне нескольких атомных орбиталей электроны сначала располагаются по одному на каждой из свободных орбиталей. После заполнения одним электроном всех орбиталей подуровня они пополняются электронами с противоположными спинами.
Распределение электронов по уровням и подуровням представляют с помощью электронных формул, а для графического описания электронной оболочки атома используют электронные схемы.
Общая идея структурной организации вещества заключается в потенциальной возможности построения вещества с заданной надатомной (надмолекулярной) архитектурой (структурой). Основой структурной организации молекул и веществ является изначальная активность атомов и их способность образовывать химические связи.
Архитектура и топология атомно-молекулярных систем всецело определяется совокупностью связей. Современная теория атомно-молекулярной сборки является основой обеспечения и сопровождения высоких технологий. Эта теория выводит исследования в области высоких технологий на качественно новый уровень, соответствующий интенсивному этапу их становления и развития. Основным звеном теории является атом, в электронной структуре которого заложена генетическая информация о структурообразовании вещества.
В современном мире важным звеном развития становится освоение нанотехнологий, в частности, систем очень малого размера, способных осуществлять команды людей. Нанотехнология — область прикладной науки и техники, имеющая дело с объектами размером менее 100 нанометров (1 нанометр равен 10-9 метра). В переводе с греческого слово «нано» означает карлик. Один нанометр (нм) – это одна миллиардная часть метра (10-9 м). Нанометр очень и очень мал.
С одной стороны, нанотехнологии уже нашли сферы применения, с другой – они остаются для большинства населения еще областью научной фантастики. В будущем значение нанотехнологий будет только возрастать.
Выводы:
Отличия в электронном строении атомов приводят к различию в способности атомов образовывать атомные структуры в виде молекул и химических соединений и объясняют тем самым наблюдаемое в природе многообразие атомно-молекулярных структур. В результате создаваемая теория вещества принимает статус прогностической теории, т.е. теории, которая может способствовать предсказанию свойств создаваемой атомно-молекулярной системы на основании данных о строении атомов и молекул. Это означает, что, располагая знаниями о строении атомов и механизмов образования атомно-молекулярных систем, появляется принципиальная возможность предсказывать физико-химические свойства вещества и функции создаваемых атомных конструкций.
Примеры и разбор решения заданий тренировочного модуля:
Задание 1/ Электронную конфигурацию атома фосфора отражает схема…
а) 1s2 2s2 2р6 3s2 Зр6 3d10 4s2 4р3;
б) 1s2 2s2 2р6 3s2 Зр6 3d3 4s2;
в) 1s2 2s22p6 3s2 3p3;
г) 1s2 2s2 2p6 3s2 3p6 4s24p3
Ответ: в.
Решение. Фосфор имеет порядковый номер 15 (см. периодическую систему химических элементов), относится к р-элементам. Атом фосфора имеет следующую электронную конфигурацию: 1s2 2s2 2рв 3s2 Зр3.
В варианте а) приведена неправильная электронная конфигурация атома фосфора, т.к. это конфигурация р-элемента IV периода.
В варианте б) электронная конфигурация соответствует атому ванадия, в варианте г — такого атома нет.
Задание 2. Запишите символы элементов, в атомах которых электроны распределены по энергетическим уровням так:
а) 2е, 8е, 2е
б) 2е, 8е, 3е
Ответы:
а) Mg;
б) Al.
Решение.
1 вариант решения: У каждого из указанных атомов по 3 энергетических уровня (перечислены количества электронов на каждом уровне через запятую в задании), следовательно, это элементы третьего периода (малого). На первом энергетическом уровне не может быть больше двух электронов; на втором – больше 8 электронов. Количество электронов на последнем энергетическом уровне соответствует номеру группы (для элементов главных подгрупп). Эти элементы принадлежат к элементам главных подгрупп (элементы малого периода). Поэтому первый элемент – элемент второй группы, третьего периода периодической системы – это Mg. А второй элемент – элемент третьей группы, третьего периода периодической системы – это Al.
2 вариант решения: Можно сложить все перечисленные на каждом энергетическом уровне электроны каждого из атомов и получить общее количество электронов в атоме. Что соответствует порядковому номеру элемента в периодической системе. В пункте а) 2+8+2=12. Этот элемент Mg. В пункте б) 2+8+3=13. Этот элемент Al.
Назад & nbsp На главную & nbsp ДалееЭлементы
Элементы – это чистые вещества. Атомы каждого элемента химически различны
и отличается от любого другого элемента. Примерно 110 элементов
теперь известно. К 1980 году 106 из них были однозначно охарактеризованы и признаны
Международным союзом теоретической и прикладной химии (IUPAC). С тех пор
время, элементы 107 и 109 были идентифицированы среди продуктов ядерного
реакция.Поиск новых элементов продолжается во многих лабораториях вокруг
мир; новые элементы могут быть объявлены в любое время.
A. Названия и символы элементов
У каждого элемента есть имя. Многие из этих имен вам уже знакомы – золото, серебро, медь, хлор, платина, углерод, кислород и азот. Сами названия интересны. Многие ссылаются на свойство элемента. Латинское название золота – aurum, означает «сияющий рассвет».«Латинское название ртути, hydrargyrum, означает« жидкое серебро ».
Продолжается практика именования элемента после одного из его свойств. Цезий был открыт в 1860 году немецким химиком Бунзеном (изобретателем горелки Бунзена). Поскольку этот элемент придает синий цвет пламени, Бунзен назвал его цезием от латинского слова caesius, что означает «небесно-голубой».
Остальные элементы названы в честь людей.Куриум назван в честь Марии Кюри (1867-1934), пионера в изучении радиоактивности. Мария Кюри, французский ученый польского происхождения, была удостоена Нобелевской премии по физике в 1903 году за свои исследования радиоактивности. Она также была удостоена Нобелевской премии по химии в 1911 году за открытие элементов полоний (названный в честь Польши) и радий (латинское, радиус , “луч” ).
Некоторые элементы названы по местам. В честь небольшого городка Иттерби в Швеции названы четыре элемента: тербий, иттрий, эрбий и иттербий.Калифорний – еще один пример элемента, названного в честь места, где он был впервые обнаружен. Этот элемент не встречается в природе. Впервые он был изготовлен в 1950 году в Радиационной лаборатории Калифорнийского университета в Беркли группой ученых во главе с Гленном Сиборгом. Сиборг был также первым, кто идентифицировал кюрий в металлургической лаборатории Чикагского университета (ныне Аргоннская национальная лаборатория) в 1944 году. Сам Сиборг был назван лауреатом Нобелевской премии в 1951 году в честь его новаторской работы по получению других неизвестных элементов.
У каждого элемента есть символ, одна или две буквы, которые представляют элемент так же, как ваши инициалы представляют вас. Символ элемента представляет один атом этого элемента. Для 14 элементов символ состоит из одной буквы. За возможным исключением иттрия (Y) и ванадия (V), вы, вероятно, знакомы с названиями всех элементов, имеющими однобуквенные символы. Эти элементы перечислены в таблице 3.1. Для 12 из этих элементов символ – это первая буква названия.
Калий был открыт в 1807 году и назван в честь поташа, вещества, из которого впервые был выделен калий. Символ калия, K, происходит от слова kalium , латинского слова, обозначающего поташ. Вольфрам, открытый в 1783 году, имеет символ W, что означает вольфрамит, минерал, из которого вольфрам был впервые выделен.
|
|
Большинство других элементов имеют двухбуквенные символы.В этих двухбуквенных символах первая буква всегда заглавная, а вторая – строчная. Одиннадцать элементов имеют имена (и символы), начинающиеся с буквы C. Один из них, углерод, имеет однобуквенный символ C. Остальные десять имеют двухбуквенные символы (см. Таблицу 3.2).
|
|
Б.Списки элементов
Когда вы изучаете химию, вам часто понадобится список элементов. К
просмотреть список элементов нажмите здесь. В списке есть символ,
атомный номер и атомный вес элемента. Значение атомной
числа и веса будут обсуждаться в главе 4. А пока достаточно
чтобы знать, что каждый элемент имеет число от 1 до 110, называется его атомным номером .
номер. Этот номер так же уникален для элемента, как его имя или символ.
Во втором списке, называемом периодической таблицей, элементы располагаются в порядке возрастания атомного номера в строках различной длины. Значение длины строки и отношения между элементами в одной строке или столбце будет обсуждаться в главе 5. Таблица Менделеева появляется при нажатии на внутреннюю сторону лицевой обложки этого текста. На протяжении всего текста мы будем ссылаться на таблицу Менделеева, потому что она содержит удивительный объем информации.На данный момент вам нужно только знать, что элементы в одном столбце имеют схожие свойства и что тяжелая ступенчатая линия, пересекающая таблицу по диагонали от бора (B) до астата (At), отделяет металлические элементы от неметаллических элементов. Таблица Менделеева также показана на Рисунке 3.3. Заштрихованные области отмечают элементы, с которыми вы чаще всего сталкиваетесь в этом тексте.
1. Металлы и неметаллы
Металлы появляются внизу и слева от жирной диагональной линии в периодической таблице.Характерные свойства металла:
- Он блестящий и блестящий.
- Проводит тепло и электричество.
- Он пластичный и податливый; то есть его можно втянуть в проволока и ее можно забить в тонкий лист.
- Это твердое вещество при 20 ° C. Единственное исключение – Меркурий. правило; это жидкость при комнатной температуре. Два других металла, галлий и цезий, имеют температуры плавления, близкие к комнатной температуре (19.8 ° C и 28,4 ° С).
Неметаллы различаются по своим свойствам больше, чем металлы; некоторые могут даже иметь одно или несколько из перечисленных металлических свойств. Некоторые неметаллы газообразны; хлор и азот – газообразные неметаллы. При 20 ° C один неметалл, бром, является жидкие, а другие – твердые, например углерод, сера и фосфор.
| Бром | |
| Углерод | |
| Сера | |
| Красный фосфор |
С.Распределение элементов
Известные элементы неравномерно распределены в мире. Только 91 обнаружен в земной коре, океанах или атмосфере; остальные были произведены в лабораториях. Следы некоторых, но не всех этих элементов были обнаружены на Земле или в звездах. Поиск остальных продолжается. Изучая этот текст, вы можете прочитать об его успехе или об обособлении новых элементов.
|
|
В таблице 3.3 перечислены 18 элементов, наиболее распространенных в земной коре, океанах и атмосфере, а также их относительный процент от общей массы Земли. Одним из наиболее ярких моментов в этом списке является чрезвычайно неравномерное распределение элементов (см. Рисунок 3.4). Кислород – безусловно самый распространенный элемент. Он составляет 21% объема атмосферы и 89% массы воды. Кислород в воздухе, воде и других местах составляет 49,2% массы земной коры, океанов и атмосферы. Кремний – второй по распространенности элемент на Земле (25,7% по массе). Кремний не встречается в природе в свободном виде, но встречается в сочетании с кислородом, в основном в виде диоксида кремния (SiO 2 ), в песке, кварце, горном хрусте, аметисте, агате, кремне, яшме и опале, а также в различных силикатах. минералы, такие как гранит, асбест, глина и слюда.Алюминий – самый распространенный металл в земной коре (7,5%). В природе всегда встречается в сочетании. Большая часть алюминия, используемого сегодня, получается при переработке бокситов, руды, богатой оксидом алюминия. Эти три элемента (кислород, кремний и алюминий) плюс железо, кальций, натрий, калий и магний составляют более 97% массы земной коры, океанов и атмосферы. Еще одна удивительная особенность распределения элементов состоит в том, что некоторые из металлов, которые наиболее важны для нашей цивилизации, относятся к числу самых редких; эти металлы включают свинец, олово, медь, золото, ртуть, серебро и цинк.
| РИСУНОК 3.4 Относительные массовые проценты элементов в земной коре, океанах и атмосфере. |
Распределение элементов в космосе сильно отличается от земного. Согласно современным знаниям, водород является самым распространенным элементом во Вселенной, составляя до 75% его массы. Гелий и водород вместе составляют почти 100% массы Вселенной.
В таблице 3.4 перечислены биологически важные элементы, которые содержатся в нормальном здоровом организме. Первые четыре из этих элементов – кислород, углерод, водород и азот – составляют около 96% от общей массы тела (см. Рис. 3.5). Другие перечисленные элементы, хотя и присутствуют в гораздо меньших количествах, тем не менее необходимы для хорошего здоровья.
|
|
| РИСУНОК 3.5 Распределение элементов (по массе) в организме человека. |
D. Как элементы встречаются в природе
Элементы встречаются как отдельные атомы или как группы атомов, химически связанных вместе. Природа этих химических связей будет обсуждаться в главе 7. Группы атомов, химически связанных вместе, называются молекулами.
или формульные единицы.
Молекулы могут содержать атомы одного элемента или они могут содержать атомы разных элементов (в этом случае молекула представляет собой соединение.) Так же, как атом – это наименьшая единица элемента, молекула – наименьшая единица соединения, то есть наименьшая единица, имеющая химическую идентичность этого соединения.
Давайте рассмотрим, как элементы могут быть классифицированы по тому, как они находятся во Вселенной.
1. Благородные газы
Лишь несколько элементов встречаются в виде отдельных несвязанных атомов; В таблице 3.5 перечислены эти элементы. В нормальных условиях все эти элементы являются газами; вместе они известны как благородные газы.Их также называют одноатомными газами, что означает, что они существуют в несвязанном виде как отдельные атомы ( моно, означает «один»). Формула каждого благородного газа – это просто его символ. Когда требуется формула гелия, используется символ He. Нижний индекс 1 понимается.
| Символ | Элемент |
|---|---|
| He | гелий |
| Ne | неон |
| Ар | аргон |
| Kr | криптон |
| Xe | ксенон |
| Rn | радон |
2.Металлы
Чистые металлы рассматриваются так, как если бы они существовали как отдельные несвязанные атомы даже
хотя образец чистого металла представляет собой совокупность миллиардов атомов. Таким образом, когда
требуется формула меди, ее символ Cu используется для обозначения одного атома
меди.
Медь металлическая |
3.Неметаллы
Некоторые неметаллы существуют при нормальных условиях температуры и давления, как
молекулы, содержащие два, четыре или восемь атомов. Те неметаллы, которые встречаются как
двухатомные (двухатомные) молекулы перечислены в таблице 3.6. Таким образом, мы используем O 2 как формула для кислорода, N 2 для азота и т. д. Среди
неметаллы, сера существует как S 8 , а фосфор находится как P 4 .
Для других неметаллов (не указанных в таблице 3.5 или 3.6) одноатомная формула
используется – например, А для мышьяка и Se для селена.
| Формула | Имя | Нормальное состояние |
|---|---|---|
| H 2 | водород | газ бесцветный |
| N 2 | азот | газ бесцветный |
| О 2 | кислород | газ бесцветный |
| Ф. 2 | фтор | бледно-желтый газ |
| Класс 2 | хлор | зеленовато-желтый газ |
| Br 2 | бром | темно-красная жидкость |
| I 2 | йод | фиолетовый черный сплошной |
4.Соединения
Хотя многие элементы могут находиться в несоединенном состоянии, все элементы, за исключением некоторых благородных газов, также встречаются в соединениях с другими элементами. В разделе 3.1 мы определили соединение как вещество, которое можно разложить обычными химическими средствами. Соединение также можно определить как чистое вещество, содержащее два или более элементов. Состав соединения выражается формулой, в которой используются символы всех элементов в соединении.За каждым символом следует нижний индекс – число, показывающее, сколько атомов элемента входит в одну молекулу (простейшую единицу) соединения; индекс 1 не отображается. Вода – это соединение с формулой H 2 O, что означает, что одна молекула (или формульная единица) воды содержит два атома водорода и один атом кислорода. Соединение гидрокарбоната натрия имеет формулу NaHCO 3 , что означает, что одна формульная единица этого соединения содержит один атом натрия, один атом водорода, один атом углерода и три атома кислорода.Обратите внимание, что сначала пишутся символы металлов в гидрокарбонате натрия, затем неметаллы, а из неметаллов – кислород. Это обычный порядок.
Иногда формула может содержать группу символов, заключенных в круглые скобки. как, например, Cu (NO 3 ) 2 . Скобки означают, что заключенная в них группа атомов действует как единое целое. Нижний индекс после скобка означает, что группа берется два раза для каждого атома меди.
Нитрат меди |
Свойства соединения совершенно не похожи на свойства элементов, из которых он сформирован. Этот факт становится очевидным, если мы сравним свойства углекислого газа, CO 2 (бесцветный газ, используемый в огнетушителях), с углем (черное горючее твердое вещество) и кислород (бесцветный газ, необходимый для горения).Более подробно свойства соединений обсуждаются в главе 6.
Назад & nbsp На главную & nbsp Далееединиц чтения: Периодическая таблица элементов
Различные элементы организованы и отображены в периодической таблице. В таблице, разработанной русским химиком Дмитрием Менделеевым (1834–1907) в 1869 году, сгруппированы элементы, которые, хотя и являются уникальными, имеют общие химические свойства с другими элементами.Свойства элементов определяют их физическое состояние при комнатной температуре: они могут быть газами, твердыми телами или жидкостями. Элементы также обладают определенной химической реакционной способностью, способностью объединяться и химически связываться друг с другом.
В периодической таблице, показанной на рисунке 1, элементы организованы и отображаются в соответствии с их атомными номерами и расположены в серии строк и столбцов на основе общих химических и физических свойств. В периодической таблице Менделеева указывается не только атомный номер каждого элемента, но и его атомная масса.Например, глядя на углерод, появляются его символ (C) и название, а также его атомный номер шесть (в верхнем левом углу) и его атомная масса 12,11.
Рис. 1. В периодической таблице указаны атомная масса и атомный номер каждого элемента. Атомный номер отображается над символом элемента, а приблизительная атомная масса – под ним.
В периодической таблице элементы сгруппированы по химическим свойствам. Различия в химической активности между элементами основаны на количестве и пространственном распределении электронов в атоме.Атомы, которые химически реагируют и связываются друг с другом, образуют молекулы. Молекулы – это просто два или более атомов, химически связанных вместе. По логике вещей, когда два атома химически связываются, образуя молекулу, их электроны, которые образуют крайнюю область каждого атома, сначала объединяются, поскольку атомы образуют химическую связь.
Посмотрите это видео, чтобы более подробно познакомиться с периодической таблицей Менделеева:
Периодическая таблица элементов | Химия
В 1869 году русский химик Дмитрий Менделеев впервые предположил, что химические элементы обладают «периодичностью свойств».” Менделеев пытался организовать химические элементы в соответствии с их атомным весом, предполагая, что свойства элементов будут постепенно меняться по мере увеличения атомного веса. Однако он обнаружил, что химические и физические свойства элементы постепенно увеличивались, а затем внезапно менялись на разных шаги или периоды. Чтобы учесть эти повторяющиеся тенденции, Менделеев сгруппировал элементы в таблице, содержащей как строки, так и столбцы.
Периодическая таблица элементовСтруктура современной таблицы Менделеева
Современная периодическая таблица элементов основана на наблюдениях Менделеева; однако, вместо того, чтобы быть организованной по атомному весу, современная таблица упорядочена по атомному номеру (z).При перемещении слева направо по строке периодической таблицы свойства элементов постепенно меняются. В конце каждого ряда происходит резкое изменение химических свойств. Следующий элемент в порядке атомного номера более похож (химически говоря) на первый элемент в строке над ним; таким образом, новая строка начинается на столе.
Например, кислород (O), фтор (F) и неон (Ne) (z = 8, 9 и 10 соответственно) – все это стабильные неметаллы, которые при комнатной температуре являются газами.Натрий (Na, z = 11), однако, представляет собой металлическое серебро, твердое при комнатной температуре, как и элемент литий (z = 3). Таким образом, натрий начинает новую строку в периодической таблице и помещается непосредственно под литием, подчеркивая их химический состав. сходства.
Строки в периодической таблице называются периодами. Как один движется слева направо в заданный период, химические свойства элементов медленно меняются. Столбцы в периодической таблице называются группами.Элементы в данной группе в периодической таблице обладают многими схожими химическими и физическими свойствами.
Контрольная точка понимания
Почему натрий стоит прямо под литием в периодической таблице?
Электронная конфигурация и таблица
«Периодическая» природа химических свойств, которые обнаружил Менделеев, связана с электронной конфигурацией атомов элементов.Другими словами, способ, которым электроны атома расположены вокруг его ядра, влияет на свойства атома.
Теория атома Нильса Бора говорит нам, что электроны не являются расположены случайным образом вокруг ядра атома, но встречаются в определенных электронных оболочках (см. наш модуль Atomic Theory II для получения дополнительной информации). Каждая оболочка имеет ограниченную емкость для электронов. По мере заполнения нижних оболочек дополнительные электроны находятся в более удаленных оболочках.
Емкость первой электронной оболочки – два электрона, а второй – восемь. Таким образом, в нашем примере, рассмотренном выше, кислород с восемью протонами и восемью электронами несет два электрона на своей первой оболочке и шесть на своей второй оболочке. Фтор с девятью электронами несет два в своей первой оболочке и семь во второй. Неон с десятью электронами несет два в первом и восемь во втором.Поскольку количество электронов во второй оболочке увеличивается, мы можем представить, почему химические свойства постепенно меняются по мере того, как мы переходим от кислорода к фтору и неону.
У натрия одиннадцать электронов. Двое поместились в его первую оболочку, но помните, что вторая оболочка может нести только восемь электронов. Одиннадцатый электрон натрия не может поместиться ни в его первую, ни в его вторую оболочку. Этот электрон поселяется на еще одной орбите, третьей электронной оболочке натрия.Причина резкого изменения химических свойств при переходе от неона к натрию заключается в том, что между двумя элементами происходит резкий сдвиг в электронной конфигурации. Но почему натрий похож на литий? Давайте посмотрим на электронные конфигурации этих элементов.
Электронные конфигурации для выбранных элементовКак вы можете видеть на иллюстрации, в то время как натрий имеет три электронные оболочки, а литий две, их общая характеристика состоит в том, что оба они имеют только один электрон на крайнем внешнем участке. электронная оболочка.Эти электроны внешней оболочки (называемые валентными электроны) важны для определения химических свойств элементов.
Химические свойства элемента определяются тем, как его атомы взаимодействуют с другими атомами. Если мы изобразим внешнюю (валентную) электронную оболочку атома как сферу, охватывающую все внутри, то только валентная оболочка может взаимодействовать с другими атомами – почти так же, как это только краска на внешней стороне вашего дома. который “взаимодействует” с, и промокает, дождевая вода.
Валентная оболочка атома «покрывает» внутренние электронные оболочкиЭлектроны валентной оболочки в атоме определяют способ его взаимодействия с соседними атомами и, следовательно, определяют его химические свойства. Поскольку и натрий, и литий имеют один валентный электрон, они обладают схожими химическими свойствами.
Контрольная точка понимания
Химические свойства элемента определяются количеством электронов в
Сокращение электронной конфигурации
Для элементов в группах, обозначенных A в периодической таблице (IA, IIA и т. Д.) количество валентных электронов соответствует номеру группы. Таким образом, Li, Na и другие элементы в группе IA имеют один валентный электрон. Be, Mg и другие элементы группы IIA имеют два валентных электрона. B, Al и другие элементы группы IIIA имеют три валентных электрона и так далее. Номер строки или периода, в котором находится элемент в таблице, равен количеству полных оболочек, содержащих электроны в атоме. H и He в первом периоде обычно имеют электроны только в первой оболочке; Li, Be, B и другие элементы периода два занимают две оболочки и так далее.Чтобы записать электронную конфигурацию элементов, ученые часто используют стенографию, в которой за символом элемента следуют его электронные оболочки. Ниже приведены несколько примеров.
| Сокращение конфигурации элемента | ||||
|---|---|---|---|---|
| Элемент | Сокращение конфигурации | |||
| Водород | H | 1e – | ||
| Литий | Li | 2e – | 1e – | |
| Фтор | F | 2e – | 7e – | |
| Натрий | Na | 2e – | 8e – | 1e – |
Для получения дополнительных сведений в таблице, приведенной ниже, показаны электронные конфигурации первых одиннадцати элементов.
Сводка
Современная таблица Менделеева основана на наблюдениях Дмитрия Менделеева 1896 года о том, что химические элементы можно сгруппировать по химическим свойствам, которые они проявляют. Этот модуль объясняет расположение элементов в таблице периодов. Он определяет периоды и группы и описывает, как различные электронные конфигурации влияют на свойства атома.
открытых учебников | Сиявула
Математика
Наука
- Читать онлайн
Учебники
Английский
Марка 7A
Марка 7Б
Оценка 7 (вместе A и B)
Африкаанс
Граад 7А
Граад 7Б
Граад 7 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Марка 8A
Марка 8Б
Оценка 8 (вместе A и B)
Африкаанс
Граад 8А
Граад 8Б
Граад 8 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Марка 9А
Марка 9Б
9 класс (A и B вместе)
Африкаанс
Граад 9А
Граад 9Б
Граад 9 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Марка 4A
Марка 4Б
Класс 4 (вместе A и B)
Африкаанс
Граад 4А
Граад 4Б
Граад 4 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Марка 5А
Марка 5Б
Оценка 5 (вместе A и B)
Африкаанс
Граад 5А
Граад 5Б
Граад 5 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Марка 6A
Марка 6Б
6 класс (A и B вместе)
Африкаанс
Граад 6А
Граад 6Б
Граад 6 (A en B saam)
Пособия для учителя
Наша книга лицензионная
Эти книги не просто бесплатные, они также имеют открытую лицензию! Один и тот же контент, но разные версии (брендированные или нет) имеют разные лицензии, как объяснено:
CC-BY-ND (фирменные версии)
Вам разрешается и поощряется свободное копирование этих версий.Вы можете делать ксерокопии, распечатывать и распространять их сколь угодно часто. Вы можете скачать их на свой мобильный телефон, iPad, ПК или флешку. Вы можете записать их на компакт-диск, отправить по электронной почте или загрузить на свой веб-сайт. Единственное ограничение заключается в том, что вы не можете адаптировать или изменять эти версии учебников, их содержание или обложки каким-либо образом, поскольку они содержат соответствующие бренды Siyavula, спонсорские логотипы и одобрены Департаментом базового образования. Для получения дополнительной информации посетите Creative Commons Attribution-NoDerivs 3.0 Непортированный.
Узнайте больше о спонсорстве и партнерстве с другими, которые сделали возможным выпуск каждого из открытых учебников.
CC-BY (версии без марочного знака)
Эти небрендированные версии одного и того же контента доступны для вас, чтобы вы могли делиться ими, адаптировать, трансформировать, модифицировать или дополнять их любым способом, с единственным требованием – дать соответствующую оценку Siyavula. Для получения дополнительной информации посетите Creative Commons Attribution 3.0 Unported.
Периодические свойства элементов
Элементы в периодической таблице расположены в порядке возрастания атомного номера.Все эти элементы демонстрируют несколько других тенденций, и мы можем использовать периодический закон и формирование таблицы, чтобы предсказать их химические, физические и атомные свойства. Понимание этих тенденций достигается путем анализа электронной конфигурации элементов; все элементы предпочитают формирование октетов и будут получать или терять электроны, чтобы сформировать эту стабильную конфигурацию.
Атомный радиус
Мы никогда не сможем определить атомный радиус атома, потому что никогда не бывает нулевой вероятности нахождения электрона и, следовательно, никогда не бывает четкой границы с атомом.Все, что мы можем измерить, – это расстояние между двумя ядрами (межъядерное расстояние). Ковалентный радиус – это половина расстояния между ядрами двух одинаковых атомов. Ионный радиус составляет половину расстояния между ядрами двух ионов в ионной связи. Расстояние должно быть распределено для меньшего катиона и большего аниона. Металлический радиус составляет половину расстояния между ядрами двух соседних атомов в кристаллической структуре. Благородные газы не учитываются в тенденциях изменения атомных радиусов, потому что экспериментальные значения их атомных радиусов вызывают большие споры.Единицами СИ для измерения атомных радиусов являются нанометр (нм) и пикометр (пм). 1 нм = 1 X 10 -9 м; 1 pm = 1 X 10 -12 м.
Рисунок 1: (слева) ковалентные радиусы, (в центре) ионные радиусы, (справа) металлические радиусы. Любезно предоставлено Джессикой Торнтон (UCD)Чтобы объяснить эту тенденцию, необходимо понять концепцию скрининга и проникновения. Проникновение обычно известно как расстояние, на котором электрон находится от ядра. Экранирование определяется как концепция внутренних электронов, блокирующих внешние электроны от заряда ядра.В рамках этой концепции мы предполагаем, что между внешними электронами нет экранирования и что внутренние электроны экранируют внешние электроны от общего положительного заряда ядра. Чтобы понять степень экранирования и проникновения в атом, ученые придумали эффективный ядерный заряд , \ (Z_ {eff} \). Уравнение для расчета эффективного заряда ядра показано ниже.
\ [Z_ {eff} = Z – S \]
В уравнении S представляет количество внутренних электронов, экранирующих внешние электроны.Студенты могут легко найти S, используя атомный номер благородного газа, который находится на одну точку над элементом. Например, S, которое мы будем использовать для хлора, будет 10 (атомный номер неона). Z – общее количество электронов в атоме. Поскольку мы знаем, что нейтральный атом имеет одинаковое количество протонов и электронов, мы можем использовать атомный номер для определения Z. Например, для хлора значение Z будет равно 17 (атомный номер хлора). Продолжая использовать хлор в качестве примера, 10 внутренних электронов (S) будут экранировать положительный заряд десяти протонов.Поэтому был бы и эффективный ядерный заряд 17-10 или +7. Эффективный заряд ядра показывает, что ядро притягивает внешние электроны с зарядом +7, и поэтому внешние электроны притягиваются ближе к ядру, и атомные радиусы меньше. Таким образом, чем больше заряд ядра, тем большее притяжение ядра оказывает на внешние электроны и тем меньше атомные радиусы. Напротив, чем меньше заряд ядра, тем меньшее притяжение ядра оказывает на внешние электроны и тем больше атомные радиусы.Кроме того, с увеличением атомного номера увеличивается и эффективный заряд ядра. На рисунке 3 показано влияние эффективного заряда ядра на атомные радиусы.
Рисунок 3: Предоставлено Джессикой Торнтон (UCD)Теперь мы готовы описать тенденцию атомного радиуса в периодической таблице. Слева направо через период увеличивается атомный номер, а затем и эффективный заряд ядра. Поэтому, двигаясь слева направо по периоду, ядро сильнее притягивает внешние электроны, и атомные радиусы уменьшаются.При движении вниз по группе в периодической таблице количество заполненных электронных оболочек увеличивается. В группе валентные электроны сохраняют одинаковый эффективный заряд ядра, но теперь орбитали удалены от ядра. Следовательно, ядро меньше притягивает внешние электроны, а атомные радиусы больше.
Рисунок 4: Предоставлено Джессикой Торнтон (UCD)Теперь мы можем использовать эту концепцию для объяснения различий в атомных радиусах катионов и анионов. Катион – это атом, потерявший один из своих внешних электронов.Катионы имеют меньший радиус, чем атом, из которого они образовались. С потерей электрона положительный ядерный заряд обесценивает отрицательный заряд, создаваемый электронами. Следовательно, положительное ядро притягивает электроны сильнее, а радиус меньше. Анион – это атом, который приобрел внешний электрон. Анионы имеют больший радиус, чем атом, из которого они образовались. Усиление электрона не изменяет заряд ядра, но добавление электрона вызывает уменьшение эффективного заряда ядра.Следовательно, электроны удерживаются более свободно, а радиус атома увеличивается.
Рисунок 5: Предоставлено Джессикой Торнтон (UCD)Энергия ионизации (потенциал ионизации)
Чтобы вытолкнуть электрон из атома, требуется достаточно энергии, чтобы преодолеть магнитное притяжение положительного заряда ядра. Следовательно, энергия ионизации (I.E. или I) – это энергия, необходимая для полного удаления электрона из газообразного атома или иона. Энергия ионизации всегда положительна.
Рисунок 6: Предоставлено Джессикой Торнтон (UCD)Энергия, необходимая для удаления одного валентного электрона, – это первая энергия ионизации, вторая энергия ионизации – это энергия, необходимая для удаления второго валентного электрона, и так далее.- \]
Энергия ионизации увеличивается относительно высокого эффективного заряда. Благородные газы обладают самой высокой энергией ионизации, потому что все они имеют высокий эффективный заряд из-за образования октетов и требуют большого количества энергии для разрушения этой стабильной конфигурации. Наибольшее количество энергии требуется для элементов в правом верхнем углу. Кроме того, элементы в левом углу имеют низкую энергию ионизации, потому что потеря электрона позволяет им иметь конфигурацию благородного газа.Следовательно, требуется меньше энергии для удаления одного из их валентных электронов
| Элемент | 1-й | 2-я | 3-й | 4-я | 5-я | 6-я | 7-я |
|---|---|---|---|---|---|---|---|
| Na | 496 | 4562 | |||||
| мг | 738 | 1451 | 7733 | ||||
| Алюминиевый | 577 | 1817 | 2745 | 11580 | |||
| Si | 786 | 1577 | 3232 | 4356 | 16090 | ||
| п. | 1060 | 1903 | 2912 | 4957 | 6274 | 21270 | |
| S | 999.6 | 2251 | 3361 | 4564 | 7013 | 8496 | 27110 |
| Класс | 1256 | 2297 | 3822 | 5158 | 6542 | 9362 | 11020 |
| Ар | 1520 | 2666 | 3931 | 5771 | 7238 | 8781 | 12000 |
Это энергии ионизации для трех элементов периода.Обратите внимание, как Na после во втором I.E., Mg в третьем I.E., Al в четвертом I.E. и так далее – все они имеют огромное увеличение энергии по сравнению с исходным. Это происходит потому, что текущая конфигурация находилась в стабильном формировании октетов; поэтому для ионизации требуется гораздо большее количество энергии.
Энергия ионизации увеличивается слева направо в течение периода и увеличивается при движении вверх по группе. По мере того, как вы поднимаетесь на группу, энергия ионизации увеличивается, потому что меньше электронов защищает внешние электроны от притяжения ядра.Следовательно, требуется больше энергии, чтобы вывести ядро из строя и удалить электрон. Когда мы перемещаемся по таблице Менделеева слева направо, энергия ионизации увеличивается из-за увеличения эффективного заряда ядра. Это связано с тем, что чем больше эффективный заряд ядра, тем сильнее ядро удерживает электрон и тем больше энергии требуется для его высвобождения.
Рисунок 7: Предоставлено Джессикой Торнтон (UCD)Энергия ионизации – это лишь общее правило. Бывают случаи, когда эта тенденция не подтверждается.Обычно это можно объяснить их электронной конфигурацией. Например, магний имеет более высокую энергию ионизации, чем алюминий. Магний имеет электронную конфигурацию [Ne] 3s2. Магний обладает высокой энергией ионизации, потому что он имеет заполненную 3s-орбиталь, и ему требуется большее количество энергии, чтобы забрать электрон с заполненной орбитали.
Сродство к электрону
Сродство к электрону (E.A.) – это изменение энергии, которое происходит, когда электрон присоединяется к газообразному атому. Сродство к электрону можно дополнительно определить как изменение энтальпии в результате присоединения электрона к газообразному атому.- \]
Труднее найти тенденции, описывающие сродство к электрону. Как правило, элементы в правой части таблицы Менделеева имеют большое отрицательное сродство к электрону. Сродство к электрону станет менее отрицательным по мере продвижения от вершины к основанию периодической таблицы. Однако азот, кислород и фтор не следуют этой тенденции. Электронная конфигурация благородных газов будет близка к нулю, потому что они не будут легко получать электроны.
Рисунок 8: Предоставлено Джессикой Торнтон (UCD)
Электроотрицательность
Электроотрицательность – это измерение атома, который борется за электроны в связи.Чем выше электроотрицательность, тем выше его способность приобретать электроны в связи. Электроотрицательность будет важна, когда мы позже определим полярные и неполярные молекулы. Электроотрицательность связана с энергией ионизации и сродством к электрону. Электроны с низкими энергиями ионизации обладают низкой электроотрицательностью, поскольку их ядра не оказывают сильного притяжения на электроны. Элементы с высокой энергией ионизации обладают высокой электроотрицательностью из-за сильного притяжения, оказываемого положительным ядром на отрицательные электроны.Следовательно, электроотрицательность увеличивается снизу вверх и слева направо.
Рисунок 9: Предоставлено Джессией Торнтон (UCD)Металлический персонаж
Металлический знак используется для определения химических свойств металлических элементов. Как правило, металлы склонны терять электроны с образованием катионов. Неметаллы стремятся получить электроны с образованием анионов. Они также обладают высоким окислительным потенциалом, поэтому легко окисляются и являются сильными восстановителями. Металлы также образуют основные оксиды; чем более щелочной является оксид, тем выше металлический характер.
Рисунок 10: Предоставлено Джессикой Торнтон (UCD)По мере того, как вы перемещаетесь по таблице слева направо, металлический характер уменьшается, потому что элементы легко принимают электроны для заполнения своих оболочек. Следовательно, эти элементы принимают неметаллический характер образования анионов. По мере продвижения вверх по таблице металлический характер уменьшается из-за того, что ядро сильнее притягивает внешние электроны. Это большее притяжение затрудняет потерю электронов атомами и образование катионов.
Другие тенденции
Точки плавления: Тенденции изменения температуры плавления и молекулярной массы бинарных углерод-галогеновых соединений и галогенидов водорода обусловлены межмолекулярными силами. Плавление разрушает расположение атомов в твердом теле, поэтому количество тепла, необходимое для плавления, зависит от силы притяжения между атомами. Эта сила притяжения увеличивается с увеличением количества электронов. Увеличение количества электронов увеличивает связь.
Пример: Точка плавления HF должна составлять приблизительно -145 ° C, исходя из точек плавления HCl, HBr и HI, но наблюдаемое значение составляет -83.6 ° С.
Показатели теплопроводности и электропроводности регулярно меняются в течение периода. Точки плавления могут постепенно увеличиваться или достигать пика внутри группы, а затем в обратном направлении.
Пример: элементы третьего периода Na, Mg и Al являются хорошими проводниками тепла и электричества, тогда как Si – только хороший проводник, а неметаллы P, S, Cl и Ar – плохие проводники.
Редокс-потенциалы
Окислительный потенциал
Окисление – это реакция, которая приводит к потере электрона.- \]
Используется для изучения периодических свойств элементов
- Предсказание большего или меньшего атомного размера и радиального распределения в нейтральных атомах и ионах
- Измерение и сравнение энергий ионизации
- Сравнение сродства к электрону и электроотрицательности
- Прогнозирование окислительно-восстановительного потенциала
- Сравнение металлического характера с другими элементами; его способность образовывать катионы
- Предсказание того, какая реакция может произойти или не произойти из-за тенденций
- Определение большего потенциала клеток (суммы окислительного и восстановительного потенциалов) между реакциями
- Завершение химических реакций в соответствии с тенденциями
Сводка периодических тенденций
В Периодической таблице элементов схожие элементы классифицируются вместе.Дмитрий Менделеев, русский ученый, был первым, кто создал общепринятое расположение элементов в 1869 году. Менделеев полагал, что, когда элементы расположены в порядке увеличения атомной массы, определенные наборы свойств периодически повторяются. Хотя большинство современных периодических таблиц организовано в восемнадцать групп (столбцов) элементов, в первоначальной периодической таблице Менделеева элементы были организованы в восемь групп и двенадцать периодов (строк).
Рисунок 11: Предоставлено Википедией для публикации этого изображения в общественном достоянииВ периодической таблице элементы, имеющие похожие свойства, находятся в одних и тех же группах (по вертикали).Слева направо атомный номер (z) элементов увеличивается от одного периода к следующему (по горизонтали). Группы пронумерованы вверху каждого столбца, а точки слева рядом с каждой строкой. Основными элементами группы являются группы 1, 2 и 13–18. Эти группы содержат элементы, наиболее богатые естественным образом, и являются наиболее важными для жизни. Элементы, заштрихованные в приведенной выше таблице светло-розовым цветом, известны как переходные металлы. Два ряда элементов, начинающихся с z = 58, иногда называют внутренними переходными металлами, и они были извлечены и помещены в нижнюю часть таблицы, потому что они сделали бы таблицу слишком широкой, если бы она оставалась непрерывной.14 элементов, следующих за лантаном (z = 57), называются лантаноидами, а следующие 14 элементов, следующие за актинием (z = 89), называются актинидами.
Элементы периодической таблицы можно разделить на две большие категории: металлы и неметаллы. Большинство металлов являются хорошими проводниками тепла и электричества, пластичны и пластичны, а их температура плавления составляет от умеренной до высокой. В общем, неметаллы не являются проводниками тепла и электричества, представляют собой нелегкие твердые вещества, а многие из них являются газами при комнатной температуре. Как показано в таблице выше, металлы и неметаллы в периодической таблице часто разделяются ступенчатой диагональной линией, а несколько элементов рядом с этой линией часто называют металлоидами (Si, Ge, As, Sb, Te и At).Металлоиды – это элементы, которые выглядят как металлы и в некотором смысле ведут себя как металлы, но также обладают некоторыми неметаллическими свойствами. Группа в самом дальнем правом углу таблицы, заштрихованная оранжевым цветом, известна как благородные газы. Благородные газы рассматриваются как особая группа неметаллов.
Щелочные металлы / Щелочноземельные металлы
Щелочные металлы входят в группу 1 периодической таблицы и состоят из лития, натрия, рубидия, цезия и франция. Эти металлы обладают высокой реакционной способностью и образуют ионные соединения (когда неметалл и металл объединяются), а также многие другие соединения.Все щелочные металлы имеют заряд +1 и самые большие размеры атомов, чем любые другие элементы, в каждый из своих периодов.
Щелочноземельные металлы относятся к группе 2 и состоят из бериллия, магния, кальция, стронция, бария и радия. В отличие от щелочных металлов, земные металлы имеют меньший размер атома и не обладают такой реакционной способностью. Эти металлы также могут образовывать ионные и другие соединения и иметь заряд +2.
Переходные металлы
Переходные металлы варьируются от групп IIIB до XIIB в периодической таблице.Эти металлы образуют положительно заряженные ионы, очень твердые и имеют очень высокие температуры плавления и кипения. Переходные металлы также являются хорошими проводниками электричества и пластичны.
Лантаноиды и актиниды
Лантаноиды (показаны в строке ** на диаграмме выше) и актиниды (показаны в строке * на диаграмме выше) образуют блок из двух строк, которые помещены внизу периодической таблицы для проблем с пространством. Они также считаются переходными металлами. Лантаноиды составляют верхний ряд этого блока и представляют собой очень мягкие металлы с высокими температурами кипения и плавления.Актиниды образуют нижний ряд и являются радиоактивными. Они также образуют соединения с большинством неметаллов. Чтобы узнать, почему у этих элементов есть отдельный раздел, посетите страницу электронных конфигураций.
Металлоиды
Как упоминалось во введении, металлоиды расположены вдоль лестницы, отделяющей металлы от неметаллов в периодической таблице. Бор, кремний, германий, мышьяк, сурьма и теллур обладают металлическими и неметаллическими свойствами. Например, кремний имеет металлический блеск, но является хрупким и неэффективным проводником электричества, как неметалл.Поскольку металлоиды обладают сочетанием металлических и неметаллических характеристик, они являются промежуточными проводниками электричества или «полупроводниками».
Галогены
Галогены состоят из пяти неметаллических элементов: фтора, хлора, брома, йода и астата. Они расположены в 17-й группе периодической таблицы и имеют заряд -1. Термин «галоген» означает «солеобразователь», а соединения, содержащие один из галогенов, являются солями. Физические свойства галогенов значительно различаются, поскольку они могут существовать в виде твердых тел, жидкостей и газов при комнатной температуре.Однако в целом галогены очень реакционноспособны, особенно со щелочными и земельными металлами 1 и 2 групп, с которыми они образуют ионные соединения.
Благородные газы
Благородные газы состоят из группы 18 (иногда называемой группой O) периодической таблицы элементов. Благородные газы имеют очень низкие температуры кипения и плавления и являются газами при комнатной температуре. Они также очень инертны, так как у них уже есть полная валентная оболочка с 8 электронами. Следовательно, благородные газы имеют небольшую тенденцию терять или приобретать электроны.
Полезные связи из периодической таблицы
Периодическая таблица элементов полезна для определения зарядов простых одноатомных ионов. Элементы основной группы, отнесенные к группам 1, 2 и 13-18, образуют ионы, они теряют то же количество электронов, что и соответствующий номер группы, в которую они попадают. Например, атомы K (группа 1) теряют один электрон, чтобы стать K + , а атомы Mg (группа 2) теряют два электрона, чтобы сформировать Mg 2 + .Другие элементы основной группы, входящие в группу 13 и выше, образуют более одного возможного иона.
Элементы в группах 3–12 называются переходными элементами или переходными металлами. Подобно элементам основной группы, описанным выше, переходные металлы образуют положительные ионы, но из-за их способности образовывать более двух или более ионов разного заряда связь между номером группы и зарядом отсутствует.
Проблемы
1. Расположите эти элементы в соответствии с уменьшающимся размером атома: Na, C, Sr, Cu, Fr
2.Расположите эти элементы в соответствии с возрастающим отрицательным значением E. A .: Ba, F, Si, Ca, O
3. Расположите эти элементы в соответствии с возрастающим металлическим характером: Li, S, Ag, Cs, Ge
4. Какая реакция, по вашему мнению, будет иметь больший клеточный потенциал?
A) 2Na (тв) + Cl2 (г) → 2NaCl (т) или 2Cs (т) + Cl2 (г) → 2RbCl (т)
B) 2Na (т.) + Cl2 (г) → 2NaCl (т) или Be (т) + Cl2 (г) → BeCl2 (т)
5. Какое уравнение вы ожидаете увидеть?
А) I2 (т) + 2Br (водн.) → Br2 (л) + 2I (водн.)
B) Cl2 (г) + 2I (водн.) → I2 (т.) + 2Cl (водн.)
ответов
1.Fr, Sr, Cu, Na, C
2. Ba, Ca, Si, O, F
3. Li, S, Ge, Ag, Cs
4. A) Второе уравнение
B) Первое уравнение
5. A) Да
Б) №
Внешние ссылки
- История Периодической таблицы – Часть 1 из 2
- Группы Периодической таблицы
Периодические тенденции
Проблемы
* Выделите ответ: _____, чтобы просмотреть ответы.
1. Элемент, который является примером металлоида, представляет собой (а) S; (б) Zn; (c) Ge; d) Re; (e) ни один из этих
Ответ: (c) Ge
2. В периодической таблице вертикальные (верхние и нижние) столбцы называются (а) периодами; (б) переходы; (c) семьи / группы; (г) металлоиды; (e) ничего из этого.
Ответ: (c) семьи / группы
3. Почему благородные газы инертны (инертны)?
Ответ: Благородные газы инертны, потому что они уже имеют полную валентную электронную оболочку и имеют небольшую тенденцию к получению или потере электронов.
4. Как называются соединения, содержащие галоген?
Ответ: Соли
5. Лантаноиды и актиниды: (а) щелочноземельные металлы; (б) переходные металлы; (в) металлоиды; (г) щелочные металлы; (e) ни один из этих
Ответ: (б) переходные металлы
Список литературы
- Хлопок, F.A .; Уилкинсон, Г. (1988). Продвинутая неорганическая химия (5-е издание). Нью-Йорк: Вили. ISBN 0-471-84997 стр. 1385.
- Хатчинсон, Джон.«Журнал химического образования». Исследования развития концепции в химии (2007). Распечатать. Внешние ссылки
- Веселый, Уильям Л. (1991). Современная неорганическая химия (2-е изд.). Нью-Йорк: Макгроу-Хилл. ISBN 0-07-112651-1.
- Петруччи, Ральф Х. Общая химия. 9 изд. Нью-Джерси: Пирсон Прентис Холл, 2005.
1.1: Периодическая таблица – Chemistry LibreTexts
Атомный вес
Атомы, конечно, слишком малы для непосредственного взвешивания; Весовые измерения могут быть сделаны только на массивном (но неизвестном) количестве атомов, наблюдаемых в химических реакциях.Ранние эксперименты Дальтона и других с комбинированным весом установили, что водород является самым легким из атомов, но грубый характер измерений и неточности в формулах многих соединений затрудняли разработку надежной шкалы относительных весов атомов. Даже самые точные измерения веса, которые мы можем провести сегодня, подвержены экспериментальным погрешностям, которые ограничивают точность в лучшем случае четырьмя значащими цифрами.
Таблица Менделеева
Элементы расположены в периодической таблице, которая, вероятно, является самым важным учебным пособием по химии.Он суммирует огромное количество информации об элементах таким образом, чтобы облегчить предсказание многих их свойств и химических реакций. Элементы расположены в семь горизонтальных рядов в порядке возрастания атомного номера слева направо и сверху вниз. Строки называются периодами, и они пронумерованы от 1 до 7. Элементы сгруппированы таким образом, что элементы с аналогичными химическими свойствами образуют вертикальные столбцы, называемые группами, пронумерованными от 1 до 18 (в более старых периодических таблицах используется система, основанная на римские цифры).Группы 1, 2 и 13–18 являются основными элементами группы, обозначенными буквой A в старых таблицах. Группы 3–12 находятся в середине периодической таблицы и являются переходными элементами, обозначенными буквой B в старых таблицах. Два ряда по 14 элементов внизу периодической таблицы – это лантаноиды и актиниды, позиции которых в периодической таблице указаны в группе 3.
Атомные орбитали
Орбиталь – это квантово-механическое уточнение орбиты Бора. В отличие от его концепции простой круговой орбиты с фиксированным радиусом, орбитали – это математически полученные области пространства с различными вероятностями наличия электрона.
Один из способов представления распределения вероятностей электронов был проиллюстрирован на рисунке 6.5.2 для 1 s орбитали водорода. Поскольку Ψ 2 дает вероятность нахождения электрона в заданном объеме пространства (таком как кубический пикометр), график зависимости Ψ 2 от расстояния от ядра ( r ) представляет собой график вероятности плотность . Орбиталь 1 s сферически симметрична, поэтому вероятность нахождения электрона 1 s в любой заданной точке зависит только от его расстояния от ядра.Плотность вероятности максимальна при r = 0 (в ядре) и неуклонно уменьшается с увеличением расстояния. При очень больших значениях r плотность вероятности электронов очень мала, но не равна нулю .
Напротив, мы можем вычислить радиальную вероятность (вероятность нахождения 1 электрона на расстоянии r от ядра), сложив вместе вероятности нахождения электрона во всех точках ряда x сферические оболочки радиуса r 1 , r 2 , r 3 ,…, r x – 1 , r x .Фактически, мы разделяем атом на очень тонкие концентрические оболочки, очень похожие на слои луковицы (часть (а) на рисунке 6.6.1), и вычисляем вероятность нахождения электрона на каждой сферической оболочке. Напомним, что плотность вероятности электронов максимальна при r = 0 (часть (b) на рисунке 6.6.1), поэтому плотность точек наибольшая для самых маленьких сферических оболочек в части (a) на рисунке 6.6.1. Напротив, площадь поверхности каждой сферической оболочки равна 4π r 2 , которая очень быстро увеличивается с увеличением r (часть (c) на рисунке 6.6.1). Поскольку площадь поверхности сферических оболочек увеличивается с увеличением r быстрее, чем уменьшается плотность вероятности электронов, график радиальной вероятности имеет максимум на определенном расстоянии (часть (d) на рисунке 6.6.1). Наиболее важно то, что когда r очень мало, площадь поверхности сферической оболочки настолько мала, что общая вероятность найти электрон близко к ядру очень мала; в ядре вероятность электрона равна нулю (часть (d) на рисунке 6.6.1).
Рисунок 6.6.1 Наиболее вероятный радиус электрона в основном состоянии атома водорода. (а) Представьте, что общий объем атома разделен на очень тонкие концентрические оболочки, как показано на луковичном рисунке. (б) График зависимости плотности вероятности электронов Ψ 2 от r показывает, что плотность вероятности электронов максимальна при r = 0 и плавно спадает с увеличением r . Таким образом, плотность точек наибольшая в самых внутренних оболочках луковицы.(c) Площадь поверхности каждой оболочки, задаваемая соотношением 4π r 2 , быстро увеличивается с увеличением r . (d) Если мы посчитаем количество точек в каждой сферической оболочке, мы получим полную вероятность нахождения электрона при заданном значении r . Поскольку площадь поверхности каждой оболочки увеличивается быстрее с увеличением r , чем уменьшается плотность вероятности электронов, график зависимости вероятности электрона от r (радиальная вероятность ) показывает пик.Этот пик соответствует наиболее вероятному радиусу для электрона 52,9 пм, что в точности соответствует радиусу, предсказанному моделью атома водорода Бора.
Для атома водорода пик на графике радиальной вероятности приходится на r = 0,529 Å (52,9 пм), что в точности соответствует радиусу, рассчитанному Бором для орбиты n = 1. Таким образом, наиболее вероятный радиус , полученный из квантовой механики, идентичен радиусу, вычисленному классической механикой.В модели Бора, однако, предполагалось, что электрон находится на этом расстоянии 100% времени, тогда как в модели Шредингера он находится на этом расстоянии только часть времени. Разница между двумя моделями объясняется волнообразным поведением электрона и принципом неопределенности Гейзенберга.
На рисунке 6.6.2 сравниваются плотности вероятности электронов для водорода 1 с , 2 с и 3 с орбиталей. Обратите внимание, что все три сферически симметричны.Однако для орбиталей 2 s и 3 s (а также для всех остальных орбиталей s ) плотность вероятности электронов не спадает плавно с увеличением r . Вместо этого на графиках радиальной вероятности наблюдаются серии минимумов и максимумов (часть (c) на рисунке 6.6.2). Минимумы соответствуют сферическим узлам (областям с нулевой вероятностью электронов), которые чередуются со сферическими областями с ненулевой вероятностью электронов.
Рисунок 6.6.2 : Плотности вероятностей для 1 с , 2 с и 3 с орбиталей атома водорода. (а) Показана плотность вероятности электрона в любой плоскости, содержащей ядро. Обратите внимание на наличие круговых областей или узлов, где плотность вероятности равна нулю. (b) Контурные поверхности содержат 90% вероятности электрона, что иллюстрирует различные размеры орбиталей 1 s , 2 s и 3 s орбиталей. Чертежи в разрезе дают частичные виды внутренних сферических узлов.Оранжевый цвет соответствует областям пространства, где фаза волновой функции положительна, а синий цвет соответствует областям пространства, где фаза волновой функции отрицательна. (c) На этих графиках вероятности электрона как функции расстояния от ядра ( r ) во всех направлениях (радиальная вероятность) наиболее вероятный радиус увеличивается по мере увеличения n , но 2 s и 3 Орбитали s имеют области значительной электронной вероятности при малых значениях r .
с ОрбиталиПо мере увеличения n с с орбиталями происходят три вещи (рисунок 6.6.2):
- Они увеличиваются в размерах, удаляясь дальше от ядра.
- Они содержат больше узлов. Это похоже на стоячую волну, у которой есть области значительной амплитуды, разделенные узлами, точками с нулевой амплитудой.
- Для данного атома орбитали s также становятся выше по энергии по мере увеличения n из-за их увеличенного расстояния от ядра.
Орбитали обычно изображаются как трехмерные поверхности, которые включают 90% электронной плотности, как было показано для водорода 1 s , 2 s и 3 s орбитали частично (b) на рисунке 6.6. .2. Хотя такие рисунки показывают относительные размеры орбиталей, они обычно не показывают сферические узлы на орбиталях 2 s и 3 s , потому что сферические узлы лежат внутри 90% поверхности. К счастью, положение сферических узлов не имеет значения для химической связи.
p ОрбиталиТолько с. орбитали сферически симметричны. По мере увеличения значения -1 количество орбиталей в данной подоболочке увеличивается, и формы орбиталей становятся более сложными. Поскольку подоболочка 2 p имеет l = 1, с тремя значениями m l (-1, 0 и +1), существует три орбитали 2 p .
Рисунок 6.6.3: Распределение вероятностей электронов для водорода 2 p Орбиталь. Узловая плоскость с нулевой электронной плотностью разделяет два лепестка орбитали 2 p . Как и на рисунке 6.6.2, цвета соответствуют областям пространства, где фаза волновой функции положительная (оранжевый) и отрицательная (синий).
Распределение вероятностей электронов для одной из орбиталей водорода 2 p показано на рисунке 6.6.3. Поскольку эта орбиталь имеет два лепестка электронной плотности, расположенных вдоль оси z , с нулевой электронной плотностью в плоскости xy (т.е.е., плоскость xy является узловой плоскостью), это орбитальная плоскость 2 p z . Как показано на рисунке 6.6.4, две другие орбитали 2 p имеют идентичную форму, но они расположены вдоль оси x (2 p x ) и оси y (2 p y ) соответственно. Обратите внимание, что каждая орбиталь p имеет только одну узловую плоскость. В каждом случае фаза волновой функции для каждой из 2 орбиталей p положительна для лепестка, который указывает вдоль положительной оси, и отрицательна для лепестка, который указывает вдоль отрицательной оси.Важно подчеркнуть, что эти знаки соответствуют фазе , волны, описывающей движение электрона, , а не положительным или отрицательным зарядам.
Рисунок 6.6.4 Три эквивалента 2 p Орбитали атома водорода
Показанные поверхности содержат 90% полной вероятности электрона для орбиталей 2 p x , 2 p y и 2 p z орбиталей.Каждая орбиталь ориентирована вдоль оси, обозначенной нижним индексом, а узловая плоскость, которая перпендикулярна этой оси, делит пополам каждую 2 p орбитали. Фаза волновой функции положительна (оранжевая) в области пространства, где x , y или z положительны и отрицательны (синий), где x , y или z равно отрицательный.
Как и в случае орбиталей s , размер и сложность орбиталей p для любого атома увеличивается по мере увеличения главного квантового числа n .Однако формы поверхностей с вероятностью 90% для орбиталей 3 p , 4 p и p с более высокой энергией по существу такие же, как те, что показаны на рис. 6.6.4.
Число валентных электронов
Число валентных электронов элемента может быть определено группой периодической таблицы (вертикальный столбец), в которой этот элемент отнесен к категории. За исключением групп 3–12 (переходные металлы), цифра единиц номера группы указывает, сколько валентных электронов связано с нейтральным атомом элемента, указанного в этом конкретном столбце.
Периодическая таблица химических элементов
* Общий метод подсчета валентных электронов обычно не подходит для переходных металлов. Вместо этого используется модифицированный метод счета d-электронов.
** За исключением гелия, который имеет только два валентных электрона.
Краткая история периодической таблицы
Периодическая таблица элементов часто встречается в классах, коридорах кампуса и библиотеках, но это больше, чем табличная организация чистых веществ.Ученые могут использовать эту таблицу для анализа реакционной способности элементов, прогнозирования химических реакций, понимания тенденций изменения периодических свойств различных элементов и размышлений о свойствах тех, которые еще предстоит открыть.
В современной таблице Менделеева элементы упорядочены по их атомным номерам и периодическим свойствам. Несколько ученых работали более века, чтобы собрать элементы в этот формат.
Викимедиа
Среди ученых, которые работали над созданием таблицы элементов, были Антуан Лавуазье, Иоганн Вольфанг Доберейнер, Джон Ньюлендс и Генри Мозли (слева направо).
В 1789 году французский химик Антуан Лавуазье попытался сгруппировать элементы как металлы и неметаллы. Сорок лет спустя немецкий физик Иоганн Вольфанг Дёберейнер обнаружил сходство физических и химических свойств некоторых элементов. Он расположил их в группы по три в порядке возрастания атомного веса и назвал их триадами, заметив, что некоторые свойства среднего элемента, такие как атомный вес и плотность, приблизительно соответствуют среднему значению этих свойств в двух других в каждой триаде.
Прорыв произошел с публикацией пересмотренного списка элементов и их атомных масс на первой международной конференции по химии в Карлсруэ, Германия, в 1860 году. Они пришли к выводу, что водороду будет присвоен атомный вес 1, а атомный вес другого элементы будут определены путем сравнения с водородом. Например, углерод, который в 12 раз тяжелее водорода, имел бы атомную массу 12,
.Дмитрий Менделеев
Лотар Мейер
Британский химик Джон Ньюлендс первым организовал элементы в периодическую таблицу с порядком возрастания атомных масс.Он обнаружил, что каждые восемь элементов обладают схожими свойствами, и назвал это законом октав. Он расположил элементы в восьми группах, но не оставил пробелов для неоткрытых элементов.
В 1869 году русский химик Дмитрий Менделеев создал структуру, которая стала современной периодической таблицей, оставив пробелы для элементов, которые еще не были обнаружены. Располагая элементы в соответствии с их атомным весом, если он обнаруживал, что они не вписываются в группу, он переставлял их. Менделеев предсказал свойства некоторых неоткрытых элементов и дал им такие названия, как «эка-алюминий» для элемента со свойствами, подобными алюминию.Позже эка-алюминий был открыт как галлий. Некоторые несоответствия остались; положение некоторых элементов, таких как йод и теллур, не могло быть объяснено.
Немецкий химик Лотар Мейер создал версию таблицы Менделеева, аналогичную таблице Менделеева, в 1870 году. Он оставил пробелы для неоткрытых элементов, но так и не предсказал их свойства. Лондонское королевское общество наградило медалью Дэви в 1882 году Менделееву и Мейеру. Позднее открытие элементов, предсказанных Менделеевым, включая галлий (1875), скандий (1879) и германий (1886), подтвердило его предсказания, и его периодическая таблица получила всеобщее признание.В 1955 году в его честь 101-й элемент был назван менделевием.
Викимедиа
Периодическая таблица Менделеева 1869 года на русском языке с названием, которое переводится как «Эксперимент над системой элементов … на основе их атомного веса и химического сходства». .
Понятия субатомных частиц не существовало в 19, и годах. В 1913 году английский физик Генри Мозли использовал рентгеновские лучи для измерения длин волн элементов и сопоставил эти измерения с их атомными номерами.Затем он переставил элементы в периодической таблице на основе атомных номеров. Это помогло объяснить различия в более ранних версиях, в которых использовались атомные массы.
В периодической таблице горизонтальные ряды называются периодами, причем металлы находятся в крайнем левом углу, а неметаллы – в правом. Вертикальные столбцы, называемые группами, состоят из элементов со схожими химическими свойствами. Таблица Менделеева предоставляет информацию об атомной структуре элементов и химическом сходстве или различии между ними.Ученые используют стол для изучения химических веществ и разработки экспериментов. Он используется для разработки химикатов, используемых в фармацевтической и косметической промышленности, и батарей, используемых в технологических устройствах.
ЮНЕСКО объявила 2019 год Международным годом Периодической таблицы Менделеева в ознаменование 150 годовщины годовщины публикации Менделеева. Исследователи и учителя со всего мира воспользовались этой возможностью, чтобы задуматься о важности периодической таблицы Менделеева и распространить информацию о ней в классах и за ее пределами.Семинары и конференции побуждали людей использовать знания периодической таблицы для решения проблем в области здравоохранения, технологий, сельского хозяйства, окружающей среды и образования.

