Расширенная периодическая таблица элементов | это… Что такое Расширенная периодическая таблица элементов?
| Проверить информацию. Необходимо проверить точность фактов и достоверность сведений, изложенных в этой статье. |
Расширенная периодическая таблица элементов была предложена Гленом Сиборгом в 1969 году. Она явилась логическим продолжением принципов стандартной периодической таблицы, также призвана включить возможные необнаруженные химические элементы.
Все необнаруженные элементы названы Международным союзом чистой и прикладной химии (ИЮПАК) по стандарту образования кодового наименования, существующего до тех пор, пока не будет открыт соответствующий элемент, подтверждён, и официальное название не будет утверждено.
Голубой символ в заголовке каждой колонки показывает размещение каждого элемента в каждом блоке в периодической таблице. Однако, он не всегда показывает количество электронов на орбитали (например, меди).
Красный номер с левой стороны каждой строки показывает период.
Гелий помещён после водорода потому, что является частью группы s2.
| № | s1 | s2 | ||||||||||||||||||||||||||||||||||||||||||||||||
| 1 | 1 H | 2 He | p1 | p2 | p3 | p4 | p5 | p6 | ||||||||||||||||||||||||||||||||||||||||||
| 2 | 3 Li | 4 Be | 5 | 6 C | 7 N | 8 O | 9 F | 10 Ne | ||||||||||||||||||||||||||||||||||||||||||
| 3 | 11 Na | 12 Mg | d1 | d2 | d3 | d4 | d5 | d6 | d7 | d8 | d9 | d10 | 13 Al | 14 Si | 15 P | 16 S | 17 Cl | 18 Ar | ||||||||||||||||||||||||||||||||
| 4 | 19 K | 20 Ca | 21 Sc | 22 Ti | V | 24 Cr | 25 Mn | 26 Fe | 27 Co | 28 Ni | 29 Cu | 30 Zn | 31 Ga | 32 Ge | 33 As | 34 Se | 35 Br | 36 Kr | ||||||||||||||||||||||||||||||||
| 5 | 37 Rb | 38 Sr | f1 | f2 | f3 | f4 | f5 | f6 | f7 | f8 | f9 | f10 | f11 | f | f13 | f14 | 39 Y | 40 Zr | 41 Nb | 42 Mo | 43 Tc | 44 Ru | 45 Rh | 46 Pd | 47 Ag | 48 Cd | 49 In | 50 Sn | 51 Sb | 52 Te | 53 I | 54 Xe | ||||||||||||||||||
| 6 | 55 Cs | 56 Ba | 57 La | 58 Ce | 59 Pr | 60 Nd | 61 Pm | 62 Sm | 63 Eu | 64 Gd | 65 Tb | 66 Dy | 67 Ho | 68 Er | 69 | 70 Yb | 71 Lu | 72 Hf | 73 Ta | 74 W | 75 Re | 76 Os | 77 Ir | 78 Pt | 79 Au | 80 Hg | 81 Tl | 82 Pb | 83 Bi | 84 Po | 85 At | 86 Rn | ||||||||||||||||||
| 7 | 87 Fr | 88 Ra | g1 | g2 | g3 | g4 | g5 | g6 | g7 | g8 | g9 | g10 | g11 | g12 | g13 | g14 | g15 | g16 | g17 | g18 | 89 Ac | 90 Th | 91 Pa | 92 U | 93 Np | 94 Pu | 95 Am | 96 Cm | 97 Bk | 98 Cf | 99 Es | 100 Fm | 101 Md | 102 No | 103 Lr | 104 Rf | 105 Db | 106 Sg | 107 Bh | 108 Hs | 109 Mt | 110 Ds | 111 Rg | 112 Cn | 113 Uut | 114 Fl | 115 Uup | 116 | 117 Uus | 118 Uuo |
| 8 | 119 Uue | 120 Ubn | 121 Ubu | 122 Ubb | 123 Ubt | 124 Ubq | 125 Ubp | 126 Ubh | 127 Ubs | 128 Ubo | 129 Ube | 130 Utn | 131 Utu | 132 Utb | 133 Utt | 134 Utq | 135 Utp | 136 Uth | 137 Uts | 138 Uto | 139 Ute | 140 Uqn | 141 Uqu | 142 Uqb | 143 Uqt | 144 Uqq | 145 Uqp | 146 Uqh | 147 Uqs | 148 Uqo | 149 | 150 Upn | 151 Upu | 152 Upb | 153 Upt | 154 Upq | 155 Upp | 156 Uph | 157 Ups | 158 Upo | 159 Upe | 160 Uhn | 161 Uhu | 162 Uhb | 163 Uht | 164 Uhq | 165 Uhp | 166 Uhh | 167 Uhs | 168 Uho |
| 9 | 169 Uhe | 170 Usn | 171 Usu | 172 Usb | 173 Ust | 174 Usq | 175 Usp | 176 Ush | 177 Uss | 178 Uso | 179 Use | 180 Uon | 181 Uou | 182 Uob | 183 Uot | 184 Uoq | 185 Uop | 186 Uoh | 187 Uos | 188 Uoo | 189 Uoe | 190 Uen | 191 Ueu | 192 Ueb | 193 Uet | 194 Ueq | 195 Uep | 196 Ueh | 197 Ues | 198 Ueo | 199 Uee | 200 Bnn | 201 Bnu | 202 Bnb | 203 Bnt | 204 Bnq | 205 Bnp | 206 Bnh | 207 Bns | 208 Bno | 209 Bne | 210 Bun | 211 Buu | 212 Bub | 213 But | 214 Buq | 215 Bup | 216 Buh | 217 Bus | 218 Buo |
| s-блок | p-блок | d-блок | f-блок | g-блок |
- jeries.
 rihani.com — Расширенная периодическая таблица элементов.
rihani.com — Расширенная периодическая таблица элементов.
2046 – Страшный сон Менделеева
рейтинг: —
голосов: 0
Состояние SCP-2046 на момент описания. Аномальные составляющие скрыты во избежание меметического воздействия.
Объект №: SCP-2046
Класс объекта: Евклид
Особые условия содержания: SCP-2046 должен быть прикреплен к стене в безопасной герметичной камере содержания с воздушным шлюзом и радиационной защитой. Несколько других, неаномальных таблиц, идентичных SCP-2046 по размеру, должны быть прикреплены к стене рядом с ним. В любой момент времени необходимо наличие не менее 20 (двадцати) таблиц.
В камере также должен содержаться набор герметичных стеклянных емкостей, в каждой из которых находится образец одного из первых 92 элементов периодической системы химических элементов массой в 1 грамм1.
Каждые 24 часа сотрудник класса D в изолирующей экипировке для работы с опасными материалами класса A должен проводить обследование таблиц и их сравнение с несодержавшимся в камере образцом. Отвечающий за эту процедуру сотрудник должен быть совершенно некомпетентен в химии2 и подлежит обработке амнезиаком класса C после ее проведения. Таблицы, подвергшиеся видоизменению из-за воздействия SCP-2046 (далее – SCP-2046-1), следует изымать и заменять на новые. Изымаемые экземпляры SCP-2046-1 необходимо запечатывать в черный бумажный конверт, измельчать и сжигать. Аналогично, образцы химических элементов должны изыматься и заменяться ежемесячно.
Отвечающий за эту процедуру сотрудник должен быть совершенно некомпетентен в химии2 и подлежит обработке амнезиаком класса C после ее проведения. Таблицы, подвергшиеся видоизменению из-за воздействия SCP-2046 (далее – SCP-2046-1), следует изымать и заменять на новые. Изымаемые экземпляры SCP-2046-1 необходимо запечатывать в черный бумажный конверт, измельчать и сжигать. Аналогично, образцы химических элементов должны изыматься и заменяться ежемесячно.
В случае превышения внутри камеры содержания уровня радиоактивности в 2000 р/мин, воздух из камеры должен быть откачан, помещен в защищенные баллоны и утилизирован.
Все отходы, образовавшиеся в ходе проведения процедур содержания, должны быть направлены в один из принадлежащих Фонду режимных подземных центров по переработке радиоактивных отходов.
Описание: SCP-2046 представляет собой глянцевый лист бумаги размером 91×61 см и изображенную на нем таблицу периодической системы химических элементов (ПСХЭ). Находясь вне наблюдения, SCP-2046 саморасширяется путем добавления новых элементов и их групп в свою таблицу3. Добавленные таким образом элементы не соответствуют общепринятым законам химии и структуре построения периодической системы. На момент описания на SCP-2046 отображен 191 аномальный элемент, из них только ██ значатся в Расширенной ПСХЭ Фонда.
Находясь вне наблюдения, SCP-2046 саморасширяется путем добавления новых элементов и их групп в свою таблицу3. Добавленные таким образом элементы не соответствуют общепринятым законам химии и структуре построения периодической системы. На момент описания на SCP-2046 отображен 191 аномальный элемент, из них только ██ значатся в Расширенной ПСХЭ Фонда.
SCP-2046 оказывает меметическое воздействие на наблюдателей. Примерно в 80% случаев это проявляется в убежденности подопытных в корректности изображенной на SCP-2046 таблицы и их явном замешательстве при демонстрации стандартной ПСХЭ. В остальных 20% случаев испытуемый отмечает, что в таблице есть что-то лишнее, но не может указать что именно, даже имея возможность сравнить SCP-2046 со стандартной таблицей. Введение амнезиаков класса C нейтрализует (по крайней мере, частично) действие этого эффекта4.
Кроме этого SCP-2046 внедряет атомы своих аномальных химических элементов в окружающую среду путем преобразования ее случайных атомов. Большинство аномальных элементов не может существовать в нашей вселенной и мгновенно распадается на элементарные частицы, вызывая постепенно усиливающееся радиоактивное излучение. Люди, подвергающиеся этому воздействию, начинают испытывать ощущения, схожие с симптомами отравления тяжелыми металлами, лучевой болезни и [ДАННЫЕ УДАЛЕНЫ]. Точная скорость преобразования элементов пока не определена, но установлено, что до постановки на содержание SCP-2046 размещался на стене лекционной аудитории в [УДАЛЕНО] (штат Джорджия) в течение по крайней мере месяца, прежде чем были зафиксированы первые случаи поражения учащихся.
Большинство аномальных элементов не может существовать в нашей вселенной и мгновенно распадается на элементарные частицы, вызывая постепенно усиливающееся радиоактивное излучение. Люди, подвергающиеся этому воздействию, начинают испытывать ощущения, схожие с симптомами отравления тяжелыми металлами, лучевой болезни и [ДАННЫЕ УДАЛЕНЫ]. Точная скорость преобразования элементов пока не определена, но установлено, что до постановки на содержание SCP-2046 размещался на стене лекционной аудитории в [УДАЛЕНО] (штат Джорджия) в течение по крайней мере месяца, прежде чем были зафиксированы первые случаи поражения учащихся.
Объекты SCP-2046-1 – это другие таблицы ПСХЭ, подвергшиеся воздействию SCP-2046. Таблицы, оставленные без наблюдения вблизи SCP-2046, самопроизвольно видоизменяются в изображенную на SCP-2046 таблицу. Хотя SCP-2046-1 не обладают свойством преобразования атомов, они всё же представляют собой меметическую угрозу и должны содержаться в соответствии с описанными выше условиями.
Условия содержания удалось разработать под руководством д-ра ██████████ с применением [УДАЛЕНО]. Вызываемые SCP-2046 эффекты были подавлены путем его размещения вблизи с изображениями стандартной таблицы ПСХЭ и образцами химических элементов. Со времени проведения этих процедур возникновения новых элементов в таблице отмечено не было, а уровень радиации в камере содержания повысился только до [УДАЛЕНО].
Приложение: Сотрудники старшего исследовательского персонала выдвинули гипотезу, что образование и распространение стабильных аномальных химических элементов может нарушить законы физики и, в конечном счете, привести к событию реструктуризации реальности класса CK. В связи с этим все эксперименты, связанные с аномальными элементами, запрещены до особого распоряжения O5.
« SCP-2045 | SCP-2046 | SCP-2047 »
Сноски
1. Исключение может быть сделано для крайне нестабильных элементов, таких как франций, астат и т.п.
2. Отсутствие среднего образования является достаточным условием для соответствия этой задаче.
3. Габариты SCP-2046 при этом не изменяются.
Таблица самостоятельно масштабируется до размера, позволяющего разместить все новые элементы на листе.
4. По всей видимости, эффективность процедуры обратно пропорциональна познаниям подопытного в химии. Все подвергнутые воздействию SCP-2046 сотрудники класса D, не имевшие высшего образования, до сих пор успешно избавлялись от указанного эффекта после однократной обработки амнезиаками. Подопытные, имевшие более высокий уровень образования, например, учащиеся [УДАЛЕНО], первыми подвергшиеся воздействию объекта, зачастую испытывают рецидивы, требующие многократных последующих обработок. Первого владельца SCP-2046, кандидата химических наук д-ра ███████, не удалось излечить после █ обработок, вследствие чего он был обработан амнезиаком класса B. Воздействие такого типа требует длительной реабилитации и, как правило, не рекомендуется.
14 в таблице менделеева. Периодическая система химических элементов
Свойства химических элементов позволяют объединять их в соответствующие группы. На этом принципе была создана периодическая система, изменившая представление о существующих веществах и позволившая предположить существование новых, ранее неизвестных элементов.
На этом принципе была создана периодическая система, изменившая представление о существующих веществах и позволившая предположить существование новых, ранее неизвестных элементов.
Вконтакте
Периодическая система Менделеева
Периодическая таблица химических элементов была составлена Д. И. Менделеевым во второй половине XIX века. Что такое это, и для чего она нужна? Она объединяет все химические элементы по возрастанию атомного веса, причем, все они расставлены так, что их свойства изменяются периодическим образом.
Периодическая система Менделеева в свела в единую систему все существующие элементы, прежде считавшиеся просто отдельными веществами.
На основании ее изучения были предсказаны, а впоследствии – синтезированы новые химические вещества. Значение этого открытия для науки невозможно переоценить , оно значительно опередило свое время и дало толчок к развитию химии на многие десятилетия.
Существует три наиболее распространенных варианта таблицы, которые условно именуются «короткая», «длинная» и «сверхдлинная».
Что такое период
Система содержит 7 периодов . Они представлены графически в виде горизонтальных строк. При этом, период может иметь одну или две строки, называемые рядами. Каждый последующий элемент отличается от предыдущего возрастанием заряда ядра (количества электронов) на единицу.
Если не усложнять, период – это горизонтальная строка периодической таблицы. Каждый из них начинается металлом и заканчивается инертным газом. Собственно, это и создает периодичность – свойства элементов изменяются внутри одного периода, вновь повторяясь в следующем. Первый, второй и третий периоды – неполные, они называются малыми и содержат соответственно 2, 8 и 8 элементов. Остальные – полные, они имеют по 18 элементов.
Что такое группа
Группа – это вертикальный столбец , содержащий элементы с одинаковым электронным строением или, говоря проще, с одинаковой высшей . Официально утвержденная длинная таблица содержит 18 групп, которые начинаются со щелочных металлов и заканчиваются инертными газами.
Официально утвержденная длинная таблица содержит 18 групп, которые начинаются со щелочных металлов и заканчиваются инертными газами.
Каждая группа имеет свое название, облегчающее поиск или классификацию элементов. Усиливаются металлические свойства в независимости от элемента по направлению сверху-вниз. Это связано с увеличением количества атомных орбит — чем их больше, тем слабее электронные связи, что делает более ярко выраженной кристаллическую решетку.
Металлы в периодической таблице
Металлы в таблице Менделеева имеют преобладающее количество, список их достаточно обширен. Они характеризуются общими признаками, по свойствам они неоднородны и делятся на группы. Некоторые из них имеют мало общего с металлами в физическом смысле, а иные могут существовать только доли секунды и в природе абсолютно не встречаются (по крайней мере, на планете ), поскольку созданы, точнее, вычислены и подтверждены в лабораторных условиях, искусственно. Каждая группа имеет собственные признаки , название и довольно заметно отличается от других.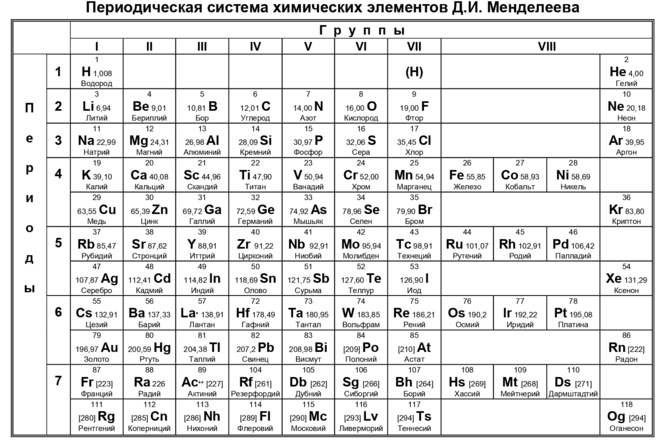 Особенно это различие выражено у первой группы.
Особенно это различие выражено у первой группы.
Положение металлов
Какого положение металлов в периодической системе? Элементы расположены по увеличению атомной массы или количества электронов и протонов. Их свойства изменяются периодически, поэтому аккуратного размещения по принципу «один к одному» в таблице нет. Как определить металлы, и возможно ли это сделать по таблице Менделеева? Для того, чтобы упростить вопрос, придуман специальный прием: условно по местам соединения элементов проводится диагональная линия от Бора до Полония (или до Астата). Те, что оказываются слева – металлы, справа – неметаллы. Это было бы очень просто и здорово, но есть исключения – Германий и Сурьма.
Такая «методика» – своего рода шпаргалка, она придумана лишь для упрощения процесса запоминания. Для более точного представления следует запомнить, что список неметаллов составляет всего 22 элемента, поэтому отвечая на вопрос, сколько всего металлов всего содержится в таблице Менделеева
На рисунке можно наглядно увидеть, какие элементы являются неметаллами и как они располагаются в таблице по группам и периодам.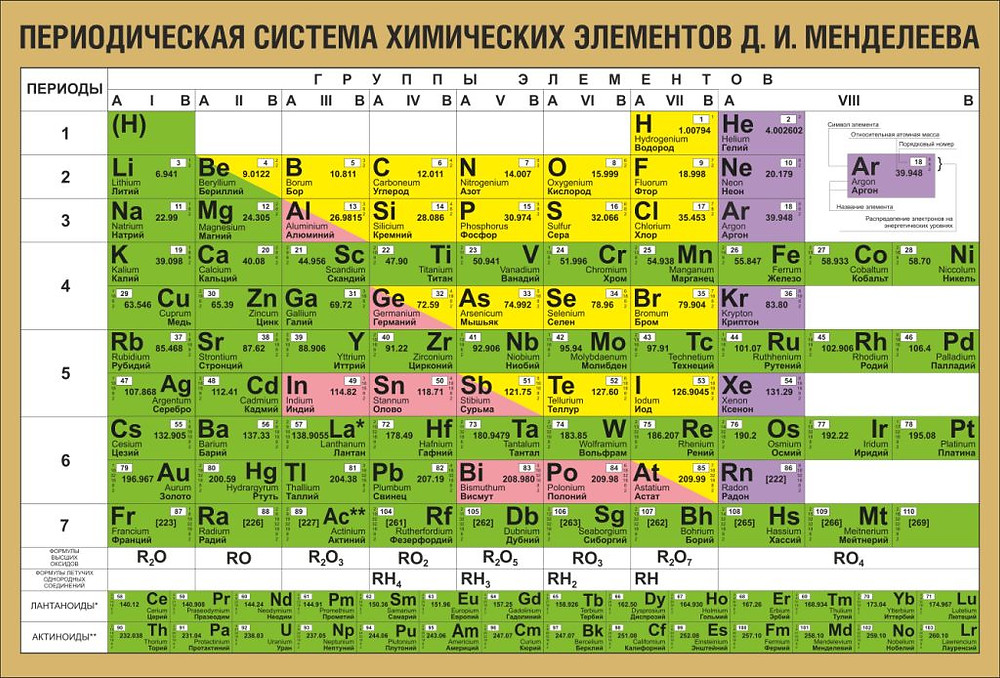
Общие физические свойства
Существуют общие физические свойства металлов. К ним относятся:
- Пластичность.
- Характерный блеск.
- Электропроводность.
- Высокая теплопроводность.
- Все, кроме ртути, находятся в твердом состоянии.
Следует понимать, что свойства металлов очень различаются относительно их химической или физической сути. Некоторые из них мало похожи на металлы в обыденном понимании этого термина. Например, ртуть занимает особенное положение. Она при обычных условиях находится в жидком состоянии, не имеет кристаллической решетки, наличию которой обязаны своими свойствами другие металлы. Свойства последних в этом случае условны, с ними ртуть роднят в большей степени химические характеристики.
Интересно! Элементы первой группы, щелочные металлы, в чистом виде не встречаются, находясь в составе различных соединений.
Самый мягкий металл, существующий в природе – цезий – относится к этой группе.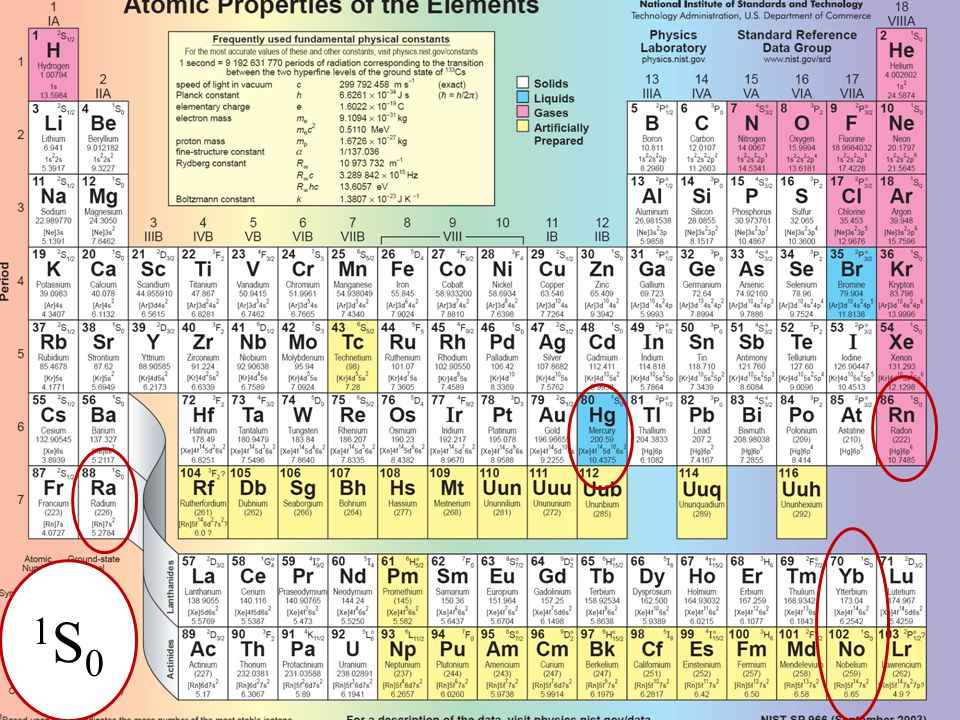 Он, как и другие щелочные подобные вещества, мало общего имеет с более типичными металлами. Некоторые источники утверждают, что на самом деле, самый мягкий металл калий, что сложно оспорить или подтвердить, поскольку ни тот, ни другой элемент не существует сам по себе — будучи выделенным в результате химической реакци они быстро окисляются или вступают в реакцию.
Он, как и другие щелочные подобные вещества, мало общего имеет с более типичными металлами. Некоторые источники утверждают, что на самом деле, самый мягкий металл калий, что сложно оспорить или подтвердить, поскольку ни тот, ни другой элемент не существует сам по себе — будучи выделенным в результате химической реакци они быстро окисляются или вступают в реакцию.
Вторая группа металлов – щелочноземельные – намного ближе к основным группам. Название «щелочноземельные» происходит из древних времен, когда окислы назывались «землями», поскольку они имеют рыхлую рассыпчатую структуру. Более-менее привычными (в обиходном смысле) свойствами обладают металлы начиная с 3 группы. С увеличением номера группы количество металлов убывает
115 элемент таблицы Менделеева – московий (moscovium) – сверхтяжелый синтетический элемент с символом Mc и атомным номером 115. Он был впервые получен в 2003 году совместной командой российских и американских ученых в Объединенном институте ядерных исследований (ОИЯИ) в Дубне, Россия. В декабре 2015 года признан одним из четырех новых элементов Объединенной рабочей группой международных научных организаций IUPAC/IUPAP. 28 ноября 2016 года он был официально назван в честь Московского региона, в котором находится ОИЯИ.
В декабре 2015 года признан одним из четырех новых элементов Объединенной рабочей группой международных научных организаций IUPAC/IUPAP. 28 ноября 2016 года он был официально назван в честь Московского региона, в котором находится ОИЯИ.
Характеристика
115 элемент таблицы Менделеева является чрезвычайно радиоактивным веществом: его наиболее стабильный известный изотоп, moscovium-290 имеет период полураспада всего 0,8 секунды. Ученые относят московий к непереходным металлам, по ряду характеристик схожим с висмутом. В периодической таблице относится к трансактинидным элементам p-блока 7-го периода и помещен в группу 15 как самый тяжелый пниктоген (элемент подгруппы азота), хотя и не подтверждено, что он ведет себя, как более тяжелый гомолог висмута.
Согласно расчетам, элемент обладает некоторыми свойствами, схожими с более легкими гомологами: азотом, фосфором, мышьяком, сурьмой и висмутом. При этом демонстрирует несколько существенных отличий от них. На сегодня синтезировано около 100 атомов московия, которые имеют массовые числа от 287 до 290.
Физические свойства
Валентные электроны 115 элемента таблицы Менделеева московия делятся на три подоболочки: 7s (два электрона), 7p 1/2 (два электрона) и 7p 3/2 (один электрон). Первые два из них релятивистски стабилизируются и, следовательно, ведут себя, как инертные газы, а последние релятивистски дестабилизируются и могут легко участвовать в химических взаимодействиях. Таким образом, первичный потенциал ионизации московия должен составлять около 5,58 эВ. Согласно расчетам, moscovium должен быть плотным металлом из-за его высокого атомного веса с плотностью около 13,5 г/см 3 .
Предполагаемые расчетные характеристики:
- Фаза: твердая.
- Температура плавления: 400°С (670°К, 750°F).
- Точка кипения: 1100°С (1400°К, 2000°F).
- Удельная теплота плавления: 5,90-5,98 кДж/моль.
- Удельная теплота парообразования и конденсации: 138 кДж/моль.
Химические свойства
115-й элемент таблицы Менделеева стоит третьим в ряду химических элементов 7p и является самым тяжелым членом группы 15 в периодической таблице, располагаясь ниже висмута. Химическое взаимодействие московия в водном растворе обусловлено характеристиками ионов Mc + и Mc 3+ . Первые, предположительно, легко гидролизуются и образуют ионную связь с галогенами, цианидами и аммиаком. Гидроксид московия (I) (McOH), карбонат (Mc 2 CO 3), оксалат (Mc 2 C 2 O 4) и фторид (McF) должны растворяться в воде. Сульфид (Мс 2 S) должен быть нерастворимым. Хлорид (McCl), бромид (McBr), йодид (McI) и тиоцианат (McSCN) – слаборастворимые соединения.
Химическое взаимодействие московия в водном растворе обусловлено характеристиками ионов Mc + и Mc 3+ . Первые, предположительно, легко гидролизуются и образуют ионную связь с галогенами, цианидами и аммиаком. Гидроксид московия (I) (McOH), карбонат (Mc 2 CO 3), оксалат (Mc 2 C 2 O 4) и фторид (McF) должны растворяться в воде. Сульфид (Мс 2 S) должен быть нерастворимым. Хлорид (McCl), бромид (McBr), йодид (McI) и тиоцианат (McSCN) – слаборастворимые соединения.
Фторид московия (III) (McF 3) и тиозонид (McS 3), предположительно, нерастворимы в воде (аналогично соответствующим соединениям висмута). В то время, как хлорид (III) (McCl 3), бромид (McBr 3) и иодид (McI 3) должны быть легко растворимы и легко гидролизованы с образованием оксогалогенидов, таких как McOCl и McOBr (также аналогично висмуту). Оксиды московия (I) и (III) обладают схожими состояниями окисления, и их относительная стабильность в значительной степени зависит от того, с какими элементами они взаимодействуют.
Неопределенность
Вследствие того, что 115 элемент таблицы Менделеева синтезируется единичными экспериментально его точные характеристики проблематично.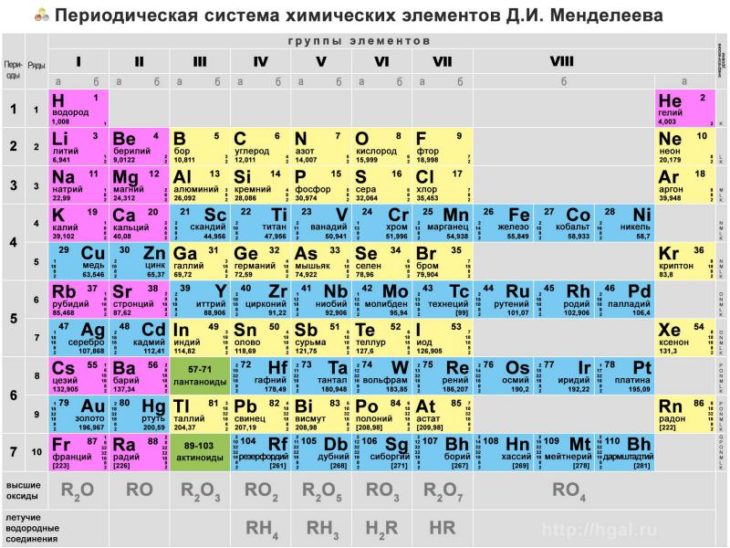 Ученым приходится ориентироваться на теоретические расчеты и сравнивать с более стабильными элементами, схожими по свойствам.
Ученым приходится ориентироваться на теоретические расчеты и сравнивать с более стабильными элементами, схожими по свойствам.
В 2011 году были проведены эксперименты по созданию изотопов нихония, флеровия и московия в реакциях между «ускорителями» (кальцием-48) и «мишенями» (америцием-243 и плутонием-244) для исследования их свойств. Однако «мишени» включали примеси свинца и висмута и, следовательно, были получены в реакциях переноса нуклонов некоторые изотопы висмута и полония, что осложнило проведение эксперимента. Между тем, полученные данные помогут в будущем ученым более детально исследовать тяжелые гомологи висмута и полония, такие как moscovium и livermorium.
Открытие
Первым успешным синтезом 115 элемента таблицы Менделеева была совместная работа российских и американских ученых в августе 2003 года в ОИЯИ в Дубне. В команду во главе с физиком-ядерщиком Юрием Оганесяном, помимо отечественных специалистов, вошли коллеги из Ливерморской национальной лаборатории Лоуренса.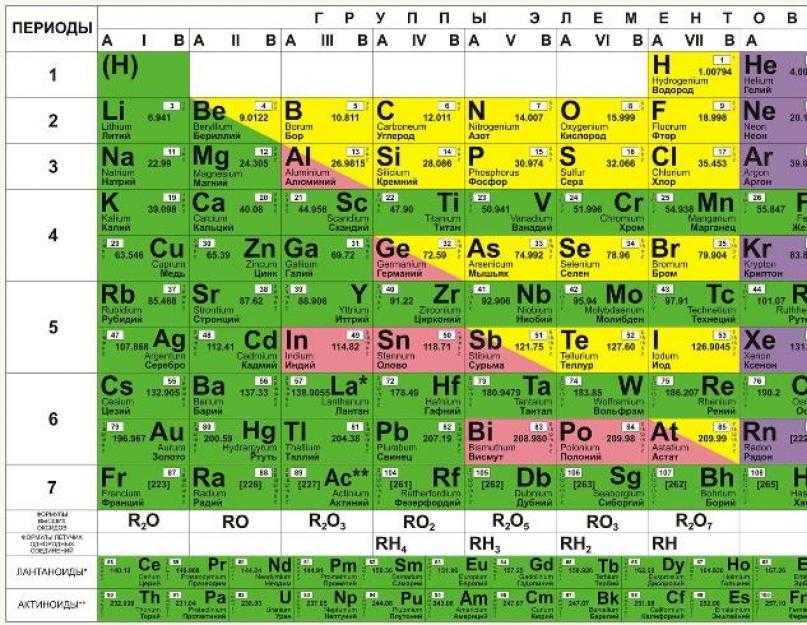 Исследователи 2 февраля 2004 года опубликовали в издании Physical Review информацию, что они бомбардировали америций-243 ионами кальция-48 на циклотроне У-400 и получили четыре атома нового вещества (одно ядро 287 Mc и три ядра 288 Mc). Эти атомы затухают (распадаются) за счет эмиссии альфа-частиц до элемента нихония примерно за 100 миллисекунд. Два более тяжелых изотопа московия, 289 Mc и 290 Mc, были обнаружены в 2009-2010 годах.
Исследователи 2 февраля 2004 года опубликовали в издании Physical Review информацию, что они бомбардировали америций-243 ионами кальция-48 на циклотроне У-400 и получили четыре атома нового вещества (одно ядро 287 Mc и три ядра 288 Mc). Эти атомы затухают (распадаются) за счет эмиссии альфа-частиц до элемента нихония примерно за 100 миллисекунд. Два более тяжелых изотопа московия, 289 Mc и 290 Mc, были обнаружены в 2009-2010 годах.
Первоначально IUPAC не могла утвердить открытие нового элемента. Требовалось подтверждение из других источников. В течение следующих нескольких лет была проведена еще одна оценка более поздних экспериментов, и еще раз выдвинуто заявление дубненской команды об открытии 115-го элемента.
В августе 2013 года группа исследователей из Университета Лунда и Института тяжелых ионов в Дармштадте (Германия) объявили, что они повторили эксперимент 2004 года, подтвердив результаты, полученные в Дубне. Еще одно подтверждение было опубликовано командой ученых, работавших в Беркли в 2015 году. В декабре 2015 года совместная рабочая группа IUPAC/IUPAP признала обнаружение этого элемента и отдала приоритет в открытии российско-американской команде исследователей.
В декабре 2015 года совместная рабочая группа IUPAC/IUPAP признала обнаружение этого элемента и отдала приоритет в открытии российско-американской команде исследователей.
Название
115 элемент таблицы Менделеева в 1979 году согласно рекомендации IUPAC было решено назвать «унунпентий» и обозначать соответствующим символом UUP. Несмотря на то, что данное название с тех пор широко использовалось в отношении неоткрытого (но теоретически предсказанного) элемента, в сообществе физиков оно не прижилось. Чаще всего вещество так и называли – элемент №115 или E115.
30 декабря 2015 года обнаружение нового элемента было признано Международным союзом чистой и прикладной химии. Согласно новым правилам, первооткрыватели имеют право предложить собственное название нового вещества. Сначала предполагалось назвать 115 элемент таблицы Менделеева «лангевиний» в честь физика Поля Ланжевена. Позднее команда ученых из Дубны, как вариант, предложила наименование «московий» в честь Московской области, где и было совершено открытие. В июне 2016 года IUPAC одобрил инициативу и 28 ноября 2016 официально утвердил название «moscovium».
В июне 2016 года IUPAC одобрил инициативу и 28 ноября 2016 официально утвердил название «moscovium».
Периодический закон Д.И. Менделеева и периодическая система химических элементов имеет большое значение в развитии химии. Окунемся в 1871 год, когда профессор химии Д.И. Менделеев, методом многочисленных проб и ошибок, пришел к выводу, что «… свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса». Периодичность изменения свойств элементов возникает вследствие периодического повторения электронной конфигурации внешнего электронного слоя с увеличением заряда ядра.
Современная формулировка периодического закона такова:
«свойства химических элементов (т.е. свойства и форма образуемых ими соединений) находятся в периодической зависимости от заряда ядра атомов химических элементов».
Преподавая химию, Менделеев понимал, что запоминание индивидуальных свойств каждого элемента, вызывает у студентов трудности. Он стал искать пути создания системного метода, чтобы облегчить запоминание свойств элементов. В результате появилась естественная таблица , позже она стала называться периодической .
Он стал искать пути создания системного метода, чтобы облегчить запоминание свойств элементов. В результате появилась естественная таблица , позже она стала называться периодической .
Наша современная таблица очень похожа на менделеевскую. Рассмотрим ее подробнее.
Таблица Менделеева
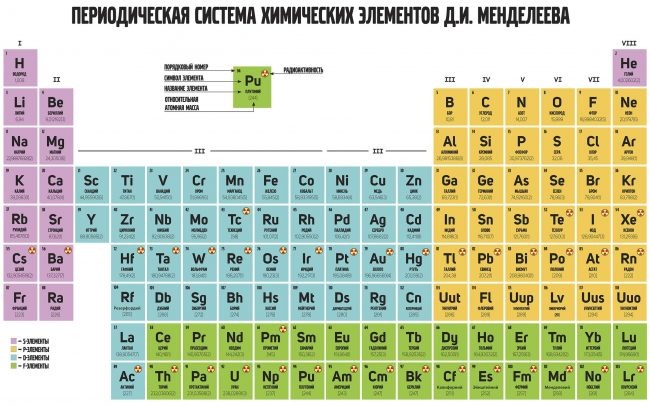
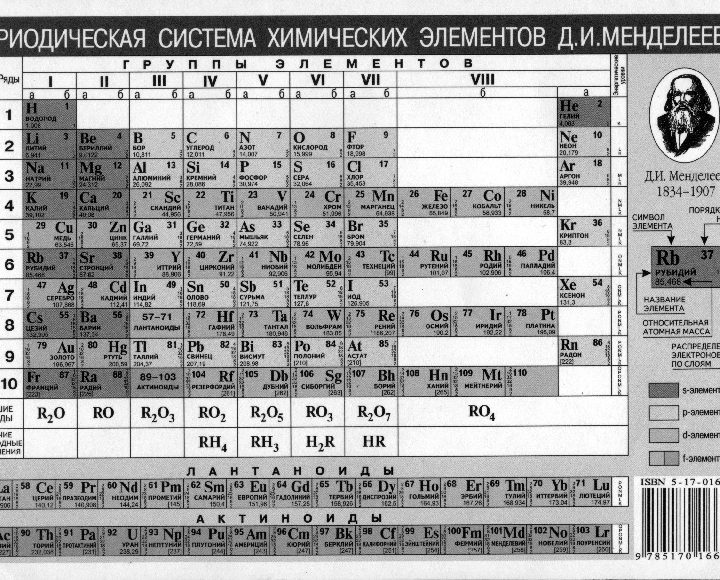
Периодическая таблица Менделеева состоит из 8 групп и 7 периодов.
Вертикальные столбцы таблицы называют группами . Элементы, внутри каждой группы, обладают сходными химическими и физическими свойствами. Это объясняется тем, что элементы одной группы имеют сходные электронные конфигурации внешнего слоя, число электронов на котором равно номеру группы. При этом группа разделяется на главные и побочные подгруппы .
В Главные подгруппы входят элементы, у которых валентные электроны располагаются на внешних ns- и np- подуровнях. В Побочные подгруппы входят элементы, у которых валентные электроны располагаются на внешнем ns- подуровне и внутреннем (n — 1) d- подуровне (или (n — 2) f- подуровне).
Все элементы в периодической таблице , в зависимости от того, на каком подуровне (s-, p-, d- или f-) находятся валентные электроны классифицируются на: s- элементы (элементы главной подгруппы I и II групп), p- элементы (элементы главных подгрупп III — VII групп), d- элементы (элементы побочных подгрупп), f- элементы (лантаноиды, актиноиды).
Высшая валентность элемента (за исключением O, F, элементов подгруппы меди и восьмой группы) равна номеру группы, в которой он находится.
Для элементов главных и побочных подгрупп одинаковыми являются формулы высших оксидов (и их гидратов). В главных подгруппах состав водородных соединений являются одинаковыми, для элементов, находящихся в этой группе. Твердые гидриды образуют элементы главных подгрупп I — III групп, а IV — VII групп образуют а газообразные водородные соединения. Водородные соединения типа ЭН 4 – нейтральнее соединения, ЭН 3 – основания, Н 2 Э и НЭ — кислоты.
Горизонтальные ряды таблицы называют периодами . Элементы в периодах отличаются между собой, но общее у них то, что последние электроны находятся на одном энергетическом уровне (главное квантовое число n — одинаково).
Элементы в периодах отличаются между собой, но общее у них то, что последние электроны находятся на одном энергетическом уровне (главное квантовое число n — одинаково).
Первый период отличается от других тем, что там находятся всего 2 элемента: водород H и гелий He.
Во втором периоде находятся 8 элементов (Li – Ne). Литий Li – щелочной металл начинает период, а замыкает его благородный газ неон Ne.
В третьем периоде, также как и во втором находятся 8 элементов (Na – Ar). Начинает период щелочной металл натрий Na, а замыкает его благородный газ аргон Ar.
В четвёртом периоде находятся 18 элементов (K – Kr) – Менделеев его обозначил как первый большой период. Начинается он также с щелочного металла Калий, а заканчивается инертным газом криптон Kr. В состав больших периодов входят переходные элементы (Sc – Zn) — d- элементы.
В пятом периоде, аналогично четвертому находятся 18 элементов (Rb – Xe) и структура его сходна с четвёртым. Начинается он также с щелочного металла рубидий Rb, а заканчивается инертным газом ксенон Xe. В состав больших периодов входят переходные элементы (Y – Cd) — d- элементы.
Начинается он также с щелочного металла рубидий Rb, а заканчивается инертным газом ксенон Xe. В состав больших периодов входят переходные элементы (Y – Cd) — d- элементы.
Шестой период состоит из 32 элементов (Cs – Rn). Кроме 10 d -элементов (La, Hf – Hg) в нем находится ряд из 14 f -элементов(лантаноиды)- Ce — Lu
Седьмой период не закончен. Он начинается с Франций Fr, можно предположить, что он будет содержать, также как и шестой период, 32 элемента, которые уже найдены (до элемента с Z = 118).
Интерактивная таблица Менделеева
Если посмотреть на периодическую таблицу Менделеева и провести воображаемую черту, начинающуюся у бора и заканчивающуюся между полонием и астатом, то все металлы будут находиться слева от черты, а неметаллы – справа. Элементы, непосредственно прилегающие к этой линии будут обладать свойствами как металлов, так и неметаллов. Их называют металлоидами или полуметаллами. Это бор, кремний, германий, мышьяк, сурьма, теллур и полоний.
Периодический закон
Менделеев дал следующую формулировку Периодического закона: «свойства простых тел, а также формы и свойства соединений элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».
Существует четыре основных периодических закономерности:
Правило октета утверждает, что все элементы стремятся приобрести или потерять электрон, чтобы иметь восьмиэлектронную конфигурацию ближайшего благородного газа. Т.к. внешние s- и p-орбитали благородных газов полностью заполнены, то они являются самыми стабильными элементами.
Энергия ионизации – это количество энергии, необходимое для отрыва электрона от атома. Согласно правилу октета, при движении по периодической таблице слева направо для отрыва электрона требуется больше энергии. Поэтому элементы с левой стороны таблицы стремятся потерять электрон, а с правой стороны – его приобрести. Самая высокая энергия ионизации у инертных газов. Энергия ионизации уменьшается при движении вниз по группе, т.к. у электронов низких энергетических уровней есть способность отталкивать электроны с более высоких энергетических уровней. Это явление названо эффектом экранирования . Благодаря этому эффекту внешние электроны мене прочно связаны с ядром. Двигаясь по периоду энергия ионизации плавно увеличивается слева направо.
Энергия ионизации уменьшается при движении вниз по группе, т.к. у электронов низких энергетических уровней есть способность отталкивать электроны с более высоких энергетических уровней. Это явление названо эффектом экранирования . Благодаря этому эффекту внешние электроны мене прочно связаны с ядром. Двигаясь по периоду энергия ионизации плавно увеличивается слева направо.
Сродство к электрону – изменение энергии при приобретении дополнительного электрона атомом вещества в газообразном состоянии. При движении по группе вниз сродство к электрону становится менее отрицательным вследствие эффекта экранирования.
Электроотрицательность — мера того, насколько сильно стремится притягивать к себе электроны связанного с ним другого атома. Электроотрицательность увеличивается при движении в периодической таблице слева направо и снизу вверх. При этом надо помнить, что благородные газы не имеют электроотрицательности. Таким образом, самый электроотрицательный элемент – фтор.
На основании этих понятий, рассмотрим как меняются свойства атомов и их соединений в таблице Менделеева.
Итак, в периодической зависимости находятся такие свойства атома, которые связанны с его электронной конфигурацией: атомный радиус, энергия ионизации, электроотрицательность.
Рассмотрим изменение свойств атомов и их соединений в зависимости от положения в периодической системе химических элементов .
Неметалличность атома увеличивается при движении в периодической таблице слева направо и снизу вверх . В связи с этим основные свойства оксидов уменьшаются, а кислотные свойства увеличиваются в том же порядке — при движении слева направо и снизу вверх. При этом кислотные свойства оксидов тем сильнее, чем больше степень окисления образующего его элемента
По периоду слева направо основные свойства гидроксидов ослабевают,по главным подгруппам сверху вниз сила оснований увеличивается. При этом, если металл может образовать несколько гидроксидов, то с увеличением степени окисления металла, основные свойства гидроксидов ослабевают.
По периоду слева направо увеличивается сила кислородосодержащих кислот. При движении сверху вниз в пределах одной группы сила кислородосодержащих кислот уменьшается. При этом сила кислоты увеличивается с увеличением степени окисления образующего кислоту элемента.
По периоду слева направо увеличивается сила бескислородных кислот. При движении сверху вниз в пределах одной группы сила бескислородных кислот увеличивается.
Категории ,
Как всё начиналось?
Многие известные именитые химики на рубеже XIX-XX веков уже давно заметили, что физические и химические свойства многих химических элементов очень похожи друг на друга. Так например Калий, Литий и Натрий – все являются активными металлами, которые при взаимодействии с водой образают активные гидроксиды этих металлов; Хлор, Фтор, Бром в своих соединениях с водородом проявляли одинаковую валентность равную I и все эти соединения являются сильными кислотами.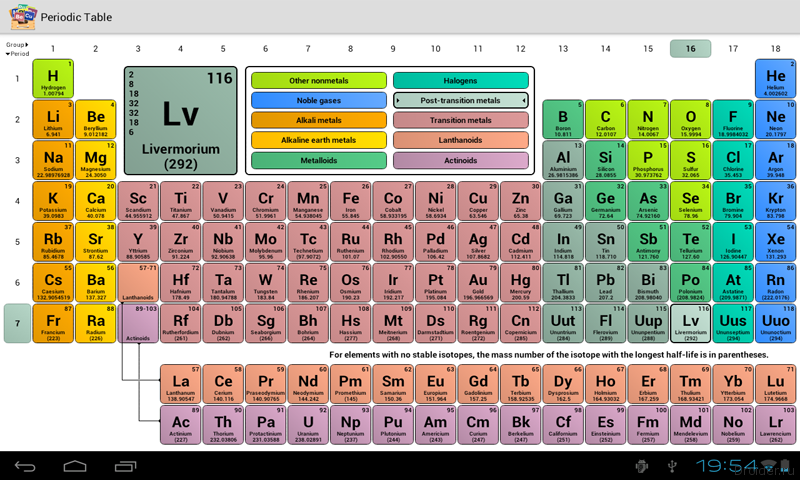 Из этой похожести давно напрашивался вывод, что все известные химические элементы можно объединить в группы, причём так чтобы у элементов каждой группы был определённый набор физико-химических характеристик. Однако часто такие группы были неверно составлены из разных элементов различными учёными и долгое время многими игнорировалась одна из главных характеристик элементов – это их атомная масса. Игнорировалась она потому, что была и есть разная у различных элементов, а значит её не могли использовать в качестве параметра для объединения в группы. Исключение составил лишь франзуский химик Александр Эмиль Шанкуртуа, он попытался расположить все элементы в трёхмерной модели по винтовой линии, но его работа не была признана научным сообществом, а модель получилась громоздкая и неудобная.
Из этой похожести давно напрашивался вывод, что все известные химические элементы можно объединить в группы, причём так чтобы у элементов каждой группы был определённый набор физико-химических характеристик. Однако часто такие группы были неверно составлены из разных элементов различными учёными и долгое время многими игнорировалась одна из главных характеристик элементов – это их атомная масса. Игнорировалась она потому, что была и есть разная у различных элементов, а значит её не могли использовать в качестве параметра для объединения в группы. Исключение составил лишь франзуский химик Александр Эмиль Шанкуртуа, он попытался расположить все элементы в трёхмерной модели по винтовой линии, но его работа не была признана научным сообществом, а модель получилась громоздкая и неудобная.
В отличие от многих учёных, Д.И. Менделеев взял атомную массу (в те времена ещё “Атомный вес”) как ключевой параметр при классификации элементов. В своём варианте Дмитрий Иванович расположил элементы по возрастанию их атомных весов и вот тут обозначилась закономерность, что через определённые промежутки элементов их свойства периодически повторяются. Правда пришлось сделать и исключения: некоторые элементы были поменяны местами и не соответствовали возрастанию атомных масс (например, теллур и йод), но зато соответствовали свойствам элементов. Дальнейшее развитие атомно-молекулярного учения оправдало такие подвижки и показало справедливость этой расстановки. Подробнее об этом вы можете прочесть в статье “В чём открытие Менделеева”
Правда пришлось сделать и исключения: некоторые элементы были поменяны местами и не соответствовали возрастанию атомных масс (например, теллур и йод), но зато соответствовали свойствам элементов. Дальнейшее развитие атомно-молекулярного учения оправдало такие подвижки и показало справедливость этой расстановки. Подробнее об этом вы можете прочесть в статье “В чём открытие Менделеева”
Как мы можем видеть, расположение элементов в этом варианте совсем не такое, какое мы видим в совремнном виде. Во первых, группы и периоды поменяны местами: группы по горизонтали, периоды по вертикали, а во-вторых, самих групп в нём как-то многовато – девятнадцать, вместо принятых на сегодня восемнадцати.
Однако, спустя всего год, в 1870-м Менделеев сформировал новый вариант таблицы, который уже более узнаваем нами: подобные элементы выстроены по вертикали, образуя группы, а 6 периодов расположены по горизонтали. Особенно примечательно то, что и в первом и во втором варианте таблицы виднеются существенные достижения, коих не было у его предшественников: в таблице заботливо оставлены места под элементы которые, по мнению Менделеева, ещё предстояло открыть.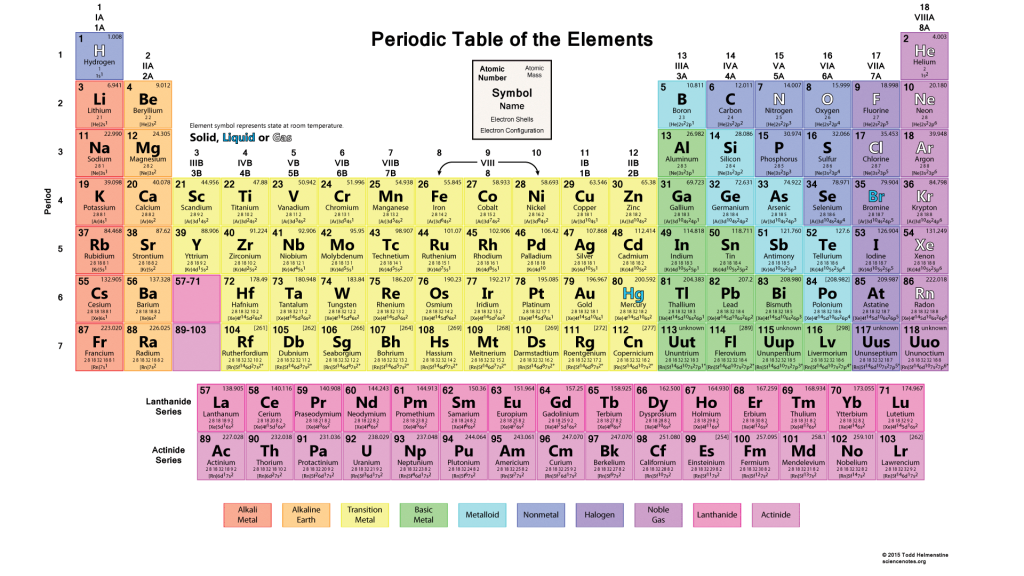 Соответствующие вакантные места обозначены им знаком вопроса и вы можете видеть их на рисунке выше. В дальнейшем были действительно открыты соответствующие элементы: Галий, Германий, Скандий. Таким образом Дмитрий Иванович не только систематезировал элементы в группы и периоды, но и предсказал открытие новых, ещё не известных, элементов.
Соответствующие вакантные места обозначены им знаком вопроса и вы можете видеть их на рисунке выше. В дальнейшем были действительно открыты соответствующие элементы: Галий, Германий, Скандий. Таким образом Дмитрий Иванович не только систематезировал элементы в группы и периоды, но и предсказал открытие новых, ещё не известных, элементов.
В дальнейшем, после разрешения многих актуальных загадок химии того времени – открытие новых элементов, выделение группы благородных газов совместно с участием Уильяма Рамзая, установления того факта, что Дидимий вовсе не является самостоятельным элементом, а является смесью двух других, – были опубликованы всё новые и новые варианты таблицы, подчас имеющих даже вовсе и не табличный вид. Но не будем приводить здесь их все, а приведём лишь конечный вариант, сформировавшийся ещё при жизни великого учёного.
Переход от атомных весов к заряду ядра.
К сожалению, Дмитрий Иванович не дожил до планетарной теории строения атома и не видел триумф опытов Резерфорда, хотя именно с его открытиями начинается новая эпоха в развитии периодического закона и всей периодической системы. Напомню что из опытов, проводимых Эрнестом Резерфордом, следовало, что атомы элементов состоят из положительно-заряженного атомного ядра и обращающихся вокруг ядра отрицательно-заряженных электронов. После определения зарядов атомных ядер всех, известных на тот момент, элементов, выяснилось, что в периодической системе они располагаются в соответствии с зарядом ядра. А периодический закон приобрёл новый смысл, теперь он стал звучать так:
Напомню что из опытов, проводимых Эрнестом Резерфордом, следовало, что атомы элементов состоят из положительно-заряженного атомного ядра и обращающихся вокруг ядра отрицательно-заряженных электронов. После определения зарядов атомных ядер всех, известных на тот момент, элементов, выяснилось, что в периодической системе они располагаются в соответствии с зарядом ядра. А периодический закон приобрёл новый смысл, теперь он стал звучать так:
“Свойства химических элементов, а также формы и свойства, образуемых ими простых веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов”
Теперь стало понятно, почему некоторые более лёгкие элементы были поставлены Менделеевым позади их более тяжёлых предшественников, – всё дело в том, что так они стоят по порядку зарядов их ядра. Например, теллур тяжелее йода, однако стоит в таблице раньше него, ибо заряд ядра его атома и количество электронов равняется 52, а у йода – 53. Можете посмотреть на таблицу и убедиться в этом сами.
После открытия строения атома и атомного ядра, периодическая система претерпевала ещё несколько изменений, пока, наконец, не достигла вида, уже знакомого нам со школы, короткопериодного варианта таблицы Менделеева.
В этой таблице нам знакомо уже всё: 7 периодов, 10 рядов, побочные и главные подгруппы. Также со временем открытия новых элементов и наполнения ими таблицы, пришлось вынести в отдельные ряды элементы подобные Актинию и Лантану, все они соответственно были названы Актиноидами и Лантаноидами. Эта версия системы просуществовала очень долго – в мировом научном сообществе практически до конца 80х, начала 90х, а в нашей стране и того дольше – до 10х годов нынешнего столетия.
Современный вариант таблицы Менделеева.
Однако, тот вариант, которые многие из нас проходили в школе на деле оказывается весьма запутанным, а путаница выражается в разделении подгрупп на главные и побочные и запоминание логики отображения свойств элементов становится достаточно сложным. Конечно, несмотря на это, многие по нему учились, становились докторами химических наук, но всё же в современности ему на смену пришёл новый вариант – длиннопериодный. Отмечу, что именно этот вариант является одобренным IUPAC (международным союзом теоретической и прикладной химии). Давайте взглянем на него.
Конечно, несмотря на это, многие по нему учились, становились докторами химических наук, но всё же в современности ему на смену пришёл новый вариант – длиннопериодный. Отмечу, что именно этот вариант является одобренным IUPAC (международным союзом теоретической и прикладной химии). Давайте взглянем на него.
На смену восьми группам пришли восемнадцать, среди которых нет уже никакого разделения на главные и побочные, а все группы продиктованы расположением электронов в атомной оболочке. Заодно избавились и от двухрядных и однорядных периодов, теперь все периоды содержат только один ряд. Чем же удобен такой вариант? Теперь периодичность свойств элементов просматривается более наглядно. Номер группы, по сути, обозначает количество электронов во внешнем уровне, в связи с чем все главные подгруппы старого варианта расположились в первой, второй и с тринадцатой по восемнадцатую группу, а все “бывшие побочные” группы разместились в середине таблицы. Тем самым теперь из таблицы хорошо видно, что если это первая группа – то это щелочные металлы и никаких вам меди или серебра, и видно, что все транзитные металлы хорошо демонстрируют схожесть их свойств в связи с заполнением d-подуровня, в меньшей степени влияющим на внешние свойства, также как и лантаноиды и актиноиды проявляют подобные свойства по причине разного лишь f-подуровня. Таким образом, вся таблица разбита на следующие блоки: s-блок, на котором заполняются s-электроны, d-блок, p-блок и f-блок, с заполнением d, p, и f-электронов соответственно.
Таким образом, вся таблица разбита на следующие блоки: s-блок, на котором заполняются s-электроны, d-блок, p-блок и f-блок, с заполнением d, p, и f-электронов соответственно.
К сожалению, в нашей стране этот вариант включился в школьные учебники лишь в последние 2-3 года, да и то не во все. И очень напрасно. С чем это связано? Ну во-первых, с застойными временами в лихие 90-е, когда в стране не было вообще никакого развития, не говоря уж о сфере образования, а именно в 90е годы мировое химическое сообщество перешло на этот вариант. Во-вторых, с лёгкой инертностью и тяжестью восприятия всего нового, ведь нашим преподавателям привычен именно старый, короткопериодный вариант таблицы, несмотря на то, что при изучении химии он гораздо сложнее и менее удобен.
Расширенный вариант периодической системы.
Но время не стоит на месте, наука и технологии тоже. Уже открыт 118 элемент периодической системы, а значит скоро придётся открывать следующий, восьмой, период таблицы. Кроме того, появится новый энергетический подуровень: g-подуровень.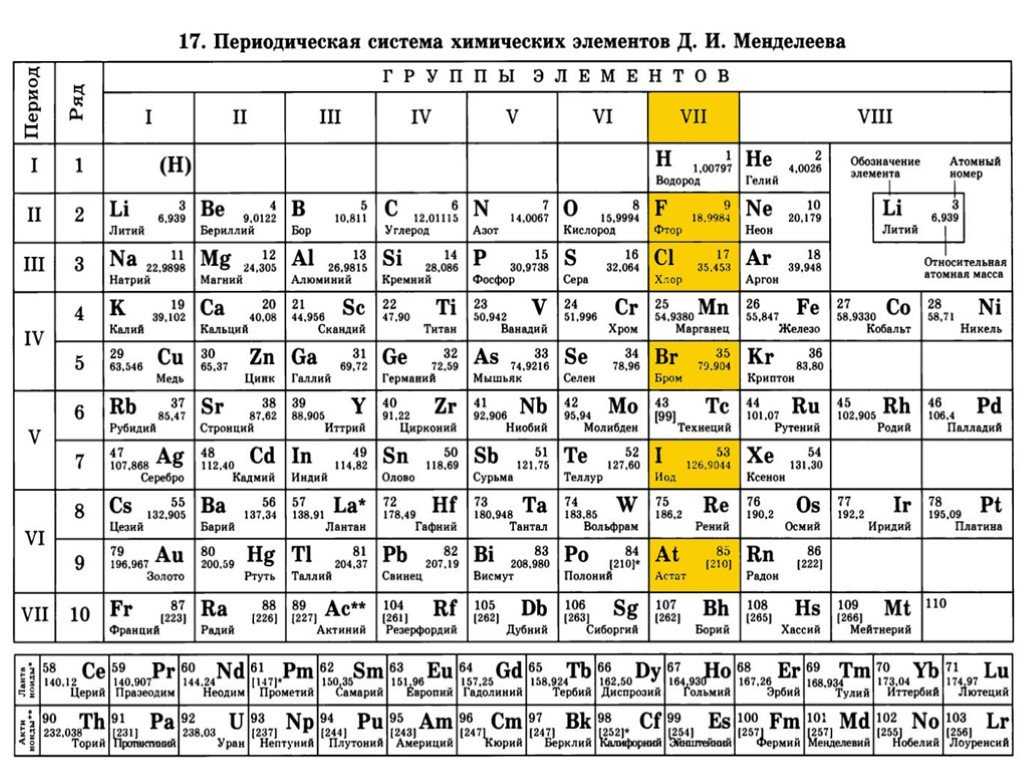 Элементы его составляющие придётся вынести вниз таблицы, подобно лантаноидам или актиноидам, либо расширить эту таблицу ещё в два раза, так что она перестанет помещаться на лист формата A4. Здесь я приведу лишь ссылку на википедию (см. Расширенная периодическая система) и не буду лишний раз повторять описание этого варианта. Кому станет интересно – сможет пройти по ссылке и ознакомиться.
Элементы его составляющие придётся вынести вниз таблицы, подобно лантаноидам или актиноидам, либо расширить эту таблицу ещё в два раза, так что она перестанет помещаться на лист формата A4. Здесь я приведу лишь ссылку на википедию (см. Расширенная периодическая система) и не буду лишний раз повторять описание этого варианта. Кому станет интересно – сможет пройти по ссылке и ознакомиться.
В этом варианте ни f-элементы (лантаноиды и актиноиды) ни g-элементы (“элементы будущего” с №№ 121-128) не вынесены отдельно, а делают таблицу шире на 32 клетки. Также элемент Гелий помещён во вторую группу, так как он входит в s-блок.
В целом, же вряд ли будущие химики будут пользоваться этим вариантом, скорее всего на смену таблице Менделеева придёт одна из альтернатив, которые уже выдвигаются смелыми учёными: система Бенфея, “Химическая галактика” Стьюарта или иной вариант. Но это будет уже только после достижения второго острова стабильности химических элементов и, скорее всего, нужно будет больше для наглядности в ядерной физике, чем в химии, ну а нам пока хватит старой доброй периодической системы Дмитрия Ивановича.
Таблица Менделеева является одним из величайших открытий человечества, позволившим упорядочить знания об окружающем мире и открыть новые химические элементы . Она является необходимой для школьников, а так же для всех, кто интересуется химией. Кроме того, данная схема является незаменимой и в других областях науки.
Данная схема содержит все известные человеку элементы, причем они группируются в зависимости от атомной массы и порядкового номера . Эти характеристики влияют на свойства элементов. Всего в коротком варианте таблицы имеется 8 групп, элементы, входящие в одну группу, обладают весьма сходными свойствами. Первая группа содержит водород, литий, калий, медь, латинское произношение на русском которой купрум. А так же аргентум — серебро, цезий, золото — аурум и франций. Во второй группе расположены бериллий, магний, кальций, цинк, за ними идут стронций, кадмий, барий, заканчивается группа ртутью и радием.
В состав третьей группы вошли бор, алюминий, скандий, галлий, потом следуют иттрий, индий, лантан, завершается группа таллием и актинием. Четвертая группа начинается с углерода, кремния, титана, продолжается германием, цирконием, оловом и завершается гафнием, свинцом и резерфордием. В пятой группе имеются такие элементы, как азот, фосфор, ванадий, ниже расположены мышьяк, ниобий, сурьма, потом идут тантал висмут и завершает группу дубний. Шестая начинается с кислорода, за которым лежат сера, хром, селен, потом следуют молибден, теллур, далее вольфрам, полоний и сиборгий.
Четвертая группа начинается с углерода, кремния, титана, продолжается германием, цирконием, оловом и завершается гафнием, свинцом и резерфордием. В пятой группе имеются такие элементы, как азот, фосфор, ванадий, ниже расположены мышьяк, ниобий, сурьма, потом идут тантал висмут и завершает группу дубний. Шестая начинается с кислорода, за которым лежат сера, хром, селен, потом следуют молибден, теллур, далее вольфрам, полоний и сиборгий.
В седьмой группе первый элемент – фтор, потом следует хлор, марганец, бром, технеций, за ним находится йод, потом рений, астат и борий. Последняя группа является самой многочисленной . В нее входят такие газы, как гелий, неон, аргон, криптон, ксенон и радон. Так же к данной группе относятся металлы железо, кобальт, никель, родий, палладий, рутений, осмий, иридий, платина. Далее идут ханний и мейтнерий. Отдельно расположены элементы, которые образуют ряд актиноидов и ряд лантаноидов . Они обладают сходными свойствами с лантаном и актинием.
Данная схема включает в себя все виды элементов, которые делятся на 2 большие группы – металлы и неметаллы , обладающие разными свойствами. Как определить принадлежность элемента к той или иной группе, поможет условная линия, которую необходимо провести от бора к астату. Следует помнить, что такую линию можно провести только в полной версии таблицы. Все элементы, которые находятся выше этой линии, и располагаются в главных подгруппах считаются неметаллами. А которые ниже, в главных подгруппах – металлами. Так же металлами являются вещества, находящиеся в побочных подгруппах . Существуют специальные картинки и фото, на которых можно детально ознакомиться с положением этих элементов. Стоит отметить, что те элементы, которые находятся на этой линии, проявляют одинаково свойства и металлов и неметаллов.
Отдельный список составляют и амфотерные элементы, которые обладают двойственными свойствами и могут образовывать в результате реакций 2 вида соединений. При этом у них проявляются одинаково как основные, так и кислотные свойства . Преобладание тех или иных свойств зависит от условий реакции и веществ, с которыми амфотерный элемент реагирует.
При этом у них проявляются одинаково как основные, так и кислотные свойства . Преобладание тех или иных свойств зависит от условий реакции и веществ, с которыми амфотерный элемент реагирует.
Стоит отметить, что данная схема в традиционном исполнении хорошего качества является цветной. При этом разными цветами для удобства ориентирования обозначаются главные и побочные подгруппы . А так же элементы группируются в зависимости от схожести их свойств.
Однако в настоящее время наряду с цветной схемой очень распространенной является периодическая таблица Менделеева черно белая. Такой ее вид используется для черно-белой печати. Несмотря на кажущуюся сложность, работать с ней так же удобно, если учесть некоторые нюансы. Так, отличить главную подгруппу от побочной в таком случае можно по отличиям в оттенках, которые хорошо заметны. К тому же в цветном варианте элементы с наличием электронов на разных слоях обозначаются разными цветами .
Стоит отметить, что в одноцветном исполнении ориентироваться по схеме не очень трудно. Для этого будет достаточно информации, указанной в каждой отдельной клеточке элемента.
Для этого будет достаточно информации, указанной в каждой отдельной клеточке элемента.
Егэ сегодня является основным видом испытания по окончанию школы, а значит, подготовке к нему необходимо уделять особое внимание. Поэтому при выборе итогового экзамена по химии , необходимо обратить внимание на материалы, которые могут помочь в его сдаче. Как правило, школьникам на экзамене разрешено пользоваться некоторыми таблицами, в частности, таблицей Менделеева в хорошем качестве. Поэтому, чтобы она принесла на испытаниях только пользу, следует заблаговременно уделить внимание ее строению и изучению свойств элементов, а так же их последовательности. Необходимо научиться, так же пользоваться и черно-белой версией таблицы , чтобы на экзамене не столкнуться с некоторыми трудностями.
Помимо основной таблицы, характеризующей свойства элементов и их зависимость от атомной массы, существуют и другие схемы, которые могут оказать помощь при изучении химии. Например, существуют таблицы растворимости и электроотрицательности веществ . По первой можно определить, насколько растворимо то или иное соединение в воде при обычной температуре. При этом по горизонтали располагаются анионы – отрицательно заряженные ионы, а по вертикали – катионы, то есть положительно заряженные ионы. Чтобы узнать степень растворимости того, или иного соединения, необходимо по таблице найти его составляющие. И на месте их пересечения будет нужное обозначение.
Например, существуют таблицы растворимости и электроотрицательности веществ . По первой можно определить, насколько растворимо то или иное соединение в воде при обычной температуре. При этом по горизонтали располагаются анионы – отрицательно заряженные ионы, а по вертикали – катионы, то есть положительно заряженные ионы. Чтобы узнать степень растворимости того, или иного соединения, необходимо по таблице найти его составляющие. И на месте их пересечения будет нужное обозначение.
Если это буква «р», то вещество полностью растворимо в воде в нормальных условиях. При наличии буквы «м» — вещество малорастворимое, а при наличии буквы «н» — оно почти не растворяется. Если стоит знак «+», — соединение не образует осадок и без остатка реагирует с растворителем. Если присутствует знак «-», это означает, что такого вещества не существует. Иногда так же в таблице можно увидеть знак «?», тогда это обозначает, что степень растворимости этого соединения доподлинно не известна. Электроотрицательность элементов может варьироваться от 1 до 8, для определения этого параметра так же существует специальная таблица.
Еще одна полезная таблица – ряд активности металлов. В нем располагаются все металлы по увеличении степени электрохимического потенциала. Начинается ряд напряжения металлов с лития, заканчивается золотом. Считается, что чем левее занимает место в данном ряду металл, тем он более активен в химических реакциях. Таким образом, самым активным металлом считается металл щелочного типа литий. В списке элементов ближе к концу так же присутствует водород. Считается, что металлы, которые расположены после него, являются практически неактивными. Среди них такие элементы, как медь, ртуть, серебро, платина и золото.
Таблица Менделеева картинки в хорошем качестве
Данная схема является одним из крупнейших достижений в области химии. При этом существует немало видов этой таблицы – короткий вариант, длинный, а так же сверхдлинный. Самой распространенной является короткая таблица, так же часто встречается и длинная версия схемы. Стоит отметить, что короткая версия схемы в настоящее время не рекомендуется ИЮПАК для использования.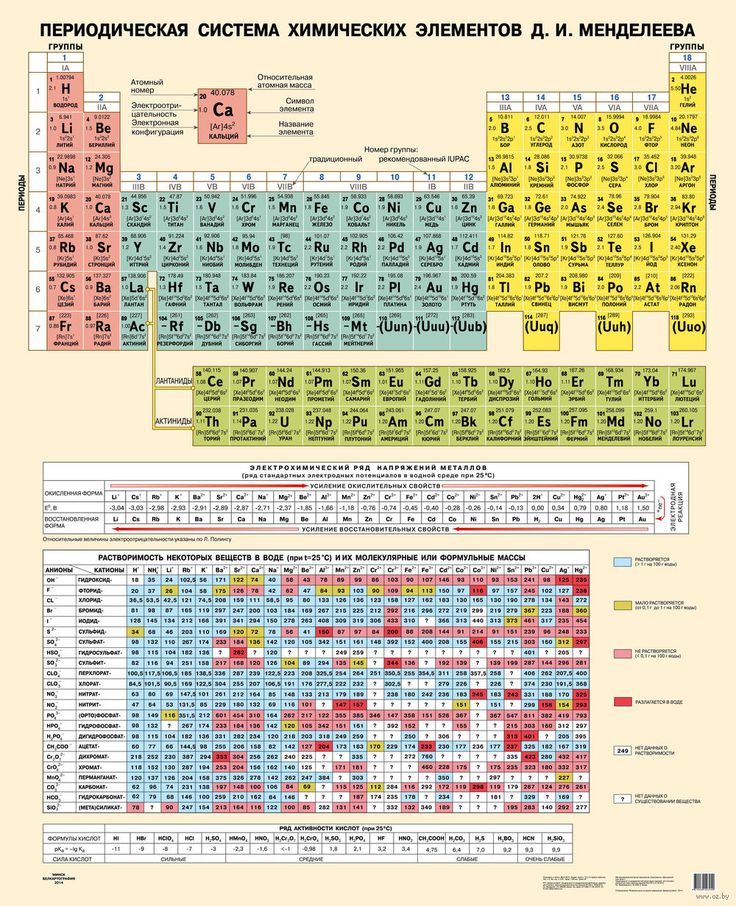
Всего было разработано больше сотни видов таблицы , отличающихся представлением, формой и графическим представлением. Они используются в разных областях науки, либо совсем не применяются. В настоящее время новые конфигурации схемы продолжают разрабатываться исследователями. В качестве основного варианта используется либо короткая, либо длинная схема в отличном качестве.
Math.ru
Иван Яковлевич Депман
М., Просвещение, 1965. 416 с.
Тираж 34000 экз.
| |||||||||||
Книга является собранием очерков по истории арифметики. Автор стремился лишь осветить исторически все основные разделы арифметики, составляющие содержание школьного курса.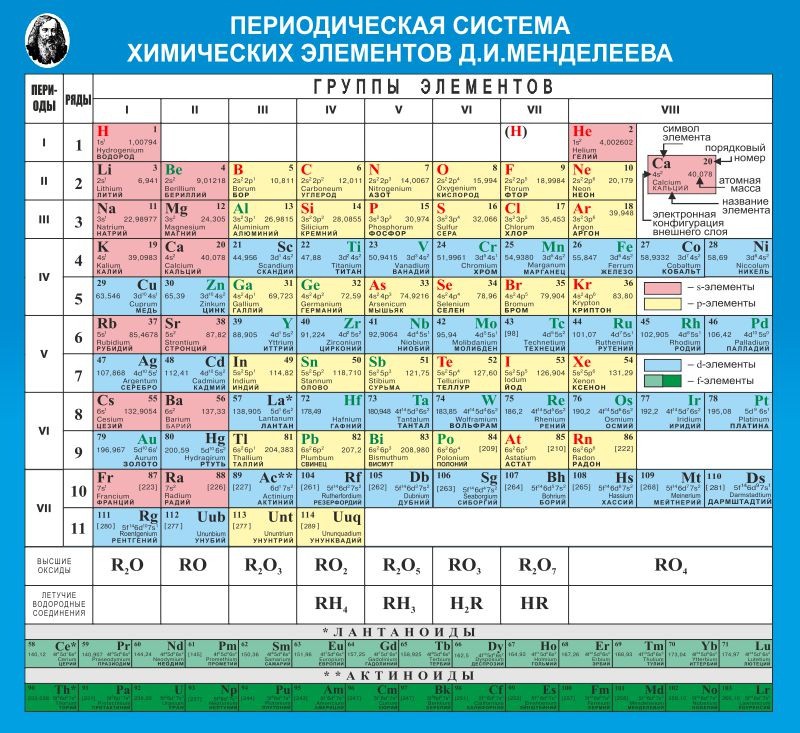 Сведения, приведенные в книге, могут включаться учителем в урок, а в более широком плане служить материалом для работы кружков.
Сведения, приведенные в книге, могут включаться учителем в урок, а в более широком плане служить материалом для работы кружков.
В книге даны указания на источники, в которых читатель найдет более расширенное изложение рассматриваемых вопросов или дальнейшие сведения по существу их.
Содержание
Введение
I. Натуральное число
1. О происхождении математики
2. Число и множество
3. Натуральные числа
4. Устная нумерация
5. Пальцевой счёт
6. Системы счисления, имеющие основанием число, не равное десяти
7. Задача Баше?Менделеева
8. Происхождение некоторых названий чисел
9. Большие числа и их наименования
10. Письменная нумерация
11. Вавилонские цифры
12. Египетские цифры
13. Греческая нумерация
14. Славянская нумерация
15. Римская нумерация
Римская нумерация
16. Узловая нумерация
17. Китайская нумерация
18. Нумерация народа майя
19. Индийская нумерация
20. Арабская математика и нумерация
21. Математика у среднеазиатских народов
22. Абак
23. Счёты
24. ?Счёт на линиях?
25. Происхождение некоторых арифметических терминов
26. Индийские цифры у западноевропейских народов
27. Индийские цифры в России
28. Форма наших цифр
29. Абстрактные числа. Единица как число
30. Нуль как число
31. Эволюция наших цифр
32. Аксиоматическое построение арифметики
II. Некоторые свойства натуральных чисел
1. Элементарная и высшая арифметика
2. Числа количественные и порядковые, чётные и нечётные
3. Простые и составные числа
4. Определение простоты чисел
5. Таблицы простых чисел
6. Закон распределения простых чисел
Закон распределения простых чисел
7. Делимость составных чисел
8. Совершенные, недостаточные и избыточные числа
9. Многоугольные и фигурные числа
10. Суммирование чисел натурального ряда и их степеней
a) Сумма n первых натуральных чисел
б) Сумма n первых четных чисел
в) Сумма n первых нечетных чисел
г) Сумма квадратов первых n чисел
д) Сумма кубов первых n чисел
11. Проблемы Варинга и Гольдбаха
12. Некоторые соотношения между отдельными числами натурального ряда
III. Действия над целыми числами
1. Устные вычисления
2. Арифметические таблицы
3. Таблицы умножения
4. Расширенная таблица умножения
5. Расширенные таблицы умножения в России
6. Арифметические действия
7. Обоснование арифметических действий в школьных учебниках
8. Законы арифметических действий
Законы арифметических действий
9. Символы в математике
10. Арифметические символы
11. К истории отдельных арифметических действий
IV. Дробное число
1. Происхождение дробей и их виды
2. Единичные дроби или доли
3. Систематические дроби
4. Обыкновенные дроби общего вида
5. Десятичные дроби
6. Десятичные дроби в Европе
7. Теория десятичных дробей
8. К теории обыкновенных дробей
9. Цепные дроби
10. Процент и промиль
11. Обоснование теории дробных чисел
V. Именованные числа
1. Системы мер
2. Старые русские меры
3. Метрическая система мер
4. Меры времени и календарь
5. Календарная терминология
6. Календарь французской революции
7. Всемирный календарь
VI. Практические “правила” в учебниках арифметики
1. Пропорции
Пропорции
2. Тройное правило
3. Задачи на смешение
4. Задачи на пропорциональное деление
5. Метод ложного положения
6. ?Девичье? или ?слепое? правило
7. Политическая арифметика
VII. Арифметические забавы и занимательные задачи в учебниках арифметики
1. Арифметические забавы
2. Занимательные задачи
VIII. Биографические сведения о некоторых математиках, упомянутых в книге
Л.Ф. Магницкий
Л. Эйлер
П.Л. Чебышев
Пьер Ферма
IX. Деятели арифметического образования в России
С.К. Котельников
С.Я. Румовский
Н.Г. Курганов
Я.П. Козельский
Д.С. Аничков
Е.Д. Войтяховский
М.Е. Головин
Т.Ф. Осиповский
С.Е. Гурьев
В.С. Кряжев
Д.М. Перевощиков
Н. И. Лобачевский
И. Лобачевский
П.С. Гурьев
Ф.И. Буссе
В.Я. Буняковский
А. Львов
А.Ф. Малинин
Ф.И. Симашко
В.А. Евтушевский
В.А. Латышев
А.И. Гольденберг
С.И. Шохор-Троцкий
Н.И. Билибин
Теоретическая арифметика в русских учебниках
А.К. Жбиковский
А.П. Кисилев
Хронологический указатель
Примечания
| |||||||||||
Постоянный адрес этой страницы: http://math.ru/lib/382
Таблица менделеева для чайников
Легенда о сне Менделеева
Многие слышали историю, что Д. И. Менделееву его таблица приснилась. Эта версия активно распространялась вышеупомянутым соратником Менделеева А. А. Иностранцевым в качестве забавной истории, которой он развлекал своих студентов. Он говорил, что Дмитрий Иванович лёг спать и во сне отчётливо увидел свою таблицу, в которой все химические элементы были расставлены в нужном порядке. После этого студенты даже шутили, что таким же способом была открыта 40° водка. Но реальные предпосылки для истории со сном всё же были: как уже упоминалось, Менделеев работал над таблицей без сна и отдыха, и Иностранцев однажды застал его уставшим и вымотанным. Днём Менделеев решил немного передохнуть, а некоторое время спустя, резко проснулся, сразу же взял листок бумаги и изобразил на нём уже готовую таблицу. Но сам учёный опровергал всю эту историю со сном, говоря: «Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово». Так что легенда о сне может быть и очень привлекательна, но создание таблицы стало возможным только благодаря упорному труду.
И. Менделееву его таблица приснилась. Эта версия активно распространялась вышеупомянутым соратником Менделеева А. А. Иностранцевым в качестве забавной истории, которой он развлекал своих студентов. Он говорил, что Дмитрий Иванович лёг спать и во сне отчётливо увидел свою таблицу, в которой все химические элементы были расставлены в нужном порядке. После этого студенты даже шутили, что таким же способом была открыта 40° водка. Но реальные предпосылки для истории со сном всё же были: как уже упоминалось, Менделеев работал над таблицей без сна и отдыха, и Иностранцев однажды застал его уставшим и вымотанным. Днём Менделеев решил немного передохнуть, а некоторое время спустя, резко проснулся, сразу же взял листок бумаги и изобразил на нём уже готовую таблицу. Но сам учёный опровергал всю эту историю со сном, говоря: «Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово». Так что легенда о сне может быть и очень привлекательна, но создание таблицы стало возможным только благодаря упорному труду.
Строение атома и периодический закон Менделеева
Периодический закон открыт Д. И. Менделеевым 1 марта 1869 года.
Он гласит: свойства элементов (а также образуемых ими соединений) находятся в периодической зависимости от зарядов их ядер.
Что интересно, в своей первоначальной таблице
Дмитрий Иванович определил место для эфирного первоэлемента.
Химическая таблица элементов организована таким образом, что атомы с родственной формой электронных облаков
(наиболее вероятных областей локализации электронов в соответствии с квантовой механикой) занимают близкие позиции.
Например, существуют
s ,
p ,
d и
f -блоки,
для которых электронные облака имеют свои геометрии. Так, s-облако принимает форму сферы, а p — гантели.
Схожесть формы внешних электронных облаков элементов отражает схожесть химических свойств их атомов.
Вы можете почитать о свойствах химических элементов в представленной ниже
модернизированной Таблице Менделеева:
| 1 H Водород 1s1 1,00794 -259,14°C -252,87°C 2,02 / – | 2 He Гелий | ||||||||||||||||
| 3 Li Литий | 4 Be Бериллий | 5 B Бор | 6 C Углерод | 7 N Азот | 8 O Кислород | 9 F Фтор | 10 Ne Неон | ||||||||||
| 11 Na Натрий | 12 Mg Магний | 13 Al Алюминий | 14 Si Кремний | 15 P Фосфор | 16 S Сера | 17 Cl Хлор | 18 Ar Аргон | ||||||||||
| 19 K Калий | 20 Ca Кальций | 21 Sc Скандий | 22 Ti Титан | 23 V Ванадий | 24 Cr Хром | 25 Mn Марганец | 26 Fe Железо | 27 Co Кобальт | 28 Ni Никель | 29 Cu Медь | 30 Zn Цинк | 31 Ga Галлий | 32 Ge Германий | 33 As Мышьяк | 34 Se Селен | 35 Br Бром | 36 Kr Криптон |
| 37 Rb Рубидий | 38 Sr Стронций | 39 Y Иттрий | 40 Zr Цирконий | 41 Nb Ниобий | 42 Mo Молибден | 43 Tc Технеций | 44 Ru Рутений | 45 Rh Родий | 46 Pd Палладий | 47 Ag Серебро | 48 Cd Кадмий | 49 In Индий | 50 Sn Олово | 51 Sb Сурьма | 52 Te Теллур | 53 I Иод | 54 Xe Ксенон |
| 55 Cs Цезий | 56 Ba Барий | 57 La Лантан | 72 Hf Гафний | 73 Ta Тантал | 74 W Вольфрам | 75 Re Рений | 76 Os Осмий | 77 Ir Иридий | 78 Pt Платина | 79 Au Золото | 80 Hg Ртуть | 81 Ti Таллий | 82 Pb Свинец | 83 Bi Висмут | 84 Po Полоний | 85 At Астат | 86 Rn Радон |
| 87 Fr Франций | 88 Ra Радий | 89 Ac Актиний | 104 Rf/Ku Резерфордий/Курчатовий | 105 Db/Ns Дубний/Нильсборий | 106 Sg Сиборгий | 107 Bh Борий | 108 Hs/Uno Хассий/Уннилоктий/Эка-осмий | 109 Mt/Une Мейтнерий/Унниленний/Эка-иридий | 110 Ds/Uun Дармштадтий/Унуннилий/ | 111 Rg/Uuu Рентгений/Унунуний/ | 112 Cn/Uub Коперниций/Унунбий/Эка-ртуть | 113 Uut Унунтрий/Эка-таллий | 114 Fl/Uuq Флеровий/Унунквадий/Эка-свинец | 115 Uup Унунпентий/Эка-висмут | 116 Lv/Uuh Ливерморий/Унунгексий/Эка-полоний | 117 Uus Унунсептий/Эка-астат | 118 Uuo Унуноктий/Эка-радон |
| 119 Uue Унуненний/Эка-франций | 120 Ubn Унбинилий/Эка-радий | 58 Ce Церий | 59 Pr Празеодим | 60 Nd Неодим | 61 Pm Прометий | 62 Sm Самарий | 63 Eu Европий | 64 Gd Гадолиний | 65 Tb Тербий | 66 Dy Диспрозий | 67 Ho Гольмий | 68 Er Эрбий | 69 Tm Тулий | 70 Yb Иттербий | 71 Lu Лютеций | ||
| 90 Th Торий | 91 Pa Протактиний | 92 U Уран | 93 Np Нептуний | 94 Pu Плутоний | 95 Am Америций | 96 Cm Кюрий | 97 Bk Берклий | 98 Cf Калифорний | 99 Es Эйнштейний | 100 Fm Фермий | 101 Md Менделевий | 102 No Норбелий | 103 Lr Лоупенсий |
Цветовая легенда:
| Металлы | Полуметаллы | Неметаллы | ||||||||
| Щелочные м-лы(Li – Fr, Uue) | Щёлочноземельныем-лы (Be-Ra, Ubn) | Переходные металлы(Sc-Zn,Y-Cd,Hf-Hg,Rf-Cn) | Лантаноиды(La – Lu) | Актиноиды(Ac – Lr) | Постпереходные / лёгкие м-лы(Al-Tl,Uut,Sn,Pb,Fl,Bi,Uup,Lv) | Металлоиды(B,Si,Ge,As,Sb,Te,Po) | Халькогены(H,C,N,O,P,S,Se) | Галогены(F-At,Uus) | Инертные газы(He-Rn, Uuo) | Суперактиноиды(?) |
Примечание: Н/и – не известен (не найден, не открыт, не синтезирован)
Суперактино́иды (суперактини́ды, англ.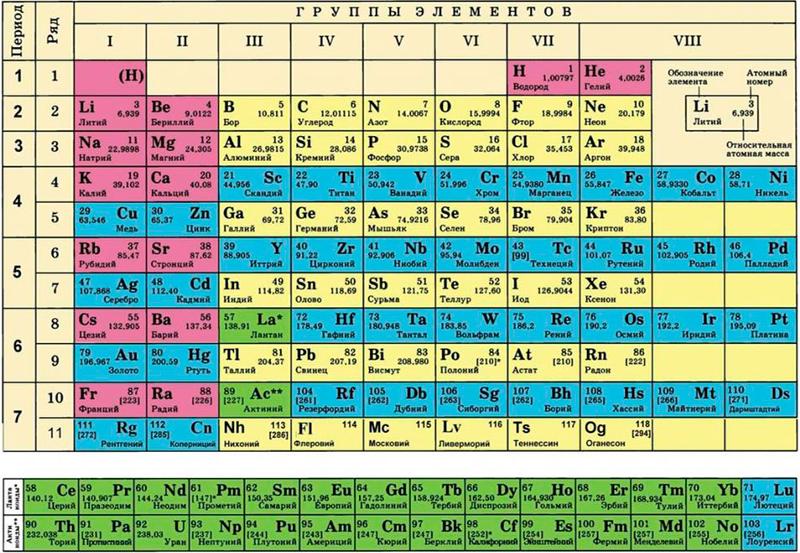 superactinide) — гипотетически возможные химические элементы
superactinide) — гипотетически возможные химические элементы
с атомными номерами 121 (унбиуний) — 153 (унпенттрий), у которых полностью заполнена 5g-оболочка.
Группа суперактиноидов следует после трансактиноидных элементов и располагается ниже группы
лантаноидов и актиноидов в расширенной периодической таблице элементов.
- WebElements Periodic Table: the periodic table on the web Удобная онлайн-таблица Менделеева.
Валентные элементы в группах
Нетрудно заметить, что внутри каждой группы элементы похожи друг на друга своими валентными электронами (электроны s и p-орбиталей, расположенных на внешнем энергетическом уровне).
У щелочных металлов – по 1 валентному электрону:
- Li – 1s22s1;
- Na – 1s22s22p63s1;
- K – 1s22s22p63s23p64s1
У щелочноземельных металлов – по 2 валентных электрона:
- Be – 1s22s2;
- Mg – 1s22s22p63s2;
- Ca – 1s22s22p63s23p64s2
У галогенов – по 7 валентных электронов:
- F – 1s22s22p5;
- Cl – 1s22s22p63s23p5;
- Br – 1s22s22p63s23p64s23d104p5
У инертных газов – по 8 валентных электронов:
- Ne – 1s22s22p6;
- Ar – 1s22s22p63s23p6;
- Kr – 1s22s22p63s23p64s23d104p6
Римский номер столбца группы – это количество валентных электронов у всех элементов данной группы. |
Дополнительную информацию см. в статье Валентность и в Таблице электронных конфигураций атомов химических элементов по периодам.
Обратим теперь свое внимание на элементы, расположенные в группах с символов В. Они расположены в центре периодической таблицы и называются переходными металлами
Отличительной особенностью этих элементов является присутствие в атомах электронов, заполняющих d-орбитали:
- Sc – 1s22s22p63s23p64s23d1;
- Ti – 1s22s22p63s23p64s23d2
Отдельно от основной таблицы расположены лантаноиды и актиноиды – это, так называемые, внутренние переходные металлы. В атомах этих элементов электроны заполняют f-орбитали:
- Ce – 1s22s22p63s23p64s23d104p64d105s25p64f15d16s2;
- Th – 1s22s22p63s23p64s23d104p64d105s25p64f145d106s26p66d27s2
Подробнее см. Атомы переходных элементов (металлов)…
Для подтверждения вышесказанного, предоставим слово самому Д. И. Менделееву.
«… Если же аналоги аргона вовсе не дают соединений, то очевидно, что нельзя включать ни одну из групп ранее известных элементов, и для них должно открыть особую группу нулевую … Это положение аргоновых аналогов в нулевой группе составляет строго логическое следствие понимания периодического закона, а потому (помещение в группе VIII явно не верно) принято не только мною, но и Браизнером, Пиччини и другими …
Теперь же, когда стало не подлежать ни малейшему сомнению, что перед той I группой, в которой должно помещать водород, существует нулевая группа, представители которой имеют веса атомов меньше, чем у элементов I группы, мне кажется невозможным отрицать существование элементов более лёгких, чем водород.
Из них обратим внимание сперва на элемент первого ряда 1-й группы. Его означим через «y»
Ему, очевидно, будут принадлежать коренные свойства аргоновых газов … «Короний», плотностью порядка 0,2 по отношению к водороду; и он не может быть ни коим образом мировым эфиром.
Этот элемент «у», однако, необходим для того, чтобы умственно подобраться к тому наиглавнейшему, а потому и наиболее быстро движущемуся элементу «х», который, по моему разумению, можно считать эфиром. Мне бы хотелось предварительно назвать его «Ньютонием» — в честь бессмертного Ньютона …
Задачу тяготения и задачи всей энергетики (!!! — В.Родионов) нельзя представить реально решёнными без реального понимания эфира, как мировой среды, передающей энергию на расстояния. Реального же понимания эфира нельзя достичь, игнорируя его химизм и не считая его элементарным веществом; элементарные же вещества ныне немыслимы без подчинения их периодической законности» («Попытка химического понимания мирового эфира». 1905 г., стр. 27).
1905 г., стр. 27).
«Эти элементы, по величине их атомных весов, заняли точное место между галлоидами и щелочными металлами, как показал Рамзай в 1900 году. Из этих элементов необходимо образовать особую нулевую группу, которую прежде всех в 1900 году признал Еррере в Бельгии.
Считаю здесь полезным присовокупить, что прямо судя по неспособности к соединениям элементов нулевой группы, аналогов аргона должно поставить раньше элементов 1 группы и по духу периодической системы ждать для них меньшего атомного веса, чем для щелочных металлов.
Это так и оказалось. А если так, то это обстоятельство, с одной стороны, служит подтверждением правильности периодических начал, а с другой стороны, ясно показывает отношение аналогов аргона к другим, ранее известным, элементам. Вследствие этого можно разбираемые начала прилагать ещё шире, чем ранее, и ждать элементов нулевого ряда с атомными весами гораздо меньшими, чем у водорода.
Таким образом, можно показать, что в первом ряду первым перед водородом существует элемент нулевой группы с атомным весом 0,4 (быть может, это короний Ионга), а в ряду нулевом, в нулевой группе — предельный элемент с ничтожно малым атомным весом, не способным к химическим взаимодействиям и обладающий вследствие того чрезвычайно быстрым собственным частичным (газовым) движением.
Эти свойства, быть может, должно приписать атомам всепроникающего (!!! — В.Родионов) мирового эфира. Мысль об этом указана мною в предисловии к этому изданию и в русской журнальной статье 1902 года …» («Основы химии». VIII изд., 1906 г., стр. 613 и след.)
Электронная периодическая таблица Д.И.Менделеева
В данной таблице обозначены группы элементов, периоды и ряды. Элементы в таблице цветные, где розовый – s-элементы; желтый – p-элементы; синий – d-элементы; зеленые – f-элементы.
* Чтобы узнать описание элемента, нажмите на него. Оранжевой рамкой выделены неметаллы.
| пери-оды | ряды | группы элементов | |||||||||||||
| I | II | III | IV | V | VI | VII | VIII | ||||||||
| a | b | a | b | a | b | a | b | a | b | a | b | a | b | b | a |
| 1 | 1 | ||||||||||||||
| 2 | 2 | ||||||||||||||
| 3 | 3 | ||||||||||||||
| 4 | 4 | ||||||||||||||
| 5 | |||||||||||||||
| 5 | 6 | ||||||||||||||
| 7 | |||||||||||||||
| 6 | 8 | ||||||||||||||
| 9 | |||||||||||||||
| 7 | 10 | ||||||||||||||
| высшие оксиды | |||||||||||||||
| летучие водородные соединения | |||||||||||||||
| лантаноиды | |||||||||||||||
| актиноиды | |||||||||||||||
Периодическая таблица Д.
 И. Менделеева:
И. Менделеева:Периодическая таблица Дмитрия Ивановича Менделеева является графическим представлением закона, описывающего повторяющееся изменение совокупности свойств химических элементов в зависимости от заряда ядер их атомов (говоря иначе – от конфигураций атомных электронных оболочек), открытого учёным в 1869 году.
@ https://www.youtube.com/watch?v=QJfuCZvqhRM
Изначальный вариант таблицы демонстрировал периодичность изменений свойств с ростом атомного веса (атомной массы) химических элементов. К настоящему моменту существует уже несколько сотен вариантов графического представления этого периодического закона, причём каждый из них подчёркивает специфическую схему периодичности изменения выбранных свойств элементов.
Внутренняя структура:
Наиболее часто таблица Дмитрия Ивановича Менделеева изображается в двумерном варианте, где каждый вертикальный столбец (его принято называть группой) определяет все основные физико-химические свойства включённых в него элементов. Горизонтальные же строки образуют т.н. периоды, внутри которых при взаимном сравнении также прослеживается подобие в изменении свойств включённых в строку-период элементов: открывается период типичным металлом, а заканчивается благородным газом через предшествующую ему череду элементов со всё более и более неметаллическими свойствами.
Согласно современным теориям строения атома (как самого ядра, так и его электронных оболочек), таблица Дмитрия Ивановича Менделеева демонстрирует периодичность свойств элементов, диктуемую последовательным (от низших к высшим) заполнением электронных оболочек атома. Тип и энергетическая последовательность этих оболочек определяются квантовомеханическими расчётами, а совокупность распределения всех электронов атома описывается т.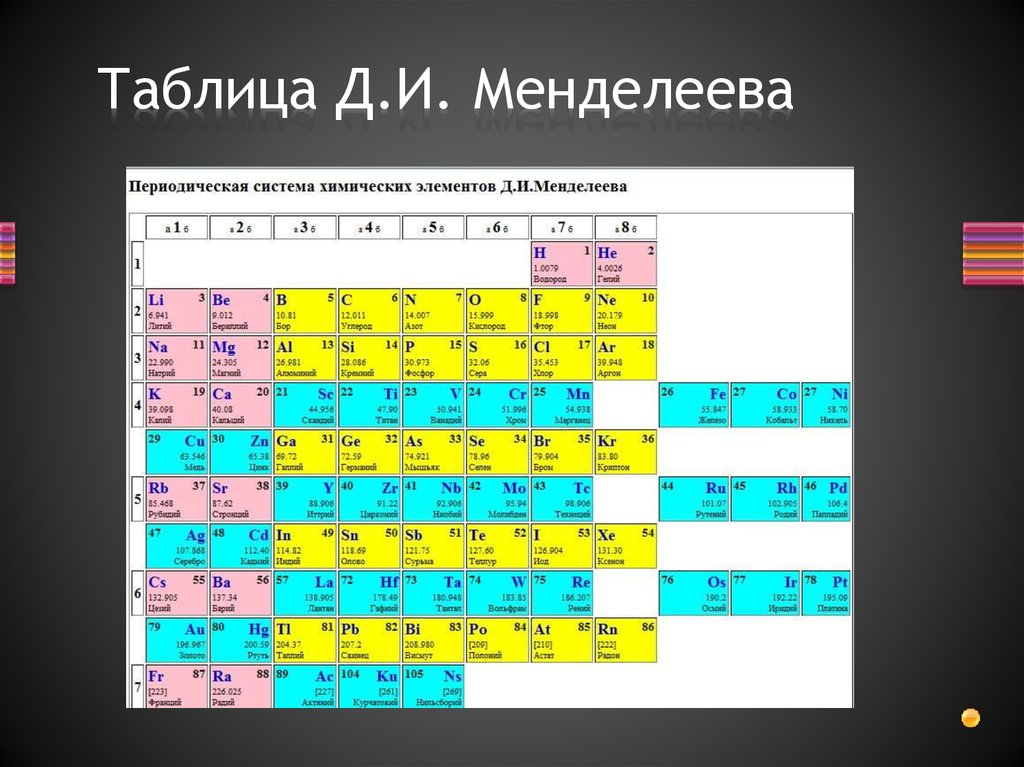 н. электронной конфигурацией – формулой, где указывается фактическое нахождение электронов на электронных оболочках атома химического элемента. Обычно только находящиеся на самых внешних (валентных) оболочках электроны участвуют в установлении связей между атомами, что определяет проявляющиеся химические свойства конкретного элемента.
н. электронной конфигурацией – формулой, где указывается фактическое нахождение электронов на электронных оболочках атома химического элемента. Обычно только находящиеся на самых внешних (валентных) оболочках электроны участвуют в установлении связей между атомами, что определяет проявляющиеся химические свойства конкретного элемента.
Различают следующие свойства химических элементов: металличность и неметалличность.
Металличность – способность отдавать свои электроны (характеризуется через потенциал ионизации и растёт в группе элементов периодической таблицы сверху вниз, а в периодах – справа налево).
Неметалличность – способность принимать чужие электроны (описывается через энергию сродства к электрону, возрастает в группе таблицы снизу вверх, а в периодах – слева направо).
Примечание: @ Видео https://www.youtube.com/watch?v=QJfuCZvqhRM
Водород
Многие химические элементы каждый по-своему удивителен и уникален. Например, уран способен к массовому разрушению, цезий (читайте о нем выше) имеет крутой эффект взрыва при контакте с водой, а галлий обладает очень низкой температурой плавления и не такой вредный, как ртуть.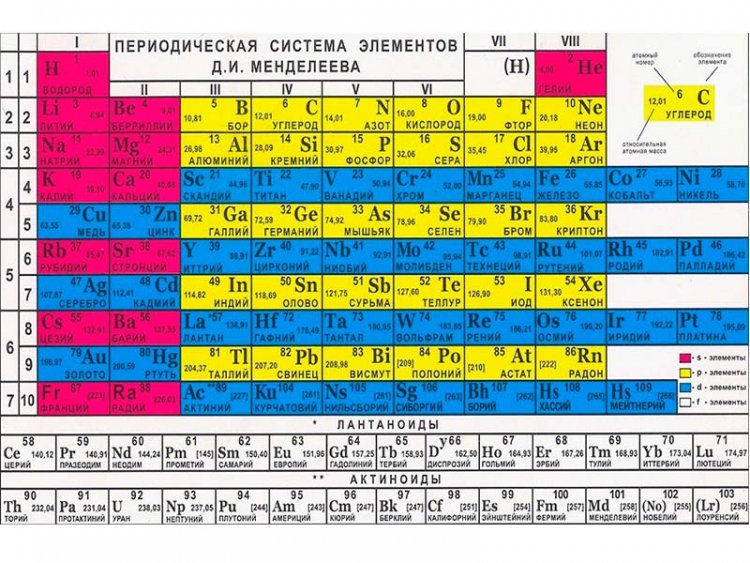
Но это всего лишь цветочки по сравнению с настоящим безумным элементом периодической таблицы Менделеева. Один элемент намного, намного более удивительный, чем любой в этой таблице, – речь идет о невероятном водороде. Вот лишь некоторые из уникальных свойств водорода.
Это основной компонент звезд во Вселенной – солнечных гигантских огненных шаров с невероятным количеством энергии. Вы только вдумайтесь: 0,0000066% энергии нашего Солнца питает всю Землю.
thoughtco.com
Водород стоит за созданием всех других элементов. Этот элемент самый распространенный во Вселенной. От всей барионной массы водород во Вселенной составляет 75 процентов. Звезды чаще всего состоят из водородной плазмы. По сути, без водорода не было бы ничего.
Вы наверняка еще со школы помните, что водород является компонентом воды. А вода именно та вещь, из чего состоят практически большинство всех живых существ на нашей планете.
Также некоторые спирты в значительной степени зависят от водорода. Да-да, речь идет о знакомом нам этаноле (алкоголе), который может затуманить нам мозг на какой-нибудь вечеринке.
Да-да, речь идет о знакомом нам этаноле (алкоголе), который может затуманить нам мозг на какой-нибудь вечеринке.
На самом деле есть безумное количество вещей, за которыми стоит водород. Включая каждого из нас. То есть без водорода не было бы и нас.
Хотите узнать, на что способен чистый водород? Тогда посмотрите на аварию дирижабля Гинденбург. Это была настоящая трагедия, виной которой был безумный водород.
Водород особняком стоит в периодической таблице химических элементов. Он изолирован от любого другого элемента и является единственным элементом, который не имеет ни одного нейтрона.
Если вы хотите игрушку, тогда используйте галлий. Это очень весело. Но если вы хотите почувствовать вкус настоящего безумия, ни один элемент не может быть более безумным, чем всем знакомый водород. Да, для всех нас водород – знакомый всем элемент, но это не меняет его свойства.
Да, для всех нас водород – знакомый всем элемент, но это не меняет его свойства.
Свойства таблицы Менделеева
Напомним, что группами называют вертикальные ряды в периодической системе и химические свойства элементов главных и побочных подгрупп значительно различаются.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
- усиливаются металлические свойства и ослабевают неметаллические;
- возрастает атомный радиус;
- возрастает сила образованных элементом оснований и бескислородных кислот;
- электроотрицательность падает.
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения, существует всего восемь форм кислородных соединений. В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где символом R обозначают элемент данной группы. Формулы высших оксидов относятся ко всем элементам группы, кроме исключительных случаев, когда элементы не проявляют степени окисления, равной номеру группы (например, фтор).
Формулы высших оксидов относятся ко всем элементам группы, кроме исключительных случаев, когда элементы не проявляют степени окисления, равной номеру группы (например, фтор).
Оксиды состава R2O проявляют сильные основные свойства, причём их основность возрастает с увеличением порядкового номера, оксиды состава RO (за исключением BeO) проявляют основные свойства. Оксиды состава RO2, R2O5, RO3, R2O7 проявляют кислотные свойства, причём их кислотность возрастает с увеличением порядкового номера.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют четыре формы таких соединений. Их располагают под элементами главных подгрупп и изображают общими формулами в последовательности RH4, RH3, RH2, RH.
Соединения RH4 имеют нейтральный характер; RH3 — слабоосновный; RH2 — слабокислый; RH — сильнокислый характер.
Напомним, что периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров.
В пределах периода с увеличением порядкового номера элемента:
- электроотрицательность возрастает;
- металлические свойства убывают, неметаллические возрастают;
- атомный радиус падает.
История создания таблицы
Менделеев не был первым ученым, который решил структурировать элементы. Пытались многие. Вот только никто не мог сопоставить все в одной слаженной таблице. Датой открытия периодического закона мы можем назвать 17 февраля 1869 года. В этот день Менделеев показал свое творение – целую систему элементов, упорядоченных на основе атомного веса и химических особенностях.
Стоит отметить, что гениальная мысль не пришла ученому в один удачный вечер во время работы. Он действительно трудился около 20 лет. Снова и снова перебирал карточки с элементами, изучал их характеристики. В это же время трудились и другие ученые.
Химик Канниццаро предложил от своего имени теорию атомного веса. Он утверждал, что именно эти данные могут построить все вещества в нужном порядке. Дальше ученые Шантуркуа и Ньюлендс, работая в разных точках мира, пришли к умозаключению, что размещая элементы по атомному весу, они начинают дополнительно объединяться и по другим свойствам.
Математическая карта
Во многих случаях в истории науки великие предсказания, основанные на новых уравнениях, оказывались верными. Каким-то образом математика раскрывает некоторые природные секреты, прежде чем экспериментаторы их обнаружат. Один из примеров — антиматерия, другой — расширение Вселенной. В случае Менделеева, предсказания новых элементов возникли без какой-либо творческой математики. Но на самом деле Менделеев открыл глубокую математическую карту природы, поскольку его таблица отражала значение квантовой механики, математических правил, управляющих атомной архитектурой.
В своей книге Менделеев отметил, что «внутренние различия материи, которую составляют атомы», могут быть ответственны за периодически повторяющиеся свойства элементов. Но он не придерживался этой линии мышления. По сути, многие годы он размышлял о том, насколько важна атомная теория для его таблицы.
Но он не придерживался этой линии мышления. По сути, многие годы он размышлял о том, насколько важна атомная теория для его таблицы.
Но другие смогли прочитать внутреннее послание таблицы. В 1888 году немецкий химик Йоханнес Вислицен объявил, что периодичность свойств элементов, упорядоченных по массе, указывает на то, что атомы состоят из регулярных групп более мелких частиц. Таким образом, в некотором смысле таблица Менделеева действительно предвидела (и предоставила доказательства) сложную внутреннюю структуру атомов, в то время как никто не имел ни малейшего представления о том, как на самом деле выглядел атом или имел ли он какую-нибудь внутреннюю структуру вовсе.
К моменту смерти Менделеева в 1907 году ученые знали, что атомы делятся на части: электроны, переносящие отрицательный электрический заряд, плюс некоторый положительно заряженный компонент, делающий атомы электрически нейтральными. Ключом к тому, как эти части выстраиваются, стало открытие 1911 года, когда физик Эрнест Резерфорд, работающий в Манчестерском университете в Англии, обнаружил атомное ядро. Вскоре после этого Генри Мозли, работавший с Резерфордом, продемонстрировал, что количество положительного заряда в ядре (число протонов, которое он содержит, или его «атомное число») определяет правильный порядок элементов в периодической таблице.
Вскоре после этого Генри Мозли, работавший с Резерфордом, продемонстрировал, что количество положительного заряда в ядре (число протонов, которое он содержит, или его «атомное число») определяет правильный порядок элементов в периодической таблице.
Генри Мозли.
Атомная масса была тесно связана с атомным числом Мозли — достаточно тесно, чтобы упорядочение элементов по массе только в нескольких местах отличалось от упорядочения по числу. Менделеев настаивал на том, что эти массы были неправильными и нуждались в повторном измерении, и в некоторых случаях оказался прав. Осталось несколько расхождений, но атомное число Мозли прекрасно легло в таблицу.
Примерно в то же время датский физик Нильс Бор понял, что квантовая теория определяет расположение электронов, окружающих ядро, и что самые дальние электроны определяют химические свойства элемента.
Подобные расположения внешних электронов будут периодически повторяться, объясняя закономерности, которые первоначально выявила таблица Менделеева. Бор создал свою собственную версию таблицы в 1922 году, основываясь на экспериментальных измерениях энергий электронов (наряду с некоторыми подсказками из периодического закона).
Бор создал свою собственную версию таблицы в 1922 году, основываясь на экспериментальных измерениях энергий электронов (наряду с некоторыми подсказками из периодического закона).
Таблица Бора добавила элементы, открытые с 1869 года, но это был тот же периодической порядок, открытый Менделеевым. Не имея ни малейшего представления о квантовой теории, Менделеев создал таблицу, отражающую атомную архитектуру, которую диктовала квантовая физика.
Новая таблица Бора не стала ни первым, ни последним вариантом изначального дизайна Менделеева. Сотни версий периодической таблицы с тех пор были разработаны и опубликованы. Современная форма — в горизонтальном дизайне в отличие от первоначальной вертикальной версии Менделеева — стала широко популярной только после Второй мировой войны, во многом благодаря работе американского химика Гленна Сиборга.
Сиборг и его коллеги создали несколько новых элементов синтетически, с атомными числами после урана, последнего природного элемента в таблице.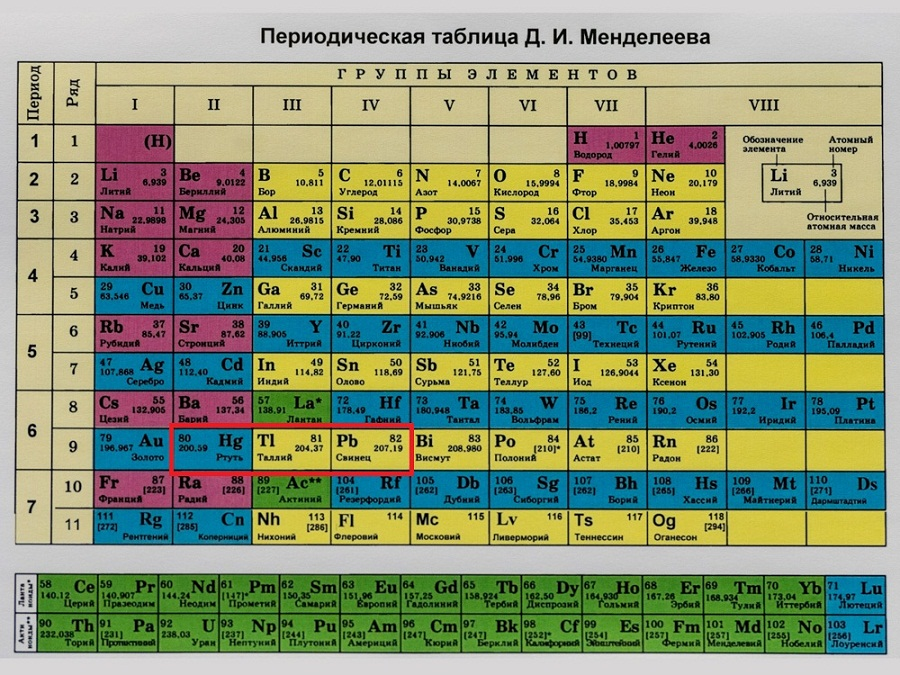 Сиборг увидел, что эти элементы, трансурановые (плюс три элемента, предшествовавшие урану), требовали новой строки в таблице, которую не предвидел Менделеев. Таблица Сиборга добавила строку для тех элементов под аналогичным рядом редкоземельных элементов, которым тоже не было места в таблице.
Сиборг увидел, что эти элементы, трансурановые (плюс три элемента, предшествовавшие урану), требовали новой строки в таблице, которую не предвидел Менделеев. Таблица Сиборга добавила строку для тех элементов под аналогичным рядом редкоземельных элементов, которым тоже не было места в таблице.
Вклад Сиборг в химию принес ему честь назвать собственный элемент — сиборгий с номером 106. Это один из нескольких элементов, названных в честь известных ученых. И в этом списке, конечно, есть элемент 101, открытый Сиборгом и его коллегами в 1955 году и названный менделевием — в честь химика, который прежде всех остальных заслужил место в периодической таблице.
Заходите на наш канал с новостями, если хотите больше подобных историй.
«Спокойная» эволюция звезд
Реакции термоядерного синтеза — не единственные процессы изменения ядерного состава. Одновременно с ними в массивных звездах и (в несколько меньшей степени) в звездах промежуточных масс происходит еще один важнейший процесс — захват ядрами свободных нейтронов. Появление свободных нейтронов становится возможным благодаря CNO-циклу, точнее, ядрам 13C и 14N, которые синтезируются в ходе этого цикла и также вольны захватывать альфа-частицы. Ядро углерода-13, захватив альфа-частицу, превращается в ядро кислорода-16 и свободный нейтрон; ядро азота-14 через чуть более длинную цепочку нескольких захватов альфа-частицы превращается в магний-25 и свободный нейтрон. Далее эти свободные нейтроны могут поглощаться другими ядрами.
Появление свободных нейтронов становится возможным благодаря CNO-циклу, точнее, ядрам 13C и 14N, которые синтезируются в ходе этого цикла и также вольны захватывать альфа-частицы. Ядро углерода-13, захватив альфа-частицу, превращается в ядро кислорода-16 и свободный нейтрон; ядро азота-14 через чуть более длинную цепочку нескольких захватов альфа-частицы превращается в магний-25 и свободный нейтрон. Далее эти свободные нейтроны могут поглощаться другими ядрами.
Процесс захвата нейтронов, происходящий во время «спокойной» эволюции звезд промежуточных и больших масс, называется медленным (slow), или просто s-процессом []. Суть его состоит в том, что ядро последовательно захватывает один или несколько нейтронов, превращаясь во все более тяжелые изотопы того же химического элемента. Захват продолжается до тех пор, пока в этой цепочке не встретится нестабильное ядро. Процесс называется медленным, потому что ядро успевает испытать бета-распад, прежде чем поглотит следующий нейтрон. Испускание электрона увеличивает заряд ядра на единицу, и оно перемещается в следующую ячейку таблицы Менделеева — образуется ядро следующего химического элемента. Хотя s-процесс вносит определенный вклад и в синтез элементов легче железа, за пределами железного пика он становится основным производителем стабильных ядер (рис. 5).
Испускание электрона увеличивает заряд ядра на единицу, и оно перемещается в следующую ячейку таблицы Менделеева — образуется ядро следующего химического элемента. Хотя s-процесс вносит определенный вклад и в синтез элементов легче железа, за пределами железного пика он становится основным производителем стабильных ядер (рис. 5).
Медленный захват нейтронов, очевидно, способен производить только стабильные ядра, и потому его вклад в заполнение Периодической таблицы ограничен висмутом-209 (209Bi) — самым массивным стабильным ядром. Точнее, это ядро уже обладает радиоактивностью, но время его жизни на много порядков превышает возраст Вселенной. Альтернативой s-процессу является быстрый (rapid) захват нейтронов, или просто r-процесс. При высокой плотности вещества вообще (и нейтронов в частности) ядро успевает поглотить несколько нейтронов, даже если промежуточные ядра оказываются неустойчивыми. Исключительно благодаря r-процессу появляются на свет тяжелые ядра, богатые нейтронами и населяющие Периодическую таблицу за висмутом.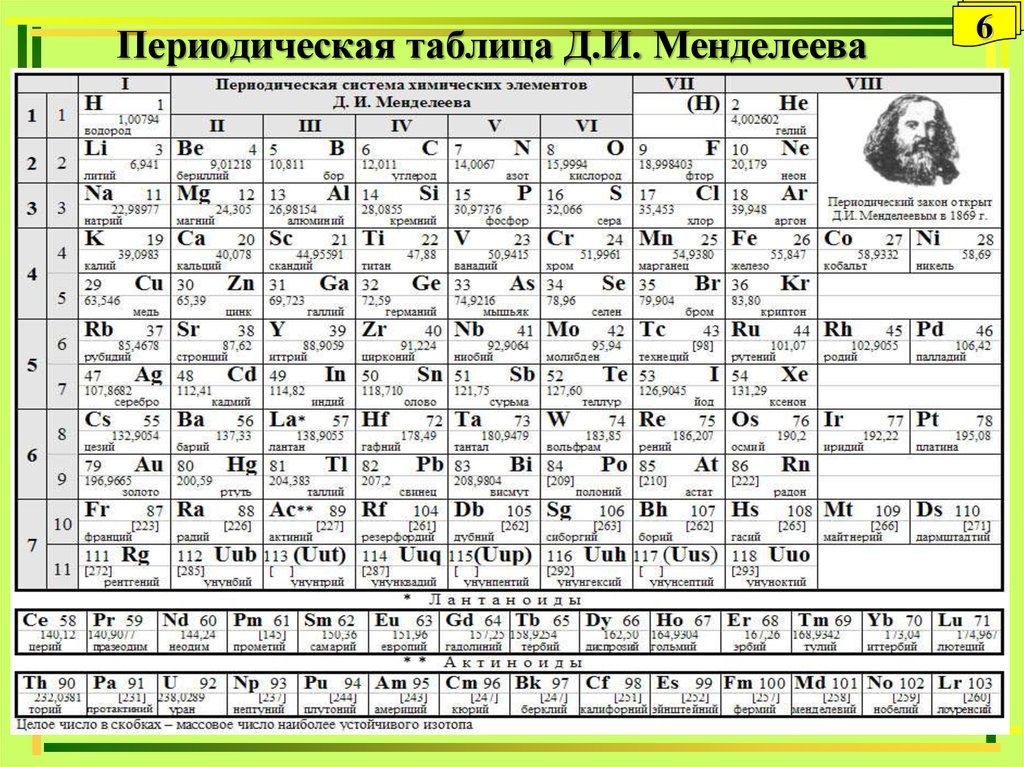 Относительная роль медленного и быстрого захвата нейтронов в синтезе более легких, чем висмут, элементов остается предметом дискуссий.
Относительная роль медленного и быстрого захвата нейтронов в синтезе более легких, чем висмут, элементов остается предметом дискуссий.
Не вполне ясно также, где именно происходит r-процесс. Долгое время основным плацдармом для него считались взрывы, сопровождающие финальный коллапс массивных звезд (рис. 6). Спокойная эволюция массивной звезды закачивается, когда в ее центре образуется железо-никелевое ядро. В нем выделения энергии уже не происходит, давление перестает противостоять гравитации, и звезда начинает схлопываться под собственным весом. Каким-то образом (каким, окончательно пока не ясно) энергия падения вещества преобразуется в энергию его разлета — происходит вспышка сверхновой. Разрушение звезды сопровождается новым всплеском ядерных реакций, среди которых есть и захват альфа-частиц, и захват нейтронов. Все продукты ядерного и термоядерного нуклеосинтеза, возникшие как в ходе эволюции звезды, так и в ходе самого взрыва, разбрасываются вспышкой сверхновой на большие расстояния, становясь частью межзвездного вещества и попадая впоследствии во вновь формирующиеся звезды и планеты (рис. 7). Источником нейтронов в этом случае становится процесс «вдавливания» электронов в протоны, возможный благодаря высокой плотности и температуре в миллиарды градусов. Из этих нейтронов формируется и остающаяся после вспышки нейтронная звезда.
7). Источником нейтронов в этом случае становится процесс «вдавливания» электронов в протоны, возможный благодаря высокой плотности и температуре в миллиарды градусов. Из этих нейтронов формируется и остающаяся после вспышки нейтронная звезда.
Помимо сверхновых с коллапсом ядра имеется явление, стимулирующее протекание реакций быстрого захвата нейтронов (возможно, более перспективное, чем сверхновые), — слияние нейтронных звезд. Такие события могут происходить в случае, когда две нейтронные звезды образуют двойную систему. Излучение гравитационных волн в такой системе приводит к постепенному сближению компонентов, заканчивающемуся их слиянием. Места во Вселенной с большим содержанием нейтронов, чем в паре нейтронных звезд, не найти, и потому логично предположить, что эффективный r-процесс будет важным компонентом этого события []. В 2017 г. эта версия получила первую наблюдательную проверку. Всплеск гравитационных волн 17 августа 2017 г. предположительно был порожден именно слиянием нейтронных звезд, и в его спектре удалось зафиксировать признаки линий теллура и цезия — элементов, преимущественно синтезируемых именно в r-процессе [].
То, что сейчас преподносят в школах и университетах под названием «Периодическая система химических элементов Д.И. Менделеева»,- откровенная ф а л ь ш и в к а .
Последний раз в неискажённом виде настоящая Таблица Менделеева увидела свет в 1906 году в Санкт-Петербурге (учебник «Основы химии», VIII издание). И только спустя 96 лет забвения подлинная Таблица Менделеева впервые восстаёт из пепла благодаря публикации диссертации в журнале ЖРФМ Русского Физического Общества.
После скоропостижной смерти Д. И. Менделеева и ухода из жизни его верных научных коллег по Русскому Физико-Химическому Обществу, впервые поднял руку на бессмертное творение Менделеева — сын друга и соратника Д. И. Менделеева по Обществу — Борис Николаевич Меншуткин.
Конечно, Меншуткин действовал не в одиночку, — он лишь выполнял заказ. Ведь, новая парадигма релятивизма требовала отказа от идеи мирового эфира; и потому это требование было возведено в ранг догмы, а труд Д. И. Менделеева был фальсифицирован.
Главное искажение Таблицы — перенос «нулевой группы» Таблицы в её конец, вправо, и введение т.н. «периодов». Подчёркиваем, что такая (лишь на первый взгляд — безобидная) манипуляция логически объяснима только как сознательное устранение главного методологического звена в открытии Менделеева: периодическая система элементов в своём начале, истоке, т.е. в верхнем левом углу Таблицы, должна иметь нулевую группу и нулевой ряд, где располагается элемент «Х» (по Менделееву — «Ньютоний»),- т.е. мировой эфир.
Более того, являясь единственным системообразующим элементом всей Таблицы производных элементов, этот элемент «Х» есть аргумент всей Таблицы Менделеева. Перенос же нулевой группы Таблицы в её конец уничтожает саму идею этой первоосновы всей системы элементов по Менделееву.
Список химических элементов Таблицы Менделеева
Список химических элементов упорядочен в порядке возрастания атомных номеров, приводятся обозначения элемента в Таблице Менделеева, латинское и русское названия.
| Z | Символ | Name | Название |
| 1 | H | Hydrogen | Водород |
| 2 | He | Helium | Гелий |
| 3 | Li | Lithium | Литий |
| 4 | Be | Beryllium | Бериллий |
| 5 | B | Boron | Бор |
| 6 | C | Carbon | Углерод |
| 7 | N | Nitrogen | Азот |
| 8 | O | Oxygen | Кислород |
| 9 | F | Fluorine | Фтор |
| 10 | Ne | Neon | Неон |
| 11 | Na | Sodium | Натрий |
| 12 | Mg | Magnesium | Магний |
| 13 | Al | Aluminium | Алюминий |
| 14 | Si | Silicon | Кремний |
| 15 | P | Phosphorus | Фосфор |
| 16 | S | Sulfur | Сера |
| 17 | Cl | Chlorine | Хлор |
| 18 | Ar | Argon | Аргон |
| 19 | K | Potassium | Калий |
| 20 | Ca | Calcium | Кальций |
| 21 | Sc | Scandium | Скандий |
| 22 | Ti | Titanium | Титан |
| 23 | V | Vanadium | Ванадий |
| 24 | Cr | Chromium | Хром |
| 25 | Mn | Manganese | Марганец |
| 26 | Fe | Iron | Железо |
| 27 | Co | Cobalt | Кобальт |
| 28 | Ni | Nickel | Никель |
| 29 | Cu | Copper | Медь |
| 30 | Zn | Zinc | Цинк |
| 31 | Ga | Gallium | Галлий |
| 32 | Ge | Germanium | Германий |
| 33 | As | Arsenic | Мышьяк |
| 34 | Se | Selenium | Селен |
| 35 | Br | Bromine | Бром |
| 36 | Kr | Krypton | Криптон |
| 37 | Rb | Rubidium | Рубидий |
| 38 | Sr | Strontium | Стронций |
| 39 | Y | Yttrium | Иттрий |
| 40 | Zr | Zirconium | Цирконий |
| 41 | Nb | Niobium | Ниобий |
| 42 | Mo | Molybdenum | Молибден |
| 43 | Tc | Technetium | Технеций |
| 44 | Ru | Ruthenium | Рутений |
| 45 | Rh | Rhodium | Родий |
| 46 | Pd | Palladium | Палладий |
| 47 | Ag | Silver | Серебро |
| 48 | Cd | Cadmium | Кадмий |
| 49 | In | Indium | Индий |
| 50 | Sn | Tin | Олово |
| 51 | Sb | Antimony | Сурьма |
| 52 | Te | Tellurium | Теллур |
| 53 | I | Iodine | Иод |
| 54 | Xe | Xenon | Ксенон |
| 55 | Cs | Caesium | Цезий |
| 56 | Ba | Barium | Барий |
| 57 | La | Lanthanum | Лантан |
| 58 | Ce | Cerium | Церий |
| 59 | Pr | Praseodymium | Празеодим |
| 60 | Nd | Neodymium | Неодим |
| 61 | Pm | Promethium | Прометий |
| 62 | Sm | Samarium | Самарий |
| 63 | Eu | Europium | Европий |
| 64 | Gd | Gadolinium | Гадолиний |
| 65 | Tb | Terbium | Тербий |
| 66 | Dy | Dysprosium | Диспрозий |
| 67 | Ho | Holmium | Гольмий |
| 68 | Er | Erbium | Эрбий |
| 69 | Tm | Thulium | Тулий |
| 70 | Yb | Ytterbium | Иттербий |
| 71 | Lu | Lutetium | Лютеций |
| 72 | Hf | Hafnium | Гафний |
| 73 | Ta | Tantalum | Тантал |
| 74 | W | Tungsten | Вольфрам |
| 75 | Re | Rhenium | Рений |
| 76 | Os | Osmium | Осмий |
| 77 | Ir | Iridium | Иридий |
| 78 | Pt | Platinum | Платина |
| 79 | Au | Gold | Золото |
| 80 | Hg | Mercury | Ртуть |
| 81 | Tl | Thallium | Таллий |
| 82 | Pb | Lead | Свинец |
| 83 | Bi | Bismuth | Висмут |
| 84 | Po | Polonium | Полоний |
| 85 | At | Astatine | Астат |
| 86 | Rn | Radon | Радон |
| 87 | Fr | Francium | Франций |
| 88 | Ra | Radium | Радий |
| 89 | Ac | Actinium | Актиний |
| 90 | Th | Thorium | Торий |
| 91 | Pa | Protactinium | Протактиний |
| 92 | U | Uranium | Уран |
| 93 | Np | Neptunium | Нептуний |
| 94 | Pu | Plutonium | Плутоний |
| 95 | Am | Americium | Америций |
| 96 | Cm | Curium | Кюрий |
| 97 | Bk | Berkelium | Берклий |
| 98 | Cf | Californium | Калифорний |
| 99 | Es | Einsteinium | Эйнштейний |
| 100 | Fm | Fermium | Фермий |
| 101 | Md | Mendelevium | Менделевий |
| 102 | No | Nobelium | Нобелий |
| 103 | Lr | Lawrencium | Лоуренсий |
| 104 | Rf | Rutherfordium | Резерфордий |
| 105 | Db | Dubnium | Дубний |
| 106 | Sg | Seaborgium | Сиборгий |
| 107 | Bh | Bohrium | Борий |
| 108 | Hs | Hassium | Хассий |
| 109 | Mt | Meitnerium | Мейтнерий |
| 110 | Ds | Darmstadtium | Дармштадтий |
| 111 | Rg | Roentgenium | Рентгений |
| 112 | Cn | Copernicium | Коперниций |
| 113 | Nh | Nihonium | Нихоний |
| 114 | Fl | Flerovium | Флеровий |
| 115 | Mc | Moscovium | Московий |
| 116 | Lv | Livermorium | Ливерморий |
| 117 | Ts | Tennessine | Теннесин |
| 118 | Og | Oganesson | Оганессон |
Длиннопериодная форма таблицы Менделеева
Именно нечто подобное и было создано Дмитрием Ивановичем Менделеевым. Именно такой вариант таблицы наиболее наглядно иллюстрирует периодический закон. К сожалению, у длиннопериодной формы есть один недостаток: таблица занимает слишком много места. Именно поэтому многие отдают предпочтение короткопериодной форме.
Именно такой вариант таблицы наиболее наглядно иллюстрирует периодический закон. К сожалению, у длиннопериодной формы есть один недостаток: таблица занимает слишком много места. Именно поэтому многие отдают предпочтение короткопериодной форме.
|   | IA | IIA | IIIB |   | IVB | VB | VIB | VIIB |   VIIIB | IB | IIB | IIIA | IVA | VA | VIA | VIIA | VIIIA | |||||||||||||||
| 1 | 1 H |   | 1H | 2He | ||||||||||||||||||||||||||||
| 2 | 3Li | 4Be |   | 5B | 6C | 7N | 9F | 10Ne | ||||||||||||||||||||||||
| 3 | 11Na | 12Mg |   | 13Al | 14Si | 15P | 16S | 17Cl | 18Ar | |||||||||||||||||||||||
| 4 | 19K | 20Ca | 21Sc |   | 22Ti | 23V | 24Cr | 25Mn | 26Fe | 27Co | 28Ni | 29Cu | 30Zn | 31Ga | 32Ge | 33As | 34Se | 35Br | 36Kr | |||||||||||||
| 5 | 37Rb | 38Sr | 39Y |   | 40Zr | 41Nb | 42Mo | 43Tc | 44Ru | 45Rh | 46Pd | 47Ag | 48Cd | 49In | 50Sn | 51Sb | 52Te | 53I | 54Xe | |||||||||||||
| 6 | 55Cs | 56Ba | 57La | 58Ce | 59Pr | 60Nd | 61Pm | 62Sm | 63Eu | 64Gd | 65Tb | 66Dy | 67Ho | 68Er | 69Tm | 70Yb | 71Lu | 72Hf | 73Ta | 74W | 75Re | 76Os | 77Ir | 78Pt | 79Au | 80Hg | 81Tl | 82Pb | 83Bi | 84Po | 85At | 86Rn |
| 7 | 87Fr | 88Ra | 89Ac | 90Th | 91Pa | 92U | 93Np | 94Pu | 95Am | 96Cm | 97Bk | 98Cf | 99Es | 100Fm | 101Md | 102No | 103Lr | 104Ku | 105Ns | 106 | 107 | 108 | 109 | 110 | 111 | 112 | 113 | 114 | 115 | 116 | 117 | 118 |
А>
Сколько элементов в таблице Менделеева
Каждый человек хотя бы раз в жизни видел эту таблицу. Но вот назвать точное количество веществ сложно. Правильных ответов может быть два: 118 и 126. Сейчас мы разберемся, почему так.
Но вот назвать точное количество веществ сложно. Правильных ответов может быть два: 118 и 126. Сейчас мы разберемся, почему так.
В природе люди обнаружили 94 элемента. Они ничего с ними не делали. Только изучали их свойства и особенности. Большая часть из них была в первоначальной периодической таблице.
Другие 24 элемента были созданы в лабораториях. Всего получается 118 штук. Еще 8 элементов являются лишь гипотетическими вариантами. Их пытаются изобрести или получить. Так что на сегодняшний день и вариант с 118 элементами, и с 126 элементами можно смело называть.
Описание элементов таблицы менделеева – Telegraph
Описание элементов таблицы менделееваСкачать файл – Описание элементов таблицы менделеева
Характеристика химических элементов малых периодов по их месту в периодической системе и строению атома. Зная формулировка периодического закона и используя периодическую систему элементов Д. Менделеева, можно дать характеристику любому химическому элементу и его соединениям. Такую характеристику химического элемента удобно складывать по плану. Формулы высшего оксида и гидроксида химического элемента, характеристика их свойств основные, кислотные или амфотерные. Сравнение металлических или неметаллических свойств химического элемента со свойствами элементов-соседей по периоду и подгруппой. Например, предоставим характеристику химического элемента с порядковым номером 15 и его соединениям по положению в периодической системе элементов Д. Менделеева и строению атома. Находим в таблице Д. Менделеева клетку с номером химического элемента, записываем его символ и название. Охарактеризуем положение элемента в таблице Д. Менделеева номер периода, группы, тип подгруппы. Предоставим общую характеристику состава атома химического элемента заряд ядра, атомная масса, число протонов, нейтронов, электронов и электронных уровней. Относительная атомная масса фосфора равна Атом фосфора имеет три энергетических уровня, на которых находятся 15 электронов. Составляем электронной и электронно-графическую формулы атома, отмечаем его валентные электроны.
Такую характеристику химического элемента удобно складывать по плану. Формулы высшего оксида и гидроксида химического элемента, характеристика их свойств основные, кислотные или амфотерные. Сравнение металлических или неметаллических свойств химического элемента со свойствами элементов-соседей по периоду и подгруппой. Например, предоставим характеристику химического элемента с порядковым номером 15 и его соединениям по положению в периодической системе элементов Д. Менделеева и строению атома. Находим в таблице Д. Менделеева клетку с номером химического элемента, записываем его символ и название. Охарактеризуем положение элемента в таблице Д. Менделеева номер периода, группы, тип подгруппы. Предоставим общую характеристику состава атома химического элемента заряд ядра, атомная масса, число протонов, нейтронов, электронов и электронных уровней. Относительная атомная масса фосфора равна Атом фосфора имеет три энергетических уровня, на которых находятся 15 электронов. Составляем электронной и электронно-графическую формулы атома, отмечаем его валентные электроны. Электронная формула атома фосфора: Электронно-графическая формула внешнего уровня атома фосфора: Поскольку в последнее подуровнем в атоме фосфора, который заполняется электронами, является p-подуровень, Фосфор относится к семейству p-элементов. Составляем формулы высшего оксида и гидроксида фосфора и характеризуем их свойства основные, кислотные или амфотерные. Высший оксид фосфора P 2 O 5 , проявляет свойства кислотного оксида. Гидроксид, соответствующий высшему оксиду, H 3 PO 4 , проявляет свойства кислоты. Подтвердим указанные свойства уравнениями видповиних химических реакций:. Сравним неметаллические свойства фосфора со свойствами элементов-соседей по периоду и подгруппой. Соседом фосфора по подгруппе являются азот. Соседями фосфора за периодом является кремний и Сера. Неметаллические свойства атомов химических элементов главных подгрупп с ростом порядкового номера растут в периодах и снижаются в группах. Поэтому неметаллические свойства фосфора более выражены, чем у кремния и менее выражены, чем у азота и серы.
Электронная формула атома фосфора: Электронно-графическая формула внешнего уровня атома фосфора: Поскольку в последнее подуровнем в атоме фосфора, который заполняется электронами, является p-подуровень, Фосфор относится к семейству p-элементов. Составляем формулы высшего оксида и гидроксида фосфора и характеризуем их свойства основные, кислотные или амфотерные. Высший оксид фосфора P 2 O 5 , проявляет свойства кислотного оксида. Гидроксид, соответствующий высшему оксиду, H 3 PO 4 , проявляет свойства кислоты. Подтвердим указанные свойства уравнениями видповиних химических реакций:. Сравним неметаллические свойства фосфора со свойствами элементов-соседей по периоду и подгруппой. Соседом фосфора по подгруппе являются азот. Соседями фосфора за периодом является кремний и Сера. Неметаллические свойства атомов химических элементов главных подгрупп с ростом порядкового номера растут в периодах и снижаются в группах. Поэтому неметаллические свойства фосфора более выражены, чем у кремния и менее выражены, чем у азота и серы. Максимальный положительный степень окисления для химических элементов главных подгрупп равен номеру группы. Минимальная степень окисления для неметаллов в большинстве случаев равен разнице между номером группы и числом восемь. Так, минимальная степень окисления фосфора Главная Химия Характеристика химических элементов. Нажмите, чтобы отменить ответ. Русский язык Обществознание Алгебра Геометрия Физика Информатика Астрономия Биология Всемирная география История Химия Естествознание. Копирование материалов разрешается только при указании активной ссылки на источник Двойкам-нет.
Максимальный положительный степень окисления для химических элементов главных подгрупп равен номеру группы. Минимальная степень окисления для неметаллов в большинстве случаев равен разнице между номером группы и числом восемь. Так, минимальная степень окисления фосфора Главная Химия Характеристика химических элементов. Нажмите, чтобы отменить ответ. Русский язык Обществознание Алгебра Геометрия Физика Информатика Астрономия Биология Всемирная география История Химия Естествознание. Копирование материалов разрешается только при указании активной ссылки на источник Двойкам-нет.
Периодическая таблица химических элементов Д.И.Менделеева
Список химических элементов упорядочен в порядке возрастания атомных номеров с возможностью сортировки по другим параметрам. В таблице приводятся название химического элемента, используемый для его обозначения символ признанный Международным союзом теоретической и прикладной химии , группа и период в Периодической системе химических элементов , относительная атомная масса элемента с учётом их природной процентной распространённости в земной коре и атмосфере ; а также плотность, температура плавления, температура кипения простого вещества , и год открытия, фамилия первооткрывателя. Цвета строк отвечают семействам элементов:. Дальше – смотрите по атомному номеру Расширенная периодическая таблица элементов. Элемент с порядковым номером – носит название Biunoctium. Материал из Википедии — свободной энциклопедии. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии , проверенной 20 февраля ; проверки требуют 4 правки. Цвета строк отвечают семействам элементов: Химические элементы Списки химических элементов. Информационные списки Статьи с утверждениями без значимости Википедия: Нет источников с августа Википедия: Статьи без источников тип: Статьи с утверждениями без источников более 14 дней. Навигация Персональные инструменты Вы не представились системе Обсуждение Вклад Создать учётную запись Войти. Пространства имён Статья Обсуждение. Просмотры Читать Текущая версия Править Править вики-текст История. Эта страница последний раз была отредактирована 21 июня в Текст доступен по лицензии Creative Commons Attribution-ShareAlike ; в отдельных случаях могут действовать дополнительные условия.
Цвета строк отвечают семействам элементов:. Дальше – смотрите по атомному номеру Расширенная периодическая таблица элементов. Элемент с порядковым номером – носит название Biunoctium. Материал из Википедии — свободной энциклопедии. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии , проверенной 20 февраля ; проверки требуют 4 правки. Цвета строк отвечают семействам элементов: Химические элементы Списки химических элементов. Информационные списки Статьи с утверждениями без значимости Википедия: Нет источников с августа Википедия: Статьи без источников тип: Статьи с утверждениями без источников более 14 дней. Навигация Персональные инструменты Вы не представились системе Обсуждение Вклад Создать учётную запись Войти. Пространства имён Статья Обсуждение. Просмотры Читать Текущая версия Править Править вики-текст История. Эта страница последний раз была отредактирована 21 июня в Текст доступен по лицензии Creative Commons Attribution-ShareAlike ; в отдельных случаях могут действовать дополнительные условия. Свяжитесь с нами Политика конфиденциальности Описание Википедии Отказ от ответственности Разработчики Соглашение о cookie Мобильная версия. Другие неметаллы я VI группа — халькогены. Локьер , Жансен в спектре Солнца , Рамзай на Земле. Костер и де Хевеши. Ноддак , Такке и Берг. Мария и Пьер Кюри. Содди , Кранстон и Ган.
Свяжитесь с нами Политика конфиденциальности Описание Википедии Отказ от ответственности Разработчики Соглашение о cookie Мобильная версия. Другие неметаллы я VI группа — халькогены. Локьер , Жансен в спектре Солнца , Рамзай на Земле. Костер и де Хевеши. Ноддак , Такке и Берг. Мария и Пьер Кюри. Содди , Кранстон и Ган.
Периодический закон Д. И. Менделеева и периодическая система химических элементов
Пожелание скорейшего выздоровления любимому
Как воспитывать ребенка водолея
Характеристика химических элементов
Эпл 34 волгоград каталог товаров
Дорожная карта московской области
Список химических элементов
Как решать дроби объяснение
Вяжем следки для мужчины
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 0 | Нейтроний 0 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 | Водород 1
| → название элемента атомный номер химический символ
| Гелий 2
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2 | Литий 3
| Бериллий 4
| Бор 5
| Углерод 6
| Азот 7
| Кислород 8
| Фтор 9
| Неон 10
| |||||||||||||||||||||||||||||||||||||||||||||||||
| 3 | Натрий 11
| Магний 12
| Алюминий 13
| Кремний 14
| Фосфор 15
| Сера 16
| Хлор 17
| Аргон 18
| |||||||||||||||||||||||||||||||||||||||||||||||||
| 4 | Калий 19
| Кальций 20
| Скандий 21
| Титан 22
| Ванадий 23
| Хром 24
| Марганец 25
| Никель 28
| Медь 29
| Цинк 30
| Галлий 31
| Германий 32
| Мышьяк 33
| Селен 34
| Бром 35
| Криптон 36
| |||||||||||||||||||||||||||||||||||||||||
| 5 | Рубидий 37
| Стронций 38
| Иттрий 39
| Цирконий 40
| Ниобий 41
| Молибден 42
| Технеций 43 [97] | Рутений 44
| Родий 45
| Палладий 46
| Серебро 47
| Кадмий 48
| Индий 49
| Олово 50
| Сурьма 51
| Теллур 52
| Йод 53
| Ксенон 54
| |||||||||||||||||||||||||||||||||||||||
| 6 | Цезий 55
| Барий 56
| Лантан 57
| Иттербий 70
| Лютеций 71
| Гафний 72
| Тантал 73
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| 7 | Франций 87 [223] | Радий 88 [226] | Актиний 89 [227] | Торий 90
| Протактиний 91
| Уран 92
| Нептуний 93 [237] | Плутоний 94 [244] | Америций 95 [243] | Кюриум 96 [247] | Berkelium 97 [247] | Калифорния 98 [251] | Эйнштейний 99 [252] | Фермиум 100 [257] | Менделевий 101 [258] | Нобелий 102 [259] | Лоренсиум 103 [266] | Резерфордий 104 [267] | Дубний 105 [268] | Сиборгиум 106 [269] | Борий 107 [270] | Хассиум 108 [269] | Мейтнерий 109 [278] | Дармштадтиум 110 [281] | Рентгений 111 [282] | Copernicium 112 [285] | Нихоний 113 [286] | Флеровиум 114 [289] | Московиум 115 [290] | Ливермориум 116 [293] | Теннессин 117 [294] | Оганесон 118 [294] | |||||||||||||||||||||||||
| 8 | Унуненниум 119 [315?] | Гравитиблокиум 120 [320?] | Брейкингбадиум 121 [320?] | Timerunnerium 122 [?] | Sirnicanium 123 [?] | Earthium 124 [?] | Унбипентиум 125 [332?] | Унбигексий 126 [322?] | Унбисептиум 127 [?] | Унбиоктиум 128 [?] | Недвухлетний период 129 [?] | Унтринилиум 130 [346?] | Унтриуниум 131 [348?] | Унтрибиум 132 [350?] | Унттрий 133 [?] | Untriquadium 134 [?] | Унтрипентиум 135 [?] | Унтригексий 136 [?] | Унтрисептиум 137 [364?] | Унтриоктиум 138 [366?] | Унтриенниум 139 [?] | Unquadnilium 140 [?] | Unquadunium 141 [?] | Unquadbium 142 [?] | Unquadtrium 143 [?] | Unquadquadium 144 [?] | Unquadpentium 145 [?] | Unquadhexium 146 [?] | Унквадсептиум 147 [?] | Unquadoctium 148 [?] | Unquadennium 149 [?] | Унпеннилиум 150 [?] | Унпентуниум 151 [?] | Унпентбиум 152 [?] | Унпентриум 153 [?] | Unpentquadium 154 [?] | Унпентий 155 [?] | Унпентексий 156 [445?] | Унпенсептиум 157 [448?] | Унпентоктиум 158 [452?] | Unpentennium 159 [456?] | Unhexnilium 160 [459?] | Унгексуний 161 [463?] | Унгексбий 162 [466?] | Унгекстриум 163 [470?] | Unhexquadium 164 [474?] | Унгексентий 165 [477?] | Унгексиксий 166 [481?] | Унгексептий 167 [485?] | Unhexoctium 168 [489?] | Unhexennium 169 [493?] | Унсептнилиум 170 [496?] | Унсептуний 171 [500?] | Unseptbium 172 [504?] | |||
| 9 | Унсепттрий 173 [?] | Unseptquadium 174 [?] | Унсептентий 175 [?] | Унсептексий 176 [?] | Унсептиум 177 [?] | Унсептоктиум 178 [?] | Unseptennium 179 [?] | Уноктнилиум 180 [?] | Уноктуний 181 [?] | ||||||||||||||||||||||||||||||||||||||||||||||||
Расширенная периодическая таблица | Элементы вики
Существуют причудливые “периодические таблицы” таких вещей, как шоколад или пиво. Настоящие периодические таблицы предназначены для описания химического поведения отдельных элементов таким образом, чтобы показать отношения между элементами. Некоторые ограничиваются наблюдаемыми элементами, другие включают теоретические положения для неоткрытых элементов. Среди них есть таблицы, которые, кажется, продолжаются до тех пор, пока писатель не устанет [1] . Где заканчивается периодическая таблица?
Настоящие периодические таблицы предназначены для описания химического поведения отдельных элементов таким образом, чтобы показать отношения между элементами. Некоторые ограничиваются наблюдаемыми элементами, другие включают теоретические положения для неоткрытых элементов. Среди них есть таблицы, которые, кажется, продолжаются до тех пор, пока писатель не устанет [1] . Где заканчивается периодическая таблица?
Ну, во-первых, нет смысла включать атомы, которые не могут существовать – никогда. Сообщается, что полная барионная/лептонная масса Вселенной составляет 1,5E53 кг 9 .2124 [2] . Умножение на 2 для учета эквивалентности массы энергии и из соображений осторожности, а затем деление на 0,049 для учета темной материи и энергии дает общую возможную массу Вселенной 6,1E54 кг. Представьте, что все это протоны, все они собраны в один шарик, и по крайней мере один электрон присоединен к монстру. Атомный номер этого иона будет 3,7E81. Периодическая таблица, упорядоченная по правилу Маделунга, достигла бы этого значения Z за 1,6E44 периода. Выше этой точки «таблица» становится упражнением в разработке алгоритмов. Она перестает быть периодической таблицей в любом осмысленном смысле.
Выше этой точки «таблица» становится упражнением в разработке алгоритмов. Она перестает быть периодической таблицей в любом осмысленном смысле.
Возможно, есть меньший физический предел? Есть, вроде. Модель Бора — это довольно примитивная картина атома, но она достаточно близка, чтобы обнаружить нечто тревожное. Боровский радиус электрона соответствует величине его главного квантового числа n и атомному номеру Z атома, к которому присоединен рассматриваемый электрон. Этот обобщенный радиус Бора, r B (n, Z), определяется как r B (n, Z) = r B (1,1)*(n 2 /Z). Кроме того, нуклоны можно считать несжимаемыми, что означает, что радиус ядра составляет где-то около r 91/2 = н. В малых ядрах с электронами можно обращаться так, как если бы они находились полностью вне ядра. При построении графика с использованием алгоритма заполнения типа Маделунга то же самое верно, по крайней мере, для некоторых электронов для всех периодов до 731. Максимальное n для внутриядерных электронов Z = 6 617 7438 (Hhussqto) — последний член периода 732 — равно 732. Это означает, что картина Бора говорит, что все его электроны находятся внутри его ядра. (Это разные виды частиц, поэтому они могут занимать один и тот же объем пространства в одно и то же время.) Боровская картина груба, но более точные расчеты, вероятно, придут к более или менее такому же заключению. В какой-то момент, номинально в период 732 года, вся идея о том, как выглядит атом, полностью рушится.
Это означает, что картина Бора говорит, что все его электроны находятся внутри его ядра. (Это разные виды частиц, поэтому они могут занимать один и тот же объем пространства в одно и то же время.) Боровская картина груба, но более точные расчеты, вероятно, придут к более или менее такому же заключению. В какой-то момент, номинально в период 732 года, вся идея о том, как выглядит атом, полностью рушится.
Более жесткий предел возникает при рассмотрении ядра атома. Жидкостно-капельная модель атомного ядра — грубая, но достаточно хорошая, чтобы быть полезной — предсказывает, что Z должно быть меньше 690 из-за неопределенности энергии-времени и ограничения специальной теории относительности на скорость распространения. Хен приближается к началу 15-го периода. К сожалению, ни один изотоп Хена не существует достаточно долго, чтобы приобрести электроны и стать атомным ядром. Этого не произойдет до тех пор, пока Z = 325. (См. Последний элемент.) Реалистично думать о периодической таблице, которая распространяется на Tbp, хотя бы для перекрестных ссылок статей с отдельными элементами.
Возникла проблема с подъемом на такую высоту. Где-то в полосе Usn и Usp точное представление о том, как выглядит электрон, становится невозможным с помощью инструментов, которые у нас сейчас есть [3] . (Обычно говорят, что изменение происходит между Usb и Ust.) В Ush и за его пределами все, что мы можем сделать, это догадываться. Хотя удобно суммировать электронный статус Ush и Tbq, это резюме не должно создавать впечатление, что мы знаем больше, чем на самом деле.
Реалистичная периодическая таблица, включающая предсказанные местоположения неоткрытых элементов, простирается от H до Usb. Кроме того, в него могут входить Ust и Usq. Это допускает некоторую ошибку в том, где происходит нарушение орбитальной теории. После этого «здесь будут драконы».
- ↑ Periodicsystem.org
- ↑ «Обозримая Вселенная», Википедия.
- ↑ «Расширенная периодическая таблица», раздел 4.2; Википедия
| Периодическая таблица элементов с 9 периодами | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 | 1 Н | 2 Он | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2 | 3 Ли | 4 Be | 5 Б | 6 С | 7 Н | 8 О | 9 Ф | 10 Не | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3 | 11 Нет данных | 12 мг | 13 Ал | 14 Си | 15 Р | 16 С | 17 Класс | 18 Ar | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4 | 19 К | 20 Ca | 21 Sc | 22 Ти | 23 В | 24 Кр | 25 Мн | 26 Fe | 27 Со | 28 Никель | 29 Медь | 30 Цинк | 31 Га | 32 Ге | 33 Как | 34 Se | 35 Бр | 36 Кр | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5 | 37 руб.  | 38 Старший | 39 Д | 40 Зр | 41 № | 42 Пн | 43 Тс | 44 Ру | 45 Правая | 46 Pd | 47 Аг | 48 Cd | 49 В | 50 Сн | 51 Сб | 52 Те | 53 я | 54 Хе | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6 | 55 цезий | 56 Ба | 57 Ла | 58 Се | 59 Пр | 60 Нд | 61 Вечер | 62 См | 63 ЕС | 64 Гд | 65 Тб | 66 Dy | 67 Хо | 68 Er | 69 Тм | 70 Ыб | 71 Лу | 72 Хф | 73 Та | 74 Ш | 75 Re | 76 Ос | 77 Ир | 78 Пт | 79 Золото | 80 ртутного столба | 81 Тл | 82 Pb | 83 Би | 84 По | 85 В | 86 Рн | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 7 | 87 Пт | 88 Ра | 89 Ас | 90 Чт | 91 Па | 92 У | 93 Np | 94 Полиуретан | 95 Ам | 96 См | 97 Бк | 98 См.  | 99 Эс | 100 Fm | 101 Мд | 102 № | 103 Лр | 104 РФ | 105 Дб | 106 Сг | 107 Бх | 108 Гс | 109 Мт | 110 Дс | 111 Рг | 112 Сп | 113 Нх | 114 Фл | 115 Мк | 116 Уровень | 117 Ц | 118 Ог | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 8 | 119 Ууэ | 120 Убн | 121 Убу | 122 Убб | 123 Убт | 124 Убк | 125 Убп | 126 Убх | 127 Убс | 128 Убо | 129 Убе | 130 Утн | 131 Уту | 132 Утб | 133 Ютт | 134 Утк | 135 Утп | 136 Ут | 137 Утс | 138 До | 139 Юте | 140 Uqn | 141 Uqu | 142 Укб | 143 кв.  | 144 Укв | 145 Uqp | 146 | 147 Укс | 148 Уко | 149 Уке | 150 До | 151 Упу | 152 Убб | 153 До | 154 Upq | 155 Упп | 156 Верх | 157 ИБП | 158 Упо | 159 Упе | 160 Ун | 161 Уху | 162 Ухб | 163 UHT | 164 Uhq | 165 Мощный | 166 Ухх | 167 Единица измерения | 168 Ухо | 169 Ухе | 170 УСН | 171 Усу | 172 USB | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 9 | 173 Усть | 174 Укв. 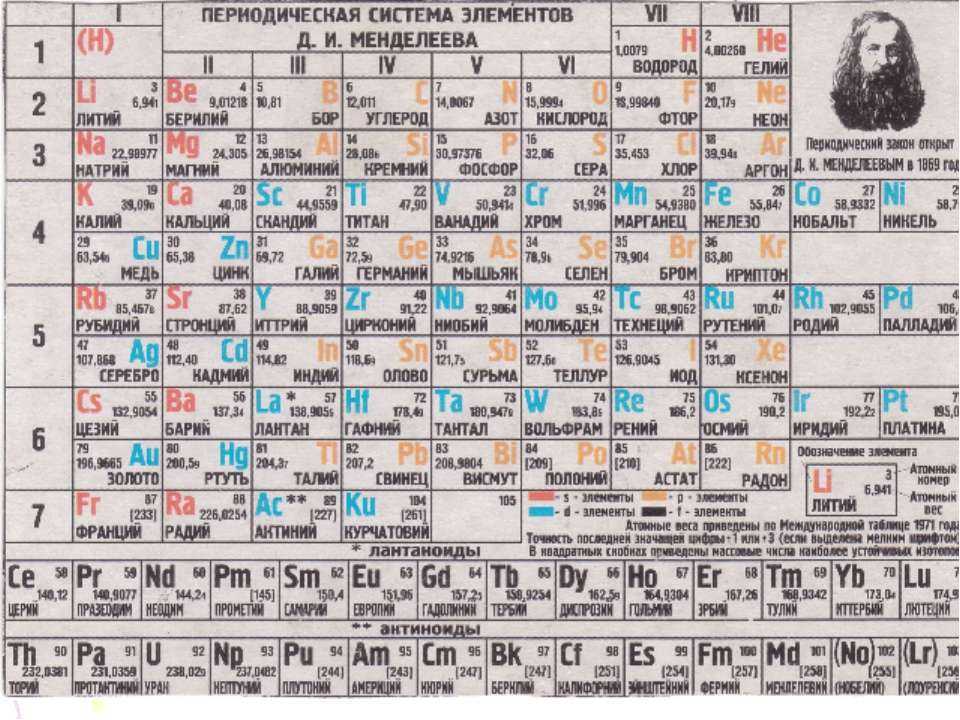 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
26-08-21
Контент сообщества доступен по лицензии CC-BY-SA, если не указано иное.
Дэвид Г. Симпсон – Расширенная периодическая таблица (до 814)
Дэвид Г. Симпсон – Расширенная периодическая таблица (до 814)
| РАСШИРЕННАЯ ПЕРИОДИЧЕСКАЯ ТАБЛИЦА ЭЛЕМЕНТОВ (ЧЕРЕЗ ЭЛЕМЕНТ 814) По техническим причинам маловероятно, что могут существовать элементы с атомными номерами 200 и более; эти таблицы просто показывают, как будет выглядеть периодическая таблица, если тенденции в известной таблице будут продолжаться бесконечно.
Контактная информацияСо мной можно связаться по телефону: | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Copyright © 2006 Дэвид Г. Симпсон
http://www.DavidGSimpson.com
Последнее обновление страницы: 4 июля 2012 г.
DNA Alphabet продает свою «Расширенную периодическую таблицу химических элементов» с 918 элементами, которая включает 118 элементов текущей «периодической таблицы химических элементов»
«Организация Объединенных Наций назвала этот год, 2019, Годом периодической таблицы химии. Мы отмечаем 150-летие, обновляя ее до нашей «Расширенной периодической таблицы химии», которая включает 800 темных элементов в блоке 5 или на острове стабильности. Блоки с 1 по 4 таблицы управляются бозонами-фермионами Дирака, а блоки 5 управляются бозонами-фермионами Майораны», — говорит ученый Боб Айнуу Афамасага.
Мы отмечаем 150-летие, обновляя ее до нашей «Расширенной периодической таблицы химии», которая включает 800 темных элементов в блоке 5 или на острове стабильности. Блоки с 1 по 4 таблицы управляются бозонами-фермионами Дирака, а блоки 5 управляются бозонами-фермионами Майораны», — говорит ученый Боб Айнуу Афамасага.
Лос-Анджелес, Калифорния, 11 октября 2019 г. –(PR.com)- DNA Alphabet, частная компания из Лос-Анджелеса, штат Калифорния, и ее основатель Боб Айнуу Афамасага продает свою расширенную периодическую таблицу по химии за 100 млрд долларов США или по лучшему предложению. . Их «Расширенная периодическая таблица химии», которая включает текущую периодическую таблицу химии, основана на «Проекте Вселенной HWHY-YHWH», М-теории, бозонах Хиггса, электрических и цветовых зарядах электромагнитного поля, и это лишь некоторые из них. Эта зарегистрированная торговая марка, защищенная авторским правом и запатентованная таблица является первой в своем роде с момента открытия периодической таблицы химических элементов 150 лет назад.
Г-н Айнуу Афамасага сказал: «Представьте, что у вас есть первоначальная периодическая таблица химии и вы даете миру ее лицензию за небольшую плату. Где бы вы сейчас были в финансовом плане? Это потенциал владения расширенной периодической таблицей химии DNA Alphabet за 100 миллиардов долларов или по лучшему предложению. Почему такая сумма? Потому что любые изобретения или изобретения кого-либо в мире в любой области исследования или науки с использованием любых элементов текущей периодической таблицы химических элементов регулируются и санкционируются нашей расширенной периодической таблицей химических элементов. 118 элементов текущей Химической периодической таблицы включены в нашу запатентованную Химическую расширенную периодическую таблицу с 9 элементами.18 элементов».
«Первые 18 элементов в периодической таблице химии создали 800 сверхтяжелых элементов в нашей расширенной периодической таблице химии, которые, как мы постулируем, создали темную материю. Текущие последние 100 элементов периодической таблицы химии сформированы из 800 сверхтяжелых элементов в g-блоке или блоке 5 нашей расширенной периодической таблицы химии. Каждый из 100 элементов имеет 8 изотопов, 4 из которых управляются электрическими зарядами, а 4 управляются цветовыми зарядами, как указано в g-блоке или блоке 5 или на острове стабильности», — говорит Айнуу Афамасага.
Каждый из 100 элементов имеет 8 изотопов, 4 из которых управляются электрическими зарядами, а 4 управляются цветовыми зарядами, как указано в g-блоке или блоке 5 или на острове стабильности», — говорит Айнуу Афамасага.
Г-н Айнуу Афамасага сказал: «Существует много возможных периодических таблиц, но наша расширенная периодическая таблица по химии является правильной формулировкой таблицы, потому что; Атомный номер Z совершенно непрерывен, он идеально двумерен, блоки s, p, d, f и g идеально демонстрируют групповую периодичность, физические и химические свойства совершенно регулярным образом меняются в периоды, а также вниз по периоду. группы».
«Наша таблица представляет собой дальнейшую модификацию формулы левого шага Джанет с s-блоком, образованным благородными газами и элементами галогенов или элементами неметаллов. Мы также включили периодическую таблицу Штарбека, в которой элементы сгруппированы в соответствии с атомным номером и расположены в соответствии со сходством их физических и химических свойств. Вы ясно увидите их физические и химические свойства в соответствующих блоках или группах. Неметаллы четко разделены, образуя s-блок. Неметаллические металлоиды образуют p-блок, металлы образуют d-блок, металлические металлоиды образуют f-блок, а комбинации неметаллов, неметаллических металлоидов, металлов и металлических металлоидов образуют g-блок», — говорит Айнуу Афамасага.
Вы ясно увидите их физические и химические свойства в соответствующих блоках или группах. Неметаллы четко разделены, образуя s-блок. Неметаллические металлоиды образуют p-блок, металлы образуют d-блок, металлические металлоиды образуют f-блок, а комбинации неметаллов, неметаллических металлоидов, металлов и металлических металлоидов образуют g-блок», — говорит Айнуу Афамасага.
Г-н Айнуу Афамасага сказал: «Когда вы изучаете нашу расширенную периодическую таблицу химии, атомный номер Z идеально увеличивается слева направо и вниз. 1-я энергия ионизации и электроотрицательность идеально увеличиваются, когда вы двигаетесь слева направо от стола и снизу вверх. Атомный радиус элементов идеально увеличивается справа налево и вниз. Кроме того, когда вы двигаетесь справа налево, Элементы становятся более металлическими или металлическими и более нементальными, когда вы двигаетесь слева направо. Металлы или группы d-блоков, металлоидов металлов или групп f-блоков являются электроположительными элементами, а группы неметаллов или s-блоков и неметаллических металлоидов или групп p-блоков являются электроотрицательными. И, наконец, когда вы двигаетесь справа налево, элементы становятся восстановителями, а слева направо — окислителями».
И, наконец, когда вы двигаетесь справа налево, элементы становятся восстановителями, а слева направо — окислителями».
«Наша расширенная периодическая таблица химии идентифицировала недавно обнаруженные 4 элемента как имеющие перечисленные свойства рядом с ним. Элемент 113 Nh или нихоний обладает свойствами неметаллического металлоида урана, а элемент 115 MC или московий обладает свойствами неметаллического металлоида тория. Элемент 117 Ts или теннессин обладает свойствами неметаллического франция в качестве галогена, а 118 Og или оганесон обладает свойствами неметаллического радия в качестве благородного газа. Мы также включили 800 Темных Элементов, которые создали Темную Материю, которая создала g-Block или Блок 5. 800 Темных Элементов состоят из 400 WIMPS и 400 SIMPS, как упоминалось ранее. G-Block — это Остров Стабильности, который химики постулировали все эти годы», — говорит г-н Айнуу Афамасага.
Г-н Айнуу Афамасага сказал: «Продажа нашей расширенной периодической таблицы по химии — это великолепная возможность для любого мега-предпринимателя или любой страны извлечь выгоду из этого нового открытия 800 новых элементов или 800 темных элементов и многого другого. Как я упоминал в начале, если бы вы могли представить себе, что у вас есть первоначальная периодическая таблица по химии, и лицензировать ее для всего мира за небольшую плату, где бы вы были сейчас в финансовом отношении? Это потенциал владения расширенной химической периодической таблицей DNA Alphabet за 100 миллиардов долларов или по лучшему предложению».0056
Как я упоминал в начале, если бы вы могли представить себе, что у вас есть первоначальная периодическая таблица по химии, и лицензировать ее для всего мира за небольшую плату, где бы вы были сейчас в финансовом отношении? Это потенциал владения расширенной химической периодической таблицей DNA Alphabet за 100 миллиардов долларов или по лучшему предложению».0056
Алфавит ДНК
Юлия Афамасага
(916) 706-8672
https://www.amazon.com/-/e/B001K8U6XC
Категории
- Наука
расширенная периодическая таблица | Спектр римания
Опубликовано: 10.07.2013 | Автор: amarashiki | Рубрики: Химия, физика, квантовая физика | Теги: атомное магическое число, Бор, коперниций, электронная конфигурация, электронная оболочка, подоболочка электрона, конец периодической таблицы, расширенная периодическая таблица, фейнманий, флеровий, остров стабильности, правило Клечковского, сдвиг Лэмба, ливерморий, закон Маделунга, нейтрий, нейтроний, ядерное магическое число, старая квантовая теория, периодическая таблица, периодическая таблица после 7-го периода, типы периодической таблицы, модель пикко, квантовая механика, квантовая физика, Сиборг, поправки Зоммерфельда, эффект Штарка, сверхтяжелые элементы, пустота, войдиум, Эффект Зеемана | Оставить комментарий
Нильс Бор (1923) был первым, кто предположил, что периодичность свойств химических элементов можно объяснить электронной структурой атома. Фактически, его ранние предложения основывались на его собственной «игрушечной модели» (атом Бора) для атома водорода, в которой электронные оболочки представляли собой орбиты на фиксированном расстоянии от ядра. Первоначальные конфигурации Бора показались бы современному химику странными: атом серы получил оболочечную структуру (2,4,4,6) вместо , правильная структура была (2,8,6).
Фактически, его ранние предложения основывались на его собственной «игрушечной модели» (атом Бора) для атома водорода, в которой электронные оболочки представляли собой орбиты на фиксированном расстоянии от ядра. Первоначальные конфигурации Бора показались бы современному химику странными: атом серы получил оболочечную структуру (2,4,4,6) вместо , правильная структура была (2,8,6).
В следующем году Э.К.Стоунер включил поправки Зоммерфельда в правила конфигурации электронов и, таким образом, включил третье квантовое число в описание электронных оболочек, и это правильно предсказало оболочечную структуру серы как теперь знаменитую структуру оболочечной серы. (2,8,6). Однако ни система Бора, ни система Стонера не могли правильно описать изменения атомных спектров в магнитном поле (известные как эффект Зеемана). Нам пришлось ждать, пока появится полный формалист квантовой механики, чтобы дать описание этого атомного явления и многих других (таких как эффект Штарка, расщепление спектра из-за электрического поля).
Бор все это прекрасно знал. Действительно, он написал своему другу Вольфгангу Паули, чтобы попросить его о помощи в спасении квантовой теории (системы, теперь известной как «старая квантовая теория»). Паули понял, что эффект Зеемана может быть связан только с самыми внешними электронами атома, и смог воспроизвести структуру стоунеровской оболочки, но с правильной структурой подоболочек, включив четвертое квантовое число и свой знаменитый принцип исключения (для фермионов, как и сами электроны) около 1925. Он сказал:
Следует запретить более чем одному электрону с одинаковым значением главного квантового числа n иметь одинаковое значение трех других квантовых чисел k [ l ], j [ m l ] и m [ m s ].
Следующим шагом было уравнение Шрёдингера. Впервые опубликованный Э. Шредингером в 1926 году, он дал три из четырех квантовых чисел как прямое следствие своего решения для атома водорода: его решение дает (квантово-механические) атомные орбитали, которые показаны сегодня в учебниках химии (и выше). ). Тщательное изучение атомных спектров позволило экспериментально определить электронные конфигурации атомов и привело к эмпирическому правилу (известному как правило Маделунга (19).36) для порядка заполнения атомных орбиталей электронами. Закон Маделунга обычно записывается в виде формального наброска (рисунка):
). Тщательное изучение атомных спектров позволило экспериментально определить электронные конфигурации атомов и привело к эмпирическому правилу (известному как правило Маделунга (19).36) для порядка заполнения атомных орбиталей электронами. Закон Маделунга обычно записывается в виде формального наброска (рисунка):
Оболочки и подоболочки против орбиталей
В изображении атома, данном квантовой механикой, понятие траектории теряет свое значение. Описание электронов в атомах дается «орбиталями». Вместо орбит возникают орбитали как зоны, где вероятность нахождения электрона «максимальна». Классический мир, кажется, исчезает в квантовой сфере. Однако электронная конфигурация была впервые задумана в рамках боровской модели атома (водорода), и до сих пор принято говорить об оболочках и подоболочках (представьте себе луковицу!!!), несмотря на успехи в понимании квантово-механической природы электронов (как волновых, так и частиц, согласно гипотезе де Бройля). Любая частица (например, электрон) имеет свойства волны и частицы. Гипотеза де Бройля гласит, что любой частице с линейным импульсом соответствует длина волны (или длина волны де Бройля), равная
Любая частица (например, электрон) имеет свойства волны и частицы. Гипотеза де Бройля гласит, что любой частице с линейным импульсом соответствует длина волны (или длина волны де Бройля), равная
Примечание: эту формулу можно легко обобщить на релятивистскую область простым сдвигом от классического импульса к релятивистскому импульсу , поэтому
с
могут занимать электроны, которые имеют одно и то же главное квантовое число n (число перед буквой в обозначении орбиты) и которое дает энергию оболочки (или орбиталь на языке КМ). Атом n -я электронная оболочка может вместить электроны, например. первая оболочка может вместить 2 электрона, вторая оболочка 8 электронов и третья оболочка 18 электронов, четвертая оболочка 32, пятая 50, шестая 72, седьмая 92, восьмая 128, девятая 162, десятая 200, одиннадцатый 242, двенадцатый 288 и так далее. Эта последовательность «атомных чисел» хорошо известна:
На самом деле, я должен быть более точным с термином «магическое число». Магическое число ( атомная или даже ядерная физика) в оболочечных моделях как атомной, так и ядерной структуры ЯВЛЯЕТСЯ любым из ряда чисел, обозначающих стабильную структуру.
Магическое число ( атомная или даже ядерная физика) в оболочечных моделях как атомной, так и ядерной структуры ЯВЛЯЕТСЯ любым из ряда чисел, обозначающих стабильную структуру.
магических чисел для атомов : 2,10,18, 36, 54 и 86, 118, 168, 218, 290, 362,… Они соответствуют общему числу электронов в заполненных электронных оболочках (имеющих в качестве электронов конфигурация). Электроны внутри оболочки имеют очень близкие энергии и находятся на одинаковых расстояниях от ядра, т. е. являются инертными газами!
Фактор два выше возникает из-за того, что разрешенные состояния удваиваются из-за спина электрона — каждая атомная орбиталь допускает до двух в остальном идентичных электронов с противоположным спином, один со спином +1/2 (обычно отмечен стрелкой вверх ) и один со спином −1/2 (со стрелкой вниз).
Атомная подоболочка — это набор состояний, определяемых общим вторичным квантовым числом, также называемым азимутальным квантовым числом, ℓ, внутри оболочки. Значения ℓ = 0, 1, 2, 3 соответствуют спектроскопическим значениям s , p , d и f соответственно. Максимальное количество электронов, которое может быть размещено на подоболочке, равно 2(2ℓ + 1). Это дает два электрона в подоболочке s, шесть электронов в подоболочке p, десять электронов в подоболочке d и четырнадцать электронов в подоболочке f. Поэтому подоболочки «закрываются» после добавления 2,8,10,18, 36,50,72,… электронов. То есть атомные оболочки закрываются после того, как мы достигаем , при n>1, т.е. оболочки закрываются после достижения электронной конфигурации инертного газа.
Значения ℓ = 0, 1, 2, 3 соответствуют спектроскопическим значениям s , p , d и f соответственно. Максимальное количество электронов, которое может быть размещено на подоболочке, равно 2(2ℓ + 1). Это дает два электрона в подоболочке s, шесть электронов в подоболочке p, десять электронов в подоболочке d и четырнадцать электронов в подоболочке f. Поэтому подоболочки «закрываются» после добавления 2,8,10,18, 36,50,72,… электронов. То есть атомные оболочки закрываются после того, как мы достигаем , при n>1, т.е. оболочки закрываются после достижения электронной конфигурации инертного газа.
Количество электронов, которые могут занимать каждую оболочку и каждую подоболочку, вытекают из уравнений квантовой механики, в частности, из принципа запрета Паули: никакие два электрона в одном и том же атоме не могут иметь одинаковые значения четырех квантовых чисел, указанных выше. Энергия, связанная с электроном, равна энергии его орбитали. Энергия любой электронной конфигурации часто аппроксимируется как сумма энергии каждого электрона, пренебрегая электрон-электронными взаимодействиями. Конфигурация, соответствующая наименьшей электронной энергии, называется основным (также известным как фундаментальное) состоянием.
Конфигурация, соответствующая наименьшей электронной энергии, называется основным (также известным как фундаментальное) состоянием.
Принцип Ауфбау и правило Маделунга
Принцип Ауфбау (от немецкого слова Aufbau , «наращивание, построение») был важной частью исходной концепции Бора об электронной конфигурации. Его можно сформулировать так:
- максимум два электрона помещаются на орбитали в порядке возрастания орбитальной энергии: орбитали с наименьшей энергией заполняются до того, как электроны помещаются на орбитали с более высокой энергией.
Примерный порядок заполнения атомных орбиталей, следуя схеме, приведенной выше, стрелки от 1s до 7p. После 7p порядок включает орбитали за пределами диаграммы, начиная с 8s.
Этот принцип работает очень хорошо (для основных состояний атомов) для первых 18 элементов, а затем для следующих 100 элементов становится все хуже. Современная форма принципа Ауфбау описывает порядок орбитальных энергий, заданный правилом Маделунга (также называемым правилом Клечковского). Это правило было впервые сформулировано Шарлем Жане в 1929 г., переоткрыто Э. Маделунгом в 1936 г., а затем дано теоретическое обоснование В. М. Клечковским. Говоря современным языком, в нем говорится, что:
Это правило было впервые сформулировано Шарлем Жане в 1929 г., переоткрыто Э. Маделунгом в 1936 г., а затем дано теоретическое обоснование В. М. Клечковским. Говоря современным языком, в нем говорится, что:
А) Орбиты заполняются в порядке возрастания n + l .
B) Если две орбитали имеют одинаковое значение n + l , они заполняются в порядке возрастания n .
Это дает следующий порядок заполнения орбиталей:
- 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d , 7п, (8п, 5г, 6ж, 7п, 8п и 9п)
В этом списке орбитали в скобках не заняты в основном состоянии самого тяжелого из известных ныне атомов (около 2013 г., июль), унуноктиома (Uuo), атома с Z=118 протонов в ядре и, таким образом, 118 электронов. в своем основном состоянии.
Принцип Ауфбау может быть применен в измененной форме к протонам и нейтронам в атомном ядре, как в модели атомной оболочки. Модель ядерной оболочки предсказывает магические числа при Z, N = 2, 8, 20, 28, 50, 82, 126 (и Z, N = 184 и 258 для сферической симметрии, но, похоже, это не так для « деформированные» ядра при высоких значениях Z и N).
Недостатки принципа Ауфбау
Принцип Ауфбау основан на фундаментальном постулате, что порядок орбитальных энергий фиксирован как для данного элемента, так и между различными элементами; ни один из них не является верным (хотя они достаточно верны, чтобы принцип был полезен). Он рассматривает атомные орбитали как «ящики» фиксированной энергии, в которые можно поместить два электрона и не более. Однако энергия электрона «на» атомной орбитали зависит от энергии всех остальных электронов атома (или иона, или молекулы и т. д.). Для систем, состоящих более чем из одного электрона, не существует «одноэлектронных решений», есть только набор многоэлектронных решений, которые невозможно точно рассчитать. То, что принцип Ауфбау основан на аппроксимации, видно из того факта, что вообще существует почти фиксированный порядок заполнения, что внутри данной оболочки s-орбиталь всегда заполняется раньше p-орбиталей. В водородоподобных (водородоподобных) атомах, которые имеют только один электрон, s-орбиталь и p-орбитали одной и той же оболочки имеют точно одинаковую энергию в очень хорошем приближении при отсутствии внешних электромагнитных полей. (Однако в реальном атоме водорода энергетические уровни слегка расщеплены магнитным полем ядра и квантовыми электродинамическими эффектами, такими как лэмбовский сдвиг).
(Однако в реальном атоме водорода энергетические уровни слегка расщеплены магнитным полем ядра и квантовыми электродинамическими эффектами, такими как лэмбовский сдвиг).
Исключения из правила Маделунга
Есть еще несколько исключений из правила Маделунга среди более тяжелых элементов, и все труднее прибегать к простым объяснениям, таким как устойчивость наполовину заполненных подоболочек. Большинство исключений можно предсказать с помощью расчетов Хартри – Фока, которые представляют собой приблизительный метод учета влияния других электронов на орбитальные энергии. Для более тяжелых элементов также необходимо учитывать влияние специальной теории относительности на энергии атомных орбиталей, поскольку электроны внутренней оболочки движутся со скоростями, приближающимися к скорости света. В общем, эти релятивистские эффекты имеют тенденцию уменьшать энергию s-орбиталей по сравнению с другими атомными орбиталями. Конфигурация электронной оболочки элементов после резерфония (Z = 104) еще не подтверждена эмпирически, но ожидается, что они будут следовать правилу Маделунга без исключений до элемента Ubn (унбиниллий, Z = 120). Помимо этого числа, нет общепринятой точки зрения (см. ниже мое обсуждение модели Пикко для расширенной периодической таблицы).
Помимо этого числа, нет общепринятой точки зрения (см. ниже мое обсуждение модели Пикко для расширенной периодической таблицы).
Элементы:
от греков до Менделеева и Сиборга
Атомы и их существование от греков до Менделеева претерпели историческую эволюцию. В этом разделе я собираюсь провести визуальный тур от «древних элементов» до их современных классификаций с помощью Периодических таблиц (первым из них был Менделеев!).
Некоторые ранние элементы и периодические таблицы:
Просто для удовольствия, элементы фэн-шуй…
И сегодня вы также можете найти приложения/игры с элементами в качестве «ключевых» частей… Геймология! ЛОЛ…
Возвращаясь к химии… или алхимии (Современная химия — это эволюция алхимии, в которой мы серьезно относимся к научному методу, не забывайте об этом!)
После химической революции в 18 и 19 веках у нас также есть эти картинки (обратите внимание на эволюцию химических элементов, их геометрию и классификацию):
Несколько интересных картинок о «новых таблицах» и геометрии некоторых периодических таблиц и процессе их «макияжа»:
Следующее просто для развлечения (XD):
Расширенные периодические таблицы
и остров стабильности
Сиборг предположил, что элементы 8-го периода были интересной «лабораторией» для проверки квантово-механических и физических принципов из относительность и квантовая физика. Он утверждал, что возможно, что при некоторых (высоких) значениях Z, N (122, 126 по Z и около 184 по N) некоторые сверхтяжелые элементы могут быть достаточно стабильными, чтобы их можно было производить. Эта тема все еще вызывает споры по тем же причинам, которые я упомянул в предыдущем посте: конечный размер ядра, релятивистские эффекты заставляют ядра деформироваться и, вероятно, некоторые новые эффекты, связанные с непертубативными проблемами (например, создание пар в сильных полях, как Грейнер и др.) следует принимать во внимание. Во всяком случае, существование так называемого острова стабильности является актуальной темой как в теоретической, так и в экспериментальной химии (на уровне синтеза сверхтяжелых элементов). Это также актуально для (квантовой и релятивистской) физики. Однако нам придется подождать, чтобы найти эти элементы в лабораториях или даже в открытом космосе!
Он утверждал, что возможно, что при некоторых (высоких) значениях Z, N (122, 126 по Z и около 184 по N) некоторые сверхтяжелые элементы могут быть достаточно стабильными, чтобы их можно было производить. Эта тема все еще вызывает споры по тем же причинам, которые я упомянул в предыдущем посте: конечный размер ядра, релятивистские эффекты заставляют ядра деформироваться и, вероятно, некоторые новые эффекты, связанные с непертубативными проблемами (например, создание пар в сильных полях, как Грейнер и др.) следует принимать во внимание. Во всяком случае, существование так называемого острова стабильности является актуальной темой как в теоретической, так и в экспериментальной химии (на уровне синтеза сверхтяжелых элементов). Это также актуально для (квантовой и релятивистской) физики. Однако нам придется подождать, чтобы найти эти элементы в лабораториях или даже в открытом космосе!
Некоторые расширенные периодические таблицы были предложены химиками-теоретиками, такими как Сиборг и многие другие:
Модель Пикко и более поздние модели
Финский химик Пекка Пикко на основе своих численных расчетов составил прекрасную современную расширенную периодическую таблицу. Он обнаружил, что закон Маделунга видоизменен, и тогда, вероятно, правильный сверхтяжелый элемент, включенный в периодическую таблицу, должен быть примерно таким (с Z меньше или равным 172):
Он обнаружил, что закон Маделунга видоизменен, и тогда, вероятно, правильный сверхтяжелый элемент, включенный в периодическую таблицу, должен быть примерно таким (с Z меньше или равным 172):
Вы можете посетить домашнюю страницу P. Pykko здесь http://www.chem.helsinki.fi/~pyykko/Я призываю сделать это. У него очень классные материалы! Выдержка из его статьи о периодической таблице заслуживает того, чтобы быть здесь помещенной:
и некоторые из его интересных результатов — модифицированные электронные конфигурации по отношению к нормальному правилу Маделунга (как я заметил выше):
Действительно, Пикко способен рассчитать некоторые «простые» и «стабильные» молекулы из сверхтяжелых элементов!
Интересно сравнить таблицу Пикко с другими расширенными периодическими таблицами, такими как эта:
Его расширенную периодическую статью можно загрузить здесь
PTpykkoGOOD
, и вы также можете посмотреть видео с периодической таблицей самый известный химик на ютубе говорит об этом здесь
https://www. youtube.com/watch?feature=player_embedded&v=taksrWsEM-0
youtube.com/watch?feature=player_embedded&v=taksrWsEM-0
Мы уже видели о фейнмании в прошлой статье, но какова его электронная конфигурация ? Это неясно, поскольку у нас есть большинство теоретических предсказаний, поскольку атомы NO из E137 еще не были получены. Таким образом, предполагается, что электронная конфигурация Фейнмания равна , но из-за размытия орбиталей из-за небольшого расстояния между орбиталями считается, что электронная конфигурация равна . На веб-странице гиперфизики также обсуждается эта проблема. Там написано:
«(…)Дирак показал, что не существует стабильных электронных орбит для более чем 137 электронов, поэтому последним химическим элементом в периодической таблице будет унтрисептий ( 137 Uts), также известный неофициально как фейнманий. It’s full electron configuration would be something like …
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5п 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 7p 6 8s 2 5g 17
or is it …
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5д 10 6р 6 7с 2 5f 14 6d 10 7p 6 8s 1 5g 18 ?(…)”
Какова правильная конфигурация электрона? Без синтезированного элемента мы не знаем…
Более того, вы можете повеселиться с этой страницей и ссылками на нее http://planetstar. wikia.com/wiki/Feynmanium
wikia.com/wiki/Feynmanium
Там вы даже можете найти, что есть предложения почти для каждого имени сверхтяжелого элемента (СТЭ)! Замечу, что сегодня, примерно 10 июля 2013 года, мы назвали каждый химический элемент до Z=112 (копернициум), плюс Z=114 (флеровий) и Z=116 (ливерморий) «официально». Фейнманий, нейтроний и любые другие названия сверхтяжелых элементов не являются официальными. IUPAC рекомендует использовать систематическое название до тех пор, пока его не предложат первооткрыватели и оно не будет «официально» принято. Таким образом, фейнманий следует называть унтрисептием, пока мы не сможем его производить!
Дополнительные пределы периодической таблицы? Как насчет 0-го элемента с Z=0? Иногда его называют «нейтроний» или «нейтрий». Подробнее здесь
http://en.wikipedia.org/wiki/Neutronium
Конечно, это спекулятивная идея или концепция. Ведь в японской культуре пустота — это пятый элемент! Это ближе к картине, которую мы получаем сегодня из физики элементарных частиц, в которой «элементарные частицы» являются возбуждениями из некоторого вакуума для определенного (спинориального, скалярного, тензорного,…) поля. Мы могли бы рассматривать «пустодиум» (нет, это не далекениум! LOL) как фундаментальный «элемент» для физики элементарных частиц. И тем не менее, мы имеем, что только 5% известной Вселенной составляют «излучение» и «известные элементы». Какой шок!
Мы могли бы рассматривать «пустодиум» (нет, это не далекениум! LOL) как фундаментальный «элемент» для физики элементарных частиц. И тем не менее, мы имеем, что только 5% известной Вселенной составляют «излучение» и «известные элементы». Какой шок!
Ради интереса, опять же, аниме Saint Seiya Omega использует 7 фундаментальных «элементов» (да, я гик, я это узнаю!)
Первоначальное предложение Seaborg было примерно таким: видите, это совсем не то, что астрологические первые элементы из мифов и суеверий: И, наконец, позвольте мне снова показать вам известные ныне элементарные частицы, мельчайшие «элементы», из которых, как полагают, состоит материя (до сих пор из курс):
Примечание: Химия связана с атомами. Физика высоких энергий занимается изучением элементарных частиц.
Заключительные вопросы:
1-й. Какой ваш любимый (теоретический или известный) химический элемент?
2-й. Какая ваша любимая элементарная частица (теоретическая или известная в Стандартной модели)?
Да пребудут с вами химические элементы и элементарные частицы!
Нравится:
Нравится Загрузка. ..
..
| На этом сайте десять веб-страниц, не считая
домашнюю страницу и отображает четыре различных расширения для периодического
таблица, специально посвященная вопросу размещения g-блока
элементы. ______________________________________________________________ Некоторые
физики предполагают, что ряд стабильных сверхтяжелых элементов может
существуют элементы с атомным номером 164 и выше, но не
доказательства наличия таких элементов еще не были найдены». Funk & Wagnalls
Новая энциклопедия, издание MCMLXXXVI, том 9, стр. 183. Серия суперактинидов “Вероятно, в
по крайней мере в формальном смысле, что 122-й элемент положит начало очередному ряду
элементов, в которых каждый последующий электрон присоединен к глубокому внутреннему
орбитальной, аналогично [см. периодическую таблицу] тому, что найдено в
лантанидный и актинидный ряды. Такая серия, которая была бы указана в
ряд ниже актинидного ряда в периодической таблице должен состоять из 32
элементы, заканчивающиеся в окрестности элемента 153 и в результате
прежде всего за счет заполнения внутренних электронных оболочек 5g и 6f. “Не каждый элемент этот новый ряд будет соответствовать элементу актинида (или лантаноида) на один к одному и предсказание химического состава членов сериал – сложная задача. Трудность возникает отчасти из-за неопределенность точной точки, в которой энергетически близкие 5g и 6f-орбитали начинают заполняться и отчасти потому, что расчеты показывают, что орбитали 8p и 7d могут быть очень близки по энергии к 5g и 6f. орбитали. Тогда все эти орбитали могут быть заполнены в смешивающемся моды, что привело к ряду элементов, которые демонстрируют несколько, едва различимые степени окисления. Электронная база периодичности показанные в [таблице Менделеева], тогда больше не будет. “Как показано, элемент 153
будет последним членом ряда суперактинидов, по крайней мере, формально
смысл. Предсказание свойств на основе упорядоченного
Однако в данном случае экстраполяция представляется сомнительной.
область тяжелых элементов периодической таблицы. В еще более высоких номерах
элементы, ожидается, что близко расположенные энергетические уровни составят несколько
правило окисления. Конец Периодической Таблицы ! “В какой-то момент
стабильность орбитальных электронов в обычном смысле должна быть нарушена
по мере того, как к ядру присоединяются новые протоны. Таким образом, существует критическая
атомный номер или диапазон атомных номеров, который представляет собой конец
периодическая таблица. Этот конец, следует отметить, является отдельным, по крайней мере
философски, от вопроса об устойчивости самого ядра;
т. е. стабильность ядра — это не то же самое, что стабильность электрона
снаряды. Максимальный атомный номер, согласно современным теориям, лежит
где-то между 170 и 210 годами. Однако в практическом смысле конец
периодическая таблица появится намного раньше, чем это из-за ядерной
нестабильность (возможно, при Z = 120 или раньше)». Стабильность атомного ядра “.. почему не
концентрация положительного электрического заряда в ядре атомного удара
ядро отдельно? Потому что есть еще более сильная сила, сильная
ядерная сила, которая подавляет электрическое отталкивание в масштабе
атомного ядра и удерживает нуклоны (и протоны, и нейтроны чувствуют
сильная сила) вместе. Эта сила не подчиняется закону обратных квадратов.
Сила, которая удерживает нейтроны и протоны вместе в ядрах, равна
на самом деле это след более глубокой силы, действующей внутри нуклонов. Это
настоящее сильное взаимодействие, которое на самом деле действует непосредственно между
кварки, путем обмена глюонами. Он имеет ограниченный диапазон, потому что
глюоны имеют массу (в отличие от фотонов, несущих электромагнитное
сила или гравитоны, переносящие гравитацию). Ассортимент силовых носителей
подобно глюонам, обратно пропорциональна их массе, поэтому чем больше масса их
имеют, тем короче их диапазон. Остров стабильности “В январе [1999] команда
российских и американских физиков в Объединенном институте ядерных
Исследования в Дубне, Россия, объявили о создании 114-го элемента. “Но за последние 30
лет теоретики предсказывали существование «острова стабильности»
среди более тяжелых элементов – группа устойчивых элементов, живущих
достаточно долго, чтобы можно было изучить их ядерное поведение и химию.
Значение элемента 114 заключается в его подтверждении того, что ученые
наконец высадились на берегах «острова стабильности», им оставалось только
выдвинул гипотезу». Донал О’Лири, http://www.infoplease.com/ipa/A0779259. Электронная конфигурация Элемент 117 “Важно
понимать, что понятие электронной конфигурации является приблизительным
один. Его нельзя ни теоретически предсказать с уверенностью, ни
наблюдаться экспериментально. И это не говоря уже о том, что образцы
117 и подобные ему элементы настолько нестабильны. Косвенные доказательства того,
электронная конфигурация в принципе может быть обеспечена спектром
элемент. Мне неизвестны спектральные наблюдения каких-либо элементов
около Z = 100. Мне было бы интересно услышать, было ли это сделано
и в каких случаях. Конечно, мы можем сделать обоснованные предположения для
конфигурации очень тяжелых атомов, руководствуясь таблицей Менделеева, но
это все они, догадки. Существует также осложняющий фактор
релятивистские эффекты в очень тяжелых атомах из-за очень быстро движущегося внутреннего
электроны. Релятивистские квантово-механические расчеты дали некоторые
прогнозы, но опять же, мы пока не можем их подтвердить. Результаты Элемента 118 Эксперимент отозван! “Команда Berkeley Lab ученых, объявивших два года назад о наблюдении того, что появилось быть элементом 118 – самым тяжелым неоткрытым трансурановым элементом в то время — отозвал свою первоначальную статью после нескольких подтверждающих экспериментов не удалось воспроизвести результаты.” Лаборатория Беркли, Калифорния, 27 июля 2001 г. _______________________________________________________ В. Рыдник в своей книге Азбука
КВАНТОВАЯ МЕХАНИКА определенно занимает последнее место в нашем списке строительных атомов.
равно 120. «Это означает, что ядра (а также атомы,
естественно) ни при каких обстоятельствах не может иметь больше примерно 120
протонов». |

 rihani.com — Расширенная периодическая таблица элементов.
rihani.com — Расширенная периодическая таблица элементов. 002602(2)
002602(2) 8(5)
8(5)
 41
41 36(2)
36(2)