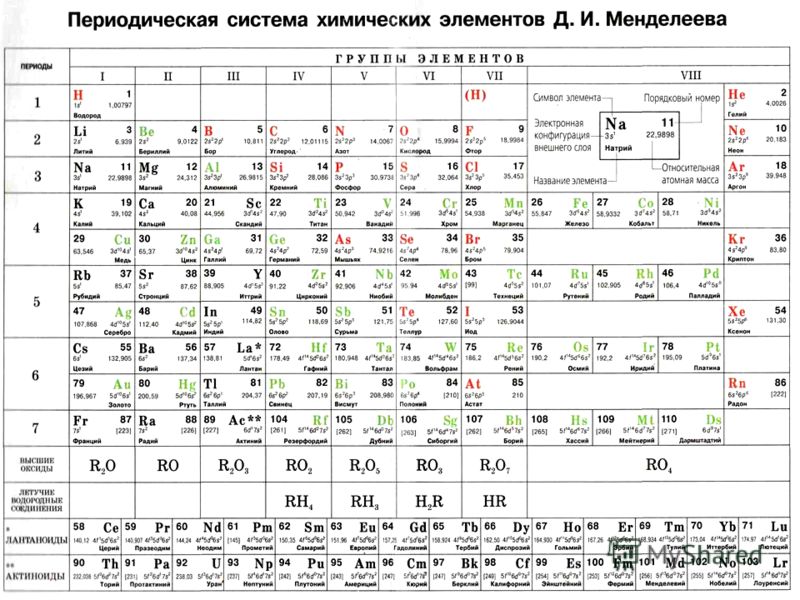
Современная форма таблицы Менделеева | Наука и жизнь
В этом году исполняется 170 лет со дня рождения выдающегося российского химика Дмитрия Ивановича Менделеева и 135 лет со дня создания им периодической системы элементов. За истекшее время таблица, наглядно демонстрирующая периодический закон, неоднократно дополнялась и расширялась. До последнего времени в научной и учебной литературе приводилась так называемая короткая форма таблицы. Современный, расширенный вариант таблицы Менделеева составлен авторами статьи на основании последних решений ИЮПАК – Междунаpодного союза теоpетической и пpикладной химии (International Union of Pure and Applied Chemistry – IUPAC). Эта оpганизация, созданная в 1919 году, кооpдиниpует исследования, тpебующие междунаpодного согласования, контpоля и стандаpтизации, pекомендует и утверждает химическую теpминологию, включая названия элементов. Россия, будучи полноправным членом союза, выполняет его решения и рекомендации. Новая форма таблицы была одобрена XVII Менделеевским съездом в сентябре 2003 года.
ИЗ ИСТОРИИ СОЗДАНИЯ И РАЗВИТИЯ ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
Первого марта 1869 года Д. И. Менделеев обнародовал периодический закон и его следствие – таблицу элементов. В 1870 году он назвал систему “естественной”, а спустя год – “периодической”. Таблица (далекий прообраз современной), демонстрирующая закон, была представлена Менделеевым под названием “Опыт системы элементов, основанный на их атомном весе и химическом сходстве”. Им же была дана формулировка закона: “Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, находятся в периодической зависимости от их атомного веса”. Таблица состояла из шести вертикальных групп, предшественниц будущих периодов. По горизонтали прослеживались еще не полные ряды элементов, прообразов будущих подгрупп (сегодня – групп) элементов.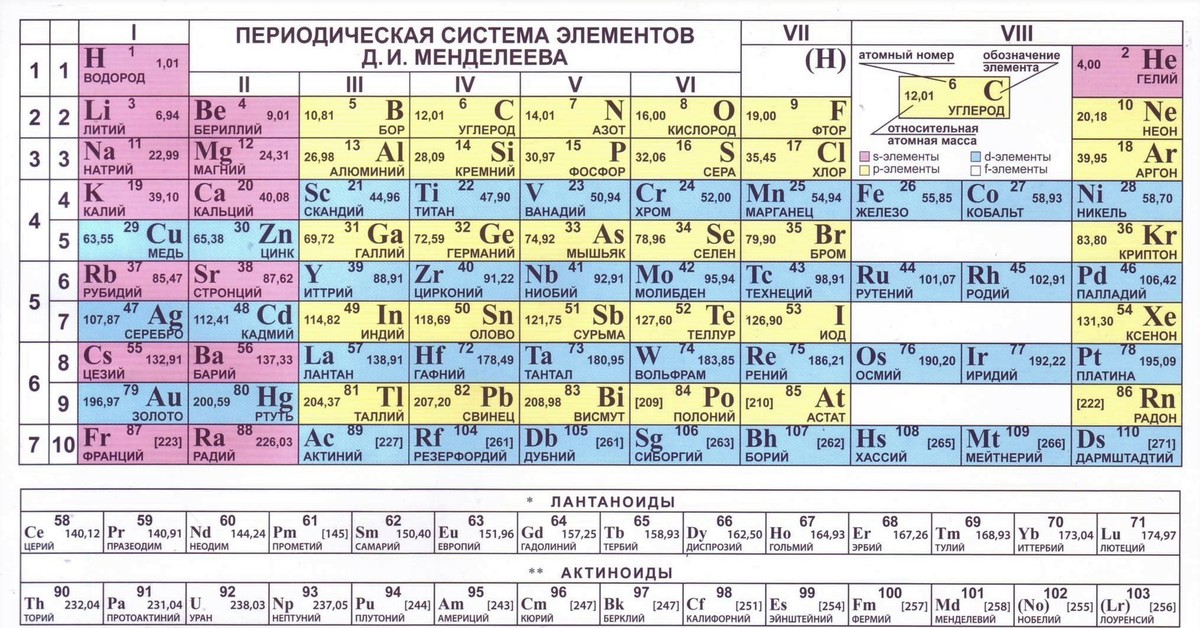
Естественно, первая таблица была несовершенной, и в последующие годы Менделеев многократно дополнял ее и вносил в ее структуру изменения. В момент представления первого варианта таблицы (март 1869 года) не были еще известны благородные (“инертные”) газы (Не, Ne, Ar, Kr, Xe, Rn) и отсутствовали сведения о внутреннем строении атомов. Лишь в двадцатых годах прошлого столетия, после революционных открытий в физике, применения рентгеновских лучей и обнаружения благородных газов, стало возможным дать современное определение закона о периодической зависимости свойств элементов от порядкового номера элемента, а не от атомного веса, как было вначале отмечено Д. Менделеевым. Иными словами, в трактовке закона понятие “атомный вес” элемента было заменено словами “порядковый (или атомный) номер”, что отвечает числу протонов в ядре атома и, соответствен но, числу электронов у нейтрального атома.
 По этой причине 3d-элементы (скандий, титан и др.) появляются лишь в четвертом периоде после двух 4s-элементов (калий и кальций). Они предшествуют 4р-элементам (от галлия до криптона). Этим объясняется возникновение обобщающего термина – “переходные элементы”, “вставная декада”. В пятом периоде наблюдается аналогичная картина, в него с опозданием приходят 4
По этой причине 3d-элементы (скандий, титан и др.) появляются лишь в четвертом периоде после двух 4s-элементов (калий и кальций). Они предшествуют 4р-элементам (от галлия до криптона). Этим объясняется возникновение обобщающего термина – “переходные элементы”, “вставная декада”. В пятом периоде наблюдается аналогичная картина, в него с опозданием приходят 4 Исключение – первый период системы, он находится всегда на особом положении.
Исключение – первый период системы, он находится всегда на особом положении.Таким образом, число элементов в семи известных периодах составляет 2, 8, 8, 18, 18, 32, 32. В соответствии с указанными числами будут наполняться элементами все периоды в порядке возрастания их порядковых номеров. При этом один и тот же элемент может оказаться в различных по номеру группах, что заметно при сравнении двух таблиц.
Рассмотренные цифры позволяют создать таблицы, состоящие из 2, 8, 18 или 32 групп элементов в трех вариантах – из (2+6), (2+6+10) или (2+6+10+14) групп. Исторически, как наиболее удобные, распространение получили в первую очередь таблицы, состоящие из 8 или 18 вертикальных групп:
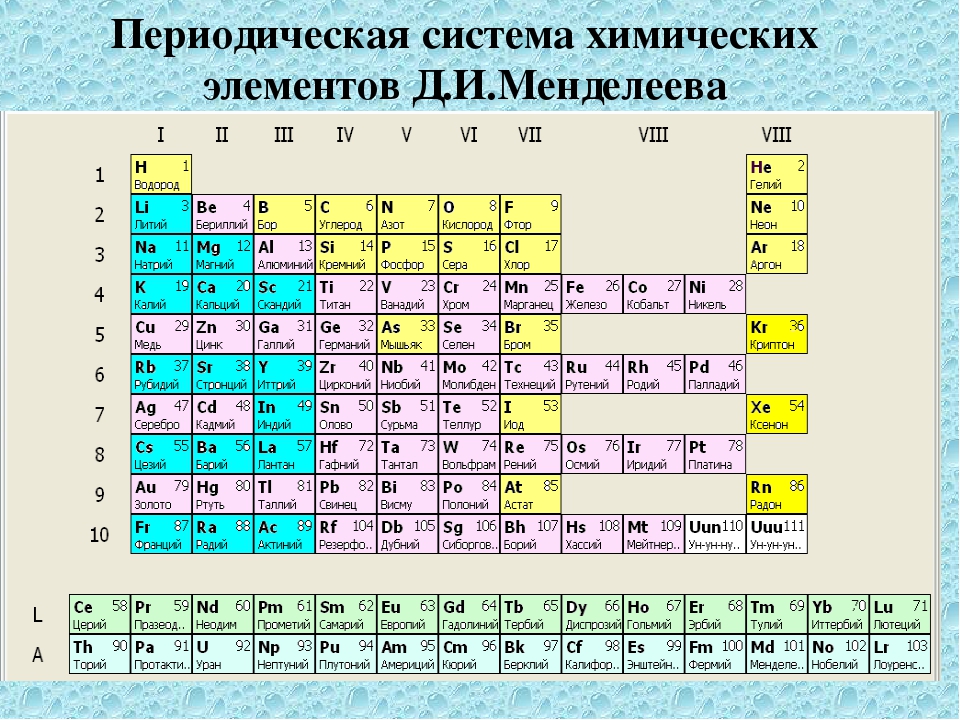
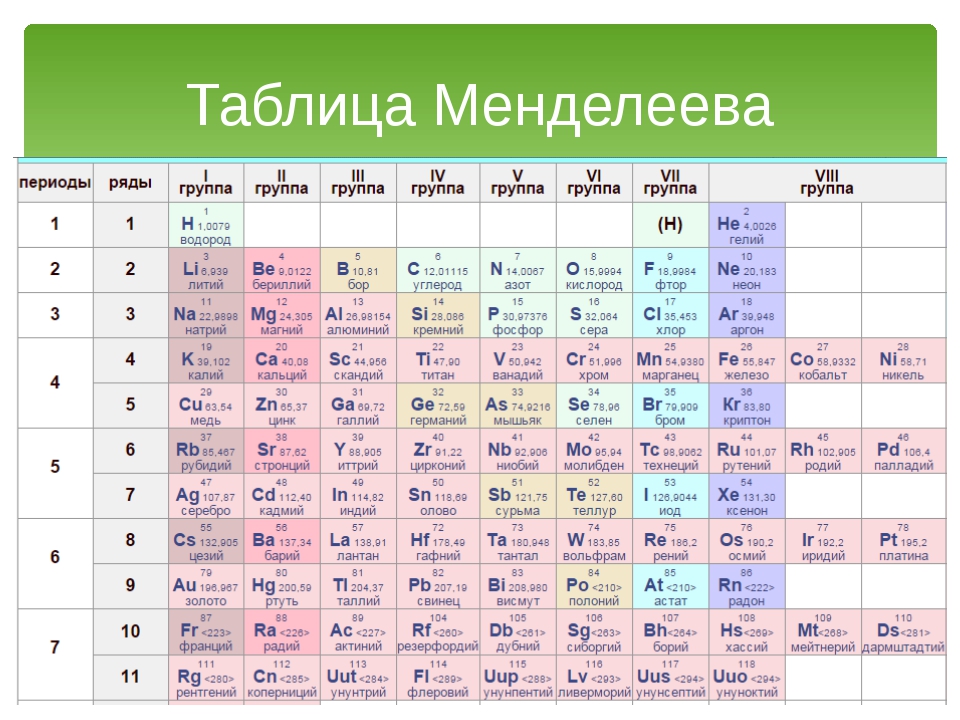
а) Короткая форма таблицы. Она, к сожалению, до сих пор приводится в большинстве российских справочников и учебных пособий, хотя официально отменена ИЮПАК в 1989 году. Таблица состояла из VIII (+0) групп “типических” элементов, подгрупп (иногда и рядов) и периодов элементов. В современной зарубежной литературе эта форма таблицы заменена длинной формой.
В современной зарубежной литературе эта форма таблицы заменена длинной формой.
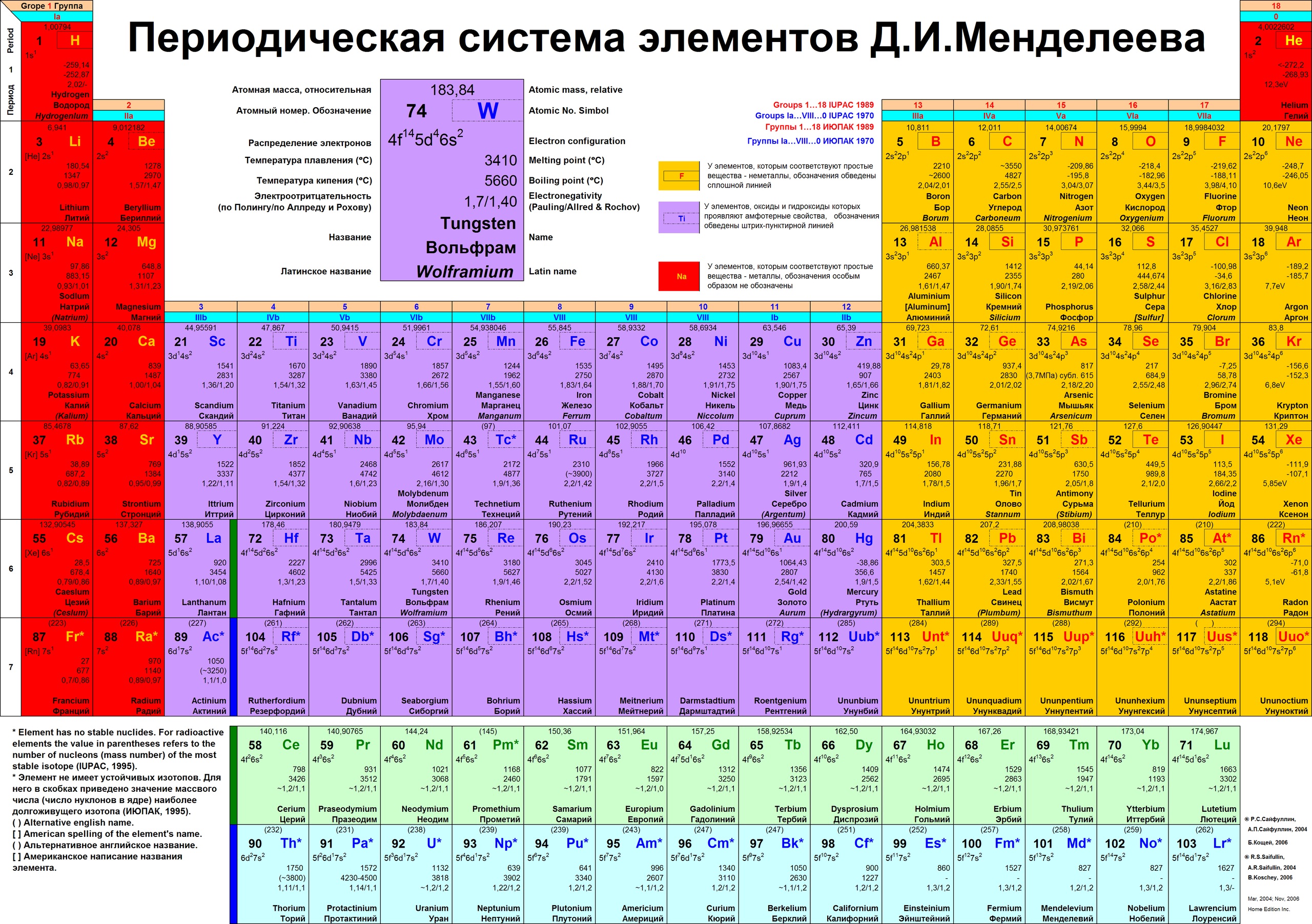
б) Длинная (реже называемая длиннопериодной или полудлинной) форма таблицы. Она была утверждена ИЮПАК в 1989 году, состоит из 18 групп, обозначенных арабскими (вместо римских) цифрами, и не содержит “типических” элементов, подгрупп, рядов и семейств. Ее упрощенные варианты появлялись гораздо раньше, но чаще всего с одним отличием – групп, обозначенных римскими цифрами, было восемь (с их растяжкой до восемнадцати за счет приставок а и b и искусственным созданием триад элементов).
в) Сверхдлинная (реже именуемая длинной) форма таблицы состояла бы из 32 групп элементов. Официально она вряд ли будет принята в предвидимом будущем, так как каждая из 14 дополнительных групп (сверх 18) содержала бы лишь два элемента (один лантаноид и один актиноид), близкие по свойствам ко всем остальным тринадцати элементам периода.
НОВАЯ ФОРМА ТАБЛИЦЫ
До 80-90-х годов прошлого века были распространены две первые формы таблицы. Первая – архаичная короткая форма с “насильственной” упаковкой элементов в восемь (I-VIII), иногда девять (+0) групп, подразделенных дополнительно еще на ряды (8 или 10) и подгруппы, содержавшие два или три “типических” элемента, предшествующих, в свою очередь, двум спорным по названиям (A, B или a, b, “главная” или “побочная”).
Первая – архаичная короткая форма с “насильственной” упаковкой элементов в восемь (I-VIII), иногда девять (+0) групп, подразделенных дополнительно еще на ряды (8 или 10) и подгруппы, содержавшие два или три “типических” элемента, предшествующих, в свою очередь, двум спорным по названиям (A, B или a, b, “главная” или “побочная”).
При выборе и утверждении длинного варианта таблицы были соблюдены “интересы” большинства элементов и принцип “золотой середины” без нарушения основы закона Менделеева – периодичности в свойствах элементов. Сорок элементов (по 10 d-элементов в каждом из периодов с 4 по 7), относимые ранее к “переходным”, или “вставным” (между s- и p-элементами), и называемые “побочными”, после 1989 года перестали быть таковыми. Они стали полноправными компонентами своих новых десяти групп.
С официальным принятием новой формы таблицы исчезли, став лишними, надуманные или принятые вынужденно термины: “типические элементы”, “подгруппа” (главная и побочная), “триада”, “ряды”, “семейства” (железа или платиновых металлов).
Длинная форма таблицы лишена несоответствий, недостатков и очевидных противоречий, присущих ее короткой форме, заметных при первом же взгляде на свойства элементов, искусственно собранных в одну и ту же группу. Так, например, в I группу короткой таблицы попали и металлы Cu, Ag, Au,и противоположные по активности щелочные металлы Na, K, Rb, Cs. Несовместимость свойств “одногрупповых” элементов прослеживается и по всем остальным группам. Обратим внимание лишь на бывшие конечные (VI-VIII)
 Это – соседство в VI группе двух “типических” элементов – O и S и их аналогов Se, Te, Po с тугоплавкими металлами – Cr, Mo, W; в VII группе – элементов, отвечающих агрессивным летучим галогенам F, Cl, Br, I, с не менее тугоплавкими металлами Mn, Tc, Re.
Это – соседство в VI группе двух “типических” элементов – O и S и их аналогов Se, Te, Po с тугоплавкими металлами – Cr, Mo, W; в VII группе – элементов, отвечающих агрессивным летучим галогенам F, Cl, Br, I, с не менее тугоплавкими металлами Mn, Tc, Re.Максимально противоречива структура VIII группы. В нее включены подгруппа VIIIb с “триадой” (“семейство железа” – Fe, Co, Ni) и “семейство платиновых металлов” (Ru, Rh, Pd, Os, Ir, Pt), куда, естественно, должны входить в виде трех вертикальных рядов и только что полученные элементы 108-110, которые никогда не относились к платиновым. В эту же группу входит, противореча здравому смыслу, и подгруппа VIIIa, куда отнесены благородные газы (He, Ne и другие).С уверенностью можно утверждать, что исторически эти триады-семейства были “втиснуты” в прокрустово ложе последней (VIII) группы вынужденно, вопреки логике, так как эта группа, согласно электронной структуре атомов, предназначена природой только для указанных газовых элементов.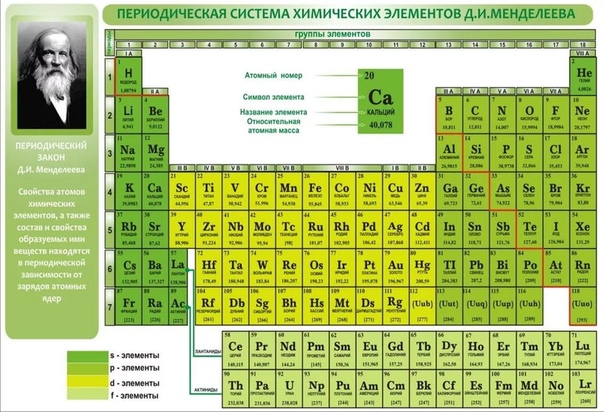 Причина образования такого “Ноева ковчега” проста: четырем триадам из 3(4) декад в каждом периоде при компоновке таблицы из восьми групп не хватило места в ее предшествующих семи группах.
Причина образования такого “Ноева ковчега” проста: четырем триадам из 3(4) декад в каждом периоде при компоновке таблицы из восьми групп не хватило места в ее предшествующих семи группах.
В официально принятой длинной форме таблицы понятия “семейство железа” и “семейство платиновых металлов” исчезают логически, так как к ним, согласно их свойствам, совместному распространению в природе, изоморфизму и последовательному изменению электронной структуры, можно было бы присоединить соседей по таблице и справа и слева. Иными словами, первое семейство можно расширить, например, до ванадия и цинка включительно, а во второе – поместить другие благородные металлы – серебро, золото, ртуть; старые понятия надуманы искусственно, будучи привязаны к структуре бывшей VIII группы.
В предложенную таблицу для каждого элемента введены также две альтернативные величины относительной электроотрицательности (ОЭО) атомов (их способности в молекуле притягивать электроны, участвующие в образовании химических связей) и основные физические параметры соответствующих простых веществ. Использовать значения ОЭО важно, в частности, для исключения и исправления устаревших ошибочных названий и написания химических формул бинарных соединений. Например, водородные соединения элементов второго периода Н4С, Н3N, H2О, НF согласно значениям ОЭО (для водорода около 2,0, для других элементов – от 2,5 для углерода до 4,0 для фтора) называются соответственно карбидом, нитридом, оксидом и фторидом водорода. В соответствии с этим приведенные написания формул аммиака и метана более справедливы, нежели традиционные (NH3 и СН4).
Использовать значения ОЭО важно, в частности, для исключения и исправления устаревших ошибочных названий и написания химических формул бинарных соединений. Например, водородные соединения элементов второго периода Н4С, Н3N, H2О, НF согласно значениям ОЭО (для водорода около 2,0, для других элементов – от 2,5 для углерода до 4,0 для фтора) называются соответственно карбидом, нитридом, оксидом и фторидом водорода. В соответствии с этим приведенные написания формул аммиака и метана более справедливы, нежели традиционные (NH3 и СН4).
Однако, несмотря на справедливое разрешение ИЮПАК давно назревшей проблемы и принятие новой системы во всем мире, ее использование в российском образовании и науке неоправданно запаздывает. Вместе с тем есть и отрадные исключения из этого. Помимо ряда изданий нового варианта таблицы, предложенного авторами настоящей статьи, можно отметить публикации простых вариантов длинной формы таблицы рядом передовых российских издательств, а современной таблицы на двух языках – в новом семитомном справочном издании. В отличие от российских, зарубежное образование и наука приняли к исполнению решение ИЮПАК 1989 года незамедлительно. Интернет также сообщает только о наличии длинной формы таблицы.
В отличие от российских, зарубежное образование и наука приняли к исполнению решение ИЮПАК 1989 года незамедлительно. Интернет также сообщает только о наличии длинной формы таблицы.
Современный вариант периодической системы, первый в российских публикациях, был создан в 1999 году. Новая форма таблицы Менделеева учебно-справочного назначения отвечает международным стандартам. Кроме русских и латинских названий элементов в ней приводятся английские и американские формы их написания. Чтобы сохранить преемственность таблиц и упростить использование ее длинной формы, новые номера групп в ней согласованы со старыми (римскими) номерами групп (I – VIII) и подгрупп (a, b), хотя зарубежные источники прежние обозначения уже не указывают. Упрощенные варианты рациональной длинной таблицы были распространены еще задолго до 1989 года, в том числе в СССР, с одним отличием – номеров групп было восемь (они обозначались римскими цифрами), но они “растягивались” до восемнадцати за счет приставок а и b и искусственного создания триад элементов.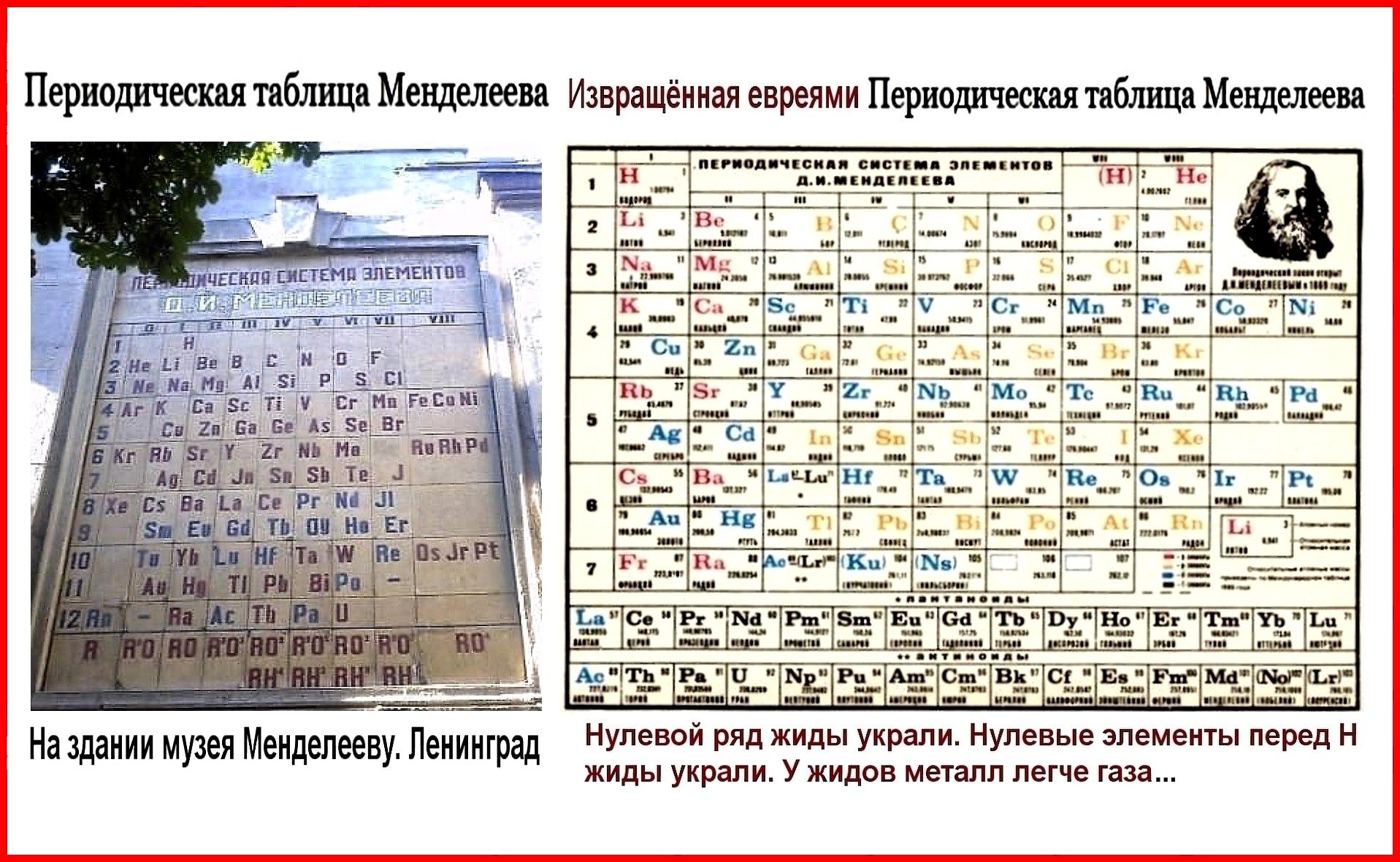 В новой таблице приведены исправленные атомные массы элементов, утвержденные ИЮПАК в 1995 году, и новые названия десяти последних элементов, окончательно утвержденные, также этой организацией, в 1997-м. Аналоги такой системы, в основном англоязычные, широко распространены в зарубежной литературе.
В новой таблице приведены исправленные атомные массы элементов, утвержденные ИЮПАК в 1995 году, и новые названия десяти последних элементов, окончательно утвержденные, также этой организацией, в 1997-м. Аналоги такой системы, в основном англоязычные, широко распространены в зарубежной литературе.
Авторы благодарныпрофессорам С. Г. Дьяконову,Н. В. Коровину, А. М. Кочневу, А. М. Кузнецову, Г. В. Лисичкину, А. И. Михайличенко, Ю. И. Сальникову, С. Н. Соловьеву, Н. А. Улаховичу, А. И. Хацринову и др., поддержавшим высказанные идеи или давшим полезные советы при оформлении современной таблицы Д. И. Менделеева.
ЛИТЕРАТУРА
Лидин Р. А. и др. Химия в помощь абитуриенту. – М.: Дрофа, 2001. 576 с.
Никольский А. Б., Суворов А. В. Химия. – СПб.: Химиздат, 2001. 512 с.
Новый справочник химика и технолога. – СПб.: НПО “Мир и семья”, 2002. Т. 1, 954 с. Т. 2, 1276 с.
Сайфуллин Р. С., Сайфуллин А. Р. Универсальный лексикон: химия, физика и технология; R. S.Saifullin, A.R.Saifullin. Universal Concise Dictionary: Chemistry, Physics andTechnology. – М.: Логос, 2001, 2002. 548 с.
S.Saifullin, A.R.Saifullin. Universal Concise Dictionary: Chemistry, Physics andTechnology. – М.: Логос, 2001, 2002. 548 с.
Хаускрофт К., Констебле Э.. Современный курс общей химии/ Пер. с англ. – М.: Мир, 2002. Т. 1, 252 с. Т. 2, 250 с.
Химия, справочник школьника и студента / Коллектив авторов. Пер. с нем. Изд. 2-е. – М.: Дрофа, 2000. 384 с.
Хисамиев Г. Г. Общая химия, задачи и упражнения (для вузов). – Казань: Магариф, 1999. 368 с.
Эмсли Дж. Элементы. – М.: Мир, 1993. 258 с.
Oxford Dictionary of Science / Ed. Isaacs A., Daintith J., Martin E. Oxford University Press, Oxford, New York, 1999. 858 p.
The New Encyclopedia Britannica, 15-th Ed., Encyclopedia Britannica, Inc. Chicago, 1974-1994.
Hawley’s Condensed Chemical Dictionary, 11-nd Ed Rev. N.I. Sax, R.J. Lewis, Sr. Van Nostrand Rheinhold Co., N.Y., 1987. 1303 p.
WebElementsTM Periodic table (professional edition) (http://www.webelements.com/. 1993-2003).
Krzysztof M. Pazdro, Chemia dla licealistov (Budowa materii w ochach chemika), Wyd. II. Oficyna Edukacyjna, Warszawa, 1996. 246 p.
Pazdro, Chemia dla licealistov (Budowa materii w ochach chemika), Wyd. II. Oficyna Edukacyjna, Warszawa, 1996. 246 p.
Подписи к иллюстрациям
Илл. 1. В современном варианте таблицы Менделеева приведены уточненные в 1995 году значения атомных масс и утвержденные в 1997 году названия девяти полученных искусственно элементов №№ 101-109.
Наука и жизнь // Иллюстрации
Наука и жизнь // Иллюстрации
Наука и жизнь // Иллюстрации
Наука и жизнь // Иллюстрации
Наука и жизнь // Иллюстрации
Наука и жизнь // Иллюстрации
‹
›
Таблица Менделеева. История создания, принцип организации
В своей работе 1668 года Роберт Бойль привёл список неразложимых химических элементов. Было их на тот момент всего пятнадцать. При этом учёный не утверждал, что кроме перечисленных им элементов больше не существует и вопрос об их количестве оставался открытым.
Через сто лет французский химик Антуан Лавуазье составил новый список из известных науке элементов. В его реестр попали 35 химических веществ, из которых 23 были впоследствии признаны теми самыми неразложимыми элементами.
В его реестр попали 35 химических веществ, из которых 23 были впоследствии признаны теми самыми неразложимыми элементами.
Работа по поиску новых элементов велась химиками во всём мире и продвигалась вполне успешно. Решающую роль в этом вопросе сыграл русский учёный-химик Дмитрий Иванович Менделеев: именно ему пришла в голову идея о возможности существования взаимосвязи между атомной массой элементов и их местом в “иерархии”. По его собственным словам “надо искать… соответствия между индивидуальными свойствами элементов и их атомными весами”.
Сопоставляя между собой известные в то время химические элементы, Менделеев после колоссальной работы обнаружил в итоге ту зависимость, общую закономерную связь между отдельными элементами, в которой они предстают как единое целое, где свойства каждого элемента является не чем-то само собой существующим, а периодически и правильно повторяющимся явлением.
Так в феврале 1869 года был сформулирован периодический закон Менделеева. В том же году 6 марта доклад, подготовленный Д.И. Менделеевым, под названием “Соотношение свойств с атомным весом элементов” был представлен Н.А. Меншуткиным на заседании Русского химического общества.
В том же году 6 марта доклад, подготовленный Д.И. Менделеевым, под названием “Соотношение свойств с атомным весом элементов” был представлен Н.А. Меншуткиным на заседании Русского химического общества.
В том же году публикация появилось в немецком журнале “Zeitschrift für Chemie”, а в 1871 году в журнале “Annalen der Chemie” вышла развёрнутая публикация Д.И. Менделеева, посвящённая его открытию — “Die periodische Gesetzmässigkeit der Elemente” (Периодическая закономерность химических элементов).
Несмотря на то, что идея сформировалась у Менделеева за довольно короткий срок, оформить свои умозаключения он долго не мог. Ему было важно представить свою идею в виде ясного обобщения, строгой и наглядной системы. Как сказал однажды сам Д.И. Менделеев в беседе с профессором А.А. Иностранцевым: “Все в голове сложилось, а выразить таблицей не могу”.
По данным биографов, после этого разговора учёный работал над созданием таблицы три дня и три ночи, не ложась спать.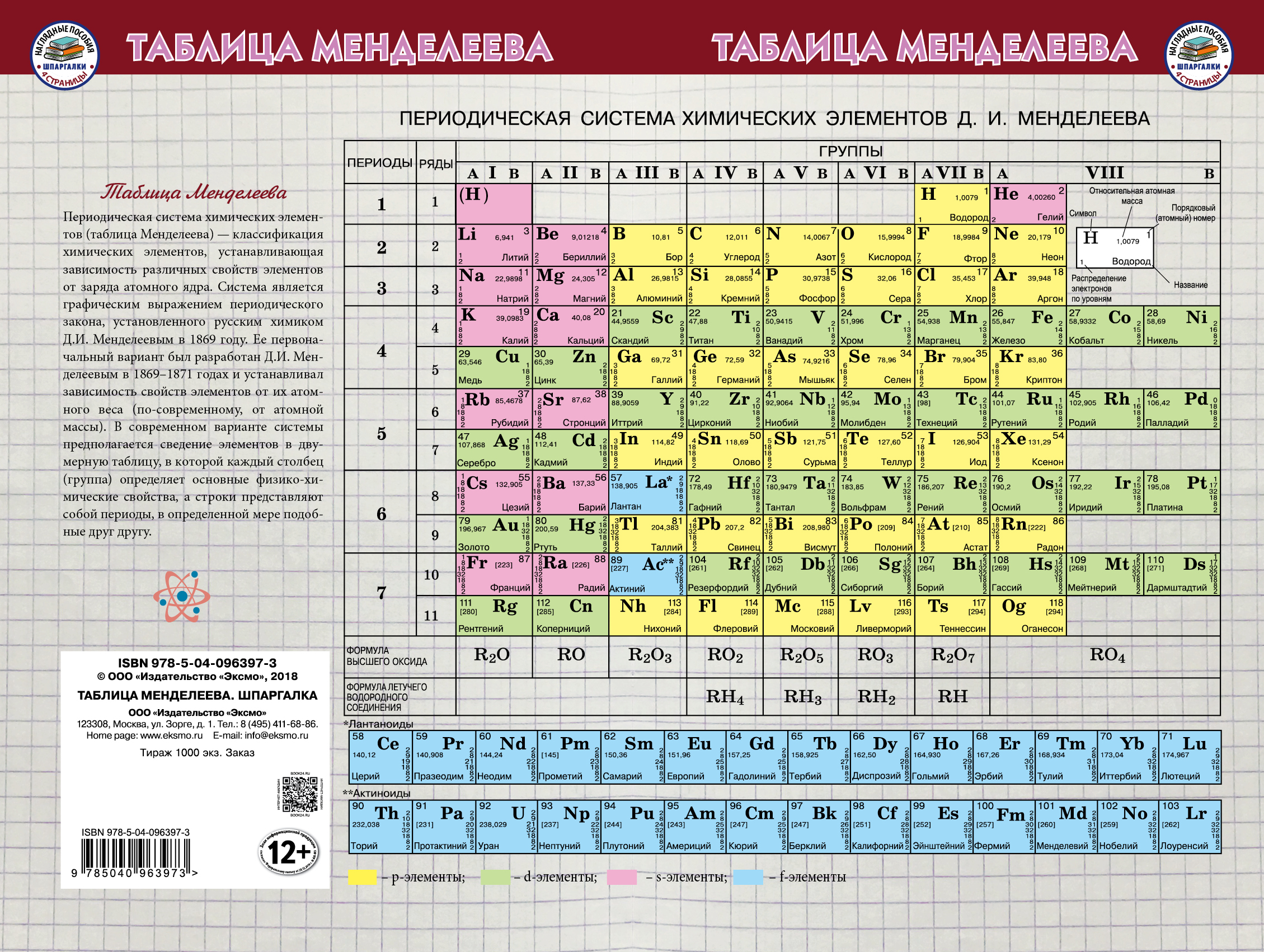 Он перебирал различные варианты, в которых могли бы быть скомбинированы элементы для организации в таблицу. Осложнялась работа и тем, что на момент создания периодической системы далеко не все химические элементы были известны науке.
Он перебирал различные варианты, в которых могли бы быть скомбинированы элементы для организации в таблицу. Осложнялась работа и тем, что на момент создания периодической системы далеко не все химические элементы были известны науке.
В 1869—1871 годах Менделеев продолжал развивать выдвинутые и принятые научным сообществом идеи периодичности. Одним из шагов было введение понятия о месте элемента в периодической системе как совокупности его свойств в сопоставлении со свойствами других элементов.
Именно на основе этого, а также с опорой на результаты, полученные в ходе изучения последовательности изменения стеклообразующих оксидов, Менделеев исправил значения атомных масс 9 элементов, в числе которых были бериллий, индий, уран и другие.
В ходе работы Д.И. Менделеев стремился заполнить пустые клетки составленной им таблицы. В результате в 1870 году им было предсказано открытие неизвестных на тот момент науке элементов. Менделеев вычислил атомные массы и описал свойства трёх ещё не открытых тогда элементов:
- “экаалюминия” – открыт в 1875 году, назван галлием,
- “экабора” – открыт в 1879 году, назван скандием,
- “экасилиция” – открыт в 1885 году, назван германием.

Следующие его реализовавшиеся прогнозы – открытие ещё восьми элементов, в том числе полония (открыт в 1898 году), астата (открыт в 1942—1943 годах), технеция (открыт в 1937 году), рения (открыт в 1925 году) и франция (открыт в 1939 году).
В 1900 году Дмитрий Иванович Менделеев и Уильям Рамзай пришли к выводу о необходимости включения в периодическую систему элементов особой, нулевой группы. Сегодня эти элементы называются благородными газами (до 1962 года эти газы называли инертными).
В своей таблице Д.И. Менделеев расположил химические элементы по рядам в порядке возрастания их массы, подобрав длину рядов таким образом, чтобы химические элементы в одной колонке имели похожие химические свойства.
Благородные газы – гелий, неон, аргон, криптон, ксенон и радон неохотно реагируют с другими элементами и проявляют низкую химическую активность и потому находятся в крайней правой колонке.
В противоположность этому элементы самой левой колонки — литий, натрий, калий и прочие реагируют с другими веществами бурно, процесс носит взрывной характер.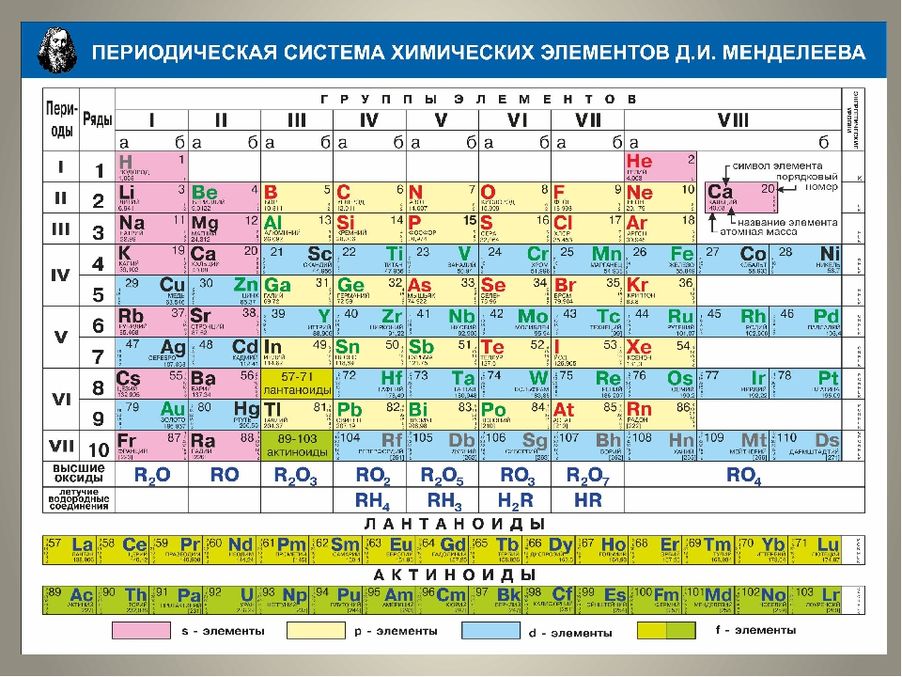 Аналогично ведут себя элементы в других колонках таблицы — внутри колонки эти свойства подобны, но варьируются при переходе от одной колонки к другой.
Аналогично ведут себя элементы в других колонках таблицы — внутри колонки эти свойства подобны, но варьируются при переходе от одной колонки к другой.
Периодическая система в своем первом варианте просто отражала существующее в природе положение дел. Первоначально таблица никак не объясняла, почему это должно быть именно так. И только с появлением квантовой механики стал понятен истинный смысл расположения элементов в периодической таблице.
Химические элементы вплоть до урана (содержит 92 протона и 92 электрона) встречаются в природе. Начиная с номера 93 идут искусственные элементы, созданные в лабораторных условиях.
Короткая таблица – Большая Энциклопедия Нефти и Газа, статья, страница 4
Короткая таблица
Cтраница 4
Уже при жизни Менделеева появились различные варианты периодической таблицы, авторы которых пытались улучшить и усовершенствовать ( часто совершенно необоснованно) классическую короткую таблицу Менделеева и развернутую длинную, предложенную им же. Так, семейство редкоземельных элементов было предложено выделить в особую интергруппу. Размещение элементов, предложенное в 1909 г. Вернером ( см. [39], стр. Менделеевым в 1871 – 1903 гг. Развернутая таблица Менделеева точнее, поскольку в ней предусмотрены места для лантаноидов и правильно в порядке возрастания атомных весов размещены церий, торий и уран.
[46]
Так, семейство редкоземельных элементов было предложено выделить в особую интергруппу. Размещение элементов, предложенное в 1909 г. Вернером ( см. [39], стр. Менделеевым в 1871 – 1903 гг. Развернутая таблица Менделеева точнее, поскольку в ней предусмотрены места для лантаноидов и правильно в порядке возрастания атомных весов размещены церий, торий и уран.
[46]
Учитывая относительно редко встречающиеся Случаи кратности комплексных и мнимых корней выше двух, для различных комбинаций параметров приведенного знаменателя может быть составлена сравнительно короткая таблица соответствий. [47]
U, In, Th, Y, Се и его спутников), переместив эти элементы па другие, соответствующие им места в короткой таблице, и, во-вторых, совершенно точно предсказать свойства неоткрытых еще элементов ( будущих Ga, So, Ge), исходя из пустующих мест в короткой таблице. Таким образом, речь идет об истории подготовки и совершения того великого научного подвига, по выражению Энгельса, который принес неувядаемую славу русской науке, русскому народу, выдвинувшему такого гения, как Менделеев.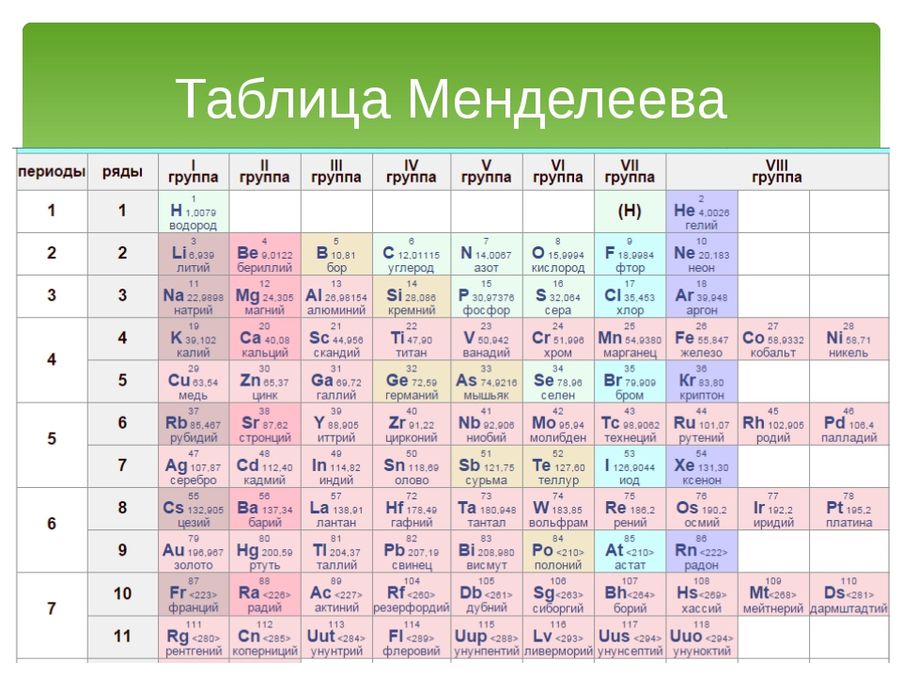 [48]
[48]
Использование атомных и вообще удельных объемов v в качестве функции от атомных весов позволило выявить еще с другой стороны различие между нечетными п четными рядами в короткой таблице: в нечетных рядах v падает, в четных v растет с увеличением атомных весов. Вместе с тем было установлено возрастание или постоянство v в пределах каждой группы с увеличением атомных весов. Это дало возможность, во-первых, правильно распределить самые тяжелые элементы по группам, устранив в этой области таблицы нарушения принципа расположения элементов по величине атомных весов; во-вторых, исследование зависимости v от атомных весов показало неправомерность первоначального помещения урана между Cd и Sn. [49]
Все обозначения, равно как и расположение Hg, Ли, Bi, Tl, Pb, даны так, как если бы соответствующие таблицы были преобразованы в короткую таблицу вертикального типа, причем прямую, а не обратную.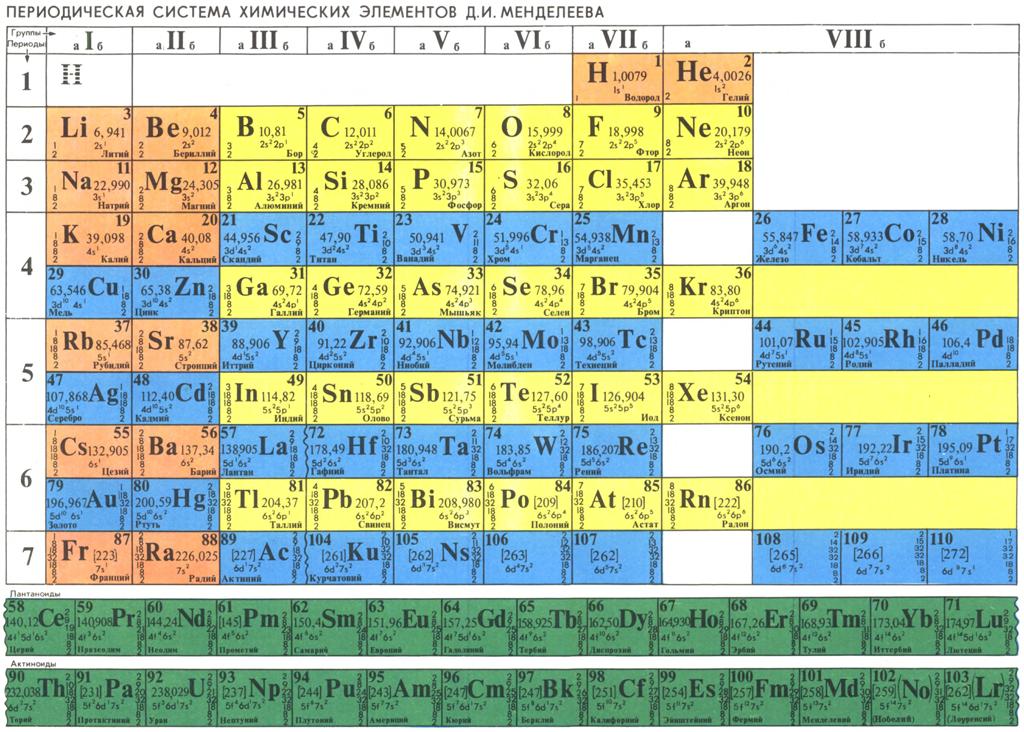 [50]
[50]
Тот факт, что результаты электронной теории так легко и естественно уложились в как бы специально предназначенные для них Менделеевым подвижные табличные формы, еще раз доказывает, что именно короткая таблица и именно с точки зрения электронного строения атома является наиболее совершенной для выражения периодической системы как естественной системы элементов. [51]
Менделеев в дневнике записывает мысли о неаддитивности удельных объемов окислов и хлористых соединений по отношению к исходным компонентам; распределяет данные об объемах окислов и хлористых соединений по группам, составляет из них короткие таблицы и намечает проверку того, аддитивны ли удельные объемы минералов по отношению к их компонентам. [52]
U, In, Th, Y, Се и его спутников), переместив эти элементы па другие, соответствующие им места в короткой таблице, и, во-вторых, совершенно точно предсказать свойства неоткрытых еще элементов ( будущих Ga, So, Ge), исходя из пустующих мест в короткой таблице. Таким образом, речь идет об истории подготовки и совершения того великого научного подвига, по выражению Энгельса, который принес неувядаемую славу русской науке, русскому народу, выдвинувшему такого гения, как Менделеев.
[53]
Таким образом, речь идет об истории подготовки и совершения того великого научного подвига, по выражению Энгельса, который принес неувядаемую славу русской науке, русскому народу, выдвинувшему такого гения, как Менделеев.
[53]
Страницы: 1 2 3 4
Занимательная химия – о сайте
Вспомните, любили ли вы химию в школе, интересно ли было вам? Вряд ли… А все потому, что в школе слишком мало занимательных экспериментов и опытов, только сухие формулы и множество непонятных законов. Смеем предположить, что тоже самое будет и с вашими детьми. Поэтому мы попытались исправить эту ситуацию создав этот сайт по химии! На нашем сайте вы не найдете скучных рассуждений, только интересные факты и химические опыты, которые, мы надеемся, помогут пробудить интерес вашего ребёнка к химии. И вполне возможно, что и ваше мнение о том, что химия скучная наука — изменится!
С уважением,
Команда сайта «Занимательная химия»
Post Scriptum
Задачи по химии
Также предлагаем вашему вниманию еще один замечательный ресурс о химической науке, помогающий студентам ВУЗов, любителям и профессионалам в этой области находить ответы на самые каверзные вопросы, — это сайт Задачи по химии.
Профессиональный сайт содержит знания в семи различных отраслях химии: органическая, неорганическая, биохимия и другие. Информативная база опирается на такие источники как химическая и советская энциклопедии, гетероциклы и углеводы, справочники и номенклатуры.
Представлена подробная, развернутая таблица Менделеева. Каждый элемент рассмотрен со сторон физических и химических свойств, основных агрегатных состояний наиболее популярных соединений, встречающихся в природе или имеющих огромное значение при синтезе.
Если тяжело разобраться что с чем реагирует, чего ожидать от подобного союза, то Вам сюда. Здесь рассмотрено множество реакций органического, неорганического и элементорганического плана. Указаны условия проведения синтеза, промежуточные и конечные продукты и подобные описания превращений. Также на сайте Задачи по химии есть функция составления собственных уравнений химических реакций.
Помимо того, что возможно беспрепятственно найти ту или иную сложную или простую формулу вещества, также имеется отличный редактор формул, где составить что-то и проверить на правильность не составит особого труда.
Для начального этапа обучения, например, в высшем учебном заведении на химфаке потребуется навыки построения электронной оболочки атома. Эти знания также предоставляет этот полезный научный ресурс.
Конвертер величин переводит величину из одного измерения в другое, категория «Термодинамические свойства» повествует о необычных показателях таких, как энтальпия, энтропия, теплоты образования и разложения и прочее.
Таким образом, вышеупомянутый источник – незаменимый помощник в освоении и использовании химической науки.
ОГЭ по химии 2020: расписание, критерии оценивания, баллы
Основные изменения в новой демоверсииВ 2020 году предлагается только одна модель КИМ.
Увеличена доля заданий с множественным выбором ответа (6, 7, 12, 14, 15) и заданий на установление соответствия между позициями двух множеств (10, 13, 16). Добавлено задание 1, предусматривающее проверку умения работать с текстовой информацией.
В часть 2 включено задание 21, направленное на проверку понимания существования взаимосвязи между различными классами неорганических веществ и сформированности умения составлять уравнения реакций, отражающих эту связь. Ещё одним контролируемым умением является умение составлять уравнения реакций ионного обмена, в частности сокращённое ионное уравнение.
В экзаменационный вариант добавлена обязательная для выполнения практическая часть, которая включает в себя два задания: 23 и 24. В задании 23 из предложенного перечня необходимо выбрать два вещества, взаимодействие с которыми отражает химические свойства указанного в условии задания вещества, и составить с ними два уравнения реакций. Задание 24 предполагает проведение двух реакций, соответствующих составленным уравнениям реакций.
Скоро мы поговорим о грядущем ОГЭ на вебинарах и в эфире нашего канала на YouTube.
Характеристика структуры и содержания КИМ ОГЭ
Все задания разделены на две части:
|
Части работы |
Тип ответа |
Максимальный балл |
Количество заданий |
|
Часть 1 |
С кратким ответом |
24 |
19 |
| Часть 2 |
С развернутым ответом |
16 |
5 |
Продолжительность ОГЭ по химии составит 140 минут.

ОГЭ. Химия. Большой сборник тематических заданий для подготовки к основному государственному экзамену
Вниманию учащихся и учителей предлагается новое учебное пособие, которое поможет успешно подготовиться к основному государственному экзамену по химии в 9 классе. Сборник содержит вопросы, подобранные по разделам и темам, проверяемым на основном государственном экзамене, и включает задания разных типов и уровней сложности. В конце пособия приводятся ответы на все задания. Предлагаемые тематические задания помогут учителю организовать подготовку к основному государственному экзамену, а учащимся — самостоятельно проверить свои знания и готовность к сдаче выпускного экзамена.
КупитьВне зависимости от уровня сложности экзамена, на ОГЭ по химии учащимся разрешено брать с собой:
-
таблицу Менделеева;
-
электрохимический ряд напряжений металлов;
-
таблицу растворимости в воде солей, кислот и оснований;
-
непрограммируемый калькулятор;
-
лабораторное оборудование для проведения химических опытов, предусмотренных заданиями.

Проект расписания ОГЭ-2020 по химии
Экзаменационный период состоит из трёх частей: досрочный, основной и дополнительный для пересдачи экзамена осенью.
Предполагаемые даты проведения экзаменов в соответствии с проектом, представленным на сайте Рособрнадзора:
|
Досрочный период |
|
|
Основной день 27 апреля (пн) |
Резервный день 13 мая (ср) 16 мая (сб) |
|
Основной период |
|
|
Основной день 26 мая (вт) 29 мая (пт) |
Резервные дни 20 июня (сб) 23 июня (вт) 25 июня (чт) 30 июня (вт) |
|
Осенняя пересдача |
|
|
1 пересдача 18 сентября (пт) |
2 пересдача 19 сентября (сб) 21 сентября (пн) |
Досрочный период для сдачи ОГЭ по химии в 2020 году предусмотрен для:
-
выпускников 2018-2019 учебного года, которые не смогли преодолеть минимальный балловый порог или решили улучшить свои показатели;
-
выпускников 2019-2020 учебного года (просьба учащегося в разрешении сдавать ОГЭ по химии досрочно рассматривается педсоветом учебного заведения).

Основной период для сдачи ОГЭ предусмотрен для большей части выпускников.
Дни осенней пересдачи предусмотрены для учащихся, которые не смогли с первого раза преодолеть минимальный порог на сдаче ОГЭ. Однако возможность пересдать неудачный экзамен получат только учащиеся с неудовлетворительными баллами по одному или двум дисциплинам. Ученикам, которые не смогли справиться с большим количеством предметов, придётся потратить на подготовку к пересдаче экзаменов весь следующий год.
Резервные дни всех периодов помогут учащимся, которые не смогли присутствовать на сдаче экзамена по уважительной причине.
Баллы ОГЭ по химии
За успешное выполнение заданий по химии ОГЭ-2020 учащийся сможет получить 40 тестовых баллов:
Результат ОГЭ заносится в аттестат учащегося. Для перевода тестового балла ОГЭ по химии в пятибалльную отметку ФИПИ рекомендует пользоваться следующей таблицей соответствия:
|
Отметка |
|
|
5 |
31-40 |
|
4 |
21-30 |
|
3 |
10-20 |
|
2 |
0-9 |
Таким образом, для сдачи экзамена учащемуся требуется получить за экзамен отметку «удовлетворительно», то есть набрать минимум 10 тестовых баллов (справедливо для экзаменов любого уровня сложности).
 Естественно, что для успешного поступления в другое учебное заведение такого балла будет недостаточно.
Естественно, что для успешного поступления в другое учебное заведение такого балла будет недостаточно. Что ещё почитать?
Критерии оценивания
Экзаменационные бланки предварительно закодированы, а начисление тестовых баллов выполняется согласно нормам, разработанным специалистами ФИПИ. Чтобы полностью исключить субъективное мнение при оценивании развёрнутых ответов, подобные полные ответы изучаются двумя преподавателями. Если разница в оценивании заданий превысила два балла, работа проверяется третьим, контрольным, преподавателем. Если же разница менее двух баллов, то выставляется среднее арифметическое двух оценок.
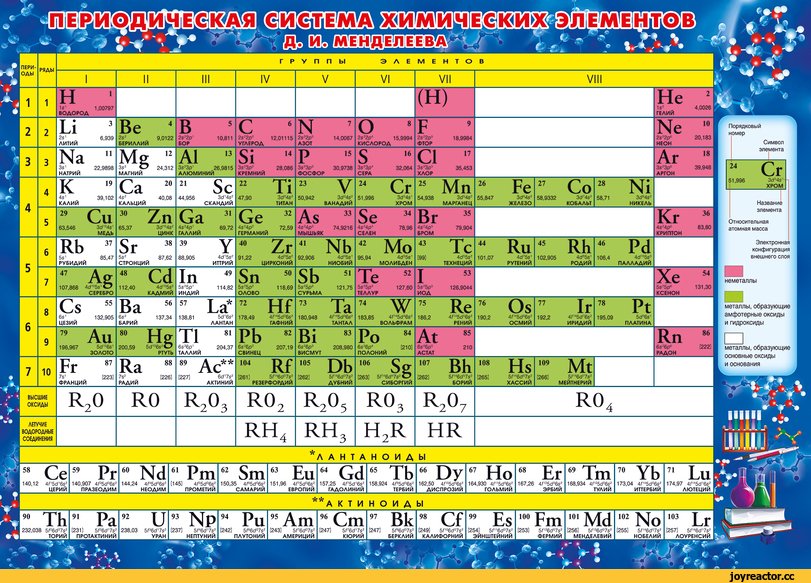
#ADVERTISING_INSERT#Периодический закон и ПСХЭ Д.И. Менделеева в свете учения о строении атома
1. Периодический закон и ПСХЭ Д. И. Менделеева в свете учения о строении атома.
1.2.
3.
4.
5.
6.
Химический элемент – это…
Атом – это ___________________ .
Изотоп – это разновидность атома
одного химического элемента…
Электрон – заряд равен ____, масса
равна__________.
Нейтрон – ________________________.
Протон – это…
3. Дмитрий Иванович Менделеев (1834-1907 )
.Выдающийся
русский химик,
открывший
периодический
закон и создавший
периодическую
систему химических
элементов.
3
Первый вариант таблицы элементов, выражавшей
периодический закон, Менделеев опубликовал в виде
отдельного листка под названием «Опыт системы
элементов, основанной на их атомном весе и
химическом сходстве» (март 1869 г.).
4
5. Современная периодическая таблица Д.И.Менделеева
08.09.20185
6. Развёрнутая форма периодической системы
08.09.20186
7. Структура периодической системы:
Формулировка периодическогозакона
«Свойства химических
элементов и их соединений
находятся в периодической
зависимости от величины
заряда ядер их атомов.».
Принцип построения
периодической системы
«Периодическая система
построена в порядке
возрастания атомной массы».

Принцип периодичности
«Периодичность – это
повторение химических
свойств через каждые восемь
элементов на девятый»
Понятие периода
А) Период – это
расположение
элементов по
горизонтали..
Б) Период начинается с
щелочного металла и
заканчивается
инертным газом.
В) В периодической
системе всего 7
периодов, 1,2,3 малые и
4,5,6,7 большие
Г) Период показывает
количество
энергетических
уровней.
7
8. Структура периодической системы:
Понятие группыА) Группа – это расположение
элементов по вертикали.
Б) В периодической системе всего
8 групп, каждая группа
подразделяется на:
главную, в которой происходит
заполнение электронов на
внешнем энергетическом
уровне и побочную в которой
происходит заполнение
предвнешнего энергетического
уровня.
В) Группа показывает количество
электронов на внешнем
энергетическом уровне только в
главных подгруппах.
Г) Группа показывает наивысшую
степень окисления в
соединениях с кислородом.
Понятие порядкового номера
Порядковый номер
показывает:
А) Заряд ядра атома.
Б) Количество протонов.
В) Количество нейтронов,
которые вычисляются
между разностью молярной
масс и порядковым
номером.
Г) Количество электронов,
которые движутся вокруг
атома и несут
отрицательный заряд.
08.09.2018
8
Закономерности
1) В периодах степень окисления в высших
оксидах и гидроксидах _ _ _ _ _ _ _ _ _
от _ _ до _ _
2) Высшие оксиды и гидроксиды от_ _ _ _ _
_ _ _ через _ _ _ _ _ _ _ _ _ _ сменяются
__________
08.09.2018
10
Домашнее задание: впиши пропущенные
слова
В пределах одного периода с увеличением
порядкового номера элемента металлические
свойства _ _ _ _ _ _ _ _ _ _ , а
неметаллические _ _ _ _ _ _ _ _ _ _, так как:
Заряды атомных ядер _ _ _ _ _ _ _ _ _ _ _ _ _
Число электронов на внешнем электронном
слое _ _ _ _ _ _ _ _ _ _ _ _ _
Число электронных слоев _ _
________
(оно равно номеру _ _ _ _ _ _ _ )
Радиус атома _ _ _ _ _ _ _ _ _ _ _
08.
 09.2018
09.201811
Домашнее задание: впиши пропущенные
слова
В пределах одной группы (главной подгруппы) с
увеличением порядкового номера элемента
металлические свойства _ _ _ _ _ _ _ _ _ _ _ ,
а неметаллические _ _ _ _ _ _ _ _ _ _, так
как:
Заряды атомных ядер _ _ _ _ _ _ _ _ _ _ _ _ _
Число электронов на внешнем электронном
слое _ _ _ _ _ _ _ _ _ _ _ _
(оно равно номеру _ _ _ _ _ _)
Число электронных слоев _ _ _ _ _ _ _ _ _ _ _
Радиус атома _ _ _ _ _ _ _ _ _ _ _ _ _
08.09.2018
12
План характ ерист ики химического
элемент а:
1. Положение в ПСХЭ:
-Порядковый номер
– Номер периода
-Номер группы
-Главная или побочная подгруппа
2. Строение атома:
-Число электронов, протонов, нейтронов
-Распределение электронов по уровням
-Электронная формула
3. Прогноз свойств:
-Металл или неметалл
-Предполагаемые формулы и свойства
соединений
08.09.2018
13
ХАРАКТЕРИСТИКА ЭЛЕМЕНТА ПО ПОЛОЖЕНИЮ
В ПЕРИОДИЧЕСКОЙ СИСТЕМЕ Д.
 И.
И.МЕНДЕЛЕЕВА
31
15
Р – 3 период, VA группа
31
15
Р · +15 )2 )8 )5 1S² 2S² 2p⁶ 3S² 3p3
СО = -3, +3, +5
Неметалл
Высший оксид – Р2О5 – кислотный
Гидроксид – Н3РО4 – фосфорная кислота
Важнейшие соли – Са3(РО4)2 – фосфаты
Летучее водородное соединение – РН3 фосфин
Задание: подчеркните символы химических
элементов-металлов и расположите их в
порядке ослабления металлических
свойств:
А) Cl; Al; S; Na; P; Mg; Si
Б) Sn; As; N; Ge; C; Pb
08.09.2018
15
Задание: подчеркните символы химических
элементов-неметаллов и расположите их в
порядке усиления неметаллических
свойств:
А) Li; F; N; Be; O; B; C
Б) Bi; As; N; Sb; P
08.09.2018
16
Задание.
а)
б)
в)
а)
б)
в)
Расположи химические
элементы в порядке возрастания
– неметаллических свойств:
P; S; Si.
P; Cl; Mg.
Ga; B; In.
– металлических свойств:
Ga; Al; In.
Ga; B; Tl.
P; Na; Al.
08.09.2018
17
Задание: Сравните атомы поставив знаки ›, ‹ или =
:
А) заряд ядра: Al … Si; C…N; O…S; Mg…Ca
Б) число электронных слоев: Al … Si; C…N;
O…S; Mg…Ca
B) Число электронов на внешнем слое:
Al … Si; C…N; O…S; Mg…Ca
Г) Радиус атома: Al … Si; C…N; O…S; Mg…Ca
Д) Металлические свойства: Al … Si; C…N;
O…S; Mg…Ca
Е) Неметаллические свойства: Al … Si; C…N;
O…S; Mg…Ca
08.09.2018
18
19. Домашнее задание:
§ 1, заполнить пропуски.Охарактеризовать элементы № 12, 18.
§ 1, 3, № 7, 8, с. 20
Неорганическая химия – Рабочая программа дисциплины – 20.03.01. Техносферная безопасность – Направления подготовки
МИНОБРНАУКИ РОССИИ
федеральное государственное бюджетное
образовательное учреждение высшего образования
«Алтайский государственный университет»
| Закреплена за кафедрой | Кафедра физической и неорганической химии |
|---|---|
| Направление подготовки | 20. 03.01. Техносферная безопасность 03.01. Техносферная безопасность |
| Профиль | Безопасность жизнедеятельности в техносфере |
| Форма обучения | Очная |
| Общая трудоемкость | 6 ЗЕТ |
| Учебный план | 20_03_01-ТБ-1-2020 |
|
| ||||||||||||||
Распределение часов по семестрам
| Курс (семестр) | 1 (1) | Итого | ||
|---|---|---|---|---|
| Недель | 17,5 | |||
| Вид занятий | УП | РПД | УП | РПД |
| Лекции | 28 | 28 | 28 | 28 |
| Лабораторные | 28 | 28 | 28 | 28 |
| Практические | 30 | 30 | 30 | 30 |
Сам. работа работа | 103 | 103 | 103 | 103 |
| Часы на контроль | 27 | 27 | 27 | 27 |
| Итого | 216 | 216 | 216 | 216 |
Программу составил(и):
к.х.н., доцент, Харнутова Е.П.
Рецензент(ы):
д.х.н., доцент, Смагин В.П.;к.х.н., доцент, Микушина И.В.
Рабочая программа дисциплины
Неорганическая химия
разработана в соответствии с ФГОС:
Федеральный государственный образовательный стандарт высшего образования по направлению подготовки 20.03.01 ТЕХНОСФЕРНАЯ БЕЗОПАСНОСТЬ (уровень бакалавриата) (приказ Минобрнауки России от 21. 03.2016 г. № 246)
03.2016 г. № 246)
составлена на основании учебного плана:
20.03.01 Техносферная безопасность
утвержденного учёным советом вуза от 30.06.2020 протокол № 6.
Рабочая программа одобрена на заседании
кафедры
Кафедра физической и неорганической химии
Протокол от 06.07.2020 г.
№ 10
Срок действия программы: 2020-2021 уч. г.
Заведующий кафедрой
д.ф.-м.н., профессор Безносюк С.А.
Визирование РПД для исполнения в очередном учебном году
Рабочая программа пересмотрена, обсуждена и одобрена для
исполнения в 2020-2021 учебном году на заседании
кафедры
Кафедра физической и неорганической химии
Протокол от 06.07.2020 г. № 10
Заведующий кафедрой д.ф.-м.н., профессор Безносюк С. А.
А.
Расширенная таблица Менделеева | Линсейская группа Сан-Диего
Питер Лобнер
Первая периодическая таблица элементов
В 1869 году русский химик Дмитрий Менделеев предложил первую современную периодическую таблицу элементов, в которой он расположил 60 известных элементов в порядке возрастания их атомных масс (средняя масса, учитывая относительное содержание изотопов в природных элементах), с элементами организованы в группы на основе их сходных свойств.Менделеев заметил, что определенные свойства периодически повторяются в периодической таблице, тем самым определяя группировки элементов.
Источник: http://we-are-star-stuff.tumblr.com
Эта первая версия таблицы Менделеева сравнивается с современной периодической таблицей на следующей диаграмме, подготовленной SIPSAWIYA.COM. Периодическая таблица Менделеева состояла из групп с I по VIII в современной периодической таблице.
Пробелы представляют собой неоткрытые элементы, предсказанные периодической таблицей Менделеева, например, Галлий (атомная масса 69. 7) и Германий (атомная масса 72,6). Вы можете узнать больше о таблице Менделеева по следующей ссылке:
7) и Германий (атомная масса 72,6). Вы можете узнать больше о таблице Менделеева по следующей ссылке:
http://www.sipsawiya.com/2015/07/history-of-periodic-table.html
Немецкий химик Лотар Мейер соревновался с Менделеевым в публикации первой таблицы Менделеева. По общему мнению, Менделеев, а не Мейер, был истинным изобретателем периодической таблицы из-за точности и детализации работы Менделеева.
Элемент менделевий (101) назван в честь Дмитрия Менделеева.
Эволюция современной периодической таблицы элементов
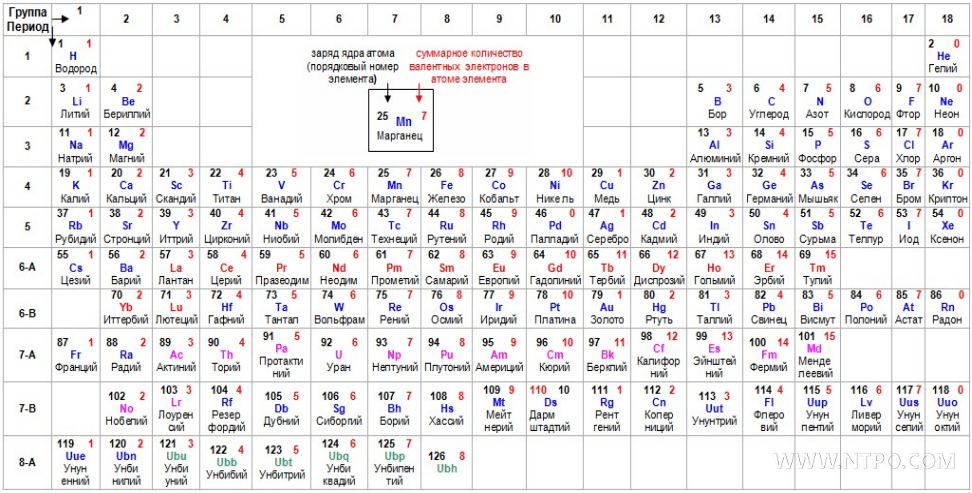
В современной периодической таблице элементы организованы в соответствии с их атомными номерами (числом протонов в ядре) на 7 периодов (по вертикали) и 18 групп (по горизонтали). Версия, показанная ниже, в формате Международного союза теоретической и прикладной химии (IUPAC), учитывает элементы с атомным номером до 118 и цветовым кодом 10 различных химических серий.
Источник: http: // sciencenotes.org / для печати-периодическая-таблица /
Сотни версий периодической таблицы элементов существовали со времени первой версии Менделеева. Вы можете просмотреть большое количество из них в Интернет-базе данных периодических таблиц , подготовленной доктором Марком Р. Личем и представленной по следующей ссылке:
Вы можете просмотреть большое количество из них в Интернет-базе данных периодических таблиц , подготовленной доктором Марком Р. Личем и представленной по следующей ссылке:
http://www.meta-synthesis.com/webbook/35_pt/pt_database.php?Button=Все
Гленн Т. Сиборг (1912 – 1999) хорошо известен своей ролью в определении структуры современной таблицы Менделеева.Его ключевой вклад в структуру периодической таблицы включает:
- В 1944 году Сиборг сформулировал «актинидную концепцию» электронной структуры тяжелых элементов, которая предсказала, что актиниды, включая первые 11 трансурановых элементов, будут образовывать переходную серию, аналогичную редкоземельной серии лантаноидов. Концепция актинидов показала, как трансурановые элементы вписываются в периодическую таблицу.
- В период с 1944 по 1958 год Сиборг идентифицировал восемь трансурановых элементов: америций (95), кюрий (96), берклий (97), калифорний (98), эйнштейний (99), фермий (100), менделевий (101) и нобелий ( 102).

Элемент сиборгий (106) был назван в честь Гленна Т. Сиборга. Ознакомьтесь с подробностями работы Гленна Т. Сиборга по трансурановым элементам по следующей ссылке:
http://www.osti.gov/accomplishments/seaborg.html
Четыре вновь открытых и проверенных элемента
30 декабря 2015 года ИЮПАК объявил о проверке открытий следующих четырех новых элементов: 113, 115, 117 и 118.
- Открытие 113-го элемента было присуждено группе ученых из института Рикен в Японии.
- Благодарность за открытие элементов 115, 117 и 118 была предоставлена российско-американской группе ученых из Объединенного института ядерных исследований в Дубне и Национальной лаборатории Лоуренса Ливермора в Калифорнии.
Эти четыре элемента завершают 7 -й период периодической таблицы элементов. Текущая таблица заполнена.
Вы можете прочитать это объявление IUPAC по следующей ссылке:
http://www.iupac.org/news/news-detail/article/discovery-and-assignment-of-elements-with-atomic-numbers-113-115-117-and-118. html
html
28 ноября 2016 года ИЮПАК утвердил названия и символы для этих четырех новых элементов: нихоний (Nh), московий (Mc), теннессин (Ts) и оганессон (Og) соответственно для элемента 113, 115, 117 и 118. Нихоний был первым элементом, названным в Азии.
Работа со сверхтяжелыми элементами помимо элемента 118
Число физически возможных элементов неизвестно.
В 1969 году Гленн Т. Сиборг предложил следующую расширенную периодическую таблицу для учета неоткрытых элементов с атомным номером от 110 до 173, включая «суперактинидный» ряд элементов (атомные номера от 121 до 155).
Источник: W. Nebergal и др., General Chemistry, 4 th ed., Pp 668-670, D.C. Heath Co, Massachusetts, 1972
В 2010 году финский химик Пекка Пюккё из Хельсинкского университета предложил расширенную периодическую таблицу с 54 предсказанными элементами. Расширение, показанное ниже, основано на вычислительной модели, которая предсказывает порядок, в котором будут заполняться орбитальные оболочки электронов, и, следовательно, положения элементов в периодической таблице вплоть до атомного номера 172. Пекка Пийкко говорит, что значение Работа состоит в том, чтобы показать, «как правила квантовой механики и теории относительности действуют при определении химических свойств.”
Пекка Пийкко говорит, что значение Работа состоит в том, чтобы показать, «как правила квантовой механики и теории относительности действуют при определении химических свойств.”
Источник: Королевское химическое общество
Более подробную информацию о расширенной таблице Менделеева Пекки Пююкко можно найти по следующей ссылке:
http://www.rsc.org/Publishing/ChemScience/Volume/2010/11/Extended_elements.asp
Вы можете прочитать более общую информацию о расширенной таблице Менделеева в Википедии по следующей ссылке:
https://en.wikipedia.org/wiki/Extended_periodic_table
Итак, где мы разместим элемент 119 в периодической таблице элементов?
На основании расширенных периодических таблиц Сиборга и Пююкко, описанных выше, элемент 119 будет началом периода 8 и будет щелочным металлом.Элемент 120 будет щелочноземельным. С элементом 121 мы войдем в новый химический ряд «суперактинидов».
Это захватывающие времена для ученых, пытающихся открыть новые сверхтяжелые элементы.
Какое место занимает нейтроний в таблице Менделеева?
Нейтроний – это название, придуманное в 1926 году ученым Андреасом фон Антропофф для предложенного «элемента с атомным номером ноль» (то есть потому, что он не имеет протонов), который он поместил во главе периодической таблицы.В современном обиходе чрезвычайно плотное ядро нейтронной звезды называют «вырожденным нейтронием».
Нейтроний также находит множество гипотетических применений в современной научной фантастике. Например, в эпизоде «Звездный путь» 1967 года, The Doomsday Machine , нейтроний сформировал корпус гигантского автономного «убийцы планет» и был изображен как неуязвимый для всех видов сканирования и оружия. Поскольку свободные нейтроны при стандартной температуре и давлении подвергаются β– распаду с периодом полураспада 10 минут 11 секунд, очень небольшое количество нейтрония может быть довольно опасным для вашего здоровья.
Обновление от 14 января 2019 г . : В 2019 г. исполняется 150 лет периодической таблице Менделеева
: В 2019 г. исполняется 150 лет периодической таблице Менделеева
Вы найдете очень хорошую статью «150 лет спустя в периодической таблице больше историй, чем элементов», Элизабет Куилл на веб-сайте Science News. Вот ссылка:
150 years on, the periodic table has more stories than it has elements
Обновление от 18 января 2019 г .: Возможно, самая старая копия таблицы Менделеева была найдена в университете Св.Эндрюс в Шотландии
17 января 2019 года Университет Сент-Эндрюс опубликовал новостную статью, в которой говорилось, что в университете недавно была обнаружена периодическая таблица элементов, датируемая 1885 годом, и она считается старейшей в мире.
Периодическая таблица 1885 года. Источник: Университет Сент-Эндрюс
.Вы можете прочитать новость Университета Сент-Эндрюс здесь:
World’s oldest periodic table chart found in St Andrews
периодическая_таблица_ (расширенная)
Расширенная периодическая таблица была предложена Гленном Т. Сиборга в 1969 году. Это логическое продолжение принципов, лежащих в основе стандартной таблицы Менделеева, с включением возможных неоткрытых химических элементов. Все обнаруженные элементы названы в соответствии со стандартом систематических имен элементов Международного союза теоретической и прикладной химии (IUPAC) для создания общего названия до тех пор, пока оно не будет обнаружено, подтверждено и не будет утверждено официальное название.
Сиборга в 1969 году. Это логическое продолжение принципов, лежащих в основе стандартной таблицы Менделеева, с включением возможных неоткрытых химических элементов. Все обнаруженные элементы названы в соответствии со стандартом систематических имен элементов Международного союза теоретической и прикладной химии (IUPAC) для создания общего названия до тех пор, пока оно не будет обнаружено, подтверждено и не будет утверждено официальное название.
Рекомендуемые дополнительные знания
Синий символ в верхней части каждого столбца показывает размещение каждого элемента в каждом блоке периодической таблицы.Он не всегда указывает количество электронов на орбитали (например, меди). Красное число слева от каждой строки показывает период: последнюю электронную оболочку.
Гелий помещается рядом с водородом, а не поверх неона, потому что он является частью группы s 2 .
| Период | с 1 | с 2 | ||||||||||||||||||||||||||||||||||||||||||||||||
| 1 | 1 H | 2 He | п. 1 | п. 2 | п. 3 | п. 4 | п. 5 | п. 6 | ||||||||||||||||||||||||||||||||||||||||||
| 2 | 3 Li | 4 Be | 5 B | 6 С | 7 N | 8 O | 9 ф. | 10 Ne | ||||||||||||||||||||||||||||||||||||||||||
| 3 | 11 Na | 12 мг | д 1 | д 2 | д 3 | д 4 | д 5 | д 6 | д 7 | д 8 | д 9 | д 10 | 13 Al | 14 Si | 15 -пол.  | 16 Ю | 17 Cl | 18 Ar | ||||||||||||||||||||||||||||||||
| 4 | 19 К | 20 Ca | 21 сбн | 22 Ti | 23 В | 24 Cr | 25 млн | 26 Fe | 27 Co | 28 Ni | 29 Cu | 30 Zn | 31 Ga | 32 Ge | 33 Как | 34 Se | 35 руб. | 36 Kr | ||||||||||||||||||||||||||||||||
| 5 | 37 руб. | 38 Sr | f 1 | f 2 | f 3 | f 4 | f 5 | f 6 | f 7 | f 8 | f 9 | f 10 | f 11 | f 12 | f 13 | f 14 | 39 Y | 40 Zr | 41 Nb | 42 Пн | 43 Tc | 44 Ру | 45 правый | 46 Pd | 47 Ag | 48 Кд | 49 дюйм | 50 Sn | 51 Сб | 52 Te | 53 Я | 54 Xe | ||||||||||||||||||
| 6 | 55 CS | 56 Ba | 57 La | 58 Ce | 59 Пр.  | 60 Nd | 61 вечера | 62 см | 63 Eu | 64 Gd | 65 Тб | 66 Dy | 67 Ho | 68 Er | 69 тм | 70 Yb | 71 Лю | 72 Hf | 73 Ta | 74 Вт | 75 Re | 76 Ос | 77 Ir | 78 Pt | 79 Au | 80 рт. | 81 тл | 82 Пб | 83 Би | 84 Po | 85 При | 86 Rn | ||||||||||||||||||
| 7 | 87 пт. | 88 Ra | г 1 | г 2 | г 3 | г 4 | г 5 | г 6 | г 7 | г 8 | г 9 | г 10 | г 11 | г 12 | г 13 | г 14 | г 15 | г 16 | г 17 | г 18 | 89 переменный ток | 90 Тыс | 91 Па | 92 U | 93 Np | 94 Pu | 95 Am | 96 см | 97 Bk | 98 Cf | 99 Es | 100 FM | 101 мкр.  | 102 Нет | 103 л. | 104 Rf | 105 Дб | 106 Sg | 107 Bh | 108 HS | 109 тонн | 110 DS | 111 Rg | 112 Ууб | 113 Уут | 114 Uuq | 115 Uup | 116 Уух | 117 Uus | 118 Uuo |
| 8 | 119 Ууэ | 120 Убн | 121 Убу | 122 Убб | 123 Убт | 124 Убк | 125 уб. | 126 Уб. | 127 Ubs | 128 УБО | 129 Убэ | 130 Утн | 131 Уту | 132 Утб | 133 Утт | 134 Utq | 135 Ут | 136 Ут | 137 Uts | 138 Уто | 139 Юте | 140 Uqn | 141 Uqu | 142 Uqb | 143 Uqt | 144 Uqq | 145 Uqp | 146 Uqh | 147 Uqs | 148 Uqo | 149 Uqe | 150 Upn | 151 Упу | 152 Упб | 153 Вверх | 154 Upq | 155 вверх | 156 Uph | 157 ИБП | 158 Упо | 159 Upe | 160 Uhn | 161 Уху | 162 Uhb | 163 Uht | 164 Uhq | 165 Uhp | 166 Ухх | 167 UHS | 168 Ухо |
| 9 | 169 Уэ | 170 Usn | 171 Усу | 172 USB | 173 Усть | 174 США | 175 УСП | 176 Уш | 177 ссс | 178 Усо | 179 Использование | 180 Уон | 181 Uou | 182 Уоб | 183 Uot | 184 Uoq | 185 Uop | 186 Uoh | 187 Уос | 188 Уоо | 189 Uoe | 190 Uen | 191 уэу | 192 Ueb | 193 Uet | 194 Ueq | 195 Уэп | 196 Ueh | 197 Ues | 198 Ueo | 199 Uee | 200 млрд | 201 млрд единиц | 202 млрд | 203 Bnt | 204 млрд.  Кв. Кв. | 205 млрд | 206 млрд | 207 млрд. | 208 Bno | 209 Bne | 210 Булочка | 211 Buu | 212 Втулка | 213 Но | 214 Buq | 215 Буп | 216 Буг | 217 Автобус | 218 Буо |
См. Также
Горизонтальные блоки называются строками или периодами.Атомный номер увеличивается с течением времени.
Столбцы, идущие вертикально, называются семействами или группами. Элементы одной группы или семейства имеют схожие химические свойства.
| 7 | 87 223,02 Франций | 88 226.03 Радий | ** | 103 262,11 Лоуренсий | 104 267,12 Резерфордий | 105 270,13 Дубний | 106 269. Сиборгий | 107 270,13 Бориум | 108 269,13 Калий | 109 278,16 Мейтнерий | 110 281.17 Дармштадтиум | 111 281,17 Рентгений | 112 285,18 Копернициум | 113 286,18 Нихоний | 114 289.19 Флеровий | 115 289,20 Московий | 116 293,20 Ливерморий | 117 293,21 Теннессин | 118 294.21 Оганессон | ** Актиноиды | ** | 89 227,03 Актиний | 90 232,04 Торий | 91 231,04 Протактиний | 92 238.03 Уран | 93 237,05 Нептуний | 94 244,06 Плутоний | 95 243,06 Америций | 96 247,07 Кюрий | 97 247. Беркелиум | 98 251,08 Калифорний | 99 252,08 Эйнштейний | 100 257,10 Фермий | 101 258.10 Менделевий | 102 259,10 Нобелий |
|---|
Нижняя часть периодической таблицы
Цель обучения
- Определите ключевые характеристики элементов f-блока.
Ключевые моменты
- Ряды лантанидов и актинидов получают свойства от электронов f-блока.
- Четыре элемента в ряду актинидов встречаются в природе, пять изотопов других иногда образуются при распаде урана, а остальные трансурановые соединения были произведены синтетическим путем.
- Наибольший атомный номер, синтезированный на сегодняшний день, составляет 118, элемент унунокций (Uuo).
Условия
- актинид Любой из 14 радиоактивных элементов периодической таблицы, которые расположены под лантаноидами, с которыми они имеют схожий химический состав.

- лантаноид Любой из 14 редкоземельных элементов от лантана до лютеция в периодической таблице. Поскольку их внешние орбитали пусты, у них очень похожий химический состав. Под ними – актиниды.
- трансуран Transuranic. Трансурановый элемент – это любой синтетический элемент, атомный номер которого больше, чем у урана (92).
Есть несколько способов подойти к этой конкретной теме, и все они относятся к тому, как представлены элементы в самой таблице.
Самое классическое представление таблицы Менделеева показывает взаимное расположение известных элементов в таблице. Сама таблица состоит из 7 периодов и 18 групп, из которых самым последним известным элементом является номер 118, ununoctium. Однако в таблице наблюдается явный разрыв. В строке 6, столбце 3, пустое пространство появляется между Ba и Hf. Атомный номер, который должен быть здесь, 57, находится внизу таблицы в строке, называемой лантаноидами. Непосредственно под пространством в строке 6 в строке 7 находится еще одно пустое пространство, которое заполнено строкой, называемой актинидами, также видимой в нижней части диаграммы.
Расширяя размеры Периодической таблицы
Увеличивая горизонтальные размеры стола, ряды актинидов и лантаноидов могут быть размещены в их правильных относительных положениях. Поскольку химический состав этой группы в основном основан на электронах f-оболочки и взаимодействиях на этом уровне энергии, это называется f-блоком.Это неуклюжее представление правильно показывает элементы, известные на сегодняшний день, вплоть до z = 118, unonoctium. Фактически, это представление является предсказательным, поскольку оно показывает химические семейства (группы) и периодичности (периоды) в их правильных относительных положениях.
Расширенная таблица Менделеева Лантаноиды и актиниды добавляются как отдельные, но связанные ряды, образуя так называемый f-блок. Если продолжить расширение периодической таблицы, рассмотрим элемент с атомным номером 92 в ряду актинидов, называемый ураном. Когда в конце 19 века были обнаружены элементы этого диапазона атомных номеров, изотопы урана были самыми крупными и тяжелыми элементами, известными в природе. В 1934 году Энрико Ферми предсказал существование трансурановых, элементов – элементов с атомным номером (z) больше или равным 93. В 1934 году были известны только 4 актинида, все меньше урана, поэтому неизвестно, что они сформировали период или семью, как лантаноиды. Первый трансурановый элемент, Np (нептуний), был синтезирован в 1940 году путем бомбардировки урана медленными нейтронами.В течение следующих двух десятилетий было произведено очень много изотопов актинидов, как правило, путем бомбардировки другими атомами или субатомными частицами. Актиниды добавляли вместе с лантаноидами.
Когда в конце 19 века были обнаружены элементы этого диапазона атомных номеров, изотопы урана были самыми крупными и тяжелыми элементами, известными в природе. В 1934 году Энрико Ферми предсказал существование трансурановых, элементов – элементов с атомным номером (z) больше или равным 93. В 1934 году были известны только 4 актинида, все меньше урана, поэтому неизвестно, что они сформировали период или семью, как лантаноиды. Первый трансурановый элемент, Np (нептуний), был синтезирован в 1940 году путем бомбардировки урана медленными нейтронами.В течение следующих двух десятилетий было произведено очень много изотопов актинидов, как правило, путем бомбардировки другими атомами или субатомными частицами. Актиниды добавляли вместе с лантаноидами.
Два новых периода
Используя предсказательные свойства периодической таблицы, наряду с растущим опытом в атомной и субатомной теории, были предсказаны два совершенно новых периода. По совету Гленна Сиборга и других, периоды 8 и 9 были добавлены в таблицу Менделеева, включая g-блок. Расположение g-блока в таблице (слева от f-блока, справа или между ними) является предположительным. Позиции в таблице соответствуют предположению, что правило Маделунга (что орбитали с более низким значением суммы квантовых чисел n и l будут заполнены раньше, чем орбитали с более высокими значениями n + l) будет продолжать выполняться для более высоких атомных номеров. В элементе 118 предполагается, что заполнены орбитали 1s, 2s, 2p, 3s, 3p, 3d, 4s, 4p, 4d, 4f, 5s, 5p, 5d, 5f, 6s, 6p, 6d, 7s и 7p, с незаполненными оставшимися орбиталями.Орбитали восьмого периода будут заполнены в порядке 8s, 5g, 6f, 7d, 8p. Однако после элемента 120 близость электронных оболочек делает проблематичным размещение в простом столе.
Расположение g-блока в таблице (слева от f-блока, справа или между ними) является предположительным. Позиции в таблице соответствуют предположению, что правило Маделунга (что орбитали с более низким значением суммы квантовых чисел n и l будут заполнены раньше, чем орбитали с более высокими значениями n + l) будет продолжать выполняться для более высоких атомных номеров. В элементе 118 предполагается, что заполнены орбитали 1s, 2s, 2p, 3s, 3p, 3d, 4s, 4p, 4d, 4f, 5s, 5p, 5d, 5f, 6s, 6p, 6d, 7s и 7p, с незаполненными оставшимися орбиталями.Орбитали восьмого периода будут заполнены в порядке 8s, 5g, 6f, 7d, 8p. Однако после элемента 120 близость электронных оболочек делает проблематичным размещение в простом столе.
Существование элементов с такими высокими атомными номерами является спекулятивным, и ожидается, что изотопы будут иметь очень короткие периоды полураспада. Различные эксперты предсказывают, что z = приблизительно 130 является максимумом, в то время как другие считают, что эффективного верхнего предела нет. Эксперименты по синтезу трансурановых элементов продолжаются.
Различные эксперты предсказывают, что z = приблизительно 130 является максимумом, в то время как другие считают, что эффективного верхнего предела нет. Эксперименты по синтезу трансурановых элементов продолжаются.
Boundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета. Этот конкретный ресурс использовал следующие источники:
Расширенная периодическая таблица
В настоящее время в периодической таблице химических элементов семь периодов, кульминацией которых является атомный номер 118.Если будут обнаружены другие элементы с более высокими атомными номерами, чем это, они будут помещены в дополнительные периоды, расположенные (как и в случае с существующими периодами), чтобы проиллюстрировать периодически повторяющиеся тенденции в свойствах соответствующих элементов. Ожидается, что любые дополнительные периоды будут содержать большее количество элементов, чем седьмой период, поскольку они рассчитаны на наличие дополнительного так называемого g-блока , содержащего 18 элементов с частично заполненными g-орбиталями в каждом периоде. Таблица с восемью периодами , содержащая этот блок, была предложена Гленном Т.Сиборг в 1969 году. [1] [2]
Таблица с восемью периодами , содержащая этот блок, была предложена Гленном Т.Сиборг в 1969 году. [1] [2]
Никакие элементы в этой области не были синтезированы или обнаружены в природе. [3] Первый элемент g-блока может иметь атомный номер 121 и, следовательно, иметь систематическое название unbiunium. Элементы в этой области, вероятно, будут очень нестабильными по отношению к радиоактивному распаду и имеют чрезвычайно короткие периоды полураспада, хотя предполагается, что элемент 126 находится внутри острова стабильности, который устойчив к делению, но не к альфа-распаду.Неясно, сколько элементов за пределами ожидаемого острова стабильности физически возможно, если период 8 завершен или есть период 9.
Согласно орбитальному приближению в квантово-механическом описании атомной структуры, g-блок соответствует элементам с частично заполненными g-орбиталями. Однако эффекты спин-орбитального взаимодействия существенно снижают применимость орбитального приближения для элементов с большим атомным номером. [4]
[4]
Расширенная таблица Менделеева, включая g-блок
Неизвестно, насколько далеко периодическая таблица Менделеева может выходить за пределы известных 118 элементов.Гленн Т. Сиборг предположил, что максимально возможный элемент может быть меньше Z = 130. [5] Однако, если высшие элементы действительно существуют, маловероятно, что они могут быть осмысленно отнесены к таблице Менделеева, примерно Z = 173, как обсуждается в следующем разделе. Таким образом, эта таблица заканчивается этим номером, что не означает, что все эти 173 элемента действительно возможны, или что более тяжелые элементы невозможны. (См. Также расширенную таблицу Менделеева (большая версия).)
Все эти гипотетические неоткрытые элементы названы в соответствии со стандартом систематических названий элементов Международного союза теоретической и прикладной химии (IUPAC), который создает общее название для использования до тех пор, пока элемент не будет обнаружен, подтвержден и утверждено официальное название.
По состоянию на апрель 2011 г. [обновление] , попытки синтеза были предприняты только для унунния, унбинилия, унбибия, унбиквадия и унбигексия. (Z = 119, 120, 122, 124 и 126)
Расположение g-блока в таблице (слева от f-блока, справа или между ними) является предположительным.Положения, показанные в таблице выше, соответствуют предположению, что правило Маделунга будет продолжать выполняться для более высоких атомных номеров; это предположение может быть правдой, а может и нет. В элементе 118 предполагается, что орбитали 1s, 2s, 2p, 3s, 3p, 3d, 4s, 4p, 4d, 4f, 5s, 5p, 5d, 5f, 6s, 6p, 6d, 7s и 7p заполнены остальные орбитали незаполнены. Орбитали восьмого периода будут заполнены в порядке 8s, 5g, 6f, 7d, 8p. Однако после элемента 120 близость электронных оболочек делает проблематичным размещение в простом столе.
Pyykkö модель
Не все модели показывают более высокие элементы по образцу, установленному более легкими элементами. Пекка Пююкко, например, использовал компьютерное моделирование, чтобы вычислить положения элементов до Z = 172, и обнаружил, что некоторые из них были смещены из правила упорядочения энергии Маделунга. [6] Он предсказывает, что орбитальные снаряды будут заполняться в следующем порядке:
[6] Он предсказывает, что орбитальные снаряды будут заполняться в следующем порядке:
- 8с,
- 5г,
- первые два места 8п,
- 6ф,
- 7д,
- 9с,
- первые два места 9р,
- остальное 8п.
Он также предлагает разделить период 8 на три части:
- 8a, содержащий восьмерки,
- 8b, содержащий первые два элемента 8p,
- 8c, содержащий 7d, а остальные 8p. [7]
| 8 | 119 Uue | 120 Убн | 121 Убу | 122 Убб | 123 Убт | 124 Убк | 125 Убп | 126 Убх | 127 Ubs | 128 УБО | 129 Убэ | 130 Ут | 131 УТУ | 132 Утб | 133 Утт | 134 Utq | 135 UTP | 136 Uth | 137 шт. 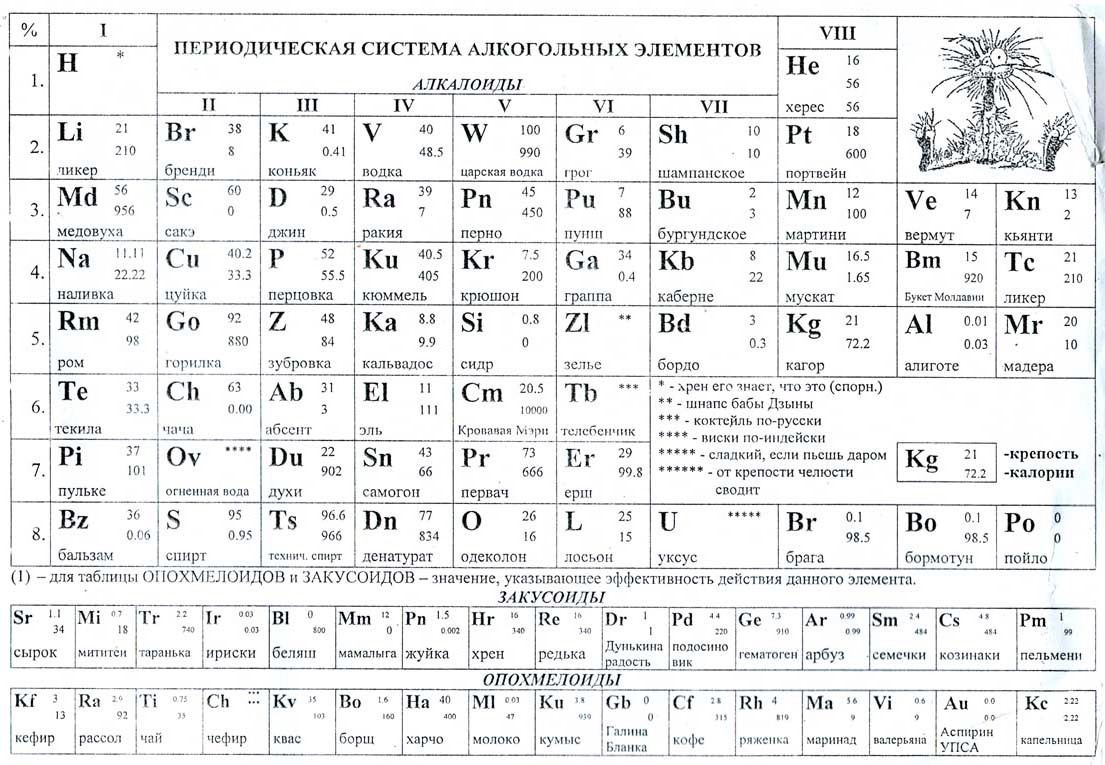 | 138 Uto | 141 Uqu | 142 Uqb | 143 Uqt | 144 Uqq | 145 Uqp | 146 Uqh | 147 UQS | 148 Uqo | 149 Uqe | 150 УПН | 151 Упу | 152 УПБ | 153 Вверх | 154 Upq | 155 Упп | 156 Uph | 157 ИБП | 158 Упо | 159 Упэ | 160 Uhn | 161 Уху | 162 Uhb | 163 Uht | 164 Uhq | 139 Юте | 140 Uqn | 169 Uhe | 170 Usn | 171 Усу | 172 USB |
| 9 | 165 Uhp | 166 Ухх | 167 UHS | 168 UHO |
Конец таблицы Менделеева
Число физически возможных элементов неизвестно. Ограничение скорости света для электронов, вращающихся во все более крупных электронных оболочках, теоретически ограничивает нейтральные атомы значением Z , равным примерно 137, [8] , после чего было бы бессмысленно распределять элементы по блокам на основе электронной конфигурации. . Однако вполне вероятно, что периодическая таблица на самом деле заканчивается намного раньше, возможно, вскоре после острова стабильности, [5] , который, как ожидается, будет сосредоточен вокруг Z = 126. [9]
Ограничение скорости света для электронов, вращающихся во все более крупных электронных оболочках, теоретически ограничивает нейтральные атомы значением Z , равным примерно 137, [8] , после чего было бы бессмысленно распределять элементы по блокам на основе электронной конфигурации. . Однако вполне вероятно, что периодическая таблица на самом деле заканчивается намного раньше, возможно, вскоре после острова стабильности, [5] , который, как ожидается, будет сосредоточен вокруг Z = 126. [9]
Дополнительно расширение периодической таблицы и таблицы нуклидов ограничено капельными линиями протонов и нейтронов.
Разбивка модели Бора
Модель Бора показывает трудности для атомов с атомным номером больше 137, поскольку скорость электрона на орбитали электрона 1 с, v , дается соотношением
, где Z – атомный номер, а α – постоянная тонкой структуры, мера силы электромагнитных взаимодействий. [10] Согласно этому приближению, любой элемент с атомным номером больше 137 потребует 1s электронов, чтобы двигаться быстрее, чем c , скорость света.Следовательно, нерелятивистская модель, такая как модель Бора, неадекватна для таких расчетов.
[10] Согласно этому приближению, любой элемент с атомным номером больше 137 потребует 1s электронов, чтобы двигаться быстрее, чем c , скорость света.Следовательно, нерелятивистская модель, такая как модель Бора, неадекватна для таких расчетов.
Уравнение Дирака
Полурелятивистское уравнение Дирака также имеет проблемы для Z > 137, для энергии основного состояния
, где m 0 – масса покоя электрона. Для Z > 137 волновая функция основного состояния Дирака является скорее колебательной, чем связанной, и нет разрыва между спектрами положительной и отрицательной энергии, как в парадоксе Клейна. [11] Ричард Фейнман указал на этот эффект, поэтому последний элемент, ожидаемый в рамках этой модели, 137 (untriseptium), иногда называют feynmanium (символ: Fy).
Однако реалистичный расчет должен учитывать конечную протяженность распределения ядерных зарядов. Это приводит к критическому значению Z ≈ 173 (несептрий), так что нейтральные атомы могут быть ограничены элементами, равными или ниже этого.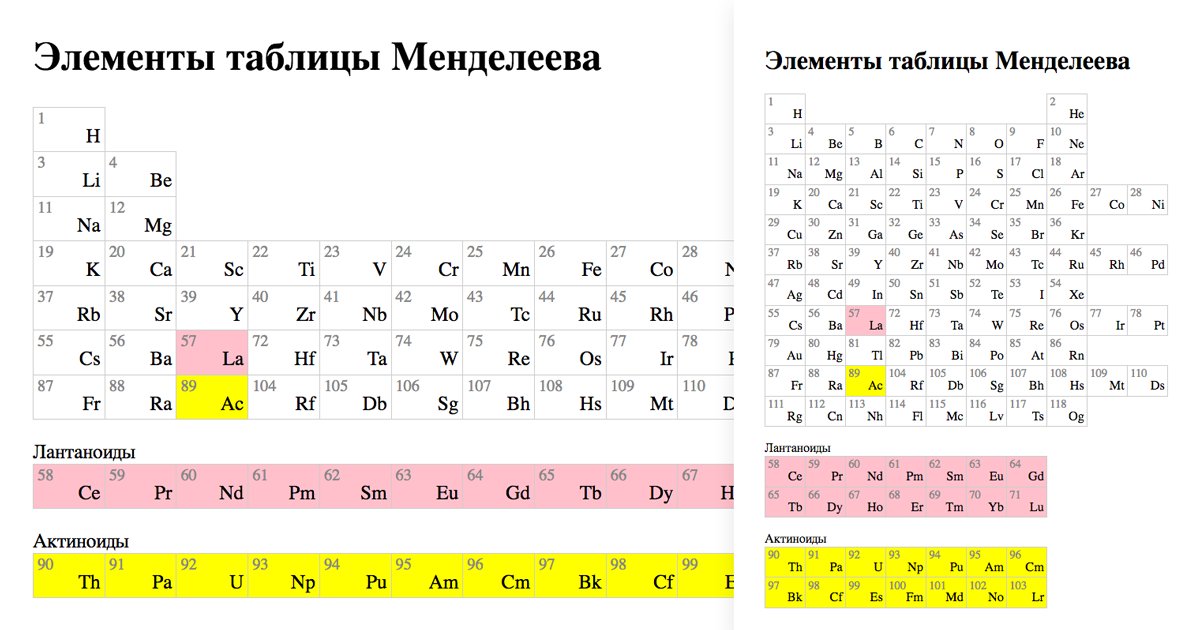 [8] Высшие элементы могут существовать только в виде ионов, например, в виде солей. Bjorken, James D .; Дрелл, Сидней Д. (1964). Релятивистская квантовая механика . Нью-Йорк: Макгроу-Хилл. ISBN 0070054932.
[8] Высшие элементы могут существовать только в виде ионов, например, в виде солей. Bjorken, James D .; Дрелл, Сидней Д. (1964). Релятивистская квантовая механика . Нью-Йорк: Макгроу-Хилл. ISBN 0070054932.
Внешние ссылки
Когда мы дойдем до конца Периодической таблицы? | Наука
Учителям химии недавно пришлось обновить декор своих классных комнат, объявив, что ученые подтвердили открытие четырех новых элементов в периодической таблице Менделеева. Пока безымянные элементы 113, 115, 117 и 118 заполнили оставшиеся пробелы в нижней части знаменитой диаграммы – дорожной карты строительных блоков материи, которая успешно использовалась химиками на протяжении почти полутора веков.
Официальное подтверждение, предоставленное Международным союзом теоретической и прикладной химии (IUPAC), готовилось годами, поскольку эти сверхтяжелые элементы очень нестабильны и их трудно создать.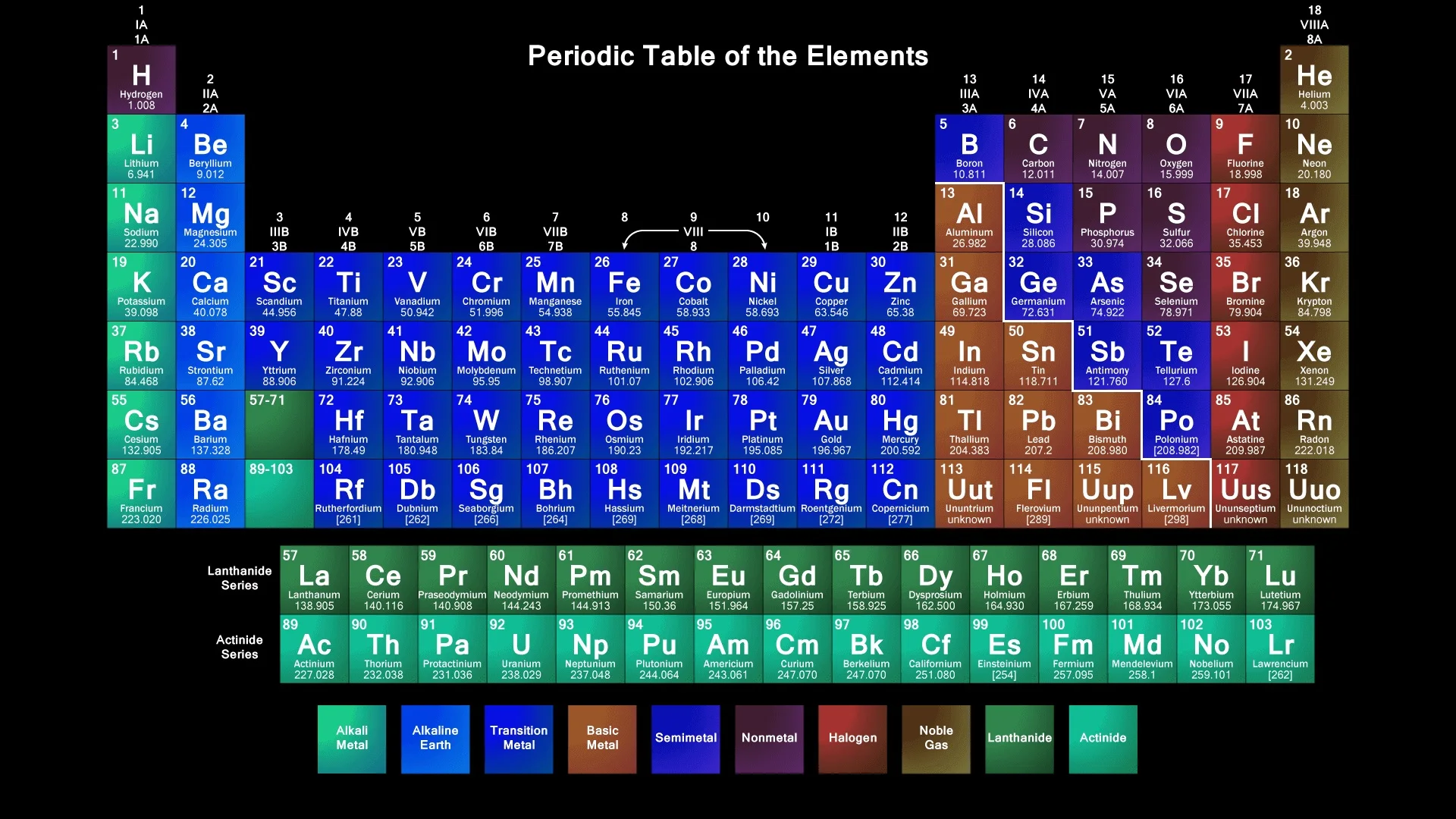 Но у ученых были веские основания полагать, что они существуют, отчасти потому, что периодическая таблица Менделеева до сих пор была удивительно последовательной. Попытки вызвать в воображении элементы 119 и 120, которые начнут новый ряд, уже ведутся.
Но у ученых были веские основания полагать, что они существуют, отчасти потому, что периодическая таблица Менделеева до сих пор была удивительно последовательной. Попытки вызвать в воображении элементы 119 и 120, которые начнут новый ряд, уже ведутся.
Но сколько именно элементов осталось, остается одной из самых стойких загадок химии, особенно с учетом того, что наше современное понимание физики выявило аномалии даже у опытных игроков.
«В таблице Менделеева начинают появляться трещины, – говорит Уолтер Лавленд, химик из Университета штата Орегон.
В современной версии периодической таблицы элементы упорядочены по строкам на основе атомного номера – числа протонов в ядре атома – и по столбцам, основанным на орбитах их самых удаленных электронов, которые, в свою очередь, обычно определяют их личности.Мягкие металлы, которые имеют тенденцию сильно реагировать с другими, такими как литий и калий, живут в одном столбце. Неметаллические химически активные элементы, такие как фтор и йод, обитают в другом.
Французский геолог Александр-Эмиль Бегуйе де Шанкуртуа был первым человеком, который осознал, что элементы могут группироваться в повторяющиеся структуры. Он представил элементы, известные в 1862 году, в порядке их веса в виде спирали, обернутой вокруг цилиндра ( см. Иллюстрацию ниже ). Элементы, расположенные вертикально друг за другом на этом цилиндре, имели схожие характеристики.
Но это была организационная схема, созданная Дмитрием Менделеевым, вспыльчивым русским, который утверждал, что видел группировки элементов во сне, и выдержала испытание временем. Его таблица Менделеева 1871 года была несовершенной; Например, он предсказал восемь несуществующих элементов. Тем не менее, он также правильно предсказал галлий (теперь используемый в лазерах), германий (теперь используемый в транзисторах) и другие все более тяжелые элементы.
Периодическая таблица Менделеева легко приняла новый столбец для благородных газов, таких как гелий, которые не удавалось обнаружить до конца 19 века из-за их склонности не реагировать с другими элементами.
Современная периодическая таблица более или менее соответствует квантовой физике, введенной в 20 веке для объяснения поведения субатомных частиц, таких как протоны и электроны. Кроме того, группировки в основном удерживались, поскольку были подтверждены более тяжелые элементы. Бориум, название, данное элементу 107 после его открытия в 1981 году, настолько хорошо сочетается с другими так называемыми переходными металлами, которые его окружают, что один из открывших его исследователей заявил, что «борий – это скучно».”
Но впереди могут быть интересные времена.
Один открытый вопрос касается лантана и актиния, которые имеют меньше общего с другими членами соответствующих групп, чем лютеций и лоуренсий. IUPAC недавно назначил целевую группу для изучения этого вопроса. Даже гелий, элемент 2, не прост – существует альтернативная версия периодической таблицы, в которой гелий помещается с бериллием и магнием вместо его соседей из благородных газов, основываясь на расположении всех его электронов, а не только самых удаленных.
«Проблемы в начале, середине и конце периодической таблицы», – говорит Эрик Скерри, историк химического факультета Калифорнийского университета в Лос-Анджелесе.
Специальная теория относительности Эйнштейна, опубликованная спустя десятилетия после таблицы Менделеева, также внесла в систему некоторые пробелы. Относительность гласит, что масса частицы увеличивается с увеличением ее скорости. Это может привести к тому, что отрицательно заряженные электроны, вращающиеся вокруг положительно заряженного ядра атома, будут вести себя странно, влияя на свойства элемента.
Рассмотрим золото: ядро заполнено 79 положительными протонами, поэтому, чтобы не упасть внутрь, электроны золота должны вращаться со скоростью, превышающей половину скорости света. Это делает их более массивными и втягивает их на более узкую орбиту с меньшей энергией. В этой конфигурации электроны поглощают синий свет, а не отражают его, придавая обручальным кольцам их характерный блеск.
Известный физик, играющий в бонго, Ричард Фейнман, как говорят, использовал теорию относительности, чтобы предсказать конец таблицы Менделеева на 137-м элементе.Для Фейнмана 137 было «магическим числом» – оно появилось без всякой очевидной причины в других областях физики. Его расчеты показали, что электроны в элементах за пределами 137 должны двигаться быстрее скорости света и, таким образом, нарушать правила относительности, чтобы избежать столкновения с ядром.
Более поздние расчеты с тех пор отменили этот предел. Фейнман рассматривал ядро как единую точку. Позвольте ему стать шаром частиц, и элементы могут продолжаться примерно до 173.Тогда ад вырвется наружу. Атомы за пределами этого предела могут существовать, но только как странные существа, способные вызывать электроны из пустого пространства.
Относительность – не единственная проблема. Положительно заряженные протоны отталкиваются друг от друга, поэтому чем больше вы упаковываете в ядро, тем менее стабильным оно становится. Уран с атомным номером 92 – последний элемент, достаточно стабильный, чтобы встречаться на Земле в естественных условиях. У каждого элемента за его пределами есть ядро, которое быстро распадается, и их период полураспада – время, необходимое для распада половины материала – может составлять минуты, секунды или даже доли секунды.
Более тяжелые, нестабильные элементы могут существовать где-нибудь во Вселенной, например, внутри плотных нейтронных звезд, но ученые могут изучать их здесь, только разбивая более легкие атомы, чтобы получить более тяжелые, а затем просеивая цепочку распада.
«Мы действительно не знаем, какой элемент является самым тяжелым из возможных», – говорит физик-ядерщик Витольд Назаревич из Университета штата Мичиган.
Теория предсказывает, что наступит момент, когда наши лабораторные ядра не доживут до настоящего атома.Радиоактивное ядро, которое распадается менее чем за десять триллионных долей секунды, не успеет собрать вокруг себя электроны и создать новый элемент.
Тем не менее, многие ученые ожидают, что дальше по дороге будут существовать острова стабильности, где сверхтяжелые элементы имеют относительно долгоживущие ядра. Загрузка некоторых сверхтяжелых атомов большим количеством дополнительных нейтронов может обеспечить стабильность, предотвращая деформацию ядер, богатых протонами. Например, ожидается, что элемент 114 будет иметь магически стабильное количество нейтронов, равное 184.Также предполагается, что элементы 120 и 126 могут быть более долговечными.
Но некоторые претензии на сверхтяжелую стабильность уже разошлись. В конце 1960-х годов химик Эдвард Андерс предположил, что ксенон в метеорите, упавшем на мексиканскую почву, возник в результате распада загадочного элемента между 112 и 119, который был бы достаточно стабильным, чтобы возникать в природе. Потратив годы на сужение области поиска, он в конце концов отказался от своей гипотезы в 1980-х годах.
Предсказать потенциальную стабильность тяжелых элементов непросто.Расчеты, требующие огромных вычислительных мощностей, не проводились для многих известных игроков. И даже если они это сделают, это совершенно новая территория для ядерной физики, где даже небольшие изменения входных данных могут оказать глубокое влияние на ожидаемые результаты.
Одно можно сказать наверняка: создавать каждый новый элемент будет труднее не только потому, что атомы с более коротким периодом жизни труднее обнаружить, но и потому, что для создания сверхтяжелых частиц могут потребоваться пучки атомов, которые сами по себе являются радиоактивными.Независимо от того, есть ли конец периодической таблицы Менделеева, возможно, наступит конец нашей способности создавать новые.
«Я думаю, что мы очень далеки от конца таблицы Менделеева», – говорит Скерри. «Ограничивающим фактором сейчас, кажется, является человеческая изобретательность».
Примечание редактора: Принадлежность Витольда Назаревича была исправлена.
Рекомендуемый список для чтения периодической таблицы
Повесть о семи стихиях
КупитьАвторитетный отчет о ранней истории периодической таблицы Менделеева можно найти в книге Эрика Скерри «Повесть о семи элементах» , в которой подробно рассматриваются споры, связанные с открытием семи элементов.
Периодическая таблица
КупитьЧитателям, интересующимся Холокостом, следует взять в руки копию трогательных мемуаров Примо Леви « Периодическая таблица». Кроме того, для получения убедительной автобиографии, в которой таблица Менделеева используется для определения жизни одного из самых любимых неврологов в мире, см. Статью Оливера Сакса New York Times «Моя таблица Менделеева ».
Исчезающая ложка: и другие правдивые сказки о безумии, любви и истории мира из Периодической таблицы элементов
КупитьСэм Кин увлекает своих читателей в живую и хаотичную возню с элементами в «Исчезающая ложка».
Утраченные элементы: теневая сторона Периодической таблицы
КупитьЭнтузиасты науки, заинтересованные в инсайдерском бейсболе, скрывающемся за элементами, которые никогда не попадали в периодическую таблицу Менделеева, могут проверить хорошо изученную книгу The Lost Elements Марко Фонтани, Мариаграции Коста и Мэри Вирджиния Орна.
Расширенная таблица Менделеева – formulasearchengine
Расширенная таблица Менделеева теоретизирует об элементах за пределами элемента 118 (последний из периода 7).В настоящее время известно и доказано семь периодов в периодической таблице химических элементов, кульминацией которых является атомный номер 118. Если будут обнаружены другие элементы с более высокими атомными номерами, чем это, они будут помещены в дополнительные периоды, расположенные (как и существующие периоды) чтобы проиллюстрировать периодически повторяющиеся тенденции в свойствах соответствующих элементов. Ожидается, что любые дополнительные периоды будут содержать большее количество элементов, чем седьмой период, поскольку они рассчитаны на наличие дополнительного так называемого g-блока , содержащего по меньшей мере 18 элементов с частично заполненными g-орбиталями в каждом периоде.Таблица с восемью периодами , содержащая этот блок, была предложена Гленном Т. Сиборгом в 1969 году. [1] [2] ИЮПАК определяет, что элемент существует, если его время жизни превышает 10 −14 секунд, что это время, за которое ядро образует электронное облако. [3]
Никакие элементы в этой области не были синтезированы или обнаружены в природе. [4] Первый элемент g-блока может иметь атомный номер 121 и, следовательно, иметь систематическое название unbiunium.Элементы в этой области, вероятно, будут очень нестабильными по отношению к радиоактивному распаду и имеют чрезвычайно короткие периоды полураспада, хотя предполагается, что элемент 126 находится внутри острова стабильности, который устойчив к делению, но не к альфа-распаду. Неясно, сколько элементов за пределами ожидаемого острова стабильности физически возможно, если период 8 завершен или есть период 9.
Согласно орбитальному приближению в квантово-механическом описании атомной структуры, g-блок соответствует элементам с частично заполненными g-орбиталями.Однако эффекты спин-орбитального взаимодействия существенно снижают применимость орбитального приближения для элементов с большим атомным номером. В то время как версия расширенного периода Сиборга содержала более тяжелые элементы по образцу, заданному более легкими элементами, поскольку она не учитывала релятивистские эффекты, модели, которые принимают во внимание релятивистские эффекты, не учитывают. Пекка Пюкко и Б. Фрике использовали компьютерное моделирование для расчета положений элементов до Z = 184 (включая периоды 8, 9 и начало 10) и обнаружили, что некоторые из них были смещены из правила Маделунга. [5] [6]
История
Неизвестно, насколько далеко периодическая таблица Менделеева может выходить за пределы известных 118 элементов. Гленн Т. Сиборг предположил, что максимально возможный элемент может быть меньше Z = 130. [7] Однако Уолтер Грейнер предсказал, что может не быть максимально возможного элемента. [8]
Шаблон: Расширенная таблица Менделеева (Фрике, 32 столбца, компактная)
Все эти гипотетические неоткрытые элементы названы в соответствии со стандартом систематических названий элементов Международного союза теоретической и прикладной химии (IUPAC), который создает общее название для использования до тех пор, пока элемент не будет обнаружен, подтвержден и утверждено официальное название.Однако обычно они даже не упоминаются в научной литературе, а упоминаются просто по их атомным номерам; следовательно, элемент 164 обычно назывался бы не «unhexquadium» (систематическое название IUPAC), а скорее «элементом 164» с символом «164», «(164)» или «E164».
Шаблон: На данный момент попытка синтеза была предпринята только для унунениума, унбинилия, унбибия, унбиквадия, унбигексия и унбисептиума. (Z = 119, 120, 122, 124, 126 и 127)
В элементе 118 предполагается, что заполнены орбитали 1s, 2s, 2p, 3s, 3p, 3d, 4s, 4p, 4d, 4f, 5s, 5p, 5d, 5f, 6s, 6p, 6d, 7s и 7p. , при этом оставшиеся орбитали незаполнены.Орбитали восьмого периода будут заполнены в порядке 8s, 5g, 6f, 7d, 8p. Однако после элемента 120 близость электронных оболочек делает проблематичным размещение в простом столе.
Шаблон: Эксперт-предмет {{safesubst: #invoke: anchor | main}} Не все модели показывают более высокие элементы по образцу, установленному более светлыми элементами. Пекка Пююкко, например, использовал компьютерное моделирование, чтобы вычислить положения элементов до Z = 172, и обнаружил, что некоторые из них были смещены из правила упорядочения энергии Маделунга. [6] Он предсказывает, что орбитальные снаряды будут заполняться в следующем порядке:
- 8с,
- 5г,
- первые два места 8п,
- 6ф,
- 7д,
- 9с,
- первые два места 9р,
- остальное 8п.
Он также предлагает разделить период 8 на три части:
- 8a, содержащий восьмерки,
- 8b, содержащий первые два элемента 8p,
- 8c, содержащий 7d, а остальные 8p. [9]
Fricke et al. также предсказал расширенную таблицу Менделеева до 184. [5] Эта модель получила более широкое распространение среди ученых и показана выше как основная форма расширенной таблицы Менделеева. Шаблон: Расширенная таблица Менделеева (автор Pyykkö, 50 столбцов, периоды 8–9)
Прогнозируемые свойства неоткрытых элементов
Элемент 118 – это последний элемент, который, как утверждается, был синтезирован. Следующие два элемента, элементы 119 и 120, должны образовывать серию 8s и быть щелочным и щелочноземельным металлами соответственно.После элемента 120 ожидается начало серии суперактинидов, когда 8s-электроны и заполнение 8p 1/2 , 7d 3/2 , 6f 5/2 и 5g 7/2 подоболочки определяют химия этих элементов. Полные и точные расчеты CCSD недоступны для элементов за пределами 122 из-за чрезвычайной сложности ситуации: орбитали 5g, 6f и 7d должны иметь примерно одинаковый уровень энергии, а в области элемента 160 – 9s, 8p 3 / 2 и 9p 1/2 орбитали также должны быть примерно равны по энергии.Это приведет к перемешиванию электронных оболочек, так что блочная концепция больше не будет применяться очень хорошо, а также приведет к новым химическим свойствам, которые очень затруднят размещение этих элементов в периодической таблице. Например, ожидается, что элемент 164 будет смешивать характеристики элементов группы 10, 12, 14 и 18. [10]
Химические и физические свойства
8с элементы
Ожидается, что первыми двумя элементами периода 8 будут унунний и унбинилий, элементы 119 и 120.Их электронные конфигурации должны иметь заполненную оболочку 8s. Однако орбиталь 8s релятивистски стабилизирована и сжата, и поэтому элементы 119 и 120 должны быть больше похожи на цезий и барий, чем на их ближайших соседей выше, франций и радий. Другой эффект релятивистского сжатия орбитали 8s состоит в том, что атомные радиусы этих двух элементов должны быть примерно такими же, как у франция и радия. Они должны вести себя как нормальные щелочные и щелочноземельные металлы, обычно образуя степени окисления +1 и +2 соответственно, но релятивистская дестабилизация подоболочки 7p 3/2 и относительно низкие энергии ионизации электронов 7p 3/2 должны сделать возможными более высокие степени окисления, такие как +3 и +4 (соответственно). [5] [10]
Суперактиниды
Предполагается, что серия суперактинидов будет содержать элементы от 121 до 155. В серии суперактинидов оболочки 7d 3/2 , 8p 1/2 , 6f 5/2 и 5g 7/2 должны полностью заполнить одновременно: [11] это создает очень сложные ситуации, настолько, что полные и точные расчеты CCSD были выполнены только для элементов 121 и 122. [10] Первый суперактинид, унбиуний (элемент 121), должен быть конгенер лантана и актиния и должен иметь схожие с ними свойства: [12] его основная степень окисления должна быть +3, хотя близость энергетических уровней валентных подоболочек может допускать более высокие степени окисления, как в элементах 119 и 120. . [10] Однако релятивистская стабилизация подоболочки 8p должна привести к конфигурации валентных электронов в основном состоянии 8s 2 8p 1 для элемента 121, в отличие от ds 2 конфигураций лантана и актиния. [10] Его первая энергия ионизации, согласно прогнозам, составит 429,4 кДж / моль, что будет ниже, чем у всех известных элементов, за исключением щелочных металлов калия, рубидия, цезия и франция: это значение даже ниже, чем у всех известных элементов. щелочной металл периода 8 унунний (463.1 кДж / моль). Точно так же следующий суперактинид, унбибий (элемент 122), может быть конгенером церия и тория с основной степенью окисления +4, но будет иметь валентность в основном состоянии 7d 1 8s 2 8p 1 электронная конфигурация, в отличие от конфигурации тория d 2 s 2 . Следовательно, его первая энергия ионизации будет меньше, чем у тория (Th: 6,54 эВ; Ubb: 5,6 эВ) из-за большей легкости ионизации электрона 8p 1/2 унбибия, чем электрона 7s тория. [10]
В первых нескольких суперактинидах энергии связи добавленных электронов, по прогнозам, будут достаточно малы, чтобы они могли потерять все свои валентные электроны; например, унбигексий (элемент 126) может легко образовывать степень окисления +8, и могут быть возможны даже более высокие степени окисления для следующих нескольких элементов. Предполагается, что унбигексий также будет демонстрировать множество других состояний окисления: недавние расчеты показали, что возможен стабильный монофторид UbhF в результате связывающего взаимодействия между 5g-орбиталью на унбигексии и 2p-орбиталью на фторе. [13] Другие предсказанные степени окисления включают +2, +4 и +6; Ожидается, что +4 будет наиболее обычной степенью окисления унбигексия. [11] Присутствие электронов в g-орбиталях, которые не существуют в основной электронной конфигурации любого известного в настоящее время элемента, должно позволить неизвестным в настоящее время гибридным орбиталям формироваться и влиять на химию суперактинидов по-новому, хотя Отсутствие г электронов в известных элементах затрудняет предсказание их химического состава. [5]
Некоторые предсказанные соединения суперактинидов (X = галоген) [9] 121 122 123 124 125 126 132 142 143 144 145 146 148 153 154 155 Соединение UbuX 3 UbbX 4 UbtX 5 UbqX 6 UbpX 6 UbhF
UbhF 6
UbhO 4UqbX 4
UqbX 6UqtF 6 UqqX 6
Шаблон: Chem
UqqF 8
UqqO 4UqpF 6 UqoO 6 Аналоги LaX 3
AcX 3CeX 4
ThX 4THF 4 UF 6
[[уранил | Шаблон: Chem]]
PuF 8
PuO 4UO 6 Степени окисления 3 4 5 6 6 1, 2, 4, 6, 8 6 4, 6 6, 8 3, 4, 5, 6, 8 6 8 12 3 0, 2 3, 5
У более поздних суперактинидов степень окисления должна стать ниже.Для элемента 132 преобладающая наиболее стабильная степень окисления будет только +6; это дополнительно уменьшается до +3 и +4 элементом 144, и в конце ряда суперактинидов оно будет только +2 (и, возможно, даже 0), потому что оболочка 6f, которая заполняется в этой точке, находится глубоко внутри электронное облако и 8s и 8p 1/2 электроны слишком сильно связаны, чтобы быть химически активными. Оболочка 5g должна быть заполнена на элементе 144, а оболочка 6f около элемента 154, и в этой области суперактинидов электроны 8p 1/2 связаны настолько сильно, что они больше не являются химически активными, так что только несколько электроны могут участвовать в химических реакциях.Расчеты Fricke et al. предсказывают, что в элементе 154 оболочка 6f заполнена и нет никаких d- или других электронных волновых функций за пределами химически неактивных оболочек 8s и 8p 1/2 . Это приведет к тому, что элемент 154 будет очень инертным, так что он может проявлять свойства, аналогичные свойствам благородных газов. [5] [10]
Подобно сокращению лантаноидов и актинидов, суперактинидное сокращение должно иметь место в суперактинидном ряду, где ионные радиусы суперактинидов меньше ожидаемого.В лантаноидах сокращение составляет около 4,4 мкм на элемент; в актинидах она составляет около 3 пм на элемент. У лантаноидов сокращение больше, чем у актинидов из-за большей локализации волновой функции 4f по сравнению с волновой функцией 5f. Сравнение с волновыми функциями внешних электронов лантаноидов, актинидов и суперактинидов приводит к предсказанию сокращения примерно на 2 мкм на элемент в суперактинидах; хотя это меньше, чем сжатие в лантаноидах и актинидах, его общий эффект больше из-за того, что 32 электрона заполнены в глубоко скрытых оболочках 5g и 6f, вместо того, чтобы заполнить только 14 электронов в оболочках 4f и 5f в лантаноиды и актиниды соответственно. [5]
Пекка Пюккё делит эти суперактиниды на три серии: серию 5g (элементы 121–138), серию 8p 1/2 (элементы 139–140) и серию 6f (элементы 141–155). ), хотя и отмечая, что между уровнями энергии будет большое перекрытие и что орбитали 6f, 7d или 8p 1/2 также могут быть заняты в ранних атомах или ионах суперактинидов. Он также ожидает, что они будут вести себя больше как «суперлантаниды» в том смысле, что 5g-электроны будут в основном химически неактивными, подобно тому, как только один или два 4f-электрона в каждом лантаноиде когда-либо ионизируются в химических соединениях.Он также предсказал, что возможные степени окисления суперактинидов могут очень сильно возрасти в ряду 6f до таких значений, как +12 в элементе 148. [9]
7d переходные металлы
Ожидается, что переходными металлами в периоде 8 будут элементы с 156 по 164. Хотя электроны 8s и 8p 1/2 настолько сильно связаны в этих элементах, что они не должны участвовать в каких-либо химических реакциях, 9s и 9p 1/2 уровней, как ожидается, будут легко доступны для гибридизации, так что эти элементы будут по-прежнему вести себя химически, как их более легкие гомологи в периодической таблице, показывая те же состояния окисления, что и они, в отличие от более ранних предсказаний, которые предсказывали переходные металлы периода 8 имеют степень окисления на два меньше, чем у их более легких родственников. [5] [10]
Ожидается, что благородные металлы этой серии переходных металлов не будут такими же благородными, как их более легкие гомологи, из-за отсутствия внешней оболочки s для защиты, а также из-за того, что Оболочка 7d сильно разбита на две подоболочки из-за релятивистских эффектов. Это приводит к тому, что энергия первой ионизации переходных металлов 7d оказывается меньше, чем у их более легких родственников. [5] [10] [11]
Расчеты предсказывают, что 7d-электроны элемента 164 (унгексвадия) должны очень легко участвовать в химических реакциях, так что негексвадий должен иметь возможность показывать стабильные +6 и + 4 степени окисления в дополнение к нормальному состоянию +2 в водных растворах с сильными лигандами.Таким образом, унегексвадий должен образовывать такие соединения, как Uhq (CO) 4 , Uhq (PF 3 ) 4 (оба тетраэдрических) и Template: Chem (линейные), поведение которых сильно отличается от поведения свинца унгексвадиум был бы более тяжелым гомологом, если бы не релятивистские эффекты. Тем не менее, двухвалентное состояние будет основным в водном растворе, и унгексвадий (II) должен вести себя более аналогично свинцу, чем унгексвадий (IV) и унгексвадий (VI). [10] [11]
Унгексвадий должен быть мягким металлом, таким как ртуть, а металлический унгексвадий должен иметь высокую температуру плавления, поскольку предполагается, что он будет связываться ковалентно.Также ожидается, что это будет мягкая кислота Льюиса с параметром мягкости по Арландсу, близким к 4 эВ. Он также должен иметь некоторое сходство с ununoctium, а также с другими элементами группы 12. [10] Унгексвадий должен быть не более чем умеренно реактивным, имея энергию первой ионизации, которая должна быть около 685 кДж / моль, что сравнимо с энергией молибдена. [5] [11] Из-за сокращений лантаноидов, актинидов и суперактинидов унгексвадий должен иметь металлический радиус всего 158 мкм, что очень близко к радиусу гораздо более легкого магния, несмотря на то, что ожидается, что он будет иметь атомную форму. вес около 474 u, около 19.В 5 раз больше, чем магния. [5] Из-за этого малого радиуса и большого веса можно ожидать, что он будет иметь чрезвычайно высокую плотность около 46 г · см -3 , что вдвое больше, чем у осмия, самого плотного из известных в настоящее время элементов, – 22,61 г · см. см −3 ; унгексвадий должен быть вторым по плотности элементом в первых 172 элементах периодической таблицы, и только его сосед негекстрий (элемент 163) является более плотным (47 г · см −3 ). [5] Металлический унгексвадий должен быть достаточно стабильным, поскольку электроны 8s и 8p 1/2 очень глубоко скрыты в ядре электрона, и только 7d-электроны доступны для связывания.Металлический унгексвадий должен иметь очень большую энергию когезии (энтальпию кристаллизации) из-за его ковалентных связей, что, скорее всего, приводит к высокой температуре плавления. [11]
Теоретический интерес к химии унексвадия в значительной степени мотивирован теоретическими предсказаниями о том, что он, особенно изотоп 482 Uhq (с 164 протонами и 318 нейтронами), будет в центре гипотетического второго острова стабильность (первая центрирована на 306 Ubb). [14] [15] [16]
Некоторые предсказанные свойства переходных металлов 7d. Металлические радиусы и плотности являются первыми приближениями. X представляет собой галоген. [5] [9] [10]
Сначала приводится наиболее аналогичная группа, за которой следуют другие аналогичные группы. [11]Имущество 156 157 158 159 160 161 162 163 164 Относительная атомная масса [445] [448] [452] [456] [459] [463] [466] [470] [474] Группа 4
(Yb группа?)5
(3)6
(4)7
(5)8
(6)9
(7)10
(8)11
(9)12
(10, 14, 18)Валентная электронная конфигурация 7д 2 7д 3 7д 4 7д 4 9с 1 7д 5 9с 1 7д 6 9с 1 7д 8 7д 9 7d 10 Стабильные степени окисления 2 , 4 3 , 5 4 , 6, 8 1 , 5, 7 2 , 6, 8 3 , 7 4 , 8 3, 5 0 , 2 , 4 , 6 Энергия первой ионизации 395.6 кДж / моль 453,5 кДж / моль 521,0 кДж / моль 337,7 кДж / моль 424,5 кДж / моль 472,8 кДж / моль 559,6 кДж / моль 617,5 кДж / моль 685,0 кДж / моль Металлический радиус 170 вечера 163 вечера 157 вечера 152 вечера 148 часов 148 часов 149 вечера 152 вечера 158 вечера Плотность 26 г / см 3 28 г / см 3 30 г / см 3 33 г / см 3 36 г / см 3 40 г / см 3 45 г / см 3 47 г / см 3 46 г / см 3 Прогнозируемые соединения UpoX 6
UpoX 8
UpoO 4УнО 4 UhqX 2
UhqX 4
…Аналоги WF 6 , SGF 6 OsO 4 , HSO 4 HgX 2
HgF 4
Элементы от 165 до 172
Элементы 165 (негекспентиум) и 166 (негексгексий) должны вести себя как обычные щелочные и щелочноземельные металлы в состояниях окисления +1 и +2 соответственно.Энергии ионизации 9s-электронов должны быть сравнимы с энергиями ионизации 3s-электронов натрия и магния из-за релятивистских эффектов, заставляющих 9s-электроны быть гораздо более прочными, чем предсказывали нерелятивистские расчеты. Элементы 165 и 166 обычно должны иметь степени окисления +1 и +2 соответственно; однако энергии ионизации 7d-электронов достаточно низки, чтобы позволить более высокие состояния окисления, такие как +3 и +4, также возникать довольно часто. [5] [10]
В элементах с 167 по 172 будут заполнены оболочки 9p 1/2 и 8p 3/2 .Их собственные значения энергии настолько близки друг к другу, что они ведут себя как одна комбинированная оболочка p , похожая на нерелятивистские оболочки 2p и 3p. Таким образом, эффект инертной пары не возникает, и наиболее распространенные степени окисления элементов с 167 по 170 должны быть +3, +4, +5 и +6 соответственно. Элемент 171 (несептуний), как ожидается, будет галогеном, демонстрирующим различные степени окисления в диапазоне от –1 до +7. Его сродство к электрону должно составлять 3,0 эВ, что позволяет ему образовывать галогенид водорода HUsu. Ожидается, что ион Usu – будет мягким основанием, сравнимым с йодидом (I – ).Элемент 172 (несептбий) должен быть благородным газом с химическим поведением, аналогичным поведению ксенона, поскольку их энергии ионизации должны быть очень похожими (Xe, 1170,4 кДж / моль; Usb, 1090,3 кДж / моль). Единственное главное различие между ними состоит в том, что элемент 172, в отличие от ксенона, должен быть жидким или твердым при стандартной температуре и давлении из-за его гораздо более высокого атомного веса. [5] Несептбий должен быть сильной кислотой Льюиса, образующей фториды и оксиды, как и его более легкий родственный ксенон. [11] Из-за этой аналогии элементов 165–172 с периодами 2 и 3, Fricke et al. считал, что они образуют девятый период периодической таблицы, в то время как восьмой период, по их мнению, заканчивался на элементе благородного металла 164. Этот девятый период был бы похож на второй и третий периоды в том, что он не должен иметь переходных металлов . [11]
Некоторые предсказанные свойства элементов 165–172. Металлические или ковалентные радиусы и плотности являются первыми приближениями. [5] [10]
Сначала дается наиболее аналогичная группа, за которой следуют другие аналогичные группы. [11]Имущество 165 166 167 168 169 170 171 172 Относительная атомная масса [477] [481] [485] [489] [493] [496] [500] [504] Группа 1
(11, 13)2
(12, 14)13 14 15 16 17 18 Валентная электронная конфигурация 9с 1 9с 2 9с 2 9п 1 9с 2 9п 2 9s 2 9p 2 8p 1 9s 2 9p 2 8p 2 9s 2 9p 2 8p 3 9s 2 9p 2 8p 4 Стабильные состояния окисления 1 , 3 2 , 4 3 4 5 6 -1 , 3 , 7 0 , 4 , 6 , 8 Энергия первой ионизации 521.0 кДж / моль 627,2 кДж / моль 617,5 кДж / моль 723,6 кДж / моль 800,8 кДж / моль 887,7 кДж / моль 984,2 кДж / моль 1090,3 кДж / моль Металлический или ковалентный радиус 250 вечера 200 вечера 190 вечера 180 часов 175 часов 170 вечера 165 вечера 220 вечера Плотность 7 г / см 3 11 г / см 3 17 г / см 3 19 г / см 3 18 г / см 3 17 г / см 3 16 г / см 3 9 г / см 3
«Эка-суперактиниды»
Сразу после элемента 172 (несептбия), первого благородного газа после элемента 118 (последний элемент периода 7), должна начаться другая длинная серия переходов, таких как суперактиниды, заполняющие оболочки 6g, 7f, 8d и, возможно, 6h.Эти электроны будут очень слабо связаны, что сделает возможным достижение чрезвычайно высоких степеней окисления. [11] Эту серию можно назвать эка-суперактинидами, поскольку это следующая длинная переходная серия в периодической таблице после суперактинидов.
Ожидается, что электронная конфигурация в основном состоянии элемента 184 (уноктадиум) будет [Usb] 6g 5 7f 4 8d 3 : только электроны 8d и 7f должны быть химически активными, с возможными небольшими причинами. радиальное расширение и большая энергия связи.Отсутствие электронов 6h 11/2 , 10s и 10p 1/2 из этой электронной конфигурации в основном состоянии предполагает, что она будет вести себя химически проще, чем ранние суперактиниды, и больше похожа на уран или нептуний. По мере того, как больше электронов ионизируются, количество электронов 6g в ионе уноктаадия будет увеличиваться: они погребены в ядре электрона и не будут участвовать в химических реакциях, в отличие от электронов 7f, которые могут. Экстраполяция урана предполагает, что состояние +4 будет наиболее стабильным в водном растворе, а +5 и +6 легко достижимы в твердых соединениях.Более высокие состояния потребуют ионизации глубоко скрытых 6g-электронов и, вероятно, маловероятны: кроме того, их энергия связи становится намного выше по мере удаления большего количества электронов. Этот эффект настолько важен, что электроны 9s и 9p 1/2 , являющиеся частью закрытого электронного ядра [Usb], войдут в подоболочку 6g в степени окисления +8 и выше. Это говорит о том, что множество одновременно заполняющихся внешних электронных оболочек по мере продвижения по длинной серии переходов не может приводить к исключительно высоким или экзотическим состояниям окисления, а также не должно приводить к аномально низкому увеличению энергии ионизации. [5] [11] Это противоречит предварительным экстраполяциям (без расчетов), которые предполагали, что unoctquadium будет иметь много степеней окисления от +4 (с 8 6g электронами) до +12 (без 6g электронов). [17]
Ядерные свойства
Ожидается, что первый остров стабильности будет сосредоточен на унбибии-306 (со 122 протонами и 184 нейтронами), [14], , а второй, как ожидается, будет сосредоточен на унгексвадиях-482 (с 164 протонами и 318 нейтронами). [15] [16] Этот второй островок стабильности должен придавать дополнительную стабильность элементам 152–168. [11]
Расчеты по методу Хартри – Фока – Боголюбова с использованием нерелятивистского взаимодействия Скирма предложили Z = 126 как замкнутую протонную оболочку. В этой области периодической таблицы N = 184 и N = 196 были предложены как замкнутые нейтронные оболочки. Поэтому наиболее интересными изотопами являются 310 Ubh и 322 Ubh, поскольку они могут быть значительно более долгоживущими, чем другие изотопы.Предполагается, что унбигексий, имеющий магическое число протонов, будет более стабильным, чем другие элементы в этой области, и может иметь ядерные изомеры с очень длительным периодом полураспада. [18]
Электронные конфигурации
Ниже приведены ожидаемые электронные конфигурации элементов 119–172 и 184. [11]
Попытки синтезировать еще неоткрытые элементы
Единственными элементами периода 8, в которых были попытки синтеза, были элементы 119, 120, 122, 124, 126 и 127.{1} \ mathrm {n}}
Унбинилий
Попытки синтезировать элемент, используя реакции синтеза при низкой энергии возбуждения, потерпели неудачу, хотя есть сообщения, что деление ядер унбинилия при очень сильном возбуждении было успешно измерено, что указывает на сильный оболочечный эффект при Z = 120. В марте – апреле 2007 г. в Лаборатории ядерных реакций им. Флерова в Дубне была предпринята попытка синтеза унбинилия путем бомбардировки мишени плутония-244 ионами железа-58.{*} \ to \ {\ mathit {fission \ only}}}
Не было обнаружено никаких атомов, что обеспечивает предел в 1,6 пбар по поперечному сечению при заданной энергии. {*}}
Они не смогли обнаружить атомы, но точные данные в настоящее время недоступны.{*}}
Результаты этого эксперимента еще не доступны. [21] В 2008 году команда из GANIL, Франция, описала результаты нового метода, который пытается измерить период полураспада составного ядра при делении при высокой энергии возбуждения, поскольку выходы значительно выше, чем выходы из каналов испарения нейтронов. Это также полезный метод для исследования влияния закрытия оболочки на выживаемость составных ядер в сверхтяжелой области, которая может указывать точное положение следующей протонной оболочки (Z = 114, 120, 124 или 126).{*} \ to \ {\ mathit {fission}}.}
Результаты показали, что ядра анбинилия образовывались при высокой (~ 70 МэВ) энергии возбуждения, которые подвергались делению с измеримыми периодами полураспада. > 10 −18 с. Хотя это очень мало, возможность измерить такой процесс указывает на сильный оболочечный эффект при Z = 120. При более низкой энергии возбуждения (см. Испарение нейтронов) эффект оболочки будет усилен, и можно ожидать, что ядра в основном состоянии будут иметь относительно длительные периоды полураспада.Этот результат может частично объяснить относительно длительный период полураспада 294 Uuo, измеренный в экспериментах в Дубне. Подобные эксперименты показали подобное явление при Z = 124 (см. Унбиквадий), но не для флеровия, предполагая, что следующая протонная оболочка действительно находится при Z> 120. [24] [25] Команда RIKEN начала программу с использованием мишеней 248 Cm и указала на будущие эксперименты, чтобы исследовать возможность Z = 120 быть следующим магическим числом, используя вышеупомянутые ядерные реакции с образованием 302 Ubn.{*} \ to \ {\ mbox {no atom}}.}
Атомов обнаружено не было, предел текучести составил 5 мб (5 000 000 000 пб). Текущие результаты (см. Flerovium) показали, что чувствительность этого эксперимента была слишком низкой, по крайней мере, на 6 порядков. {{Safesubst: #invoke: Unsubst || date = __ DATE__ | $ B = {{#invoke: Category handler | main}} {{# invoke: Category handler | main}} [ требуется ссылка ] }}
В 2000 году компания Gesellschaft für Schwerionenforschung (GSI) провела очень похожий эксперимент с гораздо более высокой чувствительностью: [27]
- U + 3070Zn → 122308Ubb ∗ → нет атомов.{*} \ to \ {\ mbox {no atom}}.}
Эти результаты показывают, что синтез таких более тяжелых элементов остается серьезной проблемой и требует дальнейшего улучшения интенсивности пучка и эффективности экспериментов. Чувствительность следует увеличить до 1 фб. {{Safesubst: #invoke: Unsubst || date = __ DATE__ | $ B = {{#invoke: Category handler | main}} {{# invoke: Category handler | main}} [ требуется ссылка ] }}
Еще одна неудачная попытка синтезировать унбибий была предпринята в 1978 году в GSI, где мишень из природного эрбия подверглась бомбардировке ионами ксенона-136: [27]
- 68natEr + 54136Xe → 298,300,302,303,304,306Ubb ∗ → без атомов.{*} \ to \ {\ mbox {no atom}}.}
Две попытки в 1970-х годах синтезировать унбибий были вызваны исследованиями, изучающими, могут ли сверхтяжелые элементы потенциально встречаться в природе. [27] В период с 2000 по 2004 год в лаборатории ядерных реакций им. Флерова было проведено несколько экспериментов по изучению характеристик деления составного ядра 306 Ubb. Были использованы две ядерные реакции, а именно 248 Cm + 58 Fe и 242 Pu + 64 Ni. [27] Результаты показали, как ядра, подобные этому, делятся преимущественно за счет вытеснения ядер с закрытой оболочкой, таких как 132 Sn (Z = 50, N = 82). Было также обнаружено, что выход для пути синтеза-деления был одинаковым для снарядов 48 Ca и 58 Fe, что указывает на возможное будущее использование снарядов 58 Fe в формировании сверхтяжелых элементов. [28]
Унбиквадий
В серии экспериментов ученые из GANIL попытались измерить прямое и отложенное деление составных ядер элементов с Z = 114, 120 и 124, чтобы исследовать оболочечные эффекты в этой области и точно определить следующую сферическую протонную оболочку. .{*} \ to \ fission.}
Команда сообщила, что им удалось идентифицировать делящиеся составные ядра с периодом полураспада> 10 −18 с. Этот результат предполагает сильный стабилизирующий эффект при Z = 124 и указывает на следующую протонную оболочку при Z> 120, а не при Z = 114, как считалось ранее. Составное ядро - это рыхлая комбинация нуклонов, которые еще не образовали ядерные оболочки. Он не имеет внутренней структуры и удерживается вместе только силами столкновения между ядрами мишени и снаряда.Подсчитано, что нуклонам требуется около 10 −14 с, чтобы организовать себя в ядерные оболочки, после чего составное ядро становится нуклидом, и это число используется ИЮПАК в качестве минимального периода полураспада заявленного изотопа. должны быть потенциально признаны обнаруженными. Таким образом, эксперименты GANIL не засчитываются как открытие элемента 124. [27]
Унбигексий
Первая и единственная попытка синтезировать унбигексий, которая не увенчалась успехом, была предпринята в 1971 году в ЦЕРНе Рене Бимботом и Джоном М.Александр использует реакцию горячего синтеза: [27]
- Шаблон: Nuclide2 + Шаблон: Nuclide2 → Шаблон: Nuclide2 * → без атомов
Наблюдалась альфа-частица высокой энергии, которая была принята в качестве возможного доказательства синтеза унбигексия. Шаблон недавнего исследования: что предполагает, что это маловероятно, поскольку чувствительность экспериментов, проведенных в 1971 году, была бы на несколько порядков ниже, чем полагается в настоящее время.
Unbiseptium
Unbiseptium предпринял одну неудачную попытку синтеза в 1978 году на ускорителе UNILAC в Дармштадте путем бомбардировки мишени из природного тантала ионами ксенона: [27]
- 73natTa + 54136Xe → 316,317Ubs ∗ → нет атомов.{*} \ to {\ mbox {no atom}}.}
Возможное природное происшествие
24 апреля 2008 г. группа во главе с Амноном Мариновым из Еврейского университета в Иерусалиме заявила, что обнаружила отдельные атомы унбибия-292 в природных отложениях тория в количестве от 10 −11 до 10 −12 . , относительно тория. [29] Заявление Маринова и др. подвергся критике со стороны части научного сообщества, и Маринов говорит, что отправил статью в журналы Nature и Nature Physics , но оба отклонили ее, не отправив на рецензирование. [30] Утверждается, что атомы унбибия-292 являются супердеформированными или гипердеформированными изомерами с периодом полураспада не менее 100 миллионов лет. [27]
Критика метода, ранее использовавшегося для предполагаемой идентификации более легких изотопов тория с помощью масс-спектрометрии, [31] была опубликована в Physical Review C в 2008 году. [32] Опровержение группы Маринова был опубликован в Physical Review C после опубликованного комментария. [33]
Повторение эксперимента с торием с использованием более совершенного метода ускорительной масс-спектрометрии (AMS) не подтвердило результаты, несмотря на 100-кратную лучшую чувствительность. [34] Этот результат ставит под сомнение результаты коллаборации Маринова в отношении их претензий на долгоживущие изотопы тория, [31] , рентгения, [35], и унбибия. [29] По-прежнему возможно, что следы унбибия могут присутствовать только в некоторых образцах тория, хотя это маловероятно. [27]
В 1976 году было высказано предположение, что первичные сверхтяжелые элементы (в основном ливерморий, унбиквадий, унбигексий и унбисептиум) могут быть причиной необъяснимого радиационного повреждения минералов.Это побудило многих исследователей искать его в природе с 1976 по 1983 год. Некоторые утверждали, что они обнаружили альфа-частицы с нужной энергией, чтобы вызвать наблюдаемое повреждение, подтверждая присутствие унбигексия, в то время как некоторые утверждали, что никакого унбигексия обнаружено не было. Однако возможные масштабы первичного unbihexium на Земле сомнительны; теперь он мог существовать только в виде следов, или мог даже полностью распасться к настоящему времени после того, как давно вызвал радиационные повреждения. [18]
Конец таблицы Менделеева
Число физически возможных элементов неизвестно.Низкая оценка – то, что периодическая таблица может закончиться вскоре после острова стабильности, [7] , который, как ожидается, сосредоточится на Z = 126, поскольку расширение периодической таблицы и таблицы нуклидов ограничено протоном и нейтронные капельные линии; [36] Однако некоторые, такие как Уолтер Грейнер, предсказывают, что периодической таблице Менделеева может и не быть конца. [8] Другие предсказания конца периодической таблицы включают Z = 128 (Джон Эмсли) и Z = 155 (Альберт Хазан). [27]
Фейнманий и элементы с атомным номером выше 137
Ричард Фейнман отметил [37] , что упрощенная интерпретация релятивистского уравнения Дирака сталкивается с проблемами с электронными орбиталями на Z > 1 / α ≈ 137, как описано в разделах ниже, предполагая, что нейтральные атомы не могут существовать за пределами unriseptium, и что периодическая таблица элементов, основанная на электронных орбиталях, поэтому ломается в этом месте. С другой стороны, более строгий анализ вычисляет предел, равный Z ≈ 173, а также то, что этот предел фактически не означает конец периодической таблицы.
Модель Бора
Модель Бора показывает трудности для атомов с атомным номером больше 137, поскольку скорость электрона на орбитали электрона 1 с, v , дается выражением
- v = Zαc≈Zc137.036 {\ displaystyle v = Z \ alpha c \ приблизительно {\ frac {Zc} {137.036}}}
, где Z – атомный номер, а α – постоянная тонкой структуры, мера силы электромагнитных взаимодействий. [38] Согласно этому приближению, любой элемент с атомным номером больше 137 потребует 1s электронов, чтобы двигаться быстрее, чем c , скорость света.{2}}}},}
где м – масса покоя электрона. Для Z > 137 волновая функция основного состояния Дирака является скорее колебательной, чем связанной, и нет разрыва между спектрами положительной и отрицательной энергии, как в парадоксе Клейна. [39] Более точные расчеты с учетом эффектов конечного размера ядра показывают, что энергия связи сначала превышает 2 mc 2 для Z > Z cr ≈ 173.Для Z > Z cr , если самая внутренняя орбиталь (1s) не заполнена, электрическое поле ядра вытянет электрон из вакуума, что приведет к спонтанному излучению позитрона. [40] Однако этого не происходит, если самая внутренняя орбиталь заполнена, так что Z = 173 не составляет ограничения для периодической таблицы. [8]
См. Также
Список литературы
Внешние ссылки
Дополнительная литература
Шаблон: Компактная расширенная таблица Менделеева. {{#invoke: Navbox | navbox}}
.




 13
13 07
07