Таблица менделеева – Электронный учебник K-tree
Электронный учебник
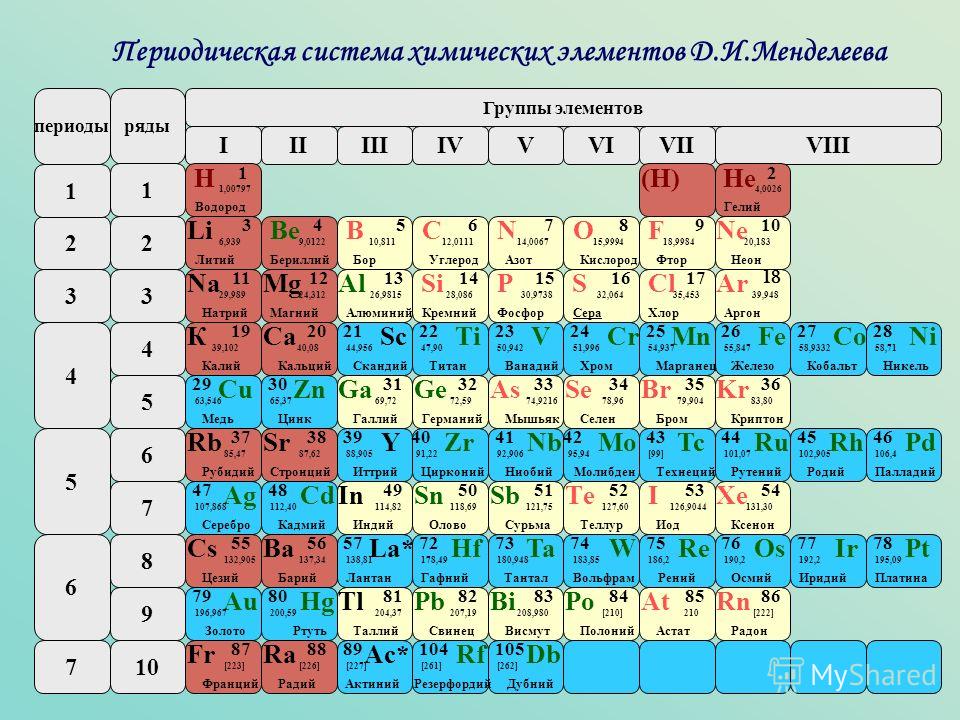
Периодический закон, открытый Д. И. Менделеевым был выражен в таблице. Периодическая таблица химических элементов, или таблица менделеева.
1
H
1.008
2
He
4.003
3
Li
6.938
4
Be
9.012
5
B
10.806
6
C
12.01
7
N
14.006
8
O
15.999
9
F
18.998
10
Ne
20.18
11
Na
22.99
12
Mg
24.304
13
Al
26.982
14
Si
28.084
15
P
30.974
16
S
32.059
17
Cl
35.446
18
Ar
39.948
19
K
39.098
20
Ca
40.078
21
Sc
44.956
22
Ti
47.867
23
V
50.942
24
Cr
51. 996
996
Mn
54.938
26
Fe
55.845
27
Co
58.933
28
Ni
58.693
29
Cu
63.546
30
Zn
65.38
31
Ga
69.723
32
Ge
72.63
33
As
74.922
34
Se
78.971
35
Br
79.901
36
Kr
83.798
37
Rb
85.468
38
Sr
87.62
39
Y
88.906
40
Zr
91.224
41
Nb
92.906
42
Mo
95.95
44
Ru
101.07
45
Rh
102.906
46
Pd
106.42
47
Ag
107.868
48
Cd
112.414
49
In
114.818
50
Sn
118.71
51
Sb
121.76
52
Te
127.6
53
I
126.904
54
Xe
131.293
55
Cs
132.905
56
Ba
137.327
57
La
138.905
72
Hf
178. 49
49
73
Ta
180.948
74
W
183.84
75
Re
186.207
76
Os
190.23
77
Ir
192.217
78
Pt
195.084
79
Au
196.967
80
Hg
200.592
81
Tl
204.382
82
Pb
207.2
83
Bi
208.98
58
Ce
140.116
59
Pr
140.908
60
Nd
144.242
62
Sm
150.36
63
Eu
151.964
64
Gd
157.25
65
Tb
158.925
66
Dy
162.5
67
Ho
164.93
68
Er
167.259
69
Tm
168.934
70
Yb
173.045
71
Lu
174.967
90
Th
232.038
91
Pa
231.036
92
U
238.029
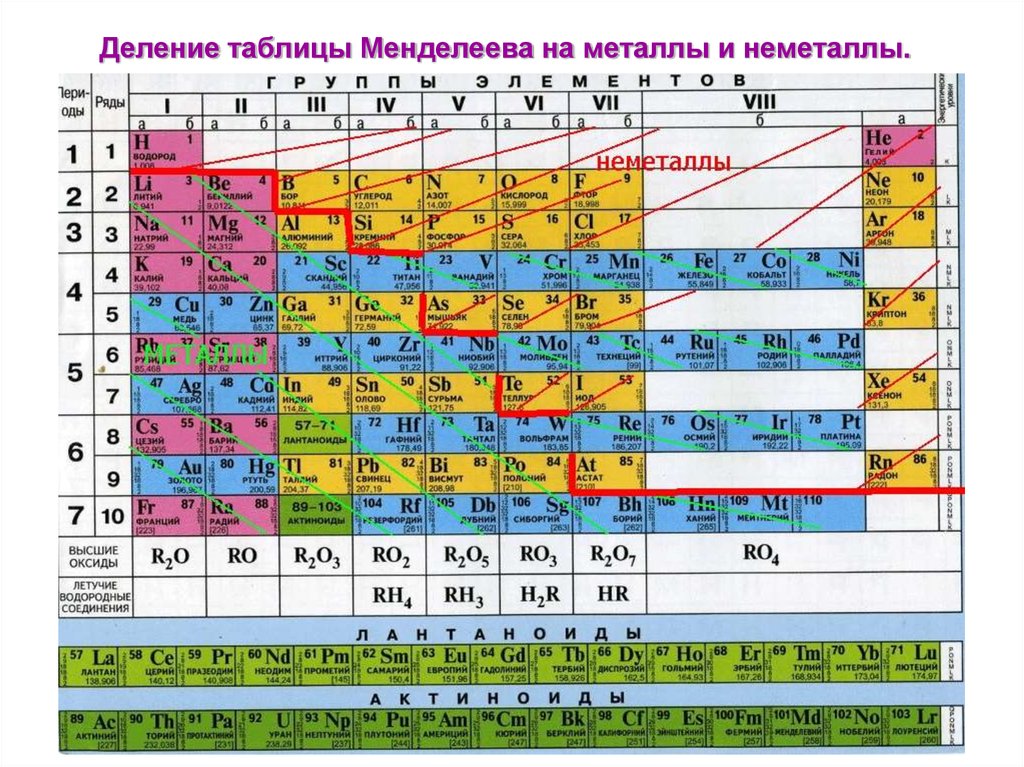
В таблице менделеева колонки называются группами, строки называются периодами. Элементы в группах как правило имеют
одинаковые электронные конфигурации внешних оболочек, например, благородные газы – последняя группа, имеют законченную
электронную конфигурацию.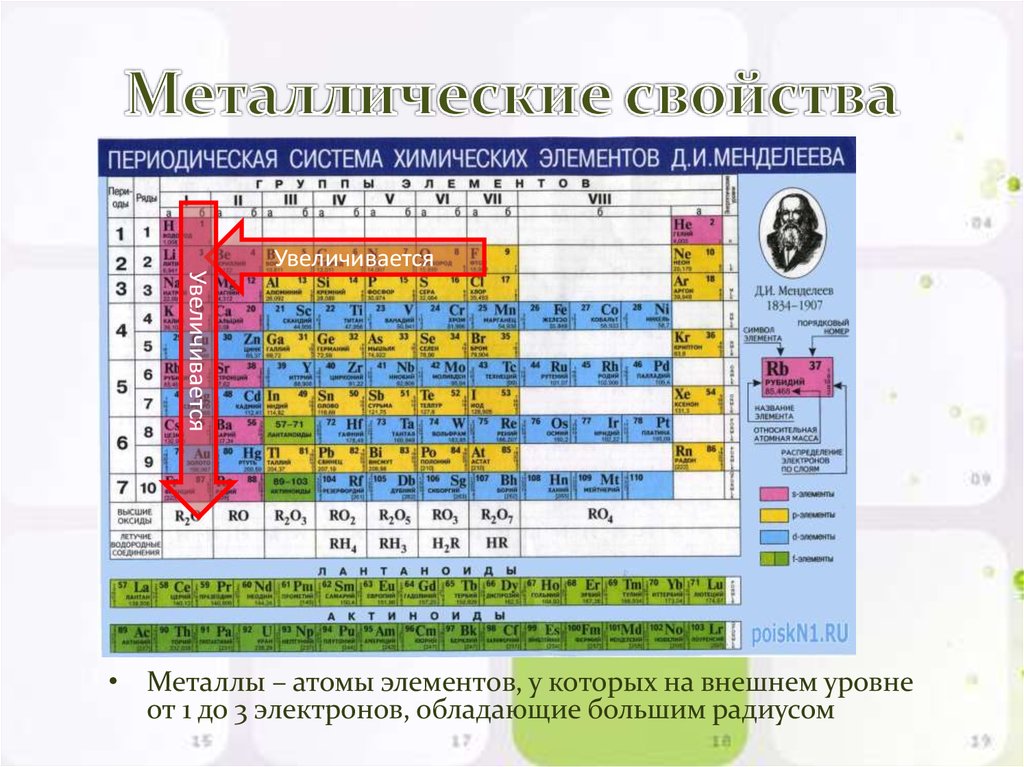
Как заполняется электронная конфигурация элементов подробно описано в статье
Скачать таблицу менделеева в хорошем качестве
© 2015-2022 – K-Tree.ru • Электронный учебник
По любым вопросам Вы можете связаться по почте [email protected]
Копия материалов, размещённых на данном сайте, допускается только по письменному разрешению владельцев сайта.
Таблица менделеева – Электронный учебник K-tree
Электронный учебник
Периодический закон, открытый Д. И. Менделеевым был выражен в таблице. Периодическая таблица химических элементов, или таблица менделеева.
1
H
1.008
2
He
4.003
3
Li
6.938
4
Be
9.012
5
B
10. 806
806
6
C
12.01
7
N
14.006
8
O
15.999
9
F
18.998
10
Ne
20.18
11
Na
22.99
12
Mg
24.304
13
Al
26.982
14
Si
28.084
15
P
30.974
16
S
32.059
17
Cl
35.446
18
Ar
39.948
19
K
39.098
20
Ca
40.078
21
Sc
44.956
22
Ti
47.867
23
V
50.942
24
Cr
51.996
25
Mn
54.938
26
Fe
55.845
27
Co
58.933
28
Ni
58.693
29
Cu
63.546
30
Zn
65.38
31
Ga
69.723
32
Ge
72.63
33
As
34
Se
78.971
35
Br
79.901
36
Kr
83.798
37
Rb
85.468
38
Sr
87. 62
62
39
Y
88.906
40
Zr
91.224
41
Nb
92.906
42
Mo
95.95
44
Ru
101.07
45
Rh
102.906
46
Pd
106.42
47
Ag
107.868
48
Cd
112.414
49
In
114.818
50
Sn
118.71
51
Sb
121.76
52
Te
127.6
53
I
126.904
54
Xe
131.293
55
Cs
132.905
56
Ba
137.327
57
La
138.905
72
Hf
178.49
73
Ta
180.948
74
W
183.84
75
Re
186.207
76
Os
190.23
77
Ir
192.217
78
Pt
195.084
79
Au
196.967
80
Hg
200.592
81
Tl
204.382
82
Pb
207.2
83
Bi
208.98
58
Ce
140.116
59
Pr
140. 908
908
60
Nd
144.242
62
Sm
150.36
63
Eu
151.964
64
Gd
157.25
65
Tb
158.925
66
Dy
162.5
67
Ho
164.93
68
Er
167.259
69
Tm
168.934
70
Yb
173.045
71
Lu
174.967
90
Th
232.038
91
Pa
231.036
92
U
238.029
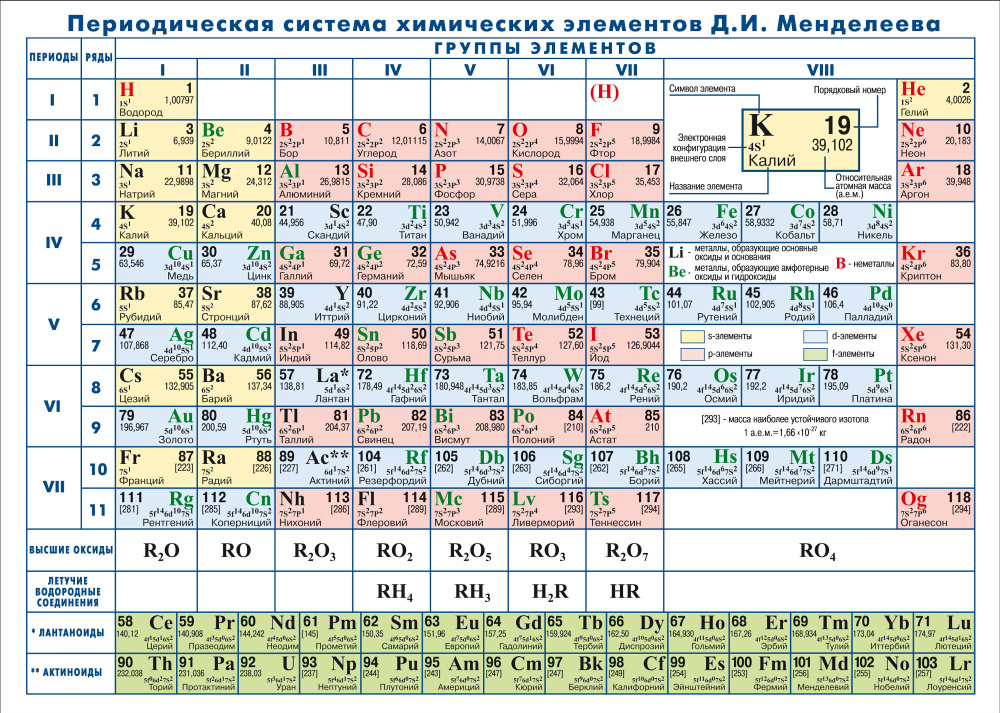
В таблице менделеева колонки называются группами, строки называются периодами. Элементы в группах как правило имеют одинаковые электронные конфигурации внешних оболочек, например, благородные газы – последняя группа, имеют законченную электронную конфигурацию.
Как заполняется электронная конфигурация элементов подробно описано в статье
Скачать таблицу менделеева в хорошем качестве
© 2015-2022 – K-Tree. ru • Электронный учебник
ru • Электронный учебник
По любым вопросам Вы можете связаться по почте [email protected]
Копия материалов, размещённых на данном сайте, допускается только по письменному разрешению владельцев сайта.
Рубидий (Rb) – Химические свойства, воздействие на здоровье и окружающую среду
- Главная
- Периодическая таблица
- Элементы
- Рубидий
| 0199 |
Рубидий — мягкий серебристо-белый металлический элемент группы щелочных металлов (группа 1). Это один из самых электроположительных и щелочных элементов. Рубидий может быть жидким при температуре окружающей среды, но только в жаркий день, так как его температура плавления составляет около 40°C. Области применения Рубидий и его соли мало используются в коммерческих целях. Металл используется в производстве фотоэлементов и для удаления остаточных газов из вакуумных трубок. Соли рубидия используются в очках и керамике, а также в фейерверках, чтобы придать им пурпурный цвет. Потенциальное использование – в ионных двигателях для космических аппаратов, в качестве рабочего тела в паровых турбинах и в качестве газопоглотителя в вакуумных трубках. Рубидий в окружающей среде Рубидий считается 16-м наиболее распространенным элементом в земной коре. Относительное содержание рубидия было переоценено в последние годы, и теперь предполагается, что оно больше, чем предполагалось ранее. Последствия воздействия: реагирует с водой. Умеренно токсичен при приеме внутрь. Если рубидий загорится, он вызовет термические ожоги. Рубидий легко реагирует с влагой кожи с образованием гидроксида рубидия, который вызывает химические ожоги глаз и кожи. Первая помощь: Глаза: немедленно промыть проточной водой в течение 15 минут, удерживая веко. Немедленно обратитесь за медицинской помощью. Кожа: удалить материал и промыть водой с мылом. Снять загрязненную одежду. Немедленно обратитесь за медицинской помощью. Вдыхание: немедленно выйти на свежий воздух. Если раздражение не проходит, обратитесь за медицинской помощью. Проглатывание: не вызывать рвоту. Немедленно обратитесь за медицинской помощью. Рубидий не играет известной биологической роли, но оказывает незначительное стимулирующее действие на обмен веществ, вероятно, потому, что он похож на калий. Эти два элемента вместе встречаются в минералах и почвах, хотя калия гораздо больше, чем рубидия. Растение довольно быстро адсорбирует рубидий. О негативном воздействии на окружающую среду не сообщалось. | |
Еще из «Элементов»
Актиний
Серебро
Алюминий
2012 АргонМышьяк
Астат
Золото
Бор
Барий
Бериллий
Борий
Висмут
Берклий
Бром
Углерод
Кальций
Кадмий
Церий
Калифорний
Хлор
8 Кюрий 0021Хром
Цезий
Медь
Дубний
Дармштадтий
Диспрозий
Эрбий
Эйнштейний
Европий
Фтор
Железо
Фермий
Франций
Галлий
Гадолиний
Германий
Водород
Гелий
Гафний
Ртуть
Гольмий
ine
Индий
Иридий
Калий
Криптон
Лантан
Литий
Лаврентий
Лютеций
Менделевий
Магний
Марганец
Молибден
Мейтнерий
Азот
Натрий
Ниобий
Неодим
Неон
Никель
Нобелий
Осмий
Фосфор
Протактиний
Свинец
Палладий
Прометий
Полоний
Празеодим
Платина
Плутоний
Радий
Рений
Резерфордий
Рентгений
Родий
Радон
Рутений
Сера
Сурьма
Скандий
Селен
1 0018 Кремний
Самарий
Олово
Стронций
Тантал
Тербий
Технеций
Теллур
Торий
Периодическая таблица элементов: Лос-Аламосская национальная лаборатория
Рубидий — мягкий серебристый металл, бурно реагирующий с водой (изображение из Википедии). |
| Атомный номер: | 37 | Атомный радиус: | 303 часа (Ван-дер-Ваальс) |
| Атомарный символ: | руб. | Температура плавления: | 39,3 °С |
| Атомный вес: | 85,47 | Точка кипения: | 688 °С |
| Электронная конфигурация: | [Kr]5s 1 | Степени окисления: | +1 , −1 (сильноосновной оксид) |
История
От латинского слова rubidus, темно-красный. Обнаружен в 1861 году Бунзеном и Кирхгофом в минерале лепидолите с помощью спектроскопа.
Источники
Этот элемент гораздо более распространен, чем считалось несколько лет назад.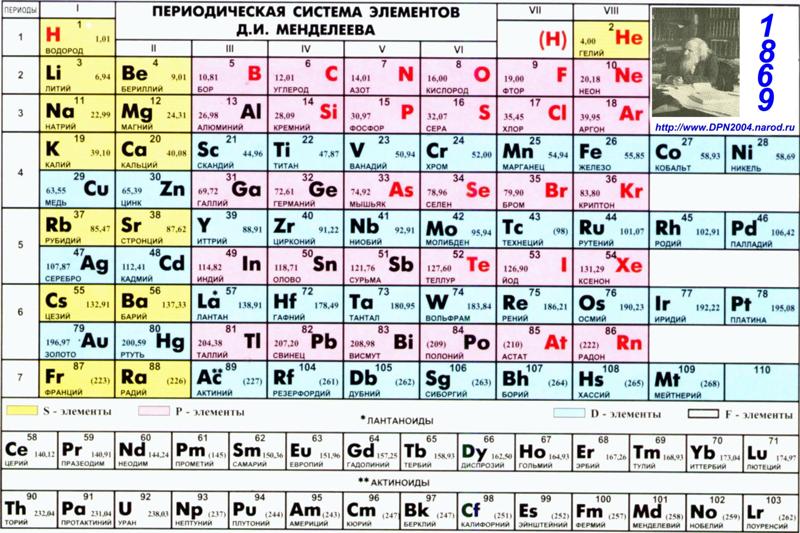 В настоящее время он считается 16-м по распространенности элементом в земной коре. Рубидий встречается в поллуците, лейците и циннвальдите, который содержит следы до 1%, в виде оксида. Он содержится в лепидолите в количестве около 1,5% и извлекается из этого источника в коммерческих целях. Минералы калия, такие как найденные в озере Сирлс, Калифорния, и хлорид калия, извлеченный из рассолов в Мичигане, также содержат этот элемент и являются коммерческими источниками. Он также обнаружен вместе с цезием в обширных отложениях поллуцита на озере Берник, Манитоба.
В настоящее время он считается 16-м по распространенности элементом в земной коре. Рубидий встречается в поллуците, лейците и циннвальдите, который содержит следы до 1%, в виде оксида. Он содержится в лепидолите в количестве около 1,5% и извлекается из этого источника в коммерческих целях. Минералы калия, такие как найденные в озере Сирлс, Калифорния, и хлорид калия, извлеченный из рассолов в Мичигане, также содержат этот элемент и являются коммерческими источниками. Он также обнаружен вместе с цезием в обширных отложениях поллуцита на озере Берник, Манитоба.
Свойства
Рубидий может быть жидким при комнатной температуре. Это мягкий серебристо-белый металлический элемент щелочной группы, второй по величине электроположительный и щелочной элемент. Он самовозгорается на воздухе и бурно реагирует в воде, поджигая выделяющийся водород. Как и другие щелочные металлы, он образует амальгамы с ртутью и сплавы с золотом, цезием, натрием и калием. Окрашивает пламя в желтовато-фиолетовый цвет.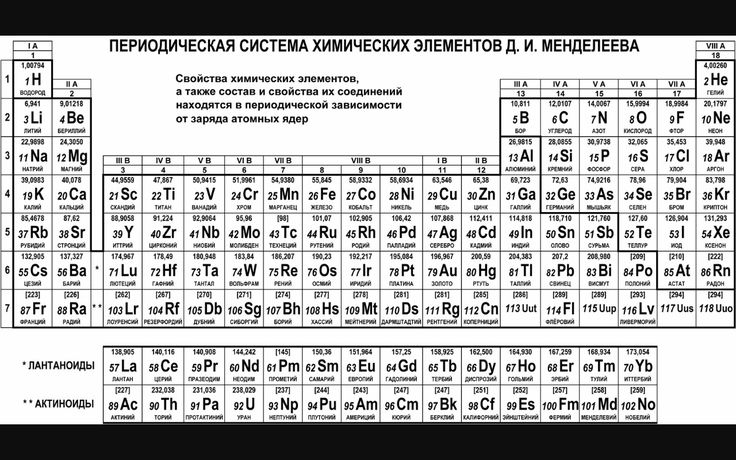 Металлический рубидий можно получить восстановлением хлорида рубидия кальцием и рядом других способов. Он должен храниться под сухим минеральным маслом или в вакууме или инертной атмосфере.
Металлический рубидий можно получить восстановлением хлорида рубидия кальцием и рядом других способов. Он должен храниться под сухим минеральным маслом или в вакууме или инертной атмосфере.
Изотопы
Известны двадцать четыре изотопа рубидия. Встречающийся в природе рубидий состоит из двух изотопов: 85 Rb и 87 Rb. Рубидий-87 присутствует в количестве 27,85% в природном рубидии и является бета-излучателем с периодом полураспада 4,9 х 10 10 лет. Обычный рубидий достаточно радиоактивен, чтобы засветить фотопленку примерно за 30–60 дней. Рубидий образует четыре оксида: Rb 2 O, Rb 2 O 2 , Rb 2 О 3 , Руб 2 О 4 .
Применение
Поскольку рубидий легко ионизируется, его рассматривали для использования в «ионных двигателях» космических аппаратов; однако цезий несколько более эффективен для этой цели. Он также предлагается для использования в качестве рабочего тела паровых турбин и для использования в термоэлектрическом генераторе, использующем магнитогидродинамический принцип, в котором ионы рубидия образуются под действием тепла при высокой температуре и проходят через магнитное поле.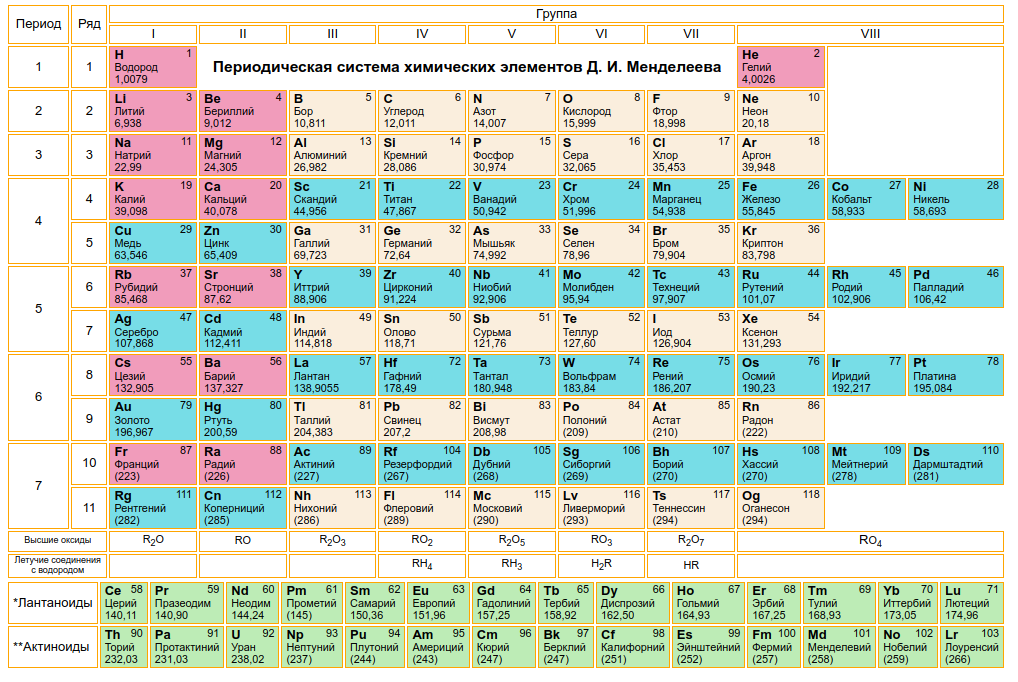

 149 нм (+1)
149 нм (+1) Он самовозгорается на воздухе и бурно реагирует с водой и даже со льдом при -100 С, поджигая выделяющийся водород. Как и все другие щелочные металлы, он образует амальгамы с ртутью. Он сплавляется с золотом, цезием, натрием и калием. Его пламя желтовато-фиолетовое.
Он самовозгорается на воздухе и бурно реагирует с водой и даже со льдом при -100 С, поджигая выделяющийся водород. Как и все другие щелочные металлы, он образует амальгамы с ртутью. Он сплавляется с золотом, цезием, натрием и калием. Его пламя желтовато-фиолетовое. Он очень похож на калий, и нет сред, где он рассматривается как угроза.
Он очень похож на калий, и нет сред, где он рассматривается как угроза.  Признаки и симптомы передозировки: ожоги кожи и глаз. Неспособность набрать вес, атаксия, гиперраздражение, кожные язвы и сильная нервозность. Медицинское состояние, усугубленное воздействием: сердечные заболевания, дисбаланс калия.
Признаки и симптомы передозировки: ожоги кожи и глаз. Неспособность набрать вес, атаксия, гиперраздражение, кожные язвы и сильная нервозность. Медицинское состояние, усугубленное воздействием: сердечные заболевания, дисбаланс калия. При стрессах из-за дефицита калия некоторые растения, например сахарная свекла, реагируют на внесение рубидия. Таким образом, рубидий попадает в пищевую цепь и, таким образом, составляет от 1 до 5 мг ежедневного потребления.
При стрессах из-за дефицита калия некоторые растения, например сахарная свекла, реагируют на внесение рубидия. Таким образом, рубидий попадает в пищевую цепь и, таким образом, составляет от 1 до 5 мг ежедневного потребления.