История открытия антибиотиков
Московская Медицинская Академия им. И.М. Сеченова
Кафедра Общей хирургии на базе ГКБ№23 (2 гнойное отделение)
«История открытия антибиотиков.»
Исполнитель:
Студентка III-ого курса
Лечебного факультета
4ой группы
Лабутина Юлия Олеговна
Преподаватель: Вавилова Г.С.
Москва 2004
Противомикробные препараты.
Сдерживание или прекращение роста микробов достигается различными методами (комплексами мер): антисептикой, стерилизацией, дезинфекцией, химиотерапией. Соответственно, химические вещества, которые применяются для осуществления этих мер, называются
 Противомикробные химические средства
подразделяют на две группы: не обладающие
избирательностью действия – губительны
в отношении большинства микробов, но
при этом токсичны для клеток макроорганизма
(антисептики и дезинфектанты), и
обладающие избирательностью действия
(химиотерапевтические средства).
Противомикробные химические средства
подразделяют на две группы: не обладающие
избирательностью действия – губительны
в отношении большинства микробов, но
при этом токсичны для клеток макроорганизма
(антисептики и дезинфектанты), и
обладающие избирательностью действия
(химиотерапевтические средства).Химиотерапевтические противомикробные лекарственные средства – это химические препараты, которые применяют при инфекционных заболеваниях для этиотропного лечения (т.е. направленного на микроб как на причину болезни), а также для профилактики инфекций.
К антимикробным химиотерапевтическим средствам относят следующие группы препаратов:
Антибиотики (действуют только на клеточные формы микроорганизмов; также известны противоопухолевые антибиотики)
Синтетические химиопрепараты разного химического строения (среди них есть препараты, которые действуют или на клеточные микроорганизмы, или на неклеточные формы микробов)
Антибиотики – это химиотерапевтические препараты
из химических соединений биологического
происхождения (природные), а также их
полусинтетические производные и
синтетические аналоги, которые в низких
концентрациях оказывают избирательное
повреждающее или губительное действие
на микроорганизмы и опухоли.
Проблема
лечения инфекционных заболеваний имеет
такую же долгую
историю, как и изучение
самих болезней. С точки зрения современного
человека, первые попытки в этом
направлении были наивны и примитивны,
хотя некоторые из них и не были лишены
здравого смысла (например, прижигание
ран или изоляция больных).

Еще в 1871-1872 гг. российские
ученые В.А. Манассеин и А.Г. Полотебнов
наблюдали эффект при лечении зараженных
ран прикладыванием плесени, хотя
почему они помогают, никто не знал, и
феномен антибиоза был неизвестен.
Однако
некоторые из первых ученых-микробиологов
сумели обнаружить и описать антибиоз
(угнетение одними организмами роста
других). Дело в том, что антагонистические
отношения между разными микроорганизмами
проявляются при их росте в смешанной
культуре. До разработки методов чистого
культивирования разные бактерии и
плесени выращивались вместе, т.е. в
оптимальных для проявления антибиоза
условиях. Луи Пастер еще в 1877 при изучении
сибирской язвы заметил, что заражение
животного смесью возбудителя и других
бактерий часто мешает развитию
заболевания, что позволило ему
предположить, что конкуренция между
микробами может блокировать патогенные
свойства возбудителя. Он описал антибиоз
между бактериями почвы и патогенными
бактериями – возбудителями сибирской
язвы и даже предположил, что антибиоз
может стать основой методов лечения.
Наблюдения Л.
Пастера (1887) подтвердили, что антагонизм
в мире микробов – это распространенное
явление, однако природа его была неясна.
Первые антибиотики были выделены еще до того, как стала известной их способность угнетать рост микроорганизмов. Так, в 1860 был получен в кристаллической форме синий пигмент
Но ни одно
лекарство не спасло столько жизней,
сколько пенициллин.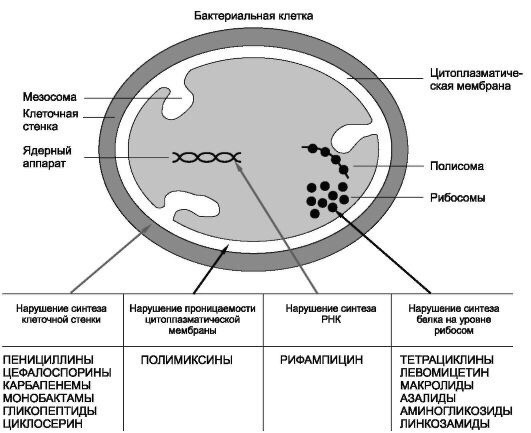 С открытием этого вещества началась
новая эра в лечении инфекционных
болезней – эра антибиотиков. Открытие
лекарств антибиотиков, к которым мы
уже так привыкли в наше время, сильнейшим
образом изменило человеческое общество.
Отступили заболевания еще не давно
считавшиеся безнадежными. Еще удивительнее
история самого открытия.
С открытием этого вещества началась
новая эра в лечении инфекционных
болезней – эра антибиотиков. Открытие
лекарств антибиотиков, к которым мы
уже так привыкли в наше время, сильнейшим
образом изменило человеческое общество.
Отступили заболевания еще не давно
считавшиеся безнадежными. Еще удивительнее
история самого открытия.
Выдающийся биолог Александр Флеминг родился 6 августа 1881 г. в Шотландии, в графстве Эршир. Мальчик рос на ферме своих родителей, со всех сторон окружённой вересковыми пустошами. Природа давала юному Александру гораздо больше, чем школа. В возрасте 13 лет юный Александр переехал в столицу Великобритании — Лондон. В то время как его сверстники учились, Флеминг 5 лет проработал в местной пароходной компании, зарабатывая себе на жизнь.
В 1901 г. Флеминг поступил
в медицинское училище Святой Марии,
сдав сложные экзамены. Ему не помешало
то, что прошло уже 5 лет, как он перестал
учиться. Более того, он был признан
лучшим из поступающих во всём Соединённом
королевстве! Флеминг никогда не делал
бесполезной работы.
После завершения учёбы Флеминга пригласили работать в бактериологической лаборатории больницы Св. Марии. Бактериология в то время находилась на переднем крае науки.
Рабочий день Флеминга в первые годы его научной деятельности был едва ли не круглосуточным. По его приходу на работу проверяли часы. И даже в два часа ночи задержавшиеся на работе сотрудники могли зайти к нему побеседовать и выпить кружку пива.
В августе 1914 г. разразилась Первая мировая война. Флеминг получил звание офицера медицинской службы и был послан создавать бактериологическую лабораторию во Францию, в город Булонь.
Каждый день, поднимаясь
на чердак госпиталя, где разместилась
лаборатория, Флеминг проходил через
госпитальные палаты, где лежали раненые.
Ежедневно прибывали всё новые и новые
их группы. Здесь, в госпитале, они сотнями
умирали от инфекции. Переломы, разрывы
внутренних тканей… Кусочки земли и
одежды, попавшие в раны, довершали
работу бомб. Лицо раненого приобретало
серый цвет, дыхание затруднялось —
начиналось заражение крови. Результат
— неизбежная смерть.
Переломы, разрывы
внутренних тканей… Кусочки земли и
одежды, попавшие в раны, довершали
работу бомб. Лицо раненого приобретало
серый цвет, дыхание затруднялось —
начиналось заражение крови. Результат
— неизбежная смерть.
Флеминг стал исследовать эту инфекцию. Он рассказывал:
«Мне советовали обязательно накладывать повязки с антисептиками: карболовой, борной кислотами или перекисью водорода. Я видел, что антисептики убивают не все микробы, но мне говорили, что они убивают некоторые из них, и лечение проходит успешнее, чем в том случае, когда не применяют антисептики».
Флеминг решил поставить простой опыт, чтобы проверить, насколько антисептики помогают бороться с инфекцией.
Края большинства ран
были неровными, со многими изгибами и
извилинами. Микробы скапливались в
этих изгибах. Флеминг сделал муляж раны
из стекла: раскалил пробирку и изогнул
её конец наподобие извилин раны. Затем
он наполнил эту пробирку сывороткой,
загрязнённой навозом. Это была как бы
общая схема обычного боевого ранения.
На следующий день сыворотка стала
мутной и издавала неприятный запах. В
ней размножилось огромное количество
микробов. Затем Флеминг вылил сыворотку
и наполнил пробирку раствором обычного
сильного антисептика, после чего снова
заполнил промытую таким образом пробирку
чистой, незаражённой сывороткой. И что
же? Сколько бы раз Флеминг ни промывал
пробирку антисептиками, чистая сыворотка
через день становилась такой же зловонной
и мутной.
Затем
он наполнил эту пробирку сывороткой,
загрязнённой навозом. Это была как бы
общая схема обычного боевого ранения.
На следующий день сыворотка стала
мутной и издавала неприятный запах. В
ней размножилось огромное количество
микробов. Затем Флеминг вылил сыворотку
и наполнил пробирку раствором обычного
сильного антисептика, после чего снова
заполнил промытую таким образом пробирку
чистой, незаражённой сывороткой. И что
же? Сколько бы раз Флеминг ни промывал
пробирку антисептиками, чистая сыворотка
через день становилась такой же зловонной
и мутной.
В изгибах пробирки
микробы сохранялись, несмотря ни на
что. Из этого опыта Флеминг сделал
вывод, что обычные антисептики нисколько
не помогают при фронтовых ранениях.
Его совет военным врачам был следующим:
удалять все омертвевшие ткани, где
легко могут развиваться микробы, и
помогать организму самому бороться с
инфекцией посредством выделения белых
кровяных телец, из которых образуется
гной. Белые кровяные клетки (свежий
гной) уничтожают колонии микробов.
Белые кровяные клетки (свежий
гной) уничтожают колонии микробов.
Флеминг писал о своих чувствах в те дни:
«Глядя на заражённые раны, на людей, которые мучились и умирали и которым мы не в силах были помочь, я сгорал от желания найти, наконец, какое-нибудь средство, которое способно было бы убить эти микробы, нечто вроде сальварсана…»
В ноябре 1918 г. закончилась война, Флеминг вернулся в Англию, в свою лабораторию.
Флеминга часто высмеивали за беспорядок в лаборатории. Но этот беспорядок, как выяснилось, был плодотворным. Один из его сотрудников рассказывал:
«Флеминг сохранял
выделенные им культуры микроорганизмов
по две-три недели и, прежде чем уничтожить,
внимательно их изучал, чтобы проверить,
не произошло ли случайно какого-нибудь
неожиданного и интересного явления.
Дальнейшая история показала, что, если
бы он был таким же аккуратным, как я, он
скорее всего не открыл бы ничего нового».
Как-то раз в 1922 г., страдая насморком, Флеминг посеял в лабораторной посуде — чашке Петри — собственную носовую слизь. В той части чашки Петри, куда попала слизь, колонии бактерий погибли. Флеминг стал исследовать это явление и выяснил, что такое же действие оказывают слёзы, обрезки ногтя, слюна, кусочки живой ткани. Когда капля слезы попадала в пробирку с раствором, мутным от множества бактерий, он за несколько секунд становился совершенно прозрачным!
Сотрудникам Флеминга пришлось перенести немало «мучений», добывая слёзы для опытов. Они срезали цедру с лимона, выжимали её себе в глаза и собирали выступавшие слёзы. В больничной газете был даже помещён юмористический рисунок, на котором дети за небольшую плату дают лаборанту себя высечь, а другой лаборант собирает у них слёзы в сосуд с надписью « антисептики ».
Флеминг
назвал открытое им вещество «лизоцим»
— от греческих слов «растворение» и
«закваска» (имелось в виду растворение
бактерий). К сожалению, лизоцим убивал
далеко не все вредные, болезнетворные
бактерии.
К сожалению, лизоцим убивал
далеко не все вредные, болезнетворные
бактерии.
Совершить самое важное открытие в его жизни Флемингу также помогли случай и творческий беспорядок в лаборатории. Как-то в 1928 г. Флеминга навестил его коллега Прайс. Флеминг перебирал чашки Петри со старыми культурами. Во многие из них залетела плесень, что бывает довольно часто. Флеминг говорил Прайсу: «Как только вы открываете чашку с культурой, вас ждут неприятности: обязательно что-нибудь попадёт из воздуха…» Вдруг он замолчал и сказал, как всегда, спокойно: «Странно…»
В чашке Петри, которую он держал в руках, тоже выросла плесень, но здесь колонии бактерий вокруг неё погибли, растворились.
С этого момента Флеминг стал исследовать смертоносную для бактерий плесень, а чашку Петри, в которую она залетела, он сохранил до самой смерти.
Александр
Флеминг наблюдая
антагонизм Penicillium
notatum и стафилококка в смешанной культуре
открыл штамм плесневого гриба пеницилла
(Penicillium notatum), выделяющего химическое вещество,
которое задерживает рост стафилококка. Вещество было названо «пенициллин».
Правда, впереди было самое важное
испытание: не окажется ли это вещество
таким же вредным для человека и животных,
как для бактерий? Если бы это было так,
пенициллин ничем бы не отличался от
множества известных и до того антисептиков.
Его нельзя было бы вводить в кровь. К
величайшей радости Флеминга и его
сотрудников, пенициллиновый бульон,
смертоносный для бактерий, был не более
опасен для подопытных кроликов и мышей,
чем обычный бульон.
Вещество было названо «пенициллин».
Правда, впереди было самое важное
испытание: не окажется ли это вещество
таким же вредным для человека и животных,
как для бактерий? Если бы это было так,
пенициллин ничем бы не отличался от
множества известных и до того антисептиков.
Его нельзя было бы вводить в кровь. К
величайшей радости Флеминга и его
сотрудников, пенициллиновый бульон,
смертоносный для бактерий, был не более
опасен для подопытных кроликов и мышей,
чем обычный бульон.
Но чтобы применять пенициллин для лечения, его нужно было получить в чистом виде, выделить его из бульона. Бульон, содержащий чужеродные для организма белки, нельзя было вводить в кровь человека.
В феврале 1929 г. Флеминг
сделал сообщение о своём открытии в
медицинском обществе. Ему не было задано
ни одного вопроса! Учёные встретили
открытие абсолютно равнодушно, без
малейшего интереса. Ещё в 1952 г. Флеминг
вспоминал об этой «ужасной минуте».
Так прошло одиннадцать лет! Те немногие химики, которые заинтересовались пенициллином, так и не смогли выделить его в чистом виде. Флеминг, впрочем, не терял надежды и верил, что у открытого им вещества большое будущее.
В 1940 г. неожиданно произошло одно из самых счастливых событий в жизни Флеминга. Из медицинского журнала он узнал, что оксфордским учёным Флори и Чейну удалось получить стабильный препарат пенициллин в очищенном виде. Флеминг ничем не выдал своей радости и только позже заметил, что о работе с такими химиками он и мечтал уже 11 лет.
История открытия
пенициллина поистине удивительна. Кто
бы мог подумать, что талантливый
еврейский мальчик-музыкант, отец
которого был выходцем из России, а мать
немкой, в конечном итоге бросит стезю
профессионального пианиста и найдет
совершенно иной путь к всемирной славе.
Речь идет об Эрнесте Каине, которого
мы знаем под его англицированным именем
Чейн. Трудно сказать, правы ли те, кто
видит судьбу человека в его имени, но
в данном случае имя Эрнест, которое
переводится как «искренний, правдивый»,
полностью соответствовало характеру
и моральным достоинствам его носителя.
Трудно сказать, правы ли те, кто
видит судьбу человека в его имени, но
в данном случае имя Эрнест, которое
переводится как «искренний, правдивый»,
полностью соответствовало характеру
и моральным достоинствам его носителя.
Отец Эрнеста был талантливым химиком, организовавшим в Берлине собственное производство. И хотя сын окончил гимназию и университет, родители видели его за роялем. Он стал талантливым концертирующим пианистом, а также музыкальным критиком берлинской газеты, однако любовь к науке пересилила. В промежутках между концертами и репетициями молодой человек пропадал в лаборатории химической патологии известнейшей берлинской клиники «Шарите» – «Милосердие».
В апреле 1933 г. Э. Чейн
был вынужден покинуть Германию, чтобы
больше никогда не возвращаться на
родину. Его друг, знаменитый английский
биолог Дж. Холдейн, устроил его в
Кембридж, где в ходе своей работы над
диссертацией Э. Чейн доказал, что
нейротоксин змеиного яда является
пищеварительным ферментом. Работа
сделала ему имя, поэтому в 1935 г. он
был приглашен профессором патологии
Г. Флори в Оксфорд, чтобы развернуть
работу по лизоциму – антибактериальному
ферменту. Э. Чейн предлагает Г. Флори
сконцентрироваться на более обещающем
пенициллине, открытом А. Флемингом.
Энтузиазм Э. Чейна заразил Г. Флори,
который не мог дождаться проверки
действия антибиотика на микробах.
Именно Флори достал первые 35 фунтов
правительственных фондов для
финансирования работы, поддержанной
Э. Мелланби из Совета медицинских
исследований.
Работа
сделала ему имя, поэтому в 1935 г. он
был приглашен профессором патологии
Г. Флори в Оксфорд, чтобы развернуть
работу по лизоциму – антибактериальному
ферменту. Э. Чейн предлагает Г. Флори
сконцентрироваться на более обещающем
пенициллине, открытом А. Флемингом.
Энтузиазм Э. Чейна заразил Г. Флори,
который не мог дождаться проверки
действия антибиотика на микробах.
Именно Флори достал первые 35 фунтов
правительственных фондов для
финансирования работы, поддержанной
Э. Мелланби из Совета медицинских
исследований.
25 мая 1940 г. под грохот
бомб, падающих на улицы Лондона, был
завершен
решающий опыт на 50 белых мышах. Каждой
из них ввели смертельную дозу микроба
стрептококка. Половина мышей не получала
никакого лечения, остальным каждые три
часа в течение двух суток вводили
пенициллин. Через 16 ч 25 подопытных
животных погибли, а 24 мыши, получавшие
лечение, выжили. Погибла только одна.
Затем наступил
биохимический триумф Э. Чейна,
показавшего, что пенициллин имеет
структуру беталактама. Оставалось
только наладить производство нового
чудо – лекарства.
Оставалось
только наладить производство нового
чудо – лекарства.
Его чудодейственные
свойства были доказаны в том же Оксфорде,
в одну из клиник которого 15 октября
того же года поступил местный полицейский,
жаловавшийся на непроходящую «заеду»
в углу рта (ранка была инфицирована
золотистым стафилококком и нагноилась).
К середине января инфекция захватила
лицо мужчины, шею и перекинулась на
руку и легкое. И тогда врачи отважились
вколоть бедняге неслыханный до сего
момента пенициллин. В течение месяца
больной чувствовал себя неплохо: но
драгоценные кристаллы, полученные из
Оксфорда, кончились, и 15 марта 1941 г.
полицейский скончался. Но не смотря на
неудачный опят Г. Флори стал собираться
в Америку в поисках коммерческой помощи
в налаживании массового производства
продукта. Известная фармацевтическая
компания «Мерк» из города Рауэй штат
Нью-Джерси, спонсировала работы
С. Ваксмана из университета Руттерса,
который, начиная с 1939 г, вел работы
по изучению «антибиозиса» стрептомицетов. Его первая работа была опубликована
24 августа 1940 г. в авторитетнейшем
«Ланцете», выходящем в Лондоне. Поэтому
приезд Г. Флори с готовыми наработками
был подобен манне небесной. «Американцы
украли пенициллин у британцев!» Это
верно лишь отчасти, поскольку Англия
вследствие военного истощения ресурсов,
не смогла бы быстро наладить промышленное
производство антибиотиков, с помощью
которых лечили и британских солдат.
Недаром же на вручении Нобелевской
премии по медицине за 1945 г. говорили,
что «Флеминг сделал для победы над
фашизмом больше, чем 25 дивизий».
Его первая работа была опубликована
24 августа 1940 г. в авторитетнейшем
«Ланцете», выходящем в Лондоне. Поэтому
приезд Г. Флори с готовыми наработками
был подобен манне небесной. «Американцы
украли пенициллин у британцев!» Это
верно лишь отчасти, поскольку Англия
вследствие военного истощения ресурсов,
не смогла бы быстро наладить промышленное
производство антибиотиков, с помощью
которых лечили и британских солдат.
Недаром же на вручении Нобелевской
премии по медицине за 1945 г. говорили,
что «Флеминг сделал для победы над
фашизмом больше, чем 25 дивизий».
Первое применение
пенициллина в США произошло в феврале
1942 г. Внезапно заболела Анна Миллер,
молодая 33-летняя жена администратора
Йельского университета, мать троих
детей. Будучи медсестрой по образованию,
она сама лечила четырехлетнего сына
от стрептококковой ангины. Мальчик
выздоровел, но вот у его мамы внезапно
случился выкидыш, осложнившийся
лихорадкой с высокой температурой. Женщина была доставлена в главный
госпиталь Нью-Хейвена в том же штате
Нью-Джерси с диагнозом стрептококковый
сепсис: в миллилитре ее крови бактериологи
насчитали 25 колоний микроба! Но что
могли сделать в те дни врачи против
грозного сепсиса? Если бы не чудо в лице
Дж. Фултона, друга Флори, лежавшего
в другой палате, который подхватил
какую-то легочную инфекцию, обследуя
солдат в Калифорнии. 12 марта лечащий
врач рассказал Дж.Фултону о приближающейся
кончине Анны, у которой температура
41° держалась уже в течение 11 дней! «А
нельзя ли получить лекарство у Флори»,
– высказал он робкую надежду. Дж. Фултон
считал, что он вправе обратиться к
другу. В конце концов именно он помогал
ему в 1939 г. получить грант фонда
Рокфеллера на 5 тысяч долларов. (Деньги
отпускались на исследование бактерицидного
действия пенициллина).
Женщина была доставлена в главный
госпиталь Нью-Хейвена в том же штате
Нью-Джерси с диагнозом стрептококковый
сепсис: в миллилитре ее крови бактериологи
насчитали 25 колоний микроба! Но что
могли сделать в те дни врачи против
грозного сепсиса? Если бы не чудо в лице
Дж. Фултона, друга Флори, лежавшего
в другой палате, который подхватил
какую-то легочную инфекцию, обследуя
солдат в Калифорнии. 12 марта лечащий
врач рассказал Дж.Фултону о приближающейся
кончине Анны, у которой температура
41° держалась уже в течение 11 дней! «А
нельзя ли получить лекарство у Флори»,
– высказал он робкую надежду. Дж. Фултон
считал, что он вправе обратиться к
другу. В конце концов именно он помогал
ему в 1939 г. получить грант фонда
Рокфеллера на 5 тысяч долларов. (Деньги
отпускались на исследование бактерицидного
действия пенициллина).
Дж. Фултон позвонил
в «Мерк», разрешение было получено, и
первые дозы пенициллина были посланы
в госпиталь Нью-Хейвена. Бесценный груз
сопровождала полиция. В 3 часа пополудни
Анне сделали первый укол. К 9 часам
следующего утра ее температура стала
нормальной! В ноябре 1942 г. «Мерк»
провела уже массовые испытания
пенициллина на людях, когда получателями
антибиотика стали полтысячи людей,
пострадавших на пожаре в ночном клубе
Бостона.
В 3 часа пополудни
Анне сделали первый укол. К 9 часам
следующего утра ее температура стала
нормальной! В ноябре 1942 г. «Мерк»
провела уже массовые испытания
пенициллина на людях, когда получателями
антибиотика стали полтысячи людей,
пострадавших на пожаре в ночном клубе
Бостона.
A в мае 1942 г. Анна Миллер, потерявшая в весе 16 кг, но счастливая и здоровая, выписалась из больницы. В августе свою «крестницу» посетил А. Флеминг. В 1990 г. ее, 82-летнюю, чествовали в Смитсонианском музее естественных наук в Вашингтоне.
В 1942 г. Флемингу также пришлось ещё раз проверить действие пенициллина на своём близком друге, заболевшем воспалением мозга. В течение месяца Флемингу удалось полностью вылечить безнадёжного больного.
В 1941—1942 гг. в Америке и Англии налаживалось промышленное производство пенициллина.
Крошечная спора,
случайно занесённая ветром в лабораторию
Флеминга, теперь творила настоящие
чудеса. Она спасала жизнь сотням и
тысячам больных и раненных на фронтах
людей. Она положила начало целой отрасли
фармацевтической промышленности —
производству антибиотиков. Позднее
как-то раз, говоря об этой споре, Флеминг
привёл поговорку: «Могучие дубы вырастают
из малых желудей». Война придала открытию
Флеминга особое значение.
Она спасала жизнь сотням и
тысячам больных и раненных на фронтах
людей. Она положила начало целой отрасли
фармацевтической промышленности —
производству антибиотиков. Позднее
как-то раз, говоря об этой споре, Флеминг
привёл поговорку: «Могучие дубы вырастают
из малых желудей». Война придала открытию
Флеминга особое значение.
Имя учёного было окружено славой, которая всё возрастала. Его, как и его лекарство, знал теперь весь мир. Действие нового лекарства превзошло самые смелые ожидания. Многим тяжелым больным он приносил полное исцеление. С этого момента началось триумфальное шествие пенициллина по всем странам мира. Его называли «чудесная плесень», «желтая магия» и т. п. Он излечивал заражение крови, воспаление легких, всевозможные нагноения и другие тяжелые недуги. Раньше от заражения крови (сепсиса) погибало 50—80 человек из каждых 100 заболевших людей. Это была одна из самых опасных болезней, перед которой медицина чаще всего оказывалась бессильной. Сейчас пенициллин спасает почти всех больных сепсисом. Смерть от заражения крови теперь уже чрезвычайное происшествие. От воспаления легких погибало много людей, особенно детей и стариков, теперь от этой болезни умирают редко. Нужно только вовремя применить пенициллин.
Английский король возвёл учёного в дворянское достоинство. А в 1945 году А. Флеминг, Х. Флори и Э. Чейн были удостоены Нобелевской премии по медицине за открытие пенициллина.
Александр Флеминг скоропостижно скончался 11 марта 1955 г. Его смерть заставила скорбеть едва ли не весь мир. В испанском городе Барселоне, который посещал Флеминг, цветочницы высыпали все цветы из корзин к мемориальной доске с его именем. В Греции, где тоже бывал учёный, объявили траур. Флеминг был погребён в лондонском соборе Св. Павла.
Хотя существуют сведения что в 1985 г. в архивах Лионского университета была найдена диссертация рано скончавшегося студента-медика (Эрнест Августин Дюшене), за сорок лет до Флеминга подробно характеризующая открытый им препарат из плесени Р. notatum, активный против многих патогенных бактерий.
В 1937 г. – М. Вельш описал первый антибиотик стрептомицетного происхождения – актиномицетин. В 1939 г. – Н.А. Красильников и А.И. Кореняко получили мицетин;
Среди первых исследователей, занявшихся целенаправленным поиском антибиотиков, был Р.Дюбо. Проведенные им и его сотрудниками эксперименты привели к открытию антибиотиков, вырабатываемых некоторыми почвенными бактериями, их выделению в чистом виде и использованию в клинической практике. В 1939 Дюбо получил тиротрицин – комплекс антибиотиков, состоящий из грамицидина и тироцидина; это явилось стимулом для других ученых, которые обнаружили еще более важные для клиники антибиотики.
Таким образом, к моменту получения пенициллина в очищенном виде было известно пять антибиотических средств (микофеноловая кислота, пиоцианаза, актиномицетин, мицетин и тиротрицин).
Так начиналась эра антибиотиков. В нашей стране большой вклад в учение об антибиотиках внесли З. В Ермольева и Г.Ф. Гаузе. Зинаида Виссарионовна Ермольева (1898 – 1974) – автор первого советского пенициллина (крустозин), полученного из P. Crustosum
Сам термин «антибиотики» (от греч. Anti, bios – против жизни) был предложен С. Ваксманом в 1942 году для обозначения природных веществ, продуцируемых микроорганизмами и в низких концентрациях антагонистичных к росту других бактерий. З.Ваксман со своими студентами в Университете Ратджерса, США, занимался актиномицетами (такими, как Streptomyces) и в 1944 открыл стрептомицин, эффективное средство лечения туберкулеза и других заболеваний. Сильнее всего действует стрептомицин при туберкулезном поражении оболочек мозга — менингите, при туберкулезе гортани, кожи. Раннее почти все заболевшие туберкулезным менингитом погибали, а теперь с помощью стрептомицина большинство больных выздоравливают. На туберкулез легких стрептомицин действует слабее. И все-таки он до сих пор остается одним из лучших средств лечения этой болезни. Стрептомицин помогает также при коклюше, воспалении легких, заражении крови.
В последующем число антибиотиков быстро росло. После 1940 было получено множество клинически важных антибиотиков, в их числе бацитрацин, хлорамфеникол (левомицетин), хлортетрациклин, окситетрациклин, амфотерицин В, циклосерин, эритромицин, гризеофульвин, канамицин, неомицин, нистатин, полимиксин, ванкомицин, виомицин, цефалоспорины, ампициллин, карбенициллин, аминогликозиды, стрептомицин, гентамицин.
История открытия антибиотиков
Народной медицине давно были известны некоторые способы применения в качестве лечебных средств микроорганизмов или продуктов их обмена, однако причина их лечебного действия в то время оставалась неизвестной. Например, для лечения некоторых язв, кишечных расстройств и других заболеваний в народной медицине применялся заплесневевший хлеб.
В 1871 —1872 гг. появились работы русских исследователей В. А. Манассеина и А. Г. Полотебнова, в которых сообщалось о практическом использовании зеленой плесени для заживления кожных язв у человека. Первые сведения об антагонизме бактерий были обнародованы основоположником микробиологии Луи Пастером в 1877 г. Он обратил внимание на подавление развития возбудителя сибирской язвы некоторыми сапрофитными бактериями и высказал мысль о возможности практического использования этого явления.
С именем русского ученого И. И. Мечникова (1894) связано научно обоснованное практическое использование антагонизма между энтеробактериями, вызывающими кишечные расстройства, и молочнокислыми микроорганизмами, в частности болгарской палочкой («мечниковская простокваша»), для лечения кишечных заболеваний человека.
В 1896 году Р. Гозио из культурной жидкости Penicillium brevicompactum выделил кристаллическое соединение – микофеноловую кислоту, подавляющее рост бактерий сибирской язвы.
Эммирих и Лоу в 1899 году сообщили об антибиотическом веществе, образуемом Pseudomonas pyocyanea, они назвали его пиоцианазой; препарат использовался в качестве лечебного фактора как местный антисептик.
Русский врач Э. Гартье (1905) применил кисломолочные продукты, приготовленные на заквасках, содержащих ацидофильную палочку, для лечения кишечных расстройств.
Пауль Эрлих (1854-1915) в результате многочисленных опытов синтезировал в 1912 году мышьяковистый препарат – сальварсан, убивающий in vitro возбудителя сифилиса. В 30-х годах прошлого столетия в результате химического синтеза были получены новые органические соединения – сульфамиды, среди которых красный стрептоцид (пронтозил) был первым эффективным препаратом, оказавшим терапевтическое действие при тяжёлых стрептококковых инфекциях.
В 1910-1913 годах O. Black и U. Alsberg выделили из гриба рода Penicillium пеницилловую кислоту, обладающую антимикробными свойствами.
Внимание!
Если вам нужна помощь в написании работы, то рекомендуем обратиться к профессионалам. Более 70 000 авторов готовы помочь вам прямо сейчас. Бесплатные корректировки и доработки. Узнайте стоимость своей работы.
В 1929 году А. Флемингом был открыт новый препарат пенициллин, который только в 1940 году удалось выделить в кристаллическом виде.
В 1937 году в нашей стране был синтезирован сульфидин – соединение, близкое к пронтозилу. Открытие сульфамидных препаратов и применение их в медицинской практике составило известную эпоху в химиотерапии многих инфекционных заболеваний, в том числе сепсиса, менингита, пневмонии, рожистого воспаления, гонореи и некоторых других.
В 1939 г. Н. А. Красильников и А. И. Кореняко из культуры фиолетового актиномицета Actinomyces violaceus, выделенного ими из почвы, получили первый антибиотик актиномицетного происхождения — мицетин — и изучили условия биосинтеза и применения мицетина в клинике.
А. Флеминг, изучая стрептококков, выращивал их на питательной среде в чашках Петри. На одной из чашек вместе со стафилококками выросла колония плесневого гриба, вокруг которой стафилококки не развивались. Заинтересовавшись этим явлением, Флеминг выделил культуру гриба, определенную затем как Penicilliurn notatum. Выделить вещество, подавляющее рост стафилококков, удалось только в 1940 г. оксфордской группе исследователей. Полученный антибиотик был назван пенициллином.
С открытия пенициллина началась новая эра в лечении инфекционных болезней — эра применения антибиотиков. В короткий срок возникла и развилась новая отрасль промышленности, производящая антибиотики в крупных масштабах. Теперь вопросы микробного антагонизма приобрели важное практическое значение и работы по выявлению новых микроорганизмов — продуцентов антибиотиков стали носить целенаправленный характер.
В СССР получением пенициллина успешно занималась группа исследователей под руководством 3. В. Ермольевой. В 1942г. был выработан отечественный препарат пенициллина. Ваксманом и Вудрафом из культуры Actinomyces antibioticus был выделен антибиотик актиномицин, который впоследствии стал использоваться как противораковое средство. Первым антибиотиком актиномицетного происхождения, нашедшим широкое применение особенно при лечении туберкулеза, был стрептомицин, открытый в 1944 г. Ваксманом с сотрудниками. К противотуберкулезным антибиотикам относятся также открытые позже виомицин (флоримицин), циклосерин, канамицин, рифамицин.
В последующие годы интенсивные поиски новых соединений привели к открытию ряда других терапевтически ценных антибиотиков, нашедших широкое применение в медицине. К ним относятся препараты с широким спектром антимикробного действия. Они подавляют рост не только грамположительных бактерий, которые более чувствительны к действию антибиотиков (возбудители пневмонии, различных нагноений, сибирской язвы, столбняка, дифтерии, туберкулеза), но и грамотрицательных микроорганизмов, которые более устойчивы к действию антибиотиков (возбудители брюшного тифа, дизентерии, холеры, бруцеллеза, туляремии), а также риккетсий (возбудители сыпного тифа) и крупных вирусов (возбудители пситтакоза, лимфогрануломатоза, трахомы и др.). К таким антибиотикам относятся хлорамфеникол (левомицетин), хлортетрациклин (биомицин), окситетрациклин (террамицин), тетрациклин, неомицин (колимицин, мицерин), канамицин, паромомицин (мономицин) и др. Кроме того, в распоряжении врачей в настоящее время имеется группа антибиотиков резерва, активных в отношении устойчивых к пенициллину грамположительных болезнетворных микроорганизмов, а также противогрибные антибиотики (нистатин, гризеофульвин, амфотерицин В, леворин).
Термин «антибиотики», или «антибиотические вещества», предложенный в 1942 г. Ваксманом, первоначально обозначал химические соединения, образуемые микроорганизмами, которые обладают способностью подавлять рост и даже разрушать бактерии и другие микроорганизмы. Это определение, как оказалось впоследствии, не совсем точно, так как в число антибиотиков нужно было бы включить вещества микробного происхождения, которые оказывают не специфическое, а общее антисептическое или консервирующее действие на живые клетки. К таким веществам относятся, в частности, спирты, органические кислоты, перекиси, смолы и др. К тому же антибактериальное действие эти соединения оказывают только в относительно высоких концентрациях. К антибиотикам следует относить только такие вещества, которые в незначительных количествах проявляют специфическое (избирательное) действие на отдельные звенья обмена веществ микробной клетки. Позже в тканях высших растений и животных были найдены соединения, способные в малых количествах специфически подавлять рост микробов. Более того, было показано, что некоторые сходные антибиотики (например, цитринин) могут синтезироваться как микробами, так и высшими растениями. Таким образом, круг организмов-продуцентов антибиотических веществ расширился, что также должно было найти отражение в термине «антибиотики». Установление структуры молекул многих антибиотиков позволило осуществить химический синтез ряда этих соединений без участия организмов-продуцентов.
Дальнейший этап развития химии антибиотиков — изменение (трансформация) молекул этих соединений для получения производных, обладающих рядом преимуществ по сравнению с исходными препаратами. Такое направление исследований объясняется в основном двумя причинами: необходимостью снижения токсичности антибиотиков при сохранении их антибактериального действия; борьбой с инфекционными заболеваниями, вызываемыми устойчивыми к широко применявшимся антибиотикам формами патогенных микроорганизмов. Преимущества производных антибиотиков по сравнению с исходными проявляются также и в изменении растворимости, удлинении срока циркуляции в организме больного и т. д.
Получить производные антибиотиков можно с помощью как химического, так и биологического синтеза. Известен и комбинированный способ получения препаратов. В этом случае ядро молекулы антибиотика формируется при биосинтезе с помощью соответствующих микроорганизмов-продуцентов, а «достройка» молекулы осуществляется методом химического синтеза. Полученные этим способом антибиотики называются полусинтетическими. Так были получены и нашли широкое применение в клинике весьма эффективные полусинтетические пенициллины (метициллин, оксациллин, ампициллин, карбенициллин) и цефалоспорины (цефалотин, цефалоридин) с новыми по сравнению с природными антибиотиками ценными терапевтическими свойствами.
Все эти данные, накопленные в процессе становления и развития науки об антибиотиках, потребовали уточнения термина «антибиотики». В настоящее время антибиотиками следует называть химические соединения, образуемые различными микроорганизмами в процессе их жизнедеятельности, а также производные этих соединений, обладающие способностью в незначительных концентрациях избирательно подавлять рост микроорганизмов или вызывать их гибель. Вполне вероятно, что и эта формулировка с дальнейшим прогрессом антибиотической науки будет уточняться.
В первые годы после открытия антибиотиков их получали с использованием метода поверхностной ферментации. Этот метод заключался в том, что продуцент выращивали на поверхности питательной среды в плоских бутылях (матрацах). Чтобы получить сколько-нибудь заметные количества антибиотика, требовались тысячи матрацев, каждый из которых после слива культуралыюй жидкости необходимо было мыть, стерилизовать, заполнять свежей средой, засевать продуцентом и инкубировать в термостатах. Малопроизводительный способ поверхностной ферментации (поверхностного биосинтеза) не мог удовлетворить потребностей в антибиотиках. В связи с этим был разработан новый высокопроизводительный метод глубинного культивирования (глубинной ферментации) микроорганизмов — продуцентов антибиотиков. Это позволило в короткий срок создать и развить новую отрасль промышленности, выпускающую антибиотики в больших количествах.
Метод глубинного культивирования отличается от предыдущего тем, что микроорганизмы-продуценты выращивают не на поверхности питательной среды, а во всей ее толще. Выращивание продуцентов ведут в специальных чанах (ферментаторах), емкость которых может превышать 50 м3. Ферментаторы снабжены приспособлениями для продувания воздуха через питательную среду и мешалками. Развитие микроорганизмов-продуцентов в ферментаторах происходит при непрерывном перемешивании питательной среды и подаче кислорода (воздуха). При глубинном выращивании во много раз по сравнению с выращиванием продуцента на поверхности среды увеличивается накопление биомассы (из расчета на единицу объема питательной среды), а значит, и возрастает содержание антибиотика в каждом миллилитре культуральной жидкости, т. е. повышается ее антибиотическая активность.
Производственная схема биосинтеза любых антибиотиков включает следующие основные стадии: ферментацию, выделение антибиотика и его химическую очистку, сушку антибиотика и приготовление лекарственной формы. Для осуществления ферментации — биохимического процесса переработки сырья — необходимо иметь питательную среду (сырье) и микроорганизмы, перерабатывающие это сырье. Питательные среды подбирают с таким расчетом, чтобы они обеспечивали хороший рост и развитие продуцента и способствовали максимально возможному биосинтезу антибиотика.
Поднятию производительности антибиотической промышленности, помимо внедрения в практику глубинной ферментации, в огромной степени способствовало использование для биосинтеза новых высокопроизводительных штаммов-продуцентов. Для их получения были разработаны специальные методы селекции. Вследствие большой вариабельности микроорганизмов-продуцентов и быстрой утраты ими исходных свойств (особенно уровня антибиотической активности) необходимо было разработать методы хранения микроорганизмов-продуцентов и поддержания активности, а также способы приготовления посевного материала для засева огромных объемов питательной среды в ферментерах.
В 70-х годах ежегодно описывалось более 300 новых антибиотиков
В настоящее время число известных антибиотиков приближается к 3000, однако в клинической практике используется всего около 50.
Поможем написать любую работу на аналогичную тему
Получить выполненную работу или консультацию специалиста по вашему учебному проекту
Узнать стоимостьИстория открытия пенициллина. Досье – Биографии и справки
ТАСС-ДОСЬЕ /Юлия Ковалева/. 75 лет назад, 12 февраля 1941 г., в Лондоне британские ученые Говард Флори и Эрнст Чейн впервые применили пенициллин для лечения человека. Редакция ТАСС-ДОСЬЕ подготовила материал об истории открытия этого препарата.
Пенициллин – антибиотик, обладающий широким антимикробным действием. Является первым эффективным лекарством против многих тяжелых заболеваний, в частности, сифилиса и гангрены, а также инфекций, вызываемых стафилококками и стрептококками. Его получают из некоторых видов плесневого грибка рода Penicillium (лат. penicillus – “кисть”; под микроскопом спороносные клетки плесени похожи на кисточку).
История открытия
Упоминания об использовании плесени в лечебных целях встречаются в трудах персидского ученого Авиценны (II в.) и швейцарского врача и философа Парацельса (XIV в.). Боливийский специалист по этноботанике Энрике Облитас Поблете в 1963 г. описал применение плесени индейскими знахарями в эпоху инков (XV-XVI вв.).
В 1896 г. итальянский врач Бартоломео Гозио, изучая причины поражения риса плесенью, вывел формулу антибиотика, схожего с пенициллином. Ввиду того, что он не смог предложить практическое применение нового лекарства, его открытие было забыто. В 1897 г. французский военный врач Эрнест Дюшен заметил, что арабские конюхи собирают плесень с сырых седел и лечат ею раны лошадей. Дюшен тщательно обследовал плесень, опробовал ее на морских свинках и выявил ее разрушающее действие на палочку брюшного тифа. Результаты своих исследований Эрнест Дюшен представил в парижском институте Пастера, но они также не были признаны. В 1913 г. американским ученым Карлу Альсбергу и Отису Фишеру Блэку удалось получить из плесени кислоту, обладающую противомикробными свойствами, однако их исследования были прерваны с началом Первой мировой войны.
В 1928 г. британский ученый Александр Флеминг проводил рядовой эксперимент в ходе исследования сопротивляемости человеческого организма бактериальным инфекциям. Он обнаружил, что некоторые колонии стафилококковых культур, оставленные им в лабораторных чашках, заражены штаммом плесени Penicillium Notatum. Вокруг пятен плесени Флеминг заметил область, в которой бактерий не было. Это позволило ему сделать вывод о том, что плесень вырабатывает убивающее бактерии вещество, которое ученый назвал “пенициллином”.
Флеминг недооценил свое открытие, полагая, что получить лекарство будет очень трудно. Его работу продолжили ученые из Оксфорда Говард Флори и Эрнст Чейн. В 1940 г. они выделили препарат в чистом виде и изучили его терапевтические свойства. 12 февраля 1941 г. инъекция пенициллина впервые была сделана человеку. Пациентом Флори и Чейна стал лондонский полицейский, умиравший от заражения крови. После нескольких инъекций ему стало лучше, однако запас лекарства быстро закончился, и больной скончался. В 1943 г. Говард Флори передал технологию получения нового препарата американским ученым, в США было налажено массовое производство антибиотика. В 1945 г. Александр Флеминг, Говард Флори и Эрнст Чейн были удостоены Нобелевской премии по физиологии и медицине.
Исследования российских и советских ученых
В 1870-х гг. исследованием плесени занимались медики Алексей Полотебнов и Вячеслав Манассеин, которые обнаружили, что она блокирует рост других микроорганизмов. Полотебнов рекомендовал использовать эти особенности плесени в медицине, в частности, для лечения кожных заболеваний. Но идея не получила распространения.
В СССР первые образцы пенициллина получили микробиологи Зинаида Ермольева и Тамара Балезина. В 1942 г. они обнаружили штамм Penicillium Crustosum, продуцирующий пенициллин. В ходе испытаний лекарство показало гораздо большую активность, чем его английские и американские аналоги. Однако полученный антибиотик терял свойства при хранении и вызывал повышение температуры у пациентов.
В 1945 г. в Советском Союзе начались испытания пенициллина, разработанного по западному образцу. Технология его производства была освоена НИИ эпидемиологии и гигиены Красной Армии под руководством Николая Копылова.
Признание
Массовое производство пенициллина было налажено во время Второй мировой войны. По некоторым оценкам, благодаря этому антибиотику в годы войны и после нее были спасены около 200 млн человек. Открытие этого препарата не раз признавалось одним из важнейших научных достижений в истории человечества. Большинство современных антибиотиков были созданы именно после исследования лечебных свойств пенициллина.
Антимикробные средства. Классификация антимикробных препаратов
По спектру активности антимикробные препараты делятся на: антибактериальные, антигрибковые и антипротозойные. Кроме того, все антимикробные средства делят на препараты узкого и широкого спектра действия.
К препаратам узкого спектра действия преимущественно на грамположительные микроорганизмы относятся, например, природные пенициллины, макролиды, линкомицин, фузидин, оксациллин, ванкомицин, цефалоспорины I поколения. К препаратам узкого спектра действия преимущественно на грамотрицательные палочки относятся полимиксины и монобактамы. К препаратам широкого спектра действия относятся тетрациклины, левомицетин, аминогликозиды, большинство полусинтетических пенициллинов, цефалоспорины начиная со 2 поколения, карбопенемы, фторхинолоны. Узкий спектр имеют антигрибковые препараты нистатин и леворин (только против кандиды), а широкий – клотримазол, миконазол, амфотерицин В.
По типу взаимодействия с микробной клеткой антимикробные препараты делятся на:
· бактерицидные – необратимо нарушают функции микробной клетки либо ее целостность, вызывая немедленную гибель микроорганизма, применяются при тяжелых инфекциях и у ослабленных больных,
· бактериостатические – обратимо блокируют репликацию или деление клетки, применяются при нетяжелых инфекциях у неослабленных больных.
По кислотоустойчивости антимикробные препараты классифицируются на:
· кислотоустойчивые – могут применяться перорально, например, феноксиметилпенициллин,
· кислотонеустойчивые – предназначены только для парентерального применения, например, бензилпенициллин.
В настоящее время используются следующие основные группы антимикробных препаратов для системного применения.
¨ Лактамные антибиотики
Лактамные антибиотики (табл. 9.2) из всех антимикробных препаратов наименее токсичны, так как, нарушая синтез клеточной стенки бактерий, не имеют мишени в организме человека. Их применение при наличии чувствительности к ним возбудителей является предпочтительным. Наиболее широкий спектр действия среди лактамных антибиотиков имеют карбапенемы, они используются как препараты резерва – только при инфекциях, резистентных к пенициллинам и цефалоспоринам, а также при госпитальных и полимикробных инфекциях.
¨ Антибиотики других групп
Антибиотики других групп (табл. 9.3) имеют различные механизмы действия. Бактериостатические препараты нарушают этапы синтеза белка на рибосомах, бактерицидные – нарушают либо целостность цитоплазматической мембраны, либо процесс синтеза ДНК и РНК. В любом случае они имеют мишень в организме человека, поэтому по сравнению с лактамными препаратами более токсичны, и должны использоваться только при невозможности применения последних.
¨ Синтетические антибактериальные препараты
Синтетические антибактериальные препараты (табл. 9.4) также имеют различные механизмы действия: ингибирование ДНК-гиразы, нарушение включения ПАБК в ДГФК и т.д. Также рекомендуются к применению при невозможности использования лактамных антибиотиков.
¨ Побочные эффекты антимикробных препаратов,
их профилактика и лечение
Антимикробные препараты обладают целым рядом разнообразных побочных эффектов, некоторые из которых могут привести к тяжелым осложнениям и даже к летальному исходу.
Аллергические реакции
Аллергические реакции могут иметь место при применении любого антимикробного препарата. Могут развиться аллергический дерматит, бронхоспазм, ринит, артрит, отек Квинке, анафилактический шок, васкулит, нефрит, волчаночноподобный синдром. Чаще всего они наблюдаются при применении пенициллинов и сульфаниламидов. У некоторых пациентов развивается перекрестная аллергия на пенициллины и цефалоспорины. Зачастую отмечаются аллергии на ванкомицин и сульфаниламиды. Очень редко дают аллергические реакции аминогликозиды и левомицетин.
Профилактике способствует тщательный сбор аллергологического анамнеза. Если пациент не может указать, на какие именно антибактериальные препараты в у него наблюдались аллергические реакции, перед введением антибиотиков необходимо выполнение проб. Развитие аллергии независимо от тяжести реакции требует немедленной отмены вызвавшего ее препарата. В последующем введение даже сходных по химической структуре антибиотиков (например, цефалоспоринов при аллергии на пенициллин) допускается только в случаях крайней необходимости. Лечение инфекции должно быть продолжено препаратами других групп. При тяжелых аллергических реакциях требуется внутривенное введение преднизолона и симпатомиметиков, инфузионная терапия. В нетяжелых случаях назначаются антигистаминные препараты.
Раздражающее действие на путях введения
При пероральном применении раздражающее действие может выражаться в диспепсических явлениях, при внутривенном введении – в развитии флебитов. Тромбофлебиты чаще всего вызывают цефалоспорины и гликопептиды.
Суперинфекция, в том числе дисбактериоз
Вероятность дисбактериоза зависит от широты спектра действия препарата. Наиболее часто возникающий кандидомикоз развивается при применении препаратов узкого спектра через неделю, при применении препаратов широкого спектра – уже от одной таблетки. Однако цефалоспорины относительно редко дают грибковую суперинфекцию. На 1 месте по частоте и тяжести вызываемого дисбактериоза находится линкомицин. Нарушения флоры при его применении могут принять характер псевдомембранозного колита – тяжелого заболевания кишечника, вызываемого клостридиями, сопровождающегося диареей, дегидратацией, электролитными нарушениями, и в отдельных случаях осложняющегося перфорацией толстой кишки. Гликопептиды тоже могут вызвать псевдомембранозный колит. Часто вызывают дисбактериоз тетрациклины, фторхинолоны, левомицетин.
Дисбактериоз требует отмены применявшегося препарата и длительного лечения эубиотиками после предварительной антимикробной терапии, которая проводится по результатам чувствительности микроорганизма, вызвавшего воспалительный процесс в кишечнике. Применяемые для лечения дисбактериоза антибиотики не должны оказывать влияния на нормальную кишечную аутофлору – бифидо- и лактобактерии. Однако при лечении псевдомембранозного колита используется метронидазол или, как альтернатива, ванкомицин. Необходима также коррекция водно-электролитных нарушений.
Нарушение толерантности к алкоголю – свойственно всем лактамным антибиотикам, метронидазолу, левомицетину. Проявляется появлением при одновременном употреблении алкоголя тошноты, рвоты, головокружения, тремора, потливости и падения артериального давления. Пациенты должны быть предупреждены о недопустимости приема алкоголя на весь период лечения антимикробным препаратом.
Органоспецифичные побочные эффекты для различных групп препаратов:
· Поражение системы крови и кроветворения – присущи левомицетину, реже линкосомидам, цефалоспоринам 1 поколения, сульфаниламидам, производным нитрофурана, фторхинолонам, гликопептидам. Проявляется апластической анемией, лейкопенией, тромбицитопенией. Необходима отмена препарата, в тяжелых случаях заместительная терапия. Геморрагический синдром может развиться при применении цефалоспоринов 2-3 поколения, нарушающих всасывание витамина К в кишечнике, антисинегнойных пенициллинов, нарушающих функции тромбоцитов, метронидазола, вытесняющего кумариновые антикоагулянты из связей с альбумином. Для лечения и профилактики используются препараты витамина К.
· Поражение печени – присущи тетрациклинам, которые блокируют ферментную систему гепатоцитов, а также оксациллину, азтреонаму, линкозаминам и сульфаниламидам. Холестаз и холестатический гепатит могут вызвать макролиды, цефтриаксон. Клиническими проявлениями служит повышение печеночных ферментов и билирубина в сыворотке крови. При необходимости применения гепатотоксических антимикробных средств более недели необходим лабораторный контроль перечисленных показателей. В случае повышения АСТ, АЛТ, билирубина, щелочной фосфатазы или глутамилтранспептидазы лечение должно быть продолжено препаратами других групп.
· Поражение костей и зубов характерны для тетрациклинов, растущих хрящей – для фторхинолонов.
· Поражение почек присуще аминогликозидам и полимиксинам, которые нарушают функции канальцев, сульфаниламидам, вызывающим кристаллурию, цефалоспоринам поколения, вызывающим альбуминурию, и ванкомицину. Предрасполагающими факторами являются старческий возраст, заболевания почек, гиповолемия и гипотензия. Поэтому при лечении данными препаратами необходима предварительная коррекция гиповолемии, контроль диуреза, подбор доз с учетом функции почек и массы ткла, Курс лечения должен быть коротким.
· Миокардит – побочный эффект левомицетина.
· Диспепсия, не являющаяся следствием дисбактериоза, характерна при применении макролидов, которые обладают прокинетическими свойствами.
· Различные поражения ЦНС развиваются от многих антимикробных препаратов. Наблюдаются:
– психозы при лечении левомицетином,
– парезы и периферические параличи при применении аминогликозидов и полимиксинов за счет их курареподобного действия (поэтому их нельзя применять одновременно с миорелаксантами),
– головная боль и центральная рвота при использовании сульфаниламидов и нитрофуранов,
– судороги и галлюцинации при использовании аминопенициллинов и цефалоспоринов в высоких дозах, являющиеся результатом антагонизма этих препаратов с ГАМК,
– судороги при применении имипенема,
– возбуждение при использовании фторхинолонов,
– менингизм при лечении тетрациклинами из-за увеличения ими продукции ликвора,
– нарушения зрения при лечении азтреонамом и левомицетином,
– периферическая нейропатия при применении изониазида, метронидазола, левомицетина.
· Поражение слуха и вестибулярные расстройства – побочный эффект аминогликозидов, более свойственный 1 поколению. Так как данный эффект связан с накоплением препаратов, длительность их применения не должна превышать 7 дней. Дополнительными факторами риска являются старческий возраст, почечная недостаточность и одновременное применение петлевых диуретиков. Обратимые изменения слуха вызывает ванкомицин. При появлении жалоб на снижение слуха, головокружение, тошноту, неустойчивость при ходьбе необходима замена антибиотика на препараты других групп.
· Поражения кожи в виде дерматита характерны для левомицетина. Тетрациклины и фторхинолоны вызывают фотосенсибилизацию. При лечении этими препаратами не назначаются физиотерапевтические процедуры, и следует избегать нахождения на солнце.
· Гипофункцию щитовидной железы вызывают сульфаниламиды.
· Тератогенность присуща тетрациклинам, фторхинолонам, сульфаниламидам.
· Возможен паралич дыхательной мускулатуры при быстром внутривенном введении линкомицина и кардиодепрессия при быстром внутривенном введении тетрациклинов.
· Электролитные нарушения вызывают антисинегнойные пенициллины. Особо опасно развитие гипокалиемии при наличии заболеваний сердечно-сосудистой системы. При назначении данных препаратов необходим контроль ЭКГ и электролитов крови. При лечении используют инфузионно-корригирующую терапию и диуретики.
Микробиологическая диагностика
Эффективность микробиологической диагностики, абсолютно необходимой для рационального подбора антимикробной терапии, зависит от соблюдения правил забора, транспортировки и хранения исследуемого материала. Правила забора биологического материала включают:
– взятие материала из области, максимально приближенной к очагу инфекции,
– предотвращение контаминации другой микрофлорой.
Транспортировка материала должна с одной стороны обеспечить жизнеспособность бактерий, а с другой – предотвратить их размножение. Желательно, чтобы материал хранился до начала исследования при комнатной температуре и не более 2 часов. В настоящее время для забора и транспортировки материала используются специальные плотно закрывающиеся стерильные контейнеры и транспортные среды.
В не меньшей степени эффективность микробиологической диагностики зависит от грамотной интерпретации результатов. Считается, что выделение патогенных микроорганизмов даже в малых количествах всегда позволяет отнести их к истинным возбудителям заболевания. Условно патогенный микроорганизм считают возбудителем, если он выделяется из стерильных в норме сред организма или в большом количестве из сред, не характерных для его обитания. В противном случае он является представителем нормальной аутофлоры либо контаминирует исследуемый материал в процессе забора или исследования. Выделение малопатогенных бактерий из нехарактерных для их обитания областей в умеренных количествах свидетельствует о транслокации микроорганизмов, однако не позволяет отнести их к истинным возбудителям заболевания.
Гораздо сложнее бывает интерпретировать результаты микробиологического исследования при высевании нескольких видов микроорганизмов. В таких случаях ориентируются на количественное соотношение потенциальных возбудителей. Чаще значимыми в этиологии данного заболевания бывают 1-2 из них. Следует иметь в виду, что вероятность равной этиологической значимости более чем 3 различных видов микроорганизмов незначительна.
В основе лабораторных тестов на выработку грамотрицательными микроорганизмами БЛРС лежит чувствительность БЛРС к ингибиторам бета-лактамаз, таким как клавулановая кислота, сульбактам и тазобактам. При этом, если микроорганизм семейства энтеробактерий оказывается резистентен к цефалоспоринам 3 поколения, а при добавлении к этим препаратам ингибиторов бета-лактамаз демонстрирует чувствительность, то данный штамм идентифицируется как БЛРС-продуцирующий.
Антибиотикотерапия должна быть направлена только на истинный возбудитель инфекции! Однако в большинстве стационаров микробиологические лаборатории не могут установить этиологию инфекции и чувствительность возбудителей к антимикробным препаратам в день поступления больного, поэтому неизбежным является первичное эмпирическое назначение антибиотиков. При этом учитываются особенности этиологии инфекций различных локализаций, характерные для данного лечебного учреждения. В связи с чем необходимы регулярные микробиологические исследования структуры инфекционных заболеваний и чувствительности их возбудителей к антибактериальным препаратам в каждом стационаре. Анализ результатов такого микробиологического мониторинга необходимо проводить ежемесячно.
Таблица 9.2.
Лактамные антибиотики.
|
Группа препаратов |
Название |
Характеристика препарата |
|||||
|
Пенициллины |
Природные пенициллины |
натриевая и калиевая соли бензилпени-циллина |
вводятся только парентерально, действуют 3-4 часа |
высоко эф-фективны в своем спек-тре действия, но этот спектр узок, кроме того, препараты неустойчивы к лактамазам |
|||
|
бициллин 1,3,5 |
вводятся только пар-ентерально, действуют от 7 до 30 суток |
||||||
|
феноксиметилпенициллин |
препарат для перорального применения |
||||||
|
Антистафило-кокковые |
оксациллин, метициллин, клоксациллин, диклоксациллин |
имеют меньшую антимикробную ак-тивность, чем природные пеницил-лины, но устойчивы к лактамазам ста-филококков, могут применяться per os |
|||||
|
Амино-пенициллины |
ампициллин, амоксициллин, бакампициллин |
препараты широкого спектра действия, могут применяться per os, но неустойчивы к бета-лактамазам |
|||||
|
Комбиниро-ванные |
Ампиокс – ампициллин+ +оксациллин |
препарат широкого спектра действия, устойчивый к бета-лактамазам, может применяться per os |
|||||
|
Антисине-гнойные |
карбенициллин, тикарциллин, азлоциллин, пиперациллин, мезлоциллин |
имеют широкий спектр действия, дей-ствуют на штаммы синегнойной палоч-ки, не вырабатывающие бета-лактамаз, в процессе лечения возможно быстрое развитие устойчивости к ним бактерий |
|||||
|
Защищенные от лактамаз – препараты с кла-вулановой кисло-той, тазобакта-мом,сульбактамом |
амоксиклав, тазоцин, тиментин, циазин, уназин |
препараты являются комбинацией пенициллинов широкого спектра действия и ингибиторов бета-лактамаз, поэтому действуют на штаммы бактерий, вырабатывающие бета-лактамазы |
|||||
|
Цефалоспорины |
1 поколения |
цефазолин |
антистафи-лококковый препарат для парентераль-ного прим. |
не устойчи-вы к лакта-мазам, име-ют узкий спектр действия |
с каждым поколе-нием цефало-споринов расширя-ется их спектр и снижает-ся ток-сичность, цефало-спорины хорошо перено-сятся и занимают первое место по частоте примене-ния в стацио-нарах |
||
|
цефалексин и цефаклор |
применяются per os |
||||||
|
2 поколения |
цефаклор, цефураксим |
применяются per os |
устойчивы к лактама-зам, спектр включает и грамполо-жительные, и грамотри-цательные бактерии |
||||
|
цефамандол, цефокситин, цефуроксим, цефотетан, цефметазол |
применяются только паренте-рально |
||||||
|
3 поколения |
цефтизоксим, цефотаксим, цефтриаксон, цефтазидим, цефоперазон, цефменоксим |
только для парентераль-ного приме-нения, обла-дают антиси-негнойной активностью |
устойчивы к лактамазам грамотрица-тельных бактений, не эффектив-ны при стафило-кокковых инфекциях |
||||
|
цефиксим, цефтибутен, цефподоксим, цефетамет |
применяются per os, обла-дают анти-анаэробной активностью |
||||||
|
4 поколения |
цефипим, цефпирон |
самый широкий спектр действия, применяются парентерально |
|||||
|
Цефалоспорины с ингибиторами бета-лактамаз |
сульперазон |
Имеет спектр действия цефоперазона, но действует и на лактамазо-продуцирующие штаммы |
|||||
|
Карбапенемы |
имипенем и его комбина-ция с цилоста-тином, предо-храняющая от разрушения в почках, – тиенам |
Более активен к грамположительным микроорганизмам |
имеют самый широкий из лактамных антибиотиков спектр действия, включа-ющий анаэробы и сине-гнойную палочку, и устой-чивы ко всем лактамазам, к ним практически не выра-батывается резистентность, они могут применяться практически при любых возбудителях, исключая метициллинрезистентные штаммы стафилококка, и в виде монотерапии даже при тяжелых инфекциях, обладают эффектом последействия |
||||
|
меропенем |
Более активен к грамотрицательным микроорганизмам |
||||||
|
эртапенем |
|||||||
|
Моно-бактамы |
азтреонам |
препарат узкого спектра, действует только на грамотрицательные палочки, но очень эффективен и устойчив ко всем лактамазам |
|||||
Таблица 9.3.
Антибиотики других групп.
|
Группа препа-ратов |
Название |
Характеристика препарата |
|
|
Глико-пептиды |
ванкомицин, тейкопламин |
имеют узкий грамположительный спектр, но в нем очень эффективны, в частности действуют на метициллинрезистентные стафилококки и на L-формы микроорганизмов |
|
|
Полимиксины |
Это самые токсичные антибиотики, используются только для местного применения, в частности per os, так как они не всасываются в ЖКТ |
||
|
Фузидин |
низкотоксичный, но и низкоэффективный антибиотик |
||
|
Левомицетин |
высоко токсичен, в настоящее время используется в основном при менингококковых, глазных и особо опасных инфекциях |
||
|
Линкоз-амины |
линкомицин, клиндамицин |
менее токсичны, действуют на стафилококк и анаэробные кокки, хорошо проникают в кости |
|
|
Тетра-цик-лины |
природные – тетрациклин, полусинтети-ческие – метациклин, синтетические – доксициклин, миноциклин |
антибиотики широкого спектра действия, включающего анаэробы и внутриклеточных возбудителей, токсичны |
|
|
Амино-глико-зиды |
1 поколения: стрептомицинканамицин мономицин |
высоко токсичны, ис-пользуются только мест-но для деконтаминации ЖКТ, при туберкулезе |
токсичные антибиотики достаточно широкого спектра действия, плохо действуют на грамположительные и анаэробные микроорганизмы, однако усиливают действие на них лактамных антибиотиков, в каждом последующем поколении снижается их токсичность |
|
2 поколения: гентамицин |
широко используется при хирургических инфекциях |
||
|
3 поколения: амикацин, сизомицин, нетилмицин, тобрамицин |
действуют на некото-рые микроорганизмы, устойчивые к гента-мицину, в отношении синегнойной палочки наиболее эффективным является тобрамицин |
||
|
Макро-лиды |
природные: эритромицин, олеандомицин |
низко токсичные, но и низко эффективные анти-биотики узкого спектра действия, действуют толь-ко на грамположительных кокков и внутрикле-точных возбудителей, могут применяться per os |
|
|
полусинтети-ческие: рок-ситромицин, кларитроми-цин, флури-тромицин |
тоже действуют на внутриклеточных возбудителей, спектр несколько шире, в частности включает геликобактер и моракселлу, хорошо проходят все барьеры в организме, проникают в различные ткани, обладают эффектом последействия до 7 суток |
||
|
азолиды: азитромицин (сумамед) |
обладают теми же свойствами, что и полусинтетические макролиды |
||
|
Рифампицин |
используется в основном при туберкулезе |
||
|
Противогриб-ковые антиби-отики |
флуконазол, амфотерицинВ |
амфотерицин В высокотоксичен, используется при отсутствии чувствительности возбудителей к флуконазолу |
|
Таблица 9.4.
Синтетические антибактериальные препараты.
|
Группа препаратов |
Название |
Характеристика препарата |
||
|
Сульфаниламиды |
Резорбтив-ного действия |
норсульфазол, стрептоцид, этазол |
препараты короткого действия |
препараты широкого спектра действия, у возбудителей часто вырабаты-вается перекрестная устойчивость ко всем препаратам этого ряда |
|
сульфадиметоксин, сульфапиридазин, сульфален |
препараты продолжительного действия |
|||
|
Действую-щие в просвете кишечника |
фталазол, сульгин, салазопиридазин |
салазопиридазин – используется при болезни Крона, неспецифическом язвенном колите |
||
|
Местного примене-ния |
сульфацил-натрий |
используется в основном в офтальмологии |
||
|
Производные нитрофурана |
фурагин, фуразолидон, нитрофурантоин |
обладают широким спектром действия, включающим клостридии и простейших, в отличие от большинства антибиотиков не угнетают, а стимулируют иммунитет, применяются местно и per os |
||
|
Производные хиноксалина |
хиноксидин, диоксидин |
обладают широким спектром действия, включающим и анаэробы, диоксидин применяется местно или парентерально |
||
|
Производные хинолона |
невиграмон, оксолиниевая и пипемидиновая кислота |
действуют на группу кишечных грамотрицательных микроорганизмов, используются в основном при уроло-гических инфекциях, к ним быстро развивается резистентность |
||
|
Фтор-хинолоны |
офлоксацин, ципрофлоксацин, пефлоксацин, ломефлоксацин, спарфлоксацин, левофлоксацин, гатифлоксацин, моксифлоксацин, гемифлоксацин |
высокоэффективные препараты широ-кого спектра, действуют на синегнойную палочку и внутриклеточных воз-будителей, на многие штаммы, проду-цирующие лактамазы, хорошо перено-сятся, широко используются в хирургии, наибольшей антисинегнойной активностью обладает ципрофлоксацин, а наибольшей антианаэробной активностью – моксифлоксацин |
||
|
Производные 8-оксихинолина |
нитроксолин, энтеросептол |
действуют на многие микроорганизмы, грибы, простейших, применяются в урологии и при кишечных инфекциях |
||
|
Нитроимида-золы |
метронидазол, тинидазол |
действуют на анаэробные микроорганизмы, простейших |
||
|
Специфические противотуберкулезные, противосифилитические, противовирусные, противоопухолевые препараты |
применяются преимущественно в специализированных учреждениях |
|||
Источник: Н.А.Кузнецов и соавт. Основы клинической хирургии. Практическое руководство. Издание 2-е, переработанное и дополненное. – М.:ГЭОТАР-Медиа, 2009.
Статья добавлена 7 июня 2016 г.
Американские ученые создали новый тип антибиотика
Автор фото, BBC World Service
Ученые из США утверждают, что нашли новый способ создания антибиотиков, который сможет помочь в борьбе с растущим числом инфекций, устойчивых к препаратам этой категории.
Исследователи из Северо-Восточного университета США в Бостоне разработали метод выращивания бактерий в почве в лабораторных условиях.
Их исследование, опубликованное в журнале Nature, привело к открытию 25 новых антибиотиков, один из которых – теиксобактин – показал свою эффективность в лечении мышей от инфекций, устойчивых к лекарствам.
Если испытания на людях пройдут успешно, новый препарат может стать первым антибиотиком нового класса за почти 30 лет.
Пик открытий новых антибиотиков пришелся на 50-е и 60-е годы прошлого века, но с 1987 года не было создано ни одного нового препарата этого вида.
С тех пор появляется все больше инфекций, которые проявляют устойчивость к воздействию известных антибиотиков. Наиболее опасным из них является туберкулез, возбудители которого когда-то легко подавлялись антибиотиками типа пенициллина, а теперь не реагируют ни на какие известные препараты.
Группа американских исследователей создала специальное устройство для культивации бактерий, присутствующих в почве. Его сравнивают с “подземным отелем”. В каждый отсек этого устройства была помещена бактерия одного вида, а все устройство было закопано в землю.
Это позволило воспроизвести природные условия обитания таких бактерий и в то же время наблюдать за их ростом.
Такие бактерии, выращенные в контролируемых условиях, выделяют вещества, обладающие антимикробными свойствами.
Руководитель группы исследователей профессор Ким Льюис заявил, что одно из этих веществ – теиксобактин – является весьма многообещающим антибиотиком.
Уже проведенные исследования показали, что теиксобактин оказывает подавляющее действие на рост бактерий, но безвреден для тканей млекопитающих. Он ликвидирует опаснейшие стафилококковые инфекции у подопытных животных.
Ученые также считают, что бактерии не смогут развить устойчивость к теиксобактину и другим подобным препаратам.
Он действует в основном на жирные кислоты, участвующие в формировании клеточных оболочек бактерий, что делает его уникальным в семействе антибиотиков. Обычные бактерии не обладают встроенными механизмами по преодолению такого воздействия.
Анализ
Автор фото, BBC World Service
Джеймс Галлахер, Би-би-си
Открытие нового типа антибиотиков – теиксобактина – имеет свои ограничения.
Воздействие препарата ограничивается грамположительными бактериями, то есть микроорганизмами с однослойными клеточными мембранами. Бактериями такого типа являются, например, метициллин-резистентный стафилококк и микобактериальный туберкулез.
Однако новый антибиотик оказывается бессильным против грамотрицательных бактерий, так как не может проникнуть через внешнюю мембрану, которой они обладают. К грамотрицательным бактериям принадлежат бактерии типа кишечной палочки.
Исследователи, опубликовавшие результаты своего открытия, сравнивают его с обнаружением другого мощного антибиотика – ванкомицина. Он был открыт в 50-е годы прошлого века, но уже к 80-м годам появились микроорганизмы, устойчивые к его воздействию.
ЕРБ ВОЗ | Часто задаваемые вопросы
1. Что такое устойчивость к антибиотикам?
Устойчивость к антибиотикам – это естественный процесс, при котором у бактерий со временем развивается устойчивость к препаратам, применяемым для борьбы с ними. По мере развития устойчивости эффективность лекарств постепенно снижается и в итоге теряется полностью. Устойчивость к антибиотикам является последствием их использования, а нерациональное применение антибиотиков ускоряет ее возникновение.
2. Что представляет собой “ненадлежащее” использование антибиотиков?
Ненадлежащее (или нерациональное) использование антибиотиков – это применение их без необходимости, в течение слишком короткого промежутка времени, в слишком малых дозах, прием препаратов ненадлежащей эффективности или же против заболевания, которое данный препарат не лечит. Негативную роль играет как чрезмерное применение антимикробных препаратов, так и их применение в недостаточных дозах: чрезмерное применение, например излишнее назначение врачами антибиотиков, является распространенной проблемой в более богатых странах; недостаточное применение этих препаратов в связи с ненадлежащей их доступностью, несоблюдением правил их приема, плохим качеством препаратов наблюдается в основном в более бедных странах. В некоторых странах, например, однократные дозы антибиотиков могут быть приобретены без рецепта. На фоне экономических трудностей многие пациенты перестают принимать антибиотики, как только почувствуют себя лучше, что может произойти до того, как микробы были полностью уничтожены.
3. Связана ли устойчивость к антибиотикам только с их ненадлежащим использованием?
Ненадлежащее использование антибиотиков, несомненно, составляет часть общей проблемы, но устойчивость к антибиотикам гораздо шире. Так как устойчивость к антибиотикам – это естественный процесс, у всех микроорганизмом может в итоге развиться устойчивость к препаратам, которые использовались для борьбы с ними. Тем не менее, благодаря реализации национальных стратегий и рациональному использованию лекарств медицинскими работниками и пациентами, а также надлежащему использованию антибиотиков в ветеринарии и животноводстве в сочетании с проведением инфекционного контроля, можно значительно замедлить развитие и распространение устойчивости к антимикробным препаратам.
4. Во что обходится обществу устойчивость к антибиотикам?
Не существует глобальных данных по тому, во что обходится устойчивость к антибиотикам, и во многих странах не проводилось оценок затрат для их собственного населения. Однако некоторые достоверные фактические данные имеются для ряда стран Европы и для Соединенных Штатов Америки. В Европейском союзе 25 000 человек умирают ежегодно в результате инфекций, вызванных бактериями с множественной лекарственной устойчивостью, что, по оценкам, стоит системам здравоохранения 1,5 миллиарда евро ежегодно. По оценкам, ежегодно в Соединенных Штатах лекарственно-устойчивые инфекции приводят к расходам на медицинскую помощь, составляющим более чем 20 млрд долл. США, а также более чем к 8 миллионам дополнительных дней, проведенных в стационаре. Общий экономический ущерб обществу составляет более 35 млрд долл. США в год.
Устойчивость к антибиотикам является причиной как медицинского, так и финансового бремени. Когда предпочтительный антибиотик (препарат первого ряда) не действует, необходимо использовать другие более дорогие антибиотики (препараты второго ряда). По оценкам, противотуберкулезные препараты второго ряда в 50–100 раз дороже препаратов первого ряда, антибиотики второго ряда в 2–60 раз дороже антибиотиков первого ряда.
5. Почему ВОЗ прилагает такие серьезные усилия в борьбе против устойчивости к антибиотикам?
Устойчивость к антибиотикам не является новой проблемой и, по сути, – это естественный феномен. Однако эта проблема становится все более опасной по мере того, как у все большего числа бактерий со все большей и вызывающей тревогу скоростью развивается устойчивость к препаратам, которые использовались для борьбы с ними. Изобретение антибиотиков и других антимикробных препаратов изменило курс истории человечества, но сегодня их эффективность находится под угрозой. Если не принять срочных ответных защитных мер, мир вступит в “постантибиотиковую эру”, когда множество распространенных инфекций больше не будут поддаваться лечению и опять станут приводить к летальным исходам.
Поэтому ВОЗ призывает правительства, работников здравоохранения, гражданское общество и пациентов к срочным и согласованным действиям, направленным на замедление процесса возникновения и распространения устойчивости к лекарственным препаратам, чтобы ограничить ее воздействие сегодня и сохранить достижения в области медицины для будущих поколений.
6. Что предпринимает ВОЗ?
Возникновение устойчивости к антимикробным средствам вызывает растущую озабоченность, что было отражено в ряде резолюций, одобренных государствами-членами и давших начало ряду инициатив ВОЗ. В сентябре 2001 г. ВОЗ выпустила Глобальную стратегию по сдерживанию устойчивости к антибиотикам, которая включает большое число вмешательств для замедления процесса возникновения и снижения распространения устойчивости в самых различных условиях. С тех пор был достигнут дальнейший прогресс, которому способствовали проведение кампаний, консультаций экспертов, оценок риска, выпуск рекомендаций и усилия по созданию потенциала в рамках различных программ ВОЗ по борьбе с устойчивостью к антимикробным препаратам.
ВОЗ продолжает активно информировать правительства о необходимости контроля и мониторинга использования антибиотиков, проведения эпиднадзора за устойчивостью к антимикробным средствам, обеспечения четкого соблюдения положений стратегий по предупреждению и борьбе с инфекциями и введения в действие или обеспечения соблюдения законов, чтобы гарантировать сохранение эффективности антимикробных препаратов. Благодаря проведению Всемирного дня здоровья 2011 г., посвященного проблеме устойчивости к антимикробным средствам, ВОЗ привлекла широкое внимание к этой многогранной проблеме. В настоящий момент ВОЗ работает над объединением всех этих мероприятий в одну всеобъемлющую стратегию, чтобы снабдить государства-члены рекомендациями и инструментами для эффективной борьбы с устойчивостью к антимикробным препаратам на всех уровнях.
7. Что предпринимает ВОЗ в Европейском регионе?
В сентябре 2011 г. на сессии Европейского регионального комитета ВОЗ в Баку (Азербайджан) представители 53 стран одобрили новый Европейский стратегический план действий по борьбе с устойчивостью к антибиотикам. Разработанный силами Европейского регионального бюро ВОЗ на основе новейших научных данных и широких консультаций с экспертами и руководителями, этот план действий опирается на плодотворные итоги Всемирного дня здоровья 2011 г., который был проведен под лозунгом “Не принять меры сегодня – нечем будет лечить завтра!”
В Европейском стратегическом плане действий по проблеме устойчивости к антибиотикам выделено семь ключевых областей для принятия мер, направленных на защиту здоровья жителей Европы. Эти области следующие:
- национальная многосекторальная координация усилий по сдерживанию устойчивости к антибиотикам;
- надзор за применением антибиотиков и устойчивостью к ним;
- стратегии рационального применения антибиотиков и усиление надзора за их использованием;
- инфекционный контроль в медицинских учреждениях;
- возникновение и распространение устойчивости к антибиотикам, применяемым в ветеринарии и сельском хозяйстве;
- инновации и научные исследования по разработке новых препаратов и технологий;
- информированность, безопасность пациентов и партнерство.
8. Что могут предпринять правительства?
Правительства могут взять на себя лидирующую роль, внедряя всеобъемлющие стратегии по предупреждению возникновения устойчивости к антибиотикам и обеспечивая, чтобы эти стратегии имели надлежащую ресурсную базу.
9. Что могут предпринять потребители?
Антибиотики являются драгоценным ресурсом для каждого жителя планеты. Мы должны охранять и ответственно использовать его как любое другое глобальное благо. Потребители могут внести свой вклад в борьбу с устойчивостью к антимикробным препаратам, используя антибиотики, только когда они назначены, и всегда доводя лечение до конца. Проведение пациентами только части курса лечения способствует развитию устойчивости к лекарствам. Для потребителей важно понимать, что антибиотики предназначены для борьбы с бактериальными инфекциями и не действуют против таких вирусных инфекций, как грипп или ОРВИ.
10. Что могут предпринять врачи?
Врачи могут подвергаться давлению со стороны пациентов и проводящих некорректный маркетинг фармацевтических компаний, вынуждающему их назначать лекарственные препараты, когда в этом нет необходимости. Важно, чтобы все работники здравоохранения, включая врачей, сопротивлялись этому давлению. Врачи должны объяснять своим пациентам, когда необходимо использовать антибиотики и другие антимикробные препараты, а когда нет. Кроме того, врачи могут проинформировать своих пациентов о том, как важно завершить полный курс лечения назначенными препаратами, а не прекращать лечение сразу же после того, как наступит улучшение.
11. Что могут предпринять фармацевты?
Роль фармацевтов особенно важна, так как в большинстве случаев именно они выдают антибиотики пациентам. Как и другие работники здравоохранения, фармацевты могут разъяснять пациентам важность приема только тех препаратов, которые им прописаны, и завершения полного курса лечения.
12. Что могут сделать ветеринары и работники сельского хозяйства?
Больных животных тоже необходимо лечить, однако, как и в отношении людей, это лечение должно быть рациональным. Применение в обычном порядке антибиотиков на большом числе здоровых животных, например для стимуляции роста, скорее всего, приведет к возникновению и распространению бактерий, устойчивых к антимикробным препаратам, что в свою очередь вызовет возникновение устойчивых инфекций как у людей, так и у животных. Устойчивые микроорганизмы, носителями которых являются сельскохозяйственные животные, могут передаваться человеку через зараженные пищевые продукты, непосредственный контакт с животными или через окружающую среду, например, зараженную воду. Работники сельского хозяйства могут оказать содействие борьбе с устойчивостью к антимикробным средствам, усовершенствовав охрану здоровья сельскохозяйственных животных, обеспечив надлежащие санитарно-гигиенические условия и соблюдение норм и правил ведения сельского хозяйства. Ветеринары должны рационально назначать антибиотики, особенно те, что имеют первостепенное значение в медицине.
13. Что может предпринять фармацевтическая промышленность?
Исследования и разработки новых препаратов, включая лекарства, вакцины и новые диагностические средства, имеют жизненно важное значение для защиты будущих поколений. Создание вакцин для предупреждения бактериальных инфекций могло бы снизить необходимость в использовании антибиотиков. С другой стороны, по мере развития устойчивости к лекарственным препаратам, возникает потребность в новых лекарствах, а также в новых методах использования уже существующих. В настоящее время в процессе исследований и разработки находится очень немного новых антимикробных препаратов, средств диагностики или вакцин. Например, из находящихся сейчас в разработке лекарств меньше 5% – новые антибиотики. Фармацевтическая индустрия должна работать совместно с партнерами, чтобы преодолеть барьеры, стоящие на пути исследований и разработки, и гарантировать широкий доступ к лекарствам, вакцинам и диагностическим средствам. Необходимо также иметь более качественные стимулы для содействия расширению исследований и разработки в этой жизненно важной области.
Разработка и регистрация лекарственных средств
Введение. Азометиновые производные 2-амино-4,5,6,7-тетрагидро-1-бензотиофен-3-карбоксамида являются ациклическими предшественниками биологически активных соединений (БАС) производных 5,6,7,8-тетрагидро-3H-бензотеофено[2,3-d]пиримидин-4-она. В литературе приведены примеры этих групп соединений, обладающих различными фармакологическими свойствами, однако главным образом описано их цитостатическое действие. Эти данные и препаративная доступность позволяют судить о перспективности дальнейшего изучения и молекулярного конструирования в ряду азометиновых производных 2-амино-4,5,6,7-тетрагидро-1-бензотиофен-3-карбоксамида. Оптимизация методов синтеза и анализа веществ данного ряда, а также выявление закономерностей «структураактивность» представляют значительный интерес для медицинской химии и фармацевтической науки. Полученные соединения-лидеры позволят в дальнейшем разработать лабораторный регламент синтеза активной фармацевтической субстанции.
Цель. Осуществить прогноз и оптимизировать методику синтеза и анализа высокоэффективной жидкостной хроматографии (ВЭЖХ) фармакологически активных азометиновых производных 2-амино-4,5,6,7-тетрагидро-1-бензотиофен-3-карбоксамида.
Материалы и методы. Прогноз биологической активности осуществлялся посредством веб-ресурса PASS Online. Синтез целевых азометинов проводился взаимодействием ароматических альдегидов с 2-амино-4,5,6,7-тетрагидро-1-бензотиофен-3-карбоксамидом в среде этанола. Контроль прохождения реакции проводили методом тонкослойной хроматографии (ТСХ). Определение родственных примесей осуществлялось методом ВЭЖХ. Анализ проводился в условиях изократического элюирования подвижной фазой ацетонитрил – вода (70:30).
Результаты и обсуждение. Прогноз биологической активности позволил предположить проявление цитостатической, противотуберкулезной и противовоспалительной активности у целевых азометинов. Анализ реакционной способности выявил влияние заместителей, содержащихся в ароматическом ядре альдегидов, на полноту прохождения реакции конденсации. Спектральные характеристики однозначно подтвердили строение продуктов, а результаты ВЭЖХ показали чистоту полученных веществ, которая составляет более 96 %.
Заключение. В результате проведенных исследований было обосновано строение перспективных азометиновых производных 2-амино-4,5,6,7-тетрагидро-1-бензотиофен-3-карбоксамида, оптимизирована их методика синтеза и анализа посредством ВЭЖХ. Результаты исследований позволят в дальнейшем выявить соединения-лидеры с заданными фармакологическими свойствами и использовать полученные закономерности «структура-активность» в дальнейшем молекулярном конструировании БАС.
История открытия противомикробных препаратов
Противомикробные препараты произвели революцию в медицинской науке в течение 20 -го века. История открытия противомикробных препаратов была долгой и легендарной и увенчалась успехами в борьбе с человеческими болезнями.
Изображение предоставлено: AnaLysiSStudiO / Shutterstock.com
Противомикробные препараты – Обзор
Существует 3 основных класса противомикробных средств – дезинфицирующие средства, антисептики и антибиотики.Дезинфицирующие средства (к которым относятся отбеливатель и обычные бытовые чистящие средства) – это неизбирательные средства, которые убивают микробы на неживых поверхностях, предотвращая их распространение. Во время операции на живые ткани наносятся антисептики, уменьшающие микробную инфекцию. Антибиотики – это лекарства, которые используются для уничтожения микробов в организме, либо убивая их, либо замедляя их развитие и рост.
Термин «антибиотики» используется специально для обозначения антибактериальных средств, но в последние годы он был расширен и теперь включает лекарства, которые лечат все формы микробов.Он также использовался для описания лекарств, полученных из живых микроорганизмов, но теперь включает синтетические препараты, такие как фторхинолоны и сульфинамиды. Антибактериальные средства можно разделить на бактерицидные и бактериостатические.
С конца 19-го -го -го / начала 20-го -го века многие противомикробные препараты были разработаны и выпущены на рынок во всем мире для лечения различных инфекционных заболеваний. Они предназначены для уничтожения или замедления активности микробов.Они включают антибактериальные, противовирусные, противогрибковые и противопаразитарные препараты.
Противомикробные препараты в древнем мире
В настоящее время большинство людей полагает, что до наступления антимикробной революции во второй половине 20-го -го -го века люди автоматически поддавались воздействию инфекционных заболеваний без какой-либо защиты от них. Однако это не так. Существует множество свидетельств того, что человеческое общество использовало противомикробные препараты более 2000 лет.
Существовало множество, хотя и плохо изученных, методов лечения жертв инфекционных заболеваний. Использовались травы, мед и даже фекалии животных. Однако в древнем мире уровень смертности был намного выше.
Возможно, наиболее актуальным и широко распространенным применением противомикробных средств в древних обществах было местное использование заплесневелого хлеба в качестве лечебного средства. Есть документальные свидетельства его использования в Египте, Сербии, Китае, Греции и Римской империи. Широкое распространение плесени таким образом было задокументировано в книге Джона Паркинсона Theatrum Botanicum, , опубликованной в 1640 году.
Есть даже археологические свидетельства антибиотиков, которые используются в современном мире в Нубии и Египте, оккупированном Римом. Следы тетрациклина были обнаружены в костях человеческих скелетов этих эпох, хотя их происхождение остается загадкой.
Возрождение и Просвещение
Однако современные открытия противомикробных препаратов не набирали обороты до 17 -го -го века, когда Антони Филипс ван Левенгук открыл бактерии с помощью своего микроскопа.После передачи своих результатов Роберту Гуку, члену-основателю Королевского общества, он начал изучение бактериологии.
В конце 1800-х годов Роберт Кох и Луи Пастер установили, что существует связь между бактериями и болезнями через распространение на животных и в искусственных средах. Это открытие оказало далеко идущее влияние на современную медицину, которая существует и по сей день.
В течение последних нескольких столетий до антибиотической эры также проводились эксперименты с возможными методами лечения, которые часто имели более серьезные побочные эффекты, чем сами болезни.
Распространение сифилиса и гонореи, распространенных в то время инфекций, передаваемых половым путем, привело к применению таких вредных тяжелых металлов, как висмут, мышьяк и ртуть. Их вводили системно или местно с помощью специально разработанных шприцев.
Современная эра открытий противомикробных препаратов
Вероятно, первым антибиотиком, который был использован для лечения инфекционных заболеваний человека, была пиоцианаза. Эммерих и Лёв выделили зеленые бактерии из бинтов в середине 19-го, -го и 9000-го века, которые подавляли рост других бактерий.Затем микроорганизм Pseudomonas aeruginosa применяли в качестве лекарственного средства, хотя и с переменным успехом.
Отец противомикробной химиотерапии – Пауль Эрлих. Он работал с другими известными фигурами, такими как Роберт Кох и Эмиль фон Беринг, над разработкой улучшенного антитоксина против дифтерии, который стал основой для современной антибактериальной терапии. Это также привело к появлению широко используемых гистологических красителей, таких как окраска по Граму.
Его работа над сальварсаном, химическим веществом на основе мышьяка, в 1909 году, вероятно, была первым действительно современным противомикробным средством.
Пенициллин – революционное лекарство
Пенициллин, когда он был открыт и стал широко доступным, дал медицинским работникам новый мощный инструмент, который помог начать революцию в борьбе с инфекционными заболеваниями. Несмотря на то, что Александру Флемингу приписывают его открытие в 1928 году, возможно, были и другие люди, совершившие это открытие до него. К ним относятся сэр Джон Скотт Бердон-Сандерсон и Джозеф Листер в 19 -м веках.
Однако на первых порах возникли проблемы с коммерческим выпуском пенициллина.Это продолжалось только после того, как Флори и Чейн опубликовали в 1940 году статью, описывающую методику очистки. В 1945 году пенициллин стал доступен для ограниченного использования.
Были проблемы с этим антибиотиком, которые сохраняются и по сей день, например, он имеет плохую биодоступность. Примерно в это же время сульфаниламиды также разрабатывались учеными компании Bayer в Германии.
Разработка современных противомикробных препаратов
«Золотой век» открытий противомикробных препаратов длился 20 лет с середины 1940-х до 1960-х годов.Первоначально основным источником новых лекарств были природные источники. Открытие и выделение стрептомицина в 1944 году привело к поиску источников новых антибиотиков во всем мире. В 1950-х годах ванкомицин был извлечен из образцов, найденных на Борнео, и отправлен обратно христианскими миссионерами.
С тех пор было разработано множество различных противомикробных препаратов как из природных, так и из синтетических источников. Метициллин был разработан в 1959 году, а ампициллин был разработан в 1961 году, как решения, повышающие устойчивость к антибиотикам.Цефалоспорины появились в 1960-х годах, что привело к разработке цефтазидима в конце 1970-х годов.
Проблема устойчивости к антибиотикам, которая была впервые выявлена в 1950-х годах, привела к новым способам мышления в области разработки противомикробных препаратов. Развитие устойчивости превзошло возможности разработки лекарств, которые могут бороться со штаммами устойчивых бактерий.
Несомненно, будущее развитие противомикробных препаратов будет зависеть от открытия новых лекарств и умного применения таких технологий, как генная инженерия и другие научные области, в области разработки противомикробных препаратов.
Источники
Bassett, E.J. и др. (1980) Меченная тетрациклином человеческая кость из древней суданской Нубии (350 г. н.э.) Science 209 (4464) стр. 1532-1534 [Доступно в Интернете 12 -е ноября 2020 г.] https://science.sciencemag.org/ content / 209/4464 / 1532.abstract
Левин, Д.П. (2006) Vancomycin: A History Clinical Infectious Diseases 42 (1) pp. S-5-S12 [Доступно в Интернете 12 -е ноября 2020 г.] https://doi.org/10.1086/4
Рассел А.D. (1975) Антибактериальная активность нового цефалоспорина, цефамандола Журнал антимикробной химиотерапии 1 (1) стр. 97-101 [Доступ в Интернете 12 -го ноября 2020 г.] https://doi.org/10.1093/jac /1.1.97
Аминов Р.И. (2010) Краткая история эпохи антибиотиков: извлеченные уроки и задачи на будущее Front. Microbiol. 8/12/2010 [Доступ онлайн 12 -е ноября 2020] https://www.frontiersin.org/articles/10.3389/fmicb.2010.00134/full
Дополнительная литература
История химиотерапии и открытия противомикробных препаратов
Цели обучения
- Сравнить и сопоставить натуральные, полусинтетические и синтетические противомикробные препараты
- Опишите химиотерапевтические подходы древних обществ
- Опишите исторически важных людей и события, которые привели к разработке противомикробных препаратов
Клиническая направленность: Накри, часть 1
Накри, 52-летняя женщина, страдала от сильных болей в животе, увеличения лимфатических узлов, утомляемости и лихорадки.Она только что вернулась домой после посещения большой семьи в своей родной стране Камбоджа. Находясь за границей, она получила медицинскую помощь в соседнем Вьетнаме по поводу сдавления спинного мозга. У нее все еще был дискомфорт, когда она уезжала из Камбоджи, но боль усилилась, когда ее поездка домой продолжалась, и ее муж отвез ее прямо из аэропорта в отделение неотложной помощи.
Ее врач рассматривает, может ли Накри страдать от аппендицита, инфекции мочевыводящих путей (ИМП) или воспалительного заболевания органов малого таза (ВЗОМТ).Однако каждому из этих состояний обычно предшествуют или сопровождают дополнительные симптомы. Он рассматривает лечение, которое она получила во Вьетнаме по поводу сдавленного спинного мозга, но боль в животе обычно не связана со сдавлением спинного мозга. Он исследует ее историю здоровья дальше.
- Какой тип инфекции или другое заболевание может быть причиной?
- Какие лабораторные анализы может назначить врач?
Мы вернемся к примеру Накри на следующих страницах.
Большинство людей связывают термин химиотерапия с лечением рака. Однако на самом деле химиотерапия – это более широкий термин, который относится к любому использованию химических веществ или лекарств для лечения болезни. Химиотерапия может включать препараты, нацеленные на раковые клетки или ткани, или может включать антимикробных препаратов , нацеленных на инфекционные микроорганизмы. Противомикробные препараты обычно действуют, разрушая или вмешиваясь в микробные структуры и ферменты, либо убивая микробные клетки, либо подавляя их рост.Но прежде чем мы исследуем, как действуют эти лекарства, мы кратко рассмотрим историю использования антимикробных препаратов людьми в химиотерапии.
Использование противомикробных препаратов в древних обществах
Рис. 1. На протяжении тысячелетий китайские травники использовали множество различных видов растений для лечения самых разных болезней человека.
Хотя открытие противомикробных препаратов и их последующее широкое использование обычно ассоциируется с современной медициной, есть свидетельства того, что люди подвергались воздействию противомикробных препаратов на протяжении тысячелетий.Химический анализ скелетных останков людей из Нубии (ныне обнаруженных на территории современного Судана), датируемых 350–550 гг. Нашей эры, показал остатки противомикробного агента тетрациклина в достаточно высоких количествах, чтобы предположить целенаправленную ферментацию производящего тетрациклин . Streptomyces в процессе приготовления пива. Полученное пиво , которое было густым и похожим на кашицу, использовалось для лечения различных заболеваний как у взрослых, так и у детей, включая болезни десен и раны.Противомикробные свойства некоторых растений также могли быть признаны различными культурами по всему миру, включая индийских и китайских травников (рис. 1), которые долгое время использовали растения для самых разных медицинских целей. Целители многих культур понимали антимикробные свойства грибов, и использование ими заплесневелого хлеба или других продуктов, содержащих плесень, для лечения ран было хорошо документировано на протяжении веков. Сегодня, хотя около 80% населения мира все еще полагается на лекарства растительного происхождения, ученые открывают активные соединения, придающие лечебные свойства, содержащиеся во многих из этих традиционно используемых растений.
Подумай об этом
- Приведите примеры использования противомикробных препаратов в древних обществах.
Первые противомикробные препараты
Рис. 2. Пол Эрлих оказал влияние на открытие соединения 606, противомикробного агента, который оказался эффективным средством лечения сифилиса.
Общества полагались на традиционную медицину тысячи лет; однако первая половина 20 века принесла эпоху открытия стратегических лекарств.В начале 1900-х годов немецкий врач и ученый Пауль Эрлих (1854–1915) задумал открыть или синтезировать химические соединения, способные убивать инфекционные микробы, не причиняя вреда пациенту. В 1909 году, после проверки более 600 соединений, содержащих мышьяк, помощник Эрлиха Сахачиро Хата (1873–1938) обнаружил одну такую «волшебную пулю». Соединение 606 нацелено на бактерию Treponema pallidum , возбудителя сифилиса. Было обнаружено, что соединение 606 успешно лечит сифилис у кроликов и вскоре после этого было продано под названием Salvarsan как средство от болезни у людей (фиг. 2).Новаторский подход Эрлиха к систематическому скринингу широкого спектра соединений остается общей стратегией открытия новых противомикробных агентов даже сегодня.
Несколько десятилетий спустя немецкие ученые Йозеф Кларер , Фриц Мицш и Герхард Домагк обнаружили антибактериальную активность синтетического красителя пронтозила , который может лечить стрептококковые и стафилококковые инфекции у мышей. Собственная дочь Домагка была одной из первых людей, получивших лекарство, которое полностью вылечило ее от тяжелой стрептококковой инфекции, возникшей в результате укола иглой для вышивания.Герхард Домагк (1895–1964) был удостоен Нобелевской премии по медицине в 1939 году за работу с пронтозилом и сульфаниламидом , активным продуктом распада пронтозила в организме. Сульфаниламид, первый созданный синтетический противомикробный препарат, послужил основой для химической разработки семейства сульфамидных препаратов. Синтетический противомикробный препарат – это лекарство, созданное на основе химического вещества, не встречающегося в природе. Успех сульфамидных препаратов привел к открытию и производству дополнительных важных классов синтетических противомикробных препаратов, включая хинолинов и оксазолидинонов .
За несколько лет до открытия пронтозила ученый Александр Флеминг (1881–1955) сделал свое собственное случайное открытие, которое оказалось монументальным. В 1928 году Флеминг вернулся из отпуска и исследовал несколько старых пластинок стафилококков в своей исследовательской лаборатории в больнице Святой Марии в Лондоне. Он заметил, что рост заражающей плесени (впоследствии идентифицированной как штамм Penicillium notatum ) подавлял рост стафилококков на одной чашке. Таким образом, Флемингу приписывают открытие пенициллина , первого природного антибиотика (рис. 3).Дальнейшие эксперименты показали, что пенициллин из плесени обладает антибактериальными свойствами против стрептококков, менингококков и Corynebacterium diphtheriae , возбудителя дифтерии.
Флемингу и его коллегам приписывают открытие и идентификацию пенициллина, но его выделение и массовое производство были выполнены группой исследователей из Оксфордского университета под руководством Говарда Флори (1898–1968) и Эрнста Chain (1906–1968). 1979) (Рисунок 3).В 1940 году исследовательская группа очистила пенициллин и сообщила о его успехе в качестве противомикробного средства против стрептококковых инфекций у мышей. Их последующая работа с людьми также показала, что пенициллин очень эффективен. За свою важную работу Флеминг, Флори и Чейн были удостоены Нобелевской премии по физиологии и медицине в 1945 году.
Рис. 3. (a) Александр Флеминг был первым, кто в 1928 году обнаружил естественный противомикробный препарат, пенициллин. (B) Ховард Флори и Эрнст Чейн открыли, как увеличить производство пенициллина.Затем они придумали, как его очистить, и показали его эффективность в качестве противомикробного средства в испытаниях на животных и людях в начале 1940-х годов.
Рис. 4. Селман Ваксман был первым, кто продемонстрировал огромные возможности производства противомикробных препаратов группой почвенных бактерий, актиномицетов.
В начале 1940-х годов ученая Дороти Ходжкин (1910–1994), изучавшая кристаллографию в Оксфордском университете, использовала рентгеновские лучи для анализа структуры различных природных продуктов. В 1946 году она определила структуру пенициллина, за что в 1964 году была удостоена Нобелевской премии по химии.Как только структура была понята, ученые смогли изменить ее, чтобы производить различные полусинтетические пенициллины. Полусинтетический противомикробный препарат представляет собой химически модифицированное производное природного антибиотика. Химические модификации обычно предназначены для увеличения диапазона бактерий, на которые нацелены, повышения стабильности, снижения токсичности или придания других свойств, полезных для лечения инфекций.
Пенициллин – лишь один из примеров природного антибиотика. Также в 1940-х годах Селман Ваксман (1888–1973) (рис. 4), известный почвенный микробиолог из Университета Рутгерса, возглавил исследовательскую группу, которая обнаружила несколько противомикробных препаратов, включая актиномицин , стрептомицин и неомицин .Открытие этих противомикробных препаратов произошло в результате исследования грибов и актинобактерий , проведенных Ваксманом, включая почвенные бактерии из рода Streptomyces , известных своим естественным производством широкого спектра противомикробных препаратов. Его работа принесла ему Нобелевскую премию по физиологии и медицине в 1952 году. актиномицетов являются источником более половины всех природных антибиотиков и продолжают служить отличным резервуаром для открытия новых противомикробных агентов.Некоторые исследователи утверждают, что мы еще не приблизились к раскрытию всего антимикробного потенциала этой группы.
Подумай об этом
- Почему почва является резервуаром генов устойчивости к противомикробным препаратам?
Ключевые концепции и краткое изложение
- Противомикробные препараты , полученные путем целенаправленной ферментации и / или содержащиеся в растениях, тысячелетиями использовались в качестве традиционных лекарств во многих культурах.
- Целенаправленный и систематический поиск химической «волшебной пули», предназначенной специально для инфекционных микробов, был инициирован Полом Эрлихом в начале 20 века.
- Открытие Александром Флемингом в 1928 году природного антибиотика , пенициллина, , положило начало современной эпохе открытий и исследований противомикробных препаратов.
- Сульфаниламид, первый синтетический противомикробный препарат , был открыт Герхардом Домагком и его коллегами и представляет собой продукт распада синтетического красителя пронтозила.
Множественный выбор
Ученый обнаруживает, что почвенная бактерия, которую он изучал, производит противомикробное средство, убивающее грамотрицательные бактерии.Она выделяет и очищает антимикробное соединение, затем химически превращает химическую боковую цепь в гидроксильную группу. Когда она тестирует антимикробные свойства этой новой версии, она обнаруживает, что этот противомикробный препарат теперь также может убивать грамположительные бактерии. Что из перечисленного считается новым противомикробным препаратом широкого спектра действия?
- устойчивый
- полусинтетический
- синтетический
- натуральный
Ответ б.Новый противомикробный препарат широкого спектра действия считается полусинтетическим.
Какой из следующих противомикробных препаратов является синтетическим?
- сульфаниламид
- пенициллин
- актиномицин
- неомицин
Ответ а. Сульфаниламид синтетический.
Заполните бланк
Группа почвенных бактерий, известных своей способностью продуцировать широкий спектр противомикробных препаратов, называется ________.
Показать ответГруппа почвенных бактерий, известных своей способностью продуцировать широкий спектр противомикробных препаратов, называется актиномицетами .
Подумай об этом
- Откуда естественным образом берутся противомикробные препараты? Почему?
- Почему сальварсан считался «волшебной пулей» для лечения сифилиса?
- Почему в природе микробы, продуцирующие противомикробные препараты, обычно также имеют гены устойчивости к противомикробным препаратам?
антибиотиков: от предыстории до наших дней | Журнал антимикробной химиотерапии
Абстракция
Противомикробные препараты использовались многие тысячи лет в самых разных форматах.В этой статье я прослежу, как мы перешли от оригинального использования агентов, доступных в окружающей среде, к химически модифицированным агентам.
Введение
В поколении, выросшем в эпоху широко доступных антибиотиков, легко предположить, что до того, как они были введены, любой, у кого была инфекция, в конце концов погиб от ее воздействия.
Это явно не так, поскольку всегда были выжившие даже от самых смертоносных инфекций, таких как бубонная чума, дифтерия и туберкулез, благодаря эффективности врожденного иммунного ответа.Однако справедливо сказать, что когда-то уровень смертности был намного выше, чем сегодня.
Древняя история
Имеются также достоверные исторические свидетельства того, что древние цивилизации использовали различные естественные методы лечения инфекций, например травы, мед и даже фекалии животных. 1 Одним из наиболее успешных методов лечения было местное применение заплесневелого хлеба, многие упоминания о его благотворном действии были получены в Древнем Египте, Китае, Сербии, Греции и Риме.Эта тема пользы плесени продолжалась на протяжении многих лет со ссылками на Джона Паркинсона (1567–1640) (рис. 1) в его книге Theatrum Botanicum , опубликованной в 1640 году.
Рисунок 1.
Джон Паркинсон (1567–1650). Первый человек, задокументировавший использование плесени для лечения инфекций.
Рис. 1.
Джон Паркинсон (1567–1650). Первый человек, задокументировавший использование плесени для лечения инфекций.
В древние времена могли быть доступны даже более современные антибиотики.Следы тетрациклинов были обнаружены в человеческих скелетах, раскопанных в Нубии и во время римской оккупации Египта. 2 Происхождение тетрациклина остается загадкой.
Возрождение и Просвещение
Открытие Антони ван Левенгука небольших живых существ или «анималкулов» 3 (1632–1723) в 1676 году – с использованием сконструированного им микроскопа – положило начало изучению бактериологии после того, как он сообщил свои открытия в 1665 году Роберту Гуку (1635). –1703), член-основатель Королевского общества.В конце 1800-х годов Роберт Кох (1843–1910) и Луи Пастер (1822–1895) смогли установить связь между отдельными видами бактерий и болезнями посредством их распространения в искусственных средах и на животных.
Распространение гонореи и сифилиса 4 побудило к дальнейшим экспериментам с возможными методами лечения, особенно среди высших слоев общества. Были испытаны тяжелые металлы, такие как мышьяк, висмут и ртуть; они вводились либо системно, либо местно с помощью специально разработанных шприцев.Хотя симптомы улучшились, введение и побочные эффекты часто оказывались хуже, чем болезнь.
Рассвет современной эпохи
Пиоцианаза, вероятно, была первым антибиотиком, который использовался для лечения инфекций человека. Рудольф Эммерих (1856–1914) и Оскар Лёв (1844–1941) обнаружили, что зеленые бактерии, выделенные из повязок раненых пациентов, подавляли рост других микробов. 5 Они выращивали организм ( Pseudomonas aeruginosa ) партиями и использовали супернатант в качестве лекарства с переменным успехом.
Только после того, как Пол Эрлих (1854–1915) (рис. 2) начал работать над антибактериальным действием красителей, настоящая эра антимикробной химиотерапии началась. Первым интересом Эрлиха была разработка красителей для гистологического исследования тканей, в частности, основы окраски Циля-Нельсона для туберкулеза и окраски по Граму. Он отметил, что некоторые пятна токсичны для бактерий, и начал поиски «волшебной пули» немецкого фольклора (изначально предназначенной для уничтожения оборотней). 6 Сальварсан, химическое вещество на основе мышьяка, открытое Эрлихом и его командой в 1909 году, оказалось эффективным средством лечения сифилиса и, вероятно, первым по-настоящему современным противомикробным средством, хотя и не было антибиотиком в строгом смысле этого слова.
Рисунок 2.
Пауль Эрлих (1854–1915). Отец антимикробной химиотерапии.
Рис. 2.
Пауль Эрлих (1854–1915). Отец антимикробной химиотерапии.
Эрлих не ограничивался химическими веществами.Он также очень интересовался иммунологией и работал с Робертом Кохом (1843–1910) и Эмилем фон Берингом (1854–1917) над улучшением антитоксина против дифтерии. Затем антитоксины стали основой антибактериальной терапии. Уильям Ослер (1849–1919) описал использование «антистрептококковой сыворотки» в качестве лечения эндокардита, при котором бактерии, выделенные из культур крови, вводили лошадям, а затем пациентам вводили лошадиную сыворотку. 7
Пенициллин
Всем известна история о том, как Александр Флеминг (1881–1955) открыл пенициллин в 1928 году, 8 , но другие, вероятно, сделали это раньше него.В 1870 году сэр Джон Скотт Бердон-Сандерсон (1828–1905) описал, как культуральная жидкость, покрытая плесенью, подавляет рост бактерий. Год спустя Джозеф Листер (1827–1912) экспериментировал с « Penicillium glaucium » (так в оригинале), продемонстрировав его антибактериальное действие на ткани человека, а в 1875 году доктор Джон Тиндалл (1820–1893) представил свои эксперименты с Penicillium notatum Королевскому обществу. Наконец, в 1897 году Эрнест Дюшен (1874–1912) наблюдал за арабскими конюхами, лечившими язвы в седлах плесенью, размножающейся на их седлах.Он взял эту плесень, подтвержденную как Penicillium notatum , и использовал ее для успешного лечения индуцированного брюшного тифа у морских свинок. 3
Флеминг понял, что пенициллин обладает огромным потенциалом, но возникли серьезные проблемы с переводом того, что можно было продемонстрировать в лаборатории, в лекарство, которое могло бы стать широко доступным. Он пытался привлечь внимание химиков в течение ряда лет, но, наконец, отказался в 1940 году, чтобы заняться другими интересами. К счастью, Ховард Флори (1898–1968), фармаколог и патолог, и Эрнст Чейн (1906–1979), биохимик, работающий в Оксфорде, опубликовали в том же году статью, описывающую методику очистки.Этот прорыв в конечном итоге привел к тому, что пенициллин стал доступен для ограниченного использования в 1945 году. 9 Несомненно, пенициллин спасал жизнь, но у него все еще были проблемы. Он имел очень короткую т 1/2 и низкую биодоступность, проблемы, которые сохраняются при его применении сегодня.
Пока Флеминг пытался очистить пенициллин, в Германии ученые компании Bayer следовали примеру Эрлиха и изучали антибактериальные эффекты красителей. Сульфаниламид был синтезирован в 1908 году, а в 1931 году путем его объединения с красителем был получен пронтозил; эта комбинация оказалась эффективной при лечении стрептококковых инфекций у мышей.В 1933 году мальчику, умирающему от стафилококковой сепсиса, препарат с чудесным успехом был введен. В 1935 году исследователи поняли, что краситель не нужен, так как пронтозил метаболизировался до сульфаниламида, и началась эра сульфонамида 10 . Сульфаниламиды якобы спасли жизни Уинстона Черчилля и сына Франклина Д. Рузвельта.
Золотой век
После этого толчка следующие 20 лет стали «золотым веком» открытия антибиотиков.Первоначально лучшим источником новых агентов были другие встречающиеся в природе микроорганизмы, и после того, как в 1944 г. был выделен стрептомицин 11 из Streptomyces griseus (организм, обнаруженный в почве), начался всемирный поиск. Были приложены все усилия, чтобы охватить все уголки земного шара, но ресурсы были ограничены. Эли Лилли пришла в голову блестящая идея попросить христианских миссионеров прислать образцы почвы из каждого экзотического места, которое они посетили. В образце с Борнео, отправленном в 1952 г., выросло Streptomyces orientalis, из которых в конечном итоге был извлечен ванкомицин ; ванкомицин стал доступен для использования пациентами в 1958 году. 12
К этому времени резистентность к антибиотикам стала очевидной, и ученые стали искать новые способы улучшения существующих агентов для борьбы с этим препятствием. Бичем разработал метициллин в 1959 году как первый устойчивый к пенициллиназе β-лактамный антибиотик, а спектр активности и фармакокинетика пенициллина были улучшены с введением ампициллина в 1961 году.
Цефалоспорины начали появляться в 1960-х годах, и их эволюция разделила их на три поколения в соответствии с их спектром активности, антипсевдомонадный агент третьего поколения цефтазидим, появившийся в конце 1970-х годов.По счастливой случайности в 1975 году в первое издание этого журнала была включена статья, описывающая антимикробную активность цефамандола. 13
Бактериальные ингибиторы β-лактамаз 14 были впервые идентифицированы как побочный продукт культур Streptomyces clavuligerus в 1976 году. Из них была получена клавулановая кислота, которая в сочетании с амоксициллином стала ко-амоксиклавом и тиенамицином. , который стал предшественником карбапенемов.
Тиенамицин превратился в имипенем, который был очень эффективным in vitro и на животных моделях, но, к сожалению, имел очень короткий результат t 1/2 в испытаниях на людях.Дальнейшие исследования выявили новый фермент в почках человека, дигидропепидазу I, который быстро метаболизирует имипенем. За счет добавления циластатина к имипенему т 1/2 было увеличено, и эта комбинация стала доступной для использования в Великобритании в конце 1980-х годов. Меропенем был лицензирован в 1995 году и имел аналогичный спектр действия, но был связан с меньшим количеством побочных эффектов. 15
Два ингибитора β-лактамазы, тазобактам и сульбактам, были объединены с другими агентами, чтобы расширить диапазон их действия. 14 Пиперациллин / тазобактам был впервые лицензирован в США в 1993 году и в том же году стал предметом дополнения к этому журналу. Комбинация в настоящее время широко используется в Великобритании в качестве замены Clostridium difficile цефалоспоринам, которые ранее были популярным выбором для эмпирической терапии.
По мере появления ряда доступных антибиотиков широкого спектра действия частота инфекций, вызываемых устойчивыми бактериями, увеличивалась под давлением отбора.До начала 1980-х годов лечение псевдомонозных инфекций требовало внутривенного введения антибиотиков и госпитализации.
Налидиксовая кислота была доступна для клинического применения в 1967 году, 16 , хотя ее использование ограничивалось лечением неосложненных инфекций мочевыводящих путей. Разработка фторхинолонов вернула эту группу антибиотиков в высшую лигу, особенно потому, что все они были доступны перорально. Ципрофлоксацин был представлен в середине 1980-х годов, когда я был стажером-микробиологом, и я наблюдал за колебаниями состояния этого агента на протяжении многих лет.Многие другие новые хинолоны либо не стали клинически доступными, либо были отменены из-за побочных эффектов после их запуска. Интересно поразмышлять над этим: многие из более ранних антибиотиков, такие как макролиды и тетрациклины, вызывают аналогичные (или даже худшие) побочные эффекты, но все еще широко используются.
С течением времени устойчивые грамположительные инфекции, такие как MRSA и энтерококки, становились все более сложными для клиницистов, поэтому при разработке антибиотиков внимание было сосредоточено на этих бактериях.
Ванкомицин все еще использовался в качестве агента первой линии для этих инфекций, но его было нелегко вводить, он обладал слабой бактерицидностью и появлялась резистентность к энтерококкам. Тейкопланин, выделенный из Actinoplanes teichomyceticus , был первым из новых гликопептидов, который стал доступен в Европе в 1990-х годах. 17 Хотя его было легче вводить, его активность против стафилококков была разочаровывающей, а его использование для гликопептид-устойчивых энтерококков (GRE) было ограниченным.Тем не менее, он все еще широко используется сегодня.
Использование гликопептидов в амбулаторных условиях привело к поиску препаратов длительного действия. Далбаванцин впервые прошел клинические испытания в 2007 году, но он не стал доступным до 2014 года, примерно в то же время, что и оритаванцин, который был лицензирован в США как однократное средство для лечения инфекций кожи и мягких тканей.
Первоначально оксазолидиноны были исследованы для лечения болезней растений. Первым антибиотиком этого класса был циклосерин, который впервые был использован в 1956 году для лечения туберкулеза.Линезолид был одобрен для использования в 2000 году и оказался полезной альтернативой гликопептидам из-за его хорошей пероральной доступности и активности против GRE. Это использование несмотря на то, что оно связано с рядом побочных эффектов и лекарственных взаимодействий. 18 Повторяя свое начало, линезолид также оказался полезным средством для лечения устойчивых к лекарствам микобактерий. Недавно стали доступны новые антибиотики того же класса, такие как тедизолид, и пока данные клинических испытаний в отношении побочных эффектов обнадеживают.
Даптомицин, 19 , как и многие другие антибиотики, описанные в этом обзоре, был получен из почвенного организма Streptomyces roseosporus , который был получен с горы Арарат в Турции. Даптомицин был впервые исследован в конце 1980-х годов; однако испытания были остановлены из-за неблагоприятных для опорно-двигательного аппарата эффектов, но агент был реанимирован и запущен в США в 2003 году.
Конец Золотого века
Между тем, осознав, что введение мер инфекционного контроля может снизить заболеваемость MRSA и GRE, внимание переключилось на проблему устойчивости грамотрицательных бактерий.Лечение инфекций, вызванных панрезистентными Acinetobacter , Enterobacteriaceae и Pseudomonas , оказалось сложной задачей для клиницистов, особенно в условиях интенсивной терапии. Были пересмотрены старые препараты, такие как колистин, хлорамфеникол, миноциклин и фосфомицин, либо по отдельности, либо в комбинации с более новыми препаратами.
Тигециклин, 20 , производное тетрациклина, был представлен в 2005 году и стал первым препаратом широкого спектра действия, получившим лицензию после моксифлоксацина в 2000 году.
Вслед за тигециклином в 2010-х годах появились цефтобипрол и цефтаролин, цефалоспорины, активные против MRSA. Совсем недавно были разработаны комбинации цефалоспорин / β-лактамаз, такие как цефтолозан / тазобактам, цефтазидим / авибактам и цефтазидим / сульбактам 21 , с активностью против устойчивых штаммов Pseudomonas ae и энтеробактерий, продуцирующих карбапенемазы.
Выводы
Журнал антимикробной химиотерапии сыграл свою роль в истории антибиотиков, публикации исследований, ведущих статей и приложений (Таблица 1).
Таблица 1.Примеры приложений к журналу, посвященных отдельным антибактериальным препаратам
| Антибактериальные . | Дополнение . |
|---|---|
| β-лактамы | |
| цефтазидим | 1981; 8 Дополнение B: 1–358 |
| цефтазидим | 1983; 12 Suppl A: 1–122 |
| клавуланатные / β-лактамные антибиотики | 1989; 24 Дополнение B: 1–226 |
| имипенем | 1983; 12 Дополнение D: 1–153 |
| имипенем | 1986; 18 Дополнение E: 1-232 |
| меропенем | 1989; 24 Suppl A: 1–320 |
| меропенем | 1995; 36 Дополнение A: 1–223 |
| пиперациллин / тазобактам | 1993; 31 Suppl A: 1–124 |
| Фторхинолоны | |
| эноксацин | 1984; 14 Дополнение C: 1–344 |
| норфлоксацин | 1984; 13 Дополнение B: 1–142 |
| ципрофлоксацин | 1986; 18 Дополнение D: 1-260 |
| пефлоксацин | 1986; 17 Дополнение B: 1–118 |
| эноксацин | 1988; 21 Дополнение B: 1–136 |
| флероксацин | 1988; 22 Дополнение D: 1-234 |
| офлоксацин | 1988; 22 Дополнение C: 1-2 |
| ципрофлоксацин | 1990; 26 Дополнение E: 1–142 |
| офлоксацин | 1990; 26 Дополнение D: 1–83 |
| пефлоксацин | 1990; 26 Дополнение B: 1–101 |
| темафлоксацин | 1991; 28 Дополнение C: 1–130 |
| спарфлоксацин | 1996; 37 Suppl A: 1–161 |
| грепафлоксацин | 1997; 40 Дополнение 1: 1–101 |
| тровафлоксацин | 1997; 39 Дополнение 2: 1–97 |
| ципрофлоксацин | 1999; 43 Suppl 1: 1–41 |
| левофлоксацин | 1999; 43 Дополнение 3: 1–90 |
| моксифлоксацин | 1999; 43 Дополнение 2: 1–100 |
| гемифлоксацин | 2000; 46 Дополнение 3: 1–37 |
| гемифлоксацин | 2000; 45 Дополнение 3: 1–107 |
| Разное | |
| ванкомицин | 1984; 14 : 1–109 |
| teicoplanin | 1988; 21 : 1–172 |
| teicoplanin | 1991; 27 : 1–73 |
| линезолид | 2003; 51 Дополнение 2: 1–53 |
| далбаванцин | 2005; 55 Приложение 2: 1–35 |
| тигециклин | 2013; 68 Дополнение 2: 1–55 |
| Антибактериальный . | Дополнение . |
|---|---|
| β-лактамы | |
| цефтазидим | 1981; 8 Дополнение B: 1–358 |
| цефтазидим | 1983; 12 Suppl A: 1–122 |
| клавуланатные / β-лактамные антибиотики | 1989; 24 Дополнение B: 1–226 |
| имипенем | 1983; 12 Дополнение D: 1–153 |
| имипенем | 1986; 18 Дополнение E: 1-232 |
| меропенем | 1989; 24 Suppl A: 1–320 |
| меропенем | 1995; 36 Дополнение A: 1–223 |
| пиперациллин / тазобактам | 1993; 31 Suppl A: 1–124 |
| Фторхинолоны | |
| эноксацин | 1984; 14 Дополнение C: 1–344 |
| норфлоксацин | 1984; 13 Дополнение B: 1–142 |
| ципрофлоксацин | 1986; 18 Дополнение D: 1-260 |
| пефлоксацин | 1986; 17 Дополнение B: 1–118 |
| эноксацин | 1988; 21 Дополнение B: 1–136 |
| флероксацин | 1988; 22 Дополнение D: 1-234 |
| офлоксацин | 1988; 22 Дополнение C: 1-2 |
| ципрофлоксацин | 1990; 26 Дополнение E: 1–142 |
| офлоксацин | 1990; 26 Дополнение D: 1–83 |
| пефлоксацин | 1990; 26 Дополнение B: 1–101 |
| темафлоксацин | 1991; 28 Дополнение C: 1–130 |
| спарфлоксацин | 1996; 37 Suppl A: 1–161 |
| грепафлоксацин | 1997; 40 Дополнение 1: 1–101 |
| тровафлоксацин | 1997; 39 Дополнение 2: 1–97 |
| ципрофлоксацин | 1999; 43 Suppl 1: 1–41 |
| левофлоксацин | 1999; 43 Дополнение 3: 1–90 |
| моксифлоксацин | 1999; 43 Дополнение 2: 1–100 |
| гемифлоксацин | 2000; 46 Дополнение 3: 1–37 |
| гемифлоксацин | 2000; 45 Дополнение 3: 1–107 |
| Разное | |
| ванкомицин | 1984; 14 : 1–109 |
| teicoplanin | 1988; 21 : 1–172 |
| teicoplanin | 1991; 27 : 1–73 |
| линезолид | 2003; 51 Дополнение 2: 1–53 |
| далбаванцин | 2005; 55 Приложение 2: 1–35 |
| тигециклин | 2013; 68 Приложение 2: 1–55 |
Примеры приложений к журналу, посвященных отдельным антибактериальным препаратам
| Антибактериальные . | Дополнение . |
|---|---|
| β-лактамы | |
| цефтазидим | 1981; 8 Дополнение B: 1–358 |
| цефтазидим | 1983; 12 Suppl A: 1–122 |
| клавуланатные / β-лактамные антибиотики | 1989; 24 Дополнение B: 1–226 |
| имипенем | 1983; 12 Дополнение D: 1–153 |
| имипенем | 1986; 18 Дополнение E: 1-232 |
| меропенем | 1989; 24 Suppl A: 1–320 |
| меропенем | 1995; 36 Дополнение A: 1–223 |
| пиперациллин / тазобактам | 1993; 31 Suppl A: 1–124 |
| Фторхинолоны | |
| эноксацин | 1984; 14 Дополнение C: 1–344 |
| норфлоксацин | 1984; 13 Дополнение B: 1–142 |
| ципрофлоксацин | 1986; 18 Дополнение D: 1-260 |
| пефлоксацин | 1986; 17 Дополнение B: 1–118 |
| эноксацин | 1988; 21 Дополнение B: 1–136 |
| флероксацин | 1988; 22 Дополнение D: 1-234 |
| офлоксацин | 1988; 22 Дополнение C: 1-2 |
| ципрофлоксацин | 1990; 26 Дополнение E: 1–142 |
| офлоксацин | 1990; 26 Дополнение D: 1–83 |
| пефлоксацин | 1990; 26 Дополнение B: 1–101 |
| темафлоксацин | 1991; 28 Дополнение C: 1–130 |
| спарфлоксацин | 1996; 37 Suppl A: 1–161 |
| грепафлоксацин | 1997; 40 Дополнение 1: 1–101 |
| тровафлоксацин | 1997; 39 Дополнение 2: 1–97 |
| ципрофлоксацин | 1999; 43 Suppl 1: 1–41 |
| левофлоксацин | 1999; 43 Дополнение 3: 1–90 |
| моксифлоксацин | 1999; 43 Дополнение 2: 1–100 |
| гемифлоксацин | 2000; 46 Дополнение 3: 1–37 |
| гемифлоксацин | 2000; 45 Дополнение 3: 1–107 |
| Разное | |
| ванкомицин | 1984; 14 : 1–109 |
| teicoplanin | 1988; 21 : 1–172 |
| teicoplanin | 1991; 27 : 1–73 |
| линезолид | 2003; 51 Дополнение 2: 1–53 |
| далбаванцин | 2005; 55 Приложение 2: 1–35 |
| тигециклин | 2013; 68 Дополнение 2: 1–55 |
| Антибактериальный . | Дополнение . |
|---|---|
| β-лактамы | |
| цефтазидим | 1981; 8 Дополнение B: 1–358 |
| цефтазидим | 1983; 12 Suppl A: 1–122 |
| клавуланатные / β-лактамные антибиотики | 1989; 24 Дополнение B: 1–226 |
| имипенем | 1983; 12 Дополнение D: 1–153 |
| имипенем | 1986; 18 Дополнение E: 1-232 |
| меропенем | 1989; 24 Suppl A: 1–320 |
| меропенем | 1995; 36 Дополнение A: 1–223 |
| пиперациллин / тазобактам | 1993; 31 Suppl A: 1–124 |
| Фторхинолоны | |
| эноксацин | 1984; 14 Дополнение C: 1–344 |
| норфлоксацин | 1984; 13 Дополнение B: 1–142 |
| ципрофлоксацин | 1986; 18 Дополнение D: 1-260 |
| пефлоксацин | 1986; 17 Дополнение B: 1–118 |
| эноксацин | 1988; 21 Дополнение B: 1–136 |
| флероксацин | 1988; 22 Дополнение D: 1-234 |
| офлоксацин | 1988; 22 Дополнение C: 1-2 |
| ципрофлоксацин | 1990; 26 Дополнение E: 1–142 |
| офлоксацин | 1990; 26 Дополнение D: 1–83 |
| пефлоксацин | 1990; 26 Дополнение B: 1–101 |
| темафлоксацин | 1991; 28 Дополнение C: 1–130 |
| спарфлоксацин | 1996; 37 Suppl A: 1–161 |
| грепафлоксацин | 1997; 40 Дополнение 1: 1–101 |
| тровафлоксацин | 1997; 39 Дополнение 2: 1–97 |
| ципрофлоксацин | 1999; 43 Suppl 1: 1–41 |
| левофлоксацин | 1999; 43 Дополнение 3: 1–90 |
| моксифлоксацин | 1999; 43 Дополнение 2: 1–100 |
| гемифлоксацин | 2000; 46 Дополнение 3: 1–37 |
| гемифлоксацин | 2000; 45 Дополнение 3: 1–107 |
| Разное | |
| ванкомицин | 1984; 14 : 1–109 |
| teicoplanin | 1988; 21 : 1–172 |
| teicoplanin | 1991; 27 : 1–73 |
| линезолид | 2003; 51 Дополнение 2: 1–53 |
| далбаванцин | 2005; 55 Приложение 2: 1–35 |
| тигециклин | 2013; 68 Suppl 2: 1–55 |
Хотя наука пытается идти в ногу с появлением все более и более устойчивых бактерий, необходимы дополнительные усилия для сохранения существующих антибиотиков и разработки новых.Более широкое использование комбинаций антибиотиков могло бы помочь преодолеть этот пробел, но, несмотря на наличие данных in vitro , для валидации необходимо больше результатов клинических исходов.
Одна из повторяющихся тем в этом обзоре заключается в том, что многие из великих достижений в открытии антибиотиков стали результатом выделения новых бактерий из окружающей среды. Эта работа требует много времени. Многие штаммы должны быть проверены на предмет их продукции, прежде чем даже потенциальный агент может быть идентифицирован.Исследования новых бактериальных мишеней, связанных с WGS, могут в конечном итоге облегчить эту работу, но в то же время естественные среды обитания, где встречаются эти микроорганизмы, подвергаются эрозии из-за вырубки лесов и глобального потепления. Времени может не хватить!
Заявления о прозрачности
Не подлежат декларированию.
Список литературы
1Keyes
K
,Lee
MD
,Maurer
JJ
.Антибиотики: механизм действия, механизмы резистентности и передачи
. В:Torrance
ME
,Isaacson
RE
, ред.Безопасность пищевых продуктов с использованием микробов в животноводстве Текущие темы
.Ames, IA, USA
:Iowa State Press
,2003
:45
–56
,2Basset
EJ
,Keith
MS
, и др. GJ ..Меченная тетрациклином человеческая кость из древней суданской Нубии (350 г. н.э.)
.Наука
1980
;209
:1532
–4
,3Портер
R
.Величайшее благо для человечества
.Вокеган, Иллинойс, США
:Fontana Press
,1999
.4Playfair
J
.Жизнь с микробами в условиях здоровья и болезней
.Оксфорд
:Oxford University Press
,2004
,5Леви
SB
.Парадокс антибиотиков
.Кембридж, Массачусетс, США
:Perseus Publishing
,2002
,6Schwartz
RS
.Волшебные пули Пауля Эрлиха
.NEJM
2004
;350
:1079
–80
,7Pruitt
RD
.Уильям Ослер и его Галстонские лекции по злокачественному эндокардиту
.Mayo Clin Proc
1982
;57
:4
–9
,8Fleming
A
.Об антибактериальном действии культуры Penicillium , с особым указанием на их использование в изоляции B
.influenzae. Br J Exp Pathol
1929
;10
:226
–36
.9Аминов
РИ
.Краткая история эпохи антибиотиков: извлеченные уроки и задачи на будущее
.Передний микробиол
2010
;1
:134
–45
.10Shambaugh
GE
.История сульфаниламидов
.Арка Отоларингол
1966
;83
:1
–2
.11Saga
T
,Yamaguchi
K
.История противомикробных агентов и резистентных бактерий
.Japan Med Assoc J
2009
;52
:103
–8
.12Левин
DP
.Ванкомицин: история
.Clin Infect Dis
2006
;42
:S5
–12
,13Russell
AD
.Антибактериальная активность нового цефалоспорина, цефамандола
.J Antimicrob Chemother
1975
;1
:97
–101
.14Drawz
SM
,Bonomo
RA
.Три десятилетия ингибиторов β-лактамаз
.Clin Microbiol Ред.
2010
;23
:60
–201
.15Papp-Wallace
KM
,Edimiani
A
,Taracila
MA
et al..Карбапенемы: прошлое, настоящее и будущее
.Противомикробные агенты Chemother
2011
;55
:4943
–60
.16Emmerson
AM
,Jones
AM
.Хинолоны: десятилетия разработки и использования
.J Antimicrob Chemother
2003
;51
Доп. S1
:13
–20
,17Гринвуд
D
.Микробиологические свойства тейкопланина
.J Antimicrob Chemother
1988
;21
;Дополнение A
:1
–13
,18Gould
FK
.Линезолид: безопасность и эффективность в особых группах населения
.J Antimicrob Chemother
2011
;66
Suppl 4
:3
–6
,19Eisenstein
BI
,Oleson
FB
,Balz
RH
.Даптомицин: от горы до клиники при существенной помощи Фрэнсиса Талли, MD
.Clin Infect Dis
2010
;50
Suppl 1
:10
–5
.20Greer
ND
.Тигециклин (Tygacil): первый антибиотик из класса глицилциклинов
.Proc Bayl Univ Med Cent
2006
;19
:155
–61
.21Жанель
CG
,Chung
P
,Зеленицкий
S
и др. .Цефтолозан / тазобактам: новая комбинация ингибиторов цефалоспорин / β-лактамаз, обладающая активностью против грамотрицательных бацилл с множественной лекарственной устойчивостью
.Лекарственные препараты
2014
;74
:31
–51
.© Автор, 2016. Опубликовано Oxford University Press от имени Британского общества антимикробной химиотерапии.Все права защищены. Для получения разрешений обращайтесь по электронной почте: [email protected]
.История разработки антибиотиков – Антибиотики – ReAct
Краткая история разработки антибиотиков как лекарств
1928: Александр Флеминг открыл первый антибиотик – пенициллин. Однако прошло более десяти лет, прежде чем пенициллин стал применяться для лечения бактериальных инфекций
1930-е годы: Первым коммерчески доступным антибактериальным средством был пронтозил, сульфонамид, разработанный немецким биохимиком Герхардом Домагком.
1945: Пенициллин широко применялся для лечения бактериальных инфекций. Это стало возможным благодаря работе Флори и Чейна, которым удалось эффективно очистить антибиотик и увеличить производство. Введение пенициллина положило начало так называемой «золотой эре» антибиотиков
1940-1962: Золотая эра антибиотиков. Большинство классов антибиотиков, которые мы используем сегодня в качестве лекарств, были открыты и представлены на рынке.Каждый класс обычно содержит несколько антибиотиков, которые были обнаружены с течением времени или являются модифицированными версиями предыдущих типов. Например, существует множество β-лактамов (произносится как бета-лактамы), таких как различные пенициллины и цефалоспорины.
Отсутствие новых антибиотиков
Сегодня в разработке очень мало новых антибиотиков. В то же время устойчивые к антибиотикам бактерии, которые выживают после лечения антибиотиками, становятся все более и более распространенными, что делает доступные антибиотики неэффективными.Таким образом, мы неизбежно сталкиваемся с серьезной проблемой со здоровьем. Подробнее о проблемах с открытием и разработкой антибиотиков читайте в разделе «Как мы здесь оказались?» – Несколько антибиотиков в стадии разработки.
Избранные ресурсы
| Ресурс | Описание |
| Сайт изучения устойчивости к противомикробным препаратам – Исторические перспективы | Сайт курса .Исторический обзор лечения бактериальных заболеваний с древних времен до эпохи до антибиотиков, вплоть до открытия и разработки антибиотиков. Включает видео / документальные фильмы. Прокрутите вниз, чтобы получить доступ к учебным модулям «Эра до антибиотиков» и «Золотой век антибиотиков и синтетических антибактериальных препаратов». |
| Антибиотики и устойчивость к бактериям в 21 веке | Журнальная статья , в которой описаны подходы к разработке антибактериальных средств и история установленных классов антибиотиков. |
История антибиотиков | Общество микробиологов
Антибиотики использовались на протяжении тысячелетий для лечения инфекций, хотя до прошлого века или около того люди не знали, что инфекции вызываются бактериями. Различные формы плесени и экстракты растений использовались для лечения инфекций некоторыми из самых ранних цивилизаций – например, древние египтяне прикладывали заплесневелый хлеб к инфицированным ранам. Тем не менее, до 20 века инфекции, которые мы теперь считаем несложными для лечения, такие как пневмония и диарея, вызываемые бактериями, были причиной номер один смерти людей в развитом мире.
Только в конце 19 века ученые начали наблюдать за действием антибактериальных химикатов. Пауль Эрлих, немецкий врач, заметил, что некоторые химические красители окрашивают одни бактериальные клетки, но не окрашивают другие. Он пришел к выводу, что в соответствии с этим принципом должна быть возможность создавать вещества, которые могут избирательно убивать определенные бактерии, не нанося вреда другим клеткам. В 1909 году он обнаружил, что химическое вещество под названием арсфенамин является эффективным средством лечения сифилиса. Это стало первым современным антибиотиком, хотя сам Эрлих назвал свое открытие «химиотерапией» – использование химического вещества для лечения болезни.Слово «антибиотики» было впервые использовано более 30 лет спустя украинско-американским изобретателем и микробиологом Сельманом Ваксманом, который за свою жизнь открыл более 20 антибиотиков.
Александр Флеминг, кажется, был немного беспорядочным в своей работе и случайно открыл пенициллин. Вернувшись из отпуска в Саффолке в 1928 году, он заметил, что грибок Penicillium notatum заразил культуральную чашку с бактериями Staphylococcus , которые он случайно оставил непокрытыми.Грибок создал зоны, свободные от бактерий, везде, где он рос на пластине. Флеминг изолировал и вырастил плесень в чистой культуре. Он обнаружил, что P. notatum оказался чрезвычайно эффективным даже при очень низких концентрациях, предотвращая рост Staphylococcus даже при 800-кратном разведении, и был менее токсичен, чем дезинфицирующие средства, используемые в то время.
После первых испытаний по лечению человеческих ран сотрудничество с британскими фармацевтическими компаниями обеспечило массовое производство пенициллина (химического антибиотика, производимого компанией P.notatum ) было возможно. После пожара в Бостоне, штат Массачусетс, США, в результате которого погибло около 500 человек, многие выжившие получили кожные трансплантаты, которые подвержены заражению Staphylococcus . Лечение пенициллином было чрезвычайно успешным, и правительство США начало поддерживать массовое производство этого препарата. Ко дню «Д» в 1944 году пенициллин широко использовался для лечения военнослужащих от инфекций как в полевых условиях, так и в больницах по всей Европе. К концу Второй мировой войны пенициллин получил прозвище «чудо-лекарство» и спас много жизней.
Ученые из Оксфорда сыграли важную роль в развитии процесса массового производства, а Ховард Флори и Эрнст Чейн разделили Нобелевскую премию по медицине 1945 года с Александром Флемингом за их роль в создании первого массового производства антибиотика.
Антимикробный агент – обзор
14.8 РАЗЛИЧНЫЕ ПРОТИВОМИКРОБНЫЕ ПРОЦЕДУРЫ
Хотя различные типы противомикробных препаратов использовались веками, за последние сорок лет или около того все больше потребителей стали обращать внимание на антимикробные препараты для напольных покрытий.Различные компании продают ковровой промышленности несколько типов противомикробных препаратов для борьбы с бактериями и грибками.
С химической точки зрения, в ковровых покрытиях используются три основных химических состава. Это органо-фенолы, органо-силаны и металлоорганические соединения. Их также можно комбинировать друг с другом.
Некоторыми из различных типов противомикробных средств, которые используются в ковровой промышленности, являются оксид бис (три-н-бутилолова), 5-хлор-2- (2,4-дихолорфенокси) фенол (триклозан, трихлортриоксидифенол), 10, 10-оксибисфеноксарин (OBPA), 1,2-бензизотизолин-3-он, 3-триметоксисилилпропилдиметилоктадециламмонийхлорид или бис (1-гидрокси-2 (1H) -пиридинтионато-O, S- (T-4) цинк (пиритион цинка) ).
Morton International произвела два противомикробных препарата. Это были Vinyzene ® и Durotex ® . Химический состав был OBPA или комбинацией OBPA и металлоорганических соединений. Материал OBPA был очень эффективным противомикробным средством широкого спектра действия, используемым в течение многих лет, пока общественность не подняла озабоченность по поводу мышьякового компонента его химической структуры; его использование было сокращено.
Sanitized ® и Dow Corning производили четвертичные силан-органосилиеновые соединения.Продукция Dow Corning называлась Sylgard ® . Активным ингредиентом Сильгарда был хлорид 3-триметоксилсилилпропилдиметилоктадециламмония. Аналогичный продукт от Sanitized назывался Requat ® . Dow Corning продает свои противомикробные препараты, такие как Sylgard, через AEGIS Environmental Management. Теперь продукция продается под торговой маркой AEGIS Microbe-Shield. Clariant продает противомикробное средство под торговой маркой Sanitized. Bioshield Technologies продает продукт на основе четвертичного силикона под торговой маркой Bioshield.Эти продукты обычно наносят на волокна местно. Компания Interface Flooring продает фосфатированный амин под названием Intersept ® в качестве антимикробного покрытия для своих ковровых покрытий.
Несколько компаний продали противомикробные препараты на основе Irgasan DP300 ® (5-хлор-2- (2,4-дихолорфенокси) фенол) компании Ciba-Geigy и Irgagard ® . Эти компании и торговые марки их противомикробных препаратов включают Clariant ® (Sanitized), Microban Products Company (Microban ® ), Thomson Research Associates (Ultra-Fresh ® ) и Vikon Chemicals (Vikol THP ® ). .
Arch Chemicals производила продукты под названием цинк-омадин ® и натрий-омадин ® . Активные ингредиенты – пиритион цинка и пиритион натрия соответственно.
Подробное обсуждение всех возможных противомикробных препаратов в этом тексте нецелесообразно из-за задействованной микробиологии. Дополнительную информацию можно найти в литературе производителей.
Развивающаяся реакция на устойчивость к антибиотикам (1945–2018 гг.)
В том же году, как будто непосредственно решая такие опасения относительно необходимости скоординированных политических действий, Дам Салли Дэвис, главный врач Великобритании, опубликовала основной отчет о «Инфекции и рост устойчивости к противомикробным препаратам», в котором говорится, что «[t] в Великобритании существует потребность в том, чтобы сделать устойчивость к противомикробным препаратам одной из основных проблемных областей, включив ее в национальный реестр рисков … и также побуждая к действиям на международном уровне. как в местных службах здравоохранения »(Дэвис, 2013, стр.16 [в оригинале выделено жирным шрифтом]). Такую просьбу подкрепляло ее более яркое (и часто цитируемое) последующее предупреждение: «Устойчивость к противомикробным препаратам – это бомба замедленного действия не только для Великобритании, но и для всего мира. Нам необходимо работать со всеми, чтобы гарантировать, что апокалиптический сценарий широко распространенной устойчивости к противомикробным препаратам не станет реальностью. Это угроза, которая, возможно, не менее важна для мира, чем изменение климата »(там же). Признавая как использование, так и потенциальные недостатки такой апокалиптической риторики, Дэвис и ее коллеги позже предсказали, что, если устойчивость к противомикробным препаратам останется неконтролируемой, «уровень смертности, связанной с инфекциями, может возрасти до уровня, сопоставимого с уровнем викторианской эпохи» (Fowler et al., 2014; Shallcross et al., 2015).
Устойчивость к противомикробным препаратам, таким образом, строилась не столько вокруг нынешнего бремени болезни, сколько в рамках логики предвосхищения грядущей чрезвычайной ситуации, катастрофического будущего, которое мы сами можем создать или уничтожить, в зависимости от нашего нынешнего выбора. Не случайно Дэвис решил сравнить устойчивость противомикробных препаратов к изменению климата, и такие прогнозируемые варианты будущего являются одновременно перформативными и генеративными в их построении и применении (Brown and Michael, 2003; Podolsky and Lie, 2016).В самом деле, усилия Дэвиса ознаменовали еще один поворотный момент в повышении глобальной обеспокоенности по поводу сопротивления (и в ответ на него). В том же году, когда она выпустила свой отчет, Центры по контролю за заболеваниями США выпустили свой собственный отчет «Угрозы устойчивости к антибиотикам в Соединенных Штатах, 2013 г.», обратив внимание на такие новые приоритетные патогены, как устойчивые к карбапенемам Enterobacteriaceae (CRE) и множественные лекарственные препараты. Устойчивый Acinetobacter, который сопровождает такие хорошо известные патогены, как MRSA, гонококки с лекарственной устойчивостью и туберкулез с множественной лекарственной устойчивостью, становится новым лицом устойчивости к противомикробным препаратам в технических и популярных отчетах (Центры по контролю за заболеваниями, 2013).К 2015 году США опубликуют свой собственный Национальный план действий по борьбе с устойчивыми к антибиотикам бактериями, сигнализируя о необходимости усиления координации между агентствами США и расширения сотрудничества таких агентств как с промышленными, так и с международными партнерами (2015).
Группы, подобные CDDEP, обращали постоянное внимание на связанную, глобальную экологию потребления антибиотиков и устойчивости к ним, отмечая рост потребления антибиотиков во всем мире на 35% в период с 2000 по 2010 год, причем 76% этого роста пришлось на Бразилию, Россию, Индия, Китай и Южная Африка (Van Boeckel et al., 2014). В то же время CDDEP и другие участники обратили внимание на необходимость сохранения или улучшения доступа к антибиотикам в развивающихся странах, в то же время следует избегать ненадлежащего использования или избытка (Ǻrdal et al., 2016 ). В этом контексте в 2015 году, в том же году, когда Организация Объединенных Наций (ООН) объявила о своих целях в области устойчивого развития (включая искоренение нищеты и голода), которые должны быть достигнуты к 2030 году, ВОЗ выпустила свой собственный «Глобальный план действий по устойчивости к противомикробным препаратам. »Через год после выпуска« Глобального отчета по эпиднадзору за [устойчивостью к противомикробным препаратам] »(ВОЗ, 2014 г .; то же самое, 2015 г.).Как заявила Генеральный директор ВОЗ Маргарет Чен в предисловии к Глобальному плану действий: «Устойчивость к противомикробным препаратам – это кризис, с которым необходимо бороться в срочном порядке. Сейчас, когда мир вступает в новую амбициозную эру устойчивого развития, мы не можем допустить, чтобы с трудом заработанные достижения в области здравоохранения были сведены на нет из-за неэффективности наших основных лекарственных средств »(ВОЗ, 2015, предисловие). Устойчивость к противомикробным препаратам должна рассматриваться как общая проблема многих государств-членов ВОЗ, предполагающая как действия отдельных государств, так и более скоординированные усилия в отношении улучшения образования и эпиднадзора, улучшения санитарных условий и профилактики инфекций, сокращения ненужного использования противомикробных препаратов как в человеческом, так и в сельскохозяйственном секторе. секторов, а также устойчивые инвестиции в новые средства диагностики и лечения.В то же время, признавая необходимость подхода «единого здоровья» к устойчивости к противомикробным препаратам, ВОЗ заявила о своем намерении на постоянной основе сотрудничать как с Продовольственной и сельскохозяйственной организацией (ФАО), так и с Всемирной организацией здравоохранения животных (МЭБ), чтобы достичь таких целей.
Этот акцент на сотрудничестве и совместной ответственности вскоре сопровождался повышенным вниманием к глобальному прогнозированию экономических последствий УПП. Хотя это не совсем новая проблема (как отмечалось выше, она была кратко отмечена в собственном докладе ВОЗ о Глобальной стратегии 2001 г., а до этого – в ее «Рабочем документе» 1994 г., а также подчеркнута в докладе Всемирного экономического форума 2013 г. «Опасности»). высокомерия в отношении здоровья человека »; см. Всемирный экономический форум 2013), такие последствия приобрели дополнительную значимость, если представить их вместе с U.Цели устойчивого развития Н. Они послужили мощным экономическим обоснованием и обоснованием безопасности для борьбы с устойчивостью к противомикробным препаратам для тех политиков, которые еще не были достаточно обеспокоены возможным возвращением только к медицине викторианской эпохи. И снова Великобритания взяла на себя инициативу, представив в 2016 году «Обзор устойчивости к противомикробным препаратам» под председательством экономиста Джима О’Нила, в котором прогнозируется, что, если не будут приняты меры по предотвращению траектории развития устойчивости к противомикробным препаратам, глобальные экономические издержки к 2050 году достигнут 100. триллионов долларов США, что сопровождается потерей 10 миллионов жизней в год (O’Neill et al., 2016). За отчетом О’Нила в начале 2017 г. последует собственный отчет Всемирного банка «Инфекции, устойчивые к лекарственным препаратам: угроза нашему экономическому будущему», который дополняет отчет О’Нила, утверждая, что неконтролируемая устойчивость к противомикробным препаратам может привести к годовому показателю 3,8. % глобальных потерь ВВП к 2050 году, что равняется 3,4 трлн долларов в год к 2030 году, при этом беднейшие страны пострадают больше всего и представляют прямую угрозу для достижения целей глобального развития (Jones et al., 2017). И снова логика предвосхищения глобального экономического спада помогла еще больше усилить опасения по поводу воздействия неконтролируемой устойчивости к противомикробным препаратам.
В этом контексте повышенного внимания к взаимосвязанным последствиям устойчивости к противомикробным препаратам для здоровья и экономики ООН в сентябре 2016 г. созвала заседание Генеральной Ассамблеи высокого уровня, посвященное устойчивости к противомикробным препаратам, и только в четвертый раз такое совещание. был явно сосредоточен на проблеме здоровья. Последующая «Политическая декларация» ООН подтвердила цели глобального плана действий ВОЗ и подтвердила необходимость координации между ВОЗ, ФАО и МЭБ, а также взаимосвязь устойчивости к противомикробным препаратам и ее собственных целей устойчивого развития (Президент Генеральной Ассамблеи, 2016 г.).ООН учредила Специальную межучрежденческую координационную группу (IACG) по устойчивости к противомикробным препаратам с участием высокого уровня; и хотя действия ООН до этого момента не имели никакого отношения к международному договору или даже прямому координирующему органу (о таких стремлениях см. Ǻrdal et al., 2016), они, похоже, выполнили задачу IACG «отстаивать и выступать за действия против УПП на самом высоком политическом уровне »и привлечь внимание и финансирование к тем, кто поставил перед собой задачу предотвратить наступление постантибиотической эры (Межучрежденческая координационная группа по устойчивости к противомикробным препаратам, 2017).
Такие «действия против УПП» в соответствии с таксономией почти каждого крупного отчета об устойчивости к противомикробным препаратам подразделяются на три широкие категории: усиление эпиднадзора и фактический подсчет использования и устойчивости к противомикробным препаратам, сокращение случаев устойчивости к противомикробным препаратам и увеличение числа случаев поставка новых противомикробных препаратов. Что касается надзора, недостаточная финансовая поддержка, стандартизация и координация которого долгое время считались недостающими элементами надлежащего глобального надзора, финансирование было увеличено через такие благотворительные группы, как Wellcome Trust и Фонд Билла и Мелинды Гейтс, в то время как усилия по координации под руководством Глобальной системы эпиднадзора за антимикробными препаратами ВОЗ (GLASS), запущенной в 2015 году (Wellcome Trust, 2015; Wellcome Trust, 2017; Всемирная организация здравоохранения, 2017; Mayor, 2018).Хотя на данный момент в программе GLASS участвуют менее трети стран-членов ВОЗ, ВОЗ, похоже, считает, что окно наблюдения наполовину заполнено и находится на «ранней стадии реализации» программы.
Усилия по сокращению спроса на противомикробные препараты основывались на широком спектре усилий, направленных на сокращение использования и чрезмерного использования противомикробных препаратов, начиная от санитарных и вакцинационных мер и заканчивая снижением заболеваемости самой инфекцией, посредством просвещения и регулирования населения, а также медицинских и ветеринарных профессий в отношении назначения противомикробных препаратов (и связанных с этим усилий по разработке улучшенной диагностики для поддержки более рациональной терапии), к дальнейшим попыткам сокращения использования антибиотиков в агробизнесе во всем мире (Laxminarayan et al., 2016; Пульчини и др., 2018; Всемирная организация здравоохранения, 2018 г.). Это остается широкой серией мер, охватывающих разнородный круг глобальных игроков, привлекающих дополнительное внимание к самим структурам повседневной жизни и медицинского обслуживания и их взаимосвязи с устойчивостью к противомикробным препаратам (Laxminarayan and Chaudhury, 2016; Alvarez-Uria et al., 2016 ).
В отличие от мероприятия, посвященного таким разрозненным мерам по сокращению спроса на антибиотики и их использования, возможно, наибольшее внимание – и финансирование – было направлено на увеличение будущих поставок антибиотиков.Меры, пропагандируемые для стимулирования промышленности к возобновлению производства антибиотиков, были описаны как механизмы «выталкивания» или «вытягивания». Механизмы «проталкивания» предполагают государственную или благотворительную поддержку разработки антибиотиков на ранней стадии и простираются от такой относительно давней поддержки, как та, которая предоставляется Управлением передовых биологических исследований и разработок США (BARDA), до таких более поздних инициатив, как «Борьба с устойчивыми к антибиотикам бактериями». Pharmaceutical Accelerator (CARB-X, финансируется BARDA и Wellcome Trust) и Глобальным партнерством по исследованиям и разработкам антибиотиков (GARDP, совместная инициатива Инициативы по лекарствам от забытых болезней и ВОЗ).Механизмы «вытягивания» влекут за собой более радикальную переосмысление самой модели возмещения затрат на антибиотики, которые традиционно продаются (действительно, в прибыльные 1950-е годы, закладывая саму основу современного фармацевтического маркетинга) и возмещаются в зависимости от объема продаж. Такие группы, как DRIVE-AB (финансируемая Инициативой инновационных лекарственных средств) и Центр политики здравоохранения Дьюка-Марголиса, с частично совпадающими ключевыми членами, обратили внимание на необходимость новых моделей финансирования, в которых вознаграждение не связано (в различной степени) с объем продаж антибиотиков, а также включение различных элементов начальных наград (в идеале, пропорциональных стоимости препарата) и обязательных усилий по управлению (Ǻrdal et al.
