закончить уравнение реакций онлайн калькулятор
Вы искали закончить уравнение реакций онлайн калькулятор? На нашем сайте вы можете получить ответ на любой математический вопрос здесь. Подробное решение с описанием и пояснениями поможет вам разобраться даже с самой сложной задачей и ионное уравнение онлайн, не исключение. Мы поможем вам подготовиться к домашним работам, контрольным, олимпиадам, а так же к поступлению в вуз. И какой бы пример, какой бы запрос по математике вы не ввели – у нас уже есть решение. Например, «закончить уравнение реакций онлайн калькулятор».
Применение различных математических задач, калькуляторов, уравнений и функций широко распространено в нашей
жизни. Они используются во многих расчетах, строительстве сооружений и даже спорте. Математику человек
использовал еще в древности и с тех пор их применение только возрастает. Однако сейчас наука не стоит на
месте и мы можем наслаждаться плодами ее деятельности, такими, например, как онлайн-калькулятор, который
может решить задачи, такие, как закончить уравнение реакций онлайн калькулятор,ионное уравнение онлайн,ионное уравнение онлайн калькулятор,ионное уравнение решить онлайн,ионное уравнение составить онлайн,ионные уравнения онлайн решение,ионные уравнения решение онлайн,калькулятор ионных уравнений,калькулятор коэффициентов онлайн химия,калькулятор коэффициентов химия онлайн,калькулятор овр онлайн,калькулятор онлайн уравнений по химии,калькулятор уравнений по химии,калькулятор уравнений по химии онлайн,калькулятор уравнений реакций,калькулятор уравнения по химии онлайн,калькулятор хим уравнений онлайн,калькулятор химических уравнений онлайн,калькулятор химических уравнений онлайн с решением,калькулятор химических уравнений онлайн с решением в полном виде,коэффициенты онлайн,метод полуреакций онлайн решение калькулятор,молекулярное уравнение онлайн,молекулярные уравнения онлайн,овр калькулятор онлайн,овр онлайн калькулятор,овр онлайн решение,окислительно восстановительные реакции решение онлайн,онлайн калькулятор ионное уравнение,онлайн калькулятор коэффициентов химия,онлайн калькулятор по химии уравнения,онлайн калькулятор уравнений по химии,онлайн калькулятор уравнения по химии,онлайн коэффициенты,онлайн овр решить,онлайн расставление коэффициентов,онлайн решатель химических уравнений,онлайн решение ионных уравнений,онлайн решение уравнений по химии,онлайн решение уравнений химия,онлайн решение хим уравнений,онлайн решение химический уравнений,онлайн решения уравнений по химии,онлайн решить овр,онлайн решить уравнение по химии,онлайн решить уравнения по химии,расставление коэффициентов онлайн,решатель уравнений по химии,решатель уравнений химических онлайн,решатель химических уравнений онлайн,решать химические уравнения онлайн,решение ионных уравнений онлайн,решение онлайн ионных уравнений,решение уравнение реакции онлайн,решение уравнений онлайн по химии,решение уравнений онлайн химия,решение уравнений химия онлайн,решение хим уравнений онлайн,решение химический уравнений онлайн,решение химических уравнений онлайн,решения уравнений онлайн по химии,решения химических уравнений онлайн,решить ионное уравнение онлайн,решить овр онлайн,решить онлайн ионное уравнение,решить онлайн уравнения по химии,решить уравнение онлайн по химии онлайн,решить уравнение онлайн химия,решить уравнение по химии онлайн,решить уравнение по химии онлайн бесплатно,решить уравнение химия онлайн,решить уравнения химические онлайн,решить химические уравнения онлайн,решить химическое уравнение онлайн,составление ионных уравнений онлайн,составление хим уравнений онлайн,уравнение реакции онлайн решение,уравнение реакции решение онлайн,уравнения молекулярные онлайн,уравнения онлайн калькулятор по химии,химические уравнения онлайн калькулятор,химические уравнения онлайн решить,химический калькулятор онлайн,химический калькулятор уравнений,химическое уравнение онлайн решение,химия калькулятор уравнений,химия онлайн решение уравнений,химия онлайн решения уравнений,химия онлайн решить уравнение,химия решение уравнений онлайн,химия решить уравнение онлайн,хімічні рівняння онлайн розв язок.
Где можно решить любую задачу по математике, а так же закончить уравнение реакций онлайн калькулятор Онлайн?
Решить задачу закончить уравнение реакций онлайн калькулятор вы можете на нашем сайте https://pocketteacher.ru. Бесплатный онлайн решатель позволит решить онлайн задачу любой сложности за считанные секунды. Все, что вам необходимо сделать – это просто ввести свои данные в решателе. Так же вы можете посмотреть видео инструкцию и узнать, как правильно ввести вашу задачу на нашем сайте. А если у вас остались вопросы, то вы можете задать их в чате снизу слева на странице калькулятора.
Решение задач по уравнениям химических реакций
Похожие презентации:
Окислительно-восстановительные реакции. Химическое равновесие
Химическое равновесие
Расчеты по химическим уравнениям. 8 класс
Химические уравнения
Расчеты по химическим уравнениям. Алгоритм решения расчетных задач
Химические реакции
Расчеты по химическим уравнениям
Основы химической термодинамики
Основные химические понятия
Скорость химических реакций. Катализ. Химическое равновесие
Закономерности химических реакций. (Лекция 3)
8 класс.
РЕШЕНИЕ ЗАДАЧ
ПО УРАВНЕНИЯМ ХИМИЧЕСКИХ РЕАКЦИЙ
Основные физические величины
8 класс.
№
Содержание
Ответ, пример
1
Относительная атомная масса меди
Ar (Cu) = 64
2
Относительная молекулярная масса Na2O
Mr (Na2O) = 62
3
Единицы измерения количества вещества
4
Мr [ г/моль]
5
Единицы измерения молярной массы
вещества
Молярная масса кислорода O2
M (O2) = 32 г/моль
6
Обозначение массы вещества
m [г]
7
Формула для расчёта массы вещества
m = M ×n
8
Числовое значение молярного объёма
22,4 л/моль
9
Формула для расчёта объёма вещества
V = Vm × n
8 класс
1.
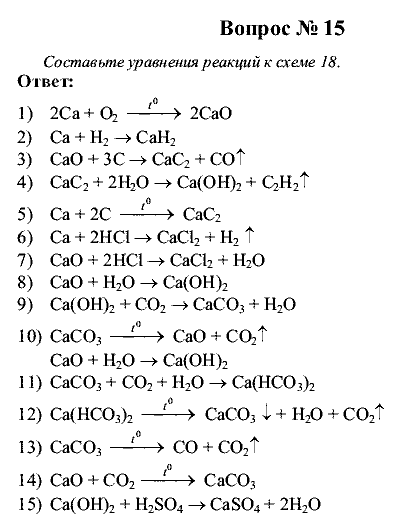 Нахождение количества одного вещества по количеству другого
Нахождение количества одного вещества по количеству другоговещества: n1 → n2
Дано:
n (O2) = 4 моль
Найти:
n (h3O) = ?
Решение
1. Записываем уравнение реакции. Обозначаем
количества веществ, о которых идёт речь:
x моль
2h3 + O2 = 2h3O
1 моль
2 моль
2. Составляем пропорцию и решаем её:
4/1=x/2
x = 8 моль
8 класс
2. Нахождение массы (объёма) одного вещества по количеству
другого вещества: n1 → m2 (n2)
Дано:
n (O2) = 4 моль
Найти:
m (h3O) = ?
Решение
1. Записываем уравнение реакции. Обозначаем
количества веществ, о которых идёт речь:
4 моль
x моль
2h3 + O2 = 2h3O
1 моль
2 моль
2. Составляем пропорцию и решаем её:
4/1=x/2
x = 8 моль (это количество h3O)
3. По формуле вычисляем неизвестную массу (объём)
вещества:
m(h3O)= n × M = 8 × ….. = ….. г
8 класс
3. Нахождение количества одного вещества по массе (объёму)
Дано:
V(O2) = 44,8 л
Найти:
n (h3O) = ?
Решение
1.
 По формуле вычисляем количество вещества по
По формуле вычисляем количество вещества поизвестной массе (объёму):
n (O2)= V / VM = 44,8 / ….. = ….. моль
2. Записываем уравнение реакции. Обозначаем
количества веществ, о которых идёт речь:
… моль
x моль
2h3 + O2 = 2h3O
1 моль
2 моль
3. Составляем пропорцию и решаем её:
…/1=x/2
x = …. моль (это количество h3O)
8 класс
4. Нахождение массы (объёма) одного вещества по массе (объёму)
другого вещества: m1 (n 1) →
V(O2) = 44,8 л
Найти:
m (h3O) = ?
m2 (n2)
Решение
1. По формуле вычисляем количество вещества по
известной массе (объёму):
n (O2)= V / VM = 44,8 / ….. = ….. моль
2. Записываем уравнение реакции. Обозначаем
количества веществ, о которых идёт речь:
… моль
x моль
2h3 + O2 = 2h3O
1 моль
2 моль
3. Составляем пропорцию и решаем её:
…/1=x/2
x = …. моль (это количество h3O)
4. По формуле вычисляем неизвестную массу (объём)
вещества:
m(h3O)= n × M = ….
 × ….. = ….. г
× ….. = ….. г8 класс
СХЕМА ДЛЯ РЕШЕНИЯ ЗАДАЧ ПО УРАВНЕНИЮ РЕАКЦИИ
Дано:
Найти:
n1
n1
m2
По уравнению реакции
n1
n2
(пропорция)
… моль
x моль
2h3 + O2 = 2h3O
1 моль
2 моль
X = ….. × 2 / 1 (моль)
English Русский Правила
Калькулятор емкости буфера| Как рассчитать буферную емкость?
Калькулятор емкости свободного буфера позволяет узнать, насколько буфер будет сопротивляться быстрому изменению рН. Укажите количество кислоты или щелочи, начальное значение рН и конечное значение рН в полях ввода инструмента и нажмите кнопку расчета, чтобы быстро проверить буферную емкость.
Калькулятор емкости буфера: Этот инструмент обеспечивает точное значение емкости буфера для заданных деталей за меньшее время. Читайте дальше, чтобы узнать, как рассчитать буферную емкость раствора, формулу буферной емкости, примеры вопросов и многое другое. Прочитайте всю статью, чтобы получить ценную информацию о буферах, емкости буфера.
Ознакомьтесь с инструкциями по определению емкости буфера раствора. Следуйте этим принципам, чтобы легко получить результат.
- Знать начальный рН, конечный рН кислот.
- В противном случае используйте уравнение Хендерсона–Хассельбаха, чтобы получить значение pH.
- Получите изменение pH путем вычитания конечного pH из начального pH.
- Разделите количество молей кислоты или основания, добавленных на литр раствора, на изменение pH, чтобы получить значение буферной емкости.
Прежде чем узнать о буферной емкости, нам нужно знать, что такое pH, как его узнать и какой буфер. pH – это количество кислой / щелочной воды, и мы можем вычислить значение pH химического раствора с помощью уравнения Хендерсона-Хассельбаха.
Буфер представляет собой раствор, представляющий собой комбинацию либо слабой кислоты с ее солью, либо слабого основания с ее солью, он устойчив к изменениям рН. Они используются для поддержания стабильного pH.
Буферная емкость означает величину устойчивости буферного раствора к изменению pH после добавления H + или ионы ОН – . Буферная емкость и начальный рН влияют на изменение рН после добавления кислотно-основного. Более концентрированные буферы будут иметь более высокую емкость, потому что в них больше молекул для взаимодействия с дополнительными основаниями или кислотами. Таким образом, буфер с более высокой концентрацией имеет более медленное изменение рН.
Буферная емкость и начальный рН влияют на изменение рН после добавления кислотно-основного. Более концентрированные буферы будут иметь более высокую емкость, потому что в них больше молекул для взаимодействия с дополнительными основаниями или кислотами. Таким образом, буфер с более высокой концентрацией имеет более медленное изменение рН.
Величина буферной емкости раствора может быть получена путем деления числа молей кислоты/основания на добавленное количество на литр буферного раствора при изменении рН.
Уравнение буферной емкости: β = n/ΔpH
Где
β – буферная емкость
n – количество молей кислоты или основания, добавленных на литр буферного раствора
pH
ΔpH = конечный pH – начальный pH
Уравнение Хендерсона–Хассельбаха pH = pK a + log 10 ([A – ]/[HA])
Здесь,
[A 9002 ] – концентрация основания в буфере
[HA] – концентрация кислоты в буфере
pK a – константа диссоциации кислоты
Пример:
буферного раствора так, чтобы его рН был равен 4? Определите рН этого буфера, чтобы иметь максимальную буферную емкость? Ка муравьиной кислоты составляет 1,8 х 10 -4 .
Ответ:
Учитывая, что
Ка муравьиной кислоты = 1,8 x 10 -4
pH = pKa + log[соль] / [кислота]
4 = -log(1,8 x 10 -4 ) + log[формиат]/[муравьиная кислота]
4 = 3,74 + log [формиат]/[муравьиная кислота]
log[формиат]/[муравьиная кислота] = 4 – 3,74
= 0,26
[формиат]/[муравьиная кислота] = 1,8
Буферная емкость будет максимальной вблизи pKa кислоты.
pH = pKa = -logKa
= -log(1,8 x 10 -4 )
= 3,74
Следовательно, буферная емкость равна 3,74
Воспользуйтесь помощью этих удобных онлайн-калькуляторов, доступных на нашем веб-сайте Chemistrycalc.Com, для решения различных задач по химии.
1. Определить емкость буфера?
Буферная емкость – это способность раствора противостоять изменениям PH. Раствор может поглощать или испускать ионы H + или OH – .
2. Какие существуют типы буферных растворов?
Какие существуют типы буферных растворов?
Существуют два разных типа буферных растворов: кислотные буферы и щелочные буферы.
3. Как рассчитать буферную емкость?
Найдите начальный и конечный pH с помощью уравнения Хендерсона-Хассельбаха. Вычтите конечный рН из начального значения рН. Разделите количество молей кислоты или основания, добавленных в буферный раствор, на изменение рН, чтобы получить буферную емкость.
4. Каково хорошее значение емкости буфера?
Буферная емкость в диапазоне от 0,01 до 0,1 используется для некоторых фармацевтических растворов. Так что это хорошая буферная емкость.
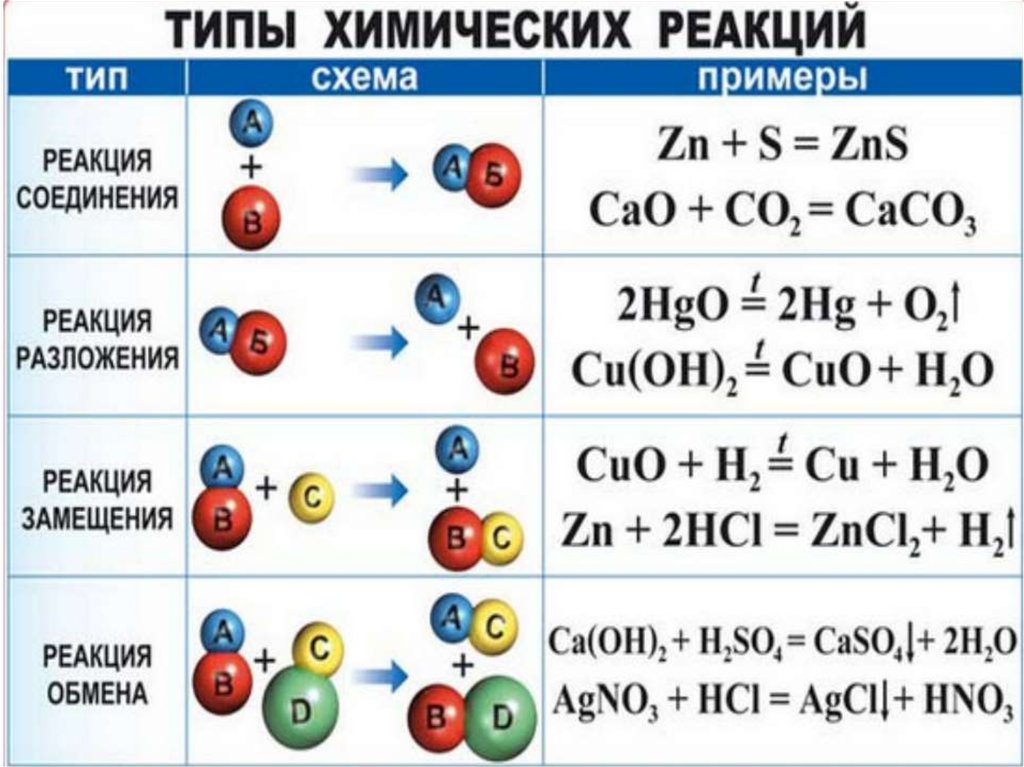
Онлайн-калькулятор: Балансировщик химических реакций
Учеба Химия
Этот онлайн-калькулятор балансирует уравнения химических реакций алгебраическим методом.
Существует несколько методов уравновешивания химических уравнений:
- Метод проверки или метод «проб и ошибок»
- Алгебраический метод
- Метод, предложенный Arcesio Garcia
- Метод изменения степени окисления
- Ионно-электронный метод или метод полуреакции
Последние два используются для окислительно-восстановительных реакций.
Этот балансировщик химических уравнений использует алгебраический метод, который обычно довольно сложен для ручных вычислений, однако он идеально подходит для компьютерной программы.
Алгебраический метод основан на Законе Сохранения Массы – материя не может быть ни создана, ни уничтожена. Следовательно, количество атомов каждого типа в каждой части химического уравнения должно быть одинаковым. Уравновешивание химических уравнений — это процесс обеспечения сохранения материи. Итак, вам просто нужно создать набор алгебраических уравнений, выражающих количество атомов каждого элемента, участвующих в реакции, и решить его. Поэтому этот метод можно использовать для любого типа химической реакции (включая окислительно-восстановительные реакции).
Позвольте мне проиллюстрировать этот метод на примере.
Рассмотрим реакцию:
Начнем с введения неизвестных коэффициентов:
Затем запишем уравнения баланса для каждого элемента через неизвестные:
Для Fe:
Для Cl:
Для Na:
Для P:
Для O:
Они составят систему линейных уравнений:
Здесь у нас пять уравнений для четырех неизвестных, однако последнее зависит от четвертого, поэтому его можно опустить.
Теперь мы можем переписать эту систему в матричной форме:
Эту систему можно решить методом исключения Гаусса. Конечно, нельзя было ожидать, что количество неизвестных всегда будет равно количеству уравнений. Однако метод исключения Гаусса на самом деле мог найти решение для любого количества уравнений и неизвестных. Я создал специальный калькулятор, реализующий метод исключения Гаусса – /6200/ – в форме, пригодной для химических реакций. Короче говоря, он просто сохраняет все дроби и в конце получает целочисленное решение.
Таким образом, приведенный ниже калькулятор просто анализирует химическую реакцию, создает систему линейных уравнений и передает ее в упомянутый выше калькулятор исключения Гаусса. Затем возвращенное решение используется для отображения сбалансированного уравнения.
Примечание. Всегда используйте верхний регистр для первого символа в имени элемента и нижний регистр для второго символа, как в периодической таблице. Сравните: Co – кобальт и CO – окись углерода.
