Решение задач по химии на Himikatus.ru
Большинство людей, за исключением тех, кто тем или иным образом связал свою жизнь с химией, весьма туманно представляют динамику протекания химических реакций. Это и не мудрено. Процесс обучения, как правило, сводится к заучиванию не всегда понятных формул. Для решения задач этого явно мало. Если ещё учесть, что кроме химии учащиеся изучают и другие предметы, то становится ясно, почему складывается такая ситуация. Желательно, чтобы информация, которая была почерпнута из учебников, подкреплялась наглядными опытами с подробным объяснением. Сие поможет систематизировать полученные знания и разложить их, что называется, по полочкам.
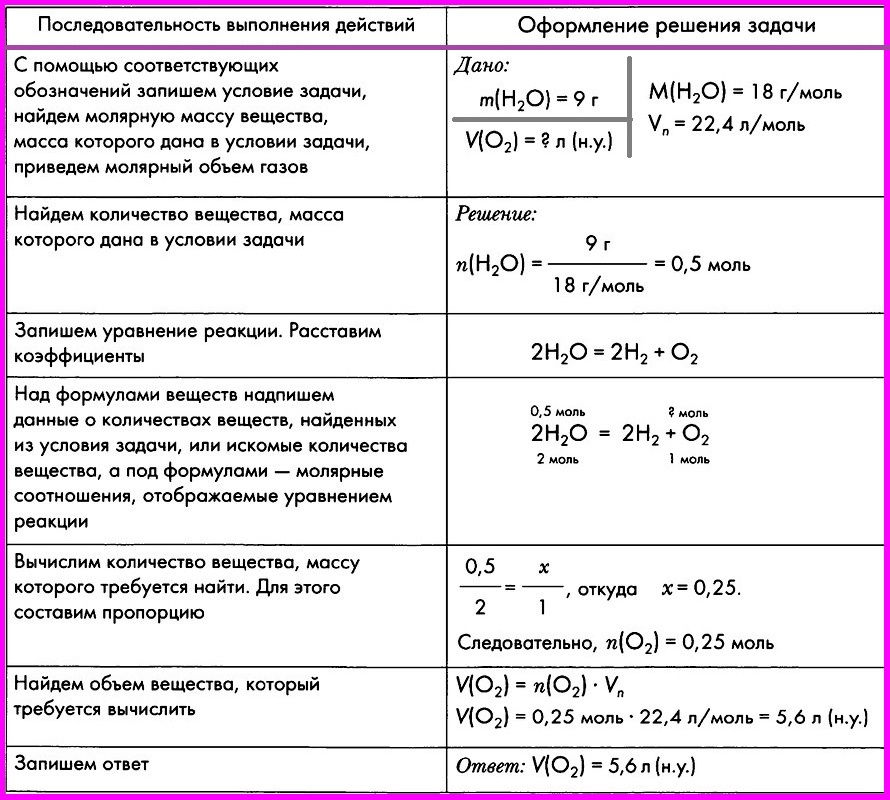
Базой для решения сложных химических задач являются простейшие уравнения, описывающие процесс химической реакции (такие задания есть и в ЕГЭ). Требуется, исходя из известной массы одного из веществ, вступающих в реакцию, рассчитать массу одной из производных реакции.
Инструкция по решению задач
Ознакомление с инструкцией, подробно описывающей решение задач по химии:
- Первым делом необходимо ознакомиться с исходными данными, представленными в условии задачи. Предположим, что 2,7 грамма алюминия добавили в серную кислоту. Нужно вычислить, какова будет масса сульфида алюминия.
- Кратко записываем условие задания.
- Решение задачи требует составления уравнения данной реакции. Серная кислота, взаимодействуя с металлом, образует соль и водород. После записи уравнения расставляются коэффициенты. Внимания к себе требуют только вещества (в нашем случае алюминий и его сульфид) с искомыми и известными данными. Другие вещества в расчётах не участвуют.
- Затем при помощи периодической таблицы Менделеева находится молекулярная масса нужных нам веществ.

- Умножив на 1 г/моль, получим молярную массу.
- Далее записывается основная формула, показывающая связь между массой, количеством вещества и молярной массой.
- Потом, основываясь на наших значениях и опираясь на основную формулу, производится расчёт.
- Наступило время решения пропорции, где количество сульфида алюминия, измеряемое в молях – это X.
- Исходя из количества и молярной массы (нам уже известных) находится масса сульфида алюминия.
- Теперь по подставленным значениям осуществляется расчёт.
- Задача решена. Записываем ответ.
Начинающим изучать химию, всё кажется очень сложным. На самом деле это абсолютно не соответствует действительности. Достаточно только спокойно и вдумчиво подойти к изучению материала, и всё пойдёт как по маслу. К тому же на просторах сети можно отыскать практически всё по интересующему вопросу. Лет двадцать тому назад ситуация была не такая, но всё же люди как-то справлялись. И вы справитесь! Попробуйте, взяв за основу приведённый выше пример, решить аналогичную задачу, но с другими данными. Вскоре формулы запомнятся, и даже решение более сложных задач не будет вызывать никакого труда. Продолжая упражняться, вы почувствуете глубокое понимание предмета, и вполне возможно, что мир обретёт ещё одного великого химика и нобелевского лауреата.
К тому же на просторах сети можно отыскать практически всё по интересующему вопросу. Лет двадцать тому назад ситуация была не такая, но всё же люди как-то справлялись. И вы справитесь! Попробуйте, взяв за основу приведённый выше пример, решить аналогичную задачу, но с другими данными. Вскоре формулы запомнятся, и даже решение более сложных задач не будет вызывать никакого труда. Продолжая упражняться, вы почувствуете глубокое понимание предмета, и вполне возможно, что мир обретёт ещё одного великого химика и нобелевского лауреата.
Литература для дополнительных занятий по химии
В наш информационный век можно без труда найти любую литературу, способную помочь тяготеющим к химии пытливым умам. Но особенно хочется отметить пособие, автором которого является Хомченко Г. П. В нём весь материал изложен просто и без всяких излишних премудростей.
Напоследок хочется сказать, что химия очень захватывающая, полезная и не такая уж скучная наука, как может показаться на первый взгляд.
расчет состава смесей по уравнениям химических реакций
математические методы решения расчетных задач по химии: расчет состава смесей по уравнениям химических реакцийРасчет состава смесей по уравнениям химических реакций
Стандартный
сценарий подобных задач сводится к тому,
что смесь двух веществ реагирует с одним
реагентом. Зная количество
израсходованного реагента (полученного
продукта), и массу смеси веществ, можно
определить доли каждого из веществ.
Возможны несколько усложненные варианты:
например, когда масса смеси веществ
неизвестна, но смесь веществ участвует в
двух реакциях, или когда дана смесь из трех
веществ с известной массой и две серии
реакций. Встречаются задачи, когда смесь из
трех веществ неизвестной массы участвует в
трех сериях реакций.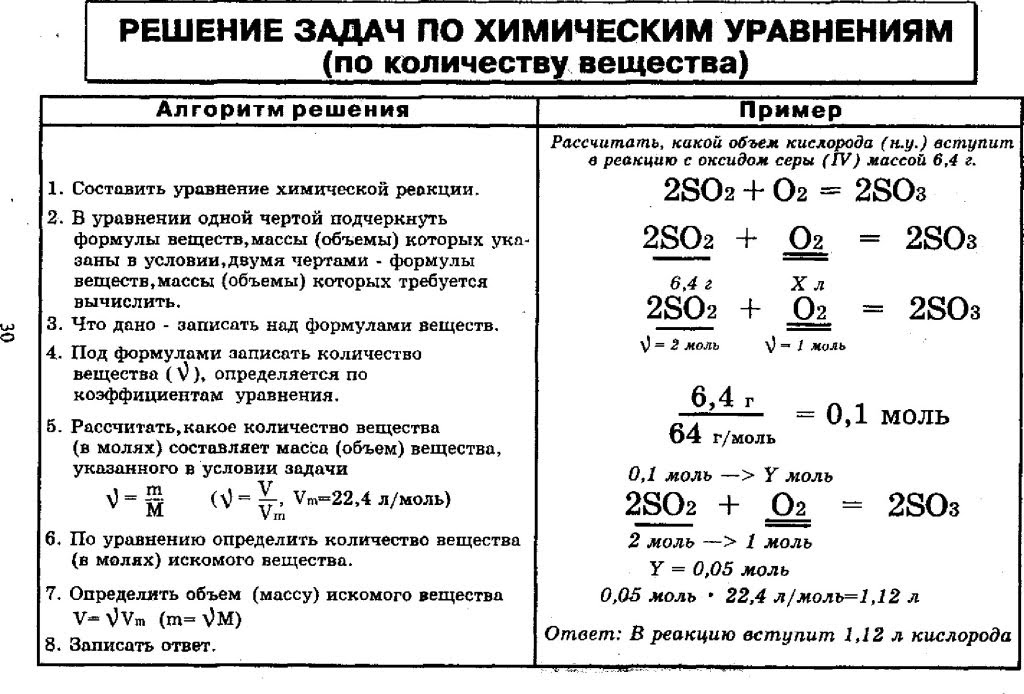
Задача
2.1. В результате
полного восстановления 30,4 г смеси
монооксида железа FeO
и триоксида дижелеза
Fe
Способ 2А. Составлением системы уравнений. Начнем решение задачи с составления уравнений реакций:
FeO + CO Fe + CO2
Fe2O3 + 3CO 2Fe + 3CO2
Под уравнениями
подставим данные, соответствующие
молярному уровню прочтения уравнения.
Например, уравнение взаимодействия
триоксида дижелеза с СО можно прочитать так:
В результате взаимодействия 1 моля Fe Над уравнением поместим данные,
соответствующие условию задачи, введя
минимальное число неизвестных.
Предварительно переведем полученный объем
углекислого газа в количество вещества n(СО2)=11,2:22,4=0,5
моль
Над уравнением поместим данные,
соответствующие условию задачи, введя
минимальное число неизвестных.
Предварительно переведем полученный объем
углекислого газа в количество вещества n(СО2)=11,2:22,4=0,5
моль
x г (0,5-y)
FeO +
СО ®
Fe + СО
1 моль 1 моль
72 г
(30,4-x)г y
Fe2O3 + 3СО ® 2Fe + 3СО2
1 моль 3 моль
160 г
Отношение массы
реагента из условия задачи к массе реагента,
подставленной из уравнения реакции, равно
такому же отношению масс, молей, объемов для
продукта реакции, т.
Способ
2Б. Составлением
системы уравнений в неявном виде. Этот
способ является более простым в сравнении с
предыдущим, т. к. связан с более легкими
расчетами. Отличие его от способа 2а состоит
в том, что количества продуктов, выражаем
двумя неизвестными, например, y
x г y1
FeO + CO ® Fe + CO2
1 моль 1 моль
72 г
(30,4-x)г y2
Fe2O3
1 моль 3 моль
160 г
Нам
известно, что y1 + y2 = 0,5 моль (11,2 л). Из пропорций выразим y1 и y2,
подставив полученные значения в предыдущее
уравнение, получим: х:72 + 3(30,4-x):160 = 0,5. Решив
уравнение получим х=14,4.
Из пропорций выразим y1 и y2,
подставив полученные значения в предыдущее
уравнение, получим: х:72 + 3(30,4-x):160 = 0,5. Решив
уравнение получим х=14,4.
Способ 2В. С использованием количества вещества.
х у
FeO + CO ® Fe + CO2
у 3у
Fe2O3 + 3CO ® 2Fe + 3CO2
Примем
количество FeO за х, а количество Fe2O3 за у.
Из уравнений реакций следует, что 1 моль FeO позволит получить 1 моль
углекислого газа. А 1 моль Fe2O3 – 3
моль углекислого газа. Следовательно из х
моль FeO
получится х моль углекислого газа, а из у
моль Fe2O3 – 3у моль СО2. Выразим массу оксидов железа через
принятые нами количества вещества. m(FeO)=72x; m(Fe2O3) =
160y. Полученные
значения масс позволяют получить первое
уравнение m(FeO) + m(Fe2O3) =
30,4 или 72х + 160у = 30,4. Найдём полученное
количество углекислого газа 11,2/22,4=0,5. Найдя
суммарное в обеих реакциях количество
углекислого газа, получим второе уравнение.
х + 3у = 0,5. Таким образом нам удалось получить
систему уравнений с двумя неизвестными: 72х +
160у = 30,4
Выразим массу оксидов железа через
принятые нами количества вещества. m(FeO)=72x; m(Fe2O3) =
160y. Полученные
значения масс позволяют получить первое
уравнение m(FeO) + m(Fe2O3) =
30,4 или 72х + 160у = 30,4. Найдём полученное
количество углекислого газа 11,2/22,4=0,5. Найдя
суммарное в обеих реакциях количество
углекислого газа, получим второе уравнение.
х + 3у = 0,5. Таким образом нам удалось получить
систему уравнений с двумя неизвестными: 72х +
160у = 30,4
х + 3у = 0,5
Умножив второе уравнение на 72 получим: 72х + 216у = 36. Отняв от первого уравнения второе найдем: 56у=5,6. Откуда у=0,1, а х = 0,2. Таким образом массовая доля монооксида железа будет равна w(FeO)= 0,2·72/30,4= 14,4/30,4=0,4737 или 47,37%.
Задача
2. 2. Смесь муравьиной и уксусной кислот
была поделена на 2 равные части. Одна часть
смеси при взаимодействии с магнием
выделила 5,6 л водорода, а
другая была сожжена. Продукты ее
сгорания были пропущены в избыток раствора
известковой воды. Масса выпавшего при этом
осадка составила 80 г. Определите состав
исходного раствора (в мольных долях) и его
массу.
2. Смесь муравьиной и уксусной кислот
была поделена на 2 равные части. Одна часть
смеси при взаимодействии с магнием
выделила 5,6 л водорода, а
другая была сожжена. Продукты ее
сгорания были пропущены в избыток раствора
известковой воды. Масса выпавшего при этом
осадка составила 80 г. Определите состав
исходного раствора (в мольных долях) и его
массу.
Для решения задачи воспользуемся способом 2в. Начнем с составления уравнений реакций химических процессов, описанных в задаче.
2CH3COOH + Mg ® Mg(CH3COO)2 + H2
2HCOOH + Mg ® Mg(HCOO)2 + H2
CH3COOH + 2O2® 2CO2 + 2H2O
HCOOH + 0,5O2 ® CO2 + H2O
CO2 + Ca(OH)2 ® CaCO3 + H2O
Найдем
количество выделившегося водорода. n (Н2) = 5,6/22,4=0,25 моль.
n (Н2) = 5,6/22,4=0,25 моль.
Из уравнений реакции кислот с магнием следует, что количество кислот вдвое превышает количество выделившегося водорода. Значит n(СН3СООН) + n(НСООН) = 0,5 моль.
С другой стороны, из уравнения реакции углекислого газа с гидроксидом кальция следует, что количество выпавшего в осадок карбоната кальция равно количеству образовавшегося в ходе реакции горения кислот углекислого газа. n(СаСО3) = m/M=80/100 = 0,8 моль. Þ n(СО2) = 0,8 моль.
Каждый моль муравьиной кислоты в результате горения образует 1 моль углекислого газа, а каждый моль уксусной кислоты образует 2 моль углекислого газа. Þ n(НСООН) + 2n(СН3СООН) = 0,8 моль.
Решим полученную систему уравнений:
n(СН3СООН)
+ n(НСООН)
= 0,5 моль.
n(НСООН) + 2n(СН3СООН) = 0,8 моль.
Решив найдем, что n(СН3СООН) = 0,3 моль (после разделения)
n(НСООН)=0,2 моль (после разделения).
Нетрудно определить, что количество исходной уксусной смеси в смеси до её разделения было равно 0,3×2=0,6 моль; количество исходной муравьиной кислоты было равно 0,2×2=0,4 моль. Мольная доля уксусной кислоты в исходной смеси равна c(СН3СООН) = 0,6/1=0,6 или 60%. Мольная доля муравьиной кислоты равна c(НСООН) = 0,4/1=0,4 или 40%.
Масса исходного раствора равна m(НСООН) + m(СН3СООН) = 0,4×46 + 0,6×60= 18,4 + 36 = 54,4 г.
Задача 2.3. При сжигании 2,48 г смеси пропана, пропена, пропина образовалось 4,03 л углекислого газа (н. у.). Сколько граммов воды получилось при этом?
Для решения найдем количество
углекислого газа. n(СО2)= V:Vм=4,03 л: 22,4 л/моль =0,18
моль. n(С)= n(СО2)=0,18
моль. Найдем массу углерода m(C)= n·M= 0,18 моль·12
г/моль=2,16 г. Масса водорода, входящего в
состав углеводородов будет равна m(H) =
2,48 г – 2,16 г = 0,32 г. Найдем количество водорода n(Н)=
m/M
0,32 г/1 г/моль = 0,32 моль. n(Н)= n(Н2О)·2. n(Н2О)=0,16
моль. m(H2O) = n·M = 0,16 моль·18=2,88
г.
n(СО2)= V:Vм=4,03 л: 22,4 л/моль =0,18
моль. n(С)= n(СО2)=0,18
моль. Найдем массу углерода m(C)= n·M= 0,18 моль·12
г/моль=2,16 г. Масса водорода, входящего в
состав углеводородов будет равна m(H) =
2,48 г – 2,16 г = 0,32 г. Найдем количество водорода n(Н)=
m/M
0,32 г/1 г/моль = 0,32 моль. n(Н)= n(Н2О)·2. n(Н2О)=0,16
моль. m(H2O) = n·M = 0,16 моль·18=2,88
г.
Решение задач по 📝 химии на заказ
Учеба на химическом факультете наполнена не только разнообразными опытами, но и обилием задач, которые придется решать, независимо от вашего желания и настроения. Решение задач по органической химии или любому другому ее разделу требует большого количества времени, а также хорошего знания всего курса, внимательности, серьезной и кропотливой работы.
Помощь в решении задач по химии
Решить задачу по физхимии или химии за деньги с радостью помогут специалисты, зарегистрированные на сайте vsesdal. com. Им не составит никакого труда выполнить решение задач по химии онлайн и через короткий промежуток времени отправить вам готовую работу. Все, что вам останется сделать – переписать ответ и сдать преподавателю. А после – удивлять однокурсников своей хорошей успеваемостью.
com. Им не составит никакого труда выполнить решение задач по химии онлайн и через короткий промежуток времени отправить вам готовую работу. Все, что вам останется сделать – переписать ответ и сдать преподавателю. А после – удивлять однокурсников своей хорошей успеваемостью.
Выполняя решение задач по органической химии, очень легко запутаться в формулах и ошибиться. База профессионалов vsesdal.com может стать для вас надежной страховкой на время учебы. Если вы сомневаетесь в правильности своего ответа на задачу, обратитесь к специалисту. Он быстро выполнит задание по химии онлайн, а затем вы сравните его решение задач по органической химии со своим собственным. Вы сможете проверить собственные знания и быстро найти и исправить допущенные ошибки.
Решение задач по химии на заказ
Самый простой способ вовремя сдать контрольную работу и получить хорошую оценку – заказать специалисту решение задач по химии онлайн. Сдавайте домашние задания, контрольные и зачеты точно в срок, и ни о чем не беспокойтесь. Как только вы договоритесь с исполнителем о срочном решении задач по органической химии или другому предмету, он сразу же возьмется за выполнение работы.
Как только вы договоритесь с исполнителем о срочном решении задач по органической химии или другому предмету, он сразу же возьмется за выполнение работы.
Наш сервис предоставляет студентам удивительную возможность. «Учиться, не учась» очень просто. Пока профессионал выполняет за вас решение задач по неорганической химии, вы можете заниматься своим любимым делом. Получать удовольствие от жизни, устраивать вечеринки с друзьями, выезжать на природу, читать любимые книги, а не учебники – мечта каждого студента станет реальностью для того, кто обратится за помощью к специалистам нашего сайта.
Впрочем, есть и другая категория студентов. Многие ребята начинают работать, только поступив в вуз. Если вы совершаете подъем по ступеням карьерной лестницы, и просто не хватает времени на посещение лекций и выполнение заданий по таким предметам как нанохимия или химическая кинетика, решение задач, заказанное на сайте vsesdal.com поможет вам сдать работу в срок, не отвлекаясь от своей основной деятельности. Решение задач по химии онлайн, выполненное профессионалом – это ваша возможность уделить время работе и накоплению тех знаний, которые вы можете применять на практике в своей сфере деятельности.
Решение задач по химии онлайн, выполненное профессионалом – это ваша возможность уделить время работе и накоплению тех знаний, которые вы можете применять на практике в своей сфере деятельности.
Наша помощь может сопровождать вас на протяжении всех лет учебы. На сайте vsesdal.com вы можете заказать ответы на экзаменационные билеты, любую лабораторную, курсовую или дипломную работу, отчет по практике и прочие виды работ, без которых ни один человек не может получить высшее образование. Мы выполняем работы абсолютно по всем предметам. Решение задач по статистике для экономистов и отчеты по фольклорной практике для филологов, решение химии на заказ и ответы на билеты по биологии, курсовая по квантовой механике и диплом по юриспруденции – нашим специалистам по силам абсолютно все. А обговорить стоимость дипломной работы по юриспруденции или любому другому предмету вы можете непосредственно с исполнителем заказа.
Кроме того, мы оказываем помощь в сдаче экзаменов в режиме реального времени. Присланные вами задания моментально выполняются специалистам, и к концу экзамена решение задач по коллоидной химии, перевод текста на немецкий язык или подробный ответ на билет по этнолингвистике будут присланы вам на телефон.
Присланные вами задания моментально выполняются специалистам, и к концу экзамена решение задач по коллоидной химии, перевод текста на немецкий язык или подробный ответ на билет по этнолингвистике будут присланы вам на телефон.
Решение химических задач с помощью пропорций
Тема урока: Решение химических задач с помощью пропорций (8 класс).
Форма урока: интегрированный урок (математика + химия).
Цель: развитие умений применения пропорций для решении химических задач.
Задачи урока:
- Образовательная: обобщить и систематизировать знания обучающихся по теме «Пропорция» и «Массовая доля вещества в растворе».
- Развивающая: развивать вычислительные навыки, умения применять знания на практике.
- Воспитательная: воспитывать интерес к
предмету и чувство взаимопомощи.

Сопровождение к уроку – компьютерная презентация (Приложение 1)
ХОД УРОКА
1. Организационный момент
2. Историческая справка
Пропорции в Древней Греции
Слово «пропорция» латинского происхождения
«proportio», означающее вообще соразмерность,
определённое соотношение частей между собой. В
древности учение о пропорциях было в большом
почёте у пифогорейцев. С пропорциями они
связывали мысли о порядке и красоте в природе, о
созвучных аккордах в музыке и гармонии во
вселенной. Некоторые виды пропорций они поэтому
и называли «музыкальными», «гармоничными».
В ІV веке до н.э. общая теория пропорций для любых
величин (соизмеримых и несоизмеримых) была
создана трудами древнегреческих учёных, среди
которых выдающееся место занимали Теэтет и
Евдокс. Эта теория подробно изложена в книгах
«Начала» Евклида. Пропорциями пользовались для
решения разных задач и в древности, и в средние
века, и сейчас.
Эта теория подробно изложена в книгах
«Начала» Евклида. Пропорциями пользовались для
решения разных задач и в древности, и в средние
века, и сейчас.
Пропорции применяются не только в математике, но
и в архитектуре, искусстве.
Заслуженное место заняла теория пропорций при
решении задач по химии.
3. Повторение материала
Учитель математики: Что называют пропорцией?
– Прочитайте равенства, записанные на доске:
; ;
0,2 : 0,3 = 40 : 60;
– Назовите крайние и средние члены пропорции.
– Сформулируйте основное свойство пропорции.
– Найдите неизвестные члены пропорций:
;
;
3 : y = 2 : 5.
Учитель химии:
– Что называют растворами?
– Какие бывают растворы?
– Что такое процентная концентрация?
– Что показывает процентная концентрация?
– Из чего состоит любой раствор?
Запишем обозначение:
mв – масса вещества;
mH2O – масса воды;
mp = mв + mH2O
– масса раствора;
mp = 100%
% – процентное
содержание вещества в растворах.
4. Применение знаний для решения задач
Задача 1. Приготовить 100 г раствора соли CuSO4 1% концентрации.
Учитель химии:
– Что такое концентрация?
– Что необходимо знать для приготовления
раствора соли?
– Назовите формулу массы раствора?
Учитель математики:
– Вычислим массу вещества и массу воды с помощью пропорции. Для этого запишем краткое условие задачи:
mp = 100 г – 100%
mв = ? – 1%
mH2O = ?
– Составим пропорцию:
;
– Выразим неизвестную величину:
Вывод: получили 1 г соли, т.е. mв = 1г.
mp = mв + mH2O
mH2O = mp – mв
mH2O = 100 – 1 = 99 (г)
Ответ: mв = 1 г, mH2O = 99 г.
По данным задачи учитель химии демонстрирует опыт по получению раствора соли CuSO4 1% концентрации. Для этого взвешивает 1 г соли CuSO4 и 99 г воды, соединяет, получает раствор массой 100 г.
Задача 2. Приготовить 150 г раствора с массовой долей хлорида натрия 5%?
Учитель химии:
– Что такое массовая доля?
– Чему она равна по условию задачи?
– Что необходимо знать для приготовления
раствора?
Учитель математики:
– Вычислим массу вещества и массу воды аналогично решению первой задачи. Известно, что масса раствора составляет 150 г, что принимаем за 100%. Составим таблицу по условию задачи.
| Условие задачи: | Составление пропорции: | Решение пропорции: | Ответ задачи: |
| mp = 150 г – 100% mв = x г – 5% |
(г) | mв = 7,5 г mH2O = 142,5 г |
|
| mH2O = mp – mв | mH2O = 150 – 7,5 = 142,5(г) |
Учитель химии: демонстрация опыта по
получению данного раствора.
Вывод: При решении задач использовались пропорции, связывающие величины mв, mp, %.
– Выразите из этой пропорции mв.
Задача 3. Какова процентная концентрация раствора, полученного растворением 5 г поваренной соли в 45 г воды?
Ученик у доски оформляет решение задачи.
mв = 5 г – х%
mH2O = 45 г
mp = ? – 100%1) mp = mв + mH2O
mp = 5 + 45 = 50 (г)
50 г – 100 %
5 г – x %
2) ; %
Ответ: 10% концентрация раствора поваренной соли.
5. Самостоятельная работа (проводится в парах или группах)
Задача 4. Рассчитайте массу вещества и
воды для приготовления раствора (120г) с массовой
долей соли 8%.
Рассчитайте массу вещества и
воды для приготовления раствора (120г) с массовой
долей соли 8%.
(решения внести в таблицы)
| Условие задачи: | Составление пропорции: | Решение пропорции: | Ответ задачи: |
| mp = 100г – 100% mв = ? – 8 % mH2O = ? |
mв = 9,6г | ||
| mp = mв + mH2O | mH2O = | mH2O = | mH2O = 110,4г |
Задача 5. Сколько грамм соли получает
организм при внутривенном вливании 100г
физиологического раствора? (Физиологический
раствор – это 0,85% раствор поваренной соли)
Сколько грамм соли получает
организм при внутривенном вливании 100г
физиологического раствора? (Физиологический
раствор – это 0,85% раствор поваренной соли)
| Условие задачи: | Составление пропорции: | Решение пропорции: | Ответ задачи: |
| mp = 100 г – 100% mв = ? – 0,85 % mH2O = ? |
mв = 0,85г | ||
| mp = |
Ответ: 0,85 г соли.
Задача 6. Содержание солей в морской воде достигает 3,5%. Сколько граммов соли останется после выпаривания 10 кг морской воды?
| Условие задачи: | Составление пропорции: | Решение пропорции: | Ответ задачи: |
| mp = mв = |
|||
Ответ: 0,35 кг соли = 350 г в 10 кг воды.
6. Контроль решения задач
Учитель математики:
– Проверим правильность решения задач.
7. Подведение итогов
Учитель математики:
– Назовите пропорцию, связывающую величины mp, mв, %.
()
– Выразите из этой формулы величины: mp, mв, %.
8. Домашнее задание
Составить таблицу изученных формул.
Программа элективного курса «Решение задач по химии»
РЕШЕНИЕ ЗАДАЧ ПО ХИМИИ
10 класс
Составитель: Милица Н.В.
учитель химии
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
Решение задач занимает в химическом образовании важное место, так как это один из приемов обучения, посредством которого обеспечивается более глубокое и полное усвоение учебного материала по химии. Чтобы научиться химии, изучение теоретического материала должно сочетаться с систематическим использованием решения различных задач. В школьной программе существует эпизодическое включение расчетных задач в структуру урока, что снижает дидактическую роль количественных закономерностей, и может привести к поверхностным представлениям у учащихся о химизме процессов в природе, технике. Сознательное изучение основ химии немыслимо без понимания количественной стороны химических процессов.
В школьной программе существует эпизодическое включение расчетных задач в структуру урока, что снижает дидактическую роль количественных закономерностей, и может привести к поверхностным представлениям у учащихся о химизме процессов в природе, технике. Сознательное изучение основ химии немыслимо без понимания количественной стороны химических процессов.
Решение задач содействует конкретизации и упрочению знаний, развивает навыки самостоятельной работы, служит закреплению в памяти учащихся химических законов, теорий и важнейших понятий. Выполнение задач расширяет кругозор учащихся, позволяет устанавливать связи между явлениями, между причиной и следствием, развивает умение мыслить логически, воспитывает волю к преодолению трудностей. Умение решать задачи является одним из показателей уровня развития химического мышления учащихся, глубины усвоения ими учебного материала.
Элективный курс «Решение задач по химии» составлен в полном соответствии с федеральным компонентом государственного образовательного стандарта по программе О. С. Габриеляна и предназначен для учащихся 10 класса, рассчитан на 34 часа.
С. Габриеляна и предназначен для учащихся 10 класса, рассчитан на 34 часа.
Данный элективный курс направлен на расширение и углубление знаний учащихся по органической химии, формированию умений выполнять различные задания: решать задачи, цепочки превращений органических и неорганических веществ, составлять ОВР, электронный баланс с участием органических веществ.
В программе реализуются межпредметные связи с биологией, математикой, физикой, географией, экологией, что позволяет учащимся осуществить интегрированный синтез знаний в целостную картину мира.
Теоретические знания и практические умения, полученные учащимися в результате изучения данного элективного курса, обеспечат повышение интереса к исследовательской работе по химии, подготовку к сдаче ЕГЭ по химии.
Цель курса: формирование и развитие у обучающихся умений и навыков по решению качественных и количественных задач по органической химии, развитие познавательной и творческой активности
Задачи курса:
– развить умения и навыки системного осмысления знаний по органической химии и их применению при решении задач;
– научить использовать математические умения и навыки при решении химических задач;
– обеспечить усвоение учащимися алгоритмов решения типовых задач
ТРЕБОВАНИЯ К УРОВНЮ УСВОЕНИЯ КУРСА
Должны знать:
– способы решения различных типов усложненных задач;
– основные формулы и законы, по которым проводятся расчеты;
– стандартные алгоритмы решения задач.
Должны уметь:
– решать усложненные задачи различных типов;
– четко представлять сущность описанных в задаче процессов;
– видеть взаимосвязь происходящих химических превращений и изменений численных параметров системы, описанной в задаче;
– работать самостоятельно и в группе;
– самостоятельно составлять типовые химические задачи и объяснять их решение;
– владеть химической терминологией;
– пользоваться справочной литературой по химии для выбора количественных величин, необходимых для решения задач.
УЧЕБНО – ТЕМАТИЧЕСКИЙ ПЛАН
№ | Тема | Количество часов |
1 | Изомерия и номенклатура органических веществ | 3 |
2 | Задачи на вывод химических формул | 5 |
3 | Задачи на смеси органических веществ | 2 |
4 | Вычисления по уравнениям химических реакций с участием органических веществ | 10 |
5 | Определение количественных отношений газов | 2 |
6 | Генетическая связь между классами органических веществ | 5 |
7 | Химия и жизнь ( решение задач из повседневной жизни) | 4 |
8 | Обобщающее повторение | 3 |
ИТОГО: | 34 |
СОДЕРЖАНИЕ ТЕМ УЧЕБНОГО КУРСА
Тема 1. Изомерия и номенклатура органических веществ. 3ч
Изомерия и номенклатура органических веществ. 3ч
Виды изомерии: структурная и пространственная. Номенклатура. Написание структурных формул изомеров и гомологов
Знать: изомерию углеродного скелета, межклассовую, положения функциональной группы.
Уметь: писать структурные формулы изомеров и гомологов.
Тема 2. Задачи на вывод химических формул. 5ч.
Алгоритм решения задач на вывод химических формул органических соединений различных классов. Алгоритм расчетов по химическим формулам: нахождение массовой доли элемента в веществе. Расчеты на выведение формулы вещества по абсолютной и относительной плотности паров газообразных веществ, по продуктам сгорания органических веществ.
Знать: общие формулы изучаемых классов органических соединений, алгоритмы расчетов
Уметь: объяснять решение типовых задач, проводить анализ условия задач.
Тема 3. Задачи на смеси органических веществ 2ч.
Основные законы химии и химическ5ие формулы, применяемые при решении задач. Решение задач на смеси органических веществ.
Решение задач на смеси органических веществ.
Знать: формулировки и химические формулы основных законов химии
Уметь: решать задачи на газообразные, жидкие, твердые смеси органических веществ
Тема 4. Вычисления по уравнениям химических реакций с участием органических веществ. 10 ч.
Расчет количества вещества, массы, объема продукта реакции или исходного вещества по имеющимся данным; решение задач на примеси, на избыток – недостаток, на выход продукта.
Знать: химические формулы на нахождение количества вещества через массу, объем, число структурных единиц
Уметь: решать усложненные задачи различных типов
Тема 5. Определение количественных отношений газов. 2ч.
Основные газовые законы. Решение задач с использованием относительной плотности газов.
Знать: молярный объем газов, нормальные условия
Уметь: решать задачи на нахождение объема, плотности газов
Тема 6. Генетическая связь между классами органических веществ. 5 ч.
5 ч.
Составление и решение цепочек превращений, отражающих генетическую связь между классами органических веществ.
Знать: химические свойства классов органических веществ, способы их получения
Уметь: писать уравнения реакций, указывать условия их проведения
Тема 7. Химия и жизнь ( решение задач из повседневной жизни) 4 ч.
Решение задач с производственным, сельскохозяйственным, экологическим содержанием.
Знать: основные формулы и законы, по которым проводятся расчеты
Уметь: видеть взаимосвязь происходящих химических превращений и изменений численных параметров системы, описанной в задаче
Тема 8. Обобщающее повторение. 3 ч.
Решение задач из сборников ЕГЭ.
УЧЕБНО – МЕТОДИЧЕСКИЕ СРЕДСТВА ОБУЧЕНИЯ
Для учителя:
Программа по химии для 8-11 классов общеобразовательных учреждений.-М.: ООО «ТИД», 2016
Габриелян О.С. Настольная книга учителя химии 10 кл/ М. : Блик и К, -2015.
: Блик и К, -2015.
Новошинский Н.Н. Типы химических задач и способы их решения/ М.: Оникс 21 век,-2010
Для учащихся:
Задачи по химии и способы их решения. 10-11 кл. / О.С. Габриелян, П.В. Решетов, И.Г.Остроумов. – М.: Дрофа, 2006
Решение химических проблем и консультации от Triclinic Labs
Решение проблем, интерпретация данных и устранение неисправностей. Повысьте растворимость, стабильность, неспособность кристаллизоваться, гигроскопичность, технологичность, фильтруемость, сжимаемость вашей молекулы
Научный персонал Triclinic Labs может помочь с интерпретацией данных, планированием проектов и решением проблем, независимо от того, собираются ли данные в нашей или вашей лаборатории. Они также могут помочь в выборе подходящего CRO для удовлетворения других ваших потребностей в развитии. Планирование проекта и интерпретация данных – гораздо более важные компоненты проекта, чем сбор данных. Мы считаем, что каждый проект уникален, потому что каждая молекула обладает уникальным набором физических свойств. Даже для такой очевидной простой задачи, как скрининг твердых форм, один протокол не применим одинаково хорошо ко всем молекулам. Для таких проблем, как изменение характеристик лекарственного препарата, потеря контроля кристаллизации или несоответствие свойств API от партии к партии, критически важно использовать существующие данные и спланировать эффективный путь к выявлению причины.В Triclinic мы привносим в этот процесс опыт и проверенную креативность.
Даже для такой очевидной простой задачи, как скрининг твердых форм, один протокол не применим одинаково хорошо ко всем молекулам. Для таких проблем, как изменение характеристик лекарственного препарата, потеря контроля кристаллизации или несоответствие свойств API от партии к партии, критически важно использовать существующие данные и спланировать эффективный путь к выявлению причины.В Triclinic мы привносим в этот процесс опыт и проверенную креативность.
Проблемы, с которыми мы можем помочь:
- Неоптимальные свойства лекарственной субстанции: (растворимость, стабильность, неспособность кристаллизоваться, гигроскопичность, технологичность, фильтруемость, прессуемость)
- Определение и контроль полиморфизма (изменения формы на поздних стадиях)
- Выбор соли и просеивание
- Оптимизация твердотельной собственности
- Скрининг кокристаллов, рецептура, проявка
- Консультации по вопросам интеллектуальной собственности (патентное преследование и судебные разбирательства)
- Определение характеристик и анализ аморфных материалов (анализ стабильности)
- Разработка аналитических методов, проверка, тестирование выпуска – даже при сверхнизкой нагрузке (<5% по массе).

- Идентификация загрязняющих веществ
- Анализ поддельных лекарств
- Репродукция известного уровня техники
- Хиральное разрешение
- Разработка аналитических и кристаллизационных методов cGMP и не-GMP
- Отказ стабильности или хранения
- Характеристики фармацевтических и тонких химических материалов
- Анализ предшествующих экспериментов и процедур
- Краткие курсы и тренинги по физической, аналитической и органической химии
Свяжитесь с нами, чтобы обсудить проблемы развития и возможные решения:
Экзамен по химическим реакциям1 и решения проблем
Химические реакции Экзамен1 и решения проблем
1. Весы после химической реакции;
C 2 H 5 OH + O 2 → CO 2 + H 2 O
Решение:
C 2 H 5 OH + O 2 → CO 2 + H 2 O
У нас 2 атома углерода в реагентах, но 1 в продуктах. Итак, мы умножаем CO 2 на 2, чтобы уравновесить количество атомов C.
Итак, мы умножаем CO 2 на 2, чтобы уравновесить количество атомов C.
C 2 H 5 OH + O 2 → 2CO 2 + H 2 O
Теперь у нас есть 6 атомов H в реагентах, но 2 атома H в продуктах.Чтобы уравновесить их, умножаем H 2 O на 3.
C 2 H 5 OH + O 2 → 2CO 2 + 3H 2 O
Наконец, мы уравновешиваем количество атомов O, чтобы уравновесить их, мы пишем 3 перед O 2 .
C 2 H 5 OH + 3O 2 → 2CO 2 + 3H 2 O
Все атомы в реагентах и продуктах уравновешены.
2. Если данная реакция сбалансирована; найти числа x, y и z в реагентах.
CxHy (OH) z + 5O 2 → 4CO 2 + 5H 2 O
Решение:
Так как реакция уравновешенная, количество атомов в обеих сторонах должно быть одинаковым.
CxHy (OH) z + 5O 2 → 4CO 2 + 5H 2 O
В товарах есть; 13 атомов O, в реагентах должно быть 13 атомов O. Но у нас 10, поэтому z должно быть 3.
В продуктах у нас 4 атома углерода, чтобы сбалансировать его, в реагентах должно быть 4, так что «x» равно 4.
C 4 Hy (OH) 3 + 5O 2 → 4CO 2 + 5H 2 O
В продуктах 10 атомов H, а в реагентах – 3. «y» должно быть 7, чтобы уравновесить количество атомов H с обеих сторон. Окончательная реакция;
C 4 H 7 (OH) 3 + 5O 2 → 4CO 2 + 5H 2 O
3. Найдите формулу соединения, обозначенного знаком «X», в следующей сбалансированной реакции.
2I – + 2X + 4H +1 → I 2 + 2NO + 2H 2 O
Решение:
Мы должны проверить количество атомов с обеих сторон, чтобы найти формулу X.
В реагентах и продуктах есть 2 атома I, поэтому в X нет атома I.
В реагентах и продуктах 4 атома Н, в X нет атома Н.
В продуктах 2N атомов, но их нет в реагентах, поэтому в реагентах должно быть 2 N атомов.
Поскольку в продуктах 4 атома O, в реагентах должно быть 4 атома O.
X должен быть “NO 2 ”
2I – + 2NO 2 + 4H +1 → I 2 + 2NO + 2H 2 O
Теперь мы должны сбалансировать количество зарядов с обеих сторон.
2I – + 2NO 2 + 4H +1 → I 2 + 2NO + 2H 2 O
2. (- 1) +2. (X) + 4. (+ 1) = 1,0 + 2,0 + 2,0
-2 + 2х + 4 = 0
x = -1, поэтому реакция становится;
2I – + 2НО 2 -1 + 4H +1 → I 2 + 2NO + 2H 2 O
и X = NO 2 -1
4. Какие из следующих реакций являются кислотно-щелочной реакцией?
Какие из следующих реакций являются кислотно-щелочной реакцией?
I. N 2 (г) + 3H 2 (г) → 2NH 3 (г)
II. Mg (OH) 2 (т) + 2HCl (л) → MgCl2 (т) + 2h3O (л)
III. CH 4 (г) + 2O 2 (г) → CO 2 (г) + 2H 2 O (л)
Решение:
I. Это реакция синтеза или образования.
II. Mg (OH) 2 – основание, а HCl – кислота. Таким образом, это кислотно-основная реакция; образуются соль и вода.
III. Это реакция горения.
5. Какую из следующих пар можно записать вместо X и Y в приведенной ниже реакции;
X + Y → Соль + H 2 O
Решение:
X + Y → Salt + H 2 O – кислотно-основная реакция. Таким образом, X и Y должны быть кислотой и основанием или основанием и кислотой.
Таким образом, X и Y должны быть кислотой и основанием или основанием и кислотой.
HCl + NaOH → NaCl + H 2 O
X Y
| Экзамены на химические реакции и решения проблем <Пред. | Далее> Экзамен по химическим реакциям2 и решения проблем |
|---|
Алгоритм геометрического программирования для решения проблем химического равновесия на JSTOR
АбстрактныйОписан новый метод расчета равновесного состава многокомпонентной однофазной химической системы.Алгоритм основан на двойственности геометрического программирования и минимизации функции свободной энергии Гиббса. Основное преимущество этого метода в том, что он уменьшает количество переменных минимизации. Включен иллюстративный пример, включающий сжигание стехиометрической смеси гидразина и кислорода.
Информация о журнале SIAM Journal on Applied Mathematics содержит исследования
статьи по математическим методам и их приложениям в физике,
инженерные, финансовые и биологические науки.
“Общество промышленной и прикладной математики является ведущим
международная ассоциация прикладной математики и ее публикации
мог бы стать ядром адекватного собрания по математике. Один из
Целями этой организации является обеспечение обмена информацией между
университет и промышленность стали более гладкими. Он превосходно выполняет эту задачу.
и многие из ведущих академических институтов мира являются его членами.”
– Журналы для библиотек, восьмое издание, 1995, Р. Р.
Боукер, Нью-Провиденс, Нью-Джерси
Общество промышленной и прикладной математики (SIAM), штаб-квартира
в Филадельфии, была основана в 1951 году для продвижения применения
математики в науку и промышленность, продвигать математические исследования и
предоставлять средства массовой информации для обмена информацией и идеями между
математики, инженеры и ученые.
SIAM имеет обширную программу публикаций в прикладных и вычислительных
математика, в том числе 11 престижных исследовательских журналов. Для полного
описание наших журналов и недавно анонсированных SIAM Journals Online,
доступ http://www.siam.org/.
Для полного
описание наших журналов и недавно анонсированных SIAM Journals Online,
доступ http://www.siam.org/.
10,6. Проблема химического уравнения – создание и запуск документация курса Open edX
Примечание
EdX не поддерживает этот тип проблем.
Тип задачи химического уравнения позволяет учащемуся ввести текст, который представляет химическое уравнение в текстовом поле. Система преобразует этот текст в химическое уравнение под текстовым полем.Оценщик оценивает ответ учащегося с помощью сценария Python, который вы создаете и встраиваете в проблема.
Примечание
Вы можете сделать калькулятор доступным для учащихся каждый страница блока. Для получения дополнительной информации см. Инструмент калькулятора.
В задачах с химическими уравнениями для создания формул используется MathJax. Для большего
информацию об использовании MathJax в Studio см. в разделе Использование MathJax для математики.
Чтобы создать указанное выше химическое уравнение, выполните следующие действия.
В блоке, в котором вы хотите создать проблему, выберите Проблема в разделе Добавьте новый компонент , а затем выберите вкладку Advanced .
Выберите Пустая расширенная проблема .
В появившемся компоненте выберите Изменить .
В редакторе компонентов вставьте приведенный ниже код.
Выбрать Сохранить .





 предлагаемые сегодня в статистике, инженерии и информатике.Развернуть
предлагаемые сегодня в статистике, инженерии и информатике.Развернуть

 Подключите Знающих. К ним относятся константы, необходимые с правильными единицами измерения, и коэффициенты преобразования, которые преобразуют все известные величины, необходимые для правильных единиц, необходимых для уравнения. Сложите все вместе и решите уравнение. Подключите все известные величины и константы к единицам измерения. Подсчитайте результаты и запустите анализ размерностей, чтобы убедиться в правильности конечной единицы ответа. Четко сформулируйте ответ, указав его единицу измерения и соответствующую значащую цифру.
Подключите Знающих. К ним относятся константы, необходимые с правильными единицами измерения, и коэффициенты преобразования, которые преобразуют все известные величины, необходимые для правильных единиц, необходимых для уравнения. Сложите все вместе и решите уравнение. Подключите все известные величины и константы к единицам измерения. Подсчитайте результаты и запустите анализ размерностей, чтобы убедиться в правильности конечной единицы ответа. Четко сформулируйте ответ, указав его единицу измерения и соответствующую значащую цифру. Кроме того, я создал 20-минутный фильм, чтобы объяснить этот метод решения проблем, пример за примером, пока вы не ПОЛУЧИТЕ ЭТО. Его можно получить у наших студентов, обучающихся по химии.
Кроме того, я создал 20-минутный фильм, чтобы объяснить этот метод решения проблем, пример за примером, пока вы не ПОЛУЧИТЕ ЭТО. Его можно получить у наших студентов, обучающихся по химии.
 В конце концов, вред PFAS был раскрыт не EPA, а в ходе судебных разбирательств по гражданскому праву штата. Во-вторых, мы анализируем действующую нормативно-правовую базу США в отношении токсичных веществ. Эта структура основана на том, что мы называем «системой чести токсичности».«Слишком часто в этой системе чести отсутствует чувство чести. В-третьих, мы обращаем внимание на то, что Министерство обороны (DoD) в значительной степени полагается на PFAS на военных объектах, а также на уникальные проблемы и возможности регулирования, которые это создает. В то время как военные пользуются уважением в вопросах национальной безопасности, военные также добиваются согласованности нормативных требований и единого обязательного стандарта питьевой воды. В заключение мы предлагаем нормативную дорожную карту для регулирования PFAS. Наше предложение отказывается от системы чести реактивной токсичности в пользу осторожного подхода к защите окружающей среды.
В конце концов, вред PFAS был раскрыт не EPA, а в ходе судебных разбирательств по гражданскому праву штата. Во-вторых, мы анализируем действующую нормативно-правовую базу США в отношении токсичных веществ. Эта структура основана на том, что мы называем «системой чести токсичности».«Слишком часто в этой системе чести отсутствует чувство чести. В-третьих, мы обращаем внимание на то, что Министерство обороны (DoD) в значительной степени полагается на PFAS на военных объектах, а также на уникальные проблемы и возможности регулирования, которые это создает. В то время как военные пользуются уважением в вопросах национальной безопасности, военные также добиваются согласованности нормативных требований и единого обязательного стандарта питьевой воды. В заключение мы предлагаем нормативную дорожную карту для регулирования PFAS. Наше предложение отказывается от системы чести реактивной токсичности в пользу осторожного подхода к защите окружающей среды.