Математические подходы к решению трудных задач по химии
АННОТАЦИЯ
В статье представлены различные математические методы решения химических задач и их преимущества.
ABSTRACT
The article presents various mathematical methods for solving chemical problems and their advantages.
Ключевые слова: пропорциональность, квадратное уравнение, валентный угол, длина связи, раствор, электролит, диссоциация, олеум.
Keywords: proportionality, quadratic equation, valence angle, bond length, solution, electrolyte, dissociation, oleum.
Указ Президента Республики Узбекистан от 14 мая 2019 года № 07/19/4319/3129 «О дополнительных мерах по совершенствованию системы приема в высшие учебные заведения путем тестирования» очень важен для работников сферы образования.
По его словам, в следующем году абитуриенты сдают 5 тестов по пяти предметам. С начала 2020/2021 учебного года, разделив тестовые предметы на два раздела, первый раздел охватывает три обязательных курса для всех абитуриентов – родной язык (узбекский, русский или каракалпак), математику и историю Узбекистана и второй раздел – Высшее образование.
Сопоставимая математика играет важную роль во всех областях образования и на протяжении всей жизни человека. Нет области, в которой мы можем представить математику.
Математика является важным фактором в приобретении основ теоретических знаний и сложных вопросов химии. Основными понятиями химии, законов, теорий и примеров лабораторных работ, решения задач и упражнений являются теория и практика математики. Решение примеров и проблем в области химии играет важную роль в развитии у молодых людей способности самостоятельно мыслить, закреплять свои теоретические знания и понимание и применять эти знания на практике.
Изучение основ математики развивает такие качества, как усердие, настойчивость, чувство ответственности, самостоятельное и логическое мышление, воля и характер, а также достижение целей. Следующие темы широко используются в исследованиях химии:
Символы дивидендов, EKUB и EKUK, пропорции, проценты, свойства уровня, корневые свойства, формулы краткого умножения, линейные уравнения, квадратное уравнение, определитель, система двумерных уравнений и уравнений, система логарифмов арифметических и геометрических уравнений, функции, тригонометрия, производная , начальная функция, интеграл, предел, дифференциальные уравнения, факторные понятия, комплексные числа.
Рассмотрим эти положения при решении следующей задачи на определение концентрации растворов:
при растворении в 56 литрах SО3 при нормальных условиях было получено 236 г неизвестного содержимого. Определите концентрацию этого олеума от растворения в 264 г воды.
Решение: олеум получают по следующему уравнению реакции:
Х+уSO3 +хH2O = хH2SO4· ySO3
n(SO3) =
Метод I Система уравнений
18у = 9 у=0,5моль х = 2,5 – 0,5 = 2 моль 2H2SO4·0,5SO3
2H2SO4·0,5SO3 +0,5H2O = 2,5H2SO4
m = 98 · 2,5= 245грамм (H2SO4)mэритма= 236 + 264 = 500г
500 г —- 100%
245 г —- х х= 49% (H2SO4)
Способ II. Детерминантный метод
2H2SO4·0,5SO3
2H2SO
M= 98 · 2,5=245грамм (H2SO4)mэритма= 236 + 264 = 500 грамм
500 грамм —- 100%
245 грамм —- х х= 49% (H2SO4)
Способ III. Метод двух неизвестных чисел
Метод двух неизвестных чисел
200 236
Х + уSO3 + хH2O = хH2SO4· ySO3
80х+80у 98х + 80у
x=2,5 – y
47200–18880у+18880у = 49000 -19600y+16000у 18000 = 36000y
y = 0,5моль x = 2,5 – y x = 2,5 – 0,5=2 моль2H2SO4·0,5SO3
2H2SO4·0,5SO3 + 0,5H2O = 2,5H2SO4
M= 98 · 2,5= 245 грамм (H2SO4) mэритма =236 + 264=500г
500 г —- 100%
245 г —- х х= 49% (H2SO4)
Метод IV. Правило смешивания (Пирс Конверт)
Если сумма чисел с правой стороны диагонали (36 + 9) = 45 г составляет 2,5 моль, то масса 36 г серной кислоты эквивалентна массе моль.
45 г —- 2,5 моль
36 г —- х моль х = 2 моль(H2SO4)
2,5 – 2 = 0,5 моль (SO3 ) 2H2SO4·0,5SO3
2H2SO4·0,5SO3 +0,5H2O = 2,5H2SO4
m=98 · 2,5=245г (H2SO4)mэритма =236 + 264=500г
500 г —- 100%
245 г —- х х= 49% (H2SO4)
Метод Б. Метод разности масс
Метод разности масс
Х + уSO3 + хH2O = хH
22,4 л —- 80 г
56 г —- х г х=200 или 2,5 моль
Согласно закону сохранения массы, масса материала реакции и полученная реакция должны быть равны. В соответствии с формулой, 36 г (2 моль) воды вступило в реакцию. То есть,
236-200=36г 36г —- 1моль
18 г —- х моль х=2моль 0,5 моль SO3 – остальные
2H2SO4·0,5SO3
2H2SO4·0,5SO3 +0,5H2O = 2,5H2SO4
m=98 · 2,5=245г (H2SO4)mэритма =236 + 264=500г
500 г —- 100%
245 г —- х х= 49% (H
В заключение можно сказать, что математические расчеты широко используются для решения задач химии. Использование математических методов в решении химических задач является наиболее удобным и эффективным способом обогащения математических знаний учащихся и их применения при решении химических задач. В связи с этим авторы считают что, было бы желательно разработать и применить на практике науку, известную как теоретическая и прикладная математическая химия.
В связи с этим авторы считают что, было бы желательно разработать и применить на практике науку, известную как теоретическая и прикладная математическая химия.
Список литературы:
- Парпиев Н.А., Муфтахов А.Г., Рахимов Х.Р. Анорганик кимё.-Тошкент: «Ўзбекистон» 2003
- Қодиров З., Муфтахов А., Норов Ш.Қ. Анорганик кимёдан амалий машғулотлар, Тошкент 1996.
- Некрасов Б.В. Основы общей химии. В 2-х томах. М.: Мир. Химия. 1974г.
- Глинка Н.Л. Задачи и упражнения по общей химии. Ленинград, «Химия», 1985.
- Реми Г. Курс неорганической химии. Изд. Мир. Москва. 1974.
- Коттон Ф., Уилкинсон Дж. Современная неорганическая химия, часть 1,2,3, Изд. “МИР”, Москва, 1969 г.
Математические способы решения сложных химических задач при подготовке к ЕГЭ и олимпиадам
В ФГОС второго поколения цель образования видится как развитие личности на основе усвоения универсальных способов деятельности[1].
Во-первых, это практическое применение изученного материала.
Во-вторых, это прекрасный способ осуществления метапредметных (особенно с математикой и физикой) и курсовых связей.
В-третьих, решение задач позволяет осуществлять обучающие, воспитывающие и развивающие функции, привлекает учащихся к работе с дополнительной и справочной литературой. И наконец, позволяет повысить мотивацию учащихся не планирующих сдавать экзамен по химии, но увлекающихся математикой. Химическая учебная задача – это модель проблемной ситуации, решение которой требует от учащихся мыслительных и практических действий, на основе знаний законов, теорий, а также использование расчётного математического инструментария, вычислительных операций [3]. Решение задач требует от учащихся умения логически рассуждать, планировать, делать краткие записи, производить расчёты и обосновывать их теоретические предпосылки, дифференцировать определённые проблемы на отдельные вопросы, после ответов на которые решаются исходные проблемы в целом. В любой расчётной химической задаче можно выделить её чисто химическую сторону (законы, теории, химизм процессов) и математический анализ, вычислительные операции.
Пример 1. Смешали 40% и 60% растворы серной кислоты и добавили 20 кг чистой воды, получили 45% раствор кислоты. если бы вместо 20кг воды добавили 20кг 90% раствора той же кислоты, то получили бы 65% раствор кислоты. сколько килограммов 40% раствора было использовано? [4]
Таблица 1. «Математические и химические знания и умения, необходимые для решения задач по теме «Растворы. Смеси. Сплавы».
«Математические и химические знания и умения, необходимые для решения задач по теме «Растворы. Смеси. Сплавы».
Химические знания | Математический аппарат |
|
|
В таблице1 приведены основные знания и умения которыми должен обладать учащийся для успешного решения задач такого типа.
Рассуждаем: пусть x это масса 40% раствора кислоты, тогда y, это масса 60% раствора. Тогда масса растворённого вещества в 40% растворе 0,4x, а в 60% растворе 0,6y (по формуле из пункта 5 таблицы химические знания). Чистая вода растворённого вещества не содержит. Поэтому масса растворенного вещества в полученном растворе, это сумма масс растворённых веществ в каждом из растворов. Тогда масса полученного 45% раствора равна x+y+20, а растворённого вещества в нём 0,45(x+y+20). Отсюда получаем первое уравнение в системе: 0,4x+0,6y=0,45(x+y+20). Затем находим массу растворённого вещества в 20 кг 90% раствора. 20*0,9=18кг. Теперь можно перейти к составлению второго уравнения системы. При тех же условиях, мы добавляем не 20 кг воды, а 20 кг 90% раствора, содержащего 18 кг растворенного вещества, и получаем 65% раствор. Масса растворенного вещества в полученном 65% растворе это сумма масс растворённых веществ в 40,60 и 90% растворе. С учётом массы раствора 20кг, получаем втрое уравнение: 04x+0,6y+18= 0,65(x+y+20). Затем учащиеся решают составленную ими систему уравнений и получают массу второго раствора равную 7,5кг. При этом происходит обсуждение и анализ математических способов решения системы уравнений. Все химические рассуждения идут с учётом тех знаний и умений, которые описаны в первом столбце таблицы1. То есть происходит одновременная подготовка к экзаменам по математике и химии, углубление и расширение знаний.
Затем учащиеся решают составленную ими систему уравнений и получают массу второго раствора равную 7,5кг. При этом происходит обсуждение и анализ математических способов решения системы уравнений. Все химические рассуждения идут с учётом тех знаний и умений, которые описаны в первом столбце таблицы1. То есть происходит одновременная подготовка к экзаменам по математике и химии, углубление и расширение знаний.
Пример 2. Смешали 10% и 25% растворы соли и получили 3 кг 20% раствора. Какое количество каждого раствора в килограммах было использовано? [4]
Знания и умения, необходимые для решения этой задачи также приведены в таблице 1. Однако к ним добавляется формула, отражающая правило креста «смешения» растворов. В ней обычно раствор с наибольшим содержанием растворённого вещества (долей «w») записывают в левом верхнем углу схемы w1, а с наименьшим в левом нижнем w2. Полученный раствор в центре схемы w3. Откуда получаем:
получаем отношение долей и масс исходных растворов в полученном растворе. Доля первого раствора в смеси это w3 – w2, а второго w1 – w3. Отсюда в нашей задаче: 25-20=5 (доля первого раствора). 20-10=10 (доля второго раствора). Если обозначить за x массу первого раствора, то тогда второго будет 3-x. Откуда получаем отношение масс первого и второго растворов: . поэтому масса первого раствора 2 кг, значит второго 1 кг. Этот способ решения является более коротким и простым. Для решения этой же задачи можно использовать и систему уравнений. Масса первого раствора x, а второго y. Тогда первое уравнение системы выглядит так: x+y=3. Находим массу растворённого вещества в полученном растворе: 3*0,2=0,6. Тогда растворённых веществ в первом и втором растворах соответственно 0,1x и 0,25y. Второе уравнение системы: 0,1x+0,25y=0,6. Решая её получим тот же ответ. И в первом и во втором способах решения виден и химизм задачи, и математические операции которые необходимо предпринять для её решения.
Доля первого раствора в смеси это w3 – w2, а второго w1 – w3. Отсюда в нашей задаче: 25-20=5 (доля первого раствора). 20-10=10 (доля второго раствора). Если обозначить за x массу первого раствора, то тогда второго будет 3-x. Откуда получаем отношение масс первого и второго растворов: . поэтому масса первого раствора 2 кг, значит второго 1 кг. Этот способ решения является более коротким и простым. Для решения этой же задачи можно использовать и систему уравнений. Масса первого раствора x, а второго y. Тогда первое уравнение системы выглядит так: x+y=3. Находим массу растворённого вещества в полученном растворе: 3*0,2=0,6. Тогда растворённых веществ в первом и втором растворах соответственно 0,1x и 0,25y. Второе уравнение системы: 0,1x+0,25y=0,6. Решая её получим тот же ответ. И в первом и во втором способах решения виден и химизм задачи, и математические операции которые необходимо предпринять для её решения.
Пример 3. Чисто химическая задача. Оксид железа(III) смешали с избытком алюминия, полученную смесь тонко измельчили. Навеску смеси массой 13,4 грамма подожгли. Полученный после реакции остаток полностью растворили в разбавленной серной кислоте, при этом выделилось 5,6 л (н.у.) газа. Определите долю оксида железа (III) в исходной смеси. [5]. Начинаем решение, с химизма задачи составляя уравнения 1-3. Формула: m=M*n. М – молярная масса по таблице Д.И.Менделеева. n – количество
Оксид железа(III) смешали с избытком алюминия, полученную смесь тонко измельчили. Навеску смеси массой 13,4 грамма подожгли. Полученный после реакции остаток полностью растворили в разбавленной серной кислоте, при этом выделилось 5,6 л (н.у.) газа. Определите долю оксида железа (III) в исходной смеси. [5]. Начинаем решение, с химизма задачи составляя уравнения 1-3. Формула: m=M*n. М – молярная масса по таблице Д.И.Менделеева. n – количество
1.Fe2O3+2Al→Al2O3+2Fe
2.Fe+H2SO4→FeSO4+H2
3. 2Al+ 3H2SO4→ Al2(SO4)3+3H2
Химический анализ позволяет вычислить количество водорода: 5,6:22,4=0,25 моль. Обозначим количество оксида железа в смеси x, а количество алюминия y. Отсюда получаем первое уравнение в системе: 160x+27y=13,4. Алюминий в избытке, остаётся и реагирует (уравнение 3), а расчёт ведём по оксиду железа (он полностью расходуется). Количество Fe2O3 x, тогда количество оставшегося Al (y-2x), по уравнениию 1. По уравнениям 2, 3 получаем, что количество железа равно количеству водорода, равно 1,5 от количества алюминия. Значит, второе уравнение выглядит так: 2x+1,5(y-2x)=0,25. Решая их, находим количества веществ в смеси, их массу и долю.
Количество Fe2O3 x, тогда количество оставшегося Al (y-2x), по уравнениию 1. По уравнениям 2, 3 получаем, что количество железа равно количеству водорода, равно 1,5 от количества алюминия. Значит, второе уравнение выглядит так: 2x+1,5(y-2x)=0,25. Решая их, находим количества веществ в смеси, их массу и долю.
Таким образом, рассмотренные примеры позволяют сделать вывод: решение сложных химических задач математическими способами обеспечивает не только формирование метапредметных результатов обучения, но и способствует:
- проявлению учащимися познавательной активности,
- осознанию целей учения, планирования и организации своей работы,
- умения себя проверить, проявить интерес к знаниям, ставить проблемы и искать способы их решения.
Литература
- Кондаков А.М., Кузнецов А.А. Концепция государственных образовательных стандартов общего образования (стандарты второго поколения).
 М. «Просвещение» 2008. с. 24.
М. «Просвещение» 2008. с. 24. - Пидкасистый П.И., Педагогика. Учебное пособие для студентов педвузов. Педагогическое общество России. М. 1998. С.204.
- Штремплер, Г.И., Хохлова А.И. Методика решения расчётных задач по химии 8-11// Москва просвещение 2001. с.5-7.
- Журнал «Математика»// издание 36, «Просвещение» 2004. С.16, 31.
- © СтатГрад 2017−2018, пробные варианты по химии ХИ10404 задание 34, сайт statgrad.org
Стратегии решения проблем STEM
Запутались при решении задач по химии, математике или физике и не знаете, что с этим делать? Вот несколько советов.
Выполните домашнее задание, чтобы изучить концепцию, а не конкретную проблему.
Можете ли вы прочитать задачу и понять, какой вопрос она задает? Можете ли вы определить формулу в задаче? Прежде чем решать проблемы, изучите концепции и убедитесь, что вы их понимаете. Понимание концепции имеет решающее значение для решения сложных проблем, с которыми вы столкнетесь! «Запоминать и применять математические формулы, не понимая их, все равно, что повторять русские слова, не зная, что они означают. Вы не говорите на языке. Вы только имитируете его шумы». (Паук)
Вы не говорите на языке. Вы только имитируете его шумы». (Паук)
| Решить проблему | Объясните процесс |
|---|---|
| Объясните процесс и сделайте пометки для личного понимания. Вставьте вопрос, который вам нужно обсудить с профессором. Попробуйте в одном-двух предложениях описать этапы решения проблемы. |
Устраните неполадки вместе с преподавателем или наставником.
Пусть ваш профессор или репетитор посмотрит, как вы решаете задачу, вместо того, чтобы показывать, как это делать. Ваш профессор сможет лучше определить точное место, где вы застряли, наблюдая за тем, как вы решаете проблемы.
Используйте домашнюю работу в качестве учебного пособия.
- Используйте свою домашнюю работу как проверку понятий, которые вы узнали в классе. Запишите свою домашнюю работу в организованном порядке. Это может пригодиться вам, когда вы пытаетесь решить более сложные задачи или подготовиться к тесту.
- Прежде чем приступить к вычислениям, обратите внимание на то, что дано, какие отношения установлены или подразумеваются, и что нужно найти или доказать.
- Найдите похожие примеры задач в своем учебнике и используйте другой учебник или дополнительный учебный материал для проработки понятий/задач.
- Решайте задачи каждый день и приступайте к выполнению задания пораньше! Выполняйте упражнения на тренировку только после того, как убедитесь, что поняли материал. В противном случае это тратит время и заставляет вас помнить неправильные процедуры.
- Сделайте справочный лист. Извлеките ключевую информацию и формулы, чтобы вы могли обращаться к ним при необходимости. Это также поможет вам подготовить карточку для экзамена, если это разрешено профессором.

Проанализируйте, как вы готовитесь к уроку.
- Подготовьтесь к уроку, просмотрев в учебнике концепции, формулы, графики и общие идеи.
- Используйте примеры из класса в качестве начальных практических задач, а затем решайте свои собственные практические задачи, чтобы убедиться, что вы можете решать разные задачи.
- Прочитайте группу задач и посмотрите, сможете ли вы определить их сходство.
- Перед посещением занятий выполните одно или два практических задания по материалу, который будет преподаваться в этот день. Генерация собственных идей о том, как решить проблему (даже если она ошибочна), увеличивает ваше понимание при изучении правильных шагов.
- Если числа настолько велики, малы или сложны, что мешают анализу проблемы, попробуйте заменить их более простыми числами. Это может показать, как решить проблему.
Используйте практические тесты в качестве учебного пособия.
- Пройдите практический тест в тестовой среде.
 Используйте только те ресурсы, которые у вас будут на момент теста, и в то время, которое вам будет позволено. Не смотрите на ответы слишком быстро. Сначала попробуйте решить проблему самостоятельно.
Используйте только те ресурсы, которые у вас будут на момент теста, и в то время, которое вам будет позволено. Не смотрите на ответы слишком быстро. Сначала попробуйте решить проблему самостоятельно. - Используйте эти тесты, чтобы выяснить, какой информации вам не хватает и какие концепции вы не понимаете. Составьте список концепций, чтобы больше практиковаться.
- Пройдите пробный тест и задайте вопросы ассистенту или профессору.
- Посмотрите на цели главы для потенциального учебного пособия или практического теста.
Накопительное исследование для большего прогресса.
Часто то, что вы изучаете на ранних этапах курса, будет строительными блоками, на которые будут накладываться более важные знания. Тщательно создавайте свою базу знаний и не пропускайте первые главы курса. Кроме того, не забудьте проверить, что вы пропустили в тесте, чтобы убедиться, что вы понимаете концепции будущих тестов.
Адаптировано с разрешения Джесси Нельсона, директора Центра академического успеха Орегонского государственного университета.
«Все инструменты и рабочие листы | Стратегии по математике, химии, физике | Академический центр успеха | Университет штата Орегон». По состоянию на 3 ноября 2015 г. http://success.oregonstate.edu/learning-corner/all-tools-worksheets.
Паук, Уолтер. Как учиться в колледже. Бостон, Массачусетс: Houghton Mifflin, 1974.
Искусство решения задач в органической химии, 2-е издание
Выбранный тип: Мягкая обложка
Количество:
Печать по требованию
51,95 $
Цифровая пробная копия
Запросить цифровую оценочную копию Мигель Э. Алонсо-Амелот
Алонсо-Амелот
ISBN: 978-1-118-53021-4 август 2014 г. 480 страниц
Электронная книга
Всего от 42 долларов США
Распечатать
Всего от 51,95 долл. США
Электронная книга com are delivered on the VitalSource platform. To download and read them, users must install the VitalSource Bookshelf Software.</li><li>E-books have DRM protection on them, which means only the person who purchases and downloads the e-book can access it.</li><li>E-books are non-returnable and non-refundable.</li><li>To learn more about our e-books, please refer to our <a href="https://www.wiley.com/wiley-ebooks" target="_blank">FAQ</a>.</li></ul>” data-original-title=”” title=””/>
42,00 $
Мягкая обложка
51,95 $
Загрузить рекламный проспект
Загрузить рекламный проспект
Загрузить флаер продукта для загрузки PDF в новой вкладке. Это фиктивное описание.
Загрузить флаер продукта — загрузить PDF в новой вкладке. Это фиктивное описание.
Загрузить флаер продукта — загрузить PDF в новой вкладке. Это фиктивное описание.
Загрузить флаер продукта — загрузить PDF в новой вкладке. Это фиктивное описание.
Это фиктивное описание.
Загрузить флаер продукта — загрузить PDF в новой вкладке. Это фиктивное описание.
Загрузить флаер продукта — загрузить PDF в новой вкладке. Это фиктивное описание.
Загрузить флаер продукта — загрузить PDF в новой вкладке. Это фиктивное описание.
Описание
Это долгожданное новое издание помогает учащимся понять и решить сложные проблемы, с которыми регулярно сталкиваются химики-органики, используя пошаговый метод и доступный текст. При решенных и проработанных проблемах автор ориентирует обсуждение каждой посредством применения различных приемов решения проблем.
- Обучает химиков-органиков структурированным и логическим методам решения проблем с реакциями и использует уникальный систематический подход.
- Подчеркивает логику и стратегию механистического решения проблем — ключевой элемент успеха органической химии, помимо конкретных реакций и фактов.
- Использует 60 решенных и отработанных задач и схем реакций, с которыми учащиеся могут попрактиковаться, а также обновленные органические реакции и иллюстрированные примеры
- Включает веб-сайт с дополнительными материалами для глав и задач: http://tapsoc.
 yolasite.com
yolasite.com
Об авторе
Мигель Э. Алонсо-Амелот — профессор органической и экологической химии Университета Лос-Андес в Венесуэле. Обладая более чем 40-летним опытом преподавания, он также вел курсы по этим темам в США, Европе и Латинской Америке. Его предыдущие исследовательские интересы включают теорию и применение карбеноидов металлов в циклопропанах и гетероциклах. В настоящее время он занимается химической экологией тропических горных экосистем и является консультантом по органической химии, поддерживающей биологическую активность растительных натуральных продуктов. Среди своих публикаций д-р Алонсо написал более 90 исследовательских статей, пять глав в книгах и четыре книги, в том числе первое издание «Искусство решения задач в органической химии» , опубликованное Wiley.
Разрешения
Запросить разрешение на повторное использование контента с этого сайта
Содержание
Предисловие xi
Предисловие к первому изданию xvii
Благодарности xix
1 Анализ проблем механизма органических реакций 1
1.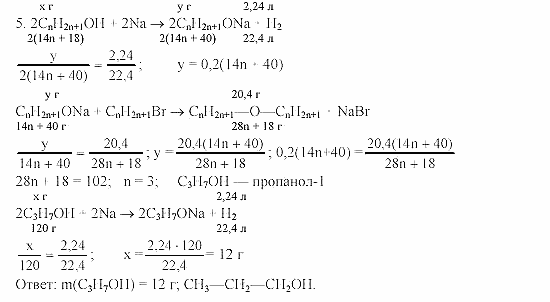 1 Обзор 1
1 Обзор 1
1,2 Введение 1
1.2.1 «Шаг вперед». Решение в формальных и исчерпывающих терминах 2
1.2.2 Уроки из этого примера 7
1.3. Уничтожение Quagmire 7
1.4. Основы. Этапы анализа проблемы 8
1.4.1 Признание проблемы 8
1.4.2 Анализ проблемы путем постановки правильных вопросов, отбрасывания неуместных 11
1.4.3 Составление первого плана руководства 12
1.4.4 Задание Правильные вопросы и предложение правильных ответов. . . достаточно? 13
1,5.
2.3.1 Проблема 1: Электроны внутри орбиталей 22
2.3.2 Проблема 2: Перенос электронов и стереохимия 23
2.3.3 Проблема 3: Уровень энергии электронов и доступность 24
2.3.4 Вопрос 4: Электронный поток и молекулярные активные секторы 26
2.3.4.1 Случай A: π–π-взаимодействия 26
2.3.4.2 Случай B: π → σ-взаимодействия 27
2.3.4.3 Случай C: Когда 27
2.3.5 Проблема 5: Электронный трафик и различия электронной плотности 31
2. 3.5.1 M 0 Металлы как источник электронов 31
3.5.1 M 0 Металлы как источник электронов 31
2.3.5.2 Гидриды металлов и органические гидриды 3 как источник электронов2
2.3.6 Проблема 6: Создание зон высокой электронной плотности 34
2.3.6.1. Природная поляризация 35
2.3.6.2 Обратите внимание на естественную поляризацию: Umpolung 35
2.3.7 Выпуск 7: Поток электронов и зоны низкой плотности электронных Создание нового LEDZ в субстрате 37
2.3.7.3 Обнаружение неожиданных LEDZ среди других реагентов в смеси 41
2.3.7.4 Когда соединения проявляют двойную индивидуальность 42
2.4 Подведение итогов 42
2.5 Организованная блок-схема анализа проблемы 44
Список литературы и примечания 45
3 Дополнительные методы для постулирования механизмов органической реакции 49
3.1 Обзор 49
3.2. Следите за своим временем 50
3.3. 50
3.3.2 Двухмерные и трехмерные изображения и «плоские» органические соединения 52
3.

 М. «Просвещение» 2008. с. 24.
М. «Просвещение» 2008. с. 24.
 Используйте только те ресурсы, которые у вас будут на момент теста, и в то время, которое вам будет позволено. Не смотрите на ответы слишком быстро. Сначала попробуйте решить проблему самостоятельно.
Используйте только те ресурсы, которые у вас будут на момент теста, и в то время, которое вам будет позволено. Не смотрите на ответы слишком быстро. Сначала попробуйте решить проблему самостоятельно. yolasite.com
yolasite.com