Задачи на растворимость | CHEMEGE.RU
Растворимость (Р, χ или ks) – это характеристика насыщенного раствора, которая показывает, какая масса (или объем для газов) растворенного вещества может максимально раствориться в 100 г растворителя. Размерность растворимости — г/ 100 г воды. Поскольку мы определяем массу соли, которая приходится на 100 г воды, в формулу растворимости добавляем множитель 100:
здесь mр.в. – масса растворенного вещества, г
mр-ля – масса растворителя, г
Иногда используют обозначение коэффициент растворимости kS.
Задачи на растворимость, как правило, вызывают сложности, так как эта физическая величина для школьников не очень привычна.
Как же решать задачи на растворимость? Я использую два способа. Давайте их рассмотрим на фрагменте задачи из реального ЕГЭ по химии 2019 года, где впервые появились задачи с упоминанием растворимости.
Давайте их рассмотрим на фрагменте задачи из реального ЕГЭ по химии 2019 года, где впервые появились задачи с упоминанием растворимости.
«Растворимость безводного карбоната натрия при некоторой температуре составляет 31,8 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество карбоната натрия к 400 мл воды.»
Первый способ.
Растворимость не показывает реальное количество соли или количество воды. Это всего лишь способ выражения концентрации в насыщенных растворах, величина, которая показывает, как соотносятся масса растворенного вещества и масса воды (или другого растворенного вещества)! Например, в условии задачи растворимость карбоната натрия 31,8 г на 100 г воды означает, что для растворения каждых 31,8 г соли необходимо 100 г воды. Зато из этих данных можно определить массовую долю растворенного вещества. Рассмотрим этот эталонный раствор, в котором содержится 31,8 г соли и 100 г воды. Массовая доля соли в таком растворе составляет:
Массовая доля соли в таком растворе составляет:
ωр.в. = mр.в./mр-ра = 31,8 г/131,8 г = 0,2413 или 24,13%
Но в нашем, реальном растворе, который получается при растворении карбоната натрия в 400 г воды, массовая доля соли такая же!
Зная массу воды и массовую долю соли, мы без труда составим уравнение и определим массу соли в реальном растворе:
ωр.в. = mр.в./(mр.в. + mр-ра)
0,2413 = mр.в./(mр.в. + 400)
mр.в. = 127,2 г
Получается, масса нитрата натрия в реальном растворе равна 127,2 г.
Второй способ.
Используя все тот же эталонный раствор, мы можем составить пропорцию, чтобы определить массу соли в реальном растворе.
На 100 г воды приходится 31,8 г соли (по условию)
на 400 г воды будет приходиться х г соли (в реальном растворе)
Определяем х из пропорции:
х = 400 г · 31,8 г/100 г = 127,2 г нитрата натрия.
Но будьте осторожны! Пропорции можно составить далеко не для всех величин. Но соотносить массу воды и массу растворенного вещества при неизменной концентрации (массовой доле) растворенного вещества можно и иногда очень удобно. Также пропорциональны масса раствора и масса растворенного вещества, масса воды и масса раствора и т.д.
Задача 1. Массовая доля вещества в насыщенном растворе равна 24% при некоторой температуре. Определите коэффициент растворимости этого вещества при данной температуре.
Еще несколько аналогичных задач:
2. Массовая доля соли в насыщенном растворе при некоторой температуре равна 28,5%. Определите коэффициент растворимости вещества при этой температуре.
3. Определите коэффициент растворимости нитрата калия при некоторой температуре, если массовая доля соли при этой температуре равна 0,48.
4. Какая масса воды и соли потребуется для приготовления 500 г насыщенного при некоторой температуре раствора нитрата калия, если его коэффициент растворимости при этой температуре равен 63,9 г соли в 100 г воды?
5. Коэффициент растворимости хлорида натрия при некоторой температуре составляет 36 г соли в 100 г воды. Определите молярную концентрацию насыщенного раствора этой соли, если плотность раствора 1,2 г/мл.
Коэффициент растворимости хлорида натрия при некоторой температуре составляет 36 г соли в 100 г воды. Определите молярную концентрацию насыщенного раствора этой соли, если плотность раствора 1,2 г/мл.
Ответ: 5,49М
6. Какая масса соли и 5% раствора её потребуется для приготовления 450г насыщенного при некоторой температуре раствора сульфата калия, если его коэффициент растворимости при этой температуре равен 439г/1000г воды?
7. Какая масса нитрата бария выделится из раствора, насыщенного при 100ºС и охлаждённого до 0ºС, если во взятом растворе было 150мл воды? Коэффициент растворимости нитрата бария при температурах 0ºС и 100ºС равен соответственно 50г и 342г в 100г воды.
8. Коэффициент растворимости хлорида калия при 90ºС равен 500г/л воды. Сколько граммов этого вещества можно растворить в 500г воды при 90ºС и какова его массовая доля в насыщенном растворе при этой температуре?
9. В 500г воды растворено при нагревании 300г хлорида аммония. Какая масса хлорида аммония выделится из раствора при его охлаждении до 50ºС, если коэффициент растворимости соли при этой температуре равен 50г/л воды?
В 500г воды растворено при нагревании 300г хлорида аммония. Какая масса хлорида аммония выделится из раствора при его охлаждении до 50ºС, если коэффициент растворимости соли при этой температуре равен 50г/л воды?
Рассмотрим несколько примеров решения задач на растворимость из реальных ЕГЭ по химии.
10. Растворимость безводного карбоната натрия при некоторой температуре составляет 31,8 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество карбоната натрия к 400 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора сульфата железа(III). К раствору во второй колбе добавили 300 г раствора азотной кислоты, также взятой в избытке. При этом, объём газа, выделившийся из второй колбы, оказался в 2 раза больше объёма газа, выделившегося из первой колбы. (Объёмы газов измерены при одинаковых условиях). Определите массовую долю нитрата натрия в конечном растворе во второй колбе.
Первый этап.
Определяем массу карбоната натрия, который растворится в 400 мл воды:
На 100 г воды приходится 31,8 г соли (по условию)
на 400 г воды будет приходиться х г соли (в реальном растворе)
Определяем х из пропорции:
х = 400 г · 31,8 г/100 г = 127,2 г нитрата натрия.
n(Na2CO3) = m(Na2CO3)/M = 127,2 г/106 г/моль = 1,2 моль
Массовая доля карбоната натрия в этом растворе:
ω(Na2CO3) = m(Na2CO3)/mр-ра = 127,2 г/(127,2 г + 400 г) = 0,2413 или 24,13%
Далее раствор карбоната натрия разделили на две порции. Как решать задачи с порциями (частями)? Очень просто. Во всем исходном растворе и в порциях (частях), которые мы отделили от основного раствора, кое-что не меняется. Давайте порассуждаем, что именно.
Меняется ли масса раствора? Без сомнения, мы же разделяем раствор на части.
Меняется ли масса растворенного вещества? Также без сомнения — часть вещества попадет в одну порцию, часть в другую.
А меняется ли массовая доля растворенного вещества? Или соотношение массы растворенного вещества и воды, или другое соотношение? Конечно, не изменяется, ведь раствор — это гомогенная система, в которой вещество распределено равномерно.
Второй этап.
В первой колбе протекает реакция:
3Na2CO3 + Fe2(SO4)3 + 3H2O = 2Fe(OH)3 + 3CO2 + 3Na2SO4
Это типичный пример реакции необратимого гидролиза.
Во второй колбе протекает реакция:
Na2CO3 + 2HNO3 = 2NaNO3 + CO2 + H2O
Пусть в первой колбе выделилось х моль углекислого газа. Количество вещества газов соотносится также, как объемы газов. Поэтому можно сказать, что во второй колбе выделится 2х моль углекислого газа.
Получается, что в первой колбе в реакцию вступает х моль карбоната натрия, а во второй колбе 2х моль карбоната натрия. Общее количество вещества карбоната натрия известно, получаем уравнение:
х + 2х = 1,2
Отсюда х = 0,4 моль.
Во второй колбе количество и масса карбоната натрия:
n2(Na2CO3) = 2х = 0,8 моль
m2(Na2CO3) = n2(Na2CO3)·M = 0,8 моль·106 г/моль = 84,8 г
Масса раствора карбоната во второй колбе (массовая доля соли в исходном растворе и в двух колбах не изменяется):
mр-ра,2(Na2CO3) = m2(Na2CO3)/ω = 84,8 г / 0,2413 = 351,47 г
Масса углекислого газа, который выделился во второй реакции:
m2(CO2) = n2(CO2)·M(СО2) = 0,8 моль·44 г/моль = 35,2 г
Масса нитрата натрия во второй колбе:
m2(NaNO3) = n2(NaNO3)·M(NaNO3) = 1,6 моль·85 г/моль = 136 г
Масса конечного раствора во второй колбе:
mр-ра,2 = mр-ра,2(Na2CO3) + mр-ра(HNO3) — m(CO2) = 351,47 г + 300 г — 35,2 г = 616,27 г
Массовая доля нитрата натрия в конечно растворе во второй колбе:
ω2(NaNO3) = m2(NaNO3)/mр-ра,2 = 136 г/616,27 г = 0,2207 или 22,07%
Ответ: ω(NaNO3) = 22,07%
Решение и ответ
Свернуть
11. Растворимость безводного сульфида натрия при некоторой температуре составляет 15,6 г на 100 г воды. При этой температуре приготовили 289 г насыщенного раствора сульфида натрия. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора хлорида алюминия. К раствору во второй колбе добавили 100 г соляной кислоты, также взятой в избытке. При этом объём газа, выделившийся из второй колбы, оказался в 1,5 раза больше объёма газа, выделившегося из первой колбы. (Объёмы газов измерены при одинаковых условиях). Определите массовую долю хлорида натрия в конечном растворе во второй колбе.
Растворимость безводного сульфида натрия при некоторой температуре составляет 15,6 г на 100 г воды. При этой температуре приготовили 289 г насыщенного раствора сульфида натрия. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора хлорида алюминия. К раствору во второй колбе добавили 100 г соляной кислоты, также взятой в избытке. При этом объём газа, выделившийся из второй колбы, оказался в 1,5 раза больше объёма газа, выделившегося из первой колбы. (Объёмы газов измерены при одинаковых условиях). Определите массовую долю хлорида натрия в конечном растворе во второй колбе.
12. Растворимость безводного хлорида алюминия при некоторой температуре составляет 53,4 г на 100 г воды. При этой температуре приготовили 306,8 г насыщенного раствора хлорида алюминия. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора карбоната калия. К раствору во второй колбе добавили 300 г раствора аммиака, также взятого в избытке.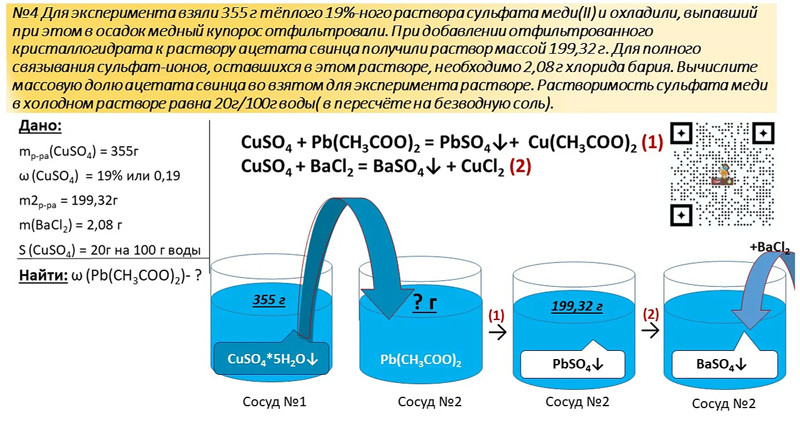 При этом, масса осадка, выпавшего во второй колбе, оказалась в 3 раза больше массы осадка, выпавшего в первой колбе. Определите массовую долю хлорида аммония в конечном растворе во второй колбе.
При этом, масса осадка, выпавшего во второй колбе, оказалась в 3 раза больше массы осадка, выпавшего в первой колбе. Определите массовую долю хлорида аммония в конечном растворе во второй колбе.
13. Растворимость безводного карбоната аммония при некоторой температуре составляет 96 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество карбоната аммония к 250 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток твёрдого гидроксида натрия и нагрели. К раствору во второй колбе добавили 250 г соляной кислоты, также взятой в избытке. При этом объём газа, выделившийся из второй колбы, оказался в 3 раза меньше объёма газа, выделившегося из первой колбы. (Объёмы газов измерены при одинаковых условиях). Определите массовую долю соли в конечном растворе во второй колбе.
14. Растворимость безводного карбоната натрия при некоторой температуре составляет 31,8 г на 100 г воды. Насыщенный раствор, приготовленный при этой температуре добавлением необходимого количества карбоната натрия к 200 мл воды, разделили на две части. К первой части прилили избыток соляной кислоты. При этом выделилось 4,48 л (н.у.) газа. Ко второй части насыщенного раствора добавили 222 г 25%-ного раствора хлорида кальция. Определите массовую долю хлорида кальция в полученном растворе.
Насыщенный раствор, приготовленный при этой температуре добавлением необходимого количества карбоната натрия к 200 мл воды, разделили на две части. К первой части прилили избыток соляной кислоты. При этом выделилось 4,48 л (н.у.) газа. Ко второй части насыщенного раствора добавили 222 г 25%-ного раствора хлорида кальция. Определите массовую долю хлорида кальция в полученном растворе.
15. Растворимость безводного сульфата железа(II) при некоторой температуре составляет 30,4 г на 100 г воды. При этой температуре приготовили 326 г насыщенного раствора сульфата железа(II). Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора хлорида бария. При этом образовалось 46,6 г осадка. К раствору во второй колбе добавили 50 г 34%-ного раствора аммиака. Определите массовую долю аммиака в конечном растворе во второй колбе.
16. Растворимость безводного сульфата алюминия при некоторой температуре составляет 34,2 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество сульфата алюминия к 300 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора аммиака. При этом образовалось 15,6 г осадка. К раствору во второй колбе добавили 320 г 25%-ного раствора гидроксида натрия. Определите массовую долю сульфата натрия в конечном растворе во второй колбе.
При этой температуре приготовили насыщенный раствор, добавив необходимое количество сульфата алюминия к 300 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора аммиака. При этом образовалось 15,6 г осадка. К раствору во второй колбе добавили 320 г 25%-ного раствора гидроксида натрия. Определите массовую долю сульфата натрия в конечном растворе во второй колбе.
17. Растворимость безводного карбоната натрия при некоторой температуре составляет 31,8 г на 100 г воды. Приготовленный при этой температуре насыщенный раствор карбоната натрия массой 395,4 г разделили на две части. К первой части прилили избыток раствора нитрата кальция. При этом образовалось 50 г осадка. Ко второй части насыщенного раствора добавили 252 г 30%-ного раствора азотной кислоты. Определите массовую долю азотной кислоты в образовавшемся растворе.
18. Растворимость безводного сульфата железа(II) при некоторой температуре составляет 30,4 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество сульфата железа(II) к 250 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора гидроксида натрия. При этом образовалось 18 г осадка. К раствору во второй колбе добавили 870 г 15%-ного раствора нитрата бария. Определите массовую долю нитрата бария в конечном растворе во второй колбе.
При этой температуре приготовили насыщенный раствор, добавив необходимое количество сульфата железа(II) к 250 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора гидроксида натрия. При этом образовалось 18 г осадка. К раствору во второй колбе добавили 870 г 15%-ного раствора нитрата бария. Определите массовую долю нитрата бария в конечном растворе во второй колбе.
19. Растворимость безводного сульфида натрия при некоторой температуре составляет 15,6 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество сульфида натрия к 250 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора соляной кислоты. При этом выделилось 4,48 л (н.у.) газа. К раствору во второй колбе добавили 450 г 15%-ного раствора хлорида меди(II). Определите массовую долю хлорида меди(II) в конечном растворе во второй колбе.
21. Растворимость безводного хлорида кальция при некоторой температуре составляет 55,5 г на 100 г воды. Насыщенный раствор, приготовленный при этой температуре добавлением необходимого количества хлорида кальция к 160 мл воды, разлили на две колбы. В первую колбу добавили избыток раствора карбоната натрия. При этом выпал осадок массой 30 г. Во вторую колбу добавили 595 г 40%-ного раствора нитрата серебра. Определите массовую долю нитрата серебра в растворе, образовавшемся во второй колбе.
Насыщенный раствор, приготовленный при этой температуре добавлением необходимого количества хлорида кальция к 160 мл воды, разлили на две колбы. В первую колбу добавили избыток раствора карбоната натрия. При этом выпал осадок массой 30 г. Во вторую колбу добавили 595 г 40%-ного раствора нитрата серебра. Определите массовую долю нитрата серебра в растворе, образовавшемся во второй колбе.
22. Растворимость безводного гидрокарбоната натрия при некоторой температуре составляет 12,6 г на 100 г воды. При этой температуре приготовили 450,4 г насыщенного раствора гидрокарбоната натрия. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора гидроксида бария. При этом образовалось 39,4 г осадка. К раствору во второй колбе добавили 245 г 20%-ного раствора серной кислоты. При этом образовалась средняя соль. Определите массовую долю серной кислоты в конечном растворе во второй колбе.
23. Растворимость хлорида алюминия при некоторой температуре составляет 53,4 г на 100 г воды.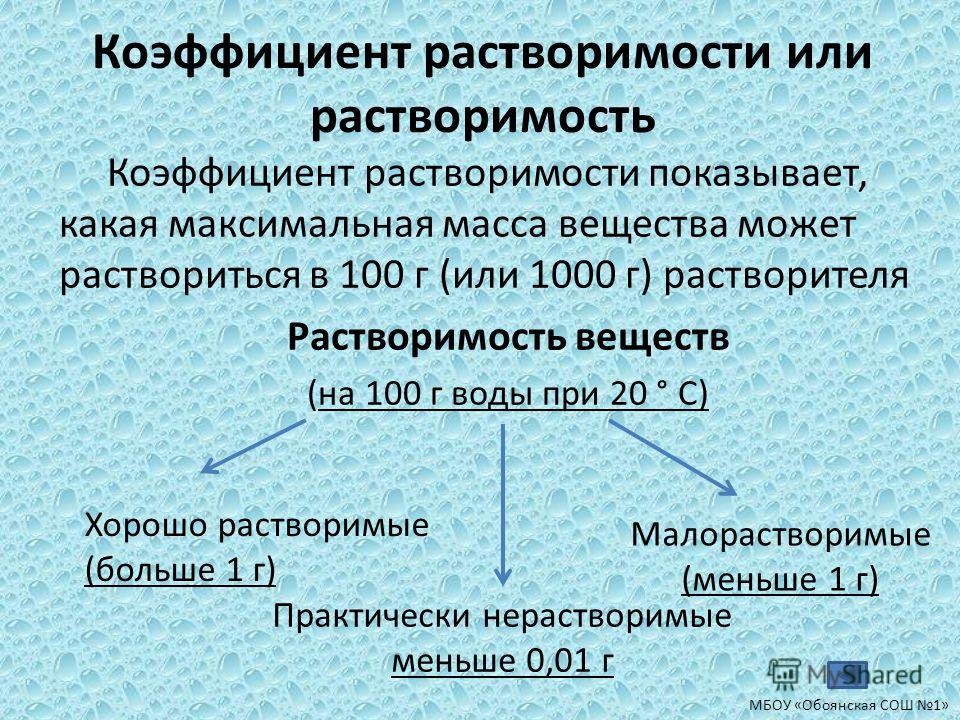 Приготовленный при этой температуре насыщенный раствор хлорида алюминия массой 767 г разлили по двум колбам. В первую колбу добавили избыток раствора нитрата серебра, при этом выпало 344,4 г осадка. Во вторую колбу добавили 960 г 40%-ного раствора гидроксида натрия. Вычислите массовую долю хлорида натрия в растворе, образовавшемся во второй колбе.
Приготовленный при этой температуре насыщенный раствор хлорида алюминия массой 767 г разлили по двум колбам. В первую колбу добавили избыток раствора нитрата серебра, при этом выпало 344,4 г осадка. Во вторую колбу добавили 960 г 40%-ного раствора гидроксида натрия. Вычислите массовую долю хлорида натрия в растворе, образовавшемся во второй колбе.
24. Растворимость безводного сульфата железа(II) при некоторой температуре составляет 30,4 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество сульфата железа(II) к 400 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора аммиака. При этом образовалось 27 г осадка. К раствору во второй колбе добавили 780 г 20%-ного раствора хлорида бария. Определите массовую долю хлорида бария в конечном растворе во второй колбе.
25. Растворимость безводного хлорида кальция при некоторой температуре составляет 55,5 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество хлорида кальция к 300 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора нитрата серебра. При этом образовалось 143,5 г осадка. К раствору во второй колбе добавили 1272 г 10%-ного раствора карбоната натрия. Определите массовую долю карбоната натрия в конечном растворе во второй колбе.
Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора нитрата серебра. При этом образовалось 143,5 г осадка. К раствору во второй колбе добавили 1272 г 10%-ного раствора карбоната натрия. Определите массовую долю карбоната натрия в конечном растворе во второй колбе.
26. Растворимость безводного сульфита натрия при некоторой температуре составляет 25,2 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество сульфита натрия к 300 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток концентрированной азотной кислоты. При этом выделился бурый газ. К раствору во второй колбе добавили 300 г раствора соляной кислоты, также взятой в избытке. При этом, объём газа, выделившийся из второй колбы, оказался равен объёму газа, выделившемуся из первой колбы. (Объёмы газов измерены при одинаковых условиях). Определите массовую долю хлорида натрия в конечном растворе во второй колбе.
27. Растворимость безводного сульфита натрия при некоторой температуре составляет 25,2 г на 100 г воды. При этой температуре приготовили 250,4 г насыщенного раствора сульфита натрия. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора сульфата алюминия. К раствору во второй колбе добавили 200 г разбавленного раствора серной кислоты, также взятой в избытке. При этом, объём газа, выделившийся из второй колбы, оказался в 3 раза меньше объёма газа, выделившегося из первой колбы. (Объёмы газов измерены при одинаковых условиях). Определите массовую долю соли в конечном растворе во второй колбе. (Учитывать образование только средних солей).
Понравилось это:
Нравится Загрузка…
Задачи по химии. Растворимость
20 Сен
Posted on Author admin 5
Чтобы поделиться, нажимайте
Задачи на тему Растворимость.

Предлагаем вашему вниманию задачи по теме Растворимость с подробными видео-объяснениями (даны сразу после условий задания) и ответами (приведены в конце страницы).
Составитель — репетитор по химии в Skype или Zoom — Александр Владимирович Коньков (подробнее здесь)
Рассчитайте массу (г) фосфата натрия, который необходимо растворить в воде объёмом 0,5 л, чтобы приготовить насыщенный при 40С раствор, если растворимость соли при указанной температуре равна 233 г/л.
Какой объём воды (см
3) необходимо взять, для растворения 89,2 г хлорида бария, чтобы приготовить насыщенный при 20С раствор? Растворимость соли при этой температуре равна 35,7 г/100г воды.
Какова растворимость (г/л) нитрата калия при 25С, если в насыщенном при этой температуре растворе массой 150 г содержится соль массой 41,225 г?
Растворимость хлорида калия при 20С равна 34,4 г/100 г воды. Вычислите массу (г) хлорида калия, содержащегося в насыщенном при этой температуре растворе массой 800 г.
Рассчитайте массу (г) воды, которую необходимо взять для приготовления насыщенного при 30С раствора массой 150 г, если Ks (Li
2SO4) = 34,1 г/100 г воды.
При 10С насыщенный раствор карбоната натрия имеет массовую долю соли 8,85%. Определить растворимость Na
2CO3 (г/л) при 10С.
Имеется 400 г насыщенного при 60С раствора нитрата калия.
 Какая масса (г) KNO3 выкристаллизуется из раствора при охлаждении до 35С, если коэффициент растворимости нитрата калия при 60С равен 110 г/100 г воды, а при 35С – 57 г/100 г воды?
Какая масса (г) KNO3 выкристаллизуется из раствора при охлаждении до 35С, если коэффициент растворимости нитрата калия при 60С равен 110 г/100 г воды, а при 35С – 57 г/100 г воды?
Растворимость нитрата серебра в 100 г воды при 30С равна 274,5 г. При охлаждении насыщенного при 30С раствора AgNO
3 массой 300 г до 0С выпал осадок массой 121,95 г. Определите растворимость (г) нитрата серебра при 0С в 100 г воды.
Растворимость хлороводорода в 100 г воды при 0С равна 82,3 г.
 При нагревании 100 г насыщенного при 0С раствора до 50С его масса составила 87,55 г. Определите растворимость HCl (г) при 50С в 100 г воды.
При нагревании 100 г насыщенного при 0С раствора до 50С его масса составила 87,55 г. Определите растворимость HCl (г) при 50С в 100 г воды.
Через раствор гидроксида натрия массой 150 г с массовой долей соли 8% пропустили избыток углекислого газа. Раствор охладили до 0С. Определите массу (г) образовавшегося осадка, если известно, что растворимость образовавшейся соли в 100 г воды при 0С равна 6,9 г.
Ответы:
- 117
- 250
- 379
- 205
- 112
- 97
- 101
- 122
- 60
- 16
В случае, если вы нашли ошибку или опечатку, просьба сообщать об этом автору проекта в контакте https://vk. com/id30891697 или на электронную почту [email protected]
com/id30891697 или на электронную почту [email protected]
Посмотреть видео-объяснения каждого задания ЦТ, РТ и ДРТ всех лет, а также получить условия всех пробных, тренеровочных и реальных вариантов ЕГЭ, вы можете получив полный доступ к сайту кликнув здесь «Получить все материалы сайта»
А также:
- Посмотреть видео-объяснения решений всех типов задач по химии
- Просмотреть все тесты по органической химии с видео-объяснениями
- Просмотреть все тесты по неорганической химии с видео-объяснениями
- Посмотреть пробные варианты ЦТ вы можете здесь,
- Посмотреть пробные и реальные варианты ЕГЭ
- Посмотреть все видео-уроки по различным разделам школьного курса
- Больше заданий РТ с видео-объяснениями
- Больше заданий ЦТ с видео-объяснениями
- Больше заданий ЕГЭ с ответами и видео-объяснениями
- Все видео-объяснения вы можете найти на YouTube канале
 При составлении заданий использованы идеи, которые были использованы составителями ЦТ и РТ, что не является нарушением авторского права. Все материалы сайта используются исключительно в образовательных целях.
При составлении заданий использованы идеи, которые были использованы составителями ЦТ и РТ, что не является нарушением авторского права. Все материалы сайта используются исключительно в образовательных целях.В доказание вышесказанного, привожу выдержки из Закона Республики Беларусь «Об авторском праве и смежных правах»:Статья 7. Произведения, не являющиеся объектами авторского права
Пункт 2. Авторское право не распространяется на собственно идеи, методы, процессы, системы, способы, концепции, принципы, открытия, факты, даже если они выражены, отображены, объяснены или воплощены в произведении.Статья 32. Свободное использование объектов авторского права и смежных прав
Пункт 2. Допускается воспроизведение отрывков из правомерно обнародованных произведений (цитирование) в оригинале и переводе в исследовательских, образовательных, полемических, критических или информационных целях в том объеме, который оправдан целью цитирования.
 Статья 36. Свободное использование произведений в образовательных и исследовательских целях
Статья 36. Свободное использование произведений в образовательных и исследовательских целяхПункт 2. Статьи и иные малообъемные произведения, правомерно опубликованные в сборниках, а также газетах, журналах и других печатных средствах массовой информации, отрывки из правомерно опубликованных литературных и иных произведений могут быть воспроизведены посредством репродуцирования и иного воспроизведения в образовательных и исследовательских целях.
Примеры решения задач по химии
1. Вычислите растворимость поваренной соли в воде при 20°С, массовую долю соли (w), молярную концентрацию соли (С) в насыщенном растворе, если при выпаривании досуха насыщенного при 20°С раствора объёмом 217,4
Решение – обратимся к определениям:
Мс = 23 + 35,5 = 58,5 г/моль,
где: mс – масса соли (г), Мс – молярная масса соли, nс – количество соли (моль).
Набор известных простых формул позволит быстро получить результат.
Итак, количество соли в растворе:
2. Коэффициент растворимости хлорида калия при 90°С равен 54, а при 20°С – соответственно 34. Вычислите массу кристаллов соли, образовавшихся при охлаждении горячего насыщенного раствора массой 300 г от 90°С до 20°С.
Решение – учтём, что коэффициент растворимости показывает отношение массы растворённого вещества (г) к массе растворителя (100 г) в насыщенном при данной температуре растворе. Надо понимать, что при нагревании растворитель как бы принимает всё больше и больше вещества и раствор становится всё крепче и крепче. Наоборот, при охлаждении растворитель уже не держит столько растворённого вещества – растворимость-то уменьшается. Избыток выпадает в осадок.
В нашем случае из условия следует, что массовая доля соли в насыщенном при 90°С растворе равна:
Если масса раствора 300 г, то очевидно, что масса соли в насыщенном горячем растворе
а масса воды
Именно эта вода при охлаждении раствора с учётом коэффициента растворимости удержит в растворе только:
–столько соли может быть в нашем растворе при 20°С.
Разница ( ) выпадает в осадок:
mкрист = 105,3 – 66,2 = 39,1 г
3. Определите состав мирабилита, содержащего в основном гидратированный сульфат натрия с небольшой долей нелетучих примесей (3,4 масс.%), если при прокаливании до постоянной массы образца минерала (10 г) потеря массы составила 5,4 г.
Решение – во-первых, ясно, что в образце масса собственно кристаллогидрата с учётом примесей составляет 10(1 – 0,034) = 9,66 г.
Во-вторых, прокаливание до постоянной массы означает полную дегидратацию по уравнению:
Далее – как обычно:
-по уравнению реакции
-по условию задачи
9,66 г крист.-гидр. – 5,4 г h3O
Откуда (142 + 18х)5,4 = 18х9,66 и х = 10.
Значит, мирабилит – это десятиводный сульфат натрия с небольшой долей примесей.
4. Определите массу этиленгликоля (НОСН2СН2ОН), который нужно растворить в воде объёмом 1 литр для приготовления антифриза с температурой замерзания –35°С.
Решение. По 2 закону Рауля: , где Kk – криоскопическая постоянная растворителя (воды), Cm – моляльность раствора, моль/кг.
Моляльность раствора (моль/кг):
Поэтому:
Молярная масса этиленгликоля: = 62 г/моль,
C учётом плотности воды r = 1 кг/л, =rV = 1 кг, получаем ответ:
5. Вычислите объём (м3, н. у.) водорода, выделившегося при электролизе слегка подсоленной (для лучшей проводимости) воды массой 1 т.
= 18 г/моль, Vo = 22,4 л/моль – мольный объём (объём одного моля любого газа при нормальных условиях).
-по уравнению реакции
-по условию задачи
6. Вычислите минимальный расход (м3) воды для гашения извести после прокаливания известняка массой 10 т с заметной долей (20 %) инородных примесей.
Решение – сущий пустяк:
С учётом примесей масса карбоната кальция в известняке 8 т = 8106 г.
Глядя на уравнения обжига и гашения, видим, что мольное соотношение разлагающегося карбоната CaCO3, оксида кальция CaO и воды h3O равно 1 : 1 : 1, т. е. моль на моль. И опять:
-по уравнению реакции
-по условию задачи
7. В стакане с водой объёмом 250 мл растворили сульфат магния массой 30 г. Вычислите массовую долю соли в растворе, плотность раствора (г/мл), молярную концентрацию соли.
Решение. Основные данные для решения:
8. Вычислите количество (моль) гидроксида калия в растворе объёмом 6 л, в котором массовая доля основания равна 12,2 %. Плотность раствора 1,15 г/мл.
Решение.
9. Вычислите количество (моль) кристаллогидрата , который смешали с водой (100 моль) и получили раствор MgCl2 с массовой долей соли, равной 16,9 %.
Решение. В данном случае необходимо понимать, что растворяем кристаллогидрат, а массовая доля рассчитана на безводную соль. Учтём, что
Учтём, что
10. Вычислите массовую долю гидроксида натрия в растворе (плотность 1,2), в котором молярная концентрация основания равна 6 моль/л.
Решение. Возьмём банку с раствором, к примеру, объёмом 3 л. Тогда, если , то n = СV = 6 моль/л3л = 18 моль. MNaOH = 40 г/моль
m = n M = 18 моль40 г/моль = 720 г – такова масса NaOH в растворе.
Масса раствора при известной плотности:
mр–ра = r*V = 1,2 г/мл*3000 мл = 3600 г.
11. Вычислите молярную концентрацию серной кислоты в растворе, получившемся при смешении крепкого раствора кислоты (V= 44 мл, w = 49 %, r = 1,137) с водой. Объём разбавленного раствора 2,5 л.
Определим количество серной кислоты , воспользовавшись параметрами крепкого раствора: mр–ра = rV = 1,137 г/мл44 мл = 50 г.
Следовательно, mк = wmр-ра = 0,49*50 = 24,5 г. При получаем
12. Вычислите объём (л) раствора соли с молярной концентрацией 3 моль/л, необходимого для приготовления разбавленного раствора этой соли объёмом 5 л и концентрацией соли 0,3 моль/л.
Решение. Сообразим, что в разбавленном растворе количество соли должно составлять
13. Вычислите массу (г) раствора серной кислоты (массовая доля кислоты 80 %), который необходимо смешать с другим раствором серной кислоты массой 0,75 кг (массовая доля кислоты 10 %) для получения раствора с массовой долей кислоты 30 %.
Решение. Сконструируем результат:
14. Вычислите объём (мл) раствора серной кислоты (w = 19,6 %, r = 1,136) для приготовления разбавленного раствора объёмом 500 мл, в котором эквивалентная концентрация кислоты равна 0,2 экв/л (r = 1).
Решение. В разбавленном растворе количество (экв) кислоты составляет
n = СV = 0,2 экв/л0,5 л = 0,1 экв, а масса кислоты (М = 98 г/моль, Э = 98 / 2 = 49 г/экв) mк= 0,1 экв49 г/экв = 4,9 г.
15. В воде содержатся катионы и анионы, концентрации (мэкв/л) которых составляют: Ca2+ – 2,5; Na+ – 1,8; Mg2+ – 0,7; HCO3– – 2,9; Cl– – 1,5; SO42– – 0,6. Определите величины общей, временной и постоянной жёсткости воды.
Определите величины общей, временной и постоянной жёсткости воды.
Решение. Содержание ионов натрия не влияет на величину жёсткости воды. Общая жёсткость определяется суммарным содержанием (мэкв/л) ионов жёсткости:
Временная жёсткость – часть общей, определяемая содержанием (мэкв/л) HCO3– – ионов, но, заметим, Жвр < Жобщ. В нашем случае
Жвр = 2,9 мэкв/л
Так как общая жёсткость есть сумма временной и постоянной жёсткости, то постоянную жёсткость можно рассчитать по разности общей и временной жёсткости:
Жпост = Жобщ – Жвр = 3,2 – 2,9 = 0,3 мэкв/л.
Если в условии этой же задачи концентрация ионов HCO3– составляла бы, к примеру, не 2,9, а 3,9 мэкв/л, то временная жёсткость была бы равна общей жёсткости: Ж`вр = 3,2 мэкв/л, а вот на долю постоянной жёсткости не осталось бы ничего: Ж`пост = Жобщ – Ж`вр = 3,2 – 3,2 = 0 мэкв/л.
16. Вычислите временную, постоянную и общую жёсткость воды, в образце которой объёмом 125 мл обнаружили гидрокарбонат кальция массой 40,5 мг, хлорид натрия массой 115 мг, хлорид кальция массой 11,1 мг, сульфат магния массой 33 мг.
Решение. Хлорид натрия не является солью жёсткости. Временная жёсткость определяется концентрацией гидрокарбоната кальция, а постоянная – концентрацией хлорида кальция и сульфата магния. Рассчитаем эквивалентные массы солей жёсткости
17. Временная (кальциевая) жёсткость в образце воды равна 8 мэкв/л. Вычислите массу (г) накипи после кипячения такой воды объёмом 1,5 м3.
Решение. При кипячении происходит разложение гидрокарбоната кальция по уравнению:
Масса накипи равна массе образовавшегося карбоната кальция. По закону эквивалентов число эквивалентов (n) CaCO3равно числу эквивалентов Ca(HCO3)2:
18. В большую бочку (300 л) с жёсткой водой для её умягчения высыпали и растворили ортофосфат натрия массой 131,2 г. Умягчили, но остаточная жёсткость, как показал анализ, составила 2 мэкв/л. Какова была первоначальная жёсткость воды в бочке?
Решение. Понижение жёсткости объясняется осаждением катионов жёсткости в виде осадков нерастворимых фосфатов. По закону эквивалентов число эквивалентов израсходованного фосфата натрия должно быть равно числу эквивалентов солей жёсткости, бывших в бочке.
По закону эквивалентов число эквивалентов израсходованного фосфата натрия должно быть равно числу эквивалентов солей жёсткости, бывших в бочке.
Достаточно разделить это число на объём воды в бочке, и мы получим величину понижения жёсткости:
Решение задачи о растворимости | Nature Reviews Chemistry
Решение проблемы растворимости
Скачать PDF
Скачать PDF
- Результаты исследований
- Опубликовано:
ГИДРОТРОПИЯ
- Габриэлла Грациано 1
Обзоры природы Химия том 4 , страница 332 (2020)Процитировать эту статью
3161 доступ
2 Цитаты
5 Альтметрический
Сведения о показателях
Предметы
- Зеленая химия
Если бы вода могла растворять как полярные, так и неполярные растворенные вещества, то одного этого растворителя было бы достаточно для всех применений. Хотя такая цель может показаться утопической, химия предлагает несколько хитрых способов растворить неполярные молекулы в воде. Поверхностно-активные вещества, например, имеют полярную головку и неполярный хвост и, в результате, собираются в мицеллы, которые могут вмещать неполярное растворенное вещество внутри ядра, становясь гомогенно диспергированными в воде. Гидротропы похожи на поверхностно-активные вещества в том, что они имеют как полярные, так и неполярные компоненты, но они не агрегируют в мицеллы — они напрямую взаимодействуют с неполярным растворенным веществом, повышая его растворимость в воде. Однако механизм действия гидротропов до конца не ясен. Теперь пишу в Chemical Communications , Жоао Коутиньо и его коллеги описывают, как они использовали 1 H-ЯМР-спектроскопию в сочетании с вычислительными подходами для разработки модели гидротропии и объяснения аполярных взаимодействий, которые ее определяют.
Хотя такая цель может показаться утопической, химия предлагает несколько хитрых способов растворить неполярные молекулы в воде. Поверхностно-активные вещества, например, имеют полярную головку и неполярный хвост и, в результате, собираются в мицеллы, которые могут вмещать неполярное растворенное вещество внутри ядра, становясь гомогенно диспергированными в воде. Гидротропы похожи на поверхностно-активные вещества в том, что они имеют как полярные, так и неполярные компоненты, но они не агрегируют в мицеллы — они напрямую взаимодействуют с неполярным растворенным веществом, повышая его растворимость в воде. Однако механизм действия гидротропов до конца не ясен. Теперь пишу в Chemical Communications , Жоао Коутиньо и его коллеги описывают, как они использовали 1 H-ЯМР-спектроскопию в сочетании с вычислительными подходами для разработки модели гидротропии и объяснения аполярных взаимодействий, которые ее определяют.
Концепция гидротропии берет свое начало в начале 20 века, когда было замечено, что добавление в воду небольших количеств солей органических кислот приводит к увеличению растворимости других органических соединений. Преимущество этого подхода заключается в том, что растворенное вещество может быть извлечено путем снижения концентрации гидротропа, что позволяет избежать необходимости в сложных процессах разделения. С тех пор механизм гидротропии во многом рационализировался. Например, было высказано предположение, что это может быть вызвано самоагрегацией гидротропов, нарушением структуры воды или чисто стехиометрическими аргументами. «Плохое понимание его молекулярных механизмов, вероятно, является причиной того, что гидротропия часто упускается из виду при обсуждении будущего зеленой химии», — говорит Коутиньо.
Преимущество этого подхода заключается в том, что растворенное вещество может быть извлечено путем снижения концентрации гидротропа, что позволяет избежать необходимости в сложных процессах разделения. С тех пор механизм гидротропии во многом рационализировался. Например, было высказано предположение, что это может быть вызвано самоагрегацией гидротропов, нарушением структуры воды или чисто стехиометрическими аргументами. «Плохое понимание его молекулярных механизмов, вероятно, является причиной того, что гидротропия часто упускается из виду при обсуждении будущего зеленой химии», — говорит Коутиньо.
Кредит: адаптировано с разрешения Abranches, D. O. et al. Хим. коммун. https://doi.org/10.1039/D0CC03217D (2020), RSC
Группа под руководством Коутиньо хотела предоставить рациональный механизм гидротропии, который хорошо согласуется со статистической термодинамической картиной, согласно которой гидрофобные взаимодействия приводят к стабилизирующему устройству. гидротропов вокруг неполярных молекул растворенного вещества. «Наша работа основана на усилиях профессора Сейши Симидзу и его сотрудников, которые в течение последних нескольких лет занимались изучением основ гидротропии с использованием статистической термодинамики», — объясняет Коутиньо. «Наше сотрудничество с исследовательской группой во главе с Элизабет Пирес, которая имеет долгую историю разработки и синтеза индивидуальных эфиров глицерина, предоставило доступ к множеству этих соединений с определенной длиной алкильной боковой цепи, что позволило нам провести последовательное исследование. гидротропия, исследуя эффект аполярности путем постепенного увеличения аполярной природы гидротропа». Достижение такой степени понимания механизма гидротропии может в конечном итоге позволить рациональный выбор комбинаций растворенного вещества и гидротропа для конкретных применений.
«Наша работа основана на усилиях профессора Сейши Симидзу и его сотрудников, которые в течение последних нескольких лет занимались изучением основ гидротропии с использованием статистической термодинамики», — объясняет Коутиньо. «Наше сотрудничество с исследовательской группой во главе с Элизабет Пирес, которая имеет долгую историю разработки и синтеза индивидуальных эфиров глицерина, предоставило доступ к множеству этих соединений с определенной длиной алкильной боковой цепи, что позволило нам провести последовательное исследование. гидротропия, исследуя эффект аполярности путем постепенного увеличения аполярной природы гидротропа». Достижение такой степени понимания механизма гидротропии может в конечном итоге позволить рациональный выбор комбинаций растворенного вещества и гидротропа для конкретных применений.
Coutinho et al. выполнили измерения 1 Н-ЯМР-спектроскопии для мониторинга взаимодействий между моноалкилглицериновыми эфирами разной полярности и двумя нерастворимыми в воде органическими кислотами — галловой кислотой и сиринговой кислотой. Было обнаружено, что химический сдвиг аполярных протонов в гидротропах эфира глицерина уменьшается с увеличением концентрации растворенного вещества. Это указывает на то, что аполярная часть гидротопа экранирована растворенным веществом от воды. Это исключает возможность самоагрегации гидротропа, которая не вызвала бы существенного изменения химического сдвига этих протонов.
Было обнаружено, что химический сдвиг аполярных протонов в гидротропах эфира глицерина уменьшается с увеличением концентрации растворенного вещества. Это указывает на то, что аполярная часть гидротопа экранирована растворенным веществом от воды. Это исключает возможность самоагрегации гидротропа, которая не вызвала бы существенного изменения химического сдвига этих протонов.
Затем экспериментальные результаты были рационализированы путем количественной оценки молекулярной поверхности, соответствующей плотности поляризационного заряда, σ. Анализ σ-профилей показал, что растворимость растворенного вещества увеличивается с увеличением площади аполярной поверхности гидротропа и достигает максимума при совпадении площади аполярной поверхности гидротропа и растворенного вещества. Дальнейшее увеличение аполярной поверхности гидротропа приводит, наоборот, к его самоагрегации.
Плохое понимание его молекулярных механизмов, вероятно, является причиной того, что гидротропия часто упускается из виду при обсуждении будущего зеленой химии
«Возможно, самым значительным открытием нашей работы является мысленная картина гидротропии, которую мы теперь можем построить», — говорит Коутиньо. «На наш взгляд, остается ряд принципиальных вопросов. Несмотря на свой возраст, концепция гидротропии остается малоизученной и малоизученной», — заключает он.
«На наш взгляд, остается ряд принципиальных вопросов. Несмотря на свой возраст, концепция гидротропии остается малоизученной и малоизученной», — заключает он.
История изменений
09 июня 2020 г.
Эта статья была обновлена, чтобы исправить незначительную опечатку в заголовке.
Ссылки
Оригинальная статья
Abranches, D. O. et al. Раскрытие механизма гидротропии: свидетельство опосредованной водой агрегации гидротропов вокруг растворенного вещества. Хим. Коммуна . https://doi.org/10.1039/D0CC03217D (2020)
Статья по теме
Бут, Дж. Дж., Эббот, С. и Симидзу, С. Механизм солюбилизации гидрофобных лекарств низкомолекулярными гидротропами. J. Phys. хим. Б 116 , 14915–14921 (2012)
КАС Статья Google ученый
Download references
Author information
Authors and Affiliations
Nature Reviews Chemistry http://www.
 nature.com/natrevchem/
nature.com/natrevchem/Gabriella Graziano
Authors
- Gabriella Graziano
View публикации автора
Вы также можете искать этого автора в PubMed Google Академия
Автор, ответственный за переписку
Габриэлла Грациано.
Права и разрешения
Перепечатка и разрешения
Об этой статье
Скачать PDF
ЗАДАЧИ НА РАЗРЕШИМОСТЬ
Вот несколько практических задач на написание выражений K sp . Напишите химическое уравнение, показывающее диссоциацию вещества, и напишите K sp выражение:
ЧАСТЬ 1:
1) AlPO 4
2) БаСО 4
3) КДС
4) Cu 3 (ПО 4 ) 2
5) КуСКН
6) Hg 2 Br 2
7) АгСН
8) Zn 3 (AsO 4 ) 2
9) Мн(ИО 3 ) 2
10) PbBr 2
11) СРКО 3
12) Би 2 С 3ОТВЕТЫ
Уравнение диссоциации K sp выражение AlPO 4 <===> Al 3+ (водн. ) + PO 4 3 ¯ (водн.)
K sp = [Al 3+ ] [PO 4 3 ¯] BaSO 4 <===> Ba 2+ (водн.) + SO 4 2 ¯ (водн.) K sp = [Ba 2+ ] [SO 4 2 ¯] CdS <===> Cd 2+ (водн.) + S 2 ¯ (водн.) К sp = [Cd 2+ ] [S 2 ¯] Cu 3 (PO 4 ) 2 <===> 3 Cu 2+ (водн.) + 2 PO 4 3 ¯ (водн.) K SP = [CU 2+ ] 3 [PO 4 3 ¯] 2 CUSCN <===> CU <===> CU <===> CU <===> CU . (водный) K sp = [Cu + ] [SCN¯] Hg 2 Br 2 <===> Hg 2 2+ (водн. ) + 2 Br¯ (водн.)
К sp = [Hg 2 2+ ] [Br¯] 2 AgCN <===> Ag + (водн.) + CN¯ (водн.) K sp = [Ag + ] [CN¯] Zn 3 (AsO 4 ) 2 <===> 3 Zn 2+ (водн.) + 2 AsO 4 1 0 q)
K sp = [Zn 2+ ] 3 [AsO 4 3 ¯] 2 Mn(IO 3 ) 2 <===> Mn 2+ (водн.) + 2 IO 3 ¯водн. K SP = [MN 2+ ] [IO 3 ¯] 2 PBBR 2 <===> PB 2 let. вода) K sp = [Pb 2+ ] [Br¯] 2 SrCO 3 <===> Sr 2+ (водн.) + CO 3 2 ¯ (водн.) K sp = [Sr 2+ ] [CO 3 2 ¯] Bi 2 S 3 <===> 2 Bi 3+ (водн. ) + 3 S 2 ¯ (водн.)
K sp = [Bi 3+ ] 2 [S 2 ¯] 3
ЧАСТЬ 2:
Рассчитайте молярную растворимость (в моль/л) насыщенного раствора вещества.Хлорид серебра, AgCl, имеет K sp = 1,77 x 10¯ 10 . Вычислите его растворимость в молях на литр.
Уравнение диссоциации такое же, как и раньше:
AgCl (т) <===> Ag + (водн.) + Cl¯ (водн.)
Выражение K sp такое же, как и раньше:
K sp = [Ag + ] [Cl¯]
Это уравнение мы должны решить. Сначала мы вставляем K sp значение:
1,77 x 10¯ 10 = [Ag + ] [Cl¯]
Теперь нам нужно вычислить значения двух парней справа. Во-первых, я понятия не имею, что это за значения, поэтому я буду использовать неизвестные. Как это:
Как это:
Я изучаю химическое уравнение и вижу, что существует соотношение один к одному между Ag + и Cl¯. Я знаю это из коэффициентов (оба по одному) сбалансированного уравнения.
Это означает, что концентрации двух ионов ОДИНАКОВЫ. Я могу использовать одно и то же неизвестное для представления обоих. Как это:
[Ag + ] = x = [Cl¯]
Подставляя, получаем:
1,77 х 10¯ 10 = (х) (х)
Теперь возьмем квадратный корень из обеих частей. Надеюсь, я не слишком оскорбляю, когда подчеркиваю обе стороны. У меня было много людей, которые извлекали квадратный корень из стороны x 2 , но не из другой. После квадратного корня получаем:
х = 1,33 х 10¯ 5 М
Это ответ, потому что существует взаимно-однозначная связь между растворенным Ag + и AgCl, из которого он получен. Итак, молярная растворимость AgCl составляет 1,33 х 10¯ 5 молей на литр.
Рассчитайте молярную растворимость (в моль/л) насыщенного раствора вещества.Однако есть дополнительные пояснения по сравнению с примером AgCl.
Вот два вещества:
| Sn(OH) 2 | K sp = 5.45 x 10¯ 27 |
| Ag 2 CrO 4 | K sp = 1.12 x 10¯ 12 |
Гидроксид олова(II)
Вот уравнение диссоциации:
Sn(OH) 2 <:===> Sn 2+ + 2 ОН¯
и вот выражение K sp :
K sp = [Sn 2+ ] [OH¯] 2
Пока ничего необычного. Тем не менее, эти два перед гидроксидом скоро вступят в игру.
Соотношение между Sn 2+ и OH¯ составляет один к двум. Это означает, что сколько бы Sn 2+ ни растворялось, мы получаем УДВОЕННОЕ количество OH¯. Это важно, так что идите медленно и обдумайте это.
Это важно, так что идите медленно и обдумайте это.
Один Sn 2+ дает два OH¯. Это означает, что если «x» Sn 2+ растворяется, то должно было раствориться «2x» OH¯.
Теперь составим уравнение:
5,45 х 10¯ 27 = (х) (2х) 2
Итак, мы имеем 4 х 3 = 5,45 х 10¯ 27
3 и
х = 1,11 х 10¯ 9 М = [Sn]
2 х = 2,22 х 10¯ 9 М = [ОН]
Хромат серебра
Вот обычная информация:
Ag 2 CrO 4 <===> 2 Ag + + CrO 4 2 ¯
K sp = [Ag + ] 2 [CrO 4 2 ¯] = 1,12 x 10¯ 12
. Без проблем!
1,12 х 10¯ 12 = (2x) 2 (x)
Теперь у нас есть:
4x 3 = 1,12 x 10¯ 12
, что решено, чтобы дать ответ:
х = 6,54 х 10¯ 5 М.
Рассчитайте молярную растворимость (в моль/л) насыщенного раствора вещества.
Два примера веществ:
| Би 2 Ю 3 | K sp = 1.82 x 10¯ 99 |
| Cu 3 (PO 4 ) 2 | K sp = 1.93 x 10¯ 37 |
Висмута сульфид
Bi 2 S 3 <===> 2 Bi 3+ + 3 S 2 ¯
K sp = [Bi 3+ ] 2 [S 2 ¯] 3
1,82 x 10¯ 99 = (2x) 2 (3x) 3
108x 5 = 1,82 x 10 10020 99
x = 7,0021 21 900
x = 7,0021 21 900
x = 7,0021 21 99
x = 7,0021 21 99
9002 М Обратите внимание, что «x» по-прежнему означает количество молей растворенного вещества.
Фосфат меди(II)
Cu 3 (PO 4 ) 2 <===> 3 Cu 2+ + 2 PO 4 3 ¯
K sp = [Cu 2+ ] 3 [PO 4 3 ¯] 2
1.93 x 10¯ 37 = (3x) 3 (2x) 2
108x 5 = 1,93 x 10¯ 37
x = 1,78 x 10¯ 8 M
Расчет влияния общего иона на растворимость
| Упражнение 6: Использование значения Ksp от Упражнение
1 рассчитать растворимость PbSO4 в 0,100 М
Na2SO4. Пусть молярная растворимость PbSO4 равна x. Ksp = [Pb 2+ ] [SO4 2- ] = = 1,96´ 10-8Поскольку x очень мало по сравнению с 0,100, 0,100 +x почти равно 0,100. Ksp = [Pb 2+ ] [SO4 2- ] = х ´ 0,100 = 1,96´ 10 -8 Молярная растворимость PbSO4 в 0,100 М Na2SO4 = 1,96´ 10 -7 Молярная растворимость PbSO4 в чистой воде = 1,40´10 -4 Обратите внимание, что растворимость очень сильно снижается в 0,100 М Na2SO 4 потому что эффекта обычного иона. |
Растворимость
Хотя некоторые растворы, например, состоящие из воды и этилового спирта, могут иметь любой промежуточный состав между чистыми компонентами, большинство растворов имеют верхний предел концентрации растворенного вещества. Этот предел называется растворимость вещества. Например, в литре раствора максимальное количество CaSO 4 растворено 0,667 грамма, что составляет 0,0049 моля этого растворенного вещества. Следовательно, растворимость сульфата кальция может быть указана либо как 0,667 г на литр, либо как 0,0049 М.
Следовательно, растворимость сульфата кальция может быть указана либо как 0,667 г на литр, либо как 0,0049 М.
Раствор, содержащий меньше растворенного вещества, чем максимум, который может раствориться, известен как разбавленный раствор и считается ненасыщенным . Раствор, содержащий столько растворенного вещества, сколько предел растворимости, называют насыщенным. Добавление большего количества растворенного вещества к насыщенному раствору обычно вызывает выделение части растворенного вещества из раствора; если разделение происходит посредством образования кристаллов растворенного вещества, говорят, что эти кристаллы выпадают из раствора. В некоторых случаях раствор может содержать больше растворенного вещества, чем предел растворимости. Но такой перенасыщенное состояние нестабильно, и когда начинается осаждение, оно быстро снижает концентрацию растворенного вещества до уровня насыщения.
Таблица 1 представляет собой полезную сводку относительной растворимости обычных химических соединений. Они классифицируются по их анионам и перечислены от наиболее растворимых вверху до наименее растворимых внизу. Также полезно помнить, что все соединения с катионом, являющимся ионом щелочного металла или аммония, хорошо растворимы.
Они классифицируются по их анионам и перечислены от наиболее растворимых вверху до наименее растворимых внизу. Также полезно помнить, что все соединения с катионом, являющимся ионом щелочного металла или аммония, хорошо растворимы.
Важно понимать, что температура заметно влияет на растворимость большинства веществ. Почти для всех солей, которые представляют собой твердые соединения, состоящие из положительных и отрицательных ионов (чаще всего из металлических и неметаллических элементов), повышение температуры приводит к увеличению количества растворяющейся соли. На рис. 1 показана растворимость хлорида калия (KCl) и нитрата калия (KNO 3 ) в зависимости от температуры.
Рисунок 1. Температурная зависимость растворимости.
Обратите внимание, что при 20°C KCl более растворим, но при 40°C более растворим KNO 3 . Хотя растворимость обеих солей увеличивается с температурой, данное повышение температуры повышает растворимость нитрата гораздо больше, чем растворимость хлорида.
Когда соединение, содержащее ионные связи, помещают в воду, полярные молекулы воды разделяют часть или все вещество на его катионы и анионы. Разделение называется ионным диссоциация .
Концентрация ионов может не совпадать с концентрацией раствора. Например, возьмите 14,2 грамма сульфата натрия (Na 2 SO 4 ) и добавьте его в воду, достаточную для получения 1 литра раствора. Сульфат натрия хорошо растворим и растворяется полностью, поэтому раствор 0,1 молярный в Na 2 SO 4 .
Однако соль полностью диссоциирует на ионы:
В предыдущем выражении (s) обозначает твердое вещество, а (aq) обозначает водный ион. В любой реакции коэффициенты пропорциональны количеству молей. Таким образом, каждый моль Na 2 SO 4 дает два моля Na + и один моль . 0,1 М раствор Na 2 SO 4 составляет, следовательно, 0,2 М в Na + и 0,1 М в .
Для ионизирующих веществ, которые мало растворимы, концентрации ионов умножаются на константу, называемую растворимость продукта в насыщенном растворе. Для гипотетического соединения CA, где один катион обозначен буквой C, а анион буквой A, уравнение растворимости имеет вид
.[С] [А] = К сп
, где молярные концентрации двух ионов указаны в квадратных скобках, а константа K sp представляет собой произведение растворимости.
Многие бинарные соединения (состоящие только из двух элементов) содержат более одного катиона или аниона. Общее бинарное соединение можно записать как C x A y , где нижние индексы означают, что соединение имеет x катионов и y анионов. В этом случае уравнение растворимости
[C] x [A] y = K sp
Выполните расчет растворимости, используя карбонат серебра (Ag 2 CO 3 ) в качестве растворенного вещества. Диссоциация соли дает три водных иона:
Диссоциация соли дает три водных иона:
В таблице 2 указано, что K sp для Ag 2 CO 3 составляет 8,5 × 10 –12 . Уравнение растворимости включает квадрат [Ag + ], поскольку каждая формульная единица дает два иона Ag + .
Поскольку молярность равна общей молярности Ag 2 CO 3 в растворе, назовите концентрацию карбоната x и концентрацию ионов серебра 2 x .
Решение, таким образом, равно 0,000129.M Ag 2 CO 3 , что идентично значению, найденному для концентрации. Поскольку формула массы Ag 2 CO 3 в граммах равна 275,75, каждый литр раствора содержит
Вы можете описать растворимость карбоната серебра как 0,0355 грамма на литр.
В таблице 2 приведены произведения растворимости некоторых важных труднорастворимых соединений. Значения даны для 25°C, и каждое из них зависит от температуры.


 Какая масса (г) KNO3 выкристаллизуется из раствора при охлаждении до 35С, если коэффициент растворимости нитрата калия при 60С равен 110 г/100 г воды, а при 35С – 57 г/100 г воды?
Какая масса (г) KNO3 выкристаллизуется из раствора при охлаждении до 35С, если коэффициент растворимости нитрата калия при 60С равен 110 г/100 г воды, а при 35С – 57 г/100 г воды? При нагревании 100 г насыщенного при 0С раствора до 50С его масса составила 87,55 г. Определите растворимость HCl (г) при 50С в 100 г воды.
При нагревании 100 г насыщенного при 0С раствора до 50С его масса составила 87,55 г. Определите растворимость HCl (г) при 50С в 100 г воды. nature.com/natrevchem/
nature.com/natrevchem/ ) + PO 4 3 ¯ (водн.)
) + PO 4 3 ¯ (водн.) ) + 2 Br¯ (водн.)
) + 2 Br¯ (водн.) ) + 3 S 2 ¯ (водн.)
) + 3 S 2 ¯ (водн.)