Решение задач по химии. Расчет по уравнениям химических реакций. In-chemistry.ru
Как решать задачи по химии? Как проводить простейшие расчеты по уравнениям химических реакций? Сколько выделяется газа, образуется воды, выпадает осадка или сколько получается конечного продукта реакций? Сейчас мы постараемся разобрать все нюансы и ответить на эти вопросы, которые очень часто возникают при изучении химии.
Решение задач в химии является неотъемлемой частью в изучении этой сложной, но очень интересной науки.
Алгоритм решения задач по химии
- Прочитать условия задачи (если они есть). Да, об этом все знают — как же решить задачу без условий — но все же, для полноты инструкции, мы не могли не указать этот пункт.
- Записать данные задачи. На этом пункте мы не будем заострять внимание, так как требования различных учебных заведений, учителей и преподавателей могут значительно отличаться.

- Записать уравнение реакции. Теперь начинается самое интересное! Здесь нужно быть внимательным! Обязательно необходимо верно расставить коэффициенты перед формулами веществ. Если вы забудете это сделать, то все наши усилия буду напрасны.
- Провести соответствующие расчеты по химическому уравнению. Далее рассмотрим, как же сделать эти самые расчеты.
Для этого у нас есть два пути, как решить задачу по химии. Условно, назовем их правильным (используя понятия количества вещества) и неправильным (используя пропорции). Конечно же, мы бы рекомендовали решать задачи правильным путем. Так как у неправильного пути имеется очень много противников. Как правило, учителя считают, что ученики, решающие задачи через пропорции, не понимают самой сути протекания процессов химических реакций и решают задачи просто математически.
Расчет по уравнениям химических реакций с использованием понятия количества вещества
Суть данного метода, состоит в том, что вещества реагируют друг с другом в строгом соотношении. И уравнение реакции, которое мы записали ранее, дает нам это соотношение. Коэффициенты перед формулами веществ дают нам нужные данные для расчетов.
И уравнение реакции, которое мы записали ранее, дает нам это соотношение. Коэффициенты перед формулами веществ дают нам нужные данные для расчетов.
Для примера, запишем простую реакцию нейтрализации серной кислоты и гидроксида натрия.
H_{2}SO_{4} + NaOH → Na_{2}SO_{4} + H_{2}O
Расставим коэффициенты:
H_{2}SO_{4} + 2NaOH → Na_{2}SO_{4} + 2H_{2}O
Исходя из этого уравнения, мы видим, что одна молекула серной кислоты взаимодействует с двумя молекулами гидроксида натрия. И в результате этой реакции получается одна молекула сульфата натрия и две молекулы воды.
Сейчас мы немного отступим от разбора задач, чтобы познакомиться с основными понятиями, которые пригодятся нам в решении задач по химии.
Рассчитывать количество молекул, например в 98 граммах серной кислоты — это не самое удобное занятие. Числа будут получаться огромными ( ≈ 6,022140857⋅1023 молекул в 98 граммах серной кислоты) . Для этого в химии ввели понятие количества вещества (моль) и молярная масса.
Для этого в химии ввели понятие количества вещества (моль) и молярная масса.
1 Моль (единица измерения количества вещества) — это такое количество атомов, молекул или каких либо еще структурных единиц, которое содержится в 12 граммах изотопа углерода-12. Позднее выяснилось, что в 12 граммах вещества углерод-12 содержится 6,022140857⋅1023 атомов. Соответственно, можно сказать, что 1 моль, это такая масса вещества, в которой содержится 6,022140857⋅1023 атомов (или молекул) этого вещества.
Но ведь молекулы и атомы имеют различный состав и различное строение. Разные атомы содержат разное количество протонов и нейтронов. Соответственно 1 моль для разных веществ будет иметь разную массу, имея при это одинаковое количество молекул ( атомов). Эта масса называется молярной.
Молярная масса — это масса 1 моля вещества.
Используя данные понятия, можно сказать, что 1 моль серной кислоты реагирует с 2 молями гидроксида натрия, и в результате получается 1 моль сульфата натрия и 2 моль воды.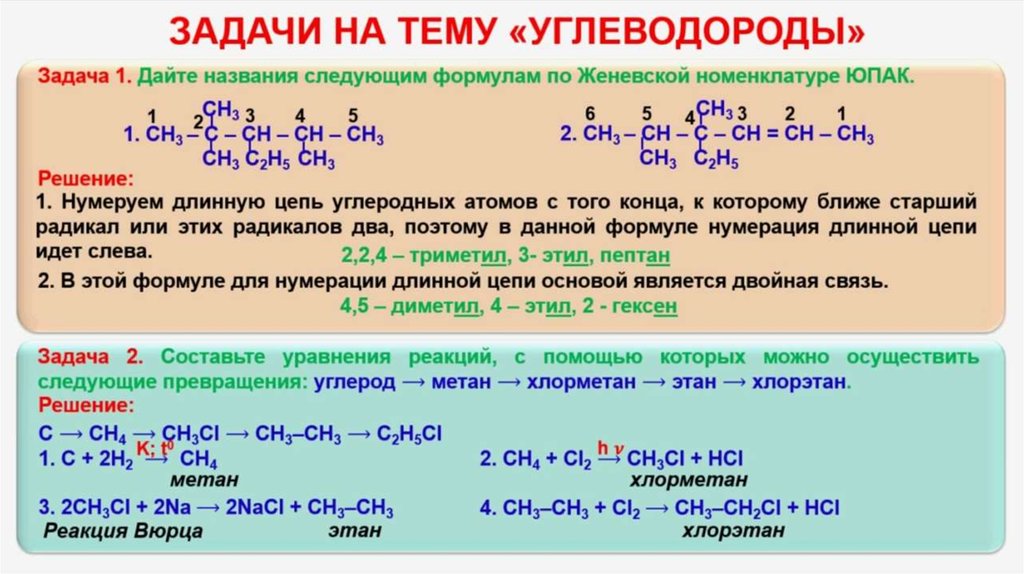 Давайте запишем эти данные под уравнением реакции для наглядности.
Давайте запишем эти данные под уравнением реакции для наглядности.
\begin{matrix}H_{2}SO_{4} & + & 2NaOH & → & Na_{2}SO_{4} & + & 2H_{2}O \\ 1 \: моль & & 2 \: моль & & 1 \: моль & & 2 \: моль \end{matrix}
Следом запишем молярные массы для этих веществ
\begin{matrix} H_{2}SO_{4} & + & 2NaOH & → & Na_{2}SO_{4} & + & 2H_{2}O \\ 1 \: моль & & 2 \: моль & & 1 \: моль & & 2 \: моль \\ 98 \: г& & 40 \: г & & 142 \: г & & 18 \: г \end{matrix}
Теперь, зная массу одного из веществ, мы можем рассчитать, сколько нам необходимо второго вещества для полного протекания реакции, и сколько образуется конечных продуктов.
Для примера, решим по этому же уравнению несколько задач.
Задача. Сколько грамм гидроксида натрия (NaOH) необходимо для того, чтобы 49 грамм серной кислоты (H2SO4) прореагировало полностью?
Итак, наши действия: записываем уравнение химической реакции, расставляем коэффициенты. Для наглядности, запишем данные задачи над уравнением реакции. Неизвестную величину примем за Х. Под уравнением записываем молярные массы, и количество молей веществ, согласно уравнению реакции:
Для наглядности, запишем данные задачи над уравнением реакции. Неизвестную величину примем за Х. Под уравнением записываем молярные массы, и количество молей веществ, согласно уравнению реакции:
\begin{matrix}49 \: г & & X \: г & & & & \\ H_{2}SO_{4} & + & 2NaOH & → & Na_{2}SO_{4} & + & 2H_{2}O \\ 1 \: моль & & 2 \: моль & & 1 \: моль & & 2 \: моль \\ 98 \: г& & 40 \: г & & 142 \: г & & 18 \: г \end{matrix}
Записывать данные под каждым веществом — не обязательно. Достаточно это будет сделать для интересующих нас веществ, из условия задачи. Запись выше дана для примера.
Примерно так должны выглядеть данные, записанные по условиям задачи. Не претендуем на единственно правильное оформление, требования у всех разные. Но так, как нам кажется, смотрится все довольно наглядно и информативно.
Первое наше действие — пересчитываем массу известного вещества в моли. Для этого разделим известную массу вещества (49 грамм) на молярную массу:
Для этого разделим известную массу вещества (49 грамм) на молярную массу:
49\98=0,5 моль серной кислоты
Как уже упоминалось ранее, по уравнению реакции 1 моль серной кислоты реагирует с 2 моль гидроксида натрия. Соответственно с 0,5 моль серной кислоты прореагирует 1 моль гидроксида натрия.
n(NaOH)=0.5*2=1 моль гидроксида натрия
Найдем массу гидроксида натрия, умножив количество вещества на молярную массу:
1 моль * 40 г/моль = 40 грамм гидроксида натрия.
Ответ: 40 грамм NaOH
Как видите, в решении задачи по уравнению реакции нет ничего сложного. Задача решается в 2-3 действия, с которыми справятся ученики начальных классов. Вам необходимо всего лишь запомнить несколько понятий.
Решение задач по химии через пропорцию
Ну и расскажем про второй способ вычислений по уравнениям химических реакций — вычисления через пропорцию. Этот способ может показаться немного легче, так как в некоторых случаях можно пропустить стадию перевода массы вещества в его количество. Чтобы было более понятно, объясню на том же примере.
Чтобы было более понятно, объясню на том же примере.
Так же, как и в прошлом примере, запишем уравнение реакции, расставим коэффициенты и запишем над уравнением и под уравнением известные данные.
Для этого способа, нам так же понадобится записать под уравнением реакции, следом за молярной массой, массу вещества, соответствующую его количеству по уравнению. Если проще, то просто перемножить две строки под уравнением реакции, количество моль и молярную массу. Должно получиться так:
\begin{matrix}49 \: г & & X \: г & & & & \\ H_{2}SO_{4} & + & 2NaOH & → & Na_{2}SO_{4} & + & 2H_{2}O \\ 1 \: моль & & 2 \: моль & & 1 \: моль & & 2 \: моль \\ 98 \: г& & 40 \: г & & 142 \: г & & 18 \: г \\ 98 \: г & & 80 \: г & & 142 \: г & & 36 \: г \end{matrix}
А теперь внимание, начинается магия! Нас интересует строка данных над уравнением, и самая нижняя строка под уравнением. Составим из этих данных пропорцию.
Составим из этих данных пропорцию.
\frac{49}{98} = \frac{X}{80}
Далее находим неизвестное значение Х из пропорции и радуемся полученному значению:
Х=49*80/98=40 грамм
Как видим, получается тот же результат. Прежде всего, при решении задач в химии, главное все же — понимание химических процессов. Тогда решение задачи не станет для вас проблемой!
ТОП-3 лучших приложения для решения химии, задач и реакций
Google Play и Apple Store содержит много школьных и обучающих программ. Среди них можно выделить три приложения для решения задач, уравнений по химии. Они содержат полезную справочную информацию и помогут при обучении школьникам, студентам.
Все три мобильных сервиса для решения задач, уравнений по химии обладают четырьмя особенностями:
- Лаконичный, ненавязчивый дизайн;
- Удобное управление, система поиска;
- Программы занимают мало памяти, поэтому пользователь может установить на свой телефон три программных продукта;
- Наличие дополнительных инструментов, справочной информации, необходимой при решении задач, уравнений, контрольных работ.

Приложения разработаны с учетом классической учебной программы. Сервисы помогут справиться с заданием любой сложности, в значительной степени облегчат процесс обучения.
Содержание
- Химия от Denis Chaschin
- Химия X10 от AppCrab LLC
- Химические реакции от Chemical Reactions App
Химия от Denis Chaschin
Химия
Developer: Denis Chaschin
Price: Free
Приложение предоставляет возможность решать уравнения по химии разной сложности с одним или несколькими неизвестными. В любой момент ученик может открыть таблицу Менделеева, растворимости веществ, воспользоваться специальным калькулятором высчитывания молярной массы.
Программа рассчитана на решение задач из разделов органической, неорганической химии. Пользователю предоставляются реакции в стандартном, ионном виде. Чтобы узнать сведения об элементе, достаточно нажать на него при просмотре удобной интерактивной таблицы Менделеева. Все необходимые данные для решения уравнений, лучшего усвоения материала содержит одно приложение. Это позволяет обойтись без учебников или справочников.
Все необходимые данные для решения уравнений, лучшего усвоения материала содержит одно приложение. Это позволяет обойтись без учебников или справочников.
Сервис содержит таблицы электрической отрицательности элементов, молекулярной массы, электрохимического ряда активности металлов. Программа отличается удобным, понятным на интуитивном уровне интерфейсом. Пользователи отмечают при написании отзывов, что используют сервис для проверки заданий. Количество скачиваний в Google Play – более 1000 000.
Вам может быть интересно: ГДЗ приложения и решебники на Андроид: ТОП-3 полезных для школы
Химия X10 от AppCrab LLC
Химия X10 — задачи и реакции
Developer: AppCrab LLC
Price: Free
Бесплатное универсальное приложение для решения домашних заданий и контрольных работ по химии рассчитано на школьников, обучающихся в 7, 8, 9, 10, 11 классах. Программа обладает возможностями:
- Решение заданий.
 «Химия X10» решит упражнение разной сложности с предоставлением объяснений решения. Пользователю необходимо только правильно ввести данные из условия задачи.
«Химия X10» решит упражнение разной сложности с предоставлением объяснений решения. Пользователю необходимо только правильно ввести данные из условия задачи.
- Шпаргалки. Сервис включает 150 шпаргалок с материалом из основных тем органической, неорганической химии. Удобная система поиска позволяет быстро найти нужные сведения.
- Калькулятор вычисления молярных масс. Инструмент предоставляет возможность узнать массу любого соединения, округлить результат или перевести его в другую единицу измерения.
- Таблица Менделеева. Она содержит подробные данные о каждом элементе.
- Конвертер. Удобный инструмент быстро переводит любую химическую величину.
Приложение работает без подключения к интернет-связи. Программа позволяет решить задачи по формулам, уравнению химической реакции, на растворы и других видов. «Химия X10» имеет защиту от преподавателя – «Звонок мамы». Эта функции позволяет замаскировать процесс списывания решения задания во время урока, когда учитель находится рядом.
Сервис подходит ученикам, которые плохо разбираются или не понимают предмет. Приложение имеет платную подписку на «Pro-версию». Она предоставляет дополнительные функции для решения химических уравнений
Химические реакции от Chemical Reactions App
Химические Реакции
Developer: Chemical Reactions App
Price: Free
Программа разработана для школьников, которые обучаются в 7-11 классах. Сервис работает бесплатно, не требует обязательного подключения к интернету, включает три основные функции:
- Поиск реакций по реагентам или продуктам. Функция отличается возможностью автоматического дополнения, позволяющая быстро найти варианты.
- Балансировка реакций, включая сложные окислительно-восстановительные превращения.
- Вычисление молекулярной массы химических веществ.
Для максимального удобства пользователей разработан механизм ввода формул. Приложение предусматривает возможность введение формулы строчными буквами, что экономит время. Периодически база данных приложения обновляется, пополняется, редактируется.
Периодически база данных приложения обновляется, пополняется, редактируется.
Программы позволяют быстро и правильно решить задания, уравнения по сложному предмету. Они полезны ученикам, абитуриентам, студентам и преподавателям, людям, чья работа связана с химической отраслью, медициной, фармацевтикой.
Читайте также:
- Приложения для решения математики: ТОП-7 лучших
- Приложения для решения задач по физике: Топ 3 лучших
Решение задач по физической химии
Цены в 2-3 раза ниже
Мы работаем
7 дней в неделю
Только проверенные эксперты
Готовые работы / Решение задач / Физическая химия / Готовое решение задач по физической химии
Что найти?
Задача № 427
В 150 г водного раствора содержится 34,2 г тростникового сахара
С 12 Н 22 О 11 . Вычислить давление пара этого раствора при 30 0 С, если давление
Вычислить давление пара этого раствора при 30 0 С, если давление
паров воды 4242,30 н/м 2 .
Дано: m (р-ра С12Н22О11) = 150 г;
m (С12Н22О11) = 34,2 г;
t°С = 30 °С;
р о = 4242,30 н/м 2 .
Найти: р -?
Решение
неэлектролитов:
относительное понижение давления пара растворителя равно
отношению числа молей растворенного вещества к общему числу молей в
растворе (растворенного вещества и растворителя):
Похожие работы
Готовое решение задач по физической химии
Решение задач, Физическая химия
Смотреть
Готовое решение задач по физической химии
Решение задач, Физическая химия
Смотреть
Готовое решение задач по физической химии
Смотреть
Готовое решение задач по физической химии
Решение задач, Физическая химия
Смотреть
Готовое решение задач по физической химии
Решение задач, Физическая химия
Смотреть
Сделайте индивидуальный заказ на нашем сервисе. Там эксперты помогают с учебой без посредников Разместите задание – сайт бесплатно отправит его исполнителя, и они предложат цены.
Там эксперты помогают с учебой без посредников Разместите задание – сайт бесплатно отправит его исполнителя, и они предложат цены.
1 000 +
Новых работ ежедневно
Работы выполняют эксперты в своём деле. Они ценят свою репутацию, поэтому результат выполненной работы гарантирован
107294
рейтинг
2646
работ сдано
1207
отзывов
100014
рейтинг
5216
работ сдано
2344
отзывов
72406
рейтинг
1840
работ сдано
1160
отзывов
62710
рейтинг
1046
работ сдано
598
отзывов
Тип работыВыберите тип работыКонтрольнаяРешение задачКурсоваяРефератОнлайн-помощьТест дистанционноЛабораторнаяЧертежЭссеОтветы на билетыПеревод с ин. языкаДокладСтатьяБизнес-планПодбор литературыШпаргалкаПоиск информацииРецензияДругое
Вадим
Липецкий Государственный Технический Университет
Решил все быстро и понятно, почерк приятен для списывания, все крупно и четко предоставлен. ..
..
Иван
ПНИПУ
Валерий выполнил всё грамотно, была одна доработка (преподаватель вредный), работа сделана…
Александр
ЮУрГУ
Спасибо огромное автору за оперативную помощь! Работа выполнена ОЧЕНЬ качественно, без как…
Решил все быстро и понятно, почерк приятен для списывания, все крупно и четко предоставлено, цена более чем приемлема, рекомендую 🙂
Вадим
Липецкий Государственный Технический Университет
Валерий выполнил всё грамотно, была одна доработка (преподаватель вредный), работа сделана досрочно. Спасибо!
Иван
ПНИПУ
Спасибо огромное автору за оперативную помощь! Работа выполнена ОЧЕНЬ качественно, без каких-либо нареканий и что самое главное досрочно! Все просто замечательно!
Александр
ЮУрГУ
Ежедневно эксперты готовы работать над 1000 заданиями. Контролируйте процесс написания работы в режиме онлайн
только что
1 минуту назад
3 минуты назад
3 минуты назад
3 минуты назад
3 минуты назад
4 минуты назад
4 минуты назад
5 минут назад
6 минут назад
8 минут назад
8 минут назад
8 минут назад
8 минут назад
8 минут назад
9 минут назад
9 минут назад
9 минут назад
Закажи индивидуальную работу за 1 минуту!
Размещенные на сайт контрольные, курсовые и иные категории работ (далее — Работы) и их содержимое предназначены исключительно для ознакомления, без целей коммерческого использования.
 Все права в отношении Работ и их содержимого принадлежат их законным правообладателям. Любое их использование возможно лишь с согласия законных правообладателей. Администрация сайта не несет ответственности за возможный вред и/или убытки, возникшие в связи с использованием Работ и их содержимого.
Все права в отношении Работ и их содержимого принадлежат их законным правообладателям. Любое их использование возможно лишь с согласия законных правообладателей. Администрация сайта не несет ответственности за возможный вред и/или убытки, возникшие в связи с использованием Работ и их содержимого.BA Химия | АСУ Онлайн
Internet Explorer не поддерживается. Предпочтительные браузеры: Хром а также Fire Fox.
Хотите совместить свою страсть к химии с карьерными целями? Степень бакалавра в области химии полезна для множества связанных карьерных путей и программ получения степени. Вы получите фундаментальное понимание органической, неорганической и аналитической химии и разовьете навыки критического мышления и решения проблем, полезные для широкого спектра карьерных возможностей.
Учить больше
Краткие факты
Дата следующего начала:
12. 10.2022
10.2022
Всего классов: 40
Недели в классе: 7,5
Всего кредитных часов: 120
Вопросы на степень, ответы.
Есть вопросы о Химия (BA) ? Заполните эту форму и мы свяжемся с вами!
Имя
Это обязательное поле.
Фамилия
Это обязательное поле.
Номер телефона
Неверный номер телефона.
Что такое бакалавр химии?
Эта онлайн-степень бакалавра гуманитарных наук обеспечивает основу знаний для различных карьерных путей, таких как судебная экспертиза, науки об окружающей среде, преподавание и многое другое.
Например, химию можно совмещать с юриспруденцией для работы над патентами, с экономикой для карьеры в области продаж и маркетинга и с информатикой для карьеры в области биоинформатики и вычислительной химии.
Студенты, желающие продолжить карьеру в области научных исследований, должны вместо этого рассмотреть возможность получения степени бакалавра в области биохимии. Тем, кто хочет продолжить карьеру в области здравоохранения, следует подумать о степени бакалавра в области медицинской химии. Для получения дополнительной информации о предмедицинском образовании и специализированной программе ASU для консультантов по предмедицинскому обслуживанию посетите наш веб-сайт, посвященный предмедицинскому обслуживанию.
Навыки, которые вы получите на курсе химии
На лекциях и лабораторных занятиях вы приобретете навыки, полезные практически для любой карьеры, которую вы выберете. Лекционные курсы программы поощряют развитие навыков решения проблем и критического мышления, которые полезны для любой карьеры. Например, курсовая работа по аналитической химии поможет студентам, которые интересуются карьерой в области токсикологии и науки об окружающей среде, поскольку они учатся анализировать соединения с использованием различных методов. Курсовая работа по неорганической химии, например, поможет тем, кто хочет продолжить карьеру в области материаловедения, поскольку они узнают о структуре и составе различных материалов и процессах их синтеза.
Лекционные курсы программы поощряют развитие навыков решения проблем и критического мышления, которые полезны для любой карьеры. Например, курсовая работа по аналитической химии поможет студентам, которые интересуются карьерой в области токсикологии и науки об окружающей среде, поскольку они учатся анализировать соединения с использованием различных методов. Курсовая работа по неорганической химии, например, поможет тем, кто хочет продолжить карьеру в области материаловедения, поскольку они узнают о структуре и составе различных материалов и процессах их синтеза.
Читать далее
Есть ли в моем бакалавре химических наук слово «онлайн»?
Нет, в дипломах Аризонского государственного университета не указано, получаете ли вы степень онлайн или лично. На всех дипломах и стенограммах написано просто «Университет штата Аризона». Это связано с тем, что онлайн-студенты ASU учатся на том же факультете и получают то же содержание курса, что и очные студенты.
Узнайте, чего вы можете достичь со степенью бакалавра искусств в области химии.
Посмотреть видеоКурсы бакалавриата по химии
Вы получите обширные знания в области химии, пройдя курсы органической, неорганической и аналитической химии. Изюминкой программы являются очные лаборатории органической химии и биохимии. Эти лаборатории на кампусе обеспечивают необходимые практические навыки, которые отличат вас от выпускников других онлайн-программ по химии.
Примечание. Несмотря на то, что многие лабораторные работы доступны в Интернете, вы должны посещать очные лабораторные курсы по органической химии и биохимии. Эти двухнедельные лаборатории проходят летом.
Посмотреть полную основную карту
CHM 341: Elementary Physical Chemistry
CHM 343: Elementary Physical Chemistry Laboratory
CHM 453: Inorganic Chemistry
CHM 113: General Chemistry I (SQ)
CHM 116: Общая химия II (SQ)
CHM 233: Общая органическая химия I
CHM 237: Лаборатория общей органической химии I
CHM 234: Общая органическая химия II
Показать больше
Что вы можете сделать со специализацией в области химии?
Бакалавр искусств в области химии готовит вас к работе в области наук об окружающей среде, судебной экспертизы, токсикологии и других областях. Он готовит вас к карьере, которая часто требует навыков и знаний, связанных с анализом веществ на молекулярном уровне. Это также полезная степень для тех, кто хочет преподавать образование K-12.
Он готовит вас к карьере, которая часто требует навыков и знаний, связанных с анализом веществ на молекулярном уровне. Это также полезная степень для тех, кто хочет преподавать образование K-12.
Chemical Technician
Growth: 2.8 %
Salary: $49,820
Chemist
Growth: 4.7 %
Salary: $79,300
Crime Scene Investigator
Growth: 14,1 %
Заработная плата: 60 590 долларов США
Учитель средней школы
Рост: 3,8 %0119 Hydrogeologist
Growth: 4.8 %
Salary: $137,940
Materials Scientist
Growth: 3. 4 %
4 %
Salary: $99,460
Medical Doctor (MD)
Growth : -0,6 %
Заработная плата: #
Фармацевт
Рост: -3,3 %
Заработная плата: $ 128,710
СВОРЕЯ СПИЧНАЛИСТ 9009
$ 128 710 0073Рост: 6,8 %
Заработная плата: $66 120
Показать больше
Заработайте основу в области химии от известного факультета
От стипендиатов Королевского общества и Американской академии до стипендиатов Маршалла и Барри Голдуотера, Школа молекулярных наук является домом для престижных студентов и преподавателей.
- 7 регентских профессоров и 2 президентских профессора, больше всех академических единиц Колледжа свободных искусств и наук
- 14 лауреатов карьеры Национального научного фонда / Министерства энергетики
- 2 победителя стипендии Альфреда П.
 Слоана
Слоана - 3 лауреата премии молодых исследователей ВВС
- 3 стула с наделом
Требования к специальности химия
Я будущий
первокурсник
Вы считаетесь первокурсником при подаче заявления, если вы вообще не посещали колледж или имеете менее 12 переносимых кредитных часов (при минимальном совокупном среднем балле 2,50).
1. Просмотрите требования к компетенции
2. Просмотрите другие требования к приеме
3. Полная онлайн -заявка
4. Файл FAFSA
5. Запрос Закон или SAT Scores
3
444444444444444444444444444444444.
5. Запрос Закон или SAT Scores
3
444444449 3
4 40004 40004
5.
 Запрос Закон или SAT Scores
Запрос Закон или SAT Scores4
40004 40004
5. Запрос. Показать больше
Не соответствуете вступительным требованиям?
Вы по-прежнему можете поступить в ASU через Earned Admission. Благодаря этому пути вы можете продемонстрировать свою способность добиться успеха в ASU, пройдя онлайн-курсы со средним баллом 2,75 или выше.
Для начала подайте заявку в АГУ. Коуч по зачислению свяжется с вами и предоставит дополнительную информацию о том, подходит ли вам программа Earned Admission Pathway.
Присоединяйтесь к аккредитованной школе в ASU
Колледж свободных искусств и наук использует междисциплинарный подход к образованию с широким спектром степеней в области социальных, естественных и гуманитарных наук. Мы вдохновляем студентов быть социально осведомленными, критически мыслящими и гражданами мира.
25 500+
зачисленных в настоящее время студентов.
140 $
млн расходов на исследования в 2018 году.
23
междисциплинарные школы и факультеты.
95+
степень бакалавра.
Показать больше
Калькулятор обучения
Калькулятор стоимости обучения ASU Online в настоящее время обновляется. Для наиболее точной оценки, пожалуйста, посетите калькулятор стоимости обучения ASU.
Наш калькулятор стоимости обучения поможет вам рассчитать стоимость обучения на дневном отделении по этой программе без финансовой помощи. Имейте в виду: более 80% наших студентов получают финансовую помощь.
Финансовая помощь может снизить наличные расходы, что приведет к меньшему финансовому стрессу и повышению академической уверенности. Учить больше.
Учить больше.
Ориентировочная стоимость обучения
Вас также может заинтересовать
Бакалавриат
Биохимия (бакалавр)
Бакалавриат
Биохимия – медицинская химия (BS)
Бакалавриат
Физика (бакалавр)
Бакалавриат
Биохимия (бакалавр)
Посмотреть все степени
Применить сейчасЭксперимент по решению проблем | НСТА
функция
Использование закона Бера для определения концентрации тартразина
Учитель естественных наук — январь/февраль 2022 г. (Том 89, Выпуск 3)
(Том 89, Выпуск 3)
Кевин Мейсон, Стив Шиффер, Тара Роуз и Грег Матиас
Эксперимент по решению проблем — это учебная деятельность, в которой используется план эксперимента для решения подлинной проблемы. Он сочетает в себе две стратегии обучения, основанные на фактических данных: обучение, основанное на проблемах, и обучение, основанное на запросах. Использование проблемного обучения и научного исследования в качестве эффективного педагогического инструмента в классе естественных наук хорошо зарекомендовало себя и активно поддерживается исследованиями (Акиноглу и Тандоган, 2007; Арепаттаманнил, 2012; Фуртак, Зайдель и Иверсон, 2012; Инел и Балим, 2010; Мерритт и др., 2017 г., Панасан и Нуангчалерм, 2010 г., Уилсон, Тейлор и Ковальски, 2010 г.).
Флойд Джеймс Резерфорд, основатель проекта 2061 Американской ассоциации содействия развитию науки (AAAS), однажды заявил: «Отделить концептуально-научное содержание от научного исследования, — подчеркнул он, — значит сделать весьма вероятным, что студент правильно ни один не понимает» (1964, с. 84). Более недавнее исследование с использованием рандомизированных контрольных испытаний показало, что учителя, которые в течение семи месяцев применяли метод исследования и проблемную педагогику, улучшили успеваемость учащихся по математике и естественным наукам (Bando, Nashlund-Hadley, and Gertler, 2019).). Эксперимент по решению проблем использует проблемно-ориентированное обучение, ставя учащимся достоверную или значимую проблему для решения, и основанное на запросах обучение, требуя, чтобы учащиеся разработали эксперимент для сбора и анализа данных для решения проблемы.
84). Более недавнее исследование с использованием рандомизированных контрольных испытаний показало, что учителя, которые в течение семи месяцев применяли метод исследования и проблемную педагогику, улучшили успеваемость учащихся по математике и естественным наукам (Bando, Nashlund-Hadley, and Gertler, 2019).). Эксперимент по решению проблем использует проблемно-ориентированное обучение, ставя учащимся достоверную или значимую проблему для решения, и основанное на запросах обучение, требуя, чтобы учащиеся разработали эксперимент для сбора и анализа данных для решения проблемы.
В эксперименте по решению задач, описанном в этой статье, учащиеся использовали закон Бера для сбора и анализа данных, чтобы определить, потреблял ли человек опасное количество тартразина (желтый краситель № 5) для своего веса. Студенты использовали свои знания о растворах, молярности, разбавлениях и законе Бера, чтобы разработать собственный эксперимент и рассчитать количество тартразина в желтом спортивном напитке (или содовой со вкусом цитрусовых).
Закон Бера
В соответствии с научными стандартами нового поколения энергия определяется как «количественное свойство системы, которое зависит от движения и взаимодействия материи и излучения с этой системой» (NGSS Lead States 2013). Взаимодействия материи и излучения могут быть одними из самых сложных для наблюдения, исследования и концептуального понимания учащимися. В результате учащиеся нуждаются в возможности наблюдать и исследовать взаимодействие материи и излучения. Свет является одним из примеров излучения, взаимодействующего с материей.
Свет — это электромагнитное излучение, воспринимаемое человеческим глазом и проявляющее свойства как волны, так и частицы. Когда свет взаимодействует с веществом, свет может отражаться на поверхности, поглощаться веществом или проходить сквозь вещество (рис. 1). Когда единственный пучок света попадает в вещество перпендикулярно (под углом 90° к поверхности), степень отражения минимальна. Следовательно, свет будет либо поглощаться веществом, либо проходить через вещество. Когда в раствор попадает свет с заданной длиной волны, количество поглощаемого света будет зависеть от идентичности вещества, толщины сосуда и концентрации раствора.
Когда в раствор попадает свет с заданной длиной волны, количество поглощаемого света будет зависеть от идентичности вещества, толщины сосуда и концентрации раствора.
Взаимодействие света с материей.
(получено с https://etorgerson.files.wordpress.com/2011/05/light-reflect-refract-absorb-label.jpg ).
Закон Бера гласит, что количество поглощенного света прямо пропорционально толщине и концентрации раствора. Закон Бера также иногда называют законом Бера-Ламберта. Раствор более высокой концентрации будет поглощать больше света и пропускать меньше света (рис. 2). Точно так же, если раствор поместить в более толстый контейнер, который требует прохождения света на большее расстояние, тогда раствор будет поглощать больше света и пропускать меньше света.
Рисунок 2Свет, проходящий через раствор.
(Получено с https://media.springernature.com/original/springer-static/image/chp%3A10. 1007%2F978-3-319-57330-4_13/MediaObjects/432946_1_En_13_Fig4_HTML.jpg ).
1007%2F978-3-319-57330-4_13/MediaObjects/432946_1_En_13_Fig4_HTML.jpg ).
Определения ключевых терминов.
Поглощение (А) – процесс захвата световой энергии веществом
Закон Бера (Закон Бера-Ламберта) – поглощение (A) света прямо пропорционально молярному поглощению (ε), толщине (b) и концентрации (C) раствора (A = εbC)
Концентрация (C) – количество растворенного вещества на количество раствора
Кювета – контейнер, используемый для хранения образца, подлежащего анализу в спектрофотометре
Energy (E) – количественное свойство системы, зависящее от движения и взаимодействия материи и излучения с этой системой (NGSS Lead States 2013).
Интенсивность (I) – количество или яркость света
Свет – электромагнитное излучение, воспринимаемое человеческим глазом и проявляющее свойства как волны, так и частицы
Молярная абсорбция (ε) – свойство, которое представляет собой количество света, поглощаемого данным веществом на молярность раствора и на сантиметр толщины (М-1 см-1)
Молярность (M) – количество молей растворенного вещества на литр раствора (моль/л)
Отражение – процесс отражения световой энергии от поверхности вещества
Спектрофотометр – устройство, используемое для измерения поглощения света веществом
Тартразин – широко используемый пищевой и жидкий краситель
Коэффициент пропускания (T) – процесс прохождения световой энергии через вещество
Количество света, поглощенного раствором, можно измерить с помощью спектрофотометра. Раствор заданной концентрации помещают в небольшую емкость, называемую кюветой. Кювета имеет известную толщину, которую можно поддерживать постоянной в ходе эксперимента. Также можно получить кюветы различной толщины для изучения влияния толщины на поглощение света. Ключевые определения терминов, связанных с законом Бера и учебной деятельностью, представленные в этой статье, представлены на рис. 3.
Раствор заданной концентрации помещают в небольшую емкость, называемую кюветой. Кювета имеет известную толщину, которую можно поддерживать постоянной в ходе эксперимента. Также можно получить кюветы различной толщины для изучения влияния толщины на поглощение света. Ключевые определения терминов, связанных с законом Бера и учебной деятельностью, представленные в этой статье, представлены на рис. 3.
Обзор эксперимента по решению проблем
В задаче, представленной студентам, спортсмен весом 140 фунтов ежедневно выпивает две бутылки желтого спортивного напитка (рис. 4; см. «Онлайн-подключения»). Когда она начинает замечать сыпь на коже, она читает этикетку спортивного напитка и замечает, что он содержит желтый краситель, известный как тартразин. Хотя тартразин безопасно пить, в больших количествах он может вызывать некоторые потенциальные побочные эффекты, включая сыпь, крапивницу или отек. Студенты должны разработать эксперимент, чтобы определить концентрацию тартразина в желтом спортивном напитке и количество миллиграммов тартразина в двух бутылках спортивного напитка.
Хотя спортивный напиток может состоять из многих ингредиентов, подавляющее большинство ингредиентов, таких как сахар или электролиты, бесцветны при растворении в водном растворе. Красители, добавляемые в спортивный напиток, отвечают за цвет спортивного напитка. Производители продуктов питания могут использовать различные красители для окрашивания спортивных напитков в желаемый цвет. Красный краситель № 40 (очаровательно-красный), синий краситель № 1 (ярко-синий), желтый краситель № 5 (тартразин) и желтый краситель № 6 (желтый закат) являются четырьмя наиболее распространенными красителями или красителями в спортивных напитках и многих других коммерческих продуктах. продукты питания (Stevens et al. 2015). Концентрация красителя в спортивном напитке влияет на количество поглощаемого света.
В этом эксперименте по решению задач учащиеся использовали ранее изученную концепцию закона Бера — используя серийные разведения и абсорбцию — для определения концентрации (молярности) тартразина в спортивном напитке. Основываясь на доказательствах, студенты затем определили, превысил ли человек максимально рекомендуемую суточную норму тартразина, указанную в мг/кг массы тела. Цели обучения для этого эксперимента по решению проблем показаны на рисунке 5 (см. Онлайн-соединения).
Основываясь на доказательствах, студенты затем определили, превысил ли человек максимально рекомендуемую суточную норму тартразина, указанную в мг/кг массы тела. Цели обучения для этого эксперимента по решению проблем показаны на рисунке 5 (см. Онлайн-соединения).
Предлабораторный опыт
Эксперимент по решению проблем — это форма управляемого исследования, которое обычно требует определенных предварительных знаний и опыта. В этом упражнении учащимся требовались предварительные знания и опыт работы с законом Бера и методами использования закона Бера для определения неизвестной концентрации. Перед выполнением задания учащиеся узнали, как используется закон Бера для связи поглощения с концентрацией, а также как использовать уравнение M 1 V 1 = M 2 V 2 для определения концентрации разведений. Студенты имели общее представление о молярности и использовании размерного анализа для изменения единиц измерения.
Методы использования закона Бера были частично введены в ходе лабораторного эксперимента с использованием различных концентраций сульфата меди. Была предоставлена известная концентрация сульфата меди, и студенты следовали процедуре приготовления растворов. Учащиеся изучили технику выбора длины волны, обеспечивающей максимальное поглощение испытуемого раствора (λ max ), что важно для закона Бера, чтобы создать линейную зависимость между поглощением и концентрацией раствора. Студенты построили график поглощения каждой концентрации в электронной таблице в виде диаграммы рассеяния и добавили линейную линию тренда. Обсуждая в классе, учитель проверял, правильно ли он использует уравнение прямой для определения концентрации неизвестного раствора сульфата меди.
Была предоставлена известная концентрация сульфата меди, и студенты следовали процедуре приготовления растворов. Учащиеся изучили технику выбора длины волны, обеспечивающей максимальное поглощение испытуемого раствора (λ max ), что важно для закона Бера, чтобы создать линейную зависимость между поглощением и концентрацией раствора. Студенты построили график поглощения каждой концентрации в электронной таблице в виде диаграммы рассеяния и добавили линейную линию тренда. Обсуждая в классе, учитель проверял, правильно ли он использует уравнение прямой для определения концентрации неизвестного раствора сульфата меди.
После того, как учащиеся построили график данных, они обсудили, как значение R2 связано с набором данных, использованным для построения графика. После завершения этого эксперимента учащимся было удобно делать разведения из исходного раствора, рассчитывать концентрации и использовать спектрофотометр для применения закона Бера для определения неизвестной концентрации.
Знакомство с проблемой
После первоначального эксперимента по закону Бера был введен эксперимент по решению задач. Проблема, представленная учащимся, показана на рисунке 4 (см. Онлайн-соединения). Эксперимент по решению проблем предоставляет учащимся ценную возможность сотрудничать с другими учащимися в разработке эксперимента и решении проблемы. Для этой деятельности студенты были распределены в лабораторные группы разнородных или смешанных способностей. Группы должны быть диверсифицированы по половому признаку; исследования показали, что гендерное разнообразие среди групп улучшает академическую успеваемость, в то время как расовое разнообразие не оказывает существенного влияния (Hansen, Owan, and Pan, 2015). Также важно поддерживать учащихся с особыми потребностями при распределении групп. Группы со смешанными способностями были созданы намеренно для того, чтобы поместить учащихся с особыми потребностями к сверстникам, обладающим академическими способностями и склонностью оказывать поддержку. Кроме того, некоторым учащимся могут потребоваться дополнительные приспособления или модификации для этой учебной деятельности, такие как структурированный лабораторный отчет, сокращенный формат лабораторного отчета или увеличенное время для выполнения анализа. Все студенты должны были носить защитные очки и перчатки от брызг химикатов и соблюдать осторожность при обращении с растворами и стеклянными приборами.
Кроме того, некоторым учащимся могут потребоваться дополнительные приспособления или модификации для этой учебной деятельности, такие как структурированный лабораторный отчет, сокращенный формат лабораторного отчета или увеличенное время для выполнения анализа. Все студенты должны были носить защитные очки и перчатки от брызг химикатов и соблюдать осторожность при обращении с растворами и стеклянными приборами.
Разработка эксперимента
Во время этого задания учащиеся работали в лабораторных группах над разработкой собственного эксперимента для решения задачи. Учитель использовал обсуждения в малых группах и всем классом, чтобы помочь учащимся понять проблему. Студенты обсудили, какая информация была предоставлена и что им нужно знать и делать, чтобы решить проблему. При планировании эксперимента учитель не предусмотрел процедуру и намеренно оказывал лишь минимальную поддержку студентам по мере необходимости. Студенты разработали собственную экспериментальную процедуру, которая поощряла критическое мышление и решение проблем. Учащимся нужно было позволить бороться в какой-то степени. Учитель давал некоторые указания и рекомендации, задавая вопросы, которые ученики должны были обдумать и ответить сами. Студентам также часто напоминали просмотреть свои записи и предыдущий эксперимент с законом Бера, чтобы помочь им лучше использовать свои ресурсы для решения проблемы. Использование разнородных или смешанных групп также помогло каждой группе стать более самодостаточной и успешной в разработке и проведении эксперимента.
Учащимся нужно было позволить бороться в какой-то степени. Учитель давал некоторые указания и рекомендации, задавая вопросы, которые ученики должны были обдумать и ответить сами. Студентам также часто напоминали просмотреть свои записи и предыдущий эксперимент с законом Бера, чтобы помочь им лучше использовать свои ресурсы для решения проблемы. Использование разнородных или смешанных групп также помогло каждой группе стать более самодостаточной и успешной в разработке и проведении эксперимента.
Учащиеся разработали процедуру эксперимента, а учитель вносил предложения или задавал вопросы, чтобы улучшить план эксперимента, если это необходимо. Безопасность была рассмотрена во время этой консультации, чтобы исправить проблемы безопасности в экспериментальном плане или обеспечить меры предосторожности для эксперимента. Студенты должны были носить брызгозащитные очки и перчатки на протяжении всего эксперимента. В нескольких случаях студенты реализовали некоторые возможности улучшить свой экспериментальный план во время эксперимента. Это было разрешено с одобрения учителя, и изменения в процедуре были задокументированы для окончательного лабораторного отчета.
Это было разрешено с одобрения учителя, и изменения в процедуре были задокументированы для окончательного лабораторного отчета.
Проведение эксперимента
Студентам был предоставлен образец спортивного напитка и маточный раствор 0,01 М маточного раствора тартразина. Есть много вариантов спортивных напитков, но рекомендуется проверять ингредиенты, чтобы убедиться, что тартразин (желтый краситель № 5) является единственным добавленным красителем. Это предотвратит влияние других красителей на результаты спектроскопии в эксперименте. В качестве альтернативы можно также использовать газированную воду со вкусом цитрусовых, потому что во многие газированные напитки также добавлен тартразин. Важно отметить, что тартразин считается безопасным для питья, но он может вызывать некоторые потенциальные побочные эффекты в больших количествах, включая сыпь, крапивницу или отек. Список материалов, необходимых для этого эксперимента по решению проблем, показан на рисунке 6 (см. Онлайн-соединения).
В этом эксперименте по решению задач учащиеся должны были создать растворы тартразина с известной концентрацией в качестве эталона для определения неизвестной концентрации тартразина в спортивном напитке. Для приготовления разведений студентам давали 0,01 М маточный раствор тартразина. Учитель купил порошкообразный тартразин, доступный у многих продавцов, для приготовления маточного раствора. 0,01 М исходный раствор готовили, взвешивая 0,534 г тартразина и растворяя его в дистиллированной воде, достаточном для получения раствора объемом 100 мл. В качестве альтернативы можно использовать желтый пищевой краситель, но для определения его концентрации потребуются некоторые исследования. Поскольку учащиеся ранее изучали экспериментальные методы, они должны уметь готовить растворы, которые будут несколько темнее и несколько светлее по цвету, чем образец желтого спортивного напитка. Студенты должны использовать пять разведений для достижения наилучших результатов.
Как правило, хорошим диапазоном для желтого спортивного напитка являются стандартные разведения от 1×10-3 М до 1×10-5 М. Преподавателю может потребоваться предупредить учащихся, что, если разведение слишком темное, оно не даст желаемого результата. хорошие результаты и снизить значение R2. Студенты, которые использовали очень темные разведения, часто понимали, что удаление этой точки данных создает лучшую линейную линию тренда, если это не уменьшает количество точек данных до менее чем четырех точек данных. Некоторые студенты даже пытались использовать 0,01 М исходный раствор без какого-либо разбавления. Это было слишком темно. Студентам нужно было сделать существенные разведения, чтобы получить растворы в ассортименте спортивного напитка.
Преподавателю может потребоваться предупредить учащихся, что, если разведение слишком темное, оно не даст желаемого результата. хорошие результаты и снизить значение R2. Студенты, которые использовали очень темные разведения, часто понимали, что удаление этой точки данных создает лучшую линейную линию тренда, если это не уменьшает количество точек данных до менее чем четырех точек данных. Некоторые студенты даже пытались использовать 0,01 М исходный раствор без какого-либо разбавления. Это было слишком темно. Студентам нужно было сделать существенные разведения, чтобы получить растворы в ассортименте спортивного напитка.
После приготовления разведений измеряли оптическую плотность каждого разведения с помощью спектрофотометра. Спектрофотометр Vernier SpectroVis (~400 долларов США) использовали для измерения оптической плотности приготовленных разведений с известными концентрациями. Студенты настроили спектрофотометр на использование различных длин волн света и выбрали длину волны с самым высоким показателем поглощения. Затем для каждого измерения поглощения использовали одну и ту же длину волны. Длина волны 650 нанометров (нм) обеспечивала точное измерение и хорошую линейную зависимость. После измерения оптической плотности растворов известных концентраций студенты измерили оптическую плотность спортивного напитка с неизвестной концентрацией тартразина с помощью спектрофотометра при той же длине волны. Если спектрофотометр недоступен, можно использовать сравнение цветов в качестве недорогой альтернативы для завершения этого эксперимента по решению проблем (рис. 7; см. Онлайн-подключения).
Затем для каждого измерения поглощения использовали одну и ту же длину волны. Длина волны 650 нанометров (нм) обеспечивала точное измерение и хорошую линейную зависимость. После измерения оптической плотности растворов известных концентраций студенты измерили оптическую плотность спортивного напитка с неизвестной концентрацией тартразина с помощью спектрофотометра при той же длине волны. Если спектрофотометр недоступен, можно использовать сравнение цветов в качестве недорогой альтернативы для завершения этого эксперимента по решению проблем (рис. 7; см. Онлайн-подключения).
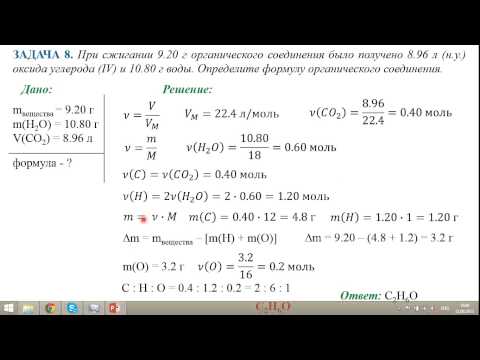
Анализ результатов
После завершения эксперимента учащиеся построили график поглощения и известных концентраций тартразина в разведениях на диаграмме рассеяния, чтобы создать линейную линию тренда. В этом эксперименте поглощение было зависимой переменной, которую следует отобразить на оси у . Некоторые студенты по ошибке поменяли местами оси на точечной диаграмме. Затем учащиеся использовали график, чтобы найти уравнение для прямой. Затем учащиеся определяют неизвестную концентрацию (молярность) тартразина в спортивном напитке с учетом линейного уравнения и экспериментально измеренной абсорбции спортивного напитка.
Затем учащиеся определяют неизвестную концентрацию (молярность) тартразина в спортивном напитке с учетом линейного уравнения и экспериментально измеренной абсорбции спортивного напитка.
Чтобы ответить на вопрос, поставленный в задаче, учащиеся также рассчитали максимальное количество тартразина, которое может безопасно употребить человек весом 140 фунтов, используя информацию, приведенную в задаче. Распространенной ошибкой при решении задачи было отсутствие перевода единиц объема, данных в задаче, из унций в литры. Используя молярность и объем в литрах, студенты рассчитали массу тартразина, потребляемого в день, в миллиграммах. Образец графика и расчеты одной группы студентов показаны на рисунке 8. Наконец, на основе своих расчетов студенты ответили на вопрос, поставленный в исходной задаче, и определили, превышает ли ежедневное потребление тартразина человеком порог безопасного потребления. В этом случае студенты пришли к выводу, что человек НЕ потреблял тартразина больше допустимой дневной нормы.
Пример графика и расчетов группы студентов.
Сообщение результатов
После проведения эксперимента студенты сообщали о своих результатах в письменном лабораторном отчете, который включал следующие разделы: название, цель, введение, гипотеза, материалы и методы, данные и расчеты, заключение и обсуждение. Лабораторный отчет оценивался с использованием шкалы баллов, показанной на рисунке 9 (см. Онлайн-подключения). В целом, учащиеся очень хорошо справились с этим экспериментом по решению задач. Студенты обычно набирали три балла или выше по каждому критерию рубрики. На протяжении всего занятия учащиеся успешно продемонстрировали свою способность планировать эксперимент, собирать данные, выполнять расчеты, решать задачи и эффективно сообщать об этих результатах.
Это упражнение представляет собой подлинное проблемное обучение науке, поскольку истинная концентрация тартразина в спортивном напитке не была указана учителем и не была известна учащимся. Студенты, как правило, были несколько предвзяты, поскольку предполагали, что эксперимент приведет к превышению рекомендуемого максимального потребления тартразина. Некоторым студентам было трудно сообщить, что рекомендуемый лимит был намного выше, чем два спортивных напитка, потребляемых человеком каждый день. Это позволяет провести обширную дискуссию об использовании научных методов и доказательств для получения непредвзятых ответов на важные вопросы и проблемы.
Студенты, как правило, были несколько предвзяты, поскольку предполагали, что эксперимент приведет к превышению рекомендуемого максимального потребления тартразина. Некоторым студентам было трудно сообщить, что рекомендуемый лимит был намного выше, чем два спортивных напитка, потребляемых человеком каждый день. Это позволяет провести обширную дискуссию об использовании научных методов и доказательств для получения непредвзятых ответов на важные вопросы и проблемы.
Наиболее распространенными ошибками в этом эксперименте по решению задач были ошибки вычислений, причем наиболее распространенными были расчеты концентраций разведений (возможно, из-за использования очень малых концентраций). Также было допущено несколько распространенных ошибок при представлении результатов в лабораторном отчете. В некоторых случаях студенты не предоставили достаточно исходной информации во введении к отчету. Когда учащиеся сообщали о результатах, некоторые учащиеся также не ссылались на конкретные данные эксперимента. Наконец, в разделе обсуждения некоторые студенты выразили обеспокоенность или сомнения в результатах не потому, что была очевидная ошибка, а потому, что они не верили, что потребляемый уровень может быть намного меньше, чем рекомендуемый предел потребления тартразина.
Наконец, в разделе обсуждения некоторые студенты выразили обеспокоенность или сомнения в результатах не потому, что была очевидная ошибка, а потому, что они не верили, что потребляемый уровень может быть намного меньше, чем рекомендуемый предел потребления тартразина.
Заключение
Научные исследования и исследования энергии и материи являются важными темами, рассматриваемыми в Научных стандартах нового поколения (рис. 10; см. Сетевые подключения). На уроках химии учащиеся должны иметь множество возможностей наблюдать и исследовать взаимодействие энергии и материи. В этом эксперименте по решению проблем студенты использовали закон Бера для сбора и анализа данных, чтобы определить, потреблял ли человек количество тартразина, превышающее максимально рекомендуемую суточную норму. Студенты правильно пришли к выводу, что человек с проблемой не потреблял больше тартразина, чем рекомендуемая суточная норма для его массы тела.
В этом упражнении учащиеся научились работать совместно над планированием эксперимента, сбором и анализом данных и решением проблемы. Эти навыки выходят за рамки любого предмета науки или класса. Благодаря этой деятельности у студентов была возможность заняться наукой из реального мира, чтобы решить проблему без ранее известного результата. Процесс разработки эксперимента может быть трудным для некоторых студентов, которые часто привыкли к экспериментальной процедуре в своем предыдущем опыте в классе естественных наук. Однако, поскольку учащимся иногда было трудно разработать собственный эксперимент и выполнить расчеты, они также научились настойчиво собирать и анализировать данные для решения проблемы, что является ценным жизненным уроком для всех учащихся. ■
Эти навыки выходят за рамки любого предмета науки или класса. Благодаря этой деятельности у студентов была возможность заняться наукой из реального мира, чтобы решить проблему без ранее известного результата. Процесс разработки эксперимента может быть трудным для некоторых студентов, которые часто привыкли к экспериментальной процедуре в своем предыдущем опыте в классе естественных наук. Однако, поскольку учащимся иногда было трудно разработать собственный эксперимент и выполнить расчеты, они также научились настойчиво собирать и анализировать данные для решения проблемы, что является ценным жизненным уроком для всех учащихся. ■
Онлайн-соединения
Закон Бера-Ламберта в химии LibreTexts: https://bit.ly/3lNpPEi
Закон Бера – Теоретические принципы: https://teaching.shu.ac.uk/hwb/chemistry/tutorials/molspec/beers1.htm
Закон Бера в Иллюстрированном глоссарии органической химии: http://www.chem.ucla.edu/~harding/IGOC/B/beers_law. html
html
Beer Lambert Law at Edinburgh Instruments: https://www.edinst.com/blog/the-beer-lambert-law/
Лаборатория права пива в интерактивном симуляторе PhET: https://phet.colorado.edu/en/simulation/beers-law-lab
Рисунок 4. Постановка задачи эксперимента по решению проблем: https://bit.ly/3pAYHtj
Рисунок 5. Цели обучения: https://bit.ly/307BHtb
Рисунок 6. Список материалов: https://bit.ly/308a57h
Рисунок 7. Использование сравнения цветов в качестве недорогой альтернативы: https://bit.ly/3du1uyO
Рисунок 9. Рубрика итоговой оценки на основе результатов: https://bit.ly/31KoZRj
Рисунок 10. Подключение к научным стандартам нового поколения : https://bit.ly/3GlJnY0
Кевин Мейсон ([email protected]) — профессор педагогики Университета Висконсин-Стаут, Меномони, Висконсин; Стив Шиффер — учитель химии в средней школе Эмери, Эмери, Висконсин; Тара Роуз — учитель химии в средней школе Эмери, Эмери, Висконсин; и Грег Матиас — доцент педагогики Университета Висконсин-Стаут, Меномони, Висконсин.
Ссылки
Акиноглу О. и Р. Тандоган. 2007. Влияние проблемно-ориентированного активного обучения в естественнонаучном образовании на академическую успеваемость учащихся, их отношение и концептуальное обучение. Евразийский журнал математики, науки и технического образования 3 (1): 77–81.
Арепаттаманнил, С. 2012. Влияние научно-исследовательского обучения на научные достижения и интерес к науке: данные из Катара. Журнал образовательных исследований 105 (2): 134–146.
Бандо Р., Э. Нэшлунд-Хэдли и П. Гертлер. 2019. Влияние исследований и проблемной педагогики на обучение: данные 10 полевых экспериментов в четырех странах. Национальное бюро экономических исследований 26280.
Фуртак Э., Т. Зайдель и Х. Айверсон. 2012. Экспериментальные и квазиэкспериментальные исследования преподавания наук, основанных на запросах: метаанализ. Обзор исследований в области образования 82 (3): 300–329.
Хансен З., Х. Оуэн и Дж. Пэн. 2015. Влияние группового разнообразия на успеваемость в классе. Экономика образования 23 (2): 238–258.
2015. Влияние группового разнообразия на успеваемость в классе. Экономика образования 23 (2): 238–258.
Инель Д. и А. Балим. 2010. Влияние использования проблемного обучения в обучении науке и технологиям на академическую успеваемость учащихся и уровни структурирования понятий. Тихоокеанский форум по изучению и преподаванию естественных наук 11 (2): 1–23.
Мерритт, Дж., М. Ли, П. Риллеро и Б. Кинач. 2017. Проблемное обучение в математике и естественных науках K – 8: обзор литературы. Междисциплинарный журнал проблемного обучения 11 (2).
Ведущие штаты NGSS. 2013. Научные стандарты следующего поколения: по штатам, по штатам. Вашингтон, округ Колумбия: Издательство национальных академий.
Панасан М. и П. Нуангчалерм. 2010. Результаты обучения проектной и исследовательской учебной деятельности. Журнал социальных наук 6 (2): 252–255.
Резерфорд, Ф. Дж. 1964. Роль исследования в преподавании естественных наук. Журнал исследований в области преподавания естественных наук 2 (2): 80–84.
Стивенс, Л.Дж., Дж.Р. Берджесс, М.А. Стохельски и Т. Кучек. 2015. Количество искусственных пищевых красителей и добавленных сахаров в пищевых продуктах и сладостях, обычно потребляемых детьми. Клиническая педиатрия 54 (4): 309–321.
Уилсон К., Дж. Тейлор и С. Ковальски. 2010. Относительное влияние и справедливость основанного на исследованиях и общепринятого преподавания естественных наук на знания, рассуждения и аргументацию учащихся. Журнал исследований в области преподавания естественных наук 47 (3): 276–301.
Химия Сквозные концепции Учебный план Ключевые дисциплинарные идеи Общая наука Расследование Учебные материалы Лаборатории Планы урока Математика НГСС Педагогика Научная и инженерная практика КОРЕНЬ Стратегии обучения Технологии Трехмерное обучение Средняя школа
Химия-Сквозные концепции-Учебная программа-Основные идеи дисциплины-Общая наука-Исследование-Учебные материалы-Лаборатории-Планы уроков-Математика-NGSS-Педагогика-Наука и инженерные практики-STEM-Стратегии обучения-Технологии-Трехмерное обучение-Высокий Школа
Вам также может понравиться
Веб-семинар
Трансформация обучения естественным наукам: Часть 2: Интеграция науки и языка с многоязычными учащимися: построение, ориентированное на активы, 15 декабря 2022 г.
Присоединяйтесь к нам в четверг, 15 декабря 2022 г., с 19:00 до 20:30 по восточноевропейскому времени, чтобы увидеть еще один выпуск журнала NSTA «Трансформация научного обучения»….
Веб-семинар
Трансформация обучения естественным наукам: Часть 1: Интеграция науки и языка с многоязычными учащимися: построение, ориентированное на активы, 14 декабря 2022 г.
Присоединяйтесь к нам в среду, 14 декабря 2022 г., с 19:00 до 20:30 по восточному времени, чтобы увидеть еще один выпуск журнала NSTA «Трансформация научного обучения»….
Веб-семинар
Трансформация обучения естественным наукам: руководство внедрением высококачественных учебных материалов для принятия стандартов: практические рекомендации на местах, 7 ноября 2022 г.
Присоединяйтесь к нам в понедельник, 7 ноября 2022 г., с 19:00 до 20:30 по восточноевропейскому времени, чтобы увидеть еще один выпуск журнала NSTA «Трансформация научного обучения»….
Отчеты Статья
Бесплатные подарки и возможности для учителей естественных наук и STEM, 11 октября 2022 г.
Химия | Learning CTR Online
Обычный и с отличием Химия
Обычный
275 $/семестр
490 $/год
Honors
330 $/семестр
$550/год
Разве ты не знаешь, что пора на уроки? (Введение) [4:02]
отрывки из типичного урока класса (6:17)
Пирсон Химия Текст
Copyright @ 2017
Wilbraham, Staley, Matta, Waterman
Wilbraham, Staley, Matta, Waterman
.
ISBN-13:
978-1-32-320591
Требования к курсу
Предварительная оценка учащихся в рамках регистрации/зачисления (нажмите здесь).
- Соглашение о зачислении
(опрос родителей) в рамках регистрации/зачисления (нажмите здесь).
Учебник (печатный или электронный).
Бесплатная учетная запись Zoom с возможностью аудио/видео для занятий.
- Настоятельно рекомендуется использовать планшет
со стилусом для письма (например, Wacom).
- Пользователи
MAC получают совместимое программное обеспечение (Word, Powerpoint, Excel), если это возможно.
Обычная химия
Учащиеся будут уделять этому курсу 8–10 часов в неделю.
Четыре (4) официальных лабораторных отчета, основанных на практических экспериментах.
Пятьдесят (50) лабораторных и/или практических занятий.

Химия с отличием
Студенты будут тратить на этот курс 9-11 часов в неделю.
Учащиеся будут делать процентную ошибку для формальных лабораторных отчетов.
Пять (5) официальных лабораторных отчетов, основанных на практических экспериментах.
Пятьдесят (50) лабораторных и/или практических занятий, фотографирование основных процедур/результатов.
Учащиеся должны выполнить ДОПОЛНИТЕЛЬНУЮ лабораторную работу по большинству разделов (сфотографировать реагенты и/или продукты и объяснить их актуальность).
Студенты будут включать органическую химию во 2-й семестр.
Учащиеся должны выполнить несколько дополнительных заданий помимо курса общей химии.
Honors
$330 / Semester
$590 / Year
Pearson Chemistry Text
Copyright @ 2017
Wilbraham, Staley, Matta, Waterman
ISBN-13:
978-1-32-3205907
Версия 2012 годится, но есть некоторые отличия (номера вопросов могут отличаться).
Необходимые лабораторные принадлежности
[Нажмите здесь, чтобы перейти по ссылке]
Описание курса
Для многих учащихся химия является одним из самых сложных предметов в старшей школе. Этот высокоинтерактивный курс подготовки к колледжу преодолевает это препятствие для мотивированных учащихся, даже если они не сильны в естественных науках. Учебная программа включает качественное и количественное изучение научных измерений и процессов, материи, атомной теории, периодической таблицы, связи, стехиометрии, газовых законов и химических реакций (включая растворы, термохимию, скорость реакции, равновесие, кислотно-основную химию и окисление). -восстановительные реакции). Особое внимание уделяется решению научных проблем и использованию научных данных для поддержки выводов.
Ресурсы курса включают в себя подробные инструкции для всех заданий, исчерпывающие / структурированные заметки о занятиях, а также учебные / дополнительные материалы, включая более 150 видео, которые моделируют и улучшают обучение.
Химия предназначена для лиц, не связанных с естественными науками, И для лиц, специализирующихся в области естественных наук, желающих получить дополнительные учебные навыки и математическую поддержку, закладывая при этом прочную основу для изучения химии AP и/или других наук. Педагогика уделяет особое внимание обучению на основе запросов, навыкам критического мышления, навыкам обучения и стратегиям решения проблем. Механическая память и базовое понимание преуменьшаются, в то время как обработка информации посредством синтеза (сборки), анализа (разбиения) и оценки (расстановки приоритетов) подчеркивается.
Еженедельный лабораторный компонент включает в себя лабораторные эксперименты на основе видео и физические, практические лабораторные работы, выполняемые дома с использованием обычных бытовых химикатов. Студенты научатся писать ЧЕТЫРЕ (4) технических (официальных) лабораторных отчета в течение года (предоставляются подробные инструкции и модели), а также возможность пересматривать лабораторный отчет.
Для размышлений, повторного обучения и усвоения материала учащимся будет предложено исправить некоторые тесты и пересмотреть свои лабораторные отчеты. Это поможет им научиться мыслить критически и даст бонусные баллы.
Примечание:
Химия может быть сложной (даже для прилежных учеников), особенно ее математические аспекты. Если вашему студенту, изучающему химию, будет полезно больше инструкций, больше времени для вопросов и больше возможностей обсудить проблемные области с учителем, подумайте о том, чтобы добавить Химическое чтение в свой курс по химии. Рецитация по химии — это дополнительный недорогой курс семинара для вопросов и ответов, повторения, размышления и повторного преподавания сложных понятий. Цели контента, домашние задания, лабораторные работы и тесты также являются основными темами обсуждения. Занятия по химическому чтению улучшают учебные навыки, развивают критическое мышление и дают дополнительную практику в решении задач.
Темы и задачи:
Введение в химию
Хорошего начала изучения химии!
Переход от практических и технических вопросов к навигации по GP6, Учебному месту и другим вопросам, не связанным с курсом.

Покажите, что многие великие ученые верили в Иисуса. Наука и Библия совместимы.
Приведите примеры обучения на основе запросов на протяжении всего урока.
Дайте определение химии и поймите ее место в науке.
Представить этапы научного метода и уметь различать каждый.
Понимать основные протоколы построения графиков (независимые и зависимые переменные) как часть экспериментов и сбора данных.
Изучите стратегии решения проблем: «AGES» для использования на протяжении всего курса.
Состояние вещества
Опишите три допущения кинетической теории применительно к газам.
Определение, измерение и расчет давления по атмосферному, газовому и нормальному (стандартному) давлению.
Сравните физические свойства твердых тел, жидкостей и газов с точки зрения формы, объема, движения (текучести), плотности, расширяемости и сжимаемости.

Различать свойства жидкостей: среднюю кинетическую энергию (температуру), динамическое равновесие, давление пара в зависимости от температуры, кипение в зависимости от испарения.
Различать свойства твердых тел и связанные с ними фазовые превращения.
Расшифровка фазовых диаграмм, определение давления, температуры, фазовых переходов и тройной точки.
Понимать взаимосвязь между межмолекулярными силами и кинетической энергией для каждого состояния вещества и фазового перехода.
Научное измерение
Используйте метрическую систему вместо английской
Записывайте числа и выполняйте вычисления в экспоненциальном представлении.
Оценка точности и прецизионности измерений (значащие цифры)
Расчет процентной ошибки как меры точности
Понимание и использование единиц массы, объема, расстояния (подчеркните метрические единицы)
Определите единицы измерения температуры, которые обычно используют ученые
Понимание и расчет плотности
Научитесь решать задачи с помощью размерного анализа (факторная маркировка)
Современная атомная теория: электроны в атомах
Опишите вклад в пересмотренную теорию атома (Бор, ДеБройль, Шрёдингер, Гейзенберг, корпускулярно-волновой дуализм, фотоэлектрический эффект, спектры поглощения и излучения)
Объясните и рассчитайте зависимость длины волны, частоты и энергии излучаемого света от изменения энергии электронов.

Понимание квантово-механической модели атома и запись электронных конфигураций элементов. Назовите 4 квантовых числа элементов от 1 до 11.
Ионные и металлические соединения
Понять условия стабильности атомов, связанные с образованием связи.
Объясните и покажите, как элементы превращаются в ионы (катионы и анионы).
Объясните ионные соединения с точки зрения образования, электрического заряда, структуры и разницы в электроотрицательности.
Изучите свойства ионных соединений.
Понимание металлических связей и свойств, включая сплавы.
Ковалентная связь
Объясните ковалентную связь с точки зрения связей (неполярных, полярных и координатно-ковалентных) и молекул (неполярных и полярных).
Определение и распознавание многоатомных ионов.

Понимание того, как представлять молекулы, соединения и типы ковалентных связей (простые, двойные, тройные) различными способами (молекулярные и структурные формулы, структуры Льюиса).
Дайте определение диссоциации связи по отношению к прочности связи.
Распознавать молекулярные орбитали (сигма- и пи-связи), относящиеся к одинарным, двойным и тройным связям.
Поймите и нарисуйте молекулы, которые имеют исключения из правила октета и демонстрируют резонанс (когда связи имеют промежуточную длину).
Понимание теории молекулярных геометрических форм (линейных, изогнутых, треугольных, плоских, пирамидальных и тетраэдрических).
Объясните теорию гибридных орбиталей с точки зрения молекулярной геометрии.
Определите и определите межмолекулярные притяжения (ван-дер-ваальсовые, водородные связи, сетчатые твердые тела) и то, как они влияют на химические свойства молекул.

1-й
Семестр
Химические реакции
Напишите и составьте химические уравнения, основанные на химических реакциях.
Определите и охарактеризуйте типы реакций, включая синтез, разложение, одиночную замену, двойную замену
и горение.Распознавать и писать сбалансированные химические уравнения для реакций синтеза, разложения, одинарного замещения, двойного замещения или реакций горения.
Используйте ряд активности, чтобы определить, будет ли происходить одна реакция замещения.
Напишите ионные уравнения, суммарные ионные уравнения и распознайте ионы-спектаторы на основе реакций с водными растворами.
Поведение газов
Сформулируйте закон Бойля, закон Шарля, закон Гей-Люссака и закон Авогадро и примените эти законы для расчета взаимосвязей между объемом, температурой и давлением.

Выведите объединенный газовый закон из закона Бойля, закона Шарля и закона Гей-Люссака и рассчитайте давление, объем или температуру.
Дайте определение парциальному давлению и примените закон парциального давления Дальтона для описания состава газов.
Сформулируйте закон идеального газа (PV = nRT) и рассчитайте количество молей газа, поняв разницу между идеальным и реальным газом.
Поймите закон Грэма, который гласит, что газы с более низкой молекулярной массой диффундируют и выделяются быстрее, чем газы с более высокой молекулярной массой.
Термохимия
Различать аспекты теплового потока (эндотермический, экзотермический, потенциальная энергия, кинетическая энергия, теплота и температура).
Определите тепловой поток, потенциальную и кинетическую энергию, фазовые переходы, а также нагрев или охлаждение для фазовых диаграмм вещества.

Расчет теплового потока для нагревания и охлаждения веществ с использованием массы, удельной теплоемкости и изменения температуры или теплоты плавления или теплоты парообразования.
Определение и расчет удельной теплоемкости вещества и теплового потока, связанного с калориметрией.
Определите реагенты, продукты, теплоту реакции и тепловой поток на диаграммах потенциальной энергии.
Расчет теплового потока в термохимических уравнениях с использованием теплоты реакции, стандартной теплоты образования и закона Гесса
Скорости реакций и равновесие
Объясните понятие скорости реакции.
Описать теорию столкновений и объяснить, как различные факторы, включая концентрацию, температуру и давление, влияют на скорость химической реакции.
Интерпретация путей реакции (PE-диаграммы) для идентификации экзотермических и эндотермических реакций, а также для определения и объяснения роли энергии активации в химической реакции.

Объясните, что такое механизм реакции, и поймите концепцию стадии, определяющей скорость реакции.
Напишите выражения равновесия, различая молярные концентрации реагентов и продуктов реакции.
Кислоты, основания и соли
Объясните кислотность и основание по Аррениусу на основе диссоциации воды.
Определение pH и pOH. Используйте шкалу pH для характеристики кислотности и щелочности растворов и свойств кислот и оснований.
Преобразование между pH, pOH, концентрацией ионов водорода и концентрацией ионов гидроксида.
Опишите кислоты и основания Бренстеда-Лоури.
Определите сопряженные кислоты и сопряженные основания, а также сопряженные пары в кислотно-основной реакции Бренстеда-Лоури.
Опишите кислоты и основания Льюиса. [Обогащение]
Различать сильные и слабые кислоты и основания на основе диссоциации и ионизации.

Объясните, как константа кислотной диссоциации Ka и константа диссоциации основания Kb связаны с силой кислоты и основания.
Различать концентрацию и крепость растворов.
Предсказать продукты кислотно-основных реакций нейтрализации и рассчитать необходимые молярные концентрации кислоты или основания.
Объясните использование титрования в химии и опишите этапы процесса титрования. Распознавать и описывать графики титрования сильных и слабых кислот и оснований.
Объясните гидролиз (обратная реакция нейтрализации). Покажите, как растворы солей могут быть кислыми, нейтральными или щелочными.
Объясните буферы и напишите полученные химические уравнения, когда в систему добавляют кислоту или основание.
2-й
Семестр
Органическая химия только для HONORS
Цели:
Понять тенденции связывания атома углерода.

Дайте определение углеводородам и определите/отличите ненасыщенные углеводороды от насыщенных углеводородов.
Нарисуйте и определите алканы, алкены и алкины.
Описать особенности и структурные характеристики алканов, алкенов и алкинов.
Объясните органические изомеры и проиллюстрируйте их различными соединениями.
Различают два типа стереоизомеров.
Определите и опишите общую структуру циклических углеводородов с примерами.
Определите углеводороды, встречающиеся в природе, и объясните их происхождение и переработку.
Классифицируйте органические соединения по их функциональной группе.
Опишите, как используются реакции замещения.
Определите, нарисуйте и объясните общую формулу спиртов, простых эфиров, аминов, карбоновых кислот, альдегидов, кетонов и сложных эфиров.
Опишите, как образуются полимеры.


 «Химия X10» решит упражнение разной сложности с предоставлением объяснений решения. Пользователю необходимо только правильно ввести данные из условия задачи.
«Химия X10» решит упражнение разной сложности с предоставлением объяснений решения. Пользователю необходимо только правильно ввести данные из условия задачи. Слоана
Слоана










