Как легко решать химические уравнения. Как уравнять химическое уравнение: правила и алгоритм
Реакции между разного рода химическими веществами и элементами являются одним из главных предметов изучения в химии. Чтобы понять, как составить уравнение реакции и использовать их в своих целях необходимо достаточно глубокое понимание всех закономерностей при взаимодействии веществ, а также процессов с химическими реакциями.
Составление уравнений
Одним из способов выражения химической реакции является – химическое уравнение. В нем записывается формула исходного вещества и продукта, коэффициенты, которые показывают, какое количество молекул имеет каждое вещество. Все известные химические реакции разделяются на четыре типа: замещение, соединение, обмен и разложение. Среди них выделяют: окислительно-восстановительные, экзогенные, ионные, обратимые, необратимые и т.д.
Подробнее о том, как составлять уравнения химических реакций:
- Необходимо определить, название веществ, взаимодействующих между собой в реакции.

- Для составления химического уравнения обязательно нужно найти коэффициенты. Вернемся к предыдущей схеме. Посмотрим на левую ее часть. В составе серной кислоты содержатся атомы водорода, кислорода и серы, в примерном соотношении 2:4:1. В правой части – 3 атома серы и 12 атомов кислорода в соли. Два атома водорода содержится в молекуле газа. В левой части соотношение этих элементов составляет2:3:12
- Для уравнивания количества атомов кислорода и серы, которые в составе сульфата алюминия (III), необходимо поставить перед кислотой в левую часть уравнения коэффициент 3.
 Теперь у нас в левой части имеется 6 атомов водорода. Для того чтобы сравнять количество элементов водорода, нужно поставить 3 перед водородом в правой части уравнения.
Теперь у нас в левой части имеется 6 атомов водорода. Для того чтобы сравнять количество элементов водорода, нужно поставить 3 перед водородом в правой части уравнения. - Теперь осталось лишь уравнять количество алюминия. Поскольку в состав соли входит два атома металла, то в левой части перед алюминием выставляем коэффициент 2. В итоге, мы получим уравнение реакции этой схемы: 2Al+3h3SO4=Al2(SO4)3+3h3
Поняв основные принципы как составить уравнение реакции химических веществ, в дальнейшем не вызовет особого труда записать любую, даже самую экзотическую, с точки зрения химии, реакцию.
Поговорим о том, как составить уравнение химической реакции. Именно этот вопрос в основном вызывает серьезные затруднения у школьников. Одни не могут понять алгоритм составления формул продуктов, другие неправильно расставляют коэффициенты в уравнении. Учитывая, что все количественные вычисления осуществляются именно по уравнениям, важно понять алгоритм действий. Попробуем выяснить, как составлять уравнения химических реакций.
Составление формул по валентности
Для того чтобы правильно записывать процессы, происходящие между различными веществами, нужно научиться записывать формулы. Бинарные соединения составляют с учетом валентностей каждого элемента. Например, у металлов главных подгрупп она соответствует номеру группы. При составлении конечной формулы между этими показателями определяется наименьшее кратное, затем расставляются индексы.
Что такое уравнение
Под ним понимают символьную запись, которая отображает взаимодействующие химические элементы, их количественные соотношения, а также те вещества, которые получаются в результате процесса. Одно из заданий, предлагаемых ученикам девятого класса на итоговой аттестации по химии, имеет следующую формулировку: «Составьте уравнения реакций, характеризующих химические свойства предложенного класса веществ». Для того чтобы справиться с поставленной задачей, ученики должны владеть алгоритмом действий.
Алгоритм действий
Например, нужно написать процесс горения кальция, пользуясь символами, коэффициентами, индексами. Поговорим о том, как составить уравнение химической реакции, воспользовавшись порядком действий. В левой части уравнения через “+” записываем знаками вещества, которые участвуют в данном взаимодействии. Так как горение происходит с участием кислорода воздуха, который относится к двухатомным молекулам, его формулу пишем О2.
Поговорим о том, как составить уравнение химической реакции, воспользовавшись порядком действий. В левой части уравнения через “+” записываем знаками вещества, которые участвуют в данном взаимодействии. Так как горение происходит с участием кислорода воздуха, который относится к двухатомным молекулам, его формулу пишем О2.
За знаком равенства формируем состав продукта реакции, используя правила расстановки валентности:
2Ca + O2 = 2CaO.
Продолжая разговор о том, как составить уравнение химической реакции, отметим необходимость использования закона постоянства состава, а также сохранения состава веществ. Они позволяют проводить процесс уравнивания, расставлять в уравнении недостающие коэффициенты. Данный процесс является одним из простейших примеров взаимодействий, происходящих в неорганической химии.
Важные аспекты
Для того чтобы понять, как составить уравнение химической реакции, отметим некоторые теоретические вопросы, касающиеся этой темы. Закон сохранения массы веществ, сформулированный М. В. Ломоносовым, объясняет возможность расстановки коэффициентов. Так как количество атомов каждого элемента до и после взаимодействия остается неизменным, можно проводить математические расчеты.
В. Ломоносовым, объясняет возможность расстановки коэффициентов. Так как количество атомов каждого элемента до и после взаимодействия остается неизменным, можно проводить математические расчеты.
При уравнивании левой и правой частей уравнения используют наименьшее общее кратное, аналогично тому, как составляется формула соединения с учетом валентностей каждого элемента.
Окислительно-восстановительные взаимодействия
После того как у школьников будет отработан алгоритм действий, они смогут составить уравнение реакций, характеризующих химические свойства простых веществ. Теперь можно переходить к разбору более сложных взаимодействий, например протекающих с изменением степеней окисления у элементов:
Fe + CuSO4 = FeSO4 + Cu.
Существуют определенные правила, согласно которым расставляют степени окисления в простых и сложных веществах. Например, у двухатомных молекул этот показатель равен нулю, в сложных соединениях сумма всех степеней окисления также должна быть равна нулю. При составлении электронного баланса определяют атомы или ионы, которые отдают электроны (восстановитель), принимают их (окислитель).
При составлении электронного баланса определяют атомы или ионы, которые отдают электроны (восстановитель), принимают их (окислитель).
Между этими показателями определяется наименьшее кратное, а также коэффициенты. Завершающим этапом разбора окислительно-восстановительного взаимодействия является расстановка коэффициентов в схеме.
Ионные уравнения
Одним из важных вопросов, который рассматривается в курсе школьной химии, является взаимодействие между растворами. Например, дано задание следующего содержания: «Составьте уравнение химической реакции ионного обмена между хлоридом бария и сульфатом натрия». Оно предполагает написание молекулярного, полного, сокращенного ионного уравнения. Для рассмотрения взаимодействия на ионном уровне необходимо по таблице растворимости указать ее для каждого исходного вещества, продукта реакции. Например:
BaCl2 + Na2SO4 = 2NaCl + BaSO4
Вещества, которые не растворяются на ионы, записывают в молекулярном виде. Реакция обмена ионами протекает полностью в трех случаях:
- образование осадка;
- выделение газа;
- получение малодиссоциируемого вещества, например воды.

При наличии у вещества стереохимического коэффициента он учитывается при написании полного ионного уравнения. После того как будет написано полное ионное уравнение, проводят сокращение тех ионов, которые не были связаны в растворе. Конечным итогом любого задания, предполагающего рассмотрение процесса, протекающего между растворами сложных веществ, будет запись сокращенной ионной реакции.
Заключение
Химические уравнения позволяют объяснять с помощью символов, индексов, коэффициентов те процессы, которые наблюдаются между веществами. В зависимости от того, какой именно протекает процесс, существуют определенные тонкости записи уравнения. Общий алгоритм составления реакций, рассмотренный выше, основывается на валентности, законе сохранения массы веществ, постоянстве состава.
Имеет валентность равную двум, но в некоторых соединениях может проявлять высшую валентность. Если будет написана неправильно, то может не уравняться.
После правильного написания получившихся формул расставляем коэффициенты.
Как только перед веществом поставлен коэффициент, значения всех элементов в этом увеличиваются в значение коэффициента. Если элемент обладает индексом, то сумма получившихся будет равняться произведению индекса и коэффициента.
После уравнивания металлов переходим к неметаллам. Затем переходим к кислотным остаткам и гидроксильным группам. Далее уравниваем водород. В самом конце проверяем
Химические реакции – это взаимодействие веществ, сопровождаемое изменением их состава. Иными словами, вещества, вступающие в , не соответствуют веществам, получающимся в результате реакции. С подобными взаимодействиями человек сталкивается ежечасно, ежеминутно. Ведь процессы, протекающие в его организме (дыхание, синтез белков, пищеварение и т.д.) – это тоже химические реакции.
С подобными взаимодействиями человек сталкивается ежечасно, ежеминутно. Ведь процессы, протекающие в его организме (дыхание, синтез белков, пищеварение и т.д.) – это тоже химические реакции.
Инструкция
Итак, запишите в левой части реакции исходные вещества: СН4 + О2.
В правой, соответственно, будут продукты реакции: СО2 + Н2О.
Предварительная запись этой химической реакции будет следующей: СН4 + О2 = СО2 + Н2О.
Уравняйте вышенаписанную реакцию, то есть добейтесь выполнения основного правила: количество атомов каждого элемента в левой и правой частях химической реакции должно быть одинаковым.
Вы видите, что количество атомов углерода совпадает, а количество атомов кислорода и водорода разное. В левой части 4 атома водорода, а в правой – только 2. Поэтому поставьте перед формулой воды коэффициент 2. Получите: СН4 + О2 = СО2 + 2Н2О.
Атомы углерода и водорода уравнены, теперь осталось сделать то же самое с кислородом. В левой части атомов кислорода 2, а в правой – 4.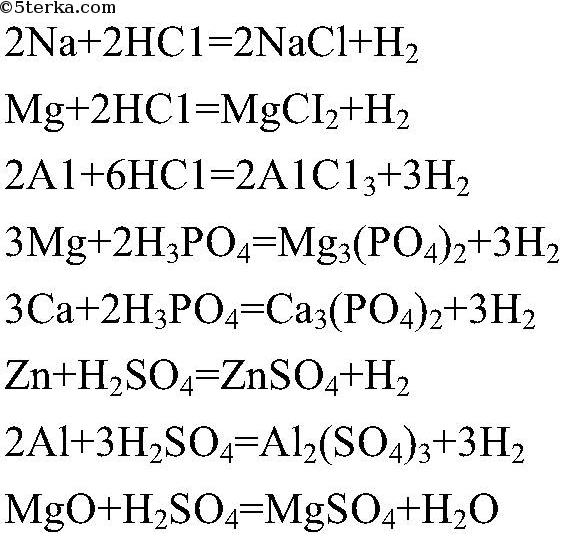
Как неудивительна природа для человека: зимой она окутывает землю снежным пуховым одеялом, весной – раскрывает, словно хлопья поп корна, все живое, летом – бушует буйством красок, осенью поджигает рыжим огнем растения… И только если вдуматься и присмотреться, можно увидеть, что стоят за всеми этими столь привычными изменениями сложные физические процессы и ХИМИЧЕСКИЕ РЕАКЦИИ. А чтобы исследовать все живое, необходимо уметь решать химические уравнения. Основным требованием при уравнивании химических уравнений – знание закона сохранения количества вещества: 1)количество вещества до реакции равно количеству вещества после реакции; 2)общее количество вещества до реакции равно общему количеству вещества после реакции.
Инструкция
Чтобы уравнять “пример” необходимо выполнить несколько шагов.
Записать уравнение реакции в общем виде. Для этого неизвестные коэффициенты перед обозначить буквами латинского (х, y, z, t и тд). Пусть требуется уравнять реакцию соединения водорода и , в результате которой получится вода. Перед молекулами водорода, кислорода и воды поставить латинские
Для этого неизвестные коэффициенты перед обозначить буквами латинского (х, y, z, t и тд). Пусть требуется уравнять реакцию соединения водорода и , в результате которой получится вода. Перед молекулами водорода, кислорода и воды поставить латинские
Часть I
1. Закон Ломоносова-Лавуазье – закон сохранения массы веществ:
2. Уравнения химической реакции – это условная запись химической реакции с помощью химических формул и математических знаков.
3. Химическое уравнение должно соответствовать закону сохранения массы веществ, что достигается расстановкой коэффициентов в уравнении реакции.
4. Что показывает химическое уравнение?
1) Какие вещества вступают в реакцию.
2) Какие вещества образуются в результате.
3) Количественные отношения веществ в реакции, т. е. количества реагирующих и образующихся веществ в реакции.
5. Правила расстановки коэффициентов в схеме химической реакции на примере взаимодействия гидроксида бария и фосфорной кислоты с образованием фосфата бария и воды.
а) Запишите схему реакции, т. е. формулы реагирующих и образующихся веществ:
б) начинайте уравнивать схему реакции с формулы соли (если она имеется). При этом помните, что несколько сложных ионов в составе основания или соли обозначаются скобками, а их число – индексами за скобками:
в) водород уравняйте в предпоследнюю очередь:
г) кислород уравняйте последним – это индикатор верной расстановки коэффициентов.
Перед формулой простого вещества возможна запись дробного коэффициента, после чего уравнение необходимо переписать с удвоенными коэффициентами.
Часть II
1. Составьте уравнения реакций, схемы которых:
2. Напишите уравнения химических реакций:
3. Установите соответствие между схемой и суммой коэффициентов в химической реакции.
4. Установите соответствие между исходными веществами и продуктами реакции.
5. Что показывает уравнение следующей химической реакции:
1) Вступили в реакцию гидроксид меди и соляная кислота;
2) Образовались в результате реакции соль и вода;
3) Коэффициенты перед исходными веществами 1 и 2.
6. С помощью следующей схемы составьте уравнение химической реакции, используя удвоение дробного коэффициента:
7. Уравнение химической реакции:
4P+5O2=2P2O5
показывает количество вещества исходных веществ и продуктов, их массу или объём:
1) фосфора – 4 моль или 124 г;
2) оксида фосфора (V) – 2 моль, 284 г;
3) кислорода – 5 моль или 160 л.
Поговорим о том, как составить химическое уравнение, ведь именно они являются основными элементами данной дисциплины. Благодаря глубокому осознанию всех закономерностей взаимодействий и веществ, можно управлять ими, применять их в различных сферах деятельности.
Теоретические особенности
Составление химических уравнений – важный и ответственный этап, рассматриваемый в восьмом классе общеобразовательных школ. Что должно предшествовать данному этапу? Прежде чем педагог расскажет своим воспитанникам о том, как составить химическое уравнение, важно познакомить школьников с термином «валентность», научить их определять данную величину у металлов и неметаллов, пользуясь таблицей элементов Менделеева.
Составление бинарных формул по валентности
Для того чтобы понять, как составить химическое уравнение по валентности, для начала нужно научиться составлять формулы соединений, состоящих из двух элементов, пользуясь валентностью. Предлагаем алгоритм, который поможет справиться с поставленной задачей. Например, необходимо составить формулу оксида натрия.
Сначала важно учесть, что тот химический элемент, который в названии упоминается последним, в формуле должен располагаться на первом месте. В нашем случае первым будет записываться в формуле натрий, вторым кислород. Напомним, что оксидами называют бинарные соединения, в которых последним (вторым) элементом обязательно должен быть кислород со степенью окисления -2 (валентностью 2). Далее по таблице Менделеева необходимо определить валентности каждого из двух элементов. Для этого используем определенные правила.
Так как натрий – металл, который располагается в главной подгруппе 1 группы, его валентность является неизменной величиной, она равна I.
Кислород – это неметалл, поскольку в оксиде он стоит последним, для определения его валентности мы из восьми (число групп) вычитаем 6 (группу, в которой находится кислород), получаем, что валентность кислорода равна II.
Между определенными валентностями находим наименьшее общее кратное, затем делим его на валентность каждого из элементов, получаем их индексы. Записываем готовую формулу Na 2 O.
Инструкция по составлению уравнения
А теперь подробнее поговорим о том, как составить химическое уравнение. Сначала рассмотрим теоретические моменты, затем перейдем к конкретным примерам. Итак, составление химических уравнений предполагает определенный порядок действий.
- 1-й этап. Прочитав предложенное задание, необходимо определить, какие именно химические вещества должны присутствовать в левой части уравнения. Между исходными компонентами ставится знак «+».
- 2-й этап. После знака равенства необходимо составить формулу продукта реакции. При выполнении подобных действий потребуется алгоритм составления формул бинарных соединений, рассмотренный нами выше.

- 3-й этап. Проверяем количество атомов каждого элемента до и после химического взаимодействия, в случае необходимости ставим дополнительные коэффициенты перед формулами.
Пример реакции горения
Попробуем разобраться в том, как составить химическое уравнение горения магния, пользуясь алгоритмом. В левой части уравнения записываем через сумму магний и кислород. Не забываем о том, что кислород является двухатомной молекулой, поэтому у него необходимо поставить индекс 2. После знака равенства составляем формулу получаемого после реакции продукта. Им будет в котором первым записан магний, а вторым в формуле поставим кислород. Далее по таблице химических элементов определяем валентности. Магний, находящийся во 2 группе (главной подгруппе), имеет постоянную валентность II, у кислорода путем вычитания 8 – 6 также получаем валентность II.
Запись процесса будет иметь вид: Mg+O 2 =MgO.
Для того чтобы уравнение соответствовало закону сохранения массы веществ, необходимо расставить коэффициенты. Сначала проверяем количество кислорода до реакции, после завершения процесса. Так как было 2 атома кислорода, а образовался всего один, в правой части перед формулой оксида магния необходимо добавить коэффициент 2. Далее считаем число атомов магния до и после процесса. В результате взаимодействия получилось 2 магния, следовательно, в левой части перед простым веществом магнием также необходим коэффициент 2.
Сначала проверяем количество кислорода до реакции, после завершения процесса. Так как было 2 атома кислорода, а образовался всего один, в правой части перед формулой оксида магния необходимо добавить коэффициент 2. Далее считаем число атомов магния до и после процесса. В результате взаимодействия получилось 2 магния, следовательно, в левой части перед простым веществом магнием также необходим коэффициент 2.
Итоговый вид реакции: 2Mg+O 2 =2MgO.
Пример реакции замещения
Любой конспект по химии содержит описание разных видов взаимодействий.
В отличие от соединения, в замещении и в левой, и в правой части уравнения будет два вещества. Допустим, необходимо написать реакцию взаимодействия между цинком и Алгоритм написания используем стандартный. Сначала в левой части через сумму пишем цинк и соляную кислоту, в правой части составляем формулы получаемых продуктов реакции. Так как в электрохимическом ряду напряжений металлов цинк располагается до водорода, в данном процессе он вытесняет из кислоты молекулярный водород, образует хлорид цинка. В результате получаем следующую запись: Zn+HCL=ZnCl 2 +H 2 .
В результате получаем следующую запись: Zn+HCL=ZnCl 2 +H 2 .
Теперь переходим к уравниванию количества атомов каждого элемента. Так как в левой части хлора был один атом, а после взаимодействия их стало два, перед формулой соляной кислоты необходимо поставить коэффициент 2.
В итоге получаем готовое уравнение реакции, соответствующее закону сохранения массы веществ: Zn+2HCL=ZnCl 2 +H 2 .
Заключение
Типичный конспект по химии обязательно содержит несколько химических превращений. Ни один раздел этой науки не ограничивается простым словесным описанием превращений, процессов растворения, выпаривания, обязательно все подтверждается уравнениями. Специфика химии заключается в том, что с все процессы, которые происходят между разными неорганическими либо органическими веществами, можно описать с помощью коэффициентов, индексов.
Чем еще отличается от других наук химия? Химические уравнения помогают не только описывать происходящие превращения, но и проводить по ним количественные вычисления, благодаря которым можно осуществлять лабораторное и промышленное получение разных веществ.
Химические уравнения
На основании закона сохранения массы веществ составляют уравнения химических реакций. Химическое уравнение – условная запись химической реакции с помощью химических формул и знаков.
В левой части уравнения записывают формулы или формулу веществ, которые вступили в химическую реакцию. Их называют исходными веществами, между ними знак «плюс», в правой части уравнения записывают формулы или формулу продуктов реакции, т.е. веществ, которые образуются в результате реакции, между ними тоже ставят знак «плюс», а между левой и правой частью уравнения ставят стрелку.
Химическую
реакцию можно изобразить молекулярным уравнением. Т.е. молекулярное
уравнение – это уравнение, в котором исходные вещества и продукты реакции
записаны в виде молекул. Если в результате реакции образуется осадок, то
возле него справа ставят стрелку, направленную вниз (↓), а если
выделяется газ, то возле него справа ставят стрелку, направленную вверх
(↑).
После записи схемы уравнения находят коэффициенты, т.е. цифры, стоящие перед формулами веществ, чтобы число атомов до и после реакции было одинаковым.
Например,
запишем уравнение реакции водорода с кислородом. Вначале укажем формулы
веществ, вступивших в химическую реакцию – это водород (Н2) и
кислород (О2), между ними ставим знак «плюс», в результате реакции
образуется вода – Н2О. Между веществами левой и правой части ставим
стрелку. Посмотрим, сколько атомов водорода в левой и правой части. Получается
два атома водорода до и после реакции, а кислорода до реакции 2 атома, после
реакции – один атом. Поэтому в правой части уравнения перед формулой воды
ставим коэффициент 2. Но теперь в правой части уравнения стало 4 атома
водорода, а в левой только 2. Чтобы уровнять число атомов водорода, необходимо
в левой части уравнения перед водородом поставить коэффициент 2. Т.к. мы
уровняли число всех атомов в левой и правой части уравнения, то теперь ставим
не стрелку, а знак равенства.
Т.к. мы
уровняли число всех атомов в левой и правой части уравнения, то теперь ставим
не стрелку, а знак равенства.
Для правильного подбора коэффициентов в уравнении реакции следует выполнять некоторые условия:
· Перед формулой простого вещества можно записывать дробный коэффициент. Например, в реакции горения бутана:
С4Н10
+ О2 → СО2 + Н2О. Перед формулой СО2
ставим коэффициент 4, т.к. в реакцию вступает 4 атома углерода, перед формулой воды
ставим коэффициент 5, т.к. в реакцию вступает 10 атомов водорода. В результате
реакции образуется 13 атомов кислорода, а до реакции 2 атома, значит перед
формулой кислорода необходимо поставить коэффициент 6,5. А так как, коэффициент
показывает не только число атомов, но и молекул, то следует удвоить коэффициент
в уравнении. Получается, уравнение будет иметь вид: 2С4Н10
+ 13О2 → 8СО2 + 10Н2О.
· Если в схеме реакции есть соль, то сначала уравнивают число ионов, образующих соль. Например, в результате реакции фосфорной кислоты и гидроксида кальция образуется соль – фосфат кальция и вода.
Н3РО4 + Са(ОН)2 → Са3(РО4)2 + Н2О. Эта соль состоит из фосфат-ионов с зарядом 3- и ионов кальция с зарядом 2+. Уравняем их число, записав перед формулой фосфорной кислоты коэффициент 2, а перед формулой гидроксида кальция – коэффициент 3.
·
Если
в схеме реакции есть атомы водорода и кислорода, то сначала уравниваются
атомы водорода, а только потом кислорода. Из предыдущей схемы видно, что в
левой части уравнения 12 атомов водорода, в правой – только 2, значит, перед
формулой воды необходимо поставить коэффициент 6. Подсчитаем число атомов
кислорода. До реакции их 14, после реакции тоже 14. Поэтому можно вместо
стрелки поставить знак равенства.
Поэтому можно вместо
стрелки поставить знак равенства.
·
Если
в схеме реакции имеется несколько формул солей, то начинать уравнивание
следует с ионов, входящих в состав соли, содержащей большее их число.
Например, в реакции нитрата бария и сульфата алюминия образуется две соли –
сульфат бария и нитрат алюминия. Наибольшее число ионов содержит соль – нитрат
алюминия, поэтому сначала нужно уравнять ионы, которыми образована эта соль,
т.е. ионы алюминия и нитрат-ионы. Ba(NO3)2
+ Al2(SO4)3
→ BaSO4
+ Al(NO3)3.
У алюминия заряд 3+, у нитрат-ионов – 1-. Поэтому в левой части уравнения
перед формулой Ba(NO3)2
ставим коэффициент 3. Перед формулой Al2(SO4)3
нужно поставить коэффициент 1, но он не ставится. Уравниваем остальные
ионы. Ионов бария до реакции 3, после реакции 1, поэтому перед формулой BaSO4
ставим коэффициент 3, нитрат-ионов до реакции 6, поэтому в правой части
уравнения перед Al(NO3)3
ставим коэффициент 2. Число атомов алюминия до и после реакции одинаково, т.е.
2. Ионов бария и сульфат-ионов до реакции и после реакции одинаково – по 3.
Число атомов алюминия до и после реакции одинаково, т.е.
2. Ионов бария и сульфат-ионов до реакции и после реакции одинаково – по 3.
·
Если
число атомов какого-то элемента в одной части схемы уравнения четное, а в
другой нечетное, то необходимо перед формулой с нечетным числом атомов
поставить коэффициент 2, а затем уровнять число всех атомов. Например,
расставим коэффициенты в реакции алюминия с кислородом. Al
+ O2 → Al2O3.
В результате реакции образуется оксид алюминия – Al2O3.
Число атомов кислорода до реакции четное, т.е. равно двум, а после реакции
нечетное – 3. Поэтому перед формулой оксида алюминия ставим коэффициент 2. В
результате у нас стало 6 атомов кислорода после реакции, значит, в левой части
уравнения перед формулой кислорода ставим коэффициент 3. Начинаем уравнивать
число атомов алюминия до и после реакции. До реакции 1 атом, после реакции – 4. Следовательно, в левой части уравнения перед формулой алюминия ставим
коэффициент 4. Теперь число атомов каждого химического элемента в левой и
правой части схемы уравнения одинаково, и стрелку следует заменить знаком
равенства.
Следовательно, в левой части уравнения перед формулой алюминия ставим
коэффициент 4. Теперь число атомов каждого химического элемента в левой и
правой части схемы уравнения одинаково, и стрелку следует заменить знаком
равенства.
Как решать химические уравнения? Как отличить реакцию соединения, замещения, разложения, обмена? Где надо ставить скобки? Как раскрывать скобки?
Как решать химические уравнения?Как отличить реакцию соединения, замещения, разложения, обмена?
Где надо ставить скобки?
Как раскрывать скобки?
РЕШЕНИЕ
Вот пример реакции соединения:
Al+O2=Al2O3
Из двух простых- одно сложное
Теперь уравниваем!
Al+O2=2Al2O3 – Сначала уравняем кислород: умножим на два потому что кислорода нечетное количество(3). После умножения стало 4 Al и 6 O. Но в левой части его 2- умножаем на 3
Al+3O2=2Al2O3
Ну а теперь уравняем алюминий, тут все просто. В левой части он один, а в правой его 4.
4Al+3O2=2Al2O3
Теперь реакция разложения
2h3O= 2h3+O2
Из одно более сложного получается несколько простых
Реакция замещения, расскажу на примере реации соляной кислоты с цинком
2HCl+ Zn=ZnCl2+ h3
Цинк как более сильный, активный выталкивает водород и становится на его место. Реакция замещения- эта та реакция, в которую вступает простое и сложное вещество
Реакция обмена- это наверно самое сложное
Реакция обмена- это реакция, в которой два сложных вещества обмениваются своими составными частями.
CuSO4(медный купорос, соль+2KOH=Cu(OH)2+K2SO4
Вот, кстати, и скобки. Все эти вещества с гидроксильной группой
(OH) называются основаниями. Скобки раскрывать не нужно. Просто в голове нужно помнить. Сu(OH)2-Это, по сути, CuO2h3, но это условно, так нельзя писать. KOH, тут тоже есть индекс-1, но когда он равен одному, скобки не пишутся (K(OH)- это неправильно.
ПОХОЖИЕ ЗАДАНИЯ:
 ..
..Тема: Реакции разложения
Тема: Реакции разложения
Тема: Какой объем кислоты
Тема: Реакции разложения
Тема: Оксиды
Ответы | § 14. Составление уравнений химических реакций — Химия, 7 класс
1. Что обозначает схема химической реакции? Чем она отличается от уравнения химической реакции?
Уравнение химической реакции – это условная запись реакции с помощью химических формул и знаков «+», «-», «=».
Схема показывает только формулы исходных и конечных веществ. Между ними ставят стрелку, не расставляют коэффициенты.
2. Почему число атомов каждого элемента в обеих частях химического уравнения должно быть одинаковым?
Составление химических уравнений основано на законе сохранения массы веществ при химических реакциях.
3. Какие из приведенных записей представляют собой схемы химических реакций, а какие — уравнения:
а) CaCO3 = CaO + CO2↑;
б) CH4 + O2→ CO2 + H2O;
в) Ca(OH)2 + 2HCl = CaCl2 + 2H2O;
Схемы химических реакция – б, г; уравнения – а, в.
4. Перечислите основные действия, которые необходимо выполнить, чтобы составить уравнение химической реакции.
1. составить формулы исходных и конечных веществ.
2. формулы исходных веществ записать слева, конечных справа.
3. уравнять числа атомов каждого элемента до и после реакции.
4. поставить знак «=».
5. Составьте уравнения химических реакций, приняв во внимание, что в образующихся веществах азот проявляет валентность три, а сера — два: а) магний + азот; б) калий + сера; в) алюминий + азот; г) алюминий + сера.
а) 3Mg+N2=Mg3N2
б) 2K + S = K2S
в) 4Al+3N2=2Al2N3
г) 2Al+3S=Al2S
6. Составьте уравнения химических реакций:
а) Zn + O2 → ; б) H2 + Cl2 → ; в) KClO3 →KCl + O2; г) Al + O2 →Al2О3.
а) 2Zn + O2 =2ZnO
б) H2 + Cl2 = 2HCl
в) 2KClO3 = 2KCl + 3O2↑
г) 4Al + 3O2 = 2Al2О3
7. Вместо знака вопроса запишите формулы веществ и составьте уравнения химических реакций:
а) HgO → Hg + ?; б) H2O→ O2 + ?; в) P + O2 →?; г) Ca + O2 = ?; д) Fe + ? →FeCl3; е) Al + S → ?.
а) 2HgO = 2Hg + O2↑
б) H2O= O2↑ + 2H2
в) 4P + 5O2 = 2P2O5
г) 2Ca + O2 = 2CaO
д) 2Fe + 3Cl2 = 2FeCl3
е) 2Al +3S = Al2S3
8. Для остановки кровотечения и дезинфекции раны ее обрабатывают раствором вещества Н2О2 (т. н. перекиси водорода). При контакте с кровью оно превращается в два новых вещества — Н2О и О2. Напишите уравнение соответствующей реакции.
9. Перечислите важнейшие химические реакции, протекающие в: а) природе; б) живых организмах; в) быту; г) промышленности.
а) образование озона при грозе, фотосинтез
б) расщепление питательных веществе с целью получения энергии, пищеварение, свёртываемость крови
в) приготовление творога, брожение сока, горение угля, прокисание молока
г) получение металлов из руд, переработка отходов, получение удобрений
Присоединяйтесь к Telegram-группе @superresheba_7, делитесь своими решениями и пользуйтесь материалами, которые присылают другие участники группы!Уравнения реакций – Справочник химика 21
Поскольку электроны не могут существовать в растворе в свободном состоянии, атомы окислителя должны получить в общей сложности ровно столько электронов, сколько их отдают атомы восстановителя. Этим условием определяются как коэффициенты в уравнениях реакций окисления — восстановления, так и весовые о- ношения в этих реакциях. Отсюда ясно, что при подсчете величин грамм-эквивалентов окислителей и восстановителей следует И1 ходить из количества электронов, получаемых или отдаваемых п >и реакции одной молекулой вещества. [c.212]Нетрудно понять, что хорошая точность анализа не может служить доказательством его правильности. Чтобы убедиться в этом, рассмотрим следующий пример. Положим, что при ряде повторных титрований равных объемов исследуемого раствора щелочи раствором соляной кислоты были израсходованы весьма близкие между собой объемы ее это указывает на хорошую точность выполнения анализа. Однако для получения окончательного результата анализа необходимо по затраченному объему раствора H I и его концентрации вычислить из уравнения реакции соответствующее количество определяемой щелочи. Если концентрация раствора H I была в свое время определена неверно, то эта ошибка в качестве постоянной систематической ошибки отразится на всех результатах отдельных определений и, несмотря на хорошую воспроизводимость, полученные результаты будут совершенно неправильными. [c.50]
Стандартный потенциал пары Сс1 /Сс1 правей —0,40 в. Какие электрохимические процессы будут происходить при работе гальванического элемента, построенного из этой пары и нормального водородного электрода Составьте общее уравнение реакции. [c.376]
Л.ЛЯ того чтобы осаждение того или иного иона могло быть практически полным, нужно, очевидно, взять достаточное количество осадителя. Сколько его потребуется, можно приблизительно вычислить по уравнению реакции. [c.71]
Сплав свинца с приблизительно 10% натрия и небольшим количеством магния расплавляют в чугунных ящиках в атмосфере азота. Затем этот сплав дробят на куски размером с горошину и загружают в автоклавы, где под повышенным давлением при 50—75° проводят реакцию с хлористым этилом. В большинстве случаев добавляют также катализатор, например хлористый алюминий или хлорное железо. К концу реакции температуру повышают до 100°. После сброса давления в автоклаве тетраэтилсвинец отпаривают водяным паром для удаления газообразных углеводородов и избытка хлористого этила [182]. Как видно из уравнения реакции, в тетраэтилсвинец превращается лишь около 25% свинца остальное количество после переработки возвращается в процесс. [c.213]
До настоящего времени не удалось достигнуть практически удовлетворительной работы над железным катализатором без давления. Технически приемлемую глубину превращения достигают только после повышения давления не менее чем до 15 ат. В этих условиях удается получать выходы продуктов синтеза, примерно соответствующие получаемым над кобальтовым катализатором. Основное уравнение реакции, протекающей при синтезе над железным катализатором, отличается от уравнения реакции над кобальтовым катализатором и выражается соотношением [c.112]
Кроме рассмотренных факторов следует отметить также влияние избытка маскирующего агента. Чем больше его концентрация в растворе, тем сильнее понижается степень ионизации комплекса, а значит, и концентрация связываемого иона. Например, расчет показывает, что при употреблении соответствующего уравнению реакции количества K N осадок Agi при действии KI должен выпадать. И только вследствие того, что фактически всегда прибавляют некоторый избыток K N, Ag+-noH оказывается замаскированным. [c.96]
Из ионного уравнения реакции видно, что два тиосульфат-иона 820з превращаются в один тетратионат-ион З Об”. [c.396]
Уравнение реакции сульфоокисления [c.492]
Посмотрим теперь, насколько полным будет осаждение РЬЗО при употреблении вычисленного по уравнению реакции количества осадителя. Так как с этим количеством его на каждый РЬ + ИОН вводят в раствор также по одному ЗО -иону, концентрации указанных ионов по окончании осаждения должны быть, очевидно, равны между собой. Поскольку произведение их равняется [c.72]
Прежде всего рассмотрим процесс образования осадков. Этот процесс, несомненно, сложнее, чем можно ожидать на основании уравнения реакции. Так, судя по уравнению [c.98]
Почему определению при помощи реакции с диметилглиоксимом мешает присутствие Ре + Как устраняют его влияние Уравнение реакции [c.192]
Уравнения реакций (19.1), (19.2) и (19.3) представляют собой суммарное выражение процесса катодного выделения водорода при различных условиях электролиза. Этот процесс состоит из ряда последовательных стадий и может протекать по различным путям в зависимости от конкретных условий. Первая стадия — доставка к поверхности электрода частиц, служащих источником получаемого катодного водорода, протекает в данном случае без существенных торможений. Следующая за ней стадия отвечает разряду ионов водорода (или молекул воды) с образованием адсорбированных атомов водорода [c.403]
Отсчитав по бюретке израсходованный на титрование объем р (Створа реагента и зная его титр, перемножают эти величины и получают израсходованное на реакцию количество реагента (в граммах). Отсюда по уравнению реакции уже нетрудно вычислить количество определяемого вещества в исследуемом растворе, а если известен объем последнего, то и титр раствора . [c.196]
Прежде всего рассчитаем, какова будет величина pH раствора в тот момент, когда оттитровано 50% уксусной кислоты (т. е. к раствору прибавлено вдвое меньше щелочи, чем требуется по уравнению реакции, именно 50 мл щелочи на 100 мл кислоты). Оттитрованная часть кислоты превратилась в соль. Поэтому отношение Скисл Ссоли равно отношению числа миллилитров неоттитрован-нои кислоты к числу миллилитров оттитрованной кислоты (или [c.264]
Сложив почленно оба написанных уравнения, получим общее уравнение реакции, происходящей при работе данного элемента [c.346]
Причина отклонений заключается в сложности этих реакции. Действительно, в процессе реакций часто происходит не только переход электронов, но и изменение состава участвующих в реакции ионов. Такое изменение состава наблюдается, например, при восстановлении анионов МпОГ и СгаО до катионов Мп + и Сг +. Сложные реакции проходят всегда через ряд промежуточных стадий, так что уравнения реакций не отражают действительного течения процесса, а являются лишь суммарными. Скорость же всего процесса зависит именно от скоростей течения отдельных промежуточных стадий и потому не может быть заранее определена на основании суммарного уравнения реакции. [c.372]
Почленно складывая уравнения (2), (3) и (4), получаем суммарное уравнение реакции (1). [c.373]
Приводим уравнения реакций, на которых основаны эти опре-дел(иия [c.399]
Уравнения (7.4) и (7.6) неопределенны в том смысле, что не всегда можно достаточно четко установить, какие именно из участников реакции следует принимать за исходные вещества, а какие — за ее продукты. Поэтому, ссли не ввести дополнительных условий, то для одной и той же электрохимической системы, в зависимости от порядка написания уравнения реакции, значения [c.156]
Осаждение такого вещества, как РЬ504, при употреблении эквивалентного (т. е. соответствующего уравнению реакции) количества осадителя весьма неполно, однако применяя избыток осадителя, можно достигнуть гораздо более полного осаждения этой соли. [c.73]
Решение. Процесс сгорания серы описывается уравнением реакции [c.66]
Количество воздуха, необходимое для горения топлива, определяется на основе уравнений реакций горения. В нефтезаводских печах при сжигании ишдкого и газообразного топлива обычно имеет место практически полное горение. [c.109]
Перечислите важнейшие типы плавней, применяемых при сплавлении осадков. Составьте уравнения реакций, происходящих при сплавлении осадков. Составьте уравнения реакций, происходящих при сплавлении а) AI2O3 с KHSO4 [c.160]
С технической точки зрения решающее значение нрн синтезе Фишера— Тропша имеют, во-первых, очень большая теплота реакции каталитического гидрирования окиси углерода и, во-вторых, необходимость очень точного соблюдения постоянной температуры синтеза, особенно иа кобальтовом катализаторе, где она должна выдерживаться практически в пределах 1°. В противном случае значительно возрастает нежелательное метанообразование. Кроме того, при высоких температурах наблюдается отложение углерода на катализаторе, приводящее к быстрой его дезактивации. Из уравнений реакции на кобальтовом и железном катализаторах можно рассчитать, что на 1 нм сйнтеэ-газа, вошедшего в реакцию, выделяется по меньшей мере 600—700 ккал, т. е. количество тепла, достаточное (в адиабатических условиях) для нагрева синтез-газа примерно до 1500°. Отсюда ясно, какие конструктивные трудности возникают при эксплуатации установок крупного размера в связи с требованием соблюдать практически постоянную температуру синтеза. [c.67]
Совместное действие двуокиси серы и брома на парафиновые углеводороды ведет к лишь едва заметному образованию сульфобро-мндов, но реакция сейчас же начинается и протекает очень быстро п гладко, если половину брома заменить хлором. Как видно из следующего уравнения реакции, бром вместе с двуокисью серы вступает в молекулу парафина с одновременным выделением хлористого водорода [c.383]
Применение органических осадителей требует создания определенных услови1[ и прежде всего надлежащей величины pH раствора. Причину этого понять нетрудно. Выше указывалось, что при образовании внутрикомплексных солей происходит замещение водорода кислотной группы реагента ионами металла при этом в раствор переходят ионы водорода, как это следует, например, из приведенного выше уравнения реакции между N1 + и диметилглиоксимом. Ясно, что положение равновесия должно зависеть от концентрации Н” , т. е. от величины pH раствора. Диметил-глиоксим (и другие подобные ему органические реагенты) ведет себя как слабая кислота. Поэтому к рассматриваемой реакции применимо все то, что говорилось ранее о значении величины pH при осаждении малорастворимых солей слабых кислот. И здесь, если известна величина ПР осадка и константа кислотной ионизации реагента, можно вычислить величину pH, при которой достигается полное осаждение. [c.125]
Согласно ионному уравнению реакции при гидролизе на каждый обр 1зующийся ОН–И0Н в растворе появляется одна молекула НАп, откуда [НАп] = [ОН ]. [c.263]
Решение. Рр = 1п (известняка)/ т (извести). Запишем уравнение реакцпп СаСО , = СаО+СОа- -ДЛ/, Опреде,лнм молярную массу СаСО, и СаО если Л1г(СаС0з) = 100,1, то М(СаСОз) = = 100,1 г/моль, п. И 100-10- т/моль. Таким же способом вычисляется молекулярная масса если Мг(СаО) =56,1, то (СаО) =56,1 г/моль, нлн 56-10- т/моль. Вычислим массу вещества оксида кальция, содержащегося в 1 т извсстн 6 сао = 1-0,94 = 0,94. Количество оксида кальция будет гс.ао = 0,94/56-И)- = 1 б 857. ( огласно уравнению реакции количество вещества карбоната кальция также равно [c.46]
Когда в уравнении реакции, происходящей при превращении окисленной формы в восстановленную, имеются стехиометрические коэффициенты, не равные единице, они входят в уравнение Нерн-ста в качестве показателей степени при соответствующих концент-piiUHHX. Например, для пары Brs/2Br- можно написать [c.352]
Особенный интерес представляют те точки на кривой титрования, которые соответствуют 0,1 мл недостатка и 0,1 мл избытка КМпОд, так как они определяют собой величину скачка потенциала около точки эквивалентности. Вычислим первую из этих точек (начало скачка). Поскольку в этот момент прилито 99,9 мл КМп04, т. е. на 0,1 мл меньше, чем требуется по уравнению реакции, в растворе осталось неоттитрованным железо(И) в объеме 0,1 мл и оттитровано (т. е. преврашено в Fe +) все остальное количество Fe2+, находившееся в объеме 99,9 мл первоначального раствора. Следовательно, для этого момента [c.361]
Так как в точке эквивалентности Мп07-ионы вводятся в раствор в количестве, соответствующем уравнению реакции 5Ре2+ + МпОГ + 8Н+ 5 5Ре + + Мп2+ + 4НгО, то и при равновесии па каждый оставшийся в растворе МпОТ-ион должно приходиться бРе -ионов. Следовательно, в точке эквивалентности концентрация Ре в пять раз больше концентрации МпОГ, т. е. [c.362]
Как видно из приведенного уравнения, реакция идет с участием Н+-И0И0В, и поэтому ее следует проводить в кислой среде. Однако для количественного протекания реакции далеко не безразлично, с какой кислотой вводят Н+-ионы. Опыт показывает, что при титровании в сернокислой среде расход перманганата строго соответствует содержанию i e2+ и результат определения получается правильным. Наоборот, при титровании в присутствии НС1 или хлоридов наблюдается повышенный расход КМПО4. Это указывает на то, что он затрачивается на какую-то побочную реакцию. Если учесть, что титруемый раствор пахнет хлором, станет ясным, что эта реакция протекает следующим образом [c.375]
Аналогично определяют ряд других восстановителей, способных восстанавливать Ь до Г-иона. Таковы, например, соли НаЗОз, НзАзОз и Нз5ЬОз, НгЗ, 5пС12 и другие вещества. Приведем уравнения реакций, протекающих при титровании этих соединений иодом [c.397]
I Для определения свинца в руде взята иавеска руды 5,0000 г. После растворения ее в кислоте РЬ -ион осажден в виде РЬСгО,, осадок отфильтрован, промыт и растворен в смеси НС и KI (уравнение реакций ). Выделенный при этой реакции иод оттитровал 0,5000 н, раствором NajSjOa и его израсходовано [c.419]
Такнм образом, по Писаржевскому, переход ионов из металла в раствор совершается не за счет физически неясной электролитической упругости растворения металла, а в результате его взаимодействия с молекулами растворителя. Явление электролитической диссоциации электролитов и возникновение электродного потенциала основаны, следовательно, на одном и том же процессе сольватации (в случае водных растворов — гидратации) ионов. Из уравнения реакции (10.20) следует, что при растворении образуются не свободные, а сольватированные ионы, свойства которых зависят от и >ироды растворителя. Поэтому в отхичие от теории Нернста значение стандартного потенциала данного электрода должно меняться при переходе от одного растворителя к другому. Подобная зависимость была действительно обнаружена и послужила предметом исследований многих авторов (Изгарышева, Бродского, Плескова, Хартли, Измайлова и др.). Было установлено, что изменение электродного потенциала при переходе от одного растворителя к другому оказывается тем большим, чем М зньше радиус и выше заряд иона, участвующего в электродной реакции. По Плескову, меньше всего изменяются потенциалы цезиевого, рубидиевого и йодного электродов, в установлении равновегия на которых участвуют одновалентные ионы значительных размеров. Напротив, эти изменения особенно велики в случае ионов водорода и поливалентных катионов малых размеров. Именно такой зависимости электродных потенциалов от природы растворителя следовало ожидать на основе представлений Писаржевского о роли сольватационных явлений в образовании скачка потенциала металл — раствор. Для количественного сравнения потенциалов в разных растворителях применяют в качестве стандартного нулевого электрода цезиевый [c.221]
Последняя стадия определяет скорость всего процесса. Для реализации этой стадии необходимо, чтобы, во-первых, разряд водородных ионов протекал беспрепятственно (или во всяком случае егче, чем разряд восстанавливаемых частиц) и, во-вторых, присоединение атома водорода к частиц(з Ох совершалось с меньшими затруднениями, чем рекомбинация двух водородных атомов. Эти условия лучше всего должны выполняться на металлах групп платины и железа, а также на других металлах, у которых рекомбинация водородных атомов или является замедленной стадией, или протекает с малой скоростью. Накопление водородных атомов на поверхности этих металлов в ходе их катодной поляризации способствует быстрому протеканию реакции гидрирования. Электрохимическое восстановление при подобном механизме становится сходным с процессом каталитического гидрирования с той разницей, что атомы водорода в первом случае поставляются током, а во втором — диссоциацией молекулярного водорода иа поверхности катализатора. В согласии с уравнением реакции (21.15) для илотности тока, идущего на реакцию восстановления, можно наиисать следующее выражение [c.438]
Реи гнае. Из уравнений реакци [c.120]
VII. Какие пз приведенных уравнений реакции имеют место прп х([ми сской деа.эрацни воды [c.127]
как сдать часть 2 ЕГЭ по химии — Учёба.ру
Чем раньше начнешь готовиться к ЕГЭ,
тем выше будет балл Поможем подготовиться, чтобы сдать экзамены на максимум и поступить в топовые вузы на бюджет. Первый урок бесплатно
Александр Есманский,
преподаватель Олимпиадных школ МФТИ по химии, репетитор ЕГЭ и ОГЭ,
автор и составитель методических разработок
Задание № 30
Что требуетсяИз предложенного перечня веществ необходимо выбрать те, между которыми возможно протекание окислительно-восстановительной реакции (ОВР), записать уравнение этой реакции и подобрать в ней коэффициенты методом электронного баланса, а также указать окислитель и восстановитель.
ОсобенностиЭто одно из самых сложных заданий ЕГЭ по предмету, поскольку оно проверяет знание всей химии элементов, а также умение определять степени окисления элементов. По этим данным нужно определить вещества, которые могут быть только окислителями (элементы в составе этих веществ могут только понижать степень окисления), только восстановителями (элементы в составе этих веществ могут только повышать степень окисления) или же проявлять окислительно-восстановительную двойственность (элементы в составе этих веществ могут и понижать, и повышать степень окисления).
Также в задании необходимо уметь самостоятельно (без каких-либо указаний или подсказок) записывать продукты широкого круга окислительно-восстановительных реакций. Кроме того, нужно уметь грамотно оформить электронный баланс, после чего перенести полученные в балансе коэффициенты в уравнение реакции и дополнить его коэффициентами перед веществами, в которых элементы не изменяли степеней окисления.
СоветыОкислительно-восстановительные реакции основаны на принципе взаимодействия веществ противоположной окислительно-восстановительной природы. Согласно этому принципу любой восстановитель может взаимодействовать практически с любым окислителем. В задаче № 30 окислители и восстановители часто подобраны таким образом, что между ними точно будет протекать реакция.
Для нахождения пары окислитель/восстановитель нужно, прежде всего, обращать внимание на вещества, содержащие элементы в минимальной и максимальной степени окисления. Тогда вещество с минимальной степенью окисления будет являться типичным восстановителем, а вещество с максимальной степенью окисления с большой долей вероятности окажется сильным окислителем.
Если в списке только одно вещество (вещество 1) содержит элемент в максимальной или минимальной степени окисления, нужно найти ему в пару вещество, в котором элемент находится в промежуточной степени окисления и может проявлять свойства и окислителя, и восстановителя (вещество 2). Тогда вещество 1 определит окислительно-восстановительную активность вещества 2.
Когда пара окислитель/восстановитель определена, нужно обязательно проверить, в какой среде (кислой, нейтральной или щелочной) может протекать эта реакция. Если нет особенных правил, связанных со средой протекания выбранной реакции, то в качестве среды следует выбрать водный раствор того вещества (кислоты или щелочи), которое есть в предложенном списке реагентов.
Чтобы верно записать продукты окислительно-восстановительной реакции, нужно знать теоретические сведения о химии того или иного вещества и специфику его свойств. Однако запоминать все реакции наизусть — дело утомительное, да и не очень полезное. Для того чтобы упростить задачу, можно выявить некоторые общие закономерности в протекании ОВР и научиться предсказывать продукты реакций. Для этого нужно следовать трем простым правилам:
- Процессы окисления и восстановления — это две стороны единого процесса: процесса передачи электрона. Если какой-либо элемент (восстановитель) отдает электроны, то в этой же реакции обязательно должен быть какой-то элемент (окислитель), который принимает эти электроны.
- Если в реакции участвует простое вещество, эта реакция — всегда окислительно-восстановительная.
- При взаимодействии сильных окислителей с различными восстановителями обычно образуется один и тот же основной продукт окисления. Многие окислители при взаимодействии с различными восстановителями также часто восстанавливаются до какого-то одного продукта, соответствующего их наиболее устойчивой степени окисления.
Задание № 31
Что требуетсяИз предложенного перечня веществ (того же, что и в задании № 30) необходимо выбрать такие вещества, между которыми возможна реакция ионного обмена. Необходимо записать уравнение реакции в молекулярной форме и привести сокращенную ионную форму.
ОсобенностиЭто задание значительно легче предыдущего, поскольку круг возможных реакций ограничен и определен условиями протекания реакций ионного обмена, которые школьники изучают еще в 8-9 классах.
СоветыНужно помнить, что любая реакция ионного обмена — это обязательно реакция, протекающая в растворе. Все реакции ионного обмена являются неокислительно-восстановительными!
В реакциях ионного обмена могут участвовать:
- солеобразующие оксиды;
- основания и амфотерные гидроксиды;
- кислоты;
- соли (средние, кислые, основные). Теоретически можно составить реакцию ионного обмена с участием смешанных, двойных или комплексных солей, но это для задания № 31 — экзотика.
Чаще всего в этой задаче встречаются реакции ионного обмена с участием оснований, амфотерных гидроксидов, кислот и средних солей. Однако обмен ионами может осуществляться далеко не с любыми парами веществ. Для того чтобы протекала реакция ионного обмена, необходимо выполнение некоторых ограничительных условий, которые связаны с реагентами и продуктами реакции.
Для написания ионных форм уравнений нужно следовать правилам, согласно которым одни вещества представляются в диссоциированной форме (в виде ионов), а другие — в недиссоциированной (в виде молекул).
Расписываем на ионы в реакциях ионного обмена:
- растворимые сильные электролиты;
- малорастворимые сильные электролиты, если они являются реагентами.
Не расписываем на ионы в реакциях ионного обмена:
- неэлектролиты;
- нерастворимые в воде вещества;
- слабые электролиты;
- малорастворимые сильные электролиты, если они являются продуктами реакции.
Когда уже сокращенная форма реакции ионного обмена записана, будет нелишним проверить для нее выполнение материального и электрического баланса. Другими словами, верно ли расставлены в сокращенной форме коэффициенты и сохраняется ли общий электрический заряд в левой и правой частях уравнения. Это позволит избежать потерянных коэффициентов или зарядов ионов на пути от молекулярной формы через полную ионную — к сокращенной.
Задание № 32
Что требуетсяПо приведенному текстовому описанию необходимо записать уравнения четырех реакций.
ОсобенностиЭто задание так же, как и задание № 30, проверяет знание всей химии элементов, которая содержится в спецификации ЕГЭ. Однако часто составление четырех уравнений, описанных в задании № 32, является более простой задачей, чем составление одного уравнения в вопросе № 30. Во-первых, здесь не нужно самостоятельно выбирать реагенты, поскольку они уже даны в условии, а продукты часто можно угадать, используя данные условия, которые, по сути, являются подсказками. Во-вторых, из четырех описанных в задании уравнений, как правило, два можно записать, используя знания 8-9 классов. Например, это могут быть реакции ионного обмена. Два других уравнения — посложнее, подобные тем, которые предлагаются в задании № 30.
СоветыКонечно, можно просто выучить всю химию элементов наизусть и с ходу записать все уравнения. Это самый верный способ. Если же возникают трудности с определением продуктов, то нужно по максимуму использовать подсказки, приведенные в условии. Чаще всего в задании указываются наблюдаемые химические явления: выпадение или растворение осадков, выделение газов, изменение цвета твердых веществ или растворов. А если еще и указан конкретный цвет осадка, газа или раствора, можно с высокой точностью определить, о каком веществе идет речь. Для этого необходимо всего лишь знать цвета наиболее часто использующихся в задачах школьной программы осадков и газов, а также цвета растворов солей. Это сильно облегчит написание проблемного уравнения реакции, и задание № 32 покажется очень даже простым.
Задание № 33
Что требуетсяНеобходимо записать уравнение пяти реакций с участием органических веществ по приведенной схеме (цепочке превращений).
ОсобенностиВ этом задании предлагается классическая цепочка превращений, какие школьники учатся решать с первого года изучения химии, только здесь в каждом уравнении участвует хотя бы одно органическое вещество. Задача на каждой стадии цепочки может быть сформулирована в двух вариантах. В первом варианте даются один из реагентов и продукт реакции. В этом случае необходимо подобрать второй реагент, а также указать все условия осуществления реакций (наличие катализаторов, нагревание, соотношение реагентов). Во втором варианте известны все реагенты, а часто и условия реакции. Необходимо только записать продукты.
СоветыЛучший способ успешно выполнить цепочку по органике — это знать наизусть все типы реакций каждого класса соединений и специфические свойства органических веществ, содержащиеся в школьном курсе органической химии.
Главное правило задания № 33 — использование графических (структурных) формул органических веществ в уравнениях реакций. Это указание обязательно прописано в каждом варианте тренировочных работ и пробных вариантов ЕГЭ по химии, поэтому известно всем выпускникам. Однако некоторые школьники все равно иногда пренебрегают этим правилом и часть органических веществ записывают в молекулярном виде. Будьте внимательны! Уравнения реакций с молекулярными формулами органических веществ в этом задании не засчитываются.
В задачах № 32 и № 33 уравнение считается написанным верно, если в нем расставлены все коэффициенты и при необходимости указаны условия протекания реакции. Уравнения реакций, в которых хотя бы один коэффициент неверен или не указаны важные условия, не засчитываются.
Задание № 34
Что требуетсяРешить расчетную задачу, тематика которой меняется от года к году и от варианта к варианту.
ОсобенностиВ спецификации ЕГЭ под номером 34 заявлены задачи с использованием понятия доли (массовой, объемной, мольной) вещества в смеси. Частным случаем таких задач являются задачи «на массовую долю вещества в растворе», задачи «на примеси», то есть с использованием понятия доли чистого вещества в составе технического. Сюда же относятся расчеты массовой или объемной доли выхода продукта реакции от теоретически возможного, а также расчеты по уравнению реакции, если один из реагентов дан в избытке.
Предсказать, какие задачи будут отобраны для ЕГЭ именно в этом году, практически невозможно. Единственное, что можно ожидать по опыту прошлых лет, — это то, что задача не окажется сложной и будет полностью соответствовать профильной школьной программе (не олимпиадной). Это значит, что такая задача по зубам любому школьнику, освоившему курс химии на профильном школьном уровне и обладающему обыкновенной математической и химической логикой.
СоветыДля того чтобы решить эту задачу, прежде всего, нужно знать базовые формулы и определения основных физических величин. Необходимо осознать понятие «математической доли» как отношения части к целому. И тогда все типы долей в химии принимают одинаковый внешний вид.
| Массовая доля вещества в смеси | \({\omega_{1}} = {{m_{в-ва}} \over m_{смеси}}\) |
| Массовая доля вещества растворе | \({\omega_{1}} = {{m_{в-ва}} \over m_{р-ра}}\) |
| Мольная доля вещества в смеси (растворе) | \({\chi} = {{\nu_{в-ва}} \over \nu_{смеси}}\) |
| Объемная доля вещества в смеси (растворе) | \({\varphi} = {{V_{в-ва}} \over V_{смеси}}\) |
| Доля чистого вещества в составе технического (степень чистоты) | \({\omega_{чист}} = {{m_{чист}} \over m_{техн}}\) |
| Доля выхода продукта от теоретически возможного (выход продукта) | \({\eta} = {{\upsilon_{практ}} \over \upsilon_{теор}} = {{m_{практ}} \over m_{теор}} \) \(m_{практ}\) — масса продукта, которая получилась в результате химической реакции \(m_{теор}\) — масса продукта, которая могла образоваться в соответствии с теоретическим расчетом по уравнению реакции |
| Количество вещества | \({v} = {m \over M} \) \([{v}] = моль \) \({\nu} = {{V} \over V_{m}}\) Молярный объем, т.3} \) |
Задание № 35
Что требуетсяРешить расчетную задачу на установление молекулярной и структурной формулы вещества, записать предложенное уравнение реакции с данным веществом.
ОсобенностиИдеологическая часть задач на вывод формулы изучается школьниками еще в 8-9 классах, поэтому это наиболее простая задача части 2 ЕГЭ. Хотя в спецификации не указано, формулу какого вещества необходимо установить. Опыт показывает, что из года в год здесь традиционно участвуют органические вещества.
СоветыВсе задачи на вывод формулы, встречающиеся в ЕГЭ, можно условно разделить на три типа. Первый тип — это установление формулы по массовым долям элементов в веществе. Здесь работает формула для массовой доли элемента в сложном веществе:
\({\omega} = {n \times {A_{r}(элемента)} \over {M_{r}(вещества)}} \times 100 \%\)где n — число атомов элемента в молекуле, то есть индекс элемента.
Иногда в этом типе задач нужно знать еще и общую формулу класса, к которому относится неизвестное органическое вещество. Затем следует выразить относительную молекулярную массу вещества через n и подставить в уравнение для массовой доли. Решением уравнения будет искомое значение n, а следовательно, и молекулярная формула вещества. Дополнительные сведений о веществе, указанные в условии задачи, позволяют установить структурную формулу вещества, с которой далее требуется записать уравнение реакции.
Второй тип задач — это установление формулы через расчеты по уравнению химической реакции. Здесь нужно обязательно знать еще общую формулу класса, к которому относится неизвестное органическое вещество, и записать с ним уравнение реакции. Иногда приходится расставлять коэффициенты в общем виде через n. Тем не менее это наиболее понятный тип задач на вывод формулы, поскольку он чаще всего сводится к одному уравнению с одним неизвестным n, решение которого дает нам искомую молекулярную формулу. Дополнительные сведения о веществе, указанные в условии задачи, позволяют установить структурную формулу вещества, с которой далее требуется записать уравнение реакции.
И, наконец, третий тип задач — это установление формулы по продуктам сгорания вещества. Этот вариант наиболее часто встречается на ЕГЭ в этом задании. Выглядит он чуть более громоздко, чем два предыдущих, однако решается также очень просто. План решения заключается в нахождении простейшей формулы вещества и переходе к истинной (то есть молекулярной) формуле через известную молярную массу вещества. Простейшая формула находится из закона, согласно которому индексы элементов относятся так же, как их количества вещества в молях. Если молярная масса вещества не дана в условии, то можно попробовать доказать единственность решения через соответствие формулы правилам валентности. Но такой подход часто бывает трудоемок, и его можно легко обойти, если использовать дополнительные сведения об искомом веществе, указанные в условии задачи. Это может быть класс соединения, наличие или отсутствие каких-либо типов изомерии и, наконец, химическая реакция, в которую это вещество способно вступать или с помощью которой оно может быть получено. Помимо молекулярной формулы, эти же дополнительные сведения позволяют однозначно определить и структурную формулу вещества, с которой далее требуется записать уравнение реакции.
Метод электронного баланса
Суть метода электронного баланса заключается в:
- Подсчете изменения степени окисления для каждого из элементов, входящих в уравнение химической реакции
- Элементы, степень окисления которых в результате произошедшей реакции не изменяется – не принимаются во внимание
- Из остальных элементов, степень окисления которых изменилась – составляется баланс, заключающийся в подсчете количества приобретенных или потерянных электронов
- Для всех элементов, потерявших или получивших электроны (количество которых отличается для каждого элемента) находится наименьшее общее кратное
- Найденное значение и есть базовые коэффициенты для составления уравнения.
Визуально алгоритм решения задачи с помощью метода электронного баланса представлен на диаграмме.
Как это выглядит на практике, рассмотрено на примере задач по шагам.
Задача.Методом электронного баланса подберите коэффициенты в схемах следующих окислительно-восстановительных реакций с участием металлов:
а) Ag + HNO3 → AgNO3 + NO + H2O
б) Ca +H2SO4 → CaSO4 + H2S + H2O
в) Be + HNO3 → Be(NO3)2 + NO + H2O
Решение.
Для решения данной задачи воспользуемся правилами определения степени окисления.
Составим электронный баланс для каждого элемента реакции окисления Ag + HNO3 → AgNO3 + NO + H2O.
Шаг 1. Подсчитаем степени окисления для каждого элемента, входящего в химическую реакцию.
Ag. Серебро изначально нейтрально, то есть имеет степень окисления ноль.
Для HNO3 определим степень окисления, как сумму степеней окисления каждого из элементов.
Степень окисления водорода +1, кислорода -2, следовательно, степень окисления азота равна:
0 – (+1) – (-2)*3 = +5
(в сумме, опять же, получим ноль, как и должно быть)Теперь перейдем ко второй части уравнения.
Для AgNO3 степень окисления серебра +1 кислорода -2, следовательно степень окисления азота равна:
0 – (+1) – (-2)*3 = +5Для NO степень окисления кислорода -2, следовательно азота +2
Для H2O степень окисления водорода +1, кислорода -2
Шаг 2. Запишем уравнение в новом виде, с указанием степени окисления каждого из элементов, участвующих в химической реакции.Ag0 + H+1N+5O-23 → Ag+1N+5O-23 + N+2O-2 + H+12O-2
Из полученного уравнения с указанными степенями окисления, мы видим несбалансированность по сумме положительных и отрицательных степеней окисления отдельных элементов.
Шаг 3. Запишем их отдельно в виде электронного баланса – какой элемент и сколько теряет или приобретает электронов:
(Необходимо принять во внимание, что элементы, степень окисления которых не изменилась – в данном расчете не участвуют)
Ag0 – 1e = Ag+1
N+5 +3e = N+2
Серебро теряет один электрон, азот приобретает три. Таким образом, мы видим, что для балансировки нужно применить коэффициент 3 для серебра и 1 для азота. Тогда число теряемых и приобретаемых электронов сравняется.
Шаг 4. Теперь на основании полученного коэффициента “3” для серебра, начинаем балансировать все уравнение с учетом количества атомов, участвующих в химической реакции.
- В первоначальном уравнении перед Ag ставим тройку, что потребует такого же коэффициента перед AgNO3
- Теперь у нас возник дисбаланс по количеству атомов азота. В правой части их четыре, в левой – один. Поэтому ставим перед HNO3 коэффициент 4
- Теперь остается уравнять 4 атома водорода слева и два – справа. Решаем это путем применения коэффииента 2 перед H2O
Ответ:
3Ag + 4HNO3 = 3AgNO3 + NO + 2H2O Пример “б”
Составим электронный баланс для каждого элемента реакции окисления Ca +H2SO4 → CaSO4 + H2S + H2O
Для H2SO4 степень окисления водорода +1 кислорода -2 откуда степень окисления серы 0 – (+1)*2 – (-2)*4 = +6Для CaSO4 степень окисления кальция равна +2 кислорода -2 откуда степень окисления серы 0 – (+2) – (-2)*4 = +6
Для H2S степень окисления водорода +1, соответственно серы -2
Ca0 +H+12S+6O-24 → Ca+2S+6O-24 + H+12S-2 + H+12O-2
Ca0 – 2e = Ca+2 (коэффициент 4)
S+6 + 8e = S-2
4Ca + 5H2SO4 = 4CaSO4 + H2S + 4H2O
Пример “в”Составим электронный баланс для каждого элемента реакции окисления Be + HNO3 → Be(NO3)2 + NO + H2O
HNO3 см. вышеДля Be(NO3)2 степень окисления бериллия +2, кислорода -2, откуда степень окисления азота ( 0 – (+2) – (-2)*3*2 ) / 2 = +5
NO см. выше
H2O см. выше
Be0 + H+1N+5O-23 → Be+2(N+5O-23)2 + N+2O-2 + H+12O-2
Be0 – 2e = Be+2 (коэффициент 3)
N+5 +3e = N+2 (коэффициент 2)
3Be + 8HNO3 → 3Be(NO3)2 + 2NO + 4H2O
3.1: Химические уравнения – Chemistry LibreTexts
Цели обучения
- Для описания химической реакции.
- Для расчета количества соединений, производимых или потребляемых в химической реакции
Что происходит с материей, когда она претерпевает химические изменения? Закон сохранения массы гласит, что « Атомы не создаются и не разрушаются во время какой-либо химической реакции ». Таким образом, после реакции присутствует тот же набор атомов, что и до реакции.Изменения, которые происходят во время реакции, включают только перегруппировку атомов. В этом разделе мы обсудим стехиометрию («измерение элементов»).
Химические уравнения
Как показано на рисунке \ (\ PageIndex {1} \), приложение небольшого количества тепла к груде оранжевого порошка дихромата аммония приводит к бурной реакции, известной как вулкан дихромата аммония. Тепло, свет и газ образуются в виде большого ворса пушистого зеленого оксида хрома (III).Эта реакция описывается химическим уравнением, выражением, которое определяет идентичность и количество веществ в химической реакции.
Рисунок \ (\ PageIndex {1} \): Вулкан из дихромата аммония: изменение во время химической реакции. Исходный материал – твердый дихромат аммония. Химическая реакция превращает его в твердый оксид хрома (III), на котором изображена часть его цепочечной структуры, газообразный азот и водяной пар (кроме того, выделяется энергия в виде тепла и света).Во время реакции распределение атомов меняется, но количество атомов каждого элемента не меняется. Поскольку номера каждого типа атомов одинаковы в реагентах и продуктах, химическое уравнение сбалансировано. (CC BY-SA 3.0; Микк Михкель Ваабель через Википедию). Смотрите видео здесь: www.youtube.com/watch?v=CW4hN0dYnkMХимические реакции представлены на бумаге химическими уравнениями . Например, газообразный водород (H 2 ) может реагировать (гореть) с газообразным кислородом (O 2 ) с образованием воды (H 2 O).Химическое уравнение для этой реакции записывается как:
\ [\ ce {2H_2 + O_2 \ rightarrow 2H_2O} \]
Химические формулы и другие символы используются для обозначения исходных материалов или реагентов, которые по соглашению записываются в левой части уравнения, и конечных соединений или продуктов, которые записываются справа. Стрелка указывает от реагента к продуктам. Химическая реакция вулкана из дихромата аммония на рисунке \ (\ PageIndex {1} \) составляет
\ [\ underbrace {\ ce {(NH_4) _2Cr_2O_7}} _ {реагент} \ rightarrow \ underbrace {\ ce {Cr_2O_3 + N_2 + 4H_2O}} _ {продукты} \ label {3.1.1} \]
Стрелка читается как «уступает» или «реагирует на форму». Уравнение \ (\ ref {3.1.1} \) указывает, что дихромат аммония (реагент) дает оксид хрома (III), азот и воду (продукты). Уравнение этой реакции еще более информативно, если записать его так:
\ [\ ce {(Nh5) 2Cr2O7 (s) \ rightarrow Cr2O3 (s) + N2 (g) + 4h3O (g)} \ label {3.1.2} \]
Уравнение \ (\ ref {3.1.2} \) идентично уравнению \ (\ ref {3.1.1} \), за исключением добавления сокращений в скобках для обозначения физического состояния каждого вида.Сокращения: (s) для твердого вещества, (l) для жидкости, (g) для газа и (aq) для водного раствора, раствора вещества в воде.
В соответствии с законом сохранения массы, номера каждого типа атомов одинаковы по обе стороны от уравнений \ (\ ref {3.1.1} \) и \ (\ ref {3.1.2} \). Каждая сторона реакции имеет два атома хрома, семь атомов кислорода, два атома азота и восемь атомов водорода.
В сбалансированном химическом уравнении номера каждого типа атомов и общий заряд одинаковы с обеих сторон.Уравнения \ (\ ref {3.1.1} \) и \ (\ ref {3.1.2} \) представляют собой сбалансированные химические уравнения. С каждой стороны уравнения различается то, как атомы расположены, чтобы образовывать молекулы или ионы. Химическая реакция представляет собой изменение распределения атомов, но не количества атомов. В этой реакции, как и в большинстве химических реакций, разрываются связи в реагентах (здесь связи Cr – O и N – H), и образуются новые связи для создания продуктов (здесь связи O – H и N≡N). . Если числа каждого типа атомов различны по обе стороны химического уравнения, то уравнение неуравновешено и не может правильно описать, что происходит во время реакции.Чтобы продолжить, сначала необходимо сбалансировать уравнение.
Химическая реакция изменяет только распределение атомов, но не количество атомов.
Уравновешивание простых химических уравнений
Когда химик сталкивается с новой реакцией, на ней обычно нет этикетки, которая показывает сбалансированное химическое уравнение. Вместо этого химик должен идентифицировать реагенты и продукты, а затем записать их в форме химического уравнения, которое может быть сбалансировано, а может и не быть сбалансировано, как было написано вначале.Рассмотрим, например, сгорание н-гептана (\ (C_7H_ {16} \)), важного компонента бензина:
\ [\ ce {C_7H_ {16} (l) + O_2 (g) \ rightarrow CO_2 (g) + H_2O (g)} \ label {3.1.3} \]
Полное сгорание любого углеводорода с достаточным количеством кислорода всегда дает диоксид углерода и воду.
Рисунок \ (\ PageIndex {2} \): Пример реакции горения. Воск в свече представляет собой высокомолекулярный углеводород, который в реакции горения выделяет газообразный диоксид углерода и водяной пар (Уравнение \ (\ ref {3.1.3} \)).Уравнение \ (\ ref {3.1.3} \) не сбалансировано: номера каждого типа атомов на стороне реагента уравнения (7 атомов углерода, 16 атомов водорода и 2 атома кислорода) не совпадают с количество атомов каждого типа на стороне продукта (1 атом углерода, 2 атома водорода и 3 атома кислорода). Следовательно, коэффициенты реагентов и продуктов должны быть скорректированы так, чтобы получить одинаковое количество атомов каждого типа по обеим сторонам уравнения. Поскольку идентичности реагентов и продуктов фиксированы, уравнение не может быть сбалансировано путем изменения индексов реагентов или продуктов.Это изменит химическую идентичность описываемых видов, как показано на рисунке \ (\ PageIndex {3} \).
Рисунок \ (\ PageIndex {3} \): Уравнения балансировки. Вы не можете изменить индексы в химической формуле, чтобы сбалансировать химическое уравнение; вы можете изменить только коэффициенты. Изменение индексов изменяет соотношение атомов в молекуле и получаемые в результате химические свойства. Например, вода (H 2 O) и перекись водорода (H 2 O 2 ) являются химически разными веществами.H 2 O 2 разлагается на газ H 2 O и газ O 2 при контакте с металлической платиной, тогда как между водой и платиной такая реакция не происходит.Самый простой и наиболее полезный метод уравновешивания химических уравнений – это «проверка», более известная как метод проб и ошибок. Ниже приводится эффективный подход к уравновешиванию химического уравнения с использованием этого метода.
Шаги по уравновешиванию химического уравнения
- Определите наиболее сложное вещество.
- Начиная с этого вещества, выберите элемент, который присутствует только в одном реагенте и одном продукте, если это возможно. Отрегулируйте коэффициенты, чтобы получить одинаковое количество атомов этого элемента с обеих сторон.
- Уравновешивает многоатомные ионы (если есть) как единое целое.
- Уравновесить оставшиеся атомы, обычно заканчивая наименее сложным веществом и при необходимости используя дробные коэффициенты. Если использовался дробный коэффициент, умножьте обе части уравнения на знаменатель, чтобы получить целые числа для коэффициентов.
- Проверьте свою работу, подсчитав количество атомов каждого сорта по обе стороны уравнения, чтобы убедиться, что химическое уравнение сбалансировано.
Пример \ (\ PageIndex {1A} \): Горение гептана
Чтобы продемонстрировать этот подход, давайте возьмем сгорание н-гептана (уравнение \ (\ ref {3.1.3} \)) в качестве примера.
- Определить наиболее сложное вещество . Самая сложная субстанция – это вещество с наибольшим числом различных атомов, то есть \ (\ ce {C_7H_ {16}} \).Сначала предположим, что окончательное сбалансированное химическое уравнение содержит 1 молекулу или формульную единицу этого вещества.
- Настройте коэффициенты . Попробуйте отрегулировать коэффициенты молекул на другой стороне уравнения, чтобы получить одинаковое количество атомов с обеих сторон. Поскольку одна молекула н-гептана содержит 7 атомов углерода, нам нужно 7 молекул CO 2 , каждая из которых содержит 1 атом углерода, с правой стороны:
\ [\ ce {C_7H_ {16} + O_2 \ rightarrow 7CO_2 + H_2O} \ label {3.1.4} \]
- Баланс многоатомных ионов как единое целое . В этой реакции не рассматриваются многоатомные ионы.
- Уравновесить оставшиеся атомы . Поскольку одна молекула н-гептана содержит 16 атомов водорода, нам нужно 8 молекул h3O, каждая из которых содержит 2 атома водорода, с правой стороны: \ [\ ce {C_7H_ {16} + O_2 \ rightarrow 7CO_2 + 8H_2O} \ label {3.1.5} \] Атомы углерода и водорода теперь уравновешены, но у нас есть 22 атома кислорода справа и только 2 атома кислорода слева.Мы можем сбалансировать атомы кислорода, регулируя коэффициент перед наименее сложным веществом, O 2 , на стороне реагента: \ [\ ce {C_7H_ {16} (l) + 11O_2 (g) \ rightarrow 7CO_2 (g ) + 8H_2O (г)} \ label {3.1.6} \]
- Проверь свою работу . Уравнение теперь сбалансировано, и дробных коэффициентов нет: с каждой стороны по 7 атомов углерода, 16 атомов водорода и 22 атома кислорода. Всегда проверяйте, сбалансировано ли химическое уравнение. Предположение, что окончательное сбалансированное химическое уравнение содержит только одну молекулу или формульную единицу самого сложного вещества, не всегда верно, но это хорошее место для начала.
Пример \ (\ PageIndex {1B} \): сжигание изооктана
Рассмотрим, например, аналогичную реакцию, горение изооктана (\ (\ ce {C8h28} \)). Поскольку при сгорании любого углеводорода с кислородом образуется диоксид углерода и вода, несбалансированное химическое уравнение выглядит следующим образом:
\ [\ ce {C_8H_ {18} (l) + O_2 (g) \ rightarrow CO_2 (g) + H_2O (g)} \ label {3.1.7} \]
- Определить наиболее сложное вещество . Начните процесс балансировки, предположив, что окончательное сбалансированное химическое уравнение содержит одну молекулу изооктана.
- Настройте коэффициенты . Первый элемент, который появляется в реагентах только один раз, – это углерод: 8 атомов углерода в изооктане означает, что в продуктах должно быть 8 молекул CO 2 : \ [\ ce {C_8H_ {18} + O_2 \ rightarrow 8CO_2 + H_2O} \ label {3.1.8} \]
- Баланс многоатомных ионов как единое целое . Этот шаг не применяется к этому уравнению.
- Уравновесить оставшиеся атомы . Восемнадцать атомов водорода в изооктане означает, что в продуктах должно быть 9 молекул H 2 O: \ [\ ce {C_8H_ {18} + O_2 \ rightarrow 8CO_2 + 9H_2O} \ label {3.1.9} \] Атомы углерода и водорода теперь уравновешены, но у нас есть 25 атомов кислорода справа и только 2 атома кислорода слева. Мы можем сбалансировать наименее сложное вещество, O 2 , но поскольку на молекулу O 2 приходится 2 атома кислорода, мы должны использовать дробный коэффициент (25/2), чтобы сбалансировать атомы кислорода: \ [\ ce {C_8H_ {18} + 25/2 O_2 \ rightarrow 8CO_2 + 9H_2O} \ label {3.1.10} \] Уравнение \ (\ ref {3.1.10} \) теперь сбалансировано, но мы обычно пишем уравнения с целочисленными коэффициентами.Мы можем исключить дробный коэффициент, умножив все коэффициенты с обеих сторон химического уравнения на 2: \ [\ ce {2C_8H_ {18} (l) + 25O_2 (g) \ rightarrow 16CO_2 (g) + 18H_2O (g)} \ этикетка {3.11} \]
- Проверь свою работу . Сбалансированное химическое уравнение имеет 16 атомов углерода, 36 атомов водорода и 50 атомов кислорода с каждой стороны.
Балансировка уравнений требует от вас некоторой практики, а также некоторого здравого смысла. Если вы обнаружите, что используете очень большие коэффициенты или безуспешно потратили несколько минут, вернитесь и убедитесь, что вы правильно написали формулы реагентов и продуктов.
Пример \ (\ PageIndex {1C} \): Гидроксиапатит
Реакция минерального гидроксиапатита (\ (\ ce {Ca5 (PO4) 3 (OH)} \)) с фосфорной кислотой и водой дает \ (\ ce {Ca (h3PO4) 2 • h3O} \) (дигидрофосфат кальция моногидрат). Напишите и сбалансируйте уравнение этой реакции.
Гидроксиапатит (\ (\ ce (Ca5 (PO4) 3 (OH)} \)) кристаллДано : реагенты и продукт
На вопрос : вычисленное химическое уравнение
Стратегия :
- Определите продукт и реагенты, а затем запишите несбалансированное химическое уравнение.
- Следуйте инструкциям по уравновешиванию химического уравнения.
Решение :
A Сначала мы должны идентифицировать продукт и реагенты и написать уравнение реакции. В задаче приведены формулы для гидроксиапатита и моногидрата дигидрофосфата кальция (напомним, что фосфорная кислота – H 3 PO 4 ). Исходное (несбалансированное) уравнение выглядит следующим образом:
\ [\ ce {Ca5 (PO4) 3 (OH) (s) + H_3PO4 (вод.) + H_2O _ {(l)} \ rightarrow Ca (H_2PO_4) _2 \ cdot H_2O _ {(s)}} \]
1. B Определите наиболее сложное вещество . Мы начинаем с предположения, что только одна молекула или формульная единица наиболее сложного вещества, \ (\ ce {Ca5 (PO4) 3 (OH)} \), появляется в сбалансированном химическом уравнении.
2. Настройте коэффициенты . Поскольку кальций присутствует только в одном реагенте и одном продукте, мы начнем с него. Одна формульная единица \ (\ ce {Ca5 (PO4) 3 (OH)} \) содержит 5 атомов кальция, поэтому нам нужно 5 Ca (H 2 PO 4 ) 2 • H 2 O на правая сторона:
\ [\ ce {Ca5 (PO4) 3 (OH) + h4PO4 + h3O \ rightarrow 5Ca (h3PO4) 2 \ cdot h3O} \]
3. Уравновесить многоатомные ионы как единое целое . Обычно легче сбалансировать уравнение, если мы признаем, что определенные комбинации атомов встречаются с обеих сторон. В этом уравнении многоатомный фосфат-ион (PO 4 3 – ) появляется в трех местах. В H 3 PO 4 ион фосфата объединяется с тремя ионами H + с образованием фосфорной кислоты (H 3 PO 4 ), тогда как в Ca (H 2 PO 4 ) 2 • H 2 O он объединяется с двумя ионами H + с образованием дигидрофосфатного иона.Таким образом, легче сбалансировать PO 4 как единицу, чем считать отдельные атомы фосфора и кислорода. На правой стороне 10 штук PO 4 , а на левой – всего 4. Самый простой способ уравновесить единицы PO 4 – поставить коэффициент 7 перед H 3 PO 4 :
\ [\ ce {Ca_5 (PO_4) _3 (OH) + 7H_3PO_4 + H_2O \ rightarrow 5Ca (H_2PO_4) _2 \ cdot H_2O} \]
Хотя OH – также является многоатомным ионом, он не появляется с обеих сторон уравнения.Таким образом, кислород и водород необходимо уравновешивать отдельно.
4. Уравновесить оставшиеся атомы . Теперь у нас 30 атомов водорода справа и только 24 слева. Мы можем уравновесить атомы водорода, используя наименее сложное вещество, H 2 O, поместив коэффициент 4 перед H 2 O с левой стороны, что в сумме даст 4 H 2 O молекул:
\ [\ ce {Ca_5 (PO_4) _3 (OH) (s) + 7H_3PO_4 (aq) + 4H_2O (l) \ rightarrow 5Ca (H_2PO_4) _2 \ cdot H_2O (s)} \]
Теперь уравнение сбалансировано.Несмотря на то, что мы явно не сбалансировали атомы кислорода, на каждой стороне находится 41 атом кислорода.
5. Проверьте свою работу . Обе части уравнения содержат 5 атомов кальция, 10 атомов фосфора, 30 атомов водорода и 41 атом кислорода.
Упражнение \ (\ PageIndex {1} \): Ферментация
Ферментация – это биохимический процесс, который позволяет дрожжевым клеткам жить в отсутствие кислорода. Люди веками использовали его для производства вина и пива, а также для выращивания хлеба.При ферментации сахара, такие как глюкоза, превращаются в этанол (\ (CH_3CH_2OH \) и диоксид углерода \ (CO_2 \). Напишите сбалансированную химическую реакцию ферментации глюкозы.
Коммерческое использование ферментации . (а) Чаны для пивоварен используются для приготовления пива. (б) Ферментация глюкозы дрожжевыми клетками – это реакция, которая делает возможным производство пива.
- Ответ
\ [C_6H_ {12} O_6 (s) \ rightarrow 2C_2H_5OH (l) + 2CO_2 (g) \ nonumber \]
Интерпретация химических уравнений
Помимо предоставления качественной информации об идентичности и физическом состоянии реагентов и продуктов, сбалансированное химическое уравнение предоставляет количественную информацию.В частности, он дает относительные количества реагентов и продуктов, потребляемых или производимых в реакции. Число атомов, молекул или формульных единиц реагента или продукта в сбалансированном химическом уравнении является коэффициентом этого вещества (например, 4 предшествующих H 2 O в уравнении \ (\ ref {3.1.1} \ )). Если перед видом не указан коэффициент, предполагается, что коэффициент равен 1. Как показано на рисунке \ (\ PageIndex {4} \), коэффициенты позволяют использовать уравнение \ (\ ref {3.1.1} \). интерпретируется любым из следующих способов:
- Два иона NH 4 + и один Cr 2 O 7 2 – выход ионов 1 формульная единица Cr 2 O 3 , 1 молекула N 2 и 4 H 2 O молекул.
- Один моль (NH 4 ) 2 Cr 2 O 7 дает 1 моль Cr 2 O 3 , 1 моль N 2 и 4 моль H 2 О.
- Масса 252 г (NH 4 ) 2 Cr 2 O 7 дает 152 г Cr 2 O 3 , 28 г N 2 и 72 г H 2 О.
- Всего 6,022 × 10 23 формульных единиц (NH 4 ) 2 Cr 2 O 7 дает 6.022 × 10 23 формульных единиц Cr 2 O 3 , 6.022 × 10 23 молекул N 2 и 24.09 × 10 23 молекул H 2 O.
Все эти химически эквивалентные способы изложения информации, содержащейся в сбалансированном химическом веществе уравнение, использующее понятия моля, молярной или формульной массы и числа Авогадро.Отношение количества молей одного вещества к количеству молей другого называется мольным соотношением. Например, мольное отношение \ (H_2O \) к \ (N_2 \) в уравнении \ (\ ref {3.1.1} \) составляет 4: 1. Общая масса реагентов равна общей массе продуктов, как предсказывает закон сохранения массы Дальтона:
\ [252 \; г \; \ текст {из} \; \ ce {(NH_4) _2Cr_2O_7} \]
выход
\ [152 + 28 + 72 = 252 \; грамм \; \ text {товаров.} \]
Химическое уравнение, однако, не показывает скорость реакции (быстро, медленно или совсем) или выделяется ли энергия в виде тепла или света.Эти вопросы более подробно рассматриваются в следующих главах.
Важная химическая реакция была проанализирована Антуаном Лавуазье, французским химиком 18 века, который интересовался химией живых организмов, а также простыми химическими системами. В классической серии экспериментов он измерил углекислый газ и тепло, выделяемое морской свинкой во время дыхания, в котором органические соединения используются в качестве топлива для производства энергии, углекислого газа и воды. Лавуазье обнаружил, что соотношение выделяемого тепла и выдыхаемого углекислого газа было аналогично соотношению, наблюдаемому при реакции древесного угля с кислородом воздуха с образованием двуокиси углерода – процесс, который химики называют горением.Основываясь на этих экспериментах, он предположил, что «Дыхание – это горение, правда, медленное, но в остальном оно совершенно похоже на горение древесного угля». Лавуазье был прав, хотя органические соединения, потребляемые при дыхании, существенно отличаются от тех, что содержатся в древесном угле. Одним из важнейших топлив в организме человека является глюкоза (\ (C_6H_ {12} O_6 \)), которая фактически является единственным топливом, используемым в мозгу. Таким образом, горение и дыхание являются примерами химических реакций.
Пример \ (\ PageIndex {2} \): Горение глюкозы
Сбалансированное химическое уравнение горения глюкозы в лаборатории (или в мозге) выглядит следующим образом:
\ [\ ce {C_6H_ {12} O6 (s) + 6O2 (g) \ rightarrow 6CO2 (g) + 6h3O (l)} \]
Постройте таблицу, показывающую, как интерпретировать информацию в этом уравнении в терминах
- одиночная молекула глюкозы.
- моль реактивов и продуктов.
- грамм реагентов и продуктов представлены 1 моль глюкозы.
- чисел молекул реагентов и продуктов, представленных 1 моль глюкозы.
Дано : вычисленное химическое уравнение
Запрошено : отношения молекул, молей и масс
Стратегия :
- Используйте коэффициенты из сбалансированного химического уравнения, чтобы определить как молекулярные, так и мольные отношения.
- Используйте молярные массы реагентов и продуктов для перевода из молей в граммы.
- Используйте число Авогадро для перевода молей в количество молекул.
Решение :
Это уравнение сбалансировано, как написано: каждая сторона имеет 6 атомов углерода, 18 атомов кислорода и 12 атомов водорода. Таким образом, мы можем использовать коэффициенты напрямую, чтобы получить желаемую информацию.
- Одна молекула глюкозы реагирует с 6 молекулами O 2 с образованием 6 молекул CO 2 и 6 молекул H 2 O.
- Один моль глюкозы реагирует с 6 моль O 2 с образованием 6 моль CO 2 и 6 моль H 2 O.
- Чтобы интерпретировать уравнение в терминах масс реагентов и продуктов, нам нужны их молярные массы и мольные отношения из части b. Молярные массы в граммах на моль следующие: глюкоза 180,16; О 2 , 31,9988; CO 2 , 44,010; и H 2 O, 18.015.
\ [\ begin {align *} \ text {масса реагентов} & = \ text {масса продуктов} \\ [4pt] g \, глюкоза + g \, O_2 & = g \, CO_2 + g \, H_2O \ end {align *} \]
\ [1 \, моль \, глюкоза \ влево ({180.16 \, g \ over 1 \, mol \, глюкоза} \ right) + 6 \, mol \, O_2 \ left ({31.9988 \, g \ over 1 \, mol \, O_2} \ right) \]
\ [= 6 \, моль \, CO_2 \ влево ({44.010 \, g \ over 1 \, mol \, CO_2} \ right) + 6 \, mol \, H_2O \ left ({18.015 \, g \ over 1 \, моль \, H_2O} \ справа) \]
\ [372,15 \, г = 372,15 \, г \]
C Один моль глюкозы содержит число Авогадро (6,022 × 10 23 ) молекул глюкозы. Таким образом, 6,022 × 10 23 молекулы глюкозы реагируют с (6 × 6.022 × 10 23 ) = 3,613 × 10 24 молекул кислорода, чтобы получить (6 × 6,022 × 10 23 ) = 3,613 × 10 24 молекулы каждая из CO 2 и H 2 O.
В табличной форме:
| \ (C_6H_ {12} O_ {6 \; (s)} \) | + | \ (6O_ {2 \; (g)} \) | → | \ (6CO_ {2 \; (г)} \) | \ (6H_2O _ {(l)} \) | ||
|---|---|---|---|---|---|---|---|
| а. | 1 молекула | 6 молекул | 6 молекул | 6 молекул | |||
| б. | 1 моль | 6 моль | 6 моль | 6 моль | |||
| г. | 180,16 г | 191,99 28 г | 264,06 г | 108,09 г | |||
| г. | 6.022 × 10 23 молекулы | 3,613 × 10 24 молекулы | 3,613 × 10 24 молекулы | 3.613 × 10 24 молекула |
Упражнение \ (\ PageIndex {2} \): взрыв нитрата аммония
Аммиачная селитра – обычное удобрение, но при неправильных условиях может быть опасным. В 1947 году корабль, загруженный нитратом аммония, загорелся во время разгрузки и взорвался, разрушив город Техас-Сити, штат Техас.
Нитрат аммония может быть опасным. На этом аэрофотоснимке Техас-Сити, штат Техас, показаны разрушения, вызванные взрывом корабля с нитратом аммония 16 апреля 1947 года.Для просмотра видео щелкните здесь.Взрыв возник в результате следующей реакции:
\ [2NH_4NO_ {3 \; (s)} \ rightarrow 2N_ {2 \; (g)} + 4H_2O _ {(g)} + O_ {2 \; (g)} \]
Создайте таблицу, показывающую, как интерпретировать информацию в уравнении в терминах
- отдельных молекул и ионов.
- моль реактивов и продуктов.
- граммов реагентов и продуктов с учетом 2 моль нитрата аммония.
- чисел молекул или формульных единиц реагентов и продуктов на 2 моля нитрата аммония.
Ответ :
| \ (2NH_4NO_ {3 \; (s)} \) | → | \ (2N_ {2 \; (g)} \) | + | \ (4H_2O _ {(g)} \) | + | \ (O_ {2 \; (g)} \) | |
|---|---|---|---|---|---|---|---|
| а. | 2NH 4 + ионы и 2NO 3 – ионы | 2 молекулы | 4 молекулы | 1 молекула | |||
| б. | 2 моль | 2 моль | 4 моль | 1 моль | |||
| г. | 160,0864 г | 56,0268 г | 72,0608 г | 31,9988 г | |||
| г. | 1,204 × 10 24 формульные единицы | 1.204 × 10 24 молекулы | 2,409 × 10 24 молекулы | 6.022 × 10 23 молекулы |
Сводка
Химическая реакция описывается химическим уравнением, которое определяет идентичность и количество реагентов и продуктов.В химической реакции одно или несколько веществ превращаются в новые вещества. Химическая реакция описывается химическим уравнением , выражением, которое определяет идентичность и количество веществ, участвующих в реакции. Химическое уравнение показывает исходное соединение (я) – реагенты – слева и конечное соединение (я) – продукты – справа, разделенные стрелкой. В сбалансированном химическом уравнении количество атомов каждого элемента и общий заряд одинаковы с обеих сторон уравнения.Число атомов, молекул или формульных единиц реагента или продукта в сбалансированном химическом уравнении – это коэффициент для этого вида. Мольное соотношение двух веществ в химической реакции – это соотношение их коэффициентов в сбалансированном химическом уравнении.
7.4: Как написать сбалансированные химические уравнения
- Последнее обновление
- Сохранить как PDF
- Коэффициенты и индексы
- Уравновешивание химического уравнения
- Резюме
- Словарь
- Вклад и авторство
Цели обучения
- Объясните роль индексов и коэффициентов в химических уравнениях.
- Уравновесить химическое уравнение, если дано несбалансированное уравнение.
- Объясните роль Закона сохранения массы в химической реакции.
Даже несмотря на то, что химические соединения распадаются и новые соединения образуются в ходе химической реакции, атомы в реагентах не исчезают, и новые атомы не появляются, чтобы образовать продукты. В химических реакциях атомы никогда не создаются и не разрушаются. Те же атомы, которые присутствовали в реагентах, присутствуют в продуктах – они просто реорганизованы в разные структуры.В полном химическом уравнении две стороны уравнения должны присутствовать на сторонах реагента и продукта.
Коэффициенты и индексы
В химических уравнениях встречаются числа двух типов. Есть индексы, которые входят в химические формулы реагентов и продуктов; и есть коэффициенты, которые помещаются перед формулами, чтобы указать, сколько молекул этого вещества используется или производится.
Рисунок \ (\ PageIndex {1} \): Уравнения балансировки. Вы не можете изменить индексы в химической формуле, чтобы сбалансировать химическое уравнение; вы можете изменить только коэффициенты. Изменение индексов изменяет соотношение атомов в молекуле и получаемые в результате химические свойства. Например, вода (H 2 O) и перекись водорода (H 2 O 2 ) являются химически разными веществами. H 2 O 2 разлагается на газ H 2 O и газ O 2 при контакте с металлической платиной, тогда как между водой и платиной такая реакция не происходит.Нижние индексы являются частью формул, и после определения формул для реагентов и продуктов нижние индексы не могут быть изменены. Коэффициенты указывают количество каждого вещества, участвующего в реакции, и могут быть изменены, чтобы сбалансировать уравнение. Приведенное выше уравнение показывает, что один моль твердой меди реагирует с двумя молями водного нитрата серебра с образованием одного моля водного нитрата меди (II) и двух атомов твердого серебра.
Уравновешивание химического уравнения
Поскольку идентичность реагентов и продуктов фиксирована, уравнение не может быть сбалансировано путем изменения индексов реагентов или продуктов. Это изменит химическую идентичность описываемых видов, как показано на рисунке \ (\ PageIndex {1} \).
Самый простой и наиболее полезный метод уравновешивания химических уравнений – это «проверка», более известная как метод проб и ошибок. Ниже приводится эффективный подход к уравновешиванию химического уравнения с использованием этого метода.
Шаги по уравновешиванию химического уравнения
- Определите наиболее сложное вещество.
- Начиная с этого вещества, выберите элемент (ы), который присутствует только в одном реагенте и одном продукте, если это возможно. Отрегулируйте коэффициенты, чтобы получить одинаковое количество атомов этого элемента (ов) с обеих сторон.
- Уравновесить многоатомные ионы (если они присутствуют в обеих частях химического уравнения) как единое целое.
- Уравновесить оставшиеся атомы, обычно заканчивая наименее сложным веществом и при необходимости используя дробные коэффициенты.Если использовался дробный коэффициент, умножьте обе части уравнения на знаменатель, чтобы получить целые числа для коэффициентов.
- Подсчитайте количество атомов каждого сорта по обе стороны уравнения, чтобы убедиться, что химическое уравнение сбалансировано.
Пример \ (\ PageIndex {1} \): сжигание гептана
Выровняйте химическое уравнение горения гептана (\ (\ ce {C_7H_ {16}} \)).
\ [\ ce {C_7H_ {16} (l) + O_2 (g) → CO_2 (g) + H_2O (g)} \ nonumber \]
Решение
| Ступеньки | Пример |
|---|---|
| 1. Определите наиболее сложное вещество. | Самая сложная субстанция – это вещество с наибольшим числом различных атомов, то есть \ (C_7H_ {16} \). Сначала предположим, что окончательное сбалансированное химическое уравнение содержит 1 молекулу или формульную единицу этого вещества. |
| 2. Настройте коэффициенты. | а. Поскольку одна молекула н-гептана содержит 7 атомов углерода, нам нужно 7 молекул CO 2 , каждая из которых содержит 1 атом углерода, с правой стороны: \ [\ ce {C7h26 (l) + O2 (g) →} \ underline {7} \ ce {CO2 (g) + h3O (g)} \ nonumber \]
г.Поскольку одна молекула н-гептана содержит 16 атомов водорода, нам нужно 8 молекул H 2 O, каждая из которых содержит 2 атома водорода, с правой стороны: \ [\ ce {C7h26 (l) + O2 (g) → 7 CO2 (g) +} \ underline {8} \ ce {h3O (g)} \ nonumber \]
|
| 3. Уравновесить многоатомные ионы как единое целое. | В этой реакции не рассматриваются многоатомные ионы. |
| 4. Сбалансируйте оставшиеся атомы. | Теперь атомы углерода и водорода уравновешены, но у нас есть 22 атома кислорода справа и только 2 атома кислорода слева. Мы можем сбалансировать атомы кислорода, регулируя коэффициент перед наименее сложным веществом, O 2 , на стороне реагента: \ [\ ce {C7h26 (l) +} \ underline {11} \ ce {O2 (g) → 7 CO2 (g) + 8h3O (g)} \ nonumber \]
|
| 5. Проверьте свою работу. | Уравнение теперь уравновешено, и нет дробных коэффициентов: есть 7 атомов углерода, 16 атомов водорода и 22 атома кислорода с каждой стороны. Всегда проверяйте, сбалансировано ли химическое уравнение. |
Пример \ (\ PageIndex {2} \): сжигание изооктана
Сжигание изооктана (\ (\ ce {C_8H_ {18}} \))
\ [\ ce {C8h28 (l) + O2 (g) -> CO_2 (g) + H_2O (g)} \ nonumber \]
Решение
Предположение, что окончательное сбалансированное химическое уравнение содержит только одну молекулу или формульную единицу самого сложного вещества, не всегда верно, но это хорошее место для начала.При сжигании любого углеводорода с кислородом образуется углекислый газ и вода.
| Ступеньки | Пример |
|---|---|
| 1. Определите наиболее сложное вещество. | Самая сложная субстанция – это вещество с наибольшим числом различных атомов, то есть \ (\ ce {C8h28} \). Сначала предположим, что окончательное сбалансированное химическое уравнение содержит 1 молекулу или формульную единицу этого вещества. |
| 2. Настройте коэффициенты. | а. Первый элемент, который появляется в реагентах только один раз, – это углерод: 8 атомов углерода в изооктане означает, что в продуктах должно быть 8 молекул CO 2 : \ [\ ce {C8h28 (l) + O2 (g) ->} \ underline {8} \ ce {CO2 (g) + h3O (g)} \ nonumber \]
г.18 атомов водорода в изооктане означает, что в продуктах должно быть 9 молекул H 2 O: \ [\ ce {C8h28 (l) + O2 (g) -> 8CO2 (g) +} \ underline {9} \ ce {h3O (g)} \ nonumber \]
|
| 3. Уравновесить многоатомные ионы как единое целое. | В этой реакции не рассматриваются многоатомные ионы. |
| 4. Сбалансируйте оставшиеся атомы. | Теперь атомы углерода и водорода уравновешены, но у нас есть 25 атомов кислорода справа и только 2 атома кислорода слева. Мы можем сбалансировать наименее сложное вещество, O 2 , но поскольку на молекулу O 2 приходится 2 атома кислорода, мы должны использовать дробный коэффициент (\ (\ dfrac {25} {2} \)), чтобы сбалансировать атомы кислорода: \ [\ ce {C8h28 (l) +} \ underline {\ dfrac {25} {2}} \ ce {O2 (g) → 8CO2 (g) + 9h3O (g)} \ nonumber \]
Уравнение теперь сбалансировано, но мы обычно пишем уравнения с целочисленными коэффициентами.Мы можем исключить дробный коэффициент, умножив все коэффициенты с обеих сторон химического уравнения на 2 : \ [\ underline {2} \ ce {C8h28 (l) +} \ underline {25} \ ce {O2 (g) ->} \ underline {16} \ ce {CO2 (g) +} \ underline {18 } \ ce {h3O (g)} \ nonumber \] |
| 5. Проверьте свою работу. | Сбалансированное химическое уравнение содержит 16 атомов углерода, 36 атомов водорода и 50 атомов кислорода с каждой стороны. Балансировка уравнений требует от вас некоторой практики, а также некоторого здравого смысла. Если вы обнаружите, что используете очень большие коэффициенты или безуспешно потратили несколько минут, вернитесь и убедитесь, что вы правильно написали формулы реагентов и продуктов. |
Пример \ (\ PageIndex {3} \): Осаждение хлорида свинца (II)
Смешивают водные растворы нитрата свинца (II) и хлорида натрия.Продуктами реакции являются водный раствор нитрата натрия и твердый осадок хлорида свинца (II). Напишите сбалансированное химическое уравнение этой реакции.
Решение
| Ступеньки | Пример |
|---|---|
| 1. Определите наиболее сложное вещество. | Наиболее сложное вещество – хлорид свинца (II). \ [\ ce {Pb (NO3) 2 (водн.) + NaCl (водн.) → NaNO3 (водн.) + PbCl2 (s)} \ nonumber \] |
| 2. Настройте коэффициенты. | В реагентах содержится вдвое больше ионов хлора, чем в продуктах. Поставьте 2 перед NaCl, чтобы уравновесить ионы хлора. \ [\ ce {Pb (NO3) 2 (водн.) +} \ Underline {2} \ ce {NaCl (водн.) → NaNO3 (водн.) + PbCl2 (s)} \ nonumber \]
|
| 3. Уравновесить многоатомные ионы как единое целое. | Нитрат-ионы все еще не сбалансированы. Поставьте 2 перед NaNO 3 . Результат: \ [\ ce {Pb (NO3) 2 (водн.) + 2NaCl (водн.) →} \ underline {2} \ ce {NaNO3 (водн.) + PbCl2 (s)} \ nonumber \]
|
| 4. Сбалансируйте оставшиеся атомы. | Нет необходимости балансировать оставшиеся атомы, потому что они уже уравновешены. |
| 5. Проверьте свою работу. | \ [\ ce {Pb (NO3) 2 (водн.) + 2NaCl (водн.) → 2NaNO3 (водн.) + PbCl2 (s)} \ nonumber \]
|
Упражнение \ (\ PageIndex {1} \)
Все ли химические уравнения сбалансированы?
- \ (\ ce {2Hg (ℓ) + O_2 (g) \ rightarrow Hg_2O_2 (s)} \)
- \ (\ ce {C_2H_4 (г) + 2O_2 (г) → 2CO_2 (г) + 2H_2O (г)} \)
- \ (\ ce {Mg (NO_3) _2 (s) + 2Li (s) \ rightarrow Mg (s) + 2LiNO_3 (s)} \)
- Ответьте на
- да
- Ответ б
- №
- Ответ c
- да
Упражнение \ (\ PageIndex {2} \)
Уравновесите следующие химические уравнения.
- \ (\ ce {N2 (г) + O2 (г) → NO2 (г)} \)
- \ (\ ce {Pb (NO3) 2 (водн.) + FeCl3 (водн.) → Fe (NO3) 3 (водн.) + PbCl2 (s)} \)
- \ (\ ce {C6h24 (l) + O2 (g) → CO2 (g) + h3O (g)} \)
- Ответьте на
- N 2 (г) + 2O 2 (г) → 2NO 2 (г)
- Ответ б
- 3Pb (NO 3 ) 2 (водный) + 2FeCl 3 (водный) → 2Fe (NO 3 ) 3 (водный) + 3PbCl 2 (s)
- Ответ c
- 2C 6 H 14 (л) + 19O 2 (г) → 12CO 2 (г) + 14H 2 O (г)
Сводка
- Чтобы быть полезным, химические уравнения всегда должны быть сбалансированы.Уравновешенные химические уравнения имеют одинаковое количество и тип каждого атома с обеих сторон уравнения.
- Коэффициенты в сбалансированном уравнении должны быть простейшим целочисленным отношением. В химических реакциях масса всегда сохраняется.
Словарь
- Химическая реакция – Процесс, в котором одно или несколько веществ превращаются в одно или несколько новых веществ.
- Реагенты – Исходные вещества в реакции.
- Продукты – Материалы, присутствующие в конце реакции.
- Сбалансированное химическое уравнение – Химическое уравнение, в котором количество атомов каждого типа равно на двух сторонах уравнения.
- Индексы – Часть химических формул реагентов и продуктов, указывающая количество атомов предыдущего элемента.
- Коэффициент – Небольшое целое число, которое появляется перед формулой в сбалансированном химическом уравнении.
Материалы и авторство
Эта страница была создана на основе содержимого следующими участниками и отредактирована (тематически или всесторонне) командой разработчиков LibreTexts в соответствии со стилем, представлением и качеством платформы:
14.2 Уравновешивание химических уравнений | Представляет химическое изменение
Уравновесите следующие уравнения:
\ [\ text {Mg} + \ text {O} _ {2} \ rightarrow \ text {MgO} \]Решение еще не доступно
\ [\ text {Ca} + \ text {H} _ {2} \ text {O} \ rightarrow \ text {Ca (OH)} _ {2} + \ text {H} _ {2} \]
Решение еще не доступно
\ [\ text {CuCO} _ {3} + \ text {H} _ {2} \ text {SO} _ {4} \ rightarrow \ text {CuSO} _ {4} + \ text {H} _ {2 } \ text {O} + \ text {CO} _ {2} \]
Решение еще не доступно
\ [\ text {CaCl} _ {2} + \ text {Na} _ {2} \ text {CO} _ {3} \ rightarrow \ text {CaCO} _ {3} + \ text {NaCl} \]
Решение еще не доступно
\ [\ text {C} _ {12} \ text {H} _ {22} \ text {O} _ {11} + \ text {O} _ {2} \ rightarrow \ text {CO} _ {2} + \ text {H} _ {2} \ text {O} \]
Решение еще не доступно
Хлорид бария реагирует с серной кислотой с образованием сульфата бария и соляной кислоты.
Решение еще не доступно
Этан \ ((\ text {C} _ {2} \ text {H} _ {6}) \) реагирует с кислородом с образованием диоксида углерода и пара.
Решение еще не доступно
Карбонат аммония часто используется как нюхательная соль. Сбалансируйте следующую реакцию для разложение карбоната аммония: \ (\ text {(NH} _ {4} \ text {)} _ {2} \ text {CO} _ {3} \ text {(s)} \ rightarrow \ text {NH} _ {3} \ text {(aq)} + \ text {CO} _ {2} \ text {(g)} + \ text {H} _ {2} \ text {O (l) } \)
Решение еще не доступно
Водородные топливные элементы чрезвычайно важны в развитии альтернативных источников энергии.Многие из эти клетки работают, взаимодействуя вместе с газами водорода и кислорода с образованием воды, реакция, которая также производит электричество. Сбалансируйте следующее уравнение: \ (\ text {H} _ {2} \ text {(g)} + \ text {O} _ {2} \ text {(g)} \ rightarrow \ text {H} _ {2} \ text {O (l)} \)
Решение еще не доступно
Синтез аммиака \ ((\ text {NH} _ {3}) \), прославленный немецким химиком Фрицем Габером в в начале 20 века, это одна из важнейших реакций в химической промышленности.Сбалансировать для получения аммиака используется следующее уравнение: \ [\ text {N} _ {2} \ text {(g)} + \ text {H} _ {2} \ text {(g)} \ rightarrow \ text {NH} _ {3} \ text {(g)} \]
Решение еще не доступно
Сбалансированное химическое уравнение: определение и примеры – видео и стенограмма урока
Как сбалансировать уравнение
Практика всегда добивается совершенства. В общем, чтобы сбалансировать уравнение, нам нужно сделать следующее:
- Подсчитайте атомы каждого элемента в реагентах и продуктах.
- Использовать коэффициенты; при необходимости разместите их перед составами.
Шаги просты, но это процесс проб и ошибок. Давайте рассмотрим еще несколько примеров уравнений и методов, которые можно использовать для балансировки каждого из них.
Пример 1
Это реакция между метаном (Ch5) и кислородом (O2) с образованием диоксида углерода (CO2) и воды (h3O).
Показанная реакция представляет собой реакцию горения : соединение реагирует с кислородом с образованием диоксида углерода и воды.Метод заключается в том, чтобы сначала уравновесить атомы углерода (C), затем атомы водорода (H), а затем атомы кислорода (O).
В этом случае атомы углерода (C) уже уравновешены. Итак, теперь мы посмотрим на атомы водорода (H). Есть 4 атома водорода (H) на стороне реагентов и 2 атома водорода (H) на стороне продуктов. Чтобы уравновесить их, мы ставим коэффициент 2 перед h3O.
Теперь атомы водорода (H) уравновешены.Из-за коэффициента 2 перед h3O всего на стороне продуктов находится 4 атома кислорода (O). Чтобы уравновесить атомы кислорода с обеих сторон, мы ставим коэффициент 2 перед O2. Теперь химическое уравнение сбалансировано.
Пример 2
Это реакция между оксидом железа (Fe2O3) и углеродом (C) с образованием железа (Fe) и диоксида углерода (CO2).
Эта реакция не сбалансирована.Во-первых, нам нужно сбалансировать атомы кислорода. Мы делаем это так, чтобы с каждой стороны было по 6 атомов кислорода. Для этого нам нужно поставить коэффициент 2 перед Fe2O3 и коэффициент 3 перед CO2.
Теперь, когда атомы кислорода уравновешены, нам нужно сначала уравновесить атомы железа (Fe). Для этого нам нужно поставить коэффициент 4 перед Fe на стороне продуктов. Теперь, когда атомы Fe уравновешены, мы можем уравновесить атомы углерода.Мы делаем это, устанавливая коэффициент 3 перед C на стороне реагентов. Теперь химическое уравнение сбалансировано.
Пример 3
При работе с химическими уравнениями с многоатомными ионами , которые представляют собой ионы, состоящие из более чем одного атома, существует специальный метод для уравновешивания химического уравнения.
Метод состоит в том, чтобы рассматривать многоатомный ион целиком, как если бы это был только один атом.Давайте посмотрим на это химическое уравнение.
Многоатомный ион в данном случае – PO4 (зеленый). Мы будем рассматривать весь этот многоатомный ион как один атом. Со стороны реагентов есть один ион PO4, а со стороны продуктов – два иона PO4.
Первый шаг – сбалансировать многоатомные ионы с обеих сторон. Для этого мы ставим коэффициент 2 перед Na3PO4. Атомы натрия (Na) удваиваются, и PO4 теперь сбалансирован с обеих сторон.
Следующий шаг – уравновесить атомы магния (Mg), натрия (Na) и хлора (Cl). Сначала мы уравновешиваем атомы магния, задав коэффициент 3 перед MgCl2.
Затем мы уравновешиваем атомы Na и Cl с обеих сторон, помещая коэффициент 6 перед NaCl. В результате получается сбалансированное уравнение:
Пример 4
Давайте рассмотрим реакцию между алюминием (Al) и серной кислотой (h3SO4).В этой реакции наш многоатомный ион, который мы будем считать за один атом, – это SO4. Со стороны реагентов имеется один ион SO4, а со стороны продуктов – три иона SO4.
Сначала нам нужно сбалансировать ионы SO4, и для этого мы ставим коэффициент 3 перед h3SO4.
Атомы водорода и алюминия неуравновешены. Следующий шаг – уравновесить атомы водорода (H), поставив коэффициент 3 перед h3.
Последний шаг – уравновесить атомы алюминия (Al). Мы делаем это, помещая коэффициент 2 перед Al. Теперь химическое уравнение сбалансировано.
Резюме урока
Согласно закону сохранения массы , масса реагентов должна быть равна массе продуктов, когда происходит химическая реакция. Это означает, что количество различных атомов, участвующих в реагирующих веществах, должно оставаться неизменным после того, как реакция протекает.Там, где есть химическая реакция, есть химическое уравнение. Химическое уравнение необходимо сбалансировать так, чтобы оно подчинялось закону сохранения массы. Сбалансированное химическое уравнение возникает, когда количество различных атомов элементов на стороне реагентов равно количеству атомов на стороне продуктов.
Уравновешивание химических уравнений – это процесс проб и ошибок. При уравновешивании химических уравнений нам сначала нужно подсчитать различные атомы на стороне реагентов и на стороне продуктов.Если уравнение не сбалансировано, нам нужно использовать коэффициентов , которые представляют собой числа, которые мы ставим перед реагирующими веществами, чтобы сбалансировать уравнение. Если перед химической формулой нет коэффициента, это означает, что коэффициент равен единице.
Для реакций горения метод заключается в уравновешивании атомов углерода (C), за которыми следуют атомы водорода (H), а затем атомы кислорода (O). Для атомов, включающих многоатомные ионы, общая методика состоит в том, чтобы считать весь многоатомный ион как один атом, сначала уравновесить их, а затем уравновесить остальные атомы.
Результаты обучения
После того, как вы закончите, вы должны уметь:
- Вспомнить, как закон сохранения массы требует сбалансированного химического уравнения
- Укажите шаги по уравновешиванию химического уравнения
- Уравновесить химическое уравнение
Сбалансированные химические уравнения – Введение в химические реакции – OCR Gateway – GCSE Chemistry (Single Science) Revision – OCR Gateway
Сбалансированное уравнение моделирует химическую реакцию с использованием формул реагентов и продуктов.Он показывает количество единиц каждого задействованного вещества.
Уравновешивание уравнения
Если вы просто напишете уравнение, заменив имена формулами, оно может не сбалансироваться. Число атомов каждого элемента слева должно быть таким же, как и справа.
Чтобы сбалансировать несбалансированное уравнение, вам нужно добавить числа слева от одной или нескольких формул. Вот один из способов выяснить, как это сделать для реакции между азотом и водородом.
| Шаг | Результат |
|---|---|
| Проверьте, равное ли количество атомов каждого элемента с обеих сторон.Здесь нет. | N 2 + H 2 → NH 3 |
| Слева расположены два атома азота, а справа – только один, поэтому слева от NH 3 добавляется большая двойка. . | N 2 + H 2 → 2NH 3 |
| Слева два атома водорода, но (2 × 3) = 6 справа, поэтому перед Н 2 . | N 2 + 3H 2 → 2NH 3 |
| Проверьте, одинаковы ли числа каждого элемента с обеих сторон.Есть. | (два атома азота и шесть атомов водорода) |
| Добавьте символы состояния, если они требуются. | N 2 (г) + 3H 2 (г) → 2NH 3 (г) |
В сбалансированных уравнениях отображаются только формулы, но не названия. Уравновешивающее число умножает все атомы в веществе рядом с ним.
Государственные символы
Сбалансированные уравнения часто включают символы состояния в скобках после каждой формулы. Они показывают физическое состояние этого вещества.
| Обозначение состояния | Значение |
|---|---|
| (с) | Твердое |
| (л) | Жидкое |
| (г) | 91 ГазВодный раствор |
Водный раствор образуется при растворении вещества в воде.
Государственные символы полезны, потому что они показывают, на что похоже вещество. Например:
- H 2 O (l) – жидкая вода, но H 2 O (g) – пар
- HCl (g) – газообразный хлористый водород, но HCl (водный) – соляная кислота
- Вопрос
Металлический натрий реагирует с водой с образованием раствора гидроксида натрия и газообразного водорода.Напишите сбалансированное уравнение реакции, включая государственные символы.
- Выявить ответ
2Na (s) + 2H 2 O (l) → 2NaOH (вод.) + H 2 (g) или
Na (s) + H 2 O ( л) → NaOH (водн.) + ½H 2 (г)
ДОМ Главы курса Основы калькулятора Обзор математики Основные понятия Расширенные концепцииРаздел Тесты Предварительное испытание Пост-тест Полезные материалы Глоссарий Онлайн-калькуляторы Калькулятор окислительно-восстановительного потенциала Калькулятор кинетики Аррениуса Калькулятор термодинамики Калькулятор ядерного распада Регрессия методом наименьших квадратов Решатель уравнений метода Ньютона Калькулятор сжимаемости Калькулятор перевода единиц Калькулятор номенклатуры Ссылки по теме Калькуляторы Texas Instruments Калькуляторы Casio Калькуляторы Sharp Калькуляторы Hewlett Packard Кредиты Связаться с веб-мастером | Стехиометрия – это математика, лежащая в основе химии.Имея достаточно информации, можно использовать стехиометрию для вычисления масс, молей и процентов в рамках химического уравнения. Что такое химическое уравнение Молла Уравновешивание химических уравнений Ограничивающие реагенты Процентный состав Эмпирические и молекулярные формулы Плотность Концентрации растворов В химии мы используем символы для обозначения различных химических веществ. Успех в химии зависит от знакомства с этими основными символами.Например, символ «С» представляет собой атом углерода, а «H» представляет собой атом водорода. Чтобы представить молекулу поваренной соли, хлорида натрия, мы будем использовать обозначение «NaCl», где «Na» представляет натрий, а «Cl» представляет собой хлор. Мы называем хлор «хлоридом» в этом случае из-за его связи с натрием. У вас будет возможность просмотреть схемы именования или номенклатуру в более позднем чтении. Химическое уравнение – это выражение химического процесса.Например: AgNO 3 (водн.) + NaCl (водн.) —> AgCl (s) + NaNO 3 (водн.)В этом уравнении AgNO 3 смешан с NaCl. Уравнение показывает, что реагенты (AgNO 3 и NaCl) реагируют посредством некоторого процесса (—>) с образованием продуктов (AgCl и NaNO 3 ). Поскольку они подвергаются химическому процессу, они коренным образом изменяются. Часто составляются химические уравнения, показывающие состояние, в котором находится каждое вещество.Знак (s) означает, что соединение является твердым. Знак (l) означает, что вещество является жидкостью. Знак (aq) обозначает водный раствор в воде и означает, что соединение растворено в воде. Наконец, знак (g) означает, что соединение представляет собой газ. Коэффициенты используются во всех химических уравнениях, чтобы показать относительные количества каждого присутствующего вещества. Это количество может представлять либо относительное количество молекул, либо относительное количество молекул. количество молей (описано ниже).Если коэффициент не указан, предполагается, что он равен единице (1). В некоторых случаях над или под стрелками будет написана различная информация. Эта информация, например значение температуры, показывает, в каких условиях должна произойти реакция. Например, на приведенном ниже графике обозначения над и под стрелками показывают, что нам нужен химикат Fe 2 O 3 , температура 1000 градусов C и давление 500 атмосфер, чтобы эта реакция протекала. На приведенном ниже рисунке отражено большинство концепций, описанных выше: Учитывая приведенное выше уравнение, мы можем определить количество молей реагентов и продуктов. Моль просто представляет собой число молекул Авогадро (6,023 x 10 23 ). Родинка похожа на термин, подобный дюжине. Если у вас есть дюжина морковок, у вас есть двенадцать е из них. Точно так же, если у вас есть родинка моркови, у вас есть 6,023 x 10 23 моркови. В приведенном выше уравнении перед членами нет цифр, поэтому предполагается, что каждый коэффициент равен единице (1).Таким образом, у вас одинаковое количество молей Ag НЕТ 3 , NaCl, AgCl, NaNO 3 .Часто важно преобразовать моль в граммы вещества. Это преобразование может быть легко выполнено, когда атомарный и / или молекулярный масса вещества (веществ) известна. Атомный или молекулярный масса вещества в граммах составляет один моль вещества. Например, кальций имеет атомный вес 40 граммов. Итак, 40 грамм кальция составляют один моль, 80 грамм – два моля и т. д. Иногда, однако, мы должны проделать некоторую работу, прежде чем использовать коэффициенты членов, чтобы представить относительное количество молекул каждого соединения. Это тот случай, когда уравнения не являются пр отлично сбалансирован. Мы будем рассматривать следующее уравнение: Al + Fe 3 O 4 —> Al 2 O 3Поскольку перед любым из членов нет коэффициентов, легко предположить, что один (1) моль Al и один (1) моль Fe 3 0 4 реагируют с образованием одного (1) моля Al 2 0 3 .Если бы это было так, реакция была бы весьма впечатляющей: атом алюминия появился бы из ниоткуда, а два (2) атома железа и один (1) атом кислорода волшебным образом исчезли бы. Мы знаем из Закона года о сохранении массы (который гласит, что материю нельзя ни создать, ни уничтожить) что этого просто не может произойти. Мы должны убедиться, что количество атомов каждого конкретного элемента в реагентах равно количеству атомов того же элемента в продуктах.К для этого мы должны вычислить относительное количество молекул каждого члена, выраженное коэффициентом члена. Уравновешивание химического уравнения в основном осуществляется методом проб и ошибок. Есть много разных способов и систем сделать это, но для всех методов важно знать, как подсчитать количество атомов в уравнении. Например, мы рассмотрим следующий срок. 2Fe 3 O 4Этот термин обозначает две (2) молекулы Fe 3 O 4 .В каждой молекуле этого вещества есть три (3) атома Fe. Следовательно, в двух (2) молекулах вещества должно быть шесть (6) атомов Fe. Точно так же есть четыре (4) атома кислорода в одной (1) молекуле вещества, поэтому в двух (2) молекулах должно быть восемь (8) атомов кислорода. Теперь давайте попробуем сбалансировать уравнение, упомянутое ранее: Al + Fe 3 O 4 —> Al 2 O 3 + Fe Разработка стратегии может быть трудной, но вот один из способов решения такой проблемы.
Пример: у химика есть только 6,0 граммов C 2 H 2 и неограниченная подача кислорода, и он желает произвести как можно больше CO 2 . Если она воспользуется приведенным ниже уравнением, сколько кислорода ей следует добавить в реакцию? 2C 2 H 2 (г) + 5O 2 (г) —> 4CO 2 (г) + 2 H 2 O (л) Чтобы решить эту проблему, необходимо определить, сколько кислорода должно
может быть добавлен, если все реагенты были израсходованы (так можно получить максимальное количество CO 2 ). Затем, поскольку на каждые две (2) молекулы C 2 H 2 приходится пять (5) молекул кислорода, нам нужно умножить моль C 2 H 2 на 5/2, чтобы получить общее количество молей кислорода, которое будет использовано для реакции со всеми C 2 H 2 . Затем мы переводим моли кислорода в граммы, чтобы найти количество кислорода, которое необходимо добавить: Можно рассчитать молярные отношения (также называемые мольными долями) между членами химического уравнения, если задан массовый процент продуктов или реагентов.процент по массе = масса части / масса целого Есть два типа задач процентного состава – задачи, в которых вам дается формула (или вес каждой части) и просят вычислить процентное содержание каждого элемента. и задачи, в которых вам задают проценты и просят вычислить формулу. В проблемах процентного состава есть много возможных решений. Всегда есть возможность удвоить ответ. Например, CH и C 2 H 2 имеют одинаковые пропорции, но представляют собой разные соединения.Стандартно давать составы в их простейшей форме, где соотношение между элементами как сокращенная, как это можно назвать – эмпирическая формула. При вычислении эмпирической формулы по процентному составу можно преобразовать проценты в граммы. Например, это обычно проще всего предположить, что у вас 100 граммов, поэтому 54,3% превратились бы в 54,3 грамма. Затем мы можем преобразовать массы в моль, что даст нам мольные отношения. Надо сводить к целым числам.Хороший прием – разделить все члены на наименьшее количество родинок. Затем соотношение молей можно перевести, чтобы написать эмпирическую формулу. Пример: если соединение состоит на 47,3% C (углерод), 10,6% H (водород) и 42,0% S (сера), какова его эмпирическая формула? Теперь мы пытаемся получить равное соотношение между элементами, поэтому делим на количество молей серы, потому что это наименьшее число: Итак, имеем: C 3 H 8 S Пример: Определите массовое процентное содержание сероводорода, H 2 SO 4 . Теперь мы можем проверить, что в сумме проценты составляют 100% По сути, это 100, поэтому мы знаем, что все сработало, и, вероятно, не допустили никаких ошибок по неосторожности. Итак, ответ таков: H 2 SO 4 состоит из 2,06% H, 32,7% S и 65,2% O по массе. Хотя эмпирическая формула представляет собой простейшую форму соединения, Молекулярная формула – это форма термина в том виде, в котором он встречается в химическом уравнение. Эмпирическая формула и молекулярная формула могут быть то же самое, или молекулярная формула может быть любым, кратным эмпирическим формула. Примеры эмпирических формул: AgBr, Na 2 S, C 6 H 10 O 5 .Примеры молекулярных формул: P 2 , C 2 O 4 , C 6 H 14 S 2 , H 2 , C 3 H 9 . Эмпирическую формулу можно рассчитать исходя из масс или процентного состава любого соединения. Мы уже обсуждали процентный состав в разделе выше. Если у нас есть только масса, все, что мы делаем, по сути, устраняем этап преобразования от процента к массе. Пример: рассчитайте эмпирическую формулу для соединения, имеющего 43.7 г P (фосфора) и 56,3 грамма кислорода. Сначала конвертируем в родинки: Затем мы разделяем родинки, чтобы добиться равномерного соотношения. Когда мы делим, мы не получаем целых чисел, поэтому мы должны умножать их на два (2). Ответ = P 2 O 5 . Вычислить молекулярную формулу, когда у нас есть эмпирическая формула, несложно. Если мы знаем эмпирическую формулу соединения, все, что нам нужно сделать, это разделить молекулярная масса соединения по массе эмпирической формулы.Это также можно сделать с помощью одного из элементов формулы; просто разделите массу этого элемента в одном моль соединения на массу этого элемента в эмпирической формуле. Результат всегда должен быть целое число. Пример: если мы знаем, что эмпирическая формула соединения – HCN, и нам говорят, что для получения соединения необходимо 2,016 грамма водорода, какова его молекулярная формула? В эмпирической формуле водород весит 1,008 грамма.Разделив 2.016 на 1.008 мы видим, что водорода требуется вдвое больше. Следовательно, эмпирическую формулу необходимо увеличить в два раза (2). Ответ: Концентрация раствора – это «сила» раствора. Раствор обычно относится к растворению некоторого твердого вещества в жидкости, например, к растворению соли в воде.Также часто необходимо выяснить, сколько воды добавить в раствор, чтобы довести его до определенной концентрации. Концентрация раствора обычно выражается в молярности. Молярность определяется как количество молей растворенного вещества (что такое фактически растворенный в растворе), деленный на литры раствора (общий объем того, что растворено и в чем оно было растворено). Молярность, вероятно, наиболее часто используется термин, потому что измерить объем жидкости довольно легко. Пример: если 5,00 граммов NaOH растворяются в 5000 мл воды, какова молярность раствора? Итак, молярность (М) раствора составляет 0,025 моль / л. Моляльность – еще одно распространенное измерение концентрации. Моляльность определяется как количество молей растворенного вещества, деленное на килограммы растворителя. (вещество, в котором он растворен, как вода). Иногда вместо молярности при экстремальных температурах используется молярность, поскольку объем может сжиматься или расширяться. Пример: Если моляльность раствора C 2 H 5 OH, растворенного в воде, составляет 1,5, а вес воды составляет 11,7 кг, вычислите, сколько C 2 H 5 OH должно было быть добавляли в раствор в граммах? Пример: если молярность раствора составляет 0,30 М, рассчитайте моляльность.
раствора, зная, что плотность составляет 3,25 г / мл. Где:
T – понижение температуры (для точки замерзания) или температурное расширение (для точки кипения) (° C) Пример: если точка замерзания соленой воды на дорогах составляет -5.2 C, какова молярность раствора? (K f для воды 1,86 C / м.) Т = К * м Практические задачи1. Если доступно только 0,25 молярного NaOH и воды, сколько NaOH нужно добавить, чтобы получить 10 литров 0.2 молярный раствор NaOH?Проверь свою работу 2. Если 2,0 моля сахарозы весом 684 грамма поместить в 1000 граммов воды и затем растворить, какой будет молярность раствора? Проверьте свою работу. 3. Если у вас 0,25-молярный раствор бензола с плотностью 15 грамм / литр, рассчитайте молярность раствора. Проверьте свою работу 4. Если плотность ртути составляет 13,534 г / см 2 и у вас 62,5 см 3 ртути, сколько граммов, молей и атомов ртути у вас есть? (Масса Меркурия 200.6 г / моль.) Проверьте свою работу [Базовый указатель] [Атомная структура] [Стехиометрия] [Химия кислотных оснований] [Номенклатура] |
Балансировка сложных химических уравнений – ChemSimplified
На прошлой неделе я опубликовал информацию о трех методах балансировки химических уравнений. Мой быстрый поиск в Google, кажется, указывает на метод 1 (методом проверки или пробной ошибки) и метод 2 (запись количества атомов), которые являются наиболее популярными методами, когда дело доходит до балансировки уравнений.Большинство студентов, с которыми я работал, знали Метод 1 только со школьных уроков по естествознанию / химии. В этом нет ничего плохого, но я думаю, что это немного пугает, когда приходится отслеживать множественное количество атомов (например, 5 или более), и это без надобности затягивает процесс. Я имею в виду, кто хочет потратить 30 минут, пытаясь сбалансировать ОДНО уравнение ??? Серьезно, эти 30 минут, вероятно, лучше потратить на другие вещи, такие как просмотр YouTube, проверка последних сообщений в FB, Instagram, Twitter, загрузка изображений в Snapchat, повышение уровня в вашей любимой игре или выполнение других вещей, которые увеличивают ваше счастье. .
Итак, представьте, что у вас есть настоящее сложное уравнение, подобное этому: K 4 [Fe (SCN) 6 ] + K 2 Cr 2 O 7 + H 2 SO 4 → Fe 2 (SO 4 ) 3 + Cr 2 (SO 4 ) 3 + CO 2 + H 2 O + K 2 SO 4 + KNO 3
, который имеет 8 типов атомов в уравнении: K, Fe, S, C, N, Cr, O и H. Как вы думаете, сколько времени потребуется, чтобы сбалансировать это?
Я попытался сбалансировать его методом 1. Я начал с K, поскольку это первый атом, с которым я столкнулся слева. Похоже у меня всего 6К. Хорошо … а что насчет справа? Похоже, что справа всего 3 КБ. Первый вопрос, как мне сбалансировать K? Я знаю, что мне нужно «удвоить» счетчик K справа, но с какого термина мне следует начать – K 2 SO 4 или KNO 3 ? Не уверен. Неважно … пока оставьте K в покое. Перейдем к Fe, кажется, проще. У меня 1 слева и 2 справа. Большой! Я могу сделать это….добавьте «2» слева перед K 4 [Fe (SCN) 6 ], так что теперь у меня есть:
2 K 4 [Fe (SCN) 6 ] + K 2 Cr 2 O 7 + H 2 SO 4 → Fe 2 (SO 4 ) 3 + Cr 2 (SO 4 ) 3 + CO 2 + H 2 O + K 2 SO 4 + KNO 3 .
Fe на данный момент сбалансирован. Осталось еще 7 атомов…
S выглядит сложным, поскольку я вижу это в нескольких терминах с обеих сторон.Прибереги это на потом. Двигайтесь к C. У меня 12 слева. Справа только 1. Это означает, что я поставлю «12» перед CO 2 .
2 K 4 [Fe (SCN) 6 ] + K 2 Cr 2 O 7 + H 2 SO 4 → Fe 2 (SO 4 ) 3 + Cr 2 (SO 4 ) 3 + 12 CO 2 + H 2 O + K 2 SO 4 + KNO 3
Превосходно, 2 вниз, 6 еще впереди…
Следующим моим атомом будет N.Кусок торта, вроде C – 12 слева и 1 справа. Итак, добавьте «12» перед KNO 3 .
2 K 4 [Fe (SCN) 6 ] + K 2 Cr 2 O 7 + H 2 SO 4 → Fe 2 (SO 4 ) 3 + Cr 2 (SO 4 ) 3 + 12 CO 2 + H 2 O + K 2 SO 4 + 12 KNO 3
Набирая обороты и уверенность… 3 вниз, еще 5 осталось.
H будет следующим. 2 слева, 2 справа. Что ж, посмотри на это! Он уже сбалансирован! Переходя к Cr. 2 слева и 2 справа. Ну как насчет того ?? Это мой счастливый день или что?
Пока что я сбалансировал Fe, C, N, H и Cr. Пока это заняло всего 1 минуту. Какие еще 3 атома (K, S и O), верно? НЕПРАВИЛЬНЫЙ!!! Те 3, которые остались, сложны, потому что они встречаются повсюду в нескольких терминах. Я имею в виду, посмотрите на K, слева он появляется в K 4 [Fe (SCN) 6 ] и K 2 Cr 2 O 7 , а справа я вижу его в K 2 СО 4 и КНО 3 .Это считается самым легким атомом из трех. Посмотрите на O. Слева это K 2 Cr 2 O 7 и H 2 SO 4 . Справа это Fe 2 (SO 4 ) 3 , Cr 2 (SO 4 ) 3 , CO 2 , H 2 O, K 2 SO 4 и КНО 3 . Кстати, это КАЖДЫЙ термин справа! Я не знаю насчет вас, но я знаю, что лучше использую свое время, чем играю методом проб и ошибок с этими тремя атомами.
Ничего не будет лучше, если я воспользуюсь Method 2 . Я имею в виду, что это поможет с точки зрения отслеживания количества атомов, но мне все равно нужно будет провести проб и ошибок с тремя атомами.
Итак, я перешел к Method 3 . Мне потребовалось 3 минуты, чтобы составить алгебраические уравнения, и еще несколько минут, чтобы решить их все. Итак, как вы думаете, какой окончательный ответ? Вот это:
6 K 4 [Fe (SCN) 6 ] + 97 K 2 Cr 2 O 7 + 355 H 2 SO 4 → 3 Fe 2 (SO 4 ) 3 + 97 Cr 2 (SO 4 ) 3 + 36 CO 2 + 355 H 2 O + 91 K 2 SO 4 + 36 KNO 3
Вот видео, в котором показаны 4 шага решения этого сложного уравнения:


 Теперь у нас в левой части имеется 6 атомов водорода. Для того чтобы сравнять количество элементов водорода, нужно поставить 3 перед водородом в правой части уравнения.
Теперь у нас в левой части имеется 6 атомов водорода. Для того чтобы сравнять количество элементов водорода, нужно поставить 3 перед водородом в правой части уравнения.
