Сообщения об ошибках
Ошибка в синтаксисе
Вы неправильно ввели уравнение химической реакции. Внимательно проверьте каждый символ и посмотрите примеры по правильному синтаксису выше.
Полностью нулевое решение
Решением вашего уравнения являются все коэффициенты, равные нулю, что является тривиальным решением для любого химического уравнения. Например, P → h3 не имеет решения, потому что единственным решением является 0P → 0h3.
Несколько независимых решений
Возможно много решений вашей химической реакции, которые не просто кратны друг другу. Вашу химическую реакцию можно рассматривать как два или более независимых уравнения, сложенных вместе. Например, H + O → h3 + O2 не имеет единственного решения, потому что есть два решения: 2H + 4O → h3 + 2O2 и 6H + 2O → 3h3 + O2, которые не кратны друг другу. Кроме того, уравнение можно разделить на H → h3 и O → O2, каждое из которых имеет единственное решение.
Арифметическое переполнение
В вашей химической реакции используются слишком большие числа, или вещество содержит элемент, который встречается слишком много раз, или во внутренних вычислениях используются слишком большие числа. Скорее всего, эта ошибка произойдёт для вымышленных химических формул, а не для реальных.
Ошибка разработчика
Автор/программист допустил серьёзную логическую ошибку. Этой ошибки быть не должно, но если это произойдет, пожалуйста, свяжитесь со мной.
Примечание. Для простоты реализации, если уравнение успешно сбалансировано, но один или несколько членов имеют отрицательный коэффициент, программа не считает этот результат причиной ошибки. В этом случае каждое слагаемое, имеющее отрицательный коэффициент, следует поставить в другую часть уравнения, а его новый коэффициент должен быть абсолютным значением отрицательного коэффициента.
Уравнение Аррениуса: онлайн калькулятор, формула, примеры
Уравнение Аррениуса — научный закон, который определяет функцию константы скорости реакции от температуры. Благодаря закону легко вычислить динамику стремительности реакции в зависимости от температуры, что пригодится не только на производстве или школьной лаборатории, но и на кухне.
Благодаря закону легко вычислить динамику стремительности реакции в зависимости от температуры, что пригодится не только на производстве или школьной лаборатории, но и на кухне.
Химические реакции
Реакция — это процесс трансформации нескольких реагентов в другие вещества, во время которой совершается реконфигурация электронов ядер. Химические реакции протекают в самых разных условиях: спонтанно при физическом контакте исходных веществ, при действии температуры, света или электрического тока, при механическом воздействии или влиянии радиации.
К наиболее распространенным «бытовым» химическим реакциям относятся процессы, протекающие при динамике температуры. Чем больше температура тела, тем быстрее движутся атомы, что приводит к разрушению кристаллической решетки и хаотичному движению молекул. Понятно, что такие реакции происходят при столкновении элементарных частиц. Однако количество молекул огромно, и если бы каждая встреча частиц провоцировала реакцию, то все термические процессы завершались бы, не успев начаться.
Шведский химик Сванте Аррениус, тот самый ученый, который открыл существование ионов, понял, что для начала реакции молекулы должны иметь в запасе энергию. При неизменной температуре спонтанные реакции возможны только при взаимодействии молекул, которые имеют эту энергию. Аррениус назвал эту излишнюю силу энергией активации, а сами частицы — активированными.
Энергия активации
Согласно постулату Аррениуса, энергия активации — это минимальное количество силы, которой должны обладать структурные частицы, чтобы их взаимодействие провоцировало реакцию и обмен электронами. Из курса химии известно, что взаимодействие частиц связано с разрушением старых химических связей и установлением новых, в результате чего каждая структурная единица вещества проходит через создание промежуточного соединения — активированного комплекса. Именно образование переменчивого активированного комплекса требует резервов энергии активации, которые тратятся на одоление сил отталкивания электронных оболочек и перестройку конфигурации атомов.
Таким образом, чем больше молекул вещества обладают энергией активации, тем быстрее будут протекать реакции с участием этого реагента. На быстроту реакции также влияет и температура, в которой совершается химическое взаимодействие: чем выше температура, тем быстрее движутся молекулы и тем чаще происходят столкновения. Аррениус связал эти постулаты в единое целое.
Уравнение Аррениуса
Химическое уравнение Аррениуса позволяет связать скорость протекания реакции с частотой столкновений молекулярных частиц в зависимости от температуры окружающей среды. Математически уравнение Аррениуса записывается как:
K = Z × e (−Ea / (R × T)),
где K — константа скорости химической реакции, Z — частота соударений реагирующих молекул, Ea — энергия активации, T — температура в Кельвинах, R — универсальная газовая постоянная.
Если внимательно посмотреть на формулу, то можно заметить, что физический смысл константы скорости реакции состоит в том, что она количественно равна скорости реакции при концентрации каждого из реагентов, равной 1 моль/л.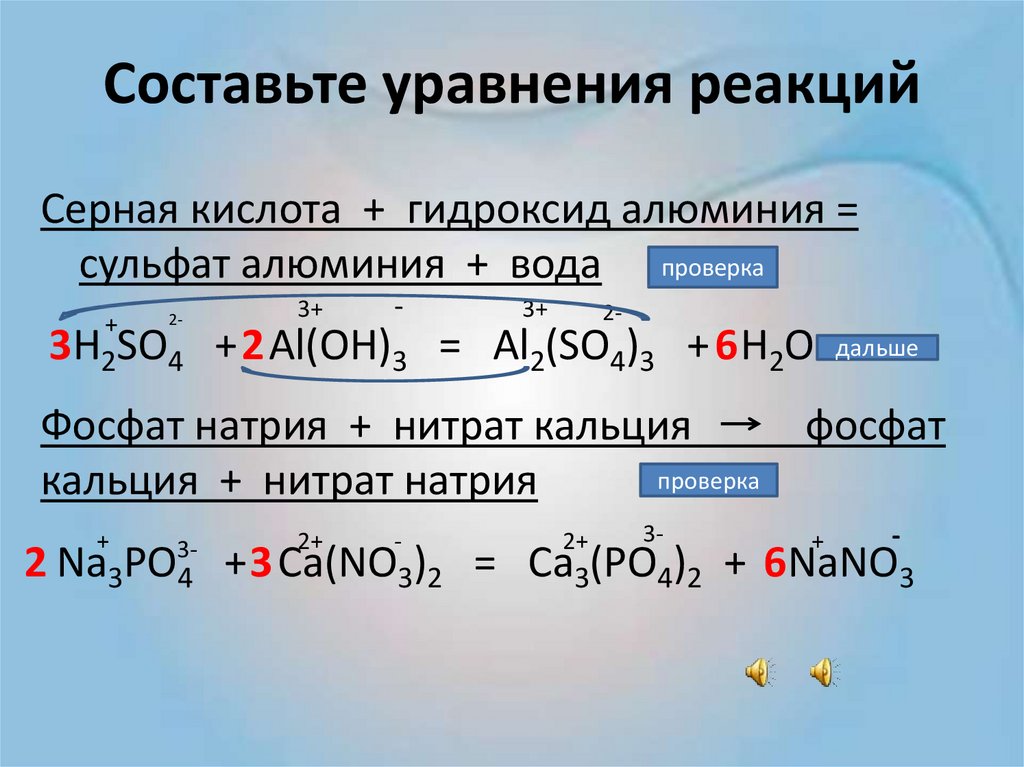
Наш онлайн-инструмент позволяет вычислить скорость протекания реакций, если известны частота соударения молекул, их энергия активации и температура. Для использования калькулятора константы скорости достаточно ввести числа в соответствующие поля и нажать кнопку «Рассчитать».
Пример использования калькулятора
Рассмотрим приближенный пример. Всем известно, что из-за изменения давления скорость химических реакций также изменяется. Уменьшение атмосферного давления высоко в горах не дает альпинистам лакомиться варенной пищей: в разряженной атмосфере температура закипания воды снижается всего на 7 градусов, что замедляет химические реакции приблизительно в 11 раз. Скороварки наоборот повышают давление, увеличивая температуру кипения и ускоряя реакции.
И если мы знаем температуру проведения реакции, а энергию активации можем найти в справочнике, то частоту соударений молекул, к примеру, при варке яиц, мы определить не в состоянии. Известно, что при фиксированной температуре T = 300 K, частота соударения молекул для реакций с молекулярностью n = 1 составляет 1013 − 1014 c-1. Возьмем это число для нашего примера и рассчитаем постоянную скорости реакции для приготовления пищи с энергией активации на уровне 150 кДж/моль. Значение универсальной газовой постоянной известно и уже вшито в код калькулятора. Введем эти данные в калькулятор и получим, что постоянная скорости в этом случае равна 0,0000000000764154 1/с.
Возьмем это число для нашего примера и рассчитаем постоянную скорости реакции для приготовления пищи с энергией активации на уровне 150 кДж/моль. Значение универсальной газовой постоянной известно и уже вшито в код калькулятора. Введем эти данные в калькулятор и получим, что постоянная скорости в этом случае равна 0,0000000000764154 1/с.
Заключение
Уравнение Аррениуса крайне важно для расчетов химической промышленности. Во время протекания реакций при неизменной температуре выделяется тепловая энергия, которая нагревает исходные вещества и может привести к неконтролируемому ускорению реакции. Грамотный расчет уравнений Аррениуса для промышленных процессов позволяет полностью контролировать выделение тепловой энергии и избежать взрыва.
Помощь с домашним заданием по химии | Онлайн-репетитор по химии
Ваше решение для домашнего задания по химии
Химия — это естественнонаучный предмет, который, как известно, сбивает с толку даже самых стойких учеников. Лабораторные работы, как правило, особенно сложны, потому что они требуют прочной основы математики, особенно анализа ошибок. Но химия также является обширной дисциплиной. Это означает, что как только вы изучите один аспект, вы должны переключиться и изучить другой. Например, кислоты и основания в основном отделены от уравнений и стехиометрии.
Лабораторные работы, как правило, особенно сложны, потому что они требуют прочной основы математики, особенно анализа ошибок. Но химия также является обширной дисциплиной. Это означает, что как только вы изучите один аспект, вы должны переключиться и изучить другой. Например, кислоты и основания в основном отделены от уравнений и стехиометрии.
Если все это не имеет смысла, не паникуйте. StudyGate здесь, чтобы удовлетворить ваши потребности в помощи домашних заданий по химии. Наши специалисты специализировались в области химии и/или сейчас работают в этой области. И они хотят поделиться своими знаниями с вами, студентом колледжа на пороге величия.
Разделы химии Помощь с выполнением домашних заданий
Чтобы получить нашу помощь, вам не обязательно посещать определенный химический класс. Наши преподаватели могут помочь с любым курсом, включая домашнее задание по органической химии. На самом деле мы перечислим здесь все филиалы, в которых мы можем оказать своевременную и качественную помощь именно тогда, когда она вам нужна.
Органическая химия
Мы получаем много запросов на помощь в выполнении домашних заданий по химии в этой области. Одним словом, органическая химия жесткая. Он изучает структуру, свойства и реакции органических соединений и требует значительного времени. С помощью нашей онлайн-справки по химии вы скоро поймете концепции этого курса.
Неорганическая химия
Эта область касается свойств и поведения неорганических соединений, включая минералы и металлы. Если запоминание новых терминов вызывает туман в голове, обратитесь к StudyGate за помощью в домашнем задании по химии.
Физическая химия
Здесь встречаются предметы физики и химии для изучения физических свойств атомов и молекул. Это чрезвычайно интенсивный курс. Вот почему многие студенты обращаются за помощью в онлайн-задачах по химии.
Аналитическая химия
Целью аналитической химии является определение того, что такое материя и сколько ее существует. Однако это нелегкий подвиг. Наши помощники по химии всегда готовы ответить на вопросы.
Однако это нелегкий подвиг. Наши помощники по химии всегда готовы ответить на вопросы.
Биохимия
Биохимия изучает химические процессы в живых организмах. Это требует большого количества лабораторного времени. Цель состоит в том, чтобы понять и решить сложные биологические проблемы. Для этого нужно сначала разобраться в теме. StudyGate рад предложить помощь в выполнении заданий по биохимии онлайн.
Экологическая химия
Эту область исследований легко спутать с зеленой химией, потому что обе они направлены на помощь нашей планете. Но экологическая химия изучает химические процессы в воздухе, воде и живой среде. Зеленая химия стремится уменьшить загрязнение в его источнике. С помощью нашей онлайн-помощи по химии вы сможете лучше понять обе области.
Промышленная химия
Эта область улучшает жизнь, превращая материю в полезные материалы. Но вам не нужно изучать эти идеи самостоятельно. Задайте нам свой вопрос и получите быструю помощь с домашним заданием по химии.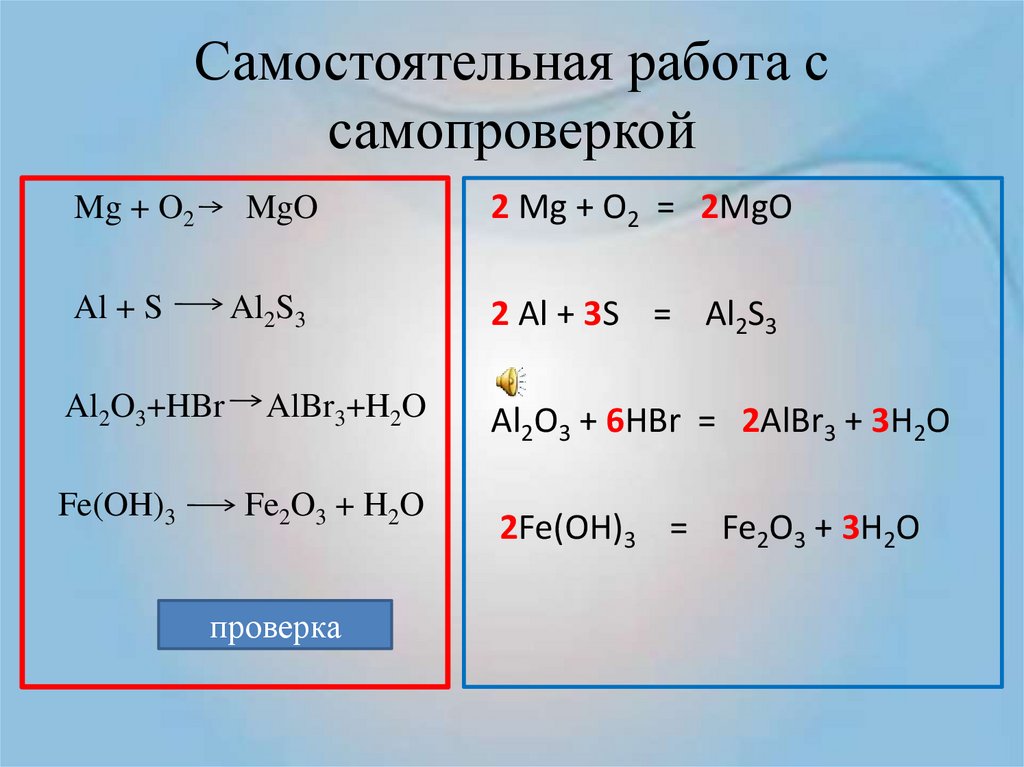
Химия полимеров
Полимер принадлежит к классу веществ, характеризующихся очень большими молекулами. Изучите этот предмет вдоль и поперек с помощью простой профессиональной помощи по химии.
Образец вопроса и ответа для домашнего задания по химии
Чтобы поверить, нужно увидеть, поэтому мы приводим здесь образец вопроса и ответа по химии. Мы хотим, чтобы вы знали, что наши репетиторы способны, и вам также может быть оказана та же помощь с заданиями по химии, которую они предоставляли в прошлом.
Вопрос
Предскажите продукт следующей реакции, при необходимости обращая внимание на стереохимию.
Ответ
Помощь в выполнении заданий по химии онлайн от квалифицированных экспертов
Большинство студентов выходят из академической среды, видя факты, повторяя их в домашних заданиях и повторяя одни и те же факты в контрольной. Но в химии важно понимать значение этих фактов, чтобы знать, как правильно их использовать.
Наши помощники по химии прокладывают путь к этим знаниям. Химия оказывает огромное влияние на нашу повседневную жизнь, включая чистящие средства, которые мы используем, воздух, которым мы дышим, и даже продукты, которые мы едим. Используя такие практические примеры, наша команда может объяснить вопросы домашнего задания и превратить невыполнимое задание в гораздо более приятное. И если часть головоломки по-прежнему не имеет смысла, мы приглашаем студентов запланировать онлайн-репетиторские занятия.
Преимущества долгосрочного обучения
Индивидуальная работа с преподавателем позволяет планировать занятия в удобное для вас время. Вы также можете использовать эту возможность, чтобы учиться с большим эффектом. Например, когда вы читаете текст в классе перед сеансом, выделите те области, которые не щелкают. Затем обратитесь за разъяснениями к своему наставнику. Это гораздо лучший способ учиться, чем читать сложный материал самостоятельно, а затем пытаться запомнить его для выполнения задания или теста.
Затем обратитесь за разъяснениями к своему наставнику. Это гораздо лучший способ учиться, чем читать сложный материал самостоятельно, а затем пытаться запомнить его для выполнения задания или теста.
Мы также можем научить студентов шагам, необходимым для успешного решения химических задач. Это требует большего, чем запоминание. Студентам необходимо уделять немного времени каждый день знакомству с предметом. Медленно, но верно процедуры, которые характеризуют химию, обретут смысл. А благодаря дополнительным знаниям наших помощников по домашней работе по химии вы с легкостью справитесь с оставшейся частью курса и получите отличную оценку.
Лучшая помощь в выполнении домашних заданий по химии от квалифицированной команды
Помощь с домашним заданием по химии должна исходить от тех, кто хорошо распределяет время и обладает навыками презентации, терпелив и может наглядно показать свою работу. StudyGate гарантирует, что каждый из членов нашей команды продемонстрирует эти качества перед тем, как принять их на работу. Мы работаем только с лучшими — профессионалами, стремящимися обеспечить ваш успех.
Мы работаем только с лучшими — профессионалами, стремящимися обеспечить ваш успех.
Внимательно следуйте инструкциям
Помощь с домашним заданием по химии мало чего стоит, если она не соответствует ожиданиям вашего преподавателя. Наши преподаватели внимательно читают инструкции, чтобы обеспечить выполнение каждой детали. Все проводимые исследования тщательно документируются, а расчеты, которые мы делаем, точны. На самом деле, мы гарантируем не менее 80% точности всех наших домашних заданий по химии. Если ваше задание не соответствует этому стандарту, вы можете запросить возврат средств.
Каждый раз отправляйте 100% уникальные ответы
Возможно, вы беспокоитесь, что наша онлайн-помощь по химии нарушит политику вашего университета в отношении плагиата, но будьте уверены, этого не произойдет. Мы разрабатываем совершенно уникальный ответ для каждого ученика по каждому предмету. А благодаря нашей жесткой политике конфиденциальности ваша личная информация находится в безопасности. Никто никогда не узнает, что вы обращались за помощью к репетитору, но это не повод для беспокойства или нервозности. Многим студентам колледжей нужна помощь в нерабочее время преподавателя, и именно поэтому мы здесь.
Никто никогда не узнает, что вы обращались за помощью к репетитору, но это не повод для беспокойства или нервозности. Многим студентам колледжей нужна помощь в нерабочее время преподавателя, и именно поэтому мы здесь.
Уникальные возможности нашей службы помощи при выполнении домашних заданий по химии
Что еще отличает StudyGate? Мы предлагаем живую помощь с домашним заданием по химии круглосуточно и без выходных, так что, когда вы мучаетесь над заданием в час ночи, вам есть куда обратиться. В такие моменты легко чувствовать себя одиноким и думать, что если вы просто уделите этому немного больше времени, тема в конечном итоге обретет смысл. Но когда вы устали и обеспокоены, вам становится все труднее сосредоточиться. Мы избавляем вас от стресса, связанного с обучением, чтобы вы могли сосредоточиться на других заданиях, других предметах и других аспектах своей жизни.
Никакое задание не является слишком большим или слишком сложным
Наши преподаватели могут предоставить любую помощь в выполнении домашних заданий по химии. Большой, маленький или промежуточный, размер проекта не имеет значения. Раньше мы давали один короткий ответ, несколько длинных ответов и даже помогали студентам писать курсовые работы. Мы возьмемся за любое задание, которое вы пришлете нам, и выполним его с осторожностью.
Большой, маленький или промежуточный, размер проекта не имеет значения. Раньше мы давали один короткий ответ, несколько длинных ответов и даже помогали студентам писать курсовые работы. Мы возьмемся за любое задание, которое вы пришлете нам, и выполним его с осторожностью.
Даже сжатые сроки не проблема
Вы целый день мучаетесь с одним и тем же домашним заданием и только сейчас понимаете, что не сможете ответить на него самостоятельно? Приближается ваш крайний срок, и с каждой минутой ваш желудок скручивается от страха? Перестаньте бороться и получите необходимую помощь по органической химии от StudyGate. Мы можем уложиться в любой срок и преуспеть в сложных ситуациях.
Получите онлайн-помощь по химии по доступной цене
После обсуждения того, как мы можем улучшить вашу академическую жизнь, пришло время поговорить о затратах. Не беспокойтесь – наши цены доступны и доступны. Вот чего ожидать: репетиторы берут от 1 до 20 долларов за вопрос, на который можно ответить за час или меньше. Они берут от 20 до 100 долларов за рабочие листы, требующие нескольких ответов — цена зависит от количества времени, необходимого для ответа на каждый вопрос. А для проектов репетиторы начинают свою цену со 100 долларов и увеличивают ее в зависимости от сложности.
Они берут от 20 до 100 долларов за рабочие листы, требующие нескольких ответов — цена зависит от количества времени, необходимого для ответа на каждый вопрос. А для проектов репетиторы начинают свою цену со 100 долларов и увеличивают ее в зависимости от сложности.
Безопасные способы оплаты
Мы предоставляем безопасный и простой способ оплаты с помощью нашего кошелька StudyGate. Это позволяет вам отслеживать, сколько вы тратите на домашнюю работу по химии, и поддерживать бюджет. Мы также можем использовать это удобное устройство для загрузки кредитов на ваш счет, если вы участвуете в нашей программе «Дай 10 долларов, получи 10 долларов». Это простой способ держать деньги в кармане. Просто используйте партнерскую ссылку, которую мы вам даем, и предложите друзьям также подписаться на наши услуги. За каждого друга, который это сделает, мы дадим вам обоим по 10 долларов, которые вы потратите на помощь в следующем задании или онлайн-репетиторство.
Часто задаваемые вопросы
и
Могу ли я заплатить кому-нибудь за домашнее задание по химии?
Да, вы можете оплатить справку по химии онлайн. Это отличный способ получить ясность, сохранить свой средний балл и получить высокую оценку, которую вы заслуживаете. И получить эту помощь легко. Просто нажмите на ссылку Помощь с домашними заданиями, выберите тему и загрузите свой вопрос. Репетиторы будут уведомлены о вашем вопросе и смогут начать торги. Вы выбираете того, с кем хотите работать, и ждете, пока вам доставят выполненное задание.
Это отличный способ получить ясность, сохранить свой средний балл и получить высокую оценку, которую вы заслуживаете. И получить эту помощь легко. Просто нажмите на ссылку Помощь с домашними заданиями, выберите тему и загрузите свой вопрос. Репетиторы будут уведомлены о вашем вопросе и смогут начать торги. Вы выбираете того, с кем хотите работать, и ждете, пока вам доставят выполненное задание.
и
Как StudyGate может помочь с химией?
Попросив о помощи, вы сразу снимаете часть бремени со своих плеч. Это дает вам возможность отвлечься от вашего задания и отдохнуть. После того, как наши преподаватели представят готовое задание, вы сможете просмотреть его и извлечь из него уроки. Мы рекомендуем сохранить эту работу и обращаться к ней для будущих заданий. И помните, что мы здесь, чтобы предоставить дополнительную помощь с домашними заданиями по химии в любое время, когда вам это нужно.
и
Где я могу выучить химию онлайн?
С преподавателем StudyGate во время сеанса онлайн-репетиторства. Просто следуйте подсказкам на нашем сайте и выберите удобную для вас дату и время. Затем подготовьте свои вопросы и задайте их своему наставнику. Это лучший способ выучить химию онлайн.
Просто следуйте подсказкам на нашем сайте и выберите удобную для вас дату и время. Затем подготовьте свои вопросы и задайте их своему наставнику. Это лучший способ выучить химию онлайн.
и
Кто-нибудь может сделать мою лабораторную по химии?
Мы будем рады помочь с этим, чтобы вы могли преуспеть в своих классах. Вы и ваш наставник можете работать вместе, когда вы задаете вопросы, а он или она дает ответы. Это отличный способ повысить вашу уверенность и почувствовать себя более комфортно в химии.
и
Как вы выполняете задания по химии?
Лучший способ приблизиться к химии — использовать проверенную методологию, изучение которой является частью самого курса. Использование логических шагов помогает разбить каждую часть вопроса или задания на более мелкие, более удобоваримые части. Затем вы можете использовать изученные концепции для определения точных ответов.
и
Какой стандарт практикует ваша служба написания домашних заданий по химии?
Мы соблюдаем несколько различных политик, защищающих учащихся, с которыми мы работаем.
У нас также есть политика «Нет ерунде», которая гарантирует прозрачное ценообразование и не менее 80% точности вашей помощи по химии. Наша политика конфиденциальности предусматривает, что мы будем использовать вашу личную информацию только для домашних заданий и в целях обучения, и, наконец, наш кодекс чести подтверждает, что все, кто использует наш сайт, делают это добросовестно.
и
Как я могу заказать у вас задания по химии?
Платформа StudyGate невероятно проста в использовании. Мы проведем вас через каждый шаг процесса справки по химии. На главной странице просто выберите категорию (например, наука), выберите предмет (например, химия) и опишите точную помощь с домашним заданием по химии, которая вам нужна. Загрузите подтверждающие документы, выберите дату родов, а мы позаботимся обо всем остальном.
Загрузите подтверждающие документы, выберите дату родов, а мы позаботимся обо всем остальном.
и
Каковы преимущества найма StudyGate?
Наша команда профессионалов хочет, чтобы вы преуспели прежде всего. Мы знаем, что ты хороший ученик. Вот как тебя приняли в колледж! И тот факт, что вы ищете помощь по химии в Интернете, еще раз демонстрирует, что вы стремитесь преуспеть. Мы полностью поддерживаем вашу академическую карьеру и, благодаря многочисленным правилам, которые мы установили, прекратим работу только тогда, когда вы почувствуете себя полностью удовлетворенным.
Главы курса Основы калькулятора Обзор математики Basic Concepts
Тесты разделов Предварительное испытание Пост-тест Онлайн-калькуляторы Калькулятор окислительно-восстановительного потенциала Кинетика Аррениуса Калькулятор Калькулятор термодинамики Калькулятор ядерного распада Линейная регрессия методом наименьших квадратов Решатель уравнений методом Ньютона Калькулятор сжимаемости Калькулятор перевода единиц Номенклатурный калькулятор Ссылки на дополнительную информацию Калькуляторы Texas Instruments Калькуляторы Casio Калькуляторы Sharp Калькуляторы Hewlett Packard Связаться с веб-мастером | Стехиометрия — это просто математика, стоящая за химией. 
В химии мы используем символы для обозначения различных химических веществ. Успех в химии зависит от прочного знакомства с этими основными символами. Например, символ «С» представляет собой атом углерода, а «Н» представляет собой атом водорода. Чтобы представить молекулу поваренной соли, хлорида натрия, мы будем использовать обозначение «NaCl», где «Na» представляет собой натрий, а «Cl» представляет собой хлор. В этом случае мы называем хлор «хлоридом» из-за его связи с натрием. Вы должны были просмотреть схемы именования, или  Химическое уравнение – это выражение химического процесса. Например: В этом уравнении AgNO 3 смешивается с NaCl. Уравнение показывает, что реагенты (AgNO 3 Часто записывают химические уравнения, показывающие состояние, в котором находится каждое вещество. Знак (s) означает, что соединение является твердым. Знак (l) означает, что вещество является жидкостью. Знак (aq) обозначает водный раствор в воде и означает, что соединение растворено в воде. Наконец, знак (g) означает, что соединение представляет собой газ. Коэффициенты используются во всех химических уравнениях, чтобы показать относительное количество каждого присутствующего вещества. В некоторых случаях над или под стрелками будет написана различная информация. Эта информация, такая как значение температуры, показывает, какие условия должны присутствовать для протекания реакции. Например, на графике ниже обозначения над и под стрелками показывают, что для протекания этой реакции нам нужен химикат Fe 2 O 3 , температура 1000°C и давление 500 атмосфер. График ниже иллюстрирует большинство концепций, описанных выше:  В приведенном выше уравнении перед членами нет чисел, поэтому предполагается, что каждый коэффициент равен единице (1). Таким образом, у вас есть такое же количество молей AgNO 3 , NaCl, AgCl, NaNO 3 . В приведенном выше уравнении перед членами нет чисел, поэтому предполагается, что каждый коэффициент равен единице (1). Таким образом, у вас есть такое же количество молей AgNO 3 , NaCl, AgCl, NaNO 3 .Преобразование между молями и граммами вещества часто важно. Это преобразование можно легко осуществить, когда атомарные и/или молекулярные масса вещества (веществ) известна. Учитывая атомарное или молекулярное масса вещества, эта масса в граммах составляет моль вещества. Например, кальций имеет атомную массу 40 атомных единиц массы. Итак, 40 грамм кальция составляет один моль, 80 граммов — два моля и т. д. Однако иногда нам нужно проделать некоторую работу, прежде чем использовать коэффициенты членов для представления относительного количества молекул каждого соединения. Это тот случай, когда уравнения не сбалансированы должным образом. Мы рассмотрим следующее уравнение:+ Fe Поскольку перед любым из членов нет коэффициентов, легко предположить, что один (1) моль Al и один (1) моль Fe 3 O 4 реагируют с образованием одного (1) моля Al 2 О 3 . Уравновешивание простого химического уравнения в основном делается методом проб и ошибок. Для этого существует множество различных способов и систем, но для всех методов важно знать, как подсчитать количество атомов в уравнении. Например, мы рассмотрим следующий термин. Этот термин выражает две (2) молекулы Fe 3 O 4 . В каждой молекуле этого вещества есть три (3) атома Fe. Теперь давайте попробуем сбалансировать уравнение, упомянутое ранее: Разработка стратегии может быть трудной, но вот один из способов решения такой проблемы.
 Это называется «ограничение
реагент». Часто
необходимо определить лимитирующий реагент в задаче. Это называется «ограничение
реагент». Часто
необходимо определить лимитирующий реагент в задаче. Пример: у химика есть только 6,0 грамм C 2 H 2 и неограниченный запас кислорода, и он хочет производить как можно больше CO 2 по возможности. Если она использует приведенное ниже уравнение, сколько кислорода она должна добавить в реакцию? Для решения этой задачи необходимо определить, сколько кислорода должно
добавить, если все реагенты были израсходованы (это способ получения максимального количества CO 2 ).
Затем, поскольку на каждые две (2) молекулы C 2 H 2 приходится пять (5) молекул кислорода, нам нужно умножить результат на 5/2, чтобы получить общее количество молекул кислорода. Затем переведем в граммы, чтобы найти количество кислорода, которое необходимо добавить:
 В задачах процентного состава существует множество возможных решений. Всегда можно удвоить ответ. Например, CH и C 2 H 2 имеют одинаковые пропорции, но это разные соединения. Стандартно давать соединения в их простейшей форме, где соотношение между элементами настолько уменьшено, насколько это возможно, — это называется эмпирической формулой. При расчете эмпирической формулы из процентного состава можно перевести проценты в граммы. Например, проще всего предположить, что у вас есть 100 г, поэтому 54,3% станут 54,3 г. Затем мы можем преобразовать массы в моли; это дает нам молярные отношения. Необходимо привести к целым числам. Хороший метод — разделить все члены на наименьшее число молей. Пример: если соединение состоит из 47,3 % C (углерода), 10,6 % H (водорода) и 42,0 % S (серы), какова его эмпирическая формула?
Теперь мы пытаемся получить равномерное соотношение между элементами, поэтому мы делим на количество молей серы, потому что это наименьшее число:
Итак имеем: C 3 H 8 S Пример: Рассчитайте процентное содержание гидросульфата по массе, H 2 СО 4 .
Теперь мы можем проверить, что проценты в сумме составляют 100% Таким образом, ответ состоит в том, что H 2 SO 4 состоит из 2,06 % H, 32,7 % S и 65,2 % O по массе. Хотя эмпирическая формула является простейшей формой соединения, молекулярная формула — это форма термина, которая могла бы появиться в химическом уравнение. Эмпирическая формула и молекулярная формула могут быть то же самое, или молекулярная формула может быть любым положительным целым числом, кратным эмпирическому формула. Примеры эмпирических формул: AgBr, Na 2 S, C 6 H 10 O 5 . Примеры молекулярных формул: P 2 , C 2 O 4 , C 6 H 14 S 2 , H 2 , C 3 3 H .  Можно рассчитать эмпирическую формулу по массе или процентному составу любого соединения. Мы уже обсуждали процентный состав в разделе выше. Если у нас есть только масса, все, что мы делаем, — это, по сути, исключаем этап преобразования от процентов к массе. Пример. Рассчитайте эмпирическую формулу соединения, содержащего 43,7 г фосфора и 56,3 г кислорода. Сначала мы конвертируем в моли:
Затем мы делим родинки, чтобы попытаться получить равное соотношение.
Когда мы делим, мы не получаем целых чисел, поэтому мы должны умножить на два (2). Рассчитать молекулярную формулу, когда у нас есть эмпирическая формула, несложно. Если мы знаем эмпирическую формулу соединения, все, что нам нужно сделать, это разделить молекулярная масса соединения по массе эмпирической формулы. Также можно сделать это с одним из элементов в формуле; просто разделите массу этого элемента в одном моле соединения на массу этого элемента в эмпирической формуле. Результат всегда должен быть натуральное число. Пример: если мы знаем, что эмпирическая формула соединения — HCN, и нам говорят, что для получения соединения необходимо 2,016 грамма водорода, какова его молекулярная формула? В эмпирической формуле водород весит 1,008 грамма. Разделив 2,016 на
1.008 мы видим, что количество необходимого водорода в два раза больше. Поэтому эмпирическую формулу необходимо увеличить в два раза (2). Ответ:  это очень распространено
термин по химии. это очень распространено
термин по химии. Концентрация раствора — это «сила» раствора. Под раствором обычно понимается растворение некоторого твердого вещества в жидкости, например растворение соли в воде. Также часто необходимо выяснить, сколько воды нужно добавить в раствор, чтобы изменить его концентрацию до определенной. Концентрация раствора обычно указывается в молярности. Молярность определяется как количество молей растворенного вещества (то, что фактически растворено в растворе), деленное на объем в литрах раствора (общий объем того, что растворено и в чем оно было растворено).
Молярность, вероятно, является наиболее часто используемым термином, потому что измерить объем жидкости довольно просто. Пример: если 5,00 г NaOH растворить в 5000 мл воды, какова молярность раствора?
Теперь мы просто используем определение молярности: моли/литры, чтобы получить ответ
Таким образом, молярность (М) раствора составляет 0,025 моль/л. Моляльность – еще одно распространенное измерение концентрации. Моляльность определяется как количество молей растворенного вещества, деленное на килограммы растворителя. (вещество, в котором он растворен, как вода).
Моляльность иногда используется вместо молярности при экстремальных температурах, потому что объем может сокращаться или увеличиваться. Пример: Если моляльность раствора C 2 H 5 OH, растворенного в воде, равно 1,5, а масса воды 11,7 кг, подсчитайте, сколько C 2 H 5 OH в граммах должно быть добавлено к раствору.
Теперь мы просто используем определение молярности: моли/литры, чтобы получить ответ. | кг растворитель | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1,5 | кг | = | 11,7 кг |
| 1,5 | кг | х 11,7 кг = 17,55 моль |
1 | х | 1 моль | = 808,5 г C 2 H 5 OH |
Можно преобразовать между молярностью и моляльностью. Единственная необходимая информация – это плотность.
Единственная необходимая информация – это плотность.
Пример: Если молярность раствора равна 0,30 М, рассчитайте моляльность
раствора, зная, что плотность составляет 3,25 г/мл.
Для решения этой задачи мы можем взять один (1) литр раствора, чтобы упростить вычисления. Нам нужно перейти от единиц молярности моль/л к единицам молярности моль/кг. Решаем задачу следующим образом, помня, что в литре 1000 мл, а в кг 1000 грамм. Это преобразование будет точным только при малых моляльностях и моляльностях.
1 л | х | 3,25 г | х | 1000 мл | х | 1 кг | = 0,09 моль/кг |
Также можно рассчитать коллигативные свойства, такие как понижение температуры кипения, используя моляльность. Уравнение понижения или расширения температуры равно 9. 0005
0005
Где:
ΔT – депрессия температуры (для точки замерзания) или температурное расширение (для точки кипения) (°C)
K f – константа точки замерзания (кг °C/моль)
m – моляльность в молях /кг
Пример: если точка замерзания соленой воды, налитой на дороги, составляет -5,2 ° C, какова моляльность раствора? (K f для воды составляет 1,86 °C/м.)
Это простая задача, в которой мы просто подставляем числа в уравнение. Одна часть информации, которую мы должны знать, заключается в том, что вода обычно замерзает при 0 ° C.
ΔT = K f * m
ΔT/K f = m
m = 5,2/1,86
m = 2,8 моль/кг
Практические задачи
2.

 Это количество может представлять либо относительное количество молекул, либо относительное количество молей (описано ниже). Если коэффициент не указан, предполагается единица (1).
Это количество может представлять либо относительное количество молекул, либо относительное количество молей (описано ниже). Если коэффициент не указан, предполагается единица (1). Если бы это было так, реакция была бы весьма эффектной: атом алюминия появился бы из ниоткуда, а два (2) атома железа и один (1) атом кислорода волшебным образом исчезли бы. Мы знаем из Закон сохранения массы (в котором говорится, что материя не может быть ни создана, ни уничтожена), что это просто не может произойти. Мы должны убедиться, что число атомов каждого конкретного элемента в реагентах равно числу атомов того же элемента в продуктах. К
для этого мы должны выяснить относительное количество молекул каждого термина, выраженное коэффициентом термина.
Если бы это было так, реакция была бы весьма эффектной: атом алюминия появился бы из ниоткуда, а два (2) атома железа и один (1) атом кислорода волшебным образом исчезли бы. Мы знаем из Закон сохранения массы (в котором говорится, что материя не может быть ни создана, ни уничтожена), что это просто не может произойти. Мы должны убедиться, что число атомов каждого конкретного элемента в реагентах равно числу атомов того же элемента в продуктах. К
для этого мы должны выяснить относительное количество молекул каждого термина, выраженное коэффициентом термина. Следовательно, в двух (2) молекулах вещества должно быть шесть (6) атомов Fe. Точно так же в одной (1) молекуле вещества содержится четыре (4) атома кислорода, поэтому в двух (2) молекулах должно быть восемь (8) атомов кислорода.
Следовательно, в двух (2) молекулах вещества должно быть шесть (6) атомов Fe. Точно так же в одной (1) молекуле вещества содержится четыре (4) атома кислорода, поэтому в двух (2) молекулах должно быть восемь (8) атомов кислорода. Что касается реагента, у нас есть коэффициент три (3), умноженный на индекс четыре (4), что дает 12 атомов кислорода. Со стороны продукта у нас есть коэффициент четыре (4), умноженный на нижний индекс три (3), что дает 12 атомов кислорода. Теперь кислород сбалансирован.
Что касается реагента, у нас есть коэффициент три (3), умноженный на индекс четыре (4), что дает 12 атомов кислорода. Со стороны продукта у нас есть коэффициент четыре (4), умноженный на нижний индекс три (3), что дает 12 атомов кислорода. Теперь кислород сбалансирован. 
 Затем соотношение молей можно перевести в эмпирическую формулу.
Затем соотношение молей можно перевести в эмпирическую формулу. 310
310  09
09 Ответ = P 2 O 5
Ответ = P 2 O 5 
