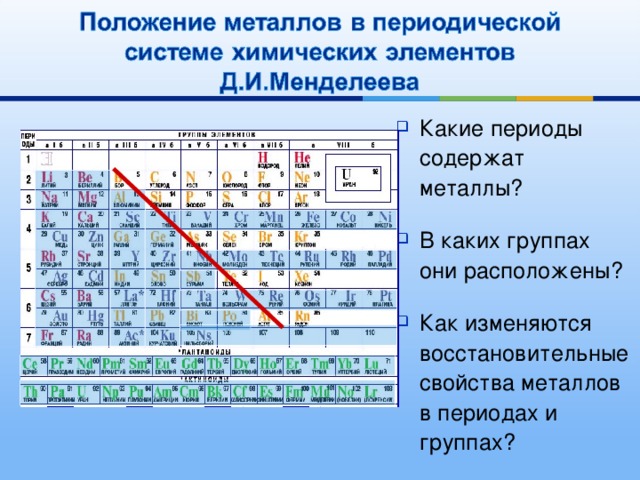
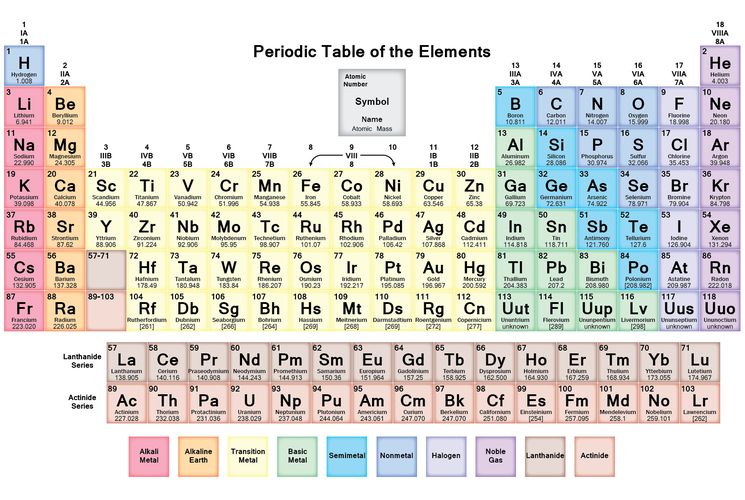
ряды, периоды, подгруппы, порядковый номер. Электронные аналоги.
Сформулирован в 1869: «Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от их атомного веса»
В 1869 было известно всего 63 элемента.
Периодическая система – изображение периодического закона.
Таблица Менделеева имеет 3 малых периода (1-3) и 4 больших (4-7).
Период – последовательность атомов с одинаковым числом электронных слоев. Большие периоды могут содержать 2 ряда (четный и нечетный). Периоды начинаются с активных Ме, по мере продвижения усиливаются неметаллические свойства, а завершаются галогеном и инертным газом. Элементы, которые осуществляют переход от Ме к неметаллу переходными.
Элементы
группы проявляют одинаковую max.
валентность по кислороду, равную номеру
группы. Элементы главных подгрупп
проявляют определенную валентность по
водороду. В
В
Периодический закон менделеева и периодическая система элементов: ряды, периоды, группы, подгруппы, порядковый номер элемента
Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов. В конце этих периодов находятся галогены, имеющие семь электронов на внешнем слое атомов, и инертные газы, у которых внешний слой завершен и содержит восемь электронов.
Таким образом, в каждом периоде с возрастанием заряда ядра металлические свойства элементов постепенно ослабевают, усиливаются неметаллические
В
таблице каждый химический элемент имеет
атомный номер, который определяется
числом протонов в ядре атома (заряд
ядра) Таким
образом, основной
признак химического элемента — это заряд
его ядра. Периодом называется ряд элементов, расположенных
в порядке возрастания атомных масс,
начинающийся со щелочного металла и
заканчивающийся инертным газом.
Периодом называется ряд элементов, расположенных
в порядке возрастания атомных масс,
начинающийся со щелочного металла и
заканчивающийся инертным газом.
Побочные подгруппы образованы только элементами больших периодов. Еще одно отличие: главная подгруппа, как правило, состоит из большего числа элементов, чем побочная (в VIII группе наоборот). В главной подгруппе по
Изменяются в группах и свойства соединений: оксид углерода (IV) — кислотный оксид, а оксид свинца обладает основными свойствами.
Периодический закон позволил систематизировать свойства химических элементов и их соединений
Электронные аналоги – элементы, объединенные в одну подгруппу и имеющие аналогичную электронную формулу (пример: Cr, Mg, W).
Периодическое изменение свойств химических элементов.
 Радиус атомов, сродство к электрону, энергия ионизации, электроотрицательность.
Радиус атомов, сродство к электрону, энергия ионизации, электроотрицательность.
Период – последовательность атомов с одинаковым числом эл-ных слоев.
Большие
периоды могут содержать 2 ряда (четный
и нечетный). Периоды нач. с активного
Ме, по мере продвижения усиливаются
немет. св-ва, а завершаются галогеном и
инертным газом. Эл-ты, которые осущ.переход
от Ме к немет., наз. переходными. Радиус
атома – расстояние между атомным ядром
и самой дальней из стабильных орбит
электронов в эл.оболочке этого атома.
Увел.с увеличением порядкового номера
элемента. Эн.ионизации – эн., которую
необх. затратить на отрыв электрона с
основного(низшего) уровня и переместить
его на дальний уровень. Атом при этом
превр. в «+».ион. можно счит. мерой
металличности: чем меньше энергия, тем
ярче проявляются металлические свойства,
и наоборот. Эн. сродства к электрону –
эн., которая выделяется при присоед.
электрона к нейтральному атому. Она
очень мала и становится заметной с
элементов 5-й группы.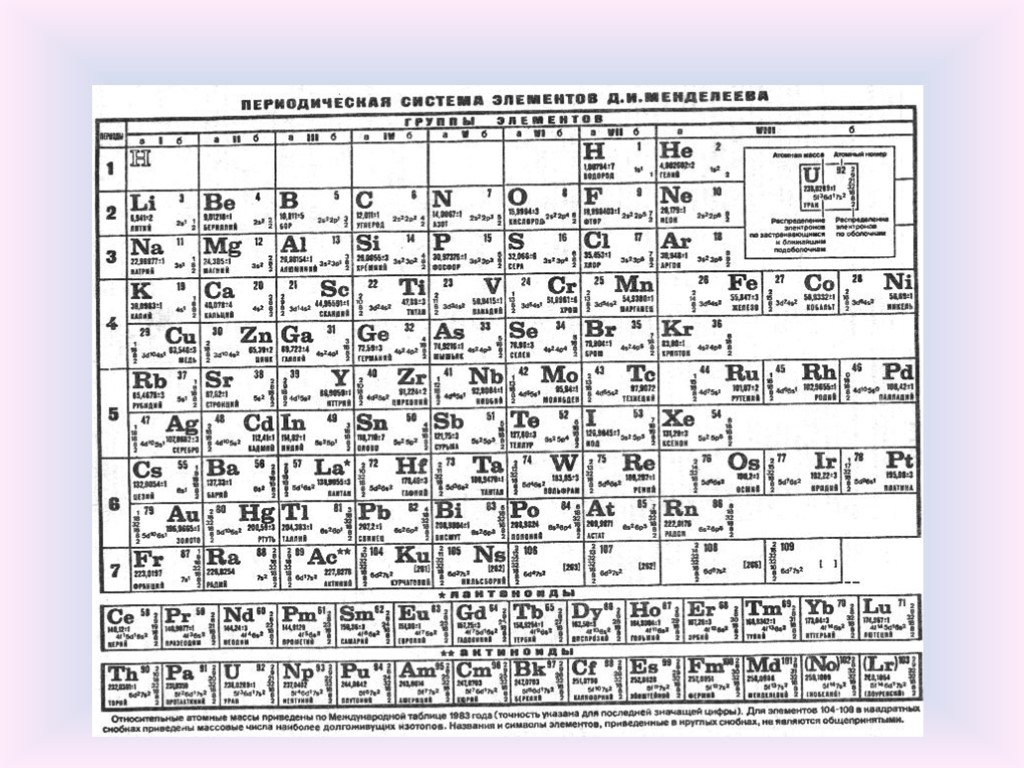
Атомный радиус является величиной, которая показывает размер электронной оболочки атома. В главных подгруппах с увеличением заряда ядра атома происходит увеличение числа электронных уровней, поэтому атомный радиус с увеличением порядкового номера в главных подгруппах увеличивается. В периодах происходит увеличение заряда ядра атома химического элемента, что приводит к усилению притяжения внешних электронов к ядру. Кроме того, с увеличением заряда ядра увеличивается число электронов на внешнем уровне, однако число электронных уровней не увеличивается. Указанные закономерности приводят к сжатию электронной оболочки вокруг ядра. Поэтому атомный радиус с увеличением порядкового номера в периодах уменьшается.
Электроотрицательность
это
способность атома в соединениях
притягивать к себе валентные электроны,
то есть электроны, посредством которых
образуются химические связи между
атомами. в главных подгруппах
электроотрицательность с увеличением
порядкового номера уменьшается. В
периодах с увеличением порядкового
номера электроотрицательность
увеличивается.
в главных подгруппах
электроотрицательность с увеличением
порядкового номера уменьшается. В
периодах с увеличением порядкового
номера электроотрицательность
увеличивается.
Энергия ионизации разновидность энергии связи, представляет собой наименьшую энергию, необходимую для удаления электрона от свободного атома в его низшем энергетическом (основном) состоянии на бесконечность.
Энергия ионизации является одной из главных характеристик атома, от которой зависят природа и прочность образуемых
атомом химических связей. От нее существенно зависят также восстановительные свойства соответствующего простого вещества.
Сродство
к электрону
количество
энергии, выделяющееся при присоединении
электрона к атому, молекуле пли радикалу.
Сродство к электрону выражается обычно
в электрон-вольтах. Значение величины
Сродства к электрону важно для понимания
природы химической связи и процессов
образования отрицательных ионов. Чем
больше Сродство к электрону, тем легче
атом присоединяет электрон.
Периодическая ⭐️ система химических элементов Менделеева: каково строение, количество элементов
Периодическая система химических элементов Менделеева
До середины XIX века мир химической науки знал о существовании 63 элементов, которые не имели какой-то определенной системы ранжирования. Сама химия как наука была исключительно описательной и не имела возможностей научного предвидения.
В этот период научный мир стоял в тупике из-за невозможности узнавать о свойствах старых и существовании новых элементов. Создание системы, которая бы могла определить закономерности химических элементов, было основной задачей ученых умов.
Многие исследователи старались первыми систематизировать знания о химических элементах, найти закономерности и создать таблицу, которая могла бы помочь науке в дальнейших исследованиях. Однако все системы имели минусы.
Однако все системы имели минусы.
1 марта (17 февраля) 1869 года в труде «Опыт системы элементов, основанной на их атомном весе и химическом свойстве» Дмитрий Иванович Менделеев предложил свою систему классификации. Она была основана на химических свойствах элементов и их атомных массах.
ОпределениеПериодическая система химических элементов Д. И. Менделеева — классификация химических элементов по принципу зависимости свойств различных элементов от заряда их атомного ядра.
Попеременно переставляя карточки с известными данными о химических элементах, Менделеев создал таблицу, которая, претерпев небольшие изменения, окончательно сформировалась к 1871 году.
Помимо составления таблицы, ученый сформулировал Периодический закон, который в современной формулировке звучит следующим образом:
ОпределениеПериодический закон — закон, который заключается в сопоставлении свойств химических элементов и их атомных масс.
Общие сведения, как устроена
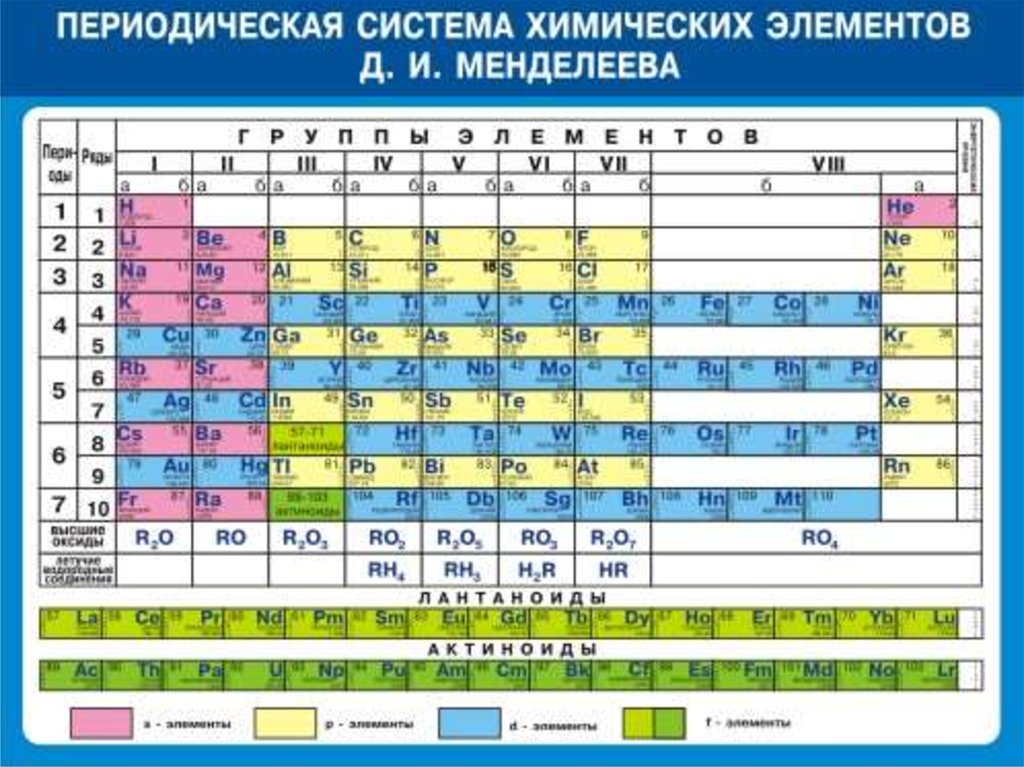
За все время поиска окончательного внешнего вида таблицы, она имела более сотни вариантов изображения, однако ее современный вид предполагает написание химических элементов в виде двумерной таблицы, в которой столбцы определяют группы элементов, а строки — периоды.
Общее количество элементов достигает 118, каждый из которых имеет свой номер и свое место в таблице Менделеева. Расположение их зависит от присущих им химических свойств.
Группы определяются по степени окисления в оксидах.
Группы делятся на:
- главные подгруппы;
- побочные.
Химические свойства в периодической системе элементов различаются в зависимости от подгруппы.
Положение элементов в таблице зависит от структуры ядра и определяется по принципу возрастания числа протонов в атомном ядре и электронов на электронных уровнях, или по принципу возрастания их порядковых номеров. Принцип возрастания атомной массы не может считаться принципом определения периодичности расположения элементов, так как некоторые элементы выбиваются из общего правила и имеют меньшую или большую массу, чем предполагается составленной периодичностью.
Периоды могут быть:
- малыми;
- большими.
Все периоды, кроме первого, начинаются с щелочного металла и завершаются благородным газом.
Структура, наиболее распространенные формы
118 химических элементов делятся на группы и закономерности в зависимости от схожести химических свойств.
ПримечаниеСтруктура периодической таблицы зависит от формы использования: короткопериодной, длиннопериодной или сверхдлинной.
Современная версия периодической системы Менделеева обладает 8 или 18 группами химических элементов. Такая разница зависит от формы использования таблицы:
- если в таблице используется нумерация каждой подгруппы в форме арабских цифр, то их число составит 18;
- если в таблице нумерация групп происходит римскими цифрами с добавлением букв A и B, то групп будет 8.
Наиболее частым вариантом использования является нумерация по второму варианту.
Элементы распределяются по подгруппам следующим образом:
- IB, IIB, IVB – VIIB имеют по 4 элемента;
- IIA – VIIA имеют по 6 элементов;
- IA, VIIIA имеют по 7 элементов;
- VIIIB имеет 12 элементов;
- IIIB имеет 32 элемента, 14 из которых являются лантаноидами и еще 14 являются актиноидами + 4 элемента основной таблицы.
Современная версия периодической системы Менделеева обладает 7 периодами, каждый из которых имеет определенное число химических элементов:
- первый — 2;
- второй — 8;
- третий — 8;
- четвертый — 18;
- пятый — 18;
- шестой — 32;
- седьмой — 32 элемента.
Первые три периода относятся к малым, остальные — к большим. В последних усиление неметаллических и ослабление металлических свойств происходит более плавно, чем в малых периодах.
«Короткая» (короткопериодная), «длинная» (длиннопериодная) и «сверхдлинная»
Короткая или короткопериодная версия таблицы по внешнему виду наиболее приближена к варианту, который создал сам Менделеев.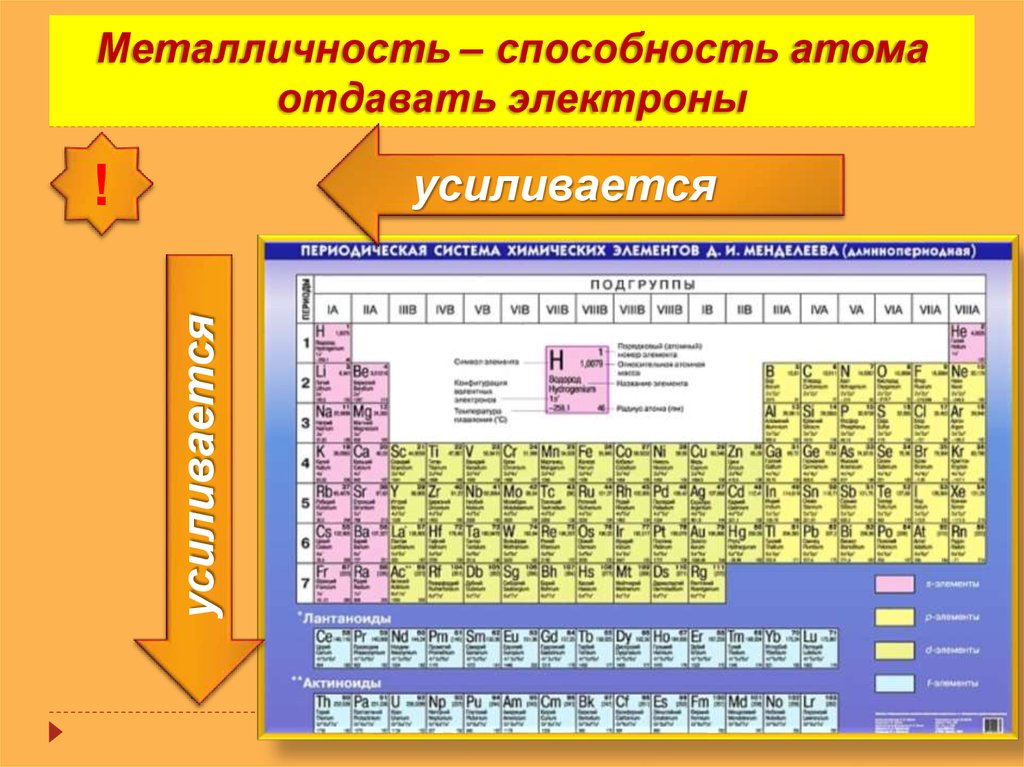 Она основана на схожести химических свойств элементов главных и побочных подгрупп.
Она основана на схожести химических свойств элементов главных и побочных подгрупп.
В данном варианте написания таблицы большие периоды занимают по 2 строчки.
Короткопериодная форма написания таблицы отменена для использования в 1989 году, однако на территории России и СНГ этот вариант до сих пор является основным.
Длиннопериодная на данный момент является общепринятой и самой часто используемой в мире химической науки.
Данный вариант предполагает вынесение отдельных элементов из основной таблицы. Это происходит из-за некоторых их специфических свойств. Они делятся на лантаноиды и актиноиды, которые соответственно относятся к шестому и седьмому периодам.
Также длинная версия периодической системы разделяет группы на подгруппы, из-за чего образуется 18 столбцов вместо 8.
Сверхдлинный вариант предусматривает расположение каждого элемента в своей строчке без вынесения в отдельные строки лантаноидов и актиноидов. Каждый период при таком написании занимает одну строчку.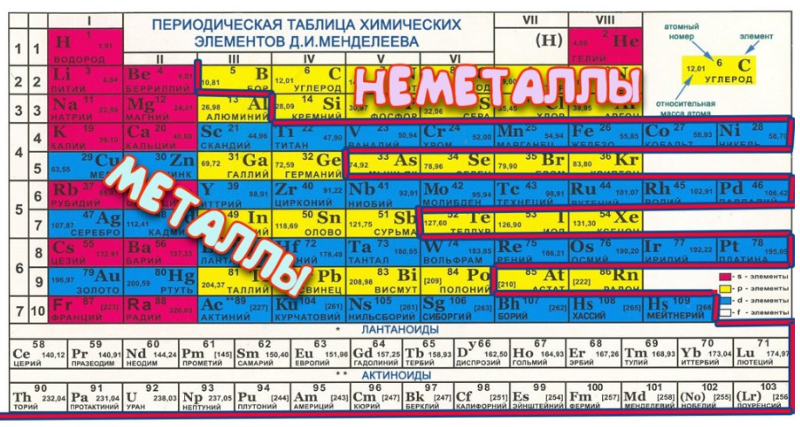
Помимо основных форм написания периодической системы химических элементов, существуют дополнительные:
- лестничная форма Бора;
- башня Циммермана;
- левосторонняя система Жанета;
- спиральная форма Бенфема;
- радужная лента Хайда;
- 3D-цветок Роя и другие.
Каждая из вышеперечисленных систем подчеркивает значение свойств химических элементов определенных групп или периодов, которые неочевидны при классическом написании традиционной таблицы.
Количество элементов, ряды
118 элемент периодической системы имеет название «оганесон». Впервые он был синтезирован в Дубне в 2002 году. Свое название данный химический элемент получил в 2016 году в честь ученого Ю. Ц. Оганесяна. Этот элемент является последним в таблице на момент Y года.
Согласно длиннопериодному варианту таблица имеет 7 рядов по количеству периодов, а также 2 ряда под основной таблицей – ряд лантаноидов и ряд актиноидов.
Ряды включают в себя:
- Водород Н, Гелий Не.

- Литий Li, Бериллий Be, Бор B, Углерод C, Азот N, Кислород O, Фтор F, Неон Ne.
- Натрий Na, Магний Mg, Алюминий Al, Кремний Si, Фосфор P, Сера S, Хлор Cl, Аргон Ar.
- Калий K, Кальций Ca, Скандий Sc, Титан Ti, Ванадий V, Хром Cr, Марганец Mn, Железо Fe, Кобальт Co, Никель Ni, Медь Cu, Цинк Zn, Галий Ga, Германий Ge, Мышьяк As, Селен Se, Бром Br, Криптон Kr.
- Рубидий Rb, Стронций Sr, Иттрий Y, Цирконий Zr, Ниобий Nb, Молибден Mo, Технеций Tc, Рутений Ru, Родий Rh, Галладий Pd, Серебро Ag, Кадмий Cd, Индий In, Олово Sn, Сурьма Sb, Теллур Te, Йод I, Ксенон Xe.
- Цезий Cs, Барий Ba, Лантан La, Гафний Hf, Тантал Ta, Вольфрам W, Рений Re, Осмий Os, Иридий Ir, Платина Pt, Золото Au, Ртуть Hg, Таллий Tl, Свинец Pb, Висмут Bi, Полоний Po, Астат At, Радон Rn.
- Франций Fr, Радий Ra, Актиний Ac, Резерфордий Rf, Дубний Db, Сиборгий Sg, Борий Bh, Хассий Hs, Мейтнерий Mt, Дармштадтий Ds, Рентгений Rg, Коперниций Cn, Нихоний Nh, Флеровий Fl, Московий Mc, Ливерморий Lv, Теннессин Ts, Оганесон Og.

- Лантаноиды: Лантан La, Церий Ce, Празеодим Pr, Неодим Nd, Прометий Pm, Самарий Sm, Европий Eu, Гадолиний Gd, Тербий Tb, Диспрозий Dy, Гольмий Ho, Эрбий Er, Тулий Tm, Иттербий Yb, Лютенций Lu.
- Актиноиды: Актиний Ac, Торий Th, Протактиний Pa, Уран U, Нептуний Np, Плутоний Pu, Америций Am, Кюрий Cm, Берклий Bk, Калифорний Cf, Эйнштейний Es, Фермий Fm, Менделевий Md, Нобелий No, Лоуренсий Lr.
Объяснительная и предсказательная функции Периодического закона
Периодическая система химических элементов Менделеева послужила мощным толчком для развития химической науки. Ученые получили твердое основание из систематизированных химических элементов, благодаря которым стало возможно проведение опытов по обнаружению новых элементов и выявлению ранее неоткрытых свойств.
Периодическая система объясняет взаимосвязи между элементами и их схожие свойства. Благодаря их систематизации произошло выявление групп и подгрупп, периодов, объединивших элементы по свойствам.
С помощью таблицы появилась возможность предсказывать открытие элементов, о которых большинство ученых того времени даже не догадывалось. Помимо открытия уже существующих в природе, но не найденных элементов, стало возможным синтезирование новых из уже существующих.
Сколько периодов в периодической таблице?
Сколько периодов в периодической таблице? Change in properties across Period 3Table shows some properties of the elements in Period 3.
| Element | Na | Mg | Al | Si | P | S | Cl | Ar |
| Номер протона | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| Electron arrangement | 2.8.1 | 2.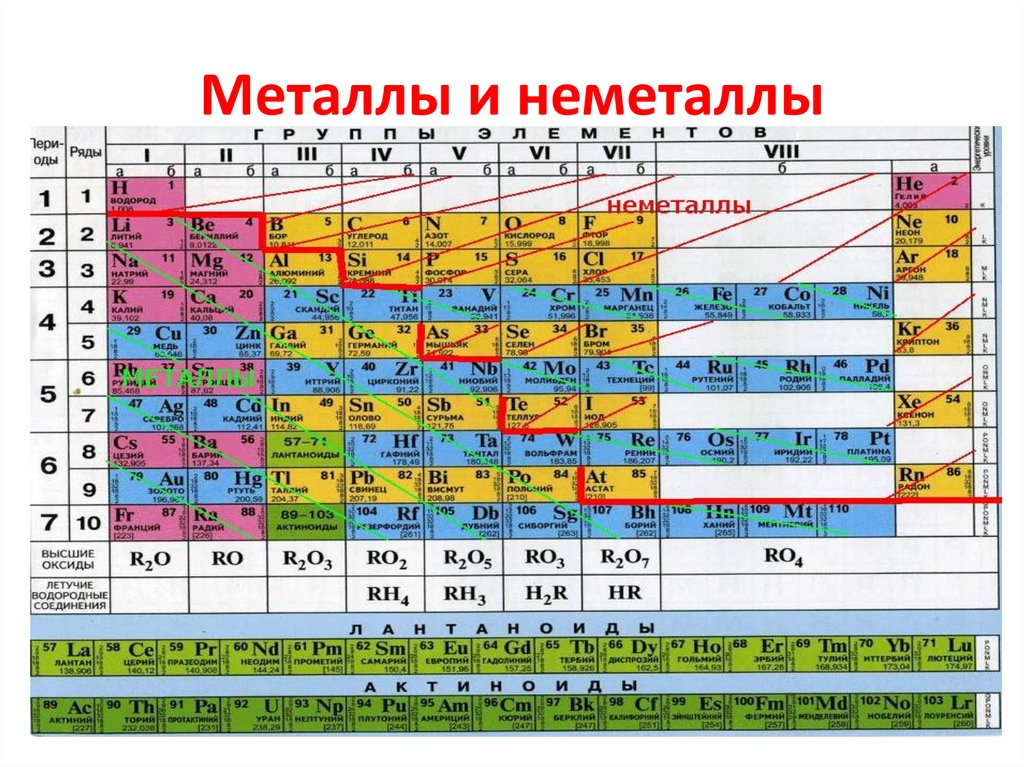 8.2 8.2 | 2.8.3 | 2.8. 4 | 2.8.5 | 2.8.6 | 2.8.7 | 2.8.8 |
| Atomic radius (pm) | 186 | 160 | 143 | 118 | 110 | 104 | 100 | 94 |
| Electronegativity | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 | – |
| Melting point (°C) | 98 | 649 | 660 | 1411 | 44 | 113 | -101 | -189 |
| .0 | 2467 | 2355 | 280 | 444 | -35 | -186 |
Atomic radius (atomic size)
- The atomic radius (atomic size) decreases when going через период слева направо.

- Это можно объяснить на примере Период 3 , как показано ниже.
- Все атомы элементов 3 периода имеют 3 оболочки, занятые электронами, , как показано расположением электронов в таблице выше.
- Число протонов увеличивается на в периоде 3 слева направо. Это вызывает увеличение на положительного заряда ядра при переходе через период 3, как показано в таблице.
Element Na Mg Al Si P S Cl Ar Charge of nucleus +11 +12 +13 + 14 +15 + 16 +17 +18 - The pulling force exerted by the increasing nuclear charge на электронах первых трех занятых оболочек становится сильнее и эти электроны притягиваются ближе к ядру при переходе через Период 3.

- В результате атомный радиус (размер атома) уменьшается при переходе через Период 3.
Электроотрицательность
- Электроотрицательность элемента представляет собой измерение силы ядра притягивает его атом к электрону 90 этого элемента в молекуле 00000.
- Электроотрицательность элементов увеличивается при переходе через период слева направо .
- Это можно объяснить следующим образом:
- Положительный заряд ядра увеличивается на за период (период 2 или период 3) из-за увеличения числа протонов.
- Атомный радиус уменьшается на за период (период 2 или период 3).
- Увеличение положительного заряда ядра и уменьшение размера атома за период вызывают увеличение силы ядра притягивать электроны. Следовательно, электроотрицательность увеличивается на .

- В период 2 или 3 металла слева на менее электроотрицательны, , тогда как неметалла справа на более электроотрицательны.
Физические состояния
- Элементы в периоде 2 и периоде 3 изменяются с твердых на газообразных при переходе через период.
- Металлы слева являются твердыми веществами, поскольку их температура плавления и кипения высока.
- (и) Неметаллы справа обычно представляют собой газы , потому что их температуры плавления и кипения низкие.
(ii) Однако некоторые неметаллы, такие как углерод из периода 2, а также кремний, фосфор и сера из периода 3, являются твердыми веществами. - В таблице показаны физические состояния элементов в Период 2 и Период 3.

Свойства металлов
- 0004 элементов уменьшение при переходе через Период 2 или Период 3.
- Металлические свойства элемента измеряются его электроположительностью.
- За период металла слева на электроположительнее , тогда как неметалла справа на менее электроположительны.
- Заштрихованные элементы на рисунке имеют как металлические, так и неметаллические свойства.
- Эти элементы известны как металлоиды или полуметаллы.
- Например, бор, кремний, германий, мышьяк, сурьма, теллур и полоний являются полуметаллами или металлоидами.
Полуметаллы (металлоиды) – элементы, промежуточные по свойствам между металлами и неметаллами. - Элементы слева Периодической таблицы — это металлы, а элементы справа Периодической таблицы — неметаллы.

- При переходе через период металлические свойства слева меняются на полуметаллические свойства и, наконец, на неметаллические свойства справа.
Electrical conductivity
Table shows the electrical conductivities of the elements when going across Period 3.
| Na Mg Al | Good conductors of electricity | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Si | слабый проводник электричества, но становится хорошим проводником электричества (полупроводник) , когда легирован небольшим количеством бора или фосфора. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| P S Cl Ar | Не может проводить электричество как показано на рисунке. Свойства оксидов элементов 3-го периода
Цель: Исследовать свойства оксидов элементов 3-го периода.
Материалы: оксид натрия, Na 2 O, оксид магния, MgO, оксид алюминия, Al 2 O 3 , оксид кремния (IV), SiOpent 2 2 P 0 9 9, оксид фосфора O 10 , диоксид серы, SO 2 газ в закрытом газовом сосуде, семиокись дихлора, Cl 2 O 7 , индикатор универсальный, 2 моль дм -3 кислота азотная, 2 моль 50 дм – 3 раствор гидроксида натрия и дистиллированная вода.
B. Амфотерные свойства оксидов элементов 3-го периода
Results: A. Acidic/basic properties of the oxides of elements in Period 3
B. Амфотерные свойства оксидов элементов 3 периода
Обсуждение: A. Кислотные/основные свойства оксидов элементов в периоде 3
B. Амфотерные свойства оксидов элементов 3-го периода
Вывод: При переходе по периоду 3 слева направо свойства оксидных элементов меняются от кислых к основным. Следовательно, гипотезу можно принять. Использование полуметаллов (металлоидов) в промышленности
Периодическая таблица – 2022 СОДЕРЖАНИЕ ИСТОРИЧЕСКОЕ РАЗВИТИЕ ПЕРИОДИЧЕСКОЙ ТАБЛИЦЫ ОСОБЕННОСТИ ПЕРИОДИЧЕСКОЙ ТАБЛИЦЫ ГРУППЫ : Вертикальные столбцы элементов или групп нумеруются от I до VIII (или 0). ПЕРИОДЫ : В химии классификация элементов началась с Лавуазье в 1787 году, чья классификация в основном состояла из металлов и неметаллов. С открытием электронной структуры атомов стало ясно, что элементы действительно регулярно изменяются не в зависимости от их относительной атомной массы, а в зависимости от их атомного номера. Следовательно, в современной периодической таблице классификация основана на атомном номере, а не на относительной атомной массе. ПЕРИОДИЧЕСКАЯ КЛАССИФИКАЦИЯ НА БЛОКИ И СЕМЕЙСТВАЭлементы в периодической таблице можно разделить на блоки в соответствии с орбиталью, на которой находятся их валентные электроны, что отвечает за положение элементов. Элементы s-блока имеют s-электроны на внешнем энергетическом уровне, тогда как p-блок имеет как s-, так и p-электроны. Переходные элементы содержат d-электроны в дополнение к своим s- и p-электронам, в то время как лантаноиды и актиноиды содержат f-электроны в дополнение к s-, p- и d-электронам. ОЦЕНКА
СЕМЕЙСТВА ЭЛЕМЕНТОВ Можно сказать, что элементы одной и той же группы принадлежат к семейству, поскольку они проявляют сходные свойства, поскольку их атомы имеют одинаковое количество валентных электронов. ГРУППА I
ГРУППА II
ГРУППА III
ГРУППА IV
ГРУППА V
ГРУППА VI
ГРУППА VII
ГРУППА VIII (0) ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ Это элементы, находящиеся между группами II и III периодической таблицы. В первый переходный ряд входят элементы: скандий (Sc), титан (Ti), ванадий (V), хром (Cr), марганец (Mn), железо (Fe), кобальт (Co), никель (Ni), медь ( Cu) и цинк (Zn).
АКТИНИДЫ И ИСКУССТВЕННЫЕ ЭЛЕМЕНТЫ: Актиниды аналогичны лантаноидам. Они встречаются в седьмом периоде, который начинается с Actinium (Ac) и заканчивается Lawrencium (Lr). Знаменитый Уран находится в этой группе. ОБЩАЯ ОЦЕНКА/ПОСМОТР ЗАДАНИЕ ПО ЧТЕНИЮ: New School Chemistry for Senior Secondary School by O.
Присоединяйтесь к обсуждению и выполняйте задание 3:1
Найдите вопросы в конце каждого урока. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 Радиус атомов, сродство к электрону, энергия ионизации, электроотрицательность.
Радиус атомов, сродство к электрону, энергия ионизации, электроотрицательность.