404 Cтраница не найдена
Мы используем файлы cookies для улучшения работы сайта МГТУ и большего удобства его использования. Более подробную информацию об использовании файлов cookies можно найти здесь. Продолжая пользоваться сайтом, вы подтверждаете, что были проинформированы об использовании файлов cookies сайтом ФГБОУ ВО “МГТУ” и согласны с нашими правилами обработки персональных данных.
Размер:
AAA
Изображения Вкл. Выкл.
Обычная версия сайта
К сожалению запрашиваемая страница не найдена.
Но вы можете воспользоваться поиском или картой сайта ниже
|
|
Принцип неопределенности Гейзенберга • Джеймс Трефил, энциклопедия «Двести законов мироздания»
Невозможно одновременно с точностью определить координаты и скорость квантовой частицы.
В обыденной жизни нас окружают материальные объекты, размеры которых сопоставимы с нами: машины, дома, песчинки и т. д. Наши интуитивные представления об устройстве мира формируются в результате повседневного наблюдения за поведением таких объектов. Поскольку все мы имеем за плечами прожитую жизнь, накопленный за ее годы опыт подсказывает нам, что раз всё наблюдаемое нами раз за разом ведет себя определенным образом, значит и во всей Вселенной, во всех масштабах материальные объекты должны вести себя аналогичным образом. И когда выясняется, что где-то что-то не подчиняется привычным правилам и противоречит нашим интуитивным понятиям о мире, нас это не просто удивляет, а шокирует.
В первой четверти ХХ века именно такова была реакция физиков, когда они стали исследовать поведение материи на атомном и субатомном уровнях. Появление и бурное развитие квантовой механики открыло перед нами целый мир, системное устройство которого попросту не укладывается в рамки здравого смысла и полностью противоречит нашим интуитивным представлениям. Но нужно помнить, что наша интуиция основана на опыте поведения обычных предметов соизмеримых с нами масштабов, а квантовая механика описывает вещи, которые происходят на микроскопическом и невидимом для нас уровне, — ни один человек никогда напрямую с ними не сталкивался. Если забыть об этом, мы неизбежно придем в состояние полного замешательства и недоумения. Для себя я сформулировал следующий подход к квантово-механическим эффектам: как только «внутренний голос» начинает твердить «такого не может быть!», нужно спросить себя: «А почему бы и нет? Откуда мне знать, как всё на самом деле устроено внутри атома? Разве я сам туда заглядывал?» Настроив себя подобным образом, вам будет проще воспринять статьи этой книги, посвященные квантовой механике.
Но нужно помнить, что наша интуиция основана на опыте поведения обычных предметов соизмеримых с нами масштабов, а квантовая механика описывает вещи, которые происходят на микроскопическом и невидимом для нас уровне, — ни один человек никогда напрямую с ними не сталкивался. Если забыть об этом, мы неизбежно придем в состояние полного замешательства и недоумения. Для себя я сформулировал следующий подход к квантово-механическим эффектам: как только «внутренний голос» начинает твердить «такого не может быть!», нужно спросить себя: «А почему бы и нет? Откуда мне знать, как всё на самом деле устроено внутри атома? Разве я сам туда заглядывал?» Настроив себя подобным образом, вам будет проще воспринять статьи этой книги, посвященные квантовой механике.
Принцип Гейзенберга вообще играет в квантовой механике ключевую роль хотя бы потому, что достаточно наглядно объясняет, как и почему микромир отличается от знакомого нам материального мира. Чтобы понять этот принцип, задумайтесь для начала о том, что значит «измерить» какую бы то ни было величину.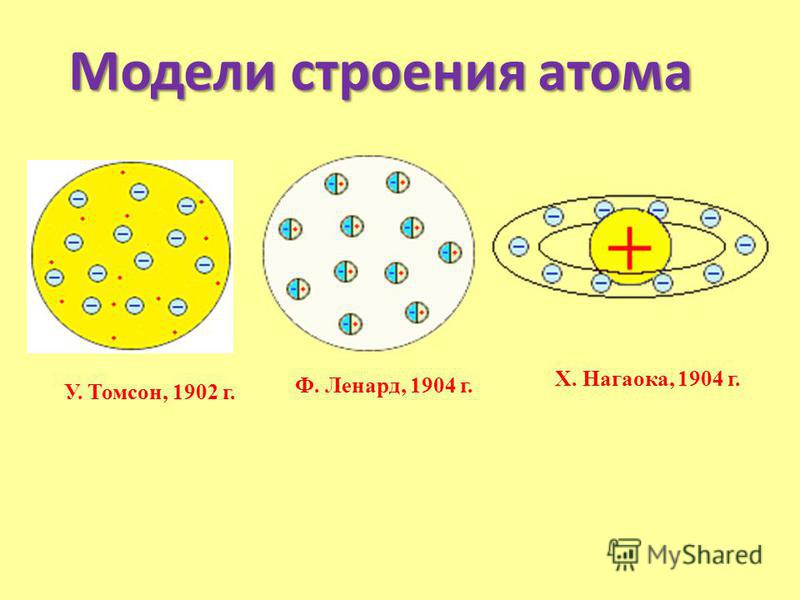 Чтобы отыскать, например, эту книгу, вы, войдя в комнату, окидываете ее взглядом, пока он не остановится на ней. На языке физики это означает, что вы провели визуальное измерение (нашли взглядом книгу) и получили результат — зафиксировали ее пространственные координаты (определили местоположение книги в комнате). На самом деле процесс измерения происходит гораздо сложнее: источник света (Солнце или лампа, например) испускает лучи, которые, пройдя некий путь в пространстве, взаимодействуют с книгой, отражаются от ее поверхности, после чего часть из них доходит до ваших глаз, проходя через хрусталик, фокусируется, попадает на сетчатку — и вы видите образ книги и определяете ее положение в пространстве. Ключ к измерению здесь — взаимодействие между светом и книгой. Так и при любом измерении, представьте себе, инструмент измерения (в данном случае, это свет) вступает во взаимодействие с объектом измерения (в данном случае, это книга).
Чтобы отыскать, например, эту книгу, вы, войдя в комнату, окидываете ее взглядом, пока он не остановится на ней. На языке физики это означает, что вы провели визуальное измерение (нашли взглядом книгу) и получили результат — зафиксировали ее пространственные координаты (определили местоположение книги в комнате). На самом деле процесс измерения происходит гораздо сложнее: источник света (Солнце или лампа, например) испускает лучи, которые, пройдя некий путь в пространстве, взаимодействуют с книгой, отражаются от ее поверхности, после чего часть из них доходит до ваших глаз, проходя через хрусталик, фокусируется, попадает на сетчатку — и вы видите образ книги и определяете ее положение в пространстве. Ключ к измерению здесь — взаимодействие между светом и книгой. Так и при любом измерении, представьте себе, инструмент измерения (в данном случае, это свет) вступает во взаимодействие с объектом измерения (в данном случае, это книга).
В классической физике, построенной на ньютоновских принципах и применимой к объектам нашего обычного мира, мы привыкли игнорировать тот факт, что инструмент измерения, вступая во взаимодействие с объектом измерения, воздействует на него и изменяет его свойства, включая, собственно, измеряемые величины. Включая свет в комнате, чтобы найти книгу, вы даже не задумываетесь о том, что под воздействием возникшего давления световых лучей книга может сдвинуться со своего места, и вы узнаете ее искаженные под влиянием включенного вами света пространственные координаты. Интуиция подсказывает нам (и, в данном случае, совершенно правильно), что акт измерения не влияет на измеряемые свойства объекта измерения. А теперь задумайтесь о процессах, происходящих на субатомном уровне. Допустим, мне нужно зафиксировать пространственное местонахождение электрона. Мне по-прежнему нужен измерительный инструмент, который вступит во взаимодействие с электроном и возвратит моим детекторам сигнал с информацией о его местопребывании. И тут же возникает сложность: иных инструментов взаимодействия с электроном для определения его положения в пространстве, кроме других элементарных частиц, у меня нет. И, если предположение о том, что свет, вступая во взаимодействие с книгой, на ее пространственных координатах не сказывается, относительно взаимодействия измеряемого электрона с другим электроном или фотонами такого сказать нельзя.
Включая свет в комнате, чтобы найти книгу, вы даже не задумываетесь о том, что под воздействием возникшего давления световых лучей книга может сдвинуться со своего места, и вы узнаете ее искаженные под влиянием включенного вами света пространственные координаты. Интуиция подсказывает нам (и, в данном случае, совершенно правильно), что акт измерения не влияет на измеряемые свойства объекта измерения. А теперь задумайтесь о процессах, происходящих на субатомном уровне. Допустим, мне нужно зафиксировать пространственное местонахождение электрона. Мне по-прежнему нужен измерительный инструмент, который вступит во взаимодействие с электроном и возвратит моим детекторам сигнал с информацией о его местопребывании. И тут же возникает сложность: иных инструментов взаимодействия с электроном для определения его положения в пространстве, кроме других элементарных частиц, у меня нет. И, если предположение о том, что свет, вступая во взаимодействие с книгой, на ее пространственных координатах не сказывается, относительно взаимодействия измеряемого электрона с другим электроном или фотонами такого сказать нельзя.
В начале 1920-х годов, когда произошел бурный всплеск творческой мысли, приведший к созданию квантовой механики, эту проблему первым осознал молодой немецкий физик-теоретик Вернер Гейзенберг. Начав со сложных математических формул, описывающих мир на субатомном уровне, он постепенно пришел к удивительной по простоте формуле, дающий общее описание эффекта воздействия инструментов измерения на измеряемые объекты микромира, о котором мы только что говорили. В результате им был сформулирован принцип неопределенности, названный теперь его именем:
неопределенность значения координаты x неопределенность скорости > h/m,
математическое выражение которого называется соотношением неопределенностей Гейзенберга:
Δx х Δv > h/m
где Δx — неопределенность (погрешность измерения) пространственной координаты микрочастицы, Δv — неопределенность скорости частицы, m — масса частицы, а h — постоянная Планка, названная так в честь немецкого физика Макса Планка, еще одного из основоположников квантовой механики. Постоянная Планка равняется примерно 6,626 x 10–34 Дж·с, то есть содержит 33 нуля до первой значимой цифры после запятой.
Постоянная Планка равняется примерно 6,626 x 10–34 Дж·с, то есть содержит 33 нуля до первой значимой цифры после запятой.
Термин «неопределенность пространственной координаты» как раз и означает, что мы не знаем точного местоположения частицы. Например, если вы используете глобальную систему рекогносцировки GPS, чтобы определить местоположение этой книги, система вычислит их с точностью до 2-3 метров. (GPS, Global Positioning System — навигационная система, в которой задействованы 24 искусственных спутника Земли. Если у вас, например, на автомобиле установлен приемник GPS, то, принимая сигналы от этих спутников и сопоставляя время их задержки, система определяет ваши географические координаты на Земле с точностью до угловой секунды.) Однако, с точки зрения измерения, проведенного инструментом GPS, книга может с некоторой вероятностью находиться где угодно в пределах указанных системой нескольких квадратных метров. В таком случае мы и говорим о неопределенности пространственных координат объекта (в данном примере, книги).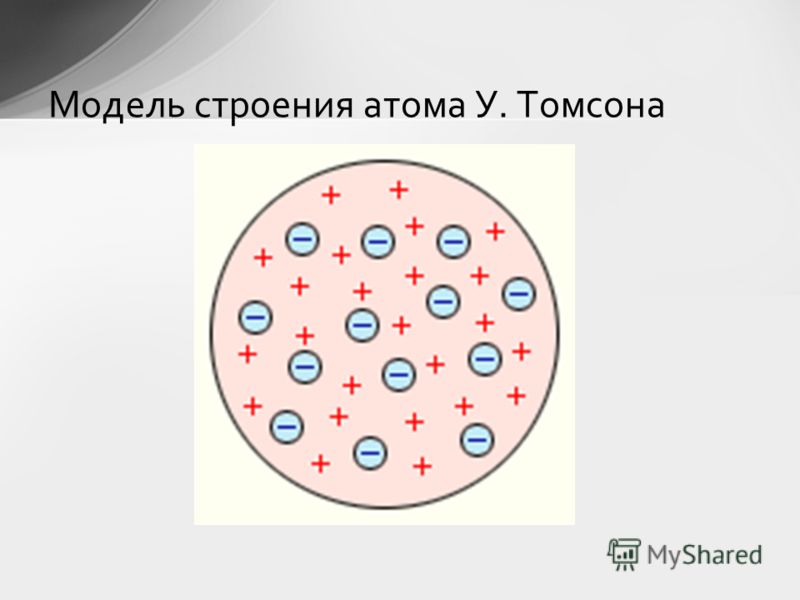 Ситуацию можно улучшить, если взять вместо GPS рулетку — в этом случае мы сможем утверждать, что книга находится, например, в 4 м 11 см от одной стены и в 1м 44 см от другой. Но и здесь мы ограничены в точности измерения минимальным делением шкалы рулетки (пусть это будет даже миллиметр) и погрешностями измерения и самого прибора, — и в самом лучшем случае нам удастся определить пространственное положение объекта с точностью до минимального деления шкалы. Чем более точный прибор мы будем использовать, тем точнее будут полученные нами результаты, тем ниже будет погрешность измерения и тем меньше будет неопределенность. В принципе, в нашем обыденном мире свести неопределенность к нулю и определить точные координаты книги можно.
Ситуацию можно улучшить, если взять вместо GPS рулетку — в этом случае мы сможем утверждать, что книга находится, например, в 4 м 11 см от одной стены и в 1м 44 см от другой. Но и здесь мы ограничены в точности измерения минимальным делением шкалы рулетки (пусть это будет даже миллиметр) и погрешностями измерения и самого прибора, — и в самом лучшем случае нам удастся определить пространственное положение объекта с точностью до минимального деления шкалы. Чем более точный прибор мы будем использовать, тем точнее будут полученные нами результаты, тем ниже будет погрешность измерения и тем меньше будет неопределенность. В принципе, в нашем обыденном мире свести неопределенность к нулю и определить точные координаты книги можно.
И тут мы подходим к самому принципиальному отличию микромира от нашего повседневного физического мира. В обычном мире, измеряя положение и скорость тела в пространстве, мы на него практически не воздействуем. Таким образом, в идеале мы можем одновременно измерить и скорость, и координаты объекта абсолютно точно (иными словами, с нулевой неопределенностью).
В мире квантовых явлений, однако, любое измерение воздействует на систему. Сам факт проведения нами измерения, например, местоположения частицы, приводит к изменению ее скорости, причем непредсказуемому (и наоборот). Вот почему в правой части соотношения Гейзенберга стоит не нулевая, а положительная величина. Чем меньше неопределенность в отношении одной переменной (например, Δx), тем более неопределенной становится другая переменная (Δv), поскольку произведение двух погрешностей в левой части соотношения не может быть меньше константы в правой его части. На самом деле, если нам удастся с нулевой погрешностью (абсолютно точно) определить одну из измеряемых величин, неопределенность другой величины будет равняться бесконечности, и о ней мы не будем знать вообще ничего. Иными словами, если бы нам удалось абсолютно точно установить координаты квантовой частицы, о ее скорости мы не имели бы ни малейшего представления; если бы нам удалось точно зафиксировать скорость частицы, мы бы понятия не имели, где она находится. На практике, конечно, физикам-экспериментаторам всегда приходится искать какой-то компромисс между двумя этими крайностями и подбирать методы измерения, позволяющие с разумной погрешностью судить и о скорости, и о пространственном положении частиц.
На практике, конечно, физикам-экспериментаторам всегда приходится искать какой-то компромисс между двумя этими крайностями и подбирать методы измерения, позволяющие с разумной погрешностью судить и о скорости, и о пространственном положении частиц.
На самом деле, принцип неопределенности связывает не только пространственные координаты и скорость — на этом примере он просто проявляется нагляднее всего; в равной мере неопределенность связывает и другие пары взаимно увязанных характеристик микрочастиц. Путем аналогичных рассуждений мы приходим к выводу о невозможности безошибочно измерить энергию квантовой системы и определить момент времени, в который она обладает этой энергией. То есть, если мы проводим измерение состояния квантовой системы на предмет определения ее энергии, это измерение займет некоторый отрезок времени — назовем его Δt. За этот промежуток времени энергия системы случайным образом меняется — происходят ее флуктуация, — и выявить ее мы не можем. Обозначим погрешность измерения энергии ΔЕ. Путем рассуждений, аналогичных вышеприведенным, мы придем к аналогичному соотношению для ΔЕ и неопределенности времени, которым квантовая частица этой энергией обладала:
Путем рассуждений, аналогичных вышеприведенным, мы придем к аналогичному соотношению для ΔЕ и неопределенности времени, которым квантовая частица этой энергией обладала:
ΔЕΔt > h
Относительно принципа неопределенности нужно сделать еще два важных замечания:
он не подразумевает, что какую-либо одну из двух характеристик частицы — пространственное местоположение или скорость — нельзя измерить сколь угодно точно;
принцип неопределенности действует объективно и не зависит от присутствия разумного субъекта, проводящего измерения.
Иногда вам могут встретиться утверждения, будто принцип неопределенности подразумевает, что у квантовых частиц отсутствуют определенные пространственные координаты и скорости, или что эти величины абсолютно непознаваемы. Не верьте: как мы только что видели, принцип неопределенности не мешает нам с любой желаемой точностью измерить каждую из этих величин. Он утверждает лишь, что мы не в состоянии достоверно узнать и то, и другое одновременно. И, как и во многом другом, мы вынуждены идти на компромисс. Опять же, писатели-антропософы из числа сторонников концепции «Новой эры» иногда утверждают, что, якобы, поскольку измерения подразумевают присутствие разумного наблюдателя, то, значит, на некоем фундаментальном уровне человеческое сознание связано с Вселенским разумом, и именно эта связь обусловливает принцип неопределенности. Повторим по этому поводу еще раз: ключевым в соотношении Гейзенберга является взаимодействие между частицей-объектом измерения и инструментом измерения, влияющим на его результаты. А тот факт, что при этом присутствует разумный наблюдатель в лице ученого, отношения к делу не имеет; инструмент измерения в любом случае влияет на его результаты, присутствует при этом разумное существо или нет.
И, как и во многом другом, мы вынуждены идти на компромисс. Опять же, писатели-антропософы из числа сторонников концепции «Новой эры» иногда утверждают, что, якобы, поскольку измерения подразумевают присутствие разумного наблюдателя, то, значит, на некоем фундаментальном уровне человеческое сознание связано с Вселенским разумом, и именно эта связь обусловливает принцип неопределенности. Повторим по этому поводу еще раз: ключевым в соотношении Гейзенберга является взаимодействие между частицей-объектом измерения и инструментом измерения, влияющим на его результаты. А тот факт, что при этом присутствует разумный наблюдатель в лице ученого, отношения к делу не имеет; инструмент измерения в любом случае влияет на его результаты, присутствует при этом разумное существо или нет.
Копаться в атомных моделях | Science News Learning
Цель: Учащиеся будут работать в группах, чтобы исследовать, создавать и представлять различные модели атома, которые показывают эволюцию понимания физиками структуры атома. Класс также узнает о стандартной модели физики элементарных частиц и проведет мозговой штурм, как ее можно показать в двух или трех измерениях.
Класс также узнает о стандартной модели физики элементарных частиц и проведет мозговой штурм, как ее можно показать в двух или трех измерениях.
Обзор процедур: Это занятие рассчитано на три академических часа и включает два домашних задания. Для подготовки к первому занятию студенты будут читать онлайн Science News статью «Как скрытая сложность материи высвободила силу ядерной физики» и ответьте на три вопроса в качестве домашнего задания.
На первом занятии учащиеся будут работать в группах над исследованием классической модели атома и приступить к подготовке презентации о ней. В качестве домашнего задания учащиеся могут работать со своими группами или индивидуально, чтобы создать двухмерную или трехмерную физическую модель классической модели своей группы. Во время второго занятия группы могут завершить работу над своими физическими моделями и выступить с презентациями перед остальной частью класса.
На заключительном занятии учителя обсудят стандартную модель физики элементарных частиц и предложат учащимся провести мозговой штурм, чтобы создать ее двухмерную или трехмерную интерпретацию. Для развития своих идей класс должен опираться на современные научные знания и использовать такие ресурсы, как CERN: Стандартная модель.
Для развития своих идей класс должен опираться на современные научные знания и использовать такие ресурсы, как CERN: Стандартная модель.
Приблизительное время занятий: 3 урока
Хотите провести виртуальный урок? Это задание можно проводить удаленно с помощью программного обеспечения для совещаний, которое позволяет собрать весь класс, а также разделить учащихся на группы.
Расходные материалы:
Бумага
Карандаши
Различные строительные материалы (например, бобы, леденцы, ватные шарики, ершики для труб, упаковочные материалы, пряжа, теннисные мячи, бейсбольные мячи, мешочки и другие предметы, которые можно найти в дома или в школе)
Доступ в Интернет
Рабочий лист «Изучаем атомные модели»
Проектор (по желанию)
Белая доска (по желанию)
Инструкции для учителей:
Установка
Перед первым занятием по этому заданию попросите учащихся прочитать онлайн-статью Science News «Как скрытая сложность материи высвободила силу ядерной физики» и ответить на первый набор вопросов в рабочем листе для учащихся. для домашней работы. Версия истории «Расщепление атома» опубликована в выпуске Science News от 10 апреля 2021 года.
для домашней работы. Версия истории «Расщепление атома» опубликована в выпуске Science News от 10 апреля 2021 года.
1. Что такое атом и почему нас волнует его строение?
Атомы составляют материю; они являются строительными блоками химии. Основными компонентами атомов являются протоны, нейтроны и электроны. Зная, сколько протонов, нейтронов и электронов имеет тот или иной атом, вы узнаете, что это за химический элемент и как он будет вести себя с атомами разных элементов. Атомная структура помогает ученым понять и предсказать свойства материи.
2. Почему со временем изменилась модель атома?
Когда ученые проводят эксперименты и делают открытия, они меняют свои модели, чтобы отражать новые знания.
3. Каковы некоторые практические последствия знания структуры атома?
Ответы будут разными. Учащиеся могут отметить, что знание структуры атомов может помочь ученым определить, как химические вещества будут реагировать друг с другом. Например, химики могут предсказать точки плавления и замерзания химических веществ, которые они создают, если им известны структуры их исходных молекул. Знание структуры атомов также помогает в разработке лекарств и материалов, таких как те, которые используются в оборудовании для мониторинга окружающей среды и солнечных панелях.
Например, химики могут предсказать точки плавления и замерзания химических веществ, которые они создают, если им известны структуры их исходных молекул. Знание структуры атомов также помогает в разработке лекарств и материалов, таких как те, которые используются в оборудовании для мониторинга окружающей среды и солнечных панелях.
Первый класс
После просмотра ответов на домашнее задание разделите учащихся на группы. Назначьте каждой группе одну из классических моделей — Дальтона, Томсона, Резерфорда, Бора и Шрёдингера.
Группы будут работать в классе и, при необходимости, дома, исследовать и готовить 5-7-минутные презентации о своих моделях, которые будут представлены на следующем занятии. Каждая презентация должна включать описание внешнего вида модели, информацию об ученых, разработавших модель, и о том, что было известно об атомах на момент разработки модели. Группы должны построить физические представления назначенных им моделей, чтобы использовать их в своих презентациях. Креативность приветствуется, но учащиеся все равно должны стремиться к точности. В качестве альтернативы вы можете поручить построение моделей учащимся индивидуально. Когда учащиеся приносят свои модели в класс, каждая группа может собраться вместе, чтобы извлечь уроки из попытки каждого участника и предложить лучшую модель или модели для своей презентации.
Креативность приветствуется, но учащиеся все равно должны стремиться к точности. В качестве альтернативы вы можете поручить построение моделей учащимся индивидуально. Когда учащиеся приносят свои модели в класс, каждая группа может собраться вместе, чтобы извлечь уроки из попытки каждого участника и предложить лучшую модель или модели для своей презентации.
Пока учащиеся готовят свои презентации и моделируют, попросите группы ответить на следующие вопросы. Вы можете использовать вопросы для оценки презентаций.
1. Какие другие названия использовались для описания назначенной вам модели и почему модель получила именно такое название?
Ответы будут различаться в зависимости от модели с присвоенным номером . Модель T he Дальтон называется моделью бильярдного шара или моделью твердой сферы. Дальтон представлял атомы твердыми сферами, которые нельзя разбить на более мелкие части. Модель Томсона известна как модель сливового пудинга. Он думал, что электроны усеяны «морем положительного заряда» 9. 0010 — что-то вроде слив в английском сливовом пудинге. Модели Резерфорда и Бора называются планетарными моделями, потому что в обеих моделях электроны вращаются вокруг ядра атома подобно тому, как планеты вращаются вокруг звезды. Модель Шредингера известна как квантово-механическая модель, потому что она включает неопределенность, присущую квантовой механике. Шредингер использовал математику, чтобы предсказать вероятное расположение электронов в атомах.
0010 — что-то вроде слив в английском сливовом пудинге. Модели Резерфорда и Бора называются планетарными моделями, потому что в обеих моделях электроны вращаются вокруг ядра атома подобно тому, как планеты вращаются вокруг звезды. Модель Шредингера известна как квантово-механическая модель, потому что она включает неопределенность, присущую квантовой механике. Шредингер использовал математику, чтобы предсказать вероятное расположение электронов в атомах.
2. Когда была разработана закрепленная за вами модель?
Ответы зависят от назначенной модели. Модель Дальтона была предложена в 1803 г., модель Томса on — в 1904 г., модель Резерфорда — в 1911 г., модель Бора — в 1913 г., а модель Шредингера — в 1926 г.
3. Хотя каждая классическая модель названа в честь ученого, который ее предложил, эти ученые либо работали с другими учеными, либо находились под их влиянием. Назовите некоторых влиятельных лиц.
Ответы зависят от назначенной модели. Дальтон частично основывал свою модель на работах Антуана Лавуазье и Жозефа Пруста. Модель Томсона названа в честь сэра Дж. Дж. Томсона, открывшего электрон. Физик по имени Джордж Джонстон Стоуни предположил существование электронов в 1874 году. Модель Резерфорда была получена из работы, которую Эрнест Резерфорд выполнил со своими коллегами Гансом Гейгером и Эрнестом Марсденом. Нильс Бор, в честь которого названа модель Бора, находился под влиянием работ Альберта Эйнштейна, Макса Планка, Вольфганга Паули и других. Эрвин Шредингер находился под влиянием работ Луи де Бройля, Вернера Гейзенберга и других физиков.
Дальтон частично основывал свою модель на работах Антуана Лавуазье и Жозефа Пруста. Модель Томсона названа в честь сэра Дж. Дж. Томсона, открывшего электрон. Физик по имени Джордж Джонстон Стоуни предположил существование электронов в 1874 году. Модель Резерфорда была получена из работы, которую Эрнест Резерфорд выполнил со своими коллегами Гансом Гейгером и Эрнестом Марсденом. Нильс Бор, в честь которого названа модель Бора, находился под влиянием работ Альберта Эйнштейна, Макса Планка, Вольфганга Паули и других. Эрвин Шредингер находился под влиянием работ Луи де Бройля, Вернера Гейзенберга и других физиков.
4. Какие открытия или новые данные привели к разработке этой модели?
Ответы будут различаться в зависимости от назначенной модели. Например, модель Томсона была разработана после открытия электрона, а модель Резерфорда была создана после того, как эксперимент дал результаты, противоречащие модели Томсона. Резерфорд и его коллеги направили альфа-частицы на кусок золотой фольги и обнаружили, что некоторые из частиц отскакивают от фольги, а не проходят прямо через нее, как предсказывает модель Томсона. Открытие привело Резерфорда к пониманию того, что ядро атома должно состоять из положительно заряженных частиц.
Открытие привело Резерфорда к пониманию того, что ядро атома должно состоять из положительно заряженных частиц.
5. Чем модель, которую вам назначили, отличается от предыдущих моделей?
Ответы будут различаться в зависимости от назначенной модели. Например, модель Бора включала в себя знание о том, что электроны имеют тенденцию занимать определенные дискретные энергетические уровни, в то время как модель Резерфорда предполагала, что все электроны имеют одинаковый энергетический потенциал. Это было передано тем, что электроны, по-видимому, вращаются вокруг ядра по кольцам, подобным планетам вокруг Солнца, а не по эллиптическим орбитам одинакового размера вокруг ядра, как это было в модели Резерфорда.
6. Есть ли места, где ваша назначенная модель все еще используется, и где вы видели ее раньше?
Вы все еще можете увидеть влияние модели Дальтона в изображениях молекул. Атомы, из которых состоит молекула, показаны сплошными кругами или сферами, связанными вместе.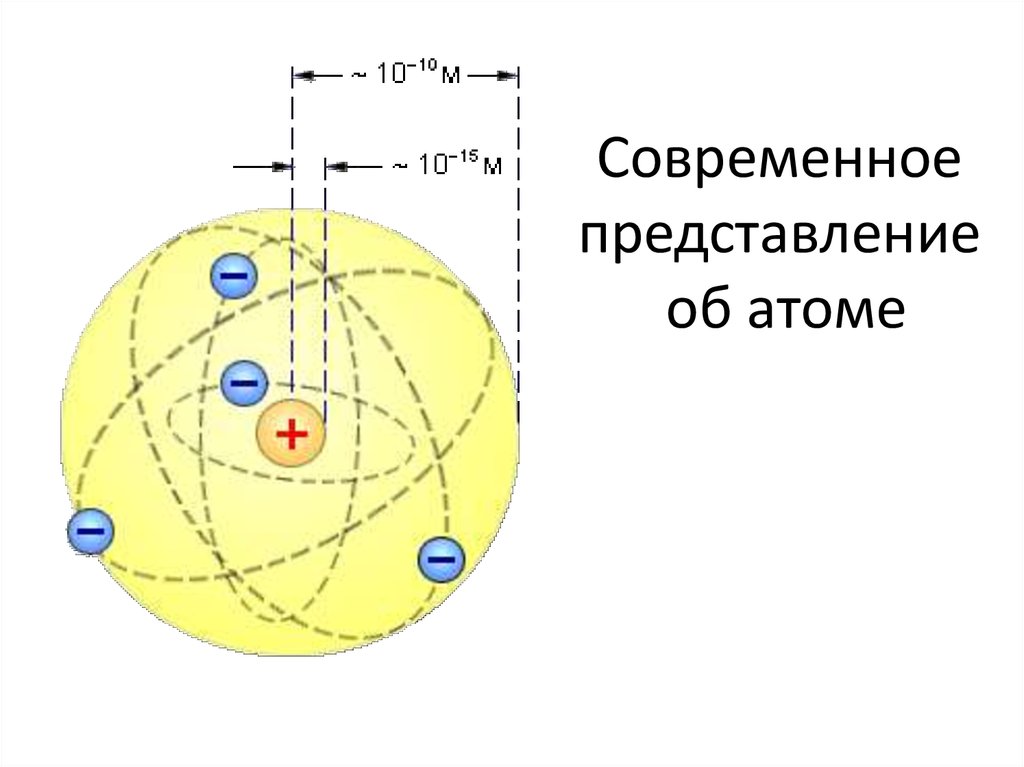 В наши дни модель Томсона не часто упоминается. Модель Резерфорда обычно используется в популярных СМИ. Модель Бора часто используется для обучения студентов электронным оболочкам. Учащиеся могут изучить основы модели Шрёдингера, когда на занятиях будут говорить о квантовых числах.
В наши дни модель Томсона не часто упоминается. Модель Резерфорда обычно используется в популярных СМИ. Модель Бора часто используется для обучения студентов электронным оболочкам. Учащиеся могут изучить основы модели Шрёдингера, когда на занятиях будут говорить о квантовых числах.
Второй класс
В начале второго класса группы должны завершить свои презентации и модели. Пока учащиеся работают, вы можете прогуляться, чтобы оценить модели и дать рекомендации. Если в группе есть несколько хороших моделей, сделанных отдельными людьми, вы можете помочь учащимся выяснить, какие компоненты из разных моделей использовать для создания улучшенной групповой модели.
Презентации должны проводиться в том порядке, в котором модели были разработаны в течение 19ом и 20 веками. Выполнение презентаций в хронологическом порядке поможет учащимся лучше понять, как продвинулась область.
Третий класс
В третьем классе познакомьте учащихся со стандартной моделью физики элементарных частиц и современной наукой, которая ее поддерживает. Если вам нужна дополнительная информация для подготовки к этому уроку, перейдите в ЦЕРН: Стандартная модель и объяснение Министерства энергетики… Стандартная модель физики элементарных частиц.
Если вам нужна дополнительная информация для подготовки к этому уроку, перейдите в ЦЕРН: Стандартная модель и объяснение Министерства энергетики… Стандартная модель физики элементарных частиц.
Предложите классу провести мозговой штурм, чтобы визуализировать стандартную модель. Студенты могут использовать бумагу, компьютер с доступом в Интернет и доску для проведения мозгового штурма.
Обсудите следующие вопросы в ходе обсуждения.
1. Что такое стандартная модель физики элементарных частиц? Что нужно знать о стандартной модели?
Стандартная модель — это хорошо зарекомендовавшая себя теория в физике элементарных частиц, которая описывает элементарные частицы (также называемые фундаментальными частицами) и объясняет, как эти частицы ведут себя. Модель учитывает три взаимодействия в природе: электромагнетизм, сильное ядерное взаимодействие и слабое ядерное взаимодействие. Элементарные частицы, называемые кварками, составляют протоны и нейтроны в ядре атома. Электроны — это своего рода лептон, еще один тип элементарных частиц. Существуют элементарные частицы, переносящие взаимодействие, называемые бозонами, которые позволяют другим частицам взаимодействовать. Например, бозон, называемый глюоном, передает сильное ядерное взаимодействие, которое удерживает кварки в протонах и нейтронах «склеенными» вместе. Известно 17 элементарных частиц.
Электроны — это своего рода лептон, еще один тип элементарных частиц. Существуют элементарные частицы, переносящие взаимодействие, называемые бозонами, которые позволяют другим частицам взаимодействовать. Например, бозон, называемый глюоном, передает сильное ядерное взаимодействие, которое удерживает кварки в протонах и нейтронах «склеенными» вместе. Известно 17 элементарных частиц.
2. Чем антиматерия отличается от материи? Приведите пример каждого.
Многие элементарные частицы имеют аналог из антиматерии. Эти аналоги имеют ту же массу, но противоположный заряд. Например, аналогом электрона в антивеществе является позитрон. Электрон имеет отрицательный заряд, а позитрон — положительный. Одна из загадочных вещей, связанных с материей и антиматерией, заключается в том, что они не присутствуют во Вселенной в равных количествах. Физики пытаются понять, почему материи намного больше, чем антиматерии.
3. Кто разработал стандартную модель физики элементарных частиц?
Стандартная модель физики элементарных частиц не была работой одного ученого. Многие физики, исследующие структуру и взаимодействие субатомных частиц, проделали экспериментальную и теоретическую работу, которая сделала возможной стандартную модель. Известные участники включают Джеймса Чедвика, Пола Дирака, Карла Андерсона, Энрико Ферми, Питера Хиггса и Шелдона Глэшоу.
Многие физики, исследующие структуру и взаимодействие субатомных частиц, проделали экспериментальную и теоретическую работу, которая сделала возможной стандартную модель. Известные участники включают Джеймса Чедвика, Пола Дирака, Карла Андерсона, Энрико Ферми, Питера Хиггса и Шелдона Глэшоу.
4. Когда была разработана стандартная модель?
С 1930-х годов физики начали находить больше субатомных частиц. Они хотели понять, какое отношение частицы имеют друг к другу, и определить, какие из них являются фундаментальными (или элементарными) частицами. Используя математику, теоретическую и экспериментальную работу, физики смогли к середине 1970-х годов установить стандартную модель физики элементарных частиц в качестве теории. С тех пор было обнаружено больше элементарных частиц, предсказанных теорией. Самый последний был в 2012 году. Он называется бозоном Хиггса.
5. Существуют ли другие распространенные названия стандартной модели?
Не совсем так.
6. Какие открытия или идеи способствовали созданию стандартной модели?
Работа многих ученых способствовала созданию стандартной модели. Вот несколько примеров. Чедвик открыл нейтрон, который помог объяснить изотопы и вырвал физику из двухчастичной модели атомов, состоящих только из электронов и протонов. Ферми выдвинул идею о том, что бета-распад, распад нейтрона на протон внутри атома, породил электрон и другую частицу, теперь называемую антинейтрино. Ферми также открыл множество субатомных частиц, используя сначала естественные космические лучи, а затем ускорители частиц. Хиггс и другие независимо друг от друга разработали теорию того, как частицы приобретают массу в 1960-е годы; их теория была подтверждена в 2012 году открытием бозона Хиггса, последней из обнаруженных элементарных частиц.
7. Чем стандартная модель отличается от изученных вами классических моделей?
Стандартная модель физики элементарных частиц намного сложнее предшествующих ей атомных моделей. Даже самые сложные классические модели включали всего три компонента: электроны, протоны и нейтроны. Стандартная модель состоит из 17 элементарных частиц, большинство из которых, вероятно, не представлялись предыдущими поколениями ученых. Стандартная модель учитывает материю и антиматерию и содержит частицы, передающие силы внутри атомов.
Даже самые сложные классические модели включали всего три компонента: электроны, протоны и нейтроны. Стандартная модель состоит из 17 элементарных частиц, большинство из которых, вероятно, не представлялись предыдущими поколениями ученых. Стандартная модель учитывает материю и антиматерию и содержит частицы, передающие силы внутри атомов.
8. Каковы недостатки стандартной модели?
Стандартная модель не учитывает гравитацию, четвертую силу природы, и не дает ответа, почему материи во Вселенной больше, чем антиматерии. Модель также не объясняет темную материю, неопознанный, невидимый тип материи во Вселенной. Темная материя, по-видимому, слабо взаимодействует со всей обычной материей, за исключением гравитации.
9. Какие визуальные изображения стандартной модели вы видели и что вы о них думаете?
Ответы учащихся могут различаться. Визуальные представления встречаются редко. Чаще всего стандартная модель представлена в виде «периодической таблицы» элементарных частиц без упоминания о том, как они объединяются для создания электронов, нейтронов и протонов ( CERN: Стандартная модель).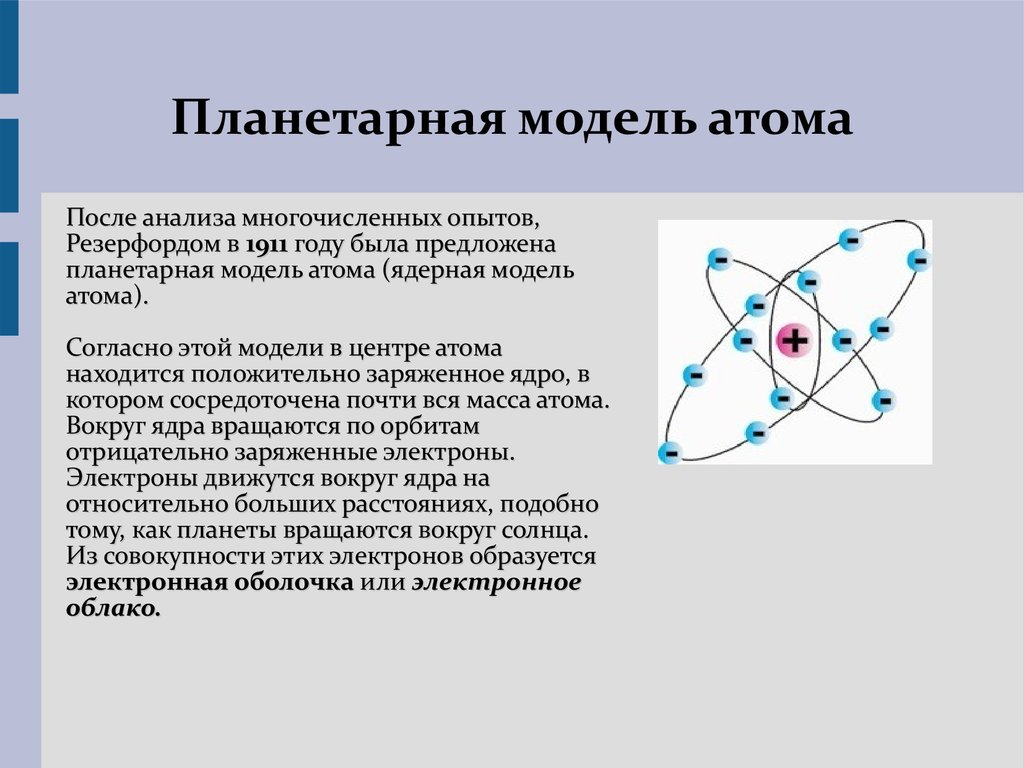 На веб-сайте Министерства энергетики США используется рисунок, на котором бозон Хиггса помещен в центр, окруженный кольцом бозонов с лептонами и кварками во внешнем кольце (DOE объясняет… Стандартную модель физики элементарных частиц).
На веб-сайте Министерства энергетики США используется рисунок, на котором бозон Хиггса помещен в центр, окруженный кольцом бозонов с лептонами и кварками во внешнем кольце (DOE объясняет… Стандартную модель физики элементарных частиц).
10. Если бы вы делали двухмерную или трехмерную визуализацию стандартной модели, включили бы вы все известные элементарные частицы? Почему или почему нет?
Ответы учеников могут быть разными. Например, студент может сказать, что было бы слишком сложно использовать все элементарные частицы в трехмерной визуализации стандартной модели. Это было бы похоже на попытку сделать трехмерную версию периодической таблицы. Кроме того, многие из этих частиц быстро исчезают, поэтому изобразить их было бы особенно сложно. Вместо этого учащийся может сказать, что сосредоточится на нескольких элементарных частицах.
11. Опишите, как бы вы изобразили стандартную модель.
Ответы учеников могут быть разными. Пример ответа приведен ниже:
В моем описании я хочу сосредоточиться на основном атоме. Я думаю, важно знать, что протоны состоят из 2 верхних кварков и одного нижнего кварка, а нейтроны состоят из одного верхнего и двух нижних кварков. В своей трехмерной визуализации я бы использовал звездообразования (в их оболочках) для представления кварков. Верхний кварк был бы желтым; нижний кварк был бы красным. У протона будет по одной желтой звездной вспышке (верхний кварк) на каждом конце, а красная (нижний кварк) будет посередине. Нейтроны будут показаны красными звездочками (нижние кварки) на концах и желтыми (верхними кварками). Я бы использовал клей с блестками, чтобы скрепить свои «протоны» и «нейтроны». Клей представляет собой глюон , бозон, удерживающий частицы вместе. Я буду использовать крошечные пакеты с застежкой-молнией для хранения своих «атомных ядер». Мешок может представлять собой электроны вокруг каждого «атомного ядра».
Я думаю, важно знать, что протоны состоят из 2 верхних кварков и одного нижнего кварка, а нейтроны состоят из одного верхнего и двух нижних кварков. В своей трехмерной визуализации я бы использовал звездообразования (в их оболочках) для представления кварков. Верхний кварк был бы желтым; нижний кварк был бы красным. У протона будет по одной желтой звездной вспышке (верхний кварк) на каждом конце, а красная (нижний кварк) будет посередине. Нейтроны будут показаны красными звездочками (нижние кварки) на концах и желтыми (верхними кварками). Я бы использовал клей с блестками, чтобы скрепить свои «протоны» и «нейтроны». Клей представляет собой глюон , бозон, удерживающий частицы вместе. Я буду использовать крошечные пакеты с застежкой-молнией для хранения своих «атомных ядер». Мешок может представлять собой электроны вокруг каждого «атомного ядра».
Чтобы передать идею антикварков и позитронов, я бы снова использовал желтые и красные звезды и крошечные мешочки, но все было бы помечено буквой «А», чтобы люди знали, что они представляют собой антивещество. Чтобы донести идею о том, что во Вселенной гораздо меньше антиматерии, чем материи, я бы положил свои антиатомы в литровый пакет с застежкой-молнией, а атомы — в мешок для мусора. Две сумки будут связаны лентой или веревкой, чтобы люди, увидевшие мою модель, знали, что между ними есть связь. Разница в масштабе двух мешков является визуальным напоминанием о том, что материя встречается чаще, чем антиматерия.
Чтобы донести идею о том, что во Вселенной гораздо меньше антиматерии, чем материи, я бы положил свои антиатомы в литровый пакет с застежкой-молнией, а атомы — в мешок для мусора. Две сумки будут связаны лентой или веревкой, чтобы люди, увидевшие мою модель, знали, что между ними есть связь. Разница в масштабе двух мешков является визуальным напоминанием о том, что материя встречается чаще, чем антиматерия.
12. Как бы вы описали взаимодействие между различными элементарными частицами?
Ответы учеников могут быть разными. Например, учащийся может сказать, что, по его мнению, взаимодействия нельзя показать в физической модели, потому что эти взаимодействия происходят очень быстро, а некоторые элементарные частицы существуют недолго. Учащийся может предложить вместо этого объяснить концепции, охватываемые стандартной моделью, в анимационном фильме .
Дополнительные ресурсы
CERN: Стандартная модель
PBS LearningMedia: Atomic Structure
Institute of Physics: The Standard Model
Stanford ATLAS: Introduction to Particle Physics
Berkeley Lab: The Particle AdventureПять тайн, которые Стандартная модель не может объяснить
Новости науки
Как скрытая сложность материи высвободила силу ядерной физикиЧитаемость: 11,1
- Физические науки: HS-PS1 Matter and its Interactions
Подпишитесь, если вы заинтересованы в получении бесплатных журналов Science News , а также ресурсов для преподавателей в следующем учебном году.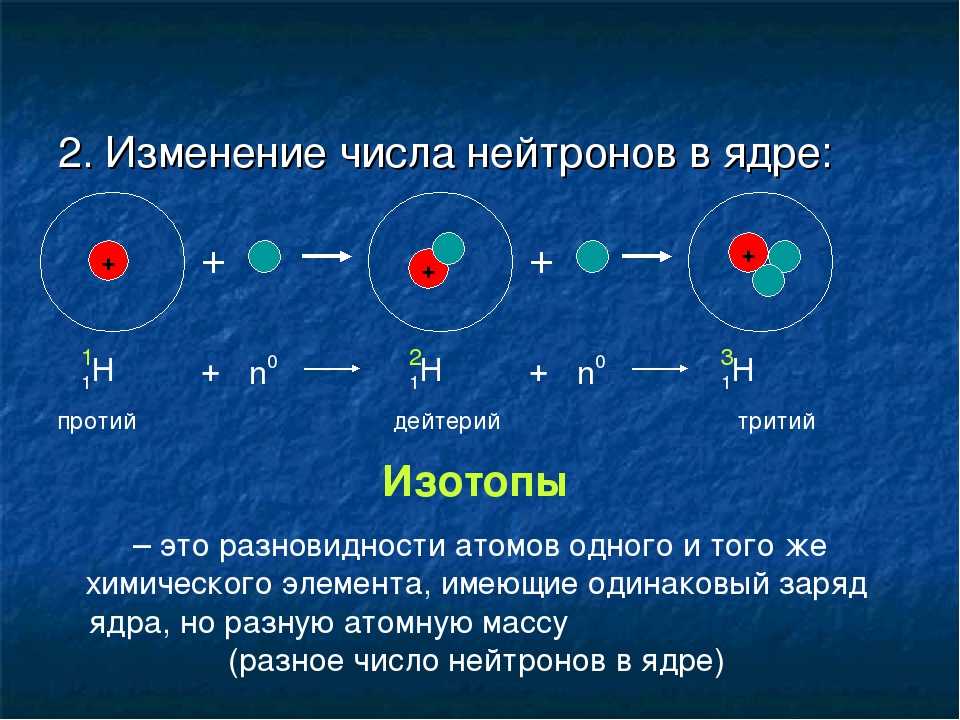 Программа Общества науки по изучению научных новостей обслуживает почти 5000 государственных средних школ в Соединенных Штатах и во всем мире.
Программа Общества науки по изучению научных новостей обслуживает почти 5000 государственных средних школ в Соединенных Штатах и во всем мире.
Подробнее
Глава 1 – Элементы и атомы – БИО 140 – Биология человека I – Учебник
Глава 1Элементы и атомы: строительные блоки материи
OpenStax, Элементы и атомы: строительные блоки материи. OpenStax CNX. 3 октября 2013 г. http://cnx.org/contents/b82d4112-06e7-42bb-bd70-4e83cdfe5df0@4. © 3 октября 2013 г. OpenStax. Контент учебников, созданный OpenStax, находится под лицензией Creative Commons Attribution License 3.0.
К концу этого раздела вы сможете:
- Обсуждать отношения между материей, массой, элементами, соединениями, атомами и субатомными частицами
- Различие между атомным номером и массовым числом
- Определите ключевое различие между изотопами одного и того же элемента
- Объясните, как электроны занимают электронные оболочки и их вклад в относительную стабильность атома
Субстанция Вселенной — от песчинки до звезды — называется материей. Ученые определяют материю как все, что занимает пространство и имеет массу. Масса объекта и его вес — связанные понятия, но не совсем одно и то же. Масса объекта — это количество материи, содержащейся в объекте, и масса объекта одинакова, находится ли этот объект на Земле или в условиях невесомости космического пространства. С другой стороны, вес объекта — это его масса, на которую действует сила тяжести. Там, где гравитация сильно притягивает массу объекта, его вес больше, чем там, где гравитация менее сильна. Например, объект определенной массы весит на Луне меньше, чем на Земле, потому что гравитация Луны меньше, чем земная. Другими словами, вес непостоянен и зависит от гравитации. Кусок сыра, который весит фунт на Земле, на Луне весит всего несколько унций.
Ученые определяют материю как все, что занимает пространство и имеет массу. Масса объекта и его вес — связанные понятия, но не совсем одно и то же. Масса объекта — это количество материи, содержащейся в объекте, и масса объекта одинакова, находится ли этот объект на Земле или в условиях невесомости космического пространства. С другой стороны, вес объекта — это его масса, на которую действует сила тяжести. Там, где гравитация сильно притягивает массу объекта, его вес больше, чем там, где гравитация менее сильна. Например, объект определенной массы весит на Луне меньше, чем на Земле, потому что гравитация Луны меньше, чем земная. Другими словами, вес непостоянен и зависит от гравитации. Кусок сыра, который весит фунт на Земле, на Луне весит всего несколько унций.
Вся материя в мире природы состоит из одной или нескольких из 92 основных субстанций, называемых элементами. Элемент — это чистое вещество, отличающееся от всех других материй тем, что его нельзя создать или разрушить обычными химическими средствами. Хотя ваше тело может собирать многие химические соединения, необходимые для жизни, из составляющих их элементов, оно не может создавать элементы. Они должны исходить из окружающей среды. Знакомый пример элемента, который вы должны принимать, — это кальций (Ca ++). Кальций необходим для человеческого организма; он усваивается и используется для ряда процессов, в том числе для укрепления костей. Когда вы потребляете молочные продукты, ваша пищеварительная система расщепляет пищу на компоненты, достаточно мелкие, чтобы попасть в кровоток. Среди них кальций, который, поскольку он является элементом, не может подвергаться дальнейшему расщеплению. Таким образом, элементарный кальций в сыре такой же, как кальций, из которого состоят ваши кости. Некоторые другие элементы, с которыми вы, возможно, знакомы, это кислород, натрий и железо. Элементы в организме человека показаны на рисунке 1, начиная с наиболее распространенных: кислорода (О), углерода (С), водорода (Н) и азота (N). Имя каждого элемента можно заменить однобуквенным или двухбуквенным символом; вы познакомитесь с некоторыми из них во время этого курса.
Хотя ваше тело может собирать многие химические соединения, необходимые для жизни, из составляющих их элементов, оно не может создавать элементы. Они должны исходить из окружающей среды. Знакомый пример элемента, который вы должны принимать, — это кальций (Ca ++). Кальций необходим для человеческого организма; он усваивается и используется для ряда процессов, в том числе для укрепления костей. Когда вы потребляете молочные продукты, ваша пищеварительная система расщепляет пищу на компоненты, достаточно мелкие, чтобы попасть в кровоток. Среди них кальций, который, поскольку он является элементом, не может подвергаться дальнейшему расщеплению. Таким образом, элементарный кальций в сыре такой же, как кальций, из которого состоят ваши кости. Некоторые другие элементы, с которыми вы, возможно, знакомы, это кислород, натрий и железо. Элементы в организме человека показаны на рисунке 1, начиная с наиболее распространенных: кислорода (О), углерода (С), водорода (Н) и азота (N). Имя каждого элемента можно заменить однобуквенным или двухбуквенным символом; вы познакомитесь с некоторыми из них во время этого курса. Все элементы в вашем теле происходят из продуктов, которые вы едите, и воздуха, которым вы дышите.
Все элементы в вашем теле происходят из продуктов, которые вы едите, и воздуха, которым вы дышите.
Элементы человеческого тела
Рисунок 1: Основные элементы, из которых состоит человеческое тело, показаны от наиболее распространенных до наименее распространенных.
В природе элементы редко встречаются поодиночке. Вместо этого они объединяются, образуя соединения. Соединение – это вещество, состоящее из двух или более элементов, соединенных химическими связями. Например, составная глюкоза является важным топливом для организма. Он всегда состоит из одних и тех же трех элементов: углерода, водорода и кислорода. Более того, элементы, входящие в состав любого данного соединения, всегда встречаются в одних и тех же относительных количествах. В глюкозе на каждые двенадцать водородных единиц всегда приходится шесть углеродных и шесть кислородных единиц. Но что же представляют собой эти «единицы» элементов?
Атомы и субатомные частицы Атом – это наименьшее количество элемента, которое сохраняет уникальные свойства этого элемента. Другими словами, атом водорода — это единица водорода — наименьшее количество водорода, которое может существовать. Как вы могли догадаться, атомы почти непостижимо малы. Точка в конце этого предложения имеет ширину в миллионы атомов.
Другими словами, атом водорода — это единица водорода — наименьшее количество водорода, которое может существовать. Как вы могли догадаться, атомы почти непостижимо малы. Точка в конце этого предложения имеет ширину в миллионы атомов.
Атомы состоят из еще более мелких субатомных частиц, три типа которых важны: протон, нейтрон и электрон. Количество положительно заряженных протонов и незаряженных («нейтральных») нейтронов придает атому массу, а количество каждого из них в ядре атома определяет элемент. Количество отрицательно заряженных электронов, которые «крутятся» вокруг ядра со скоростью, близкой к скорости света, равно количеству протонов. Электрон имеет примерно 1/2000 массы протона или нейтрона.
На рис. 2 показаны две модели, которые помогут вам представить структуру атома — в данном случае гелия (He). В планетарной модели два электрона гелия вращаются вокруг ядра по фиксированной орбите, изображенной в виде кольца. Хотя эта модель помогает визуализировать структуру атома, в действительности электроны не движутся по фиксированным орбитам, а беспорядочно вращаются вокруг ядра в так называемом электронном облаке.
Хотя эта модель помогает визуализировать структуру атома, в действительности электроны не движутся по фиксированным орбитам, а беспорядочно вращаются вокруг ядра в так называемом электронном облаке.
Две модели строения атома
Рис. 2: (а) В планетарной модели электроны гелия показаны на фиксированных орбитах, изображенных в виде колец, на точном расстоянии от ядра, что-то вроде орбит планет. солнце. (b) В модели электронного облака электроны углерода показаны в различных местах, которые они могли бы иметь на разных расстояниях от ядра с течением времени.
Протоны и электроны атома несут электрические заряды. Протоны с их положительным зарядом обозначаются p+. Электроны, имеющие отрицательный заряд, обозначаются e – . Нейтроны атома не имеют заряда: они электрически нейтральны. Так же, как магнит прилипает к стальному холодильнику, потому что их противоположные заряды притягиваются, положительно заряженные протоны притягивают отрицательно заряженные электроны. Это взаимное притяжение придает атому некоторую структурную устойчивость. Притяжение положительно заряженного ядра помогает электронам не уходить далеко. Количество протонов и электронов в нейтральном атоме одинаково, поэтому общий заряд атома уравновешен.
Это взаимное притяжение придает атому некоторую структурную устойчивость. Притяжение положительно заряженного ядра помогает электронам не уходить далеко. Количество протонов и электронов в нейтральном атоме одинаково, поэтому общий заряд атома уравновешен.
Атом углерода уникален для углерода, а протон углерода – нет. Один протон ничем не отличается от другого, независимо от того, находится ли он в атоме углерода, натрия (Na) или железа (Fe). То же самое верно для нейтронов и электронов. Итак, что придает элементу его отличительные свойства — что отличает углерод от натрия или железа? Ответ — уникальное количество протонов, содержащихся в каждом из них. Углерод по определению — это элемент, атомы которого содержат шесть протонов. Ни один другой элемент не имеет ровно шесть протонов в своих атомах. Более того, все атомов углерода, найденные в вашей печени или в куске угля, содержат шесть протонов. Таким образом, атомный номер, который представляет собой число протонов в ядре атома, идентифицирует элемент. Поскольку атом обычно имеет то же количество электронов, что и протоны, атомный номер также определяет обычное количество электронов.
Таким образом, атомный номер, который представляет собой число протонов в ядре атома, идентифицирует элемент. Поскольку атом обычно имеет то же количество электронов, что и протоны, атомный номер также определяет обычное количество электронов.
В своей наиболее распространенной форме многие элементы также содержат такое же количество нейтронов, как и протоны. Наиболее распространенная форма углерода, например, имеет шесть нейтронов, а также шесть протонов, всего 12 субатомных частиц в ядре. Массовое число элемента — это сумма количества протонов и нейтронов в его ядре. Таким образом, наиболее распространенной формой массового числа углерода является 12. (У электронов настолько малая масса, что они не вносят заметного вклада в массу атома.) Углерод — относительно легкий элемент. Уран (U), напротив, имеет массовое число 238 и относится к тяжелым металлам. Его атомный номер 92 (у него 92 протона), но содержит 146 нейтронов; он имеет наибольшую массу из всех встречающихся в природе элементов.
Периодическая таблица элементов, показанная на рисунке 3, представляет собой диаграмму, в которой указаны 92 элемента, встречающихся в природе, а также несколько более крупных нестабильных элементов, обнаруженных экспериментально. Элементы расположены в порядке их атомного номера: водород и гелий вверху таблицы, а более массивные элементы внизу. Периодическая таблица является полезным инструментом, поскольку для каждого элемента она определяет химический символ, атомный номер и массовое число, а элементы упорядочиваются в соответствии с их склонностью реагировать с другими элементами. Количество протонов и электронов в элементе равно. Число протонов и нейтронов может быть одинаковым для некоторых элементов, но не одинаковым для всех.
Периодическая таблица элементов
Рисунок 3: (кредит: Р. А. Драгосет, А. Масгроув, К. В. Кларк, В. К. Мартин)
Изотопы Хотя каждый элемент имеет уникальное количество протонов, он может существовать в виде разных изотопов. Изотоп — это одна из различных форм элемента, отличающихся друг от друга разным числом нейтронов. Стандартный изотоп углерода 12 C, обычно называемый углеродом двенадцать. 12 C имеет шесть протонов и шесть нейтронов, что соответствует массовому числу двенадцать. Все изотопы углерода имеют одинаковое количество протонов; следовательно, 13 C имеет семь нейтронов, а 14 C имеет восемь нейтронов. Различные изотопы элемента также могут быть указаны через дефис через массовое число (например, C-12 вместо 12 C). Водород имеет три общих изотопа, показанных на рисунке 4.
Изотоп — это одна из различных форм элемента, отличающихся друг от друга разным числом нейтронов. Стандартный изотоп углерода 12 C, обычно называемый углеродом двенадцать. 12 C имеет шесть протонов и шесть нейтронов, что соответствует массовому числу двенадцать. Все изотопы углерода имеют одинаковое количество протонов; следовательно, 13 C имеет семь нейтронов, а 14 C имеет восемь нейтронов. Различные изотопы элемента также могут быть указаны через дефис через массовое число (например, C-12 вместо 12 C). Водород имеет три общих изотопа, показанных на рисунке 4.
Изотопы водорода
Рисунок 4: Протий, обозначенный 1 H, имеет один протон и не имеет нейтронов. Это, безусловно, самый распространенный изотоп водорода в природе. Дейтерий, обозначенный как 2 H, имеет один протон и один нейтрон. Тритий, обозначенный 3 H, имеет два нейтрона
Изотоп, который содержит большее, чем обычно, количество нейтронов, называется тяжелым изотопом. Примером может служить 14 C. Тяжелые изотопы имеют тенденцию быть нестабильными, а нестабильные изотопы радиоактивны. Радиоактивный изотоп — это изотоп, ядро которого легко распадается, испуская субатомные частицы и электромагнитную энергию. Различные радиоактивные изотопы (также называемые радиоизотопами) различаются по периоду полураспада — времени, которое требуется для распада половины образца изотопа любого размера. Например, период полураспада трития — радиоизотопа водорода — составляет около 12 лет, что указывает на то, что для распада половины ядер трития в образце требуется 12 лет. Чрезмерное воздействие радиоактивных изотопов может повредить клетки человека и даже вызвать рак и врожденные дефекты, но когда воздействие контролируется, некоторые радиоактивные изотопы могут быть полезны в медицине. Для получения дополнительной информации см. Карьерные связи.
Примером может служить 14 C. Тяжелые изотопы имеют тенденцию быть нестабильными, а нестабильные изотопы радиоактивны. Радиоактивный изотоп — это изотоп, ядро которого легко распадается, испуская субатомные частицы и электромагнитную энергию. Различные радиоактивные изотопы (также называемые радиоизотопами) различаются по периоду полураспада — времени, которое требуется для распада половины образца изотопа любого размера. Например, период полураспада трития — радиоизотопа водорода — составляет около 12 лет, что указывает на то, что для распада половины ядер трития в образце требуется 12 лет. Чрезмерное воздействие радиоактивных изотопов может повредить клетки человека и даже вызвать рак и врожденные дефекты, но когда воздействие контролируется, некоторые радиоактивные изотопы могут быть полезны в медицине. Для получения дополнительной информации см. Карьерные связи.
Интервенционный радиолог
Контролируемое использование радиоизотопов позволило улучшить медицинскую диагностику и лечение заболеваний. Интервенционные радиологи — это врачи, которые лечат заболевания с помощью минимально инвазивных методов, включающих облучение. Многие состояния, которые когда-то можно было лечить только длительной и травматичной операцией, теперь можно лечить без хирургического вмешательства, что снижает стоимость, боль, продолжительность пребывания в больнице и время восстановления для пациентов. Например, в прошлом единственными вариантами для пациента с одной или несколькими опухолями в печени были хирургическое вмешательство и химиотерапия (введение лекарств для лечения рака). Однако к некоторым опухолям печени трудно получить доступ хирургическим путем, а при других может потребоваться удаление слишком большого количества печени. Более того, химиотерапия очень токсична для печени, и некоторые опухоли в любом случае плохо реагируют на нее. В некоторых таких случаях интервенционный радиолог может лечить опухоли, нарушая их кровоснабжение, которое им необходимо, чтобы они продолжали расти. В этой процедуре, называемой радиоэмболизацией, рентгенолог получает доступ к печени с помощью тонкой иглы, продетой через один из кровеносных сосудов пациента.
Интервенционные радиологи — это врачи, которые лечат заболевания с помощью минимально инвазивных методов, включающих облучение. Многие состояния, которые когда-то можно было лечить только длительной и травматичной операцией, теперь можно лечить без хирургического вмешательства, что снижает стоимость, боль, продолжительность пребывания в больнице и время восстановления для пациентов. Например, в прошлом единственными вариантами для пациента с одной или несколькими опухолями в печени были хирургическое вмешательство и химиотерапия (введение лекарств для лечения рака). Однако к некоторым опухолям печени трудно получить доступ хирургическим путем, а при других может потребоваться удаление слишком большого количества печени. Более того, химиотерапия очень токсична для печени, и некоторые опухоли в любом случае плохо реагируют на нее. В некоторых таких случаях интервенционный радиолог может лечить опухоли, нарушая их кровоснабжение, которое им необходимо, чтобы они продолжали расти. В этой процедуре, называемой радиоэмболизацией, рентгенолог получает доступ к печени с помощью тонкой иглы, продетой через один из кровеносных сосудов пациента. Затем рентгенолог вводит крошечные радиоактивные «семена» в кровеносные сосуды, питающие опухоли. В течение нескольких дней и недель после процедуры излучение, испускаемое семенами, разрушает сосуды и непосредственно убивает опухолевые клетки в непосредственной близости от лечения.
Затем рентгенолог вводит крошечные радиоактивные «семена» в кровеносные сосуды, питающие опухоли. В течение нескольких дней и недель после процедуры излучение, испускаемое семенами, разрушает сосуды и непосредственно убивает опухолевые клетки в непосредственной близости от лечения.
Радиоизотопы испускают субатомные частицы, которые можно обнаружить и отследить с помощью технологий визуализации. Одним из наиболее передовых применений радиоизотопов в медицине является позитронно-эмиссионный томограф (ПЭТ), который обнаруживает активность в организме очень маленькой инъекции радиоактивной глюкозы, простого сахара, который клетки используют для получения энергии. Камера ПЭТ показывает медицинской бригаде, какие ткани пациента поглощают больше всего глюкозы. Таким образом, наиболее метаболически активные ткани проявляются на изображениях в виде ярких «горячих точек» (рис. 5). ПЭТ может выявить некоторые раковые образования, потому что раковые клетки потребляют глюкозу с высокой скоростью, чтобы способствовать их быстрому размножению.
Рис. 5: ПЭТ выделяет участки тела, в которых наблюдается относительно высокий уровень использования глюкозы, что характерно для раковой ткани. Это ПЭТ-сканирование показывает места распространения большой первичной опухоли на другие участки.
Поведение электронов
В человеческом теле атомы не существуют как независимые сущности. Скорее, они постоянно реагируют с другими атомами, образуя и разрушая более сложные вещества. Чтобы полностью понять анатомию и физиологию, вы должны понять, как атомы участвуют в таких реакциях. Ключ в понимании поведения электронов.
Хотя электроны не следуют жестким орбитам на заданном расстоянии от ядра атома, они имеют тенденцию оставаться в определенных областях пространства, называемых электронными оболочками. Электронная оболочка представляет собой слой электронов, окружающих ядро на определенном энергетическом уровне.
Атомы элементов, обнаруженных в организме человека, имеют от одной до пяти электронных оболочек, и все электронные оболочки содержат восемь электронов, кроме первой оболочки, которая может содержать только два. Эта конфигурация электронных оболочек одинакова для всех атомов. Точное количество оболочек зависит от количества электронов в атоме. Водород и гелий имеют только один и два электрона соответственно. Если вы взглянете на периодическую таблицу элементов, то заметите, что водород и гелий расположены отдельно по обе стороны от верхнего ряда; это единственные элементы, которые имеют только одну электронную оболочку (рис. 6). Вторая оболочка необходима для удержания электронов во всех элементах крупнее водорода и гелия.
Эта конфигурация электронных оболочек одинакова для всех атомов. Точное количество оболочек зависит от количества электронов в атоме. Водород и гелий имеют только один и два электрона соответственно. Если вы взглянете на периодическую таблицу элементов, то заметите, что водород и гелий расположены отдельно по обе стороны от верхнего ряда; это единственные элементы, которые имеют только одну электронную оболочку (рис. 6). Вторая оболочка необходима для удержания электронов во всех элементах крупнее водорода и гелия.
Литий (Li), атомный номер которого равен 3, имеет три электрона. Два из них заполняют первую электронную оболочку, а третий переходит на вторую оболочку. На второй электронной оболочке может разместиться до восьми электронов. Углерод со своими шестью электронами полностью заполняет свою первую оболочку и наполовину заполняет вторую. С десятью электронами неон (Ne) полностью заполняет свои две электронные оболочки. Опять же, взгляд на периодическую таблицу показывает, что все элементы во втором ряду, от лития до неона, имеют только две электронные оболочки. Атомам с более чем десятью электронами требуется более двух оболочек. Эти элементы занимают третью и последующие строки таблицы Менделеева.
Атомам с более чем десятью электронами требуется более двух оболочек. Эти элементы занимают третью и последующие строки таблицы Менделеева.
Электронные оболочки
Рис. 6. Электроны вращаются вокруг атомного ядра на различных уровнях энергии, называемых электронными оболочками. а) Имея один электрон, водород лишь наполовину заполняет свою электронную оболочку. Гелий тоже имеет одинарную оболочку, но его два электрона полностью ее заполняют. б) Электроны углерода полностью заполняют его первую электронную оболочку, но только наполовину заполняют вторую. (c) Неон, элемент, который не встречается в организме, имеет 10 электронов, заполняющих обе его электронные оболочки
Фактором, наиболее сильно определяющим склонность атома к участию в химических реакциях, является число электронов на его валентной оболочке. Валентная оболочка — это самая внешняя электронная оболочка атома. Если валентная оболочка заполнена, атом стабилен; это означает, что его электроны вряд ли будут отрываться от ядра электрическим зарядом других атомов.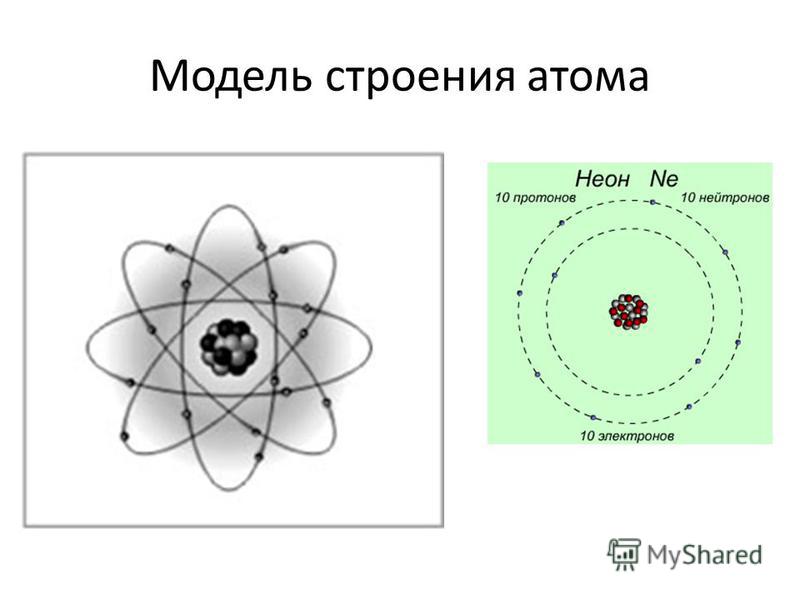 Если валентная оболочка не заполнена, атом реактивен; это означает, что он будет реагировать с другими атомами таким образом, что валентная оболочка будет заполнена. Рассмотрим водород, у которого один электрон лишь наполовину заполняет его валентную оболочку. Этот единственный электрон, вероятно, будет втянут в отношения с атомами других элементов, так что можно будет стабилизировать одновалентную оболочку водорода.
Если валентная оболочка не заполнена, атом реактивен; это означает, что он будет реагировать с другими атомами таким образом, что валентная оболочка будет заполнена. Рассмотрим водород, у которого один электрон лишь наполовину заполняет его валентную оболочку. Этот единственный электрон, вероятно, будет втянут в отношения с атомами других элементов, так что можно будет стабилизировать одновалентную оболочку водорода.
Все атомы (кроме водорода и гелия с их одноэлектронными оболочками) наиболее стабильны, когда в их валентной оболочке ровно восемь электронов. Этот принцип называется правилом октета и гласит, что атом будет отдавать, приобретать или делиться электронами с другим атомом, так что в итоге он окажется с восемью электронами в своей собственной валентной оболочке. Например, кислород с шестью электронами на валентной оболочке, скорее всего, будет реагировать с другими атомами таким образом, что к валентной оболочке кислорода присоединятся два электрона, в результате чего их число достигнет восьми. Когда два атома водорода делят свой единственный электрон с кислородом, образуются ковалентные связи, в результате чего образуется молекула воды H 2 O.
Когда два атома водорода делят свой единственный электрон с кислородом, образуются ковалентные связи, в результате чего образуется молекула воды H 2 O.
В природе атомы одного элемента имеют тенденцию соединяться с атомами других элементов характерным образом. Например, углерод обычно заполняет свою валентную оболочку, соединяясь с четырьмя атомами водорода. При этом два элемента образуют простейшую из органических молекул — метан, который также является одним из самых распространенных и стабильных углеродосодержащих соединений на Земле. Как указано выше, другим примером является вода; кислороду нужно два электрона, чтобы заполнить его валентную оболочку. Он обычно взаимодействует с двумя атомами водорода, образуя H 2 O. Кстати, название «водород» отражает его вклад в воду (hydro- = «вода»; -gen = «создатель»). Таким образом, водород является «производителем воды».
Обзор главы Тело человека состоит из элементов, наиболее распространенными из которых являются кислород (О), углерод (С), водород (Н) и азот (N). Вы получаете эти элементы из пищи, которую едите, и воздуха, которым дышите. Наименьшая единица элемента, сохраняющая все свойства этого элемента, — это атом. Но сами атомы содержат множество субатомных частиц, три наиболее важные из которых — протоны, нейтроны и электроны. Эти частицы не различаются по качеству от одного элемента к другому; скорее то, что придает элементу его отличительную идентификацию, – это количество его протонов, называемое его атомным номером. Протоны и нейтроны составляют почти всю массу атома; количество протонов и нейтронов является массовым числом элемента. В природе могут встречаться более тяжелые и более легкие версии одного и того же элемента, потому что эти версии имеют разное количество нейтронов. Различные версии элемента называются изотопами.
Вы получаете эти элементы из пищи, которую едите, и воздуха, которым дышите. Наименьшая единица элемента, сохраняющая все свойства этого элемента, — это атом. Но сами атомы содержат множество субатомных частиц, три наиболее важные из которых — протоны, нейтроны и электроны. Эти частицы не различаются по качеству от одного элемента к другому; скорее то, что придает элементу его отличительную идентификацию, – это количество его протонов, называемое его атомным номером. Протоны и нейтроны составляют почти всю массу атома; количество протонов и нейтронов является массовым числом элемента. В природе могут встречаться более тяжелые и более легкие версии одного и того же элемента, потому что эти версии имеют разное количество нейтронов. Различные версии элемента называются изотопами.
Склонность атома быть стабильным или легко реагировать с другими атомами во многом обусловлена поведением электронов внутри самой внешней электронной оболочки атома, называемой его валентной оболочкой.

 Педагогический (научно-педагогический) состав
Педагогический (научно-педагогический) состав