ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ • Большая российская энциклопедия
ПЕРИОДИ́ЧЕСКАЯ СИСТЕ́МА ХИМИ́ЧЕСКИХ ЭЛЕМЕ́НТОВ, упорядоченное множество химич. элементов и их естеств. классификация. Является табличным представлением периодического закона, открытого Д. И. Менделеевым. Прообразом П. с. х. э. служит таблица «Опыт системы элементов, основанной на их атомном весе и химическом сходстве», составленная Менделеевым в 1869 (рис. 1). По мере совершенствования этой таблицы Менделеев развил представления о периодах и группах элементов и о месте каждого элемента в системе. К 1871 в кн. «Основы химии» Менделеевым была включена «Естественная система элементов Д. Менделеева» – первая классич. короткая форма П. с. х. э. Опираясь на неё, Менделеев выполнил впоследствии оправдавшийся прогноз существования и свойств неизвестных в то время элементов (Ga, Sc, Ge).
Рис. 1. Таблица, составленная Д. И. Менделеевым 1. 3.1869.
Физич. смысл периодичности в свойствах элементов стал ясен после появления планетарной модели атома (Э. Резерфорд, 1911) и было показано (нидерл. физик А. ван ден Брук и Г. Мозли, 1913–14), что порядковый номер элемента в П. с. х. э. равен положительному заряду (Z) ядра атома. Теория П. с. х. э. в осн. создана Н. Бором (1913–21) на базе квантовой модели атома. Бор разработал схему построения электронных конфигураций атомов по мере возрастания Z, опирающуюся на определённую последовательность заполнения электронами оболочек и подоболочек в атомах с ростом числа Z.
Совр. П. с. х. э. включает более ста химич. элементов. Наиболее тяжёлые элементы получены ядерным синтезом. Порядок заполнения электронами уровней в атомах определяется правилами, совокупность которых называют «принципом построения»: заполнение атомных орбиталей (АО) происходит в порядке увеличения энергии орбиталей: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 6d и т.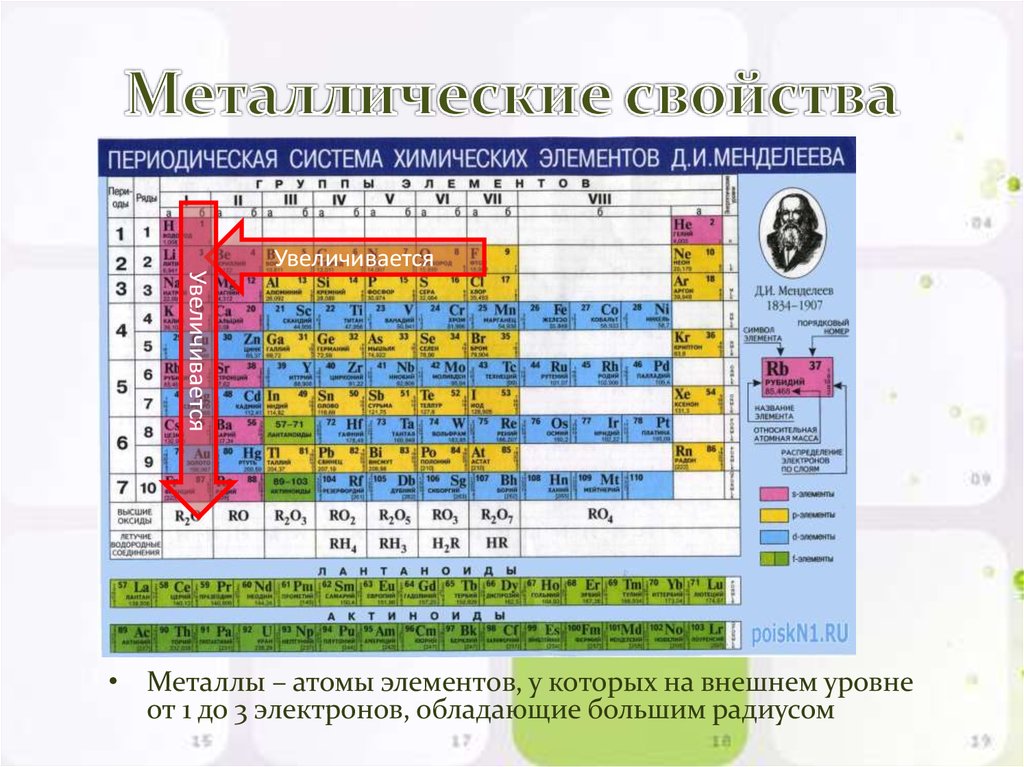 д.; согласно Паули принципу, каждая АО (характеризуется квантовыми числами n, l, m) может содержать не более 2 электронов; АО с одинаковыми l и n заполняются так, чтобы суммарный спин электронов был максимален (т. е. заполняется макс. число АО с разными m по Хунда правилу).
д.; согласно Паули принципу, каждая АО (характеризуется квантовыми числами n, l, m) может содержать не более 2 электронов; АО с одинаковыми l и n заполняются так, чтобы суммарный спин электронов был максимален (т. е. заполняется макс. число АО с разными m по Хунда правилу).
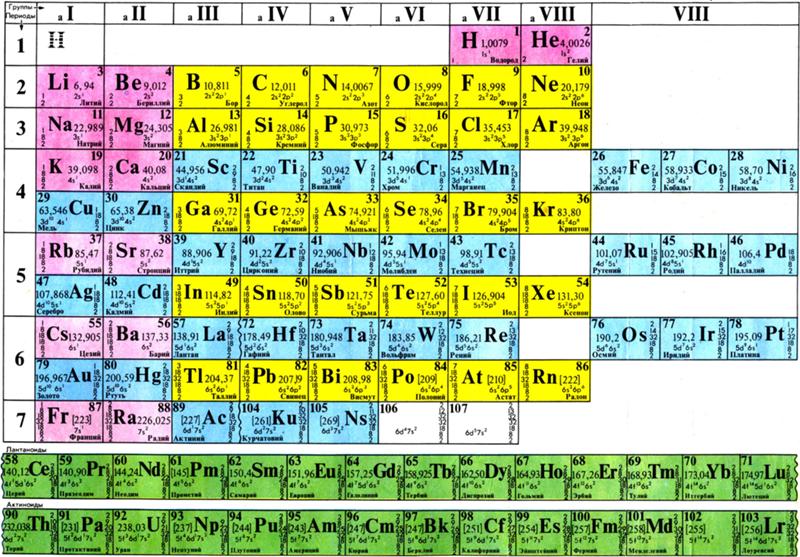
Рис. 2. Короткий вариант периодической системы химических элементов Д. И. Менделеева (в соответствии с данными ИЮПАК на 1973).
Согласно (n+l)-правилу Клечковского, построение электронных конфигураций гл. обр. происходит в соответствии с последовательным увеличением суммы (n+l). При этом в пределах каждой такой суммы сначала заполняются подоболочки с бóльшими l и меньшими n, затем с меньшими l и бóльшими n.
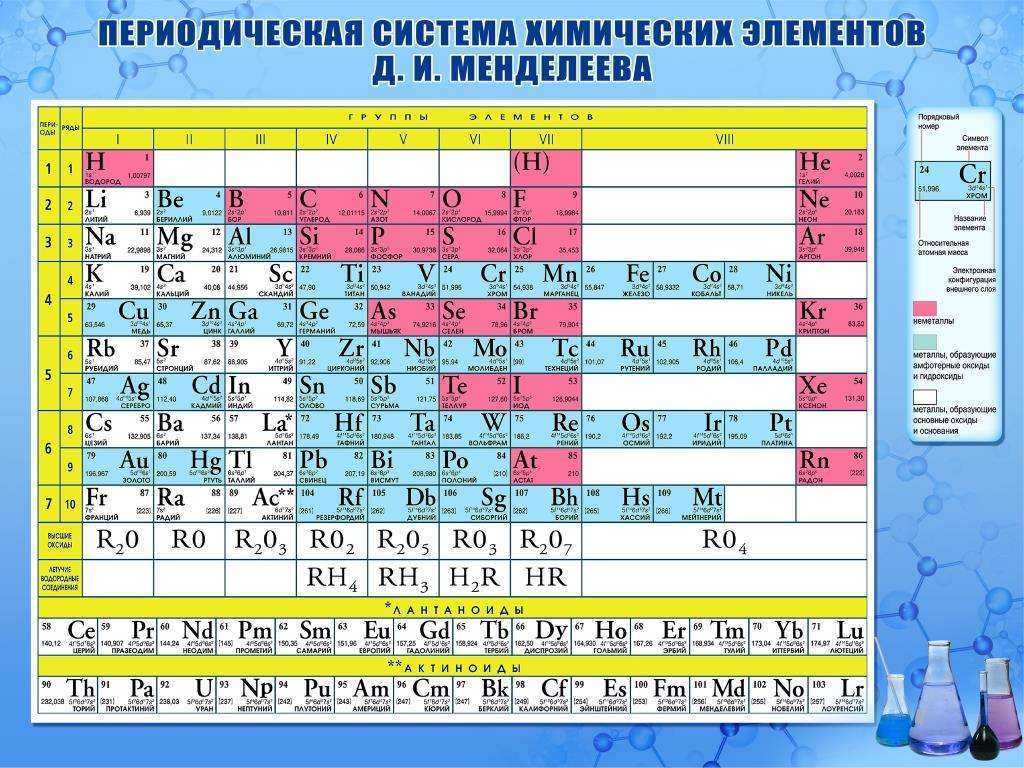
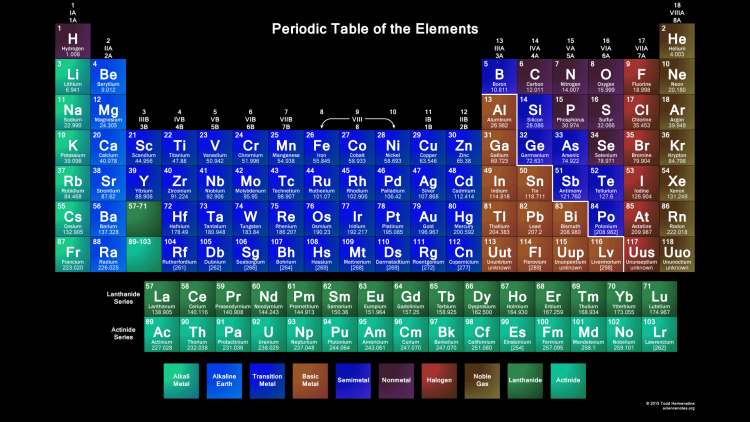
Опубликовано св. 500 вариантов П. с. х. э., что связано с попытками поиска решения некоторых частных проблем её структуры. Наиболее распространены две табличные формы П. с. х. э.: короткая (рис. 2) и длинная (разрабатывалась Д. И. Менделеевым, усовершенствована в 1905 А. Вернером; рис. 3). В структуре П. с. х. э. выделяют периоды (горизонтальные ряды) и группы (вертикальные столбцы) элементов.
с. х. э.: короткая (рис. 2) и длинная (разрабатывалась Д. И. Менделеевым, усовершенствована в 1905 А. Вернером; рис. 3). В структуре П. с. х. э. выделяют периоды (горизонтальные ряды) и группы (вертикальные столбцы) элементов.
Рис. 3. Длинная форма периодической системы химических элементов (в соответствии с данными ИЮПАК на 2013).
Совр. форма П. с. х. э. (в 1989 ИЮПАК рекомендована длинная форма П. с. х. э.) состоит из 7 периодов (горизонтальных последовательностей элементов, расположенных по возрастанию порядкового номера) и 18 групп (вертикальных последовательностей элементов в соответствии с количеством валентных электронов), а короткая форма П. с. х. э. – из 8 групп. Число элементов в периодах, начиная со второго, попарно повторяется: 8, 8, 18, 18, 32, 32,… (первый период содержит два элемента). Номер группы элементов короткого варианта П. с. х. э. соответствует числу валентных электронов во внешней электронной оболочке атомов. В длиннопериодном варианте П. с. х. э. номер группы в бoльшей мере формален. Группы короткого варианта включают главную (а) и побочную (б) подгруппы, в каждой из которых содержатся элементы, сходные по химич. свойствам, их атомы характеризуются одинаковым строением внешних электронных оболочек. Элементы некоторых групп имеют собств. тривиальные названия: щелочные металлы (группа 1 длинной формы П. с. х. э.), щёлочноземельные металлы (группа 2), халькогены (группа 16), галогены (группа 17), благородные газы (группа 18). В П. с. х. э. для каждого элемента указывается его символ, название, порядковый номер и значение относит. атомной массы.
с. х. э. соответствует числу валентных электронов во внешней электронной оболочке атомов. В длиннопериодном варианте П. с. х. э. номер группы в бoльшей мере формален. Группы короткого варианта включают главную (а) и побочную (б) подгруппы, в каждой из которых содержатся элементы, сходные по химич. свойствам, их атомы характеризуются одинаковым строением внешних электронных оболочек. Элементы некоторых групп имеют собств. тривиальные названия: щелочные металлы (группа 1 длинной формы П. с. х. э.), щёлочноземельные металлы (группа 2), халькогены (группа 16), галогены (группа 17), благородные газы (группа 18). В П. с. х. э. для каждого элемента указывается его символ, название, порядковый номер и значение относит. атомной массы.
Первый период содержит два элемента – Н и Не. Водород имеет некоторое сходство как со щелочными элементами, так и с галогенами. В связи с этим символ Н помещают либо в подгруппу Iа, либо в подгруппу VIIa короткого варианта П. с. х. э., либо в обе одновременно.
В связи с этим символ Н помещают либо в подгруппу Iа, либо в подгруппу VIIa короткого варианта П. с. х. э., либо в обе одновременно.
Второй и третий периоды (Li – Ne; Na – Ar) содержат по 8 элементов, причём характер изменения химич. свойств вертикальных аналогов во многом близок. Элементы первых трёх периодов относятся к гл. подгруппам короткого варианта периодич. системы химич. элементов.
Элементы групп 1 и 2 длинной формы называются s-элементами, групп 13–18 – p-элементами, групп 3–12 – d-элементами; d-элементы (за исключением цинка, кадмия и ртути) называют также переходными элементами.
Четвёртый период (K–Kr) содержит 18 элементов. После K и Са (s-элементы) следует ряд из десяти (Sc – Zn) 3d-элементов (побочные подгруппы короткого варианта П. с. х. э.). Переходные элементы проявляют высшие степени окисления, в осн. равные номеру группы короткого варианта П.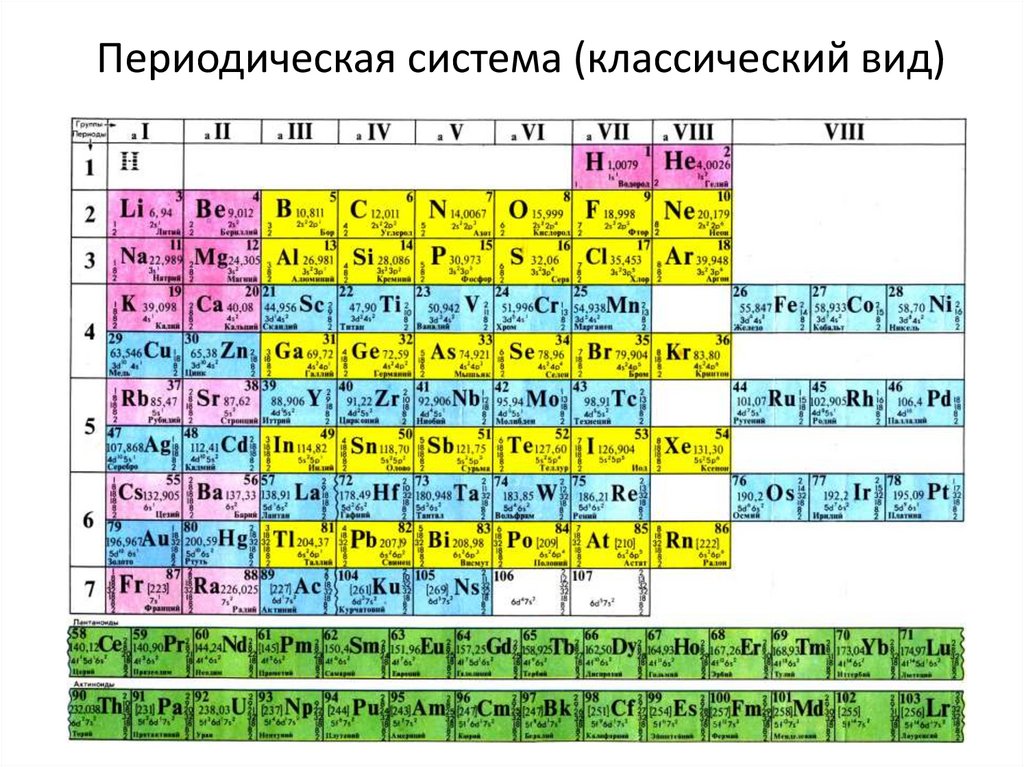 с. х. э. (исключая Co, Ni и Cu). Элементы от Ga до Kr относятся к гл. подгруппам (р-элементы).
с. х. э. (исключая Co, Ni и Cu). Элементы от Ga до Kr относятся к гл. подгруппам (р-элементы).
Пятый период (Rb – Xe) построен аналогично четвёртому; в нём также имеется «вставка» из десяти переходных 4d-элементов (Y – Cd). Особенности изменения свойств в этом периоде: в триаде Ru – Rh – Pd рутений проявляет макс. степень окисления +8, родий +6, палладий +5; все элементы гл. подгрупп, включая Хе, проявляют высшие степени окисления, равные номеру группы.
Шестой период (Сs – Rn) содержит 32 элемента. В него, помимо десяти 5d-элементов (La, Hf – Hg), входит семейство из четырнадцати 4f-элементов – лантаноидов (лантанидов, Ln). В степени окисления +3, +4 они являются химич. аналогами актиноидов, в степени окисления +2 – щёлочноземельных элементов. Лантаноиды размещены в группе 3 длинной формы, клетка La, и для удобства вынесены под таблицу. Особенностью элементов шестого периода является то, что в триаде Os – Ir – Pt два элемента – осмий и иридий – проявляют степень окисления +8, платина +6 (для Ir – данные 2010).
Особенностью элементов шестого периода является то, что в триаде Os – Ir – Pt два элемента – осмий и иридий – проявляют степень окисления +8, платина +6 (для Ir – данные 2010).
Седьмой период, подобно шестому, содержит 32 элемента. Актиний – аналог лантана. После Ас следует семейство из четырнадцати 5f-элементов – актиноидов (актинидов, An) (Z= 90–103). В П. с. х. э. их размещают в клетке Ас и, подобно Ln, записывают отд. строкой под таблицей. Этот приём предполагает наличие существенного химич. сходства элементов двух f-семейств. Именно на этом основывалась «актинидная концепция» Г. Сиборга (1944), сыгравшая ведущую роль при разработке методов разделения продуктов деления урана и поиске новых элементов. Однако эта концепция справедлива лишь для трёх- и четырёхвалентных An. Актиноиды же проявляют степени окисления от +2 до +7 (последняя характерна для Np, Pu, Am) и +8 (для плутония). Для наиболее тяжёлых An характерна стабилизация низших степеней окисления (+2 или даже +1 для Md).
Для наиболее тяжёлых An характерна стабилизация низших степеней окисления (+2 или даже +1 для Md).
Эксперим. оценки химии элементов с Z=104 (резерфордий) и Z=105 (дубний) позволили заключить, что они являются аналогами соответственно Hf и Та, т. е. 6d-элементами (должны располагаться в IVб и Vб подгруппах короткой формы). Химич. идентификация элементов с Z=106–118 не проводилась из-за слишком коротких «времён жизни» синтезированных изотопов, но в соответствии со структурой П. с. х. э. можно считать, что элементы Rf, Db, Sg, Bh, Hs, Mt, Ds, Rg, Cn относятся к 6d-элементам, элементы c Z=113–118 близки соответственно вертикальным аналогам. Это же следует из совр. квантовохимич. расчётов.
П. с. х. э. является важным звеном эволюции атомно-молекулярного учения, способствует уточнению представлений о простых веществах и соединениях, оказала значит. влияние на разработку теории строения атомов. С П. с. х. э. связана постановка проблемы прогнозирования в химии, что проявилось в предсказании как существования неизвестных элементов и их свойств, так и особенностей химич. поведения известных элементов. П. с. х. э. – основа неорганич. химии; служит задачам синтеза веществ с заранее заданными свойствами, созданию новых материалов, в частности сверхпроводников и полупроводников, подбору специфич. катализаторов для разл. химич. процессов и др. П. с. х. э. – науч. база преподавания общей и неорганич. химии, а также некоторых разделов атомной физики.
влияние на разработку теории строения атомов. С П. с. х. э. связана постановка проблемы прогнозирования в химии, что проявилось в предсказании как существования неизвестных элементов и их свойств, так и особенностей химич. поведения известных элементов. П. с. х. э. – основа неорганич. химии; служит задачам синтеза веществ с заранее заданными свойствами, созданию новых материалов, в частности сверхпроводников и полупроводников, подбору специфич. катализаторов для разл. химич. процессов и др. П. с. х. э. – науч. база преподавания общей и неорганич. химии, а также некоторых разделов атомной физики.
Что такое P электрон?
Статьи › Чем отличается › Чем физические свойства неметаллов отличаются от физических свойств металлов охарактеризуйте?
P-блок в периодической таблице элементов — электронная оболочка атомов, валентные электроны которых с наивысшей энергией занимают p-орбиталь.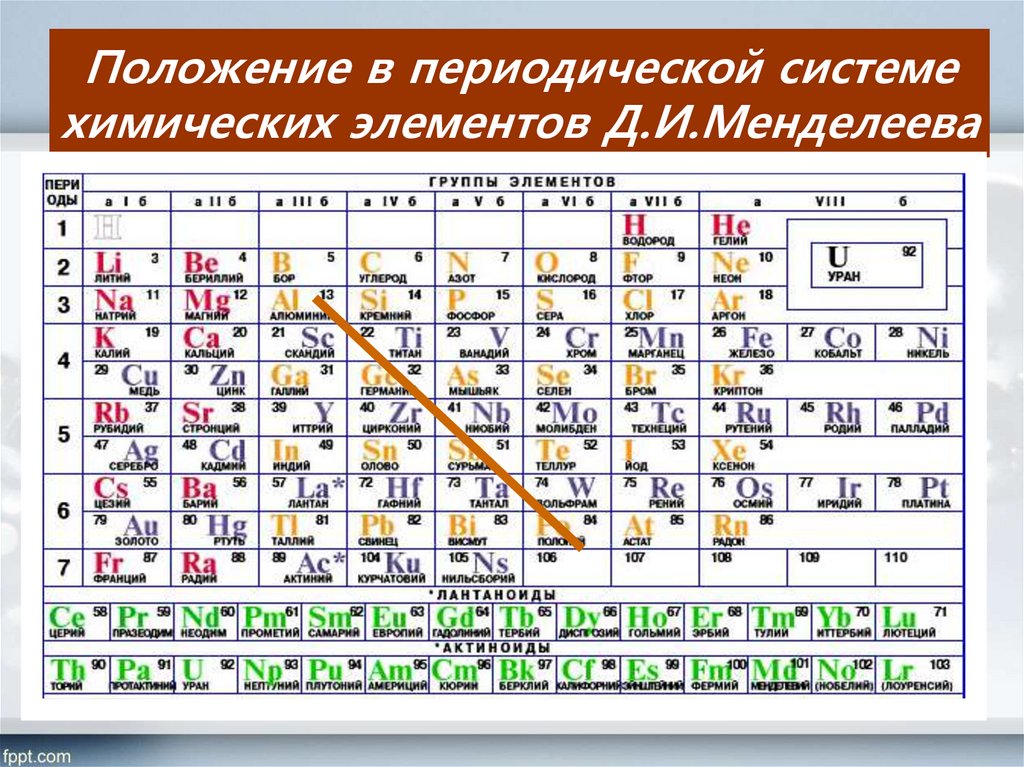 В p-блок входят последние шесть элементов главной подгруппы, исключая гелий (который находится в s-блоке).
В p-блок входят последние шесть элементов главной подгруппы, исключая гелий (который находится в s-блоке).
- Как определить s и P элементы?
- Где находятся Р элементы?
- Что такое S элементы?
- Какие степени окисления могут проявлять P элементы?
- Что означает p элемент?
- Что такое P блок?
- Что относится к p элементам?
- Что означает буква p в химии?
- Что относится к D элементам?
- Как определить Овр это или нет?
- Что значит Овр?
- Как найти p электроны?
- Какого цвета P элементы?
- Что такое s и p орбитали?
- Какие бывают подгруппы?
- Какой элемент обозначается буквой Р?
- Как обозначают элементы?
- Что такое с п д ф элементы?
- Что такое f элементы в химии?
- Что означает f в химии?
- Когда атом отдает электроны?
- Как определить степень окисления простыми словами?
- Где узнать степень окисления?
- Какие элементы относятся к s?
- Как называется химический элемент s?
- Какой заряд у s?
- Что такое s p d f элементы?
Как определить s и P элементы?
Токсическое действие:
- s-блок в периодической таблицеэлементов — электронная оболочка, включающая в себя первые два слоя s-электронов.

- p-блок в периодической таблице элементов — электронная оболочка атомов, валентные электроныкоторых с наивысшей энергией занимают p-орбиталь.
Где находятся Р элементы?
P-Элементы имеют общую электронную конфигурацию ns2np1–6 и образуют подгруппы IIIА, IVА, VА, VIА, VIIА и VIIIА периодической системы.
Что такое S элементы?
S-Элеме́нты в периодической таблице элементов — химические элементы, внешняя электронная оболочка которых образована s-электронами (одним или двумя). Такие элементы объединяются в группу, называемую s-блок.
Какие степени окисления могут проявлять P элементы?
Элементы этой группы образуют чаще три связи. Типичная степень окисления +3, и только таллий проявляет степень окисления +1 и +3.
Что означает p элемент?
P-блок в периодической таблице элементов — электронная оболочка атомов, валентные электроны которых с наивысшей энергией занимают p-орбиталь. В p-блок входят последние шесть элементов главной подгруппы, исключая гелий (который находится в s-блоке).
Что такое P блок?
P -блок (блок перестановки) подобен традиционному шифру транспозиции символов. Он перемещает биты. В современных блочных шифрах мы можем найти три типа P -блоков: прямые P -блоки, P -блоки расширения и P -блоки сжатия, что и показано на рис.
Что относится к p элементам?
А p-элементы углерод (C), кремний (Si), германий (Ge), олово (Sn) и свинец (Pb) — это элементы главной подгруппы той же IV-й группы.
Что означает буква p в химии?
В химии P — символ фосфора.
Что относится к D элементам?
D-элементы — группа атомов в периодической таблице элементов (d-блок), в электронной оболочке которых валентные электроны с наивысшей энергией занимают d-орбиталь. Данный блок представляет собой часть периодической таблицы; в него входят элементы от 3 до 12 группы.
Как определить Овр это или нет?
Для того чтобы определить, является ли реакция окислительно-восстановительной, надо:
- указать степени окисления всех элементов в исходных веществах и продуктах реакции;
- сравнить степени окисления каждого элемента в исходных веществах и в продуктах.
Что значит Овр?
Окислительно-восстановительные реакции (ОВР) — это реакции, при протекании которых происходит изменение степени окисления химических элементов, входящих в состав реагентов. Степень окисления — условный (формальный) заряд атома в химическом соединении, который находят, считая химические связи в соединении чисто ионными.
Откуда берется степень окисления?
Степень окисления равна числу электронов, смещённых от атома или к атому. Если электроны смещаются от атома, то его степень окисления положительная. Положительная степень окисления у атома с меньшей электроотрицательностью. Если смещение электронов происходит к атому, то его степень окисления отрицательная.
Как найти p электроны?
Найдем элемент P в периодической таблице. Чтобы найти количество электронов в фосфор, сначала найдем этот элемент в периодической таблице. Затем найдите атомное число, которое указано над символом этого элемента. Поскольку атомное число фосфор равно 15, то у P электронов 15.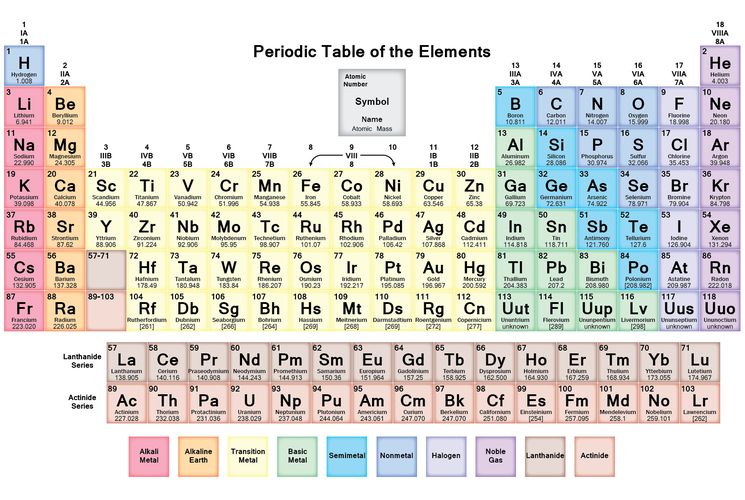
Какого цвета P элементы?
Клеточки с элементами, у которых в процессе заполнения находятся p-орбитали — в желтый цвет. Таким образом, в красных клеточках находятся s-элементы, а в желтых — p-элементы.
Что такое s и p орбитали?
Буквенные обозначения атомных орбиталей произошли от описания спектральных линий в атомных спектрах: s (sharp) — резкая серия в атомных спектрах, p (principal)— главная, d (diffuse) — диффузная, f (fundamental) — фундаментальная.
Какие бывают подгруппы?
В короткопериодном варианте периодической системы группы подразделяются на подгруппы — главные (или подгруппы A), начинающиеся с элементов первого и второго периодов, и побочные (подгруппы В), содержащие d-элементы.
Какой элемент обозначается буквой Р?
Названия химических элементов
Z | Символ | Name |
|---|---|---|
13 | Al | Aluminium |
14 | Si | Silicon |
15 | P | Phosphorus |
16 | S | Sulfur |
Как обозначают элементы?
Современные символы химических элементов состоят из первой буквы или из первой и одной из следующих букв латинского названия элементов.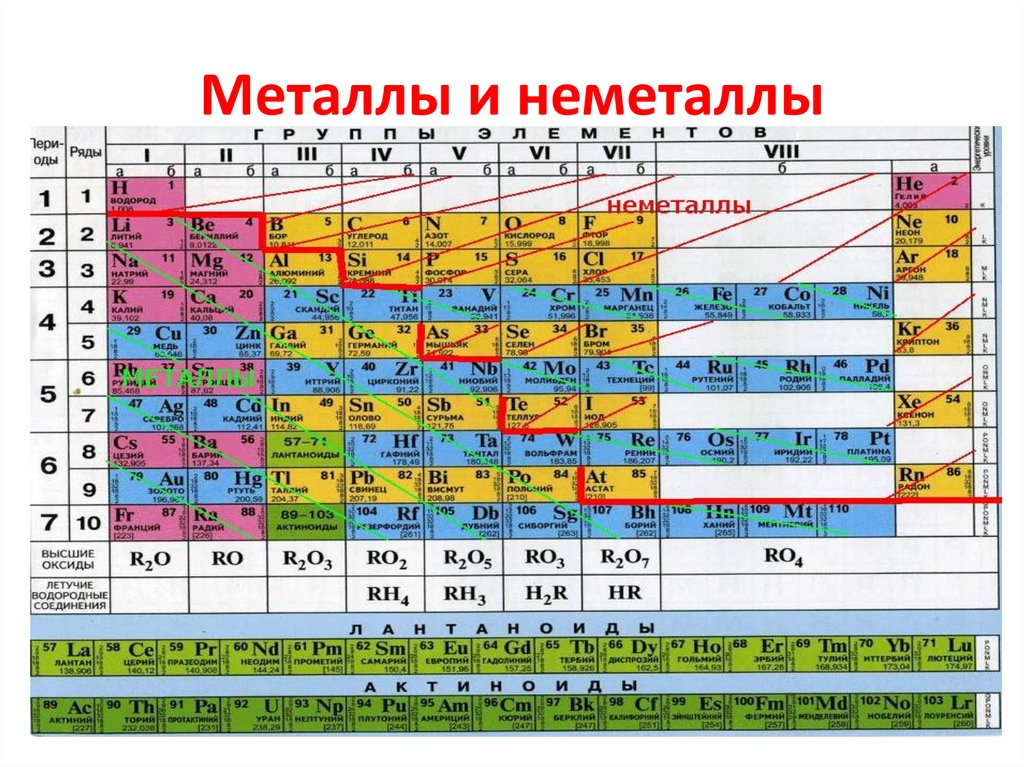 При этом только первая буква — заглавная. Например, H — водород (лат. Hydrogenium), N — азот (лат.
При этом только первая буква — заглавная. Например, H — водород (лат. Hydrogenium), N — азот (лат.
Что такое с п д ф элементы?
Названия блоков и орбиталей (s, p, d, f и g) произошло от качественной характеристики спектральных линий связанных с ними атомных орбиталей: sharp (острый), principal (главный), diffuse (расплывчатый) и fundamental (фундаментальный). Последующие названия даются в алфавитном порядке.
Что такое f элементы в химии?
F-элементы в периодической таблице — блок элементов у атомов которых валентные электроны с наивысшей энергией занимают f-орбиталь. В данный блок входят лантаноиды и актиноиды.
Что означает f в химии?
Фто́р (химический символ — F, устар. «флюор»; от лат. Fluorum) — химический элемент 17-й группы (по устаревшей классификации — главной подгруппы седьмой группы, VIIA) второго периода периодической системы химических элементов Д.
Когда атом отдает электроны?
Передача электронов от атома к атому называется окислением-восстановлением. Окисляется тот атом, который отдает свои электроны, а принимающий электроны — восстанавливается.
Окисляется тот атом, который отдает свои электроны, а принимающий электроны — восстанавливается.
Как определить степень окисления простыми словами?
Запомните: Численно степень окисления равна количеству электронов, которые перешли от одного атома к другому. У атома с меньшей ЭО, который отдает электроны, — положительная степень окисления. У атома с большей ЭО, который притягивает электроны, — отрицательная степень окисления.
Где узнать степень окисления?
Как определить степень окисления?:
- Отметим, что степень окисления указывается в верхнем правом углу атома в формате или, где
- – Исключения у водорода соединения, в которых у водорода степень окисления
- Пример 1: расставьте степени окисления в соединении.
- Пример 2: Найдите степени окисления всех атомов в соединении
Какие элементы относятся к s?
Элементы IА и IIА подгрупп, у которых заполняется внешний ns-уровень, относятся к s-элементам: ns1 — Li, Na, K, Rb, Cs, Fr называют щелочными, а ns2 — Be, Mg, Ca, Sr, Ba, Ra — щелочноземельными.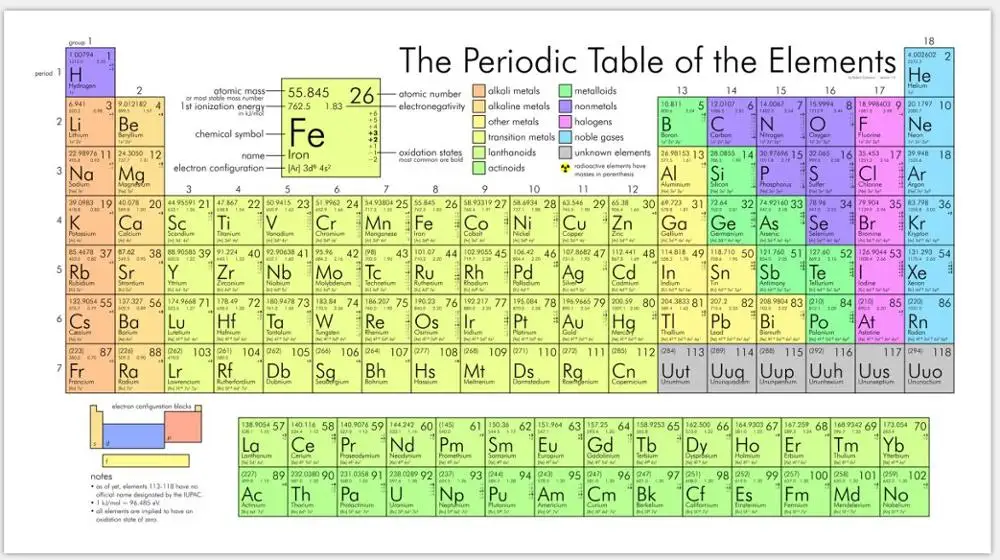
Как называется химический элемент s?
Сера (лат. Sulfur) S, химический элемент VI группы периодической системы Менделеева; атомный номер 16, атомная масса 32,06.
Какой заряд у s?
А вот в сернистой кислоте у серы заряд всего +4, поэтому она может проявлять и окислительную способность, и восстановительную.
Что такое s p d f элементы?
Названия блоков и орбиталей (s, p, d, f и g) произошло от качественной характеристики спектральных линий связанных с ними атомных орбиталей: sharp (острый), principal (главный), diffuse (расплывчатый) и fundamental (фундаментальный). Последующие названия даются в алфавитном порядке.
Блоки в периодической таблице Учебное пособие
Инструменты для творчества скоро появятся, чтобы вдохновить!
Присоединяйтесь к списку рассылки, чтобы узнать, когда мы запустимся.
Химия
Общая химия
Периодическая таблица
Блоки в периодической таблице Учебное пособие
Swati Talwar
Элементы в периодической таблице делятся на блоки в зависимости от их валентных орбиталей.
ВВЕДЕНИЕ:
В эту эпоху технологического развития вы наверняка сталкивались с функцией биометрической идентификации по отпечатку пальца. Что такого особенного в кончиках пальцев, что мы могли бы использовать их в качестве доказательства идентификации? Чем ваш отпечаток пальца отличается от отпечатка пальца другого человека? Неудивительно, что у каждого человека на этой планете есть уникальный отпечаток пальца, не похожий ни на один другой.
Каждый отпечаток пальца имеет свою уникальную особенность, будь то текстура или дизайн тонких линий, которые вы можете видеть на изображении ниже. Точно так же элементы в блоках периодической таблицы (табличное отображение химических элементов) обладают уникальными свойствами, которые не совпадают со свойствами и характеристиками любых других элементов. Давайте узнаем о них больше!
Источник
ТЕНДЕНЦИИ БЛОКОВ ПЕРИОДИЧЕСКОЙ ТАБЛИЦЫ:
Элементы периодической таблицы можно сравнить с различными стилями музыки. У каждого набора элементов есть свои особенности, но разные наборы элементов имеют некоторые общие черты электронного расположения. В периодической таблице мы можем распознать модели электрического состава и реактивности, которые помогают нам лучше понять поведение конкретных элементов.
У каждого набора элементов есть свои особенности, но разные наборы элементов имеют некоторые общие черты электронного расположения. В периодической таблице мы можем распознать модели электрического состава и реактивности, которые помогают нам лучше понять поведение конкретных элементов.
ПЕРИОДЫ:
Периоды — это семь горизонтальных рядов периодической таблицы. Количество электронов, способных заселить подуровни, которые заполняются в течение каждого периода, определяет продолжительность каждого периода.
БЛОКИ:
Блок периодической таблицы представляет собой группу элементов, связанных атомными орбиталями, в которых находятся валентные электроны или вакантные позиции. S-блок, p-блок, d-блок и f-блок обозначаются после соответствующих им орбиталей.
Источник
S-БЛОК
За исключением гелия, все элементы s-блока находятся в левой части таблицы Менделеева. Все элементы s-блока являются металлами, за исключением гелия (и, возможно, водорода).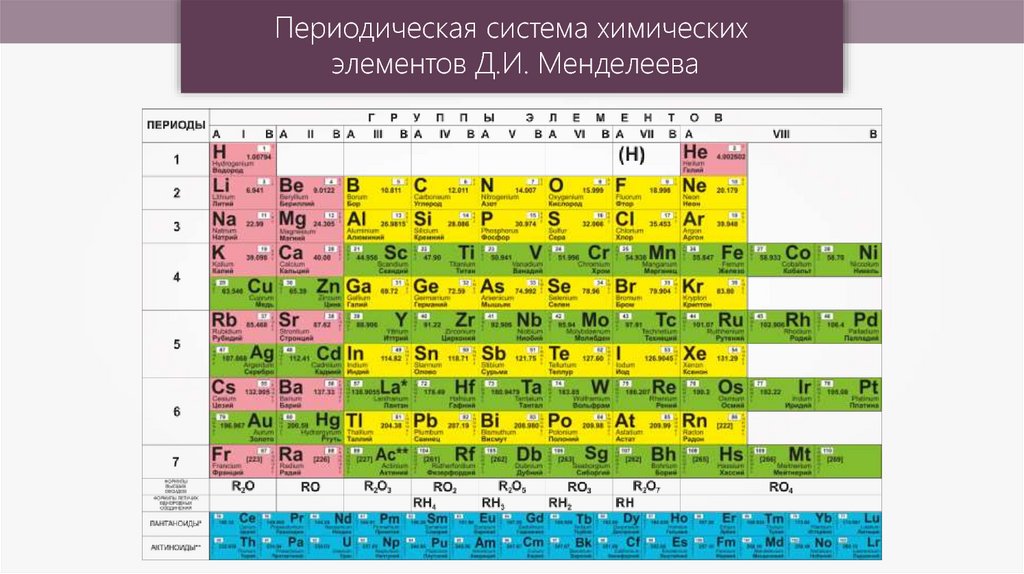 Щелочные металлы и щелочноземельные металлы составляют s-блок. Металлический характер усиливается вниз по группе.
Щелочные металлы и щелочноземельные металлы составляют s-блок. Металлический характер усиливается вниз по группе.
P-БЛОК
Элементы p-блока находятся в правой части периодической таблицы. Это последние группы из шести элементов таблицы (кроме гелия). Металлы P-блока обладают характеристиками металла, такими как блеск и хорошие проводники тепла и электричества.
D-БЛОК
Переходные металлы (элемент, имеющий частично заполненную d-подоболочку на атоме или способный образовывать катионы с незаполненной d-подоболочкой) составляют d-блок (группы 3-12). Характеристики элементов d-блока аналогичны характеристикам высокореактивных электроположительных элементов s-блока и более электроотрицательных элементов p-блока. По этой причине их называют «переходными» металлами. Они обладают типичными металлическими свойствами, каталитическими свойствами и парамагнитными свойствами.
F-БЛОК
Лантаниды и актиноиды представляют собой элементы f-блока или внутренние переходные металлы. Два ряда элементов под основной структурой периодической таблицы состоят из элементов f-блока. Все лантаноиды представляют собой серебристо-белые мягкие металлы, быстро тускнеют на воздухе и используются для производства легированных сталей для толстолистового и трубного проката. Актиноиды — радиоактивные элементы серебристого цвета.
Два ряда элементов под основной структурой периодической таблицы состоят из элементов f-блока. Все лантаноиды представляют собой серебристо-белые мягкие металлы, быстро тускнеют на воздухе и используются для производства легированных сталей для толстолистового и трубного проката. Актиноиды — радиоактивные элементы серебристого цвета.
ВЫВОД:
- Блоки таблицы Менделеева указывают на заполнение электронного подуровня.
- В периодической таблице группы — это вертикальные столбцы.
- Горизонтальные строки периодической таблицы называются периодами.
Часто задаваемые вопросы:
1. Как называются горизонтальные ряды периодической таблицы?
Периоды — это горизонтальные строки периодической таблицы.
2. Какой подуровень заполняется в периоде 1?
В первом периоде заполняется только первый подуровень. Первый период включает только два элемента, потому что все орбитали могут нести два электрона.
3. Как электронная конфигурация элемента дает информацию о периоде, в котором он находится?
Периодическая таблица представляет количество кругов в электронной структуре элемента как номер периода, к которому принадлежит элемент.
4. Какие 4 блока в периодической таблице?
Элементы в периодической таблице разделены на блоки в зависимости от их орбиталей валентных электронов. S-блок, p-блок, d-блок и f-блок — это четыре блока.
Мы надеемся, что вам понравился этот урок, и вы узнали что-то интересное о Блоках в периодической таблице ! Присоединяйтесь к нашему сообществу Discord, чтобы получить ответы на любые вопросы и пообщаться с другими студентами, такими же, как и вы! Не забудьте загрузить наше приложение, чтобы испытать наши веселые классы виртуальной реальности – мы обещаем, это делает учебу намного веселее! 😎
ИСТОЧНИКИ:
- Блоки Периодической таблицы. https://www.

- Химия класса 12. Примечания к пересмотру главы 8 — Элементы блоков d и f. https://www.vedantu.com/revision-notes/cbse-class-12-chemistry-notes-chapter-8-the-d-and-f-block-elements. По состоянию на 27 января 2022 г.
Положение элементов в периодической таблице
Элементы в середине периодической таблицы, от групп 3 до 12, называются элементами d-блока. Название d-блок происходит от того, что последний электрон попадает на d-орбиталь предпоследней оболочки. Их часто называют переходными элементами, потому что их свойства занимают промежуточное положение между высокореакционноспособными металлическими элементами s-блока и неметаллическими элементами p-блока. Блок d содержит четыре серии, соответствующие заполнению 3d-, 4d-, 5d- или 6d-орбиталей.
В общем случае переходным элементом является любой элемент, соответствующий d-блоку современной таблицы Менделеева (группы 3-12). Лантаниды и актиниды, которые являются элементами f-блока, также могут быть отнесены к категории переходных металлов. Однако, поскольку элементы f-блока содержат частичные f-орбитали, они также известны как внутренние переходные элементы или внутренние переходные металлы.
Лантаниды и актиниды, которые являются элементами f-блока, также могут быть отнесены к категории переходных металлов. Однако, поскольку элементы f-блока содержат частичные f-орбитали, они также известны как внутренние переходные элементы или внутренние переходные металлы.
Общие свойства переходных элементов
Электронная конфигурация соответствует (n-1)d 5 нс 1 или (n-1)d 10 нс 1 . Это связано со стабильностью электронных орбиталей, которые заполнены наполовину или полностью. Цинк, кадмий и ртуть не считаются переходными элементами, поскольку их электрическая конфигурация отличается от конфигурации других переходных металлов. С другой стороны, свойства остальных элементов d-блока очень похожи, и это сходство можно увидеть в каждой строке периодической таблицы.
Свойства элементов второго и третьего рядов постепенно изменяются по мере движения слева направо по периодической таблице. Внешние оболочки этих элементов имеют плохие экранирующие свойства, что увеличивает эффективный заряд ядра по мере добавления к ядру большего количества протонов. Характеристики переходных элементов перечислены ниже.
Характеристики переходных элементов перечислены ниже.
- Когда эти элементы смешиваются, они образуют цветные соединения и ионы. Переход электрона dd объясняет его цвет.
- Разница в энергии между возможными степенями окисления этих элементов невелика. В результате переходные элементы имеют широкий диапазон степеней окисления.
- Эти элементы производят огромное количество парамагнитных соединений из-за неспаренных электронов на d-орбитали.
- С этими элементами могут связываться самые разные лиганды. В результате переходные элементы образуют разнообразный набор стабильных комплексов.
- Отношение заряда к радиусу этих элементов очень велико.
- Переходные металлы твердые и имеют относительно высокую плотность по сравнению с другими элементами.
- Поскольку делокализованные d-электроны участвуют в металлических связях, эти элементы имеют высокие температуры кипения и плавления.
- Переходные элементы также являются хорошими проводниками электричества благодаря металлической связи делокализованных d-электронов.

Позиция в периодической таблице: элементы d и f – блоки
Изучение того, какие элементы находятся в определенной групповой позиции в периодической таблице, важно для понимания таких элементов в целом. Есть причина, по которой различные элементы в периодической таблице классифицируются. Компоненты блока d и f имеют определенные особенности, которые позволяют отнести их к этой категории.
Элементы d-блока состоят из элементов, созданных электронами, заполняющими оболочки 3d, 4d и 5d. Они также известны как переходные элементы, поскольку их положение в периодической таблице находится между элементами s-блока и p-блока. Их свойства являются переходными между чрезвычайно реакционноспособными металлическими элементами s-блока, часто образующими ионные соединения, и преимущественно ковалентными элементами р-блока.
Элементы D-блока или переходные элементы — это те элементы или ионы, которые имеют частично заполненную d-подоболочку, или те элементы, в которых дифференцирующиеся электроны занимают (n-1) d-подоболочку. Они назвали переходные элементы, потому что их атрибуты показывают переход от элементов левой стороны (s-блок) к светлой стороне (элементы p-блок). Существует четыре d-серии, каждая из которых начинается с (n-1)d 1 ns 2 и варьируется от группы 3 до группы 12 (или от группы IIIB до II B).
Они назвали переходные элементы, потому что их атрибуты показывают переход от элементов левой стороны (s-блок) к светлой стороне (элементы p-блок). Существует четыре d-серии, каждая из которых начинается с (n-1)d 1 ns 2 и варьируется от группы 3 до группы 12 (или от группы IIIB до II B).
В d-блоке электроны добавляются к предпоследней оболочке, увеличивая ее размер с 8 до 18. Обычно переходные элементы имеют незавершенный d-уровень. Группа 12 (цинк) имеет конфигурацию d 10 , и поскольку оболочка d полная, соединения этих элементов необычны и отличаются от других. Элементы разбиты на три полных ряда по десять элементов в каждом, а также неполный четвертый ряд. Части f-блока используются для обсуждения положения незавершенной четвертой серии. Эти элементы включают в себя драгоценные металлы, такие как серебро, золото и платина, а также важные для промышленности элементы, такие как железо, медь и никель.
Положение переходных металлов в периодической таблице
- Внутренние переходные элементы — это еще один термин для «f» — блочные элементы.
 В этих элементах последний электрон обычно входит в предпоследнюю орбиталь, т.е. (n – 2)f. Отличительный электрон в переходных элементах может входить на 4f- или 5f-орбитали, что позволяет далее классифицировать их как лантаниды или актиниды.
В этих элементах последний электрон обычно входит в предпоследнюю орбиталь, т.е. (n – 2)f. Отличительный электрон в переходных элементах может входить на 4f- или 5f-орбитали, что позволяет далее классифицировать их как лантаниды или актиниды. - Дифференцирующий электрон в лантаноидах достигает 4f-орбитали. Они варьируются от церия до лютеция. Лантаниды названы в честь элементов, которые идут сразу после лантана. Дифференцирующий электрон в актинидах выходит на 5f-орбитали. Как правило, это торий или лоуренсий.
- В периодической таблице эти элементы появляются вскоре после актиния. (n–2) f 1–14 (n–1) d 0–1 ns2 – общая электронная конфигурация f – блочных элементов. Лантаниды имеют электронную конфигурацию [Xe]4f 1–14 5d 0–1 6s 2 , а актиноиды имеют электронную конфигурацию [Rn]5f 1–14 6d 0–1 23 2 .
Примеры вопросов
Вопрос 1. Каковы металлические свойства переходных металлов?
Ответ:
Ковкость, пластичность, высокая прочность на растяжение и металлический блеск — все это характеристики переходных металлов.
Они являются хорошими проводниками тепла и электричества и имеют склонность к кристаллизации. Тенденции в металлических свойствах переходных элементов, с другой стороны, видны. Такие элементы, как хром и молибден, являются одними из самых твердых переходных металлов, поскольку они содержат большое количество неспаренных электронов.
Вопрос 2: Почему все переходные элементы являются металлами?
Ответ:
Все переходные элементы являются металлами, потому что их внешние оболочки содержат только два электрона. Благодаря прочным металлическим соединениям они также податливы, долговечны и пластичны.
Ответ:
Последний электрон в d-блоке переходит на d-орбиталь предпоследней оболочки. Электрон выходит на f-орбиталь антипредпоследней оболочки в элементах f-блока.