|
|||||||||
Наука: Наука и техника: Lenta.
 ru
ruФизики-экспериментаторы продолжают споры о положении в таблице химических элементов синтезированного искусственным образом в Дубне и Беркли атома лоуренсия. Исследование свойств этого элемента затруднено из-за его небольшого времени жизни. Об этом рассказывает Nature News.
Споры возобновились после эксперимента ученых из Японского агентства по атомной энергии. Недавно они получили изотоп лоуренсий-256 (с 103 протонами и 153 нейтронами), обстреливая атомами бора мишень из изотопов тоже искусственного элемента калифорния. Период полураспада лоуренсия составил 27 секунд, а установка позволяла получать один атом за несколько секунд.
Этот атом ученые затем направляли в среду с йодистым кадмием и осаждали на металлической подложке, нагретой до 2,7 тысячи кельвинов. Это позволило высвободить один свободный электрон на внешней оболочке лоуренсия и измерить его первый ионизационный потенциал — минимальную энергию, необходимую для отрыва внешнего электрона от свободного атома и превращения его в простейший положительно заряженный ион.
Полученное значение этой величины оказалось равным 4,96 электронвольта, что напоминает поведение внешнего электрона у таких химических элементов, как натрий и калий (из s-блока). Такое значение первого ионизационного потенциала у лоуренсия ранее теоретически предсказывали авторы из Тель-Авивского университета в Израиле. Такие расчеты часто используют эффекты специальной теории относительности.
Химическая таблица элементов организована таким образом, что атомы с родственной формой электронных облаков (наиболее вероятных областей локализации электронов в соответствии с квантовой механикой) занимают близкие позиции. Например, существуют s, p, d и f-блоки, для которых электронные облака имеют свои геометрии. Так, s-облако принимает форму сферы, а p — гантели. Схожесть формы внешних электронных облаков элементов отражает схожесть химических свойств их атомов.
Материалы по теме
13:01 — 13 мая 2014
В соответствии с этим многие ученые полагают, что лоуренсий более похож на скандий и иттрий и поэтому должен быть помещен в d-блок таблицы — туда же, где и эти элементы. Однако большинство таблиц элементов (в том числе и Менделеева) помещают лоуренсий в последнюю ячейку двух рядов 30-и элементов (f-блок), называемых лантаноидами и актиноидами.
Однако большинство таблиц элементов (в том числе и Менделеева) помещают лоуренсий в последнюю ячейку двух рядов 30-и элементов (f-блок), называемых лантаноидами и актиноидами.
Международный союз теоретической и прикладной химии, занимающийся вопросами официального регулирования химической номенклатуры, собирается рассмотреть подробно вопрос положения лоуренсия (а также лютеция) в ходе своего заседания, которое должно состояться летом 2015 года.
Русско-американский элемент снова потерял место в таблице Менделеева (Russian-American elements loses its place in the periodic table again) — the University of Groningen research portal
Publication in Lenta.ru concerning our article in Nature on the measurement of the first ionization potential of lawrencium (Nature 520, 209 (2015), cover page feature).
Физики-экспериментаторы продолжают споры о положении в таблице химических элементов синтезированного искусственным образом в Дубне и Беркли атома лоуренсия. Исследование свойств этого элемента затруднено из-за его небольшого времени жизни.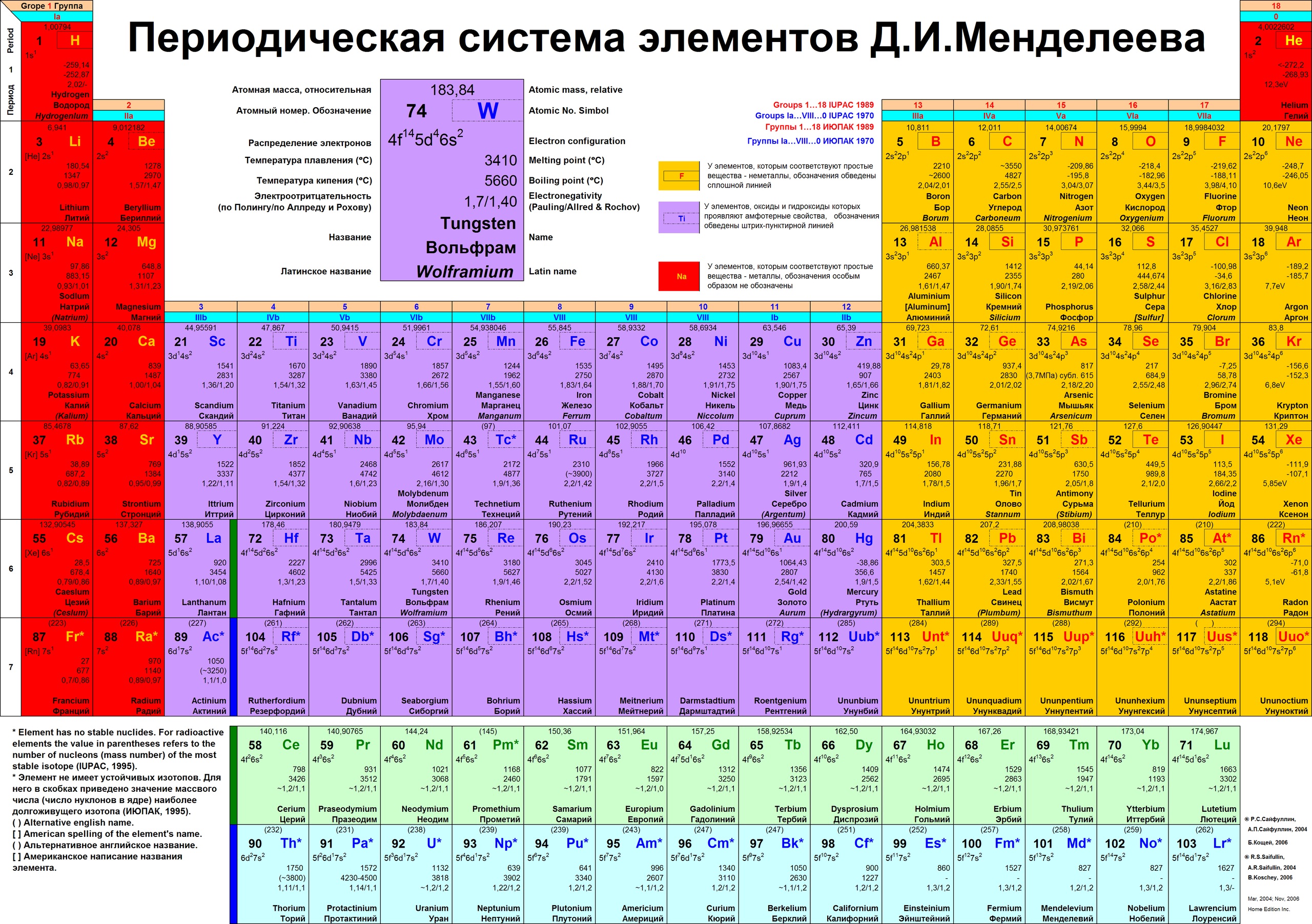 Об этом рассказывает Nature News.
Об этом рассказывает Nature News.
Этот атом ученые затем направляли в среду с йодистым кадмием и осаждали на металлической подложке, нагретой до 2,7 тысячи кельвинов. Это позволило высвободить один свободный электрон на внешней оболочке лоуренсия и измерить его первый ионизационный потенциал — минимальную энергию, необходимую для отрыва внешнего электрона от свободного атома и превращения его в простейший положительно заряженный ион.
Полученное значение этой величины оказалось равным 4,96 электронвольта, что напоминает поведение внешнего электрона у таких химических элементов, как натрий и калий (из s-блока). Такое значение первого ионизационного потенциала у лоуренсия ранее теоретически предсказывали авторы из Тель-Авивского университета в Израиле. Такие расчеты часто используют эффекты специальной теории относительности.
Такое значение первого ионизационного потенциала у лоуренсия ранее теоретически предсказывали авторы из Тель-Авивского университета в Израиле. Такие расчеты часто используют эффекты специальной теории относительности.
Химическая таблица элементов организована таким образом, что атомы с родственной формой электронных облаков (наиболее вероятных областей локализации электронов в соответствии с квантовой механикой) занимают близкие позиции. Например, существуют s, p, d и f-блоки, для которых электронные облака имеют свои геометрии. Так, s-облако принимает форму сферы, а p — гантели. Схожесть формы внешних электронных облаков элементов отражает схожесть химических свойств их атомов.
13:01 13 мая 2014
В соответствии с этим многие ученые полагают, что лоуренсий более похож на скандий и иттрий и поэтому должен быть помещен в d-блок таблицы — туда же, где и эти элементы. Однако большинство таблиц элементов (в том числе и Менделеева) помещают лоуренсий в последнюю ячейку двух рядов 30-и элементов (f-блок), называемых лантаноидами и актиноидами.
Международный союз теоретической и прикладной химии, занимающийся вопросами официального регулирования химической номенклатуры, собирается рассмотреть подробно вопрос положения лоуренсия (а также лютеция) в ходе своего заседания, которое должно состояться летом 2015 года.
Элементы главной подгруппы — щелочные металлы
В соответствии с особенностями электронной структуры и положением в периодической системе различают s-, p-, d- и /-металлы. К s-металлам относятся элементы, у которых происходит заполнение внешнего s-уровня. Это элементы главных подгрупп I и II групп периодической системы химических элементов Д. И. Менделеева — щелочные и щелочноземельные металлы. Они наиболее сильные восстановители среди металлов. К числу р-металлов относятся элементы III — IV групп, находящиеся в главных подгруппах и расположенные левее диагонали бор — астат. Металлические свойства этих элементов выражены гораздо слабее. Металлы IV— [c.141]К элементам главной подгруппы П группы относятся бериллий, магний, кальций, стронций, барий и радий.
 Все они, за исключением бериллия (проявляющего амфотерные свойства), элементы с резко выраженными металлическими свойствами. В свободном состоянии это серебристо-белые вещества. Они значительно тверже щелочных металлов. Плавятся [c.264]
Все они, за исключением бериллия (проявляющего амфотерные свойства), элементы с резко выраженными металлическими свойствами. В свободном состоянии это серебристо-белые вещества. Они значительно тверже щелочных металлов. Плавятся [c.264]У галогенов — элементов главной подгруппы УП группы – электронные конфигурации внешних оболочек одинаковые и выражаются формулой Это значит, что до восьмиэлектронной оболочки у галогенов не хватает по одному электрону. Поэтому при образовании соединения атомов щелочного металла и галогена перенос электрона схематически может быть показан так [c.72]
Главная подгруппа I группы периодической системы химических элементов Д. И. Менделеева, называемая также подгруппой щелочных металлов, включает литий Ы, натрий Ыа, калий К, рубидий КЬ, цезий Сз и франций Гг. Последний радиоактивен его единственный природный изотоп имеет период полураспада [c.142]
Элементы, составляющие главные подгруппы, по своим химическим свойствам существенно отличаются от таковых побочных подгрупп. Это можно проследить на примере I и VII групп. В главной подгруппе VII группы находятся галогены — наиболее типичные неметаллы, в то время как в побочной подгруппе находятся марганец, технеций и рений, проявляющие металлические свойства. Различия в свойствах элементов главных подгрупп и элементов побочных внутри групп вначале ослабевают при переходе от I группы ко II, III, затем вновь усиливаются в VII группе. Так, если в I группе элементы главной подгруппы (щелочные металлы) резко отличаются от элементов побочной подгруппы (медь, серебро, золото), то все элементы III группы близки по своим свойствам. Внутри подгрупп с увеличением заряда ядра возрастают металлические свойства и ослабевают неметаллические. [c.39]
Это можно проследить на примере I и VII групп. В главной подгруппе VII группы находятся галогены — наиболее типичные неметаллы, в то время как в побочной подгруппе находятся марганец, технеций и рений, проявляющие металлические свойства. Различия в свойствах элементов главных подгрупп и элементов побочных внутри групп вначале ослабевают при переходе от I группы ко II, III, затем вновь усиливаются в VII группе. Так, если в I группе элементы главной подгруппы (щелочные металлы) резко отличаются от элементов побочной подгруппы (медь, серебро, золото), то все элементы III группы близки по своим свойствам. Внутри подгрупп с увеличением заряда ядра возрастают металлические свойства и ослабевают неметаллические. [c.39]
А. ЭЛЕМЕНТЫ ГЛАВНОЙ ПОДГРУППЫ —ЩЕЛОЧНЫЕ МЕТАЛЛЫ [c.338]
Элементы первой главной подгруппы (щелочные металлы) [c.143]
К щелочноземельным металлам относят элементы главной подгруппы II группы периодической системы кальций Са, стронций 8г, барий Ва и радий Ка. Кроме них, в эту группу входят бериллий Ве и магний Mg. На внешнем слое атомов щелочноземельных металлов находится два я-электрона. Во всех соединениях они проявляют степень окисления +2. Активность металлов растет с увеличением атомного номера. Все эти элементы — типичные металлы, по свойствам близкие к щелочным. [c.146]
Кроме них, в эту группу входят бериллий Ве и магний Mg. На внешнем слое атомов щелочноземельных металлов находится два я-электрона. Во всех соединениях они проявляют степень окисления +2. Активность металлов растет с увеличением атомного номера. Все эти элементы — типичные металлы, по свойствам близкие к щелочным. [c.146]
Из атомов элементов главных подгрупп обычно получаются ноны, имеющие конфигурацию атомов благородных газов. Химическую связь в молекулах и кристаллах, состоящих пз ионов, называют ионной. Примерами веществ с ионной связью являются галогениды щелочных металлов. В дальнейшем мы увидим, что полный переход электронов от одного атома к другому никогда не происходит, следовательно, 100%-ой ионной связи не бывает. [c.68]
Рассматривая связь значения электроотрицательности с положением элемента в периодической системе, можно отметить некоторые закономерности. В горизонтальных рядах периодической системы (т. е. в периодах) наблюдается увеличение электроотрицательности слева направо (особенно для элементов главных подгрупп). Например, электроотрицательность элементов второго периода увеличивается от 1,0 для лития до 4,0 для фтора электроотрицательность элементов третьего периода — от 0,9 для натрия до 3,0 для хлора. В вертикальных рядах периодической системы (в подгруппах) наблюдается уменьшение электроотрицательности сверху вниз. Так, в подгруппе щелочных металлов электроотрицательность [c.89]
е. в периодах) наблюдается увеличение электроотрицательности слева направо (особенно для элементов главных подгрупп). Например, электроотрицательность элементов второго периода увеличивается от 1,0 для лития до 4,0 для фтора электроотрицательность элементов третьего периода — от 0,9 для натрия до 3,0 для хлора. В вертикальных рядах периодической системы (в подгруппах) наблюдается уменьшение электроотрицательности сверху вниз. Так, в подгруппе щелочных металлов электроотрицательность [c.89]
В химическом отношении элементы главной подгруппы I группы схожи. Все они активны, причем с увеличением атомного номера химическая активность металлов усиливается. При взаимодействии с неметаллами щелочные металлы образуют соединения с ионной связью. [c.143]
I. Структура группы. Первая группа элементов объединяет две подгруппы а) подгруппу щелочных металлов Ь, На, К, НЬ, Сз и Рг (главная подгруппа) и б) подгруппу меди Си, Ag и 1 и (побочная подгруппа). [c.397]
[c.397]
Почему элементы главной подгруппы второй группы менее активны, чем щелочные металлы [c.70]
Почему металлы Са, 5г, Ва, На носят название щелочно-земельных На основании сопоставления атомных радиусов и зарядов ядер элементов главных подгрупп первых и вторых групп (табл. 5 приложения) обоснуйте более слабые [c.161]
Элементы главной подгруппы I группы периодической системы элементов Д. И. Менделеева — литий, натрий, калий, рубидий, цезий и франций — называются щелочными металлами. [c.223]
Щелочными металлами называют элементы главной подгруппы первой группы периодической системы Д. И. Менделеева. К ним относятся литий натрий Na, калий К, рубидий КЬ, цезий Сз н франций Рг. Щелочными их называют потому, что их гидроксиды хорошо растворяются в воде и представляют собой сильные щелочи. [c.6]
ЩЕЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ — химические элементы главной подгруппы И группы периодической системы элементов Д. И. Менделеева Са, 8г, Ва, На. Название объясняется тем, что оксиды этих металлов (по терминологии алхимиков — земли) при растворении в воде дают щелочную реакцию. Щ. м. химически очень активны, соли их имеют большое практическое значение. [c.288]
И. Менделеева Са, 8г, Ва, На. Название объясняется тем, что оксиды этих металлов (по терминологии алхимиков — земли) при растворении в воде дают щелочную реакцию. Щ. м. химически очень активны, соли их имеют большое практическое значение. [c.288]
У элементов главных подгрупп в пределах данного периода по мере повышения номера группы (т. е. общего числа электронов на внешней оболочке) металлические свойства понижаются, а неметаллические повышаются. Так, первый член каждого периода с конфигурацией внешнего слоя fls —щелочной металл (Li, N8, Кит. д.), а предпоследний член — с атомной конфигурацией вида пз пр — типичный неметалл (Р, С1, Вг и т. д.). Замыкает период, как уже отмечалось ранее, инертный элемент с атомной конфигурацией пз пр . [c.52]
Щелочные металлы — общее название элементов главной подгруппы I группы, в которую входят литий, натрий, калий, рубидий, цезий и франций. [c.378]
Из атомов элементов главных подгрупп обычно получаются ионы, имеющие электронную конфигурацию атомов благородных газов. Химическая связь, образованная за счет кулоновских сил притяжения между противоположно заряженными ионами, на-зывается ионной. Ионная связь характерна для неорганических солей, которые в твердом состоянии существуют в виде кристаллов (ионные кристаллы). Типичными представителями ионных соединений являются галогениды щелочных металлов. Далее будет показано, что полный переход электронов от одного атома к другому никогда не происходит и 100%-ной ионной связи не бывает. [c.72]
Химическая связь, образованная за счет кулоновских сил притяжения между противоположно заряженными ионами, на-зывается ионной. Ионная связь характерна для неорганических солей, которые в твердом состоянии существуют в виде кристаллов (ионные кристаллы). Типичными представителями ионных соединений являются галогениды щелочных металлов. Далее будет показано, что полный переход электронов от одного атома к другому никогда не происходит и 100%-ной ионной связи не бывает. [c.72]
Связь между способностью элемента образовывать комплексы и положением его в таблице Менделеева. Способность элементов к комплексообразованию находится в связи с их положением в таблице Менделеева. Так, элементы главной подгруппы I группы (щелочные металлы) практически не обнаруживают способности образовывать комплексные соединения. В то же время у элементов побочной подгруппы той же группы (Си, А , Аи) это свойство ярко выражено.. [c.229]
Элементы, в атомах которых заполняются электронами s-подуровни, называют -элементами. На внешнем уровне атомов s-элементов содержится у щелочных металлов по 1 электрону, у щелочноземельных — по 2 электрона. В таблице Менделеева s-элементы расположены в главных подгруппах I—П1 групп. [c.104]
На внешнем уровне атомов s-элементов содержится у щелочных металлов по 1 электрону, у щелочноземельных — по 2 электрона. В таблице Менделеева s-элементы расположены в главных подгруппах I—П1 групп. [c.104]
Элементы главной подгруппы I группы — литий Li, натрий Ка, калий К, рубидий КЬ, цезий Сз и франций Рг — называются щелочными металлами. [c.240]
Побочную подгруппу VI группы составляют элементы хром Сг, молибден Мо и вольфрам W. Они относятся к -элементам. Их атомы на внешнем энергетическом уровне содержат у хрома и молибдена по одному электрону, у вольфрама — два электрона, что обусловливает их металлический характер и отличие от элементов главной подгруппы. В соответствии с числом валентных электронов они проявляют максимальную степень окисления +6 и образуют оксиды типа НОз, которым соответствуют кислоты общей формулы НаНО,. Сила кислот закономерно падает от хромовой до вольфрамовой.
 Большинство солей этих кислот в воде малорастворимо, однако хорошо растворяются соли щелочных металлов и аммония. [c.195]
Большинство солей этих кислот в воде малорастворимо, однако хорошо растворяются соли щелочных металлов и аммония. [c.195]ВосстаьДовительные свойства металлов в основном зависят от агрегатного состояния, среды, радиуса атома и количества валентных электронов. Наиболее сильными восстановителями являются атомы элементов главных подгрупп двух первых групп периодической системы элементов Д. И. Менделеева — щелочные и щелочно-земельные металлы, а также лантаноиды и актиноиды. Такие металлы, как Аи, Ag, Р1, 1г, Оз, Рс1, Ни, НЬ, химически малоактивны, трудно окисляются. Они имеют большие потенциалы ионизации. [c.119]
Металлы чаще всего обладают восстановительными свойствами. В периодах с повышением порядкового номера элемента восстановительные свойства простых веществ понижаются, а окислительные возрастают и становятся максимальными у галогенов. Например, в третьем периоде натрий — самый активный восстановитель, а хлор — самый активный окислитель. У элементов главных подгрупп с повышением порядкового номера усиливаются восстановительные свойства и ослабевают окислительные. Наиболее сильные восстановители — щелочные металлы, наиболее активные из них Fr и s. Лучшие окислители — галогены. [c.320]
У элементов главных подгрупп с повышением порядкового номера усиливаются восстановительные свойства и ослабевают окислительные. Наиболее сильные восстановители — щелочные металлы, наиболее активные из них Fr и s. Лучшие окислители — галогены. [c.320]
Элементы главной подгруппы. Щелочные металлы — наиболее типичные представители металлов. Металлические свойства выражены у них наиболее резко. Атомы их слабо удерживают свой единственный валентный электрон. Поэтому они легко окисляются, будучи в то же время энергичными восстановителями. Они расположены в начале электрохимического ряда встречаются в природе только в виде химических соединениГг. Не могут быть восстановлены нз этих соединений ни углем, ни окисью углерода, ни водородом. [c.390]
I группу составляют элементы ns (главная подгруппа— щелочные металлы) и (п—l)fl °ns (побочная подгруппа—меди). Во П группе находятся элементы ns (главная подгруппа — бериллия) и (п—l)d °ns (побочная подгруппа — цинка), в П1 группе — ns np (главная подгруппа — бора) и (п— )d ns (побочная подгруппа — скандия), в 1Vгруппе —п, 2 р2 (главная подгруппа — углерода) и (п—I)d ns (побочная подгруппа — титана), bV группе — ns np (главная подгруппа — азота) и (п—l) ns2 или [п—l)o %s (побочная подгруппа — ванадия), в VI группе — ns np (главная подгруппа — кислорода) и (п— )d ns пли (п—l)flf ns (побочная подгруппа— хрома), в VII группе — ns np (главная подгруппа— фтора) и п— )d ns (побочная подгруппа — марганца). В VIII группе не было главной подгруппы, но [c.96]
В VIII группе не было главной подгруппы, но [c.96]
К -элементам относят подгруппу щелочных металлов (Ы, Ка, К, ИЬ, Сй, Рг) со стру1 турой внешнего слоя 1, главную подгруппу второй группы (Ве, Мд, Са, 8г, Ва, Ка) со структурой а также водород и гелий. Всего в периодической системе 14 -элементов. [c.80]
Атомные и ионные радиусы элементов главной подгруппы II группы значительно меньше радиусов соседних щелочных металлов. Это связано с большим зарядом и по.пным заполнением внешних электронных 8-слоев щелочноземельных металлов. Сравнительные характеристики щелочных и щелочноземельных элементов даны в таблице 29. Физические свойства щелочноземельных металлов приведены а таблице 31. [c.146]
Поэтому наиболее слабыми комплпксообразователями являются благородные газы и элементы главных подгрупп I и УП групп периодической системы (щелочные элементы и галогены). Максимальная комплексообразующая способность наблюдается у -элементов УП1 группы (элементы семейства железа и платиновые металлы), а также у элементов побочных подгрупп I и И групп периодической системы.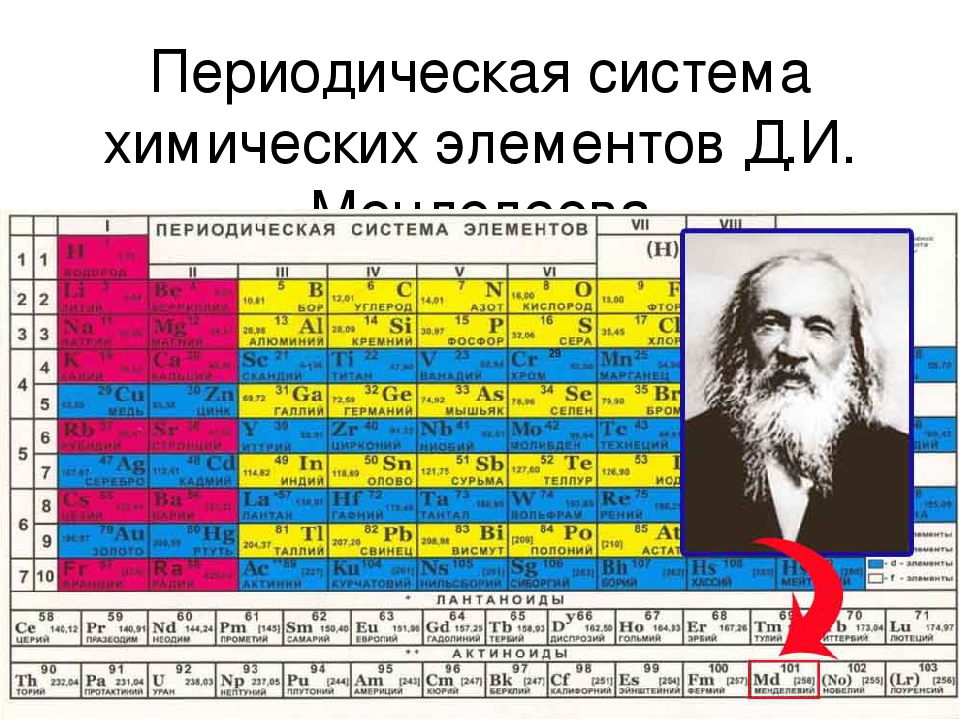 [c.365]
[c.365]
ЩЕЛОЧНЫЕ МЕТАЛЛЫ — химические элементы главной подгруппы I группы периодической системы элементов Д. И. Менделеева 11, Ыа, К1 Р1), Сз и радиоактианый элемент Рг. Гидроксиды Щ. м.— сильные основания (щелочи). Щ. м.— химически активные элементы — активность их возрастает от кРг. [c.288]
Вторая группа. Для всех элементов этой группы характерна степень окисления – -2. Атомы элементов главной подгруппы (Ве, Mg, Са, 5г, Ва и На) имеют на внешнем слое два з-электрона. По восстановительной способности элементы этой подгруппы уступают щелочным металлам (атомы последних имеют б6льц1ие размеры), хотя в связи с возрастанием атомных радиусов Са, 8г, Ва и Ка являются сильными восстановителями. Ионы Ве2+, Са +, Зг – , Ва – и Ка – , будучи аналогами ионов подгруппы лития, имеют конфигурацию атомов благородных газов, но отличаются от зарядом и меньшими радиусами. Поэтому их гидроксиды слабее гидроксидов щелочных металлов. Рост радиусов ионов в ряду Ве +—Ка + приводит к тому, что если Ве(ОН)г — амфотерное соединение, а Mg(0H)2 — слабое основание, то Са(ОН)2 — сильное основание, а Ва(0Н)г — очень сильное основание, хорошо растворимое в воде это щелочь, что нашло отражение и в его названии (едкий барит). [c.90]
[c.90]
Элементы главной подгруппы. В таблице XVI1-3 приводится структура атомов щелочных металлов по электронным слоям. Валентные электроны ( з ) обозначены курсивом. [c.399]
Оксиды элементов главной подгруппы I группы, т. е. оксиды щелочных металлов, получают косвенным путем. Только литий при сгорании в кислороде образует оксид 20, натрий дает пероксид МагОг, калий, рубидий и цезий — соединения типа МеОг. Известны также озониды типа МеОз. Все эти высшие оксиды —пероксиды и супероксиды — обнаруживают тем большую устойчивость, чем больше радиус атома металла, т. е. чем больше стабилизирующее действие катиона на пероксид-анион О . [c.287]
Элементы главной подгруппы I группы—литий 1т, натрий Ма, калий К, рубидий кЬ, цезий Сз и франций Рг — наз ,1варот щелочными металлами. [c.266]
У элементов главных подгрупп с повышением порядкового номера усиливаются восстановительные свойства и ослабевают окислительные.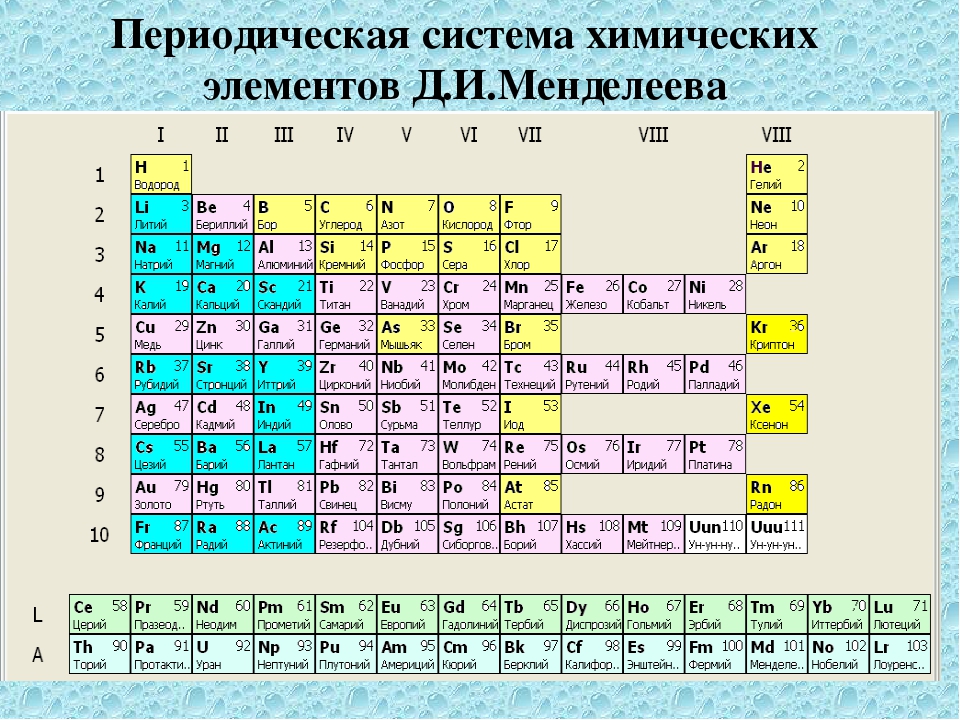 Лучшие восстановители.— щелочные металлы, а наиболее активные из них Fr и s. Лучшие окислители— галогены. Элементы главных подгрупп IV—VII групп (неметаллы) могут как отдавать, так и принимать электроны и проявлять восстаноЕитель-ные и окислительные свойства. Исключение составляет фтор. Он проявляет только окислительные свойства, так как обладает наибольшей относительной электроотрицательностью (см. табл. 1.2). [c.89]
Лучшие восстановители.— щелочные металлы, а наиболее активные из них Fr и s. Лучшие окислители— галогены. Элементы главных подгрупп IV—VII групп (неметаллы) могут как отдавать, так и принимать электроны и проявлять восстаноЕитель-ные и окислительные свойства. Исключение составляет фтор. Он проявляет только окислительные свойства, так как обладает наибольшей относительной электроотрицательностью (см. табл. 1.2). [c.89]
Японские учёные оспорили место химического элемента № 103 в таблице Менделеева
Физики-экспериментаторы продолжают споры о положении в таблице химических элементов синтезированного искусственным образом в Дубне и Беркли атома химического элемента №103. Исследование свойств этого элемента затруднено из-за его небольшого времени жизни. Об этом рассказывает Nature News.
Споры возобновились после эксперимента ученых из Японского агентства по атомной энергии. Недавно они получили изотоп лоуренсий-256 (с 103 протонами и 153 нейтронами), обстреливая атомами бора мишень из изотопов тоже искусственного элемента калифорния. Период полураспада лоуренсия составил 27 секунд, а установка позволяла получать один атом за несколько секунд.
Период полураспада лоуренсия составил 27 секунд, а установка позволяла получать один атом за несколько секунд.
Этот атом ученые затем направляли в среду с йодистым кадмием и осаждали на металлической подложке, нагретой до 2,7 тысячи кельвинов. Это позволило высвободить один свободный электрон на внешней оболочке лоуренсия и измерить его первый ионизационный потенциал — минимальную энергию, необходимую для отрыва внешнего электрона от свободного атома и превращения его в простейший положительно заряженный ион.
Полученное значение этой величины оказалось равным 4,96 электронвольта, что напоминает поведение внешнего электрона у таких химических элементов, как натрий и калий (из s-блока). Такое значение первого ионизационного потенциала у лоуренсия ранее теоретически предсказывали авторы из Тель-Авивского университета в Израиле. Такие расчеты часто используют эффекты специальной теории относительности.
Химическая таблица элементов организована таким образом, что атомы с родственной формой электронных облаков (наиболее вероятных областей локализации электронов в соответствии с квантовой механикой) занимают близкие позиции. Например, существуют s, p, d и f-блоки, для которых электронные облака имеют свои геометрии. Так, s-облако принимает форму сферы, а p — гантели. Схожесть формы внешних электронных облаков элементов отражает схожесть химических свойств их атомов.
Например, существуют s, p, d и f-блоки, для которых электронные облака имеют свои геометрии. Так, s-облако принимает форму сферы, а p — гантели. Схожесть формы внешних электронных облаков элементов отражает схожесть химических свойств их атомов.
В соответствии с этим многие ученые полагают, что лоуренсий более похож на скандий и иттрий и поэтому должен быть помещен в d-блок таблицы — туда же, где и эти элементы. Однако большинство таблиц элементов (в том числе и Менделеева) помещают лоуренсий в последнюю ячейку двух рядов 30-и элементов (f-блок), называемых лантаноидами и актиноидами.
Это уже не первый случай неопределённости с химическими свойства сверхтяжёлых элементов. Химический элемент с атомнем номером 112, открытый в середине 1990-х годов независимо друг от друга учеными из Дубны (Россия) и Дармштадта (Германия) и получивший в 2009 году название “коперниций”, по своему месту в таблице Менделеева должен быть химическим аналогом ртути. Однако опыты, проведенные в Дубне в 2003 году, неожиданно показали, что 112-й элемент является химическим аналогом не ртути, а инертного газа радона. То есть свойства сверхтяжелых элементов отклоняются от таблицы Менделеева. Ученые трактовали это как “первое яркое подтверждение влияния релятивистских эффектов на свойства сверхтяжелых элементов”. Однако более точные эксперименты, проведенные в Дубне в 2006 году, показали, что 112-й элемент является все-таки аналогом ртути.
То есть свойства сверхтяжелых элементов отклоняются от таблицы Менделеева. Ученые трактовали это как “первое яркое подтверждение влияния релятивистских эффектов на свойства сверхтяжелых элементов”. Однако более точные эксперименты, проведенные в Дубне в 2006 году, показали, что 112-й элемент является все-таки аналогом ртути.
Международный союз теоретической и прикладной химии (IUPAC), занимающийся вопросами официального регулирования химической номенклатуры, собирается рассмотреть подробно вопрос положения лоуренсия (а также лютеция) в ходе своего заседания, которое должно состояться летом 2015 года.
Напомним, о синтезе химического элемента №103 впервые объявили в 1961 году сотрудники национальной лаборатории в Беркли, которые предложили для данного элемента название “лоуренсий” (в честь изобретателья циклотрона Э.Лоуренса). Однако экперименты, проведённые в СССР и в Европе, не подтвердили достоверность этих экспериментов. Фактически реальный синтез элемента №103 был проведён сотрудниками Г. Н. Флёрова в Объединённом институте ядерных исследований в Дубне в 1965-1967 гг., которые предложили для этого элемента название “резерфордий” в честь Э.Резерфорда. Американцы в журнале “The Physical Review” (август 1971 г.) были вынуждены признать, что “элемент номер 103 впервые был синтезирован в Дубне”. Тем не менее в 1997 году IUPAC утвердил за этим элементом название “лоуренсий”.
Н. Флёрова в Объединённом институте ядерных исследований в Дубне в 1965-1967 гг., которые предложили для этого элемента название “резерфордий” в честь Э.Резерфорда. Американцы в журнале “The Physical Review” (август 1971 г.) были вынуждены признать, что “элемент номер 103 впервые был синтезирован в Дубне”. Тем не менее в 1997 году IUPAC утвердил за этим элементом название “лоуренсий”.
Электронная структура и периодическая таблица
8.4 Электронная структура и периодическая таблица
Цели обучения
- Свяжите электронные конфигурации элементов с формой периодической таблицы.
- Определите ожидаемую электронную конфигурацию элемента по его месту в периодической таблице.
В главе 3 «Атомы, молекулы и ионы» мы представили периодическую таблицу как инструмент для систематизации известных химических элементов.Таблица Менделеева показана на рис. 8.8 «Периодическая таблица». Элементы перечислены по атомному номеру (числу протонов в ядре), а элементы с аналогичными химическими свойствами сгруппированы вместе в столбцы.
Рисунок 8.8 Периодическая таблица
Почему периодическая таблица Менделеева имеет такую структуру? Ответ довольно прост, если вы понимаете электронные конфигурации: форма периодической таблицы имитирует заполнение подоболочек электронами .
Начнем с H и He. Их электронные конфигурации: 1 с 1 и 1 с 2 соответственно; He заполнена оболочка n = 1. Эти два элемента составляют первую строку периодической таблицы (см. Рис. 8.9 «1»).
Рисунок 8.9. 1 s Subshell
H и He представляют собой заполнение подоболочки 1 s .
Следующие два электрона, для Li и Be, войдут в подоболочку 2 s .Рисунок 8.10 «2» показывает, что эти два элемента находятся рядом в периодической таблице.
Рисунок 8.10 2 s Дополнительная оболочка
В Li и Be заполняется подоболочка 2 s .
Для следующих шести элементов подоболочка 2 p занята электронами. В правой части периодической таблицы эти шесть элементов (от B до Ne) сгруппированы вместе (рис. 8.11 «2»).
Рисунок 8.11 The 2 p Дополнительная оболочка
Для B – Ne занята подоболочка 2 p .
Следующая подоболочка, которую необходимо заполнить, – это подоболочка 3 s . Когда эта подоболочка заполняется, элементы Na и Mg снова находятся в левой части периодической таблицы (рис. 8.12 «3»).
Рисунок 8.12 3 s Дополнительная оболочка
Сейчас занята подоболочка 3 s .
Затем подоболочка 3 p заполняется следующими шестью элементами (рисунок 8.13 «Тройка»).
Рисунок 8.13 3 p Дополнительная оболочка
Далее подоболочка 3 p заполняется электронами.
Вместо заполнения подоболочки 3 d затем электроны переходят в подоболочку 4 s (рис.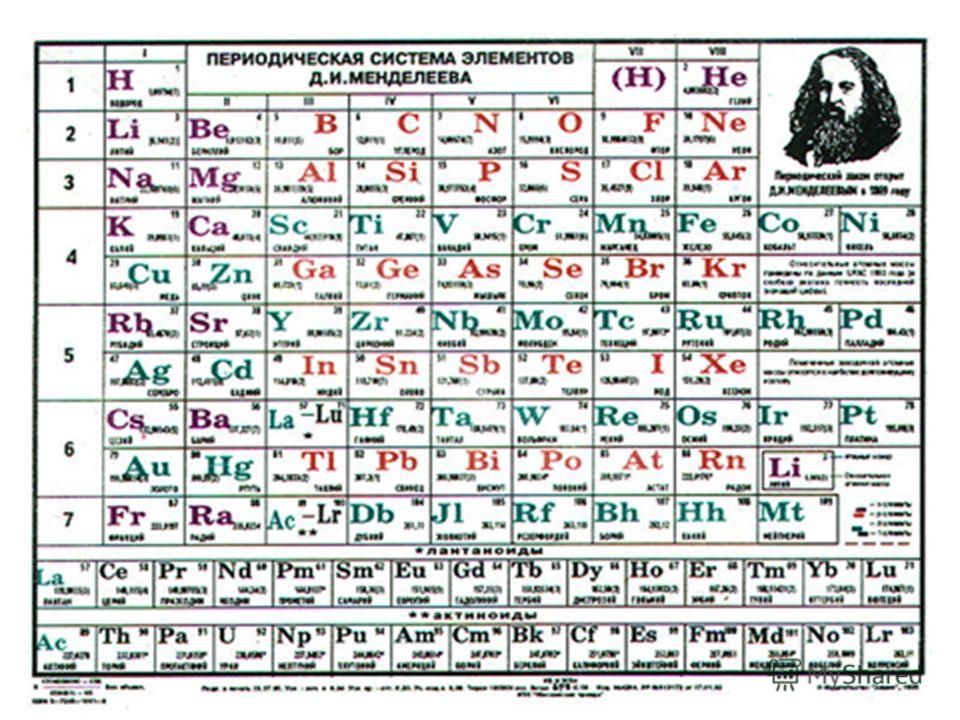 8.14 «4»).
8.14 «4»).
Рисунок 8.14. 4 s Дополнительная оболочка
Подоболочка 4 s заполняется перед подоболочкой 3 d . Это отражено в структуре таблицы Менделеева.
После заполнения подоболочки 4 s , подоболочка 3 d заполняется максимум 10 электронами. Это объясняет раздел из 10 элементов в середине периодической таблицы (рис. 8.15 «3»).
Рисунок 8.15. 3 d Дополнительная оболочка
Подоболочка 3 d заполнена в средней части таблицы Менделеева.
И так далее. Когда мы проходим по строкам периодической таблицы, общая форма таблицы показывает, как электроны занимают оболочки и подоболочки.
Первые два столбца в левой части таблицы Менделеева – это то место, где заняты подоболочки s . Из-за этого первые две строки периодической таблицы помечены как блок s Столбцы периодической таблицы, в которых заняты s подоболочки. будучи занятым. – крайние правые шесть столбцов периодической таблицы, блок d Столбцы периодической таблицы, в которых заняты d подоболочки.это средние 10 столбцов периодической таблицы, а блок f – столбцы периодической таблицы, в которых заняты f подоболочки. это секция из 14 столбцов, которая обычно изображается отдельно от основной части таблицы Менделеева. Она могла быть частью основного тела, но тогда таблица Менделеева была бы довольно длинной и громоздкой. На рисунке 8.16 «Блоки периодической таблицы» показаны блоки периодической таблицы.
будучи занятым. – крайние правые шесть столбцов периодической таблицы, блок d Столбцы периодической таблицы, в которых заняты d подоболочки.это средние 10 столбцов периодической таблицы, а блок f – столбцы периодической таблицы, в которых заняты f подоболочки. это секция из 14 столбцов, которая обычно изображается отдельно от основной части таблицы Менделеева. Она могла быть частью основного тела, но тогда таблица Менделеева была бы довольно длинной и громоздкой. На рисунке 8.16 «Блоки периодической таблицы» показаны блоки периодической таблицы.
Рисунок 8.16 Блоки периодической таблицы
Периодическая таблица разделена на блоки в зависимости от того, какая подоболочка заполняется атомами, принадлежащими к этому разделу.
Электроны в оболочке с самым большим номером плюс любые электроны в последней незаполненной подоболочке, называются валентными электронами. Электроны в оболочке с самым высоким номером плюс любые электроны в последней незаполненной подоболочке; Оболочка с наибольшим номером называется валентной оболочкой. Оболочка с наибольшим номером в атоме, которая содержит электроны … (Внутренние электроны называются остовными электронами ). Валентные электроны в значительной степени контролируют химию атома. Если мы посмотрим только на электронную конфигурацию валентной оболочки, мы обнаружим, что в каждом столбце электронная конфигурация валентной оболочки одинакова.Например, возьмите элементы в первом столбце периодической таблицы: H, Li, Na, K, Rb и Cs. Их электронные конфигурации (сокращенно для более крупных атомов) следующие, с выделенной электронной конфигурацией валентной оболочки:
Оболочка с наибольшим номером в атоме, которая содержит электроны … (Внутренние электроны называются остовными электронами ). Валентные электроны в значительной степени контролируют химию атома. Если мы посмотрим только на электронную конфигурацию валентной оболочки, мы обнаружим, что в каждом столбце электронная конфигурация валентной оболочки одинакова.Например, возьмите элементы в первом столбце периодической таблицы: H, Li, Na, K, Rb и Cs. Их электронные конфигурации (сокращенно для более крупных атомов) следующие, с выделенной электронной конфигурацией валентной оболочки:
| H: | 1с 1 |
| Li: | 1 с 2 2 с 1 |
| Na: | [Ne] 3s 1 |
| К: | [Ar] 4s 1 |
| руб: | [Kr] 5s 1 |
| CS: | [Xe] 6s 1 |
Все они имеют одинаковую электронную конфигурацию в их валентных оболочках: один электрон s . Поскольку большая часть химии элемента находится под влиянием валентных электронов, мы ожидаем, что эти элементы будут иметь схожий химический состав – и . Организация электронов в атомах объясняет не только форму периодической таблицы, но и тот факт, что элементы в одном столбце периодической таблицы имеют схожий химический состав.
Поскольку большая часть химии элемента находится под влиянием валентных электронов, мы ожидаем, что эти элементы будут иметь схожий химический состав – и . Организация электронов в атомах объясняет не только форму периодической таблицы, но и тот факт, что элементы в одном столбце периодической таблицы имеют схожий химический состав.
То же самое относится и к другим столбцам периодической таблицы. Элементы в каждом столбце имеют одинаковые электронные конфигурации валентной оболочки, и элементы имеют схожие химические свойства.Это строго верно для всех элементов в блоках s и p . В блоках d и f из-за исключений из порядка заполнения подоболочек электронами аналогичные валентные оболочки не являются абсолютными в этих блоках. Однако в этих блоках действительно существует много общего, поэтому ожидается сходство по химическим свойствам.
Сходство электронной конфигурации валентной оболочки означает, что мы можем определить электронную конфигурацию атома только по его положению в периодической таблице. Рассмотрим Se, как показано на рис. 8.17 «Селен в таблице Менделеева». Он находится в четвертом столбце блока p . Это означает, что его электронная конфигурация должна заканчиваться электронной конфигурацией p 4 . Действительно, электронная конфигурация Se имеет вид [Ar] 4 s 2 3 d 10 4 p 4 , как и ожидалось.
Рассмотрим Se, как показано на рис. 8.17 «Селен в таблице Менделеева». Он находится в четвертом столбце блока p . Это означает, что его электронная конфигурация должна заканчиваться электронной конфигурацией p 4 . Действительно, электронная конфигурация Se имеет вид [Ar] 4 s 2 3 d 10 4 p 4 , как и ожидалось.
Рисунок 8.17 Селен в Периодической таблице
Пример 8
По положению элемента в таблице Менделеева предскажите электронную конфигурацию валентной оболочки для каждого атома.См. Рис. 8.18 «Различные элементы периодической таблицы».
- Ca
- Sn
Решение
- Ca находится во втором столбце блока s . Можно ожидать, что его электронная конфигурация должна заканчиваться на s 2 . Электронная конфигурация кальция [Ar] 4 s 2 .

- Sn расположен во втором столбце блока p , поэтому мы ожидаем, что его электронная конфигурация будет заканчиваться на p 2 .Электронная конфигурация олова [Kr] 5 s 2 4 d 10 5 p 2 .
Проверьте себя
По положению элемента в таблице Менделеева предскажите электронную конфигурацию валентной оболочки для каждого атома. См. Рис. 8.18 «Различные элементы периодической таблицы».
- Ti
- Класс
Ответить
- [Ar] 4 с 2 3 d 2
- [Ne] 3 с 2 3 p 5
Рисунок 8.18 различных элементов периодической таблицы
Приложение для еды и напитков: искусственные красители
Цвет предметов обусловлен другим механизмом, нежели цвета неоновых и других газоразрядных ламп. Хотя цветные огни создают свои цвета, объекты окрашены, потому что они предпочтительно отражают определенный цвет от белого света, который на них падает. Красный помидор, например, ярко-красный, потому что он отражает красный свет, поглощая все остальные цвета радуги.
Хотя цветные огни создают свои цвета, объекты окрашены, потому что они предпочтительно отражают определенный цвет от белого света, который на них падает. Красный помидор, например, ярко-красный, потому что он отражает красный свет, поглощая все остальные цвета радуги.
Многие продукты, например помидоры, сильно окрашены; Фактически, распространенное утверждение «вы сначала едите глазами» – это неявное признание того, что внешний вид пищи так же важен, как и ее вкус. Но как насчет полуфабрикатов?
Во многие обработанные пищевые продукты добавлены пищевые красители. Пищевые красители бывают двух видов: натуральные и искусственные. Натуральные пищевые красители включают карамелизованный сахар для коричневого цвета; аннато, куркума и шафран для различных оттенков оранжевого или желтого; бетанин из свеклы для пурпура; и даже кармин, темно-красный краситель, который получают из кошенили, небольшого насекомого, паразитирующего на кактусах в Центральной и Южной Америке. (Правильно: возможно, вы едите сок насекомых!)
(Правильно: возможно, вы едите сок насекомых!)
Некоторые расцветки искусственные. В США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов в настоящее время одобряет только семь соединений в качестве искусственных красителей в продуктах питания, напитках и косметике:
- FD&C Blue # 1: бриллиантовый синий FCF
- FD&C Синий # 2: Индиготин
- FD&C Green # 3: Быстрый зеленый FCF
- RD&C Red # 3: Эритрозин
- FD&C Red # 40: Красный Allura AC
- FD&C Yellow # 5: тартразин
- FD&C Желтый # 6: Желтый закат FCF
Цвета с меньшими номерами больше не представлены на рынке или были удалены по разным причинам.Обычно эти искусственные красители представляют собой большие молекулы, которые очень сильно поглощают свет определенных цветов, что делает их полезными даже при очень низких концентрациях в пищевых продуктах и косметике.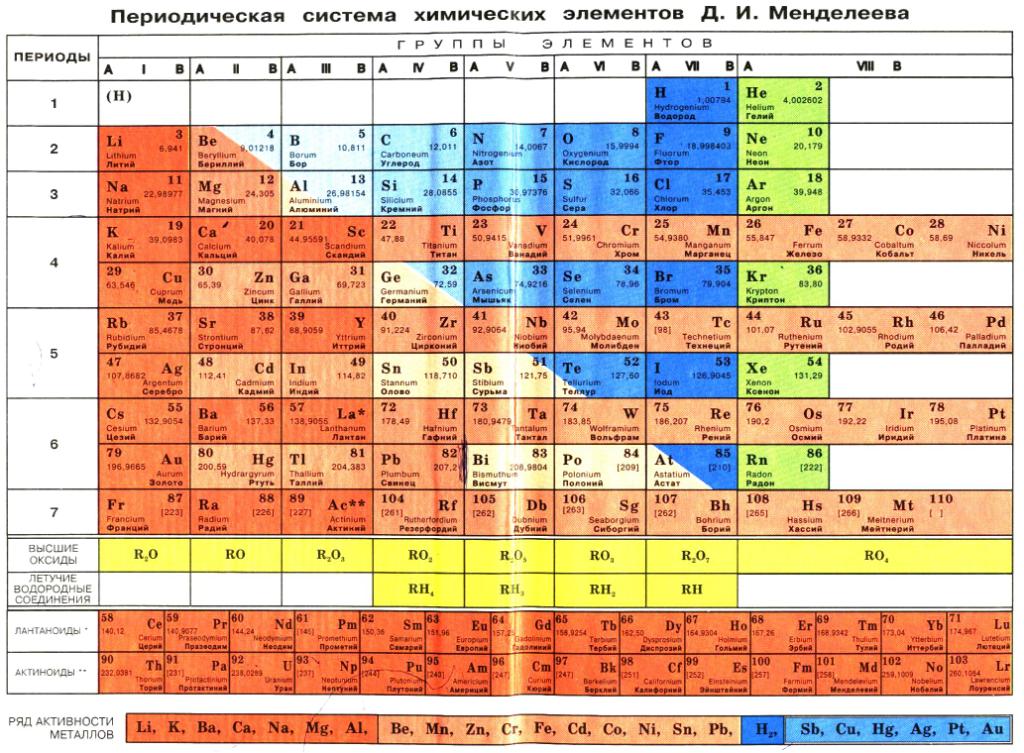 Некоторые критики заявляют, что даже при таких небольших количествах, небольшая часть населения (особенно дети) чувствительны к искусственным окраскам, и призывают сократить или прекратить их использование. Однако формальные исследования искусственной окраски и ее влияния на поведение неубедительны или противоречивы. Несмотря на это, большинство людей по-прежнему предпочитают обработанные пищевые продукты с искусственными красителями (как показано на прилагаемом рисунке).
Некоторые критики заявляют, что даже при таких небольших количествах, небольшая часть населения (особенно дети) чувствительны к искусственным окраскам, и призывают сократить или прекратить их использование. Однако формальные исследования искусственной окраски и ее влияния на поведение неубедительны или противоречивы. Несмотря на это, большинство людей по-прежнему предпочитают обработанные пищевые продукты с искусственными красителями (как показано на прилагаемом рисунке).
Искусственные пищевые красители содержатся в различных пищевых продуктах, например, в обработанных пищевых продуктах, конфетах и яичных красителях. Даже корма для домашних животных содержат искусственные пищевые красители, хотя вполне вероятно, что животному все равно!
Ключевые выводы
- Расположение электронов в атомах определяет форму таблицы Менделеева.
- Электронные конфигурации можно предсказать по положению атома в периодической таблице.

Упражнения
Где в периодической таблице находятся s подоболочки, занятые электронами?
Где в периодической таблице находятся подоболочки d , занятые электронами?
В каком блоке находится Ра?
В каком блоке находится Br?
Каковы электронные конфигурации валентных оболочек элементов во втором столбце периодической таблицы?
Каковы электронные конфигурации валентных оболочек элементов в предпоследнем столбце периодической таблицы?
Каковы электронные конфигурации валентных оболочек элементов в первом столбце блока p ?
Каковы электронные конфигурации валентных оболочек элементов в последнем столбце блока p ?
По положению элемента в таблице Менделеева предскажите электронную конфигурацию каждого атома.

- Sr
- S
По положению элемента в таблице Менделеева предскажите электронную конфигурацию каждого атома.
- Fe
- Ba
По положению элемента в таблице Менделеева предскажите электронную конфигурацию каждого атома.
- В
- Ар
По положению элемента в таблице Менделеева предскажите электронную конфигурацию каждого атома.
- Класс
- К
По положению элемента в таблице Менделеева предскажите электронную конфигурацию каждого атома.

- Ge
- С
По положению элемента в таблице Менделеева предскажите электронную конфигурацию каждого атома.
- мг
- Я
ответов
- 1 с 2 2 с 2 2 п 6 3 с 2 3 с 6 4 с 2 3 d 10 4 п.
 6 5 с 2
6 5 с 2 - 1 с 2 2 с 2 2 с 6 3 с 2 3 с 4
- 1 с 2 2 с 2 2 п 6 3 с 2 3 с 6 4 с 2 3 d 10 4 п.
- 1 с 2 2 с 2 2 п 6 3 с 2 3 с 6 4 с 2 3 d 3
- 1 с 2 2 с 2 2 с 6 3 с 2 3 с 6
- 1 с 2 2 с 2 2 п 6 3 с 2 3 с 6 4 с 2 3 d 10 4 п 2
- 1 с 2 2 с 2 2 с 2
5.
 17: Электронные конфигурации и периодическая таблица
17: Электронные конфигурации и периодическая таблица Обычно используемая длинная форма таблицы Менделеева предназначена для подчеркивания электронных конфигураций. Поскольку именно внешние (валентные) электроны в первую очередь участвуют в химических взаимодействиях между атомами, последних электронов, добавленных к атому в процессе наращивания, представляют гораздо больший интерес для химика, чем первый. Этот последний электрон называется , отличительным электроном , потому что он отличает атом от атома, непосредственно предшествующего ему в периодической таблице.Тип подоболочки ( s, p, d, f ), в которую помещается отличительный электрон, очень тесно связан с химическим поведением элемента и дает начало классификации, показанной цветовой кодировкой на периодической таблице. здесь. Представительные элементы – это те, в которых отличительный электрон входит в подоболочку s или p . Большинство элементов, химический состав и валентность которых мы обсуждали до сих пор, попадают в эту категорию. Многие химические свойства типичных элементов можно объяснить на основе диаграмм Льюиса.То есть валентность типичных элементов может быть предсказана на основе количества имеющихся у них валентных электронов или количества электронов, которые должны были бы быть добавлены для достижения такой же электронной конфигурации, как у атома благородного человека. газ. Для репрезентативных элементов количество валентных электронов такое же, как номер периодической группы, а количество, необходимое для соответствия следующей конфигурации благородного газа, равно 8 минус номер группы. Это согласуется с правилами валентности, полученными из периодической таблицы, и приводит к формулам для хлоридов первой дюжины элементов, которые показывают периодическое изменение валентности.
Многие химические свойства типичных элементов можно объяснить на основе диаграмм Льюиса.То есть валентность типичных элементов может быть предсказана на основе количества имеющихся у них валентных электронов или количества электронов, которые должны были бы быть добавлены для достижения такой же электронной конфигурации, как у атома благородного человека. газ. Для репрезентативных элементов количество валентных электронов такое же, как номер периодической группы, а количество, необходимое для соответствия следующей конфигурации благородного газа, равно 8 минус номер группы. Это согласуется с правилами валентности, полученными из периодической таблицы, и приводит к формулам для хлоридов первой дюжины элементов, которые показывают периодическое изменение валентности.
| Элемент | Атомный вес | Водородные соединения | Кислородные соединения | Соединения хлора |
|---|---|---|---|---|
| Водород | 1,01 | H 2 | H 2 O, H 2 O 2 | HCl |
| Гелий | 4. 00 00 | Не сформировано | Не сформировано | Не сформировано |
| Литий | 6,94 | LiH | Li 2 O, Li 2 O 2 | LiCl |
| Бериллий | 9,01 | BeH 2 | BeO | BeCl 2 |
| Бор | 10.81 | В 2 В 6 | B 2 O 3 | BCl 3 |
| Углерод | 12. 01 01 | CH 4 , C 2 H 6 , C 3 H 8 | CO 2 , CO, C 2 O 3 | CCl 4 , C 2 Класс 6 |
| Азот | 14.01 | NH 3 , N 2 H 4 , HN 3 | N 2 O, NO, NO 2 , N 2 O 5 | NCl 3 |
| Кислород | 16,00 | H 2 O, H 2 O 2 | О 2 , О 3 | |
| фтор | 19. 00 00 | HF | ИЗ 2 , О 2 Ф 2 | ClF, ClF 3 , ClF 5 |
| Неон | 20,18 | Не сформировано | Не сформировано | Не сформировано |
| Натрий | 22,99 | NaH | Na 2 O, Na 2 O 2 | NaCl |
| Магний | 24. 31 31 | мг / ч 2 | MgO | MgCl 2 |
Первые три горизонтальных ряда или периода в современной периодической таблице полностью состоят из репрезентативных элементов. В первом периоде отличительные электроны для H и He находятся в подоболочке 1 s . Во втором периоде Li и Be имеют отличительные электроны в подоболочке 2 s , и электроны добавляются к подоболочке 2 p в атомах от B до Ne.В третьем периоде подоболочка 3 s заполняется для Na и Mg и, следовательно, для Al, Si, P, S, Cl и Ar. Как правило, в случае репрезентативных элементов отличительный электрон будет в подоболочке нс или нс . Значение n , главного квантового числа для различимого электрона, можно быстро определить путем обратного отсчета от вершины таблицы Менделеева. Например, йод является типичным элементом пятого периода .Следовательно, отличительный электрон должен занимать подоболочку 5 s или 5 p . Поскольку я находится справа от таблицы, правильный выбор 5 p .
Например, йод является типичным элементом пятого периода .Следовательно, отличительный электрон должен занимать подоболочку 5 s или 5 p . Поскольку я находится справа от таблицы, правильный выбор 5 p .
Когда главное квантовое число равно трем или более, возможны также подоболочки типа d . Переходные элементы или переходные металлы – это те элементы, чей отличительный электрон находится на орбитали d . Первые примеры переходных металлов (Sc, Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Zn) находятся в четвертом периоде , хотя в каждом случае отличительным электроном является 3 d электронов. и относится к третьей оболочке .Этот перерыв возникает, как мы уже видели, потому что 4 s имеет меньшую энергию, чем 3 d . Таким образом, 4 орбитали s начинают заполняться, начиная четвертый период до того, как любая из 3 орбиталей d может быть занята.
На рисунке \ (\ PageIndex {1} \) сравниваются распределения вероятностей 4 s и 3 d электрона в атоме V. Хотя электронное облако 4 s находится в среднем дальше от ядра, чем облако 3 d , небольшая часть электронной плотности 4 s находится очень близко к ядру, где оно почти не защищено от общей ядерный заряд +23.Это очень сильная сила притяжения этой небольшой части общей плотности электронов 4 s , которая понижает энергию электрона 4 s ниже энергии электрона 3 d .
Хотя электронное облако 4 s находится в среднем дальше от ядра, чем облако 3 d , небольшая часть электронной плотности 4 s находится очень близко к ядру, где оно почти не защищено от общей ядерный заряд +23.Это очень сильная сила притяжения этой небольшой части общей плотности электронов 4 s , которая понижает энергию электрона 4 s ниже энергии электрона 3 d .
Тот факт, что электронное облако 4 s шире, чем облако 3 d , оказывает важное влияние на химию переходных элементов. Когда атом, такой как V (рисунок \ (\ PageIndex {1} \)), взаимодействует с другим атомом, именно 4 s электронов, идущие дальше всего от ядра, первыми контактируют с другим атомом.Таким образом, 4 s электронов часто более значимы, чем 3 d при определении валентности и формул соединений. 3 d электронов «похоронены» под поверхностью атомов переходных металлов. Добавление еще одного электрона 3 d оказывает значительно меньшее влияние на их химические свойства, чем добавление еще одного электрона 3 s или 3 p в случае типичных элементов. Следовательно, происходит медленный, но устойчивый переход свойств от одного переходного элемента к другому.Обратите внимание, например, что, за исключением Sc, все переходные металлы образуют хлориды, MCl2, где металл имеет валентность 2; примерами являются TiCl2, VCl2, CrCl2 и так далее. Это можно увидеть в таблице вверху этой страницы. Валентность 2 соответствует двум валентным электронам 4s.
Добавление еще одного электрона 3 d оказывает значительно меньшее влияние на их химические свойства, чем добавление еще одного электрона 3 s или 3 p в случае типичных элементов. Следовательно, происходит медленный, но устойчивый переход свойств от одного переходного элемента к другому.Обратите внимание, например, что, за исключением Sc, все переходные металлы образуют хлориды, MCl2, где металл имеет валентность 2; примерами являются TiCl2, VCl2, CrCl2 и так далее. Это можно увидеть в таблице вверху этой страницы. Валентность 2 соответствует двум валентным электронам 4s.
Каждый из переходных металлов также проявляет другие валентности, в которых также задействованы один или несколько из 3 d электронов. Например, в некоторых соединениях V (ванадий) имеет валентность 2 (VO, VCl 2 ), в других он имеет валентность 3 (V 2 O 3 , VCl 3 ), в третьих он имеет валентность 4 (VO 2 , VCl 4 ), и по крайней мере в одном случае (V 2 O 5 ) он имеет валентность 5. Химия переходных металлов более сложна, и из-за этой переменной валентности возможно более широкое разнообразие формул для соединений переходных металлов. В некоторых случаях электроны в подоболочках d действуют как валентные электроны, а в других – нет. Хотя 3 электронных облака d не простираются дальше от ядра, чем 3 s и 3 p (и, следовательно, не составляют другую оболочку, как 4 s электронов), они полностью защищены от ядерных заряжаются и поэтому часто действуют как валентные электроны.Такое поведение Джекила и Хайда для 3 d электронов делает жизнь более сложной (и часто гораздо более интересной) для химиков, изучающих переходные элементы.
Химия переходных металлов более сложна, и из-за этой переменной валентности возможно более широкое разнообразие формул для соединений переходных металлов. В некоторых случаях электроны в подоболочках d действуют как валентные электроны, а в других – нет. Хотя 3 электронных облака d не простираются дальше от ядра, чем 3 s и 3 p (и, следовательно, не составляют другую оболочку, как 4 s электронов), они полностью защищены от ядерных заряжаются и поэтому часто действуют как валентные электроны.Такое поведение Джекила и Хайда для 3 d электронов делает жизнь более сложной (и часто гораздо более интересной) для химиков, изучающих переходные элементы.
| Z | Элемент | Конфигурация |
|---|---|---|
| 1 | H | 1 с 1 |
| 2 | He | 1 с 2 |
| 3 | Ли | [He] 2 s 1 |
| 4 | Be | [He] 2 s 2 |
| 5 | B | [He] 2 с 2 2 с 1 |
| 6 | С | [He] 2 с 2 2 с 2 |
| 7 | N | [He] 2 с 2 2 с 3 |
| 8 | 0 | [He] 2 с 2 2 с 4 |
| 9 | F | [He] 2 с 2 2 с 5 |
| 10 | Ne | [He] 2 с 2 2 с 6 |
| 11 | Na | [Ne] 3 с 1 |
| 12 | мг | [Ne] 3 с 2 |
| 13 | Al | [Ne] 3 с 2 3 с 1 |
| 14 | Si | [Ne] 3 с 2 3 с 2 |
| 15 | P | [Ne] 3 с 2 3 с 3 |
| 16 | S | [Ne] 3 с 2 3 с 4 |
| 17 | Класс | [Ne] 3 с 2 3 с 5 |
| 18 | Ar | [Ne] 3 с 2 3 с 6 |
| 19 | К | [Ar] 4 с 1 |
| 20 | Ca | [Ar] 4 с 2 |
| 21 | SC | [Ar] 3 d 1 4 s 2 |
| 22 | Ti | [Ar] 3 d 2 4 s 2 |
| 23 | В | [Ar] 3 d 3 4 s 2 |
| 24 | Cr | [Ar] 3 d 5 4 s 1 |
| 25 | Mn | [Ar] 3 d 5 4 s 2 |
| 26 | Fe | [Ar] 3 d 6 4 s 2 |
| 27 | Co | [Ar] 3 d 7 4 s 2 |
| 28 | Ni | [Ar] 3 d 8 4 s 2 |
| 29 | Cu | [Ar] 3 d 10 4 s 1 |
| 30 | Zn | [Ar] 3 d 10 4 s 2 |
| 31 | Ga | [Ar] 3 d 10 4 s 2 4 p 1 |
| 32 | Ge | [Ar] 3 d 10 4 s 2 4 p 2 |
| 33 | As | [Ar] 3 d 10 4 s 2 4 p 3 |
| 34 | SE | [Ar] 3 d 10 4 s 2 4 p 4 |
| 35 | Br | [Ar] 3 d 10 4 s 2 4 p 5 |
| 36 | Кр | [Ar] 3 d 10 4 s 2 4 p 6 |
| 37 | руб. | [Kr] 5 с 1 |
| 38 | Sr | [Kr] 5 с 2 |
| 39 | Y | [Kr] 4 d 1 5 s 2 |
| 40 | Zr | [Kr] 4 d 2 5 s 2 |
| 41 | Nb | [Kr] 4 d 4 5 s 1 |
| 42 | Пн | [Kr] 4 d 5 5 s 1 |
| 43 | TC | [Kr] 4 d 5 5 s 2 |
| 44 | Ру | [Kr] 4 d 7 5 s 1 |
| 45 | Rh | [Kr] 4 d 8 5 s 1 |
| 46 | Pd | [Kr] 4 д 10 |
| 47 | Ag | [Kr] 4 d 10 5 s 1 |
| 48 | Cd | [Kr] 4 d 10 5 s 2 |
| 49 | В | [Kr] 4 d 10 5 s 2 5 p 1 |
| 50 | Sn | [Kr] 4 d 10 5 s 2 5 p 2 |
| 51 | Сб | [Kr] 4 d 10 5 s 2 5 p 3 |
| 52 | Te | [Kr] 4 d 10 5 s 2 5 p 4 |
| 53 | I | [Kr] 4 d 10 5 s 2 5 p 5 |
| 54 | Xe | [Kr] 4 d 10 5 s 2 5 p 6 |
| 55 | CS | [Xe] 6 с 1 |
| 56 | Ba | [Xe] 6 с 2 |
| 57 | Ла | [Xe] 5 d 1 6 s 2 |
| 58 | CE | [Xe] 4 f 1 5 d 1 6 s 2 |
| 59 | Pr | [Xe] 4 f 3 6 s 2 |
| 60 | Nd | [Xe] 4 f 4 6 s 2 |
| 61 | PM | [Xe] 4 f 5 6 s 2 |
| 62 | см | [Xe] 4 f 6 6 s 2 |
| 63 | Eu | [Xe] 4 f 7 6 s 2 |
| 64 | Gd | [Xe] 4 f 7 5 d 1 6 s 2 |
| 65 | Тб | [Xe] 4 f 9 6 s 2 |
| 66 | Dy | [Xe] 4 f 10 6 s 2 |
| 67 | Ho | [Xe] 4 f 11 6 s 2 |
| 68 | Er | [Xe] 4 f 12 6 s 2 |
| 69 | ТМ | [Xe] 4 f 13 6 s 2 |
| 70 | Yb | [Xe] 4 f 14 6 s 2 |
| 71 | Лю | [Xe] 4 f 14 5 d 1 6 s 2 |
| 72 | Hf | [Xe] 4 f 14 5 d 2 6 s 2 |
| 73 | Ta | [Xe] 4 f 14 5 d 3 6 s 2 |
| 74 | Вт | [Xe] 4 f 14 5 d 4 6 s 2 |
| 75 | Re | [Xe] 4 f 14 5 d 5 6 s 2 |
| 76 | 0с | [Xe] 4 f 14 5 d 6 6 s 2 |
| 77 | Ir | [Xe] 4 f 14 5 d 7 6 s 2 |
| 78 | Pt | [Xe] 4 f 14 5 d 9 6 s 1 |
| 79 | Au | [Xe] 4 f 14 5 d 10 6 s 1 |
| 80 | Hg | [Xe] 4 f 14 5 d 10 6 s 2 |
| 81 | Тл | [Xe] 4 f 14 5 d 10 6 s 2 6 p 1 |
| 82 | Пб | [Xe] 4 f 14 5 d 10 6 s 2 6 p 2 |
| 83 | Bi | [Xe] 4 f 14 5 d 10 6 s 2 6 p 3 |
| 84 | Po | [Xe] 4 f 14 5 d 10 6 s 2 6 p 4 |
| 85 | по адресу | [Xe] 4 f 14 5 d 10 6 s 2 6 p 5 |
| 86 | Rn | [Xe] 4 f 14 5 d 10 6 s 2 6 p 6 |
| 87 | Fr | [Rn] 7 с 1 |
| 88 | Ra | [Rn] 7 с 2 |
| 89 | Ac | [Rn] 6 d 1 7 s 2 |
| 90 | Чт | [Rn] 6 d 2 7 s 2 |
| 91 | Па | [Rn] 5 f 2 6 d 1 7 s 2 |
| 92 | U | [Rn] 5 f 3 6 d 1 7 s 2 |
| 93 | Np | [Rn] 5 f 4 6 d 1 7 s 2 |
| 94 | Pu | [Rn] 5 f 6 7 s 2 |
| 95 | Am | [Rn] 5 f 7 7 s 2 |
| 96 | см | [Rn] 5 f 7 6 d 1 s 2 |
| 97 | Bk | [Rn] 5 f 9 s 2 |
| 98 | Cf | [Rn] 5 f 10 s 2 |
| 99 | Es | [Rn] 5 f 11 s 2 |
| 100 | Fm | [Rn] 5 f 12 s 2 |
| 101 | Md | [Rn] 5 f 13 s 2 |
| 102 | № | [Rn] 5 f 14 s 2 |
| 103 | Lr | [Rn] 5 f 14 6 d 1 s 2 |
| 104 | Rf | [Rn] 5 f 14 6 d 2 s 2 |
Третья основная категория элементов возникает, когда отличительный электрон занимает подоболочку f . Первый пример имеет место в случае лантаноидов (элементы с атомными номерами от 57 до 71). Лантаноиды имеют общую электронную конфигурацию
Первый пример имеет место в случае лантаноидов (элементы с атомными номерами от 57 до 71). Лантаноиды имеют общую электронную конфигурацию
- [Kr] 4 d 10 4 f i 5 s 2 5 p 6 5 d 0 или 1 6 s 2
, где i – число от 0 до 14.Таким образом, в процессе наращивания лантаноидов электроны добавляются к подоболочке (4 f ), главное квантовое число которой на два меньше, чем у самой внешней орбитали (6 s ). Добавление еще одного электрона во внутреннюю оболочку, похороненную так глубоко, как 4 f , практически не влияет на химические свойства этих элементов. Все они очень похожи на лантан (La) и могут поместиться в точно такое же пространство в периодической таблице, что и La. Элементы лантаноидов настолько похожи друг на друга, что для их разделения требуются специальные методы. В результате даже приблизительно чистые образцы большинства из них не были приготовлены до 1870-х годов. За элементом актиний (Ac) идет ряд атомов, в которых заполняется подоболочка 5 f . Актиноиды несколько менее похожи на Ac, чем лантаноиды на La, потому что некоторые исключения из обычного порядка заполнения орбиталей происходят в случае Th, Pa и U (Таблица \ (\ PageIndex {1} \)).
В результате даже приблизительно чистые образцы большинства из них не были приготовлены до 1870-х годов. За элементом актиний (Ac) идет ряд атомов, в которых заполняется подоболочка 5 f . Актиноиды несколько менее похожи на Ac, чем лантаноиды на La, потому что некоторые исключения из обычного порядка заполнения орбиталей происходят в случае Th, Pa и U (Таблица \ (\ PageIndex {1} \)).
Поскольку лантаноиды и большинство актиноидов химически ведут себя так, как будто они должны соответствовать группе IIIB периодической таблицы (где находятся Lu и Lr), обе группы отделены от остальной части таблицы и помещены вместе в блок ниже. Взятые вместе, лантаноиды и актиноиды называются внутренними переходными элементами , потому что заполняемые подоболочки и лежат так глубоко в оставшейся электронной структуре их атомов.
Рисунок \ (\ PageIndex {2} \) суммирует тип подоболочки, в которой должен быть найден отличительный электрон для атомов элементов в различных областях периодической таблицы. Эта сводная информация позволяет относительно просто использовать периодическую таблицу для получения электронных конфигураций, как показано в следующем примере.
Пример \ (\ PageIndex {1} \): электронная конфигурация
Получите электронную конфигурацию для (a) Nb; (б) Пр.
Решение
a) Nb, номер элемента 41, находится в пятом периоде и в области периодической таблицы, где заполняется подоболочка d (вторая серия переходов).Двигаясь назад (к более низким атомным номерам) по периодической таблице, ближайший благородный газ – это Kr, поэтому мы используем ядро Kr:
Nb [Kr] _____
Следующий элемент после 36 K – это 37 Rb, которым заполняется подоболочка 5s. Перемещаясь еще на одну позицию вправо, мы приходим к 38 Sr, который имеет пару 5 s 2 . Пока у нас есть Nb [Kr] _____ 5 s 2 для конфигурации Nb. Теперь мы переместимся дальше вправо в область 4 d подоболочки периодической таблицы и посчитаем по трем пробелам (Y, Zr, Nb), чтобы получить Nb.Таким образом, полная электронная конфигурация равна Nb [Kr] 4 d 3 5 s 2 (Обратите внимание, что главное квантовое число подоболочки d равно 4 – на единицу меньше числа периода. , если вы посмотрите на таблицу электронных конфигураций, следует отметить, что Nb является исключением из типичных правил заполнения орбиты) b) Аналогичная процедура выполняется для Pr, элемент номер 59. Двигаясь назад по таблице, ближайший благородный газ – Xe, поэтому мы используем ядро Xe.Снова считая вперед, Cs и Ba соответствуют 6 s 2 . Тогда La, Ce и Pr соответствуют еще трем электронам в подоболочке 4 f . Таким образом, конфигурация следующая: Pr … [Xe] 4 f 3 6 s 2
Пока у нас есть Nb [Kr] _____ 5 s 2 для конфигурации Nb. Теперь мы переместимся дальше вправо в область 4 d подоболочки периодической таблицы и посчитаем по трем пробелам (Y, Zr, Nb), чтобы получить Nb.Таким образом, полная электронная конфигурация равна Nb [Kr] 4 d 3 5 s 2 (Обратите внимание, что главное квантовое число подоболочки d равно 4 – на единицу меньше числа периода. , если вы посмотрите на таблицу электронных конфигураций, следует отметить, что Nb является исключением из типичных правил заполнения орбиты) b) Аналогичная процедура выполняется для Pr, элемент номер 59. Двигаясь назад по таблице, ближайший благородный газ – Xe, поэтому мы используем ядро Xe.Снова считая вперед, Cs и Ba соответствуют 6 s 2 . Тогда La, Ce и Pr соответствуют еще трем электронам в подоболочке 4 f . Таким образом, конфигурация следующая: Pr … [Xe] 4 f 3 6 s 2 Следует подчеркнуть еще один момент, касающийся взаимосвязи между электронной конфигурацией и периодической таблицей. Атомы элементов в одном вертикальном столбце таблицы имеют схожую электронную конфигурацию .Например, рассмотрим щелочноземельные элементы (группа IIA). Используя наши правила для получения электронных конфигураций (Пример 1), мы имеем
Атомы элементов в одном вертикальном столбце таблицы имеют схожую электронную конфигурацию .Например, рассмотрим щелочноземельные элементы (группа IIA). Используя наши правила для получения электронных конфигураций (Пример 1), мы имеем
| Элемент | Электронная конфигурация | Диаграмма Льюиса |
|---|---|---|
| Be | [He] 2 с 2 | Be : |
| мг | [Ne] 3 с 2 | мг : |
| Ca | [Ар] 4 с 2 | Ca : |
| Sr | [Kr] 5 с 2 | Sr : |
| Ba | [Xe] 6 с 2 | Ba : |
| Ra | [Rn] 7 с 2 | Ra : |
Таким образом, сходство химического поведения и валентности, отмеченное ранее для этих элементов, коррелирует со сходством их внешних электронных облаков. Такое сходство объясняет успех предсказаний Менделеева свойств неоткрытых элементов.
Такое сходство объясняет успех предсказаний Менделеева свойств неоткрытых элементов.
Авторы и авторство
6.9: Электронные конфигурации и периодическая таблица
Цели обучения
- Для согласования расположения атомов в периодической таблице создаются блоки, соответствующие заполнению орбиталей ns , np , nd и nf
Как вы уже знаете, электронные конфигурации элементов объясняют необычную форму периодической таблицы Менделеева.Хотя таблица была первоначально организована на основе физического и химического сходства между элементами внутри групп, это сходство в конечном итоге связано с орбитальными энергетическими уровнями и принципом Паули, который заставляет отдельные подоболочки заполняться в определенном порядке. В результате периодическая таблица может быть разделена на «блоки», соответствующие типу заполняемой подоболочки, как показано на рисунке \ (\ PageIndex {1} \). Например, два столбца слева, известные как блок s , состоят из элементов, в которых заполняются орбитали ns .Шесть столбцов справа, элементы, в которых заполняются орбитали np , составляют блок p . Между ними находятся 10 столбцов блока d , элементы, в которых заполнены орбитали ( n – 1) d . Внизу лежат 14 столбцов блока f , элементы в которых заполнены орбитали ( n -2) f . Поскольку два электрона могут быть размещены на одной орбитали, количество столбцов в каждом блоке такое же, как максимальная электронная емкость подоболочки: 2 для нс , 6 для np , 10 для ( n – 1) d и 14 для ( n -2) f .В каждом столбце каждый элемент имеет одинаковую конфигурацию валентных электронов, например, нс 1 (группа 1) или нс 2 нс 1 (группа 13). Как вы увидите, это отражается в важном сходстве химической активности и связи элементов в каждой колонке.
Например, два столбца слева, известные как блок s , состоят из элементов, в которых заполняются орбитали ns .Шесть столбцов справа, элементы, в которых заполняются орбитали np , составляют блок p . Между ними находятся 10 столбцов блока d , элементы, в которых заполнены орбитали ( n – 1) d . Внизу лежат 14 столбцов блока f , элементы в которых заполнены орбитали ( n -2) f . Поскольку два электрона могут быть размещены на одной орбитали, количество столбцов в каждом блоке такое же, как максимальная электронная емкость подоболочки: 2 для нс , 6 для np , 10 для ( n – 1) d и 14 для ( n -2) f .В каждом столбце каждый элемент имеет одинаковую конфигурацию валентных электронов, например, нс 1 (группа 1) или нс 2 нс 1 (группа 13). Как вы увидите, это отражается в важном сходстве химической активности и связи элементов в каждой колонке.
Поскольку каждая орбиталь может иметь максимум 2 электрона, есть 2 столбца в блоке s , 6 столбцов в блоке p , 10 столбцов в блоке d и 14 столбцов в блоке f .
Водород и гелий расположены несколько произвольно. Хотя водород не является щелочным металлом, его электронная конфигурация предполагает сходство с литием ([He] 2 s 1 ) и другими элементами в первой колонке.Хотя гелий с заполненной подоболочкой нс должен быть химически подобен другим элементам с электронной конфигурацией нс 2 , закрытая основная оболочка доминирует в его химическом составе, что оправдывает ее размещение над неоном справа.
Пример \ (\ PageIndex {1} \)
Используйте таблицу Менделеева, чтобы предсказать конфигурацию валентных электронов всех элементов группы 2 (бериллий, магний, кальций, стронций, барий и радий).
Дано: серия элементов
Запрошено: конфигураций валентных электронов
Стратегия:
- Укажите блок в периодической таблице, которому принадлежат элементы группы 2.Найдите ближайший благородный газ перед каждым элементом и определите главное квантовое число валентной оболочки каждого элемента.

- Запишите конфигурацию валентных электронов каждого элемента, сначала указав заполненные внутренние оболочки, используя символ ближайшего предшествующего благородного газа, а затем перечислив главное квантовое число его валентной оболочки, его валентные орбитали и количество валентных электронов на каждой орбитали. как надстрочные индексы.
Раствор:
A Элементы группы 2 находятся в блоке s периодической таблицы, и, как элементы группы 2, все они имеют два валентных электрона.Начиная с бериллия, мы видим, что ближайшим к нему предшествующим благородным газом является гелий, а главное квантовое число его валентной оболочки составляет n = 2.
B Таким образом, бериллий имеет электронную конфигурацию [He] s 2 . Ожидается, что следующий элемент ниже, магний, будет иметь точно такое же расположение электронов в основной оболочке n = 3: [Ne] s 2 . Путем экстраполяции мы ожидаем, что все элементы группы 2 будут иметь электронную конфигурацию нс 2 .
Путем экстраполяции мы ожидаем, что все элементы группы 2 будут иметь электронную конфигурацию нс 2 .
Упражнение \ (\ PageIndex {1} \)
Используйте таблицу Менделеева, чтобы предсказать характерную конфигурацию валентных электронов галогенов в группе 17.
- Ответ
Все они имеют электронную конфигурацию нс 2 np 5 , на один электрон меньше электронной конфигурации благородного газа. (Обратите внимание, что более тяжелые галогены также имеют заполненные ( n – 1) d 10 подоболочки, а также ( n – 2) f 14 подоболочки для Rn; однако это не так. , влияют на их химию каким-либо существенным образом.
Сводка
Расположение атомов в периодической таблице приводит к появлению блоков, соответствующих заполнению орбиталей ns , np , nd и nf для получения отличительных химических свойств элементов в блоке s , p block , d block и f block соответственно.
Таблица Менделеева
Периодическая таблицаПериодическая таблица элементов
| щелочные металлы | щелочноземельных металлов | переходные металлы | калькогенов |
| галогены | благородные газы | лантаноидов | актинидов |
щелкните элемент, чтобы просмотреть его свойства
Вернуться в главное меню| # = атомный номер | масса = атомная масса (в г / моль) |
| плотность = плотность (в г / мл) | № оксида = наиболее частая степень окисления |
| т.пл. = точка плавления (в градусах Цельсия) | bp = точка кипения (в градусах Цельсия) |
| EN = электроотрицательность | Энергия ионизации = (в кДж / моль) |
рад. = атомный радиус (в Ангстремах) = атомный радиус (в Ангстремах) |
| Элемент (симв.) | # | Масса | плотность | оксид # | mp | bp | EN | Энергия ионизации | рад. |
|---|---|---|---|---|---|---|---|---|---|
| Водород (H) | 1 | 1,01 | 0,00009 | +1, -1 | -259 | -286 | 2,1 | 1314 | 0,37 |
| Гелий (He) | 2 | 4.00 | 0,00018 | – | – | -269 | – | 2372 | 1,22 |
| Литий (Li) | 3 | 6,94 | 0,53 | +1 | 181 | 1347 | 1,0 | 520, 7298 | 1,52 |
| Бериллий (Be) | 4 | 9,012 | 1,85 | +2 | 1278 | 2970 | 1,5 | 899, 1757, 14848 | 1.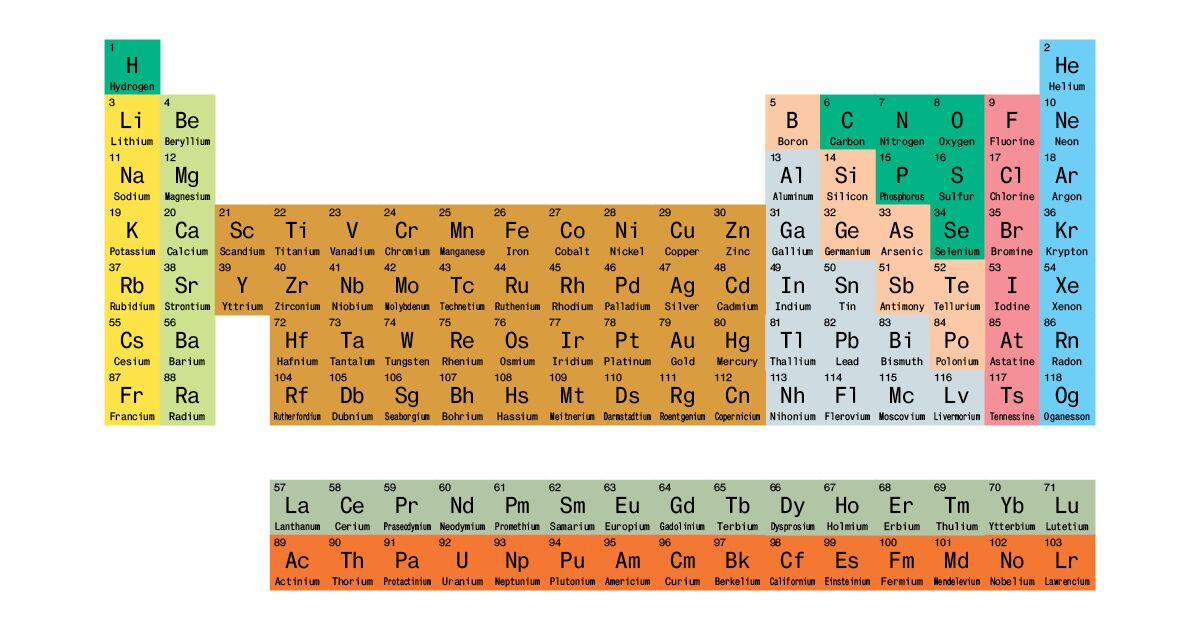 11 11 |
| Бор (B) | 5 | 10,81 | 2,34 | +3 | 2300 | 2550 | 2,0 | 801, 2427, 3660, 25025 | 0,88 |
| Углерод (C) | 6 | 12,011 | 3,51 | +4 | 3550 | 4827 | 2,5 | 1086 | 0,77 |
| Азот (N) | 7 | 14,01 | 0.00125 | +5, -3 | -210 | -196 | 3,0 | 1402 | 0,70 |
| Кислород (O) | 8 | 16,00 | 0,00143 | -2, -1 | -218 | -183 | 3,5 | 1314 | 0,66 |
| Фтор (F) | 9 | 19,00 | 0,00169 | -1 | -220 | -188 | 4,0 | 1681 | 0.64 |
| Неон (Ne) | 10 | 20,18 | 0,0009 | – | -249 | -246 | – | 2079 | 1,6 |
вернуться к таблице
| Элемент (симв.) | # | Масса | плотность | Оксид № | mp | bp | EN | Энергия ионизации | |
|---|---|---|---|---|---|---|---|---|---|
| Натрий (Na) | 11 | 22.99 | 0,97 | +1 | 98 | 883 | 0,9 | 496, 4562 | 1,86 |
| Магний (Mg) | 12 | 24,31 | 1,74 | +2 | 649 | 1090 | 1,2 | 738, 1451, 7733 | 1,60 |
| Алюминий (Al) | 13 | 26,98 | 2,70 | +3 | 660 | 2467 | 1.5 | 578, 1817, 2745, 11577 | 1,43 |
| Кремний (Si) | 14 | 28,09 | 2,33 | +4 | 1410 | 2355 | 1,8 | 786 | 1,11 |
| Фосфор (P) | 15 | 20,97 | 1,82 | +5 | 44 | 280 | 2,1 | 1012 | 1,11 |
| Сера (S) | 16 | 32.07 | 2,07 | +6, +4, -2 | 113 | 445 | 2,5 | 1000 | 1,04 |
| Хлор (Cl) | 17 | 35,45 | 0,00321 | -1 | -101 | -35 | 3,0 | 1251 | 0,99 |
| Аргон (Ar) | 18 | 39,95 | 0,00178 | – | -189 | -186 | – | 1519 | 1.91 |
| Калий (К) | 19 | 39,10 | 0,86 | +1 | 64 | 774 | 0,8 | 419, 3051 | 2,31 |
| Кальций (Ca) | 20 | 40,08 | 1,54 | +2 | 839 | 1484 | 1,0 | 590, 1145, 4912 | 1,97 |
вернуться к таблице
| Элемент (симв.) | # | Масса | плотность | Оксид № | mp | bp | EN | Энергия ионизации | |
|---|---|---|---|---|---|---|---|---|---|
| Скандий (Sc) | 21 | 44,96 | 3,0 | +3 | 1541 | 2831 | 1,3 | 632 | 1,44 |
| Титан (Ti) | 22 | 47,88 | 4,5 | +4 | 1660 | 3287 | 1,5 | 657 | 1,32 |
| Ванадий (V) | 23 | 50,94 | 6,0 | +5 | 1890 | 3380 | 1.5 | 649 | 1,22 |
| Хром (Cr) | 24 | 52,00 | 7,2 | +3, +6 | 1857 | 2672 | 1,6 | 653 | 1,18 |
| Марганец (Mn) | 25 | 54,94 | 7,2 | +7, +4, +2 | 1244 | 1962 | 1,5 | 715 | 1,17 |
| Железо (Fe) | 26 | 55.85 | 7,9 | +3, +2 | 1535 | 2750 | 1,8 | 757 | 1,17 |
| Кобальт (Co) | 27 | 58,93 | 8,9 | +3, +2 | 1495 | 2870 | 1,8 | 757 | 1,16 |
| Никель (Ni) | 28 | 58,96 | 8,9 | +2 | 1453 | 2732 | 1,8 | 736 | 1.15 |
| Медь (Cu) | 29 | 63,55 | 8,9 | +2, +1 | 1083 | 2567 | 1,9 | 745 | 1,17 |
| Цинк (Zn) | 30 | 65,39 | 7,1 | +2 | 420 | 907 | 1,6 | 908 | 1,25 |
вернуться к таблице
| Элемент (симв.) | # | Масса | плотность | Оксид № | mp | bp | EN | Энергия ионизации | |
|---|---|---|---|---|---|---|---|---|---|
| Галлий (Ga) | 31 | 69,72 | 5,90 | +3 | 30 | 2403 | 1,6 | 577 | 1,22 |
| Германий (Ge) | 32 | 72,61 | 5,35 | +4 | 937 | 2830 | 1,8 | 761 | 1,22 |
| Мышьяк (As) | 33 | 74,92 | 5,73 | +3 | 613 | 613 | 2.4 | 946 | 1,21 |
| Селен (Se) | 34 | 78,96 | 4,81 | +6, -2 | 217 | 685 | 2,4 | 941 | 1,17 |
| Бром (Br) | 35 | 79,90 | 3,12 | -1 | -7 | 59 | 2,8 | 1140 | 1,14 |
| Криптон (Kr) | 36 | 83.80 | 0,0037 | +4, +2 | -157 | -152 | – | 1351 | 2,0 |
| Рубидий (Rb) | 37 | 85,47 | 1,53 | +1 | 39 | 688 | 0,8 | 403, 2632 | 2,44 |
| Стронций (Sr) | 38 | 87,62 | 2,6 | +2 | 769 | 1384 | 1,0 | 549, 1064, 4210 | 2.15 |
| Иттрий (Y) | 39 | 88,91 | 4,47 | +3 | 1522 | 3338 | 1,2 | 615 | 1,81 |
| Цирконий (Zr) | 40 | 91,22 | 6,44 | +4 | 1853 | 4376 | 1,4 | 661 | 1,6 |
вернуться к таблице
| Элемент (симв.) | # | Масса | плотность | Оксид № | mp | bp | EN | Энергия ионизации | |
|---|---|---|---|---|---|---|---|---|---|
| Ниобий (Nb) | 41 | 92,21 | 8,57 | +5, +4 | 2468 | 4742 | 1,6 | 665 | 1,43 |
| Молибден (Мо) | 42 | 95,94 | 10,22 | +6 | 2610 | 5560 | 1,8 | 686 | 1,36 |
| Technicium (Tc) | 43 | (98) | – | +7 | 2171 | 4876 | 1.9 | 703 | 1,36 |
| Рутений (Ру) | 44 | 101,07 | 12,41 | +3 | 2310 | 3900 | 2,2 | 711 | 1,33 |
| Родий (Rh) | 45 | 102,91 | 12,4 | +3 | 1966 | 3727 | 2,2 | 720 | 1,35 |
| Палладий (Pd) | 46 | 106.42 | 12,26 | +2 | 1551 | 3140 | 2,2 | 803 | 1,38 |
| Серебро (Ag) | 47 | 107,87 | 10,5 | +1 | 962 | 2212 | 1,9 | 732 | 1,44 |
| Кадмий (Cd) | 48 | 112,41 | 8,65 | +2 | 321 | 765 | 1,7 | 866 | 1.49 |
| Индий (In) | 49 | 114,82 | 7,30 | +3 | 157 | 2080 | 1,7 | 558, 1821, 2704, 5200 | 1,62 |
| Олово (Sn) | 50 | 118,71 | 7,28 | +4, +2 | 232 | 2260 | 1,8 | 709 | 1,40 |
вернуться к таблице
| Элемент (симв.) | # | Масса | плотность | Оксид № | mp | bp | EN | Энергия ионизации | |
|---|---|---|---|---|---|---|---|---|---|
| Сурьма (Sb) | 51 | 121,76 | 6,68 | +3, +5, -3 | 631 | 1750 | 1,9 | 834 | |
| Теллур (Te) | 52 | 127,60 | 6,25 | +6, -2 | 452 | 1390 | – | 869 | 1,37 |
| Йод (I) | 53 | 126,91 | 4.93 | -1 | 114 | 184 | 2,5 | 1008 | 1,33 |
| Ксенон (Xe) | 54 | 131,29 | 0,00589 | +6, +4, +2 | -112 | -107 | – | 1172 | 2,0 |
| Цезий (Cs) | 55 | 132,91 | 1,88 | +1 | 28 | 678 | 0,7 | 376, 2420 | 2.62 |
| Барий (Ba) | 56 | 137,327 | 3,51 | +2 | 725 | 1640 | 0,9 | 503, 965, 3430 | 2,17 |
| Лантан (La) | 57 | 138,91 | 6,15 | +3 | 918 | 3464 | 1,1 | 540 | 1,88 |
| Церий (Ce) | 58 | 140,16 | 6.77 | +3, +4 | 798 | 3433 | 1,1 | 527 | 1,83 |
| Празеодин (Pr) | 59 | 140,91 | 7,26 | +3, +4 | 937 | 3512 | 1,1 | 523 | 1,83 |
| Неодин (Nd) | 60 | 144,24 | 6,8 | +3 | 1021 | 3068 | 1,1 | 531 | 1.82 |
вернуться к таблице
| Элемент (симв.) | # | Масса | плотность | Оксид № | mp | bp | EN | Энергия ионизации | |
|---|---|---|---|---|---|---|---|---|---|
| Прометий (Pm) | 61 | (145) | 7,26 | +3 | 1042 | 3000 | 1,1 | 536 | 1,81 |
| Самарий (Sm) | 62 | 150.36 | 7,52 | +2, +3 | – | – | 1,1 | 544 | 1,8 |
| Европий (Eu) | 63 | 151,97 | 5,25 | +2, +3 | 822 | 1529 | 1,1 | 548 | 2,04 |
| Гадолиний (Gd) | 64 | 157,25 | 7,9 | +3 | 1312 | 3273 | 1,1 | 594 | 1.8 |
| Тербий (Tb) | 65 | 158,93 | 8,23 | +3, +4 | 1365 | 3230 | 1,1 | 565 | 1,78 |
| Диспрозий (Dy) | 66 | 162,50 | 8,55 | +3 | 1412 | 2567 | 1,1 | 573 | 1,77 |
| Гольмий (Ho) | 67 | 164,93 | 8,80 | +3 | 1472 | 2700 | 1.1 | 582 | 1,77 |
| Эрбий (Er) | 68 | 167,26 | 9,07 | +3 | 1529 | 2868 | 1,1 | 590 | 1,76 |
| Тулий (Tm) | 69 | 168,93 | 9,32 | +2, +3 | 1545 | 1950 | 1,1 | 598 | 1,75 |
| Иттербий (Yb) | 70 | 173.04 | 6,97 | +3 | 819 | 1196 | 1,1 | 602 | 1,94 |
вернуться к таблице
| Элемент (симв.) | # | Масса | плотность | Оксид № | mp | bp | EN | Энергия ионизации | |
|---|---|---|---|---|---|---|---|---|---|
| Лютеций (Lu) | 71 | 174,97 | 9,84 | +3 | 1663 | 3402 | 1.2 | 523 | 1,73 |
| Гафний (Hf) | 72 | 178,49 | 13,3 | +4 | 2230 | 4602 | 1,3 | 674 | 1,56 |
| Тантал (Ta) | 73 | 180,95 | 16,63 | +5 | 2996 | 5427 | 1,5 | 761 | 1,43 |
| Вольфрам (Вт) | 74 | 183.85 | 19,3 | +6, +4 | 3410 | 5660 | 1,7 | 770 | 1,37 |
| Рений (Re) | 75 | 186,21 | 21 | +7 | 3180 | 5620 | 1,9 | 761 | 1,37 |
| Осмий (Os) | 76 | 190,2 | 22,6 | +8, +4 | 3045 | 5027 | 2,2 | 879 | 1.36 |
| Иридий (Ir) | 77 | 192,22 | 22,4 | +4, +3 | 2410 | 4130 | 2,2 | 879 | 1,36 |
| Платина (Pt) | 78 | 195,08 | 21,4 | +4, +2 | 1772 | 3800 | 2,2 | 870 | 1,38 |
| Золото (Au) | 79 | 196,97 | 19,3 | +3, +1 | 1064 | 3080 | 2.4 | 891 | 1,44 |
| Ртуть (Hg) | 80 | 200,59 | 13,6 | +2, +1 | -39 | 357 | 1,9 | 1008 | 1,6 |
вернуться к таблице
| Элемент (симв.) | # | Масса | плотность | Оксид № | mp | bp | EN | Энергия ионизации | |
|---|---|---|---|---|---|---|---|---|---|
| Таллий (Tl) | 81 | 204.38 | 11,85 | +3, +1 | 304 | 1457 | 1,8 | 589, 1971, 2875, 4890 | 1,71 |
| Свинец (Pb) | 82 | 207,2 | 11,3 | +2, +4 | 328 | 1740 | 1,8 | 716 | 1,47 |
| Висмут (Bi) | 83 | 208,98 | 9,80 | +3 | 271 | 1560 | 1.9 | 703 | 1,46 |
| Полоний (Po) | 84 | (209) | 9,32 | +2 | 254 | 962 | 2,0 | 812 | 1,46 |
| Астатин (Ат) | 85 | (210) | – | -1 | 302 | 377 | 2,2 | – | 1,45 |
| Радон (Rn) | 86 | (222) | 9.76 | – | -71 | -62 | – | 1038 | – |
| Франций (Fr) | 87 | (223) | 2,4 | +1 | 27 | 677 | 0,7 | – | 2,7 |
| Радий (Ra) | 88 | 226,03 | 5 | +2 | 700 | 1140 | 0,9 | 510 | 2,2 |
| Актиний (Ас) | 89 | 227.03 | – | +3 | 1050 | 3300 | 1,1 | 665 | 1,88 |
| Торий (Th) | 90 | 232,04 | 11,5 | +4 | 1740 | 4780 | 1,3 | – | 1,8 |
вернуться к таблице
| Элемент (симв.) | # | Масса | плотность | Оксид № | mp | bp | EN | Энергия ионизации | |
|---|---|---|---|---|---|---|---|---|---|
| Проактиний (Па) | 91 | 231,04 | – | +4, +5 | – | – | – | – | – |
| Уран (U) | 92 | 238,03 | – | +2, +3, +4, +5, +6 | – | – | – | – | – |
| Нептуний (Np) | 93 | 237,05 | – | +3, +4, +5, +6 | – | – | – | – | – |
| Плутоний (Pu) | 94 | (244) | – | +3, +4, +5, +6 | – | – | – | – | – |
| Америций (Am) | 95 | (243) | – | +2, +3, +4, +5, +6 | – | – | – | – | – |
| Кюрий (см) | 96 | (247) | – | +3, +4 | – | – | – | – | – |
| Berkelium (Bk) | 97 | (247) | – | +3, +4 | – | – | – | – | – |
| Калифорний (Cf) | 98 | (251) | – | – | – | – | – | – | – |
| Эйнштейний (Es) | 99 | (252) | – | – | – | – | – | – | – |
| Фермий (Fm) | 100 | (257) | – | – | – | – | – | – | – |
вернуться к таблице
| Элемент (симв.) | # | Масса | плотность | Оксид № | mp | bp | EN | Энергия ионизации | |
|---|---|---|---|---|---|---|---|---|---|
| Менделевий (Md) | 101 | (258) | – | +2, +3 | – | – | – | – | – |
| Нобелий (Нет) | 102 | (259) | – | +2, +3 | – | – | – | – | – |
| Лоуренсий (Lr) | 103 | (260) | – | – | – | – | – | – | – |
вернуться к таблице
Frontiers | Стекло: обитель периодической таблицы
Введение
Стекло известно человечеству более 5000 лет, и это один из самых распространенных материалов в современной жизни.Несмотря на свою долгую историю, стекло остается одним из самых интересных объектов для изучения в области неорганического материаловедения. Благодаря работе исследователей со всего мира и разнообразию химических элементов, собранных в Периодической таблице, каждый год создаются новые составы стекла и методы обработки, создавая новые материалы для развития жизненно важных и устойчивых технологий. Согласно теоретическим расчетам, количество возможных составов стекол настолько велико, что для синтеза всех составов потребуется количество атомов, близкое к максимальному теоретическому содержанию атомов во всей Вселенной (Zanotto and Coutinho, 2004).Понимая важность стекольной науки и техники, Д. И. Менделеев сам активно занимался разработкой новых материалов на его основе, основные его результаты отражены в его книге 1864 года «Стекольное производство» (Менделеев, 1864).
В этой статье, посвященной недавней годовщине Периодической таблицы химических элементов, мы кратко описываем, как большой класс стекол может быть классифицирован по группам химических элементов Периодической таблицы, и даем взгляд на перспективные разработки в области стекло, что делает его одним из самых перспективных материалов нашего времени.
Стеклянные семейства и их место в Периодической таблице
Как упоминалось выше, почти все элементы Периодической таблицы могут быть использованы для производства стекла, что делает его своеобразным «домом» для всех элементов. В зависимости от типа химических соединений, образующих стекла, они делятся на классы, каждый из которых имеет уникальную структуру и свойства, определяющие их применение.
Самый распространенный класс стекол – это оксидные стекла. Они образованы структурными единицами, которые представляют собой соединения различных элементов с кислородом.К этим элементам в первую очередь относятся Si, Ge, B, P, As, их оксиды легко получить в стеклообразном состоянии, и большинство стекол производится на их основе. Кроме того, оксиды Te, Ti, Se, Sb, Mo, W, Bi, Al, Ga, V и других элементов могут действовать как стеклообразующие агенты либо по отдельности, либо в смеси с другими оксидами. В зависимости от типа основного стеклообразующего оксида происходит название группы стекол – силикатные, фосфатные, теллуритные и др.
Особое место среди оксидных стекол занимает плавленый кварц или кварцевое стекло (SiO 2 ).Это наиболее тугоплавкое стекло, оно имеет широкое окно прозрачности в оптической области и аномально низкий коэффициент теплового расширения (КТР), равный 5,5 · 10 −7 / K −1 (LeLosq et al., 2019 ). Это определяет его широкий спектр применения – от УФ-ламп до оптических элементов. Благодаря развитию технологии кварцевого стекла и производству оптических волокон стало возможным глобальное внедрение широкополосного доступа в Интернет (Ballato and Dragic, 2016).
Силикатные стекла, в состав которых входят оксиды различных химических элементов от 1 до 17 групп, являются наиболее обширной группой стекол. Помимо Si и O, важнейшими элементами силикатных стекол являются щелочные (Li, Na, K) и щелочноземельные (Mg, Ca, Sr, Ba) металлы, а также элементы Al и B. Благодаря высокой прозрачности, Приемлемая прочность и относительно невысокая стоимость производства, изделия из силикатного стекла присутствуют во всех сферах жизнедеятельности человека: строительстве и транспорте, хранении изделий, станках и многом другом.Ионообменная технология, включающая замену мелких ионов металлов на более крупные в поверхностном слое силикатных стекол, позволяет значительно повысить прочность стекла, которое используется для создания гибких мобильных устройств (Mauro, Morten, 2016). На основе силикатных стекол и различных тонкопленочных слоев разработаны умные очки. Технология умного стекла позволяет изготавливать устройства на основе стекла для управления проходящим светом. Это может значительно снизить энергопотребление здания за счет улучшения внутренней среды (Rezaei et al., 2017). Введение в состав стекла различных химических элементов (в основном переходных, редкоземельных и благородных металлов) приводит к окрашиванию стекол. Для производства очков можно использовать даже элементы группы актинидов. Так, U 2 O 3 давно используется для производства посуды, украшений и оптических фильтров, поскольку ионы U придают стеклу ярко-зеленый цвет (Strahan, 2001). В настоящее время способность силикатных стекол содержать радиоактивные элементы (U, Pu) используется для захоронения радиоактивных отходов в технологии стеклования (Gin et al., 2013). При необходимости некоторые элементы можно даже перевести в радиоактивное состояние в очках, создав таким образом радиофармпрепараты. Так, стеклянные микросферы с изотопом Y 90 для лечения рака печени производятся с использованием стекла Y 2 O 3 -Al 2 O 3 -SiO 2 (Ehrhardt and Day, 1987; Sigaev et al. др., 2012). Более того, используя силикатные стекла, содержащие оксиды Al, Li, Mg, Ca, Ti, Zr, P и другие элементы, стеклокерамика может быть получена с помощью процедуры объемной ядерно-ядерной кристаллизации.Стеклокерамика демонстрирует различные комбинации свойств [высокая прочность, нулевая пористость, точно регулируемый коэффициент теплового расширения (КТР), включая близкие к нулю значения, биосовместимость и т. Д.] И находит применение в различных областях от медицины до астрономии (Zanotto, 2010).
Промышленное производство некремнеземнооксидных стекол менее распространено. Между тем новые задачи в науке и технике приводят к разработке таких очков. Стекла на основе ТеО 2 имеют повышенный показатель преломления (> 2.0) и используются в сложных оптических устройствах видимого и ближнего ИК диапазона. Стекла на основе GeO 2 активно исследуются для создания новых оптических и лазерных компонентов (Сигаев и др., 2011; Старобор и др., 2016). Боратные стекла (на основе B 2 O 3 ) с добавками различных оксидов используются в медицине для восстановления мягких тканей, в оптике и фотонике (Lorenzi et al., 2018; Feller, 2019). Фосфатные стекла (на основе P 2 O 5 ), содержащие оксиды редкоземельных элементов (Nd, Eu, Tb, Er, Yb), используются в промышленности для производства активных элементов мощных лазеров (Campbell and Suratwala). , 2000).Фосфатные и боратные стекла с добавками оксидов Zn, Sn, B, Al, Na, K широко используются для: герметизации материалов с различными значениями КТР, биомедицинских применений и разработки твердых электролитов для батарей нового поколения (Muñoz et al. др., 2019).
Стекла, образованные элементами группы 16 (S, Se, Te) вместе с элементами группы 14 и 15 (Ge, Sn, P, As, Sb), относятся к классу халькогенидных стекол. Эти стекла обладают сверхвысокой прозрачностью в ИК-диапазоне (до 25 мкм), что определяет их использование в качестве устройств формирования ИК-изображений в тепловизорах нового поколения, оптических сенсорах для ИК-спектроскопии и активных элементах волоконных СО 2 лазеров (Hubert et al., 2011).
К классу галогенидных стекол относятся материалы на основе элементов 17 группы (прежде всего F, а также Cl, Br, I) в сочетании с металлами (Be, Zr, Hf, Ba, La, Al, Y). Наиболее изученным составом стекла является ZBLAN (в системе ZrF 4 -BaF 2 -LaF 3 -AlF 3 -NaF). Производство таких стекол осложняется их высокой склонностью к кристаллизации и чрезвычайно высокими требованиями к степени чистоты сырья. Однако исследования в этой области оправданы возможностью получения оптических волокон с минимальными оптическими потерями, которые могут обеспечить значительное (до 100 раз) увеличение скорости передачи данных по сравнению с существующими оптоволоконными кабелями и открыть путь для нового поколения кабелей ближнего действия. -IR волоконных лазеров (Wetenkamp et al., 1992; Clare et al., 2019). Стоит отметить, что исследователи установили возможность получения бездефектного волокна из стекла ZBLAN в условиях отсутствия гравитации и в настоящее время проводят эксперименты по получению такого волокна на Международной космической станции (Стародубов и др., 2014).
Металлические стекла – это общее название широкого класса аморфных материалов, состоящих из металлов или сплавов металлов и металлоидов, включая элементы 2-15 групп (наиболее распространены Zr, Ti, Cu, Ni, Be, Mg, Fe, Co и др.). Металлические стекла имеют высокую тенденцию к кристаллизации, которую можно преодолеть с помощью необычно высоких скоростей охлаждения расплава (от 10 5 до 10 12 ° C / с). Преимуществами металлических стекол перед металлами и металлическими сплавами являются высокие значения механической прочности, коррозионной стойкости, магнитных свойств и электрического сопротивления. В настоящее время возможно производство не только металлических стекол в виде тонких пластин, но и объемных продуктов со сложной морфологией поверхности (Greer, 1995; Schroers, 2013).
Таким образом, почти все элементы Периодической таблицы в различных соотношениях и соединениях могут входить в состав стекла, изменяя его структуру и придавая материалу уникальные свойства. Обилие вариаций в составе и методах производства стекла открывает новые направления его использования в многообещающих областях оптики, медицины, фотоники, энергетики и многих других.
Прямая лазерная запись на стекле и перераспределение элементов
Помимо изменения химического состава стекла, методы постобработки являются важными технологиями для создания материалов с заданными свойствами.Используя методы ионного обмена и поверхностных покрытий, можно создавать высокопрочные и энергоэффективные материалы с заданными оптическими свойствами. Сразу же возможность микро- и даже наноразмерного управления свойствами стекла открывает ранее невозможные пути для разработки новых материалов и устройств. В связи с интенсивным развитием фемтосекундной лазерной технологии появилось широкое поле исследований взаимодействия ультракоротких лазерных импульсов со стеклами. Благодаря многофотонному механизму энергия сфокусированных ультракоротких лазерных импульсов поглощается стеклом в зоне фокусировки.В этой области интенсивность лазерного излучения превышает значения 10 13 Вт / см 2 , что приводит к модификации структуры стекла. Нелинейный характер поглощения ультракоротких импульсов позволяет управлять пространственным положением модифицированных областей в объеме стекла, что открывает перспективы их трехмерной (3D) модификации на микро- и наномасштабах за счет такового так называемая техника прямой лазерной записи (DLW) (Osellame et al., 2012; Sugioka and Cheng, 2014; Phillips et al., 2015).
В последние годы исследования DLW различных структур в стеклах выявили широкий спектр явлений, которые происходят, когда материал поглощает ультракороткие импульсы. К ним относятся локальные изменения показателя преломления и записи оптических волноводов (Phillips et al., 2015), формирование поверхностных и объемных двулучепреломляющих нанопериодических структур (нанорешеток) (Shimotsuma et al., 2003; Lotarev et al., 2019a), образование микро- и нанопузырьков (Bellouard, Hongler, 2011), локальная кристаллизация нелинейных фаз в стекле (Липатиев и др., 2018b, 2020; Лотарев и др., 2019б), осаждение металлических кластеров, наночастиц и полупроводниковых квантовых точек (Marquestaut et al., 2014; Шахгильдян и др., 2018; Ветчинников и др., 2018; Hu et al., 2019). Несмотря на физическую природу процессов взаимодействия лазерных импульсов со стеклом, они приводят к локальному изменению химического состава стекла за счет миграции ионов в различные участки зоны воздействия лазера. Согласно последним исследованиям, ионы модификатора стекла (Na, K, Mg, Ca, Sr, Ba, Zr) наиболее подвержены миграции.При наблюдении в плоскости, перпендикулярной лазерному лучу, такие ионы мигрируют к периферии зоны воздействия лазера, а стеклообразующие ионы имеют тенденцию концентрироваться в центре (Fernandez et al., 2018; Lotarev et al., 2018). Наиболее перспективным применением DLW в очках является многомерное оптическое хранилище данных с большой емкостью и практически неограниченным сроком службы. Этот метод основан на периодических наноструктурах (нанорешетках), записанных лазером в кварцевом стекле (Shimotsuma et al., 2003). Нанрешетки образованы периодическими нанопористыми областями, чередующимися с твердым стеклом.Они ориентированы перпендикулярно плоскости поляризации записывающего луча и демонстрируют двойное лучепреломление формы, которое можно использовать для кодирования данных (Zhang et al., 2014). Для увеличения скорости записи данных было предложено использовать в качестве носителя вместо кварцевого стекла нанопористое стекло SiO 2 (Федотов и др., 2018; Липатиев и др., 2018а). При этом двулучепреломляющие субмикронные полые полости формировались под действием сверхбыстрых лазерных импульсов. Вышеупомянутые многообещающие результаты послужили основой для запуска проектов прикладных исследований, направленных на создание технологии оптической памяти на основе стекла.Первый подобный проект был запущен в Университете Менделеева в России (Проект «Кварц») Лотарев (2017), следующий в лабораториях Microsoft (Проект «Силика») Project Silica (2017).
Таким образом, используя различные комбинации химических элементов для производства стекла и методы лазерной обработки, можно создавать новые материалы и устройства для широкого спектра применений. В первую очередь, это защищенное хранилище данных, а также элементы интегральных фотонных схем (волноводы, интерферометры, переключатели), оптические датчики, микрофлюидные устройства и многое другое.Процессы, происходящие при взаимодействии фемтосекундного лазерного излучения со стеклом, в большинстве случаев приводят к локальному изменению его химического состава и миграции химических элементов в определенные зоны, ограниченные лазерным пятном, что во многом определяет измененные свойства образующейся области. . В то же время возможность точной настройки состава стекла на этапе производства позволяет обеспечить наиболее эффективный поток процессов ЛСО.
Вечная и миниатюрная периодическая таблица
Чтобы символически обозначить возможность использования почти всех элементов Периодической таблицы в стекле, мы вписали цветное изображение в поляризованном свете Периодической таблицы в объем имеющегося в продаже кварцевого стекла типа КУ-1 (TechnoQuartz Ltd., Россия) методом DLW. Эта технология записи основана на свойствах двойного лучепреломления лазерно-индуцированных нанорешеток и напряжения, благодаря которым можно изменять длину волны света, проходящего через поляризатор и анализатор света (Spring et al., 2010; Sun et al., 2020 ).
В этой работе Периодическая таблица была записана в образце кварцевого стекла толщиной 10 мм на глубине 900 микрон от поверхности с помощью лазерного луча, сфокусированного линзой Mitutoyo MPlan APO 5X (N.A. = 0,14). Мы использовали фемтосекундный лазер Pharos 6 Вт (Light Conversion Dev.) с центральной длиной волны 1030 нм. Чтобы контролировать цвет клеток через их двойное лучепреломление в Периодической таблице, меняли энергию лазерных импульсов, количество слоев и расстояние между ними. Скорость сканирования лазерного луча составляла 2 мм / с. Условия записи определенных групп элементов показаны в таблице 1. Следует отметить, что таблица 1 представляет фактический межслойный сдвиг, тогда как соответствующий сдвиг образца во время записи Периодической таблицы равен этим значениям, деленным на 1.45 с учетом преломления, поскольку показатель преломления кварцевого стекла составляет 1,45 на длине волны 1030 нм. Названия элементов были написаны с использованием более жесткой фокусировки лазерного луча с помощью линзы Olympus LCPLNIR 20X (N.A. = 0,45) и с относительным поворотом плоскости поляризации лазерного луча на 45 °.
Таблица 1 . Условия записи DLW Периодической таблицы в образце кварцевого стекла.
Фотография образца стекла с написанной Таблицей представлена на Рисунке 1а.Общий размер стола 3,6 × 2,4 мм. Чтобы увидеть Таблицу в цвете, необходимо наблюдать ее в микроскоп со скрещенными поляризаторами (Рисунок 1b), в то время как изображение Таблицы без скрещенных поляризаторов показано на Рисунке 1c. Размер каждой ячейки Таблицы составляет 200 × 200 мкм. Отжиг образца стекла с письменной таблицей при 900 ° C в течение 1 ч не приводит к заметной деградации изображения, тем не менее, его цвет немного изменился из-за релаксации лазерного напряжения. После многократных термоударов (быстрое охлаждение от 900 ° С до холодной воды) образец стекла с написанной Таблицей полностью сохраняет свою целостность.Благодаря высокой химической и радиационной стойкости кварцевого стекла написанное изображение также не подвергается деградации под воздействием влаги, кислот, щелочей и радиационного воздействия (в пределах устойчивости кварцевого стекла). Таким образом, с одной стороны, стекло можно производить, используя почти все элементы Периодической таблицы, а с другой, благодаря методу DLW, стекло становится вечным хранилищем Периодической таблицы.
Рис. 1. (a) Изображение образца кварцевого стекла в реальном размере с периодической таблицей, записанной лазером; (b, c) Изображение лазера с периодической таблицей, полученное с помощью оптического микроскопа, записанное в образце кварцевого стекла, полученное со скрещенными поляризаторами и без них, соответственно.Длина одной ячейки 200 мкм.
Обсуждение и заключение
Несмотря на долгую историю, сегодня стекло – важнейший класс материалов, востребованных в различных отраслях промышленности. Многообразие свойств и применений стекла связано с невообразимо большим количеством возможных составов – комбинаций различных химических элементов. Новые возможности для создания материалов на основе стекла с уникальными свойствами открывают методы лазерной модификации, позволяющие создавать в объеме стекла различные многофункциональные конструкции и объекты.
В честь 150-летия Периодической таблицы химических элементов мы показали возможность создания цветного изображения Периодической таблицы элементов в кварцевом стекле с использованием технологии прямой лазерной записи. Это изображение занимает площадь 3,6 × 2,4 мм, при этом размер каждой ячейки таблицы составляет 200 × 200 мкм. Отжиг образца стекла с письменной таблицей при 900 ° C в течение 1 ч не приводит к заметной деградации изображения. После многократных термоударов образца стекла столиком он полностью сохраняет свою целостность.Благодаря высокой химической и радиационной стойкости кварцевого стекла написанное изображение также не подвергается деградации под воздействием влаги, кислот, щелочей и радиационного воздействия (в пределах устойчивости кварцевого стекла). Поэтому созданный имидж Таблицы можно считать вечным.
Таким образом, мы хотим показать, что, с одной стороны, стекло можно производить, используя почти все элементы Периодической таблицы, а с другой, что благодаря методу DLW стекло становится вечным хранилищем Периодической таблицы.В этих выводах мы хотим подчеркнуть важность развития исследований в области стеклообразных материалов, которые, благодаря разнообразию элементов Периодической таблицы Менделеева и использованию новых технологий, обеспечивают постоянно ускоряющееся развитие материаловедения. приборно-информационная база человечества.
Заявление о доступности данных
Наборы данных, созданные для этого исследования, доступны по запросу соответствующему автору.
Авторские взносы
GS, AL, SL и VS внесли свой вклад в концепцию и дизайн исследования.Экспериментальные работы проводились AL и SF (программирование, моделирование и лазерная запись) под руководством SL и VS. GS написал рукопись и подготовил изображения с использованием AL, SL и VS в определенных разделах. Все авторы участвовали в анализе и обсуждении полученных результатов.
Финансирование
Работа поддержана грантом Менделеевского университета, проект № 2020-020.
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Список литературы
Баллато, Дж., И Драгич, П. (2016). Стекло: носитель света – краткая история оптического волокна. Внутр. J. Appl. Glass Sci. 7, 413–422. DOI: 10.1111 / ijag.12239
CrossRef Полный текст | Google Scholar
Кэмпбелл, Дж. Х., и Суратвала, Т. И. (2000). Фосфатные стекла с примесью неодима для лазеров высокой энергии / большой пиковой мощности. J. Non Cryst. Твердые тела 263–264, 318–341. DOI: 10.1016 / S0022-3093 (99) 00645-6
CrossRef Полный текст | Google Scholar
Клэр, А.Г., Вахтель, П. Ф., Масгрейвс, Дж. Д. (2019). «Галогенидные стекла», в Springer Handbook of Glass , ред. J. D. Musgraves, J. Hu, L. Calvez (Springer International Publishing), 595–616. DOI: 10.1007 / 978-3-319-
CrossRef Полный текст | Google Scholar
Федотов С.С., Охримчук А.Г., Липатьев А.С., Степко А.А., Пиянзина К.И., Шахгильдян Г.Ю. и др. (2018). 3-битная запись информации в нанопористом стекле с помощью одиночной субмикросекундной пачки фемтосекундных импульсов. Опт. Lett. 43: 851. DOI: 10.1364 / ol.43.000851
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Феллер, С. (2019). «Боратные стекла», в Springer Handbook of Glass , ред. Дж. Д. Масгрейвс, Дж. Ху, Л. Кальвез. 505–524. DOI: 10.1007 / 978-3-319-
CrossRef Полный текст | Google Scholar
Фернандес, Т. Т., Сакакура, М., Итон, С. М., Сотилло, Б., Сигел, Дж., Солис, Дж. И др. (2018). Изготовленные на заказ фотонные устройства, использующие сверхбыструю миграцию ионов в очках, управляемую лазером. Progr. Матер. Sci. 94, 68–113. DOI: 10.1016 / j.pmatsci.2017.12.002
CrossRef Полный текст | Google Scholar
Gin, S., Abdelouas, A., Criscenti, L.J., Ebert, W.L., Ferrand, K., Geisler, T., et al. (2013). Международная инициатива по долгосрочному поведению высокоактивных ядерных отходов стекла. Mater. Сегодня 16, 243–248. DOI: 10.1016 / j.mattod.2013.06.008
CrossRef Полный текст | Google Scholar
Ху, Ю., Чжан, В., Е, Ю., Чжао, З., и Лю, К. (2019). Индуцированное фемтосекундным лазером осаждение нанокристаллов перовскита CsPbBr3 в стеклах для преобразования солнечного спектра. ACS Appl. Nano Mater. 3, 850–857. DOI: 10.1021 / acsanm.9b02362
CrossRef Полный текст | Google Scholar
Hubert, M., Delaizir, G., Monnier, J., Godart, C., Ma, H.L., Zhang, X.H., et al. (2011). Новаторский подход к разработке высокоэффективных халькогенидных стекол и стеклокерамики, прозрачных в инфракрасном диапазоне. Opticsexpress 19, 23513–23522.DOI: 10.1364 / OE.19.023513
PubMed Аннотация | CrossRef Полный текст | Google Scholar
ЛеЛоск, К., Чиккони, М. Р., Гривз, Г. Н. и Невилл, Д. Р. (2019). «Силикатные стекла», в Springer Handbook of Glass , ред. Дж. Д. Масгрейвс, Дж. Ху, Л. Кальвез. 441–503. DOI: 10.1007 / 978-3-319-
CrossRef Полный текст | Google Scholar
Липатьев А.С., Федотов С.С., Охримчук А.Г., Лотарев С.В., Васецкий А.М., Степко А.А. и др.(2018a). Многоуровневая запись данных в нанопористое стекло несколькими фемтосекундными лазерными импульсами. Заявл. Опт. 57, 978–982. DOI: 10.1364 / АО.57.000978
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Липатьев А.С., Лотарев С.В., Смаев М.П., Липатева Т.О., Каратеев И.А., Пресняков М.Ю. и др. (2020). Пространственно-избирательная кристаллизация стекла оптическим вихревым пучком. CrystEngComm 22, 430–434. DOI: 10.1039 / c9ce01869g
CrossRef Полный текст | Google Scholar
Липатьев, А.С., Моисеев И.А., Лотарев С.В., Липатева Т.О., Пресняков М.Ю., Федотов С.С. и др. (2018b). Рост треков монокристалла фресноита внутри стекла с использованием фемтосекундного лазерного луча с последующей термообработкой. Кристалл. Рост Des. 18, 7183–7190. DOI: 10.1021 / acs.cgd.8b01358
CrossRef Полный текст | Google Scholar
Лоренци Р., Голубев Н. В., Зяйтдинова М. З., Яр, Й, В., Бабин, В., Малашкевич, Г. Э. и др. (2018). Радио- и фотолюминесцентные свойства со-легированных Ce / Tb стекол хантитоподобного состава. Опт. Матер. 78, 247–252. DOI: 10.1016 / j.optmat.2018.02.016
CrossRef Полный текст | Google Scholar
Лотарев С., Федотов С., Липатьев А., Пресняков М., Казанский П., Сигаев В. (2018). Световая нанопериодическая модуляция распределения щелочных катионов внутри силикатного стекла. J. Non Cryst. Твердые тела 479, 49–54. DOI: 10.1016 / j.jnoncrysol.2017.10.008
CrossRef Полный текст | Google Scholar
Лотарев, С.В., Федотов, С.С., Курина, А.И., Липатьев, А.С., Сигаев, В.Н. (2019a). Сверхбыстрые лазерно-индуцированные нанорешетки в стеклах из германата натрия. Опт. Lett. 44, 1564–1567. DOI: 10.1364 / ol.44.001564
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лотарев С.В., Липатьев А.С., Липатева Т.О., Федотов С.С., Наумов А.С., Моисеев И.А. и др. (2019b). Сверхбыстрая лазерная остекловывание записанных лазером кристаллических треков в оксидных стеклах. J. Non Cryst.Твердые тела 516, 1–8. DOI: 10.1016 / j.jnoncrysol.2019.04.027
CrossRef Полный текст | Google Scholar
Маркисто, Н., Пети, Ю., Ройон, А., Мунаикс, П., Кардинал, Т., и Каниони, Л. (2014). Формирование трехмерных наночастиц серебра с помощью фемтосекундного лазерного излучения в фосфатных стеклах: аналогия с фотографией. Adv. Функц. Матер. 24, 5824–5832. DOI: 10.1002 / adfm.201401103
CrossRef Полный текст | Google Scholar
Мауро, Дж.К., и Мортен, М. С. (2014). Ультратонкие усиленные очки . Заявка на патент США № 13/961, 211.
.Google Scholar
Менделеев, Д. И. (1864). Производство стекла . Санкт-Петербург: Общественное благо.
Муньос, Ф., Рочерулле, Дж., Ахмед, И., и Ху, Л. (2019). «Фосфатные стекла», Springer Handbook of Glass , ред. Дж. Д. Масгрейвс, Дж. Ху, Л. Кальвез. 553–594. DOI: 10.1007 / 978-3-319-
CrossRef Полный текст | Google Scholar
Оселлам, Р., Серулло, Г., и Рампони, Р., (ред.). (2012). «Фемтосекундная лазерная микрообработка», в Темах прикладной физики (Берлин; Гейдельберг: Springer). DOI: 10.1007 / 978-3-642-23366-1
CrossRef Полный текст | Google Scholar
Филлипс, К. К., Ганди, Х. Х., Мазур, Э. и Сундарам, С. К. (2015). Сверхбыстрая лазерная обработка материалов: обзор. Adv. Опт. Фотоника 7: 684. DOI: 10.1364 / aop.7.000684
CrossRef Полный текст | Google Scholar
Rezaei, S.Д., Шанниграхи С., Рамакришна С. (2017). Обзор традиционных, передовых и интеллектуальных технологий и материалов остекления для улучшения внутренней среды. Solar Energy Mater. Солнечные батареи 159, 26–51. DOI: 10.1016 / j.solmat.2016.08.026
CrossRef Полный текст | Google Scholar
Шахгильдян Г.Ю., Липатьев А.С., Ветчинников М.П., Попова В.В., Лотарев С.В., Голубев Н.В. и др. (2018). Одностадийная микромодификация оптических свойств цинк-фосфатных стекол, легированных серебром, с помощью фемтосекундной прямой лазерной записи. J. Non Cryst. Твердые тела 481, 634–642. DOI: 10.1016 / j.jnoncrysol.2017.12.011
CrossRef Полный текст | Google Scholar
Шимоцума Ю., Казанский П. Г., Цю Дж. И Хирао К. (2003). Самоорганизованные нанорешетки в стекле при облучении ультракороткими световыми импульсами. Phys. Rev. Lett. 91: 247405. DOI: 10.1103 / Physrevlett.91.247405
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сигаев В.Н., Атрощенко Г.Н., Савинков В.И., Саркисова П. Д., Бабаевб Г., Лингель К. и др. (2012). Структурная перестройка на обедненной иттрием поверхности иттрийалюмосиликатного стекла, обработанного HCl, для брахитерапии с использованием Y-микросфер 90 . Mater. Chem. Phys. 133, 24–28. DOI: 10.1016 / j.matchemphys.2011.12.079
CrossRef Полный текст | Google Scholar
Сигаев В. Н., Голубев Н. В., Игнатьева Е. С., Савинков В. И., Кампионе М., Лоренци Р. и др. (2011). Рост с помощью никеля и селективное легирование шпинелеподобных нанокристаллов оксида галлия в германо-силикатных стеклах для получения широкополосного инфракрасного излучения. Нанотехнологии 23: 15708. DOI: 10.1088 / 0957-4484 / 23/1/015708
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Старобор А. В., Железнов Д. С., Палашов О. В., Савинков В. И., Сигаев В. Н. (2016). Очки Борогерманата для изоляторов Фарадея при большой средней мощности. Опт. Commun. 358, 176–179. DOI: 10.1016 / j.optcom.2015.09.047
CrossRef Полный текст | Google Scholar
Стародубов Д., Мечери С., Миллер Д., Ulmer, C., Willems, P., Ganley, J., et al. (2014). Волокна ZBLAN: от испытаний в условиях невесомости до орбитального производства. Заявл. Инд. Оптика. DOI: 10.1364 / aio.2014.am4a.2
CrossRef Полный текст | Google Scholar
Страхан, Д. (2001). Уран в стекле, глазури и эмали: история, идентификация и обращение. Шпилька. Консерв. 46, 181–195. DOI: 10.1179 / sic.2001.46.3.181
CrossRef Полный текст | Google Scholar
Сугиока, К., Ченг, Ю.(2014). Сверхбыстрые лазеры – надежные инструменты для современной обработки материалов. Light Sci. Прил. 3: e149. DOI: 10.1038 / lsa.2014.30
CrossRef Полный текст | Google Scholar
Сан, К., Ли, Т., Бересна, М., и Брамбилла, Г. (2020). Контроль кумулятивного напряжения, индуцированного лазером, для эффективной обработки плавленого кварца. Sci. Отчет 10: 3819. DOI: 10.1038 / s41598-020-60828-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ветчинников, М.П., Липатьев А.С., Шахгильдян Г.Ю., Голубев Н.В., Игнатьева Е.С., Федотов С.С. и др. (2018). Формирование квантовых точек CdS внутри силикатного стекла под действием прямого фемтосекундного лазера. Опт. Lett. 43, 2519–2522. DOI: 10.1364 / ol.43.002519
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Wetenkamp, L., West, G.F., and Többen, H. (1992). Оптические свойства стекол ZBLAN, легированных редкоземельными элементами. J. Non Cryst. Твердые тела 140, 35–40. DOI: 10.1016 / s0022-3093 (05) 80737-9
CrossRef Полный текст | Google Scholar
Занотто, Э. Д. (2010). Светлое будущее стеклокерамики. Am. Керамика Соц. Бык. 89, 19–27.
Google Scholar
Занотто, Э. Д., и Коутиньо, Ф. А. Б. (2004). Сколько некристаллических твердых тел можно сделать из всех элементов таблицы Менделеева? J. Non Cryst. Твердые тела 347, 285–288. DOI: 10.1016 / j.jnoncrysol.2004.07.081
CrossRef Полный текст | Google Scholar
Чжан, Дж., Гецявичюс, М., Бересна, М., Казанский, П. Г. (2014). Казалось бы, неограниченное пожизненное хранение данных в наноструктурированном стекле. Phys. Rev. Lett . 112: 033901. DOI: 10.1103 / PhysRevLett.112.033901
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Periodic Trends – Введение в химию – 1-е канадское издание
- Уметь определять, как меняются определенные свойства атомов в зависимости от их относительного положения в периодической таблице.
Одна из причин, по которой периодическая таблица настолько полезна, заключается в том, что ее структура позволяет нам качественно определить, как некоторые свойства элементов меняются в зависимости от их положения в периодической таблице.Изменение свойств в зависимости от положения в периодической таблице называется периодическими тенденциями. В науке нет другого инструмента, который позволил бы нам судить об относительных свойствах такого класса объектов, как этот, что делает периодическую таблицу очень полезным инструментом. Многие периодические тенденции носят общий характер. Может быть несколько точек, где наблюдается противоположная тенденция, но есть общая тенденция, если рассматривать ее по всей строке или вниз по целому столбцу периодической таблицы.
Многие периодические свойства атомов зависят от электронной конфигурации; в частности, валентные электроны и степень их притяжения к ядру.
Валентные электроны одновременно притягиваются к положительному заряду ядра и экранируются (отталкиваются) отрицательными зарядами других электронов. Этот чистый ядерный заряд, ощущаемый валентными электронами, известен как его эффективный ядерный заряд, Z eff (произносится как «zed-эффективный»). Эффективный заряд ядра всегда меньше действительного заряда ядра, и его можно приблизительно оценить с помощью следующего уравнения:
Где Z – заряд ядра (равный количеству протонов), а S – константа экранирования, которая может быть приближена к количеству невалентных или «остовных» электронов.
Например: попробуйте приблизительно определить эффективный ядерный заряд магния.
Во-первых, мы должны определить электронную конфигурацию магния, чтобы определить количество электронов в остове:
Следовательно, магний имеет 10 электронов ядра из 1 s 2 , 2 s 2 и 2 p 6 орбиталей.
Магний – это элемент 12, поэтому он имеет 12 протонов и ядерный заряд 12:
.Двигаясь слева направо через период в периодической таблице, каждый последующий элемент имеет дополнительный протон и валентный электрон, но основные электроны, которые ответственны за большую часть экранирования, остаются прежними.Это приводит к тенденции, что в целом эффективный ядерный заряд увеличивается слева направо в любой период периодической таблицы.
Двигаясь сверху вниз по столбцу периодической таблицы, мы можем ожидать, что элементы будут иметь одинаковый эффективный ядерный заряд, поскольку все они имеют одинаковое количество валентных электронов. Однако на самом деле мы видим небольшое увеличение Z eff при перемещении вниз по столбцу периодической таблицы. По мере увеличения главного квантового числа ( n ) размер орбиты увеличивается, в результате чего электронные облака ядра становятся более разбросанными.Эти более диффузные основные электронные облака также не экранируются, что дает небольшое увеличение до Z eff (см. Рисунок 8.23 «Повышение эффективного ядерного заряда»).
Рисунок 8.23 «Повышение эффективного ядерного заряда». Периодический тренд эффективного ядерного заряда.Атомный радиус – это показатель размера атома. Хотя понятие определенного радиуса атома немного расплывчато, атомы ведут себя так, как если бы они имели определенный радиус. Такие радиусы можно оценить с помощью различных экспериментальных методов, таких как рентгеновская кристаллография кристаллов.
По мере того, как вы спускаетесь по столбцу периодической таблицы, атомные радиусы увеличиваются. Это связано с тем, что валентная электронная оболочка становится больше и увеличивается главное квантовое число, поэтому валентная оболочка находится физически дальше от ядра. Эту тенденцию можно резюмировать следующим образом:
Где PT означает «таблица Менделеева». Если пересечь строку в периодической таблице слева направо, тенденция будет иной. Это потому, что, хотя валентная оболочка поддерживает одно и то же главное квантовое число, количество протонов – и, следовательно, ядерный заряд – увеличивается по мере того, как вы пересекаете ряд.Увеличивающийся положительный заряд приводит к большему эффективному заряду ядра, который сильнее захватывает валентные электроны, поэтому, когда вы пересекаете периодическую таблицу, атомные радиусы уменьшаются. Опять же, мы можем резюмировать эту тенденцию следующим образом:
Рисунок 8.24 «Тенденции атомных радиусов в Периодической таблице» показывает сферы, представляющие атомы блоков s и p периодической таблицы в масштабе, показывая две тенденции для атомного радиуса.
Рисунок 8.24 «Тенденции атомных радиусов в Периодической таблице». Хотя в тенденции есть некоторые развороты (например, см. Po в нижнем ряду), атомы обычно становятся меньше, когда вы пересекаете периодическую таблицу, и больше, когда вы спускаетесь по любому столбцу. Числа – это радиусы в пм. [Длинное описание]Ссылаясь только на периодическую таблицу, а не на рисунок 8.24 «Тенденции атомных радиусов в Периодической таблице», какой атом больше в каждой паре?
- Si или S
- S или Te
Решения
- Si находится слева от S в периодической таблице, поэтому он больше, потому что по мере продвижения по строке атомы становятся меньше.
- S выше Te в периодической таблице, поэтому Te больше, потому что по мере того, как вы спускаетесь вниз по столбцу, атомы становятся больше.
Ссылаясь только на периодическую таблицу, а не на рисунок 8.24 «Тенденции атомных радиусов в Периодической таблице», какой атом меньше, Ca или Br?
Ответ
руб.
Энергия ионизации (IE) – это количество энергии, необходимое для удаления электрона из атома в газовой фазе:
IE обычно выражается в кДж / моль атомов.Он всегда положительный, потому что удаление электрона всегда требует подвода энергии (т.е. оно эндотермическое). IE также показывает периодические тенденции. По мере того, как вы спускаетесь по таблице Менделеева, становится легче удалить электрон из атома (т.е. IE уменьшается), потому что валентный электрон находится дальше от ядра. Таким образом:
Однако, когда вы пересекаете периодическую таблицу и электроны сближаются, требуется больше энергии, чтобы удалить электрон; в результате IE увеличивается:
Рисунок 8.25 «Тенденции энергии ионизации в периодической таблице» показывает значения IE в зависимости от положения в периодической таблице. Опять же, тенденция не абсолютна, но общие тенденции, проходящие по периодической таблице Менделеева, должны быть очевидны.
Рисунок 8.25 «Энергия ионизации периодической таблицы». Значения указаны в кДж / моль. [Длинное описание] IEтакже показывает интересную тенденцию в пределах данного атома. Это связано с тем, что можно определить более одного IE путем удаления следующих друг за другом электронов (если они есть в атоме):
И так далее.
Каждый последующий IE больше предыдущего, потому что электрон удаляется из атома с постепенно увеличивающимся положительным зарядом. Однако IE делает большой скачок, когда последовательная ионизация переходит в новую оболочку. Например, следующие три ИЭ для Mg, электронная конфигурация которых: 1 с 2 2 с 2 2 с 6 3 с 2 :
Второй IE вдвое больше первого, что неудивительно: первый IE включает удаление электрона из нейтрального атома, а второй включает удаление электрона из положительного иона.Однако третий IE в пять раз больше , чем предыдущий. Почему он намного больше? Поскольку первые два электрона удаляются из подоболочки 3 s , но третий электрон должен быть удален из оболочки n = 2 (в частности, подоболочки 2 p , которая имеет меньшую энергию, чем n = 3 оболочки). Таким образом, требуется гораздо больше энергии, чем можно было бы предположить, просто преодолев больший ионный заряд. Подобные тенденции демонстрируют, что электроны организованы в атомы в группы.
Какой атом в каждой паре имеет больший IE?
- Ca или Sr
- К или К +
Решения
- Так как Sr ниже Ca в периодической таблице Менделеева, из него легче удалить электрон; таким образом, Ca имеет более высокий IE.
- Поскольку K + имеет положительный заряд, будет труднее удалить из него другой электрон, поэтому его IE больше, чем IE K. Действительно, он будет значительно больше, потому что следующий электрон в K + будет удалено происходит из другой оболочки.
Какой атом имеет меньшую энергию ионизации, C или F?
Ответ
С
Противоположность IE описывается сродством к электрону (EA), которое представляет собой изменение энергии, когда атом в газовой фазе принимает электрон:
EA также обычно выражается в кДж / моль. EA также демонстрирует некоторые периодические тренды, хотя они менее очевидны, чем другие периодические тренды, рассмотренные ранее. Как правило, при переходе по таблице Менделеева значение EA увеличивается:
Нет определенной тенденции при движении вниз по таблице Менделеева; иногда EA увеличивается, иногда уменьшается.На рис. 8.26 «Сродство к электрону в периодической таблице» показаны значения EA в зависимости от положения в периодической таблице для элементов блока s и p . Тенденция не абсолютная, особенно с учетом больших положительных значений советника во втором столбце. Однако общая тенденция, наблюдаемая в периодической таблице, должна быть очевидна.
Рисунок 8.26 «Сродство к электрону в Периодической таблице». Значения указаны в кДж / моль. [Длинное описание]Предскажите, какой атом в каждой паре будет иметь наибольшую величину EA.
- C или F
- Na или S
Решения
- C и F находятся в одной строке периодической таблицы, но F находится дальше вправо. Следовательно, F должен иметь большую величину EA.
- Na и S находятся в одной строке периодической таблицы, но S находится правее. Следовательно, у S должна быть большая величина EA.
Предскажите, какой атом будет иметь наибольшую величину EA, As или Br.
Ответ
руб.
- Определенные свойства – в частности, эффективный заряд ядра, атомный радиус, IE и EA – можно качественно понять по положению элементов в периодической таблице.
- Напишите химическое уравнение с изменением энергии IE.
- Напишите химическое уравнение с изменением энергии EA.
- Укажите тенденции изменения атомных радиусов в периодической таблице Менделеева.
- Укажите тенденции в IE по мере продвижения по таблице Менделеева.
- Какой атом в каждой паре больше?
- Na или Cs
- N или Bi
- Какой атом в каждой паре больше?
- C или Ge
- Be или Ba
- Какой атом в каждой паре больше?
- K или Cl
- Ba или Bi
- Какой атом в каждой паре больше?
- Si или S
- H или He
- У какого атома более высокий IE?
- Na или S
- Ge или Br
- У какого атома более высокий IE?
- C или Ne
- Rb или I
- У какого атома более высокий IE?
- Li или CS
- Se или O
- У какого атома более высокий IE?
- Al или Ga
- F или I
- Элемент третьей строки имеет следующие последовательные IE: 738; 1450; 7,734; и 10,550 кДж / моль.Определите элемент.
- Элемент третьей строки имеет следующие последовательные IE: 1,012; 1,903; 2,912; 4940; 6270; и 21,300 кДж / моль. Определите элемент.
- Для какого следующего IE есть большой скачок IE для Ca?
- Для какого следующего IE есть большой скачок IE для Al?
- Какой атом имеет большую величину EA?
- C или F
- Al или Cl
- Какой атом имеет большую величину EA?
- К или рублей
- мг или S
- По мере продвижения атомные радиусы уменьшаются; по мере того, как вы опускаетесь, атомные радиусы увеличиваются.
- CS
- Bi
- К
- Ba
- S
- рублей
- Ли
- О
- мг
- Третий IE показывает большой скачок Ca.
- Ф
- Класс
Рисунок 8.24 описание: Диаграмма трендов атомных радиусов в периодической таблице. Данные собраны в следующей таблице:
| Ряд | Элемент | Атомный радиус (пикометры) |
|---|---|---|
| Первая | H | 37 |
| Первая | He | 31 |
| Второй | Ли | 152 |
| Второй | Be | 111 |
| Второй | В | 80 |
| Второй | С | 77 |
| Второй | N | 74 |
| Второй | O | 73 |
| Второй | F | 72 |
| Второй | Ne | 71 |
| Третий | Na | 186 |
| Третий | мг | 160 |
| Третий | Al | 143 |
| Третий | Si | 118 |
| Третий | -П | 110 |
| Третий | S | 103 |
| Третий | Класс | 100 |
| Третий | Ar | 98 |
| Четвертый | К | 227 |
| Четвертый | Ca | 197 |
| Четвертый | Ga | 125 |
| Четвертый | Ge | 122 |
| Четвертый | как | 120 |
| Четвертый | SE | 119 |
| Четвертый | Br | 114 |
| Четвертый | Кр | 112 |
| Пятая | руб. | 248 |
| Пятая | Sr | 215 |
| Пятая | В | 167 |
| Пятая | Sn | 140 |
| Пятая | Сб | 140 |
| Пятая | Te | 142 |
| Пятая | I | 133 |
| Пятая | Xe | 131 |
| Шестой | CS | 265 |
| Шестой | Ba | 222 |
| Шестой | Ti | 170 |
| Шестой | Пб | 146 |
| Шестой | Bi | 150 |
| Шестой | Po | 168 |
| Шестой | по адресу | (140) |
| Шестой | Rn | (141) |
[Вернуться к рисунку 8.24]
Рисунок 8.25 description: График энергии ионизации по периодической таблице. Данные собраны в следующей таблице:
| Ряд | Элемент | Энергия ионизации (кДж / моль) |
|---|---|---|
| Первая | H | 1312 |
| Первая | He | 2372 |
| Второй | Ли | 520 |
| Второй | Be | 111 |
| Второй | В | 800 |
| Второй | С | 1086 |
| Второй | N | 1402 |
| Второй | O | 1214 |
| Второй | F | 1681 |
| Второй | Ne | 2080 |
| Третий | Na | 496 |
| Третий | мг | 160 |
| Третий | Al | 578 |
| Третий | Si | 786 |
| Третий | -П | 1012 |
| Третий | S | 1000 |
| Третий | Класс | 1251 |
| Третий | Ar | 1520 |
| Четвертый | К | 419 |
| Четвертый | Ca | 197 |
| Четвертый | Ga | 579 |
| Четвертый | Ge | 762 |
| Четвертый | как | 946 |
| Четвертый | SE | 940 |
| Четвертый | Br | 1140 |
| Четвертый | Кр | 1350 |
| Пятая | руб. | 403 |
| Пятая | Sr | 550 |
| Пятая | В | 558 |
| Пятая | Sn | 708 |
| Пятая | Сб | 833 |
| Пятая | Te | 870 |
| Пятая | I | 1008 |
| Пятая | Xe | 1170 |
| Шестой | CS | 376 |
| Шестой | Ba | 503 |
| Шестой | Ti | 590 |
| Шестой | Пб | 715 |
| Шестой | Bi | 703 |
| Шестой | Po | 812 |
| Шестой | по адресу | 800 |
| Шестой | Rn | 1040 |
[Вернуться к рисунку 8.25]
Рисунок 8.26 description: Диаграмма сродства к электрону в периодической таблице. Данные собраны в следующей таблице:
| Ряд | Элемент | Сродство к электрону (кДж / моль) |
|---|---|---|
| Первая | H | −73 |
| Второй | Ли | −60 |
| Второй | Be | 241 |
| Второй | В | −27 |
| Второй | С | −122 |
| Второй | N | ~ 0 |
| Второй | O | −141 |
| Второй | F | −328 |
| Третий | Na | −53 |
| Третий | мг | 230 |
| Третий | Al | −43 |
| Третий | Si | −134 |
| Третий | -П | −72 |
| Третий | S | −200 |
| Третий | Класс | −349 |
| Четвертый | К | −48 |
| Четвертый | Ca | 156 |
| Четвертый | Ga | −29 |
| Четвертый | Ge | −119 |
| Четвертый | как | −78 |
| Четвертый | SE | −195 |
| Четвертый | Br | −325 |
| Пятая | руб. | −47 |
| Пятая | Sr | 167 |
| Пятая | В | −29 |
| Пятая | Sn | −107 |
| Пятая | Сб | −103 |
| Пятая | Te | −190 |
| Пятая | I | −295 |
| Шестой | CS | −46 |
| Шестой | Ba | 52 |
| Шестой | Ti | −19 |
| Шестой | Пб | −35 |
| Шестой | Bi | −35 |
[Вернуться к рисунку 8.26]
Авторство в СМИ
Термины Периодической таблицы | Shmoop
Термины Периодической таблицы
Актиниды
Актиниды содержат элементы с 89 по 103. Их, наряду с актинидами, часто называют f-элементами, потому что они имеют валентные электроны в f-оболочке.
Щелочные металлы
Щелочные металлы составляют первую колонку (группу) периодической таблицы и включают от Li до Fr.
Щелочноземельные металлы
Щелочноземельные металлы составляют вторую колонку (группу) периодической таблицы, от Ве до Ра.
Атомный номер
Атомный номер – это количество протонов в атомном ядре.
Атомная орбиталь
Атомные орбитали – это области пространства вокруг ядра атома, где с наибольшей вероятностью можно найти электрон.
Атомный радиус
Атомный радиус – это полное расстояние от ядра атома до внешней орбитали электрона.
Атомный вес
Атомный вес – это средняя масса атома элемента.
Химический символ
Химический символ – это обозначение одной или двух букв, представляющих химический элемент.
Проводник
Материал, проводящий тепло или электричество, что означает, что электроны могут легко проходить через объект.
Diatomic
Комплекс, состоящий из двух атомов.
D-блок
D-блок – это часть элементов периодической таблицы в группах с 3 по 12.
Сродство к электрону
Сродство к электрону – это количество энергии, поглощаемой при добавлении электрона к атому.
Электроотрицательность
Электроотрицательность – это мера притяжения атома к электронам.
Элемент
Элемент – это вещество, состоящее из атомов с одинаковым атомным номером.
Экзотермический
Экзотермический термин, используемый для описания реакции, при которой выделяется тепло.
F-блок
F-блок – это часть элементов ниже основной части таблицы Менделеева, состоящая из лантаноидов и актинидов.
Семейство
Таксон (группа организмов), состоящий из родственных родов.
Испытание пламенем
Испытание пламенем – это испытание для обнаружения присутствия определенных металлов путем определения цвета, который они излучают при попадании в пламя.
Группа
Группа также называется семьей. Это столбец элементов периодической таблицы, у всех одинаковые свойства.
Галогены
Галогенные элементы – это подмножество неметаллов.Они составляют группу 17 периодической таблицы, от F до At.
Энергия ионизации
Энергия ионизации – это энергия, необходимая для удаления электрона из атома.
Лантаноиды
Лантаноиды содержат элементы с 57 по 71. Наряду с актинидами их часто называют f-элементами, поскольку они имеют валентные электроны в f-оболочке.
Элементы основной группы
Группы 1-2 и 13-18 называются элементами основной группы.
Ковкость
Ковкость означает, что объект может быть разбит на листы или формы.
Металлоиды
Металлоиды также называют полуметаллами. Это элементы B, Si, Ge, As, Sb, Te и Po.
Металлы
Металл – это вещество, проводящее тепло и электричество, блестящее, его можно расколоть молотком или протянуть в проволоку.
Благородные газы
Благородные газы составляют группу 18. Как правило, они очень стабильны, не имеют цвета и запаха.
Неметаллы
Термин неметаллы используется для классификации элементов H, C, N, P, O, S и Se.
Степень окисления
Степень окисления – это заряд, связанный с атомом.
Оксид
Оксид – это соединение, состоящее из металла и кислорода.
p-блок
p-блок – это часть периодической таблицы, состоящая из последних шести групп или столбцов.
Период
Период – это горизонтальная строка периодической таблицы.
Периодический закон
Периодический закон – это принцип, согласно которому свойства или характеристики элементов периодически повторяются по мере увеличения их атомных номеров.
S-блок
S-блок – это часть элементов периодической таблицы, состоящая из первых двух групп или столбцов.
Переходные металлы
Переходные элементы – это металлы, которые имеют частично заполненную подоболочку d и включают группы с 3 по 12, а также лантаноиды и актиниды.




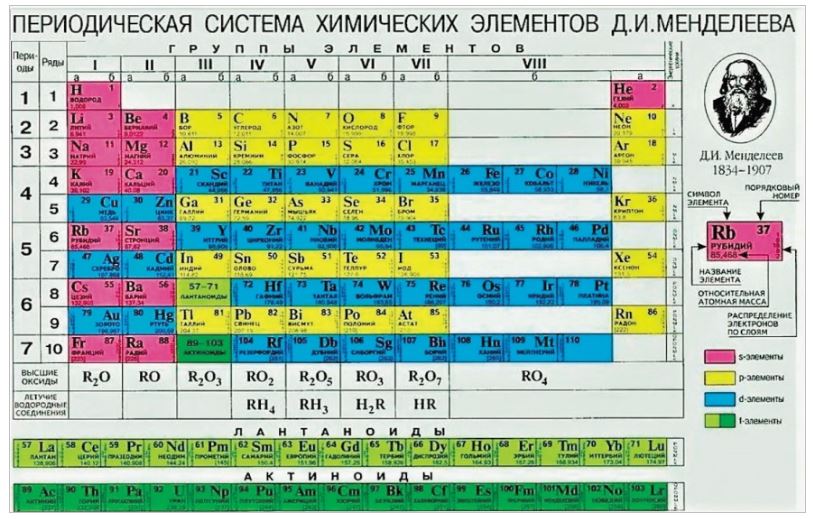
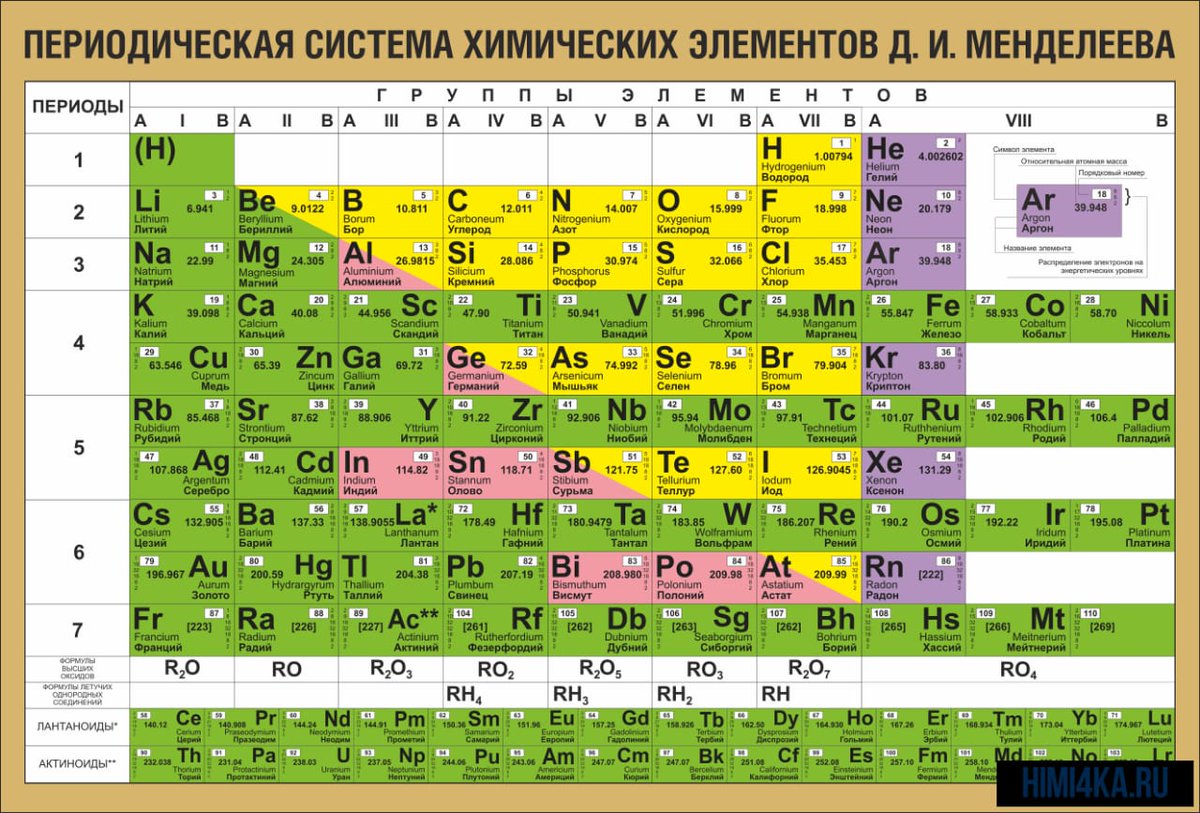 6 5 с 2
6 5 с 2 