самый лёгкий элемент в таблице Менделеева?
Нитрат лития подвергли термическому разложению, при этом его масса уменьшилась на 50%. Определите степень разложения нитрата лития. Ответ приведите в … % с точностью до целых.
Завершите уравнение химической реакции взаимодействия нитрита натрия и гидросульфида натрия в солянокислом растворе. NaNO2+NaHS+HCl→S+… В ответе приве … дите сумму всех коэффициентов в уравнении реакции. Коэффициенты — минимальные натуральные числа.
Смесь кальция и магния полностью прореагировала с азотом. При этом масса твёрдого остатка увеличилась по сравнению с исходным состоянием на 36,5%. Опр … еделите мольную долю магния в исходной смеси. Ответ приведите в % с точностью до целых.
Чему равна средняя молярная масса газовой смеси N2 и CO? Ответ приведите в г/моль с точностью до целых.
Помогите срочно!Озон окисляет сульфид свинца PbS до сульфата PbSO4. Составьте уравнение этой реакции, если известно, что второй продукт реакции — кисл
… ород, причём его количество вещества равно количеству вещества озона.
ПОМОГИТЕ СРОЧНО!При взаимодействии надпероксида калия KO2 с холодной водой образуются пероксид водорода, гидроксид калия и кислород. Составьте уравнен … ие этой реакции. В ответе приведите сумму всех коэффициентов (коэффициенты должны быть минимальными натуральными числами).
Нитрат калия часто используют как окислитель в реакциях с твёрдыми веществами, протекающих при сплавлении. Например: KNO3+MnO2+K2CO3−→t∘KNO2+K2MnO4+CO … 2 Рассчитайте, какое количество вещества нитрата калия потребуется для окисления 80 г оксида марганца(IV), если нитрата калия требуется в 1,5 раза больше по сравнению с теоретическим значением? Ответ приведите в молях с точностью до сотых.
Фосфорная кислота, получаемая обработкой фосфата кальция серной кислотой, часто содержит примеси последней. Рассчитайте массовую долю серной кислоты в
… водном растворе, если известно, что соотношение числа атомов фосфора и серы равно 900:1, а число атомов кислорода в системе в 1,276 раза больше числа атомов водорода. Ответ приведите в % с точностью до десятых.
Ответ приведите в % с точностью до десятых.
при взаимодействии 10.2 г оксида алюминия с серной кислотой получается сульфат алюминия. Вычислите его массу
определите массу хлора для хлорирования смеси меди и железа массой 60 г. Массовая доля меди в смеси = 53.3%. В результате реакции образуется хлорид ме … ди 2 и хлорид железа 3. Мои расчёты : m (Cu) = 31.98 г m (Fe) = 28.02 г Потом я вычислила кол-во в-ва железа и меди n(Cu) = 0.5 моль n(Fe)=0.5 моль Дальше я не понимаю как решать
Путешествие по таблице элементов: от водорода до оганесона
Александр Рулёв,
доктор химических наук,
Иркутский институт химии им. А. Е. Фаворского СО РАН
«Наука и жизнь» №6, 2019
Периодическая таблица химических элементов по праву считается одним из величайших достижений химической науки. Сегодня она насчитывает почти вдвое больше элементов, чем полтора века назад, когда Дмитрий Иванович Менделеев опубликовал свой «Опыт системы элементов, основанный на их атомном весе и химическом сродстве».
Представим себе, что мы смогли проникнуть в наномир и познакомиться с элементами, «населяющими» современную таблицу. В этом случае периодическая система предстала бы в виде высотного здания, имеющего семь «этажей» (периодов), 18 «блок-секций» (групп) которого насчитывают 118 уютных «квартир» (клеток). Некоторые из жильцов — элементы-рекордсмены, многие могут рассказать о себе немало интересного, не без основания претендуя на звание «самый-самый».
В квартире под номером один живёт удивительный элемент — водород H. Он рекордсмен сразу в нескольких номинациях. Это и самый простой, и самый распространённый в природе элемент. На него приходится более 90% всех атомов видимой Вселенной. В обычных условиях он существует в виде самого лёгкого газа: один литр его весит меньше 0,09 г. При охлаждении до −253°С водород переходит в жидкое состояние, превращаясь в самую лёгкую жидкость: десятилитровое ведро такой жидкости весило бы всего 708 г. Водород — единственный химический элемент, все семь братьев-изотопов которого имеют собственные имена.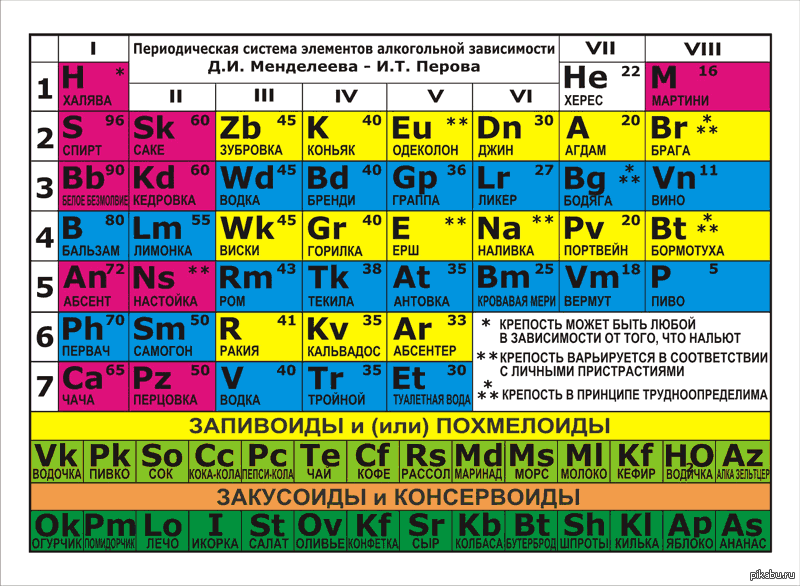
Сосед водорода, занимающий квартиру номер два, инертный газ гелий He. Несмотря на то что элемент назван в честь греческого бога Солнца, вещество, состоящее из его атомов, — самая холодная жидкость на Земле: его температура кипения (−269°С) лишь на четыре градуса выше абсолютного нуля. Это единственное простое вещество, температура плавления которого неизвестна: даже при абсолютном нуле оно остаётся жидким и переходит в твёрдое состояние лишь при давлении около 25 атм. Гелий — обладатель самого маленького атома: его радиус всего 31 пм (1 пикометр = 1 · 10 Напротив, самыми «пышными формами» может похвастаться цезий Cs, проживающий в квартире номер 55. Его атомный радиус почти на порядок больше — 298 пм. К тому же цезий — самый мягкий металл, да ещё и редкого светло-золотистого цвета (как правило, все металлы серые). Впрочем, и самый твёрдый металл хром Cr имеет голубовато-серебристый цвет. Способность цезия легко отдавать электрон внешнего энергетического уровня делает его ещё и самым активным металлом.
Напротив, самыми «пышными формами» может похвастаться цезий Cs, проживающий в квартире номер 55. Его атомный радиус почти на порядок больше — 298 пм. К тому же цезий — самый мягкий металл, да ещё и редкого светло-золотистого цвета (как правило, все металлы серые). Впрочем, и самый твёрдый металл хром Cr имеет голубовато-серебристый цвет. Способность цезия легко отдавать электрон внешнего энергетического уровня делает его ещё и самым активным металлом.
Самый лёгкий металл расположился этажом ниже под водородом. Это литий Li. Его плотность составляет всего 0,534 г/см3, он почти в два раза легче воды. Самый тяжёлый металл — осмий Os — занимает квартиру номер 76. Изготовленный из него куб с ребром 1 м весил бы 22,59 т. Он на сотые доли процента опережает своего соседа из квартиры 77 (иридий Ir) в борьбе за звание элемента с самой высокой плотностью.
Путешествуя по таблице элементов, мы непременно должны постучаться в дверь с номером шесть. Это апартаменты самого важного для жизни на Земле элемента — углерода C.
 Как знать, может быть, именно фуллерен принёс на Землю атомы или молекулы, благодаря которым зародилась жизнь на нашей планете.
Как знать, может быть, именно фуллерен принёс на Землю атомы или молекулы, благодаря которым зародилась жизнь на нашей планете.Две соседние с углеродом квартиры занимают рекордсмены по распространённости. Азот N (элемент номер семь) — самый распространённый элемент в атмосфере (чуть более 78% по объёму). Появившийся в атмосфере нашей планеты около двух миллиардов лет назад кислород (элемент номер восемь) держит пальму первенства по распространённости в литосфере (почти 49% по массе) и гидросфере Земли (86% веса всех океанов), а также в теле человека (около двух третей по массе). Так, в 70-килограммовом представителе вида Homo Sapiens на долю кислорода O приходится почти 45 кг. Согласно данным журнала New Scientist, опубликованным в декабре 2005 года, эмпирическая формула человеческого тела имеет вид:
H15750 N310 O6500 C2250 Ca63 P48 K15 S15 Na10 Cl6 Mg3 Fe1.
В ней кислород уступает водороду по количеству атомов, но значительно превосходит его по массе.
Антиподы азота и кислорода занимают квартиры под номерами 85 и 86. Имя первого — астат At (от греческого αστατος — ‘неустойчивый’) — говорит само за себя: все его изотопы — короткоживущие (период полураспада самого устойчивого 210At составляет чуть более восьми часов). Именно поэтому астат самый редкий природный элемент Периодической таблицы. По разным данным, его содержание в земной коре в любой конкретный момент времени не превышает одного грамма. Радон Rn, занимающий 86-ю квартиру, самый редко встречающийся в атмосфере элемент — его содержание в ней всего около 0,0000000000000000001%. При стандартных температуре и давлении радон — самый тяжёлый из газообразных простых веществ: 1 литр его весит 9,73 г.
Несмотря на то что квартиры двух других элементов расположены на одной площадке (во втором периоде), их хозяева являют собой полную противоположность друг другу. В девятой квартире проживает самый электроотрицательный и самый активный из всех элементов-неметаллов — фтор F. Даже благородные газы — ксенон Xe и криптон Kr — пасуют перед этим химическим монстром. В его атмосфере горит, казалось бы, самое несгораемое вещество — вода. Сила фтора как окислителя настолько велика, что кислород окисляется в его атмосфере, образуя фториды OF2, O2F2 и O3F2! Напротив, сосед фтора, проживающий в десятой квартире, — неон Ne славится своим олимпийским спокойствием и с недавних пор носит титул самого инертного химического элемента. Это звание закрепилось за ним после того, как в марте 2018 года журнал American Scientist опубликовал ошеломляющую статью о способности гелия образовывать соединения с некоторыми элементами. Причём это происходит без образования классической химической связи, то есть без участия валентных электронов. Напротив, ни одного устойчивого соединения неона до сих пор идентифицировать не удалось.
В девятой квартире проживает самый электроотрицательный и самый активный из всех элементов-неметаллов — фтор F. Даже благородные газы — ксенон Xe и криптон Kr — пасуют перед этим химическим монстром. В его атмосфере горит, казалось бы, самое несгораемое вещество — вода. Сила фтора как окислителя настолько велика, что кислород окисляется в его атмосфере, образуя фториды OF2, O2F2 и O3F2! Напротив, сосед фтора, проживающий в десятой квартире, — неон Ne славится своим олимпийским спокойствием и с недавних пор носит титул самого инертного химического элемента. Это звание закрепилось за ним после того, как в марте 2018 года журнал American Scientist опубликовал ошеломляющую статью о способности гелия образовывать соединения с некоторыми элементами. Причём это происходит без образования классической химической связи, то есть без участия валентных электронов. Напротив, ни одного устойчивого соединения неона до сих пор идентифицировать не удалось.
Квартиру номер 26 занимает один из семи металлов древности. Вероятно, железо Fe — самый первый металл, с которым познакомился человек. Это единственный химический элемент, имя которого по праву запечатлено в названии целой исторической эпохи — железного века. Да и сегодня, в период широкого использования полимеров и искусственных материалов, железо по-прежнему верно служит человеку. По данным Королевского химического общества, его доля среди всех получаемых металлов достигает 90%. Большая часть железа идёт на производство стали.
Чемпион по тугоплавкости при нормальных условиях — вольфрам W — проживает в квартире номер 74. Он начинает плавиться при 3422°С. Вольфрам — обладатель и самой высокой температуры кипения (5555°С), сравнимой с температурой поверхности Солнца. Неподалёку от самого тугоплавкого расположился самый легкоплавкий металл ртуть Hg, находящийся в жидком состоянии при температуре выше −39°С. Это самый загадочный и необыкновенный металл, известный человеку с незапамятных времён. Алхимики рассматривали ртуть как главное действующее начало философского камня. На протяжении тысячелетий ртуть пленяла и продолжает очаровывать людей своей красотой. Не случайно её нередко называют живым серебром (по-латыни — argentum vivum).
Алхимики рассматривали ртуть как главное действующее начало философского камня. На протяжении тысячелетий ртуть пленяла и продолжает очаровывать людей своей красотой. Не случайно её нередко называют живым серебром (по-латыни — argentum vivum).
А настоящее серебро Ag расположилось в квартире номер 47. Благодаря наивысшей электропроводности и отражательной способности серебро давно с успехом используется в электронике, электротехнике и при изготовлении зеркал. По данным Института серебра (The Silver Institute, USA), мировой спрос на серебро в 2018 году вырос на 4%, а его добыча достигла почти 30 тысяч тонн.
На земле весь род людской
Чтит один кумир священный,
Он царит над всей Вселенной,
Тот кумир — телец златой!
Вряд ли кому не известна ария Мефистофеля из оперы Шарля Гуно «Фауст». Это всё о нём, о жильце квартиры 79, именуемом золотом Au. Оно самое романтичное и самое кровавое, самое почитаемое и самое презренное, самое желанное и самое проклятое. Получать золото, превращая в него другие металлы, было заветной мечтой алхимиков. Недаром они называли его «царём металлов», обозначая символом Солнца. Причины такой магической притягательной силы золота связаны с его уникальными свойствами: оно химически стойко, обладает удивительной ковкостью (из кусочка золота массой 1 г можно вытянуть тончайшую проволоку длиной почти 3,5 км), имеет привлекательный цвет и практически вечно сохраняет блеск. Никакой другой металл не может сравниться в этом отношении с золотом! Справедливости ради нужно отметить, что золото не столь благородно и при определённых условиях способно реагировать с некоторыми простыми веществами, а также со щелочами, с кислотами или их смесями, например с царской водкой — смесью (3:1 по объёму) концентрированных соляной и азотной кислот. Самый стойкий к кислотам металл — иридий Ir, что проживает в квартире 77: до сих пор неизвестно ни одной кислоты или их смеси, способных его растворить.
Получать золото, превращая в него другие металлы, было заветной мечтой алхимиков. Недаром они называли его «царём металлов», обозначая символом Солнца. Причины такой магической притягательной силы золота связаны с его уникальными свойствами: оно химически стойко, обладает удивительной ковкостью (из кусочка золота массой 1 г можно вытянуть тончайшую проволоку длиной почти 3,5 км), имеет привлекательный цвет и практически вечно сохраняет блеск. Никакой другой металл не может сравниться в этом отношении с золотом! Справедливости ради нужно отметить, что золото не столь благородно и при определённых условиях способно реагировать с некоторыми простыми веществами, а также со щелочами, с кислотами или их смесями, например с царской водкой — смесью (3:1 по объёму) концентрированных соляной и азотной кислот. Самый стойкий к кислотам металл — иридий Ir, что проживает в квартире 77: до сих пор неизвестно ни одной кислоты или их смеси, способных его растворить.
Бесспорно, золото издревле было и остаётся символом красоты, власти и богатства.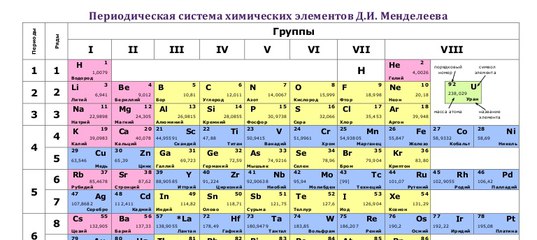 Однако самым престижным считается его сосед, занимающий квартиру 78. Серебристо-белая «госпожа» платина Pt входит в элитный клуб благородных металлов, будучи королевой ювелирного дела. По спросу платина опережает даже золото. Это связано с её высокой химической устойчивостью к сильным кислотам и коррозии даже при высоких температурах. Именно поэтому она широко востребована и в научных исследованиях, и в промышленности.
Однако самым престижным считается его сосед, занимающий квартиру 78. Серебристо-белая «госпожа» платина Pt входит в элитный клуб благородных металлов, будучи королевой ювелирного дела. По спросу платина опережает даже золото. Это связано с её высокой химической устойчивостью к сильным кислотам и коррозии даже при высоких температурах. Именно поэтому она широко востребована и в научных исследованиях, и в промышленности.
Несмотря на то что серебро, золото и платина — мерила богатства, по стоимости они не идут ни в какое сравнение с некоторыми искусственно полученными металлами. Самым дорогим химическим элементом считается один из изотопов калифорния 252Cf, за один грамм которого придётся выложить 27 миллионов долларов США! Его ежегодное производство составляет около 40 мкг, а общий мировой запас, вероятно, не превышает 8 г. Уникальность калифорния ещё и в том, что он является очень мощным источником нейтронов, что позволяет использовать его в медицине и ядерной физике.
Что за волшебные звуки льются из квартиры номер 51? Здесь живёт известный с глубокой древности самый музыкальный химический элемент — сурьма Sb. В отличие от большинства металлов, сурьма при кристаллизации расплава расширяется. Но любопытна другая её особенность: оказывается, при медленном охлаждении и застывании расплавленная сурьма издаёт восхитительные низкочастотные звуки, напоминающие «пение» тибетских колоколов и чаш или чарующее пение сирен.
Химический элемент менделевий Md с порядковым номером 101, синтезированный в 1955 году в Калифорнийской национальной лаборатории имени Эрнеста Лоуренса в Беркли и названный в честь создателя одного из первых вариантов Периодической таблицы, претендует на шутливое звание самого хулиганистого. Дело в том, что рождения желанного атома ждут месяцами и даже годами, по эмоциональному состоянию оно сродни рождению ребёнка. Поэтому легко понять радость коллектива исследователей во главе с Гленном Сиборгом, которому при бомбардировке изотопа эйнштейния 253Es ядрами гелия удалось получить семнадцать (!) атомов менделевия Md. При этом американские учёные позволили себе такую шутку: счётчик, фиксирующий рождение атома нового элемента, они подсоединили к пожарной сигнализации, которая, естественно, срабатывала каждый раз, как только желаемая частица появлялась в реакторе. Так продолжалось до тех пор, пока пожарная служба не пресекла это «хулиганство».
При этом американские учёные позволили себе такую шутку: счётчик, фиксирующий рождение атома нового элемента, они подсоединили к пожарной сигнализации, которая, естественно, срабатывала каждый раз, как только желаемая частица появлялась в реакторе. Так продолжалось до тех пор, пока пожарная служба не пресекла это «хулиганство».
Завершающий на сегодняшний день седьмой период таблицы элемент, имеющий порядковый номер 118, не только самый тяжёлый (по массе), но, вероятно, и самый скандальный. Дело в том, что его рождение связано с крупным научным скандалом. В мае 1999 года физики всё той же лаборатории в Беркли опубликовали в журнале Physical Review Letters статью, в которой сообщили о получении желанного элемента. Когда их коллегам из Германии и Японии (а затем и в самом Беркли) не удалось воспроизвести результаты, возникли подозрения в достоверности полученных данных. Два года спустя результаты были признаны сфальсифицированными, статья отозвана, а фальсификатор уволен.
Успешный синтез нового элемента осуществлён в 2002 и 2005 годах совместно американскими и российскими физиками под руководством Юрия Оганесяна. Три его атома просуществовали менее одной тысячной доли секунды. В ноябре 2016 года новорождённому дано название «оганесон» Og. Так были отмечены заслуги академика Оганесяна в открытии сверхтяжёлых элементов, а оганесон стал вторым (после сиборгия) элементом, названным в честь здравствующего учёного («Наука и жизнь» писала об этом в январе 2017 года, статья «Унуноктий стал оганесоном» ).
Три его атома просуществовали менее одной тысячной доли секунды. В ноябре 2016 года новорождённому дано название «оганесон» Og. Так были отмечены заслуги академика Оганесяна в открытии сверхтяжёлых элементов, а оганесон стал вторым (после сиборгия) элементом, названным в честь здравствующего учёного («Наука и жизнь» писала об этом в январе 2017 года, статья «Унуноктий стал оганесоном» ).
Сегодня физики и химики спорят, есть ли граница у периодической системы и сколько химических элементов может она содержать. Мнения разделились: кто-то полагает, что таблица близка к завершению, кто-то надеется, что могут существовать элементы, имеющие порядковые номера 170 и более. Сейчас начинается строительство восьмого этажа. Как знать, скольким новосёлам ещё предстоит обживать новые квартиры!
Литий – самый лёгкий металл
Элемент №3 Таблицы Менделеева был открыт в 1817 году шведским минералогом и химиком, учеником знаменитого Берцелиуса – Августом Арфведсоном, при изучении минерала петалита (LiAlSi4O10), найденном на железном руднике Уто в Швеции.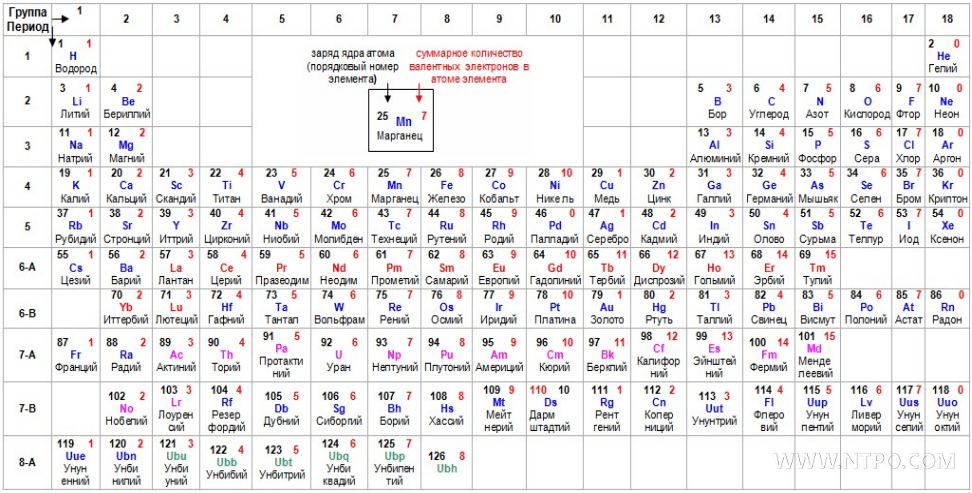 Точно установив, что содержания кремния, алюминия и кислорода в минерале составляют 96% массы минерала, учёный предположил, что оставшиеся 4% принадлежат неизвестному щелочному металлу. В чистом виде новый элемент впервые выделил британский химик и геолог Гемфри Дэви в 1818 году. Позже, по предложению Берцелиуса, новый металл получил название литий, так как был найден в камнях, от др. греч. λίθος — камень. В большинстве европейских языков, как и в латыни, элемент №3 называется Lithium и обозначается символом Li.
Точно установив, что содержания кремния, алюминия и кислорода в минерале составляют 96% массы минерала, учёный предположил, что оставшиеся 4% принадлежат неизвестному щелочному металлу. В чистом виде новый элемент впервые выделил британский химик и геолог Гемфри Дэви в 1818 году. Позже, по предложению Берцелиуса, новый металл получил название литий, так как был найден в камнях, от др. греч. λίθος — камень. В большинстве европейских языков, как и в латыни, элемент №3 называется Lithium и обозначается символом Li.
Петалит (LiAlSi4O10), месторождение Palelni (Мьянма), 4х2 см
Литий — серебристо-белый металл, мягкий, твёрже натрия, но мягче свинца, легко режется ножом. Среди щелочных металлов литий имеет самую высокую температуру плавления и кипения (180 и 1340 °C, соответственно) и самую низкую плотность среди всех металлов – 0,53 г/см³. Это самый лёгкий металл в Таблице Менделеева, поэтому он всплывает в воде.
Литий — серебристо-белый металл.
Согласно космологической теории Большого взрыва литий вместе с водородом и гелием, является одним из первичных элементов, которые появились в результате этого события 13,8 миллиарда лет назад. Среднее содержание (кларк) лития в земной коре составляет 40 г/т. Его основные минералы: лепидолит KLi1,5Al1,5[Si3AlO10](F, OH)2 и сподумен LiAl[Si2O6]. Исходным сырьём для получения этого металла являются минеральные литиевые руды (например, сподумен) и рассолы соляных озёр, богатые его соединениями. Почти все месторождения литиевых руд являются комплексными и отрабатываются для получения лития c попутным извлечением ряда других ценных компонентов. Месторождения этого элемента известны в Боливии, США,Чили, Аргентине, Конго, Китае, Бразилии, Сербии. Солончак Уюни в Боливии — крупнейшее в мире комплексное месторождение литиевых руд.
Солончак Уюни, Боливия.
В России более 50 % запасов литиевых руд сосредоточено в редко-метальных месторождениях Мурманской области.
Самая распространённая область применения этого элемента – литиевые источники питания, которые используются там, где нужна компактность. Литий применяется при изготовлении стекол и керамики, защитных покрытий, смазочных материалов. Его используют в ядерной энергетике, медицине, металлургии и многих других областях промышленного производства.
Элементы: замечательный сон профессора Менделеева
Наступивший 2019 год объявлен Организацией объединенных наций годом Периодической таблицы Дмитрия Ивановича Менделеева, так как именно в этом году ей исполняется 150 лет. Таблицу Менделеева все помнят со школы, но много ли обычный человек, не профессиональный химик, знает о составляющих ее элементах? Чтобы восполнить этот пробел, Аркадий Курамшин написал книгу «Элементы: замечательный сон профессора Менделеева» (Издательство АСТ, 2019 год).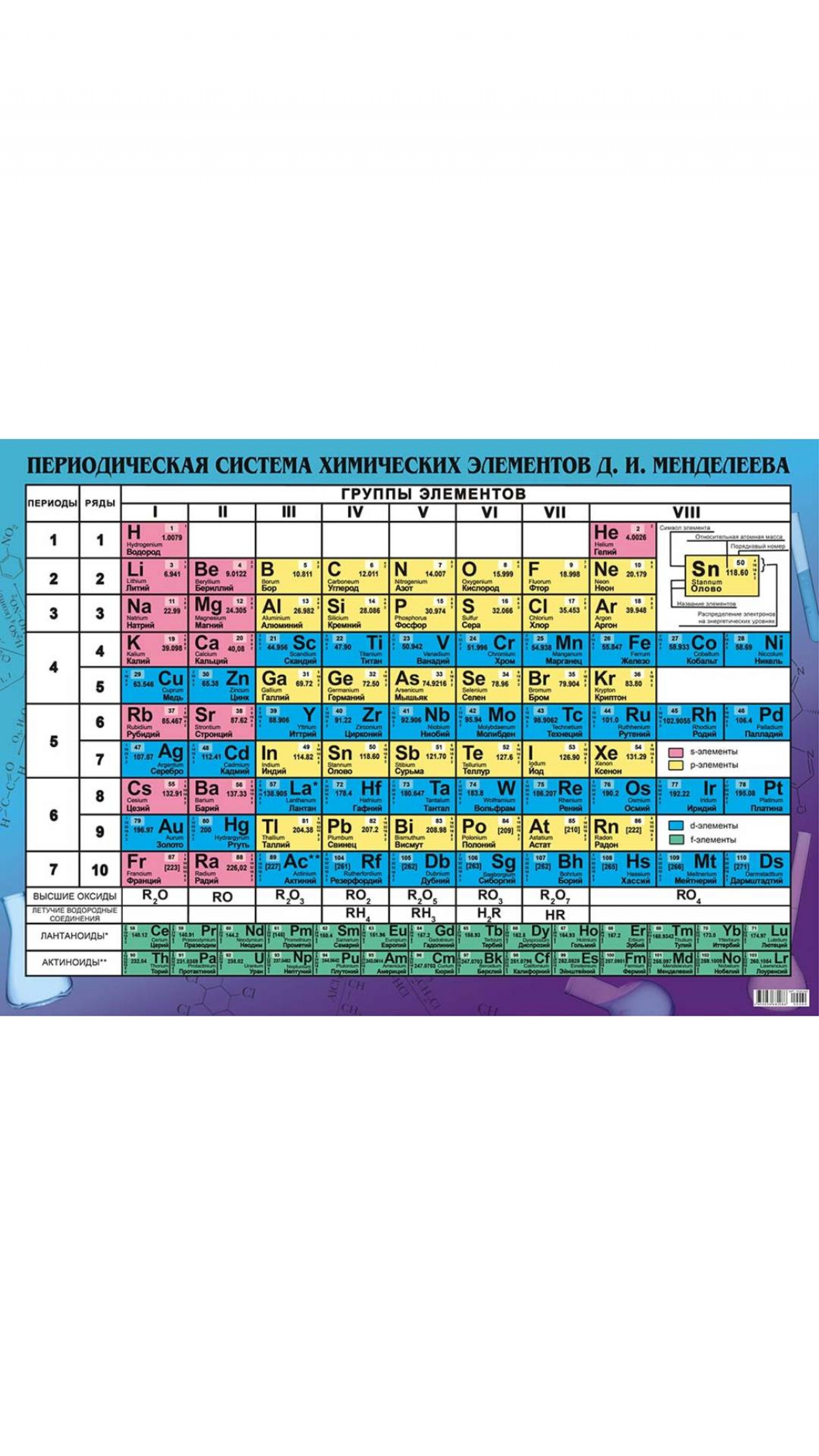 N + 1 публикует первую главу из его книги, которая, естественно, посвящена водороду.
N + 1 публикует первую главу из его книги, которая, естественно, посвящена водороду.
1. Водород
В классическом анекдоте химиков говорится о том, что жена никогда не понимала Дмитрия Ивановича Менделеева и часто выговаривала ему за то, что он, дескать, ставил на первое место не семью, а водород. С точки зрения истории химии и Периодического закона, анекдот, увы, неверен — в составленной Менделеевым таблице до водорода стояли короний и ньютоний — формы светозарного эфира, в существование которого верил Дмитрий Иванович. Тем не менее, самый простой и самый элегантный химический элемент, в состав которого входит всего один протон и один электрон, в полной мере стоит на первом месте.
Тем не менее, самый простой и самый элегантный химический элемент, в состав которого входит всего один протон и один электрон, в полной мере стоит на первом месте.
Водород занимает первое место в Периодической системе, водород — первый химический элемент, который появился во Вселенной, водород стал «сырьём», необходимым для появления всех остальных элементов. Несмотря на то, что появление водорода можно отсчитывать почти с начала времён нашего мира — согласно модели Большого горячего взрыва первые атомы водорода появились в нашей Вселенной через 380000 лет после начала её расширения, и за миллиарды лет огромное количество звезд превращали водород в гелий, водород до сих пор составляет 75% от всего наблюдаемого вещества космоса.
Ещё одно отличие водорода от всех остальных элементов в том, что только его изотопам даны уникальные названия. Простейший атом водорода, состоящий из протона и электрона называют протием, нуклид, ядро которого состоит из протона и нейтрона (с ядром все также связан один электрон) называют дейтерием (др. -греч. δεύτερος «второй») или тяжелым водородом, атом, в ядре которого два нейтрона и протон — тритием (др.-греч. τριτος «третий») или сверхтяжёлым водородом. Никакой другой «квартирант» Периодической системы не заслужил, чтобы его изотопы получили свои собственные имена.
-греч. δεύτερος «второй») или тяжелым водородом, атом, в ядре которого два нейтрона и протон — тритием (др.-греч. τριτος «третий») или сверхтяжёлым водородом. Никакой другой «квартирант» Периодической системы не заслужил, чтобы его изотопы получили свои собственные имена.
Маленькое терминологическое отступление, которое необходимо здесь и далее для понимания. Как человек, придерживающийся строгих правил в терминологии, поясняю. Нуклид — вид атомов с определённым массовым числом и определённым атомным номером, часто вместо этого термина в научно-популярной и даже научной литературе можно встретить термин «изотоп», но это неправильно — мы можем говорить «изотопы элемента», «радиоактивные изотопы», термин «изотоп» не предполагает применения в единственном числе, только во множественном, поэтому здесь и далее, если нужно сказать о каком-то конкретном типе атомов, будет применяться правильный термин «нуклид».
Водород чрезвычайно важен для вселенной, жизни и всего такого прочего. Без водорода не сформировалось бы дающее нам свет и тепло Солнце. Водород входит в состав тех органических соединений, которые мы считаем строительными блоками жизни, и, что не менее важно, без водорода не было бы того вещества, которое столь важно для существования жизни — воды. Можно сказать, что пользоваться жидкой водой мы можем тоже благодаря «сверхспособности» водорода, точнее его способности участвовать в образовании водородных связей. Водородные связи — прочные межмолекулярные взаимодействия, которые возникают между молекулами, в которых водород связан с кислородом, азотом или фтором и являются причиной многих особых свойств веществ, молекулы которых притягиваются друг ко другу за счет этих связей. Если бы не существовало водородных связей, температура кипения воды составляла бы –70°С, и на Земле просто не могло бы существовать жидкой воды.
Без водорода не сформировалось бы дающее нам свет и тепло Солнце. Водород входит в состав тех органических соединений, которые мы считаем строительными блоками жизни, и, что не менее важно, без водорода не было бы того вещества, которое столь важно для существования жизни — воды. Можно сказать, что пользоваться жидкой водой мы можем тоже благодаря «сверхспособности» водорода, точнее его способности участвовать в образовании водородных связей. Водородные связи — прочные межмолекулярные взаимодействия, которые возникают между молекулами, в которых водород связан с кислородом, азотом или фтором и являются причиной многих особых свойств веществ, молекулы которых притягиваются друг ко другу за счет этих связей. Если бы не существовало водородных связей, температура кипения воды составляла бы –70°С, и на Земле просто не могло бы существовать жидкой воды.
Невольным первооткрывателем водорода можно считать Парацельса — швейцарского алхимика шестнадцатого века, также известного как Филипп Ауреол Теофраст Бомбаст фон Гогенхайм. Парацельс заметил, что растворении большинства металлов в кислотах выделяются пузырьки воспламеняемого «воздуха», причем чаще всего свойства этих пузырьков не зависели ни от природы металла, ни от взятой для его растворения кислоты. Чуть позже, независимо от Парацельса выделение горючих пузырьков наблюдал английский химик Роберт Бойль, вполне возможно, что это могли наблюдать и другие алхимики.
Тем не менее, официальным первооткрывателем водорода, человеком, который предположил, что водород является индивидуальным веществом, был Генри Кавендиш. С 1760 по 1780 год Кавендиш выделил водород, назвал его «негорючим воздухом» и обнаружил, что при горении в «дефлогистированном воздухе» (сейчас мы называем его кислородом) образуется вода. Современное название — водород — «рождающий воду» было предложено Антуаном Лораном Лавуазье.
Высокая горючесть молекулярного водорода и то, что это самый легкий из газов, не дает возможности водороду накапливаться в атмосфере Земли в виде простого вещества — сейчас он, если и появляется в атмосфере, то тут же окисляется кислородом воздуха. Ранее, когда атмосфера Земли еще не была окисляющей, до «большого кислородного события», в ходе которого кислород появился в земной атмосфере и стал вторым газом по содержанию, в четырнадцать раз более легкий чем азот и в двадцать два раза более легкий чем углекислый газ, водород просто поднимался в верхние слои атмосферы и улетучивался в космическое пространство (сейчас по такой же схеме наша атмосфера теряет гелий, образующийся в земной коре во время процессов распада радиоактивных элементов). Небольшая плотность молекулярного водорода привела к тому, что прежде всего он начал применяться в воздухоплавании. Первый заполненный водородом воздушный шар был построен в 1783 году французским ученым Жаком Александром Сезаром Шарлем, вскоре после первого полета братьев Монгольфьер. Шарль справедливо рассудил, что замена горячего воздуха на более легкий газ увеличит подъёмную силу шара и создал свое «воздухоплавательное судно» — заполнил водородом оболочку шара из шёлка, для увеличения герметичности пропитанного природным каучуком (с тех пор воздушный шар, наполняемый водородом или другим газом легче воздуха, стали называть «шарльер»).
Казалось, благодаря водороду, воздухоплавание и летательные аппараты легче воздуха ждет большое будущее. Особые надежды на такие аппараты стали возлагаться с заменой мягких оболочек воздушных шаров на оболочки, усиленные внутренними каркасами. Изобретателем и энтузиастом создания воздухоплавательного парка из таких машин был немецкий граф Фердинанд фон Цеппелин, в честь которого такие воздушные суда стали называть цеппелинами (нам они известны как дирижабли). Золотой век дирижаблей пришелся на 1920–1930-е годы, когда они использовались и для перевозки грузов, и людей, в том числе и через Атлантический океан. Тем не менее, водород, обеспечил не только расцвет эры управляемых шарльеров, но и их закат — главной проблемой водорода является его реакционная способность и высокая горючесть. Из-за того, что наполнявший оболочки воздушных шаров водород загорался, часто случались аварии, а после 6 мая 1937 года, когда возгорание цеппелина «Гинденбург», унесшее жизни 36 человек, было заснято на киноплёнку (справедливости ради, были аварии дирижаблей и с большим количеством жертв, но они не попадали в кинохронику), люди всерьез задумались о безопасности перемещения по воздуху на шаре, наполненном водородом. К счастью, дальнейший прогресс авиации позволил безболезненно прекратить использование дирижаблей. Тем не менее, водород и сейчас не теряет своего значения для средств передвижения. Правда, в наши дни водород привлекает инженеров уже не из-за небольшой плотности, а из-за того, что он сгорает с выделением большого количества энергии. В двигателях многих ракет НАСА топливом является сжиженный водород, который сгорает в чистом кислороде.
Ещё одна тенденция нашего времени — попытка рассматривать водород как альтернативу другим видам топлива, в первую очередь — получаемым с помощью переработки нефти. Конечно, с точки зрения экологии водород выглядит более привлекательным, чем бензин или дизельное топливо — хотя бы потому, что он сгорает только с образованием воды, не давая парниковых газов. Однако, с точки зрения инженера или логиста, перейти на водородное топливо не так просто. Наиболее вероятный способ использовать водород — не сжигать его (это может привести к взрыву), а применять как топливо для электрохимической реакции, выделяющийся в результате которой электрический ток и будет приводить в действие двигатель автомобиля. Несмотря на то, что уже сообщается о создании работающих прототипов водородных автомобилей, есть сомнения в том, что в будущем их производство станет массовым. Во-первых, для обеспечения работы таких машин потребуется сеть «водородных заправок», а со времен аварии Гинденбурга водород ни стал не менее взрывчатым, ни менее огнеопасным. Еще одна проблема в том, что из литра бензина можно получить в три раза больше полезной энергии, чем из литра сжиженного водорода, и, очевидно, понятно, что для сжижения легкого газообразного водорода энергию нужно потратить. Нельзя не упомянуть и то, что в настоящее время у нас нет и достаточно эффективных способов получения водорода — его получают либо из углеводородов (попутно при этом образуются парниковые газы), либо электролизом воды, а электричество для процесса тоже может быть получено с помощью «грязных технологий».
Но, даже если в будущем нас не ждёт эра водородных автомобилей, водород может стать топливом для более энергоёмкого процесса — управляемого термоядерного синтеза. Скорее всего, разработки промышленных термоядерных реакторов для получения электроэнергии придётся ждать еще десятилетия, но термоядерные процессы — процесс слияния атомов водорода в гелий, точно такие же, которые протекают в звезде по имени Солнце и в других звездах, с именами и без, позволит добиться получения наиболее чистой и безотходной электроэнергии. И, какое бы применение мы уже не нашли водороду, и, какое применение мы еще найдем для него, он навсегда останется элементом №1, тем элементом, с которого начинается и Периодическая система, и началась Вселенная.
Подробнее читайте:
Курамшин, Аркадий. Элементы: замечательный сон профессора Менделеева / Аркадий Курамшин — Москва : Издательство АСТ, 2019. — 416 с. — (Научпоп Рунета).
Элементы под рукой
В этом году мир отмечает 150-летний юбилей со дня открытия периодической системы элементов. Недавно в честь него мы предлагали пройти тест на знание названий химических элементов, которые по тем или иным причинам в таблицу Менделеева не попали. Однако споры вокруг названий элементов — далеко не единственные разногласия, которые были связаны с периодической системой за полтора века ее истории. На этот раз мы расскажем об альтернативных вариантах формы таблицы элементов, которые в большом количестве предлагались за это время, но в итоге так и не стали широко использоваться.
Наверняка многие из вас видели «таблицы Менделеева», составленные для сортов шоколада, героев мультсериалов, алкогольных напитков или, например, профессиональных велосипедистов. Более научные, но тоже не самые оригинальные варианты периодических систем можно получить, если в ячейках обычной таблицы химических элементов вместо их атомных масс указывать какие-то другие параметры: дату открытия элемента, его фотографию в форме простого вещества, период полураспада, элеткроотрицательность или изображения электронных орбиталей. Например, в нашем материале «Европейский след» мы писали о том, как те или иные элементы зарождаются в недрах звезд, и для наглядности использовали таблицу Менделеева с указанием процессов, которые приводят к появлению каждого из них.
Многие из этих таблиц по-своему интересны, информативны, красивы или смешны, но речь сейчас пойдет не о них. Мы предлагаем вам познакомиться с теми формами периодической системы элементов, которые принципиально отличаются от ее традиционного представления. Эти системы включают те же самые элементы, но для наглядности физических принципов, на которых основана периодичность их свойств, или просто для удобства использования ученые в разное время пытались представить их не в виде привычной нам таблицы из восемнадцати столбцов и семи строчек, а как-то иначе. Для этого они меняли направление периодов и групп, наматывали последовательность элементов на цилиндр и представляли их в виде ветвящихся деревьев.
Периодичность свойств
Чтобы разобраться, почему для периодической таблицы химических элементов предлагали так много разных способов графического представления, сначала кратко напомним о физических основах периодического закона.
В любой версии таблицы элементы расположены по увеличению заряда ядра: у первого элемента — водорода — он самый маленький и равен (по модулю) заряду одного электрона, а у самого тяжелого из известных на данный момент оганесона, расположенного в нижнем правом углу таблицы, он равен (тоже по модулю) заряду сразу 118 электронов. Поскольку заряд ядра определяется количеством в нем протонов, то вместе с зарядом растет и его масса (редкие исключения возможны из-за непостоянного соотношения между числом протонов и нейтронов в ядре), а периодичность свойств связана со структурой электронных оболочек атомов.
Грубо говоря, орбитали, на которых могут находиться электроны вокруг ядра атома, расположены «слоями». Эти слои отличаются между собой по размеру, энергии и форме. Первыми из них заполняются электронами те, которые расположены ближе всего к ядру, а если на них все места уже заняты, то электроны выбирают оболочки подальше от ядра и, соответсвенно, побольше. При этом вместе с увеличением радиуса растет и их энергия, и разнообразие форм: так, у самого близкого к ядру электронного слоя есть только одна сферическая s-орбиталь, а следующий слой состоит уже из четырех орбиталей: к одной сферической присоединяются еще три гантелевидные p-орбитали.
На следующих периодах появляются еще пять крестообразных d-орбиталей, а затем еще и 7 f-орбиталей. Подробнее о физических принципах, на которых основана периодичность химических свойств, вы можете прочитать в нашем материале «Элемент неожиданности».
От того, на каком слое находится «самый дальний» от ядра электрон, и зависит, в каком периоде окажется элемент, а каждый переход к новому слою (когда все более маленькие оказываются занятыми) означает переход к новому периоду в таблице. При этом последовательность заполнения электронных оболочек важна для формирования структуры таблицы и определяется значениями главного и орбитального квантового чисел электронов и формулируется как правило Клечковского (оно же правило Маделунга): сначала заполняется уровень с наименьшим значением суммы этих двух чисел, а при равенстве этих сумм приоритет оказывается у оболочки с меньшим значением главного числа.
Схема заполнения электронами энергетических уровней согласно правилу Клечковского
Wikimedia commons
Логичный вопрос — как всю эту сложную периодическую систему с большим разнообразием электронных орбиталей, увеличением их числа и типов на каждом новом уровне представить графически: куда стоит помещать те или иные элементы, в каком направлении должно происходить увеличение массы атома, как лучше всего продемонстрировать периодичность и сходство свойств, как связать положение элементов с их электронной структурой.
Самый простой пример возникающих сложностей можно найти в самом начале таблицы Менделеева — это водород. С одной стороны, у него на внешнем уровне всего один электрон, что сразу делает его похожим на щелочные металлы: литий, натрий или калий, — а с другой стороны, того же одного электрона водороду не хватает до конфигурации инертного газа, из-за чего для него характерны и некоторые свойства галогенов — фтора или хлора.
В результате в течение долгого времени водород метался между первой группой и седьмой, а в некоторых вариантах таблицы занимал одновременно две позиции в первом периоде таблицы. Подобных коллизий — как фундаментального, так и эстетического характера — за историю периодической таблицы возникало немало.
Вертикально или горизонтально
Например, один из первых вопросов, который задаст учитель химии школьнику, только что познакомившемуся с таблицей элементов, — где в ней находятся периоды, а где группы, кто из них располагается по вертикали, а кто по горизонтали? Прилежному восьмикласснику ответить на этот вопрос никакого труда не составит: конечно, периоды расположены в строках таблицы, а группы — в столбцах.
А вот сам Менделеев уверен в этом не был и в какой-то момент мог ответить на этот вопрос иначе. Самая первая версия таблицы, которую он в 1869 году сначала нарисовал у себя в дневнике, а затем опубликовал в журнале Русского химического общества, была вертикальной: каждый новый период располагался в новом столбце, а похожие по химическим свойствам элементы из одной и той же группы располагались по горизонтальным рядам. В результате 63 известных на тот момент элемента занимали 6 столбцов и 19 строчек.
Рукопись Д. И. Менделеева 1869 года, на которой приведена одна из первых версий периодической таблицы элементов в вертикальной форме
Музей-архив Д. И. Менделеева при СПбГУ
Французский экземпляр «Опыта системы элементов» с вертикальной версией таблицы, разосланный Менделеевым иностранным ученым в 1869 году
Музей-архив Д. И. Менделеева при СПбГУ
Уже в следующем году Менделеев предложил горизонтальную версию таблицы (такую форму имеет и найденная недавно в Сент-Эндрюсском университете одна из старейших сохранившихся копий настенных периодических таблиц, напечатанная в 1885 году, и таблица в аудитории СПбГУ, изготовленная по указанию самого ученого в 1876 году). Тем не менее, вплоть до конца XIX века вертикальные таблицы и их модифицированные версии продолжали использоваться наряду с горизонтальными.
Вопрос о старейшем экземпляре таблицы Менделеева для N + 1 прокомментировал заведующий Музеем-архивом Д. И. Менделеева при СПбГУ Игорь Дмитриев:«Насколько можно судить по сохранившимся документам, Менделеев размышлял о систематике химических элементов по крайне мере с 1867 года, а в активную фазу работа по систематике элементов вошла в начале 1869 года. Провыв наступил 17 февраля (1 марта по новому стилю) 1869 года — именно этим числом датирован и один из сохранившихся набросков. На нем сверху рукою Менделеева написано: “Опыт системы элементов, основанной на их атомном весе и химическом сходстве, Д. Менделеева”. Этот вариант систематики элементов вскоре был отпечатан в виде отдельного листка тиражом 200 экземпляров и разослан русским и иностранным химикам».
Подробнее о самых старых копиях таблицы Менделеева читайте в нашем блоге «Дело не в таблице».
Компактно или наглядно
Количество периодов в периодической таблице за 150 лет увеличилось с шести до семи (и этот факт вопросов не вызывает), а вот насчет «правильного» количества столбцов в таблице до сих пор спорят. Большинство читателей в ответ на вопрос о возможных вариантах таблицы Менделеева наверняка сразу вспомнят про короткопериодную и длиннопериодную версии.
В первом случае d-элементы, у которых появляются электроны на d-орбиталях и которые присутствуют в таблице начиная с 4 периода, записываются в две строчки. Такая запись возможна благодаря сходству степеней окисления у элементов главной группы (то есть p-элементов) и расположенных над ними переходных металлов из d-блока таблицы.
Горизонтальная короткопериодная таблица Менделеева, опубликованная в 1871 году
Wikimedia commons
Короткая запись таблицы получается весьма компактной, но, например, некоторые из металлов в такой системе целыми тройками оказываются как будто бы в той же группе, что и инертные газы, хотя по своим химическим свойствам совершенно на них не похожи. В результате в 1989 году ИЮПАК официально отменил короткий вариант таблицы и сейчас она используется редко, а основной версией таблица стала «длиннопериодная».
В ней все элементы из одного периода записываются одной строкой. С одной стороны, это позволяет избежать некоторой путаницы, но с другой — таблица при этом становится значительно менее компактной и резко увеличивается по ширине. Поэтому чтобы избежать дальнейшего разрастания таблицы элементов в горизонтальном направлении, все f-элементы — лантаноиды и актиноиды — в обоих вариантах таблицы выносятся в отдельные секции в нижней части таблицы.
Несмотря на избыточную ширину даже такого варианта таблицы, физик Гленн Сиборг решил, однако, на нем не останавливаться и в 1969 году предложил свою версию сверхрасширенной таблицы. В этой версии таблицы без переносов строки включаются не только d-элементы, но и f-элементы, то есть лантаноиды и актиноиды (которые сейчас всегда выносятся в отдельную секцию), а также g-элементы, ни один из которых на данный момент не получен. Всего в таблице оказалось 218 элементов — даже сейчас таблица ровно на сто элементов короче, а в тот момент их было синтезировано еще меньше.
Стоит отметить, что насчет научной ценности такой таблицы у ученых возникают сомнения. Во-первых, это просто неудобно — полная версия таблицы будет занимать несколько разворотов книги (да и на экран монитора не уместится). Во-вторых, у большинства химиков вопросы вызывает сохранение периодических закономерностей для химических свойств у настолько тяжелых элементов — при такой массе их свойства сильнее зависят от состава ядра, чем от заполненности электронных оболочек. Эта проблема становится актуальной уже для актиноиодов, а недавно было показано, что и оганесон — последний элемент седьмого периода — не так уж сильно похож на инертный газ.
«Левосторонняя» таблица элементов Шарля Жане 1928 года
Charles Janet / Imprimerie De ́partementale de l’Oise, Beauvais, 1928
Справа или слева
Попытка уместить каждый период в единственную строчку, вплоть до абсурдных вариантов с 50 столбцами, — на самом деле самый простой и безобидный способ изменить внешний вид таблицы, чтобы сделать ее нагляднее. Эти таблицы почти не отличаются от традиционных, и перестроиться на них труда не составит. Значительно сложнее это сделать при работе со некоторыми другими периодическими системаи.
Например, одна из наиболее известных версия альтернативного способа заполнения — это так называемая «левосторонняя» таблица Шарля Жане, которую он предложил в 1928 году. Жане опубликовал за один год две работы, в которых предложил сразу три модификации такой таблицы, остановившись на наиболее наглядной версии.
В отличие от традиционной таблицы, блоки s- и p-элементов в ней расположены в обратном порядке: s-блок (щелочные и щелочноземельные металлы) справа, а p-блок — слева от него. При этом заполняется эта таблица, как и традиционная, слева направо, поэтому переход от одного периода к другому происходит между 2-й и 13-й (или 3-й в короткопериодном варианте) группами. Таким образом, s-элементы в таблице оказываются расположены около правого края, слева от них — инертные газы и весь p-блок, еще левее — d-элементы.
Основное преимущество подобного расположения элементов состоит в том, что с помощью него в «длиннопериодном» варианте таблицы удается избежать разрывов между s- и p-элементами, благодаря чему можно с ходу, практически не задумываясь, определить электронную конфигурацию атома того или иного элемента в незаряженном состоянии, просто отсчитывая нужные блоки с правой стороны.
Другая необычная версия таблицы — это «древовидная» таблица, которую предложил Эдвард Мазурс в 1967 году. В ней не только новый период, а каждый новый блок элементов (s-, p-, d- и f-блоки), начинается на новой строчке. Каждый из них выравнивается по центру, в результате чего образуется структура, напоминающая рисунок елки, треугольные уровни у которой перевернуты вверх ногами. «Ствол» это дерева состоит из s-элементов, над ними находятся p-элементы, затем d- и f-металлы (если они в периоде есть).
Эта таблица также позволяет быстро определить электронную структуру элементов, а для облегчения восприятия, как и в традиционных вариантах, ее ячейки подкрашивают тем или иным цветом.
Древовидная периодическая таблица Эдварда Мазурса, опубликованная на форзаце его книги 1974 года
E. G. Mazurs, Graphic Representation of the Periodic System during One Hundred Years, 1974
Таблица или дерево
При этом далеко не все варианты альтернативных периодических систем, предложенных за 150 лет их истории, представляли собой таблицы. Например, в конце XIX века и начале XX века на основе первоначального вертикального варианта Менделеева ученые пытались построить всевозможные ветвящиеся структуры, которые должны были, по мысли авторов, лучше описывать периодичность свойств, чем таблица из столбцов и строчек.
Как и значительно более поздний вариант Мазурса, эти таблицы тоже напоминают разрастающиеся деревья, но состоят не из отдельных ячеек, а представляют собой элементы, связанные между собой веточками, определяющими родство свойств.
Разветвленная система элементов Бэйли 1882 года
G. N. Quam and Mary Bettell Quam / Journal of Chemical Education, 1934
Во всех этих вариантах ученые использовали идею увеличения длины периода с ростом массы элемента — на каждом следующем шаге между щелочными металлами и галогенами (инертные газы на момент публикации большинства этих вариантов еще не были известны) встраивается все большее число новых элементов.
Ветвистые структуры из элементов, соединенных палочками, иногда принимали довольно необычные формы. Например, в периодической системе Старека 1932 года элементы сгруппированы по сходству физических свойств и образуют зигзагообразную систему с диагональным выравниванием элементов, напоминающую проекцию какой-то сложной трехмерной структуры.
Периодическая система, предолженная Стареком в 1932 году
G. N. Quam and Mary Bettell Quam / Journal of Chemical Education, 1934
Строчки или витки
Пожалуй, самой популярной альтернативой табличному представлению за всю историю периодической системы элементов оказались всевозможные модификации спиральных структур. Основная проблема формы таблицы — прерывистость ее структуры. Чтобы перейти в ней от одного периода к другому, так или иначе нужно перескакивать с конца предыдущей строки к началу новой. Такой скачок, однако, противоречит постепенному росту заряда ядра — при переходе от инертного газа к щелочному металлу следующего периода нужно увеличить заряд ядра на заряд всего одного протона — так же, как и при переходе к следующему элементу в середине периода.
Наиболее очевидной геометрической структурой, которая позволяет показать одновременно и периодичность системы, и последовательность роста атомной массы, оказалась именно спираль. Спиральные формы для систем элементов начали предлагать еще в конце XIX века, а одну из первых значимых с научной точки зрения спиралей элементов предложил в 1902 году Гуго Эрдманн. В предложенной им системе цепочка с последовательностью элементов наматывается на архимедову спираль, при этом короткие периоды (без переходных металлов) проходят один оборот, а длинные — два.Спиральная периодическая система Гуго Эрдманна 1902 года
G. N. Quam and Mary Bettell Quam / Journal of Chemical Education, 1934
В начале XX века было предложено еще несколько «спиралей Менделеева», а значительный шаг в их улучшении сделал тот же Шарль Жане. После публикации своей «левосторонней» версии таблицы он в том же 1928 году начал работать над спиральными версиями структуры. Жане разработал несколько версий объемных и плоских спиралей, что, помимо прочего, помогло ему фактически прийти к верному правилу последовательности заполнения электронных орбиталей на шесть лет раньше Маделунга и на 21 год раньше Клечковского.
Повторные обороты на длинных периодах Жане заменил петлями — покороче для d-элементов и подлиннее — для f-элементов, так что структура в зависимости от формы записи стала напоминать голову кролика или кактус.
Вторая версия спиральной периодической системы Шарля Жане 1928 года
Charles Janet, La classification hélicoïdale des elements chimiques, 1928
Спиральная система Шарля Жане в форме лемнискаты
E. G. Mazurs / Graphic Representation of the Periodic System during One Hundred Years, 1974
Спиральная периодическая система Гордона Ирвина 1939 года
K. Gordon Irwin / Journal of Chemical Education, 1939
Спиральная периодическая система Теодора Бенфея, опубликованная в 1964 году
Wikimedia commons
Подобные плоские спирали продолжали дорабатываться и дополняться в течение еще нескольких десятков лет, но стать полноценной заменой таблицам так и не смогли.
Плоская или объемная
Интересно, что не так мало альтернативных версий периодической системы элементов были не плоскими, а объемными. И в основе большинства из них тоже оказывались спиральные структуры. Обычно цепочки последовательностей элементов предлагали «наматывать» на цилиндр или конус (в последнем случае таблица становится похожа на гирлянду на новогодней елке).
Однако из-за невозможности нормально работать с изображениями этих спиралей на бумаге и небольшой наглядности все эти варианты остались лишь экспериментами.
Модель спиральной периодической системы в форме восьмерки, предложенная Круксом в 1898 году
G. N. Quam and Mary Bettell Quam / Journal of Chemical Education, 1934
При этом, кроме научно значимых попыток создания объемных структур, ученые и художники наносили периодическую таблицу и на другие объемные фигуры. Например, в начале XX века появилась сферическая версия таблицы элементов, которая заполнялась сверху вниз, при этом на нижнюю половину сферы должны были попадать все неустойчивые элементы. Или совсем экстравагантные варианты, такие как таблица Менделеева на ленте Мёбиуса, которая имеет, правда, лишь эстетическую ценность.
Из-за того, что многочисленные версии таблиц элементов стали возникать сразу же после формулировки периодического закона, уже с конца XIX века появились и первые обзорные статьи, которые сравнивали эти варианты между собой, определяя наиболее удобные, наглядные и подходящие для дальнейшего использования версии. Сейчас новые подобные публикации в форме отдельных статей и целых монографий все еще продолжают появляться, хотя носят уже скорее исторический интерес.
Александр Дубов
Литература
1. G. N. Quam and Mary Battel Quam, Types of Graphic Classifications of the Elements, Journal of Chemical Education, 1934.2. Edward G. Mazurs, Graphic Representations of the Periodic System During One Hundred Years, University of Alabama Press, 1974.
3. Eric Scerri, The Periodic Table: Its Story and Its Significance, Oxford University Press, 2006.
Первый в таблице Менделеева | Новости сибирской науки
Кабардино-Балкарский государственный университет (КБГУ) вступил в научный консорциум “Технологическая водородная долина”, который занимается водородными технологиями и энергетикой. В нем состоят ведущие научно-исследовательские институты и вузы России. Ученые из КБР здесь смогут реализовать сразу несколько проектов. Подробности узнал корреспондент “РГ”.
15 апреля прошло заседание Совета индустриальных партнеров консорциума, на котором был представлен доклад о наработках КБГУ в области водородных технологий, на нем же и одобрили заявку вуза на вступление в организацию. Идеи ученых из Нальчика оказались востребованы, так как в России больше никто не занимается такими проектами.
– В университете вырабатываются новые топливные элементы, относящиеся к “зеленому” водороду, композиты, из которых можно изготавливать резервуары для его транспортировки, а также поглотители водорода, – рассказала проректор по научной работе КБГУ Светлана Хаширова.
Она занимает должность директора Центра прогрессивных материалов и аддитивных технологий при КБГУ. Здесь трудятся над созданием полимерных материалов и их внедрением. Именно эти исследования ученые планируют использовать для дальнейшей работы над технологиями транспортировки водородного топлива.
Водород считается самым перспективным сырьем в глобальной экономике.
– Сейчас резервуары делают из металла, замена на полимерные позволит значительно снизить их вес. Мы пока не говорим о форме, объеме и других характеристиках изделий. Речь идет о том, чтобы разработать материал, способный не пропускать водород. Это первый элемент в таблице Менделеева, самый легкий, атомы маленькие, поэтому он без труда проникает сквозь различные материалы. Считаем, что для резервуаров можно использовать наши суперконструкционные композиты, – подчеркнула Хаширова. – Нам предстоит решить сложную задачу, но мы знаем, в каком направлении двигаться и что делать.
Сложность заключается в том, что резервуар должен быть, по меньшей мере, двухслойным: внутреннюю часть необходимо делать с использованием титана, а внешнюю – из композитов. При этом материал должен выдерживать температуры от минус 200 до плюс 200 градусов по Цельсию.
– За технологиями, основанными на использовании водорода, – будущее, – отметила Хаширова. – Они приносят минимальный ущерб окружающей среде. Экономическое развитие многих стран связано с ними. К примеру, Япония приняла в 2017 году “Базовую водородную стратегию”, это масштабный правительственный план. В этой стране также сформировали систему ассоциаций, которые отвечают за конкретные исследования.
Сейчас промышленные предприятия, университеты и академические учреждения, входящие в российский консорциум, разрабатывают “дорожную карту”. В ней будут расписаны компетенции каждого члена союза. Далее они смогут объединяться для ускорения работы по своему направлению.
“Уже есть предварительные договоренности о создании междисциплинарных групп для проведения совместных научных исследований, у КБГУ мощный потенциал в химии и физике, а научное объединение дает возможность обмениваться опытом и искать новые направления работы”, – сообщили в пресс-службе КБГУ.
Водород считается самым перспективным сырьем в глобальной экономике, предполагается, что после 2040 года он станет основным энергоносителем и будет играть примерно такую же роль, как нефть и газ сейчас. Согласно оценкам Международного водородного совета, к 2050 году он аккумулирует 18 процентов общемирового спроса на энергоносители.
При этом водород очень опасно перевозить, потому что он воспламеняется при любом контакте с кислородом, в том числе содержащимся в обычном воздухе. Из-за взрывоопасности транспортировка технически усложняется, что делает ее очень дорогостоящей. Альтернатива – строительство специальных трубопроводов, что также требует значительных инвестиций.
В Энергетической стратегии РФ на период до 2035 года отмечается, что расширение производства и использования водорода – одна из главных ее целей. Дело в том, что в связи с мировым трендом на отказ от углеводородного топлива Россия может лишиться крупных рынков сбыта нефти и газа. Поэтому есть планы перейти на экспорт топлива будущего и дальше наращивать его. Плановые показатели таковы: к 2024-му РФ должна вывозить 0,2 миллиона тонн водородного топлива в год, а к 2035-му – два миллиона тонн. Но для этого необходимо разработать собственные высокоэффективные электролизеры воды и системы компактного хранения и транспортировки водорода.
Между тем
Согласно “дорожной карте” минэнерго РФ “Развитие водородной энергетики в России” на 2020-2024 годы этим направлением займутся крупные госкорпорации – “Росатом” и “Газпром”. Компании внедрят пилотные водородные установки на атомных электростанциях, объектах добычи газа и предприятиях по переработке сырья. В 2024 году планируется построить опытный полигон для железнодорожного транспорта на водородном топливе. Первые поезда на нем должны начать курсировать на Сахалине.
Без химии нет альтернативы | Решения на РБК+ Татарстан
В общественном сознании альтернативная энергетика ассоциируется в основном со впечатляющими полями солнечных панелей или громадных ветряков. В действительности реальную альтернативу пока создает лишь химпром: 55% рынка возобновляемых энергоресурсов занимает водородная энергетика, еще 15% приходится на биотопливо.
Легок на помине
Самый легкий элемент таблицы Менделеева считают кандидатом на роль универсального топлива по множеству причин: водород экологически чист, потенциально его запасы очень велики, ведь получать его можно не только из различных гидратов, но и из обычной воды с помощью процесса электролиза. Водородный двигатель внутреннего сгорания, работающий на основе цикла Отто, в среднем на 8% эффективнее бензинового. А электрический двигатель, энергию которому дают топливные ячейки, осуществляющие «холодное сжигание» водорода, оказывается в два-три раза эффективнее обычного. Топливные ячейки считаются перспективной технологией, которую можно задействовать не только в двигателях электромобилей, но для электроснабжения и обогрева зданий. Важным для использования водорода в качестве источника энергии для промышленных предприятий и зданий является то, что установки, работающие на этом топливе, могут осуществлять когенерацию — при их работе выделяется не только электричество, но и тепло, а конечным продуктом процесса является та же вода.
В настоящее время промышленное получение водорода осуществляется в основном из природных (и в массе своей невозобновляемых) источников — прежде всего из природного газа. Однако электролиз позволит выйти из этого порочного круга. Можно получать водород и с помощью колоний одноклеточных водорослей и некоторых видов бактерий — этот способ сейчас активно исследуется.
Все эти преимущества водорода позволят ему год от года упрочивать позиции лучшего возобновляемого топлива. Согласно прогнозу консалтингового агентства Freedonia Group Inc. «Глобальный водород», в период до 2018 года мировой спрос на самый легкий элемент будет расти в среднем на 3,5% в год. Основные драйверы роста так или иначе связаны с ужесточением законов, ограничивающих выбросы в атмосферу диоксида углерода. Насколько эффективны государственные законы, показывает пример США, где объем производства водорода ежегодно растет примерно на 10% (впрочем, согласно тому же исследованию по темпам роста производства водорода вскоре будет лидировать Китай, правительство которого планирует постепенно снижать долю в энергетике нынешнего лидера — угля). А вот в странах ЕС и Японии и производство, и потребление водорода будет оставаться низким. Практически отсутствует и едва ли появится сколько-нибудь масштабное производство топливного водорода и в России: крупнейшая водородная установка филиала башкирской компании «Башнефть-Новойл», введенная в строй в прошлом году и рассчитанная на получение 153 тыс. т продукта ежегодно, будет производить этот газ для других нужд: водород используется при очистке нефтепродуктов, в производстве химикатов и металлов.
Враг печени — друг двигателю
И все-таки, несмотря на все плюсы, у водорода есть ряд серьезных минусов. Он взрывоопасен, а значит, его хранение и транспортировка будут требовать совершенно иных условий безопасности, чем бензина. Электролиз сам по себе нуждается в значительных объемах энергии, то есть для получения водорода придется строить станции, питать которые будут, например, солнечные батареи. Впрочем, в конечном счете это поможет решить одну из важных проблем солнечной энергетики — как хранить получаемую энергию.
Имеющиеся минусы могут оказаться фатальными. «У меня ощущение, что водородные проекты в мире понемногу сворачиваются, — говорит президент Российской биотопливной ассоциации Алексей Аблаев. — Дело в том, что водород плохо получается хранить: он быстро утекает из любых емкостей. Даже автомобильные аккумуляторы выгоднее — они дольше хранят заряд».
Более перспективным, нежели водородная энергетика, может оказаться использование биотоплива. Биотопливо в отличие от водорода не какой-то элемент или соединение, а целый класс различных углеводородов. Например, им может служить этанол — хорошо знакомый нам по алкогольным напиткам этиловый спирт, который также прочат в качестве если не замены бензину, то эффективной добавки к нему. Бензиново-этанольная смесь чище бензиновой и в перспективе дешевле, хотя топливная эффективность бензина в полтора раза выше. Сейчас в мировой дорожно-транспортной индустрии этанол составляет примерно 6–7% от всего используемого автомобилями топлива. Здесь, конечно, многое зависит от государственной политики: так, например, в США уже сейчас эта цифра выше — более 10%, здесь работают более двухсот предприятий, занимающихся производством этанола.
В 2014 году в мире было произведено около 94,8 млрд л этанола. 87% этого объема используется в качестве топлива, остальное идет на другие нужды промышленности и потребительского сектора (напитки, косметика). 54,2 млрд л из указанного объема производятся в США, 23,5 млрд — в Бразилии, тогда как в странах ЕС — менее 6 млрд л. Суммарно это более 80% производимого в мире этанола, и наращивание объемов его использования является правительственной политикой. Так, принятый в США в 2007 году Акт энергетической независимости и безопасности ставит целью использование к 2022 году 36 млрд галлонов возобновляемого топлива. Примечательно, что в таких странах, как Китай и Индия, производство этанола за последние годы сократилось, в то время как в США и ЕС оно растет. В России производство этанола — хорошо развитая отрасль, однако речь идет не о топливном этаноле.
Авгиевы свинарники
Привлекательность этанола в том, что он выгоден в производстве. «Это единственное жидкое топливо, которое может себя окупать без господдержки, — объясняет Алексей Аблаев. — Основным драйвером роста рынка этанола как за рубежом, так и в России является необходимость чем-то загрузить сельское хозяйство: многие страны полностью закрывают свою потребность в зерне, а «лишнее» зерно (особенно с удаленных территорий, откуда его вывоз невыгоден) направляют на получение биотоплива». Но в России этому мешает законодательство: любая смесь этанола с бензином подпадает под такой же акциз, как и производство водки. Сейчас в Думу внесен законопроект, который направлен на отмену этого порядка, но судьба его неясна.
Другие виды биотоплива — например, биогаз (газ, получаемый водородным или метановым брожением биомассы) — рентабельны не сами по себе, но лишь в качестве «побочного продукта» решения проблемы органических отходов. Биогазовые установки, например, позволяют перевести на энергетическое самообеспечение крупные фермерские хозяйства. В западных странах эта технология сейчас весьма популярна: в Евросоюзе функционирует 5 тыс. биогазовых заводов. В денежном выражении объем рынка биогаза в ЕС превышает $1,4 млрд и растет на 8–12% в год. «В России крупных биогазовых установок крайне мало, — говорит основатель компании Wisesoil (Екатеринбург) Александр Смотрицкий. — Причины тут экономические: установка, рассчитанная на производство энергии в 1 МВт, обходится в €3–4 млн. Вот почему распространяются они в основном там, где существует господдержка: например, в Германии свыше 9 тыс. биогазовых установок именно потому, что там действуют субсидированные тарифы на поставку произведенной на них энергии. А когда установки начинают окупаться, льготы на них потихоньку отменяют».
Впрочем, способы обойтись почти без господдержки существуют: например, разработанная Wisesoil технология (она задействует обработку сырья ультразвуком) позволяет вдвое повысить скорость переработки сырья, то есть становится эффективным использование менее крупных и менее дорогих реакторов. «Такого рода проекты могли бы быть привлекательными, если бы не высокие капитальные вложения: биогазовая установка — вещь выгодная, но окупится она только за десять лет. И здесь снова свою роль могла бы сыграть правительственная политика, — говорит Алексей Аблаев. — Если бы в России действовали жесткие законы, например, по утилизации свиного помета, фермы вынуждены были бы ставить такие установки».
Самый легкий элемент в таблице Менделеева – это химический элемент 11 класса лития CBSE
Подсказка: Таблица Менделеева представляет собой табличное расположение элементов, встречающихся в природе. Элементы расположены в соответствии с их химическими свойствами и размером. Чтобы найти самые легкие и самые тяжелые элементы, запишите атомные номера данных элементов. Используйте его, чтобы определить количество протонов и нейтронов, так как он даст нам средний атомный вес. Полный пошаговый ответ:
Мы знаем, что таблица Менделеева представляет собой табличное отображение химических элементов, встречающихся в природе.В периодической таблице 118 элементов. Они расположены в соответствии с их атомным номером, электронной конфигурацией и повторяющимися химическими свойствами.
Мы знаем, что атом состоит из субатомных частиц, а именно протона, нейтрона и электрона. Средний атомный вес элемента определяется количеством нейтронов и протонов в его ядрах.
Давайте обсудим данные элементы и попробуем найти самые легкие из них.
Литий имеет атомный номер 3 и химический символ Li.Он содержит три протона, четыре нейтрона и три электрона. Его атомная масса 6,941 а.е.м.
Фтор имеет атомный номер 9 и химический символ F. Он содержит 9 протонов, 10 нейтронов и 9 электронов. Это одновалентный ядовитый газообразный галоген, его содержание составляет 18,998 а.е.м.
Водород имеет атомный номер 1 и химический символ H. Он состоит только из одного протона и одного электрона и не состоит из нейтронов. Это самый легкий газ с атомной массой 1,00794 а.е.м.
Гелий имеет атомный номер 2 с химическим символом He.Он состоит из двух протонов, двух нейтронов и двух электронов. Его атомная масса 4,0026 а.е.м.
Из приведенного выше обсуждения видно, что водород имеет только 1 протон, который отвечает за атомный вес. Таким образом, водород – самый легкий элемент.
Итак, правильный ответ – «Вариант В».
Примечание: Водород – самый легкий элемент в периодической таблице, но периодическая таблица разделена на группы. Среди элементов группы 1 литий является самым легким, а среди элементов группы 17 самым легким является фтор.Литий – самый легкий щелочной металл серебристого цвета с мягкой, но твердой консистенцией. Фтор – самый химически реактивный и электроотрицательный из всех элементов. Он образует соединения даже с благородными газами криптоном, ксеноном и радоном.
Легкая таблица Менделеева играет большую роль в жизни на Земле
Несмотря на то, что водород является легким из химических элементов, он обладает серьезным преимуществом, когда дело доходит до его роли в жизни и его потенциала в качестве решения некоторых мировых проблем.Когда мы празднуем 150-летие периодической таблицы Менделеева, кажется разумным снять шляпу перед этим, первым элементом таблицы.
Один атом кислорода соединяется с двумя атомами водорода, образуя воду. Лясковская Екатерина / SHutterstock.comВодород является самым распространенным элементом во Вселенной, но не на Земле из-за его легкого веса, который позволяет газу просто улетать в космос. Водород необходим для нашей жизни – он питает солнце, которое каждую секунду превращает сотни миллионов тонн водорода в гелий.А два атома водорода присоединены к одному атому кислорода, чтобы образовалась вода. Обе эти вещи делают нашу планету пригодной для жизни.
Водород не только позволяет солнцу согревать Землю и помогает создавать воду, которая поддерживает жизнь, но этот простейший из всех элементов может также дать ключ к поиску чистого источника топлива для питания планеты.
Инь и ян водорода как источник энергии
Немецкий пассажирский дирижабль Гинденбург через секунду после возгорания, 6 мая 1937 года.История Эверетта / Shutterstock.comКак и многие другие химические элементы, водород имеет для нас огромную ценность, но имеет и темную сторону. Будучи легче воздуха, он заставляет вещи плавать, поэтому его использовали на ранних дирижаблях. Но водород очень взрывоопасен, и в 1937 году немецкий дирижабль «Гинденбург» после трансатлантического путешествия взорвался при попытке состыковаться со своей швартовной мачтой, в результате чего погибли 36 человек.
Родственники водорода, дейтерий и тритий, называемые тяжелым водородом, использовались для изготовления водородных бомб.Здесь тяжелые атомы водорода сливаются вместе в процессе, называемом ядерным синтезом, с образованием гелия, что немного похоже на реакцию, происходящую на солнце. Количество энергии, производимой этим процессом, больше, чем в любом другом известном процессе – область в центре взрыва по существу испаряется, генерируя ударные волны, которые разрушают все на своем пути. Яркий белый свет может ослепить людей за много миль. Он также производит радиоактивные продукты, которые переносятся по воздуху и вызывают широкомасштабное загрязнение окружающей среды.
Изотопы водорода: протий, дейтерий и тритий. Designua / Shutterstock.comОднако приручение зверя может быть решением энергетических проблем будущего. При контролируемом сжигании водород представляет собой самое чистое топливо, в результате чего в качестве отходов образуется только вода. Это здорово по сравнению с бензиновым двигателем, который вырабатывает углекислый газ, вызывающий изменение климата, и ряд других вредных газов. При хранении под высоким давлением и очень низкой температурой -400 градусов по Фаренгейту водород существует в виде жидкости, и его сжигание с кислородом используется для запуска ракет в космос.
Однако машина с баком взрывоопасного водородного ракетного топлива не кажется беспроигрышной. В настоящее время проводится множество исследований, направленных на решение проблемы хранения. Большое количество ученых пытаются разработать химические соединения, которые безопасно удерживают и выделяют водород. На самом деле это крепкий орешек, и для решения этого потребуется время и много великих умов.
Мощность водорода
Атомы водорода также придают таким вещам, как лимонный сок и уксус, характерный терпкий вкус.Положительно заряженные атомы водорода, называемые протонами, лишенные своего единственного электрона, плавают в этих растворах и являются ключевым компонентом кислот. Химический состав этих протонов также отвечает за фотосинтез, процесс, посредством которого растения превращают световую энергию в химическую энергию, а также за многие процессы в организме человека.
Это символ и электронная диаграмма водорода. BlueRingMedia / Shutterstock.comПротоны также являются ключевым компонентом топливных элементов.Вместо того, чтобы сжигать водород, топливные элементы преобразуют его в электричество и рассматриваются как путь будущего. Они делают это, разделяя газообразный водород на протоны и электроны на одной стороне топливного элемента. Положительно заряженные протоны переходят на другую сторону ячейки, оставляя позади отрицательно заряженные электроны. Это создает поток электричества между сторонами ячейки при подключении к внешней цепи. Этот ток может питать электродвигатель, включенный в эту цепь. Поезда, работающие на водороде, уже работают в Германии, и несколько международных производителей автомобилей разрабатывают автомобили на топливных элементах.Опять же, единственным побочным продуктом процесса является вода.
Я думаю, что в будущем мы увидим рост использования водорода в качестве топлива. Чтобы он был полезным, есть две основные проблемы. Большой вопрос – это проблема хранения. Инженерам нужно выяснить, как безопасно хранить водород, и начать строить места, где люди могут заправиться. Благодаря быстрому развитию химии и техники, водородные станции могут вскоре начать появляться и стать таким же обычным явлением, как сегодня бензозаправочные станции. Такая инфраструктура будет необходима.Вы не хотите, чтобы в поездке закончилось топливо, потому что, в отличие от газового автомобиля, вы не можете позвонить другу, чтобы принести вам баллончик с водородом.
Водородный топливный насос на станции Shell для автомобилей, работающих на экологически чистых водородных топливных элементах. Роб Крэндалл / Shutterstock.comДругой проблемой является получение самого водорода. Доступного нам природного газообразного водорода очень мало, потому что он всплывает и выходит из атмосферы. Вместо этого он должен быть получен из какого-то другого источника и зафиксирован.
В настоящее время большая часть водорода в мире производится либо из древесины, либо из ископаемых видов топлива, таких как природный газ и нефть. Это лишает нас возможности быть чистым источником энергии. Самый большой источник водорода – это самая безопасная и доступная жидкость на Земле: вода. Если мы, химики, сможем найти лучшие способы расщеплять молекулы воды и извлекать из них атомы водорода, это было бы огромным шагом вперед.
ЭЛЕМЕНТОВ: Z1-Z10
ЭЛЕМЕНТОВ: Z1-Z10 ДОБРО ПОЖАЛОВАТЬ РАЙ СТУДЕНТЫ VALLEY CC:ЭТО ВАШ “ ЗНАЙ СВОИ ЭЛЕМЕНТЫ ” ВЕБ-САЙТ
ВОДОРОД
(греч. Образование воды), символ H, реактивный, бесцветный, без запаха, и безвкусный газообразный элемент.Атомный номер водорода равен 1. Элемент обычно относится к группе 1 (или Ia) периодической таблицы. Как большинство газообразных элементов, водород двухатомный (его молекулы содержат два атомов), но при высоких температурах распадается на свободные атомы.
ЭЛЕКТРОННАЯ КОНФИГУРАЦИЯ: 1 с 1
Обнаружен свободный водород. только в очень мелких следах в атмосфере, но в солнечном и звездном спектрах показывают, что его много на Солнце и других звездах, и на самом деле он самый распространенный элемент во вселенной.В сочетании с другими элементами он широко распространен на земле, где наиболее важны и многочисленны соединение водорода – вода, h3O. Это компонент всех составляющих живого вещества, а также многих минералов.
Является неотъемлемой частью всех углеводородов. и огромное количество других органических веществ. Все кислоты содержат водород; отличительной чертой кислоты является ее диссоциация, при входе в раствор, на дают ионы водорода.
Самый легкий из всех газов, водород использовался для надувания воздушных шаров и дирижаблей. Он воспламеняется очень легко, однако, небольшая искра, заставившая его загореться, и несколько дирижаблей, включая Гинденбург, были уничтожены водородными пожарами. Гелий, который имеет 92 процента подъемной силы водорода и не воспламеняется, используется везде, где это возможно.
Известно, что водород существует в трех изотопных формы. Ядро каждого атома обычного водорода состоит из один протон. Дейтерий, содержащийся в обычном водороде в количестве 0,02 процентов, содержит один протон и один нейтрон в ядре каждого атома и имеет атомную массу два. Тритий, нестабильный радиоактивный изотоп, содержит один протон и два нейтрона в ядре каждого атома и имеет атомная масса равна трем и составляет только 1 из 10 18 атомов водорода.
ГЕЛИЙ
(греч. Helios, «солнце»), символ He, инертный, бесцветный, газообразный без запаха
элемент.В 18 группе таблицы Менделеева. Гелий – один из
благородные газы. Атомный номер гелия равен 2. Атомный вес
гелий – 4,003.
ЭЛЕКТРОННАЯ КОНФИГУРАЦИЯ: 1с 2
Французский астроном Пьер Янссен обнаружил гелий в спектре короны Солнца во время затмения 1868 года. Гелий – второй самый распространенный элемент во Вселенной после водорода.
Гелий состоит из одноатомных молекул и является самым легким всех газов, кроме водорода.. Гелий, как и другие благородные газы, химически инертен. Его единственная электронная оболочка заполнена, что делает возможным реакции с другими элементами чрезвычайно сложны, и образующиеся соединения довольно нестабильно. Гелий – самый трудный для сжижения газ и невозможно затвердеть при нормальном атмосферном давлении. Эти свойства делают жидкий гелий чрезвычайно полезным в качестве хладагента и для экспериментальных работают при создании и измерении температур, близких к абсолютному нулю. Жидкий гелий можно охладить почти до абсолютного нуля при нормальном давлении. за счет быстрого удаления пара над жидкостью. При температуре немного выше абсолютного нуля он превращается в гелий II, также называемый сверхтекучим гелий, жидкость с уникальными физическими свойствами. Не имеет точки замерзания, и его вязкость, по-видимому, равна нулю; это легко проходит через минуту трещин и пор, и даже будет ползать по бокам и по краю контейнер. Гелий-3, более легкий изотоп гелия с массой 3, который имеет даже более низкая температура кипения, чем у обычного гелия, показывает заметно другие свойства в жидком состоянии.
Поскольку гелий негорючий, предпочтительнее к водороду в качестве подъемного газа в аэростатах легче воздуха; в нем 92 процентов подъемной силы водорода, хотя он весит вдвое больше. Гелий используется для повышения давления и повышения жесткости конструкции ракет перед взлета и герметизации баков жидкого водорода или другого топлива в для нагнетания топлива в ракетные двигатели. Это полезно для этого приложения потому что он остается газом даже при низкой температуре жидкого водорода.Потенциальное использование гелия в качестве теплоносителя в ядерных реакторах. потому что он остается химически инертным и нерадиоактивным в условиях которые существуют внутри реакторов.
ПОДУМАЙТЕ О ХИМИЧЕСКОЙ ИНЕРТНОСТИ ГЕЛИЯ В УСЛОВИЯ ЕГО ПЕРВОГО ОСНОВНОГО УРОВНЯ ЭНЕРГИИ ИЛИ ЗАПОЛНЕНИЯ ОБОЛОЧКИ. НУЖНО ЛИ ЭТОЙ ЭЛЕМЕНТ ПРИНЯТЬ ИЛИ ПОЖЕРТВОВАТЬ ЭЛЕКТРОНЫ?
ЛИТИЙ
Symbol Li, серебристо-белый химически активный металлический элемент, который
самый легкий из всех металлов.В группе 1 (или Ia) периодических
Таблица. Литий – один из щелочных металлов.
Атомный номер лития 3.
ЭЛЕКТРОННАЯ КОНФИГУРАЦИЯ: 1с 2 , 2с 1
По химическому составу литий похож на натрий в том, что оба имеют валентный электрон np 1 . Они образуют катионы 1+. Оно делает не встречаются в природе в свободном состоянии, а только в соединениях, которые широко распространенный.Важные соединения лития включают гидроксид, используется для связывания углекислого газа в системах вентиляции космических аппаратов. и подводные лодки; и гидрид, используемый для надувания спасательных шлюпок. Литий карбонат, распространенный минерал, используется при лечении маниакально-депрессивных состояний. психоз (основной компонент психоактивных препаратов, таких как валиум).
БЕРИЛЛИЙ
Символ Be, серый, хрупкий металлический элемент, с атомным номером
из 4. Он находится в группе 2 (или IIa) периодической таблицы.Его атомный вес
составляет 9,012.
ЭЛЕКТРОННАЯ КОНФИГУРАЦИЯ: 1с 2 , 2с 2
Бериллий, один из щелочноземельных металлов . Он образует 2+ катионов.
Часто добавление бериллия в некоторые сплавы приводит к продуктам, имеющим высокую термостойкость, улучшенную коррозию сопротивление, большую твердость, лучшие изоляционные свойства и лучшую литейные качества.Многие детали сверхзвуковых самолетов изготовлены из бериллия. сплавы из-за их легкости, жесткости и стабильности размеров.
УГЛЕРОД
ЭЛЕКТРОННАЯ КОНФИГУРАЦИЯ : 1с 2 , 2с 2 , 2п 2
Символ C, элемент, имеющий решающее значение для существования живых организмов, и это имеет много важных промышленных применений. Атомный номер углерода – 6; элемент находится в группе 14 периодической таблицы.Его атомная масса 12,01115.
Три формы элементарного углерода, которые встречаются в природе – алмаз, графит и аморфный углерод – твердые вещества с чрезвычайно высокой высокие температуры плавления и нерастворимы во всех растворителях при обычных температурах. Физические свойства трех форм сильно различаются из-за различия в кристаллической структуре. Алмаз – самый твердый материал. известно, каждый атом связан с четырьмя другими атомами в трехмерной структуре, тогда как графит состоит из слабосвязанных плоских слоев атомов, которые расположены в шестиугольниках.
Углерод обладает уникальной способностью связываться с другими
атомы углерода с образованием сложных цепочек и колец. Это свойство приводит к
почти бесконечное количество углеродных соединений, наиболее распространенными из которых являются
содержащий углерод и водород. Были идентифицированы первые углеродные соединения
в живом веществе в начале XIX века, и поэтому
изучение углеродных соединений получило название «органической» химии.
Углерод при нормальных температурах характеризуется
низкой реактивностью.При высоких температурах он напрямую реагирует с большинством
металлы с образованием карбидов и с кислородом с образованием окиси углерода
(CO) и диоксид углерода (CO 2 ). Углерод в виде кокса используется для удаления кислорода из оксидных руд металлов с целью получения
чистый металл. Углерод также образует соединения с большинством неметаллических элементов.
Углерод – широко распространенный элемент в природе; Встречается в основном в виде карбонатов.Углекислый газ – это важный компонент атмосферы и основной источник углерода включены в живую материю. Растения в процессе фотосинтеза, превращают диоксид углерода в органические углеродные соединения, которые впоследствии потребляется другими организмами. ЭТО ОДИН ИЗ САМЫХ ВАЖНЫХ БИОХИМИЧЕСКИХ РЕАКЦИИ, ПРОИСХОДЯЩИЕ НА ЗЕМЛЕ.
Самый распространенный изотоп углерода – углерод-12; в 1961 году этот изотоп был выбран для замены изотопа кислорода-16 в качестве стандарта для атомной весов, и ему был присвоен атомный вес 12.
Этот веб-сайт создан на основе материалов, взятых из Энциклопедии Энциклопедии.
96 от Microsoft.
10 фактов о гелии – атомный номер 2 в периодической таблице
Гелий – второй элемент в периодической таблице, с атомным номером 2 и символом элемента He. Это легчайший благородный газ. Вот десять фактов об элементе гелий.Проверьте полный список гелия, если вам нужны дополнительные сведения об элементах.
10 фактов о гелии
- Атомный номер гелия равен 2, что означает, что каждый атом гелия имеет два протона. Самый распространенный изотоп элемента имеет 2 нейтрона. Для каждого атома гелия энергетически выгодно иметь 2 электрона, что дает ему стабильную электронную оболочку.
- Гелий имеет самую низкую температуру плавления и кипения среди элементов, поэтому он существует только в виде газа, за исключением экстремальных условий.При нормальном давлении гелий является жидкостью при абсолютном нуле. Чтобы он стал твердым, он должен находиться под давлением.
- Гелий – второй по легкости элемент. Самый легкий элемент или элемент с самой низкой плотностью – водород. Хотя водород обычно существует в виде двухатомного газа, состоящего из двух связанных вместе атомов, один атом гелия имеет более высокое значение плотности. Это связано с тем, что наиболее распространенный изотоп водорода имеет один протон и не имеет нейтронов, в то время как каждый атом гелия обычно имеет два нейтрона, а также два протона.
- Гелий – второй по распространенности элемент во Вселенной (после водорода), хотя на Земле он встречается гораздо реже. На Земле элемент считается невозобновляемым ресурсом. Гелий не образует соединений с другими элементами, в то время как свободный атом достаточно легкий, чтобы избежать гравитации Земли и истечь через атмосферу. Некоторые ученые обеспокоены тем, что в один прекрасный день у нас может закончиться гелий или, по крайней мере, его изоляция станет чрезмерно дорогостоящей.
- Гелий не имеет цвета, запаха, вкуса, нетоксичен и инертен.Из всех элементов гелий наименее реакционноспособен, поэтому в обычных условиях он не образует соединений. Чтобы связать его с другим элементом, он должен быть ионизирован или находится под давлением. Под высоким давлением гелид динатрия (HeNa 2 ), клатратоподобный титанат La 2/3-x Li 3x TiO 3 He, силикатный кристобалит He II (SiO 2 He), дигелий могут существовать арсенолит (AsO 6 · 2He) и NeHe 2 .
- Большая часть гелия получается путем извлечения его из природного газа.Его использование включает воздушные шары для вечеринок с гелием, в качестве защитной инертной атмосферы для хранения химикатов и реакций, а также для охлаждения сверхпроводящих магнитов для ЯМР-спектрометров и аппаратов МРТ.
- Гелий является вторым наименее реактивным благородным газом (после неона). Считается, что реальный газ наиболее точно соответствует поведению идеального газа.
- При стандартных условиях гелий является одноатомным. Другими словами, гелий находится в виде отдельных атомов элемента.
- Вдыхание гелия временно изменяет звучание голоса человека.Хотя многие люди думают, что вдыхание гелия делает голос выше, на самом деле это не меняет высоту звука. Хотя гелий нетоксичен, его дыхание может вызвать удушье из-за кислородного голодания.
- Доказательства существования гелия были получены при наблюдении желтой спектральной линии от Солнца. Название элемента происходит от греческого бога Солнца Гелиоса.
Какой металл самый легкий?
Литий – самый легкий металл в мире. Здесь он хранится в аргоне, потому что он реагирует с воздухом.(фото: 2 × 910)Назовите самый легкий металл? Большинство металлов тяжелые или плотные, но некоторые металлы могут плавать в воде, а другие почти такие же легкие, как воздух. Узнайте о самом легком элементарном металле и самом легком сплаве.
Самый легкий металл, являющийся элементом
Когда мы говорим о легкости материала, на самом деле мы говорим о плотности. Плотность – это количество вещества на единицу объема. Чем меньше материи в космосе, тем она легче. Итак, самый легкий металлический элемент – это тот, у которого наименьшая плотность.Самым легким или наименее плотным элементом, который представляет собой металл, является литий. Литий имеет атомный номер 3 в периодической таблице с плотностью 0,534 г / см 3 . Это сопоставимо с плотностью древесины сосны. Плотность воды составляет около 1 г / см 3 , поэтому литий плавает на воде. Но, как и другие щелочные металлы, литий обладает высокой реакционной способностью, поэтому он быстро реагирует с выделением тепла и образованием гидроксида лития и газообразного водорода. Он также горит на воздухе, поэтому чистый металл хранится в масле (где он также плавает) или в инертной атмосфере.
Литий также плавает в масле. (W. Oelen)В обычных условиях только два других металлических элемента достаточно легкие, чтобы плавать в воде: калий и натрий. Плотность калия составляет 0,862 г / см 3 , а плотность натрия составляет 0,971 г / см 3 . Литий, калий и натрий – все щелочные металлы. Причина, по которой они такие легкие, заключается в том, что эти элементы являются первыми атомами в период своего периода в периодической таблице, которые получают дополнительную электронную оболочку. Оболочка делает атомы большими по массе.
А водород? Он относится к группе щелочных металлов и даже легче лития. Обычно водород ведет себя как неметаллический газ. Однако при определенных условиях водород образует твердый металл с плотностью 0,0763 г / см 3 . Это был бы самый легкий металл, если бы он существовал естественным образом на Земле!
Самый легкий металлический сплав
Металлическая микрорешетка настолько легкая, что голова одуванчика может удержать ее, не будучи раздавленной. (Дэн Литтл, HRL Laboratories)Самый легкий металл на Земле – это сплав, а не элемент.Это решетка из никель-фосфорных трубок (Микрорешетка), которую изобрели исследователи из Калифорнийского университета в Ирвине. Плотность Микрорешетки составляет 0,0009 г / см 3 или 9 мг / см 3 . После удаления воздуха истинная плотность металлической конструкции составляет всего 2,1 мг / см 3 . Он в сто раз легче пенополистирола и примерно в 1,76 раза тяжелее воздуха при 25 ° C. Кусок сплава может опираться на одуванчик, не сгибая его.
Кусок никелевого фосфора имеет плотность 9.0 г / см 3 . Решетка такая легкая потому, что она состоит из полых трубок в решетке, состоящей на 99,99% из воздуха и всего 0,01% из металла. Исследователи покрыли шаблон сплавом, а затем протравили шаблон, оставив полые трубки толщиной всего около 100 нанометров (в тысячу раз тоньше человеческого волоса). Микрорешетки очень перспективны в качестве теплоизоляторов, акустических и виброгасителей.
Микрорешетка из никель-фосфорного сплава – самый легкий металл, поскольку состоит из полых трубок.Это 99,99% воздуха!
Ссылки
- Brandes, E.A .; Брук, Г. (ред.) (1998). Справочник по легким металлам . Баттерворт Хайнеманн. Оксфорд. ISBN 0-7506-3625-4.
- Lide, D. R., ed. (2005). CRC Справочник по химии и физике (86-е изд.). Бока-Ратон (Флорида): CRC Press. ISBN 0-8493-0486-5.
- Polmear, I. (2006). Легкие сплавы: от традиционных сплавов к нанокристаллам (4-е изд.). Баттерворт Хайнеманн. Оксфорд. ISBN 0-7506-6371-5.
- Шедлер Т.А .; Якобсен, А. Дж .; Торренты, А .; Соренсен, А. Э .; Lian, J .; Greer, J. R .; Valdevit, L .; Картер, В. Б. (12 октября 2011 г.). «Сверхлегкие металлические микрорешетки». Наука . 334 (6058): 962–5. doi: 10.1126 / science.1211649
Свойства водорода | Введение в химию
Цель обучения
- Укажите различные виды реакций, в которых может участвовать водород, и обсудите его основные свойства
Ключевые моменты
- Водород – самый легкий элемент, который взрывается при концентрациях от 4 до 75 процентов по объему в присутствии солнечного света, пламени или искры.
- Несмотря на свою стабильность, водород образует множество связей и присутствует во многих различных соединениях.
- Существуют три встречающихся в природе изотопа водорода: протий, дейтерий и тритий, каждый из которых имеет разные свойства из-за разницы в количестве нейтронов в ядре.
Срок
- двухатомный, состоящий из двух атомов
Физические свойства водорода
Водород – самый маленький химический элемент, потому что он состоит только из одного протона в своем ядре.Его символ – H, а его атомный номер – 1. Он имеет средний атомный вес 1,0079 а.е.м., что делает его самым легким элементом. Водород – самое распространенное химическое вещество во Вселенной, особенно в звездах и газовых планетах-гигантах. Однако одноатомный водород редко встречается на Земле из-за его склонности к образованию ковалентных связей с большинством элементов. При стандартной температуре и давлении водород является нетоксичным, неметаллическим, без запаха, вкуса, бесцветным и легковоспламеняющимся двухатомным газом с молекулярной формулой H 2 .Водород также широко распространен на Земле в форме химических соединений, таких как углеводороды и вода.
Водород имеет один протон и один электрон; самый распространенный изотоп протий ( 1 H) не имеет нейтронов. Водород имеет температуру плавления -259,14 ° C и точку кипения -252,87 ° C. Водород имеет плотность 0,08988 г / л, что делает его менее плотным, чем воздух. Он имеет две различные степени окисления (+1, -1), что позволяет ему действовать как окислитель, так и как восстанавливающий агент. Его ковалентный радиус 31.17:00.
Водород существует в виде двух разных спиновых изомеров двухатомных молекул водорода, которые различаются относительным спином их ядер. Ортоводородная форма имеет параллельные спины; параводородная форма имеет антипараллельные спины. При стандартной температуре и давлении водородный газ состоит на 75 процентов из ортоводорода и на 25 процентов из параводорода. Водород доступен в различных формах, таких как сжатый газообразный водород, жидкий водород и жидкий водород (состоящий из жидкого и твердого), а также в твердой и металлической формах.
Атом водорода Многие химические свойства атома водорода возникают из-за его небольшого размера, таких как его склонность к образованию ковалентных связей, воспламеняемость и спонтанная реакция с окисляющими элементами.Химические свойства водорода
Газообразный водород (H 2 ) легко воспламеняется и может гореть в воздухе в очень широком диапазоне концентраций от 4 до 75 процентов по объему. Энтальпия сгорания водорода составляет -286 кДж / моль и описывается уравнением:
[латекс] 2 H_2 (г) + O_2 (г) \ rightarrow 2 H_2O (l) + 572 кДж (286 кДж / моль H_2) [/ латекс]
Водородный газ также может взорваться в смеси хлора (от 5 до 95 процентов).Эти смеси могут взорваться от искры, тепла или даже солнечного света. Температура самовоспламенения водорода (температура, при которой произойдет самовозгорание) составляет 500 ° C. Чистое водородно-кислородное пламя излучает ультрафиолетовый свет и невидимо невооруженным глазом. Таким образом, обнаружение утечки горящего водорода опасно и требует наличия детектора пламени. Поскольку водород плавучий в воздухе, водородное пламя поднимается быстро и причиняет меньший ущерб, чем углеводородные пожары. H 2 реагирует с окисляющими элементами, которые, в свою очередь, самопроизвольно и бурно реагируют с хлором и фтором с образованием соответствующих галогенидов водорода.
H 2 действительно образует соединения с большинством элементов, несмотря на свою стабильность. Участвуя в реакциях, водород может иметь частичный положительный заряд при взаимодействии с большим количеством электроотрицательных элементов, таких как галогены или кислород, но он может иметь частичный отрицательный заряд при взаимодействии с большим количеством электроположительных элементов, таких как щелочные металлы. Когда водородная связь с фтором, кислородом или азотом, она может участвовать в форме нековалентной (межмолекулярной) связи средней силы, называемой водородной связью, которая имеет решающее значение для стабильности многих биологических молекул.Соединения, которые имеют водородную связь с металлами и металлоидами, известны как гидриды .
Окисление водорода удаляет его электрон и дает ион H + . Часто H + в водных растворах называют ионом гидроксония (H 3 O + ). Этот вид важен в химии кислотно-щелочного соединения.
Изотопы водорода
В природе водород существует в виде трех изотопов, обозначенных 1 H, 2 H и 3 H. 1 H встречается с распространением 99,98% и имеет официальное название протий. 2 H известен как дейтерий и содержит один электрон, один протон и один нейтрон (массовое число = 2). Дейтерий и его соединения используются в качестве нерадиоактивных меток в химических экспериментах и в растворителях для спектроскопии 1 H-ЯМР. 3 H известен как тритий и содержит один протон, два нейтрона и один электрон (массовое число = 3). Он радиоактивен и распадается на гелий-3 посредством бета-распада с периодом полураспада 12.32 года.
Показать источникиBoundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета. Этот конкретный ресурс использовал следующие источники:
Самые легкие металлы: наука и технологии от лития до кальция
Авторы XI
Серия Предисловие XV
Предисловие к тому XVII
ЧАСТЬ 1: ИСТОРИЯ ВОПРОСА 1
Взаимосвязи между легчайшими металлами 3
Николас К.Бойд и Тимоти П. Хануса
Возникновение и производство бериллия 23
Стивен Фриман
Появление минералов магнезии и производство магния химических веществ и металлов 35
Марк А. Шанд
Возникновение и производство алюминия 47
Halvor Kvande
Статус стратегического металла 57
Дебора А. Крамер
Устойчивость ресурсов 67
Дэвид А. Этвуд
ЧАСТЬ 2: ОСНОВЫ 71
Low Oxidation State Chem. .Hill
ЯМР в растворе легких металлов основной группы 91
Тимоти П. Хануса
Твердотельный ЯМР легких металлов основной группы 117
Роберт В. Шурко и Майкл Дж. Ярошевич
Катион – π Взаимодействия 173
Йи Ан и Стивен Уиллер
Ионные каналы и ионофоры 185
Питер Дж. Крэгг
Токсикология металлического бериллия: текущая перспектива 205
Теренс М.Civic
ЧАСТЬ 3: ПРИМЕНЕНИЕ 211
Переосмысление реакции Гриньяра 213
Свен Крик и Маттиас Вестерхаузен
Ариллитий и гетариллитий: образование и реакционная способность магния 9000 4500 в составе магния и кальциевого магния. 255
Merle Arrowsmith
Катализ на основе алюминия 281
Марк Р. Мейсон
Литий-ионные батареи: основы и безопасность 303
Isidor Buchmann
Литий-ионные батареи и не только 315 Проблемы дизайна
Юн Хва и Элтон Дж.Кэрнс
Синтез материалов для хранения водорода под высоким давлением 335
Хироюки Сайто, Шигеюки Такаги, Кацутоши Аоки и Син-ичи Оримо
Обработка и применение прозрачной керамики 343
Лин Хуэнг Конг, Чжилин Динь Бинг Конг, Ичжун Тяньшу Чжан, Вэньсю Цюэ, Цзянь Чжан, Динъюань Танг и Шон Ли
Сверхпроводники из легких элементов 371
Андреас Херманн
Одномерный катализ, усиленный наноструктурами 387
Сибо Ван, Чжэнго Рен и Сибо Ван, Чжэнго Рен и Сиань Гао
Фармакология лития 417
Филип Г.Яничак и Брэдли Р. Катлер
Солнечная энергия и фотоэлектрическая энергия 427
Арнульф Джагер-Вальдау
Аббревиатуры и сокращения 437
Индекс 441
.